Сполуки, композиції та способи, які інгібують протеази, для лікування та профілактики імуномедіаторних запальних хвороб
Формула / Реферат
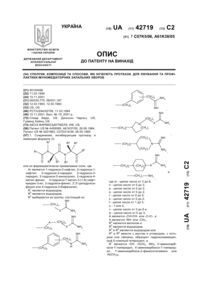
1. Соединения, ингибирующие протеазу и имеющие формулу (I):
или их фармацевтически приемлемые соли, где
Аr является 1-гидрокси-2-нафтил, 2-гидрокси-1-нафтил, 3-гидрокси-2-пиридил, 2-гидрокси-3-пиридил, 2-гидрокси-3-хиноксалил, 2-гидрокси-4-метил-фенил, 4-гидрокси-7-метил-3-(1,8)-нафтиридин-3-ил, 2-гидрокси-фенил, 2',5'-дигидрокси-фенил или 4-гидрокси-3-бифенилил,
R1 является водородом,
R2 является водородом,
R3 выбирается из группы, состоящей из
где m - целое число от 3 до 6,
n - целое число от 0 до 3,
р - целое число от 0 до 2,
q - целое число от 0 до 2,
r - целое число от 0 до 5,
s - целое число от 0 до 2,
t - целое число от 1 до 3,
u - 1 или 2,
v - целое число от 3 до 6 и
w - целое число от 0 до 3,
А является -СН=СН- или -С=С-, и
Х является -NH- или -СН;-,
R4 является метилом и
R5 является водородом,
R5 и R6 являются водородом или
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют гидроксизамещенный 5-членный гетероцикл, и
R7 является -ОН, -ОСН3, -NH2, 3'-аминокарбокси-1'-пиперидил, 4'-аминокарбокси-1'-пиперидил, 1'-аминокарбокси-2-фенилэтиламино или -N(CH3)2.
2. Соединение по п. 1, отличающееся тем, что
R3 выбирается из группы, состоящей из
где m - целое число от 3 до 6,
n - целое число от 0 до 3,
р - целое число от 0 до 2,
q - целое число от 0 до 2 и
w - целое число от 0 до 3,
А является -СН=СН- или -С=С-, и
Х является -NH- или -СН2-.
3. Соединение по п. 2, отличающееся тем, что
Аr является 1-гидрокси-2-нафтил,
R1 является водородом,
R2 является водородом,
R3 является -(CH2)3NH(CNH)NH2,
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5-членный гетероцикл,
R6 является водородом и
R7 является –NH2, а именно 1-гидрокси-2-нафтоил-L-аргинил-L-пролинамид.
4. Соединение по п. 2, отличающееся тем, что
Аr является 2-гидрокси-1-нафтил,
R1 является водородом,
R2 является водородом,
R3 является -(CH2)3NH(CNH)NH2,
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5-членный гетероцикл,
R6 является водородом и
R7 является –NH2, а именно 2-гидрокси-1-нафтоил-L-аргинил-L-пролинамид.
5. Аэрозольный состав для лечения иммуномедиаторных воспалительных расстройств, содержащий соединение формулы (I) или его фармацевтически приемлемую соль в аэрозолированном, фармацевтически приемлемом растворе-носителе или сухом порошке.
6. Состав по п. 5, отличающийся тем, что Аr является 1-гидрокси-2-нафтил, 2-гидроксил-1-нафтил, 3-гидрокси-2-пиридил или 2-гидрокси-3-хиноксалил,
R1 является водородом,
R2 является водородом,
R3 выбирается из группы, состоящей из
где m - целое число от 3 до 6,
n - целое число от 0 до 3,
p - целое число от 0 до 2,
q - целое число от 0 до 2 и
w - целое число от 0 до 3,
А является -СН=СН- или -С=С-, и
Х является -NH- или –СН2-,
R4 является низшим алкилом, и
R5 и R6 - водородом, или
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, а
R6 является водородом, и
R7 является -ОН, -ОСН3, -NH2, 3'-аминокарбокси-1'-пиперидил или -N(СН3)2.
7. Состав по п. 6, отличающийся тем, что
Аr является 1-гидрокси-2-нафтил,
R1 является водородом,
R2 является водородом,
R3 является -(CH2)3NH(CNH)NH2,
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5-членный гетероцикл,
R6 является водородом и
R7 является –NH2.
8. Состав по п. 6, отличающийся тем, что
Аr является 2-гидрокси-1-нафтил,
R1 является водородом,
R2 является водородом,
R3 является -(CH2)3NH(CNH)NH2,
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5-членный гетероцикл,
R6 является водородом и
R7 является –NH2.
9. Состав по п. 5, отличающийся тем, что воспалительным расстройством респираторного тракта является астма.
10. Состав по п. 5, отличающийся тем, что воспалительным расстройством респираторного тракта является аллергический ринит.
11. Состав по п. 5, отличающийся тем, что соединение по п. 1 присутствует в растворе-носителе в концентрации от 0,1 до 30 мг/мл.
12. Состав по п. 5, отличающийся тем, что он также содержит соединение b-адренергического агониста.
13. Состав по п. 12, отличающийся тем, что соединение b-адренергического агониста выбирается из группы, состоящей из альбутерола, тербуталина, формотерола, фенотерола и преналина.
14. Состав по п. 5, отличающийся тем, что он также содержит противовоспалительный кортикостероид.
15. Состав по п. 14, отличающийся тем, что противовоспалительный кортикостероид выбирается из группы, состоящей из беклометазома, триамцинолона, флуризолида и дексаметазона.
16. Состав по п. 5, отличающийся тем, что он также содержит ипратропий бромид.
17. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым носителем.
18. Композиция по п. 17, отличающаяся тем, что фармацевтически приемлемый носитель содержит нетоксичный, фармацевтически приемлемый носитель для местного применения.
19. Композиция по п. 17, отличающаяся тем, что
Аr является 1-гидрокси-2-нафтил, 2-гидроксил-1-нафтил, 3-гидрокси-2-пиридил или 2-гидрокси-3-хиноксалил,
R1 является водородом,
R2 является водородом,
R3 выбирается из группы, состоящей из
где m - целое число от 3 до 6,
n - целое число от 0 до 3,
р - целое число от 0 до 2,
q - целое число от 0 до 2 и
w - целое число от 0 до 3,
А является -СН=СН- или -С=С-, и Х является -NH- или -СН;-,
R4 является низшим алкилом, и
R5 и R6 - водородом, или
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, а
R6 является водородом, и
R7 является -ОН, -ОСН3, -NH2, -3'аминокарбокси-1'-пиперидил или -N(СН3)2.
20. Композиция по п. 19, отличающаяся тем, что
Аr является 1-гидрокси-2-нафтил,
R1 является водородом,
R2 является водородом,
R3 является -(CH2)3NH(CNH)NH2,
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5-членный гетероцикл,
R6 является водородом и
R7 является –NH2.
21. Композиция по п. 19, отличающаяся тем, что
Аr является 2-гидрокси-1-нафтил,
R1 является водородом,
R2 является водородом,
R3 является -(CH2)3NH(CNH)NH2,
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5-членный гетероцикл,
R6 является водородом и
R7 является –NH2.
22. Способ лечения иммуномедиаторного воспалительного расстройства респираторного тракта, заключающийся во введении пациенту фармацевтической композиции, отличающийся тем, что в качестве фармацевтической композиции пациенту вводят ингаляторную композицию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль, в аэрозолированном фармацевтически приемлемом растворе-носителе или сухом порошке.
23. Способ по п. 22, отличающийся тем, что
Аr является 1-гидрокси-2-нафтил, 2-гидроксил-1-нафтил, 3-гидрокси-2-пиридил или 2-гидрокси-3-хиноксалил,
R1 является водородом,
R2 является водородом,
R3 выбирается из группы, состоящей из
где m - целое число от 3 до 6,
n - целое число от 0 до 3,
р - целое число от 0 до 2,
q - целое число от 0 до 2 и
w - целое число от 0 до 3,
А является -СН=СН- или -С=С-, и
Х является -NH- или –CH2-,
R4 является низшим алкилом, и
R5 и R6 - водородом, или
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, а
R6 является водородом, и
R7 является -ОН, -ОСН3, -NH2, 3'-аминокарбокси-1'-пиперидил или -N(СН3)2.
24. Способ по п. 23, отличающийся тем, что
Аr является 1-гидрокси-2-нафтил,
R1 является водородом,
R2 является водородом,
R3 является -(CH2)3NH(CNH)NH2,
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5-членный гетероцикл,
R6 является водородом и
R7 является –NH2.
25. Способ по п. 23, отличающийся тем, что
Аr является 2-гидрокси-1-нафтил,
R1 является водородом,
R2 является водородом,
R3 является -(CH2)3NH(CNH)NH2,
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5-членный гетероцикл,
R6 является водородом и
R7 является –NH2.
26. Способ по п. 22, отличающийся тем, что указанное соединение присутствует в растворе-носителе в концентрации от 0,1 до 30 мг/мл.
27. Способ по п. 22, отличающийся тем, что он также содержит соединение b-адренергического агониста.
28. Способ по п. 27, отличающийся тем, что соединение b-адренергического агониста выбирается из группы, состоящей из альбутерола, тербуталина, формотерола, фенотерола и преналина.
29. Способ по п. 22, отличающийся тем, что он также содержит противовоспалительный кортикостероид.
30. Способ по п. 29, отличающийся тем, что противовоспалительный кортикостероид выбирается из группы, состоящей из беклометазома, триамцинолона, флуризолида и дексаметазона.
31. Способ по п. 22, отличающийся тем, что он также содержит ипратропий бромид.
32. Способ лечения иммуномедиаторных воспалительных заболеваний кожи, включающий локальное введение пациенту композиции, содержащей терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли в нетоксичном, фармацевтически приемлемом носителе для местного введения.
33. Способ по п. 32, отличающийся тем, что
Аr является 1-гидрокси-2-нафтил, 2-гидроксил-1-нафтил, 3-гидрокси-2-пиридил или 2-гидрокси-3-хиноксалил,
R1 является водородом,
R2 является водородом,
R3 выбирается из группы, состоящей из
где m - целое число от 3 до 6,
n - целое число от 0 до 3,
р - целое число от 0 до 2,
q - целое число от 0 до 2 и
w - целое число от 0 до 3,
А является -СН=СН- или -С=С-, и
Х является -NH- или –CH2-,
R4 является низшим алкилом, и
R5 и R6 - водородом, или
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, а
R6 является водородом, и
R7 является -ОН, -ОСН3, -NH2, 3'-аминокарбокси-1'-пиперидил или -N(СН3)2.
34. Способ по п. 33, отличающийся тем, что
Аr является 1-гидрокси-2-нафтил,
R1 является водородом,
R2 является водородом,
R3 является -(CH2)3NH(CNH)NH2,
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5-членный гетероцикл,
R6 является водородом и
R7 является –NH2.
35. Способ по п. 33, отличающийся тем, что
Аr является 2-гидрокси-1-нафтил,
R1 является водородом,
R2 является водородом,
R3 является -(CH2)3NH(CNH)NH2,
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5-членный гетероцикл,
R6 является водородом и
R7 является –NH2.
36. Способ профилактики иммуномедиаторного воспалительного расстройства респираторного тракта, отличающийся тем, что он включает в себя введение пациенту ингаляторной композиции, содержащей профилактически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли в аэрозолированном фармацевтически приемлемом растворе-носителе или сухом порошке.
37. Способ по п. 36, отличающийся тем, что
Аr является 1-гидрокси-2-нафтил, 2-гидроксил-1-нафтил, 3-гидрокси-2-пиридил или 2-гидрокси-3-хиноксалил,
R1 является водородом,
R2 является водородом,
R3 выбирается из группы, состоящей из
и
где m - целое число от 3 до 6,
n - целое число от 0 до 3,
р - целое число от 0 до 2,
q - целое число от 0 до 2 и
w - целое число от 0 до 3,
А является -СН=СН- или -С=С-, и
Х является -NH- или –СН2-,
R4 является низшим алкилом, и
R5 и R6 - водородом, или
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, а
R6 является водородом, и
R7 является -ОН, -ОСН3, -NH2, 3'-аминокарбокси-1'-пиперидил или -N(СН3)2.
38. Способ по п. 37, отличающийся тем, что
Аr является 1-гидрокси-2-нафтил,
R1 является водородом,
R2 является водородом,
R3 является -(CH2)3NH(CNH)NH2,
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5-членный гетероцикл,
R6 является водородом и
R7 является –NH2.
39. Способ по п. 37, отличающийся тем, что
Аr является 2-гидрокси-1-нафтил,
R1 является водородом,
R2 является водородом,
R3 является -(CH2)3NH(CNH)NH2,
R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5-членный гетероцикл,
R6 является водородом и
R7 является -NH2.
40. Способ по п. 36, отличающийся тем, что указанное соединение присутствует в растворе-носителе в концентрации от 0,1 до 30 мг/мл.
41. Способ по п. 36, отличающийся тем, что он также включает соединение b-адренергического агониста.
42. Способ по п. 41, отличающийся тем, что соединение р-адренергического агониста выбирается из группы, состоящей из альбутерола, тербуталина, формотерола, фенотерола и преналина.
43. Спооб по п. 36, отличающийся тем, что он также содержит противовоспалительный кортикостероид.
44. Способ по п. 43, отличающийся тем, что противовоспалительный кортикостероид выбирается из группы, состоящей из беклометазома, триамцинолона, флуризолида и дексаметазона.
45. Способ по п. 36, отличающийся тем, что он также содержит ипратропий бромид.
Текст
1. Соединения, ингибирующие протеазу и имеющие формулу (I): R1 R5 R6 O X (CH2)p NH2 (CH2)r , (CH2)t NH N (CH2)p NH2 , , (CH2)w NH2 X , NH (CH2)q N H NH2 , и (CH2)v NH2 , где m - целое число от 3 до 6, n - целое число от 0 до 3, р - целое число от 0 до 2, q - целое число от 0 до 2, r - целое число от 0 до 5, s - целое число от 0 до 2, t - целое число от 1 до 3, u - 1 или 2, v - целое число от 3 до 6 и w - целое число от 0 до 3, А является -СН=СН- или -С=С-, и Х является -NH- или -СН2-, R4 является метилом и R5 является водородом, R5 и R6 являются водородом или R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют гидроксизамещенный 5-членный гетероцикл, и R7 является -ОН, -ОСН3, -NH2, 3'-аминокарбокси-1'-пиперидил, 4'-аминокарбокси-1'-пиперидил, 1'-аминокарбокси-2-фенилэтиламино или -N(CH3)2. (13) NH2 42719 X (11) (CH2)u UA NH2 (CH2)p C2 NH NH (CH2)p (CH2)s N X , (CH2)t O O R2 R3 R4 или их фармацевтически приемлемые соли, где Аr является 1-гидрокси-2-нафтил, 2-гидрокси-1нафтил, 3-гидрокси-2-пиридил, 2-гидрокси-3пиридил, 2-гидрокси-3-хиноксалил, 2-гидрокси-4метил-фенил, 4-гидрокси-7-метил-3-(1,8)-нафтиридин-3-ил, 2-гидрокси-фенил, 2',5'-дигидроксифенил или 4-гидрокси-3-бифенилил, R1 является водородом, R2 является водородом, R3 выбирается из группы, состоящей из NH (CH2)m (CH2)n NH NH R7 N A (CH2 )p NH2 (19) Ar (CH2)q 42719 2. Соединение по п. 1, отличающееся тем, что R3 выбирается из группы, состоящей из NH NH (CH2)m X (CH2)m X NH2 (CH2)n , A (CH2)n (CH2)w NH2 X X NH2 NH (CH2)p NH2 N H NH2 и и (CH2)q (CH2)q , (CH2)q NH (CH2)p (CH2)w , (CH2)q N H , NH NH A NH2 NH2 (CH2)p NH2 NH , где m - целое число от 3 до 6, n - целое число от 0 до 3, p - целое число от 0 до 2, q - целое число от 0 до 2 и w - целое число от 0 до 3, А является -СН=СН- или -С=С-, и Х является -NH- или -СН2-, R4 является низшим алкилом, и R5 и R6 - водородом, или R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 4членный, 5-членный или 6-членный гетероцикл, а R6 является водородом, и R7 является -ОН, -ОСН3, -NH2, 3'-аминокарбокси-1'-пиперидил или -N(СН3)2. 7. Состав по п. 6, отличающийся тем, что Аr является 1-гидрокси-2-нафтил, R1 является водородом, R2 является водородом, R3 является -(CH2)3NH(CNH)NH2, R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5членный гетероцикл, R6 является водородом и R7 является -NH2. 8. Состав по п. 6, отличающийся тем, что Аr является 2-гидрокси-1-нафтил, R1 является водородом, R2 является водородом, R3 является -(CH2)3NH(CNH)NH2, R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5членный гетероцикл, R6 является водородом и R7 является -NH2. 9. Состав по п. 5, отличающийся тем, что воспалительным расстройством респираторного тракта является астма. 10. Состав по п. 5, отличающийся тем, что воспалительным расстройством респираторного тракта является аллергический ринит. 11. Состав по п. 5, отличающийся тем, что соединение по п. 1 присутствует в раствореносителе в концентрации от 0,1 до 30 мг/мл. (CH2)p NH , где m - целое число от 3 до 6, n - целое число от 0 до 3, р - целое число от 0 до 2, q - целое число от 0 до 2 и w - целое число от 0 до 3, А является -СН=СН- или -С=С-, и Х является -NH- или -СН2-. 3. Соединение по п. 2, отличающееся тем, что Аr является 1-гидрокси-2-нафтил, R1 является водородом, R2 является водородом, R3 является -(CH2)3NH(CNH)NH2, R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5членный гетероцикл, R6 является водородом и R7 является -NH2, а именно 1-гидрокси-2нафтоил-L-аргинил-L-пролинамид. 4. Соединение по п. 2, отличающееся тем, что Аr является 2-гидрокси-1-нафтил, R1 является водородом, R2 является водородом, R3 является -(CH2)3NH(CNH)NH2, R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5членный гетероцикл, R6 является водородом и R7 является -NH2, а именно 2-гидрокси-1нафтоил-L-аргинил-L-пролинамид. 5. Аэрозольный состав для лечения иммуномедиаторных воспалительных расстройств, содержащий соединение формулы (I) или его фармацевтически приемлемую соль в аэрозолированном, фармацевтически приемлемом раствореносителе или сухом порошке. 6. Состав по п. 5, отличающийся тем, что Аr является 1-гидрокси-2-нафтил, 2-гидроксил1-нафтил, 3-гидрокси-2-пиридил или 2-гидрокси3-хиноксалил, R1 является водородом, R2 является водородом, R3 выбирается из группы, состоящей из 2 42719 R7 является -ОН, -ОСН3, -NH2, -3'аминокарбокси-1'-пиперидил или -N(СН3)2. 20. Композиция по п. 19, отличающаяся тем, что Аr является 1-гидрокси-2-нафтил, R1 является водородом, R2 является водородом, R3 является -(CH2)3NH(CNH)NH2, R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5членный гетероцикл, R6 является водородом и R7 является -NH2. 21. Композиция по п. 19, отличающаяся тем, что Аr является 2-гидрокси-1-нафтил, R1 является водородом, R2 является водородом, R3 является -(CH2)3NH(CNH)NH2, R4 и R5 вместе с азотом и углеродом, с которым онисвязаны, образуют замещенный 5членный гетероцикл, R6 является водородом и R7 является -NH2. 22. Способ лечения иммуномедиаторного воспалительного расстройства респираторного тракта, заключающийся во введении пациенту фармацевтической композиции, отличающийся тем, что в качестве фармацевтической композиции пациенту вводят ингаляторную композицию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль, в аэрозолированном фармацевтически приемлемом растворе-носителе или сухом порошке. 23. Способ по п. 22, отличающийся тем, что Аr является 1-гидрокси-2-нафтил, 2-гидроксил1-нафтил, 3-гидрокси-2-пиридил или 2-гидрокси3-хиноксалил, R1 является водородом, R2 является водородом, R3 выбирается из группы, состоящей из NH 12. Состав по п. 5, отличающийся тем, что он также содержит соединение b-адренергического агониста. 13. Состав по п. 12, отличающийся тем, что соединение b-адренергического агониста выбирается из группы, состоящей из альбутерола, тербуталина, формотерола, фенотерола и преналина. 14. Состав по п. 5, отличающийся тем, что он также содержит противовоспалительный кортикостероид. 15. Состав по п. 14, отличающийся тем, что противовоспалительный кортикостероид выбирается из группы, состоящей из беклометазома, триамцинолона, флуризолида и дексаметазона. 16. Состав по п. 5, отличающийся тем, что он также содержит ипратропий бромид. 17. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым носителем. 18. Композиция по п. 17, отличающаяся тем, что фармацевтически приемлемый носитель содержит нетоксичный, фармацевтически приемлемый носитель для местного применения. 19. Композиция по п. 17, отличающаяся тем, что Аr является 1-гидрокси-2-нафтил, 2-гидроксил1-нафтил, 3-гидрокси-2-пиридил или 2-гидрокси3-хиноксалил, R1 является водородом, R2 является водородом, R3 выбирается из группы, состоящей из NH (CH2)m X NH2 , NH A (CH2)n (CH2)w NH2 X , (CH2)m X NH (CH2)q (CH2)p NH2 N H (CH2)q (CH2)p NH NH2 , NH и A (CH2)n (CH2)w NH2 X NH2 , NH (CH2)q , где m - целое число от 3 до 6, n - целое число от 0 до 3, р - целое число от 0 до 2, q - целое число от 0 до 2 и w - целое число от 0 до 3, А является -СН=СН - или -С=С -, и Х является -NH- или -СН2-, R4 является низшим алкилом, и R5 и R6 - водородом, или R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 4членный, 5-членный или 6-членный гетероцикл, а R6 является водородом, и (CH2)p N H NH2 (CH2)q (CH2 )p NH где m - целое число от 3 до 6, n - целое число от 0 до 3, р - целое число от 0 до 2, q - целое число от 0 до 2 и w - целое число от 0 до 3, А является -СН=СН- или -С=С-, и 3 NH2 , и 42719 Х является -NH- или -CH2-, R4 является низшим алкилом, и R5 и R6 - водородом, или R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, а R6 является водородом, и R7 является -ОН, -ОСН3, -NH2, 3'-аминокарбокси-1'-пиперидил или -N(СН3)2. 24. Способ по п. 23, отличающийся тем, что Аr является 1-гидрокси-2-нафтил, R1 является водородом, R2 является водородом, R3 является -(CH2)3NH(CNH)NH2, R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5членный гетероцикл, R6 является водородом и R7 является -NH2. 25. Способ по п. 23, отличающийся тем, что Аr является 2-гидрокси-1-нафтил, R1 является водородом, R2 является водородом, R3 является -(CH2)3NH(CNH)NH2, R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5членный гетероцикл, R6 является водородом и R7 является -NH2. 26. Способ по п. 22, отличающийся тем, что указанное соединение присутствует в раствореносителе в концентрации от 0,1 до 30 мг/мл. 27. Способ по п. 22, отличающийся тем, что он также содержит соединение b-адренергического агониста. 28. Способ по п. 27, отличающийся тем, что соединение b-адренергического агониста выбирается из группы, состоящей из альбутерола, тербуталина, формотерола, фенотерола и преналина. 29. Способ по п. 22, отличающийся тем, что он также содержит противовоспалительный кортикостероид. 30. Способ по п. 29, отличающийся тем, что противовоспалительный кортикостероид выбирается из группы, состоящей из беклометазома, триамцинолона, флуризолида и дексаметазона. 31. Способ по п. 22, отличающийся тем, что он также содержит ипратропий бромид. 32. Способ лечения иммуномедиаторных воспалительных заболеваний кожи, включающий локальное введение пациенту композиции, содержащей терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли в нетоксичном, фармацевтически приемлемом носителе для местного введения. 33. Способ по п. 32, отличающийся тем, что Аr является 1-гидрокси-2-нафтил, 2-гидроксил1-нафтил, 3-гидрокси-2-пиридил или 2-гидрокси3-хиноксалил, R1 является водородом, R2 является водородом, R3 выбирается из группы, состоящей из NH NH A (CH2)n NH2 NH2 X , NH (CH2)q (CH2)p N H (CH2)q (CH2)p NH2 и NH2 NH , где m - целое число от 3 до 6, n - целое число от 0 до 3, р - целое число от 0 до 2, q - целое число от 0 до 2 и w - целое число от 0 до 3, А является -СН=СН- или -С=С-, и Х является -NH- или -CH2-, R4 является низшим алкилом, и R5 и R6 - водородом, или R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, а R6 является водородом, и R7 является -ОН, -ОСН3, -NH2, 3'-аминокарбокси-1'-пиперидил или -N(СН3)2. 34. Способ по п. 33, отличающийся тем, что Аr является 1-гидрокси-2-нафтил, R1 является водородом, R2 является водородом, R3 является -(CH2)3NH(CNH)NH2, R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5членный гетероцикл, R6 является водородом и R7 является -NH2. 35. Способ по п. 33, отличающийся тем, что Аr является 2-гидрокси-1-нафтил, R1 является водородом, R2 является водородом, R3 является -(CH2)3NH(CNH)NH2, R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5членный гетероцикл, R6 является водородом и R7 является -NH2. 36. Способ профилактики иммуномедиаторного воспалительного расстройства респираторного тракта, отличающийся тем, что он включает в себя введение пациенту ингаляторной композиции, содержащей профилактически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли в аэрозолированном фармацевтически приемлемом раствореносителе или сухом порошке. 37. Способ по п. 36, отличающийся тем, что Аr является 1-гидрокси-2-нафтил, 2-гидроксил1-нафтил, 3-гидрокси-2-пиридил или 2-гидрокси3-хиноксалил, R1 является водородом, R2 является водородом, (CH2)m X (CH2)w , 4 42719 R3 выбирается из группы, состоящей из NH R1 является водородом, R2 является водородом, R3 является -(CH2)3NH(CNH)NH2, R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5членный гетероцикл, R6 является водородом и R7 является -NH2. 39. Способ по п. 37, отличающийся тем, что Аr является 2-гидрокси-1-нафтил, R1 является водородом, R2 является водородом, R3 является -(CH2)3NH(CNH)NH2, R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 5членный гетероцикл, R6 является водородом и R7 является -NH2. 40. Способ по п. 36, отличающийся тем, что указанное соединение присутствует в раствореносителе в концентрации от 0,1 до 30 мг/мл. 41. Способ по п. 36, отличающийся тем, что он также включает соединение b-адренергического агониста. 42. Способ по п. 41, отличающийся тем, что соединение b-адренергического агониста выбирается из группы, состоящей из альбутерола, тербуталина, формотерола, фенотерола и преналина. 43. Способ по п. 36, отличающийся тем, что он также содержит противовоспалительный кортикостероид. 44. Способ по п. 43, отличающийся тем, что противовоспалительный кортикостероид выбирается из группы, состоящей из беклометазома, триамцинолона, флуризолида и дексаметазона. 45. Способ по п. 36, отличающийся тем, что он также содержит ипратропий бромид. (CH2)m X NH2 , NH A (CH2)n (CH2)w X NH2 , NH (CH2)q (CH2)p NH2 N H и (CH2)q (CH2)p NH2 NH , где m - целое число от 3 до 6, n - целое число от 0 до 3, р - целое число от 0 до 2, q - целое число от 0 до 2 и w - целое число от 0 до 3, А является -СН=СН- или -С=С-, и Х является -NH- или -СН2-, R4 является низшим алкилом, и R5 и R6 - водородом, или R4 и R5 вместе с азотом и углеродом, с которым они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, а R6 является водородом, и R7 является -ОН, -ОСН3, -NH2, 3'-аминокарбокси-1'-пиперидил или -N(СН3)2. 38. Способ по п. 37, отличающийся тем, что Аr является 1-гидрокси-2-нафтил, тивны при предотвращении и лечении поздней фазы бронхостеноза и гиперреактивности дыхательных путей при хронической астме. Астма является комплексным заболеванием, вовлекающим множество биохимических медиаторов как при остром, так и при хроническом ее проявлении. Астма зачастую характеризуется прогрессивным развитием гиперреактивности трахеи и бронхов как к иммуноспецифическим аллергенам, так и к общим химическим и физическим раздражителям. Гиперреактивность астматической бронхиальной ткани является, как полагают, результатом хронических воспалительных реакций, которые раздражают и повреждают эпителий, облегающий стенки дыхательных путей, и способствуют патологическому утолщению нижележащей ткани. Исследования бронхиальной биопсии показали, что даже у пациентов со слабой астмой имеют место признаки воспаления стенок дыхательных путей. Одним из инициаторов воспалительного процесса является аллергический отклик на вдыхаемые аллергены. В эпителии и нижележащих мягких мышечных тканях бронхов присутствуют лей Настоящее изобретение является частично продолжающим совместно рассматриваемую заявку сер. № 08/031187, относящуюся к существу изобретения заявки на Патент США сер. 08/030770, поданных 12 марта 1993 г. и имеющих следующие наименования: "Compositions and Methods for the Treatment of Immunomediated Inflammatory Disorders" (Составы и способы лечения иммуномедиаторных воспалительных расстройств) и "Methods for the Treatment of Hyperresponsivenes Associated with Chronic Asthma" (Способы лечения гиперреактивности, связанной с хронической астмой) соответственно. Эти совместно рассматриваемые заявки включены в настоящее описание в форме ссылок на литературу. Настоящее изобретение относится к составам и способам предотвращения и лечения иммуномедиаторных воспалительных расстройств. Более конкретно, изобретение относится к предотвращению и лечению воспалительных заболеваний, связанных с респираторным трактом, таких как астма и аллергический ринит. Составы и способы согласно данному изобретению особенно эффек 5 42719 коциты, несущие рецепторы IgE, особенно тучные клетки и базофилы, а также моноциты, макрофаги и эозинофилы, где они активируются вначале связыванием вдыхаемых специфических антигенов с рецепторами IgE. Активированные тучные клетки выделяют целый ряд предварительно образованных или первичных химических медиаторов воспалительного отклика и ферменты. Кроме того, множество вторичных воспалительных медиаторов генерируются in situ ферментативными реакциями активированных тучных клеток, в том числе супероксидных и липидных производных медиаторов. В дополнение к этому, при дегрануляции тучных клеток выделяется несколько больших молекул: протеогликаны, пероксидаза, арилсульфатаза В и особенно трипсиноподобная протеаза и химотриптиновая протеиназа (химаза) (Drug therapy of asthma (Медикаментозная терапия астмы), С ар. 62, 1054-54). Эти химические выделения из тучных клеток являются, очевидно, ответственными за ранний бронхиально-стенозный отклик, возникающий у обладающих повышенной чувствительностью лиц после воздействия на них аэроаллергенов. Ранняя астматическая реакция является максимальной в течение приблизительно 15 минут после воздействия аллергенов, а восстановление происходит через 1-2 ч. У 25-35% лиц ранняя астматическая реакция сопровождается снижением респираторной функции в пределах нескольких часов и является максимальной через 6-12 ч после аллергенного воздействия. Эта поздняя астматическая реакция сопровождается значительным увеличением количества воспалительных клеток, проникающих в мягкие мышечные и эпителиальные ткани бронхов и вытекающих в дыхательные пути. Такими клетками являются эозинофилы, нейтрофилы и лимфоциты - все они притягиваются к данному месту выделениями тучными клетками производных хемотактных агентов. Просачивающиеся клетки активируются сами по себе на поздней стадии реакции. Поздний астматический отклик является, как полагают, вторичной воспалительной реакцией, частично опосредованной секреторной активностью макрофагов. Соответствующая группа воспалительных реакций наблюдается в слизистой оболочке верхнего дыхательного пути обычно в ответ на воздействие аэроаллергенов. Как и при астме, тучные клетки активируются поперечным связыванием молекул IgE с особыми антигенами. При аллергическом, хроническом и вазомоторном рините тучные клетки могут активироваться и без ощутимого воздействия особого антигена. В любом случае, активированные тучные клетки выделяют первичные и вторичные медиаторы воспаления после дегрануляции. Для сохранения воспалительной реакции к данному месту притягиваются эозинофилы и макрофаги. На поздних стадиях реакции часто происходит разрушение носовой эпителиальной ткани. Основной секреторной протеазой тучных клеток человека является триптаза, которая, как полагают, вовлекается в процессирование нейропептидов и воспаление тканей. Созревшая триптаза человека является гликозилированным, гепарин-ассоциированным тетрамером гетерогенных каталитически активных субъединиц. Аминокис лотная последовательность мономера триптазы, подобно ее генной структуре, не имеет близкого соответствия среди множества других исследованных сериновых протеиназ (см., например, Vanderslice et al. (1990) Рroc. Natl. Acad. Sci. USA 87:3811-3815; Miller et al. (1990) J. Clin. Invest. 86:864-870; Miller et al. (1989) J. Clin. Invest. 84:1188-1195; Vandreslice et al. (1989) Biochemistry 28:4148-4155). Триптаза сохраняется в секреторных гранулах тучных клеток. После активации тучных клеток триптаза человека легко поддается измерениям в различных биологических жидкостях. Например, после анафилаксии триптаза появляется в токе крови, где присутствие ее можно наблюдать в течение нескольких часов (Schwartz et al., (1937) N. EngI. J. Med. 116:1622-1626). Она обнаруживалась в образцах носовой и легочной промывной жидкости из атопических объектов, стимулированных специфическим антигеном (Castells and Schwartz (1988) J. Allerg. Clin. Immunol. 82:348-355; Wenzel et al. (1988) Am. Rev. Resp Dis. 141:563-568). Уровни триптазы в легочной промывной жидкости у атонических астматиков возрастают после эндобронхиального аллергенного стимулирования (там же). У некоторых курильщиков сигарет отмечается резкий подъем уровня триптазы в бронхоальвеолярной промывной жидкости по сравнению с некурящими пациентами, являясь подтверждением предположения о том, что выделение протеиназ из активированных тучных клеток может способствовать деструкции легких курильщиков при эмфиземе (KaIenderian et al. (1988) Chest 94:119123). Кроме того, было показано, что триптаза является сильным мутагеном для вибробластов, что позволяет говорить о ее вовлечении в фиброз легких и болезни средних легких (Ruoss et al. (1991) J. Clin. Invest. 88:493-499). Триптазу привлекали к самым различным биологическим процессам, в том числе к деградации сосудорасширяющих и бронхорелаксирующих нейропептидов (Caughey et al. (1988) J. Pharmacol. Exp. Ther. 244:133-137; Franconi et al. (1988) J. Pharmacol. Exp. Ther. 248:947-951: Tam et al. (1990) Am. J. Respir. Cell Mol. Biol. 3:27-32) и модуляции бронхиальной чувствительности к гистамину (Sekizawa et al. (1989) J. Clin. Invest. 83:175179). Согласно результатам этих исследований, триптаза, возможно повышает бронхостеноз при астме в результате разрушения бронхорасширяющих пептидов. Кроме того, было показано, что триптаза расщепляет a-цепи фибриногенов, а также высокомолекулярный кининоген, возможно с выделением кининов, и, таким образом, вместе с гепарином может играть роль локального антикоагулянта. Способность триптазы активировать простромелизин (про-ММР-3) и проколлагеназу (про-ММР-1) через ММР-3 указывает на то, что триптаза может также вовлекаться в воспаление и реконструкцию тканей. Эти факты также свидетельствуют о том, что триптаза может участвовать в деструкции суставов при ревматоидном артрите. Кроме того, было показано, что триптаза расщепляет кальцитониновый генносоотнесенный пептид. А поскольку этот пептид привлекается к нейрогенному воспалению, триптаза может служить регулирующим 6 42719 фактором реакций-вспышек при нейрогенных воспалениях кожного покрова (Caughey (1991) Am. J. Respir. Cell Mol. Biol. 4:387-394). Астма стала наиболее широко распространенным хроническим заболеванием в промышленно развитых странах. На сегодняшний день обычные методы и терапевтические агенты лечения астмы и других иммуноопосредованных воспалительных расстройств являются малоэффективными. В связи с этим, желательно найти улучшенные составы и методы, позволяющие избежать недостатков обычных агентов и методов и, таким образом, обеспечить эффективное лечение этих заболеваний. Настоящим изобретением предлагаются новые ингибиторы триптазы, содержащие соединения с формулой I: R1 R5 R6 O Ar N , , , где m - целое число от 3 до 6, n - целое число от 0 до 3, р - целое число от 0 до 2, q - целое число от 0 до 2; r - целое число от 0 до 5; s - целое число от 0 до 2; t - целое число от 1 до 3; u 1 или 2; v – це-лое число от 3 до 6; и w - целое число от 0 до 3; А - -СН =СН- или -СºС-; и Х - NH- или –СН2-; R4 - низший алкил, замещенный арилалкил или замещенный гетероарилалкил и R5 и R6 – выбираются независимо друг от друга из группы, состоящей из водорода, низшего алкила, замещенного арилалкила и замещенного гетероарилалкила; или R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, и R6 - водород; или R4 и R6 вместе с азотом и углеродом, с которыми они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, и R5 - водород; и R7 - -ОR8 или –NR8R9, где R8 и R9 выбираются независимо друг от друга из группы, состоящей из водорода, низшего алкила, арила, арилалкила или гетероарилалкила, или R8 и R9 вместе с азотом, с которым они связаны, образуют замещенный 5-членный или 6-членный гетероцикл. В предпочтительном варианте осуществления изобретения Аr является 1-гидрокси-2-нафтилом, 2-гидроксил-1-нафтилом, 3-гидрокси-2-пиридилом или 2-гидрокси-3-хиноксалилом; R1 - водород; R2 водород; R3 - выбирается из группы, состоящей из: R7 N O O R2 R3 R4 или их фармацевтически приемлемую соль, где: Аr - гидроксильно-замещенный арил или гидроксильно-замещенный гетероарил, где гидроксил занимает орто-положение в цепи с амидной стороны и где при Аr являющимся гидроксильнозамещенным арилом, ароматическое кольцо, содержащеецепь с амидной стороны, не замещается галогеном и не содержит низшую алкильную группу в орто-положении к гидроксилу; R1 - водород, низший алкил, арилалкил или гетероарилалкил; R2 - водород или низший алкил; R3 - выбирается из группы, состоящей из: , , , , , где m - целое число от 3 до 8, n - целое число от 0 до 3, p - целое число от 0 до 2, q - целое 7 42719 бенно гиперреактивности, связанной с хронической астмой, эти фармацевтические составы приготавливаются в формах аэрозолей, порошков или растворов. При использовании для лечения иммуномедиаторных воспалений кожи соединения согласно изобретению используются в комбинациях с нетоксичными, фармацевтически приемлемыми носителями для местного наружного применения. Предлагаемые соединения могут использоваться в комбинациях с антивоспалительными агентами и другими способами лечения астмы, такими как b-адренергические агонисты, противовоспалительные кортикостероны, антихолинергическими средствами и др. На фиг. 1 показан график изменения во времени удельной стойкости легких овцы после антигенного стимулирования. Здесь светлыми квадратиками показаны контрольные величины, а зачерненными кружками - величины удельного сопротивления для того же животного после введения ему соединения 3 согласно табл. I и II. На фиг. 2 показана диаграмма продуцирования гиперреактивности овцы на индуцированное карбохолом сужение бронхов через 24 ч после аллергенного стимулирования, когда перед карбохолом животному было введено соединение 3 согласно табл. I и II. Здесь прямоугольник с темной штриховкой соответствует контрольной, базовой линии; левый прямоугольник с более светлой штриховкой соответствует медикаментозной базовой линии; правый прямоугольник с более светлей штриховкой соответствует контрольному замеру после антигенного воздействия; и, наконец, незаштрихованный прямоугольник соответствует медикаментозному лечению после антигенного воздействия. Описание конкретных примеров осуществления изобретения 1. Определения и общие параметры Терминология, использованная в настоящем описании, полностью соответствует данным ниже определениям. Термин "иммуномедиаторное воспалительное расстройство" охватывает все заболевания, связанные с выделениями медиаторов тучных клеток и поддающимися лечению ингибитором триптазы. В качестве примеров таких расстройств можно назвать заболевания, связанные с гиперреактивностью непосредственного типа, такие как астма, аллергический ринит, крапивница и ангионевротический отек, экзематозный дерматит (атонический дерматит), анафилаксия, а также гиперпролиферативные заболевания кожи, пептическая язва, воспалительные расстройства кишечника, воспаления кожи и др. Термин "гиперреактивность" относится к связанным с хронической астмой поздней фазе сужения бронхов и гиперреактивности дыхательных путей. Гиперреактивность астматической бронхиальной ткани является, очевидно, результатом реакций хронического воспаления, которые раздражают и повреждают эпителий, выстилающий стенки дыхательных путей, и способствуют патологическому утолщению нижележащей ткани. Термин "галоген" относится к атомам фтора, брома, хлора, йода. Термин "гидроксил" относится к группе -ОН. число от 0 до 2; w - целое число от 0 до 3; А -СН=СН- или -СºС-; Х - -NH- или -СН-; R4 - низший алкил и R5 и R6 - водород, либо R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл и R6 – водород, и R7 - -ОН, -ОСН3, -NH2, 3'-аминокарбокси-1'-пиперидил или -N(CH3)2. Особенно предпочтительным ингибитором триптазы с формулой 1 является соединение 3 из табл. I и II: H CONH2 O N N O OH H N HN NH2 Другим предпочтительным ингибитором триптазы с формулой 1 является соединение 15 из табл. I и II: N OH CONH2 O H N O H HN N NH2 Описанные здесь соединения могут использоваться для предотвращения и лечения иммуномедиаторных воспалительных расстройств и особенно расстройств, связанных с дыхательным трактом, в том числе астмы и особенно гиперреактивной фазы, связанной с хронической астмой и аллергическим ринитом. Таким образом, настоящим изобретением предлагается также способ лечения иммуномедиаторных воспалительных расстройств, при котором пациент, страдающий иммуномедиаторным воспалительным расстройством, то есть чувствительный к лечению ингибитором триптазы, получает терапевтически эффективную дозу или количество соединения согласно изобретению. Изобретением предлагаются также фармацевтические составы описанных здесь соединений. Эти составы могут иметь самые различные формы, в том числе дозированных единиц для перорального введения, а также растворов для инъекций и вливания. Обычно при использовании в целях профилактики или лечения астмы и осо 8 42719 Термин "низший алкил" относится к циклическим, разветвленным и неразветвленным алкильным группам из 1-6 атомов углерода. Далее этим термином именуются такие группы, как метильная, этильная, n-пропильная, i-пропильная, n-бутильная, t-бутильная, i-бутильная (или 2-метилпропильная), циклопропилметильная, i-амильная, nамильная и гексильная. Термин "арил'' или "Аr" относится к ароматической карбоциклической группе, имеющей одно кольцо (например, фенил), множество колец (например, бифенил) или множество конденсированных колец, из которых по меньшей мере одно кольцо является ароматическим например, 1,2,3,4-тетрагидронафтил, нафтил, антрил, пенантрил, которое могут замещаться или не замещаться, например, галогеном, низшим алкилом, низшим алкокси, низшим алкилтио, трифторметилом, низшим ацилокси, арилом, гетероарилом и гидрокси. Однако, согласно изобретению, ароматическое кольцо, содержащее амидостороннюю цепь не может более замещаться галогеном. Кроме того, ароматическое кольцо, имеющее амидостороннюю цепь, не может иметь низшую алкильную группу орто с гидроксильной группой (то есть мета с амидосторонней цепью). Термин "гетероцикл" относится к насыщенным, ненасыщенным и ароматическим карбоциклическим группам, имеющим одно кольцо (например, морфолино, пиридил или фурил) или множество конденсированных колец (например, нафтиридинил, хиноксалил, хинолинил, индолизинил или бензо[b]тиэнил), а внутри кольца - по меньшей мере один гетероатом, такой как N, О или S, который может замещаться или не замещаться, например, галогеном, низшим алкилом, низшим алкокси, низшим алкилтио, трифторметилом, низшим ацилокси и гидрокси. Термин "гетероарил" или "HetAr" относится к гетероциклу, в котором по меньшей мере одно гетероциклическое кольцо является ароматическим. Термин "арилалкил" относится к группе -R-Ar, где Ar - арильная группа, a R – неразветвленноцепная или разветвленноцепная алифатическая группа. Арилалкильные группы могут быть как замещенными, так и незамещенными, например, галогеном, низшим алкилом, низшим алкокси, низшим алкилтио, трифторметилом, низшим ацилокси и гидрокси. Термин "гетероарилалкил" относится к группе -R-HetAr, где HetAr - гетероарильная группа, a R неразветвленноцепная или разветвленноцепная алифатическая группа. Гетероарильные группы могут быть как замещенными, так и незамещенными, например, галогеном, низшим алкилом, низшим алкокси, низшим алкилтио, трифторметилом, низшим ацилокси и гидрокси. Термин "фармацевтически приемлемая соль" относится к солям, сохраняющим биологическую эффективность и свойства родительского соединения и не являющиеся нежелательными по своим биологическим и другим характеристикам. Термин "фармацевтически или терапевтически приемлемый носитель" относится к средам носителей, которые не снижают эффективность биологического действия активных ингредиентов и не являются токсичными по отношению к хозяину или пациенту. Термин "стереоизомер" относится к химическим соединениям, имеющим одинаковые молекулярный вес, химический состав и конституцию, но различным образом сгруппированные атомы. Иными словами, некоторые их идентичные химические части имеют различную ориентацию в пространстве и, следовательно, в чистом виде обладают способностью вращать плоскость поляризации света. Однако некоторые чистые стереоизомеры могут давать такое слабое оптическое вращение, что его не всегда можно обнаружить с помощью нынешнего инструментария. Соединения согласно изобретению могут иметь один и более асимметричных атомов углерода и, следовательно, давать различные стереоизомеры. Все эти стереоизомеры охватываются объемом настоящего изобретения. Термин "лечение" относится к любому введению ингибитора триптазы in vitro или in vivo и охватывает: (1) ингибирование симптомов заболевания; (2) ослабление или ингибирование долговременных эффектов заболевания; и (3) облегчение симптомов заболевания. II. Ингибиторы триптазы Настоящим изобретением предлагаются составы, содержащие эффективный ингибитор серинпротеазы, а точнее ингибитор триптазы, то есть используемый для снятия иммуномедиаторных воспалительных расстройств и, в частности, бронхостеноза, индуцируемого аллергическим стимулом в астматическом организме. Ингибиторы триптазы являются веществами, снижающими или предотвращающими активность триптазы. Согласно одному из аспектов изобретения, ингибиторы триптазы содержат соединение с формулой I: R1 R5 R6 O Ar N R7 N O O R2 R3 R4 или его фармацевтически приемлемую соль, где: Аr - гидроксил-замещенный арил или гидроксил-замещенный гетероарил, где гидроксил размещен орто к амидосторонней цепи и где, если Аr является гидроксил-замещенным арилом, ароматическое кольцо, содержащее амидостороннюю цепь, не замещается галогеном и не содержит низшую алкильную группу в положении орто к гидроксилу; R1 - водород, низший алкил, арилалкил, гетероарилалкил; R2 - водород или низший алкил; R3 - выбирается из группы, состоящей из: 9 42719 где m - целое число от 3 до 6, n - целое число от 0 до 3, р - целое число от 0 до 2, q - целое число от 0 до 2; и w - целое число от 0 до 3; А -СН=СН- или -СºС-; Х - -NH- или –СН2-; R4 - низший алкил, а R5 и R6 - водород; или R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, a R6 – водород; и R7 - -ОН, -OCH3, -NH2, -3'-аминокарбокси, -1-пиперидил или -N(СН3)2. Предпочтительным ингибитором триптазы является соединение 3 по табл. I и II: H где m - целое число от 3 до 6, n - целое число от 0 до 3, р - целое число от 0 до 2, q - целое число от 0 до 2; r - целое число от 0 до 5; s – целое число от 0 до 2; t - целое число от 1 до 3; u 1 или 2; v - целое число от 3 до 6; w - целое число от 0 до 3; А - -СН=СН- или -СºС-; Х - -NH-или –СН2-; R4 - низший алкил, замещенный арилалкил или замещенный гетероарилалкил, а R5 и R6 выбираются независимо друг от друга из группы, состоящей из водорода, низшего алкила, замещенного арилалкила и замещенного гетероарилалкила; или R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, а R6 - водород; или R4 и R5 вместе с азотом и углеродом, с которыми они связаны образуют замещенный 4-членный, 5-членный или 6-членный гетероцикл, а R5 - водород; и R7 - -OR8 или –NR8R9, где R8 и R9 выбираются независимо друг от друга из группы, состоящей из водорода, низшего алкила, арила, арилалкила или гетероарилалкила, или R8 и R9 вместе с азотом, с которым они связаны, образуют замещенный 5-членный или 6-членный гетероцикл. В предпочтительном варианте осуществления Аr является 1-гидрокси-2-нафтилом, 2-гидроксил1-нафтилом, 3-гидрокси-2-пиридилом или 2гидрокси-3-хиноксалилом; R1 - водород; R2 – водород; R3 выбирается из группы, состоящей из: CONH2 O N N O OH H N HN NH2 Еще одним предпочтительным ингибитором триптазы является соединение 15 по табл. I и II: N OH CONH2 O H N O H HN N NH2 Еще одним предпочтительным ингибитором триптазы является соединение 21 по табл. I и II: 10 42719 CONH2 O H N OH таниях проводятся измерения индуцируемого триптазой гидролиза основанных на пептидах хромогенных веществ. Ниже один из таких процессов рассмотрен подробно. Кроме того, активность соединений согласно изобретению может быть оценена in vivo с помощью животной модели астмы (Larson, "Experimental Models of Reversible Airway Obstruction", in The Lung: Scientific Foundations, Crystal, West et al., eds., Raven Press, New York, 1991; Warner et al. (1990) Am. Rev. Respir. Dis. 141:253-257). С помощью идеальной животной модели можно было бы в точности отобразить основные клинические и физиологические характеристики астмы человека, в том числе гиперреактивность дыхательных путей к химическим медиаторам и физическим раздражителям; обратимую обструкцию дыхательных путей медикаментами, используемыми при лечении астмы человека (b-адренергические агенты, метилксантины, кортикостероны и др.); воспаление дыхательных путей с инфильтрацией активированных лейкоцитов; хронические воспалительные дегенеративные изменения, такие как утолщение основной мембраны, гипертрофия мягких мышц и повреждения эпителия. В качестве подопытных животных при этом могут использоваться мыши, крысы, морские свинки, кролики, собаки и овцы. Каждый из этих видов имеет свои ограничения, и правильный выбор животной модели будет зависеть от конкретных решаемых вопросов. Начальную астматическую реакцию можно оценивать на морских свинках и собаках, и особенно на африканских борзых, у которых развивается неспецифическая гиперреактивность дыхательных путей к целому ряду неаллергенных веществ, таких как метахолин и лимонная кислота. Некоторые селектированные породы овец проявляют двойственный отклик на антигенное стимулирование белками Ascaris. У животных с двойственным откликом за начальной астматической реакцией (IАR) следует поздняя астматическая реакция (LAR) через 6-8 ч после воздействия. У животных, у которых проявляется LAR, гиперчувствительность к холинэргическому агонисту – карбахолу - возрастает через 24 ч после антигенного стимулирования. Аллергические модели на овцах использовались для оценки потенциальных антиастматических эффектов соединений согласно изобретению. Введение составов, содержащих аэрозольные растворы предлагаемых соединений аллергическим овцам перед воздействием специфическими аллергенами и после него показывает, что такие составы значительно облегчают и/или снимают позднюю астматическую реакцию и последующую гиперреактивность. Предлагаемые соединения могут использоваться также при лечении других иммуномедиаторных воспалительных расстройств, в которых активность триптазы вносит вклад в патологическое состояние. К таким расстройствам относятся воспалительные заболевания, связанные с тучными клетками, такие как ревматоидный артрит, ревматоидный спондилит, остеоартрит, подагрический артрит и другие артритные состояния, вос N O HN HN NH2 Ингибиторы триптазы согласно изобретению могут быть получены известными методами из доступных исходных материалов так, как описано ниже. Соединения согласно изобретению могут в зависимости от природы функциональных групп образовывать дополнительные соли с различными неорганическими и органическими кислотами и основаниями. Эти соли могут образовываться с неорганическими кислотами, такими как соляная, бромисто-водородная, серная, фосфорная и др. кислоты, и органическими кислотами, такими как уксусная, пропионовая, гликолевая, пирувиновая, щавелевая, яблочная, малоновая, янтарная, малеиновая, фумаровая, винная, лимонная, бензойная, коричная, миндальная, метансульфокислота, метансульфокислота, р-толуолсульфокислота, салициловая и другие кислоты. Соли могут быть образованы также из остатков карбоновых кислот путем обработки их щелочными металлами или основаниями щелочных металлов, такими как гидроксиды и алкоксиды щелочных металлов, или щелочноземельными металлами либо основаниями щелочноземельных металлов, такими как гидроксиды и алкоксиды щелочноземельных металлов. Кроме того, соли могут быть образованы из карбоновой кислоты и органического основания, такого как триметиламин, диэтиламин, этаноламин, пиперидин, изопропиламин, холин, кофеин и т.п. Соли могут быть образованы обычными средствами, например, путем реакции свободнокислотных или основных форм продукта с одним или более эквивалентами соответствующего основания или кислоты в растворителе или среде, в которых соль является нерастворимой, или в растворителе, таком как вода, который затем удаляется вакуумной отгонкой или морозильной сушкой, либо обменом катионов существующей соли на другие катионы соответствующего ионообменного полимера. III. Испытания in vitro и in vivo В данной области техники хорошо известны методики in vitro отбора потенциальных ингибиторов по их способности ингибировать триптазу (см., например Sturzebecher et al. (1992) Biol. Chem. Hoppe-Seyler 373:1025-1030). Обычно в этих испы 11 42719 паления кишечника, пептическая язва и различные заболевания кожи. Эффективность предлагаемых соединений при лечении ими преобладающего большинства иммуномедиаторных воспалительных расстройств может быть оценена как in vitro, так и in vivo методиками. Так, противовоспалительная эффективность предлагаемых соединений может быть продемонстрирована путем испытаний методами, хорошо известными специалистам в данной области, например, методом обратной пассивной реакции Артуса (RPAR)-PAW (Ganguly еt аl. 1992. Патент США № 5126352). Хорошо известны методики оценки терапевтической эффективности медикаментозных соединений при лечении различных заболевании кожи, таких как гиперпролиферативные заболевания кожи например, арахидонокислотные испытания на мышином ухе (там же). Оценку эффективности предлагаемых соединений при лечении язвы можно производить по методикам, описанным в Chiu et al. (1984) Archives Internationales de Pharmacodynamie et de Therapie 270:128-140. IV. Введение составов in vivo Согласно изобретению, пациенту, страдающему иммуномедиаторным воспалительным расстройством, вводится терапевтически или фармацевтически эффективное количество ингибитора триптазы и, в частности, соединения с формулой I. Согласно одному из вариантов осуществления изобретения, предлагаемые составы могут применяться для предотвращения и облегчения астматических состояний. При применении этих составов для лечения астмы предлагаемые соединения могут назначаться как в профилактических целях до воздействия аллергенами или другими ускоряющими факторами, так и после такого воздействия. Эти соединения особенно эффективны при облегчении поздних фаз деструкции тканей как при сезонных, так и при круглогодичных ринитах. Другим своим аспектом данное изобретение направлено на предотвращение и лечение других иммуномедиаторных воспалительных расстройств, связанных с тучными клетками, таких как крапивница и ангионевротический отек, экзематозный дерматит (атопический дерматит), анафилаксия, а также гиперпролиферативные заболевания кожи, пептическая язва и т.п. Составы, содержание данное соединение, могут назначаться как в профилактических, так и в терапевтических целях. При терапевтическом применении данные составы вводятся пациенту, страдающим тем или иным заболеванием, в количествах, достаточных для лечения или по меньшей мере частичного останова развития симптомов заболевания и его осложнений. Адекватное выполнению этой задачи количество медикамента именуется здесь "терапевтически эффективным количеством или дозой". Эффективное количество состава зависит от тяжести и течения заболевания, предшествующей терапии, состояния здоровья пациента и его реакции на данный медикамент, а также от мнения лечащего врача. При профилактическом применении составы, содержание предлагаемые соединения, назначаются пациенту, восприимчивому к данному заболеванию или находящемуся в группе его риска. Такое количество именуется здесь "профилактически эффективным количеством или дозой". В этом случае также точное количество соединения зависит от состояния здоровья пациента, его веса и т.п. факторов. В том случае, если наступило улучшение состояния пациента, может назначаться поддерживающая доза. Впоследствии дозы и частота приема лекарства могут уменьшаться в зависимости от проявляемых симптомов до уровня, при котором сохраняется улучшенное состояние. В том случае, если происходит снижение симптомов до желаемого уровня, лечение может быть прекращено. Однако в случае возобновления симптомов заболевания пациент может потребовать периодического лечения на долговременной основе. Вообще говоря, эффективная доза ингибитора триптазы находится в пределах от 0,1 до 1000 мг в день, предпочтительно от 1 до 100 мг в день. Эту дозу желательно разделять на две, три, четыре и более субдоз, принимаемых с соответствующими интервалами в течение дня. Эти субдозы могут приниматься в форме одной дозировочной единицы, содержащей, например, от 5 до 1000 мг, предпочтительно от 10 до 100 мг активного ингредиента. Используемые в этой терапии составы могут иметь самые различные формы, например, твердых, полутвердых и жидких дозировочных единиц, таких как таблетки, пилюли, порошки, жидкие растворы и суспензии, липосомы, растворы для инъекций и вливаний. Назначение той или иной формы зависит от предполагаемого способа введения медикамента и его терапевтического применения. Несмотря на возможность назначать пациенту чистый активный ингредиент, предлагаемый изобретением, предпочтительно все же применять его в виде части фармацевтического состава. Такой состав согласно изобретению включает в себя по меньшей мере одно предлагаемое соединение или ингибитор в терапевтически или фармацевтически эффективной дозе вместе с одним или более фармацевтически или терапевтически приемлемыми носителями и, возможно, другими терапевтическими ингредиентами. С различными мнениями по этому вопросу можно ознакомиться, например, в работах Гильмана (Gilman et al. (eds) (1990) Goodman and Gilman's: The Pharmacological Bases of Therapeutics, 8th Ed., Pergamon Press) и Ремингтона (см. выше). В этих работах рассматриваются методы введения медикаментов – перорального, внутривенного, внутриперитонеального, внутримышечного и др. В качестве фармацевтически приемлемых носителей при этом используются вода, физиологический раствор, буферы и другие соединения, описанные, например, в Меrсk Index, Меrсk. & Со., Rahway, NJ. При использовании предлагаемых соединений для лечения астмы или аллергического ринита они могут приготавливаться в форме аэрозолей. Под термином "аэрозоль" здесь понимается газовая взвесь соединения, введение которой можно осуществлять путем вдыхания в бронхиальные или носовые проходы. Аэрозоль может приготавливаться также в форме газокапельной суспензии предлагаемого соединения, в том числе в дозированных ингаляторах или распылителях и т.п. В по 12 42719 нятие "аэрозоль" включаются также сухие порошковые составы предлагаемых соединений, взвешенных в воздухе или других газах-носителях и вводимых, например, путем вдувания ингалятором. Предпочтительные концентрации растворов, используемых для приготовления аэрозолей согласно изобретению, находятся в пределах 0,1100 мг/мл, более предпочтительно 0,1-30 мг/мл и наиболее предпочтительно 1-10 мг/мл. Обычно эти растворы буферизуются физиологически приемлемыми буферами, такими как фосфаты или бикарбонаты. Величина рН при этом находится в пределах 5-9, предпочтительно 6,5-7,8 и более предпочтительно 7,0-7,6. Обычно для заведения осмотичности раствора в физиологический диапазон, предпочтительно в пределах 10% от изотонического, в него добавляют хлорид натрия. Техника приготовления таких растворов в форме аэрозольных ингалянтов рассматривается в [Remington's Pharmaceutical Sciences], а также в [Ganderton and Jones, Drug Delivery to the Respiratory Tract, Ellis Horwood (1987); Gonda (1990) Critical Reviews in Therapeutic Drug Carrier Systems 6:273-313; and Raeburn et al. (1992) J. Pharmacol. Toxicol. Methods 27:143-159]. Растворы предлагаемых соединений могут приготавливаться в форме аэрозолей любым из известных способов, обычно используемых при изготовлении фармацевтических ингалянтов. В общем случае такие методы включают в себя заполнение газом под давлением или предоставление средств для заполнения газом (обычно инертным газом-носителем) и пропускания сжатого газа через малое отверстие, вытягивая тем самым капли раствора в ротовую полость и трахею пациента, которому данное лечение назначено. Обычно на выходное отверстие контейнера насаживается мундштук, облегчающий введение взвеси в ротовую полость и трахею. В одном из вариантов осуществления изобретения предлагаемые устройства содержат растворы предлагаемых соединений, связанные с используемыми при лечении астмы средствами создания аэрозолей или содержащие такие средства в себе, к которым относятся дозированные ингаляторы, струйные и ультразвуковые распылители. Такое устройство может содержать также мундштук, насаживаемый на выходное отверстие. Для лечения аллергического ринита устройство может содержать раствор предлагаемого соединения в носовом распылителе. Одним из вариантов осуществления изобретения является также сухой порошок, содержащий предлагаемое соединение и, возможно, эксципиент. Такой медикамент может вводиться с помощью порошкового ингалятора, содержащего вышеописанный порошок. Вполне понятно, что способы согласно изобретению могут использоваться в комбинациях с другими агентами, предназначенными для лечения иммуномедиаторных воспалительных расстройств и, в частности, астмы. Особенно эффективными в таких комбинациях могут являться bадренергические агонисты, ввиду их высокой способности приносить симптоматическое облегчение начальной астматической реакции, в то время предлагаемые соединения дают облегчение поздней астматической реакции. Предпочтительными b-адренергическими агонистами в этих растворах являются любые обычные b-агонисты, используемые для облегчения астмы, такие как альбутерол, тербуталин, формотерол, фанотерол и преналин. В число других агентов, которые могут использоваться в комбинациях с предлагаемыми соединениями, входят антихолинергические агенты, такие как ипратропийбромид, и противовоспалительные кортикостероны (адренокортикальные стероиды), такие как беклометазон, триамцинолон, флуризолид, дексаметазон. Предлагаемые соединения могут также применяться при лечении иммуномедиаторных воспалительных заболеваний кожи, таких как крапивница и ангионевротический отек, экзематозный дерматит, и гиперпролиферативные заболевания кожи у животных, например, псориаз. При наружном местном применении соединения с формулой 1 можно ожидать ремиссию этих симптомов. Так, у больных, страдающих иммуномедиаторными воспалительными заболеваниями кожи, можно ожидать уменьшения шелушения, эритемы, размеров бляшек, прурита и других симптомов, связанных с состоянием кожи. Дозировка медикамента и продолжительность времени, требуемые для успешного лечения, у разных пациентов могут быть различными и легко определяться с приведением их в соответствие с применяемым курсом лечения. Изобретением предусматривается также его осуществление в форме препаратов для местного наружного применения на коже, содержащих соединение с формулой 1 в концентрациях обычно в пределах от 0,001% до 10%, вместе с нетоксичным, фармацевтически приемлемым носителем для местного наружного применения. Эти препараты могут приготавливаться путем комбинирования активного ингредиента согласно изобретению с обычными фармацевтическими разбавителями и носителями, находящими применение в фармацевтической технологии приготовления сухих, жидких, кремовых и аэрозольных препаратов для местного наружного применения. Мази и кремы могут, например, приготавливаться на водной или масляной основе с добавками соответствующих загустителей и/или гель-образующих агентов. В качестве основы при этом могут применяться вода и/или масла, такие как жидкий парафин и растительное масло, например, ореховое или касторовое масло. В качестве загустителей в соответствии с природой основы препарата могут использоваться такие вещества, как мягкий парафин, стеарат алюминия, цетостеариловый спирт, пропиленгликоль, полиэтиленгликоли, ланолин, гидрогенизированный ланолин, пчелиный воск и др. Лосьоны могут приготавливаться на водной или масляной основе и, в общем случае, могут включать в себя следующие вещества: стабилизирующие агенты, эмульгирующие агенты, диспергирующие агенты, суспендирующие агенты, загустители, красители, ароматизаторы и т.п. Порошковые препараты могут приготавливаться с использованием любой соответствующей порошковой основы, например, талька, лактозы, крахмала и т.п. Капельная форма порошковых 13 42719 препаратов может приготавливаться как на водной, так и неводной основе и содержать также диспергирующие агенты, суспендирующие агенты, агенты повышения растворимости и т.п. Фармацевтические составы для местного наружного применения согласно изобретению могут включать в себя предохраняющие и бактериостатические агенты, например, гидроксибензоат, пропилгидроксибензоат, хлоркрезол, хлориды бензалкония и т.п. Фармацевтические составы для местного наружного применения могут содержать и другие активные ингредиенты, такие как антимикробные агенты и, в частности, антибиотики, анестетики, анальгетики и противозудные агенты. Соединения согласно изобретению могут применяться также при лечении пептической язвы. В частности, они проявляют хемотерапевтическую активность, позволяющую им ослаблять симптомы пептической язвы и стрессового изъязвления и способствовать заживлению гастрических и/или дуоденальных язв. Эти соединения могут применяться совместно с другими терапевтическими агентами, такими как антивоспалительные и/или анальгизирующие агенты, например, аспирином, индометацином, фенилбутазоном, ибупрофеном, напроксеном, толемтимом и т.п. Данные фармацевтические составы могут вводиться парентерально или перорально как в профилактических, так и в терапевтических целях. Их дозы и формы зависят от способа введения. Например, для перорального введения фармацевтические составы могут приготавливаться в форме порошков, таблеток, пилюль, капсул и драже. Может применяться также внутривенное введение данных составов. Так, настоящим изобретением предусматриваются составы для внутривенного введения, которые содержат раствор соединения, растворенного или суспендированного в соответствующем, предпочтительно водном, носителе. При этом могут использоваться самые различные водные носители, в том числе вода, буферизованная вода, 0,4%-й физиологический раствор и др. Данные составы могут также подвергаться стерилизации обычными, хорошо известными методами, либо пропускаться через стерильные фильтры. Приготовленные водные растворы могут дозироваться для применения без дополнительной обработки либо подвергаться лиофилизации перед их введением в форме лиофилизованного препарата, комбинированного со стерильным водным раствором. Составы могут содержать фармацевтически приемлемые дополнительные вещества, требующиеся для приближения к физиологическим условиям, такие как рНрегулирующие и буферизующие агенты, регуляторы тонизированности, смачивающие агенты и т.п., такие, например, как ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция, монолаурат сорбитана, олеат триэтаноламина и т.п. В твердых составах могут использоваться нетоксичные твердые носители фармацевтической чистоты, такие, например, как маннит, лактоза, крахмал, стеарат магния, натрийсахарин, тальк, целлюлоза, глюкоза, сахароза, карбонат магния и др. Для перорального введения фармацевтически приемлемый нетоксичный состав приготавливают с добавлением любого, обычно используемого эксципиента, такого как вышеперечисленные носители, и обычно 0,1-95%, предпочтительно около 20%, активного ингредиента. С целью дать более глубокое представление о существе изобретения ниже приводятся некоторые примеры его практического осуществления. Вполне понятно, что эти примеры носят чисто иллюстративный характер и ни в коей мере не ограничивают идею и объем настоящего изобретения. Экспериментальная часть І. Общие сведения Неуказанные здесь исходные материалы могут быть легко приобретены либо приготовлены хорошо известными методами. Соединение с формулой І может быть получено по известной технологии твердофазного или жидкофазного синтеза. Исходные материалы для получения соединений с формулой І хорошо известны специалистам в данной области и могут быть получены хорошо известными методами. Например, методы твердофазного синтеза полипептидов списаны в работе [Solid Phase Peptide Synthesis: A Practical Approach, (eds. E. Atherton and R.C. Sheppard) IRL Press at Oxford University Press (1989)], а также в [Merrifield, J. Amer. Chem. Soc. 85:2149-2156 (1963)]. Имеется описание также пептид-связывающей химической технологии The Peptides, Vol. 1, (eds. Gross, E., and J. Meienhofer), Academic Press, Orlando (1979). Известны и другие методы, описанные в работах Geysen et al., J. Imm. Meth., (1987) 102:259-274; Hougten et al., Nature (1991) 154:84-86. В рассматриваемом здесь процессе получения соединений согласно изобретению требования, предъявляемые к защитным группам, в общем случае хорошо известны специалистам по органической химии. В связи с этим, в приводимых здесь описаниях процессов приготовления использование соответствующих защитных групп считается общеизвестным и не требующим подробных разъяснений. Выделение и очистка описанных здесь соединений и промежуточных продуктов могут осуществляться при желании любыми соответствующими методами, такими, например, как фильтрация, экстрагирование, кристаллизация, колоночная хроматография, тонкослойная и толстослойная хроматография, жидкостная хроматография высокого давления, либо комбинации этих методов друг с другом. Специфическое освещение подходящих процессов сепарирования и выделения можно найти в литературе по ссылкам в рассматриваемых ниже примерах, однако наряду с ними могут использоваться также другие эквивалентные методы сепарирования и выделения. Для детектирования аргинина и пептидов, содержащих аргинин, использовались испытания методом Сакагути [Stewart and Young] (Stewart and Young "Solid Phase Рeptide Synthesis", 2d Ed., Pierce Chemical Company, p. 114). Был приготовлен раствор I, содержащий 0,01% a-нафтола и 5% мочевины в 95% этанола. Раствор II приготавливался растворением 2 г бромина в 100 мл 8%-го водного раствора гидроксида натрия. В раствор I добавили 5 таблеток гидроксида натрия. Анализ 14 42719 образца осуществлялся с помощью тонкослойной хроматографии (TLC). Хроматографический планшет с пятном образца оросили раствором I. Затем планшет был просушен на воздухе и орошен раствором 2. Образовавшееся красное пятно указывало на существование аминоиминометановые группы. II. Твердофазный синтез соединений с формулой I А. Получение соединения 3 по табл. I и II Была приготовлена суспензия 4-(2',4'диметоксифенил-фторенилметилоксикарбонил (Fmос)-аминометил-феноксидной смолы (смолы Ринка; Bachem, шт. Калифорния, США): 3,5 г при загрузке 0,289 мэкв/г, 1,01 ммоля в 30 мл раствора N,N-диметилформамида (DМF) в толуоле в соотношении 1:1, содержащего 30% (об.) пиперидина. Реакционную смесь перемешивали в течение 5 мин, а затем отфильтровали. Далее в нее был добавлен раствор пиперидина (30 мл), и смесь перемешивали в течение еще 5 мин. После фильтрации смоляные гранулы были промыты вначале DМF (6 раз), а затем метиленхлоридом (6 раз). В 30 мл DMF были растворены Fmoc-L-пролин (Milligen; 6,06 ммоля), бензотриазол-1-ил-окси-три(диметиламин)-фосфонийгексафторфосфат (ВОР, Novabiochem; 6,06 ммоля) и 1-гидроксибензотриазол (НОВТ, AIdrich; 6,06 ммоля). Полученный светлый раствор был добавлен в смолу Ринка, и суспензию перемешивали (путем барботирования азотом) в течение 4 ч. Реакционную смесь отфильтровали, а смоляные гранулы промыли так, как описано выше. Группа Fmoc была удалена пиперидином так, как списано выше. Раствор Fmoc-L-аргинина (РМС) (Millsgen; 6,06 ммоля), ВОР (6,06 ммоля) и НОВТ (6,06 моля) в DMF (30 мл) был добавлен в смоляные гранулы, и суспензию перемешивали в течение 4 ч, а затем отфильтровали, промыли, обработали пиперидином и вновь промыли так, как описано выше. Раствор 1-окси-2-нафтоиновой кислоты (AIdrich; 1,14 г, 6,06 ммоля), 1,3-диизопропилкарбодиимида (DIPCDI; Aldrich; 0,949 мл, 6,06 ммоля) и НОВТ (0,819 г, 6,06 мл) в DMF (45 мл) был добавлен в реакционную смесь, которую затем перемешивали (механической качающейся мешалкой) в течение 7 ч. После фильтрации, промывки и обработки пиперидином (как описано выше) смолу промыли последовательно DМF (6 раз), метиленхлоридом (6 раз) и метанолом (6 раз). Затем смолу суспендировали в метаноле и перемешивали (механической качающейся мешалкой) в течение 15 ч. Далее смолу отфильтровали и дважды промыли метанолом. Полученный свободно текущий продукт белого цвета был суспендирован в растворе трифторуксусной кислоты (TFA), анизола и воды (90:5:5, 30 мл). Смола тут же приняла розовый цвет, а затем потемнела в течение 1-2 мин до темнокрасного цвета. После 5 мин перемешивания реакционную смесь отфильтровали. Данный процесс повторили еще два раза со свежим расщепляющим реагентом с тем отличием, что время контакта было увеличено до 10 мин. TFA-растворы были совмещены, а полученный светло-оранжевый раствор оставили отстаиваться при комнатной температуре в течение 3,5 ч. После вакуумной концентрации был получен бледно-желтый маслянистый продукт, который был выдержан в вакууме (ниже 1 Top) в течение 3 ч. Затем масло растворили в 50%-м водном растворе ацетонитрила (100 мл) и лиофилизовали, получив в результате сырой продукт в виде твердого тела грязно-белого цвета (471 мг). Жидкофазный хроматографический анализ высокого давления (колонка 100А PLRP лаборатории Polymer Laboratories, 1,0х150 мм, элюирование с линейным градиентом от 20 до 45%-м ацетонитрилом в течение 13 мин с потоком 0,1 мл/мин) показал, что сырой продукт представлял собой практически одно соединение (время выдержки 10,35 мин, >98% по УФ поглощению). Очистку производили путем жидкофазной хроматографии высокого разрешения (ЖХВР) с использованием силикагель-колонки С18 (Vydac; 22х250 мм, 15-20 мкм, 300 Å, элюирование с линейным градиентом от 20 до 35% в течение 30 мин с потоком 10 мл/мин). Требовалось проводить многочисленные инъекции в количестве 3035 мг. Подобные фракции (время выдержки 4443 мин) были совмещены и лиофилизованы, в результате чего был получен продукт в форме пушистого твердого тела белого цвета (350 мг), представлявший собой (по результатам ЖХВР) одно соединение. Электрораспылительная масс-спектроскопия (расчетный молекулярный вес 440,49, измеренный М+1=441,1 и ЯМР спектроскопия (протонная и 13С) показали согласие с прогнозируемой структурой. Результаты ЯМР спектроскопии: 1 Н ЯМР (CD3OD) d 7,89 (d, J=8 Гц, 1H), 7,78 (d, J=6 Гц, 1H), 7,76 (d, J=6 Гц, 1H), 7,57 (dt, J=8,1 Гц, 1Н), 7,48 (dt, J=8,1 Гц, 1H), 7,29 (d, J=8 Гц, 1H), -4,95 (не определено, 1Н), 4,49 (dd, J=8,5 Гц, 1Н), 3,97 (dt, J=10,7 Гц, 1Н), 3,73 (dt, J=10,7 Гц, 1Н), 3,23 (t, I=7 Гц, 2Н), 2,29 (m, 1Н), 1,7-2,2 (m, 8Н). В. Получение других соединений с формулой I Следуя процедуре, описанной в разделе А, с заменой 1-окси-2-нафтоиновой кислоты следующими соединениями: 2-окси-4-метилбензойной кислотой; 3-окси-2-хиноксалинкарбоновой кислотой; 3-окси-2-нафтоиновой кислотой; 2-окси-1-нафтоиновой кислотой; 3-окси-2-пиридинкарбоновой кислотой; 4-окси-7-метил-3-нафтиридинкарбоновой кислотой; 2-окси-3-пиридинкарбоновой кислотой; 2-оксибензойной кислотой; 2,5-дисксибензойной кислотой; 2-окси-5-фенилбензойной кислотой (см. ниже Е), были получены следующие соединения: соединение 2 по табл. I и II; соединение 9 по табл. I и II; соединение 14 по табл. I и II; соединение 15 по табл. I и II; соединение 16 по табл. I и II; соединение 17 по табл. I и II; соединение 18 по табл. I и II; соединение 19 по табл. I и II; соединение 20 по табл. I и II; соединение 21 по табл. I и II. 15 42719 С. Получение других соединений с формулой І Следуя процедуре, описанной в разделе А, с заменой Fmоc-L-пролина Fmоc-D-пролином, было получено соединение 12 по табл. III. D. Получение дополнительных соединений с формулой І Для получения соединения 13 по табл. I и II вначале было проверено связывание Fmоc-Lфенилаланина со смолой с помощью процесса, аналогичного использованному выше в разд. А для связывания Fmоc-L-пролина. Затем Fmоcгруппа была удалена, а фенилаланин был связан с Fmоc-L-пролином. В остальном синтез соединения 13 был осуществлен по процессу, описанному выше в разд. А. Подобным же образом, для получения соединений 6 и 7 по табл. I и II использовалось связывание Fmoc-пиперидин-3-карбоновой кислоты и Fmоc-пиперидин-4-карбоновой кислоты соответственно со смолой, удаление группы Fmoc и затем связывание Fmоc-L-пролина. В остальном процесс синтеза был таким же, как описано выше в разд. А. Е. Получение 2-окси-5-фенилбензойной кислоты Синтез 2-окси-5-фенилбензойной кислоты производился следующим образом. Раствор защищенного тетрагидропираном (ТНР) 4-фенилфенола (474 мг, 2 ммоля, приготовленного из 4фенилфенола стандартным методом, описанным в [Green and Wuts, pp. 31-34]) в безводном THF (5 мл) был охлажден до -78°С и обработан бутиллитием (2 мл, 1,8 М в гексане). Реакционную смесь при перемешивании нагрели до комнатной температуры, образовав при этом суспензию рыжевато-коричневого цвета. Через 2 ч реакционную смесь охладили до -78°С и обработали избыточным безводным СО2 в течение нескольких минут. Затем, перемешивая, реакционную смесь нагрели до комнатной температуры. Через 2 ч смесь разделили между этиловым эфиром и водным 1н NaОH. Водный слой был охлажден до 0°С на льду и окислен до рН 2 1н водным раствором НСl. Водный раствор был разделен метиленхлоридом. Органический слой был высушен над сульфатом магния. После концентрации в вакууме был получен сырой продукт в форме грязно-белого твердого тела (258 мг, 2-окси-5-фенилбензойная кислота). ЯМР-спектроскопия сырого материала подтвердила его предполагаемую структуру. 1Н ЯМР (DMSO-d6) d 8,04 (d, I=3 Гц, 1Н), 7,76 (dd, I=9,3 Гц, 1Н), 7,62 (d, J=7 Гц, 2Н), 7,44 (t, I=7 Гц, 2Н), 7,32 (t, J=7 Гц, 1H), 7,00 (d, 1=9 Гц, 1H). Расчетная масса: 466,5; измеренная масса: 467,2. Жидкофазнохроматографический градиент 25-45% ацетонитрила через 13 мин. Время выдержки при жидкофазной хроматографии 3,5 мин. Полученный материал использовался без дальнейшей очистки. III. Твердофазный синтез соединений с формулой І А. Получение соединения 10 по табл. І и III К 20 г (L)-фенилаланина, охлажденного до -5°С в соляно-ледяной бане, было добавлено 74 мл концентрированной серной кислоты. Температуре реакционной смеси дали установиться на постоянный уровень, и по капле в течение 5 мин добавили в нее 9,4 мл концентрированной азотной кислоты. Реакционную смесь перемешивали в течение 30 мин и затем влили ее в 700 мл воды с измельченным льдом, рН раствора установили на 8-9 с помощью концентрированного гидроксида аммония. Далее раствору дали кристаллизоваться при комнатной температуре, а затем охладили в течение полусуток до 4°С. Полученный светложелтый кристаллический продукт был собран на отвержденной фильтровальной бумаге, промыт холодной водой и просушен. Затем продукт подвергли повторной кристаллизации в горячей воде, а фильтрат выпарили и рекристаллизовали (2 раза) с общим выходом 55%. Точка плавления: 218-232°С (сырой). Тонкослойная хроматография: Rf(F) 0,18. ЯMP: (D2O/NaОD), 2,99 (dd, J=13,4, 7,2 Гц, 1H), 3,10 (dd, J=13,4, 6,0 Гц, 1H), 3,57 (dd, J=7,2, 6,0 Гц, 1H), 7,48 (d, J=8,6 Гц, 2Н), 8,21 (d, J=8,7 Гц, 2Н). Аминокислоты, защищенные t-бутиоксилкарбонилом (ВОС), могут быть получены по стандартной технологии, см., например, [Greene and Wuts, Protective Groups in Organic Synthesis, 2nd Ed., John Wiley & Sons, Inc.: New York, pp. 327-328 (1991)]. В охлажденный до -23°С раствор ВОС-защищенного р-нитрофенилаланина (3,00 г, 9,67 ммоля) в безводном метиленхлориде (5 мл) добавили N-метилморфолин (NМM, 1,07 мл, 9,67 ммоля), а затем изобутилхлорформат (1,25 мл, 9,67 ммоля). Реакционную смесь перемешивали в течение 15 мин при -20°С. Затем в смесь добавили гидрохлорид метил-L-пролина (L-Рro-ОМе, 1,60 г, 9,67 ммоля) в качестве твердой фазы и дополнительное количество NMM (1,07 мл, 9,67 ммоля). После перемешивания в течение 1 ч при -20°С и 1 ч при комнатной температуре реакционную смесь концентрировали в вакууме и затем разбавили этилацетатом. Раствор этилацетата был промыт 10%-м водным раствором лимонной кислоты, водой и морской водой, просушен над сульфатом магния и концентрирован в вакууме. После колоночной хроматографии реакционной смеси был получен продукт в количестве 2,4 г (выход более 60%). Группа ВОС была удалена обработкой соляной кислотой (НСl) в диоксане в нормальных условиях, см., например, [Greene and Wuts, выше, с. 328-329]. В раствор 1-окси-2-нафтоиновой кислоты (160 мг, 0,84 ммоля) в метиленхлориде и N,N-диметилформамиде (1:1, 3 мл) был добавлен 1-оксибензотриазол (159 мг, 1,17 ммоля). Раствор охладили до 0°С и добавили в него 1-(3-диметиламинопропил)-3-этилкарбодиамидгидрохлорид (ЕDСl, 161 мг, 0,86 ммоля). После перемешивания в течение 45 мин при 0°С в него был влит приготовленный (см. выше) раствор дипептида (300 мг, 0,84 ммоля) и затем NMM (93 мкл, 0,84 ммоля). Реакционную смесь перемешивали в течение 1 ч при 0°С и 45 мин при комнатной температуре. Затем смесь концентрировали в вакууме и разбавили этилацетатом и водой. Органический слой был сепарирован, промыт (4 раза) водой, а затем морской водой, просушен и концентрирован в вакууме. После хроматографии раствора был получен связанный продукт(300 мг, выход 73%). 16 42719 В раствор связанного продукта (410 мг, 0,83 ммоля) в этилацетате (20 мл) была добавлена ледяная уксусная кислота (10 капель) и 10%-й Pd на активированном углероде (100 мг). Полученный раствор гидрогенизировали в течение 5 ч. Затем реакционную смесь отфильтровали через селит, а раствор концентрировали в вакууме до получения 375 мг продукта (выход 98%), который был использован в дальнейшем процессе без дополнительной очистки. В раствор продукта вышеуказанной реакции гидрогенизации (200 мг, 0,45 ммоля) в безводном метаноле (10 мл) добавили формамидинсульфокислоту 118 мг, 0,95 ммоля, приготовлена окислением коммерческой формамидинсульфокислоты по технологии, описанной в [Maryanoff et аl., (1985) J. Org. Chem. 1882]. Затем реакционную смесь перемешивали в течение 3 дней. Далее ее концентрировали в вакууме, а продукт выделили с помощью хроматографии (элюирование смесью метанола с метиленхлоридом), получив в результате соединение 10 (табл. III) в количестве 17 мг. IV. Альтернативный твердофазный синтез соединений с формулой І А. Получение соединения 3 по табл. І и II Раствор 1-бензилокси-2-нафтоиновой кислоты (2,247 г) в тионилхлориде (15 мл) подвергли перегонке с обратным холодильником в течение 4 ч. Избыточные реагенты были выпарены в вакууме. Осадок разбавили безводным DMF (9 мл) и концентрировали приблизительно до ~2 мл. В этот раствор добавили 4-диметил-аминопиридин (1,02 г). Смесь перемешивали при комнатной температуре в течение полусуток. Полученный пиридиновый комплекс добавили в перемешиваемый раствор нитро-L-аргинина (1,77 г), тетраметилгуанидина (1 мл) и хлорида лития (4,56 г) в DMF (60 мл). Смесь перемешивали при комнатной температуре в течение 48 ч. Большая часть DMF была выпарена в вакууме, а остаток разделен между 1,5н водным раствором НСl и этилацетатом. Комбинированные органические слои были промыты насыщенным водным раствором хлорида натрия и просушены над сульфатом магния. После концентрации в вакууме был получен сырой продукт (1бензилокси-2-нафтоил-N-нитро-L-аргининовая кислота, 3,5 г). Тонкослойная хроматография: Rf продукта = 0,22 (при использовании силикагельпланшета и элюировании 10%-м метанол/уксусной кислотой в хлороформе). Полученный материал использовался в дальнейшем процессе без дополнительной очистки. Раствор 1-бензилокси-2-нафтоил-N-нитро-Lаргининовой кислоты (150 мг) в безводном DMF (5 мл) был охлажден до -25°С и обработан изобутилхлорформатом (0,053 мл). Реакционную смесь перемешали и нагрели до комнатной температуры. Через 20 мин в нее добавили твердый Lпролинамид (в виде его соли соляной кислоты, 65,9 мг). Смесь перемешивали в течение 16 ч и затем разбавили этилацетатом. Раствор этилацетата был промыт 5%-м водным раствором лимонной кислоты, насыщенным водном раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, а затем высушен над сульфатом магния. Далее раствор концентрировали в вакууме, а остаток разбавили в этаноле (40 мл, содержащем 10% метанола и 10% уксусной кислоты) и гидрогенизировали при давлении 52 фунта/кв.дюйм (35766 Па) над 10%-м Pd на углероде (10 мг) до полного завершения реакции (тонкослойная хроматография на силикагеле, элюирование смесью хлороформа с метанолом в соотношении 9:1) с контролем по исчезновению быстро движущегося пятна. Реакционную смесь отфильтровали через селит, а также промыли этанолом и метанолом. Затем смесь концентрировали в вакууме и очистили с помощью жидкостной хроматографии высокого давления, получив в результате 1-окси-2-нафтоил-L-аргинил-L-пролинамид (41 мг, электрораспылительный масс-спектр: М+1=441), выделенный в форме его трифторацетата. В. Получение соединения 1 по табл. III Следуя процедуре, описанной в разд. А, с заменой 1-бензил-окси-2-нафтоиновой кислоты 2бензиолокси-1-нафтоиновой кислотой и L-пролинамида саркозинамидом, было получено соединение 1 по табл. III. С. Получение других соединений с формулой І Следуя процедуре, описанной выше в разд. В, с заменой саркозинамида следующими соединениями: L-пролин-N,N-диметиламидом; L-пролинметиловым эфиром и транс-4-гидрокси-L-пролинметиловым эфиром, были получены: соединение 5 по табл. І и II; соединение 8 по табл. І и II и соединение 4 по табл. III. V. Физические характеристики Таблица I Table I Соединение Compound 1 2 3 4 5 63 7 8 9 Расчетная масса Mass Calculated 414,24 404,26 440,26 471,26 468,29 551,34 551,34 455,26 442,26 Измеренная масса (М+1)1 Mass Found (M+1)1 415,1 405,5 441,1 472,2 469,1 552,3 552,1 456,0 443,0 17 ЖХ градиент2 LC Gradient2 D В А D D D D D D Время ЖХ выдержки, мин Retention Time (min) 5,8 11,5 10,3 6,2 6,8 7,5 7,3 7,0 5,5 42719 Продолжение табл. І Соединение Compound 10 11 12 13 14 15 16 17 18 19 20 21 Расчетная масса Mass Calculated 456,26 440,26 587,34 440,26 440,26 391,5 456,49 393,22 390,4 406,4 466,5 Измеренная масса (М+1)1 Mass Found (M+1)1 456,7 441,2 588,0 440,5 440,24 391,84 456,74 391,84 391,1 407,2 467,2 ЖХ градиент2 LC Gradient2 С С с А В D В В А С Е Время ЖХ выдержки, мин Retention Time (min) 24,4 25,4 26,9 9,0 8,4 5,6 9,0 5,5 4,7 20,7 3,5 1. При отсутствии других указаний определение массы производилось с помощью электрораспылительного масс-спектрометра Финнигана. 2. Во всех случаях использовался бинарный градиент системы, состоящей из ацетонитрила и воды. Все элюенты содержали 0,1% триторуксусной кислоты. А: 20-45% ацетонитрила в течение 13 мин. В: 1035% ацетонитрила в течение 13 мин. С: 5-95% ацетонитрила в течение 45 мин. D: 2-95% ацетонитрила в течение 10 мин. Е: 25-45% ацетонитрила в течение 13 мин. 3. Испытуемым материалом являлась смесь диастереомеров. 4. Определение массы производилось с помощью масс-спектрометра "Biolon". В таблице даны величины М+. каждого из образцов были использованы измерения начальной скорости с расчетом по кривым роста по программе кинетического анализа, именуемой "BatchKi" (поставщик: фирма Biokin Ltd, г. Мэдисон, шт. Висконсин, США). Эта программа разработана для выполнения регрессии и аппроксимации кривых по нелинейным данным. В табл. II приведены константы ингибирования (Кi', (mМ) микромолярные), определенные для нескольких соединений согласно изобретению, где R1 - водород; R2 - водород; R3 - (СH2)3-NH-(C=NH)NH2; R4 и R5 вместе с азотом и углеродом, с которыми они связаны, образуют пятичленный гетероцикл; R6 - водород. Согласно изобретению, соединение характеризовалось как "активное", то есть эффективное в качестве ингибитора триптазы, если его величина Кi' была менее 1000 мкМ. В отличие от Кi, константа Кi' не может быть действительной константой диссоциации ферментоингибиторного комплекса; Кi'= Кi у неконкурентоспособных ингибиторов и является прямопропорциональной Кi у конкурентоспособных ингибиторов. Воздействие света на испытуемое соединение в испытательной среде может снизить Кi'. В общем случае условия испытаний не исключают воздействия света, интенсивность которого, таким образом, может повлиять на воспроизводимость испытаний. Ввиду присутствия этого потенциального источника погрешности, некоторые испытания проводились в условиях темноты. Те величины Кi' в табл. II и III, которые указаны без скобок, были получены в условиях окружающего освещения. Величины Кi', указанные в скобках, получены в условиях темноты. Величины Кi', отмеченные звездочкой (*) были получены в условиях освещения, указанных выше (то есть при интенсивности освещения в пределах 400-450 фут-свечей). VI. Испытания in vitro на ингибирование триптазы Соединения (приблизительно 1 мг), предназначаемые для испытаний на ингибирование триптазы, были реконституированы в диметилсульфоксид (DMSO) и разбавлены в соотношении 1:10 в буфере, содержащем 50 мМ Tris-HCI с рН 8,2, 100 мМ NaCI и 0,05% Tween-20. После этого в том же самом буфере, дополненном 10% DMSO было произведено еще 7 тройных разбавлении. Затем из каждого из 8 растворов были взяты аликвотные образцы (50 мкл) и перенесены в индивидуальные лунки 95-луночного микротитровального планшета с U-дном. В каждую лунку была введена триптаза (25 мкл; конечная концентрация 0,5 нМ), образцы были перемешаны и инкубировались в течение 1 ч при комнатной температуре либо при окружающем освещении (то есть при комнатном свете во время эксперимента), либо в условиях регулируемого "света" или ''темноты". Здесь под "условиями света" понимается интенсивность освещения 400-450 фут-свечей (1 фут-свеча = 10,764 лк) флуоресцентной лампой. "Условия темноты" создавались путем помещения образцов в контейнеры, обвернутые алюминиевой фольгой. Затем добавлением синтетического трипептидного субстрата - тозил-GlyProLys-р-нитроанилида (25 мл; конечная концентрация 0,5 мМ) была инициирована ферментативная реакция. Микротитровальные планшеты были тут же перенесены в устройство кинетического считывания микропланшет UV/MAX Kinetic Microplate Reader (фирма Molecular Devices), и гидролиз хромогенного субстрата был прослежен спектрофотометрическим способом на длине волны 405 нм в течение 5 мин. В этих условиях ферментативные испытания обычно давали кривые линейного роста. Для определения констант кажущегося ингибирования 18 42719 Таблица II Table II Соединение Compound Кi' R7 2 >500 -NH2 Ar CH3 OH OH 3 0,3* (82) -NH2 5 15 -N(CH3)2 OH CONH2 6 82 OH N OH 7 664 8 208 N CONH2 OH -OCH3 N 9 23* (56) -NH2 N CONH2 H 13 N 0,6* (110) 14 OH OH 752* (707) -NH2 OH 19 42719 Продолжение табл. II Соединение Compound Кi' R7 15 0,84 -NH2 Ar OH N 16 8* (63) -NH2 OH CH2 17 900 N N -NH2 OH N 18 452 -NH2 19 8* (2450) OH -NH2 OH HO 20 20 -NH2 OH 21 18* (149) -NH2 OH характиризовалось как "активное" или эффективное в качестве ингибитора триптазы, если его величина Кi' была менее 1000 мкМ. В табл. III приведены константы ингибирования (Кi', в мкМ), полученные для нескольких соединений, предлагаемых настоящим изобретением. В соответствии с изобретением, соединение 20 42719 Таблица III Соединение Compound Структура Structure Кi' O H N 1 3* (637) OH CONH2 N O CH3 H N HN NH2 O O H H N 4 749 OH O CH3 N O OH H N HN NH2 H N OH 10 O CONH2 O N CH2 2,5* (18) H N NH2 NH 21 42719 Продолжение табл. ІІІ Соединение Compound Структура Structure Кi' H N 11 OH 0,3* (40) CONH2 O N O OH H N HN NH2 H N 12 OH 2,5* (818) HN 6,5 14 7,0 8,0 7,5 5,4 N NH2 изводиться в течение времени не более 5 мин. Кроме того, соединение 3 должно реконституироваться в DMSO. VIII. Испытания in vivo В этих исследованиях была использована аллергическая модель астмы на овцах. Аналогичная методика была опубликована ранее в работах [Abraham et al. (1983) Am. Rev. Resp. Dis. 128: 839844; Allegra et al.(1983) J. Appl. Physiol. 55: 726730; Russi et al. (1985) J. Appl. Physiol. 59: 14161422; Soler et al. (1989) J. Appl. Physiol. 67: 406413]. Каждая подопытная овца одновременно служила в качестве собственного контрольного образца. Вес подопытных животных находился в диапазоне 20-50 кг. В данных испытаниях 9 мг соединения 3 по табл. 1 и 2 растворили в 3 мл буферизованного физиологического раствора и весь раствор вводили в форме аэрозоля за 0,5 ч до, 4 ч после и 24 ч после антигенного стимулирования (общая доза 27; n=6). Соединение 3 показало тенденцию к уменьшению ранней реакциии ослабило позднюю реакцию (см. фиг. 1). В контрольных опытах (вводился только носитель) антигенное стимулирование вызывало пиковый ранний и поздний рост над базовой линией удельного легочного сопротивления (SRL) до 374±104% и 212±21% (средняя квадратичная ошибка). В противоположность этому, у овец, обработанных соединением 3 по табл. I и II, ранний и поздний рост SRL составлял 280±39% и 72±9% (р
ДивитисяДодаткова інформація
Назва патенту англійськоюCompositions and methods for the treatment of immunomediated inflammatory disorders
Автори англійськоюSpear Kerry, Johnson Charles, Gschwend Heinz
Назва патенту російськоюСоединения, композиции и способы, которые ингибируют протеазы, для лечения и профилактики иммуномедиаторных воспалительных болезней
Автори російськоюСпеар Керри, Джонсон Чарльз, Гшвенд Хайнц
МПК / Мітки
МПК: C07K 5/065, C07K 5/072, A61P 43/00, A61P 27/16, A61P 11/00, A61K 38/00, A61K 9/12, A61K 31/57, A61K 31/44, A61M 11/00, A61P 29/00, C07D 471/04, A61P 37/08, C07K 5/068
Мітки: сполуки, композиції, протеази, імуномедіаторних, профілактики, запальних, хвороб, лікування, способи, інгібують
Код посилання
<a href="https://ua.patents.su/24-42719-spoluki-kompozici-ta-sposobi-yaki-ingibuyut-proteazi-dlya-likuvannya-ta-profilaktiki-imunomediatornikh-zapalnikh-khvorob.html" target="_blank" rel="follow" title="База патентів України">Сполуки, композиції та способи, які інгібують протеази, для лікування та профілактики імуномедіаторних запальних хвороб</a>