Похідна глюкагоноподібного пептиду-1 (варіанти), фармацевтична композиція та спосіб одержання лікувального засобу (варіанти), спосіб лікування діабету (варіанти) і ожиріння
Номер патенту: 72181
Опубліковано: 15.02.2005
Автори: Кнудсен Ліселотте Б'єрр, Нільсен Пер Франклін, Хуусфелдт Пер Олаф
Формула / Реферат
1. Похідна GLP-1 (7-37) або аналога GLP-1 (7-37), що являє собою агоніст рецептора GLP-1 людини, яка відрізняється тим, що вказана похідна має лише один ліпофільний замісник, приєднаний до амінокислотного залишку, який не є N-кінцевим або С-кінцевим амінокислотним залишком.
2. Похідна за п. 1, яка відрізняється тим, що аналог GLP-1 (7-37) вибраний з групи, яка включає:
3. Похідна за п. 1, яка відрізняється тим, що GLP-1 (7-37) вибраний з групи, яка включає:
4. Похідна за будь-яким з пп. 1-3, яка відрізняється тим, що ліпофільний замісник включає від 4 до 40 атомів вуглецю, краще - від 8 до 25 атомів вуглецю.
5. Похідна за будь-яким з пп. 1-4, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду таким чином, що карбоксильна група ліпофільного замісника утворює амідний зв'язок з аміногрупою амінокислотного залишку.
6. Похідна за будь-яким з пп. 1-4, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду таким чином, що аміногрупа ліпофільного замісника утворює амідний зв'язок з карбоксильною групою амінокислотного залишку.
7. Похідна за будь-яким з пп. 1-6, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду через спейсер.
8. Похідна за п. 7, яка відрізняється тим, що спейсер являє собою нерозгалужену групу алканової α,ω-дикарбонової кислоти, що має від 1 до 7 метиленових груп, краще - дві метиленові групи, які утворюють місток між аміногрупою пептиду та аміногрупою ліпофільного замісника.
9. Похідна за п. 7, яка відрізняється тим, що спейсер являє собою амінокислотний залишок, за винятком Cys, або дипептид, такий як Gly-Lys.
10. Похідна за п. 9, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою Lys або дипептиду, що містить залишок Lys, а інша аміногрупа Lys спейсера або дипептидного спейсера, що містить залишок Lys, утворює амідний зв'язок з карбоксильною групою ліпофільного замісника.
11. Похідна за п. 9, яка відрізняється тим, що аміногрупа вихідного пептиду утворює амідний зв'язок з карбоксильною групою амінокислотного залишку або дипептидного спейсера, і аміногрупа амінокислотного залишку або дипептидного спейсера утворює амідний зв'язок з карбоксильною групою ліпофільного замісника.
12. Похідна за п. 9, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою спейсера, який є амінокислотним залишком, або дипептидного спейсера, або карбоксильна група спейсера, який є амінокислотним залишком, або дипептидного спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника.
13. Похідна за п. 9, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою спейсера, який є Asp або Glu, або дипептидного спейсера, який містить Asp або Glu залишок, і карбоксильна група спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника.
14. Похідна за будь-яким з пп. 1-13, яка відрізняється тим, що ліпофільний замісник включає частково або повністю гідрогенізовану циклопентанофенантренову структуру.
15. Похідна за будь-яким з пп. 1-13, яка відрізняється тим, що ліпофільний замісник є прямим ланцюгом або розгалуженою алкільною групою.
16. Похідна за будь-яким з пп. 1-13, яка відрізняється тим, що ліпофільний замісник є ацильною групою прямоланцюгової або розгалуженої жирної кислоти.
17. Похідна за п. 16, яка відрізняється тим, що ацильну групу вибирають з групи, яка включає СН3(СН2)nСО-, у якій n є цілим числом від 4 до 38, перевагу віддають СН3(СН2)6СО-, СН3(СН2)8СО-, СН3(СН2)10СО-, СН3(СН2)12СО-, СН3(СН2)14СО-, СН3(СН2)16СО-, СН3(СН2)18СО-, СН3(СН2)20СО- та СН3(СН2)22СО-.
18. Похідна за будь-яким з пп. 1-13, яка відрізняється тим, що ліпофільний замісник є ацильною групою прямоланцюгової або розгалуженої алканової -дикарбонової кислоти.
19. Похідна за п. 18, яка відрізняється тим, що ацильну групу вибирають з групи, яка включає НООС(СН2)mСО-, у якій m є цілим числом від 4 до 38, переважно від 4 до 24, більш переважно вибирають з групи, яка включає НООС(СН2)14СО-, НООС(СН2)16СО-, НООС(СН2)18СО-, НООС(СН2)20СО- та НООС(СН2)22СО-.
20. Похідна за будь-яким з пп. 1-13, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)р((СН2)qСOОН)СНNН-СО(СН2)2СО-, у якій p та q є цілими числами, a p+q є цілим числом від 8 до 33, переважно від 12 до 28.
21. Похідна за будь-яким з пп. 1-13, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)rСО-NНСН(СООН)(СН2)2СО-, де r є цілим числом від 10 до 24.
22. Похідна за будь-яким з пп. 1-13, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)sСО-NНСН((СН2)2СООН)СО-, де s є цілим числом від 8 до 24.
23. Похідна за будь-яким з пп. 1-13, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули -NHCH(COOH)(CH2)4NH-CO(CH2)uCH3, у якій u є цілим числом від 8 до 18.
24. Похідна за будь-яким з пп. 1-13, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули -NHCH(COOH)(CH2)4NH-СОСН((СН2)2СООН)NН-СО(СН2)wСН3, у якій w є цілим числом від 10 до 16.
25. Похідна за будь-яким з пп. 1-13, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули –NНСH(СООН)(СH2)4NН-СО(СН2)2СН(СООН)NН-СО(СН2)хСН3, у якій х є цілим числом від 10 до 16.
26. Похідна за будь-яким з пп. 1-13, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули –NНСH(СООН)(СH2)4NН-СО(СН2)2СН(СООН)NН-СО(СН2)yСН3, у якій у є нулем або цілим числом від 1 до 22.
27. Похідна за будь-яким з пп. 1-26, яка відрізняється тим, що усі амінокислотні залишки GLP-1 (7-37), кількість яких сягає шести, замінено на інший -амінокислотний залишок, який може бути кодований генетичним кодом.
28. Похідна за п. 1, яка відрізняється тим, що є Lуs26(-тетрадеканоїл)-GLP-1(7-37).
29. Похідна за п. 1, яка відрізняється тим, що є Lуs34(-тетрадеканоїл)-GLP-1(7-37).
30. Похідна за п. 46, яка відрізняється тим, що є Lуs26,34-біc(-тетрадеканоїл)-GLP-1(7-37).
31. Похідна за п. 1, яка відрізняється тим, що є Lуs26(-тетрадеканоїл)Arg34-GLP-1(7-37).
32. Похідна за п. 1, яка відрізняється тим, що є Gly8Arg26,34Lys36(-тетрадеканоїл)-GLP-1(7-37).
33. Похідна за п. 1, яка відрізняється тим, що є Arg26,34Lys36(-тетрадеканоїл)-GLP-1(7-37).
34. Похідна за п. 1, яка відрізняється тим, що є Arg34Lys26(-(-карбоксинонадеканоїл))-GLP-1(7-37).
35. Похідна за п. 1, яка відрізняється тим, що є Arg34Lys26(-(-карбоксигептадеканоїл))-GLP-1(7-37).
36. Похідна за п. 1, яка відрізняється тим, що є Arg26,34Lys36(-(-карбоксигептадеканоїл))-GLP-1(7-37).
37. Похідна за п. 1, яка відрізняється тим, що є Arg26,34Lys36(-(-карбоксіундеканоїл))-GLP-1(7-37).
38. Похідна за п. 1, яка відрізняється тим, що є Arg,34Lys26(-(-карбоксіундеканоїл))-GLP-1(7-37).
39. Похідна за п. 1, яка відрізняється тим, що є Arg34Lys26(-(-карбоксигептаноїл))-GLP-1(7-37).
40. Похідна за п. 1, яка відрізняється тим, що є Arg26,34Lys36(-(-карбоксигептаноїл))-GLP-1(7-37).
41. Похідна за п. 1, яка відрізняється тим, що є Arg34Lys26(-(-карбоксипентадеканоїл))-GLP-1(7-37).
42. Похідна за п. 1, яка відрізняється тим, що є Arg34Lys26(-літохоліл)-GLP-1(7-37).
43. Похідна за п. 1, яка відрізняється тим, що є Arg34Lys26(-(-глутаміл(-гексадеканоїл)))-GLP-1(7-37).
44. Похідна за п. 1, яка відрізняється тим, що є Arg34Lys26(-(-глутаміл(-тетрадеканоїл)))-GLP-1(7-37).
45. Похідна GLP-1 (7-37) або аналога GLP-1 (7-37), що являє собою агоніст рецептора GLP-1 людини, яка відрізняється тим, що вказана похідна має лише два ліпофільні замісники, один з яких приєднаний до амінокислотного залишку, який не є N-кінцевим або С-кінцевим амінокислотним залишком.
46. Похідна за п. 45, яка відрізняється тим, що один з ліофільних замісників приєднаний до С-кінцевого амінокислотного залишку пептиду, а інший приєднаний до амінокислотного залишку, який не є N-кінцевим або С-кінцевим амінокислотним залишком.
47. Похідна за будь-яким з пп. 45 або 46, яка відрізняється тим, що аналог GLP-1 (7-37) вибраний з групи, яка включає:
48. Похідна за будь-яким з пп.45 або 46, яка відрізняється тим, що GLP-1 (7-37) вибраний з групи, яка включає:
49. Похідна за будь-яким з пп. 45-48, яка відрізняється тим, що ліпофільний замісник включає від 4 до 40 атомів вуглецю, краще - від 8 до 25 атомів вуглецю.
50. Похідна за будь-яким з пп. 45-49, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду таким чином, що карбоксильна група ліпофільного замісника утворює амідний зв'язок з аміногрупою амінокислотного залишку.
51. Похідна за будь-яким з пп. 45-49, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду таким чином, що аміногрупа ліпофільного замісника утворює амідний зв'язок з карбоксильною групою амінокислотного залишку.
52. Похідна за будь-яким з пп. 45-51, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду через спейсер.
53. Похідна за п. 52, яка відрізняється тим, що спейсер являє собою нерозгалужену групу алканової α,ω-дикарбонової кислоти, що має від 1 до 7 метиленових груп, краще - дві метиленові групи, які утворюють місток між аміногрупою пептиду та аміногрупою ліпофільного замісника.
54. Похідна за п. 52, яка відрізняється тим, що спейсер являє собою амінокислотний залишок, за винятком Cys, або дипептид, такий як Gly-Lys.
55. Похідна за п. 54, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою Lys або дипептиду, що містить залишок Lys, а інша аміногрупа Lys спейсера або дипептидного спейсера, що містить залишок Lys, утворює амідний зв'язок з карбоксильною групою ліпофільного замісника.
56. Похідна за п. 54, яка відрізняється тим, що аміногрупа вихідного пептиду утворює амідний зв'язок з карбоксильною групою амінокислотного залишку або дипептидного спейсера, і аміногрупа амінокислотного залишку або дипептидного спейсера утворює амідний зв'язок з карбоксильною групою ліпофільного замісника.
57. Похідна за п. 54, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою спейсера, який є амінокислотним залишком, або дипептидного спейсера, або карбоксильна група спейсера, який є амінокислотним залишком, або дипептидного спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника.
58. Похідна за п. 54, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою спейсера, який є Asp або Glu, або дипептидного спейсера, який містить Asp або Glu залишок, і карбоксильна група спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника.
59. Похідна за будь-яким з пп. 45-58, яка відрізняється тим, що ліпофільний замісник включає частково або повністю гідрогенізовану циклопентанофенантренову структуру.
60. Похідна за будь-яким з пп. 45-58, яка відрізняється тим, що ліпофільний замісник є прямим ланцюгом або розгалуженою алкільною групою.
61. Похідна за будь-яким з пп. 45-58, яка відрізняється тим, що ліпофільний замісник є ацильною групою прямоланцюгової або розгалуженої жирної кислоти.
62. Похідна за п. 61, яка відрізняється тим, що ацильну групу вибирають з групи, яка включає СН3(СН2)nСО-, у якій n є цілим числом від 4 до 38, перевагу віддають СН3(СН2)6СО-, СН3(СН2)8СО-, СН3(СН2)10СО-, СН3(СН2)12СО-, СН3(СН2)14СО-, СН3(СН2)16СО-, СН3(СН2)18СО-, СН3(СН2)20СО- та СН3(СН2)22СО-.
63. Похідна за будь-яким з пп. 45-58, яка відрізняється тим, що ліпофільний замісник є ацильною групою прямоланцюгової або розгалуженої алканової -дикарбонової кислоти.
64. Похідна за п. 63, яка відрізняється тим, що ацильну групу вибирають з групи, яка включає НООС(СН2)mСО-, у якій m є цілим числом від 4 до 38, переважно від 4 до 24, більш переважно вибирають з групи, яка включає НООС(СН2)14СО-, НООС(СН2)16СО-, НООС(СН2)18СО-, НООС(СН2)20СО- та НООС(СН2)22СО-.
65. Похідна за будь-яким з пп. 45-58, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)р((СН2)qСOОН)СНNН-СО(СН2)2СО-, у якій p та q є цілими числами, a p+q є цілим числом від 8 до 33, переважно від 12 до 28.
66. Похідна за будь-яким з пп. 45-58, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)rСО-NНСН(СООН)(СН2)2СО-, де r є цілим числом від 10 до 24.
67. Похідна за будь-яким з пп. 45-58, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)sСО-NНСН((СН2)2СООН)СО-, де s є цілим числом від 8 до 24.
68. Похідна за будь-яким з пп. 45-58, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули -NHCH(COOH)(CH2)4NH-CO(CH2)uCH3, у якій u є цілим числом від 8 до 18.
69. Похідна за будь-яким з пп. 45-58, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули -NHCH(COOH)(CH2)4NH-СОСН((СН2)2СООН)NН-СО(СН2)wСН3, у якій w є цілим числом від 10 до 16.
70. Похідна за будь-яким з пп. 45-58, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули –NНСH(СООН)(СH2)4NН-СО(СН2)2СН(СООН)NН-СО(СН2)хСН3, у якій х є цілим числом від 10 до 16.
71. Похідна за будь-яким з пп. 45-58, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули –NНСH(СООН)(СH2)4NН-СО(СН2)2СН(СООН)NН-СО(СН2)yСН3, у якій у є нулем або цілим числом від 1 до 22.
72. Похідна за будь-яким з пп. 45-71, яка відрізняється тим, що усі амінокислотні залишки GLP-1 (7-37), кількість яких сягає шести, замінено на інший -амінокислотний залишок, який може бути кодований генетичним кодом.
73. Похідна GLP-1 (7-37) або аналога GLP-1 (7-37), що являє собою агоніст рецептора GLP-1 людини, яка відрізняється тим, що вказана похідна має лише два ліпофільні замісники, які приєднані до амінокислотних залишків, які не є N-кінцевими або С-кінцевими амінокислотними залишками.
74. Похідна за п. 73, яка відрізняється тим, що аналог GLP-1 (7-37) вибраний з групи, яка включає:
75. Похідна за п. 73, яка відрізняється тим, що GLP-1 (7-37) вибраний з групи, яка включає:
76. Похідна за будь-яким з пп. 73-75, яка відрізняється тим, що ліпофільний замісник включає від 4 до 40 атомів вуглецю, краще - від 8 до 25 атомів вуглецю.
77. Похідна за будь-яким з пп. 73-76, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду таким чином, що карбоксильна група ліпофільного замісника утворює амідний зв'язок з аміногрупою амінокислотного залишку.
78. Похідна за будь-яким з пп. 73-76, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду таким чином, що аміногрупа ліпофільного замісника утворює амідний зв'язок з карбоксильною групою амінокислотного залишку.
79. Похідна за будь-яким з пп. 73-78, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду через спейсер.
80. Похідна за п. 79, яка відрізняється тим, що спейсер являє собою нерозгалужену групу алканової α,ω-дикарбонової кислоти, що має від 1 до 7 метиленових груп, краще - дві метиленові групи, які утворюють місток між аміногрупою пептиду та аміногрупою ліпофільного замісника.
81. Похідна за п. 79, яка відрізняється тим, що спейсер являє собою амінокислотний залишок, за винятком Cys, або дипептид, такий як Gly-Lys.
82. Похідна за п. 81, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою Lys або дипептиду, що містить залишок Lys, а інша аміногрупа Lys спейсера або дипептидного спейсера, що містить залишок Lys, утворює амідний зв'язок з карбоксильною групою ліпофільного замісника.
83. Похідна за п. 81, яка відрізняється тим, що аміногрупа вихідного пептиду утворює амідний зв'язок з карбоксильною групою амінокислотного залишку або дипептидного спейсера, і аміногрупа амінокислотного залишку або дипептидного спейсера утворює амідний зв'язок з карбоксильною групою ліпофільного замісника.
84. Похідна за п. 81, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою спейсера, який є амінокислотним залишком, або дипептидного спейсера, або карбоксильна група спейсера, який є амінокислотним залишком, або дипептидного спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника.
85. Похідна за п. 81, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою спейсера, який є Asp або Glu, або дипептидного спейсера, який містить Asp або Glu залишок, і карбоксильна група спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника.
86. Похідна за будь-яким з пп. 73-85, яка відрізняється тим, що ліпофільний замісник включає частково або повністю гідрогенізовану циклопентанофенантренову структуру.
87. Похідна за будь-яким з пп. 73-85, яка відрізняється тим, що ліпофільний замісник є прямим ланцюгом або розгалуженою алкільною групою.
88. Похідна за будь-яким з пп. 73-85, яка відрізняється тим, що ліпофільний замісник є ацильною групою прямоланцюгової або розгалуженої жирної кислоти.
89. Похідна за п. 88, яка відрізняється тим, що ацильну групу вибирають з групи, яка включає СН3(СН2)nСО-, у якій n є цілим числом від 4 до 38, перевагу віддають СН3(СН2)6СО-, СН3(СН2)8СО-, СН3(СН2)10СО-, СН3(СН2)12СО-, СН3(СН2)14СО-, СН3(СН2)16СО-, СН3(СН2)18СО-, СН3(СН2)20СО- та СН3(СН2)22СО-.
90. Похідна за будь-яким з пп. 73-85, яка відрізняється тим, що ліпофільний замісник є ацильною групою прямоланцюгової або розгалуженої алканової -дикарбонової кислоти.
91. Похідна за п. 90, яка відрізняється тим, що ацильну групу вибирають з групи, яка включає НООС(СН2)mСО-, у якій m є цілим числом від 4 до 38, переважно від 4 до 24, більш переважно вибирають з групи, яка включає НООС(СН2)14СО-, НООС(СН2)16СО-, НООС(СН2)18СО-, НООС(СН2)20СО- та НООС(СН2)22СО-.
92. Похідна за будь-яким з пп. 73-85, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)р((СН2)qСOОН)СНNН-СО(СН2)2СО-, у якій p та q є цілими числами, a p+q є цілим числом від 8 до 33, переважно від 12 до 28.
93. Похідна за будь-яким з пп. 73-85, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)rСО-NНСН(СООН)(СН2)2СО-, де r є цілим числом від 10 до 24.
94. Похідна за будь-яким з пп. 73-85, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)sСО-NНСН((СН2)2СООН)СО-, де s є цілим числом від 8 до 24.
95. Похідна за будь-яким з пп. 73-85, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули -NHCH(COOH)(CH2)4NH-CO(CH2)uCH3, у якій u є цілим числом від 8 до 18.
96. Похідна за будь-яким з пп. 73-85, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули -NHCH(COOH)(CH2)4NH-СОСН((СН2)2СООН)NН-СО(СН2)wСН3, у якій w є цілим числом від 10 до 16.
97. Похідна за будь-яким з пп. 73-85, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули –NНСH(СООН)(СH2)4NН-СО(СН2)2СН(СООН)NН-СО(СН2)хСН3, у якій х є цілим числом від 10 до 16.
98. Похідна за будь-яким з пп. 73-85, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули –NНСH(СООН)(СH2)4NН-СО(СН2)2СН(СООН)NН-СО(СН2)yСН3, у якій у є нулем або цілим числом від 1 до 22.
99. Похідна за будь-яким з пп. 73-85, яка відрізняється тим, що усі амінокислотні залишки GLP-1 (7-37), кількість яких сягає шести, замінено на інший -амінокислотний залишок, який може бути кодований генетичним кодом.
100. Похідна за п. 73, яка відрізняється тим, що є Lуs26,34біс(-(-карбоксинонадеканоїл)-GLP-1(7-37).
101. Похідна за п. 73, яка відрізняється тим, що є Lуs26,34-біс((ω-карбоксіундеканоїл)-GLP-1(7-37).
102. Похідна за п. 73, яка відрізняється тим, що є Lуs26,34-біс((ω-карбоксигептаноїл)-GLP-1(7-37).
103. Похідна за п. 73, яка відрізняється тим, що є Lуs26,34-біс((ω-карбокситридеканоїл)-GLP-1(7-37).
104. Похідна за п. 73, яка відрізняється тим, що є Lys26,34-біс(-(-глутаміл(-тетрадеканоїл)))-GLP-1(7-37).
105. Похідна за п. 73, яка відрізняється тим, що є Lys26,34-біс(-(-глутаміл(-гексадеканоїл)))-GLP-1(7-37).
106. Похідна аналога GLP-1 (7-37), що являє собою агоніст рецептора GLP-1 людини, де аналог являє собою GLP-1 (7-С), в якому С являє собою ціле число від 38 до 45, яка відрізняється тим, що вона має лише один ліпофільний замісник, який приєднаний до С-кінцевого амінокислотного залишку.
107. Похідна за п. 106, яка відрізняється тим, що аналог GLP-1 (7-37) вибраний з групи, яка включає:
108. Похідна за п. 106, яка відрізняється тим, що GLP-1 (7-37) вибраний з групи, яка включає:
109. Похідна за будь-яким з пп. 106-108, яка відрізняється тим, що ліпофільний замісник включає від 4 до 40 атомів вуглецю, краще - від 8 до 25 атомів вуглецю.
110. Похідна за будь-яким з пп. 106-109, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду таким чином, що карбоксильна група ліпофільного замісника утворює амідний зв'язок з аміногрупою амінокислотного залишку.
111. Похідна за будь-яким з пп. 106-109, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду таким чином, що аміногрупа ліпофільного замісника утворює амідний зв'язок з карбоксильною групою амінокислотного залишку.
112. Похідна за будь-яким з пп. 106-111, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду через спейсер.
113. Похідна за п. 112, яка відрізняється тим, що спейсер являє собою нерозгалужену групу алканової α,ω-дикарбонової кислоти, що має від 1 до 7 метиленових груп, краще - дві метиленові групи, які утворюють місток між аміногрупою пептиду та аміногрупою ліпофільного замісника.
114. Похідна за п. 112, яка відрізняється тим, що спейсер являє собою амінокислотний залишок, за винятком Cys, або дипептид, такий як Gly-Lys.
115. Похідна за п. 114, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою Lys або дипептиду, що містить залишок Lys, а інша аміногрупа Lys спейсера або дипептидного спейсера, що містить залишок Lys, утворює амідний зв'язок з карбоксильною групою ліпофільного замісника.
116. Похідна за п. 114, яка відрізняється тим, що аміногрупа вихідного пептиду утворює амідний зв'язок з карбоксильною групою амінокислотного залишку або дипептидного спейсера, і аміногрупа амінокислотного залишку або дипептидного спейсера утворює амідний зв'язок з карбоксильною групою ліпофільного замісника.
117. Похідна за п. 114, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою спейсера, який є амінокислотним залишком, або дипептидного спейсера, або карбоксильна група спейсера, який є амінокислотним залишком, або дипептидного спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника.
118. Похідна за п. 114, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою спейсера, який є Asp або Glu, або дипептидного спейсера, який містить Asp або Glu залишок, і карбоксильна група спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника.
119. Похідна за будь-яким з пп. 106-118, яка відрізняється тим, що ліпофільний замісник включає частково або повністю гідрогенізовану циклопентанофенантренову структуру.
120. Похідна за будь-яким з пп. 106-118, яка відрізняється тим, що ліпофільний замісник є прямим ланцюгом або розгалуженою алкільною групою.
121. Похідна за будь-яким з пп. 106-118, яка відрізняється тим, що ліпофільний замісник є ацильною групою прямоланцюгової або розгалуженої жирної кислоти.
122. Похідна за п. 121, яка відрізняється тим, що ацильну групу вибирають з групи, яка включає СН3(СН2)nСО-, у якій n є цілим числом від 4 до 38, перевагу віддають СН3(СН2)6СО-, СН3(СН2)8СО-, СН3(СН2)10СО-, СН3(СН2)12СО-, СН3(СН2)14СО-, СН3(СН2)16СО-, СН3(СН2)18СО-, СН3(СН2)20СО- та СН3(СН2)22СО-.
123. Похідна за будь-яким з пп. 106-118, яка відрізняється тим, що ліпофільний замісник є ацильною групою прямоланцюгової або розгалуженої алканової -дикарбонової кислоти.
124. Похідна за п. 123, яка відрізняється тим, що ацильну групу вибирають з групи, яка включає НООС(СН2)mСО-, у якій m є цілим числом від 4 до 38, переважно від 4 до 24, більш переважно вибирають з групи, яка включає НООС(СН2)14СО-, НООС(СН2)16СО-, НООС(СН2)18СО-, НООС(СН2)20СО- та НООС(СН2)22СО-.
125. Похідна за будь-яким з пп. 106-118, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)р((СН2)qСOОН)СНNН-СО(СН2)2СО-, у якій p та q є цілими числами, a p+q є цілим числом від 8 до 33, переважно від 12 до 28.
126. Похідна за будь-яким з пп. 106-118, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)rСО-NНСН(СООН)(СН2)2СО-, де r є цілим числом від 10 до 24.
127. Похідна за будь-яким з пп. 106-118, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)sСО-NНСН((СН2)2СООН)СО-, де s є цілим числом від 8 до 24.
128. Похідна за будь-яким з пп. 106-118, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули -NHCH(COOH)(CH2)4NH-CO(CH2)uCH3, у якій u є цілим числом від 8 до 18.
129. Похідна за будь-яким з пп. 106-118, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули -NHCH(COOH)(CH2)4NH-СОСН((СН2)2СООН)NН-СО(СН2)wСН3, у якій w є цілим числом від 10 до 16.
130. Похідна за будь-яким з пп. 106-118, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули –NНСH(СООН)(СH2)4NН-СО(СН2)2СН(СООН)NН-СО(СН2)хСН3, у якій х є цілим числом від 10 до 16.
131. Похідна за будь-яким з пп. 106-118, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули –NНСH(СООН)(СH2)4NН-СО(СН2)2СН(СООН)NН-СО(СН2)yСН3, у якій у є нулем або цілим числом від 1 до 22.
132. Похідна за будь-яким з пп. 106-131, яка відрізняється тим, що усі амінокислотні залишки GLP-1 (7-37), кількість яких сягає шести, замінено на інший -амінокислотний залишок, який може бути кодований генетичним кодом.
133. Похідна аналога GLP-1 (7-37), що являє собою агоніст рецептора GLP-1 людини, де аналог являє собою GLP-1 (А-В), у якому А є цілим числом від 1 до 7 і В є цілим числом від 38-45, яка відрізняється тим, що похідна має один ліпофільний замісник приєднаний до С-кінцевого амінокислотного залишку і другий необов’язковий ліофільний замісник приєднаний до одного з інших амінокислотних залишків.
134. Похідна за п. 133, яка відрізняється тим, що аналог GLP-1 (7-37) вибраний з групи, яка включає:
135. Похідна за п. 133, яка відрізняється тим, що GLP-1 (7-37) вибраний з групи, яка включає:
136. Похідна за будь-яким з пп. 133-135, яка відрізняється тим, що ліпофільний замісник включає від 4 до 40 атомів вуглецю, краще - від 8 до 25 атомів вуглецю.
137. Похідна за будь-яким з пп. 133-136, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду таким чином, що карбоксильна група ліпофільного замісника утворює амідний зв'язок з аміногрупою амінокислотного залишку.
138. Похідна за будь-яким з пп. 133-136, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду таким чином, що аміногрупа ліпофільного замісника утворює амідний зв'язок з карбоксильною групою амінокислотного залишку.
139. Похідна за будь-яким з пп. 133-138, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку пептиду через спейсер.
140. Похідна за п. 139, яка відрізняється тим, що спейсер являє собою нерозгалужену групу алканової α,ω-дикарбонової кислоти, що має від 1 до 7 метиленових груп, краще - дві метиленові групи, які утворюють місток між аміногрупою пептиду та аміногрупою ліпофільного замісника.
141. Похідна за п. 139, яка відрізняється тим, що спейсер являє собою амінокислотний залишок, за винятком Cys, або дипептид, такий як Gly-Lys.
142. Похідна за п. 141, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою Lys або дипептиду, що містить залишок Lys, а інша аміногрупа Lys спейсера або дипептидного спейсера, що містить залишок Lys, утворює амідний зв'язок з карбоксильною групою ліпофільного замісника.
143. Похідна за п. 141, яка відрізняється тим, що аміногрупа вихідного пептиду утворює амідний зв'язок з карбоксильною групою амінокислотного залишку або дипептидного спейсера, і аміногрупа амінокислотного залишку або дипептидного спейсера утворює амідний зв'язок з карбоксильною групою ліпофільного замісника.
144. Похідна за п. 141, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою спейсера, який є амінокислотним залишком, або дипептидного спейсера, або карбоксильна група спейсера, який є амінокислотним залишком, або дипептидного спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника.
145. Похідна за п. 141, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою спейсера, який є Asp або Glu, або дипептидного спейсера, який містить Asp або Glu залишок, і карбоксильна група спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника.
146. Похідна за будь-яким з пп. 133-145, яка відрізняється тим, що ліпофільний замісник включає частково або повністю гідрогенізовану циклопентанофенантренову структуру.
147. Похідна за будь-яким з пп. 133-145, яка відрізняється тим, що ліпофільний замісник є прямим ланцюгом або розгалуженою алкільною групою.
148. Похідна за будь-яким з пп. 133-145, яка відрізняється тим, що ліпофільний замісник є ацильною групою прямоланцюгової або розгалуженої жирної кислоти.
149. Похідна за п. 148, яка відрізняється тим, що ацильну групу вибирають з групи, яка включає СН3(СН2)nСО-, у якій n є цілим числом від 4 до 38, перевагу віддають СН3(СН2)6СО-, СН3(СН2)8СО-, СН3(СН2)10СО-, СН3(СН2)12СО-, СН3(СН2)14СО-, СН3(СН2)16СО-, СН3(СН2)18СО-, СН3(СН2)20СО- та СН3(СН2)22СО-.
150. Похідна за будь-яким з пп. 133-145, яка відрізняється тим, що ліпофільний замісник є ацильною групою прямоланцюгової або розгалуженої алканової -дикарбонової кислоти.
151. Похідна за п. 150, яка відрізняється тим, що ацильну групу вибирають з групи, яка включає НООС(СН2)mСО-, у якій m є цілим числом від 4 до 38, переважно від 4 до 24, більш переважно вибирають з групи, яка включає НООС(СН2)14СО-, НООС(СН2)16СО-, НООС(СН2)18СО-, НООС(СН2)20СО- та НООС(СН2)22СО-.
152. Похідна за будь-яким з пп. 133-145, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)р((СН2)qСOОН)СНNН-СО(СН2)2СО-, у якій p та q є цілими числами, a p+q є цілим числом від 8 до 33, переважно від 12 до 28.
153. Похідна за будь-яким з пп. 133-145, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)rСО-NНСН(СООН)(СН2)2СО-, де r є цілим числом від 10 до 24.
154. Похідна за будь-яким з пп. 133-145, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули СН3(СН2)sСО-NНСН((СН2)2СООН)СО-, де s є цілим числом від 8 до 24.
155. Похідна за будь-яким з пп. 133-145, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули -NHCH(COOH)(CH2)4NH-CO(CH2)uCH3, у якій u є цілим числом від 8 до 18.
156. Похідна за будь-яким з пп. 133-145, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули -NHCH(COOH)(CH2)4NH-СОСН((СН2)2СООН)NН-СО(СН2)wСН3, у якій w є цілим числом від 10 до 16.
157. Похідна за будь-яким з пп. 133-145, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули –NНСH(СООН)(СH2)4NН-СО(СН2)2СН(СООН)NН-СО(СН2)хСН3, у якій х є цілим числом від 10 до 16.
158. Похідна за будь-яким з пп. 133-145, яка відрізняється тим, що ліпофільний замісник зі спейсером є групою формули –NНСH(СООН)(СH2)4NН-СО(СН2)2СН(СООН)NН-СО(СН2)yСН3, у якій у є нулем або цілим числом від 1 до 22.
159. Похідна за будь-яким з пп. 133-158, яка відрізняється тим, що усі амінокислотні залишки GLP-1 (7-37), кількість яких сягає шести, замінено на інший -амінокислотний залишок, який може бути кодований генетичним кодом.
160. Похідна за п. 133, яка відрізняється тим, що є Arg26,34Lys38(-(-карбоксинонадеканоїл))-GLP-1(7-38).
161.Похідна за п. 133, яка відрізняється тим, що є Arg26,34Lys38(-(-карбоксигептадеканоїл))-GLP-1(7-38).
162. Похідна за п. 133, яка відрізняється тим, що є Arg26,34Lys38(-(-карбоксиундеканоїл))-GLP-1(7-38).
163. Похідна за п. 133, яка відрізняється тим, що є Arg26,34Lys38(-(-карбоксигептаноїл))-GLP-1(7-38).
164. Похідна за п. 133, яка відрізняється тим, що є Glu22,23,30Arg26,34Lys38(-(-глутаміл(-гексадеканоїл)))-GLP-1(7-38).
165. Похідна за п. 133, яка відрізняється тим, що є Glu23,26Arg34Lys38(-(-глутаміл(-тетрадеканоїл)))-GLP-1(7-38).
166. Похідна за п. 133, яка відрізняється тим, що є Arg26,34Lys38(-(ω-карбоксипентадеканоїл))-GLP-1(7-38).
167. Похідна за п. 133, яка відрізняється тим, що є Arg26,34Lys38(-(-глутаміл(-тетрадеканоїл)))-GLP-1(7-38).
168. Похідна за п. 133, яка відрізняється тим, що є Arg26,34Lys38(-(ω-карбоксипентадеканоїл))-GLP-1(7-38).
169. Похідна за п. 133, яка відрізняється тим, що є Arg26,34Lys38(-(-глутаміл(-гексадеканоїл)))-GLP-1(7-38).
170. Похідна за п. 133, яка відрізняється тим, що є Arg18,23,26,30,34Lys38(-гексадеканоїл)-GLP-1(7-38).
171. Похідна за п. 133, яка відрізняється тим, що є Arg26,34Lys38(-(ω-карбокситридеканоїл))-GLP-1(7-38).
172. Похідна за п. 133, яка відрізняється тим, що є Arg26,34Lys38(-(-глутаміл(-октадеканоїл)))-GLP-1(7-38).
173. Похідна аналогу GLP-1 (7-37), де аналог являє собою агоніст рецептора GLP-1 людини, яка відрізняється тим, що принаймні один амінокислотний залишок має приєднаний ліпофільний замісник, причому аналог вибраний з групи, яка включає:
за умови, що коли присутній лише один ліпофільний замісник і цей замісник приєднаний до N-кінцевого або до С-кінцевого амінокислотного залишку, то цей замісник являє собою алкільну групу або групу, яка має ω-карбоксильну групу.
174. Похідна за п. 173, яка відрізняється тим, що ліпофільний замісник включає від 4 до 40 атомів вуглецю, краще від 8 до 25 атомів вуглецю.
175. Похідна за будь-яким з пп. 173-174, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку таким чином, що карбоксильна група ліпофільного замісника утворює амідний зв'язок з аміногрупою амінокислотного залишку.
176. Похідна за будь-яким з пп. 173-174, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку таким чином, що аміногрупа ліпофільного замісника утворює амідний зв'язок з карбоксильною групою амінокислотного залишку.
177. Похідна за будь-яким з пп. 173-176, яка відрізняється тим, що ліпофільний замісник приєднаний до амінокислотного залишку через спейсер.
178. Похідна за п. 177, яка відрізняється тим, що спейсер являє собою нерозгалужену групу алканової -дикарбонової кислоти, що має від 1 до 7 метиленових груп, краще - дві метиленові групи, яка утворює місток між аміногрупою пептиду та аміногрупою ліпофільного замісника.
179. Похідна за п. 177, яка відрізняється тим, що спейсер являє собою амінокислотний залишок, за винятком Cys, або дипептид такий як Gly-Lys.
180. Похідна за п. 179, яка відрізняється тим, що карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою Lys або дипептиду, що містить залишок Lys, а інша аміногрупа Lys спейсера або дипептидного спейсера, що містить залишок Lys, утворює амідний зв'язок з карбоксильною групою ліпофільного замісника.
181. Похідна за п. 179, яка відрізняється тим, що аміногрупа пептиду утворює амідний зв'язок з карбоксильною групою амінокислотного залишку або дипептидного спейсера, і аміногрупа амінокислотного залишку або дипептидного спейсера утворює амідний зв'язок з карбоксильною групою ліпофільного замісника.
182. Похідна за п. 179, яка відрізняється тим, що карбоксильна група пептиду утворює амідний зв'язок з аміногрупою спейсера, який є амінокислотним залишком, або дипептидного спейсера, і карбоксильна група спейсера, який є амінокислотним залишком, або дипептидного спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника.
183. Похідна за п. 179, яка відрізняється тим, що карбоксильна група пептиду утворює амідний зв'язок з аміногрупою спейсера, який являє собою Asp або Glu, або дипептидного спейсера, що включає Asp або Glu залишок, і карбоксильна група спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника.
184. Похідна за будь-яким з пп. 173-183, яка відрізняється тим, що ліпофільний замісник включає частково або повністю гідрогенізовану циклопентанофенантренову структуру.
185. Похідна за будь-яким з пп. 173-183, яка відрізняється тим, що ліпофільний замісник являє собою нерозгалужену або розгалужену алкільну групу.
186. Похідна за будь-яким з пп. 173-183, яка відрізняється тим, що ліпофільний замісник являє собою ацильну групу нерозгалуженої або розгалуженої жирної кислоти.
187. Похідна за п. 186, яка відрізняється тим, що ацильна група вибрана з групи, яка включає СН3(СН2)nСО-, в якій n приймає значення від 4 до 38, переважно СН3(СН2)6СО-, СН3(СН2)8СО-, СН3(СН2)10СО-, СН3(СН2)12СО-, СН3(СН2)14СО-, СН3(СН2)16СО-, СН3(СН2)18СО-, СН3(СН2)20СО- та СН3(СН2)22СО-.
188. Похідна за будь-яким з пп. 173-183, яка відрізняється тим, що ліпофільний замісник являє собою ацильну групу нерозгалуженої або розгалуженої алканової -дикарбонової кислоти.
189. Похідна за п. 188, яка відрізняється тим, що ацильна група вибрана з групи, яка включає НООС(СН2)mСО-, у якій m приймає значення від 4 до 38, переважно від 4 до 24, більш переважно вибрана з групи, яка включає НООС(СН2)14СО-, НООС(СН2)16СО-, НООС(СН2)18СО-, НООС(СН2)20СО- і НООС(СН2)22СО-.
190. Похідна за будь-яким з пп. 173-183, яка відрізняється тим, що ліпофільний замісник зі спейсером являє собою групу формули CH3(CH2)p((CH2)qCOOH)CHNH-CO(CH2)2CO-, у якій р і q являють собою цілі числа і p+q являє собою ціле число від 8 до 33, переважно від 12 до 28.
191. Похідна за будь-яким з пп. 173-183, яка відрізняється тим, що ліпофільний замісник зі спейсером являє собою групу формули СН3(СН2)rСО-NHCH(COOH)(CH2)2CO-, у якій r являє собою ціле число від 10 до 24.
192. Похідна за будь-яким з пп. 173-183, яка відрізняється тим, що ліпофільний замісник зі спейсером являє собою групу формули CH3(CH2)sCO-NHCH((CH2)2COOH)CO-, у якій s являє собою ціле число від 8 до 24.
193. Похідна за будь-яким з пп. 173-183, яка відрізняється тим, що ліпофільний замісник зі спейсером являє собою групу формули -NHCH(COOH)(CH2)4NH-СО(СН2)uСН3, у якій u являє собою ціле число від 8 до 18.
194. Похідна за будь-яким з пп. 173-183, яка відрізняється тим, що ліпофільний замісник зі спейсером являє собою групу формули -NHCH(COOH)(CH2)4NH-COCH((CH2)2COOH)NH-CO(CH2)wCH3, у якій w являє собою ціле число від 10 до 16.
195. Похідна за будь-яким з пп. 173-183, яка відрізняється тим, що ліпофільний замісник зі спейсером являє собою групу формули -NHCH(COOH)(CH2)4NH-CO(CH2)2CH(COOH)NH-CO(CH2)xCH3, у якій х являє собою ціле число від 10 до 16.
196. Похідна за будь-яким з пп. 173-183, яка відрізняється тим, що ліпофільний замісник зі спейсером являє собою групу формули -NHCH(COOH)(CH2)4NH-CO(CH2)2CH(COOH)NH-CO(CH2)yCH3, у якій у являє собою нуль або ціле число від 1 до 22.
197. Похідна за будь-яким з пп. 173-196, яка відрізняється тим, що усі амінокислотні залишки, кількість яких сягає шести, GLP-1(7-37) замінено на інший α-амінокислотний залишок, який може бути кодований генетичним кодом.
198. Фармацевтична композиція, яка відрізняється тим, що включає похідну за будь-яким з пп. 1-197 та фармацевтично прийнятний наповнювач або носій.
199. Спосіб виготовлення лікарського засобу, що має пролонгований профіль дії по відношенню до GLP-1(7-37), який відрізняється тим, що похідну за будь-яким з пп. 1-197 комбінують з фармацевтично прийнятним наповнювачем або носієм.
200. Спосіб виготовлення лікарського засобу, для лікування інсулінонезалежного цукрового діабету, який відрізняється тим, що похідну за будь-яким з пп. 1-197 комбінують з фармацевтично прийнятним наповнювачем або носієм.
201. Спосіб виготовлення лікарського засобу, для лікування інсулінозалежного цукрового діабету, який відрізняється тим, що похідну за будь-яким з пп. 1-197 комбінують з фармацевтично прийнятним наповнювачем або носієм.
202. Спосіб виготовлення лікарського засобу, для лікування ожиріння, який відрізняється тим, що похідну за будь-яким з пп. 1-197 комбінують з фармацевтично прийнятним наповнювачем або носієм.
203. Спосіб виготовлення лікарського засобу, для лікування одного або більше з станів, вибраних з інсулінонезалежного цукрового діабету, інсулінозалежного цукрового діабету та ожиріння, який відрізняється тим, що похідну за будь-яким з пп. 1-197 комбінують з фармацевтично прийнятним наповнювачем або носієм.
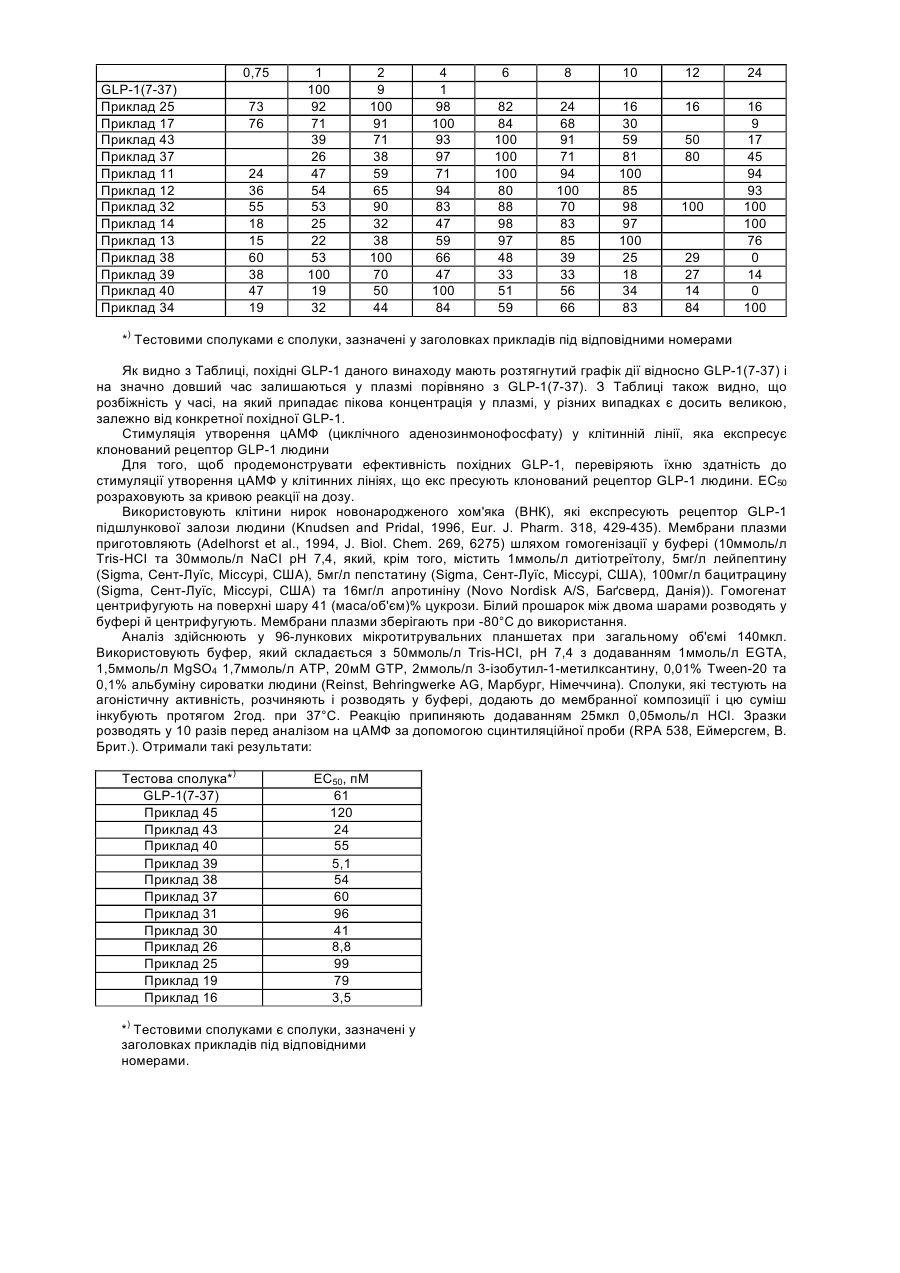
Текст
Даний винахід стосується нових похідних глюкагоноподібного пептиду людини-1 (GLP-1) та його фрагментів і аналогів таких фрагментів, які мають тривалу дію, а також способів їх одержання та використання. Пептиди широко використовують у медицині, а оскільки вони можуть бути одержані з застосуванням технології рекомбінантної ДНК, то можна сподіватися, що значення їх зростатиме й у найближчі роки. При використанні природних пептидів або їхніх аналогів для лікування було виявлено, що вони мають високий кліренс. Високий кліренс терапевтичного агенту є незручним у випадках, коли потрібне підтримання його високого рівня у крові протягом тривалого періоду часу, оскільки у такому разі виникає необхідність у повторних призначеннях. Прикладами пептидів з високим кліренсом є: АКТГ, фактор вивільнення кортикотропіну, ангіотензин, кальцитонін, інсулін, глюкагон, глюкагоноподібний пептид-1, глюкагоноподібний пептид-2, інсуліноподібний фактор росту-1, інсуліноподібний фактор росту-2, шлунковий інгібуючий пептид, фактор вивільнення гормону росту, активуючий пептид аденілату циклази гіпофізу, секретин, ентерогастрин, соматостатин, соматотропін, соматомедин, гормон паращитовидної залози, тромбопоїетин, еритропоїетин, релізинг-фактори гіпоталамусу, пролактин, стимулюючі гормони щитовидної залози, ендорфіни, енкефаліни, вазопресин, окситоцин, опіоди та їхні аналоги, супероксид-дисмутаза, інтерферон, аспарагіназа, аргіназа, аргініндеаміназа, аденозиндеаміназа та рибонуклеаза. У деяких випадках можна впливати на графік вивільнення пептидів через застосування відповідних фармацевтичних композицій, проте такий підхід має ряд недоліків і не завжди може застосовуватися. Гормони, які регулюють секрецію інсуліну, належать до так званої ентероінсулярної осі, що позначає групу гормонів, вивільнених зі слизової оболонки шлунково-кишкового тракту у відповідь на присутність та абсорбцію поживних речовин у кишечнику, що сприяє швидкому й посиленому вивільненню інсуліну. Підсилюючий ефект на секрецію інсуліну, так званий ендокринний ефект, можливо, є суттєвим для нормальної толерантності до глюкози. Багато шлунково-кишкових гормонів, включаючи гастрин та секретин (холецистокінін в організмі людини не є інсулінотропним), є інсулінотропними, але лише фізіологічно важливі, ті, що відповідають за ендокринний ефект, є глюкозозалежним інсулінотропним поліпептидом (GIP) та глюкагоноподібним пептидом-1 (GLP-1). Завдяки інсулінотропному ефектові, GIP, виділені у 1973р. (1), відразу ж викликали до себе значний інтерес у діабетологів. Однак численні дослідження, проведені протягом наступних років, чітко показали, що недостатня секреція GIP не має відношення до патогенезу інсулін-залежного цукрового діабету (IDDM) або не залежного від інсуліну цукрового діабету (NIDDM) (2). Крім того, як інсулінотропний гормон, GIP виявився майже неефективним при NIDDM (2). Інший ендокринний гормон, GLP-1, є найбільш сильнодіючою інсулінотропною речовиною з відомих речовин (3). На відміну від GIP, він є напрочуд ефективним при стимулюванні секреції інсуліну у пацієнтів, хворих на NIDDM. До того ж, на відміну від інших інсулінотропних гормонів (хіба що за винятком секретину), він також ефективно інгібує секрецію глюкагону. Завдяки цій дії він має чітко виражений ефект, який полягає у зниженні глюкози крові, зокрема, у пацієнтів, хворих на NIDDM. GLP-1, продукт проглюкагону (4), є одним з наймолодших представників секретин-VIP родини пептидів, але вже зарекомендував себе як важливий кишковий гормон з регуляторною функцією у метаболізмі глюкози та секреції й метаболізмі у шлунково-кишковому тракті (5). Ген глюкагону інакше обробляється у підшлунковій залозі та у кишечнику. У підшлунковій залозі (9) ця обробка веде до утворення та паралельної секреції 1) самого глюкагону, який займає позиції 33-61 проглюкагону (PG), 2) N-кінцевого пептиду 30 амінокислот (PG (1-30)), який нерідко називають гліцентин-зв'язаним пептидом підшлункової залози, GRPP (10, 11); 3) гексапептиду, який відповідає PG (64-69); 4) і, нарешті, так званого головного фрагменту проглюкагону (PG (72-158)), у якому містяться дві глюкагоноподібні послідовності (9). Очевидно, глюкагон є єдиним біологічно активним продуктом. І навпаки, у слизовій оболонці кишечнику це глюкагон, який міститься у великій молекулі, тоді як два глюкагоноподібні пептиди утворені окремо (8). Паралельно утворюються й секретуються такі продукти: 1) гліцентин, який відповідає PG (1-69) з глюкагоновою послідовністю, яка заповнює залишки №№ 33-61 (12); 2) GLP-1(7-36)aмід (PG (78-107))амід (13), не той, який спочатку вважали PG (72-107)амідом, або 108, який є неактивним. У невеликих кількостях також утворюються GLP-1(7-37), (PG (78-108)), які подовжені гліцином на С-кінці, але мають таку саму біоактивність (14); 3) проміжний пептид-2 (PG (111-122)амід) (15); та 4) GLP-2 (PG (126-158)) (15, 16). Фракція гліцентину далі розщеплюється на GRPP (PG (1-30)) та оксинтомодулін (PG (33-69)) (17, 18). Серед цих пептидів GLP-1 виявляє найбільшу біологічну активність. Оскільки GLP-1 виділяється паралельно з гліцентином/ентероглюкагоном, то багато моментів, що стосуються секреції ентероглюкагону (6, 7) деякою мірою стосуються й секреції GLP-1, але GLP-1 метаболізується швидше, маючи період напіврозпаду плазми у людині 2хв. (19). Вуглеводи або жирна їжа стимулюють секрецію (20), очевидно, в результаті безпосередньої взаємодії ще не абсорбованих поживних речовин з мікроворсинками L-клітин відкритого типу слизової оболонки кишечнику. Ендокринні або нейтральні механізми, які сприяють секреції GLP-1, можуть існувати, але не виявили себе у людини. Ендокринна функція GLP-1 (29-31) була чітко показана в експериментах з антагоністом GLP-1рецептора, ексендином 9-39, який значною мірою знижує ендокринний ефект, який був виявлений ротовою глюкозою щура (21, 22). Гормон безпосередньо взаємодіє з b-клітинами через GLP-1-рецептор (23), який належить до родини з'єднаних з G-протеїном глюкагон/VІР/кальцитонін-рецепторів, які 7 разів проходять крізь мембрану. Роль GLP-1-рецептора у регулюванні секреції інсуліну була показана у попередніх експериментах, у яких на мишах здійснювали спрямований розрив GLP-1-рецептора. Тварини, гомозиготні для розриву, мали дуже послаблену толерантність до глюкози та викликану голодуванням гіперглікемію, і навіть гетерозиготні тварини були нетолерантними до глюкози (24). Механізм трансдукції сигналів (25) насамперед включає активацію аденілатциклази, але суттєвим є також підвищення внутрішньоклітинного Са2+ (25, 26). Дію гормону найкращим чином описано як викликання стимульованого глюкозою вивільнення інсуліну (25), але механізм зв'язку між глюкозою та стимуляцією GLP-1 невідомий. Він може включати індуковане кальцієм вивільнення кальцію (26, 27). Як уже згадувалося, інсулінотропна дія GLP-1 зберігається у діабетичних b-клітинах. Не є відомим і зв'язок останніх з його здатністю передавати "компетентність глюкози" виділеним інсуліносекретуючим клітинам (26, 28), які слабо відповідають глюкозі або GLP-1 поодинці, але повністю відповідають їхній комбінації. Особливо важливим, однак, є те, що гормон також активно інгібує секрецію глюкагону (29). Механізм передачі невідомий, але, очевидно, він є паракринним, через сусідні клітини інсуліну або соматостатину (25). Глюкагоностатична дія також залежить від глюкози таким чином, що інгібуючий ефект знижується зі зниженням глюкози у крові. Завдяки цьому подвійному ефектові, якщо концентрація GLP-1 у плазмі зростає або через підвищення секреції, або через екзогенне вливання, молярне співвідношення інсуліну до глюкагону у крові, яка надходить у печінку через портальний кровообіг, значно зростає при зниженні продукування глюкози у печінці (30). В результаті концентрація глюкози у крові знижується. Через залежність глюкози від інсулінотропної та глюкагоностатичної дій ефект зниження глюкози є самообмежуючим, і тому гормон не викликає гіпоглікемії, незалежно від дози (31). Ці ефекти зберігаються у пацієнтів, хворих на цукровий діабет (32), у яких вливання GLP-1 у дозах, які дещо перевищують фізіологічні, може повністю нормалізувати рівень глюкози крові, незважаючи на слабкий метаболічний контроль та брак сульфонілсечовини, який виникає внаслідок цього (33). Важливість глюкагоностатичного ефекту ілюструється виявленням того, що GLP-1 також знижує глюкозу крові у діабетиків 1-го типу без залишкової здатності b-клітин до секреції (34). Крім впливу на панкреатичні острівці, GLP-1 активно діє на шлунково-кишковий тракт. При вливанні у фізіологічних кількостях GLP-1 активно інгібує індуковану пентагастрином та їжею секрецію шлункової кислоти (35, 36). Він також стримує швидкість спорожнення шлунку та інгібує секрецію ферменту підшлункової залози (36). Такого самого інгібуючого впливу на секрецію та рухливість шлунку та підшлункової залози у людини можна досягти в результаті перфузії клубової кишки розчинами, що містять вуглеводи або ліпіди (37, 38). Разом з цим значною мірою стимулюється GLP-1 секреція, і є припущення, що GLP-1 є принаймні одним з чинників так званого ефекту "пробивання непрохідності" (38). Фактично, останні дослідження показують, що з фізіологічної точки зору ефект пробивання непрохідності з боку GLP-1 може бути важливішим, ніж його вплив на панкреатичні острівці. Таким чином, у дослідах з вивчення реакції на дозу GLP-1 впливає на швидкість спорожнення шлунку при швидкості вливання, принаймні настільки низькій, наскільки це потрібно для впливу на секрецію в острівцях (39). Очевидно, GLP-1 впливає на засвоєння їжі. Внутрішньошлуночкове введення of GLP-1 повністю інгібує засвоєння їжі у щурів (40, 42). Очевидно, цей вплив є дуже специфічним. Отже, подовжений на N-кінці GLP1 (PG 72-107)амід є неактивним, і відповідні дози антагоніста GLP-1, ексендину 9-39, зводять вплив GLP-1 (41) нанівець. Різке периферичне введення GLP-1 різко не інгібує засвоєння їжі у щурів (41, 42). Щоправда, зберігається ймовірність того, що GLP-1, секретований з кишкових L-клітин, діятиме також як сигнал насищання. У діабетиків (43) зберігається не лише інсулінотропний вплив, але й вплив GLP-1 на шлунковокишковий тракт, що може сприяти обмеженню індукованої їжею екскурсії глюкози і, що більш важливо, може також впливати на засвоєння їжі. При внутрішньовенному введенні протягом тижня при нормі 4нг/кг/хв GLP1 продемонстрував значне поліпшення контролю глікемії у пацієнтів з NIDDM без помітних побічних ефектів (44). Пептид виявляє повну активність після підшкірного введення (45), але швидко розщеплюється, насамперед, через розщеплення дипептидилпептидазними IV-подібними ферментами (46, 47). Амінокислотна послідовність GLP-1 показана, наприклад, у роботі Schmidt et al. (Diabetologia 28 704-707 (1985)). Хоча цікаві фармакологічні властивості GLP-1(7-37) та його аналогів в останні роки привернули значну увагу, про структуру цих молекул відомо небагато. Вторинну структуру GLP-1 у міцелах було описано у роботі Thorton et al. (Biochemistry 33 3532-3539 (1994)), але у нормальному розчині GLP-1 вважають дуже гнучкою молекулою. Несподівано нами було виявлено, що в результаті дериватизації цієї відносно невеликої й дуже гнучкої молекули виникали сполуки, профіль плазми яких був дуже видовжений і все ж зберігав активність. GLP-1 та аналоги GLP-1 та його фрагментів можуть потенційно використовуватися також для лікування діабету 1 та 2 типів. Однак високий ступінь очищення обмежує використання цих сполук, а, отже, зберігається необхідність вдосконалень у цій галузі. Відповідно, одна з задач даного винаходу полягає у забезпеченні похідних GLP-1 та їх аналогів, які мають розтягнутий графік дії відносно GLP-1(7-37). Ще однією задачею винаходу є забезпечення похідних GLP-1 та їх аналогів, які мають нижчий кліренс, ніж у GLP-1(7-37). Іншою задачею винаходу є забезпечення фармацевтичної композиції, яка включає сполуку згідно з винаходом та використання сполуки згідно з винаходом для забезпечення такої композиції. Задача даного винаходу також полягає у забезпеченні способу лікування інсулін-залежного та інсулін-незалежного цукрового діабету. Посилання. 1. Pederson RA. Gastric Inhibitory Polypeptide. In Walsh JH, Dackray GJ (eds) Gut peptides: Biochemistry and Physiology. Raven Press, New York 1994, pp.217-259. 2. Krarup T. Immunoreactive gastric inhibitory polypeptide. Endocr Rev 1988; 9:122-134. 3. Ærskov C. Glucagon-like peptide-1, a new hormone of the enteroinsular axis. Diabetologia 1992; 35:701711. 4. Bell Gl, Sanchez-Pescador R, Laybourn PJ, Najarian RC. Exon duplication and divergence in the human preproglucagon gene. Nature 1983; 304: 368-371. 5. Hoist JJ. Glucagon-like peptide-1 (GLP-1) - a newly discovered Gl hormone. Gastroenterology 1994; 107:1848-1855. 6. Hoist JJ. Gut glucagon, enteroglucagon, gut GLI, glicentin - current status. Gastroenterology 1983;84:16021613. 7. Hoist JJ, Ærskov C. Glucagon and other proglucagon-derived peptides. In Walsh JH, Dockray GJ, eds. Gut peptides: Biochemistry and Physiology. Raven Press, New York, pp.305-340, 1993. 8. Ærskov C, Hoist JJ, Knuhtsen S, Baldissera FGA, Poulsen SS, Nielsen OV. Glucagon-like peptides GLP-1 and GLP-2, predicted products of the glucagon gene, are secreted separately from the pig small intestine, but not pancreas. Endocrinology 1986; 119:1467-1475. 9. HoIst JJ, Bersani M, Johnsen AH, Kofod H, Hartmann B, Ærskov С. Proglucagon processing in porcine and human pancreas. J. BioI. Chem., 1994; 269: 18827-1883. 10. Moody AJ, Hoist JJ, Thim L, Jensen SL. Relationship of glicentin to proglucagon and glucagon in the porcine pancreas. Nature 1981; 289: 514-516. 11. Thim L, Moody AJ, Очищення and chemical characterisation of a glicentin-related pancreatic peptide (proglucagon fragment) from porcine pancreas. Biochim BiophysActa 1982; 703:134-141. 12. Thim L, Moody AJ. The primary structure of glicentin (proglucagon). Regul Pept 1981; 2:139-151. 13. Ærskov C, Bersani M, Johnsen AH. Højrup P, Hoist JJ. Complete sequences of Glucagon-like peptide-1 (GLP-1) from human and pig small intestine. J. Biol. Chem. 1989; 264:12826-12829. 14. Ærskov C, RabenhÆaj L, Kofod H, Wettergren A. Hoist JJ. Production and secretion of amidated and glycine-extended glucagon-like peptide-1 (GLP-1) in man. Diabetes 1991; 43:535-539. 15. Buhl T, Thim L, Kofod H, Ærskov C, Harling H, & Hoist JJ: Naturally occurring products of proglucagon 111-160 in the porcine and human small intestine. J. Biol. Chem. 1988; 263:8621-8624. 16. Ærskov C, Buhl T, Rabenhøj L. Kofod H, & Holst JJ: Carboxypeptidase-B-like processing of the C-terminus of glucagon-like peptide-2 in pig and human small intestine. FEBS letters. 1989; 247:193-106. 17. Hoist JJ. Evidence that enteroglucagon (11) is identical with the C-terminal sequence (residues 33-69) of glicentin. Biochem J. 1980; 187:337-343. 18. Bataille D, Tatemoto K, Gespach C, Jornvall H, Rosseiln G, Mutt V. Isolation of glucagon-37 (bioactive enteroglucagon/oxyntomodulin) from porcine jejuno-ileum. Characterisation of peptide. FEBS Lett 1982; 146:7986. 19. Ærskov C, Wettergren A, Hoist JJ. The metabolic rate and the biological effects of GLP-1 7-36 amide and GLP-1 7-37 in healthy volunteers are identical. Diabetes 1993; 42:658-661. 20. Elliott RM, Morgan LM, Tredger JA, Deacon S, Wright J, Marks V. Glucagon-like peptide-1(7-36)amide and glucose-dependent insutinotropic polypeptide secretion in response to nutrient ingestion in man: acute postprandial and 24-h secretion patterns. J Endocrinol 1993; 138:159-166. 21. Kolligs F, Fehmann HC, Göke R. Göke B. Reduction of incretin effect in rats by the glucagon-like peptide1 receptor antagonist exendin (9-39)amide. Diabetes 1995; 44:16-19. 22. Wang Z, Wang RM, Owji AA, Smith DM, Ghatei M, Bloom SR. Glucagon-like peptide-1 is a physiological incretin in rat. J. Clin. Invest. 1995; 95:417-421. 23. Thorens B. Expression cloning of the pancreatic b cell receptor for the gluco-incretin hormone glucagonlike peptide 1. Proc Natl Acad Sci 1992; 89:4641-4645. 24. Scrocchi L, Auerbach AB, Joyner AL, Drucker DJ. Diabetes in mice with targeted disruption of the GLP-1 receptor gene. Diabetes 1996; 45:21A. 25. Fehmann HC, Göke R, Göke B. Cell and molecular biology of the incretin hormones Glucagon-like peptide-l (GLP-1) and glucose-dependent insulin releasing polypeptide (GIP). Endocrine Reviews, 1995; 16:390410. 26. Gromada J, Dissing S, Bokvist K, Renstrom E, Frøkjzer-Jensen J, Wulff BS, Rorsman P. Glucagon-Ііke peptide I increases cytoplasmic calcium in insulin-secreting bТСЗ-cells by enhancement of intracellutar calcium mobilisation. Diabetes 1995; 44:767-774. 27. Holz GG, Leech CA, Habener JF. Activation of a cAMP-regulated Ca2+-signaling pathway in pancreatic bcells by the insulinotropic hormone glucagon-like peptide-1. J. Biol. Chem., 1996; 270:17749-17759. 28. Holz GG, Kuhltreiber WM, Habener JF. Pancreatic beta-cells are rendered glucose competent by the insulinotropic hormone glucagon-like peptide-1(7-37). Nature 1993; 361:362-365. 29. Ærskov C, Hoist JJ, Nielsen OV: Effect of truncated glucagon-like peptide-1 (proglucagon 78-107 amide) on endocrine secretion from pig pancreas, antrum and stomach. Endocrinology 1988; 123:2009-2013. 30. Hvidberg A, Toft Nielsen M, Hilsted J. Ærskov C, Holst JJ. Effect of glucagon-like peptide-1 (proglucagon 78-107amide) on hepatic glucose production in healthy man. Metabolism 1994; 43:104-108. 31. Qualmann C, Nauck M, Holst JJ, Ærskov C, Creutzfeldt W. Insulinotropic actions of intravenous glucagonlike peptide-1 [7-36 amide] in the fasting state in healthy subjects. Ada Diabetologica, 1995; 32:13-16. 32. Nauck MA, Heimesaat MM, Ærskov C, Holst JJ, Ebert R, Creutzfeldt W. Preserved incretin activity of GLP1(7-36amide) but not of synthetic human GIP in patients with type 2-diabetes mellitus. J Clin Invest 1993; 91:301307. 33. Nauck MA, Kleine N, Ærskov C, Hoist JJ, Willms B, Creutzfeldt W. Normalisation of fasting hyperglycaemia by exogenous GLP-1(7-36amide) in type 2-diabetic patients. Diabetologia 1993; 36:741-744. 34. Creutzfeldt W, Kleine N. Willms B, Ærskov C, Hoist JJ, Nauck MA. Glucagonostatic actions and reduction of fasting hyperglycaemia by exogenous glucagon-liem, peptide-1(7-36amide) in type I diabetic patients. Diabetes Care 1996; 19:580-586. 35. Schjoldager BTG, Mortensen PE, Christiansen J, Ærskov C, Hoist JJ. GLP-1 (Glucagon-like peptide-1) and truncated GLP-1, fragments of human proglucagon, inhibit gastric acid secretion in man. Dig. Dis. Sci. 1989; 35:703-708. 36. Wettergren A, Schjoldager B, Mortensen PE, Myhre J, Christiansen J, Holst JJ. Truncated GLP-1 (proglucagon 72-107amide) inhibits gastric and pancreatic functions in man. Dig Dis Sci 1993; 38:665-673. 37. Layer P. Holst JJ, Grandt D, Goebell H: lleal release of glucagon-like peptide-1 (GLP-1): association with inhibition of gastric acid in humans. Dig Dis Sci 995; 40:1074-1082. 38. Layer P, Hoist JJ. GLP-1: A humoral mediator of the Heal brake in humans? Digestion 1993; 54:385-386. 39. Nauck M, Ettler R, Niedereichholz U. Ærskov C, Hoist JJ, Schmiegel W. Inhibition of gastric emptying by GLP-1 (7-36 amide) or (7-37): effects on postprandial glycaemia and insulin secretion. Abstract. Gut 1995; 37 (suppl. 2): A124. 40. Schick RR. vorm Walde T, Zimmermann JP, Schusdziarra V, Classen M. Glucagon-like peptide 1 - a novel brain peptide involved in feeding regulation, in Ditschuneit H, Gries FA, Hauner H, Schusdziarra V, Wechsler JG (eds.) Obesity in Europe. John Libbey & Company ltd, 1994; pp.363-367. 41. Tang-Christensen M, Larsen PJ, Göke R, Fink-Jensen A. Jessop DS. Møller M, Sheikh S. Brain GLP-1 (736) amide receptors play a major role in regulation of food and water intake. Am. J. Physiol., 1996, in press. 42. Turton MD, O'Shea D, Gunn I. Beak SA, Edwards CMB, Meeran K, et al. A role for glucagon-like peptide-1 in the regulation of feeding. Nature 1996; 379:69-72. 43. Willms B, Wemer J, Creutzteldt W, Ærskov C, Hoist JJ. Nauck M. Inhibition of gastric emptying by glucagon-like peptide-1(7-36 amide) in patients with type-2-diabetes mellitus. Diabetologia 1994; 37, suppl. 1:A118. 44. Larsen J, Jallad N, Damsbo P. One-week continuous infusion of GLP-1(7-37) improves glycaemic control in NIDDM. Diabetes 1996; 45, suppl. 2:233A. 45. Ritzel R, Ærskov C, Holst JJ, Nauck MA. Pharmacokinetic, insulinotropic, and glucagonostatic properties of GLP-1 [7-36 amide] after subcutaneous injection in healthy volunteers. Dose-response relationships. Diabetologia 1995; 38:720-725. 46. Deacon CF, Johnsen AH, Holst JJ. Degradation of glucagon-like peptide-1 by human plasma in vitro yields an N-terminally truncated peptide that is a major endogenous metabolite in vivo. J Clin Endocrinol Metab 1995; 80:952-957. 47. Deacon CF. Nauck MA, Toft-Nielsen M, Pridal L. Willms B. Hoist JJ. 1995. Both subcutaneous and intravenously administered glucagon-like peptide-1 are rapidly degraded from the amino terminus in type II diabetic patients and in healthy subjects. Diabetes 44:1126-1131. GLP-1 людини являє собою пептид з 37 амінокислотних залишків, який походить з препроглюкагону, синтезованого також у L-клітинах у дистальній клубовій кишці, у підшлунковій залозі та у мозку. Обробка препроглюкагону з метою отримання GLP-1(7-36)aміду, GLP-1 (7-37) та GLP-2 відбувається здебільшого у L-клітинах. Для опису фрагментів та аналогів цього пептиду застосовується проста система. Так, наприклад, Gly8-GLP-1(7-37) означає фрагмент GLP-1, який відповідним чином отримують з GLP-1 шляхом видалення амінокислотних залишків №№1-6 та заміщення природного амінокислотного залишку у позиції 8 (Ala) на Gly. Так само Lys34(Ne-тетрадеканоїл)-GLP-1(7-37) означає GLP-1(7-37) у якому e-аміногрупу Lysзалишку у позиції 34 було тетрадеканоїльовано. Якщо у тексті зроблено посилання на подовжені на С-кінці аналоги GLP-1, амінокислотний залишок у позиції 38 є Аrg, якщо не зазначено інакше, необов'язковий амінокислотний залишок у позиції 39 також є Аrg, якщо не зазначено інакше, а необов'язковий амінокислотний залишок у позиції 40 є Asp, якщо не зазначено інакше. Також, якщо подовжений на С-кінці аналог простягається до позиції 41, 42, 43, 44 або 45, амінокислотна послідовність цього подовження є такою, як у відповідній послідовності у препроглюкагоні людини, якщо не зазначено інакше. У найширшому аспекті даний винахід стосується похідних GLP-1 та їх аналогів. Похідні згідно з винаходом мають цікаві фармакологічні властивості, зокрема, вони мають більш розтягнутий графік дії порівняно з вихідними пептидами. У даному тексті термін "аналог" використовується для позначення пептиду, у якому один або кілька амінокислотних залишків вихідного пептиду було заміщено іншим амінокислотним залишком, і/або у якому один або кілька амінокислотних залишків вихідного пептиду було видалено, і/або у якому один або кілька амінокислотних залишків було додано до вихідного пептиду. Таке додавання може відбуватися на N-кінці або на С-кінці вихідного пептиду, або на обох кінцях. Термін "похідна" використовується у даному тексті для позначення пептиду, у якому один або кілька амінокислотних залишків вихідного пептиду було модифіковано хімічним шляхом, наприклад, шляхом алкілування, ацилювання, естероутворення або амідоутворення. Термін "похідна GLP-1" використовується у даному тексті для позначення похідної GLP-1 або її аналога. У даному тексті вихідний пептид, з якого, згідно з технологією, походить ця похідна, у деяких місцях називається "GLP-1 складова" похідної. В оптимальному варіанті, як описано у п.1 формули, даний винахід стосується похідної GLP-1, у якій принаймні один амінокислотний залишок вихідного пептиду має приєднаний ліпофільний замісник, за умови, що у разі наявності лише одного ліпофільного замісника й приєднання цього замісника до амінокислотного залишку вихідного пептиду на N-кінці або С-кінці цей замісник є алкільною групою або групою, яка має w-карбонову кислотну групу. В іншому оптимальному варіанті, як описано у п.2 формули, даний винахід стосується похідної GLP-1, що має лише один ліпофільний замісник. В іще одному оптимальному варіанті, як описано у п.3 формули, даний винахід стосується похідної GLP-1, яка має лише один ліпофільний замісник, який є алкільною групою або групою, яка має w-карбонову кислотну групу й приєднана до амінокислотного залишку вихідного пептиду на N-кінці. В іще одному оптимальному варіанті, як описано у п.4 формули, даний винахід стосується похідної GLP-1, яка має лише один ліпофільний замісник, який є алкільною групою або групою, яка має w-карбонову кислотну групу й приєднана до амінокислотного залишку вихідного пептиду на С-кінці. В іще одному оптимальному варіанті, як описано у п.5 формули, даний винахід стосується похідної GLP-1, яка має лише один ліпофільний замісник, який може бути приєднаний до будь-якого амінокислотного залишку, який не є амінокислотним залишком вихідного пептиду, розташованим на N-кінці або на С-кінці. В іще одному оптимальному варіанті, як описано у п.6 формули, даний винахід стосується похідної GLP-1, у якій є два ліпофільні замісники. В іще одному оптимальному варіанті, як описано у п.7 формули, даний винахід стосується похідної GLP-1 у якій є два ліпофільні замісники, один з яких приєднується до амінокислотного залишку на N-кінці, а інший приєднується до амінокислотного залишку на С-кінці. В іще одному оптимальному варіанті, як описано у п.8 формули, даний винахід стосується похідної GLP-1 у якій є два ліпофільні замісники, один приєднується до амінокислотного залишку на N-кінці, а інший приєднується до амінокислотного залишку, який не є амінокислотним залишком, розташованим на N-кінці або на С-кінці. В іще одному оптимальному варіанті, як описано у п.9 формули, даний винахід стосується похідної GLP-1 у якій є два ліпофільні замісники, один з яких приєднується до амінокислотного залишку на С-кінці, а інший приєднується до амінокислотного залишку, який не є амінокислотним залишком, розташованим на Nкінці або на С-кінці. В іще одному оптимальному варіанті, як описано у п.10 формули, даний винахід стосується похідної GLP-1(7-C), у якій С вибирають з групи, яка включає 38, 39, 40, 41, 42, 43, 44 та 45, і ця похідна має лише один ліпофільний замісник, який приєднується до амінокислотного залишку вихідного пептиду на С-кінці. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій ліпофільний замісник включає від 4 до 40 атомів вуглецю, краще - від 8 до 25 атомів вуглецю. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій ліпофільний замісник приєднується до амінокислотного залишку таким чином, що карбоксильна група ліпофільного замісника утворює амідний зв'язок з аміногрупою амінокислотного залишку. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій ліпофільний замісник приєднується до амінокислотного залишку таким чином, що аміногрупа ліпофільного замісника утворює амідний зв'язок з карбоксильною групою амінокислотного залишку. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій ліпофільний замісник приєднується до вихідного пептиду через спейсер. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій ліпофільний замісник - необов'язково через спейсер - приєднується до w-аміногрупи Lys-залишку, що міститься у вихідному пептиді. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій ліпофільний замісник приєднується до вихідного пептиду через спейсер, який є нерозгалуженою алкановою a,wдикарбоновою кислотною групою, яка має від 1 до 7 метиленових груп, краще - дві метиленові групи, спейсер яких утворює міст між аміногрупою вихідного пептиду та аміногрупою ліпофільного замісника. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій а ліпофільний замісник приєднується до вихідного пептиду через спейсер, який є амінокислотним залишком, за винятком Cys, або дипептидом, таким як Gly-Lys. У даному тексті вираз "дипептид, такий як Gly-Lys" використовується для позначення дипептиду, у якому амінокислотним залишком на С-кінці є Lys, His або Тrp, краще - Lys, і у якому амінокислотний залишок на N-кінці вибирають з групи, яка включає Ala, Arg, Asp, Asn, Gly, Glu, Gin, lie, Leu, Val, Phe та Pro. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій ліпофільний замісник приєднується до вихідного пептиду через спейсер, який є амінокислотним залишком, за винятком Cys, або є дипептидом, таким як Gly-Lys, і у якій карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою Lys-залишку або дипептиду, що містить Lys-залишок, а інша аміногрупа Lys-залишку або дипептиду, що містить Lys-залишок, утворює амідний зв'язок з карбоксильною групою ліпофільного замісника. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій ліпофільний замісник приєднується до вихідного пептиду через спейсер, який є амінокислотним залишком, за винятком Cys, або є дипептидом, таким як Gly-Lys, і у якій аміногрупа вихідного пептиду утворює амідний зв'язок з карбоксильною групою амінокислотного залишку або дипептидного спейсера, а аміногрупа амінокислотного залишку або дипептидного спейсера утворює амідний зв'язок з карбоксильною групою ліпофільного замісника. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій ліпофільний замісник приєднується до вихідного пептиду через спейсер який є амінокислотним залишком, за винятком Cys, або є дипептидом, таким як Gly-Lys, і у якій карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою спейсера, який є амінокислотним залишком, або дипептидного спейсера, а карбоксильна група спейсера, який є амінокислотним залишком, або дипептидного спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій ліпофільний замісник приєднується до вихідного пептиду через спейсер, який є амінокислотним залишком, за винятком Cys, або є дипептидом, таким як Gly-Lys, і у якій карбоксильна група вихідного пептиду утворює амідний зв'язок з аміногрупою спейсера, який являє собою Asp або Glu, або дипептидного спейсера, який містить залишок Asp або Glu, а карбоксильна група спейсера утворює амідний зв'язок з аміногрупою ліпофільного замісника. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, який включає частково або повністю гідрогенізовану циклопентанофенантренову структуру. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, що є алкільною групою з прямим ланцюгом або розгалуженою алкільною групою. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, що є ацильною групою жирної кислоти, з прямим ланцюгом або розгалуженою ацильною групою. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, що є ацильною групою, вибраною з групи, яка включає СН3(СН2)nСО-, у якій η є цілим числом від 4 до 38, краще - цілим числом від 4 до 24, перевагу віддають замісникові, вибраному з групи, яка включає СН3(СН2)6СО-, СН3(СН2)8СО-, СН3(СН2)10СО-, СН3(СН2)12СО-, СН3(СН2)14СО-, СН3(СН2)16СО-, СН3(СН2)18СО, СН3(СН2)20СО- та СН3(СН2)22СО-. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, що є ацильною групою алканової a,w-дикарбонової кислоти, з прямим ланцюгом або розгалуженої. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, що є ацильною групою, вибраною з групи, яка включає НООС(СН2)m СО-, у якій т є цілим числом від 4 до 38, краще - цілим числом від 4 до 24, перевагу віддають замісникові, вибраному з групи, яка включає НООС(СН2)14СО-, НООС(ССН2)16СО-, НООС(СН2)18СО-, НООС(СН2)20СО- та НООС(СН2)22СО-. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, що є групою формули CH3(CH2)p((CH2)qCOOH)CHNH-CO(CH2)2CO-, у якій ρ та q є цілими числами, a p+q є цілим числом від 8 до 33, краще - від 12 до 28. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, що є групою формули СН3(СН2)rСО-NHCH(COOH)(CH2)2CO-, у якій r є цілим числом від 10 до 24. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, що є групою формули СН3(СН2)sСО-NHCH((CH2)2COOH)CO-, у якій s є цілим числом від 8 до 24. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, що є групою формули COOH(CH2)tCO-, у якій t є цілим числом від 8 до 24. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, який є групою формули -NHCH(COOH)(CH2)4NH-CO(CH2)uCH3, у якій u є цілим числом від 8 до 18. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, який є групою формули -NHCH(COOH)(CH2)4NH-COCH((CH2)2COOH)NH-CO(CH2)wCH3, у якій w є цілим числом від 10 до 16. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, що є групою формули -NHCH(COOH)(CH2)4NH-CO(CH2)2CH(COOH)NH-CO(CH2)xCH3, у якій x є цілим числом від 10 до 16. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, який є групою формули -NHCH(COOH)(CH2)4NH-CO(CH2)2CH(COOH)NHCO(CH2)yCH3, в якій у є нулем або цілим числом від 1 до 22. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка має ліпофільний замісник, що може бути негативно заряджений. Такий ліпофільний замісник може, наприклад, бути замісником, який має карбоксильну групу. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, вихідний пептид якої вибирають з групи, яка включає GLP-1(1-45) або його аналог. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яка походить від фрагменту GLP-1, вибраного з групи, яка включає GLP-1(7-35), GLP-1(7-36), GLP-1 (7-36)амід, GLP-1(7-37), GLP-1(7-38), GLP-1(7-39), GLP-1(7-40) та GLP-1 (7-41) або його аналог. Ще в одному оптимальному варіанті даний винахід стосується аналога GLP-1, який походить від аналога GLP-1, вибраного з групи, яка включає GLP-1(1-35), GLP-1(1-36), GLP-1 (1-36)амід, GLP-1(1-37), GLP-1(1-38), GLP-1(1-39), GLP-1(1-40) та GLP-1(1-41) або його аналог. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій маркувальний аналог включає похідні, в яких усі амінокислотні залишки, кількість яких сягає п'ятнадцяти, краще - десяти, замінено на будь-який a-амінокислотний залишок. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій маркувальний аналог включає похідні, в яких усі амінокислотні залишки, кількість яких сягає п'ятнадцяти, краще - десяти, замінено на будь-який a-амінокислотний залишок, який може бути кодований генетичним кодом. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій маркувальний аналог включає похідні, у якій усі амінокислотні залишки, кількість яких сягає шести, замінено на інший aамінокислотний залишок, який може бути кодований генетичним кодом. Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1 (A-В), у якій А є цілим числом від 1 до 7, а В є цілим числом від 38 до 45, або аналога, який включає один ліпофільний замісник, приєднаний до амінокислотного залишку на С-кінці, та, необов'язково, другий ліпофільний замісник, приєднаний до іншого амінокислотного залишку. Ще в одному оптимальному варіанті вихідний пептид для похідної згідно з винаходом вибирають з групи, яка включає Arg26-GLP-1(7-37); Arg34-GLP-1(7-37); Lys36-GLP-1(7-37); Arg26,34Lys36GLP-1(7-37); Arg26,34Lys38GLP-1(7-38); Arg26,34Lys39GLP-1(7-39); Arg26,34Lys40-GLP-1(7-40); Arg26Lys36-GLP-1(7-37); 34 36 26 39 34 40 26,34 Arg Lys -GLP-1(7-37); Arg Lys GLP-1(7-39); Arg Lys -GLP-1(7-40); Arg Lys36,39-GLP-1(7-39); 26,34 36,40 8 26 8 34 Arg Lys -GLP-1(7-40); Gly Arg -GLP-1(7-37); Gly Arg -GLP-1(7-37); Gly8Lys36GLP-1(7-37); 8 26,34 36 8 26,34 39 8 26,34 40 Gly Arg Lys -GLP-1(7-37); Gly Arg Lys -GLP-1(7-39); Gly Arg Lys -GLP-1(7-40); GIy8Arg26Lys36-GLP1(7-37); Gly8Arg34Lys36GLP-1(7-37); Gly8Arg26Lys39-GLP-1(7-39); Gly8Arg34Lys40-GLP-1(7-40); 8 26,34 36,39 8 26,34 36,40 Gly Arg Lys -GLP-1(7-39) та Gly Arg Lys -GLP-1(7-40). Ще в одному оптимальному варіанті вихідний пептид для похідної згідно з винаходом вибирають з групи, яка включає Arg26,34Lys38GLP-1(7-38); Arg26,34Lys39GLP-1(7-39); Arg26,34Lys40GLP-1(7-40); Arg26,34Lys41GLP-1(7-41); Arg26,34Lys39GLP-1(7-42); Arg26,34Lys43GLP-1(7-43); Arg26,34Lys44GLP-1(7-44); Arg26,34Lys45GLP-1(7-45); Arg26,34Lys38GLP-1(1-38); Arg26,34Lys39GLP-1(1-39); 26,34 40 26,34 41 26,34 42 Arg Lys GLP-1(1-40); Arg Lys GLP-1(1-41); Arg Lys GLP-1(1-42); Arg26,34Lys43GLP-1(1-43); Arg26,34Lys44GLP-1(1-44); Arg26,34Lys45GLP-1(1-45); Arg26,34Lys38GLP-1(2-38); Arg226,34Lys39GLP-1(2-39); Arg26,34Lys40GLP-1(2-40); Arg26,34Lys41GLP-1(2-41); Arg26,34Lys42GLP-1(2-42); Arg26,34Lys43GLP-1(2-43); 26,34 44 26,34 45 26,34 38 Arg Lys GLP-1(2-44); Arg Lys GLP-1(2-45); Arg Lys GLP-1(3-38); Arg26,34Lys39GLP-1(3-39); 26,34 40 26,34 41 26,34 42 Arg Lys GLP-1(3-40); Arg Lys GLP-1(3-41); Arg Lys GLP-1(3-42); Arg26,34Lys43GLp-1(3-43). 26,34 44 26,34 45 26,34 38 Arg Lys GLP-1(3-44); Arg Lys GLP-1(3-45); Arg Lys GLP-1(4-38); Arg26,34Lys39GLP-1(4-39); Arg26,34Lys40GLP-1(4-40); Arg26,34Lys41GLP-1(4-41); Arg26,34Lys42GLP-1(4-42); Arg26,34Lys43GLP-1(4-43); Arg26,34Lys44GLP-1(4-44); Arg26,34Lys45GLP-1(4-45); Arg26,34Lys38GLP-1(5-38); Arg26,34Lys39GLP1(5-39); 26,34 40 26,34 41 26,34 42 Arg Lys GLP-1(5-40); Arg Lys GLP-1(5-41); Arg Lys GLP-1(5-42); Arg26,34Lys43GLP-1(5-43); 26,34 44 26,34 45 26,34 38 Arg Lys GLP-1(5-44); Arg Lys GLP-1(5-45); Arg Lys GLP-1(6-38); Arg26,34Lys39GLP-1(6-39); 26,34 40 26,34 41 26,34 42 Arg Lys GLP-1(6-40); Arg Lys GLP-1(6-41); Arg Lys GLP-1(6-42); Arg26,34Lys43GLP-1(6-43). Arg26,34Lys43GLP-1(6-44); Arg26,34Lys45GLP-1(6-45); Arg26Lys38GLP-1(1-38); Arg34Lys38GLP-1(1-38); 26,34 36,38 26 38 34 38 26,34 Arg Lys GLP-1(1-38); Arg Lys GLP-1(7-38); Arg Lys GLP-1(7-38); Arg Lys38,38GLP-1(7-38); Arg26,34Lys38GLЗ-1(7-38); Arg26Lys39GLP-1(1-39); Arg34Lys39GLP-1(1-39); Arg26,34Lys36,39GLP-1(1-39); Arg26Lys39GLP-1(7-39); Arg34Lys39GLP-1(7-39) та Arg26,34Lys36,39GLP-1(7-39). Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій вихідний пептид вибирають з групи, яка включає Arg26-GLP-1(7-37), Arg34-GLP-1(7-37), Lys36GLP-1(7-37), Arg26,34Lys36-GLP1(7-37), Arg26Lys36-GLP-1(7-37), Arg34Lys36-GLP-1(7-37), Gly8Arg26GLP-1(7-37), Gly8Arg34-GLP-1(7-37), Gly8Lys36-GLP-1(7-37), Gly8Arg26,34Lys36-GLP-1(7-37), Gly8Arg26Lys36-GLP-1(7-37) та Gly8Arg34Lys36-GLP-1(7 37). Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій вихідний пептид вибирають з групи, яка включає Arg26Lys38-GLP-1(7-38), Arg26,34Lys38-GLP-1(7-38), Arg26,34Lys36,38-GLP-1(738), Gly8Arg26Lys38-GLP-1(7-38) та Gly8Arg26,34Lys36,38-GLP-1(7.38) Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, у якій вихідний пептид вибирають з групи, яка включає Arg26Lys39-GLP-1(7-39), Arg26,34Lys36.39-GLP-1(7-39), Gly8Arg26Lys39-GLP-1(739) та Gly8Arg26,34Lys36,39-GLP-1(7-39). Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, y якій вихідний пептид вибирають з групи, яка включає Arg34Lys40-GLP-1(7-40), Arg26,34Lys36,40-GLP-1(7-40), Gly8Arg34Lys40GLP-1(740) та Gly8Arg26,34Lys36,40-GLP-1(7-40). Ще в одному оптимальному варіанті даний винахід стосується похідної GLP-1, яку вибирають з групи, що включає: Lys26(Ne-тетрадеканоїл)-GLP-1(7-37); Lys34(Ne-тетрадеканоїл)-GLP-1(7-37); Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-37); Gly8Lys26(Ne-тетрадеканоїл)-GLP-1(7-37); Gly8Lys34(Ne-тетрадеканоїл)-GLP-1(7-37); Gly8Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-37); Arg26Lys34(Ne-тетрадеканоїл)-GLP-1(7-37); Lys26(Ne-тетрадеканоїл)-GLP-1(7-38); Lys34(Ne-тетрадеканоїл)-GLP-1(7-38); Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-38); Gly8Lys26(Ne-тетрадеканоїл)-GLP-1(7-38); Gly8Lys34(Ne-тетрадеканоїл)-GLP-1(7-38); Gly8Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-38); Arg26Lys34(Ne-тетрадеканоїл)-GLP-1(7-38); Lys26(Ne-тетрадеканоїл)-GLP-1(7-39); Lys34(Ne-тетрадеканоїл)-GLP-1(7-39); Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-39); Gly8Lys26(Ne-тетрадеканоїл)-GLP-1(7-39); Gly8Lys34(Ne-тетрадеканоїл)-GLP-1(7-39); Gly8Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-39); Arg26Lys34(Ne-тетрадеканоїл)-GLP-1(7-39); Lys26(Ne-тетрадеканоїл)-GLP-1(7-40); Lys34(Ne-тетрадеканоїл)-GLP-1(7-40); Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-40); Gly8Lys26(Ne-тетрадеканоїл)-GLP-1(7-40); GІу8Lys34(Ne-тетрадеканоїл)-GLР-1(7-40); Gly8Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-40); Arg26Lys34(Ne-тетрадеканоїл)-GLP-1(7-40); Lys26(Ne-тетрадеканоїл)-GLP-1(7-36); Lys34(Ne-тетрадеканоїл)-GLP-1(7-36); Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-36); Gly8Lys26(Ne-тетрадеканоїл)-GLP-1(7-36); Gly8Lys34(Ne-тетрадеканоїл)-GLP-1(7-36); Gly8Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-36); Arg26Lys34(Ne-тетрадеканоїл)-GLP-1(7-36); Lys26(Ne-тетрадеканоїл)-GLP-1(7-35); Lys34(Ne-тетрадеканоїл)-GLP-1(7-35); Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-35); Gly8Lys26(Ne-тетрадеканоїл)-GLP-1(7-35); GIу8Lys34(Ne-тетрадеканоїл)-GLP-1(7-35); Gly8Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-35); Arg26Lys34(Ne-тетрадеканоїл)-GLP-1(7-35); Lys26(Ne-тетрадеканоїл)-GLP-1(7-36)aмiд; Lys34(Ne-тетрадеканоїл)-GLP-1(7-36)aмiд; Lys26,34-бi(Ne-тетрадеканоїл)-GLP-1(7-36)aмiд; Gly8Lys26(Ne-тетрадеканоїл)-GLP-1(7-36)aмiд; Gly8Lys34(Ne-тетрадеканоїл)-GLP-1(7-36)aмiд; Gly8Lys26,34-бi(тетрадеканоїл)-GLP-1(7-36)aмiд; Arg26Lys34(Ne-тетрадеканоїл)-GLP-1(7-36)aмiд; Gly8Arg26Lys34(Ne-тетрадеканоїл)-GLP-1(7-37); Lys26(Ne-тетрадеканоїл)Arg34-GLP-1(7-37); Gly8Lys26(Ne-тетрадеканоїл)Arg34-GLP-1(7-37); Arg26,34Lys36(Ne-тетрадеканоїл)-GLP-1(7-37); Gly8Arg26,34Lys36(тетрадеканоїл)-GLP-1(7-37); Gly8Arg26Lys34(Ne-тетрадеканоїл)-GLP-1(7-38); Lys26(Ne-тетрадеканоїл)Arg34-GLP-1(7-38); Gly8Lys26(Ne-тетрадеканоїл)Arg34-GLP-1(7-38); Arg26,34Lys36(Ne-тетрадеканоїл)-GLP-1(7-38); Arg26,34Lys38(Ne-тетрадеканоїл)-GLP-1(7-38); Gly8Arg26,34Lys36(Ne-тетрадеканоїл)-GLP-1(7-38); Gly8Arg26Lys34(Ne-тетрадеканоїл)-GLP-1(7-39); Lys26(Ne-тетрадеканоїл)Arg34-GLP-1(7-39); Gly8Lys26(Ne-тетрадеканоїл)Arg34-GLP-1(7-39); Arg26,34Lys36(Ne-тетрадеканоїл)-GLP-1(7-39); GІy8Arg26,34Lys36(Ne-тетрадеканоїл)-GLP-1(7-39); Gly8Arg26Lys34(Ne-тетрадеканоїл)-GLP-1(7-40); Lys26(Ne-тетрадеканоїл)Arg34-GLP-1(7-40); Gly8Lys26(Ne-тетрадеканоїл)Arg34-GLP-1(7-40); Arg26,34Lys36(Ne-тетрадеканоїл)-GLP-1(7-40); Gly8Arg26,34Lys36(Ne-тетрадеканоїл)-GLP-1(7-40); Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-37); Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-37); [_уs26,34-бі(Ne-(w-карбоксинонадеканоїл)GLP-1(7-37); Gly8Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-37); GIу8Lуs34(Ne-(w-карбоксинонадеканоїл))-GLР-1(7-37); GІу8Lуs26,34-бі(Ne-(w-карбоксинонадеканоїл))-GLР-1(7-37); Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-38); Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-38); Lys26,34-бi(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-38); Gly8Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-38); Gly8Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-38); Gly8Lys26,34-бi(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-38); Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-39); Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-39); Lys26,34-бi(Ne(w-карбоксинонадеканоїл))-GLP-1(7-39); Gly8Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-39); Gly8Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-39); Gly8Lys26,34-бi(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-39); Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-40); Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-40); LyS26,34-бі(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-40); Gly8Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-40); Gly8Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-40); Gly8Lys26,34-бi(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-40); Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-36); Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-36); Lуs26,34бі(Ne-(w-карбоксинонадеканоїл))-GLР-1(7-36); Gly8Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-36); Gly8Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-36); Gly8Lys26,34бi(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-36); Lys26(Ne(w-карбоксинонадеканоїл))-GLP-1(7-36)амід; Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-36)aмiд; Lys26,34-бi(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-36)амід; Gly8Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-36)aмiд; Gly8Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-36)aмiд; Gly8Lys26,34-бi(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-36)aмiд; Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-35); Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-35); Lуs26,34-бі(Ne-(w-карбоксинонадеканоїл))-СLР-1(7-35); Gly8Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-35); Gly8Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-35); Gly8Lys26,34-бi(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-35); Аrg26Lуs34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-37); Gly8Arg26Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-37); Lys26(Ne-(w-карбоксинонадеканоїл))Arg34-GLP-1(7-37); Gly8Lys26(Ne-(w-карбоксинонадеканоїл))Arg34-GLP-1(7-37); Arg26,34Lys36(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-37); Gly8Arg26,34Lys36(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-37); Arg26,34Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-38); Gly8Arg26Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-38); Lys26(Ne-(w-карбоксинонадеканоїл))Arg34-GLP-1(7-38); Gly8Lys26(Ne-(w-карбоксинонадеканоїл))Arg34-GLP-1(7-38); Arg26,34Lys36(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-38); Arg26,34Lys38(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-38); Gly8Arg26,34Lys36(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-38); Arg26Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-39); Gly8Arg26Lys34(Ne-(w-карбоксинонадеканоїл)-GLP-1(7-39); Lуs26(Ne-(w-карбоксинонадеканоїл))Аrg34-GІР-1(7-39); Gly8Lys26(Ne-(w-карбоксинонадеканоїл))Arg34-GLP-1(7-39); Arg2S,34Lys36(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-39); Gly8Arg26,34Lys36(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-39); Arg26Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-40); Gly8Arg26Lys34(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-40); Lys26(Ne-(w-карбоксинонадеканоїл))Arg34-GLP-1(7-40); Gly8Lys26(Ne-(w-карбоксинонадеканоїл))Arg34-GLP-1(7-40); Arg26,34Lys36(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-40); GIy8Arg26,34Lys36(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-40); Lys26(N6-(7-дезоксихолоїл))-GLP-1(7-37); Lys34(Ne-(7-дезоксихолоїл)-GLР-1(7-37); Lуs26,34-бi(Ne-(7-дезоксихолоїл))-СLР-1(7-37) GІу8Lуs26(Ne(7-дезоксихолоїл))-GLP-1(7-37); Gly8Lys34(Ne-(7-дезоксихолоїл))-GLP-1(7-37); Gly8Lys26,34-бі(Ne-(7-дезоксихолоїл))-GLР-1(7-37); Arg26Lys34(Ne-(7-дезоксихолоїл))-GLP-1(7-37); Lys26(Ne-(7-дезоксихолоїл))-GLP-1(7-38); Lys34(Ne-(7-дезоксихолоїл))-GLP-1(7-38); Lys26,34-бi(Ne-(7-дезоксихолоїл))-GLP-1(7-38); GІу8Lуs26(Ne-(7-дезоксихолоїл))-GLР-1(7-38); GІу8Lys34(Ne-(7-дезоксихолоїл))-GLР-1(7-38); Gly8Lys26,34-бі(Ne-(7-дезоксихолоїл)),GLР-1(7-38); Arg26Lys34(Ne-(7-дезоксихолоїл))-GLР-1(7.38); Lуs26(Ne-(7-дезоксихолоїл))-GLР-1(7-39); Lуs34(Ne-(7-дезоксихолоїл))-GLР-1(7-39); Lys26,34-бi(Ne-(7-дезоксихолоїл))-GLP-1(7-39); GІу8Lуs26(Ne(7-дезоксихолоїл))-GLР-1(7-39); Gly8Lys34(Ne-(7-дезоксихолоїл))-GLP-1(7-39); GІу8Lуs26,34-бі(Ne-(7-дезоксихолоїл))-GLР-1(7-39); Аrg26Lуs34(Ne-(7-дезоксихолоїл))-GLР-1(7-39); Lys26(Ne-(7-дeзoкcиxoлoїл))-GLP-1(7-40); Lуs34(Ne-(7-дезоксихолоїл))-GLР-1(7-40); Lуs26,34-бі(Ne-(7-дезоксихолоїл))-GLР-1(7-40); Gly8Lys26(Ne-(7-дезоксихолоїл))-GLP-1(7-40); GІу8Lуs34(Ne-(7-дезоксихолоїл))-GLР-1(7-40); GІу8Lуs26,34-бі(Ne-(7-дезоксихолоїл))-GLP-1(7-40); Аrg26Lуs34(Ne-(7-дезоксихолоїл))-GLР-1(7-40); Lуs26(Ne-(7-дезоксихолоїл))-GLР-1(7-36); Lys34(Ne-(7-дезоксихолоїл))-GLP-1(7-36); Lуs26,34-бі(Ne-(7-дезоксихолоїл))-GLР-1(7-36); Gly8Lys26(Ne-(7-дезоксихолоїл))-GLP-1(7-36); Gly8Lys34(Ne-(7-дезоксихолоїл))-GLP-1(7-36); GIy8Lys26,34-бi(Ne-(7-дезоксихолоїл))-GLP-1(7-36); Аrg26Lуs34(Ne-(7-дезоксихолоїл))-GLР-1(7-36); Lys26(Ne-(7-дезоксихолоїл))-GLP-1(7-35); Lys34(Ne-(7-дезоксихолоїл))-GLP-1(7-35); Lуs26,34-бі(Ne-(7-дезоксихолоїл))-GLР-1(7-35); GІу8Lуs26(Ne-(7-дезоксихолоїл))-GLР-1(7-35); GIу8Lуs34(Ne-(7-дезоксихолоїл))-GLР-1(7-35); Glу8Lуs26,34-бі(Ne(7-дезоксихолоїл))-GLP-1(7-35); Аrg26Lуs34(Ne-(7-дезоксихолоїл))-GLР-1(7-35); Lуs26(Ne-(7-дезоксихолоїл))-GLР-1(7-36)амід; Lys34(Ne-(7-дезоксихолоїл))-GLР-1(7-36)aмiд; Lуs26,34-бі(Ne-(7-дезоксихолоїл))-GLР-1(7-36)амід; GІу8Lуs26(Ne-(7-дезоксихолоїл))-GLР-1(7-36)амід; GІу8Lys34(Ne-(7-дезоксихолоїл))-СLР-1(7-36)амід; СІу8Lуs26,34-бі(Ne (7-дезоксихолоїл))-GLP-1(7-36)амід. Аrg26Lуs34-(Ne-(7-дезоксихолоїл))-GLР-1(7-36)амід; GІу8Аrg26Lуs34(Ne-(7-дезоксихолоїл))-GLР-1(7-37); Lys26(Ne-( 7-дезоксихолоїл))Arg34-GLP-1(7-37); GІу8Lуs26(Ne-(7-дезоксихолоїл))Аrg34-GLР-1(7-37); Arg26,34Lуs36(Ne-(7-дезоксихолоїл))-GLP-1(7_37); Glу8Arg26,34Lуs36(Ne-(7-дезоксихолоїл))-GLP-1(7-37); Lys26(Ne-(холоїл))-GLP-1(7-37); Lys34(Ne(холоїл))-GLP-1(7-37); Lys26,34-бi(Ne-(холоїл))-GLP-1(7-37); Gly8Lys26(Ne-(холоїл))-GLP-1(7-37); Gly8Lys34(Ne-(холоїл))-GLP-1(7-37); Gly8Lys26,34-бi(Ne-(холоїл))-GLP-1(7-37); Arg26Lys34(Ne-(холоїл))-GLP-1(7-37); GІу8Аrg26Lуs34(Ne-(7-дезоксихолоїл))-СLР-1(7-38); Lys26(Ne-(7-дезоксихолоїл))Arg34-GLP-1(7-38); Glу8Lys26(Ne-(7-дезоксихолоїл))Аrg34-GLР-1(7-38); Аrg26,34Lуs36(Ne-(7-дезоксихолоїл))-GLР-1(7-38); Аrg26,34Lуs38(Ne-( 7-дезоксихолоїл))-GLP-1(7-38); GІу8Аrg26,34Lуs36(Ne-(7-дезоксихолоїл))-GLР-1(7-38); Lуs26(Ne-(холоїл)}-GLР-1(7-38); Lys34(Ne-(холоїл))-GLP-1(7-38); Lуs26,34-бі(Ne-(холоїл))-GLР-1(7-38); Glу8Lуs26(Ne-(холоїл))-GLР-1(7-38); GIу8Lуs34(Ne-(холоїл))-GLР-1(7-38); Gly8Lys26,34-бi(Ne-(холоїл))-GLP-1(7-38); Arg26Lys34(Ne-(холоїл))-GLР-1(7-38); GІу8Аrg26Lуs34(Ne-(7-дезоксихолоїл))-GLР-1(7-39); Lуs26(Ne-(7-дезоксихолоїл))Аrg34-GLР-1(7-39); GІу8Lуs26(Ne-(7-дезоксихолоїл))Аrg34-GLР-1(7-39); Аrg26,34Lуs36(Ne-(7-дезоксихолоїл))-GLР-1(7-39); GІу8Arg26,34Lуs36(Ne-(7-дезоксихолоїл))-GLP-1(7-39); Lуs26(Ne-(холоїл))-GLР-1(7-39); Lys34(Ne-(холоїл))-GLP-1(7-39); Lys26,34-бi(Ne-(холоїл))-GLP-1(7-39); Gly8Lys26(Ne-(холоїл))-GLP-1(7-39); Gly8Lys34(Ne-(холоїл))-GLP-1(7-39); Gly8Lys26,34-бi(Ne-(холоїл))-GLP-1(7-39); Arg26Lys34(Ne-(холоїл))-GLP-1(7-39); GІу8Аrg26Lуs34(Ne-(7-дезоксихолоїл))-GLР-1(7-40); Lys26(Ne-(7-дезоксихолоїл))Arg34-GLP-1(7-40); GIу8Lуs26(Ne-(7-дезоксихолоїл))Arg34GLP-1(7-40); Аrg26,34Lуs36(Ne-(7-дезоксихолоїл))-GLP-1(7-40); Gly8Arg26,34Lys36(Ne-(7-дезоксихолоїл))-GLP-1(7-40); Lуs26(Ne-(холоїл))-GLР-1(7-40); Lys34(Ne-(холоїл))-GLP-1(7-40); Lуs26,34-бi(Ne-(холоїл))-GLР-1(7-40); GІу8Lуs26(Ne-(холоїл))-GLР-1(7-40); GІу8Lуs34(Ne-(холоїл))-GLР-1(7-40); GIy8Lys26,34-бi(Ne-(холоїл))-GLP-1(7-40); Аrg26Lуs34(Ne-(холоїл))-GLР-1(7-40); Lуs26(Ne-(холоїл))-GLР-1(7-36); Lуs34(Ne-(холоїл))-GLР-1(7-36); Lys26,34-бi(Ne-(холоїл))-GLP-1(7-36); GІу8Lуs26(Ne-(холоїл))-GLР-1(7-36); GІу8Lуs34(Ne-(холоїл))-GLР-1(7-36); Gly8Lys26,34-бI(Ne-(холоїл))-GLP-1(7-36); Аrg26Lуs34(Ne-(холоїл))-GLР-1(7-36); Lys26(Ne-(холоїл))-GLP-1(7-35); Lуs34(Ne-(холоїл))-GLР-1(7-35); Lys26,34-бi(Ne-(холоїл))-GLP-1(7-35); Gly8Lys26(Ne-холоїл))-GLP-1(7-35); Gly8Lys34(Ne-(холоїл))-GLP-1(7-35); GIy8Lys26,34бj(Ne-(холоїл))-GLP-1(7-35); Arg26Lys34(Ne-(холоїл))-GLP-1(7-35); Lys26(Ne-(холоїл))-GLP-1(7-36)aмiд; Lys34(Ne-(холоїл))-GLP-1(7-36)aмiд; Lys26,34-бi(Ne-(холоїл))-GLP-1(7-36)aмiд; GІу8Lys26(Ne-(холоїл))-GLР-1(7-36)амід; GІу8Lуs34(Ne-(холоїл))-GLР-1(7-36)амід; Gly8Lys26,34-бi(Ne-(холоїл))-GLP-1(7-36)aмiд; Аrg26Lys34(Ne-(холоїл))-GLP-1(7-36)aмiд; Gly8Arg26Lys34(Ne-(холоїл))-GLP-1(7-37); Lys26(Ne-(холоїл))Аrg34-GLР-1(7-37); Glу8Lуs26Ne-(холоїл))Аrg34-GLР-1(7-37); Arg26,34Lys36(Ne-(холоїл))-GLP-1(7-37); Gly8Arg26,34Lys36(Ne-(холоїл))-GLP-1(7-37); Lуs26(Ne-(літохолоїл))-GLP-1(7-37); Lys34(Ne-(літохолоїл))-GLР-1(7-37); Lys26,34-бі(Ne-літохолоїл))-GLР-1(7-37); GIу8Lys26(Ne-(літохолоїл))-GLР-1(7-37); GІу8Lуs34(Ne-(літохолоїл))-GLР-1(7-37); Gly8Lys26,34-бi(Ne-(літохолоїл))-GLP-1(7-37); Аrg26Lуs34(Ne-(літохолоїл))-GLР-1(7-37); GІу8Аrg26Lуs34-(холоїл))-GLР-1(7-38); Lуs26(Ne-(холоїл))Аrg34-GLР-1(7-38); Gly8Lys26(Ne-(холоїл))Arg34-GLP-1(7-38); Arg26,34Lys36(Ne-холоїл))-GLP-1(7-38); Arg26,34Lys38(Ne-(холоїл))-GLP-1(7-38); GIy8Arg26,34Lys36(Ne-(холоїл))-GLP-1(7-38); Lys26(Ne-(літохолоїл))-GLP-1(7-38); Lys34(Ne-(літохолоїл))-GLP-1(7-38); Lуs26,34-бі(Ne-(літохолоїл))-GLР-1(7-38); Gly8Lys26(Ne-(літохолоїл))-GLP-1(7-38); GІу8Lуs34(Ne-(літохолоїл))-GLР-1(7-38); GІу8Lуs26,34-бі(Ne-(літохолоїл))-GLР-1(7-38); Arg26Lys34(Ne-(літохолоїл))-GLP-1(7-38); GІу8Аrg26Lуs34(Ne-(холоїл))-GLР-1(7-39); Lуs26(Ne-(холоїл))Аrg34-GLР-1(7-39); Gly8Lys26(Ne-(холоїл))Arg34-GLP-1(7-39); Arg26,34Lys36(Ne-(холоїл))-GLP-1(7-39); СІу8Аrg26,34Lуs36(Ne-(холоїл))-GLР-1(7-39); Lуs26(Ne-(літохолоїл))-GLР-1(7-39); Lys34(Ne-(літохолоїл))-GLP-1(7-39); Lys26,34-бi(Ne-(лiтooxoлoїл))-GLP-1(7-39); GІу8Lуs26(Ne-(літохолоїл))-GLР-1(7-39); GІу8Lуs34(Ne-(літохолоїл))-GLР-1(7-39); Gly8Lys34-бi(Ne-(літохолоїл))-GLP-1(7-39); Аrg26Lуs34(Ne-(літохолоїл))-GLР-1(7-39); GІу8Аrg26Lуs34(Ne-(холоїл))-GLР-1(7-40); Lуs26(Ne-(холоїл))Аrg34-GLР-1(7-40); Gly8Lys26(Ne-(холоїл))Arg34-GLP-1(7-40); Arg26,34Lys36(Ne-(холоїл))-GLP-1(7-40); Gly8Arg26,34Lys36(Ne-(холоїл))-GLP-1(7-40); Lys26(Ne-(літохолоїл))-GLP-1(7-40); Lуs34(Ne-(літохолоїл))-GLР-1(7-40); Lуs26,34-бі(Ne-(літохолоїл))-GLР-1(7-40); Gly8Lys26(Ne-(літохолоїл))-GLP-1(7-40); Gly8Lys34(Ne-(літохолоїл))-GLP-1(7-40); Gly8Lys26,34-бі(Ne-(літохолоїл))-GlP-(7-40); Arg26Lys34(Ne-(літохолоїл))-GLР-1(7-37); Lуs26(Ne-(літохолоїл))-GLР-1(7-36); Lys34(Ne-(літохолоїл))-GLP-1(7-36); Lуs26,34-бі(Ne-(літохолоїл))-GLР-1(7-36); GIу8Lуs26(Ne-(літохолоїл))-GLР-1(7-36); GІу8Lуs34(Ne-(літохолоїл))-GLР-1(7-36); Gly8Lys26,34-бi(Ne-(літохолоїл))-GLP-1(7-36); Аrg26Lуs34(Ne-(літохолоїл))-GLР-1(7-36); Lуs26(Ne-(літохолоїл))-GLР-1(7-35); Lуs34(Ne-(літохолоїл))-GLР-1(7-35); Lуs26,34-бі(Ne-(літохолоїл))-GLР-1(7-35); GІу8Lуs26(Ne-(літохолоїл))-GLР-1(7-35); GІу8Lуs34(Ne-(літохолоїл))-GLР-1(7-35); GІу8Lуs26,34-бі(Ne-(літохолоїл))-GLP-1(7-35); Аrg26Lуs34(Ne-(літохолоїл))-GLР-1(7-35); Lуs26(Ne-(літохолоїл))-GLР-1(7-36)амід; Lуs34(Ne-(літохолоїл))-GLР-1(7-36)амід; Lуs26,34-бі(Ne-(літохолоїл))-GLР-1(7-36)амід; GІу8Lуs26(Ne-(літохолоїл))-GLР-1(7-36)амід; GІу8Lуs34(Ne-(літохолоїл))-GLР-1(7-36)амід; GІу8Lуs26,34-бі(Ne-(літохолоїл))-GLР-1(7-36)амід; Arg26Lys34(Ne-(літохолоїл))-GLP-1(7-36)aмiд; Gly8Arg26Lys34(Ne-(літохолоїл))-GLP-1(7-37); Lys26(Ne-(літохолоїл))Arg34GLP-1(7-37); GІу8Lуs26(Ne-(літохолоїл))Аrg34-GLР-1(7-37); Аrg26,34Lуs36(Ne-(літохолоїл))-GLР-1(7-37); Аrg26,34Lуs38(Ne-(літохолоїл))-GLР-1(7-37); Gly8Arg26,34Lys36(Ne-(літохолоїл))-GLP-1(7-37); GIy8Arg26,34Lys34(Ne-(літохолоїл))-GLP-1(7-38); Lуs26(Ne-(літохолоїл))Аrg34-GLР-1(7-38); GІу8Lуs26(Ne-(літохолоїл))Аrg34-GLР-1(7-38); Аrg26,34Lуs36(Ne-(літохолоїл))-GLР-1(7-38); Arg26,34Lуs38(Ne-(літохолоїл)-GLP-1(7-38); Gly8Arg26,34Lys36(Ne-(літохолоїл))-GLP-1(7-38); GІу8Аrg26Lуs34(Ne-(літохолоїл))-GLР-1(7-39); Lуs26(Ne-(літохолоїл))Аrg34-GLР-1(7-39); GІу8Lуs26(Ne-(літохолоїл))Аrg34-GLР-1(7-39); Arg26,34Lys36(Ne-(літохолоїл))-GLP-1(7-39); Gly8Arg26,34Lys36-(літохолоїл))-GLP-1(7-39); GІу8Аrg26Lуs34(Ne-(літохолоїл))-GLР-1(7-40); Lуs26(Ne-(літохолоїл))Аrg34-GLР-1(7-40); GІу8Lуs26(Ne-(літохолоїл))Аrg34-GLР-1(7-40); Аrg26,34Lуs36(Ne-(літохолоїл))-GLP-1(7_40); тa Gly8Arg26,34Lys36(Ne-(літохолоїл))-GLP-1(7-40). Ще в одному оптимальному варіанті даний винахід стосується фармацевтичної композиції, яка включає похідну GLP-1 та фармацевтично прийнятну зв'язуючу речовину або носій. Ще в одному оптимальному варіанті даний винахід стосується використання похідної GLP-1 згідно з винаходом для одержання композиції, яка має розтягнутий графік дії відносно GLP-1(7-37). Ще в одному оптимальному варіанті даний винахід стосується використання похідної GLP-1 згідно з винаходом для приготування композиції тривалої дії для лікування інсулін-незалежного цукрового діабету. Ще в одному оптимальному варіанті даний винахід стосується використання похідної GLP-1 згідно з винаходом для приготування композиції тривалої дії для лікування інсулін-залежного цукрового діабету. Ще в одному оптимальному варіанті даний винахід стосується використання похідної GLP-1 згідно з винаходом для приготування композиції тривалої дії для лікування ожиріння. Ще в одному оптимальному варіанті даний винахід стосується способу лікування інсулін-залежного або інсулін-незалежного цукрового діабету у пацієнта, який потребує такого лікування, що включає введення пацієнтові терапевтично прийнятної кількості похідної GLP-1 згідно з п.1 формули разом з фармацевтично прийнятним носієм. Для досягнення достатньо розтягнутого графіку дії похідної GLP-1 ліпофільний замісник, приєднаний до складової GLP-1, в оптимальному варіанті включає 4-40 атомів вуглецю, точніше, 8-25 атомів вуглецю. Ліпофільний замісник може приєднуватися до аміногрупи складової GLP-1 за допомогою карбоксильної групи ліпофільного замісника, що утворює амідний зв'язок з аміногрупою амінокислотного залишку, до якого вона приєднана. Або ж, ліпофільний замісник можна приєднувати до вищезгаданого амінокислотного залишку таким чином, що аміногрупа ліпофільного замісника утворює амідний зв'язок з карбоксильною групою амінокислотного залишку. Як ще один можливий варіант, ліпофільний замісник можна приєднувати до складової GLP-1 через естерний зв'язок. Згідно з технологією, естер може бути утворений або шляхом реакції між карбоксильною групою складової GLP-1 та гідроксильною групою потенційного замісника, або шляхом реакції між гідроксильною групою складової GLP-1 та карбоксильною групою потенційного замісника. У ще одному альтернативному варіанті ліпофільний замісник може бути алкільною групою, яку вводять у первісну аміногрупу складової GLP-1. В одному з оптимальних варіантів винаходу ліпофільний замісник приєднується до складової GLP-1 через спейсер таким чином, що карбоксильна група спейсера утворює амідний зв'язок з аміногрупою складової GLP-1. Прикладами підходящих спейсерів є бурштинова кислота, Lys, Glu або Asp, або дипептид, такий як Gly-Lys. Якщо спейсер є бурштиновою кислотою, одна її карбоксильна група може утворювати амідний зв'язок з аміногрупою амінокислотного залишку, а інша ЇЇ карбоксильна група може утворювати амідний зв'язок з аміногрупою ліпофільного замісника. Якщо спейсером є Lys, Glu або Asp, то його карбоксильна група може утворювати амідний зв'язок з аміногрупою амінокислотного залишку, а його аміногрупа може утворювати амідний зв'язок з карбоксильною групою ліпофільного замісника. Якщо Lys використовують як спейсер, то ще один спейсер може бути вставлений на певній відстані між e-аміногрупою Lys та ліпофільним замісником. В одному оптимальному варіанті цим ще одним спейсером є бурштинова кислота, яка утворює амідний зв'язок з e-аміногрупою Lys та з аміногрупою, присутньою у ліпофільному заміснику. В іншому оптимальному варіанті цим ще одним спейсером є Glu або Asp, який утворює амідний зв'язок з e-аміногрупою Lys, а інший амідний зв'язок - з карбоксильною групою, присутньою у ліпофільному заміснику, тобто ліпофільний замісник є Ne-ацильованим лізиновим залишком. В іще одному оптимальному варіанті даного винаходу ліпофільний замісник має групу, яка може бути негативно зарядженою. Однією з негативно заряджених груп, яким віддають перевагу, є група карбонової кислоти. Вихідний пептид може бути одержаний способом, який включає культивавання клітини-хазяїна, яка містить ДНК-послідовність, яка кодує поліпептид і здатна на експресію поліпептиду у підходящому живильному середовищі за умов, що дозволяють здійснювати експресію пептиду, після якої отриманий в результаті пептид виділяють з культури. Середовищем, використовуваним для культивування клітин, може бути будь-яке традиційне середовище, придатне для вирощування клітин-хазяїв, таке, як мінімальні або комплексні середовища, які містять відповідні додатки. Підходящі середовища можна придбати через торговельну мережу або приготувати згідно з опублікованими рецептами (наприклад, у каталогах Американського зібрання типових культур). Пептид, утворений клітинами, після цього може бути виділений з культурального середовища традиційними способами, включаючи відокремлення клітин-хазяїв від середовища шляхом центрифугування або фільтрування, осадження білкових компонентів супернатанту або фільтрату за допомогою солі, наприклад, сульфату амонію, очищення за допомогою різних хроматографій, наприклад, іонообмінної хроматографії, гель-фільтраційної хроматографії, афінної хроматографії і т. п., залежно від типу конкретного пептиду. ДНК-послідовність, яка кодує вихідний пептид, може походити від геномної ДНК або кДНК, наприклад, отриманої шляхом приготування бібліотеки геномної ДНК або кДНК та відбору ДНК-послідовностей, які кодують увесь або частину пептиду шляхом гібридизації з використанням синтетичних олігонуклеотидних проб згідно з традиційними технологіями (див., наприклад, Sambrook, J, Fritsch, EF and Maniatis, Τ, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, 1989). ДНК-послідовність, яка кодує пептид, може також бути одержана синтетично загальноприйнятими способами, наприклад, фосфоамідитним способом, описаним у роботі Beaucage and Caruthers, Tetpahedron Letters 22 (1981), 18591869, або способом, описаним у роботі Matthes et al., EMBO Journal 3 (1984), 801-805. ДНК-послідовність також може бути одержана шляхом полімеразної ланцюгової реакції з використанням специфічних праймерів, наприклад, як описано у US 4,683,202 або у роботі Saiki et al., Science 239 (1988), 487-491. ДНК-послідовність може бути вставлена у будь-який вектор, який може бути підданий дії підходящої рекомбінантної ДНК, і вибір вектора часто залежить від клітини-хазяїна, у який його мають вводити. Таким чином, цим вектором може бути вектор автономної реплікації, тобто вектор, який існує як позахромосомне утворення, реплікація якого залежить від реплікації хромосом, наприклад, плазміда. Або ж, вектор може бути вектором, який, після введення у клітину-хазяїн, вводиться у геном клітини-хазяїна й реплікується разом з хромосомою(ами), у яку(які) його було введено. Вектором в оптимальному варіанті є вектор експресії, у якому ДНК-послідовність, яка кодує пептид, є функціонально з'єднаною з додатковими сегментами, необхідними для транскрипції ДНК, наприклад, промотором. Промотором може бути будь-яка ДНК-послідовність, яка виявляє транскрипційну активність у вибраній клітині-хазяїні і може походити від генів, що кодують протеїни, гомологічні або гетерологічні для клітини-хазяїна. Приклади підходящих промоторів для спрямування транскрипції ДНК, що кодує пептид даного винаходу у різних клітинах-хазяях, добре відомі спеціалістам (пор., наприклад, з вищезгаданою роботою Sambrook et al.). ДНК-послідовність, яка кодує пептид, може також у разі необхідності бути функціонально з'єднана з відповідним термінатором, сигналами поліаденілювання, послідовностями - енхансерами транскрипції та енхансерами трансляції. Рекомбінантний вектор даного винаходу може також включати ДНК-послідовність, яка робить можливою реплікацію вектору у конкретній клітині-хазяїні. Вектор також може включати селектабельний маркер, наприклад, ген, продукт якого доповнює нестачу у клітині-хазяїні, або такий, що забезпечує резистентність до ліків, таких як, наприклад, ампіцилін, канаміцин, тетрациклін, хлорамфенікол, неоміцин, гідроміцин або метотрексат. Для спрямування вихідного пептиду даного винаходу на секреторний шлях клітин-хазяїв у рекомбінантному векторі може бути передбачена секреторна сигнальна послідовність (відома також як лідерна послідовність, препро-послідовність або пре-послідовність). Секреторна сигнальна послідовність приєднана до ДНК-послідовності, яка кодує пептид у належній рамці зчитування. Секреторні сигнальні послідовності, як правило, розташовують у позиції 5' ДНК-послідовності, що кодує пептид. Секреторною сигнальною послідовністю може бути послідовність, з'єднана за нормальних умов з пептидом, або може бути частиною гену, який кодує інший секретований протеїн. Процедури, застосовані для лігування ДНК-послідовностей, які відповідно кодують даний пептид, промотор та, необов'язково, термінатор та/або секреторну сигнальну послідовність, а також для введення їх у відповідні вектори, що містять інформацію, необхідну для реплікації, добре відомі спеціалістам (пор., наприклад, з вищезгаданою роботою Sambrook et al.). Клітиною-хазяїном, у яку вводять ДНК-послідовність або рекомбінантний вектор, може бути будь-яка клітина, здатна виробляти даний пептид, i включає бактерії, дріжджі, грибки та вищі еукаріотні клітини. Прикладами відповідних клітин-хазяїв, добре відомих спеціалістам і використовуваних ними, є, крім інших, Е. соlі, Saccharomyces cerevisiae, або лінії клітин ссавців ВНК (нирок новонародженого хом'яка) або СНО (яєчників китайського хом'яка). Приклади сполук, які можуть використовуватися як складові GLP-1 згідно з даним винаходом, описані у Міжнародній патентній заявці № WO 87/06941 (The General Hospital Corporation), яка стосується фрагмента пептиду, який включає GLP-1(7-37) та його функціональні похідні, а також його використання як інсулінотропного агенту. Інші аналоги GLP-1 описані у Міжнародній патентній заявці №90/11296 (The General Hospital Corporation), яка стосується фрагментів пептидів, які включають GLP-1(7-36) та його функціональні похідні й мають інсулінотропну активність, яка є більшою за інсулінотропну активність GLP-1(1-36) або GLP-1(1-37), а також їхнього використання як інсулінотропних агентів. У Міжнародній патентній заявці №91/11457 (Bucktey et al.) описані аналоги активних GLP-1-пептидів 734, 7-35, 7-36 та 7-37, які також можуть використовуватися як складові GLP-1 згідно з даним винаходом. Фармацевтичні композиції Фармацевтичні композиції, які містять похідну GLP-1 згідно даним винаходом, можуть парентерально вводитися пацієнтам, які потребують такого лікування. Парентеральне введення може здійснюватися шляхом підшкірних, внутрішньом'язових або внутрішньовенних ін'єкцій за допомогою шприца, наприклад, ручкоподібного шприца. Або ж, парентеральне введення можна здійснювати за допомогою інфузійного насосу. Як інший можливий варіант, можна використовувати композицію, яка може бути порошком або рідиною для введення похідної GLP-1 у формі аерозольного розчину для назального або пульмонального введення. Як ще один можливий варіант, похідні GLP-1 даного винаходу також можна вводити крізьшкірно, скажімо, через пластир, наприклад, іонофоретичний, або крізь слизову оболонку, наприклад, трансбукально. Фармацевтичні композиції, які містять похідну GLP-1 даного винаходу, одержують за традиційними технологіями, наприклад, так, як описано у роботах Remington's Pharmaceutical Sciences, 1985 або Remington: The Science and Practice of Pharmacy, 19th edition, 1995. Таким чином, ін'єкційні композиції похідної GLP-1 даного винаходу одержують, застосовуючи традиційну для фармацевтичної промисловості технологію, яка включає розчинення та змішування інгредієнтів, необхідних для одержання потрібного кінцевого продукту. Згідно з однією процедурою, похідну GLP-1 розчиняють у кількості води, яка є дещо меншою за кінцевий об'єм готової композиції. Додають необхідні ізотонічний агент, консервант та буфер, і у разі необхідності коректують рівень рН розчину, використовуючи кислоту, наприклад, соляну кислоту, або основу, наприклад, водний розчин гідроксиду натрію, якщо потрібно. Нарешті, об'єм розчину доводять додаванням води до необхідної концентрації інгредієнтів. Прикладами ізотонічних агентів є хлорид натрію, маніт та гліцерин. Прикладами консервантів є фенол, m-крезол, метил р-гідроксибензоат та бензиловий спирт. Прикладами підходящих буферів є ацетат натрію та фосфат натрію. Крім вищезгаданих компонентів, розчини, що містять похідну GLP-1 згідно з даним винаходом, можуть також містити поверхнево-активну речовину для поліпшення розчинності та/або стабільності похідної GLP1. Композицію для назального введення певних пептидів одержують, наприклад, як описано у Європейському Патенті №272097 (виданому Novo Nordisk A/S) або у WO 93/18785. Згідно з одним з оптимальних варіантів даного винаходу, похідну GLP-1 пропонують у формі композиції, придатної для введення шляхом ін'єкції. Така композиція може бути або готовим до використання ін'єкційним розчином, або може бути певною кількістю твердої композиції, наприклад, ліофілізованого продукту, який перед ін'єкцією має бути розчиненим у розчиннику. Ін'єкційний розчин в оптимальному варіанті містить не менше приблизно 2мг/мл, краще - не менше приблизно 5мг/мл, ще краще - не менше приблизно 10мг/мл похідної GLP-1 і бажано - не більше приблизно 100мг/мл похідної GLP-1. Похідні GLP-1 даного винаходу можуть бути використані для лікуванні різних захворювань. Конкретна похідна GLP-1 та оптимальна доза для кожного пацієнта залежить від хвороби, від якої його лікують, та від різних чинників, включаючи ефективність конкретної застосовуваної похідної пептиду, віку, маси тіла, фізичної активності та режиму харчування пацієнта, від можливого поєднання з іншими медикаментами, а також від ступеня тяжкості хвороби. Дозу похідної GLP-1 даного винаходу для кожного окремого пацієнта мають визначати спеціалісти. Зокрема, передбачається, що похідну GLP-1 використовуватимуть для одержання медикаменту з розтягнутим графіком дії для лікування інсулінонезалежного цукрового діабету та/або для лікування ожиріння. Даний винахід далі ілюструється нижчеподаними прикладами, які, однак, не повинні розглядатися як такі, що ними обмежується обсяг заявки. Особливості, описані у попередньому описі та у наведених далі прикладах, можуть як поодинці, так і у будь-якій комбінації, бути матеріалом для реалізації винаходу у різних його формах. Приклади Для хімікатів, які реалізуються через торговельну мережу, використовують такі скорочення: DMF: Ν,Ν-Диметилформамід. NMP: N-Метил-2-піролідон. EDPA: N-Етил-N,N-диізопропіламін. EGTA: Етиленгліколь-бі(b-аміноетиловий ефір)-N,N,N'N'-тетраоцтова кислота. GTP: Гуанозин-5'-трифосфат. TFA: Трифтороцтова кислота. THF: Тетрагідрофуран. Myr-ONSu: 2,5-діоксопіролідин-1-іловий естер тетрадеканової кислоти. Pal-ONSu: 2,5-діоксопіролідин-1-іловий естер гексадеканової кислоти. Ste-ONSu: 2,5-діоксопіролідин-1-іловий естер октадеканової кислоти. HOOC-(CH2)6-COONSu: 2,5-діоксопіролідин-1-іловий естер w-карбоксигептанової кислоти. HOOC-(CH2)10-COONSu: 2,5-діоксопіролідин-1-іловий естер w-карбоксиундеканової кислоти. HOOC-(CH2)12-COONSu: 2,5-діоксопіролідин-1-іловий естер w-карбокситридеканової кислоти. HOOC-(CH2)14-COONSu: 2,5-діоксопіролідин-1-іловий естер w-карбоксипентадеканової кислоти. HOOC-(CH2)16-COONSu: 2,5-діоксопіролідин-1-іловий естер w-карбоксигептадеканової кислоти. HOOC-(CH2)18-COONSu: 2,5-діоксопіролідин-1-іловий естер w-карбоксинонадеканової кислоти. Абревіатури: PDMS: Mac-спектрометрія з десорбцією плазми MALDI-MS: Лазерна десорбція за допомогою матриць/іонізаційна мас-спектрометрія HPLC: Рідинна хроматографія з високою роздільною здатністю а.о.м.: атомна одиниця маси Аналітична мас-спектрометрія з десорбцією плазми Одаржаиня зразків: Зразок розчиняють у 0,1% TFA/EtOH (1:1) при концентрації 1мкг/мкл. Розчин зразка (5-10мкл) наносять на нітроцелюлозну мішень (Bio-ion АВ, Упсала, Швеція) і залишають для абсорбування поверхнею мішені на 2 хвилини. Мішень після цього промивають 2х25мкл 0,1% TFA і сушать у відцентровій сушарці. Насамкінець нітроцелюлозну мішень розміщують у каруселі, яку вставляють у мас-спектрометр. Mac-спектрометричний аналіз: PDMS-аналіз здійснюють з використанням апарату часу прольоту Віо-іоn 20 (Bio-ion Nordic AB, Упсала, Швеція). Подають напругу прискорення 15кВ, і молекулярні іони, утворені у процесі бомбардування поверхні нітроцелюлози уламками ділення Cf252, прискорюються у напрямку стоп-детектора. Одержаний спектр часу прольоту калібрують з дійсним мас-спектром, використовуючи іони Н+ та NO+ при м/з (відношенні маси до заряду) 1 та 30 відповідно. Мас-спектри, як правило, акумулюють для 1,0[106 актів ділення, що відповідає 15-20хв. Усі визначені в результаті маси відповідають середнім ізотопним молекулярним масам. Похибка визначення, як правило, становить менше за 0,1%. MALDI-мас-спектрометрія MALDI-TOF мас-спектрометричний аналіз здійснюють, використовуючи апарат Voyager RP (PerSeptive Biosystems inc., Фремінгам, Масачусетс) з затриманою екстракцією, який працює у лінійному режимі. Як матрицю використовують альфа-ціано-4-гідрокси-коричну кислоту, і визначення маси базується на зовнішньому калібруванні. Приклад 1 Синтез Lys26(Ne-тетрадекандіолу)-GLP-1(7-37). Зазначену сполуку синтезують з GLP-1(7-37). Суміш GLP-1(7-37) (25мг, 7,45мкм), EDPA (26,7мг, 208мкм), NMP (520мкл) та води (260мкл) обережно перемішують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин Myr-ONSu (2,5мг, 7,67мкм) в NMP (62,5мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають на 20хв. Додають додаткову кількість Myr-ONSu (2,5мг, 7,67мкм) у NMP (62,5мкл) і отриману в результаті суміш обережно збовтують протягом 5хв. По закінченні повного часу реакції - 40хв. - реакцію припиняють додаванням розчину гліцину (12,5мг, 166мкмоль) у 50% водному розчині етанолу (12,5мл). Зазначену сполуку виділяють з реакційної суміші за допомогою HPLC з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFА, вихід: 1,3мг (що відповідає 4,9% від теоретично розрахованого виходу). Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділений продукт аналізують за допомогою PDMS і виявлене відношення маса/заряд для протонованого молекулярного іона становить 3567,9±3. Таким чином, остаточна молекулярна маса становить 3566,9±3 а.о.м. (теоретичне значення: 3565,9а.о.м.). Позицію ацилювання (Lys26) уточнюють шляхом ферментативного розщеплення зазначеної сполуки за допомогою V8 протеази Staphylococcus aureus та наступного визначення маси фрагментів пептиду шляхом PDMS. Крім зазначеної сполуки, з реакційної суміші були ізольовані дві інші похідні GLP-1 з використанням такої самої хроматографічної колонки та зменшеного градієнту (35-38% ацетонітрилу за 60 хвилин), див. Приклади 2 та 3. Приклад 2 Синтез Lys34(Ne-тетрадеканоїл)-GLP-1(7-37). Зазначену сполуку виділяють за допомогою HPLC з реакційної суміші, описаної у Прикладі 1. PDMS аналіз дає протонований молекулярний іон з відношенням маса/заряд 3567,7±3. Таким чином, виявляють молекулярну масу, яка становить 3566,7±3а.о.м. (теоретичне значення: 3565,9а.о.м.). Сайт ацилювання визначають на основі моделі фрагментації. Приклад 3 Синтез Lys26,34-бі(Ne-тетрадеканоїл)-GLP-1(7-37). Зазначену сполуку виділяють за допомогою HPLC з реакційної суміші, описаної у Прикладі 1. PDMS аналіз дає протонований молекулярний іон з відношенням маса/заряд 3778,4±3. Таким чином, виявляють молекулярну масу, яка становить 3777,4±3а.о.м. (теоретичне значення: 3776,1а.о.м.). Приклад 4 Синтез Lys26(Ne-тетрадеканоїл)Arg34-GLP-1(7-37). Зазначену сполуку синтезують з Arg34-GLP-1(7-37). Суміш Arg34-GLP-1(7-37) (5мг, 1,47мкм), EDPA (5,3мг, 41,1мкм), NMP (105мкл) та води (50мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин Myr-ONSu (0,71мг, 2,2мкм) у NMP (17,8мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають на 20хв. По закінченні повного часу реакції - 30хв. - реакцію припиняють додаванням розчину гліцину (25мг, 33,3мкм) у 50% водному розчині етанолу (2,5мл). Реакційну суміш очищають шляхом HPLC, як описано у Прикладі 1. PDMS аналіз дає протонований молекулярний іон з відношенням маса/заряд 3594,9±3. Таким чином, виявляють молекулярну масу, яка становить 3593,9+3а.о.м. (теоретичне значення: 3593,9а.о.м.). Приклад 5 Синтез Gly8Arg26,34Lys36(Ne-тетрадеканоїл)-GLP-1(7-37). Зазначену сполуку синтезують з Gly8Arg26,34Lys36-GLP-1(7-37) від фірми QCB. Суміш Gly8Arg26,34Lys36GLP-1(7-37) (1,3мг, 0,39мкм), EDPA (1,3мг, 10мкм), NMP (125мкл) та води (30мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин Myr-ONSu (0,14мг, 0,44мкм) у NMP (3,6мл), реакційну суміш обережно збовтують протягом 15хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (0,1мг, 1,33мкм) у 50% водному розчині етанолу (10мкл). Реакційну суміш очищають шляхом HPLC і виділяють зазначену сполуку (60мкг, 4%). Приклад 6 Синтез Arg26,34Lys36(Ne-тетрадеканоїл)-GLP-1(7-37)-ОН. Суміш Arg26,34Lys36-GLP-1(7-37)-OH (5,0мг, 1,477мкмоль), EDPA (5,4мг, 41,78мкмоль), NMP (105мкл) та води (50мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин Myr-ONSu (0,721мг, 2,215мкмоль) у NMP (18мкл). Реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають стояти ще 45хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,5мг, 33,3мкмоль) у 50% водному розчині етанолу (250мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (1,49мг, 28%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3595±3. Таким чином, молекулярна маса в результаті становить 3594±3а.о.м. (теоретичне значення 3594а.о.м.). Приклад 7 Синтез Lys26,34бі(Ne-(w-карбоксинонадеканоїл)-GLP-1(7-37)-ОН. Суміш GLP-1(7-37)-OH (70мг, 20,85мкмоль), EDPA (75,71мг, 585,8мкмоль), NMP (1,47мл) та води (700мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин НООС-(CH2)18-COONSu (27,44мг, 62,42мкмоль) у NMP (686мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 50хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (34,43мг, 458,7мкмоль) у 50% водному розчині етанолу (3,44мл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (8,6мг, 10%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 4006±3. Таким чином, молекулярна маса в результаті становить 4005±3а.о.м. (теоретичне значення 4005а.о.м.). Приклад 8 Синтез Arg26,34Lys36(Ne-(w-карбоксинонадеканоїл)-GLP-1(7-36)-ОН. Суміш Arg26,34Lys36-GLP-1(7-36)-OH (5,06мг, 1,52мкмоль), EDPA (5,5мг, 42,58мкмоль), NMP (106мкл) та води (100мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин HOOC-(CH2)18-COONSu (1,33мг, 3,04мкмоль) у NMP (33,2мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 2год. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,50мг, 33,34мкмоль) у 50% водному розчині етанолу (250мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,46мг, 8%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3652±3. Таким чином, остаточна молекулярна маса становить 3651±3а.о.м. (теоретичне значення 3651а.о.м.). Приклад 9 Синтез Arg26,34Lys38(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-38)-OH. Суміш Arg2634Lys38-GLP-1(7-38)-OH (5,556мг, 1,57мкмоль), EDPA (5,68мг, 43,96мкмоль), NMP (116,6мкл) та води (50мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин HOOC-(CH2)18-COONSu (1,38мг, 3,14мкмоль) у NMP (34,5мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 2,5год. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,5мг, 33,3мкмоль) у 50% водному розчині етанолу (250мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,7мг, 12%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3866±3. Таким чином, остаточна молекулярна маса становить 3865±3а.о.м. (теоретичне значення 3865а.о.м.). Приклад 10 Синтез Arg34Lys26(Ne-(w-карбоксинонадеканоїл))-GLP-1(7-37)-OH. Суміш Arg34GLP-1(7-37)-OH (5,04мг, 1,489мкмоль), EDPA (5,39мг, 41,70мкмоль), NMP (105мкл) та води (50мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин HOOC-(CH2)18-COONSu (1,31мг, 2,97мкмоль) у NMP (32,8мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають стояти ще 30хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,46мг, 32,75мкмоль) у 50% водному розчині етанолу (246мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (1,2мг, 22%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3709±3. Таким чином, остаточна молекулярна маса становить 3708±3а.о.м. (теоретичне значення 3708а.о.м.). Приклад 11 Синтез Arg34Lys26(Ne-(w-карбоксигептадеканоїл))-GLP-1(7-37)-OH. Суміш Arg34-GLP-1(7-37)-OH (5,8мг, 1,714мкмоль), EDPA (6,20мг, 47,99мкмоль), NMP (121,8мкл) та води (58мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин HOOC-(CH2)18-COONSu (2,11мг, 5,142мкмоль) у NMP (52,8мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 2год. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,83мг, 37,70мкмоль) у 50% водному розчині етанолу (283мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,81мг, 13%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3681±3. Таким чином, молекулярна маса в результаті становить 3680±3а.о.м. (теоретичне значення 3680а.о.м.). Приклад 12 Синтез Arg26,34Lys36(Ne-(w-карбоксигептадеканоїл))-GLP-1(7-37)-OH. Суміш Arg26,34Lys36-GLP-1(7-37)-OH (3,51мг, 1,036мкмоль), EDPA (3,75мг 29,03мкмоль), NMP (73,8мкл) та води (35мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин HOOC-(CH2)16-COONSu (1,27мг, 3,10мкмоль) у NMP (31,8мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 2год. 10хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (1,71мг, 22,79мкмоль) у 50% водному розчині етанолу (171мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,8мг, 21%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3682±3. Таким чином, остаточна молекулярна маса становить 3681±3а.о.м. (теоретичне значення 3681а.о.м.). Приклад 13 Синтез Arg26,34Lys38(Ne-(w-карбоксигептадеканоїл))-GLP-1(7-38)-OH. Суміш Arg26,34Lys38-GLP-1(7-38)-OH (5,168мг, 1,459мкмоль), EDPA (5,28мг, 40,85мкмоль), NMP (108,6мкл) та води (51,8мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин HOOC-(CH2)16-COONSu (1,80мг, 4,37мкмоль) у NMP (45мкл), реакційну суміш обережно збовтують протягом 10хв. при кімнатній температурі, а потім залишають ще на 2год. 15хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,41мг, 32,09мкмоль) у 50% водному розчині етанолу (241мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,8мг, 14%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3838±3. Таким чином, остаточна молекулярна маса становить 3837±3а.о.м. (теоретичне значення 3837а.о.м.). Приклад 14 Синтез Arg26,34Lys36(Ne-карбоксигептадеканоїл)-GLP-1(7-36)-OH. Суміш Arg26,34Lys36-GLP-1(7-36)-OH (24,44мг, 7,34мкмоль), EDPA (26,56мг, 205,52мкмоль), NMP (513мкл) та води (244,4мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин HOOC-(CH2)16-COONSu (9,06мг, 22,02мкмоль) у NMP (1,21мл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 30хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (12,12мг, 161,48мкмоль) у 50% водному розчині етанолу (1,21мл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (7,5мг, 28%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3625±3. Таким чином, остаточна молекулярна маса становить 3624±3а.о.м. (теоретичне значення 3624а.о.м.). Приклад 15 Синтез Arg26,34Lys36(Ne-(w-карбоксиундеканоїл))-GLP-1(7-37)-OH. Суміш Arg26,34Lys36-GLP-1(7-37)-OH (4,2мг, 1,24мкмоль), EDPA (4,49мг, 34,72мкмоль), NMP (88,2мкл) та води (42мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин HOOC-(CH2)10-COONSu (1,21мг, 3,72мкмоль) у NMP (30,25мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 40хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,04мг, 27,28мкмоль) у 50% водному розчині етанолу (204мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,8мг, 18%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3598±3. Таким чином, остаточна молекулярна маса становить 3597±3а.о.м. (теоретичне значення 3597а.о.м.). Приклад 16 Синтез Arg26,34Lys38(Ne-(w-карбоксиундеканоїл))-GLP-1(7-38)-OH. Суміш Arg26,34Lys38-GLP-1(7-38)-OH (5,168мг, 1,46мкмоль), EDPA (5,28мг, 40,88мкмоль), NMP (108,6мкл) та води (51,7мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин HOOC-(CH2)10-COONSu (1,43мг, 4,38мкмоль) у NMP (35,8мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 50хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,41мг, 32,12мкмоль) у 50% водному розчині етанолу (241мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,85мг, 16%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3753±3. Таким чином, остаточна молекулярна маса становить 3752±3а.о.м. (теоретичне значення 3752а.о.м.). Приклад 17 Синтез Lys26,34бі(Ne-(w-карбоксиундеканоїл))-GLP-1(7-37)-OH. Суміш GLP-1(7-37)-OH (10,0мг, 2,98мкмоль), EDPA (10,8мг, 83,43мкмоль), NMP (210мкл) та води (100мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин НООС-(CH2)10-COONSu (2,92мг, 8,94мкмоль) у NMP (73мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 50хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (4,92мг, 65,56мкмоль) у 50% водному розчині етанолу (492мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/ТFА система. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (1,0мг, 9%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3781±3. Таким чином, остаточна молекулярна маса становить 3780±3а.о.м. (теоретичне значення 3780а.о.м.). Приклад 18 Синтез Arg26,34Lys36бі(Ne-(w-карбоксиундеканоїл))-GLP-1(7-36)-OH. Суміш Arg26,34Lys36-GLP-1(7-36)-OH (15,04мг, 4,52мкмоль), EDPA (16,35мг, 126,56мкмоль), NMP (315,8мкл) та води (150,4мкл) обережно збовтують протягом 10 хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин HOOC-(CH2)10-COONSu (4,44мг, 13,56мкмоль) у NMP (111мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 40хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (7,5мг, 99,44мкмоль) у 50% водному розчині етанолу (750мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (3,45мг, 22%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3540±3. Таким чином, остаточна молекулярна маса становить 3539±3а.о.м. (теоретичне значення 3539а.о.м.). Приклад 19 Синтез Arg34Lys26(Ne-(w-карбоксиундеканоїл))-GLP-1(7-37)-OH. Суміш Arg43-GLP-1(7-37)-OH (5,87мг, 1,73мкмоль), EDPA (6,27мг, 48,57мкмоль), NMP (123,3мкл) та води (58,7мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До отриманої 8 результаті суміші додають розчин HOOC-(CH2)10-COONSu (1,70мг, 5,20мкмоль) у NMP (42,5мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 40хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,86мг, 286мкмоль) у 50% водному розчині етанолу (286мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (1,27мг, 20%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3597±3. Таким чином, остаточна молекулярна маса становить 3596±3а.о.м. (теоретичне значення 3596а.о.м.). Приклад 20 Синтез Arg34Lys26(Ne-(w-карбоксигептаноїл))-GLP-1(7-37)-OH. Суміш Arg34-GLP-1(7-37)-OH (4,472мг, 1,32мкмоль), EDPA (4,78мг, 36,96мкмоль), NMP (94мкл) та води (44,8мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин HOOC-(CH2)6-COONSu (1,07мг, 3,96мкмоль) у NMP (26,8мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 1год. 50хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,18мг, 29,04мкмоль) у 50% водному розчині етанолу (218мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,5мг, 11%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3540±3. Таким чином, остаточна молекулярна маса становить 3539±3а.о.м. (теоретичне значення 3539а.о.м.). Приклад 21 Синтез Arg26,34Lys38(Ne-(w-карбоксигептаноїл))-GLP-1(7-38)-OH. Суміш Arg26,34Lys38-GLP-1(7-38)-OH (5,168мг, 1,459мкмоль), EDPA (5,28мг, 40,65мкмоль), NMP (108,6мкл) та води (51,6мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин HOOC-(CH2)6-COONSu (1,18мг, 4,37мкмоль) у NMP (29,5мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 1год. 50хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,40мг, 32,09мкмоль) у 50% водному розчині етанолу (240мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,5мг, 9%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3697±3. Таким чином, остаточна молекулярна маса становить 3695±3а.о.м. (теоретичне значення 3695а.о.м.). Приклад 22 Синтез Arg26,34Lys36(Ne-(w-карбоксигептаноїл))-GLP-1(7-37)-OH. Суміш Arg26,34Lys36-GLP-1(7-37)-OH (5,00мг, 1,47мкмоль), EDPA (5,32мг, 41,16мкмоль), NMP (105мкл) та води (50мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин HOOC-(CH2)6-COONSu (1,19мг, 4,41мкмоль) у NMP (29,8мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 2год. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,42мг, 32,34мкмоль) у 50% водному розчині етанолу (242мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,78мг, 15%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3542±3. Таким чином, остаточна молекулярна маса становить 3541±3а.о.м. (теоретичне значення 3541а.о.м.). Приклад 23 Синтез Arg26,34Lys36(Ne-(w-карбоксигептаноїл))-GLP-1(7-36)-OH. Суміш Arg26,34Lys36-GLP-1(7-36)-OH (5,00мг, 1,50мкмоль), EDPA (5,44мг, 42,08мкмоль), NMP (210мкл) та води (50мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин HOOC-(CH2)6-COONSu (1,22мг, 4,5мкмоль) у NMP (30,5мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 2год. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,47мг, 33,0мкмоль) у 50% водному розчині етанолу (247мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,71мг, 14%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3484±3. Таким чином, остаточна молекулярна маса становить 3483±3а.о.м. (теоретичне значення 3483а.о.м.). Приклад 24 Синтез Lys26,34бі(Ne-(w-карбоксигептаноїл))-GLP-1(7-37)-OH. Суміш GLP-1(7-37)-OH (10мг, 2,5мкмоль), EDPA (10,8мг, 83,56мкмоль), NMP (210мкл) та води (100мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин НООС-(СН2)6-COONSu (2,42мг, 8,92мкмоль) у NMP (60,5мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають стояти ще 2год. 35хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (4,92мг, 65,54мкмоль) у 50% водному розчині етанолу (492мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрилДРА. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (2,16мг, 24%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3669±3. Таким чином, остаточна молекулярна маса становить 3668±3а.о.м. (теоретичне значення 3668а.о.м.). Приклад 25 Синтез Arg34Lys26(Ne-(w-карбоксигептаноїл))-GLP-1(7-37)-OH. Суміш Arg34-GLP-1(7-37)-OH (4,472мг, 1,321мкмоль), EDPA (4,78мг, 36,99мкмоль), NMP (93,9мкл) та води (44,7мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин HOOC-(CH2)14-C0ONSu (1,519мг, 3,963мкмоль) у NMP (38мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 1год. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,18мг, 29,06мкмоль) у 50% водному розчині етанолу (218мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,58мг, 12%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3654±3. Таким чином, остаточна молекулярна маса становить 3653±3а.о.м. (теоретичне значення 3653а.о.м.). Приклад 26 Синтез Arg26,34Lys36(Ne-(w-карбоксигептаноїл))-GLP-1(7-36)-OH. Суміш Arg26,34Lys36-GLP-1(7-36)-OH (5,00мг, 1,50мкмоль), EDPA (5,44мг, 42,08мкмоль), NMP (210мкл) та води (50мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин HOOC-(CH2)14-COONSu (1,72мг, 4,5мкмоль) у NMP (43мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 1год. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,48мг, 33мкмоль) у 50% водному розчині етанолу (248мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,58мг, 11%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3596±3. Таким чином, остаточна молекулярна маса становить 3595±3а.о.м. (теоретичне значення 3595а.о.м.). Приклад 27 Синтез 2,5-діоксо-піролідин-1-ілового естеру літохолевої кислоти. До суміші літохолевої кислоти (5,44г, 14,34мкмоль), N-гідроксисукциніміду (1,78г, 15,0ммоль), безводного THF (120мл) та безводного ацетонітрилу (30мл), яку тримають при температурі до 10°С, додають розчин of Ν,Ν'-дициклогексилкарбодііміду (3,44г, 16,67мкмоль) у безводному THF. Реакційну суміш перемішують при температурі навколишнього середовища протягом 16год., фільтрують і концентрують in vacuo. Залишок розчиняють у дихлорметані (450мл), промивають 10% водним розчином Na2CO3 (2x150мл) та водою (2x150мл) і сушать (MgSO4). Потім фільтрують і фільтрат концентрують in vacuo для одержання кристалічного залишку. Залишок рекристалізують з суміші дихлорметану (30мл) та н-гептану (30мл) для одержання зазначеної сполуки (3,46г, 51%) у вигляді кристалічної твердої речовини. Приклад 28 Синтез Arg34Lys26(Ne-(w-літохоліл))-GLP-1(7-37)-OH. Суміш Arg34-GLP-1(7-37)-OH (4,472мг, 1,32мкмоль), EDPA (4,78мг, 36,96мкмоль), NMP (94мкл) та води (44,8мкл) обережно збовтують протягом 10хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин 2,5-діоксо-піролідин-1-ілового естеру літохолевої кислоти (1,87мг, 3,96мкмоль) у NMP (46,8мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 1год. при кімнатній температурі. Реакцію припиняють .додаванням розчину гліцину (2,18мг, 29,04мкмоль) у 50% водному розчині етанолу (218мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (1,25мг, 25%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3744±3. Таким чином, остаточна молекулярна маса становить 3743±3а.о.м. (теоретичне значення 3743а.о.м.). Приклад 29 Синтез Na-тетрадеканоїл-Clu(ONSu)-OBut. До суспензії H-Glu(OH)-OBut (2,5г, 12,3ммоль), DMF (283мл) та EDPA (1,58г, 12,3ммоль) по краплях додають розчин Myr-ONSu (4,0г, 12,3ммоль) у DMF (59мл). Реакційну суміш перемішують протягом 16год. при кімнатній температурі, а потім концентрують in vacuo до загального об'єму 20мл. Залишок розподіляють між 5% водним розчином лимонної кислоти (250мл) та етилацетатом (150мл) і фази відокремлюють. Органічну фазу концентрують in vacuo і залишок розчиняють у DMF (40мл). Одержаний в результаті розчин по краплях додають до 10% водного розчину лимонної кислоти (300мл), яку тримають при 0°С. Осаджену сполуку збирають і промивають крижаною водою й сушать у вакуумній сушильній печі. Висушену сполуку розчиняють у DMF (23мл) і додають HONSu (1,5г, 13ммоль). До одержаної в результаті суміші додають розчин Ν,Ν'-дициклогексилкарбодііміду (2,44г, 11,9ммоль) у дихлорметані (47мл). Реакційну суміш перемішують протягом 16год. при кімнатній температурі і осаджену сполуку відфільтровують. Для одержання зазначеної сполуки осад рекристалізують з н-гептану/2-пропанолу (3,03г, 50%). Приклад 30 Синтез Glu22,23,30Arg26,34Lys38(Ne-(g-глутаміл(Na-тетрадеканоїл)))-GLP-1(7-38)-OH. Суміш Glu22,23,30Arg26,34Lys38-GLP-1(7-38)-OH (1,0мг, 0,272мкмоль), EDPA (0,98мг, 7,62мкмоль), NMP (70мкл) та води (70мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин Νa-тетрадеканоїл-Glu(ONSu)-OBut, одержаний, як описано у Прикладі 29, (0,41мг, 0,816мкмоль) у NMP (10,4мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають стояти ще 45хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (0,448мг, 5,98мкмоль) у 50% водному розчині етанолу (45мкл). Додають 0,5% водний розчин ацетату амонію (0,9мл) і отриману в результаті суміш іммобілізують на Varian 500 mg С8 Mega Bond ElutÒ картриджі, іммобілізовану сполуку промивають 5% водним розчином ацетонітрилу (10мл) і, нарешті, вивільнюють з картриджу шляхом елюювання за допомогою TFA (10мл). Елюат концентрують in vacuo, реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,35мг, 32%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 4012±3. Таким чином, остаточна молекулярна маса становить 4011±3а.о.м. (теоретичне значення 4011а.о.м.). Приклад 31 Синтез Glu23,26Arg34Lys38(Ne-(g-глутаміл(Na-тетрадеканоїл)))-GLP-1(7-38)-OH. Суміш Glu23,26Arg34Lys38-GLP-1(7-38)-OH (6,07мг, 1,727мкмоль), EDPA (6,25мг, 48,36мкмоль), NMP (425мкл) та води (425мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин Na-тетрадеканоїл-GІu(ONSu)-ОВut, одержаний, як описано у Прикладі 29, (2,65мг, 5,18мкмоль) у NMP (66,3мкл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 45хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (2,85мг, 38,0мкмоль) у 50% водному розчині етанолу (285мкл). Додають 0,5% водний розчин ацетату амонію (5,4мл) і отриману в результаті суміш іммобілізують на Varian 500 mg С8 Mega Bond ElutÒ картриджі, іммобілізовану сполуку промивають 5% водним розчином ацетонітрилу (10мл) і, нарешті, вивільнюють з картриджу шляхом елюювання за допомогою TFA (10мл). Елюат концентрують in vacuo і реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,78мг, 12%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3854±3. Таким чином, остаточна молекулярна маса становить 3853±3а.о.м. (теоретичне значення 3853а.о.м.). Приклад 32 Синтез Lys26,34-бi(Ne-(w-карбокситридеканоїл))-GLP-1(7-37)-ОH. Суміш GLP-1(7-37)-OH (30мг, 89мкмоль), EDPA (32,3мг, 250мкмоль), NMP (2,1мл) та води (2,1мл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин НООС-(СН2)12-COONSu (12,7мг, 35,8мкмоль) у NMP (318мкл), реакційну суміш обережно збовтують протягом 1год. 40хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (3,4мг, 44,7мкмоль) у 50% водному розчині етанолу (335мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (10мг, 29%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3840±3. Таким чином, остаточна молекулярна маса становить 3839±3а.о.м. (теоретичне значення 3839а.о.м.). Приклад 33 Синтез Lys26,34бі(Ne-(g-глутаміл(Na-тетрадеканоїл)))-GLP-1(7-37)-OH. (NNC 90-1167). Суміш GLP-1(7-37)-OH (300мг, 79,8мкмоль), EDPA (288,9мг, 2,24ммоль), NMP (21мл) та води (21мл) обережно збовтують протягом 5хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин Νa-тетрадеканоїл-Glu(ONSu)-OBut, одержаний, як описано у Прикладі 29, (163мг, 319,3мкмоль) у NMP (4,08мл), реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 1год. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (131,8мг, 1,76ммоль) у 50% водному розчині етанолу (13,2мл). Додають 0,5% водний розчин ацетату амонію (250мл) і отриману в результаті суміш розділяють на чотири рівні частини. Кожну частину елююють на Varian 500 mg С8 Mega Bond ElutÒ картриджі, іммобілізовану сполуку промивають 0,1% водним розчином TFA (3,5мл), і нарешті, вивільнюють з картриджу шляхом елюювання за допомогою 70% водного розчину ацетонітрилу (4мл). Комбіновані елюати розводять 0,1% водним розчином TFA (300мл). Осаджену сполуку збирають шляхом центрифугування, промивають 0,1% водним розчином TFA (50мл) і, нарешті, виділяють шляхом центрифугування. До осаду додають TFA (60мл) і одержану в результаті реакційну суміш перемішують протягом 1год. 30хв. при кімнатній температурі. Надлишок TFA видаляють in vacuo, а залишок виливають у воду (50мл). Осаджену сполуку очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA система. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (27,3мг, 8%) і продукт аналізують за допомогою PDMS. Відношення маса/заряд для протонованого молекулярного іона становить 4036±3. Таким чином, остаточна молекулярна маса становить 4035±3а.о.м. (теоретичне значення 4035а.о.м.). Приклад 34 Синтез Arg26,34Lys38(Ne-(w-карбоксипентадеканоїл))-FLP-1(7-38)-OH. Суміш Arg26,34Lys38-GLP-1(7-38)-OH (30мг, 8,9мкмоль), EDPA (32,3мг, 250мкмоль), NMP (2,1мл) та води (2,1мл) обережно збовтують протягом 5хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин НООС-(CH2)14-COONSu (13,7мг, 35,8мкмоль) у NMP (343мкл), реакційну суміш обережно збовтують протягом 1год. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (3,4мг, 44,7мкмоль) у 50% водному розчині етанолу (335мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (4,8мг, 14%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3894±3. Таким чином, остаточна молекулярна маса становить 3893±3а.о.м. (теоретичне значення 3893а.о.м.). Приклад 35 Синтез Na-гексадеканоїл-Glu(ONSu)-OBut. До суспензії H-Glu(OH)-OBut (4,2г, 20,6ммоль), DMF (500мл) та EDPA (2,65г, 20,6ммоль) по краплях додають розчин Pal-ONSu (7,3г, 20,6ммоль) у DMF (100мл). Реакційну суміш перемішують протягом 64год. при кімнатній температурі, а потім концентрують in vacuo до загального об'єму 20мл. Залишок розподіляють між 10% водним розчином лимонної кислоти (300мл) та етилацетатом (250мл) і фази відокремлюють. Органічну фазу концентрують in vacuo і залишок розчиняють у DMF (50мл). Одержаний в результаті розчин по краплях додають до 10% водного розчину лимонної кислоти (500мл), яку тримають при 0°С. Осаджену сполуку збирають і промивають крижаною водою та сушать у вакуумній сушильній печі. Висушену сполуку розчиняють у DMF (45мл) і додають HONSu (2,15г, 18,7ммоль). До одержаної в результаті суміші додають розчин Ν,Ν'-дициклогексилкарбодііміду (3,5г, 17ммоль) у дихлорметані (67мл). Реакційну суміш перемішують протягом 16год. при кімнатній температурі і осаджену сполуку відфільтровують. Осад рекристалізують з н-гептану/2-пропанолу для одержання зазначеної сполуки (6,6г, 72%). Приклад 36 Синтез Lys26,34бі(Ne-(g-глутаміл(Na-гексадеканоїл)))-GLP-1(7-37)-OH. Суміш GLP-1(7-37)-OH (10мг, 2,9мкмоль), EDPA (10,8мг, 83,4мкмоль), NMP (0,7мл) та води (0,7мл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин Νa-гексадеканоїл-GІu(ОNSu)-ОВut, одержаний, як описано у Прикладі 33, (163мг, 319,3мкмоль) у ΝΜΡ (4,08мл), реакційну суміш обережно збовтують протягом 1год. 20хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (4,9мг, 65,6мкмоль) у 50% водному розчині етанолу (492мкл). Додають 0,5% водний розчин ацетату амонію (9мл) і одержану в результаті суміш елююють на Varian 1g С8 Mega Bond ElutÒ картриджі, іммобілізовану сполуку промивають 5% водним розчином ацетонітрилу (10мл) і, нарешті, вивільнюють з картриджу шляхом елюювання за допомогою TFA (10мл). Елюат концентрують in vacuo і залишок очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Зазначену сполуку (2,4мг, 20%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 4092±3. Таким чином, остаточна молекулярна маса становить 4091±3а.о.м. (теоретичне значення 4091а.о.м.). Приклад 37 Синтез Arg34Lys26(Ne-(g-глутаміл(Na-гексадеканоїл)))-GLP-1(7-37)-OH. Суміш Arg34-GLP-1(7-37)-OH (3,7мг, 1,1мкмоль), EDPA (4,0мг, 30,8мкмоль), ацетонітрилу (260мкл) та води (260мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин Na-гексадеканоїл-Glu(ONSu)-OBut, одержаний, як описано у Прикладі 35, (1,8мг, 3,3мкмоль) в ацетонітрилі (44,2мкл), і реакційну суміш обережно збовтують протягом 1год. 20хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (1,8мг, 24,2мкмоль) у 50% водному розчині етанолу (181мкл). Додають 0,5% водний розчин ацетату амонію (12мл) та NMP (300мкл) і отриману в результаті суміш елююють на Varian 1g С8 Mega Bond ElutÒ картриджі, іммобілізовану сполуку промивають 5% водним розчином ацетонітрилу (10мл) і, нарешті, вивільнюють з картриджу шляхом елюювання за допомогою ТРА (6мл). Елюат залишають стояти протягом 2год. при кімнатній температурі, а потім концентрують іn vacio. Залишок очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,23мг, 6%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3752±3. Таким чином, остаточна молекулярна маса становить 3751±3а.о.м. (теоретичне значення 3751а.о.м.). Приклад 38 Синтез Arg26,34Lys38(Ne-(g-глутаміл(Na-тетрадеканоїл)))-GLP-1(7-38)-OH. Суміш Arg26,34Lys38-GLP-1(7-38)-OH (14мг, 4,0мкмоль), EDPA (14,3мг, 110,6мкмоль), NMP (980мкл) та води (980мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин Na-тетрадаканоїл-GІu(ONSu)-ОВut, одержаний, як описано у Прикладі 29, (12,1мг, 23,7мкмоль) у NMP (303мкл) і реакційну суміш обережно збовтують протягом 2год. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (6,5мг, 86,9ммоль) у 50% водному розчині етанолу (652мкл). Додають 0,5% водний розчин ацетату амонію (50мл) і отриману в результаті суміш елююють на Varian 1g С8 Mega Bond ElutÒ картриджі, іммобілізовану сполуку промивають 5% водним розчином ацетонітрилу (15мл) і, нарешті, вивільнюють з картриджу шляхом елюювання за допомогою TFA (6мл). Елюат залишають на 1год. 45хв. при кімнатній температурі, а потім концентрують in vacuo. Залишок очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0100% за 60 хвилин. Виділяють зазначену сполуку (3,9мг, 26%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3881±3. Таким чином, остаточна молекулярна маса становить 3880±3а.о.м. (теоретичне значення 3880а.о.м.). Приклад 39 Синтез Arg26,34Lys38(Ne-(w-карбоксипентадеканоїл)-GLP-1(7-37)-OH. Суміш Arg26,34Lys38-GLP-1(7-38)-OH (14мг, 4,0мкмоль), EDPA (14,3мг, 111мкмоль), NMP (980мкл) та води (980мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин HOOC-(CH2)14-COONSu (4,5мг, 11,9мкмоль) у NMP (114мкл), реакційну суміш обережно збовтують протягом 1год. 45хв. при кімнатній температурі. Ще додають розчин HOOC-(CH2)14-COONSu (4,0мг, 10,4мкмоль) у NMP (100мкл) і отриману в результаті суміш обережно збовтують іще 1год. 30хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (1,5мг, 19,8мкмоль) у 50% водному розчині етанолу (148мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (3,9мг, 26%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3809±3. Таким чином, остаточна молекулярна маса становить 3808±3а.о.м. (теоретичне значення 3808а.о.м.). Приклад 40 Синтез Arg26,34Lys38(Ne-(g-глутаміл(Na-тетрадеканоїл)))-GLP-1(7-38)-OH. Суміш Arg26,34Lys38-GLP-1(7-38)-OH (14мг, 4,0мкмоль), EDPA (14,3мг, 110,6мкмоль), NMP (980мкл) та води (980мкл) обережно збовтують протягом 5хв., при кімнатній температурі. До одержаної в результаті суміші додають розчин Na-гексадеканоїл-GІu(ОNSu)-ОВut, одержаний, як описано у Прикладі 35, (6,4мг, 11,9мкмоль) у NMP (160мкл) і реакційну суміш обережно збовтують протягом 1год. 20хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (6,5мг, 87ммоль) у 50% водному розчині етанолу (653мкл). Додають 0,5% водний розчин ацетату амонію (50мл) і отриману в результаті суміш елююють на Varian 1g С8 Mega Bond ElutÒ картриджі, іммобілізовану сполуку промивають 5% водним розчином ацетонітрилу (10мл) і, нарешті, вивільнюють з картриджу шляхом елюювання за допомогою TFA (6мл). Елюат залишають на 1год. 30хв. при кімнатній температурі, а потім концентрують in vacuo. Залишок очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0100% за 60 хвилин. Виділяють зазначену сполуку (7,2мг, 47%) і продукт аналізують за допомогою PDMS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3881±3. Таким чином, остаточна молекулярна маса становить 3880±3а.о.м. (теоретичне значення 3880а.о.м.). Приклад 41 Синтез Arg18,23,26,30,34Lys38(Ne-гексадеканоїл)))-GLP-1(7-38)-OH. Суміш Arg18,23,26,30,34Lys38-GLP-1(7-38)-OH (1,0мг, 0,27мкмоль), EDPA (0,34мг, 2,7мкмоль) та DMSO (600мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин of Pal-ONSu (0,28мг, 0,8мкмоль) у NMP (7мкл). Реакційну суміш обережно збовтують протягом 5хв. при кімнатній температурі, а потім залишають ще на 6год. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (1,6мг, 21,7мкмоль) у 50% водному розчині етанолу (163мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (0,17мг, 16%) і продукт аналізують за допомогою MALDI-MS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3961±3. Таким чином, остаточна молекулярна маса становить 3960±3а.о.м. (теоретичне значення 3960а.о.м.). Приклад 42 Синтез Arg26,34Lys38(Ne-(w-карбокситридеканоїл)))-GLP-1(7-38)-OH. Суміш Arg26,34Lys38GLP-1(7-38)-OH (14мг, 4,0мкмоль), EDPA (14,3мг, 111мкмоль), NMP (980мкл) та води (980мкл) обережно збовтують протягом 5хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин HOOC-(CH2)12-COONSu (4,2мг, 11,9мкмоль) у NMP (105мкл), реакційну суміш обережно збовтують протягом 1год. 50хв. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (6,5мг, 87мкмоль) у 50% водному розчині етанолу (652мкл). Реакційну суміш очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (5,8мг, 39%) і продукт аналізують за допомогою MALDI-MS. Відношення маса/заряд для протонованого молекулярного іона становить 3780±3. Таким чином, остаточна молекулярна маса становить 3779±3а.о.м. (теоретичне значення 3781а.о.м.). Приклад 43 Синтез Arg34Lys26(Ne-(g-глутаміл(Na-тетрадеканоїл)))-GLP-1(7-37)-OH. Суміш Arg34-GLP-1(7-37)-OH (15мг, 4,4мкмоль), EDPA (16мг, 124мкмоль), NMP (2мл) та води (4,8мл) обережно збовтують протягом 5хв. при кімнатній температурі. До одержаної в результаті суміші додають розчин Νa-тетрадеканоїл-Glu(ONSu)-OBut, одержаний, як описано у Прикладі 29, (12,1мг, 23,7мкмоль) у NMP (303мкл), і реакційну суміш обережно збовтують протягом 2год. при кімнатній температурі- Реакцію припиняють додаванням розчину гліцину (6,5мг, 869мкмоль) у 50% водному розчині етанолу (652мкл). Додають 0,5% водний розчин ацетату амонію (50мл) і одержану в результаті суміш елююють на Varian 1g С8 Mega Bond ElutÒ картриджі, іммобілізовану сполуку промивають 5% водним розчином ацетонітрилу (15мл) і, нарешті, вивільнюють з картриджу шляхом елюювання за допомогою TFA (6мл). Елюат залишають на 1год. 45хв. при кімнатній температурі, а потім концентрують in vacuo. Залишок очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (3,9мг, 26%) і продукт аналізують за допомогою MALDI-MS. Відношення маса/заряд для протонованого молекулярного іона становить 3723±3. Таким чином, остаточна молекулярна маса становить 3722±3а.о.м. (теоретичне значення 3723а.о.м.). Приклад 44 Синтез Νa-октадеканоїл-Glu(ONSu)-OBut. До суспензії H-Glu(OH)-Obut (2,82г, 13,9ммоль), DMP (370мл) та EDPA (1,79г, 13,9ммоль) по краплях додають розчин Ste-ONSu (5,3г, 13,9ммоль) у DMF (60мл). Додають дихлорметан (35мл) і реакційну суміш перемішують протягом 24год. при кімнатній температурі, а потім концентрують in vacuo. Залишок розподіляють між 10% водним розчином лимонної кислоти (330мл) та етилацетатом (200мл) і фази відокремлюють. Органічну фазу концентрують in vacuo і залишок розчиняють у DMF (60мл). Одержаний в результаті розчин по краплях додають до 10% водного розчину лимонної кислоти (400мл), яку тримають при 0°С. Осаджену сполуку збирають, промивають крижаною водою і сушать у вакуумній сушильній печі. Висушену сполуку розчиняють у DMF (40мл) і додають HONSu (1,63г, 14,2ммоль) додають. До одержаної в результаті суміші додають розчин DCC (2,66г, 12,9ммоль) у дихлорметані (51мл). Реакційну суміш перемішують протягом 64год. при кімнатній температурі і осаджену сполуку відфільтровують. Осад рекристалізують з н-гептану/2-пропанолу для одержання зазначеної сполуки (4,96г, 68%). Приклад 45 Синтез Arg26,34Lys38(Ne -(g-глутаміл(Na-октадеканоїл)))-GLP-1(7-38)-OH. Суміш Arg26,34-GLP-1(7-38)-OH (28мг, 7,9мкмоль), EDPA (28,6мг, 221,5мкмоль), NMP (1,96мл) та води (1,96мл) обережно збовтують протягом 5хв. при кімнатній температурі. До отриманої в результаті суміші додають розчин Na-октадеканоїл-GIu(ОNSu)-ОВut (17,93г, 31,6мкмоль), одержаний, як описано у Прикладі 44, у NMP (448мкл), і реакційну суміш обережно збовтують протягом 2год. при кімнатній температурі. Реакцію припиняють додаванням розчину гліцину (13,1мг, 174мкмоль) у 50% водному розчині етанолу (1,3мл). Додають 0,5% водний розчин ацетату амонію (120мл) і одержану в результаті суміш розділяють на дві рівні частини. Кожну з частин елююють на Varian 5g С8 Mega Bond EIutÒ картриджі, іммобілізовану сполуку промивають 5% водним розчином ацетонітрилу (25мл) і, нарешті, вивільнюють з картриджу шляхом елюювання TFA (25мл). Комбіновані елюати залишають на 1год. 25хв. при кімнатній температурі, а потім концентрують in vacuo. Залишок очищають шляхом колонкової хроматографії з використанням ціанопропілової колонки (Zorbax 300SB-CN) та традиційної системи ацетонітрил/TFA. Колонку нагрівають до 65°С і градієнт ацетонітрилу становить 0-100% за 60 хвилин. Виділяють зазначену сполуку (3,6мг, 11%) і продукт аналізують за допомогою MALDI-MS. Виявлене відношення маса/заряд для протонованого молекулярного іона становить 3940±3. Таким чином, остаточна молекулярна маса становить 3939±3а.о.м. (теоретичне значення 3937а.о.м.). Біологічні знахідки Подовження дії похідних GLP-1 після підшкірного введення Подовження дії багатьох похідних GLP-1 даного винаходу визначають шляхом спостереження за їх концентрацією у плазмі після підшкірного введення здоровим свиням з використанням способу, описаного нижче. Для порівняння спостерігали також концентрацію GLP-1(7-37) у плазмі після підшкірного введення. Результати представлено у Таблиці. Подовження дії інших похідних GLP-1 даного винаходу визначають так само. Свиней (50% - породи Дюрок, 25% - йоркширських, 25% - датських ландрасів, пр. 40кг) тримають голодними з початку експерименту. Кожній зі свиней на 1кг маси тіла вводять 0,5нмоль тестової сполуки у 50мкМ ізотонічному розчині (5мМ фосфату, рН 7,4, 0,02% TweenÒ-20 (Merck), 45мг/мл маніту (без пірогену, Novo Nordisk). Зразки крові забирають через катетер, вставлений у шийну вену, по годинах, вказаних у Таблиці. 5мл зразків крові виливають в охолоджені склянки, які містять 175мкл такого розчину: 0,18Μ EDTA, 1500КІЕ/мл апротиніну (Novo Nordisk) та 3% бацитрацину (Sigma), рН 7,4. За 30хв. зразки центрифугують протягом 10хв. при 5-6000*g. Температуру утримують на рівні 4°С. Супернатант піпеткою переносять в інші склянки й тримають при -20°С аж до використання. Концентрацію пептидів у плазмі визначають шляхом радіоізотопного аналізу з використанням моноклонального антитіла, специфічного до N-кінцевої ділянки GLP-1(7-37). Перехресна реактивність становить менше 1% для GLP-1(1-37) та GLP-1(8-36) аміду і
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of glucanolike peptide-1
Назва патенту російськоюПроизводные глюкагонообразного пептида-1
МПК / Мітки
МПК: A61K 38/00, C07K 14/605, A61P 3/00, A61K 38/26, A61P 3/04, A61P 3/10, A61K 38/28, A61P 5/50, A61K 31/00
Мітки: спосіб, лікування, композиція, одержання, варіанти, ожиріння, засобу, пептиду-1, лікувального, фармацевтична, діабету, похідна, глюкагоноподібного
Код посилання
<a href="https://ua.patents.su/24-72181-pokhidna-glyukagonopodibnogo-peptidu-1-varianti-farmacevtichna-kompoziciya-ta-sposib-oderzhannya-likuvalnogo-zasobu-varianti-sposib-likuvannya-diabetu-varianti-i-ozhirinnya.html" target="_blank" rel="follow" title="База патентів України">Похідна глюкагоноподібного пептиду-1 (варіанти), фармацевтична композиція та спосіб одержання лікувального засобу (варіанти), спосіб лікування діабету (варіанти) і ожиріння</a>
Попередній патент: Модифікована ацил-апб-десатураза
Наступний патент: Лікарська форма негайної після затримки дії для перорального введення та спосіб її виготовлення
Випадковий патент: Синергетична гербіцидна композиція та спосіб боротьби з небажаною рослинністю