Спосіб лікування інфекційної та/або запальної хвороби кишечнику фармацевтичною композицією, яка містить рифаксимін b
Номер патенту: 110212
Опубліковано: 10.12.2015
Автори: Джузеппе Клаудіо Віскомі, Марія Ґрімальді, Паола Маффей, Джузеппе Боттоні
Формула / Реферат
1. Спосіб лікування інфекційної та/або запальної хвороби кишечнику, за яким пацієнту, що цього потребує, вводять фармацевтичну композицію, яка знаходиться у формі таблеток, що містить гідратну або сольватну форму рифаксиміну β в гастрорезистентних мікрогранулах у кількості 100-800 мг.
2. Спосіб лікування інфекційної та/або запальної хвороби кишечнику за п. 1, де інфекційну та/або запальну хворобу кишечнику вибрано з наступного: діарейні синдроми, пронос мандрівників, діареї, спричинені зміненою рівновагою бактеріальної флори кишечнику, хвороба Крона, ентерит, виразковий ректоколіт, синдром подразненого кишечнику, бактеріальне розростання в тонкій кишці, дивертикулярна хвороба, гіперамоніємія, антибактеріальна профілактика перед та після хірургічного втручання, печінкова енцефалопатія, обумовлена стресом хвороба, інтерстиціальний коліт, бактеріальний перитоніт, інфекції, спричинені постійним застосуванням інгібіторів протонного насоса.
3. Спосіб лікування інфекційної та/або запальної хвороби кишечнику за п. 2, де запальна хвороба кишечнику є хворобою Крона.
4. Спосіб лікування інфекційної та/або запальної хвороби кишечнику за п. 3, де фармацевтична композиція містить гідратну або сольватну форму рифаксиміну β.
5. Спосіб лікування інфекційної та/або запальної хвороби кишечнику за п. 4, де фармацевтичну композицію вводять в кількості 800 мг-2400 мг щодобово.
6. Спосіб лікування інфекційної та/або запальної хвороби кишечнику за п. 5, де період лікування для клінічної ремісії складає 10-12 тижнів.
7. Спосіб лікування інфекційної та/або запальної хвороби кишечнику за п. 1 без супутнього лікування.
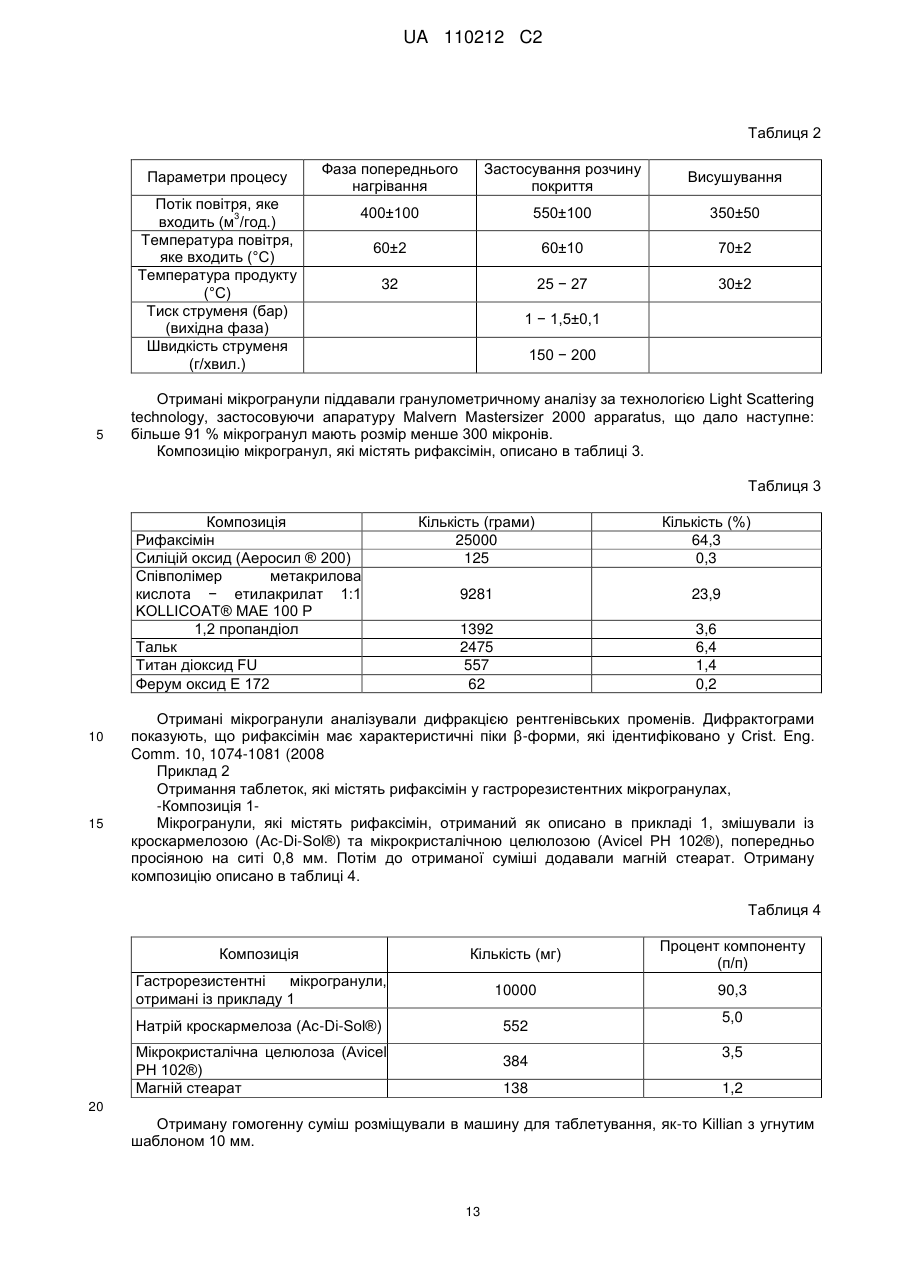
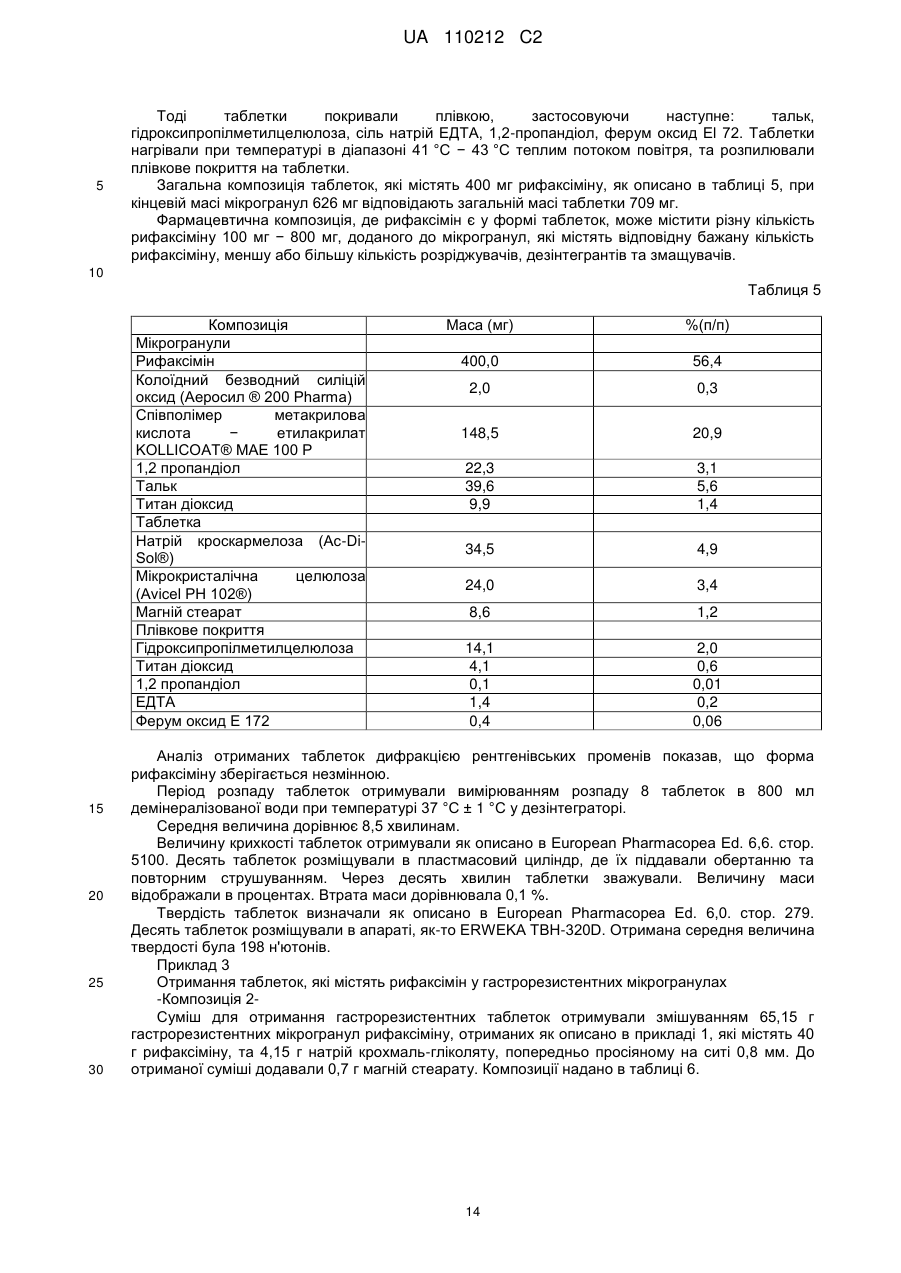
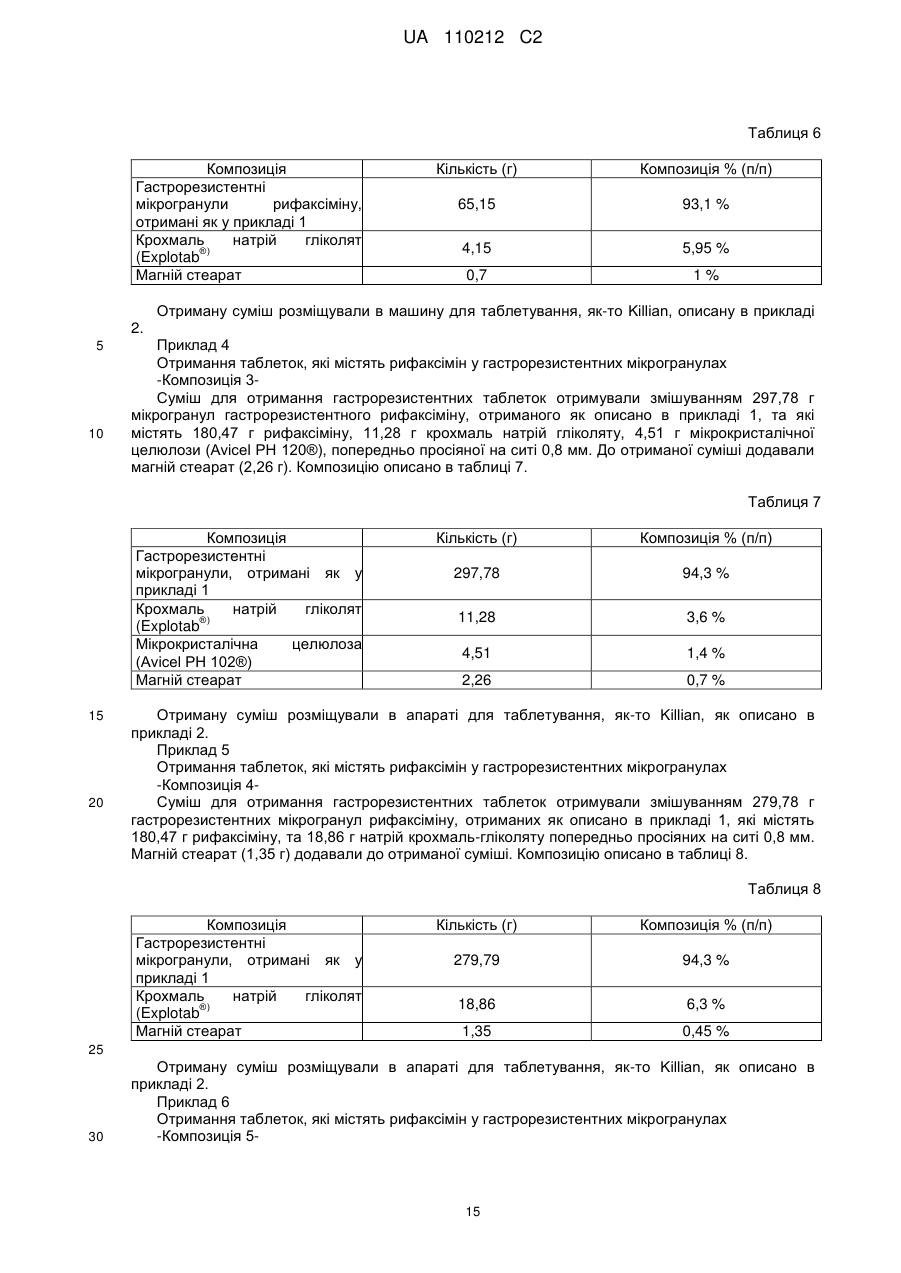
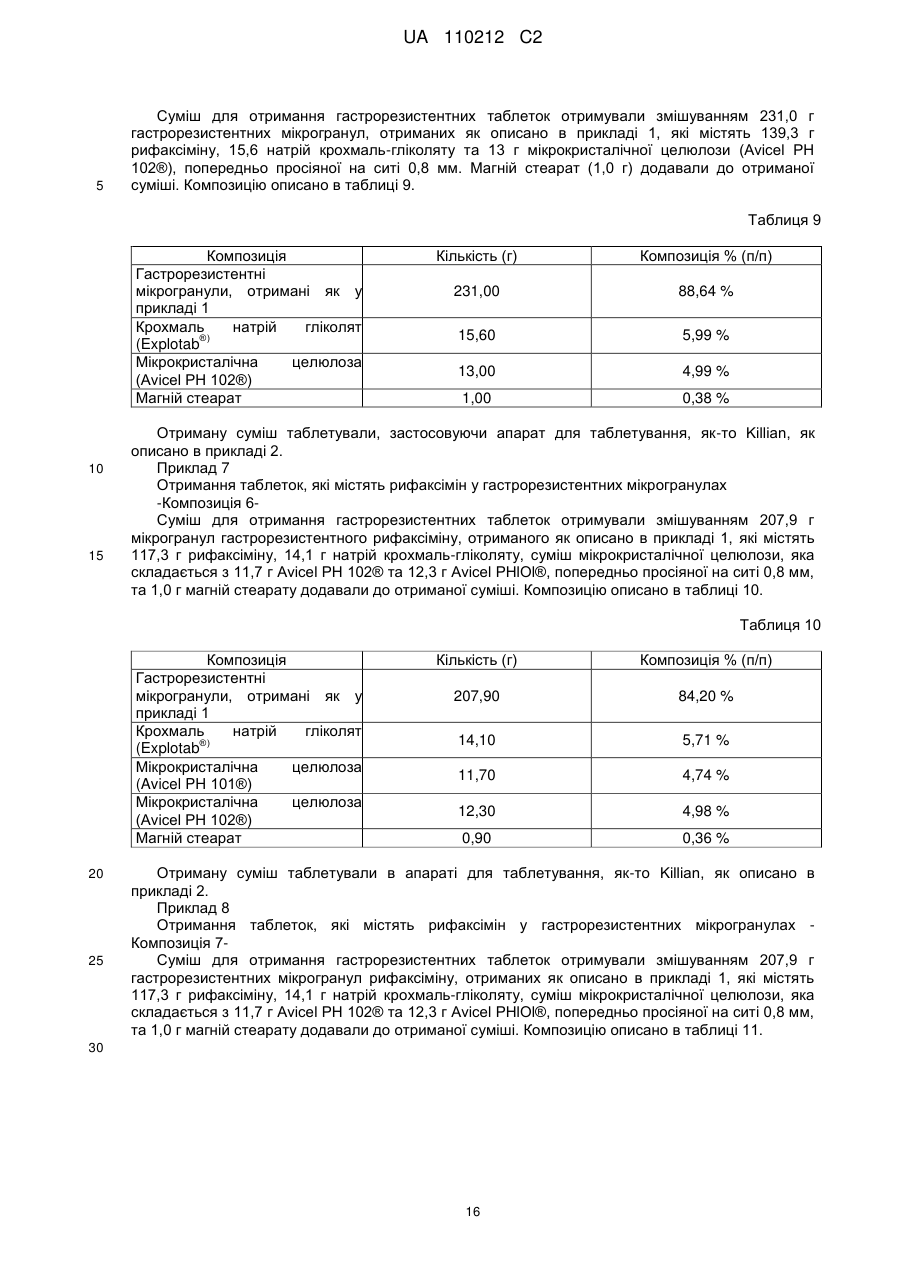
Текст
Реферат: Винахід стосується способу лікування інфекційної та/або запальної хвороби, за яким пацієнту, що цього потребує, вводять фармацевтичну композицію, яка знаходиться у формі таблеток, що містить гідратну або сольватну форму рифаксиміну β в гастрорезистентних мікрогранулах у кількості 100-800 мг. UA 110212 C2 (12) UA 110212 C2 UA 110212 C2 5 10 15 20 25 30 35 40 45 50 55 Мета винаходу стосується гастрорезистентних таблеток, які містять рифаксімін, отриманий способами гастрорезистентних мікрогранул, які інгібують вивільнення рифаксіміну при величинах pH 1,5 − 4,0, і вони дозволяють його вивільнення при величинах pH 5,0 − 7,5, способів їх отримання та їх застосування в лікуванні та попередженні хвороб, які безпосередньо або опосередковано походять від запальних хвороб кишечнику. Серед патологій органів травлення частішими є ті, які мають інфекційну етіологію та/або етіологію запаленої кишки. Вони охоплюють кишкові інфекції, синдроми подразненої кишки та запальні хвороби кишечнику. Термін "кишкові інфекції" охоплює, наприклад, наступне: діарейні синдроми, пронос мандрівників, діареї, спричинені зміненим балансом інтестинальної бактеріальної флори, ентерит. Термін запальні хвороби кишечнику також означає, наприклад, хворобу Крона та виразковий ректо-коліт. Інші кишкові патології охоплюють синдроми подразненого кишечнику (IBS), також названі "хворобою подразненого кишечнику", бактеріальну гіпертрофію в тонкій кишці, також названу "малою інтестинальною бактеріальною гіпертрофією" (SIBO), та дивертикулярні синдроми. Етіологію вказаних раніше кишкових патологій вірогідно відносити, принаймні, частково до бактеріальних патогенних факторів або альтерацій інтестинальної бактеріальної флори. Печінкову енцефалопатію також лікували рифаксіміном, оскільки сама патологія та її ускладнення можуть виникати внаслідок продукування інтестинальною мікробіотою аміаку. У випадку запальних хвороб кишечнику метою медичного лікування є зменшення запального стану застосуванням ліків, як-то антибіотики, стероїди, 5-аміносаліцилати (5-ASA), імуносупресанти, конкретні фармакотерапії та так звані біологічні ліки, як-то, наприклад, інфліксимаб, етанерцепт, адалімумаб, аналкірна. У цих межах антибіотики широко застосовано з метою зменшення бактеріального навантаження в інтестинальній порожнині, та, отже, їх залучено при запальному стані з подальшою ремісією симптоматики, асоційованої з патологічним станом (діарея, болі в кишечнику, метеоризм, біль при дефекації, абсцеси, фістули, т.д.). Застосовані ліки часто асоційовано з тяжкими побічними ефектами та/або побічними діями, що також призводить до затримки лікування. Отже, існує потреба в отриманні нових доступних ліків, які є ефективними в лікуванні таких патологій та мають придатний безпечний профіль, котрий також дозволяє їх постійне застосування. Рифаксімін є активним антибіотиком проти грам-позитивної та грам-негативної бактерії, про який повідомлено, що він не може бути абсорбованим, як описано в Descombe J. et al. у Int. J. Clin. Pharmacol. Res., 14 (2), 51-56, (1994) та діє тільки локально в шлунково-кишковому протоці. Завдяки антибіотичній та локальній активності рифаксімін грає доречну роль у терапії проти інфекційних та запальних хвороб кишечнику в їх гострих та хронічних періодах. Рифаксімін існує в кристалічній та аморфній формах, які описано, наприклад, у U.S. Patent No. 7 045 620 та U.S. Заявка на патент, яка має номери публікації. US20080262024 та US20090130201, які повністю охоплено тут посиланням. Різні форми рифаксіміну асоційовано з відмінними рівнями абсорбції в крові. Дивись, U.S. Patent Application No. US200801332530, яку також повністю охоплено тут посиланням. Тепер рифаксімін дозволено для лікування патологій, етіологія яких частково або повністю розглядається як гострі та хронічні хвороби кишечнику, спричинені грам-позитивною та грамнегативною бактерією, як-то діарейний синдроми, пронос мандрівників, діареї, спричиненні зміненим балансом інтестинальної бактеріальної флори, як-то діареї влітку, бігуча діарея, ентероколіт. Крім того, його застосовано для перед- та післяопераційної профілактики інфекційних ускладнень при хірургічних втручаннях до шлунково-кишкового протоку, як співад'ювант у лікуванні гіпераммоніємії та для зменшення ризику гострих випадків печінкової енцефалопатії. Рифаксімін також є корисним при синдромі втоми суглобів, інтерстиціальному коліті, бактеріальному перитоніті та інфекціях внаслідок постійного застосування інгібіторів протонного насосу. Для вказаних раніше застосувань рифаксімін слабкої абсорбції, котрий тепер є в продажу, далі є переважним, оскільки він зменшує долю небажаних ефектів, як-то, наприклад, селекцію бактеріальних стійких до антибіотиків штамів та ризик можливих фармакологічних взаємодій. Тепер рифаксімін є в продажу у формі таблеток або капсул при дозах 100 мг − 550 мг, або у препаратах для педіатричного застосування, або в мазях для лікування місцевих інфекцій. Клінічні дослідження показали ефективність рифаксіміну в лікуванні патологій з альтераціями мікробіоти та запальних хвороб кишечнику, як-то, наприклад, синдром 1 UA 110212 C2 5 10 15 20 25 30 35 40 45 50 55 подразненого кишечнику (IBS), мала інтестинальна бактеріальна гіпертрофія (SIBO) та дивертикулярна хвороба, хвороба Крона та резервуарний ілеїт. Рифаксімін, застосований за різними терапевтичними схемами з дозами до 1200 мг/добу при максимальній тривалості чотири тижні, індукував значне поліпшення симптомів IBS та SIBO як сповіщено Pimentel M. у Expert Opin. Investig. Drugs 2009; 18 (3), 349-358 та Prantera C. et al. Aliment. Pharmacol. 23,1117-1125, 2006. Серед запальних хвороб кишки особливо значимою вважають хворобу Крона, патологію, яка може охоплювати весь травний тракт, де дистальна клубова кишка та ободова кишка є найбільш охопленими ділянками. Запальні процеси типово є переміжними. Для хвороби характерним є подовжений та змінний курс із системними та періанальними ускладненнями та рецидивною тенденцією навіть після хірургічного та медичного лікування. Також про застосування рифаксіміну стосовно цієї патології повідомлено, наприклад, у Shafran I. et al., Am. J. Gastroenterol., 2003, 98 (Suppl), S250 та Current Medical Research Opinion, 2005, 21(8), 1165-6, де сповіщають про те, що спостерігали при застосуванні таблеток, які є в продажу та містять 200 мг рифаксіміну, в лікуванні пацієнтів, уражених хворобою Крона, клінічну ефективність в індукуванні ремісії хвороби. У Rizzello F. et al., Gut, 2000, 47, Suppl, 3, A12 повідомлено про застосування 200 мг таблеток рифаксіміну в попередженні рецидиву. Latella et al., у Int. J. Colorectal Dis., 2003, 18, 55-62 сповіщають про ефективність застосування таблеток рифаксіміну, які є в продажу, для поліпшення симптомів пацієнтів, уражених неускладненою дивертикулярною хворобою. Терапевтична ефективність рифаксіміну в лікуванні печінкової енцефалопатії повідомлено в Bass et al., Нов Eng. J. Med., 2010, 362, 1071-1081. Щоб покращити терапевтичну ефективність рифаксіміну в лікуванні запальних хвороб кишечнику, було запропоновано останнім часом фармацевтичні композиції у формі мікрогранул, які мають розмір менший 300 мікронів, та які покрито гастрорезистентною плівкою, як описано в IT1362820. Ці мікрогранули відповідають вимозі вивільнення тільки антибіотику в кишці, та внаслідок їх великої площі поверхні та композиції гастрорезистентного покриття полімерами, яке є біоадгезивним до слизової оболонки, підсилюють контакт активної складової зі слизовою оболонкою кишечнику. Приготування фармацевтичних композицій, які містять рифаксімін у гастрорезистентних мікрогранулах, переважно у водних розчинах для перорального застосування, описано в International application WO 2006/094737 та U.S. Patent Application, які мають номер публікації US 20090011020, які повністю охоплено тут посиланням. Також в WO 2006/094737 повідомлено, що цей препарат може бути корисним для лікування запальних хвороб кишечнику. Prantera C. et al., у Aliment. Pharmacol. Ther., 2006, 23, 1117-1125 описують результати, отримані при лікуванні хвороби Крона рифаксіміном у гастрорезистентних мікрогранулах, отриманих згідно із WO 2006/094737 для водних суспензій, де 12-тижневе лікування дозою 800 мг двічі на добу спричиняло клінічну ремісію у 52 % пацієнтів. Швидкість клінічної ремісії досягала 63 %> у підгрупі пацієнтів із підвищеним вихідним рівнем величини C-реактивного білку. Застосування рифаксіміну в мікрогранулах для суспензії дало кращі та непередбачувані результати в порівнянні з тими, про які повідомлено в Shafran I. et al., Am. J. Gastroenterol., 2003, 98 (Suppl), S250 та Current Medical Research & Opinion 2005, 21(8), 1165-6, де повідомляли, що застосування таблеток рифаксіміну 200 мг три рази на добу після 12тижневого лікування призводило до ремісії хвороби в 52 %> випадків. Щоб отримати вищу ефективність, середню тривалість лікування слід продовжити, принаймні, до 16 тижнів. При порівнянні результатів, отриманих лікуванням пацієнтів таблетками, які є в продажу, у порівнянні з лікуванням пацієнтів гастрорезистентними мікрогранулами для водних суспензій, також слід відзначити, що в клінічному дослідженні, повідомленому Shafran, Am. J. Gastroenterol, 2003, 98 (Suppl), S250 та Current Medical Research та Opinion 2005, 21(8), 1165-6, 27,6 % пацієнтів також застосовували кортикостероїди як супутнє лікування, тоді як кортикостероїди вилучали з дослідження, виконаного в Prantera, Aliment. Pharmacol. Ther., 2006, 23,1117-1125. Shafran et al., Dig. Dis. Sci., 2010, 55(4), 1079-84 також сповіщають про результати застосування рифаксіміну у таблетках 200 мг три рази на добу в 68 пацієнтів, уражених хворобою Крона, яких підтримували окрім рифаксіміну різними супутніми лікуваннями, охоплюючи кортикостероїди, інші антибіотики, так звані біологічні продукти, імуномодулятори та протидіарейні засоби протягом лікування тривалістю 0,4 − 134,9 тижнів (величина середньої 2 UA 110212 C2 5 10 15 20 25 30 35 40 45 50 55 60 тривалості 16,6 тижнів). У цьому дослідженні сповіщено, що клінічну ремісію хвороби отримували в 65 % пацієнтів. Хоча раніше вказані лікування, описані Shafran, були достатньо різнорідними, можна зробити висновок, що результати, повідомлені Prantera, Aliment. Pharmacol. Ther., 2006, 23, 1117-1125, свідчать про терапевтичну ефективність, оскільки клінічну ремісію отримано за коротший період лікування з меншою частотою добових застосувань та без супутніх лікувань кортикостероїдами, іншими антибіотиками та/або біологічними продуктами. У WO2006/094737 описано отримання гастрорезистентних мікрогранул рифаксіміну та розкрито отримання композицій у суспензіях, таблетках та капсулах. Крім того, описано застосування композицій у мікрогранулах для водних суспензій при дозах до 1600 мг/добу до пацієнтів, уражених хворобою Крона, але без повідомлення щодо ефективності та безпечності при вищих дозах та щодо тривалості ремісії хвороби після закінчення лікування. Крім того, в WO2006/094737 описано можливі фармацевтичні форми застосування мікрогранул, як таблетки, капсули, пакетики, та встановлено, що ці мікрогранули можуть містити α, β, γ, δ та ε-поліморфи рифаксіміну. Рифаксімін також може існувати в гідратній та/або сольватній формах. Сольвати рифаксіміну, у яких форму рифаксіміну стабілізовано сольватом, описано в WO2008/029208 (також опубліковано як U. S. Patent Application Pub. No. 20100010028). Згідно з метою цього винаходу запропоновано більш ефективні фармацевтичні форми для лікування запальних хвороб, чутливих до лікування рифаксіміном. Несподівано було знайдено, що відбором таблеток для застосування серед можливих фармацевтичних форм, та відбором для застосування серед усіх поліморфних форм рифаксіміну гідратної або сольватної форми β-поліморфу рифаксіміну отримано більш ефективну фармацевтичну форму для лікування запальних хвороб., як показано в таблиці 1. Цей результат є непередбачуваним та несподіваним, оскільки серед усіх фармацевтичних форм таблетки єдині, де діючий компонент є менш швидко доступним у часі, та гідратна або сольватна форма рифаксіміну β-поліморфу рифаксіміну є менш біодоступною та менш розчинною серед усіх відомих поліморфних форм рифаксіміну. Комбінація цих двох факторів робить несподіваною та непередбачуваною підвищену терапевтичну ефективність композицій цього винаходу в лікуванні запальних хвороб та, зокрема, хвороби Крона. Таблетки винаходу переважно виготовляють за умови, щоб гідратна або сольватна форма рифаксіміну β зберігалася протягом усього способу отримання та протягом їх зберігання. Крім того, отримані таблеткам слід зберігати гастрозахист мікрогранул; та містити змінні кількості гідратної або сольватної форми рифаксіміну β, як такого або в суміші з іншими поліморфними або аморфними формами рифаксіміну, також при дозах рівних або вищих ніж описані в WO2006/094737A1, тобто 1600 мг/добу; мати прийнятний розмір; мати придатну твердість, щоб легко було оперувати при виготовленні та пакуванні без небезпеки поломки або подрібнення; мати час розпаду достатньо швидкий, який дозволяє вивільнення активної складової у кишечнику; та мати профіль розчинності активної складової, еквівалентний отриманому з водними суспензіями гастрорезистентних гранул, описаний в WO2006/094737A1. Крім того, таблеткам винаходу слід бути стабільними в часі, щоб їх було легко застосовувати та вони були прийнятними для пацієнтів при кишкових інфекційних та запальних хворобах. Крім того, хоч рифаксімін існує в різних поліморфних, енантіомерних, гідратних, сольватних та аморфних формах, як описано, наприклад, у WO2005/044823, WO2006/094662, US 200908255 8, WO2008/035 1 08, WO2008/155728, WO2009/10873001, U.S. Patent No. 7,045,620, WO2008/029208 (також опубліковано в U. S. Patent Application Pub. No. 20100010028 та в Crist. Eng. Comm., 2008, 10, 1074-1081 (усе вказане вище повністю охоплено тут посиланням), та різні форми можна охарактеризувати різними фізикохімічним властивостями та біодоступністю (дивись наприклад, U.S. Patent Application publication No. 20080132530, котру повністю охоплено тут посиланням), фармацевтичні препарати цього винаходу для застосування в таблетках, отримані з гастрорезистентними мікрогранулами, зберігають форму рифаксіміну, яка містить, зокрема, гідратну або сольватну форму рифаксіміну β, як таку або в суміші з іншими формами рифаксіміну. У WO2008/029208 (також опубліковано як U. S. Patent Application Pub. No. 20100010028 (охоплено тут посиланням) описано поліол-сольвати рифаксіміну, які стабілізують поліморфну форму рифаксіміну, конкретно β-форму, котра також є придатною для застосування згідно з цим винаходом. Інші сольвати рифаксіміну, крім із поліолами, також є придатними для застосування згідно із цим винаходом. У переважному втіленні гідратна або сольватна форма β-форми рифаксіміну дорівнює, принаймні, половині загальної кількості рифаксіміну, присутньому в композиції таблетки. В інших утіленнях гідратна або сольватна форма рифаксіміну β дорівнює, принаймні, 70 %, 75 %, 3 UA 110212 C2 5 10 15 20 25 30 35 40 45 50 80 %, 85 %, 90 %, 95 %o або 100 % загальної кількості рифаксіміну, присутньому в композиції таблетки. Крім того, фармацевтична форма в таблетках, які містять гідратну або сольватну форму рифаксіміну β як такого або в суміші з іншими кристалічними або аморфними формами рифаксіміну у гастрорезистентних мікрогранулах, отриманих як описано в WO2006/094737, містить фармацевтично прийнятні екстрагранульовані наповнювачі, де загальна кількість усіх екстрагранульованих наповнювачів переважно не перевищує 30 %> за масою таблетки. зокрема, наповнювачі охоплюють дезінтегранти, як-то, наприклад, натрій карбоксиметилцелюлоза, також названа кармелозою, перехресно зв'язана натрій карбоксиметилцелюлоза, також названа кроскармелозою, або натрій крохмаль-гліколят, та змащувачі, як-то, наприклад, магній або кальцій стеарат, натрій стеарилфумарат, рослинні гідрогенізовані олії, мінеральні олії, поліетиленгліколі, натрій лаурилсульфат, гліцериди, натрій бензоат. Тверда композиція, яка є біоадгезивною, містить мікрогранули, покриті сполуками, які мають біоадгезивні властивості. Таблетки також можуть містити розріджувачі, як-то, наприклад, целюлоза, мікрокристалічна целюлоза, кальцій фосфат, крохмаль, каолін, гідратований кальцій сульфат, кальцій карбонат, лактоза, цукроза, глюкоза, глюкани, ксилоглюкани, передбачена сума маси наповнювачів завжди, приблизно, є нижчою 30 % за масою таблеток, зокрема, більше − 5,0− 20,0 %. Необов'язково таблетки. які містять мікрогранули рифаксіміну, також можуть бути покритими плівкогенним покриттям. Немає потреби, щоб гастрорезистентне плівкове покриття та навіть диспергування таблеток зберігало гастрорезистентність. Бажана та корисна властивість нової композиції гастрорезистентних таблеток винаходу, які містять гідратну або сольватну форму рифаксіміну β як таку або в суміші з іншими аморфними, гідратованими або сольватованими кристалічними формами в деяких утіленнях, є такою, яка не є необхідною для таблеток, щоб містити ліганд та/або глідантні наповнювачі, звичайно застосовані в рівні техніки. Таблетки. які містять гідратні або сольватні форм рифаксіміну β, як такі або в суміші з іншими формами рифаксіміну, є стабільними протягом трьох років при 25 °C та протягом шести місяців при 40 °C та мають придатну твердість, крихкість та властивість дезагрегації та зберігають гастрорезистентну властивість навіть коли таблетки розділено. Крім гастрорезистентних мікрогранул, які містять гідратну або сольватну форму рифаксіміну β, як таку або в суміші з іншими формами рифаксіміну, можна отримувати таблетки, які містять змінні кількості рифаксіміну, оскільки мікрогранули можна змішувати з одним або більш наповнювачами, які відомі у рівні техніки, до досягнення бажаної маси таблетки як альтернатива їх можливому поділу. Таблетки, отримані з мікрогранулами, які містять гідратну або сольватну форму рифаксіміну β, як таку або в суміші з іншими формами рифаксіміну, можуть містити змінні кількості рифаксіміну, уміст якого дорівнює 100 − 800 мг, та їх можна з користю застосовувати при показаннях, які потребують високих доз, та, зокрема, доз вищих 1600 мг на добу до пацієнтів, уражених кишковими інфекційними та запальними хворобами, як-то, але без обмеження, наприклад, хвороба Крона, з показаною терапевтичною ефективністю, безпечністю та терпимістю. Таблетки, отримані згідно із заявленим винаходом, які містять гідратну або сольватну форму рифаксіміну β, як таку або в суміші з іншими формами рифаксіміну, в гастрорезистентних мікрогранулах, подібно молекулам, описаним у WO2006/094737, показали вищу терапевтичну ефективність в лікуванні кишкових запальних хвороб, подібних, наприклад, хворобі Крона, у порівнянні з результатами, отриманими застосуванням таких же мікрогранул у водному розчині. Наприклад, у таблиці 1 наведено результати, отримані із клінічного дослідження, описаного в у прикладі 11, де показано процент пацієнтів, які отримували повну клінічну ремісію хвороби після застосування таблеток, які містять гідратну або сольватну форму рифаксіміну β в гастрорезистентних мікрогранулах у порівнянні з пацієнтами, які отримували суспензію таких же мікрогранул, отриманих як повідомлено в прикладі 7 WO2006/094737. 55 4 UA 110212 C2 Таблиця 1 Доза/добу Тривалість лікування Процент клінічної ремісії 5 10 15 20 25 30 35 40 45 50 Таблетки 400 мг рифаксіміну, отримані як у прикладі 2 (Приклад 11 заявленого винаходу) 1600 мг 12 тижнів 62,2 % Мікрогранули рифаксіміну у водній суспензії (Приклад 7 WO2006/094737) 1600 мг 12 тижнів 51,9 % Нова таблетка композиції винаходу, яка містять гідратну або сольватну форму рифаксіміну β, та спосіб їх отримання є такими, що дають непередбачену терапевтичну перевагу в порівнянні з рифаксіміном, отриманим у мікрогранулах для водних суспензій. У цьому винаході запропоновано застосування фармацевтичної твердої композиції гідратної або сольватної форми рифаксіміну β, як такої або у суміші з іншими кристалічними, гідратними, сольватними або аморфними формами рифаксіміну, присутніми в гастрорезистентних мікрогранулах, для застосування до пацієнтів, які потребують добового дозування, вищого 2000 мг, протягом періоду лікування більшого 7 діб, котре не індукує накопичення рифаксіміну в плазмі. У дослідженні заявленого винаходу пацієнти отримували 1200 мг рифаксіміну, отриманого як у прикладі 2, на добу 1; 2400 мг на доби 2, 3, 4, 5, 6; та 1200 мг на добу 7. Стійкий стан концентрації плазми досягали на 3 добу, оскільки концентрація плазми при 3 та 5 добах перед дозою на зростала в порівнянні з добою 7 перед дозою. У втіленні винаходу у фармацевтичній композиції рифаксіміну запропоновано величину максимальної концентрації рифаксіміну плазми (Cмакс.) меншу 7 нг/мл після п'яти або семи діб лікування при дозуванні вищому 2000 мг/добу. У ще одному втіленні в застосуванні фармацевтичної композиції згідно із винаходом запропоновано величину AUC0-24год, яка є меншою 48 нг-год./мл після п'яти або семи діб лікування при дозуванні вищому 2000 мг/добу. У ще одному втіленні винаходу запропоновано застосування фармацевтичної композиції згідно з винаходом, де Cмакс. досягнуто менше ніж за 4 години після п'яти або семи діб лікування при дозуванні вищому 2000 мг/добу. Згідно з винаходом також запропоновано для застосування фармацевтичної твердої композиції, яка містить гідратну або сольватну форму рифаксіміну β, як такого або у суміші з іншими кристалічними, гідратними, сольватними або аморфними формами в гастрорезистентних мікрогранулах, які є ефективними без супутнього лікування при добовій дозі 800 мг − 2400 мг для лікування інтестинальних інфекційних та запальних хвороб, як-то, наприклад, хвороба Крона. В інших утіленнях винаходу запропоновано способи лікування осіб, які потребують лікування, які мають інтестинальну інфекційну та/або запальну хворобу, як-то, наприклад, хвороба Крона. У втіленні спосіб винаходу полягає в застосуванні до пацієнтів, які цього потребують, добового дозування фармацевтичної твердої композиції, яка містить гідратну або сольватну форму рифаксіміну β, як такого або у суміші з іншими кристалічними, гідратними, сольватними або аморфними формами рифаксіміну в гастрорезистентних мікрогранулах, де дозування є вищим 2000 мг на добу протягом періоду лікування довшого семи діб, та не індукує накопичення рифаксіміну в плазмі. Способи винаходу можна застосовувати, щоб досягати додаткових застосувань винаходу, описаних вище. Згідно із цим винаходом також охоплено фармацевтичні композиції, які містять гідратну або сольватну форму рифаксіміну β, як таку або у суміші з іншими кристалічними, гідратними, сольватними або аморфними формами рифаксіміну, присутніми в гастрорезистентних мікрогранулах, для застосування до пацієнтів, які цього потребують, при добовому дозуванні вищому 2000 мг протягом періоду лікування довшому семи діб, що не індукує накопичення рифаксіміну в плазмі. Метою винаходу є отримання твердих композицій у формі гастрорезистентних таблеток, отриманих із гастрорезистентними мікрогранулами, які мають розмір 300 мікронів або менше, які містять гідратну або сольватну форму рифаксіміну β та фармацевтично прийнятні наповнювачі. Тверді композиції у формі таблеток, які можуть містити кількість гідратної або сольватної форми рифаксіміну β, як такого або в суміші з іншими формами рифаксіміну 100 − 800 мг гідратної або сольватної форми рифаксіміну β, здатні заважати вивільненню рифаксіміну при величинах pH, приблизно, 1,5 − 4,0, та дозволяють вивільнення рифаксіміну при величинах pH, приблизно, 5,0 − 7,5. 5 UA 110212 C2 5 10 15 20 25 30 35 40 45 50 55 60 Тверді композиції згідно з винаходом, отримані з гастрорезистентними мікрогранулами, які містять гідратну або сольватну форму рифаксіміну β, як таку або в суміші з іншими формами рифаксіміну, мають непередбачувані властивості терапевтичної ефективності та відповідну твердість, дезагрегацію, гомогенність та стабільність протягом часу, також дозволяючи отримання подільних таблеток при підтриманні їх гастрорезистентності. Композиції у формі таблеток, які містять гідратну або сольватну форму рифаксіміну β, як таку або в суміші з іншими формами рифаксіміну, в гастрорезистентних мікрогранулах, які мають біоадгезивні властивості, необов'язково охоплюють фармацевтично прийнятні екстрагранулярні наповнювачі у кількості, яка перевищувала б 30 %, переважно 5-20 %, за масою таблетки. Ці екстрагранулярні наповнювачі охоплюють: дезінтегранти, як-то, наприклад, натрій карбоксиметилцелюлоза, також названа кармелозою, перехресно зв'язана натрій карбоксиметилцелюлоза, також названа кроскармелозою, або натрій крохмаль-гліколят та змащувачі, як-то, наприклад, магній або кальцій стеарат, натрій стеарилфумарат, рослинні гідрогенізовані олії, мінеральні олії, поліетиленгліколі, натрій лаурилсульфат, гліцериди, натрій бензоат. Таблетки також можуть містити розріджувачі, як-то, наприклад, целюлоза, мікрокристалічна целюлоза, кальцій фосфат, крохмаль, каолін, ди-гідратований кальцій сульфат, кальцій карбонат, лактоза, сахароза, глюкоза, полісахариди, глюкани, ксилоглюкани. Таблетки також можуть містити барвники, ароматизатори, антиоксиданти, підсолоджувачі. Доречним аспектом винаходу є наступне: загальна сума всіх екстрагранулярних наповнювачів, додана до гастрорезистентних мікрогранул, у будь-якому можливому співвідношенні, але не більше 30 % за масою таблетки, та переважно з умістом 5 % − 20 %. У ще одному аспекті винаходу запропоновано таблетки, які містять гідратну або сольватну форму рифаксіміну β, як таку або в суміші з іншими формами рифаксіміну, в гастрорезистентних мікрогранулах, та мають час дезінтеграції достатньо довгий для отримання придатної для вивільнення активної складової рифаксіміну у кишечнику. Переважно час дезінтеграції, принаймні, дорівнює 8, 8,5 або 9 хвилинам. Згідно із ще одним аспектом запропоновано таблетки, які містять гідратну або сольватну форму рифаксіміну β, як таку або в суміші з іншими формами рифаксіміну, в гастрорезистентних мікрогранулах, які мають твердість 180 − 215 н'ютонів, таким чином з таблетками можна легко обходитися без особливих осторог протягом вироблення, пакування у блістери або склянки. Ще одним аспектом винаходу є таблетки, які містять гідратну або сольватну форму рифаксіміну β, як таку або в суміші з іншими формами рифаксіміну, в гастрорезистентних мікрогранулах, з величинами крихкості між 0,0 % та 0,1 %, таким чином з таблетками можна легко обходитися протягом вироблення. Композиції згідно з винаходом дозволяють вивільнення в порожнину кишечнику всієї кількості дози гідратної або сольватної форми рифаксіміну β та інших можливих форм рифаксіміну, охоплених у композиції. Згідно із ще одним аспектом запропоновано фармацевтичні композиції, корисні для лікування/поліпшення стану суб'єктів, уражених хворобами кишечнику, як-то, але без обмеження, інфекційні кишкові патології, спричинені не ентероінвазивними бактеріями (бігуча діарея, ентерит, дизентерія), запалення кишки як-то, наприклад, хвороба Крона, виразковий ректоколіт, синдроми подразненої кишки (IBS), недостатності, надмірно швидке бактеріальне розростання в тонкій кишці (SIBO), дивертикулярні синдроми; патології безпосереднього або опосередкованого походження від кишкових інфекцій, як-то, наприклад, печінкова енцефалопатія, або придатні для вживання в профілактиці кишкових інфекцій перед та після хірургічного втручання. "Обробка," "лікування," або "терапія" хвороби або розладу означає вповільнення, зупинення, або зміна напряму на протилежний хвороби або розладу, що підтверджено зменшенням або усуненням клінічних або діагностичних симптомів. Ці терміни не обов'язково означають загальне одужання. Будь-яке полегшення будь-яких небажаних ознак або симптомів хвороби щодо будь-якої тривалості або вповільнення розвитку хвороби можна вважати лікуванням. Крім того, лікування може охоплювати дії, які можуть погіршувати загальні відчуття пацієнта. Лікування також може охоплювати подовження життя пацієнта, навіть якщо симптом не послаблено, умови хвороби не покращено, або загальні відчуття пацієнта не покращено. Композиції таблетки згідно з винаходом можуть охоплювати фармацевтично прийнятні наповнювачі та/або інші активні складові, застосовані в поєднанні з іншими активними складовими без небезпечних взаємодій. 6 UA 110212 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таблетки винаходу твердої композиції можна вводити в комплекти, які містять таблетки, отримані з мікрогранулами, які містять терапевтично ефективні кількості гідратної або сольватної форми рифаксіміну β, як такої або в поєднанні з іншими формами рифаксіміну, для лікування пацієнтів з хворобами кишечнику та інструкції для застосування названих таблеток. Ще один аспект винаходу полягає в способі лікування та/або попередження кишкових інфекційних та запальних хвороб або для профілактики хвороб кишечнику в особи, яка цього потребує, який полягає в застосуванні фармацевтичної композиції у формі таблеток, які містять гідратну або сольватну форму рифаксіміну β, як таку або в поєднанні з іншими формами рифаксіміну, в гастрорезистентних мікрогранулах, де одна або більше таблеток застосовано для досягнення терапевтично ефективної кількості, та де названа терапевтично ефективна кількість може охоплювати дози вищі 1600 мг на добу з показаною ефективністю, безпечністю та терпимістю. В одному втіленні винаходу дозування може бути до та охоплюючи 2400 мг на добу. Інші дози, придатні для застосування згідно з винаходом, можуть бути 1700, 1800, 1900, 2000, 2100, 2200 та 2300 мг на добу. Ще один конкретний аспект винаходу в способі лікування пацієнта гастрорезистентною композицією, яка містить застосування до пацієнта, який цього потребує, фармацевтичної композиції, яка містить мікрогранули, які містять кількість гідратної або сольватної форми рифаксіміну β, як такої або в поєднанні з іншими формами рифаксіміну, ефективної для ремісії кишкових інфекцій та/або запалень у кінці лікування названою фармацевтичною композицією. Такі інфекції та/або запалення можуть охоплювати, але без обмеження щодо вибраних із наступної групи: синдром подразненого кишечнику (IBS), хвороба Крона, синдроми подразненого кишечнику з неконтрольованими діареями (dIBS), печінкова енцефалопатія, діареї, бігуча діарея, виразковий коліт, ентерит, бактеріальне розростання в тонкій кишці, хронічний панкреатит, недостатність підшлункової залози, коліт та дивертикулярні синдроми. Згідно з винаходом також можна застосовувати спосіб для антибактеріальної профілактики перед хірургічним втручанням. Перевагою способу згідно з винаходом є те, що при завершенні застосування протягом періоду лікування, яке охоплює 10 − 20 тижнів, у пацієнта не спостерігали токсичних дій та була гарна терпимість. Ще один аспект винаходу охоплює застосування твердої композиції винаходу, яка містить мікрогранули, які містять гідратну або сольватну форму рифаксіміну β, як таку або в поєднанні з іншими формами рифаксіміну, для підтримання ремісії запалення кишечнику протягом періоду довшому трьох місяців після закінчення фармакологічного лікування рифаксіміном у гастрорезистентній композиції. Ще один аспект винаходу полягає в способі застосування композицій винаходу, які містять гідратну або сольватну форму рифаксіміну β, як таку або в поєднанні з іншими формами рифаксіміну, в гастрорезистентних мікрогранулах, який полягає в застосуванні до пацієнта, який цього потребує, доз рифаксіміну, вищих 1600 мг/добу, охоплюючи дози 2400 мг/добу та в інтервалі між вказаними вище дозами, для отримання ремісії хвороби в пацієнта, враженого запальними хворобами кишечнику та, зокрема, хворобою Крона, яка має величини Cреактивного білку 5 − 10 мг/л. Композиція та способи винаходу надають доказану ефективність фармацевтичної композиції винаходу, сформовану в таблетках, яка містить гастрорезистентні мікрогранули гідратної або сольватної форми рифаксіміну β, як такі або в поєднанні з іншими формами рифаксіміну, для лікування та ремісії помірно активної хвороби Крона. Гідратні або сольватні форми рифаксіміну β, як такі або в поєднанні з іншими формами рифаксіміну, при дозуванні 100 − 800 мг у формі таблеток, які містять рифаксімін в гастрорезистентних мікрогранулах, можна застосовувати при відповідному дозуванні: одна доза − один, дві або три рази на добу; дві дози − один, два або три рази на добу; або три дози − один або два рази на добу; або чотири дози − один або два рази на добу, без значного обмеження або побічної дії, або взаємодії з їжею або іншими супутніми ліками, котрі треба споживати. Перевагою винаходу є те, що застосування таблеток, які містять гідратну або сольватну форму рифаксіміну β, як таку або в поєднанні з іншими формами рифаксіміну в формі гастрорезистентних мікрогранул, можна повторювати при будь-якому дозуванні протягом кількох циклів лікування. Такі цикли лікування можна надавати протягом застосування рифаксіміну до та охоплюючи, принаймні, 10 − 20 тижнів лікування, якщо потрібно зменшити або усунути симптом, асоційовані з хворобою кишечнику, придатною для лікування рифаксіміном, як-то встановлене вище, охоплюючи хворобу Крона. Гідратні або сольватні форм рифаксіміну β, як такі або в поєднанні з іншими формами рифаксіміну, в композиції в гастрорезистентних мікрогранулах, можна надавати як такі або з іншими супутніми ліками з незначною взаємодією або відсутністю взаємодії, як-то, наприклад, 5 7 UA 110212 C2 5 10 15 20 25 30 35 40 45 50 55 60 ASA, імуносупресанти як-то, наприклад, азатіоприн, метотрексат, 6-меркаптопурин, кортикостероїди, біологічні продукти, як-то інфліксимаб, етанерцепт, адалімумаб, аналкірна. Гастрорезистентні мікрогранули, які містять гідратну або сольватну форму рифаксіміну β, як таку або в поєднанні з іншими формами рифаксіміну, можна отримувати як описано в прикладі 1. Покриття мікрогранул містить полімерні матеріали котрі, переважно, є нерозчинними при величинах pH, приблизно, 1,5 − 4,0, та котрі є розчинними при величинах pH 5,0 − 7,5. Взагалі, гастрорезистентні покриття зроблено з будь-якого матеріалу, який є нерозчинним у діапазоні pH 1,5 − 4,0 та який є розчинним при вищих величинах pH, переважно при величинах pH 5,0 − 7,5. Приклади конкретних полімерів, які придатні для застосування згідно із цим винаходом, вибрано серед співполімерів акрилової кислоти, як-то співполімер метакрилова кислота-етилакрилат 1:1 та співполімер метакрилова кислота-метил метакрилат 1:2, полівінілацетат фталат, гідроксипропілметилцелюлоза фталат, целюлоза ацетат фталат, які є в продажу, наприклад, торгових марок Kollicoat®, Eudragit®, Aquateric®, Aqoat®. Кількість гастрорезистентного матеріалу, застосованого для виготовлення мікрогранул для застосування згідно з винаходом дорівнює, переважно, 10 % − 60 %, краще − 20 %> − 40 %, при порівнянні з загальною масою гастрорезистентної гранули. Гастрорезистентне покриття, нанесене на активну складову в мікрогранулах, необов'язково також може містити пластифікатори, розріджувачі, засоби проти злипання, засоби проти агломерації, ковзні засоби, добавку проти піни, барвники та антиоксиданти. Компонентам, які застосовано для покриття мікрогранул, надавали розчинність застосуванням органічних розчинників або водної суспензії. Розчини або суспензії матеріалу покриття нанесено розпилюванням на порошки або гранули, або мікрогранули, які переміщувалися в резервуарі для покриття або в повітряній суспензії в пристрої для псевдозрідженого шару протягом застосування способу покриття. Приклади органічних розчинників, але без обмеження, які можна застосовувати для надання розчинності матеріалу покриття − метиленхлорид, метил-кислота, ізопропіловий спирт, триетилацетат та етиловий спирт. Як альтернатива, гастрорезистентний полімерний матеріал можна застосовувати через водні суспензії, що є переважною технікою, оскільки це не потребує застосування токсикологічно небезпечних розчинників. Гастрорезистентні мікрогранули також можна отримувати іншими способами, які відомі в рівні фармацевтичної техніки. Такі технології можуть охоплювати, наприклад, гранулювання активної складової рифаксіміну разом із розріджувачами, ковзними засобами та лігандами, та наданням висушених та просіяних мікрогранул для наступного способу з гастрорезистентним покриттям. Інша система, яку можна застосовувати для отримання мікрогранул, охоплює застосування рифаксіміну через сполуки ліганду, вибрані із групи, яка містить наступне: целюлоза, похідні целюлози, крохмалі, картопляний крохмаль, кукурудзяний крохмаль, смоли, синтетична смола, полівінілпіролідон, натрій карбоксиметилцелюлоза, мікрокристалічна целюлоза, гідроксипропілцелюлоза, гідроксиетилцелюлоза, гідроксипропілметилцелюлоза, етилцелюлоза, поліетиленгліколь, желатин, поліпропіленгліколь, альгінова кислота, альгінати, цукри, та їх комбінації, до гранул мікрокристалічної целюлози, які мають діаметр, приблизно, 100 − 200 мікронів, та піддаючи отримані мікрогранули наступному покриттю гастрорезистентною плівкою. Описано препарати гастрорезистентних таблеток згідно з винаходом, де конкретні поліморфні форми рифаксіміну можна вводити в гастрорезистентні мікрогранули. Способи отримання гастрорезистентних мікрогранул переважно потребують умов, які описано в прикладі 1, охоплюючи гідратні або сольватні форми рифаксіміну β. Рифаксімін β можна отримувати способами, які відомі в рівні техніки, та як описано, наприклад, у U.S. Patent No. 7,045,620 та U.S. публікація заявки на патент no. US20080262220, які охоплено тут посиланням повністю. Якщо гідратна або сольватна форма рифаксіміну β отримують із рифаксіміну, одним джерелом поліморфу рифаксіміну є рифаксімін, який тепер апробовано та здійснено промислове впровадження для клінічного застосування в Європі, та він є в продажу як Normix®. Приклади сольватів рифаксіміну β, які також придатні для застосування згідно із цим винаходом, описано у WO2008/029208 (також опубліковано як U. S. Patent Application Pub. No. 20100010028 (охоплений тут посиланням), де описано сольвати поліолу рифаксіміну, які стабілізують поліморфну форму рифаксіміну, конкретно β. Інші сольвати рифаксіміну, крім із поліолами, також придатні для застосування згідно із цим винаходом як джерело. Гастрорезистентні мікрогранули мають біоадгезивні властивості, це означає, що вони можуть прилипати до слизової оболонки. 8 UA 110212 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади полімерів та олігомерів або їх сумішей, які можна вводити в мікрогранули, є наступними: пектини, зеїни, казеїн, желатин, альбумін, колаген, кітозан, олігосахариди та полісахариди, як-то, наприклад, целюлоза, декстран, полісахариди з насіння тамаринду, ксантан-смола, гуміарабік, гіалуронова кислота, альгінова кислота, натрій альгінат. Коли біоадгезивом є синтетичний полімер, полімер вибрано серед наступного: поліаміди, полікарбонати, поліалкілени, поліалкіленгліколі, поліалкіленоксиди, поліалкілентерефталати, полівініловий спирт, полівінілетери, полівінілестери, полівінілпіролідон, полісилоксани, поліуретани, полістироли, полімери акрилової кислоти та метакрилат-естери, співполімери метакрилової кислоти-етилакрилату, поліактиди, полібарбитурові кислоти, поліангідриди, поліортоестери та їх суміші. Іншими корисним полімерами є наступні: метилцелюлоза, етилцелюлоза, гідроксипропілцелюлоза, гідроксибутилметилцелюлоза, ацетат целюлози, пропіонатцелюлози, ацетат-бутиратцелюлози, карбоксиметилцелюлоза, триацетат целюлози, сіль натрій сульфат-целюлоза, поліметилметакрилат, полі-ізопропілметакрилат, поліізобутилакрилат, полі(октадецилакрилат), поліпропілен, поліетиленгліколь, поліетиленоксид, поліетилентерефталат, полівінілацетат, полівінілхлорид, полістирол, полівінілпіролідон, полівінілфенол та їх суміші. Ще одною групою полімерів, корисних для отримування біоадгезивності, є полімери, які мають розгалужену групу, яка містить, принаймні, одну зв'язану гідрофобну групу, де гідрофобними групами звичайно є неполярні групи. Приклади, але без обмеження, таких гідрофобних груп охоплюють наступні групи: алкіл, алкеніл та алкініл. Переважно гідрофобні групи вибирають для підвищення біоадгезивності полімерів. Інші полімери охарактеризовано гідрофобним розгалуженням, принаймі, гідрофільною групою, як-то карбонові кислоти, сильфонові кислоти та фосфонові кислоти, нейтральні та позитивно заряджені аміни, аміди та іміни, де гідрофільними групами є такі, які підвищують біоадгезивність полімеру. Згідно з переважним способом суміш, яка містить сполуки, придатні створювати покриття, отримують суспендуванням різних компонентів у демінералізованій воді та гомогенізацією водної суспензії системою з високою швидкістю змішування, переважно гомогенізатором Ultra Turrax homogenizer, щоб отримати гомогенну суспензію, яка містить 15 % − 30 % твердих часточок. Застосування гастрорезистентних покриттів до фармацевтичних форм далі можна робити способами покриття на лотках або технологією в псевдозрідженому шарі, наприклад, працюючи в умовах, повідомлених у таблиці 2 прикладу 1, застосовуючи наповнювачі, указані в у таблиці 3. Для виготовлення таблеток фармацевтично прийнятні екстрагранулярні наповнювачі можна додавати до гастрорезистентних мікрогранул із кількістю маси переважно нижче 30 %, та краще 5 % − 20 %, у порівнянні з загальною масою готової таблетки. Екстрагранулярні наповнювачі охоплюють дезінтегранти, які можна вибирати з наступного: натрій карбоксиметилцелюлоза, також названу натрій кармелозою, перехресно зв'язана натрій карбоксиметилцелюлоза, також названа кроскармелозою, полівінілпіролідон, також названий повідоном, перехресно зв'язаний полівінілполіпіролідон, також названий кросповідоном, крохмаль, попередньо желатинізований крохмаль, діоксид кремнію та змащувачі, вибрано з наступного магній або кальцій стеарат, натрій стеарилфумарат, рослинні гідрогенізовані олії, мінеральні олії, поліетиленгліколі, натрій лаурилсульфат, гліцериди, натрій бензоат. Таблетки винаходу також можуть містити розріджувачі, вибрані з наступного: наприклад, целюлоза, мікрокристалічна целюлоза, кальцій фосфат, крохмаль, каолін, ді-гідратований кальцій сульфат, кальцій карбонат, лактоза, сахароза, глюкоза, сорбіт та манітол. Барвники, ароматизатори, антиоксиданти та підсолоджувачі також необов'язково можна додавати до композицій таблетки. Один або більше дезінтегрантів, один або більше змащувачів та, можливо, один або більше розріджувачів необов'язково можна застосовувати у виготовленні таблеток. Суміш, яка містить мікрогранули гідратної або сольватної форми рифаксіміну β, як такої або в суміші з іншими формами рифаксіміну, дезінтегрантами, змащувачами та, необов'язково розріджувачами, барвниками, антиоксидантами та підсолоджувачами, розміщували в пристрій для виготовлення таблеток, вже відомий у рівні техніки, оснащений придатними формами для виготовлення таблеток бажаної конфігурації та розміру. Композиції у формі таблеток можна покривати сумішшю покриття, яка містить, наприклад, наступне: тальк, похідні целюлози, антиоксиданти, солі, барвники, ароматизатори. Згідно з переважним втіленням винаходу кількість дезінтегрантів у таблетках варіює, приблизно, у діапазоні 3 % − 8 % за масою; кількість змащувачів варіює, приблизно, в діапазоні 2 % − 3 % за масою, та кількість розріджувачів варіює, приблизно, в діапазоні 0 % − 10 % за масою таблетки. 9 UA 110212 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як установлено вище, можна формувати таблетки зі змінними кількостями гідратної або сольватної форми рифаксіміну β або в поєднанні з іншими формами рифаксіміну згідно із кількістю введеного рифаксіміну, який містять мікрогранули. У прикладах 2-9 описано кілька корисних композицій для отримання таблеток, які містять гастрорезистентні мікрогранули, які містять гідратну або сольватну форму рифаксіміну β, охарактеризовані тим, що вони мають кількість екстрагранулярних наповнювачів за масою меншу 20 %> маси таблетки. У прикладі 2 описано отримання таблеток, де дезагрегант, як-то, наприклад, натрій кроскармелоза, та змащувач, як-то, наприклад, магній стеарат, та розріджувач, як-то, наприклад, мікрокристалічна целюлоза, додавали до гастрорезистентних мікрогранул, які містять рифаксімін, отриманий як у прикладі 1, де сума компонентів менше 10 %> за масою таблетки. Отримання таблеток не видозмінює поліморфну форму рифаксіміну, який міститься в гастрорезистентних мікрогранулах, отриманих як у прикладі 1. Зокрема, у таблиці 5 надано точну композицію таблетки, яка містить 400 мг рифаксіміну, зроблену як описано в прикладі 2, яка містить ті самі пропорції гастрорезистентних мікрогранул та екстрагранулярних наповнювачів таблиці 4 та має покриття, де загальна маса менше 710 мг. У цьому конкретному втіленні винаходу отримані гастрорезистентні таблетки втримують форму рифаксіміну, який міститься в гастрорезистентних мікрогранулах, та мають величин твердості 198 н'ютонів, час дезінтеграції 8,5 хвилин та не є крихкими. У прикладі 3 описано отримання таблеток, де дезагрегант, у цьому прикладі − натрій крохмаль-гліколят, та змащувач, у цьому прикладі − магній стеарат, додавали до гастрорезистентних мікрогранул, які містять рифаксімін, отриманий як у прикладі 1, де сума двох компонентів менше 7 % за масою таблетки. У прикладі 4 описано отримання таблеток, де дезагрегант, у цьому прикладі − натрій крохмаль-гліколят, змащувач, у цьому прикладі − магній стеарат та розріджувач, у цьому прикладі − мікрокристалічна целюлоза, додавали до гастрорезистентних мікрогранул, які містять рифаксімін, отриманий як у прикладі 1, де сума компонентів менше 6 % за масою таблетки. У прикладі 5 описано отримання таблеток, які містять рифаксімін у мікрогранулах, отриманий як у прикладі 1, де дезагрегант, у цьому прикладі − натрій крохмаль-гліколят та змащувач, у цьому прикладі − магній стеарат, додавали до гастрорезистентних мікрогранул, які містять більшу кількість рифаксіміну ніж у прикладі 3, де сума двох компонентів менше 7 % за масою таблетки. У прикладі 6 описано отримання таблеток, де дезагрегант, у цьому прикладі − натрій крохмаль-гліколят, змащувач, у цьому прикладі − магній стеарат та розріджувач, у цьому прикладі − мікрокристалічна целюлоза, додавали до гастрорезистентних мікрогранул, які містять рифаксімін, отриманий як у прикладі 1, де сума екстрагранулярних наповнювачів менше 12 % за масою таблетки. У прикладі 7 описано отримання таблеток, де дезагреганти, у цьому прикладі − натрій крохмаль-гліколят, та змащувач, у цьому прикладі − магній стеарат, та суміш базових розріджувачів мікрокристалічної целюлози, додавали до гастрорезистентних мікрогранул, які містять рифаксімін, отриманий як у прикладі 1, де сума компонентів екстрагранулярних наповнювачів менше 16 % за масою таблетки. У прикладі 8 описано отримання таблеток, де дезагрегант, у цьому прикладі − натрій крохмаль-гліколят, та змащувач, у цьому прикладі − магній стеарат, та суміш базових розріджувачів мікрокристалічної целюлози додавали до гастрорезистентних мікрогранул, які містять рифаксімін, отриманий як у прикладі 1, де сума компонентів екстрагранулярних наповнювачів менше 17 % за масою таблетки. У прикладі 9 описано отримання таблеток, де дезагрегант, у цьому прикладі − натрій кроскармелоза, змащувач, у цьому прикладі − магній стеарат, та розріджувач, у цьому прикладі − мікрокристалічна целюлоза, додавали до гастрорезистентних мікрогранул, які містять рифаксімін, отриманий як у прикладі 1, де сума компонентів екстрагранулярних наповнювачів менше 12 % за масою таблетки. Таблетки можна отримувати у формах, які можна розділити до менших форм дозування, якто, наприклад, дві, три або чотири частини, де розділення далі дозволяє змінювати дозування без утрати гастрорезистентності. Таблетки винаходу є стабільними протягом періоду більшому 12 місяців при температурах 25 °C − 30 °C та протягом періоду більшому 6 місяців при 40 °C. Безпечність детермінації рифаксіміну в композиції у формі таблеток, отриманих як у прикладі 2, визначали як описано в прикладі 10, де 18 здорових добровольців отримували 10 UA 110212 C2 5 10 15 20 25 30 35 40 45 50 55 60 добове дозування рифаксіміну вище 1000 мг застосуванням таблеток рифаксіміну перед та після прийняття їжі. Отримані результати показують відсутність повідомлення щодо несприятливих наслідків стосовно застосування ліків або інших протипоказань до їх застосування. Безпечність рифаксіміну в композиції у формі таблеток, які містять рифаксімін, отриманий як у прикладі 2, у гастрорезистентних мікро гранулах, визначали також у пацієнтів, уражених запальною хворобою кишечнику, наприклад, хворобою Крона. зокрема, як описано в прикладі 10, 18 голодних пацієнтів з активною хворобою Крона застосовували дозування вище 1000 мг/добу таблеток рифаксіміну, отриманих як у прикладі 2. Отримані результати показують відсутність повідомлення щодо несприятливих наслідків стосовно застосування ліків або інших протипоказань до їх застосування. У прикладі 11 описано клінічний експеримент, де 402 пацієнтів, уражених запаленням кишечнику з величиною CDAI 220 − 400, лікували протягом 12 тижнів композицією винаходу у формі таблеток, які містять рифаксімін, отриманий як у прикладі 2, у порівнянні з плацебо. Пацієнтів клінічного експерименту розподіляли на чотири групи: Пацієнти групи А застосовували отриману як у прикладі 2 одну таблетку 400 мг рифаксіміну, розміщеного в гастрорезистентних мікрогранулах, двічі на добу для загального дозування 800 мг рифаксіміну; Пацієнти групи B: застосовували отримані як у прикладі 2 дві таблетки 400 мг рифаксіміну, розміщеного в гастрорезистентних мікро гранулах, 2 рази на добу для загального дозування 1600 мг рифаксіміну; Пацієнти групи C: застосовували отримані як у прикладі 2 три таблетки 400 мг рифаксіміну, розміщеного в гастрорезистентних мікрогранулах, 2 рази на добу для загального дозування 2400 мг рифаксіміну; Пацієнти групи D: 99 застосовували три таблетки плацебо 2 рази на добу. В усіх пацієнтів зберігали їх супутнє лікування, якщо його застосовували перед початком клінічного випробування. У таблиці 13 повідомлено результати клінічного експерименту в пацієнтів із хворобою Крона, до яких застосовували нову композицію у формі таблеток, описану в прикладі 2, при добовому дозуванні 800 мг/добу − 2400 мг/добу та плацебо. З повідомлених у таблиці 13 результатів видно, що, таблетки, які містять гастрорезистентні мікрогранули рифаксіміну, отриманого як у прикладі 2, є більш ефективними ніж плацебо. Як можна бачити з таблиці 13, у порівнянні із плацебо: більший процент пацієнтів мав клінічну ремісію в кінці лікування; більший процент пацієнтів мав клінічний відгук у кінці лікування; більший процент пацієнтів зберігав клінічний відгук після 12 тижнів після кінця лікування; кількість діб для отримання клінічної ремісії зменшували; та процент пацієнтів, які не реагували на клінічне лікування зменшували також. Визначення несприятливих результатів та побічних дій у пацієнтів, яких лікували таблетками, які містять гастрорезистентні мікрогранули рифаксіміну, отриманими як у прикладі 2, у порівнянні з пацієнтами, які отримували плацебо, описано в таблиці 14. Визначення показує відсутність будь-як різниці в кількості та жорсткості несприятливих результатів між кількома дозуваннями рифаксіміну в порівнянні із плацебо. Ці результати підтверджують, що таблетки, які містять гастрорезистентний рифаксімін, при добовому дозуванні 800 мг/добу − 2400 мг/добу є безпечними. У прикладі 12 описано клінічну ремісію хвороби Крона в пацієнтів із величинами реактивного білку C більшими 5 мг/л, які застосовували таблетки високих добових дозувань, які містять гастрорезистентні мікрогранули рифаксіміну, отриманого як у прикладі 2. У таблиці 15 повідомлено про вищий процент пацієнтів, які отримували клінічну ремісію в кінці лікування, які застосовували дозування більше 1600 мг/добу в порівнянні з пацієнтами, які застосовували плацебо або дозування менші 1600 мг/добу. У прикладі 13 описано визначення накопичення рифаксіміну в плазмі після повторних застосувань гастрорезистентних таблеток, які містять рифаксімін, отриманий як у прикладі 2, до 12 пацієнтів, уражених хвороба Крона від м'якої до помірної активності. Рифаксімін, отриманий як у прикладі 2 у формі гастрорезистентних таблеток, застосовували до пацієнтів у кількості 1200 мг 1 раз на добу; 1200 мг двічі на добу, протягом загального дозування 2400 мг/добу на 2, 3, 4, 5, 6 доби; та на 7-ому добу 1200 мг, для загального дозування 14400 мг рифаксіміну за сім діб. Величини концентрації плазми рифаксіміну при попередній дозі третьої та п'ятої діб зіставляли з концентраціями плазми при попередній дозі сьомої доби, що показало досягнення стійкого стану концентрації плазми рифаксіміну. 11 UA 110212 C2 5 10 15 20 25 30 35 40 45 50 55 Концентрації плазми рифаксіміну аналізували перед застосуванням першого дозування та до 24 год. застосування наступного дозування протягом першої доби лікування, та до 48 год. після останньої дози протягом сьомої доби лікування. Концентрації плазми також визначали перед застосуванням дозування на третю та п'яту добу. Визначали фармакокінетичні параметри, як-то максимальна концентрація плазми (Cмакс.), область під кривою концентрацій плазми (AUClast) та час досягнення максимальної концентрації (Tмакс.). У таблиці 16 повідомлено величини Cмакс., AUClast та Tмакс. після застосування рифаксіміну на першу та сьому добу. Результати показують, що рифаксімін є слабко абсорбованим у пацієнтів, уражених хворобою Крона від м'якої до помірної активності, та навіть наступне повторне застосування рифаксіміну, отриманого як у прикладі 2, при високих дозуваннях не призвело до його накопичення в плазмі. У прикладі 14 описано ефективність рифаксіміну у формі гастрорезистентних таблеток у пацієнтів, уражених хворобою Крона помірної активності без супутнього лікування, яких лікували дозуванням рифаксіміну, отриманого як у прикладі 2, що дорівнює 800, 1600 та 2400 мг/добу. Пацієнтів розподілено на чотири групи, де: Груп A: лікували одною 400 мг таблеткою рифаксіміну, отриманої як у прикладі 2, 2 рази на добу при загальному дозуванні 800 мг/добу; Група B: лікували двома 400 мг таблетками гастрорезистентного рифаксіміну, отриманими як у прикладі 2, два рази на добу при загальному дозуванні, яке дорівнює 1600 мг/добу; Група C: лікували трьома 400 мг таблетками рифаксіміну, отриманими як у прикладі 2, два рази на добу при загальному дозуванні, яке дорівнює 2400 мг/добу; Група D: лікували гастрорезистентними таблетками без рифаксіміну (плацебо). У таблиці 17 показано результати, де пацієнти, яких лікували гастрорезистентними таблетками рифаксіміну, отримували більшу клінічну ремісію ніж пацієнти, яких лікували плацебо. Конкретно, група пацієнтів, яких лікували дозуванням 1600 мг/добу рифаксіміну, отриманого як у прикладі 2, показала статистично важливу відмінність у швидкості клінічній ремісії в порівнянні із плацебо. Виразковий коліт та хворобу Крона асоційовано з підвищеним ризиком раку кишечнику (CRC). Окиснювальне навантаження внаслідок хронічного запалення, асоційованого з інтестинальною хворобою кишечнику, може бути одною із причин CRC у пацієнтів з IBD, як описано в Eaden et al. n Gut, 2001, 48, 526-35 та Roessner у Pathol. Res. Pract, 2008, 204, 511-24. Дослідження вмістів фекалій є безконтактним способом контролю мутагенних та генотоксичних субстанцій слизової оболонки ободової кишки. Гель-электрофорез одиничної клітини (Comet-аналіз) успішно застосовували в дослідженнях аліментарного втручання для контролю ураження ДНК в ободовій кишці клітинних ліній карциноми, як описано, наприклад, в Venturi et al. in Carcinogenesis 1997, 18, 2353-9 та Klinder у Nutr. Cancer 2007, 57, 158-67. У прикладі 15 описано дію лікування рифаксіміном на фекальну водну генотоксичність та ураження ДНК через Comet-аналіз та показано, що в пацієнтів, які отримували рифаксімін, отриманий як у прикладі 2, показано значне зменшення ниткового враження, спричиненого фекальною водою. У наступних прикладах описано отримання гастрорезистентних таблеток, які містять рифаксімін, отриманих як у прикладі 2, та їх застосування в лікуванні запальних хвороб кишечнику, та вони є подальшою ілюстрацією винаходу без будь-якого обмеження. Приклад 1 Отримання рифаксіміну в гастрорезистентних мікрогранулах В апарат із псевдозрідженим шаром, Glatt GPC 30, із системою Wurster, 18 дюймів, з 1,8 мм форсункою завантажували 25000 г порошку рифаксіміну та 125 г аеросилу Aerosil як розріджувачу. Одночасно в змішувачі при струшуванні отримували суспензію, застосовуючи 48107 г демінералізованої води, 9281 г співполімеру метакрилова кислота − етилакрилат, торгова марка − KOLLICOAT® MAE 100 P, 1392 г 1,2 пропандіолу, 2475 г тальку, 557 г титан діоксиду FU та 62 г ферум оксиду E 172. Тверді компоненти суспензії змішували до гомогенного стану в демінералізованій воді при високій швидкості гомогенізатора (Ultra Turrax). Отриману суспензію завантажували в апарат типу Wurster зі шланговим насосом та розпилювали при тиску 1,0 − 1,5 бар через форсунку 1,8 мм на суміш порошку рифаксіміну та аеросилу Aerosil 200, утримувану в суспензії в псевдозрідженому шарі потоком теплого повітря. Застосовані умови описано в таблиці 2: 12 UA 110212 C2 Таблиця 2 Параметри процесу Потік повітря, яке 3 входить (м /год.) Температура повітря, яке входить (°C) Температура продукту (°C) Тиск струменя (бар) (вихідна фаза) Швидкість струменя (г/хвил.) 5 Фаза попереднього нагрівання Застосування розчину покриття Висушування 400±100 550±100 350±50 60±2 60±10 70±2 32 25 − 27 30±2 1 − 1,5±0,1 150 − 200 Отримані мікрогранули піддавали гранулометричному аналізу за технологією Light Scattering technology, застосовуючи апаратуру Malvern Mastersizer 2000 apparatus, що дало наступне: більше 91 % мікрогранул мають розмір менше 300 мікронів. Композицію мікрогранул, які містять рифаксімін, описано в таблиці 3. Таблиця 3 Композиція Рифаксімін Силіцій оксид (Аеросил ® 200) Співполімер метакрилова кислота − етилакрилат 1:1 KOLLICOAT® MAE 100 P 1,2 пропандіол Тальк Титан діоксид FU Ферум оксид E 172 10 15 Кількість (грами) 25000 125 Кількість (%) 64,3 0,3 9281 23,9 1392 2475 557 62 3,6 6,4 1,4 0,2 Отримані мікрогранули аналізували дифракцією рентгенівських променів. Дифрактограми показують, що рифаксімін має характеристичні піки β-форми, які ідентифіковано у Crist. Eng. Comm. 10, 1074-1081 (2008 Приклад 2 Отримання таблеток, які містять рифаксімін у гастрорезистентних мікрогранулах, -Композиція 1Мікрогранули, які містять рифаксімін, отриманий як описано в прикладі 1, змішували із кроскармелозою (Ac-Di-Sol®) та мікрокристалічною целюлозою (Avicel PH 102®), попередньо просіяною на ситі 0,8 мм. Потім до отриманої суміші додавали магній стеарат. Отриману композицію описано в таблиці 4. Таблиця 4 Композиція Кількість (мг) Процент компоненту (п/п) Гастрорезистентні мікрогранули, отримані із прикладу 1 10000 90,3 Натрій кроскармелоза (Ac-Di-Sol®) 552 Мікрокристалічна целюлоза (Avicel PH 102®) Магній стеарат 384 138 5,0 3,5 1,2 20 Отриману гомогенну суміш розміщували в машину для таблетування, як-то Killian з угнутим шаблоном 10 мм. 13 UA 110212 C2 5 Тоді таблетки покривали плівкою, застосовуючи наступне: тальк, гідроксипропілметилцелюлоза, сіль натрій ЕДТА, 1,2-пропандіол, ферум оксид El 72. Таблетки нагрівали при температурі в діапазоні 41 °C − 43 °C теплим потоком повітря, та розпилювали плівкове покриття на таблетки. Загальна композиція таблеток, які містять 400 мг рифаксіміну, як описано в таблиці 5, при кінцевій масі мікрогранул 626 мг відповідають загальній масі таблетки 709 мг. Фармацевтична композиція, де рифаксімін є у формі таблеток, може містити різну кількість рифаксіміну 100 мг − 800 мг, доданого до мікрогранул, які містять відповідну бажану кількість рифаксіміну, меншу або більшу кількість розріджувачів, дезінтегрантів та змащувачів. 10 Таблиця 5 Композиція Мікрогранули Рифаксімін Колоїдний безводний силіцій оксид (Аеросил ® 200 Pharma) Співполімер метакрилова кислота − етилакрилат KOLLICOAT® MAE 100 P 1,2 пропандіол Тальк Титан діоксид Таблетка Натрій кроскармелоза (Ac-DiSol®) Мікрокристалічна целюлоза (Avicel PH 102®) Магній стеарат Плівкове покриття Гідроксипропілметилцелюлоза Титан діоксид 1,2 пропандіол ЕДТА Ферум оксид E 172 15 20 25 30 Маса (мг) %(п/п) 400,0 56,4 2,0 0,3 148,5 20,9 22,3 39,6 9,9 3,1 5,6 1,4 34,5 4,9 24,0 3,4 8,6 1,2 14,1 4,1 0,1 1,4 0,4 2,0 0,6 0,01 0,2 0,06 Аналіз отриманих таблеток дифракцією рентгенівських променів показав, що форма рифаксіміну зберігається незмінною. Період розпаду таблеток отримували вимірюванням розпаду 8 таблеток в 800 мл демінералізованої води при температурі 37 °C ± 1 °C у дезінтеграторі. Середня величина дорівнює 8,5 хвилинам. Величину крихкості таблеток отримували як описано в European Pharmacopea Ed. 6,6. стор. 5100. Десять таблеток розміщували в пластмасовий циліндр, де їх піддавали обертанню та повторним струшуванням. Через десять хвилин таблетки зважували. Величину маси відображали в процентах. Втрата маси дорівнювала 0,1 %. Твердість таблеток визначали як описано в European Pharmacopea Ed. 6,0. стор. 279. Десять таблеток розміщували в апараті, як-то ERWEKA TBH-320D. Отримана середня величина твердості була 198 н'ютонів. Приклад 3 Отримання таблеток, які містять рифаксімін у гастрорезистентних мікрогранулах -Композиція 2Суміш для отримання гастрорезистентних таблеток отримували змішуванням 65,15 г гастрорезистентних мікрогранул рифаксіміну, отриманих як описано в прикладі 1, які містять 40 г рифаксіміну, та 4,15 г натрій крохмаль-гліколяту, попередньо просіяному на ситі 0,8 мм. До отриманої суміші додавали 0,7 г магній стеарату. Композиції надано в таблиці 6. 14 UA 110212 C2 Таблиця 6 Композиція Гастрорезистентні мікрогранули рифаксіміну, отримані як у прикладі 1 Крохмаль натрій гліколят ®) (Explotab Магній стеарат Кількість (г) Композиція % (п/п) 65,15 93,1 % 4,15 5,95 % 0,7 1% Отриману суміш розміщували в машину для таблетування, як-то Killian, описану в прикладі 2. 5 10 Приклад 4 Отримання таблеток, які містять рифаксімін у гастрорезистентних мікрогранулах -Композиція 3Суміш для отримання гастрорезистентних таблеток отримували змішуванням 297,78 г мікрогранул гастрорезистентного рифаксіміну, отриманого як описано в прикладі 1, та які містять 180,47 г рифаксіміну, 11,28 г крохмаль натрій гліколяту, 4,51 г мікрокристалічної целюлози (Avicel PH 120®), попередньо просіяної на ситі 0,8 мм. До отриманої суміші додавали магній стеарат (2,26 г). Композицію описано в таблиці 7. Таблиця 7 Композиція Гастрорезистентні мікрогранули, отримані як у прикладі 1 Крохмаль натрій гліколят ®) (Explotab Мікрокристалічна целюлоза (Avicel PH 102®) Магній стеарат 15 20 Кількість (г) Композиція % (п/п) 297,78 94,3 % 11,28 3,6 % 4,51 1,4 % 2,26 0,7 % Отриману суміш розміщували в апараті для таблетування, як-то Killian, як описано в прикладі 2. Приклад 5 Отримання таблеток, які містять рифаксімін у гастрорезистентних мікрогранулах -Композиція 4Суміш для отримання гастрорезистентних таблеток отримували змішуванням 279,78 г гастрорезистентних мікрогранул рифаксіміну, отриманих як описано в прикладі 1, які містять 180,47 г рифаксіміну, та 18,86 г натрій крохмаль-гліколяту попередньо просіяних на ситі 0,8 мм. Магній стеарат (1,35 г) додавали до отриманої суміші. Композицію описано в таблиці 8. Таблиця 8 Композиція Гастрорезистентні мікрогранули, отримані як у прикладі 1 Крохмаль натрій гліколят ®) (Explotab Магній стеарат Кількість (г) Композиція % (п/п) 279,79 94,3 % 18,86 6,3 % 1,35 0,45 % 25 30 Отриману суміш розміщували в апараті для таблетування, як-то Killian, як описано в прикладі 2. Приклад 6 Отримання таблеток, які містять рифаксімін у гастрорезистентних мікрогранулах -Композиція 5 15 UA 110212 C2 5 Суміш для отримання гастрорезистентних таблеток отримували змішуванням 231,0 г гастрорезистентних мікрогранул, отриманих як описано в прикладі 1, які містять 139,3 г рифаксіміну, 15,6 натрій крохмаль-гліколяту та 13 г мікрокристалічної целюлози (Avicel PH 102®), попередньо просіяної на ситі 0,8 мм. Магній стеарат (1,0 г) додавали до отриманої суміші. Композицію описано в таблиці 9. Таблиця 9 Композиція Гастрорезистентні мікрогранули, отримані як у прикладі 1 Крохмаль натрій гліколят ®) (Explotab Мікрокристалічна целюлоза (Avicel PH 102®) Магній стеарат 10 15 Кількість (г) Композиція % (п/п) 231,00 88,64 % 15,60 5,99 % 13,00 4,99 % 1,00 0,38 % Отриману суміш таблетували, застосовуючи апарат для таблетування, як-то Killian, як описано в прикладі 2. Приклад 7 Отримання таблеток, які містять рифаксімін у гастрорезистентних мікрогранулах -Композиція 6Суміш для отримання гастрорезистентних таблеток отримували змішуванням 207,9 г мікрогранул гастрорезистентного рифаксіміну, отриманого як описано в прикладі 1, які містять 117,3 г рифаксіміну, 14,1 г натрій крохмаль-гліколяту, суміш мікрокристалічної целюлози, яка складається з 11,7 г Avicel PH 102® та 12,3 г Avicel PHlOl®, попередньо просіяної на ситі 0,8 мм, та 1,0 г магній стеарату додавали до отриманої суміші. Композицію описано в таблиці 10. Таблиця 10 Композиція Гастрорезистентні мікрогранули, отримані як у прикладі 1 Крохмаль натрій гліколят ®) (Explotab Мікрокристалічна целюлоза (Avicel PH 101®) Мікрокристалічна целюлоза (Avicel PH 102®) Магній стеарат 20 25 Кількість (г) Композиція % (п/п) 207,90 84,20 % 14,10 5,71 % 11,70 4,74 % 12,30 4,98 % 0,90 0,36 % Отриману суміш таблетували в апараті для таблетування, як-то Killian, як описано в прикладі 2. Приклад 8 Отримання таблеток, які містять рифаксімін у гастрорезистентних мікрогранулах Композиція 7Суміш для отримання гастрорезистентних таблеток отримували змішуванням 207,9 г гастрорезистентних мікрогранул рифаксіміну, отриманих як описано в прикладі 1, які містять 117,3 г рифаксіміну, 14,1 г натрій крохмаль-гліколяту, суміш мікрокристалічної целюлози, яка складається з 11,7 г Avicel PH 102® та 12,3 г Avicel PHlOl®, попередньо просіяної на ситі 0,8 мм, та 1,0 г магній стеарату додавали до отриманої суміші. Композицію описано в таблиці 11. 30 16 UA 110212 C2 Таблиця 11 Композиція Гастрорезистентні мікрогранули, отримані як у прикладі 1 Крохмаль натрій гліколят ®) (Explotab Магній стеарат Мікрокристалічна целюлоза (Avicel PH 102®) Мікрокристалічна целюлоза (Avicel PH 101®) 5 10 Кількість (г) Композиція % (п/п) 207,90 83,78 % 14,10 5,68 % 2,15 0,87 % 11,70 4,71 12,30 4,96 % Отриману суміш таблетували, застосовуючи апарат для таблетування, як-то Killian, як описано в приклад 2. Приклад 9 Отримання таблеток, які містять рифаксімін у гастрорезистентних мікрогранулах -Композиція 8Суміш для отримання гастрорезистентних таблеток отримували змішуванням 200,9 г гастрорезистентних мікрогранул рифаксіміну, отриманих як описано в прикладі 1 та, які містять 113,3 г рифаксіміну, 1 1,3 г натрій кроскармелози (Ac-Di-Sol®.) та 11,3 г мікрокристалічної целюлози (Avicel PH 101), попередньо просіяної на ситі 0,8 мм. Магній стеарат 2,30 г додавали до отриманої суміші. Композицію описано в таблиці 12. Таблиця 12 Композиція Гастрорезистентні мікрогранули, отримані як у прикладі 1 Натрій кроскармелоза (Ac-DiSol®) Мікрокристалічна целюлоза (Avicel PH 101®) Магній стеарат 15 20 25 30 35 Кількість (г) Композиція % (п/п) 200,0 88,93 % 11,30 5,02 % 11,30 5,02 % 2,30 1,02 % Приклад 10 Визначення безпечності таблеток, які містять гастрорезистентні мікрогранули, які містять рифаксімін, у здорових добровольців та в пацієнтів, уражених хворобою Крона Безпечність композиції визначали оцінкою перед та після застосування ліків долі шкідливих дій, життєвих параметрів, як-то кров'яний тиск, серцевий ритм, температура тіла, визначених за допомогою інструментів, як-то електрокардіограма, та лабораторний аналіз, як-то кров та аналіз сечі. Три таблетки, які містять 400 мг рифаксіміну, отриманого як у прикладі 2, загальної кількості 1200 мг/добу рифаксіміну застосовували при умовах голодування та харчування до 18 здорових добровольців (9 чоловіків та 9 жінок) у кросоверному дослідженні з інтервал 8 діб між застосуванням в умові голодування та харчування. У дослідженні повідомлено про чотири несприятливих випадки. В усіх випадках був помірний головний біль, який не стосувався застосування ліків. Після застосування ліків не виявлено зміни життєвих параметрів, як-то кров'яний тиск, серцевий ритм та біохімічний аналіз крові та аналіз сечі. Безпечність фармацевтичної композиції в таблетках, які описано в прикладі 2, визначали в пацієнтів, уражених запальною хворобою кишечнику, як, наприклад, хвороба Крона. 18 пацієнтів, уражених помірно активною хворобою Крона, застосовували три таблетки рифаксіміну 400 мг, отриманого як у прикладі 2, при загальній кількості 1200 мг/добу. Безпечність визначали перед та після застосування ліків вимірюванням долі шкідливих дій на життєві параметри, як-то кров'яний тиск, серцевий ритм, температура тіла, та визначенням 17 UA 110212 C2 5 10 15 20 25 30 35 40 45 50 за допомогою інструментів, як-то електрокардіограма та лабораторний аналіз, як-то аналіз крові та сечі. Протягом дослідження зареєстрували тільки один несприятливий результат (анемію), який, як уважають дослідники, не стосувався ліків. Показано відсутність зміни стосовно біохімічного аналізу крові та сечі після застосування ліків. До того ж, не спостерігали значних змін життєвих параметрів. З усіх цих результатів випливає, що ліки, отримані як у прикладі 2 є добре терпимими. Приклад 11 Лікування пацієнтів із хворобою Крона таблетками, які містять рифаксімін у гастрорезистентних мікрогранулах Композицію у формі таблеток, які містять гастрорезистентні мікрогранули рифаксіміну, отриманих як у прикладі 2, застосовували в багатоцентровому подвійному сліпому рандомізованому дослідженні в порівнянні із плацебо до пацієнтів, уражених хворобою Крона. До випробування залучено 410 пацієнтів, уражених хворобою Крона від середньої до помірної активності, яка має величину CDAI між 220 − 400. Вісім пацієнтів не отримували будьякого лікування. Первинну кінцеву точку клінічного експерименту, яка відображала ефективність рифаксіміну індукувати клінічну ремісію, охарактеризовано величиною CDAI нижчою 150. Кінцеві точки клінічного експерименту, які також продемонстрували ефективність рифаксіміну індукувати клінічний відгук, визначено як зниження величини CDAI, принаймні, у 100 точок стосовно основної величини; та демонстрували збереження спричиненої лікуванням рифаксіміном клінічної ремісії протягом 12 тижнів після зупинки лікування. Недостатність лікування визначили, як відсутність зменшення величини CDAI, принаймні, в 70 точках після одного місяця лікування; або збільшення величин CDAI в 100 точках протягом лікування; або потребою хірургічного втручання, або рятувального лікування, або підвищення дозування супутнього лікування. Пацієнтів розподіляли на чотири групи: Група A: 101 пацієнт застосовували одну таблетку рифаксіміну 400 мг, отриману як у прикладі 2, розміщеного в гастрорезистентних мікрогранулах та дві таблетки плацебо двічі на добу для загального дозування 800 мг рифаксіміну; Група B: 104 пацієнти застосовували дві таблетки рифаксіміну 400 мг, отримані як у прикладі 2, розміщеного в гастрорезистентних мікрогранулах, та одну таблетку плацебо двічі на добу для загального дозування 1600 мг рифаксіміну; Група C: 98 пацієнтів застосовували три таблетки рифаксіміну 400 мг, отримані як у прикладі 2, розміщеного в гастрорезистентних мікрогранулах двічі на добу для загального дозування 2400 мг рифаксіміну; Група D: 99 пацієнтів застосовували три таблетки плацебо двічі на добу. Усіх пацієнтів лікували протягом 12 тижнів. Протягом клінічного експерименту пацієнти могли продовжувати отримувати супутнє лікування, як-то 5-ASA та/або імунодепресант (азатіоприн, метотрексат, 6-меркаптопурин, т.д.) за умови, якщо вони його застосовували при стабільному дозуванні протягом трьох місяців перед початком клінічного експерименту та протягом усього періоду клінічного випробування Для визначення довжини ремісії після завершення лікування стежили за пацієнтами, які отримали клінічну ремісію від лікування, протягом подальших 12 тижнів. Профіль безпечності застосованого лікування оцінювали аналізом несприятливих результатів; лабораторним аналізом крові та сечі та основних показників стану організму, як-то кров'яний тиск, температура та серцевий ритм. Результати клінічного експерименту, повідомлені в таблиці 13, показують, що таблетки, отримані як у прикладі 2, та які містять гастрорезистентну мікрогранулу рифаксіміну, отриману як у прикладі 1, при добовому дозуванні 800 мг/добу − 2400 мг/добу є більш ефективними ніж плацебо в показниках клінічної ремісії, клінічного відгуку, і швидкості лікування ураження та проценту пацієнтів, які зберігали ремісію протягом 12 тижнів після кінця лікування. Крім того, середній час до ремісії дорівнював 47 діб у пацієнтів, які отримували плацебо, 35 діб для пацієнтів, які застосовували рифаксімін-EIR 400 мг двічі за добу, 27 діб для тих, які отримували рфаксімін-EIR 800 мг двічі за добу, та 38 діб із рифаксіміном-EIR 1200 мг двічі за добу. 55 18 UA 110212 C2 Таблиця 13 Рифаксімін (Таблетки, приклад 2) 800 мг/добу Рифаксімін (Таблетки, приклад 2) 1600 мг/добу Рифаксімін (Таблетки, приклад 2) 2400 мг/добу Рифаксімін (Таблетки, приклад 2) Сумарні дози 42,6 % (43/101) 53,8 % (56/104) 62,2 %* (61,98) 47,5 % (47/99) 54,5 % (104\301) 55,9 % (52,93) 62,8 % (59,94) 72,0 %* (67,93) 57,5 % (50,87) 64,2 % (176/274) 28,6 % (28/98) 38,3 % (39/102) 44,9 %* (40/89) 31,9 % (30/94) 38»% (109,285) 47 діб 35 діб 27 діб 38 діб 33 доби 44,6 % (45/101) 38,5 % (40/104) 25,5 %* (25/98) 38,4 % (38/99) 34,2 % (103/301) Плацебо Клінічна ремісія кінця лікування (EOT) Клінічний відгук EOT Збереження клінічної ремісії через 12 тижнів після кінця лікування Час для отримання клінічної ремісії Швидкість лікування ураження (*) п 5 мг/л Клінічна ремісія EOT у пацієнтів з недавнім діагнозом CD Клінічна ремісія EOT у пацієнтів з CD, локалізованим у клубовій-ободовій кишці та ободовій кишці 5 10 15 20 25 Приклад 13 Визначення накопичення в плазмі після застосування в повторних дозах Композицію у формі таблеток, які містять гастрорезистентні мікрогранули рифаксіміну, отримані як у прикладі 2, застосовували з повторними дозами до 12 пацієнтів віком 18 − 75, уражених хворобою Крона від середньої до помірної активності, локалізованою в клубовій та/або ободовій кишці, для оцінки накопичення рифаксіміну у плазмі. Гастрорезистентні таблетки, які містять рифаксімін, отримані як у прикладі 2, застосовували до пацієнтів при дозуванні 1200 мг один раз на добу 1; 1200 мг двічі на добу (вранці та ввечері), при загальному дозуванні 2400 мг/добу, на доби − 2, 3, 4, 5, 6; та 1200 мг − на 7 добу, при загальному дозуванні 14400 мг рифаксіміну за сім діб. Концентрації рифаксіміну в плазмі визначали: перша доба перед та при 1, 2, 4, 8, 12 та 24 годині від першого застосування; третя та п'ята доба перед першим застосуванням; сьома доба перед першим застосуванням та при 1, 2, 4, 8, 12, 24 та 48 годині від останнього застосування. Наступні фармакокінетичні параметри визначали: максимальну концентрацію рифаксіміну в плазмі (Cмакс.), область під кривою концентрацій рифаксіміну в плазмі в порівнянні з часом від 0 до 24 год. (AUC0-24 год.) та час досягнення максимальної концентрацій рифаксіміну в плазмі (Tмакс.). Концентрації рифаксіміну в плазмі перед дозою на 3 добу та 5 добу зіставляли з концентрацією в плазмі перед дозою на 7 добу, це показало, що стійкого стану концентрацій рифаксіміну в плазмі досягали на 3 добу. Визначення рифаксіміну робили аналізом ВЕРХ, поєднаним із мас-спектрометром. Результати повідомлено в таблиці 16. 20 UA 110212 C2 Таблиця 16 Смакс (нг/мл) AUC0-24 год. Tмакс 7,8 34,6 1,5 6,1 41,8 3,1 Доба 1, застосування рифаксіміну натще до 12 пацієнтів, уражених хворобою Крона від середньої до помірної активності Доба 7, застосування рифаксіміну натще до 12 пацієнтів, уражених хворобою Крона від середньої до помірної активності, повзуча доза 1200 мг двічі на добу 5 10 15 20 Раніше припинена Pt 007/007 на добу 1 внаслідок AE не стосувалася дослідження ліків; Pt 011/010 виключили з аналізу внаслідок відхилення головного протоколу (рифаксімін у зразках перед дозою) Приклад 14 Визначення ефективності рифаксіміну у формі гастрорезистентних таблеток у пацієнтів, уражених хворобою Крона, у гострій – м'якій до помірної, без будь-якого супутнього лікування Ефективність рифаксіміну у формі гастрорезистентних таблеток отриманих як у прикладі 2, застосованих при добових дозах 800, 1600 та 2400 мг/добу, визначали в пацієнтів, уражених хворобою Крона помірної активності, які не отримували будь-якого супутнього лікування, як-то імунодепресивне та/або 5-аміносаліцилати, за три місяці перед лікуванням та протягом період лікування рифаксіміном. Пацієнтів розподілено на чотири групи де: Група A: лікували одною таблеткою 400 мг рифаксіміну, отриманою як у прикладі 2, застосованою двічі на добу при загальному дозуванні 800 мг/добу; Група B: лікували двома гастрорезистентними таблетками рифаксіміну 400 мг, отриманими як у прикладі 2, застосованими двічі на добу, при загальному дозуванні 1600 мг/добу; Група C: лікували трьома гастрорезистентними таблетками рифаксіміну 400 мг 400 мг, отриманими як у прикладі 2, застосованими двічі на добу, при загальному дозуванні 2400 мг/добу; Група D: лікували плацебо, як таким. Результати повідомлено в таблиці 17. Таблиця 17 Плацебо N % P 8/27 29,6 Рифаксімін Рифаксімін Рифаксімін (Таблетки, приклад (Таблетки, приклад (Таблетки, приклад 2) 2) 2) 800 мг/добу 1600 мг/добу 2400 мг/добу 13/27 17/28 18/34 48,1 60,7 53,9 0,1628 0,0206 0,0674 25 30 Приклад 15 Визначення дії рифаксімінової терапії на генотоксичність фекальної води та ураження ДНК способом Comet-аналізу Ефект рифаксімінової терапії на генотоксичність фекальної води та ураження ДНК аналізували способом Comet-аналізу, як-то гель-электрофорез-аналіз одиничного розриву ланцюгу одиничної клітини (Comet-аналіз), який є чутливим способом виявлення ураження ДНК. Він охоплює інкапсуляцію клітин у суспензії низькоплавкої агарози, лізис клітин у нейтральних або лужних умовах, та електрофорез суспендованих підданих лізису клітин. Потім − візуальний 21 UA 110212 C2 5 10 15 20 25 30 35 40 45 аналіз з фарбуванням ДНК та розрахунок флуоресценції для визначення ступеню ураження ДНК.) Одинадцять пацієнтів з активною хворобою Крона з CDAI, складеним між 150 та 400, лікували протягом 7 діб рифаксіміном 800 мг у таблетках, отриманих як у прикладі 2, три рази на добу, що відповідає загальній кількості рифаксіміну 2400 мг/добу. Фекальні зразки збирали в пацієнтів перед та після рифаксімінової терапії, та екстрагували фекальну воду. Іморталізовані фібробласти щура піддавали зразкам фекальної води при концентрації 1 % за масою, збирали до та після семи діб терапії рифаксіміном. Стисло, суспензії клітин (1,0 × 105 клітин/100 мкл) у MEM інкубували в трубках еппендорфа протягом 30 хвил. при 37 °C у присутності зразків фекальної води (1 %). Потім клітини переносили на лід, та життєздатність аналізували до та після інкубування витисненням трипановим синім. Для позитивного та негативного контролю, відповідно, застосовували обробку 100 мМ H2О2 або PBS. Клітини по 100 г центрифугували при 4 °C протягом 5 хвил., надосадну рідину відкидали та клітини ресуспендували в низькоплавкій агарозі (1,0 × 104 клітин/100 мкл 0,5 % низькоплавкої агарози в PBS) та негайно наносили піпеткою на покриті агарозою предметні скельця (1,5 % у PBS, які містять 5 мМ ЕДТА). Потім клітини покривали шаром агарози (0,5 % у PBS) та дозволяли коротко гуснути. Скельця занурювали в охолоджений льодом розчин для лізису (2,5M NaCl, 100 мМ ЕДТА, 10 мМ Tris, 1 % саркозил, 10 % диметилсульфоксид та 1 % Triton X-100 (pH 10,0)) протягом 60 хвил. при 4 °C. Потім їх переносили в електрофоретичну кювету з лужним буфером (0,3 N NaOH, 1 мМ ЕДТА) та дозволяли врівноважуватися протягом 20 хвил. при кімнатній температурі перед електрофорезом, який робили при 300 мA протягом 20 хвил. у тому ж буфері. Потім скельця промивали, морили протягом 5 хвил. 2 мг/мл етидіум бромідом (EB) та аналізували за допомогою флуоресцентного мікроскопу Eclipse E600 (Nikon Corporation, Tokyo, Japan). Зображення отримували камерою, з'єднаною з комп'ютером, та аналізували, застосовуючи програму Image-Pro Plus 4,1. Також це застосовували для визначення залежності між міграцією нуклеарного генетичного матеріалу, або 'голови' комети та отриманим 'хвостом'. Ураження ДНК, представлені як 'момент хвоста', який бере до уваги кількості ДНК, присутньої у хвості, та ступінь міграції генетичного матеріалу (довжина хвоста). Момент хвоста визначали як: TM=I*L, де I − фракційна кількість ДНК у comet-хвості, та L − повна довжина comet-хвоста від центру comet-голови до кінця хвоста. Величина моменту хвоста для негативних контролів з PBS розміщували при 100. Усі експерименти робили повторювали тричі та результати надавали як % ± SD у порівнянні з негативним контролем. Величина позитивного контролю (гідроген пероксид 100 мМ) дорівнювала 420±92, та окремі дані повідомлено в таблиці 1. У семи пацієнтів (пацієнти No. 1, 2, 3, 4, 6, 10) спостерігали значне зменшення розрив ланцюгу ДНК, спричинене фекальною водою, після терапії рифаксіміном. Не спостерігали відмінностей у пацієнтів 5 та 11, оскільки перед терапією не спостерігали генотоксичності (вихідна величин подібна негативному контролю), а в інших двох пацієнтів (8, 9) рифаксімін не індукував будь-якого зменшення розриву ланцюгу ДНК, спричиненого фекальною водою: величини були високими при добі 0 та при добі 7, у кінці лікування. Таблиця 18 Визначення розриву ланцюгу ДНК, спричиненого зразками фекальної води, зібраної перед та після семи діб терапії рифаксіміном Негативний контроль 100 Позитивний контроль (гідроген пероксид 100 мМ) 420±92 Пацієнт 1 2 3 4 5 6 8 9 10 11 Доба 0 Доба 7 280+52 360+68 260+66 240±34 122+26 248±52 268±47 268±47 264±46 130+56 120±30 147±42 126±24 124±38 120±28 154±56 300±64 300±64 146±44 132±26 22 UA 110212 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 1. Спосіб лікування інфекційної та/або запальної хвороби кишечнику, за яким пацієнту, що цього потребує, вводять фармацевтичну композицію, яка знаходиться у формі таблеток, що містить гідратну або сольватну форму рифаксиміну β в гастрорезистентних мікрогранулах у кількості 100-800 мг. 2. Спосіб лікування інфекційної та/або запальної хвороби кишечнику за п. 1, де інфекційну та/або запальну хворобу кишечнику вибрано з наступного: діарейні синдроми, пронос мандрівників, діареї, спричинені зміненою рівновагою бактеріальної флори кишечнику, хвороба Крона, ентерит, виразковий ректоколіт, синдром подразненого кишечнику, бактеріальне розростання в тонкій кишці, дивертикулярна хвороба, гіперамоніємія, антибактеріальна профілактика перед та після хірургічного втручання, печінкова енцефалопатія, обумовлена стресом хвороба, інтерстиціальний коліт, бактеріальний перитоніт, інфекції, спричинені постійним застосуванням інгібіторів протонного насоса. 3. Спосіб лікування інфекційної та/або запальної хвороби кишечнику за п. 2, де запальна хвороба кишечнику є хворобою Крона. 4. Спосіб лікування інфекційної та/або запальної хвороби кишечнику за п. 3, де фармацевтична композиція містить гідратну або сольватну форму рифаксиміну β. 5. Спосіб лікування інфекційної та/або запальної хвороби кишечнику за п. 4, де фармацевтичну композицію вводять в кількості 800 мг-2400 мг щодобово. 6. Спосіб лікування інфекційної та/або запальної хвороби кишечнику за п. 5, де період лікування для клінічної ремісії складає 10-12 тижнів. 7. Спосіб лікування інфекційної та/або запальної хвороби кишечнику за п. 1 без супутнього лікування. 25 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 23
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of treatment infectious and / or inflammatory bowel disease pharmaceutical composition comprising rifaximin b
Автори англійськоюGiuseppe Claudio, Viscomi, Paola, Maffei, Giuseppe, Bottoni, Maria, Grimaldi
Назва патенту російськоюСпособ лечения инфекционного и / или воспалительного заболевания кишечника фармацевтической композицией, содержей рифаксимин b
Автори російськоюДжузеппе Клаудио Вискоми, Паола Маффей, Джузэппэ Боттони, Мария Гримальди
МПК / Мітки
МПК: A61K 9/16, A61P 31/00, A61K 9/20, A61K 31/44
Мітки: містить, інфекційної, хвороби, кишечнику, запальної, фармацевтичною, рифаксимін, яка, спосіб, лікування, композицією
Код посилання
<a href="https://ua.patents.su/25-110212-sposib-likuvannya-infekcijjno-ta-abo-zapalno-khvorobi-kishechniku-farmacevtichnoyu-kompoziciehyu-yaka-mistit-rifaksimin-b.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування інфекційної та/або запальної хвороби кишечнику фармацевтичною композицією, яка містить рифаксимін b</a>
Попередній патент: Нові склади 14-eпi-аналогів вітаміну d
Наступний патент: Застосування сигма-лігандів при індукованій опіоїдами гіпералгезії
Випадковий патент: Занурювальний моноблочний насос