Виділене антитіло, яке зв’язується з her-3, та його застосування
Номер патенту: 97473
Опубліковано: 27.02.2012
Автори: Радінскій Боб, Фріман Дан, Боргез Ерік, Тредер Мартін, Роте Майк, Хартманн Сузанн
Формула / Реферат
1. Виділений зв'язувальний білок, який зв'язується з HER-3, який містить:
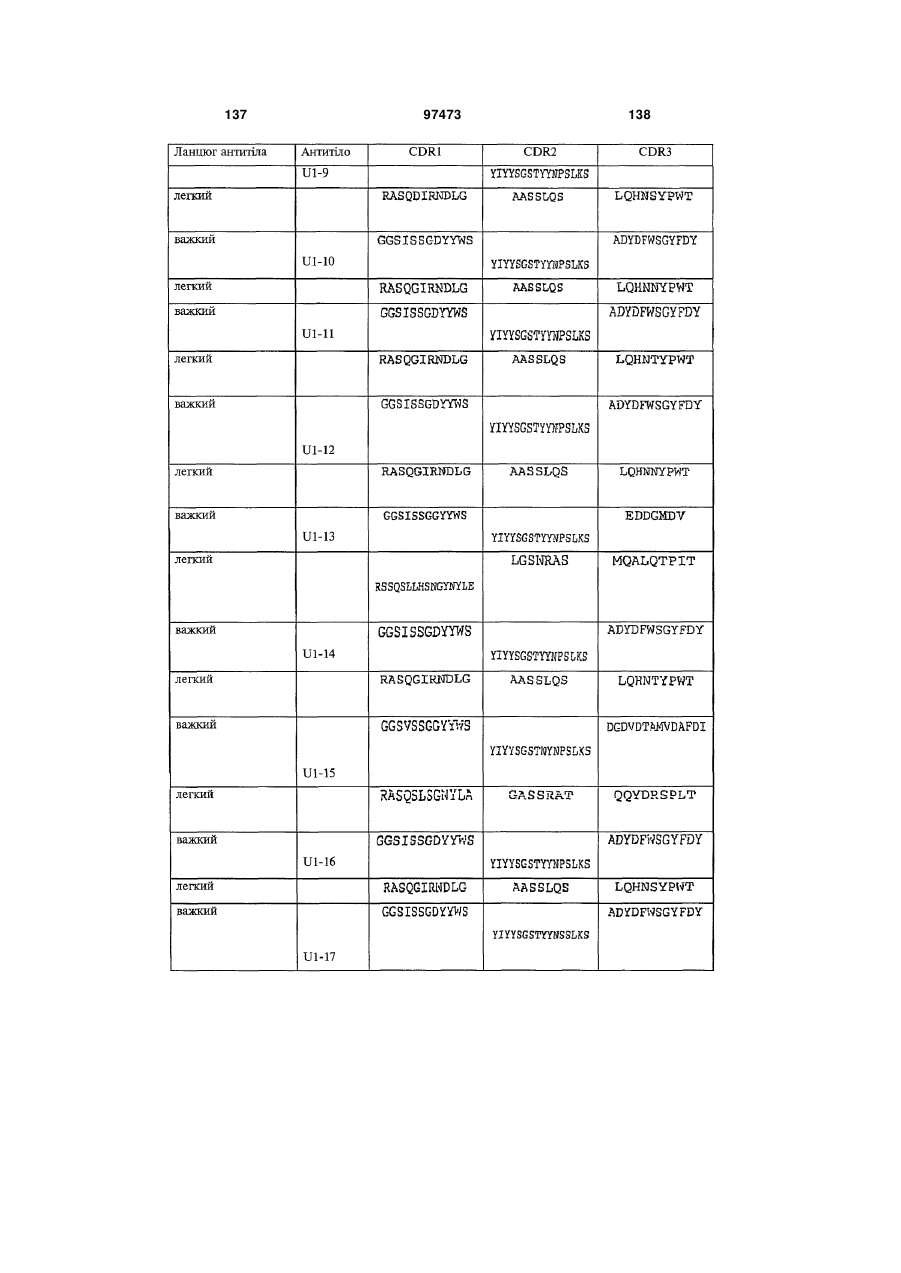
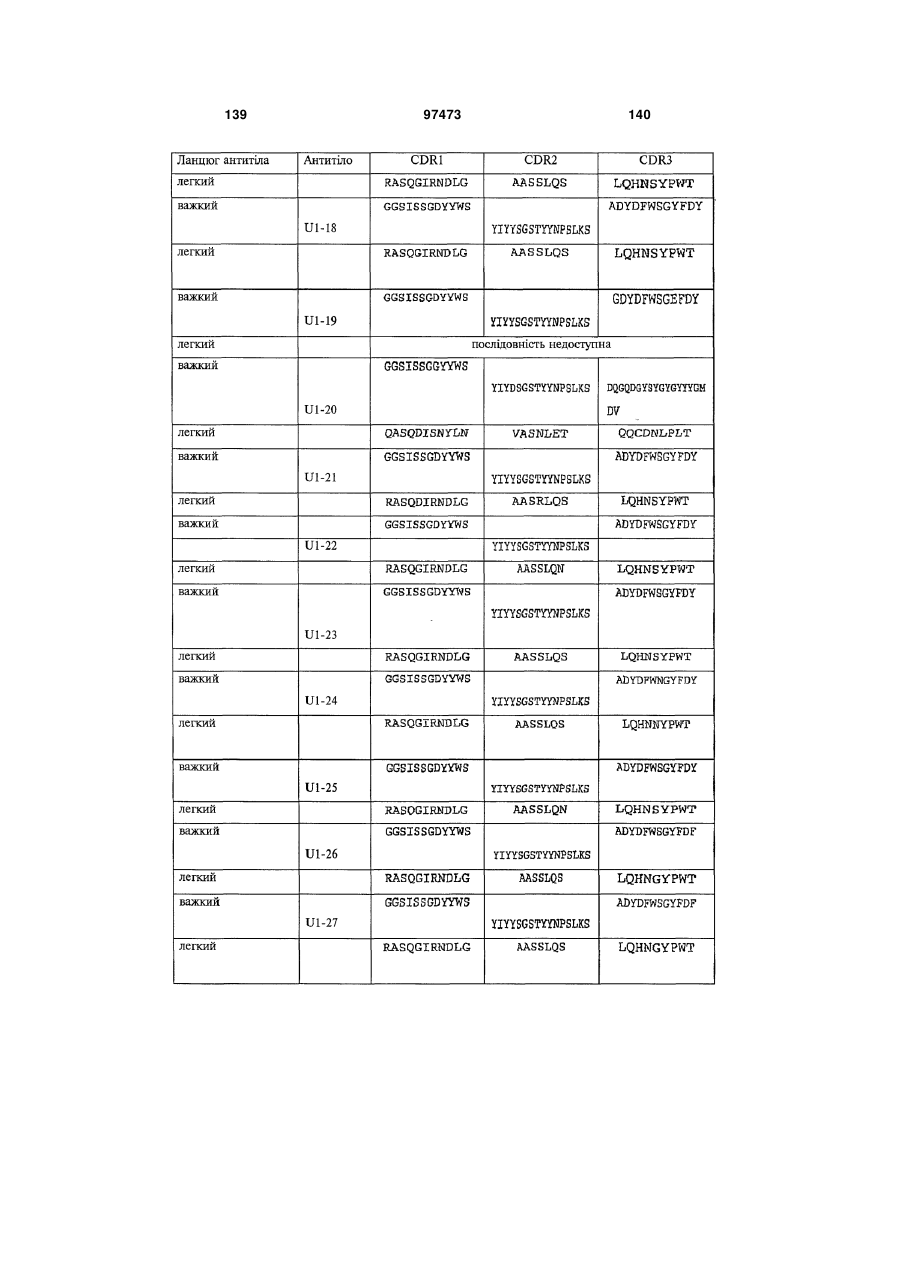
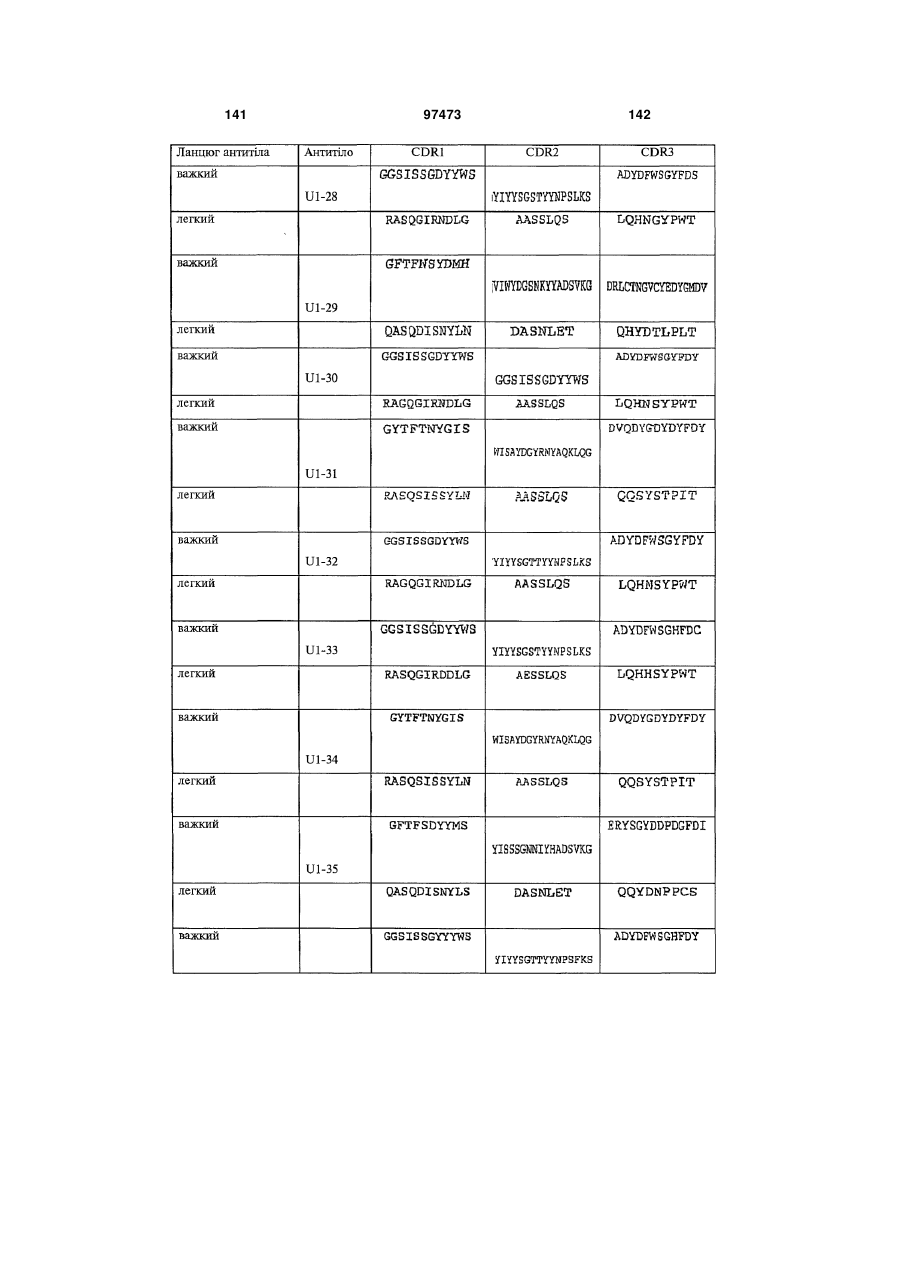
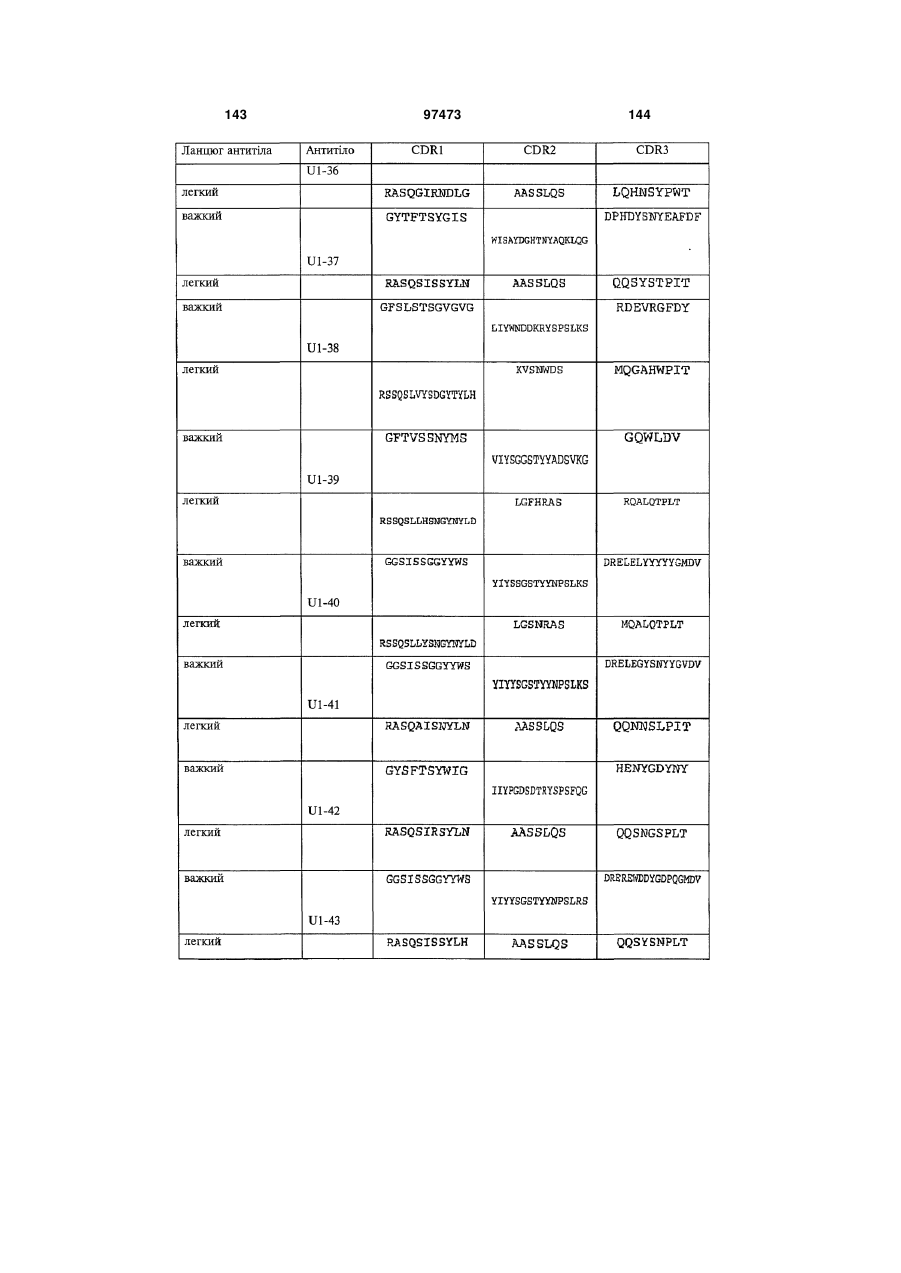
амінокислотну послідовність важкого ланцюга, яка містить щонайменше одну з гіперваріабельних ділянок (CDR), вибрану з групи, до складу якої входять: (a) CDRH1, представлені ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 46, 50, 60, 62, 66, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230; (b) CDRH2, представлені ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 46, 50, 60, 62, 66, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230; і (с) CDRH3, представлені ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 46, 50, 60, 62, 66, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230.
2. Виділений зв'язувальний білок, який зв'язується з HER-3, який містить:
амінокислотну послідовність легкого ланцюга, яка містить щонайменше одну з гіперваріабельних ділянок (CDR), вибрану з групи, до складу якої входять: (d) CDRL1, представлені ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 48, 52, 58, 64, 68, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232; (e) CDRL2, представлені ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 48, 52, 58, 64, 68, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232; і (f) CDRL3, представлені ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 48, 52, 58, 64, 68, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232.
3. Виділений зв'язувальний білок за п. 1 або п. 2, який містить: амінокислотну послідовність важкого ланцюга, яка містить щонайменше одну з гіперваріабельних ділянок (CDR), вибрану з групи, до складу якої входять: (a) CDRH1, представлені ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 46, 50, 60, 62, 66, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230; (b) CDRH2, представлені ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 46, 50, 60, 62, 66, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230; і (с) CDRH3, представлені ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 46, 50, 60, 62, 66, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230, та
амінокислотну послідовність легкого ланцюга, яка містить щонайменше одну з гіперваріабельних ділянок (CDR), вибрану з групи, до складу якої входять: (d) CDRL1, представлені ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 48, 52, 58, 64, 68, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232; (e) CDRL2, представлені ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 48, 52, 58, 64, 68, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232; і (f) CDRL3, представлені ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 48, 52, 58, 64, 68, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232.
4. Виділений зв'язувальний білок за п. 1 або п. 2, який містить амінокислотну послідовність важкого ланцюга, яка містить CDRH1, CDRH2 та CDRH3 з будь-якими ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 46, 50, 60, 62, 66, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230, або амінокислотну послідовність легкого ланцюга, яка містить CDRL1, CDRL2 та CDRL3 з будь-якими ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 48, 52, 58, 64, 68, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232.
5. Виділений зв'язувальний білок за п. 3, який містить амінокислотну послідовність важкого ланцюга, яка містить CDRH1, CDRH2 та CDRH3 з будь-якими ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 46, 50, 60, 62, 66, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230, і амінокислотну послідовність легкого ланцюга, яка містить CDRL1, CDRL2 та CDRL3 з будь-якими ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 48, 52, 58, 64, 68, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232.
6. Виділений зв'язувальний білок за п. 1, який містить:
амінокислотну послідовність важкого ланцюга, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 46, 50, 60, 62, 66, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230.
7. Виділений зв'язувальний білок за п. 2, який містить:
амінокислотну послідовність легкого ланцюга, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 48, 52, 58, 64, 68, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232.
8. Виділений зв'язувальний білок за п. 1, який містить:
амінокислотну послідовність важкого ланцюга, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 46, 50, 60, 62, 66, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230; і
амінокислотну послідовність легкого ланцюга, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 48, 52, 58, 64, 68, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232.
9. Виділений зв'язувальний білок за п. 1, який містить CDRH3 з будь-якою з ПОСЛІДОВНОСТЕЙ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 46, 50, 60, 62, 66, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230.
10. Виділений зв'язувальний білок за п. 9, який містить амінокислотну послідовність легкого ланцюга, представлену будь-якою з ПОСЛІДОВНОСТЕЙ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 48, 52, 58, 64, 68, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232.
11. Виділений зв'язувальний білок, який зв'язується з об'ємною структурою, яка утворюється амінокислотними залишками 1-160; 161-358; 359-575; 1-358; 359-604 зрілого HER-3, зокрема, зрілого людського HER-3.
12. Виділений зв'язувальний білок за будь-яким із пп. 1-12, який є спрямованим проти позаклітинного домену HER-3.
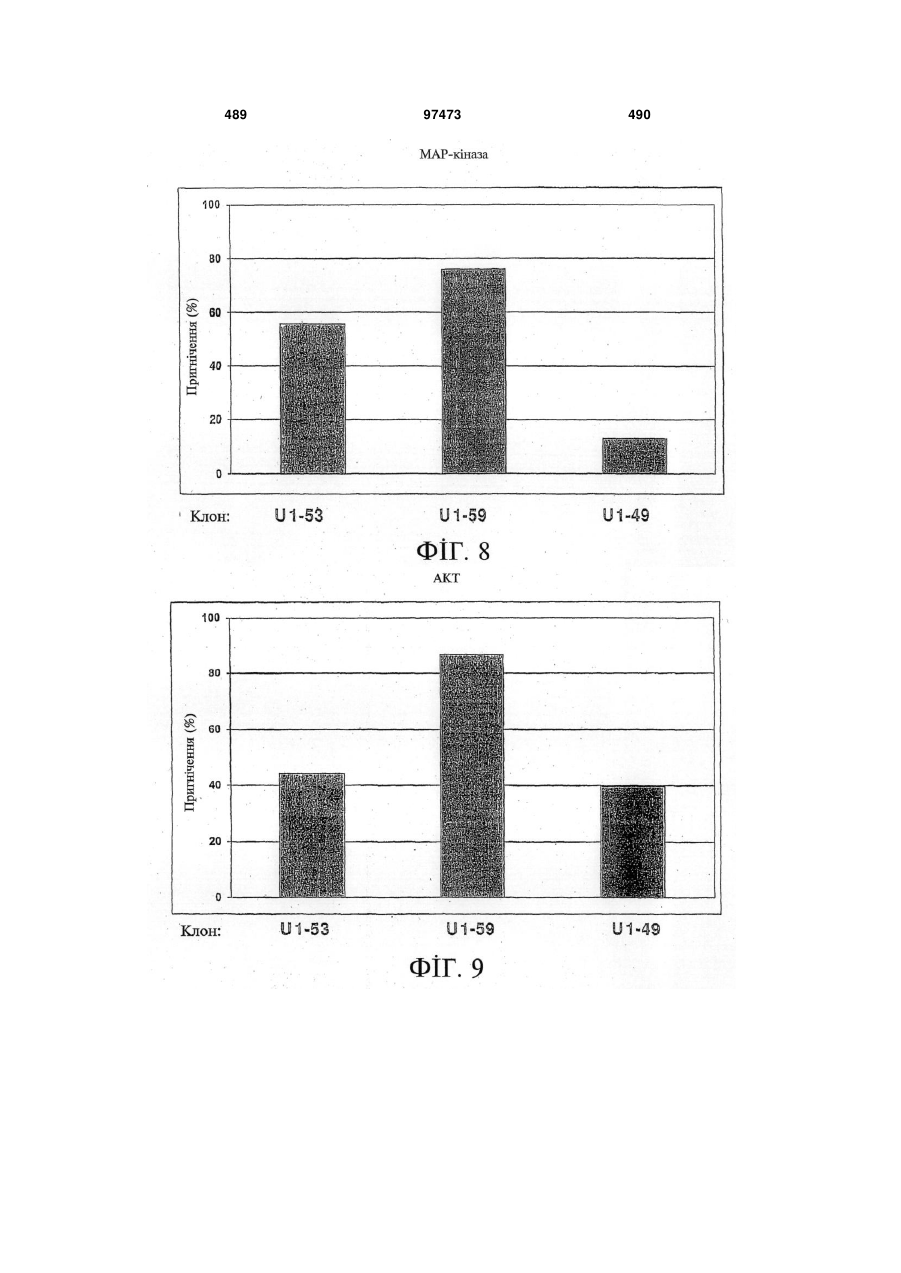
13. Виділений зв'язувальний білок за будь-яким із пп. 1-12, де зв'язування зв'язувального білка з HER-3 зменшує трансдукцію сигналу, яка опосередковується HER-3.
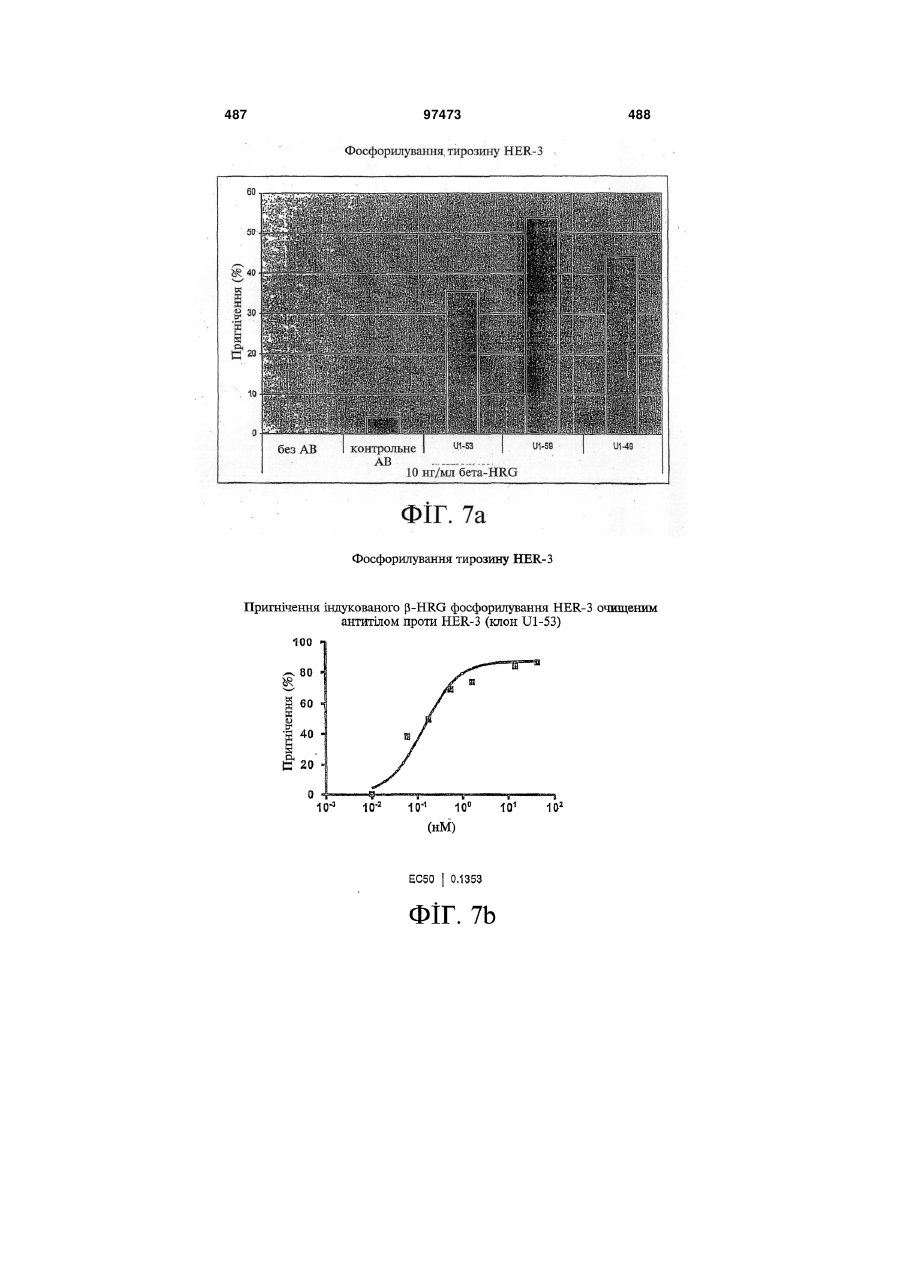
14. Виділений зв'язувальний білок за будь-яким із пп. 1-12, де зв'язування зв'язувального білка з HER-3 зменшує фосфорилування HER-3.
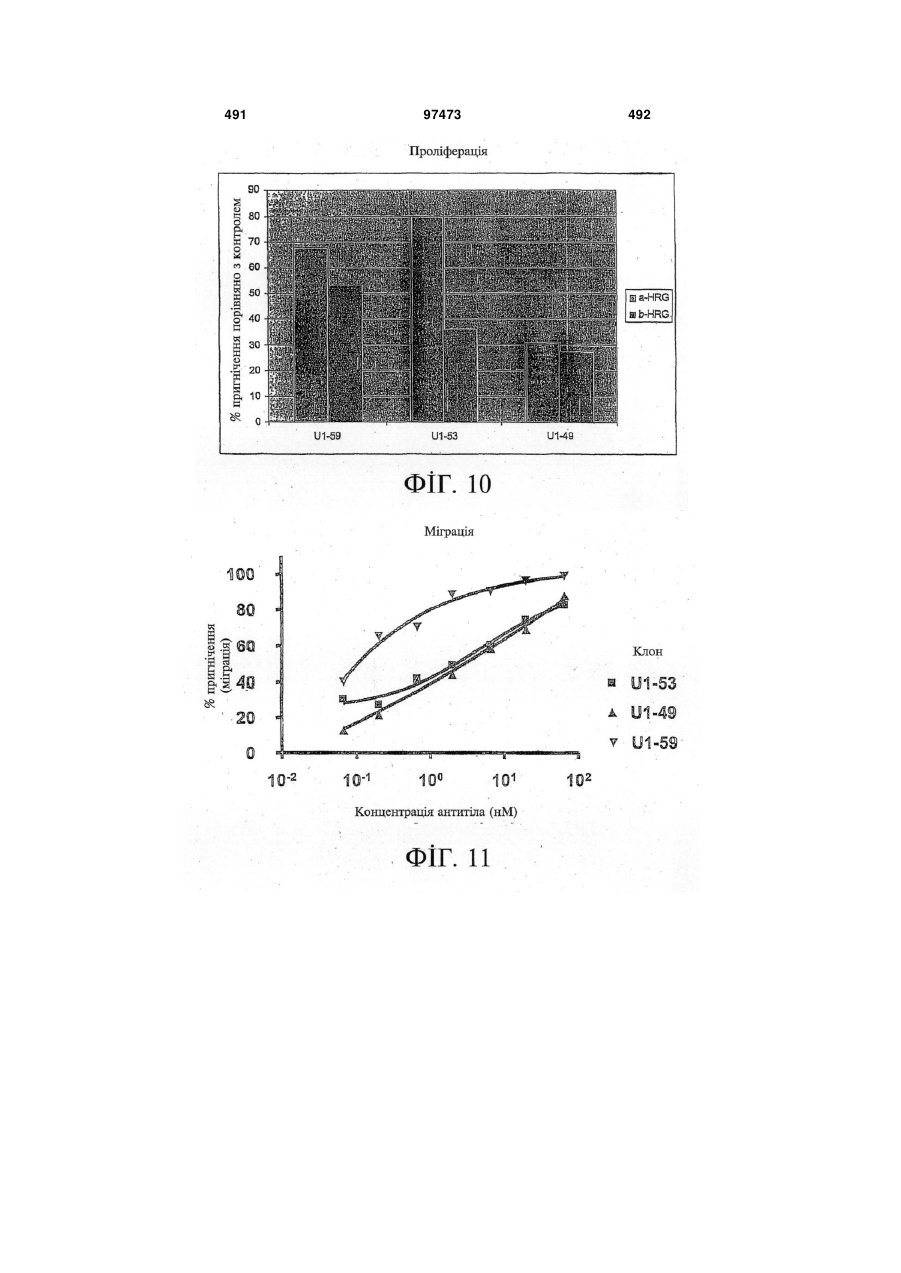
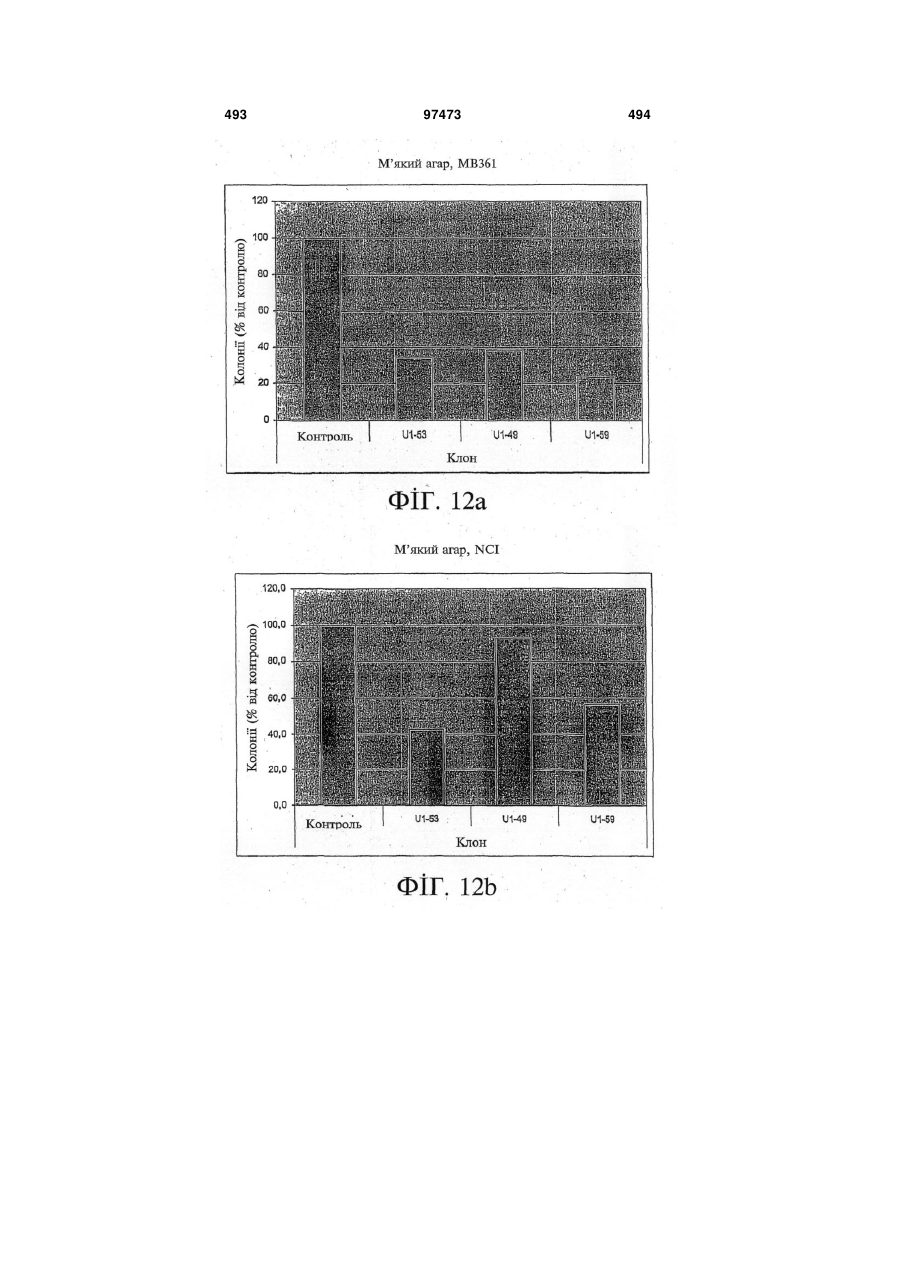
15. Виділений зв'язувальний білок за будь-яким із пп. 1-12, де зв'язування зв'язувального білка з HER-3 зменшує проліферацію клітин.
16. Виділений зв'язувальний білок за будь-яким із пп. 1-12, де зв'язування зв'язувального білка з HER-3 зменшує міграцію клітин.
17. Виділений зв'язувальний білок за будь-яким із пп. 1-12, де зв'язування зв'язувального білка з HER-3 підвищує регуляцію HER-3 за типом зворотного зв'язку.
18. Виділений зв'язувальний білок за будь-яким із пп. 1-17, який являє собою антитіло.
19. Виділений зв'язувальний білок за п. 18, де згаданим антитілом є моноклональне антитіло, поліклональне антитіло, рекомбінантне антитіло, гуманізоване антитіло, людське антитіло, химерне антитіло, поліспецифічне антитіло або фрагмент антитіла.
20. Виділений зв'язувальний білок за п. 19, де фрагментом антитіла є Fab-фрагмент, Fab'-фрагмент, F(ab')2-фрагмент, Fv-фрагмент, двочасткове антитіло або молекула одноланцюгового антитіла.
21. Виділений зв'язувальний білок за будь-яким із пп. 1-20, який є білком типу IgG1, IgG2, IgG3 або IgG4.
22. Виділений зв'язувальний білок за будь-яким із пп. 1-21, який є сполученим з групою-міткою.
23. Виділений зв'язувальний білок за п. 22, де групою-міткою є радіоізотоп, флуоресцентна група, ферментативна група, хемілюмінесцентна група, біотинілована група або попередньо визначена поліпептидна антигенна детермінанта.
24. Виділений зв'язувальний білок за будь-яким із пп. 1-21, який є сполученим з ефекторною групою.
25. Виділений зв'язувальний білок за п. 24, де ефекторною групою є радіоізотоп або радіонуклід, токсин або терапевтична чи хіміотерапевтична група.
26. Виділений зв'язувальний білок за п. 25, де терапевтична або хіміотерапевтична група вибрана з групи, яку складають калікаміцин, ауристатин-РЕ, гелданаміцин, мейтензин та їх похідні.
27. Виділена молекула нуклеїнової кислоти, яка кодує зв'язувальний білок за будь-яким із пп. 1-26.
28. Виділена молекула нуклеїнової кислоти за п. 27, яка є функціонально зв'язаною з контрольною послідовністю.
29. Вектор, який містить молекулу нуклеїнової кислоти за п. 27.
30. Вектор, який містить молекулу нуклеїнової кислоти за п. 28.
31. Клітина-хазяїн, трансформована вектором за п. 29.
32. Клітина-хазяїн, трансформована вектором за п. 30.
33. Спосіб одержання виділеного зв'язувального білка за будь-яким з пп. 1-26, який включає стадію виділення згаданого зв'язувального білка з клітини-хазяїна.
34. Спосіб за п. 33, який відрізняється тим, що клітиною-хазяїном є клітина ссавця, клітина рослини, клітина гриба або прокаріотна клітина.
35. Фармацевтична композиція, яка містить як активний агент щонайменше один виділений зв'язувальний білок за будь-яким із пп. 1-26 і фармацевтично прийнятний носій, розріджувач або ад'ювант.
36. Композиція за п. 35 для терапевтичного застосування.
37. Композиція за п. 35 для діагностичного застосування.
38. Спосіб лікування або запобігання захворювання, пов'язаного з HER-3, у хворого, який включає введення фармацевтично ефективної кількості фармацевтичної композиції за п. 35 або п. 36 суб'єкту, який цього потребує.
39. Спосіб за п. 38, який відрізняється тим, що захворюванням є гіперпроліферативне захворювання.
40. Спосіб за п. 39, який відрізняється тим, що згадане гіперпроліферативне захворювання вибране з групи, яку складають рак молочної залози, рак шлунково-кишкового тракту, рак підшлункової залози, рак передміхурової залози, рак яєчників, рак шлунка, рак ендометрія, рак слинних залоз, рак легень, рак нирок, рак товстої кишки, рак анастомозу ободової та прямої кишки, рак щитовидної залози, рак сечового міхура, гліома, меланома, рак яєчок, саркома м'яких тканин, рак голови та шиї, інші раки з експресією або надекспресією HER-3 і утворення пухлинних метастазів.
41. Спосіб за п. 39 або п. 40, який відрізняється тим, що згадане гіперпроліферативне захворювання пов'язане з підвищеним фосфорилуванням HER-3, підвищеною гетеродимеризацією HER-2/HER-3 або підвищеною активністю РІ3-кінази, c-jun-термінальної кінази, АКТ, ERK2 та/або PYK2.
42. Спосіб діагностування захворювання, пов'язаного з HER-3, який включає:
(a) введення в контакт зразка із зв'язувальним білком за будь-яким із пп. 1-23 за умов, придатних для забезпечення можливості зв'язування згаданого зв'язувального білка з HER-3; і
(b) виявлення зв'язування згаданого зв'язувального білка з HER-3.
43. Спосіб за п. 42, який відрізняється тим, що захворюванням є гіперпроліферативне захворювання.
44. Спосіб за п. 43, який відрізняється тим, що згадане гіперпроліферативне захворювання вибране з групи, яку складають рак молочної залози, рак шлунково-кишкового тракту, рак підшлункової залози, рак передміхурової залози, рак яєчників, рак шлунка, рак ендометрія, рак слинних залоз, рак легень, рак нирок, рак товстої кишки, рак анастомозу ободової та прямої кишки, рак щитовидної залози, рак сечового міхура, гліома, меланома, інші раки з експресією або надекспресією HER-3, рак яєчок, саркома м'яких тканин, рак голови та шиї і утворення пухлинних метастазів.
45. Спосіб за п. 43 або п. 44, який відрізняється тим, що згадане гіперпроліферативне захворювання пов'язане з підвищеним фосфорилуванням HER-3, підвищеною гетеродимеризацією HER-2/HER-3 або підвищеною активністю РІ3-кінази, c-jun-термінальної кінази, АКТ, ERK2 та/або PYK2.
46. Набір, до складу якого входить виділений зв'язувальний білок за будь-яким із пп. 1-25.
47. Набір за п. 46, який відрізняється тим, що до його складу входить додатковий терапевтичний агент.
48. Набір за п. 47, який відрізняється тим, що додатковим терапевтичним агентом є протипухлинний агент.
49. Набір за п. 48, який відрізняється тим, що протипухлинним агентом є протипухлинне антитіло або хіміотерапевтичний агент.
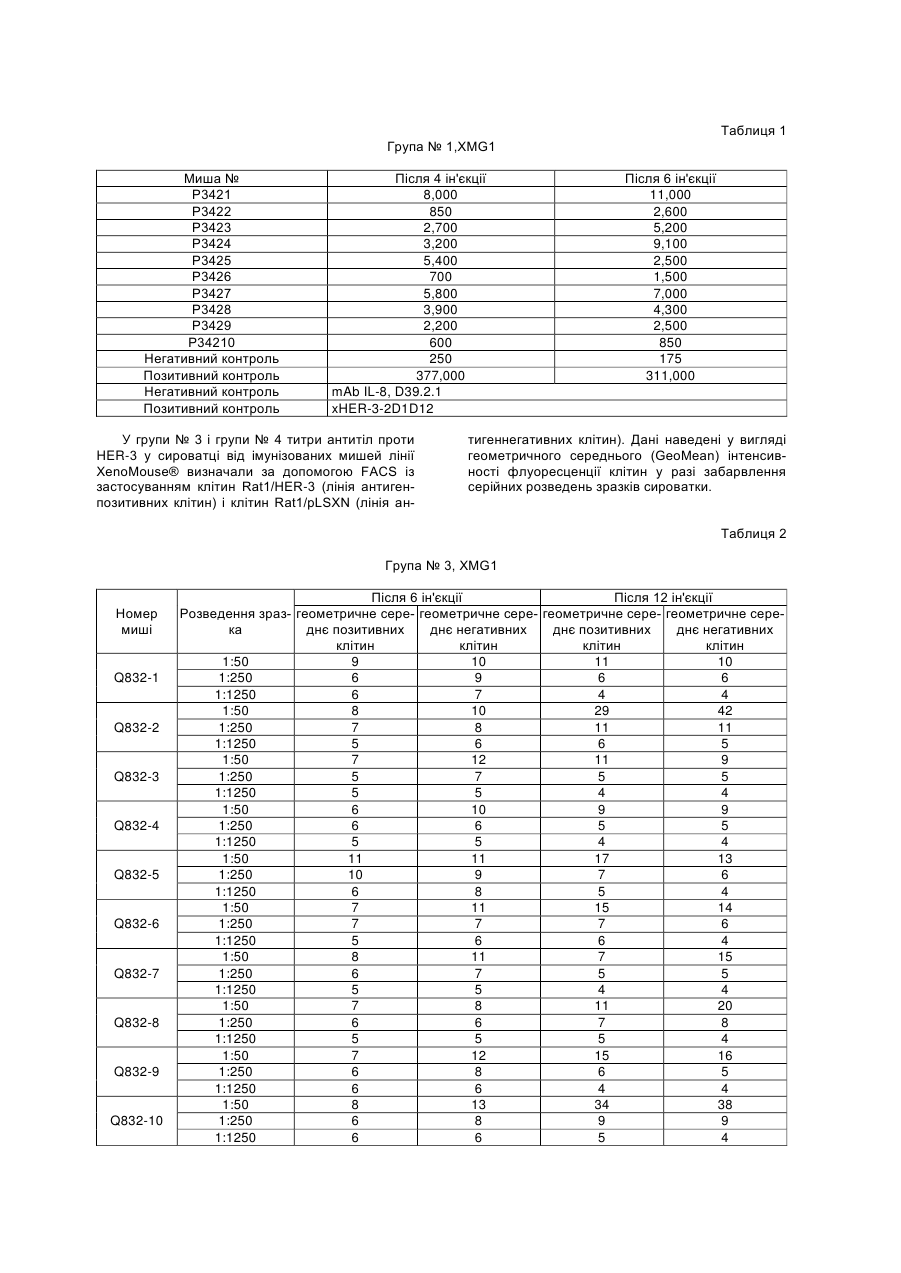
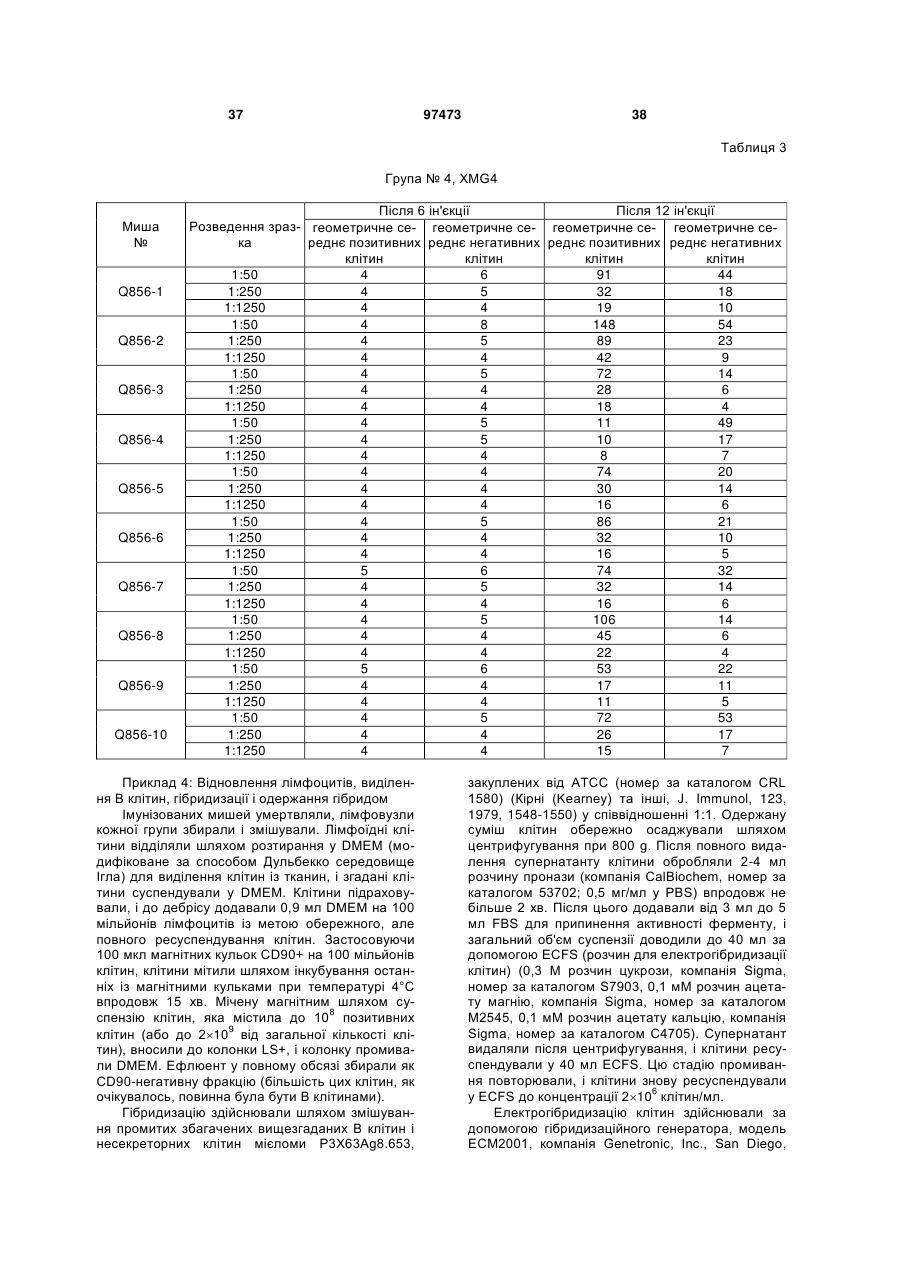
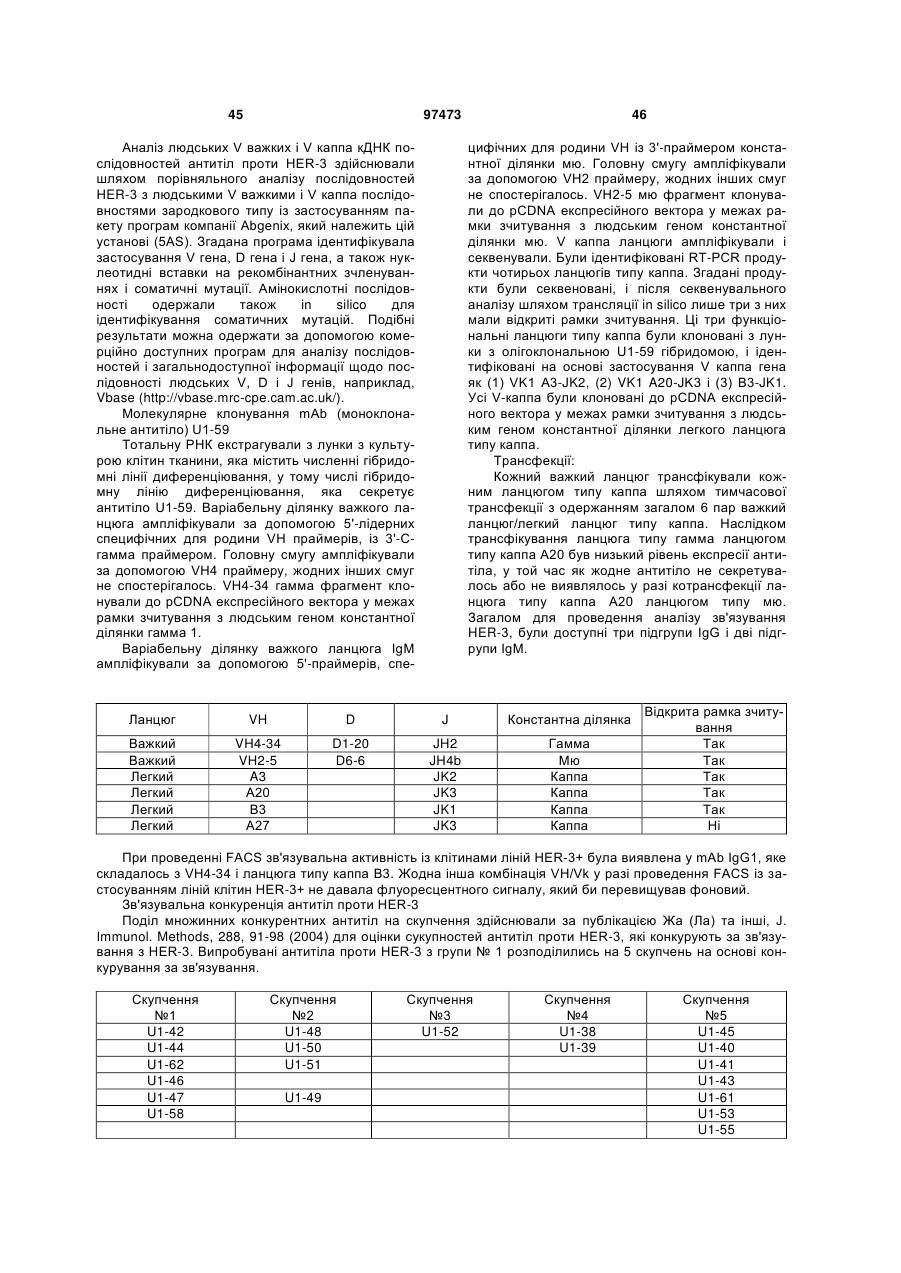
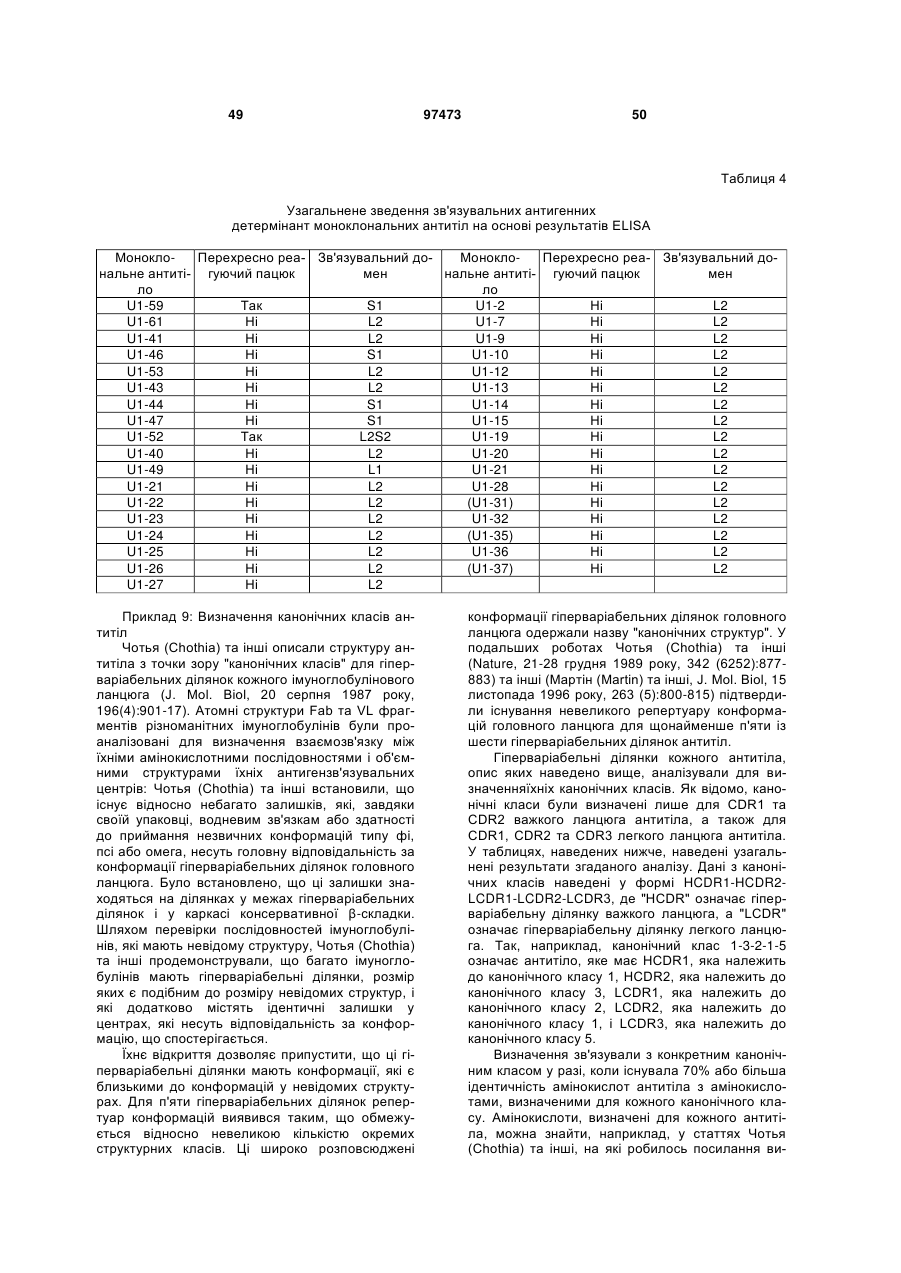
Текст
1. Виділене антитіло, що зв'язується з HER-3, яке вибране з антитіл (1)-(3): (1) антитіло, яке характеризується тим, що CDR1 важкого ланцюга представлена послідовністю GGSFSGYYWS, CDR2 важкого ланцюга представлена послідовністю EINHSGSTNYNPSLKS, CDR3 важкого ланцюга представлена послідовністю DKWTWYFDL, CDR1 легкого ланцюга представлена послідовністю RSSQSVLYSSSNRNYLA, CDR2 легкого ланцюга представлена послідовністю WASTRES та CDR3 легкого ланцюга представлена послідовністю QQYYSTPRT; 2 (19) 1 3 3. Виділене антитіло за будь-яким із пп. 1 або 2, яке спрямовується на позаклітинний домен HER-3. 4. Виділене антитіло за будь-яким із пп. 1-3, причому зв'язування антитіла з HER-3 зменшує опосередковану HER-3 трансдукцію сигналу. 5. Виділене антитіло за будь-яким із пп. 1-4, причому зв'язування антитіла з HER-3 зменшує фосфорилування HER-3. 6. Виділене антитіло за будь-яким із пп. 1-5, причому зв'язування антитіла з HER-3 зменшує проліферацію клітин. 7. Виділене антитіло за будь-яким із пп. 1-6, причому зв'язування антитіла з HER-3 зменшує міграцію клітин. 8. Виділене антитіло за будь-яким із пп. 1-7, причому зв'язування антитіла з HER-3 посилює даунрегуляцію HER-3. 9. Виділене антитіло за будь-яким із пп. 1-8, причому антитіло являє собою моноклональне антитіло, поліклональне антитіло, рекомбінантне антитіло, гуманізоване антитіло, людське антитіло, химерне антитіло, поліспецифічне антитіло або фрагмент антитіла. 10. Виділене антитіло за будь-яким із пп. 1-9, причому фрагментом антитіла є Fab-фрагмент, Fabфрагмент, F(ab)2-фрагмент, Fv-фрагмент, діатіло або одноланцюгова молекула антитіла. 11. Виділене антитіло за будь-яким із пп. 1-10, яке є антитілом типу IgG1, IgG2, IgG3 aбо IgG4. 12. Виділене антитіло за будь-яким із пп. 1-11, сполучене з групою-міткою. 13. Виділене антитіло за будь-яким із пп. 1-12, де групою-міткою є радіоізотоп або радіонуклід, флуоресцентна група, ферментативна група, хемілюмінесцентна група, біотинілована група або заздалегідь визначена поліпептидна антигенна детермінанта. 14. Виділене антитіло за будь-яким із пп. 1-13, сполучене з ефекторною групою. 15. Виділене антитіло за п. 14, де ефекторною групою є радіоізотоп або радіонуклід, токсин або терапевтична чи хіміотерапевтична група. 16. Виділене антитіло за п. 15, де терапевтична або хіміотерапевтична група вибрана з групи, яку складають калікаміцин, ауристатин-РЕ, гелданаміцин, мейтензин та їх похідні. 17. Виділена молекула нуклеїнової кислоти, яка кодує антитіло за будь-яким із пп. 1-16. 18. Виділена молекула нуклеїнової кислоти за п. 17, функціонально зв'язана з контрольною послідовністю. 19. Вектор, який містить молекулу нуклеїнової кислоти за п. 17 або за п. 18. 20. Клітина-хазяїн, трансформована вектором за п. 19. 21. Спосіб одержання виділеного антитіла за будьяким із пп. 1-16, який включає стадію виділення згаданого виділеного антитіла з клітини-хазяїна. 22. Спосіб за п. 21, який відрізняється тим, що клітиною-хазяїном є клітина ссавця, клітина рослини, клітина гриба або прокаріотна клітина. 23. Фармацевтична композиція, яка містить як активний агент виділене антитіло за будь-яким із пп. 1-16 і фармацевтично прийнятний носій, розріджувач або ад'ювант. 97473 4 24. Композиція за п. 23 для терапевтичного застосування. 25. Композиція за п. 23 для діагностичного застосування. 26. Спосіб лікування або запобігання захворювання, пов'язаного з HER-3, у пацієнта, який включає введення фармацевтично ефективної кількості фармацевтичної композиції за п. 24 пацієнту, який цього потребує. 27. Спосіб за п. 26, який відрізняється тим, що захворюванням є гіперпроліферативне захворювання. 28. Спосіб за п. 27, який відрізняється тим, що згадане гіперпроліферативне захворювання вибране з групи, яку складають рак молочної залози, рак шлунково-кишкового тракту, рак підшлункової залози, рак передміхурової залози, рак яєчників, рак шлунка, рак ендометрія, рак слинних залоз, рак легень, рак нирок, рак товстої кишки, рак анастомозу ободової та прямої кишки, рак щитовидної залози, рак сечового міхура, гліома, меланома, рак яєчок, саркома м'яких тканин, рак голови та шиї, інші раки з експресією або надекспресією HER-3 і утворення пухлинних метастазів. 29. Спосіб за п. 27 або п. 28, який відрізняється тим, що згадане гіперпроліферативне захворювання пов'язане з підвищеним фосфорилуванням HER-3, підвищеною гетеродимеризацією HER2/HER-3 aбо підвищеною активністю PI3-кінази, cjun-термінальної кінази, AKT, ERK2 та/або PYK2. 30. Спосіб діагностування захворювання, пов'язаного з HER-3, який включає: (а) введення в контакт зразка з антитілом за будьяким із пп. 1-16 за умов, придатних для уможливлення зв'язування згаданого антитіла з HER-3; і (b) виявлення зв'язування згаданого антитіла з HER-3. 31. Спосіб за п. 30, який відрізняється тим, що захворюванням є гіперпроліферативне захворювання. 32. Спосіб за п. 31, який відрізняється тим, що згадане гіперпроліферативне захворювання вибране з групи, яку складають рак молочної залози, рак шлунково-кишкового тракту, рак підшлункової залози, рак передміхурової залози, рак яєчників, рак шлунка, рак ендометрія, рак слинних залоз, рак легень, рак нирок, рак товстої кишки, рак анастомозу ободової та прямої кишки, рак щитовидної залози, рак сечового міхура, гліома, меланома, інші раки з експресією або надекспресією HER-3, рак яєчок, саркома м'яких тканин, рак голови та шиї і утворення пухлинних метастазів. 33. Спосіб за п. 31 або п. 32, який відрізняється тим, що згадане гіперпроліферативне захворювання пов'язане з підвищеним фосфорилуванням HER-3, підвищеною гетеродимеризацією HER2/HER-3 aбо підвищеною активністю PI3-кінази, cjun-термінальної кінази, AKT, ERK2 та/або PYK2. 34. Набір, до складу якого входить виділене антитіло за будь-яким із пп. 1-16. 35. Набір за п. 34, який відрізняється тим, що до його складу входить додатковий терапевтичний агент. 5 97473 6 36. Набір за п. 35, який відрізняється тим, що додатковим терапевтичним агентом є протипухлинний агент. 37. Набір за п. 36, який відрізняється тим, що протипухлинним агентом є протипухлинне антитіло або хіміотерапевтичний агент. Цей винахід стосується зв'язувальних білків, у тому числі антитіл та їхніх зв'язувальних фрагментів, які зв'язуються з HER-3 та полінуклеотидами, які його кодують. Пропонуються також експресійні вектори та клітини-хазяї, які містять HER-3 для продукування зв'язувального білка за цим винаходом. На додаток до цього, цей винахід пропонує композиції та способи діагностування та лікуваннях захворювань, пов'язаних із трансдукцією сигналів, опосередкованою HER-3 та/або його лігандом гергуліном. Рецептор людського епідермального фактора росту 3 (HER-3, відомий також як ЕrbВ3) являє собою рецепторний білок тирозинкіназу і належить до підродини рецепторів епідермального фактора росту (EGFR), до якої належать рецепторні білки тирозинкінази і яка охоплює також HER-1 (відомий також як EGFR), HER-2 та HER-4 (Plowman et al., Proc. Natl. Acad. Sci. U.S.A. 87 (1990), 4905-4909; Kraus et al., Proc. Natl Acad. Sci. U.S.A. 86 (1989), 9193-9197; Kraus et al., Proc. Natl. Acad. Sci. U.S.A. 90 (1993), 2900-2904). Подібно до прототипового рецептора епідермального фактора росту, трансмембранний рецептор HER-3 містить позаклітинний лігандзв'язувальний домен (ECD), димеризаційний домен у межах ECD, трансмембранний домен, домен внутрішньоклітинного білка тирозинкінази (TKD) і С-кінцевий домен фосфорилування. Ліганд гергулін (HRG) зв'язується з позаклітинним доменом HER-3 і активізує рецепторопосередкований шлях передавання сигналу шляхом стимулювання димеризації з іншими членами родини рецепторів людського епідермального фактора росту (HER) і трансфосфорилування його внутрішньоклітинного домену. Утворення димерів між членами родини HER збільшує потенціал передавання сигналу HER-3, і є засобом не лише для диверсифікації сигналу, але також і для ампліфікації сигналу. Наприклад, гетеродимер HER2/HER-3 індукує один із найважливіших мітогенних сигналів серед членів родини HER. Було встановлено, що HER-3 надекспресується у разі раку декількох типів, наприклад, раку молочної залози, раку шлунково-кишкового тракту й раку підшлункової залози. Цікавим фактом є те, що була продемонстрована кореляція між експресією HER-2/HER-3 і розвитком від неінвазивної до інвазивної стадії (Alimandi et al., Oncogene 10, 1813-1821; deFazio et al., Cancer 87, 487-498; Naidu et al., Br. J. Cancer 78, 1385-1390). Відповідним чином, бажаними є засоби, які перешкоджають передаванню сигналу, який опосередковується HER-3. Повідомляли про мишачі або химерні антитіла проти HER-3, наприклад, у патент США № 5968511, патент США № 5480968 та WO 03013602. Нещодавно було продемонстровано, що гуманізоване моноклональне антитіло проти HER-2, Herceptin®, перешкоджає передаванню сигналу, який опосередковується HER-2, і є терапевтично ефективним у людей (Fendly et al., Hybridoma 6, 359-370; Hudziak et al., Моl. Cell. Вiol. 9, 1165-1172; Stebbing et al., Cancer Treat. Rev. 26, 287-290). Було показано, що Herceptin® діє через посередництво двох різних механізмів, а саме залучення ефекторних клітин імунної системи, а також безпосередній цитотоксичний апоптозіндукувальний ефект. Однак лише пацієнти з високим рівнем ампліфікації HER-2 суттєво реагують на лікування Herceptin®, що обмежує кількість пацієнтів, придатних для лікування. На додаток до цього, унаслідок розвитку стійкості до лікарських засобів або зміни експресії чи послідовності антигенної детермінанти HER-2 на ракових клітинах, навіть ці придатні для лікування пацієнти втрачаютьздатність реагування на згадане антитіло і, тим самим, зводяться нанівець його терапевтичні переваги. Таким чином, існує необхідність у більшій кількості лікарських засобів для розробки методів лікування, спрямованих на додаткових членів родини HER, наприклад, HER-3. Фіг. 1 показує рівень експресії HER-3 на ділянці людських ліній ракових клітин і демонструє, що HER-3 експресується різноманітними раками людини. Фіг. 2 показує результати FACS (клітинний сортер із збудженням флуоресценції) аналізу зв'язування антитіла проти HER-3 з клітинами Rat1, які стабільно експресують різні члени родини HER, або лише з порожнім вектором. Фіг. 3 показує групи конкурентного зв'язування антитіла, картовані на доменах HER-3. Фіг. 4 показує результати непрямого FACS Scatchard аналізу спорідненості антитіл, який було здійснено з антитілами проти HER-3 за цим винаходом. Результати аналізу вказують на те, що антитіла проти HER-3 за цим винаходом мають високий ступінь спорідненості і сильні константи зв'язування з HER-3, експресованим на поверхні клітин. Фіг. 5 показує прискорений ендоцитоз HER-3, індукований антитілами проти HER-3 за цим винаходом. Фіг. 6а-е показують результати аналізу конкуренції лігандів, який було здійснено з антитілами проти HER-3 за цим винаходом. Результати демонструють, що антитіла за цим винаходом спе125 125 цифічно зменшують зв'язування [ I]--HRG/[ I]-HRG з клітинами, які експресують ендогенний HER-3. Фіг. 7а показує результати ELISA (твердофазний імуноферментний аналіз) фосфотирозину HER-3, який було здійснено з антитілами проти HER-3 за цим винаходом. Антитіла за цим винаходом були здатними до пригнічення -HRGопосередкованої активації HER-3, на що вказує підвищений рівень фосфорилування рецепторного 7 тирозину. Окрім того, Фіг. 7b показує репрезентативні результати цього експерименту з титрованим антитілом. Фіг. 8 показує результати ELISA р42/р44 МАРкінази, який було здійснено з антитілами проти HER-3 за цим винаходом. Антитіла за цим винаходом були здатними до зменшення рівня -HRGопосередкованої активації р42/р44 МАР-кінази (мітогенактивована протеїнкіназа), на що вказує підвищений рівень фосфорилування МАР-кінази. Фіг. 9 показує результати ELISA фосфорилування АКТ (протеїнкіназа В), який було здійснено з антитілами проти HER-3 за цим винаходом. Антитіла за цим винаходом були здатними до зменшення рівня -HRG-опосередкованої активації АКТ, на що вказує фосфорилування АКТ. Фіг. 10 показує пригнічення проліферації клітин MCF7 людськими антитілами проти HER-3 за цим винаходом. Антитіла за цим винаходом пригнічують HRG-індукований ріст людських ракових клітин. Фіг. 11 показує трансміграцію клітин MCF7, яка пригнічується людськими антитілами проти HER-3 за цим винаходом. Фіг. 12а-і показують пригнічення незалежного від зв'язування росту клітин людськими антитілами проти HER-3 за цим винаходом. Фіг. 13 показує пригнічення росту ксенотрансплантату людських ракових клітин молочної залози T47D людським антитілом проти HER-3 за цим винаходом. Фіг. 14 показує зменшення людських ракових клітин підшлункової залози ВхРС3 у мишей після введення антитіл проти HER-3 (U1-59 та U1-53) або проти EGFR (Erbitux). Фіг. 15 показує зменшення росту ксенотрансплантату людських ракових клітин підшлункової залози ВхРС3 людським антитілом проти HER-3 за цим винаходом та у поєднанні з антитілами проти EGFR (Erbitux). Фіг. 16 показує, що антитіла за цим винаходом уповільнюють ріст клітин людської меланоми (НТ144) у "голих" мишей. Фіг. 17 показує зменшення росту ксенотрансплантату людських клітин раку товстої кишки НТ-29 людськими антитілами проти HER-3 за цим винаходом (U1-53, U1-59 та U1-7). Фіг. 18 показує зменшення росту ксенотрансплантату людських клітин раку легень Calu-3 людськими антитілами проти HER-3 за цим винаходом (U1-59, U1-53 та U1-7). Фіг. 19 показує зменшення росту ксенотрансплантату людських клітин раку підшлункової залози ВхРС-3 людськими антитілами проти HER-3 за цим винаходом (U1-7, U1-59 та U1-53). Фіг. 20 демонструє, що антитіло за цим винаходом (U1-59) спричинює супресію HER-3 у ксенотрансплантатах людських клітин раку підшлункової залози ВхРС3. Перший аспект цього винаходу стосується виділеного зв'язувального білка, який зв'язується з HER-3. За одним із варіантів здійснення цього винаходу, виділений зв'язувальний білок за цим винаходом містить амінокислотну послідовність важко 97473 8 го ланцюга, яка містить щонайменше одну з гіперваріабельних ділянок (CDR), вибрану з групи, до складу якої входять: (a) CDRH1, представлені ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 42, 46, 50, 54, 60, 62, 66, 70, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230, (b) CDRH2, представлені ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 42, 46, 50, 54, 60, 62, 66, 70, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230, і (с) CDRH3, представлені ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 42, 46, 50, 54, 60, 62, 66, 70, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230, та/або амінокислотну послідовність легкого ланцюга, яка містить щонайменше одну з гіперваріабельних ділянок (CDR), вибрану з групи, до складу якої входять: (d) CDRL1, представлені ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 44, 48, 52, 56, 58, 64, 68, 72, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232, (e) CDRL2, представлені ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 44, 48, 52, 56, 58, 64, 68, 72, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232, і (f) CDRL3, представлені ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 44, 48, 52, 56, 58, 64, 68, 72, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232. За іншим варіантом здійснення цього винаходу, виділений зв'язувальний білок за цим винаходом містить амінокислотну послідовність важкого ланцюга, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 42, 46, 50, 54, 60, 62, 66, 70, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230, та/або амінокислотну послідовність легкого ланцюга, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 44, 48, 52, 56, 58, 64, 68, 72, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232. За ще одним варіантом здійснення цього винаходу, виділений зв'язувальний білок за цим винаходом містить амінокислотну послідовність важкого ланцюга і амінокислотну послідовність легкого ланцюга, представлені ПОСЛІДОВНОСТЯМИ: 2 і 4, 6 і 8, 10 і 12, 14 і 16, 18 і 20, 22 і 24, 26 і 28, 30 і 9 32, 36 і 38, 42 і 44, 46 і 48, 50 і 52, 54 і 56, 60 і 58, 62 і 64, 66 і 68, 70 і 72, 74 і 76, 78 і 82, 80 і 82, 84 і 86, 88 і 90, 92 і 94, 96 і 98, 100 і 102, 104 і 106, 108 і 110, 112 і 114, 116 і 118, 122 і 124, 126 і 128, 130 і 132, 134 і 136, 138 і 140, 142 і 144, 146 і 148, 150 і 152, 154 і 156, 158 і 160, 162 і 164, 166 і 168, 170 і 172, 174 і 176, 178 і 180, 182 і 184, 186 і 188, 190 і 192, 194 і 196, 198 і 200, 202 і 204, 206 і 208, 210 і 212, 214 і 216, 218 і 220, 222 і 224, 226 і 228, 230 і 232, або амінокислотну послідовність важкого ланцюга, представлену ПОСЛІДОВНОСТЯМИ 34, 40, 60, 62 або 120 чи амінокислотну послідовність легкого ланцюга, представлену ПОСЛІДОВНОСТЯМИ 58 або 64. За цим винаходом, виділений зв'язувальний білок, який є здатним до зв'язування з HER-3, взаємодіє щонайменше з однією антигенною детермінантою на позаклітинній частині HER-3. Згадані антигенні детермінанти, за варіантом, якому віддається перевага, розміщені на домені L1 (амінокислоти 19-184), який є амінокінцевим доменом, на домені S1 (амінокислоти 185-327) та домені S2 (амінокислоти 500-632), які являють собою два збагачені цистеїном домени, або на домені L2 (амінокислоти 328-499), який фланкується двома збагаченими цистеїном доменами. Згадані антигенні детермінанти можуть також розміщуватись на комбінаціях доменів, наприклад (але без обмеження), антигенна детермінанта, яка складається із частин L1 та S1. Додаткову перевагу віддають виділеному зв'язувальному білку, який зв'язується з об'ємною структурою, яка утворюється амінокислотними залишками 1-160, 161-358, 359-575, 1-358 та/або 359-604 зрілого HER-3, зокрема, зрілого людського HER-3. За варіантом, якому віддається перевага, виділеним зв'язувальним білком за цим винаходом є каркасний білок, який має антитілоподібну зв'язувальну активність, або антитіло, наприклад, антитіло проти HER-3. Зокрема, антитіло проти HER-3 вибране з групи, яку складають антитіло U1-1, антитіло U1-2, антитіло U1-3, антитіло U1-4, антитіло U1-5, антитіло U1-6, антитіло U1-7, антитіло U1-8, антитіло U1-9, антитіло U1-10, антитіло U1-11, антитіло U1-12, антитіло U1-13, антитіло U1-14, антитіло U1-15, антитіло U1-16, антитіло U1-17, антитіло U1-18, антитіло U1-19, антитіло U1-20, антитіло U1-21, антитіло U1-22, антитіло U1-23, антитіло U1-24, антитіло U1-25, антитіло U1-26, антитіло U1-27, антитіло U1-28, антитіло U1-29, антитіло U1-30, антитіло U1-31, антитіло U1-32, антитіло U1-33, антитіло U1-34, антитіло U1-35, антитіло U1-36, антитіло U1-37, антитіло U1-38, антитіло U1-39, антитіло U1-40, антитіло U1-41, антитіло U1-42, антитіло U1-43, антитіло U1-44, антитіло U1-45, антитіло U1-46, антитіло U1-47, антитіло U1-48, антитіло U1-49, антитіло U1-50, антитіло U1-51, антитіло U1-52, антитіло U1-53, антитіло U1-55.1, антитіло U1-55, антитіло U1-57.1, антитіло U1-57, антитіло U1-58, антитіло U1-59, антитіло U1-61.1, антитіло U1-61, антитіло U1-62 або антитіло, яке має щонайменше один важкий або легкий ланцюг одного зі згаданих антитіл. Особлива перевага віддається антитілам U1-49 (ПОСЛІДОВНІСТЬ № 42/44), U1-53 (ПОСЛІДОВ 97473 10 НІСТЬ № 54/56) та U1-59 (ПОСЛІДОВНІСТЬ № 70/72) або антитілу, яке має щонайменше один важкий або легкий ланцюг одного із згаданих антитіл. На додаток до цього, додаткові варіанти здійснення цього винаходу пропонують виділений зв'язувальний білок, сполучений з групою-міткою або ефекторною групою. За варіантом, якому віддається перевага, такий зв'язувальний білок є придатним для лікування гіперпроліферативних захворювань, зокрема онкологічних захворювань, наприклад, раку молочної залози, раку шлунковокишкового тракту, раку підшлункової залози, раку передміхурової залози, раку яєчників, раку шлунка, раку ендометрія, раку слинних залоз, раку легень, раку нирок, раку товстої кишки, раку анастомозу ободової та прямої кишки, раку щитовидної залози, раку сечового міхура, гліоми, меланоми, раку яєчок, саркоми м'яких тканин, раку голови та шиї або інших раків з експресією або надекспресією HER-3 і утворення пухлинних метастазів. Інші аспекти цього винаходу мають відношення до виділеної молекули нуклеїнової кислоти, яка кодує зв'язувальний білок за цим винаходом, вектора, який має молекулу нуклеїнової кислоти, яка кодує зв'язувальний білок за цим винаходом та клітини-хазяїна, наприклад, клітини СНО, клітини мієломи NS/0, трансформованої такою молекулою нуклеїнової кислоти або вектором. Додатковий аспект цього винаходу стосується способу одержання зв'язувального білка за цим винаходом шляхом одержання згаданого зв'язувального білка з клітини-хазяїна, який секретує згаданий зв'язувальний білок. За варіантом, якому віддається перевага, зв'язувальний білок за цим винаходом одержують з лінії клітин гібридоми, яка секретує зв'язувальний білок, або з клітини СНО чи клітини іншого типу, трансформованої молекулою нуклеїнової кислоти, яка кодує зв'язувальний білок за цим винаходом. Інший аспект цього винаходу стосується способу одержання зв'язувального білка за цим винаходом шляхом одержання згаданого зв'язувального білка з тканини, продукту або секрету тварини, рослини або гриба, трансгенного за молекулою нуклеїнової кислоти або молекулами нуклеїнової кислоти, які кодують зв'язувальний білок за цим винаходом. За варіантом, якому віддається перевага, зв'язувальний білок за цим винаходом одержують із тканини, продукту або секрету трансгенної тварини, наприклад, корови, вівці, кроля, курчати або іншого виду ссавця або птаха, трансгенної рослини, наприклад, кукурудзи, тютюну або іншої рослини чи трансгенного грибу, наприклад, Aspergillus, Pichia або грибу іншого виду. Інший аспект цього винаходу стосується фармацевтичної композиції, яка містить як активний агент щонайменше один зв'язувальний білок за цим винаходом у суміші із фармацевтично прийнятними носіями, розріджувачами та/або ад'ювантами. За іншим варіантом здійснення цього винаходу, якому віддається перевага, фармацевтична композиція за цим винаходом додатково містить щонайменше один інший активний агент, наприклад, щонайменше один протипухлинний агент. 11 Ще інший аспект цього винаходу стосується застосування щонайменше одного зв'язувального білка за цим винаходом і, факультативно, щонайменше одного іншого активного агента, наприклад, щонайменше одного протипухлинного агента, у суміші із фармацевтично прийнятними носіями, розріджувачами та/або ад'ювантами для одержання фармацевтичної композиції. Згадана фармацевтична композиція є придатною для діагностування, запобігання або лікування гіперпроліферативного захворювання, зокрема, онкологічного захворювання, наприклад, раку молочної залози, раку шлунково-кишкового тракту, раку підшлункової залози, раку передміхурової залози, раку яєчників, раку шлунка, раку ендометрія, раку слинних залоз, раку легень, раку нирок, раку товстої кишки, раку анастомозу ободової та прямої кишки, раку щитовидної залози, раку сечового міхура, гліоми, меланоми або інших раків з експресією або надекспресією HER-3 і утворення пухлинних метастазів. Більше того, цей винахід за додатковим аспектом стосується способу діагностування захворювань або станів, пов'язаних з експресією HER-3, який включає контактування зразка із щонайменше одним зв'язувальним білком за цим винаходом і виявлення присутності HER-3. До числа захворювань або станів, яким віддається перевага, належать згадані вище гіперпроліферативні захворювання. Ще одним аспектом цього винаходу є спосіб запобігання або лікування захворювань або станів, пов'язаних з експресією HER-3 у пацієнта, який потребує цього, який включає введення пацієнту ефективної кількості щонайменше одного зв'язувального білка за цим винаходом і факультативно щонайменше одного іншого активного агента, наприклад, щонайменше одного протипухлинного агента. За варіантом, якому віддається перевага, пацієнтом є ссавець, за варіантом, якому віддається більша перевага, людина. Захворюваннями або станами, пов'язаними з експресією HER-3, яким віддається перевага, є згадані вище гіперпроліферативні захворювання. Додатковий аспект цього винаходу стосується набору для діагностування, запобігання або лікування захворювань або станів, пов'язаних з експресією HER-3, який містить щонайменше один зв'язувальний білок та/або молекулу нуклеїнової кислоти та/або вектор за цим винаходом. Факультативно, набір за цим винаходом може додатково містити щонайменше один інший активний агент, наприклад, щонайменше один протипухлинний агент. За варіантом, якому віддається перевага, захворюваннями або станами, пов'язаними з експресією HER-3, є згадані вище гіперпроліферативні захворювання. Перший аспект цього винаходу стосується виділеного зв'язувального білка, який зв'язується з HER-3. За одним із варіантів здійснення цього винаходу, виділений зв'язувальний білок за цим винаходом містить амінокислотну послідовність важкого ланцюга, яка містить щонайменше одну з гіперваріабельних ділянок (CDR), вибрану з групи, до складу якої входять: (a) CDRH1, представлені 97473 12 ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 42, 46, 50, 54, 60, 62, 66, 70, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230, (b) CDRH2, представлені ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 42, 46, 50, 54, 60, 62, 66, 70, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230, і (с) CDRH3, представлені ПОСЛІДОВНОСТЯМИ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 42, 46, 50, 54, 60, 62, 66, 70, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230, та/або амінокислотну послідовність легкого ланцюга, яка містить щонайменше одну з гіперваріабельних ділянок (CDR), вибрану з групи, до складу якої входять: (d) CDRL1, представлені ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 44, 48, 52, 56,58, 64, 68, 72, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232, (e) CDRL2, представлені ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 44, 48, 52, 56, 58, 64, 68, 72, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232, і (f) CDRL3, представлені ПОСЛІДОВНОСТЯМИ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 44, 48, 52, 56, 58, 64, 68, 72, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232. За іншим варіантом здійснення цього винаходу, виділений зв'язувальний білок за цим винаходом містить амінокислотну послідовність важкого ланцюга, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ: 2, 6, 10, 14, 18, 22, 26, 30, 34, 36, 40, 42, 46, 50, 54, 60, 62, 66, 70, 74, 78, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226 і 230, та/або амінокислотну послідовність легкого ланцюга, вибрану з групи, до складу якої входять ПОСЛІДОВНОСТІ: 4, 8, 12, 16, 20, 24, 28, 32, 38, 44, 48, 52, 56, 58, 64, 68, 72, 76, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228 і 232. За ще одним варіантом здійснення цього винаходу, виділений зв'язувальний білок за цим винаходом містить амінокислотну послідовність важкого ланцюга і амінокислотну послідовність легкого ланцюга, представлені ПОСЛІДОВНОСТЯМИ: 2 і 4, 6 і 8, 10 і 12, 14 і 16, 18 і 20, 22 і 24, 26 і 28, 30 і 32, 36 і 38, 42 і 44, 46 і 48, 50 і 52, 54 і 56, 60 і 58, 62 і 64, 66 і 68, 70 і 72, 74 і 76, 78 і 82, 80 і 82, 84 і 86, 88 і 90, 92 і 94, 96 і 98, 100 і 102, 104 і 106, 108 і 13 110, 112 і 114, 116 і 118, 122 і 124, 126 і 128, 130 і 132, 134 і 136, 138 і 140, 142 і 144, 146 і 148, 150 і 152, 154 і 156, 158 і 160, 162 і 164, 166 і 168, 170 і 172, 174 і 176, 178 і 180, 182 і 184, 186 і 188, 190 і 192, 194 і 196, 198 і 200, 202 і 204, 206 і 208, 210 і 212, 214 і 216, 218 і 220, 222 і 224, 226 і 228, 230 і 232, або амінокислотну послідовність важкого ланцюга, представлену ПОСЛІДОВНОСТЯМИ 34, 40, 60, 62 або 120 чи амінокислотну послідовність легкого ланцюга, представлену ПОСЛІДОВНОСТЯМИ 58 або 64. За цим винаходом слід розуміти, що амінокислотна послідовність зв'язувального білка за цим винаходом не обмежується двадцятьма традиційними амінокислотами (Дивись довідник Immunology - A Synthesis (2-е видання, редактори Е.С. Голуб (E.S. Golub) та Д.Р. Грен (D.R. Gren), Sinauer Associates, Sunderland, штат Массачусетс (1991), який включено до цього опису шляхом посилання). Наприклад, згадані амінокислоти можуть включати стереоізомери (наприклад, Dамінокислоти) двадцяти традиційних амінокислот, штучні амінокислоти, наприклад, -,-двозаміщені амінокислоти, N-алкільні амінокислоти, молочну кислоту та інші нетрадиційні амінокислоти. Прикладами нетрадиційних амінокислот, які можуть також бути придатними складовими зв'язувального білка за цим винаходом, є: 4-гідроксипролін, карбоксиглютамат, -Ν,Ν,Ν-триметиллізин, -Νацетиллізин, О-фосфосерин, N-ацетилсерин, Nформілметіонін, 3-метилгістидин, 5-гідроксилізин, -Ν-метиларгінін та інші подібні амінокислоти та імінокислоти, наприклад, 4-гідроксипролін. На додаток до цього, за цим винаходом, незначні варіації амінокислотних послідовностей, представлених ПОСЛІДОВНОСТЯМИ 1-232 передбачаються як такі, що входять до обсягу цього винаходу, за умови, що варіації амінокислотної послідовності зберігають щонайменше 75%, за варіантом, якому віддається більша перевага, щонайменше 80%, 90%, 95% і за варіантом, якому віддається найбільша перевага, 99% послідовностей, представлених ПОСЛІДОВНОСТЯМИ 1-232. Згадані варіації можуть відбуватись у межах каркасних ділянок (тобто за межами гіперваріабельних ділянок), у межах гіперваріабельних ділянок або у межах каркасних ділянок і гіперваріабельних ділянок. Варіації амінокислотних послідовностей, представлених ПОСЛІДОВНОСТЯМИ 1-232, яким віддається перевага, тобто делеції, інсерції та/або заміни щонайменше однієї амінокислоти, відбуваються поблизу від меж функціональних доменів. Структурні та функціональні домени можуть ідентифікуватись шляхом порівняння даних, які мають відношення до нуклеотидних та/або амінокислотних послідовностей, з базами даних послідовностей, які є суспільною або чиєюсь власністю. Комп'ютеризовані методи порівняння можуть застосовуватись для ідентифікування мотивів послідовностей або прогнозованих конформаційних доменів білків, які зустрічаються у інших зв'язувальних білках відомої структури та/або функції. Відомі способи ідентифікування послідовностей білків, які укладаються до відомої об'ємної структури. Дивись, наприклад, Bowie та інші, Science 253, 164 97473 14 (1991); Proteins, Structures and Molecular Principles (редактор Крейтон (Creighton), W.H. Freemand and Company, New York (1984)); Introduction to Protein Structure (редактори К. Бренден (С. Branden) та Дж. Туз (J. Tooze), Garland Publishing, New York. N.Y. (1991); Торнтон (Thornton) та інші, Nature 354, 105 (1991), усі з яких включено до цього опису як посилання. Таким чином, фахівці у цій галузі можуть розпізнавати мотиви послідовностей та структурні конформації, які можуть застосовуватись для визначення структурних і функціональних доменів за цим винаходом. Варіаціями амінокислотних послідовностей, представлених ПОСЛІДОВНОСТЯМИ 1-174 та 1232, яким віддається особлива перевага, є варіації, наслідками яких є знижена сприйнятливість до протеолізу або окиснення, змінені схеми глікозилування або змінені зв'язувальні спорідненості, забезпечення або модифікування інших фізикохімічних або функціональних властивостей зв'язувального білка. Передбачаються, зокрема, заміни консервативних амінокислот. Консервативними замшами є заміни, які відбуваються у межах родини амінокислот, які є спорідненими за своїми бічними ланцюгами. Родинами амінокислот, яким віддають перевагу, є такі: кислотна родина = аспартат, глутамат; основна родина = лізин, аргінін, гістидин; неполярна родина = аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, метіонін, триптофан; і незаряджена полярна родина = гліцин, аспарагін, глутамін, цистеїн, серин, треонін, тирозин. Родинами, яким віддається більша перевага, є такі: аліфатично-гідроксильна родина = серин і треонін; амідовмісна родина = аспарагін і глутамін; аліфатична родина = аланін, валін, лейцин та ізолейцин; і ароматична родина = фенілаланін, триптофан і тирозин. Логічно, наприклад, очікувати, що виділена заміна лейцину на ізолейцин або валін, аспартату на глутамат, треоніну на серин або подібна заміна амінокислоти на структурно споріднену амінокислоту не буде муттєво впливати на зв'язування або властивості зв'язувального білка, який одержують унаслідок цього, особливо якщо згадана заміна не залучає амінокислоти у межах каркасної ділянки. Цим винаходом, однак, передбачаються також усі інші можливі амінокислотні заміни. Чи приведе амінокислотна заміна до одержання функціонального зв'язувального білка, тобто зв'язувального білка, який зв'язується з HER-3 і зменшує трансдукцію сигналу членами родини HER, можна легко визначити шляхом встановлення специфічної активності зв'язувального білка, який одержали, за допомогою аналізу ELISA або FACS на зв'язування з HER-3 або за допомогою in vitro чи in vivo функціонального аналізу. Відповідно до цього винаходу, зв'язувальний білок за цим винаходом взаємодіє щонайменше з однією антигенною детермінантою на позаклітинній частині HER-3. Згадані антигенні детермінанти, за варіантом, якому віддається перевага, є розміщеними на домені L1 (амінокислоти 19-184), який є амінокінцевим доменом, на домені S1 (амінокислоти 185-327) та S2 (амінокислоти 500-632), які являють собою два збагачені цистеїном домени, 15 на домені L2 (амінокислоти 328-499), який фланкується двома збагаченими цистеїном доменами або на комбінації доменів HER-3. Згадані антигенні детермінанти можуть розміщуватись на комбінаціях доменів, наприклад (але без обмеження), антигенна детермінанта, яка складається із частин L1 та S1. Більше того, зв'язувальний білок за цим винаходом додатково відрізняється тим, що його зв'язування з HER-3 зменшує HER-3опосередковану трансдукцію сигналу. За цим винаходом, зменшення HER-3-опосередкованої трансдукції сигналу може, наприклад, спричинюватись даун-регуляцією HER-3, наслідком чого є принаймні часткове зникнення молекул HER-3 з поверхні клітин або стабілізацією HER-3 на поверхні клітин у по суті неактивній формі, тобто у формі, яка демонструє нижчу трансдукцію сигналу, порівняно з нестабілізованою формою. За альтернативним варіантом, зменшення HER-3опосередкованої трансдукції сигналу може також спричинюватись впливом, наприклад, зменшенням або пригніченням, на зв'язування ліганду або іншого члена родини HER з HER-3, GRB2 (білок зв'язування рецептора фактора росту) з HER-2 або GRB2 з SHC (SH2-вмісні a2 колагенспоріднені білки), пригніченням фосфорилування рецепторного тирозину, фосфоритування АКТ, фосфорилування тирозину PYK2 (збагачена проліном тирозинкіназа) або фосфорилування ERK2 (позаклітинно регульована кіназа) чи зменшенням ступеня інвазивності пухлини. За альтернативним варіантом, зменшення HER-3-опосередкованої трансдукції сигналу може також спричинюватись впливом, наприклад, зменшенням або пригніченням, утворення HER-3-вмісних димерів з іншими членами родини HER. Одним із прикладів, з-посеред інших, може бути зменшення або пригнічення утворення білкового комплексу HER-3-EGFR. За варіантом, якому віддається перевага, зв'язувальним білком за цим винаходом є каркасний білок, який має антитілоподібну зв'язувальну активність, або антитіло, тобто антитіло проти HER-3. За контекстом цього винаходу термін "каркасний білок" у значенні, вживаному у цьому описі, означає поліпептид або білок із відкритими площинами поверхні, які мають дуже високий рівень толерантності до амінокислотних інсерцій, замін або делецій. Прикладами каркасних білків, які можуть застосовуватись за цим винаходом, є білок A Staphylococcus aureus, білінзв'язувальний білок Pieris bmssicae або інші ліпокаліни, білки повтору анкірину та людський фібронектин (оглядова стаття Binz and Pluckthun, Curr. Opin. Biotechnol, 16, 459-69). Генно-інженерне конструювання каркасного білка може вважатись пересадженням або інтегруванням функції спорідненості на або у структурний каркас стабільно укладеного білка. Функція спорідненості означає зв'язувальну спорідненість до білка за цим винаходом. Каркас може структурно відокремлюватись від амінокислотних послідовностей з наданням зв'язувальної специфічності. Взагалі, білки, які видаються придатними для створення таких штучних споріднених реактивів, можуть одержуватись раціональними методами або, частіше, комбінаторними методами білко 97473 16 вої інженерії, наприклад, пенінгом проти HER-3, очищеного білка або білка, який проявляється на поверхні клітини, для зв'язування агентів у бібліотеці штучних каркасів, які проявляються in vitro, які є відомими у цій галузі (Skerra, J. Моl, Recog., 2000; Binz and Plückthun, 2005). На додаток до цього каркасний білок, який має антитілоподібну зв'язувальну активність, можна одержати з акцепторного поліпептиду, який містить каркасний домен, який може пересаджуватись із зв'язувальними доменами донорного поліпептиду з наданням зв'язувальної специфічності донорного поліпептиду каркасному домену, який містить акцепторний поліпептид. Згаданими вставленими зв'язувальними доменами може бути, наприклад, ділянка, яка обумовлює комплементарність (CDR) антитіла, зокрема, антитіла проти HER-3. Вставка може здійснюватись різними методами, відомими фахівцям у цій галузі, наприклад, синтезом поліпептидів, нуклеїновокислотним синтезом кодувальної амінокислоти, а також різноманітними рекомбінантними методами, добре відомими фахівцям у цій галузі. Більше того, термін "антитіло" або "антитіло проти HER-3", у значенні, вживаному у цьому описі, означає моноклональне антитіло, поліклональне антитіло, рекомбінантне антитіло, гуманізоване антитіло (Джоне (Jones) та інші, Nature, 321 (1986), 522-525; Річмен (Riechmann) та інші, Nature, 332 (1988), 323-329; Преста (Presta), Curr. Op. Struct. Βiοl., 2 (1992), 593-596), химерне антитіло (Моррісон (Morrison) та інші, Рrос. Natl. Acad. Sci. U.S.A., 81 (1984), 6851-6855), поліспецифічне антитіло (наприклад, біспецифічне антитіло), яке одержали із щонайменше двох антитіл, або фрагменти цих антитіл. Термін "фрагмент антитіла" означає будьяку частину вищезгаданих антитіл, за варіантом, якому віддається перевага, їхні антигензв'язувальні центри або варіабельні ділянки. Прикладами фрагментів антитіл є Fab-фрагменти, Fab'фрагменти, F(ab')2-фрагменти, Fv-фрагменти, діатіла (Холлінгер (Hollinger) та інші, Рrос. Natl. Acad. Sci. U.S.A., 90 (1993), 6444-6448), одноланцюгові молекули антитіл (Plückthun у: The Pharmacology of Monoclonal Antibodies, 113, редактори Розенбург (Rosenburg) і Мур (Moore), Springer Verlag, N.Y. (1994), 269-315) та інші фрагменти доти, доки вони демонструють бажану здатність до зв'язування з HER-3. На додаток до цього, термін "антитіло" або "антитіло проти HER-3" у значенні, вживаному у цьому описі, може означати антитілоподібні молекули, які містять сконструйовані методами генної інженерії субдомени антитіл або природних варіантів антитіл. Ці антитілоподібні молекули можуть бути однодоменними антитілами, наприклад, лише VH або лише VL доменами, які одержують із природних джерел, наприклад, від верблюдів (Міддерманс (Muyldermans) та інші, Reviews in Molecular Biotechnology, 74, 277-302) або шляхом in vitro проявлення бібліотек від людей, верблюдів або інших видів (Холт (Holt) та інші, Trends Biotechnol, 21, 484-90). За цим винаходом "Fv-фрагмент" являє собою мінімальний фрагмент антитіла, який містить пов 17 ний сайт розпізнавання і антигензв'язувальний центр. Ця ділянка являє собою варіабельний домен одного важкого і одного легкого ланцюга у тісному нековалентному зв'язку. Саме у цій конфігурації три гіперваріабельні ділянки кожного варіабельного домену взаємодіють з утворенням антигензв'язувального центру на поверхні VH-VL димеру. У сукупності, шість гіперваріабельних ділянок надають антитілу антигензв'язувальну специфічність. Однак навіть один варіабельний домен (або половина Fv, що містить лише три гіперваріабельні ділянки, специфічні щодо антигену) має здатність до розпізнавання і зв'язування антигену, хоча зазвичай з нижчою спорідненістю, аніж цілий антигензв'язувальний центр. "Fab-фрагмент" містить також константний домен легкого ланцюга і перший константний домен (СН1) важкого ланцюга. "Fab-фрагмент" відрізняється від "Fab'фрагмента" доданням декількох залишків на карбоксильному кінці домену СН1 важкого ланцюга з включенням одного або декількох залишків цистеїну із шарнірної ділянки антитіла. Вихідний варіант "F(ab')2-фрагмента" являє собою пару "Fab'фрагментів", які мають між собою шарнірні залишки цистеїну. Фахівцям у цій галузі відомі методи одержання таких фрагментів антитіл, наприклад, розщеплення папаїном або пепсином. За варіантом здійснення цього винаходу, якому віддається перевага, антитіло проти HER-3 за цим винаходом належить до типу IgA, IgD, IgE, IgG або IgM, за варіантом, якому віддається перевага, до типу IgG або IgM з включенням (але без обмеження) типу IgG1, IgG2, IgG3, IgG4, IgM1 та IgM2. За варіантами здійснення, яким віддається найбільша перевага, згадане антитіло належить до типу IgG1, IgG2 або IgG4. За іншим варіантом здійснення цього винаходу, якому віддається перевага, антитіло проти HER-3 за цим винаходом являє собою антитіло проти HER-3, спрямоване на позаклітинний домен (ECD) HER-3. У певних відношеннях, наприклад, у зв'язку з одержанням антитіл, у вигляді терапевтичних засобів-кандидатів проти HER-3, бажаним може бути, щоб антитіло проти HER-3 за цим винаходом було здатним до зв'язування комплементу і прийняття участі у комплементзалежній цитотоксичності (CDC). Існує ряд ізотипів антитіл, які є здатними до вищезгаданого, у тому числі (без обмеження) такі: мишачий IgM, мишачий IgG2a, мишачий IgG2b, мишачий IgG3, людський IgM, людський IgG1, людський IgG3 і людський IgA. Слід розуміти, що антитіла, які одержують, початково не обов'язково належать до такого ізотипу, скоріше, одержують антитіло, яке має будь-який ізотип і ізотип згаданого антитіла може бути переключеним шляхом додання молекулярно клонованих генів або кДНК V-ділянки до молекулярно клонованих генів або кДНК константної ділянки у відповідних експресійних векторах за допомогою традиційних методів молекулярної біології, які є добре відомими у цій галузі, з подальшою експресією антитіл у клітинах-хазяях за допомогою методів, відомих у цій галузі. Антитіло з переключеним ізотипом може також мати Fc-ділянку, яка була 97473 18 сконструйована методами молекулярної інженерії таким чином, щоб воно демонструвало переважний рівень CDC, порівняно з природними варіантами (Ідусогі (Idusogie) та інші, J. Immunol, 166, 2571-2575) і експресувалось методами генної інженерії у клітинах-хазяях із застосуванням методів, відомих у цій галузі. Такі методи, разом з іншими, включають застосування безпосередніх методів генної інженерії (дивись, наприклад, патент США № 4,816,397), серед інших, методи гібридизації клітин (дивись, наприклад, патенти США № 5,916,771 та № 6,207,418). За методом гібридизації клітин одержують лінію клітин мієломи або іншу лінію клітин, наприклад, СНО, яка має важкий ланцюг будь-якого бажаного ізотипу, та іншу лінію клітин мієломи або іншу лінію клітин, наприклад, СНО, яка має легкий ланцюг. Такі клітини у подальшому можуть зливатись із виділенням лінії клітин, яка експресує інтактне антитіло. Наприклад, ізотип людського антитіла IgG4 проти HER-3, яке має бажану здатність до зв'язування з антигеном HER-3, може легко переключатись з одержанням людського ізотипу IgM, людського ізотипу IgG1 або людського ізотипу IgG3 з одночасним збереженням тієї самої варіабельної ділянки (яка визначає специфічність антитіла і певною мірою його спорідненість). Такі молекули можуть у подальшому бути здатними до зв'язування комплементу і прийняття участі у CDC. Більше того, бажаним може бути також, щоб антитіло проти HER-3 за цим винаходом було здатним до зв'язування Fc-рецепторів на ефекторних клітинах, наприклад, моноцитах і природних клітинах-кілерах (NK), і прийняття участі у антитілозалежній клітинній цитотоксичності (ADCC). Існує ряд ізотипів антитіл, які є здатними до вищезгаданого, у тому числі (без обмеження) такі: мишачий IgG2a, мишачий IgG2b, мишачий IgG3, людський IgG1 та людський IgG3. Слід розуміти, що антитіла, які одержують, початково не обов'язково належать до такого ізотипу, скоріше, одержують антитіло, яке має будь-який ізотип, і ізотип згаданого антитіла може бути переключений шляхом додання молекулярно клонованих генів або кДНК Vділянки до молекулярно клонованих генів або кДНК константної ділянки у відповідних експресійних векторах за допомогою традиційних методів молекулярної біології, які є добре відомими у цій галузі, з подальшою експресією антитіл у клітинаххазяях за допомогою методів, відомих у цій галузі. Антитіло з переключеним ізотипом може також мати Fc-ділянку, яка була сконструйована методами молекулярної інженерії таким чином, щоб воно демонструвало переважний рівень ADCC, порівняно з природними варіантами (Шілдс (Shields) та інші, J. Biol. Chem., 276, 6591-6604), і експресувалось методами генної інженерії у клітинах-хазяях із застосуванням методів, відомих у цій галузі. Такі методи, разом з іншими, включають застосування безпосередніх методів генної інженерії (дивись, наприклад, патент США № 4,816,397), серед інших, методи гібридизації клітин (дивись, наприклад, патенти СІЛА № 5,916,771 та № 6,207,418). За методом гібридизації клітин одержують лінію клітин мієломи або іншу лінію клітин, 19 наприклад, СНО, яка має важкий ланцюг будьякого бажаного ізотипу та іншу лінію клітин мієломи або іншу лінію клітин, наприклад, СНО, яка має легкий ланцюг. Такі клітини у подальшому можуть зливатись з виділенням лінії клітин, яка експресує інтактне антитіло. Наприклад, ізотип людського антитіла IgG4 проти HER-3, яке має бажану здатність до зв'язування з антигеном HER-3, може легко переключатись з одержанням людського ізотипу IgG1 або людського ізотипу IgG3 з одночасним збереженням тієї самої варіабельної ділянки (яка визначає специфічність антитіла і певною мірою його спорідненість). Такі молекули можуть у подальшому бути здатними до зв'язування з FcR на ефекторних клітинах і прийняття участі у ADCC. Окрім того, за цим винаходом слід розуміти, що антитіло проти HER-3 за цим винаходом є повністю людським або гуманізованим антитілом. Людські антитіла дозволяють запобігти певних проблем, пов'язаних із ксеногенними антитілами, наприклад, антитілами, які мають мишачі або пацючі варіабельні та/або константні ділянки. Присутність білків ксеногенного походження, наприклад, білків мишачого або пацючого походження, може привести до розвитку у пацієнта імунної реакції проти згаданого антитіла, подальшим наслідком чого є швидке виведення згаданих антитіл, втрата терапевтичної придатності унаслідок нейтралізації згаданого антитіла та/або тяжкі, навіть загрозливі для життя алергічні реакції. За варіантом, якому віддається перевага, антитіло проти HER-3 за цим винаходом вибране з групи, яку складають антитіло U1-1, антитіло U1-2, антитіло U1-3, антитіло U1-4, антитіло U1-5, антитіло U1-6, антитіло U1-7, антитіло U1-8, антитіло U1-9, антитіло U1-10, антитіло U1-11, антитіло U112, антитіло U1-13, антитіло U1-14, антитіло U1-15, антитіло U1-16, антитіло U1-17, антитіло U1-18, антитіло U1-19, антитіло U1-20, антитіло U1-21, антитіло U1-22, антитіло U1-23, антитіло U1-24, антитіло U1-25, антитіло U1-26, антитіло U1-27, антитіло U1-28, антитіло U1-29, антитіло U1-30, антитіло U1-31, антитіло U1-32, антитіло U1-33, антитіло U1-34, антитіло U1-35, антитіло U1-36, антитіло U1-37, антитіло U1-38, антитіло U1-39, антитіло U1-40, антитіло U1-41, антитіло U1-42, антитіло U1-43, антитіло U1-44, антитіло U1-45, антитіло U1-46, антитіло U1-47, антитіло U1-48, антитіло U1-49, антитіло U1-50, антитіло U1-51, антитіло U1-52, антитіло U1-53, антитіло U1-55.1, антитіло U1-55, антитіло U1-57.1, антитіло U1-57, антитіло U1-58, антитіло U1-59, антитіло U1-61.1, антитіло U1-61, антитіло U1-62. За варіантом здійснення цього винаходу, якому віддається перевага, зв'язувальний білок за цим винаходом сполучається з групою-міткою. Такий зв'язувальний білок є особливо придатним для діагностичних застосувань. Термін "групамітка", у значенні, вживаному у цьому описі, означає виявлюваний маркер, наприклад, амінокислоту з радіоактивною міткою або біотиніловану складову, яка може бути виявлена міченим авідином (наприклад, стрептавідином, зв'язаним із флуоресцентним маркером або з ферментативною активністю, яка може виявлятись оптичними або коло 97473 20 риметричними методами). У цій галузі відомі різні методи мічення поліпептидів та глікопротеїнів, наприклад, антитіл, які можуть застосовуватись при здійсненні цього винаходу. Прикладами придатних груп-міток є (але без обмеження) такі: ра3 14 діоізотопи або радіонукліди (наприклад, Н, С, 15 35 90 99 111 125 131 N, S, Y, Тс, Іn, І, І), флуоресцентні групи, (наприклад, FITC (флуоресцинізотіоціанат), родамін, лантанідні люмінофори), ферментативні групи (наприклад, пероксидаза з хрону, βгалактозидаза, люцифераза, лужна фосфатаза), хемілюмінесцентні групи, біотинілові групи або попередньо визначені поліпептидні антигенні детермінанти, які розпізнаються другою "репортерною" групою (наприклад, послідовності лейцинової лінкерної пари, зв'язувальні центри других антитіл, металзв'язувальні домени, мітки антигенних детермінант). Подеколи бажаним може бути приєднання груп-міток спейсерними групами різної довжини для зменшення потенційної стеричної невідповідності. За іншим, альтернативним, варіантом здійснення цього винаходу, якому віддається перевага, зв'язувальний білок за цим винаходом може приєднуватись до ефекторної групи. Такий зв'язувальний білок є особливо придатним для терапевтичного застосування. Термін "ефекторна група" у значенні, вживаному у цьому описі, означає цитотоксичну групу, наприклад, радіоізотоп або радіонуклід, токсин, терапевтичну групу або іншу ефекторну групу, відому у цій галузі. Прикладами відповідних ефекторних груп є радіоізотопи або 3 14 15 35 90 99 радіонукліди (наприклад, Н, С, N, S, Y, Тс, 111 125 131 Ιn, І, І), калікаміцин, аналоги доластатину, наприклад, ауристатини та хіміотерапевтичні засоби, наприклад, похідні гедданаміцину (geldanamycin) та мейтензину (maytansine), у тому числі DM1. Подеколи бажаним може бути приєднання ефекторних груп спейсерними групами різної довжини для зменшення потенційної стеричної невідповідності. Другий аспект цього винаходу стосується способу одержання виділеного зв'язувального білка за цим винаходом, який включає стадію одержання зв'язувального білка з клітини-хазяїна, яка секретує згаданий зв'язувальний білок. Клітинамихазяями, які можуть застосовуватись за цим винаходом, є гібридоми; еукаріотні клітини, наприклад, клітини ссавців, наприклад, хом'яка, кролика, пацюка, свині, миші або клітини інших тварин, клітини рослин, клітини грибів, наприклад, Saccharomyces cerevisiae, Pichia pastoris; прокаріотні клітини, наприклад, Ε. coli; та інші клітини, які застосовуються у цій галузі для одержання зв'язувальних білків. У цій галузі відомі різні способи одержання та виділення зв'язувальних білків, наприклад, каркасних білків або антитіл, із клітинхазяїв, які можуть застосовуватись у разі здійснення цього винаходу. Більше того, способи одержання фрагментів зв'язувальних білків, наприклад, фрагментів каркасних білків або фрагментів антитіл, наприклад, шляхом розщеплення папаїном або пепсином, сучасні методи клонування, методи одержання одноланцюгових молекул антитіл (Pliickthun у: The Pharmacology of Monoclonal 21 Antibodies, 113, редактори Розенбург (Rosenburg) та Мур (Moore), Springer Verlag, N.Y. (1994), 269315) та діатіл (Холлінгер (Hollinger) та інші, Рrос. Natl. Acad. Sci. U.S.A., 90 (1993), 6444-6448) також відомі фахівцям у цій галузі і можуть застосовуватись у разі здійснення цього винаходу. За варіантом здійснення цього винаходу, якому віддається перевага, зв'язувальний білок за цим винаходом одержують з гібридоми, яка секретує згаданий зв'язувальний білок. Дивись, наприклад, Колер (Kohler) та інші, Nature, 256 (1975), 495. За іншим варіантом здійснення цього винаходу, якому віддається перевага, зв'язувальний білок за цим винаходом одержують методами генної інженерії шляхом оптимізації та/або підсилення експресії згаданого зв'язувального білка у клітиніхазяїні і виділення зв'язувального білка із згаданої клітина-хазяїна. З цією метою клітини-хазяї трансформують або трансфікують ДНК, яка кодує зв'язувальний білок, або вектором, який містить ДНК, яка кодує зв'язувальній білок, і культивують за відповідних умов для одержання зв'язувального білка за цим винаходом. Дивись, наприклад, патент США № 4,816,567. Клітинами-хазяями, яким віддають перевагу, можуть бути клітини СНО, клітини мієломи лінії NS/0, клітини нирок зародка людини лінії 293, Е. соlі та Saccharomyces cerevisiae. Щодо зв'язувальних білків, які є антитілами, ці антитіла можна одержати від тварин, які були піддані генно-інженерним маніпуляціям для продукування повністю людських антитіл або з бібліотеки проявлення антитіл у бактеріофагах, дріжджах, рибосомах або Е. соlі. Дивись, наприклад, Клаксон (Clackson) та інші, Nature, 352 (1991), 624-628, Маркс (Marks) та інші, J. Моl. Віоl., 222 (1991), 581597, Фелдхаус (Feldhaus) і Сігел (Siegel), J. Immunol Methods, 290, 69-80, Гровс (Groves) і Осборн (Osbourn), Expert. Opin. Biol. Ther., 5, 125-135, Джосток (Jostock) і Дубел (Dubel), Comb. Chem. High Throughput Screen. 8, 127-133. Людські антитіла запобігають певним проблемам, пов'язаним з антитілами, які мають мишачі або пацючі варіабельні та/або константні ділянки. Наслідком присутності таких білків мишачого або пацючого походження може бути швидке виведення антитіл або розвиток у пацієнта імунної реакції проти згаданого антитіла. Для запобігання застосування антитіл мишачого або пацючого походження, повністю людські антитіла можна одержати шляхом введення гризуну, іншому ссавцю або тварині локусів функціональних людських антитіл таким чином, щоб згаданий гризун, інший ссавець або тварина продукувала повністю людські антитіла. Одним зі способів одержання повністю людських антитіл є застосування мишей лінії XENOMOUSE®, які були одержані методами генної інженерії таким чином, що вони містять фрагменти зародкової конформації локусу людського важкого ланцюга і локусу легкого ланцюга типу каппа довжиною 245 т.п.н. і 190 т.п.н. Миші інших ліній XenoMouse містять фрагменти зародкової конформації локусу людського важкого ланцюга і 97473 22 локусу легкого ланцюга типу каппа довжиною 980 т.п.н. і 800 т.п.н. Миші ше інших ліній XenoMouse містять фрагменти зародкової конформації локусу людського важкого ланцюга і локусу легкого ланцюга типу каппа довжиною 980 т.п.н. і 800 т.п.н. плюс зародкову конформацію повного локусу людського легкого ланцюга типу ламбда довжиною 740 т.п.н. Дивись Мендес (Mendez) та інші, Nature Genetics, 15:146-156 (1997), і Грін (Green) і Якобовіц (Jakobovits), J. Exp. Med., 188:483-495 (1998). Миші лінії XENOMOUSE® є доступними від компанії Abgenix, Inc. (Fremont, штат Каліфорнія). Одержання мишей лінії XENOMOUSE® додатково обговорюється і описується у заявках на патент США № 07/466,008, яку було подано 12 січня 1990 року, № 07/610,515, яку було подано 8 листопада 1990 року, № 07/919,297, яку було подано 24 липня 1992 року, № 07/922,649, яку було подано 30 липня 1992 року, № 08/031,801, яку було подано 15 березня 1993 року, № 08/112,848, яку було подано 27 серпня 1993 року, № 08/234,145, яку було подано 28 квітня 1994 року, № 08/376,279, яку було подано 20 січня 1995 року, № 08/430,938, яку було подано 27 квітня 1995 року, № 08/464,584, яку було подано 5 червня 1995 року, № 08/464,582, яку було подано 5 червня 1995 року, № 08/463,191, яку було подано 5 червня 1995 року, № 08/462,837, яку було подано 5 червня 1995 року, № 08/486,853, яку було подано 5 червня 1995 року, № 08/486,857, яку було подано 5 червня 1995 року, № 08/486,859, яку було подано 5 червня 1995 року, № 08/462,513, яку було подано 5 червня 1995 року, № 08/724,752, яку було подано 2 жовтня 1996 року та № 08/759,620, яку було подано 3 грудня 1996 року, № 2003/0217373, яку було подано 20 листопада 2002 року, і патентах США №6,833,268, №6,162,963, № 6,150,584, № 6,114,598, № 6,075,181 та № 5,939,598, патентах Японії № 3 068 180 В2, № 3 068 506 В2 та № 3 068 507 В2. Дивись також європейський патент ЕР 0 463 151 В1, публікація від 12 червня 1996 року, WO 94/02602, опубліковану 3 лютого 1994 року, WO 96/34096, опубліковану 31 жовтня 1996 року, WO 98/24893, опубліковану 11 червня 1998 року, WO 00/76310, опубліковану 21 грудня 2000 року. Розкриття кожного з вищенаведених патентів, заявок і посилань включено до цього опису у повному обсязі шляхом посилання. За альтернативним варіантом підходу інші, у тому числі компанія GenPharm International, Inc., вдались до "мінілокусного" підходу. За згаданим мінілокусним підходом, екзогенний локус Ig імітують шляхом включення шматочків (окремих генів) локусу Ig. Таким чином, один або декілька VH генів, один або декілька DH генів, один або декілька JH генів, константну ділянку мю і другу константну ділянку (за варіантом, якому віддається перевага, константну ділянку гамма) включають до складу генно-інженерної конструкції для введення тварині. Цей підхід описують у патенті США № 5,545,807 на ім'я Сурані (Surani) та інші, патентах США № 5,545,806, № 5,625,825, № 5,625,126, № 5,633,425, № 5,661,016, № 5,770,429, № 5,789,650, № 5,814,318, № 5,877,397, № 5,874,299 і № 6,255,458, кожен на ім'я Лонберг (Lonberg) та Кей 23 (Кау), патентах США № 5,591,669 і № 6,023,010 на ім'я Крімпенфорт (Krimpenfort) та Берне (Berns), патентах США № 5,612,205, № 5,721,367 та № 5,789,215 на ім'я Берне (Berns) та інші, патенті США № 5,643,763 на ім'я Чой (Choi) та Данн (Dunn), заявках на патент США від компанії GenPharm International № 07/574,748, яку було подано 29 серпня 1990 року, № 07/575,962, яку було подано 31 серпня 1990 року, № 07/810,279, яку було подано 17 грудня 1991 року, № 07/853,408, яку було подано 18 березня 1992 року, № 07/904,068, яку було подано 23 червня 1992 року, №07/990,860, яку було подано 16 грудні 1992 року, № 08/053,131, яку було подано 26 квітня 1993 року, № 08/096,762, яку було подано 22 липня 1993 року, № 08/155,301, яку було подано 18 листопада 1993 року, № 08/161,739, яку було подано 3 грудня 1993 року, № 08/165,699, яку було подано 10 грудня 1993 року, № 08/209,741, яку було подано 9 березня 1994 року, розкриття яких включено до цього опису шляхом посилання. Дивись також європейський патент № 0 546 073 В1, WO 92/03918, WO 92/22645, WO 92/22647, WO 92/22670, WO 93/12227, WO 94/00569, WO 94/25585, WO 96/14436, WO 97/13852, і WO 98/24884 і патент США № 5,981,175, розкриття яких включено до цього опису у повному обсязі шляхом посилання. Додатково дивись Тейлор (Taylor) та інші, 1992, Чен (Chen) та інші, 1993, Тайон (Tuafflon) та інші, 1993, Чой (Choi) та інші, 1993, Лонберг (Lonberg) та інші, (1994), Тейлор (Taylor) та інші, (1994), Тайон (Tuaillon) та інші, (1995), Фішвайлд (Fishwild) та інші, (1996), розкриття яких включено до цього опису у повному обсязі шляхом посилання. Кірін (Kіrіn) також продемонстрував одержання людських антитіл від мишей, яким, шляхом злиття мікроклітин, були введені великі відрізки хромосом або цілі хромосоми. Дивись заявки на європейський патент № 773 288 та № 843 961, розкриття яких включено до цього опису шляхом посилання. На додаток до цього одержали мишей лінії KM™, які є результатом кросбрідингу мишей лінії Тс Кіріна та мишей Medarex's minilocus (Humab). Ці миші мають НС трансхромосому мишей Кіріна і трансген ланцюга типу каппа мишей Medarex (Ішіда (Ishida) та інші, Cloning Stem Cells, (2002) 4:91102). Людські антитіла можна також одержати in vitro методами. Відповідні приклади включають (але ними не обмежуються) проявлення у фагах (серійне виробництво компаніями Cambridge Antibody Technology, Morphosys, Dyax, Biosite/Medarex, Xoma, Symphogen, Alexion (раніше Proliferon), Affimed), проявлення у рибосомах (серійне виробництво компанією Cambridge Antibody Technology), проявлення у дріжджах тощо. Антитіла, опис яких наведено, одержали за методом XENOMOUSE®, як описано нижче. Такі миші, таким чином, є здатними до продукування людських імуноглобулінових молекул і антитіл і не продукують мишачих імуноглобулінових молекул і антитіл. Методи, які застосовуються для досягнення вищезгаданого, розкривають у патентах, заявках і посиланнях, розкриття яких наведено у 97473 24 розділі "Передумови створення винаходу". Зокрема, варіант одержання трансгенних мишей і антитіл від них, якому віддається перевага, розкритий у заявці на патент США № 08/759,620, яку було подано 3 грудня 1996 року, у WO 98/24893, яку було опубліковано 11 червня 1998 року, і у WO 00/76310, яку було опубліковано 21 грудня 2000 року, розкриття яких включено до цього опису шляхом посилання. Дивись також статтю Мендес (Mendez) та інші, Nature Genetics, 15:146-156 (1997), розкриття якої включено до цього опису шляхом посилання. Завдяки застосуванню згаданого методу були одержані повністю людські моноклональні антитіла до цілого ряду антигенів. По суті мишей ліній XENOMOUSE® імунізують антигеном, який становить інтерес (наприклад, HER-3), лімфатичні клітини (наприклад, В-клітини) відбирають у мишей, які експресують антитіла, і відібрані лінії клітин зливають із лінією клітин мієлоїдного типу з одержання імморталізованої лінії клітин гібридоми. Ці лінії клітин гібридоми піддають скринінгу і відбору для ідентифікування ліній клітин гібридоми, які продукують антитіла, специфічні відносно антигену, який становить інтерес. У цьому описі наведені методи одержання численних ліній клітин гібридоми, які продукують антитіла, специфічні щодо HER-3. На додаток до цього у цьому описі наведені характеристики антитіл, які продукуються згаданими лініями клітин, у тому числі результати аналізу нуклеотидних і амінокислотних послідовностей важких і легких ланцюгів таких антитіл. Взагалі, антитіла, продуковані злитими гібридомами, являли собою важкі ланцюги людського IgG1 з повністю людськими легкими ланцюгами типу каппа. Антитіла, опис яких наведено, мають важкі ланцюги людського IgG4, а також важкі ланцюги IgG1. Антитіла можуть також належати до інших людських ізотипів, у тому числі IgG2 або IgG3. Згадані антитіла мали високий ступінь спорі-6 дненості з KD, як правило, від приблизно 10 Μ до -13 приблизно 10 Μ або нижче, у разі визначення твердофазними методами або методами на основі клітин. Інший аспект цього винаходу стосується виділеної нуклеїновокислотної молекули, яка кодує зв'язувальний білок за цим винаходом. У контексті цього винаходу термін "виділена нуклеїновокислотна молекула", у значенні, вживаному у цьому описі, означає полінуклеотид геномного, кДНК або синтетичного походження чи певної їх комбінації, де, завдяки своєму походженню, "виділена нуклеїновокислотна молекула" (1) не є пов'язаною з усім або частиною полінуклеотиду, у якому "виділений полінуклеотид" знаходиться за природних умов, (2) є функціонально зв'язаною з полінуклеотидом, з яким вона не є зв'язаною за природних умов, або (3) не зустрічається у природі як частина більшої послідовності. На додаток до цього термін "нуклеїновокислотна молекула", який застосовують у цьому описі, означає полімерну форму нуклеотидів довжиною щонайменше 10 основ, рибонуклеотидів або дезоксинуклеотидів чи модифіковану форму нуклеотиду будь-якого типу, наприклад, 25 нуклеотидів із модифікованими або заміщеними цукровими групами тощо. Згаданий термін означає також одно- і дволанцюгові форми ДНК. За одним із варіантів здійснення цього винаходу нуклеїновокислотна молекула за цим винаходом є функціонально зв'язаною з контрольною послідовністю. Термін "контрольна послідовність" у значенні, вживаному у цьому описі, означає полінуклеотидні послідовності, необхідні для здійснення експресії та процесингу кодувальних послідовностей, з якими вони зв'язані. Природа таких контрольних послідовностей різниться у залежності від організма-хазяїна. У прокаріотів такі контрольні послідовності включають, взагалі, промотори, центри зв'язування рибосом і термінатори транскрипції. У еукаріотів, взагалі, такі контрольні послідовності включають промотори і термінатори транскрипції. За цим винаходом термін "контрольна послідовність" означає, як мінімум, усі компоненти, присутність яких є обов'язковою для експресії і процесингу, і може також означати додаткові компоненти, присутність яких є бажаною, наприклад, лідерні послідовності і послідовності партнерів гібридизації. На додаток до цього термін "функціонально зв'язаний" у значенні, вживаному у цьому описі, означає положення подібним чином описаних компонентів, які знаходяться у такому взаємозв'язку, який забезпечує можливість їх функціонування відповідним чином. Більше того, за цим винаходом, контрольна послідовність експресії, функціонально зв'язана з кодувальною послідовністю, є зв'язаною таким чином, що експресія кодувальної послідовності відбувається за умов, сумісних із контрольною послідовністю експресії. Додатковим аспектом цього винаходу є вектор, який містить нуклеїновокислотну молекулу, яка кодує зв'язувальний білок за цим винаходом. Нуклеїновокислотна молекула може бути функціонально зв'язаною з контрольною послідовністю. На додаток до цього, згаданий вектор може додатково містити ген сайту ініціації реплікації або селекційного маркеру. Прикладами векторів, які можуть застосовуватись за цим винаходом, є, наприклад, плазміди, косміди, фаги, віруси тощо. Інший аспект цього винаходу стосується клітини-хазяїна, трансформованої нуклеїновокислотною молекулою або вектором за цим винаходом. Трансформація може здійснюватись за допомогою будь-якого відомого методу введення полінуклеотидів до клітини-хазяїна, у тому числі, наприклад, пакування полінуклеотиду до вірусу (або до вектора на основі вірусу) або за допомогою методів трансфекції, відомих у цій галузі, приклади яких наведені у патентах США № 4,399,216, № 4,912,040, № 4,740,461 та № 4,959,455, які включено до цього опису шляхом посилання. Зокрема, методи введення гетерологічних полінуклеотидів до клітин ссавців є добре відомими у цій галузі і включають декстранопосередковану трансфекцію, фракціонування фосфатом кальцію, полібренопосередковану трансфекцію, злиття протопластів, електропорацію, капсулювання полінуклеотиду(-ів) до ліпосом і безпосередню мікроін'єкцію ДНК до ядер. Прикладами клітин-хазяїв, які можуть застосовуватись за цим винаходом, є гібридоми, еукарі 97473 26 отні клітини, наприклад, клітини ссавців, наприклад, хом'яка, кролика, пацюка, свині, миші або клітини інших тварин; клітини рослин і клітини грибів, наприклад, кукурудзи, тютюну, Saccharomyces cerevisiae, Pichia pastoris; прокаріотні клітини, наприклад, Ε. coli; та інші клітини, які застосовують у цій галузі для продукування антитіл. Зокрема, лінії клітин ссавців, доступні як хазяї для експресії, є добре відомими у цій галузі і включають багато імморталізованих ліній клітин, доступних від Американської колекції типових культур (АТСС), у тому числі (але без обмеження) клітини яєчника китайського хом'ячка (СНО), клітини HeLa, клітини нирок зародка хом'яка (ВНК), клітини нирок мавпи (COS), клітини злоякісної гепатоми людини (наприклад, Hep G2) і ряд інших ліній клітин. Ще одним аспектом цього винаходу є фармацевтична композиція, яка містить як активний агент щонайменше один зв'язувальний білок за цим винаходом і фармацевтично прийнятні носії, розріджувачі та/або ад'юванти. Термін "фармацевтична композиція", у значенні, вживаному у цьому описі, означає хімічну сполуку або композицію, здатну до індукування бажаного терапевтичного ефекту у разі відповідного введення пацієнту (The McGraw-Hill Dictionary of Chemical Terms, редактор С. Паркер (Parker S.), McjGraw-Нill, San Francisco (1985), який включено до цього опису шляхом посилання). Відповідно до цього винаходу, ефективність фармацевтичної композиції за цим винаходом грунтується на зв'язуванні щонайменше одного зв'язувального білка з HER-3. За варіантом, якому віддається перевага, наслідком цього зв'язування є зниження HER-3-опосередкованої трансдукції сигналу. На додаток до цього термін "носії", у значенні, вживаному у цьому описі, означає носії, наповнювачі або стабілізатори, які є нетоксичними для клітини або ссавця, яких піддають їхній дії у застосовуваних дозах і концентраціях. Часто фізіологічно прийнятним носієм є водний розчин з рНбуферною домішкою або ліпосома (невеликий міхурець, який складається з ліпідів, фосфоліпідів та/або поверхнево-активних речовин різних типів, який є придатним для доставки лікарського засобу ссавцю). Прикладами фізіологічно прийнятних носіїв є буфери, наприклад, фосфат, цитрат та інші органічні кислоти; антиоксиданти, які включають аскорбінову кислоту; низькомолекулярні (менше ніж приблизно 10 залишків) поліпептиди; білки, наприклад, сироватковий альбумін, желатин або імуноглобуліни; гідрофільні полімери, наприклад, полівінілпіролідон; амінокислоти, наприклад, гліцин, глутамін, аспарагін, аргінін або лізин; моносахариди, дисахариди та інші вуглеводи, у тому числі глюкоза, маноза або декстрини; хелатоутворювачі, наприклад, EDTA (етилендіамінтрифтороцтова кислота); цукрові спирти, наприклад, маніт або сорбіт; солетворні протиіони, наприклад, натрій; та/або неіоногенні поверхнево-активні речовини, наприклад, TWEEN™, поліетиленгліколь (PEG) і PLURONICS™. За одним із варіантів здійснення цього винаходу, щонайменше один зв'язувальний білок за цим винаходом, який входить до складу фармаце 27 втичної композиції, є сполученим з ефектором, наприклад, калікамідином, ауристатином-РЕ (Auristatin-PE), радіоізотопом або токсичним хіміотерапевтичним агентом, наприклад, гедданаміцином та мейтензином. Зокрема, ці кон'югати зв'язувального білка є придатними для цілеспрямованого досягнення клітин, наприклад, ракових клітин, які експресують HER-3, для ліквідації. Більше того, сполучення зв'язувальних білків за цим винаходом із радіоізотопами, наприклад, надає переваги при лікуванні пухлин. На відміну від хіміотерапії та інших форм лікування раку, радіоімунотерапія або введення комбінації радіоізотоп-зв'язувальний білок безпосередньо поціляє у ракові клітини з мінімальним пошкодженням навколишньої нормальної здорової тканини. За допомогою цієї "чарівної кулі" пацієнта можна лікувати набагато меншою кількістю радіоізотопів, аніж у разі інших форм лікування, доступних на сьогоднішній день. Радіоізотопами, яким віддають пере90 90 111 111 131 99 вагу, є ітрий ( Y), індій ( Іn), І, mТС, ра213 діосрібло-111, радіосрібло-199 та вісмут . Сполучення радіоізотопів із зв'язувальними білками за цим винаходом може, наприклад, здійснюватись за допомогою традиційних біфункціональних хелатів. Оскільки срібло є одновалентним, для зв'язування радіосрібла-111 та радіосрібла-199 можуть застосовуватись лінкери на основі сірки (Хазра (Hazra) та інші, Cell Biophys., 24-25, 1-7 (1994)). Зв'язування радіоізотопів срібла може включати відновлення імуноглобуліну аскорбіновою кислотою. На додаток до цього, туксетан являє собою лінкерний хелатор MX-DTPA (1ізотіаціанатбензил-3метилдіетилентриамінпентаоцтова кислота), приєднаний до ібрітумомабу з одержанням ібритумомабу туксетану (компанія Zevalin) (Вітціг Т.Е. (Witzig Т.Е.), Cancer Chemother. Pharmacol, 48, Додаток 1, 91-5 (2001). Ібритумомаб туксетану може реагувати з радіоізотопами, наприклад, інді111 111 90 111 єм ( Іn) або Y, з одержанням Іn90 ібритумомабу туксетану та Y-ібритумомабу туксетану, відповідно. На додаток до цього зв'язувальний білок за цим винаходом, зокрема, у разі його застосування для лікування раку, може кон'югуватись із токсичними хіміотерапевтичними лікарськими засобами, наприклад, калікаміцином (Хемман (Hamman) та інші, Bioconjug. Chem., 13(1), 40-6 (2002)), гелданаміцином (Мандлер (Mandler) та інші, J. Natl. Cancer Inst., 92(19), 1549-1551 (2000)) і мейтензином, наприклад, із мейтензиноподібним лікарським засобом, DM1 (Лю (Liu) та інші, Рrос. Natl. Acad. Sci. U.S.A., 93:8618-8623 (1996). Різні лінкери, які виділяють згадані лікарські засоби за кислих або відновних умов чи під впливом специфічних протеаз, можуть застосовуватись за цим методом. Відповідно до цього винаходу зв'язувальний білок за цим винаходом може кон'югуватись, як описано у цій галузі. Ауристатин-РЕ, наприклад, являє собою агент проти мікроканальців і є структурною модифікацією складової пептиду доластатину 10 морського безпанцирного молюска. Ауристатин-РЕ має як 97473 28 протипухлинну активність, так і протипухлинну васкулярну активність (Отані (Otani) та інші, Jpn. J. Cancer Res., 91(8), 837-44 (2000)). Наприклад, ауристатин-РЕ пригнічує ріст клітин і індукує зупинку клітинного циклу і апоптоз у лініях ракових клітин підшлункової залози (Лі (Li) та інші, Int. J. Моl. Med., 3(6), 647-53 (1999)). Відповідним чином, для специфічного спрямування протипухлинної активності і протипухлинної васкулярної активності ауристатину-РЕ проти конкретних пухлин, ауристатин-РЕ може кон'югуватись із зв'язувальним білком за цим винаходом. За одним із варіантів здійснення цього винаходу фармацевтична композиція містить щонайменше один додатковий активний агент. Прикладами додаткових активних агентів, які можуть застосовуватись за цим винаходом, є антитіла або низькомолекулярні інгібітори інших рецепторних протеїнкіназ, наприклад, EGFR (рецептор епідермального фактора росту), HER-2, HER-4, IGFR-1 (рецептор інсуліноподібного фактора росту) або cmet, рецепторні ліганди, наприклад, фактор росту судинного ендотелію (VEGF), цитотоксичні агенти, наприклад, доксорубіцин, цисплатин або карбоплатин, цитокіни або протипухлинні агенти. На разі у цій галузі відомо багато протипухлинних агентів. За одним із варіантів здійснення протипухлинний агент вибраний з групи терапевтичних білків, яку складають (але без обмеження ними) антитіла або імуномодуляторні білки. За іншим варіантом здійснення протипухлинний агент вибраний з групи низькомолекулярних інгібіторів або хіміотерапевтичних агентів, яку складають інгібітори мітозу, інгібітори кіназ, алкілувальні агенти, антиметаболіти, інтеркалярні антибіотики, інгібітори фактора росту, інгібітори клітинного циклу, ферменти, інгібітори топоізомераз, інгібітори гістондеацетилази, антисептичні засоби, модифікатори біологічних реакцій, антигормональні препарати, наприклад, антиандрогени та антиангіогенні агенти. У разі, коли протипухлинним засобом є випромінення, лікування може здійснюватись із застосуванням внутрішнього (контактна променева терапія: ВТ) або зовнішнього (зовнішня дистанційна променева терапія: EBRT) джерела. Фармацевтична композиція за цим винаходом є особливо придатною для діагностування, запобігання або лікування гіперпроліферативного захворювання. Згадане гіперпроліферативне захворювання може, наприклад, пов'язуватись з підвищеною трансдукцією сигналу членами родини HER. Зокрема, захворювання може пов'язуватись із підвищеним фосфорилуванням HER-3 та/або посиленим комплексоутворенням між HER3 та іншими членами родини HER та/або підвищеною активністю кінази Різ та/або підвищеною активністю термінальної кінази c-jun та/або активністю АКТ та/або підвищеною активністю ERK2 та/або активністю PYK2. За варіантом, якому віддається перевага, гіперпроліферативне захворювання вибране з групи, яку складають рак молочної залози, рак шлунково-кишкового тракту, рак підшлункової залози, рак передміхурової залози, рак яєчників, рак шлунка, рак ендометрія, рак слинних залоз, рак легень, рак нирок, рак товстої кишки, рак анас 29 томозу ободової та прямої кишки, рак щитовидної залози, рак сечового міхура, гліома, меланома або інші раки з експресією або надекспресієюHER-3 і утворення пухлинних метастазів. За цим винаходом термін "запобігання або лікування" у значенні, вживаному у цьому описі, означає як терапевтичне лікування, так і профілактичні або запобіжні заходи, за допомогою яких у пацієнта, який потребує цього, необхідно запобігти або уповільнити (ослабити прояв) цільового патологічного стану або розладу. До числа пацієнтів, які потребують запобігання або лікування, належать пацієнти, які вже мають розлад, а також пацієнти, схильні до розвитку розладу, чи пацієнти, у яких слід запобігти розвитку розладу. Пацієнтом, який потребує запобігання або лікування, є ссавець, тобто будь-яка тварина, яка належить до ссавців, у тому числі люди, домашні та сільськогосподарські тварини, зоопаркові, спортивні або домашні тварини, наприклад, собаки, кішки, велика рогата худоба, коні, вівці, свині, кози, кролики тощо. За варіантом, якому віддається перевага, пацієнтом, який потребує лікування, є людина. Відповідно до цього винаходу фармацевтичну композицію за цим винаходом можна одержати шляхом змішування активного(-их) агента(-ів) із фізіологічно прийнятними носіями, розріджувачами та/або ад'ювантами і факультативно іншими агентами, які, як правило, включають до складу композицій для забезпечення поліпшеного перенесення, доставки, толерантності тощо. Фармацевтичну композицію за цим винаходом можна одержати, наприклад, у формі ліофілізованих композицій, водних розчинів, дисперсій або твердих препаратів, наприклад, таблеток, драже або капсул. Велику кількість відповідних композицій можна знайти у фармакологічному довіднику, відомому усім хімікам-фармацевтам: Remington's Pharmaceutical Sciences (18-е видання, Mack Publishing Company, Easton, штат Пенсільванія (1990)), зокрема, у розділі 87 (автори Блок (Block), Лоуренс (Lawrence)), який входить до його складу. Ці композиції включають, наприклад, порошки, пасти, мазі, гелі, які містять лікарські речовини, воски, масла, ліпіди, міхурці, які містять ліпіди (катіоногенні або аніоногенні) (наприклад, Lipofectin™), ДНК-кон'югати, безводні абсорбційні пасти, емульсії типу "масло у воді" або "вода у маслі", емульсії карбоваксу (поліетиленгліколі різної молекулярної маси), напівтверді гелі і напівтверді суміші, які містять карбовакс. Будь-яка з вищезгаданих сумішей може бути прийнятною для лікування за цим винаходом, за умови, що активний агент у складі цієї композиції не є інактивованим композицією, а композиція є фізіологічно прийнятною і сумісною із прийнятим шляхом введення. Дивись також Балдрік П. (Baldrick P.), "Pharmaceutical excipient development: the need for preclinical guidance.", ReguL Toxicol Pharmacol, 32(2), 210-218 (2000); Ванг В. (Wang W.), "Lyophilization and development of solid protein Pharmaceuticals.", Int. J. Pharm., 203(1-2), 1-60 (2000); Чарман B.H. (Charman W.N.), "Lipids, lipophilic drugs, and oral drug delivery-some emerging concepts.", J. Pharm. Sci., 89(8), 967-978 97473 30 (2000); Пауелл (Powell) та інші, "Compendium of excipients for parenteral formulations", PDA J. Pharm. Sci. Technol, 52, 238-311 (1998); та посилання у згаданих джерелах для додаткової інформації відносно композицій, наповнювачів і носіїв, добре відомих хімікам-фармацевтам. Інший аспект цього винаходу стосується застосування щонайменше одного виділеного зв'язувального білка за цим винаходом і факультативно щонайменше одного іншого активного агента, наприклад, щонайменше одного протипухлинного активного агента, як описано вище, у суміші із фармацевтично прийнятними носіями, розріджувачами та/або ад'ювантами, для виготовлення фармацевтичної композиції для діагностування, запобігання або лікування гіперпроліферативного захворювання. За варіантом, якому віддається перевага, згаданою фармацевтичною композицією є фармацевтична композиція, опис якої наведено вище, а згаданим гіперпроліферативним захворюванням є гіперпроліферативне захворювання, яке згадувалось вище. Ще один аспект цього винаходу стосується способу діагностування захворювань або станів, пов'язаних з експресією HER-3, який включає введення в контакт зразка із зв'язувальним білком за цим винаходом і виявлення присутності HER-3 у згаданому зразку. Згаданим зразком може бути клітина, яка демонструє експресію HER-3, наприклад, ракова клітина, проба крові або інший придатний зразок. За варіантом здійснення цього винаходу, якому віддається перевага, хворобами або станами, пов'язаними з експресією HER-3, є гіперпроліферативні захворювання, визначення яких було наведено вище. За цим винаходом згаданий спосіб може, наприклад, застосовуватись для виявлення антигену HER-3 у клітині, для визначення концентрації антигену HER-3 у пацієнтів, які страждають на гіперпроліферативне захворювання, яке згадувалось вище, або для визначення стадії згаданого гіперпроліферативного захворювання у пацієнта. Для визначення стадії розвитку гіперпроліферативного захворювання у суб'єкта, якого піддають обстеженню, або для визначення реакції згаданого суб'єкта на хід лікування, проба крові може, наприклад, відбиратись у згаданого суб'єкта з визначенням концентрації антигену HER-3, присутнього у згаданій пробі. Визначену таким чином концентрацію застосовують для ідентифікування ділянки концентрацій, на яку припадає визначене значення. Визначений таким чином діапазон корелює зі стадією розвитку або стадією лікування, встановленою на різних групах діагностованих суб'єктів, із встановленням тим самим стадії у суб'єкта, якого піддають обстеженню. Біоптат ураженої, наприклад, ракової тканини, одержаний від пацієнта, може також застосовуватись для визначення кількості присутнього антигену HER-3. Кількість антигену HER-3, присутня в ураженій тканині, може визначатись імуногістохімічними методами, за допомогою ELISA або наборів антитіл із застосуванням антитіл проти HER-3 за цим винаходом. Іншими параметрами діагностичного інтересу є стан димеризації, а також димеризаційні партнери 31 білка HER-3, стан активації HER-3 і його партнерів. Білкові аналітичні методи визначення цих параметрів є добре відомими у цій галузі і включають, серед інших, вестерн-блотинг, методи імунопреципітації, FACS аналіз, хімічне перехресне зв'язування, міграцію біолюмінісцентної енергії (BRET), міграцію флуоресцентної енергії (FRET) тощо (наприклад, Прайс (Price) та інші, Methods in Molecular Biology, 218:255-268 (2002) або метод eTag (WO 0503707, WO 04091384, WO 04011900). На додаток до цього цей винахід за іншим аспектом стосується способу запобігання або лікування захворювань чи станів, пов'язаних з експресією HER-3 у пацієнта, який включає введення пацієнту, який цього потребує, ефективної кількості щонайменше одного зв'язувального білка за цим винаходом. За варіантом, якому віддається перевага, захворюванням або станом, пов'язаним з експресією HER-3, є гіперпроліферативні захворювання, визначення яких було наведено вище. Пацієнтом, який потребує запобігання або лікування, є ссавець, тобто будь-яка тварина, яка належить до ссавців, у тому числі люди, домашні та сільськогосподарські тварини, зоопаркові, спортивні або домашні тварини, наприклад, собаки, кішки, велика рогата худоба, коні, вівці, свині, кози, кролики тощо. За варіантом, якому віддається перевага, пацієнтом, який потребує лікування, є людина. За варіантом здійснення цього винаходу, якому віддається перевага, спосіб запобігання або лікування гіперпроліферативного захворювання у пацієнта, який цього потребує, включає введення пацієнту ефективної кількості щонайменше одного зв'язувального білка за цим винаходом і додатково щонайменше одного іншого активного агента, наприклад, щонайменше одного протипухлинного агента, як згадувалось вище. За варіантом, якому віддається перевага, цей спосіб призначений для пригнічення аномального росту, міграції або інвазії клітин. На додаток до класичних способів введення потенційних лікарських засобів, які містять зв'язувальний білок, наприклад, за допомогою вищезгаданих композицій, придатними можуть виявитись також новорозроблені способи введення за цим винаходом. Наприклад, повідомлялось про місце131 ве введення І-міченого моноклонального антитіла для лікування первинних пухлин головного мозку після видалення хірургічним шляхом. На додаток до цього клінічному та передклінічному дослідженню піддають також пряму стереотаксичну інтрацеребральну ін'єкцію моноклональних антитіл та їхніх фрагментів. Інтракаротидне гіперосмотичне вливання являє собою експериментальну стратегію для цілеспрямованої доставки людських моноклональних антитіл, кон'югованих із лікарським засобом, до первинної злоякісної пухлини головного мозку. У залежності від типу і тяжкості стану для лікування пацієнту, який цього потребує, може вводитись від приблизно 1 мкг/кг до 15 мг/кг щонайменше одного зв'язувального білка за цим винаходом, наприклад, впродовж одного або декількох окремих введень чи шляхом безперервного вливання. 97473 32 Типова добова доза може становити від приблизно 1 мкг/кг до приблизно 100 мг/кг або більше, у залежності від згаданих вище факторів. Для повторних введень впродовж декількох днів або довше, у залежності від стану для лікування, лікування продовжують доти, доки не відбудеться бажане пригнічення симптомів захворювання. Доза щонайменше одного протипухлинного агента, яка вводиться, залежить від цілого ряду факторів. До них належить, наприклад, природа згаданого агента, тип пухлини або шлях введення. Слід звернути увагу на те, що цей винахід не обмежується будь-якою дозою. І, нарешті, цей винахід за додатковим аспектом стосується набору для діагностування, запобігання або лікування гіперпроліферативного захворювання, пов'язаного з HER-3-опосередкованою трансдукцією сигналу, до складу якого входить щонайменше один зв'язувальний білок та/або нуклеїновокислотна молекула та/або вектор за цим винаходом. На додаток до цього до складу набору за цим винаходом може додатково входити щонайменше один інший активний агент, наприклад, щонайменше один інший протипухлинний агент, як згадувалось вище. Далі цей винахід буде пояснюватись наведеними нижче прикладами і супровідними фігурами. Приклади Наведені нижче приклади, у тому числі проведені експерименти і одержані результати, надаються лише з ілюстративною метою і не повинні розглядатись як такі, що обмежують цей винахід. Приклад 1: Одержання антигену HER-3 і ліній клітин При проведенні цього дослідження одержали рекомбінантні білки HER-3. кДНК позаклітинного домену HER-З (ECD) клонували засобами полімеразної ланцюгової реакції (PCR) з pcDNA3-HER-3 (експресійний вектор з непроцесованим людським HER-3, K. Уоллеш (С. Wallasch) та інші, ЕМВО J., 14, 4267-4275) із праймерів, основу яких становить послідовність HER-3 (номер депонування Genebank NM_001982). Праймери, які застосовувались для ампліфікації HER-3, мали такий вигляд: Прямий праймер: 5'CGGGATCCATGTCCTAGCCTAGGGGC-3' (ПОСЛІДОВНІСТЬ № 233) Зворотний праймер: 5'GCTCTAGATTAATGATGATGATGATGATGTGTCCTAAA CAGTCTTG-3' (ПОСЛІДОВНІСТЬ № 234) Продукт полімеразної ланцюгової реакції (PCR) розщеплювали за допомогою BamH1 та ХbаІ і літували до pcDNA3 (компанія Invitrogen), розщепленого за допомогою BamH1 та ХbаІ. Плазміди трансфікували до клітин НЕK293 за методом СаРО4. Гібридний білок HER-3-HIS очищали із зібраних кондиціонованих середовищ засобами NiNTA афінної хроматографії. Клітини Rat1 HER-3 одержали шляхом перенесення ретровірусного гена. Стисло, клітини 5 GP+E86 (310 ) висівали на 60 мм чашку Петрі і трансфікували 2 мкг/мл вектора pIXSN або кДНК 33 pIXSN-HER-3 (K. Уоллеш (С. Wallasch), PhD thesis, Max-Planck Institute of Biochemistry, Martinsried, Germany) за допомогою кальційфосфатного методу. Через 24 год середовище замінювали на свіже, і клітини GP+E86 інкубували впродовж 4-8 год. 5 Після цього субконфлюентні клітини Rat1 (210 клітин на 6 см чашку) інкубували із супернатантами клітин GP+E86 з виділенням pLXSN або 6 pLXSN-HER-3 з високим титром, ρ вірусу (>110 G418 колонієтвірних одиниць/мл; множинність зараження 10) впродовж 4-12 год у присутності полібрену (4 мг/мл; компанія Aldrich). Після заміни середовища розпочинали підбір клітин Rat1 за допомогою G418. Стабільні клони вибирали, як правило, після відбору впродовж 21 дня. Приклад 2: Експресія HER-3 у людських лініях ракових клітин Рецепторні тирозинкінази, як, наприклад, HER3, відіграють вирішальну роль у започаткуванні та розвитку гіперпроліферативних захворювань, наприклад, при переході від росту доброякісних гіпершіастичних клітин до злоякісної карциноми. Оскільки експресія HER-3 різниться між раковими клітинами і нормальною тканиною, аналіз експресії HER-3 є критичним фактором для ідентифікування підгруп пацієнтів, яким було б корисним лікування зв'язувальними білками за цим винаходом. Таким чином, здійснювали кількісне визначення експресії HER-3 на наборі людських ліній ракових клітин для встановлення ролі HER-3 у розвитку раку людини. Лінії ракових клітин вирощували за рекомендаціями АТСС (Американська колекція типових куль5 тур). Докладніше, 10 клітин збирали з 10 мМ EDTA (етилендіамінтрифтороцтова кислота) у PBS (забуферений фосфатом фізіологічний розчин), один раз промивали FACS (клітинний сортер із збудженням флуоресценції) буфером (PBS, 3% FCS (фетальна теляча сироватка), 0,4% азиду) і висівали на 96-лунковий планшет із круглим дном. Клітини центрифугували впродовж 3 хв при 1000 об/хв для видалення супернатанту, після чого ресуспендували з антитілом проти a-HER-3 2D1D12 (WO 03013602) (3 мкг/мл). Суспензію клітин інкубували на льоду впродовж 1 год, двічі промивали FACS буфером і ресуспендували з другим антитілом (100 мкл на лунку) (осляче антилюдське РЕ) (компанія Jackson), розбавленим 1:50 у FACS буфері. Суспензії клітин інкубували на льоду та у темряві впродовж 30 хв, двічі промивали FACS буфером і аналізували (FACS, компанія Beckman Coulter). Фіг. 1 показує репрезентативні результати аналізу і демонструє, що HER-3 експресується раками людини різноманітних типів. Приклад 3: Імунізація і титрування Білок ECD HER-3, який одержали, як описано у Прикладі 1, і клітини С32 (меланома людини; АТСС № CRL-1585) застосовували як антиген. Моноклональні антитіла проти HER-3 одержали шляхом послідовної імунізації мишей лінії XenoMouse® (лінії XenoMouse®: XMG1 та XMG4, компанія Abgenix, Inc., Fremont, штат Каліфорнія). Імунізацію мишей лінії XenoMouse® здійснювали шляхом ін'єкції до подушечки на лапці. Загальний 97473 34 об'єм кожної ін'єкції становив 50 мкл на мишу, 25 мкл на подушечку на лапці. У групи № 1 (10 мишей лінії XMG1), сенсибілізацію здійснювали 10 мкг білка ECD HER-3 у суміші 1:1 (у об'ємному відношенні) з TITERMAX GOLD® (компанія Sigma, Oakville, ON) на мишу. Подальші п'ять реімунізацій здійснювали 10 мкг білка ECD HER-3 у суміші 1:1 (у об'ємному відношенні) із 100 мкг алюмогелю (компанія Sigma, Oakville, ON) у апірогенному D-PBS (забуферений фосфатом фізіологічний розчин Дульбекко). Для шостої реімунізації застосовували 10 мкг білка ECD HER-3 у суміші 1:1 (у об'ємному відношенні) з TITERMAX GOLD®. Для сьомої реімунізації застосовували 10 мкг білка ECD HER-3 у суміші 1:1 (у об'ємному відношенні) з 100 мкг алюмогелю. Завершувальну реімунізації здійснювали 10 мкг білка ECD HER-3 у апірогенному DPBS без ад'юванту. Мишей лінії XenoMouse® за цим методом імунізували на 0 день, 4 день, 7 день, 11 день, 15 день, 20 день, 24 день і 29 день; гібридизацію здійснювали на 33 день. Два ретроорбітальні кровопускання здійснювали на 13 день після четвертої реімунізації і на 19 день після шостої реімунізації. Групи № 2 не було. У групи № 3 (10 мишей лінії XMG1) і групи № 4 (10 мишей лінії. XMG4) першу ін'єкцію здійснювали 7 10 клітин С32 у апірогенному забуференому фосфатом фізіологічному розчині Дульбекко (DPBS) у суміші 1:1 (у об'ємному відношенні) з TITERMAX GOLD® на мишу. Наступні чотири реімунізації 7 здійснювали 10 клітин С32 у апірогенному DPBS у сумипі з 25 мкг Adju-Phos і 10 мкг CpG на мишу. 7 Шосту реімунізацію здійснювали 10 клітин С32 у апірогенному DPBS у суміїпі 1:1 (у об'ємному відношенні) з TITERMAX GOLD® на мишу. Сьому, 7 восьму, дев'яту реімунізації здійснювали 10 клітин С32 у апірогенному DPBS у сумпді з 25 мкг AdjuPhos і 10 мкг CpG на мишу. Реімунізації з десятої по чотирнадцяту здійснювали 5 мкг білка ECD HER-3 у апірогенному DPBS у суміші з 25 мкг AdjuPhos і 10 мкг CpG на мишу. Кінцеву реімунізацію здійснювали 5 мкг білка ECD HER-3 у апірогенному DPBS без ад'юванту. Мишей лінії XenoMouse® групи № 3 і групи №4 за цим методом імунізували на 0 день, 3 день, 7 день, 11 день, 14 день, 17 день, 21 день, 24 день, 28 день, 33 день, 35 день, 38 день, 42 день і 45 день; гібридизацію здійснювали на 49 день. Три ретроорбітальні кровопускання здійснювали на 12 день після четвертої реімунізації, на 19 день після шостої реімунізації і на 40 день після дванадцятої реімунізації. Відбір тварин для збирання за титром У групи № 1 титри антитіл проти HER-3 у сироватці від імунізованих мишей лінії XenoMouse® визначали за допомогою ELISA проти білка ECD HER-3. Специфічний титр кожної тварини лінії XenoMouse® визначали за оптичною густиною при 650 нм; результати наведені у представленій нижче Таблиці 1. Значення титру є зворотною величиною найбільшого розведення сироваток із показником оптичної густини, який удвічі перевищував фоновий показник. Таким чином, чим більшим є значення, тим більшою була гуморальна імунна відповідь на ECD HER-3. Таблиця 1 Група № 1,XMG1 Миша № Р3421 Р3422 Р3423 Р3424 Р3425 Р3426 Р3427 Р3428 Р3429 Р34210 Негативний контроль Позитивний контроль Негативний контроль Позитивний контроль Після 4 ін'єкції 8,000 850 2,700 3,200 5,400 700 5,800 3,900 2,200 600 250 377,000 mAb IL-8, D39.2.1 xHER-3-2D1D12 У групи № 3 і групи № 4 титри антитіл проти HER-3 у сироватці від імунізованих мишей лінії XenoMouse® визначали за допомогою FACS із застосуванням клітин Rat1/HER-3 (лінія антигенпозитивних клітин) і клітин Rat1/pLSXN (лінія ан Після 6 ін'єкції 11,000 2,600 5,200 9,100 2,500 1,500 7,000 4,300 2,500 850 175 311,000 тигеннегативних клітин). Дані наведені у вигляді геометричного середнього (GeoMean) інтенсивності флуоресценції клітин у разі забарвлення серійних розведень зразків сироватки. Таблиця 2 Група № 3, XMG1 Номер миші Q832-1 Q832-2 Q832-3 Q832-4 Q832-5 Q832-6 Q832-7 Q832-8 Q832-9 Q832-10 Після 6 ін'єкції Після 12 ін'єкції Розведення зраз- геометричне сере- геометричне сере- геометричне сере- геометричне серека днє позитивних днє негативних днє позитивних днє негативних клітин клітин клітин клітин 1:50 9 10 11 10 1:250 6 9 6 6 1:1250 6 7 4 4 1:50 8 10 29 42 1:250 7 8 11 11 1:1250 5 6 6 5 1:50 7 12 11 9 1:250 5 7 5 5 1:1250 5 5 4 4 1:50 6 10 9 9 1:250 6 6 5 5 1:1250 5 5 4 4 1:50 11 11 17 13 1:250 10 9 7 6 1:1250 6 8 5 4 1:50 7 11 15 14 1:250 7 7 7 6 1:1250 5 6 6 4 1:50 8 11 7 15 1:250 6 7 5 5 1:1250 5 5 4 4 1:50 7 8 11 20 1:250 6 6 7 8 1:1250 5 5 5 4 1:50 7 12 15 16 1:250 6 8 6 5 1:1250 6 6 4 4 1:50 8 13 34 38 1:250 6 8 9 9 1:1250 6 6 5 4 37 97473 38 Таблиця 3 Група № 4, XMG4 Миша № Q856-1 Q856-2 Q856-3 Q856-4 Q856-5 Q856-6 Q856-7 Q856-8 Q856-9 Q856-10 Після 6 ін'єкції Після 12 ін'єкції Розведення зраз- геометричне се- геометричне се- геометричне се- геометричне сека реднє позитивних реднє негативних реднє позитивних реднє негативних клітин клітин клітин клітин 1:50 4 6 91 44 1:250 4 5 32 18 1:1250 4 4 19 10 1:50 4 8 148 54 1:250 4 5 89 23 1:1250 4 4 42 9 1:50 4 5 72 14 1:250 4 4 28 6 1:1250 4 4 18 4 1:50 4 5 11 49 1:250 4 5 10 17 1:1250 4 4 8 7 1:50 4 4 74 20 1:250 4 4 30 14 1:1250 4 4 16 6 1:50 4 5 86 21 1:250 4 4 32 10 1:1250 4 4 16 5 1:50 5 6 74 32 1:250 4 5 32 14 1:1250 4 4 16 6 1:50 4 5 106 14 1:250 4 4 45 6 1:1250 4 4 22 4 1:50 5 6 53 22 1:250 4 4 17 11 1:1250 4 4 11 5 1:50 4 5 72 53 1:250 4 4 26 17 1:1250 4 4 15 7 Приклад 4: Відновлення лімфоцитів, виділення В клітин, гібридизації і одержання гібридом Імунізованих мишей умертвляли, лімфовузли кожної групи збирали і змішували. Лімфоїдні клітини відділяли шляхом розтирання у DMEM (модифіковане за способом Дульбекко середовище Ігла) для виділення клітин із тканин, і згадані клітини суспендували у DMEM. Клітини підраховували, і до дебрісу додавали 0,9 мл DMEM на 100 мільйонів лімфоцитів із метою обережного, але повного ресуспендування клітин. Застосовуючи 100 мкл магнітних кульок CD90+ на 100 мільйонів клітин, клітини мітили шляхом інкубування останніх із магнітними кульками при температурі 4°С впродовж 15 хв. Мічену магнітним шляхом су8 спензію клітин, яка містила до 10 позитивних 9 клітин (або до 210 від загальної кількості клітин), вносили до колонки LS+, і колонку промивали DMEM. Ефлюент у повному обсязі збирали як СD90-негативну фракцію (більшість цих клітин, як очікувалось, повинна була бути В клітинами). Гібридизацію здійснювали шляхом змішування промитих збагачених вищезгаданих В клітин і несекреторних клітин мієломи P3X63Ag8.653, закуплених від АТСС (номер за каталогом CRL 1580) (Кірні (Kearney) та інші, J. Immunol, 123, 1979, 1548-1550) у співвідношенні 1:1. Одержану суміш клітин обережно осаджували шляхом центрифугування при 800 g. Після повного видалення супернатанту клітини обробляли 2-4 мл розчину пронази (компанія CalBiochem, номер за каталогом 53702; 0,5 мг/мл у PBS) впродовж не більше 2 хв. Після цього додавали від 3 мл до 5 мл FBS для припинення активності ферменту, і загальний об'єм суспензії доводили до 40 мл за допомогою ECFS (розчин для електрогібридизації клітин) (0,3 Μ розчин цукрози, компанія Sigma, номер за каталогом S7903, 0,1 мМ розчин ацетату магнію, компанія Sigma, номер за каталогом М2545, 0,1 мМ розчин ацетату кальцію, компанія Sigma, номер за каталогом С4705). Супернатант видаляли після центрифугування, і клітини ресуспендували у 40 мл ECFS. Цю стадію промивання повторювали, і клітини знову ресуспендували 6 у ECFS до концентрації 210 клітин/мл. Електрогібридизацію клітин здійснювали за допомогою гібридизаційного генератора, модель ЕСМ2001, компанія Genetronic, Inc., San Diego, 39 штат Каліфорнія. Величина застосованої гібридизаційної камери дорівнювала 2,0 мл із наведеними нижче уставками приладів: умови впорядкованого розміщення: напруга: 50 В, час: 50 с, руйнування мембрани: напруга 3000 В, час: 30 мкс; тривалість постгібридизаційного витримування: 3 с. Після електрогібридизації суспензії клітин обережно видаляли з гібридизаційної камери за стерильних умов і переносили до стерильної пробірки, яка містила такий самий об'єм середовища для культивування гібридом (DMEM (компанія JRH Biosciences), 15% FBS (компанія Hyclone), яке було доповнене L-глутаміном, пеніциліном/стрептоміцином, ОРІ (оксалоацетат, піруват, інсулін великої рогатої худоби) (все від компанії Sigma) та IL-6 (компанія Boehringer Mannheim). Клітини інкубували впродовж 15-30 хв при температурі 37°С, після чого центрифугували при 400 g впродовж 5 хв. Клітини обережно ресуспендували у невеликому об'ємі середовища для відбору гібридом (середовище для культивування гібридом, доповнене 0,5НА (гіалуронова кислота) (компанія Sigma, номер за каталогом А9666)), і об'єм відповідним чином доводили за допомогою певної додаткової кількості середовища для відбору гібридом, виходячи з кінцевого висівання 6 загалом 510 В клітин на 96-лунковий планшет, 200 мкл на лунку. Клітини обережно перемішували, за допомогою піпетки переносили на 96лункові планшети, і витримували для росту. На 7 день або 10 день половину середовища видаляли, і клітини підживлювали середовищем для відбору гібридом. Приклад 5: Відбір антитіл-кандидатів за допомогою ELISA Після 14 днів культивування первинну перевірку супернатантів гібридом з групи № 1 (миші у групі один були довільно розділені на гібридизацію № 1 і № 2) на специфічні антитіла проти HER-3 здійснювали за допомогою ELISA із застосуванням очищеного міченого гістидином ECD HER-3 із зустрічною перевіркою проти стороннього міченого гістидином білка за допомогою ELISA із застосуванням козячого анти-huIgGFcHRP (компанія Caltag Inc., номер за каталогом Η10507, із застосуванням розведення 1:2000) для виявлення зв'язування людського IgG з ECD HER-3, іммобілізованим на планшетах для проведення ELISA. Супернатанти старих культур із лунок із ростом позитивних гібридомних клітин, виходячи з результатів первинної перевірки, видаляли, HER-3-позитивні гібридомні клітини суспендували свіжим середовищем для культивування гібридом і переносили на 24-лункові планшети. Після культивування впродовж 2 днів ці супернатанти були готовими для другої підтверджувальної перевірки. Під час проведення другої підтверджувальної перевірки на HER-3специфічні повністю людські антитіла IgGk, клітини, позитивні за результатами першої перевірки, перевіряли за допомогою ELISA з двома наборами ідентифікувальних антитіл: козяче антиhuIgGFc-HRP (компанія Caltag Inc., номер за каталогом Н10507, із застосуванням розведення 1:2000) для виявлення людського ланцюга типу 97473 40 гамма і козяче анти-hIgkappa-HRP (компанія Southern Biotechnology, номер за каталогом 206005) для виявлення людського легкого ланцюга типу каппа. З групи № 1 одержали 91 повністю людське IgG/каппа HER-3 специфічне моноклональне антитіло. Приклад 6: Відбір антитіл-кандидатів за допомогою FMAT/FACS Після 14 днів культивування супернатанти гібридом із групи № 3 і групи № 4 (гібридизація № 3 і № 4) перевіряли на HER-3-специфічні моноклональні антитіла за допомогою FMAT. Під час першої перевірки супернатанти гібридом із кінцевим розведенням 1:10 інкубували з клітинами Rat1-Неr3, які експресували людський HER-3, і з 400 нг/мл кон'югованого з Су5 козячого F(ab')2 антилюдського IgG, Fc-специфічного антитіла (компанія Jackson ImmunoResearch, номер за каталогом R109-176-098) при кімнатній температурі впродовж 6 год. Зв'язування антитіл і виявлення комплексів антитіла-клітини визначали за допомогою FMAT (компанія Applied Biosystems). Неспецифічне зв'язування антитіл із клітинами визначали за їх зв'язуванням із вихідними клітинами Rat1. Під час першої перевірки гібридизації № 3 було відібрано загалом 420 гібридом, які продукували HER-3-специфічні антитіла. Супернатанти цих збільшених за об'ємом культур знову перевіряли за допомогою того самого методу FMAT, і було підтверджено специфічне зв'язування 262 з них із клітинами, які експресували HER-3. Під час першої перевірки гібридизації № 4 було відібрано загалом 193 гібридоми, які продукували HER-3-специфічні антитіла. Супернатанти цих збільшених за об'ємом культур перевіряли за допомогою FMAT, і було підтверджено специфічне зв'язування 138 з них із клітинами, які експресували HER-3. Під час проведення підтверджувального аналізу клітини Rat1-Xher3 і вихідні клітини Rat1 (як негативний контроль) інкубували із супернатантами гібридом у розведенні 1:2 впродовж 1 год при температурі 40°С у PBS, який містив 2% FBS. Після промивання PBS зв'язування антитіл із клітинами виявляли за допомогою 2,5 мкг/мл кон'югованого з Су5 козячого F(ab)2 антилюдського IgG, Fc-специфічного антитіла (JIR № 109-176-098) і 5 мкг/мл кон'югованого з РЕ козячого F(ab)2 анти-людського каппаспецифічного антитіла (SB № 2063-09). Після видалення незв'язаних антитіл шляхом промивання PBS, клітини фіксували за допомогою cytofix (BD № BD 51-2090KZ) у розведенні 1:4 і аналізували за допомогою FACSCalibur. Приклад 7: Відбір гібридом для клонування Антитіла з груп № 1 і № 2 відбирали для клонування гібридом на основі специфічності до HER-3, порівняно з HER-1 (EGFR), HER-2 і HER-4 у ELISA із застосуванням очищених рекомбінантних позаклітинних доменів, доступних від, наприклад, компанії R&D Biosystems, і аналізу на основі FACS людських ліній ракових клітин, які експресують різні члени родини HER, та більше за п'ятикратне посилення середньої інтенсивності флуоресценції при FACS забарвленні HER-3позитивних клітин, порівняно із фоновою інтенси 41 вністю. Виходячи із цих критеріїв, для клонування шляхом висівання клітин методом серійних розведень було відібрано загалом 23 лінії гібридом. Антитіла з групи № 3 і групи № 4 відбирали для клонування гібридом на основі специфічності до HER-3, порівняно з HER-1 (EGFR), HER-2 і HER-4 плюс три інші критерії. Першим критерієм було масове обстеження за допомогою ELISA для виявлення антитіл з антигенними детермінантами, які знаходились у межах домену L2 HER-3 (дивись Приклад "Структурний аналіз антитіл проти HER-3 за цим винаходом"). Другим критерієм була нейтралізація зв'язування біотинілованого гергуліну-альфа з клітинами, які експресують HER-3, у аналізі на основі FACS. Клітини SKBR-3 збирали, промивали у культуральному середовищі, осаджували шляхом центрифугування і ресуспендували у культуральному середовищі. Ресуспендовані клітини поділяли на аліквоти на 96-лункових планшетах. Планшети центрифугували для осадження клітин. Експериментальні антитіла у вичерпаних супернатантах гібридом додавали із розрахунку 25 мкл на лунку та інкубували впродовж 1 год на льоду для забезпечення зв'язування антитіл. До кожної лунки додавали 50 мкл 10 нМ розчину гергуліну-альфа (компанія R&D Biosystems, Minneapolis, штат Міннесота) до кінцевої концентрації 5 нМ та інкубували на льоду впродовж 1,5 год. Клітини промивали у 150 мкл PBS, осаджували шляхом центрифугування, і супернатант видаляли. Клітини ресуспендували у 50 мкл козячого aнти-HRG-альфа поліклонального антитіла (10 мкг/мл) та інкубували впродовж 45 хв на льоду. Клітини промивали у 200 мкл PBS, осаджували шляхом центрифугування, і супернатант видаляли. Додавали 50 мкл розчину кролячого міченого Су5 антикозячого поліклонального антитіла (5 мкг/мл) плюс 7AAD (10 мкг/мл), та інкубували на льоду впродовж 15 хв. Клітини промивали у 200 мкл PBS, осаджували шляхом центрифугування, і супернатант видаляли. Клітини ресуспендували у 100 мкл FACS буфера і зчитували за допомогою FACS. Експериментальними антитілами проти HER-3, які зменшували зв'язування гергуліну-альфа, були антитіла, які мали найнижчу інтенсивність флуоресценції. Як позитивні контролі застосовували серійні розведення (1:5) від 10000 нг/мл до 16 нг/мл мишачого моноклонального антитіла проти HER-3 (105.5) або людського моноклонального антитіла IgG1 проти HER-3, U1-49. Негативними контролями був сам гергулін-альфа, самі клітини, саме козяче анти-гергулін-альфа поліклональне антитіло і саме кроляче мічене Су-5 антикозяче поліклональне антитіло. Третім критерієм була відносна класифікація за спорідненістю та/або більш високою відносною середньою інтенсивністю флуоресценції при проведенні FACS із застосуванням ліній клітин, які експресують HER-3. Відносну класифікацію за спорідненістю здійснювали шляхом нормалізації концентрації антитіл, специфічних до HER-3, і нанесення на графік у залежності від даних 97473 42 ELISA з обмеженою кількістю антигену наведеним нижче чином. Нормалізація концентрацій антитіла, специфічного до антигену із застосуванням ELISA з великою кількістю антигену За допомогою ELISA були нормалізовані супернатанти за концентрацією антитіла, специфічного до антигену. Застосовуючи два паралельно титрованих людських антитіла IgG1 проти HER-3 з групи № 1 із відомою концентрацією, одержали стандартну криву, і з цим стандартом порівнювали кількість антитіл, специфічних до антигену, у експериментальних супернатантах гібридом групи № 3 і групи № 4. Подібним чином була визначена концентрація людського антитіла IgG проти HER-3 у кожній культурі гібридоми. Нейтравідинові планшети одержували шляхом сенсибілізації розчином нейтравідину (8 мкг/мл) у 1xPBS/0,05% азиду натрію планшетів Costar 3368 із зв'язувальним середовищем із розрахунку 50 мкл на лунку з інкубуванням впродовж ночі при температурі 4°С. Наступного дня планшети блокували розчином 1xPBS/1% знежиреного молока. Фотобіотинілований мічений гістидином ECD HER-3 (500 нг/мл) у розчині 1xPBS/1% знежиреного молока зв'язувався з нейтравідиновими планшетами шляхом інкубування впродовж 1 год при кімнатній температурі. Супернатант гібридом, серійно розведений 1:2,5 від початкового розведення 1:31 до кінцевого розведення 1:7568 у розчині 1xPBS/1% знежиреного молока/0,05% азиду, додавали з розрахунку 50 мкл на лунку, після чого інкубували впродовж 20 год при кімнатній температурі. Серійні розведення застосовували для забезпечення одержання показань оптичної густини для кожного невідомого у лінійному діапазону згаданого аналізу. Після цього друге ідентифікувальне антитіло, козяче антилюдське IgG Fc HRP (400 нг/мл), у розчині 1xPBS/1% знежиреного молока додавали з розрахунку 50 мкл на лунку. Через 1 год при кімнатній температурі планшети знову п'ять разів промивали водою, і до кожної лунки додавали 50 мкл однокомпонентного субстрату ТМВ. Реакцію припиняли через 30 хв шляхом додання до кожної лунки 50 мкл 1 Μ розчину хлористоводневої кислоти, і планшети зчитували при довжині хвилі 450 нм. Стандартну криву одержали за двома IgG1 HER-3 mAbs (моноклональні антитіла) з групи № 1, які серійно розводили (1:2) з 1000 нг/мл до 0,06 нг/мл, і визначали за допомогою ELISA за вищенаведеним методом. Для кожного невідомого, показання оптичної густини у лінійному діапазоні аналізу застосовували для визначення концентрації людського IgG проти HER-3 у кожному зразку. Аналіз з обмеженою кількістю антигену являє собою метод, який ранжує за спорідненістю антигенспецифічні антитіла, які були одержані у супернатантах культур В клітин, відносно усіх інших антигенспецифічних антитіл. За умови дуже слабкої сенсибілізації антигеном, лише антитіла з найвищою спорідненістю є здатними до зв'язування з будь-яким виявлюваним рівнем у стані рівноваги (Дивись, наприклад, WO/03048730A2 43 під назвою "Identification of high affinity molecules by limited dilution screening", яка була опублікована 12 червня 2003 року). У цьому випадку два mAbs з групи № 1, обидва з відомими концентраціями і Ко, були застосовані як критерії при проведенні аналізу. Нейтравідинові планшети одержували шляхом сенсибілізації розчином нейтравідину (8 мкг/мл) у 1xPBS/0,05% азиду натрію планшетів Costar 3368 із зв'язувальним середовищем із розрахунку 50 мкл на лунку з інкубуванням впродовж ночі при температурі 4°С. Наступного дня планшети блокували розчином 1xPBS/1% знежиреного молока. Біотинілований мічений гістидином ECD HER-3 (50 мкл на лунку) зв'язувався з 96-лунковими нейтравідиновими планшетами у п'яти концентраціях: 125 нг/мл, 62,5 нг/мл, 31,2 нг/мл, 15,6 нг/мл та 7,8 нг/мл у розчині 1xPBS/1% знежиреного молока впродовж 1 год при кімнатній температурі. Кожний планшет 5 разів промивали водою. Супернатанти гібридом, серійно розведені 1:31 у розчині 1xPBS/1% знежиреного молока/0,05% азиду, додавали з розрахунку 50 мкл на лунку. Після 20 год інкубування при кімнатній температурі на струшувальному пристрої планшети знову 5 разів промивали dH2O. Після цього друге ідентифікувальне антитіло, козяче антилюдське IgG Fc HRP (пероксидаза з хрону) (400 нг/мл), у розчині 1xPBS/1% знежиреного молока додавали з розрахунку 50 мкл на лунку. Через 1 год при кімнатній температурі планшети знову 5 разів промивали dH2O, і до кожної лунки додавали 50 мкл однокомпонентного субстрату ТМВ. Реакцію припиняли через 30 хв шляхом додання до кожної лунки 50 мкл 1 Μ розчину хлористоводневої кислоти, і планшети зчитували при довжині хвилі 450 нм. Показання оптичної густини концентрації антигену, яка забезпечувала одержання значень оптичної густини у лінійному діапазоні, застосовували для аналізу даних. Побудова кривої за даними щодо високої концентрації антигену, які надають можливість здійснення порівняльного визначення концентрації специфічних антитіл (докладніше дивись вище), у зіставленні з оптичною густиною при обмеженій кількості антигену, ілюструвала, що антитіла з відносно вищою спорідненістю, наприклад, антитіла, які зв'язались, мали вищу оптичну густину у аналізі з обмеженою кількістю антигену, з одночасними меншими кількостями IgG HER-3 антитіла у супернатанті. Гібридоми з групи № 3 і групи № 4 для 33 антитіл із найкращими характеристиками у цих серіях аналізів були відібрані для клонування шляхом висіву гібридом методом серійних розведень. За альтернативним варіантом FACS аналіз експресії HER-3 клітинами Rat1/pLXSN та Rat1/HER-3 показав подібні результати (відсутність перехресної реактивності з ендогенними антигенними детермінантами пацюків) (Фіг. 2). 5 Докладніше, 1х10 клітин збирали з 10 мМ EDTA у PBS, один раз промивали FACS буфером (PBS, 3% FCS, 0,4% азиду), і висівали на 96лунковий планшет із круглим дном. Клітини центрифугували впродовж 3 хв при 1000 об/хв 97473 44 для видалення супернатанту, після чого ресуспендували із специфічними антитілами родини HER (3 мкг/мл). Суспензію клітин інкубували на льоду впродовж 45 хв, двічі промивали FACS буфером і ресуспендували з другим антитілом (100 мкл на лунку) (осляче антилюдське РЕ) (компанія Jackson Immunoresearch, штат Пенсільванія), розбавленим 1:50 у FACS буфері. Суспензії клітин інкубували на льоду та у темряві впродовж 30 хв, двічі промивали FACS буфером і аналізували (FACS, компанія Beckman Coulter). Приклад 8: Структурний аналіз антитіл проти HER-3 за цим винаходом У наведеному нижче обговоренні пропонується структурна інформація, яка стосується антитіл, які були одержані за цим винаходом. Для аналізу структур антитіл, які були одержані за цим винаходом, з конкретних гібридом ампліфікували гени, які кодують фрагменти важких і легких ланцюгів. Секвенування здійснювали наведеним нижче чином: VH і VL транскрипти ампліфікували з окремих клонів гібридом у 96-лунковому планшеті за допомогою полімеразної ланцюгової реакції із зворотною транскриптазою (RT-PCR). Роlу(А)+ мРНК 5 виділяли приблизно з 2х10 клітин гібридом за допомогою набору Fast-Track Kit (компанія Invitrogen). Для кожної гібридоми було здійснено чотири ПЛР: дві для легкого ланцюга типу каппа ( ) і дві для важкого ланцюга типу гамма (). Для ампліфікування застосовували набір для проведення одностадійної полімеразної ланцюгової реакції при кімнатній температурі (компанія Qiagen, номер за каталогом 210212). У сполучених полімеразних ланцюгових реакціях, які проводили при кімнатній температурі, кДНК синтезували сумішшю ферментів для застосування при кімнатній температурі (Omniscript та Sensiscript) із застосуванням специфічного праймеру з антисмисловою послідовністю, який відповідав С- або консенсусній послідовності СН1 ділянок С генів. Зворотну транскрипцію здійснювали при температурі 50°С впродовж 1 год з подальшою ПЛР ампліфікацією кДНК за допомогою ДНКполімерази HotStarTaq для високої специфічності та чутливості. У кожній полімеразній ланцюговій реакції застосовували суміш 5'-прямих праймерів; основу послідовностей праймерів становлять лідерні послідовності VH та VK, доступні на Vbase веб-сайті (http://vbase.mrc-cpe.cam.ac.uk/). Полімеразні ланцюгові реакції проводили при температурі 94°С впродовж 15 хв, після "гарячого запуску" було здійснено 40 циклів при температурі 94°С тривалістю 30 с (денатурація), при температурі 60°С тривалістю 30 с (ренатурація) і при температурі 72°С тривалістю 1 хв (подовження). Продукти ПЛР очищали і піддавали прямому секвенуванню із застосування прямих і зворотних ПЛР праймерів за допомогою набору АВІ PRISM BigDye terminator cycle sequencing ready reaction Kit (компанія Perkin Elmer). Обидва ланцюги секвенували за допомогою наборів Prism dyeterminator sequencing kits на секвенаторі АВІ 377. Аналіз послідовностей 45 97473 Аналіз людських V важких і V каппа кДНК послідовностей антитіл проти HER-3 здійснювали шляхом порівняльного аналізу послідовностей HER-3 з людськими V важкими і V каппа послідовностями зародкового типу із застосуванням пакету програм компанії Abgenix, який належить цій установі (5AS). Згадана програма ідентифікувала застосування V гена, D гена і J гена, а також нуклеотидні вставки на рекомбінантних зчленуваннях і соматичні мутації. Амінокислотні послідовності одержали також in silico для ідентифікування соматичних мутацій. Подібні результати можна одержати за допомогою комерційно доступних програм для аналізу послідовностей і загальнодоступної інформації щодо послідовності людських V, D і J генів, наприклад, Vbase (http://vbase.mrc-cpe.cam.ac.uk/). Молекулярне клонування mAb (моноклональне антитіло) U1-59 Тотальну РНК екстрагували з лунки з культурою клітин тканини, яка містить численні гібридомні лінії диференціювання, у тому числі гібридомну лінію диференціювання, яка секретує антитіло U1-59. Варіабельну ділянку важкого ланцюга ампліфікували за допомогою 5'-лідерних специфічних для родини VH праймерів, із 3'-Сгамма праймером. Головну смугу ампліфікували за допомогою VH4 праймеру, жодних інших смуг не спостерігалось. VH4-34 гамма фрагмент клонували до pCDNA експресійного вектора у межах рамки зчитування з людським геном константної ділянки гамма 1. Варіабельну ділянку важкого ланцюга IgM ампліфікували за допомогою 5'-праймерів, спе 46 цифічних для родини VH із 3'-праймером константної ділянки мю. Головну смугу ампліфікували за допомогою VH2 праймеру, жодних інших смуг не спостерігалось. VH2-5 мю фрагмент клонували до pCDNA експресійного вектора у межах рамки зчитування з людським геном константної ділянки мю. V каппа ланцюги ампліфікували і секвенували. Були ідентифіковані RT-PCR продукти чотирьох ланцюгів типу каппа. Згадані продукти були секвеновані, і після секвенувального аналізу шляхом трансляції in silico лише три з них мали відкриті рамки зчитування. Ці три функціональні ланцюги типу каппа були клоновані з лунки з олігоклональною U1-59 гібридомою, і ідентифіковані на основі застосування V каппа гена як (1) VK1 A3-JK2, (2) VK1 A20-JK3 і (3) B3-JK1. Усі V-каппа були клоновані до pCDNA експресійного вектора у межах рамки зчитування з людським геном константної ділянки легкого ланцюга типу каппа. Трансфекції: Кожний важкий ланцюг трансфікували кожним ланцюгом типу каппа шляхом тимчасової трансфекції з одержанням загалом 6 пар важкий ланцюг/легкий ланцюг типу каппа. Наслідком трансфікування ланцюга типу гамма ланцюгом типу каппа А20 був низький рівень експресії антитіла, у той час як жодне антитіло не секретувалось або не виявлялось у разі котрансфекції ланцюга типу каппа А20 ланцюгом типу мю. Загалом для проведення аналізу зв'язування HER-3, були доступні три підгрупи IgG і дві підгрупи IgM. Ланцюг VH D J Константна ділянка Важкий Важкий Легкий Легкий Легкий Легкий VH4-34 VH2-5 A3 А20 В3 А27 D1-20 D6-6 JH2 JH4b JK2 JK3 JK1 JK3 Гамма Мю Каппа Каппа Каппа Каппа Відкрита рамка зчитування Так Так Так Так Так Ні При проведенні FACS зв'язувальна активність із клітинами ліній HER-3+ була виявлена у mAb IgG1, яке складалось з VH4-34 і ланцюга типу каппа В3. Жодна інша комбінація VH/Vk у разі проведення FACS із застосуванням ліній клітин HER-3+ не давала флуоресцентного сигналу, який би перевищував фоновий. Зв'язувальна конкуренція антитіл проти HER-3 Поділ множинних конкурентних антитіл на скупчення здійснювали за публікацією Жа (Ла) та інші, J. Immunol. Methods, 288, 91-98 (2004) для оцінки сукупностей антитіл проти HER-3, які конкурують за зв'язування з HER-3. Випробувані антитіла проти HER-3 з групи № 1 розподілились на 5 скупчень на основі конкурування за зв'язування. Скупчення №1 U1-42 U1-44 U1-62 U1-46 U1-47 U1-58 Скупчення №2 U1-48 U1-50 U1-51 U1-49 Скупчення №3 U1-52 Скупчення №4 U1-38 U1-39 Скупчення №5 U1-45 U1-40 U1-41 U1-43 U1-61 U1-53 U1-55 Визначення характеристик антигенних детермінант антитіл проти HER-3 Визначали характеристики антигенних детермінант людських антитіл проти HER-3 за цим винаходом. Спочатку дот-блотинг відновленого, "денатурованого, очищеного ECD білка міченого гістидином HER-3 продемонстрував відсутність зв'язування випробуваних антитіл проти HER-3 (U1-59, U1-61, U1-41, U1-46, U1-53, U1-43, U1-44, U1-47, U1-52, U1-40, U1-49), що свідчило про те, що усі вони мали антигенні детермінанти, чутливі до відновлення дисульфідних зв'язків, що дозволяє припустити присутність у всіх згаданих антитіл антигенних детермінант переривчастого типу. Після цього антитіла були картовані до визначених доменів молекули HER-3 шляхом конструювання різних химерних людських-пацючих молекул HER-3, виходячи з поділу позаклітинного домену HER-3 на чотири домени: 1) L1 (D1): другорядний лігандзв'язувальний домен, 2) S1 (D2): перший збагачений цистеїном домен, 3) L2 (D3): головний лігандзв'язувальний домен, і 4) S2 (D4): другий збагачений цистеїном домен. Позаклітинний домен (ECD) кДНК людського HER-3 ампліфікували з Rat1-HER-3 клітин. кДНК пацючого HER-3 ампліфікували за допомогою RT-PCR із РНК печінки пацюків і підтверджували секвенуванням. кДНК, які експресували ECD людського і пацючого HER-3, клонували до експресійних векторів ссавців, як V5-His гібридні білки. Домени ECD людського HER-3 переносили до каркаса, який надавався ECD пацючого HER-3, за допомогою внутрішніх сайтів рестрикції Mfe1, BstX1 та Dralll. Подібним чином були сконструйовані різні химерні пацючі/людські гібридні білки HER-3 ECD HIS (амінокислоти 1-160, 161-358, 359-575, 1-358, 359-604) і експресовані шляхом тимчасової трансфекції клітин НЕК 293Т. Експресію згаданих генно-інженерних конструкцій підтверджували за допомогою пацючого поліклонального антитіла проти людського HER-3. Людські моноклональні антитіла перевіряли за допомогою ELISA на зв'язування із секретованими химерними ECD. Два людські антитіла, у тому числі антитіло U1-59, перехресно реагували з пацючим HER-3. Для визначення зв'язувальних доменів ці моноклональні антитіла перевіряли проти скороченої форми HER-3, який являє собою мічений гістидином L1-S1-V5 білок, очищений із супернатанту клітин НЕК 293Т, трансфікованих плазмідною ДНК, яка кодує експресію L1-S1 позаклітинних доменів HER-3. Моноклональне антитіло U1-59 зв'язувалось із L1-S1 білком при проведенні ELISA, що свідчить на користь того, що його антигенна детермінанта знаходиться на L1-S1. Моноклональне антитіло 2.5.1 не зв'язувалось із L1S1 білком, що свідчить на користь того, що його антигенна детермінанта знаходиться на L2-S2. Додаткове картування антитіла U1-59 здійснювали за допомогою SELDI (мас-спектроскопія з іонізацією методом лазерної десорбції вторинного випромінювання із часопролітним аналізатором) із протеолітичними гідролізатами комплексів mAb-HER-3 ECD на чіпі. Картування антигенних детермінант U1-59 за допомогою SELDI Додаткове картування антитіла U1-59 здійснювали за допомогою SELDI протеолітичними гідролізатами комплексів mAb-HER-3 ECD на чіпі. Білок А ковалентно зв'язували із чіпом (білок PS20) і застосовували для захоплення моноклонального антитіла U1-59. Після цього комплекс чіпу-білка PS20 і моноклонального антитіла інкубували з HER-3-His очищеним антигеном. Потім комплекс антитіло-антиген розщеплювали високою концентрацією Asp-N. Чіп промивали, наслідком чого було затримання лише пептиду HER-3, зв'язаного з антитілом на чіпі. Антигенну детермінанту визначали за допомогою SELDI та ідентифікували за масою фрагмента. Ідентифікований 6814 D фрагмент відповідав двом можливим очікуваним пептидам, які одержали шляхом часткового розщеплення HER-3-his ECD. Обидва пептиди, які взаємонакладались, були картовані до домену S1. Шляхом сполучення результатів SELDI із зв'язуванням із делеційною генноінженерною конструкцією HER-3, згадану антигенну детермінанту було картовано до залишків 252-325. Місця знаходження зв'язувальних доменів на позаклітинній частині HER-3, які розпізнаються людськими моноклональними антитілами проти HER-3 за цим винаходом, підсумовані у Таблиці 4. Результати картування доменів антигенних детермінант співпадали з результатами скупчень конкурентного зв'язування антитіл, причому антитіла, які взаємно перехресно конкурували за зв'язування з HER-3, бути також картовані до тих самих доменів на HER-3 (Фіг. 3). 49 97473 50 Таблиця 4 Узагальнене зведення зв'язувальних антигенних детермінант моноклональних антитіл на основі результатів ELISA МоноклоПерехресно реа- Зв'язувальний доМоноклоПерехресно реа- Зв'язувальний дональне антиті- гуючий пацюк мен нальне антиті- гуючий пацюк мен ло ло U1-59 Так S1 U1-2 Ні L2 U1-61 Ні L2 U1-7 Ні L2 U1-41 Ні L2 U1-9 Ні L2 U1-46 Ні S1 U1-10 Ні L2 U1-53 Ні L2 U1-12 Ні L2 U1-43 Ні L2 U1-13 Ні L2 U1-44 Ні S1 U1-14 Ні L2 U1-47 Ні S1 U1-15 Ні L2 U1-52 Так L2S2 U1-19 Ні L2 U1-40 Ні L2 U1-20 Ні L2 U1-49 Ні L1 U1-21 Ні L2 U1-21 Ні L2 U1-28 Ні L2 U1-22 Ні L2 (U1-31) Ні L2 U1-23 Ні L2 U1-32 Ні L2 U1-24 Ні L2 (U1-35) Ні L2 U1-25 Ні L2 U1-36 Ні L2 U1-26 Ні L2 (U1-37) Ні L2 U1-27 Ні L2 Приклад 9: Визначення канонічних класів антитіл Чотья (Chothia) та інші описали структуру антитіла з точки зору "канонічних класів" для гіперваріабельних ділянок кожного імуноглобулінового ланцюга (J. Моl. Віоl, 20 серпня 1987 року, 196(4):901-17). Атомні структури Fab та VL фрагментів різноманітних імуноглобулінів були проаналізовані для визначення взаємозв'язку між їхніми амінокислотними послідовностями і об'ємними структурами їхніх антигензв'язувальних центрів: Чотья (Chothia) та інші встановили, що існує відносно небагато залишків, які, завдяки своїй упаковці, водневим зв'язкам або здатності до приймання незвичних конформацій типу фі, псі або омега, несуть головну відповідальність за конформації гіперваріабельних ділянок головного ланцюга. Було встановлено, що ці залишки знаходяться на ділянках у межах гіперваріабельних ділянок і у каркасі консервативної β-складки. Шляхом перевірки послідовностей імуноглобулінів, які мають невідому структуру, Чотья (Chothia) та інші продемонстрували, що багато імуноглобулінів мають гіперваріабельні ділянки, розмір яких є подібним до розміру невідомих структур, і які додатково містять ідентичні залишки у центрах, які несуть відповідальність за конформацію, що спостерігається. Їхнє відкриття дозволяє припустити, що ці гіперваріабельні ділянки мають конформації, які є близькими до конформацій у невідомих структурах. Для п'яти гіперваріабельних ділянок репертуар конформацій виявився таким, що обмежується відносно невеликою кількістю окремих структурних класів. Ці широко розповсюджені конформації гіперваріабельних ділянок головного ланцюга одержали назву "канонічних структур". У подальших роботах Чотья (Chothia) та інші (Nature, 21-28 грудня 1989 року, 342 (6252):877883) та інші (Мартін (Martin) та інші, J. Моl. Віоl, 15 листопада 1996 року, 263 (5):800-815) підтвердили існування невеликого репертуару конформацій головного ланцюга для щонайменше п'яти із шести гіперваріабельних ділянок антитіл. Гіперваріабельні ділянки кожного антитіла, опис яких наведено вище, аналізували для визначенняїхніх канонічних класів. Як відомо, канонічні класи були визначені лише для CDR1 та CDR2 важкого ланцюга антитіла, а також для CDR1, CDR2 та CDR3 легкого ланцюга антитіла. У таблицях, наведених нижче, наведені узагальнені результати згаданого аналізу. Дані з канонічних класів наведені у формі HCDR1-HCDR2LCDR1-LCDR2-LCDR3, де "HCDR" означає гіперваріабельну ділянку важкого ланцюга, a "LCDR" означає гіперваріабельну ділянку легкого ланцюга. Так, наприклад, канонічний клас 1-3-2-1-5 означає антитіло, яке має HCDR1, яка належить до канонічного класу 1, HCDR2, яка належить до канонічного класу 3, LCDR1, яка належить до канонічного класу 2, LCDR2, яка належить до канонічного класу 1, і LCDR3, яка належить до канонічного класу 5. Визначення зв'язували з конкретним канонічним класом у разі, коли існувала 70% або більша ідентичність амінокислот антитіла з амінокислотами, визначеними для кожного канонічного класу. Амінокислоти, визначені для кожного антитіла, можна знайти, наприклад, у статтях Чотья (Chothia) та інші, на які робилось посилання ви 51 97473 ще. У Таблиці 5 і Таблиці 6 наведено дані по канонічним класам для кожного антитіла проти HER-3. У разі ідентичності, меншої за 70%, визначення канонічного класу помічається зірочкою ("*") для позначення того, що найкраще визначення відповідного канонічного класу було зроблено на основі довжини кожної гіперваріабельної ділянки і узагальненої сукупності даних. У разі 52 відсутності відповідного канонічного класу з такою самою довжиною гіперваріабельної ділянки, визначення канонічного класу помічається літерою s і цифрою, наприклад, "sl8", що означає, що розмір гіперваріабельної ділянки дорівнює 18. У разі відсутності доступних даних із секвенування для важкого або легкого ланцюгів, канонічний клас помічається літерою "Z". Таблиця 5 Антитіло (сортоваH1-H2-L1-L2-L3 не) U1-38 3-1-4-1-1 U1-39 1-1-4-1*-1 U1-40 3-1-4-1-1 U1-41 3-1-2-1-1 U1-42 1-2-2-1-1 U1-43 3-1-2-1-1 U1-44 1-2-2-1-1 U1-45 1-2*-2-1-1 U1-46 3-s18-Z-Z-Z U1-47 3-s18-2-1-1 U1-48 1-1-Z-Z-Z U1-49 1-3-4-1-1 U1-50 3-1-2-1-1 U1-51 1-1-3-1-1 U1-52 3-1-8-1-1 U1-53 1-3-2-1-1 U1-55 3-1-4-1-1 U1-57 3-1-4-1-1 U1-58 1-3-2-1-1 U1-59 1-1-3-1-1 U1-61.1 3-1*-2-1-1 U1-62 1-2-8-1-1 U1-2 3-1-2-1-1 Довжина Н3 9 6 15 15 9 17 9 16 17 16 16 17 17 19 15 10 15 15 12 9 16 12 12 У Таблиці 7 наведено результати аналізу кількості антитіл/клас. Кількість антитіл, які мають конкретний канонічний клас, визначений у лівому стовпчику, вказана у правому стовпчику. До цього підрахунку не включені чотири моноклональні антитіла, яким бракує даних із послідовності одного ланцюга, і які, унаслідок цього, мають "Z" у канонічному визначенні. Найпоширенішою структурою є 3-1-2-1-1: Цю комбінацію мали двадцять одне з сорока одного моноклонального антитіла, які мали послідовності як важких, так і легких ланцюгів. Таблиця 6 H1-H2-L1-L2-L3 1-1-3-1-1 1-1-4-1*-! 1-2-2-1-1 1-2-8-1-1 1-3-2-1-1 1-3-4-1-1 3-1-2-1-1 3-1-4-1-1 3-1-8-1-1 3-s18-2-1-1 Кількість 2 1 4 1 3 1 21 5 2 1 Антитіло (сортоваH1-H2-L1-L2-L3 не) U1-7 3-1-2-1-1 U1-9 3-1-2-1-1 U1-10 3-1-2-1-1 U1-12 3-1-2-1-1 U1-13 3-1-4-1-1 U1-14 3-1-2-1-1 U1-15 3-1-8-1-1 U1-19 3-1-Z-Z-Z U1-20 3-1-2-1-1 U1-21 3-1-2-1-1 U1-22 3-1-2-1-1 U1-23 3-1-2-1-1 U1-24 3-1-2-1-1 U1-25 3-1-2-1-1 U1-26 3-1-2-1-1 U1-27 3-1-2-1-1 U1-28 3-1-2-1-1 U1-31 1-2-2-1-1 U1-32 3-1-2-1-1 U1-35 1-3-2-1-1 U1-36 3-1-2-1-1 U1-37 1-2-Z-Z-Z Довжина Н3 12 12 12 12 7 12 14 12 19 12 12 12 12 12 12 12 12 13 12 14 12 13 Приклад 10: Визначення спорідненості антитіл Визначення спорідненості антитіл проти HER3 за цим винаходом здійснювали за допомогою непрямого FACS Scatchard аналізу. Таким чином, 5 10 клітин, які представляють інтерес, або клітин SK-Br 3, збирали з 10 мМ EDTA у PBS, один раз промивали FACS буфером (PBS, 3% FCS, 0,4% азиду) і висівали на 96-лунковий планшет із круглим дном. Клітини центрифугували впродовж 3 хв при 1000 об/хв для видалення супернатанту, після чого ресуспендували з -HER-3 антитілом (3 мкг/мл) або з розведеннями антитіл (100 мкл на лунку), розпочинаючи з 20 мкг/мл людського моноклонального антитіла у FACS буфері з розведенням стадіями 1:2. Суспензії клітин інкубували на льоду впродовж 1 год, двічі промивали FACS буфером і ресуспендували з другим антитілом (100 мкл на лунку) (осляче антилюдське РЕ) (компанія Jackson), розбавленим 1:50 у FACS буфері. Суспензії клітин інкубували на льоду та у темряві впродовж 30 хв, двічі промивали FACS буфером і аналізували (FACS, компанія Beckman Coulter). За FACS Scatchard аналізом для кожного визначення розраховували середнє значення флуоресценції. Фонове забарвлення (= без 1-го 53 97473 антитіла) віднімали від кожного середнього значення флуоресценції. Одержали графік Скетчарда із значенням x - середнє значення флуоресценції і значенням у - середнє значення флуоресценції/концентрація моноклонального антитіла (нМ). Значення Kd приймали як абсолютне значення 1/м лінійного рівняння. На Фіг. 4 зображено кінетичний аналіз із застосуванням антитіла U1-59 за цим винаходом. У наведеній нижче Таблиці 8 наведені результати визначення спорідненості для різних антитіл за цим винаходом, які відбирали подібним чином. Таблиця 7 Клон U1-38 U1-39 U1-40 U1-41 U1-42 U1-43 U1-44 U1-52 U1-61 U1-62 U1-46 U1-47 U1-49 U1-50 U1-51 U1-53 U1-55.1 U1-58 U1-59 U1-24 U1-7 KD (нM) дані відсутні 102 6,7 0,18 дані відсутні 0,57 4 16,8 0,13 20,4 13,8 9,38 1 39,3 131,6 0,082 3,7 6,4 3,69 0,06 0,02 Приклад 11: Антитіла проти HER-3 за цим винаходом індукують ендоцитоз рецептора HER3 HER-3 було ідентифіковано як фактор, який може впливати на ініціацію та розвиток гіперпроліферативних захворювань шляхом відігравання ролі важливого регулятора передавання сигналу клітинами, яке опосередковується родиною HER. Таким чином, якщо HER-3 ефективно видаляється з поверхні/мембрани клітини шляхом інтерналізації рецептора, передавання сигналу клітиною і, таким чином, трансформування та/або підтримання клітин у стані злоякісності можуть бути, зрештою, зменшені або пригнічені. Для встановлення того, чи є антитіла проти HER-3 за цим винаходом здатними до індукування прискореного ендоцитозу HER-3, порівнювали відносну кількість молекул HER-3 на поверхні клітини після 0,5 год та 4 год інкубування клітин з 5 антитілами проти HER-3 за цим винаходом. 310 клітин висівали на нормальне середовище для вирощування на 24-лунковому планшеті і витримували з прорастаниям впродовж ночі. Клітини попередньо інкубували з 10 мкг/мл моноклональних антитіл проти HER-3 у нормальному середовищі для вирощування впродовж зазначених пе 54 ріодів часу при температурі 37°С. Клітини відділяли за допомогою 10 мМ розчину EDTA та інкубували з 10 мкг/мл моноклональних антитіл проти HER-3 у буфері для промивання (PBS, 3% FCS, 0,04% азиду) впродовж 45 хв при температурі 4°С. Клітини двічі промивали буфером для промивання, інкубували з другим ослячим антилюдським-РЕ антитілом (компанія Jackson) у розведенні 1:100 впродовж 45 хв при температурі 4°С, двічі промивали буфером для промивання і аналізували за допомогою FACS (компанія BeckmanCoulter, EXPO). Дані, подані на Фіг. 5, демонструють, що наслідком обробки клітин антитілами проти HER-3 є інтерналізація рецептора. Дані подані як відсоток інтерналізації, і означають зменшення середньої інтенсивності флуоресценції зразків, оброблених антитілами проти HER-3, порівняно з відповідними показниками зразків, оброблених контролем. Приклад 12: Пригнічення зв'язування ліганду з людськими раковими клітинами SKBr3 людськими антитілами проти HER-3 за цим винаходом Експерименти з конкурентним зв'язуванням радіоактивного ліганду здійснювали з метою кількісного визначення здатності антитіл проти HER-3 за цим винаходом до пригнічення зв'язування ліганду з HER-3 у клітинному аналізі. Таким чином, аналіз зв'язування рецептора HER-3 здійс5 нювали з 410 клітин SK-BR-3, які інкубували з різними концентраціями антитіл впродовж 30 хв на льоду. До кожної лунки додавали 1,25 нМ 125 125 [ І]--HRG/[ I]--HRG, і інкубування продовжували на протязі 2 год на льоду. Планшети промивали п'ять разів, піддавали повітряному сушінню, і здійснювали підраховування за допомогою сцинтиляційного лічильника. На Фігурах ба-е подані результати цих експериментів, які були здійснені з репрезентативними антитілами проти HER-3 за цим винаходом, і ці фігури демонструють, що антитіла за цим винаходом є здатними до спе125 цифічного зменшення зв'язування [ I]-125 HRG/[ I]--HRG з клітинами, які експресують ендогенний HER-3. Приклад 13: Пригнічення індукованого лігандом фосфоритування HER-3 людськими антитілами проти HER-3 за цим винаходом Експерименти з ELISA здійснювали з метою дослідження того, чи є антитіла за цим винаходом здатними до блокування опосередкованої лігандом -HRG активації HER-3. Опосередковану лігандом активацію HER-3 виявляли за підвищеним фосфорилуванням рецепторного тирозину. День 1: 1х96-лунковий планшет сенсибілізували розчином (20 мкг/мл) колагену І у 0,1 Μ розчині оцтової кислоти впродовж 4 год при темпе5 ратурі 37°С. 2,510 клітин висівали на нормальне середовище для вирощування. День 2: Клітини вирощували у 100 мкл безсироваткового середовища впродовж 24 год. День 3: Клітини піддавали попередньому інкубуванню з 10 мкг/мл моноклональних антитіл проти HER-3 впродовж 1 год при температурі 37°С, після чого обробляли 30 нг/мл -HRG-EGF домену (компанія R&D Systems) впродовж 10 хв. 55 Середовище різко струшували, і клітини фіксували 4% розчином формальдегіду у PBS впродовж 1 год при кімнатній температурі. Розчин формальдегіду видаляли, і клітини промивали буфером для промивання (PBS/0,1% твій 20). Клітини блокували 1% Н2О2, 0,1% NaN3 у буфері для промивання та інкубували впродовж 20 хв при кімнатній температурі, після чого блокували за допомогою NET-Gelantine впродовж 5 год при температурі 4°С. Перше антитіло фocфo-HER-3 (Туr1289) (поліклональне кроляче; технологія Cell Signalling № 4791; 1:300) додавали впродовж ночі при температурі 4°С. День 4: Планшет промивали тричі буфером для промивання, після чого інкубували з антикролячим-POD, розбавленим 1:3000 у PBS; до кожної лунки додавали 0,5% BSA, і інкубували впродовж 1,5 год при кімнатній температурі. Планшет промивали 3х буфером для промивання і один раз PBS. Додавали тетраметилбензидин (ТМВ, компанія Calbiochem) з контролюванням при 650 нм. Реакцію припиняли доданням 100 мкл 250 нМ розчину НС1, і оптичну густину визначали при 450 нм з еталонною довжиною хвилі 650 нм за допомогою пристрою зчитування планшетів Vmax (компанія Thermo Lab Systems). На Фіг. 7а подані репрезентативні результати цього експерименту, які показують, що антитіла проти HER-3 за цим винаходом були здатними до зниження опосередкованої лігандом активації HER-3, на що вказує зниження фосфорилування рецепторного тирозину. Дані представлені як відсоткове зниження терапевтичними антитілами відносно контрольного антитіла. Для перевірки ефективності пригнічення індукованої лігандом активації HER-3 моноклональним антитілом U1-53, клітини MCF-7 вирощували на мінімальному середовищі впродовж 24 год, інкубували з моноклональним антитілом U1-53 впродовж 1 год при температурі 37°С і стимулювали 10 нМ розчином HRG-β впродовж 10 хв. Лізати переносили на планшет для проведення ELISA з 1В4 (мишаче моноклональне антитіло проти HER-3), і фосфорилування HER-3 аналізували за допомогою антитіла 4G10. Як показано на Фіг. 7b, фосфорилування HER-3 майже повністю пригнічувалось дозозалежним чином при ІС50 0,14 нМ. Приклад 14: Пригнічення індукованого лігандом фосфорилування р42/р44 МАР-кінази людськими антитілами проти HER-3 за цим винаходом Наступні експерименти з ELISA здійснювали з метою дослідження того, чи є антитіла за цим винаходом здатними до блокування опосередкованої лігандом β-HRG активації р42/р44 МАРкінази. Опосередковану лігандом активацію HER3 виявляли за підвищеним фосфорилуванням білка (Thr202/Tyr204). День 1: 1х96-лунковий планшет сенсибілізували розчином (20 мкг/мл) колагену І у 0,1 Μ розчині оцтової кислоти впродовж 4 год при темпе5 ратурі 37°С. 310 клітин висівали на нормальне середовище для вирощування. 97473 56 День 2: Клітини вирощували у 100 мкл безсироваткового середовища впродовж 24 год. День 3: Клітини піддавали попередньому інкубуванню з 5 мкг/мл моноклональних антитіл проти HER-3 впродовж 1 год при температурі 37°С, після чого обробляли 20 нг/мл β-HRG-EGF домену (компанія R&D Systems) впродовж 10 хв. Середовище різко струшували, і клітини фіксували 4% розчином формальдегіду у PBS впродовж 1 год при кімнатній температурі. Розчин формальдегіду видаляли, і клітини промивали буфером для промивання (PBS/0,1% твій 20). Клітини блокували 1% Н2О2, 0,1% NaN3 у буфері для промивання та інкубували впродовж 20 хв при кімнатній температурі, після чого блокували за допомогою PBS/0,5% BSA впродовж 5 год при температурі 4°С. Перше антитіло фосфо-р44/р42 МАР-кіназа (Thr202/Tyr204) (поліклональне кроляче; технологія Cell Signalling № 9101; 1:3000) додавали впродовж ночі при температурі 4°С. День 4: Планшет промивали тричі буфером для промивання, після чого інкубували з антикролячим-HRP, розбавленим 1:5000 у PBS; до кожної лунки додавали 0,5% BSA і інкубували впродовж 1,5 год при кімнатній температурі. Планшет промивали тричі буфером для промивання і один раз PBS. Додавали тетраметилбензидин (ТМВ, компанія Calbiochem) із контролюванням при 650 нм. Реакцію припиняли доданням 100 мкл 250 нМ розчину НС1, і оптичну густину визначали при 450 нм з еталонною довжиною хвилі 650 нм за допомогою пристрою зчитування планшетів Vmax (компанія Thermo Lab Systems). На Фіг. 8 подані репрезентативні результати цього експерименту. Антитіла за цим винаходом були здатними до зниження опосередкованої лігандом активації р42/р44 МАР-кінази, на що вказує зниження фосфорилування. Дані представлені як відсоткове зниження терапевтичними антитілами відносно контрольного антитіла. Приклад 15: Пригнічення індукованого β-HRG фосфорилування фосфо-АКТ людськими антитілами проти HER-3 за цим винаходом У наведеному нижче експерименті з ELISA автори досліджували, чи є антитіла проти HER-3 за цим винаходом здатними до блокування опосередкованої β-HRG активації АКТ-кінази. Опосередковану лігандом активацію АКТ виявляли за підвищеним фосфорилуванням білка (Ser473). День 1: 1х96-лунковий планшет сенсибілізували розчином (20 мкг/мл) колагену І у 0,1 Μ розчині оцтової кислоти впродовж 4 год при темпе5 ратурі 37°С. 310 клітин висівали на нормальне середовище для вирощування. День 2: Клітини вирощували у 100 мкл безсироваткового середовища впродовж 24 год. День 3: Клітини піддавали попередньому інкубуванню з 5 мкг/мл моноклональних антитіл проти HER-3 впродовж 1 год при температурі 37°С, після чого обробляли 20 нг/мл β-HRG-EGF домену (компанія R&D Systems) впродовж 10 хв. Середовище різко струшували, і клітини фіксували 4% розчином формальдегіду у PBS впродовж 1 год при кімнатній температурі. Розчин формальдегіду видаляли, і клітини промивали буфером 57 для промивання (PBS/0,1% твій 20). Клітини блокували 1% Н2О2, 0,1% NaN3 у буфері для промивання та інкубували впродовж 20 хв при кімнатній температурі, після чого блокували за допомогою PBS/0,5% BSA впродовж 5 год при температурі 4°С. Перше антитіло фосфо-Akt (Ser473) (поліклональне кроляче; технологія Cell Signalling № 9217; 1:1000) додавали впродовж ночі при температурі 4°С. День 4: Планшет промивали тричі буфером для промивання, після чого інкубували з антикролячим-HRP, розбавленим 1:5000 у PBS; до кожної лунки додавали 0,5% BSA і інкубували впродовж 1,5 год при кімнатній температурі. Планшет промивали тричі буфером для промивання і один раз PBS. Додавали тетраметилбензидин (ТМВ, компанія Calbiochem) із контролюванням при 650 нм. Реакцію припиняли доданням 100 мкл 250 нМ розчину НС1, і оптичну густину визначали при 450 нм з еталонною довжиною хвилі 650 нм за допомогою пристрою для зчитування планшетів Vmax (компанія Thermo Lab Systems). На Фіг. 9 подані репрезентативні результати цього експерименту. Антитіла проти HER-3 за цим винаходом були здатними до зниження опосередкованої β-HRG активації АКТ, на що вказує зниження фосфорилування. Дані представлені як відсоткове зниження терапевтичними антитілами відносно контрольного антитіла. Приклад 16: Пригнічення опосередкованої HRG/-HRG проліферації клітин MCF7 людськими антитілами проти HER-3 за цим винаходом In vivo експерименти були проведені для визначення здатності антитіл за цим винаходом до пригнічення стимульованої HRG проліферації клітин. 2000 клітин MCF7 висівали на середовище, яке містило FCS, на 96-лункові планшети впродовж ночі. Клітини попередньо інкубували у чотирьох повторностях з антитілом, розведеним у середовищі з 0,5% FCS впродовж 1 год при температурі 37°С. Клітини стимулювали 30 нг/мл - або 20 нг/мл β-HRG (компанія R&D Systems) шляхом додання ліганду безпосередньо до розчину антитіла з подальшим витримуванням для росту впродовж 72 год. Додавали АіатагВше™ (компанія BIOSOURCE) і інкубували при температурі 37°С у темряві. Оптичну густину визначали при 590 нм кожні 30 хв. Дані збирали через 90 хв після додання аламару синього. Результати, подані на Фіг. 10, показують, що репрезентативні антитіла за цим винаходом пригнічують індукований HRG ріст людських ракових клітин. Дані представлені як відсоткове зниження терапевтичними антитілами відносно контрольного антитіла. Приклад 17: Пригнічення індукованої β-HRG міграції клітин MCF7 людськими антитілами проти HER-3 за цим винаходом Експерименти з трансміграції здійснювали для визначення того, чи блокують антитіла за цим винаходом міграцію клітин. Клітини MCF7, які вирощували на безсироватковому середовищі, піддавали попередньому інкубуванню шляхом додання вказаної кількості антитіла до суспензії 97473 58 клітин та інкубуванню обох впродовж 45 хв при температурі 37°С. Після цього 500 мкл суспензії клітин (50000 клітин) вносили до верхньої камери сенсибілізованої колагеном І лунки з напівпроникною перегородкою (компанія BD Falcon, 8 мкм пори). У нижній камері застосовували 750 мкл середовища (MEM (мінімальне підтримувальне середовище), амінокислоти, Na-піруват, пеніцилін-стрептоміцин, 0,1% BSA, без фетальної телячої сироватки) самостійно або у суміші з лігандами β-HRG-EGF домену (компанія R&D Systems). Клітини, забарвлені DAPI (4',6-діамідино-2феніліндол), мали можливість мігрувати впродовж 8 год при температурі 37°С. Забарвлені ядра підраховували вручну; відсоток пригнічення виражали як пригнічення відносно контрольного антитіла. На Фіг. 11 подано результат експерименту, який демонструє те, що репрезентативні антитіла проти HER-3 за цим винаходом зменшували індуковану HRG міграцію клітин. Приклад 18: Аналіз утворення колоній (аналіз на м'якому агарі) Аналізи на м'якому агарі здійснювали для визначення здатності антитіл проти HER-3 за цим винаходом до пригнічення незалежного від закріплення росту клітин. Аналіз утворення колоній на м'якому агарі є стандартним in vitro аналізом для перевірки на трансформовані клітини, оскільки на м'якому агарі можуть рости лише такі трансформовані клітини. Від 750 клітин до 2000 клітин (у залежності від лінії клітин) заздалегідь інкубували з вказаними антитілами (10 мкг/мл) у IMDM (середовище Дульбекко, модифіковане за способом Ісков) (компанія Gibco) впродовж 30 хв і ресуспендували у 0,4% диференціювального агару компанії Difco. Суспензію клітин висівали на 0,75% агарозний прошарок, який містив 20% FCS, у чотирьох повторностях на 96-лунковому планшеті. Колонії, утворення яких тривало впродовж 14 днів, забарвлювали 50 мкл МТТ (3-(4,5-диметилтіазол-2-іл)2,5-дифенілтетразолію бромід) (0,5 мг/мл у PBS) впродовж ночі. На Фіг. 12а-і подані результати цих експериментів, які здійснювали з трьома репрезентативними антитілами за цим винаходом. Ці результати демонструють, що антитіла проти HER-3 за цим винаходом зменшують незалежний від закріплення ріст клітин раку молочної залози MDA-MB361 та NCI-ADR (Фіг. 12а, Фіг. 12b), клітин раку шлунка MKN-28 (Фіг. 12с), клітин меланоми НТ144 (Фіг. 12d), клітин раку яєчника Skov3 (Фіг. 12е), клітин раку передміхурової залози РРС-1 (Фіг. 12f), клітин раку підшлункової залози ВХ-РС3 (Фіг. 12g), клітин плоскоклітинного раку А431 (Фіг. 12h) і клітин раку легень (Фіг. 12і). Колонії підраховували за допомогою системи камер Scanalyzer HTS (Lenmatec, Wuerselen). Приклад 19: Людські антитіла проти HER-3 пригнічують ріст людського раку молочної залози у "голих" мишей Протипухлинну ефективність терапевтичних антитіл часто оцінюють шляхом проведення досліджень на людських трансплантованих пухлинах. Під час цих досліджень людські пухлини рос 59 97473 туть як трансплантати у мишей з порушеною імунологічною реактивністю, і терапевтичну ефективність визначають за ступенем пригнічення росту пухлин. Для визначення того, чи перешкоджають антитіла проти HER-3 за цим винаходом росту пухлин людського раку молочної залози у "голих" 6 мишей, 5х10 клітин T47D імплантували "голим" мишам-самицям лінії NMRI. Пухлини були підшкірними, і росли на спині тварин. Обробки розпочали через вісім дтв після імплантації, коли пух3 лини досягли середнього об'єму 20 мм . Перед першою обробкою миші були довільно розподілені на групи, і їх піддали статистичним випробу 60 ванням для впевненості у однорідності вихідних об'ємів пухлин (середнє, середнє абсолютне і середнє квадратичне відхилення) у експериментальних групах. Обробку розпочали з ударної дози 50 мкг/кг з подальшими ін'єкціями у дозі 25 мг/кг один раз на тиждень шляхом підшкірної ін'єкції. Контрольна група одержувала доксорубіцин (фармацевтичної чистоти). Усім тваринам додатково внутрішньоочеревинним шляхом вводили естроген (0,5 мг/кг/тиждень). Нижче наведені подробиці відносно експериментальних груп. Група Ν Перша сполука Ударна доза (мг/кг) Тижнева доза (мг/кг) 1 10 PBS 2 доксорубіцин 8 мг/кг 3 U1-53 50 мг/кг 20 мл/кг 25 мг/кг 10 мл/кг Шлях введен- Схема застоня сування внутрішньоодин раз на очеревинно тиждень Внутрішньоодин раз на венно тиждень* внутрішньоодин раз на очеревинно тиждень * обробка доксорубіцином за описом Бовен (Boven) та інші, Cancer Research, 1992. Дані з середнього абсолютного об'єму пухлини (Фіг. 13) демонструють, що наслідком введення антитіла проти HER-3 за цим винаходом є зменшення росту пухлини. Приклад 20: Людські антитіла проти HER-3 пригнічують ріст людських пухлин підшлункової залози ν мишей з тяжким комбінованим імунодефіцитом Для перевірки терапевтичного потенціалу антитіл проти HER-3 на солідних пухлинах інших типів антитіла проти HER-3, U1-53 та U1-59 перевіряли на мишах із розвинутими пухлинами, які походили від людської лінії клітин раку підшлункової залози ВхРС3. Як контрольні тварини були включені групи мишей, яких обробляли носієм, PBS або відомим терапевтичним антитілом 6 Erbitux. 5x10 клітин ВхРС3 вводили підшкірним шляхом без матригелю мишам лінії СВ17 з тяжким комбінованим імунодефіцитом. Мишам з роз3 винутими пухлинами середнім об'ємом 140 мм вводили 50 мг/кг U1-53, U1-59, Erbitux або еквівалентний об'єм PBS шляхом внутрішньоочеревинної ін'єкції. У подальшому впродовж дослідження миші один раз на тиждень одержували ін'єкції у дозі 25 мг/кг. Результати цього експерименту показані на Фіг. 14. U1-53 і U1-59 зменшували ріст людських пухлин підшлункової залози цитостатичним чином. Слід звернути увагу на те, що при проведенні цього експерименту U1-53 та U1-59 були ефективнішими щодо уповільнення росту пухлин, аніж антитіло Erbitux, спрямоване проти EGFR (рецептор епідермального фактора росту). Ці дані продемонстрували терапевтичну ефективність антитіл проти HER-3 за цим винаходом, порівняно з еталонним терапевтичним агентом. Приклад 21: Комбінування людських антитіл проти HER-3 з антитілами проти EGFR підвищує протипухлинну активність Лікування гіперпроліферативних захворювань цілеспрямованими антитілами часто ускладнюється такими проблемами, наприклад, як, з одного боку, розвиток стійкості до лікарських засобів, і, з другого боку, зміна антигенності. Наприклад, втрата антигенності після тривалого лікування може зробити пухлинні клітини нечутливими до терапевтичних антитіл, оскільки ті пухлинні клітини, які не експресують або втратили цільовий антиген, мають перевагу щодо вибіркового росту. Цих проблем можна уникнути шляхом застосування антитіл за цим винаходом у комбінації з терапевтичним антитілом, яке спрямовується на інший рецептор на пухлинних клітинах або іншим протипухлинним агентом. Терапевтичний ефект може також забезпечити втручання до численних шляхів передавання сигналу чи навіть до споріднених шляхів, але шляхом численних стадій втручання. Ці комбіновані способи лікувального впливу повинні, ймовірно, бути більш ефективними, оскільки вони об'єднують два протипухлинні засоби, кожен з яких має різні механізми дії. Для демонстрації прийнятності антитіл проти HER-3 за цим винаходом, U1-53 та U1-59, як придатних комбінаторних агентів, ми порівняли самостійне терапевтичне введення U1-53 та U1-59 з методами лікувального впливу, за якими U1-53 або U1-59 комбінували із специфічним антитілом 6 проти EGR, Erbitux. 510 клітин ВхРС3 вводили підшкірним шляхом із матригелем мишам лінії СВ17 із тяжким комбінованим імунодефіцитом. 3 Після досягнення пухлинами об'єму 200 мм , мишей довільно розподіляли на окремі експериментальні групи. Здійснювали щотижневе внутрішньоочеревинне введення U1-53, U1-59 та Erbitux незалежно одне від одного або у комбінаціях будь-якого антитіла проти HER-3 з Erbitux чи у вигляді суміші двох антитіл проти HER-3. Усі ан
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;antibodies directed to her-3 and uses thereof
Автори англійськоюRothe Mike, Treder Martin, Hartmann Susanne, Freeman Dan, Radinsky Bob, Borges Eric
Назва патенту російськоюВыделенное антитело, которое связывается с her-3, и его применение
Автори російськоюРоте Майк, Тредер Мартин, Хартманн Сузанн, Фриман Дан, Радинский Боб, Боргез Эрик
МПК / Мітки
МПК: A61K 39/395, C12N 15/63, G01N 33/577, C12N 5/10, C12N 15/13, A61P 35/00, C12P 21/08, C07K 16/28
Мітки: застосування, зв'язується, антитіло, виділене, яке, her-3
Код посилання
<a href="https://ua.patents.su/255-97473-vidilene-antitilo-yake-zvyazuehtsya-z-her-3-ta-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Виділене антитіло, яке зв’язується з her-3, та його застосування</a>
Попередній патент: Фільтрувальний картридж для джбанів
Наступний патент: Сполуки для лікування порушень, пов’язаних з активністю dgat1
Випадковий патент: Спосіб автоматичної роботи фільтрпреса