Інактивований вірус вітряної віспи, спосіб його одержання і застосування
Номер патенту: 112970
Опубліковано: 25.11.2016
Автори: Барр Коллін М., Ягодіч Мері, Крісс Дженніфер А., Дехавен Джилл, Крах Девід Л.
Формула / Реферат
1. Інактивований вірус вітряної віспи (VZV), який підходить для введення пацієнту з ослабленим імунітетом у вакцині проти VZV, де VZV інактивований з використанням від 10 до 25 кГр гамма-опромінення, де інфекційність VZV складає £0,040 бляшкоутворювальних одиниць (БУО)/мл.
2. Фармацевтична композиція, яка містить терапевтично ефективну кількість VZV за п. 1 і фармацевтично прийнятний носій.
3. Фармацевтична композиція за п. 2, де інфекційність інактивованого VZV складає £0,010 бляшкоутворювальних одиниць (БУО)/мл.
4. Фармацевтична композиція за п. 2, де інфекційність інактивованого VZV складає £0,002 бляшкоутворювальних одиниць (БУО)/мл.
5. Фармацевтична композиція за будь-яким з пп. 2-3, де штам VZV являє собою штам Ока або похідне штаму Ока.
6. Фармацевтична композиція за п. 5, де композиція є ліофілізованою.
7. Фармацевтична композиція за п. 6, де імунна відповідь, яка викликається композицією, суттєво не відрізняється від імунної відповіді, яка викликається контрольним зразком, що містить аналогічну кількість неінактивованого VZV.
8. Фармацевтична композиція за п. 7, де імунна відповідь, що викликається інактивованим VZV, відрізняється від імунної відповіді, що викликається контрольним зразком, на 25 % або менше.
9. Фармацевтична композиція за будь-яким з пп. 2-3, де інфекційність VZV визначають аналізом утворення бляшок вітряної віспи.
10. Спосіб одержання інактивованого вірусу вітряної віспи (VZV), який включає гамма-опромінення зразка, що містить VZV, із застосуванням від приблизно 10 кГр до приблизно 25 кГр гамма-опромінення.
11. Спосіб за п. 10, де гамма-опромінення зразка забезпечують експонуванням зразка 60Со-випромінюванням.
12. Спосіб за п. 11, де VZV являє собою штам Ока або похідне штаму Ока.
13. Спосіб за п. 11, де зразок ліофілізують до опромінення.
14. Спосіб лікування оперізувального лишаю у пацієнта, який включає введення пацієнту фармацевтичної композиції, що містить терапевтично ефективну кількість інактивованого вірусу вітряної віспи (VZV), який має інфекційність £0,040 бляшкоутворювальних одиниць (БУО)/мл, і фармацевтично прийнятний носій, де VZV інактивований з використанням від 10 до 25 кГр гамма-опромінення.
15. Спосіб за п. 14, де спосіб введення фармацевтичної композиції є підшкірним або внутрішньом'язовим.
16. Спосіб за п. 15, де вік пацієнта становить 50 років або більше.
17. Спосіб за п. 15 або 16, де пацієнт має ослаблений імунітет.
18. Спосіб за п. 17, де пацієнт має щонайменше один стан, вибраний з групи, що складається з: гематологічне злоякісне новоутворення, перенесена імуносупресивна терапія, перенесена трансплантація гематопоетичних стовбурових клітин, перенесена трансплантація цілого органа, інфікування ВІЛ і аутоімунне захворювання.
19. Спосіб за п. 15 або 16, де спосіб додатково включає очікування певної кількості часу і введення пацієнту однієї або більше доз фармацевтичної композиції.
Текст
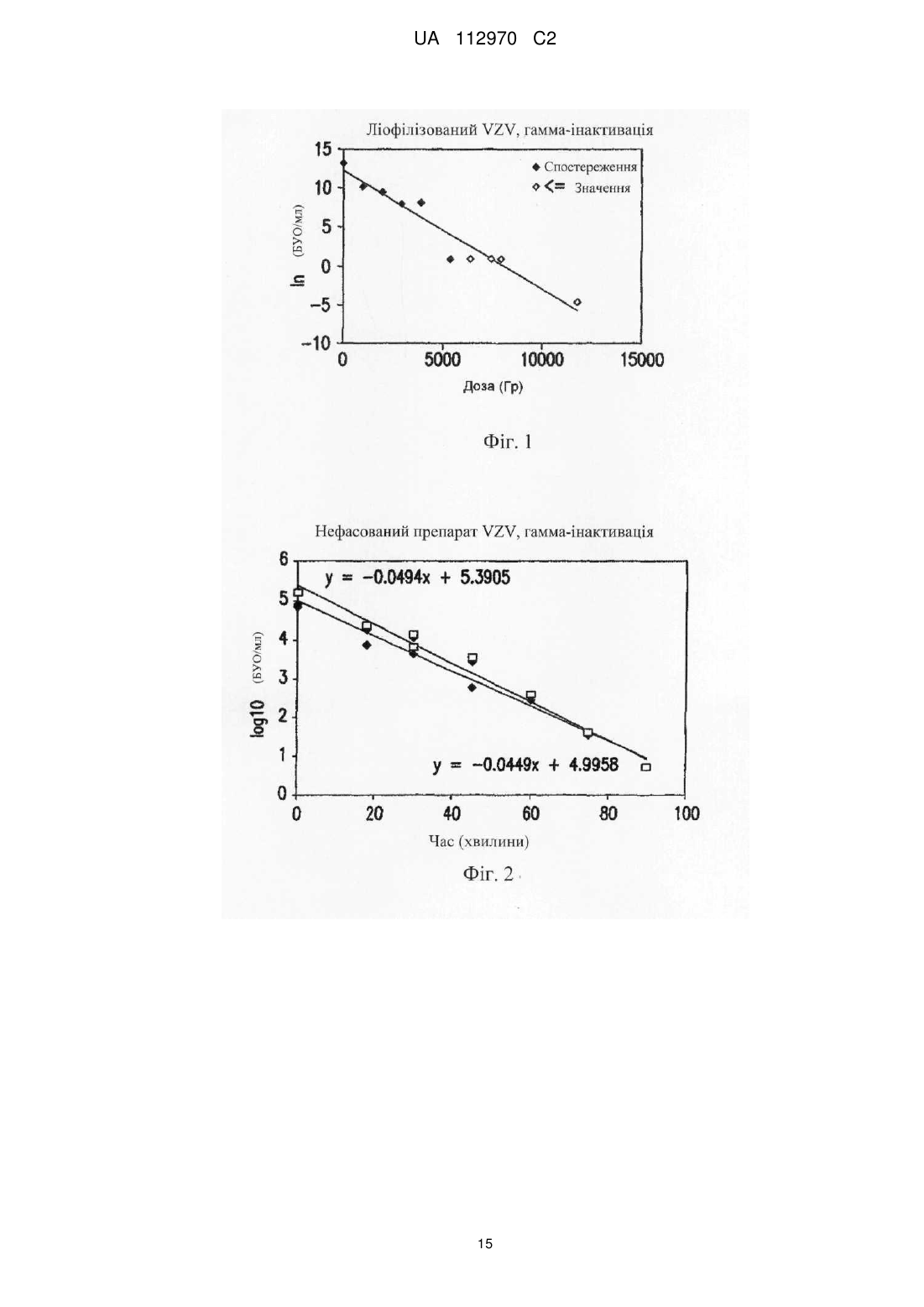
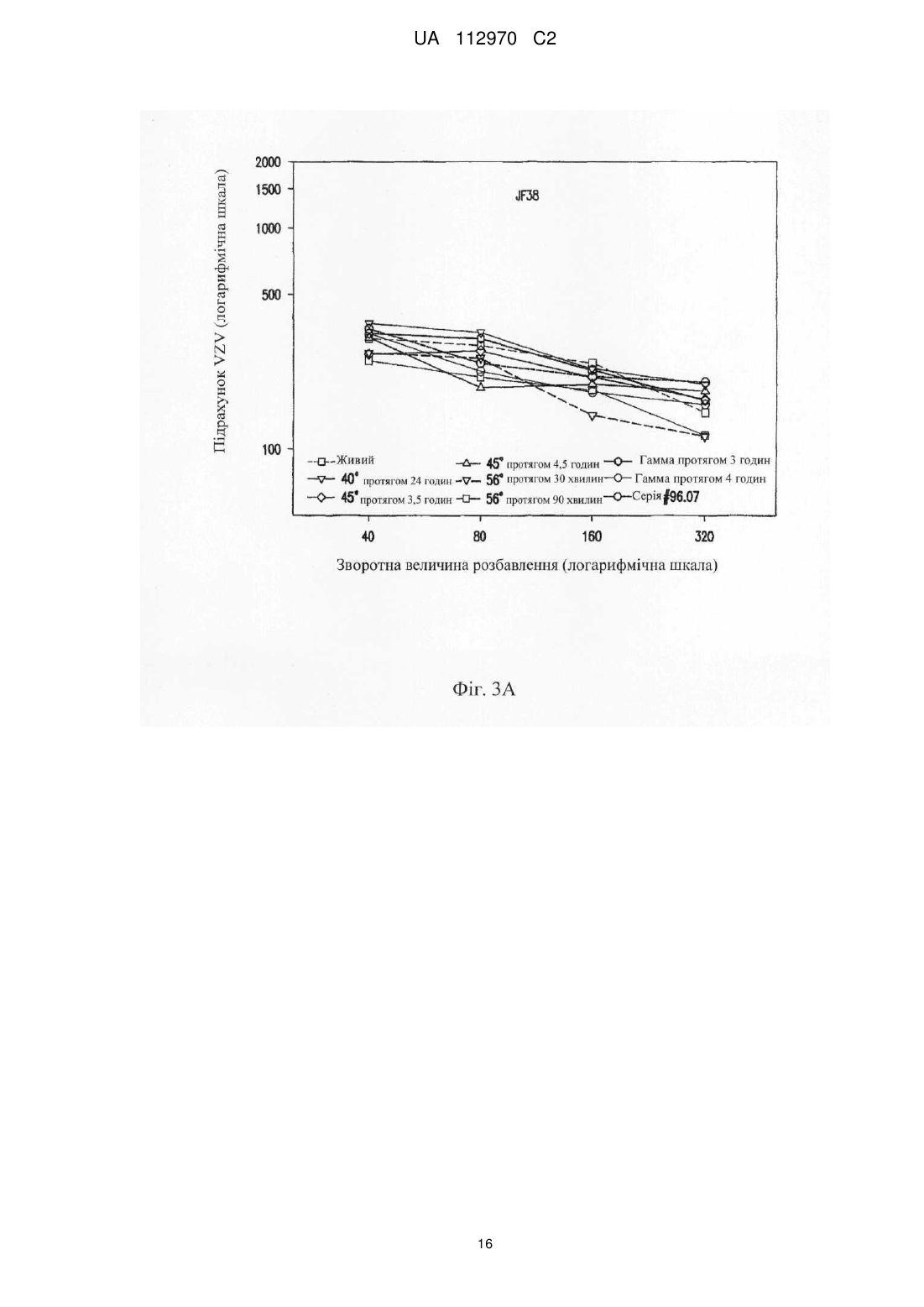
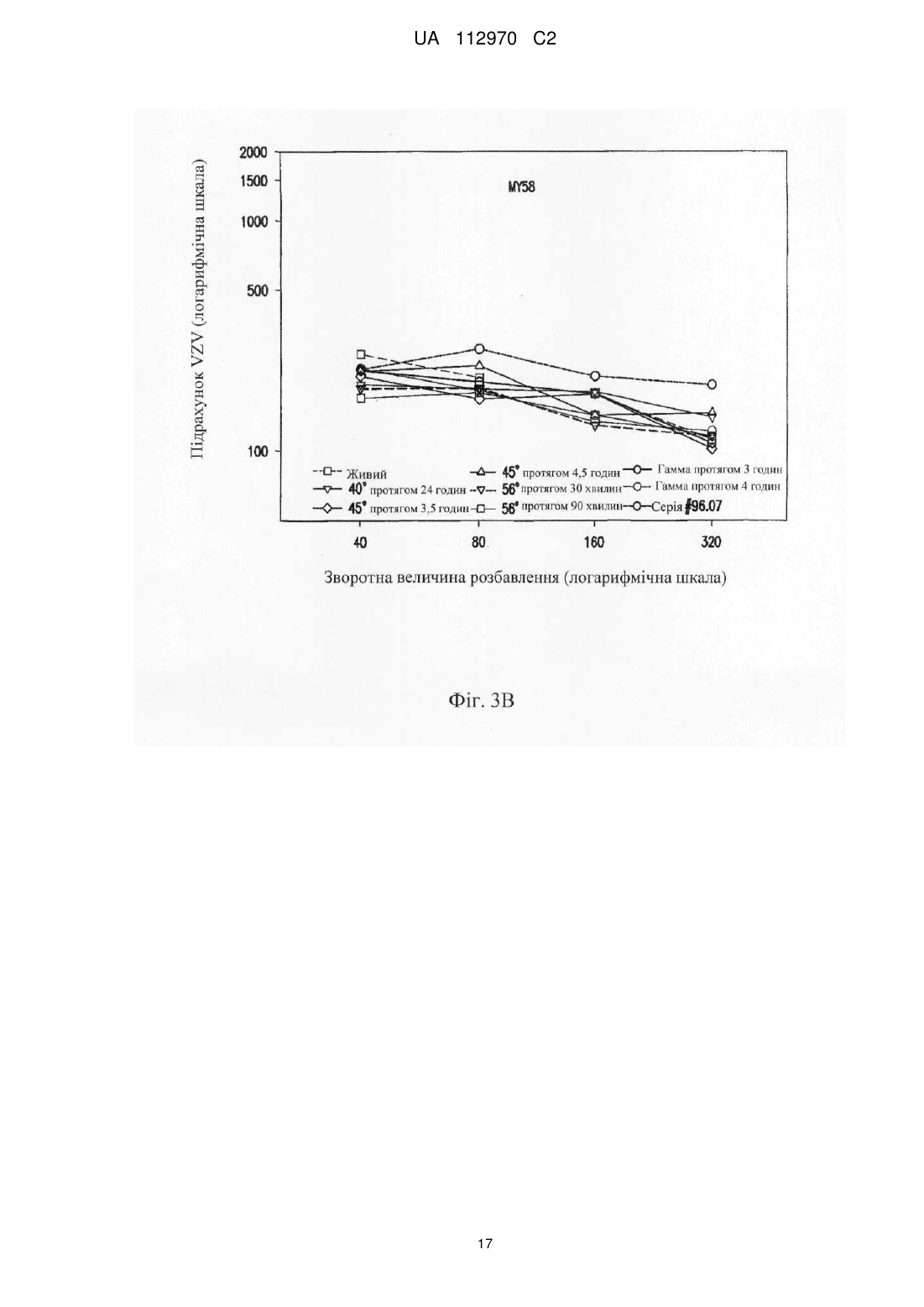
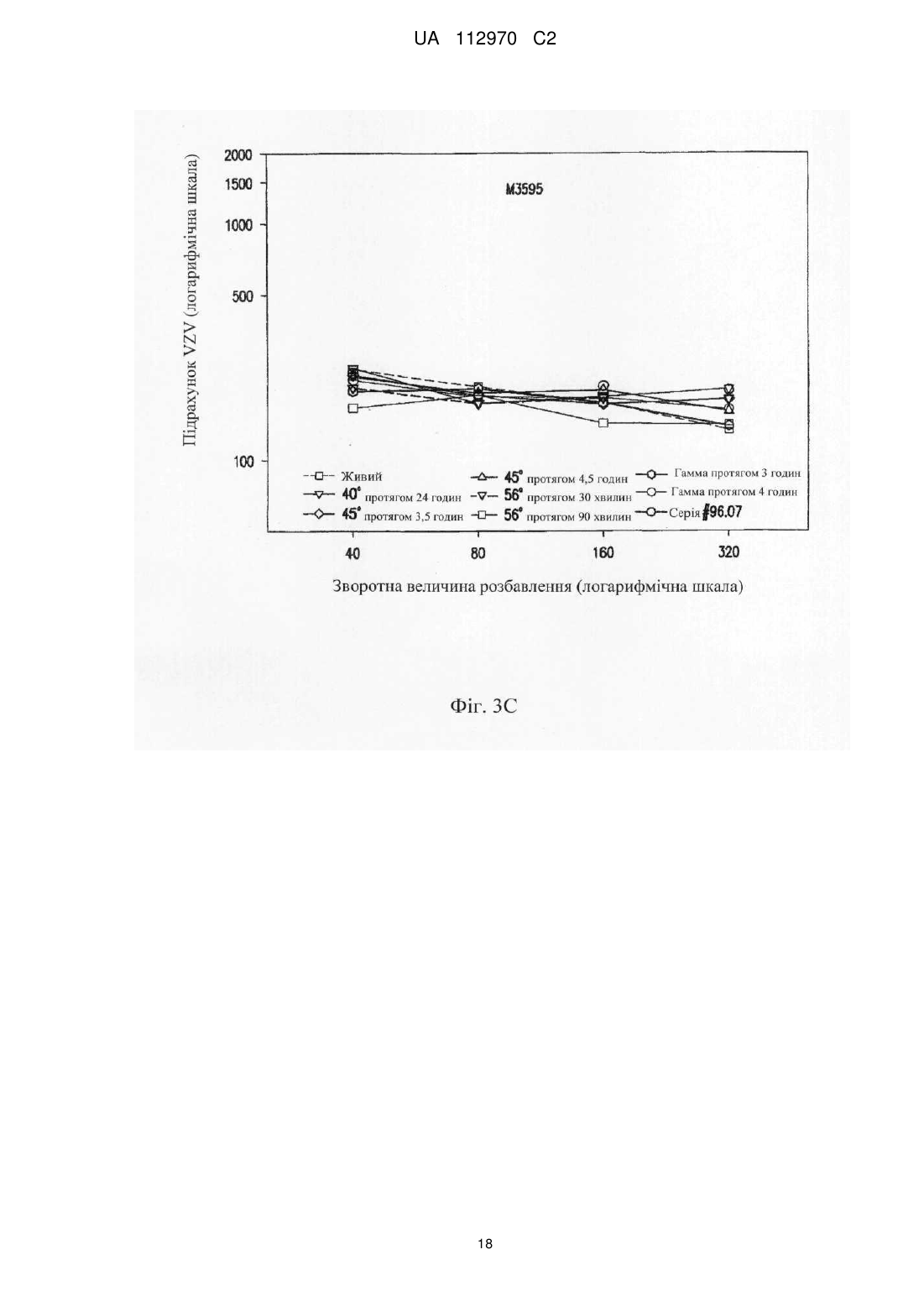
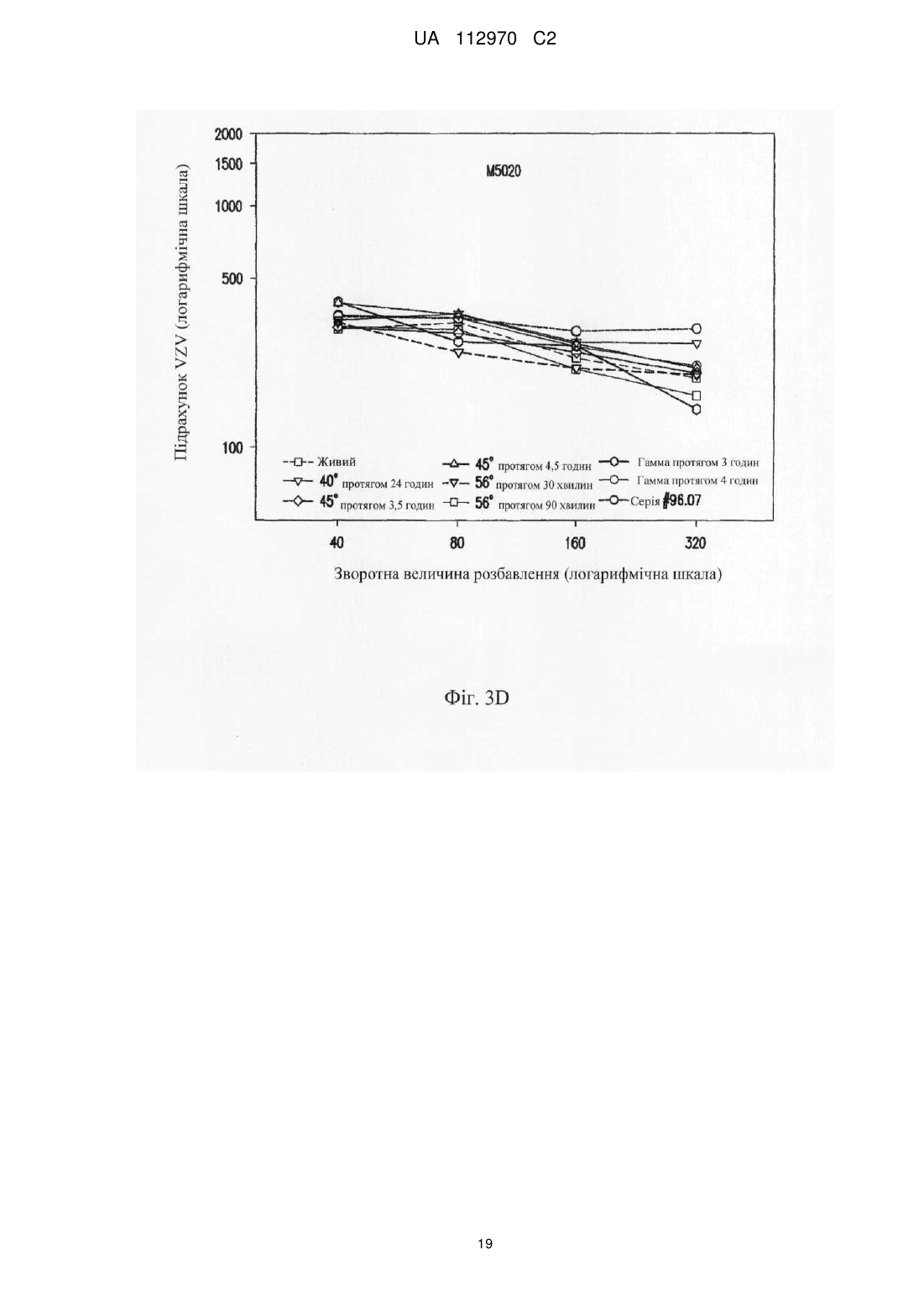
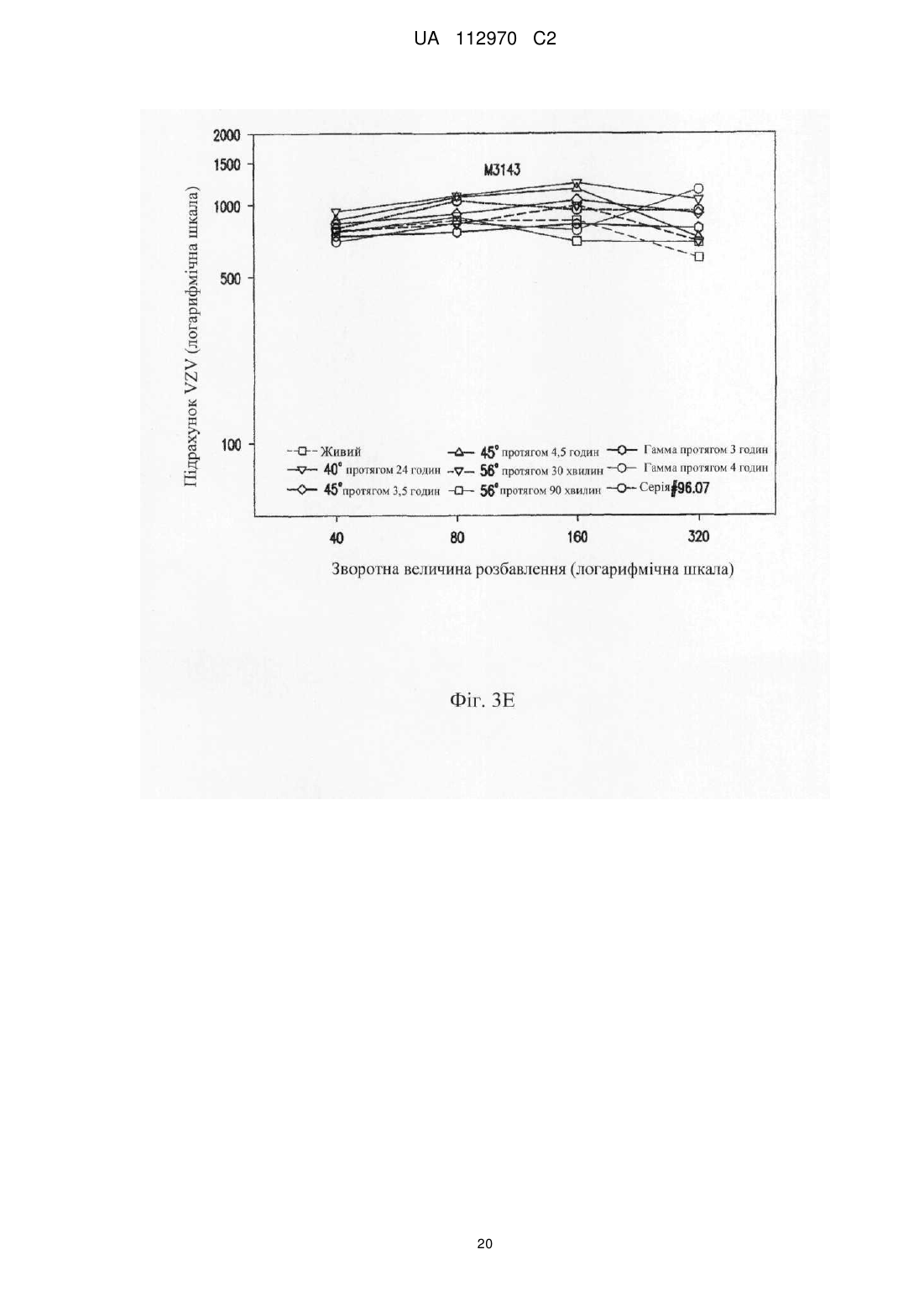
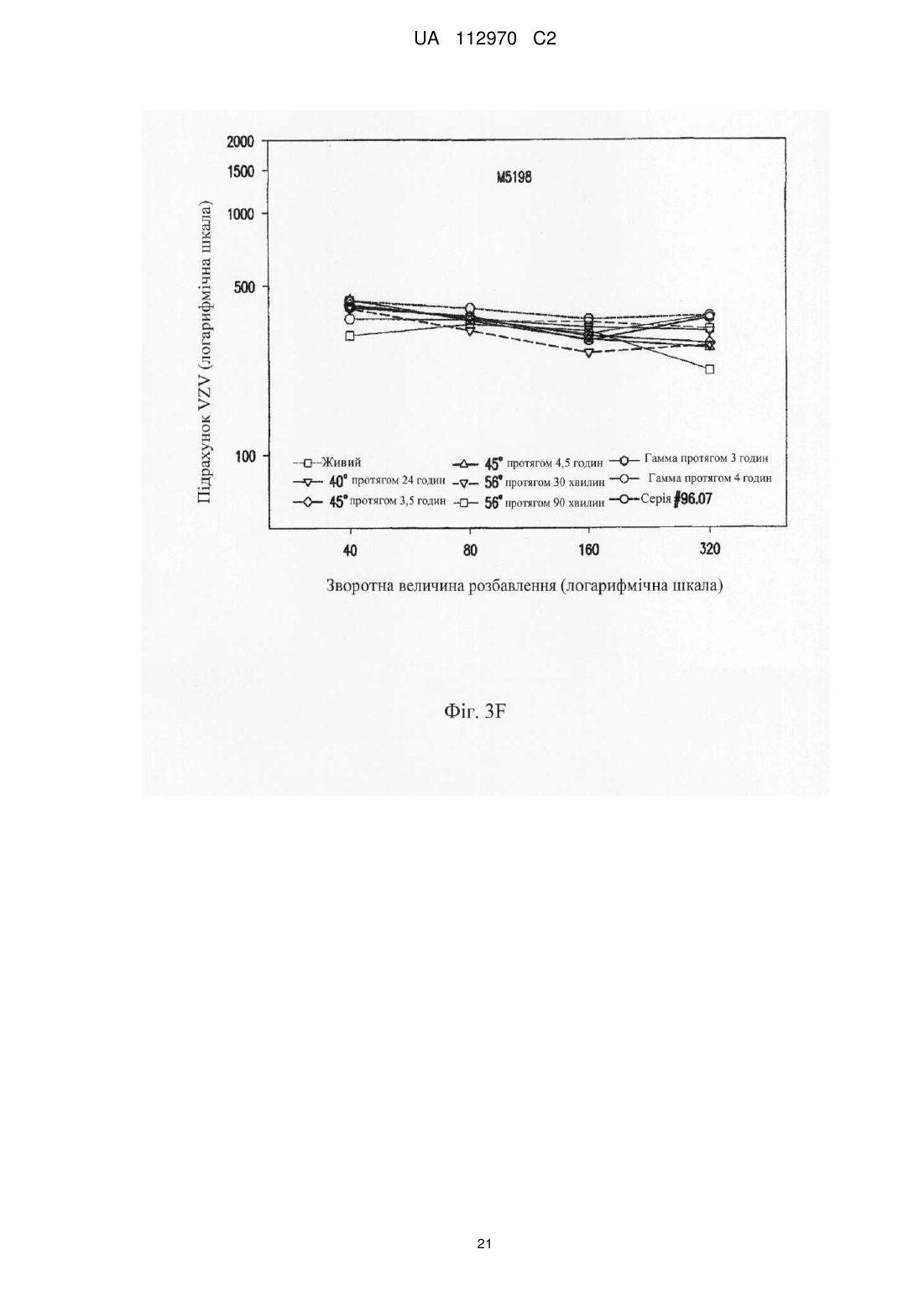
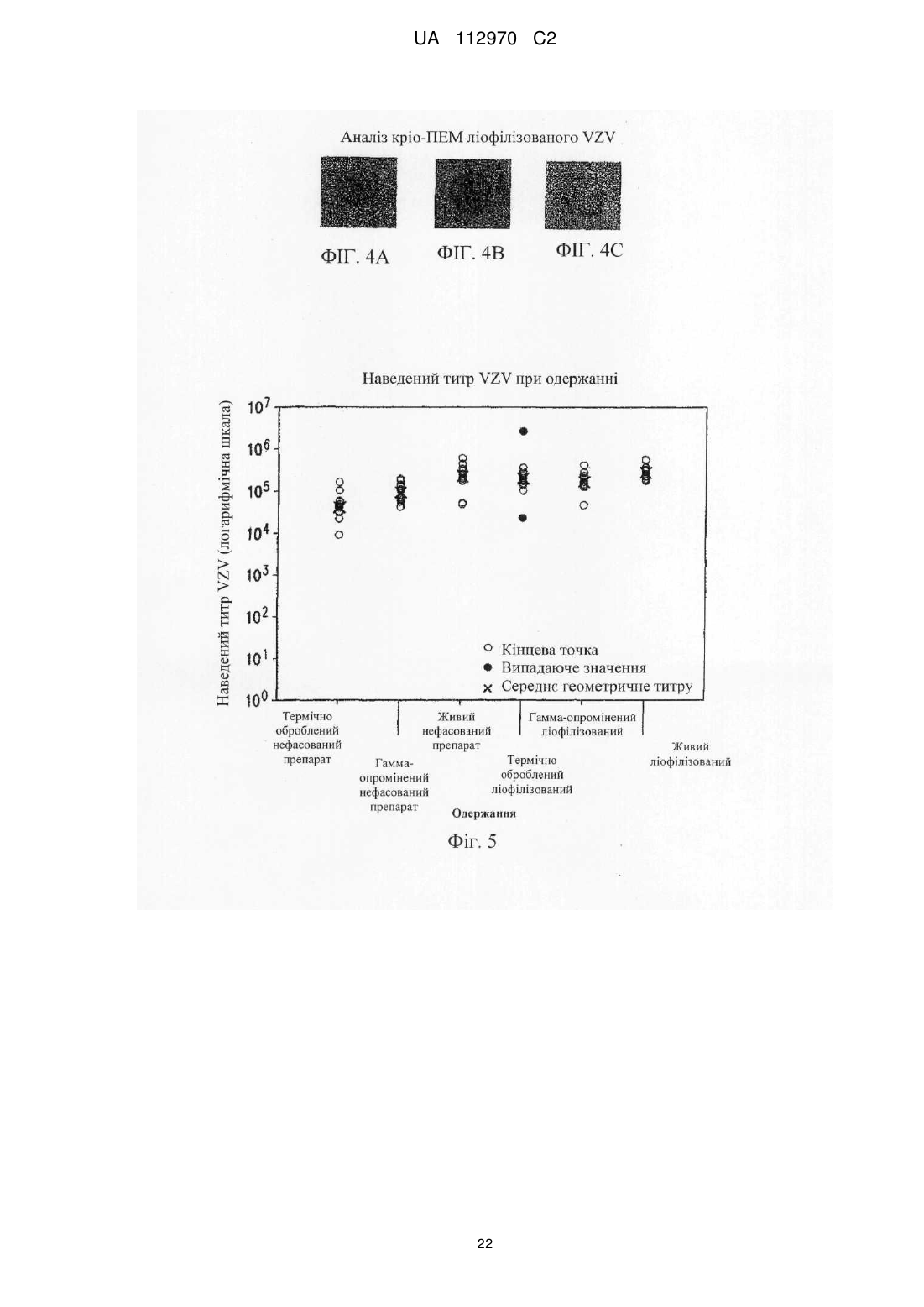
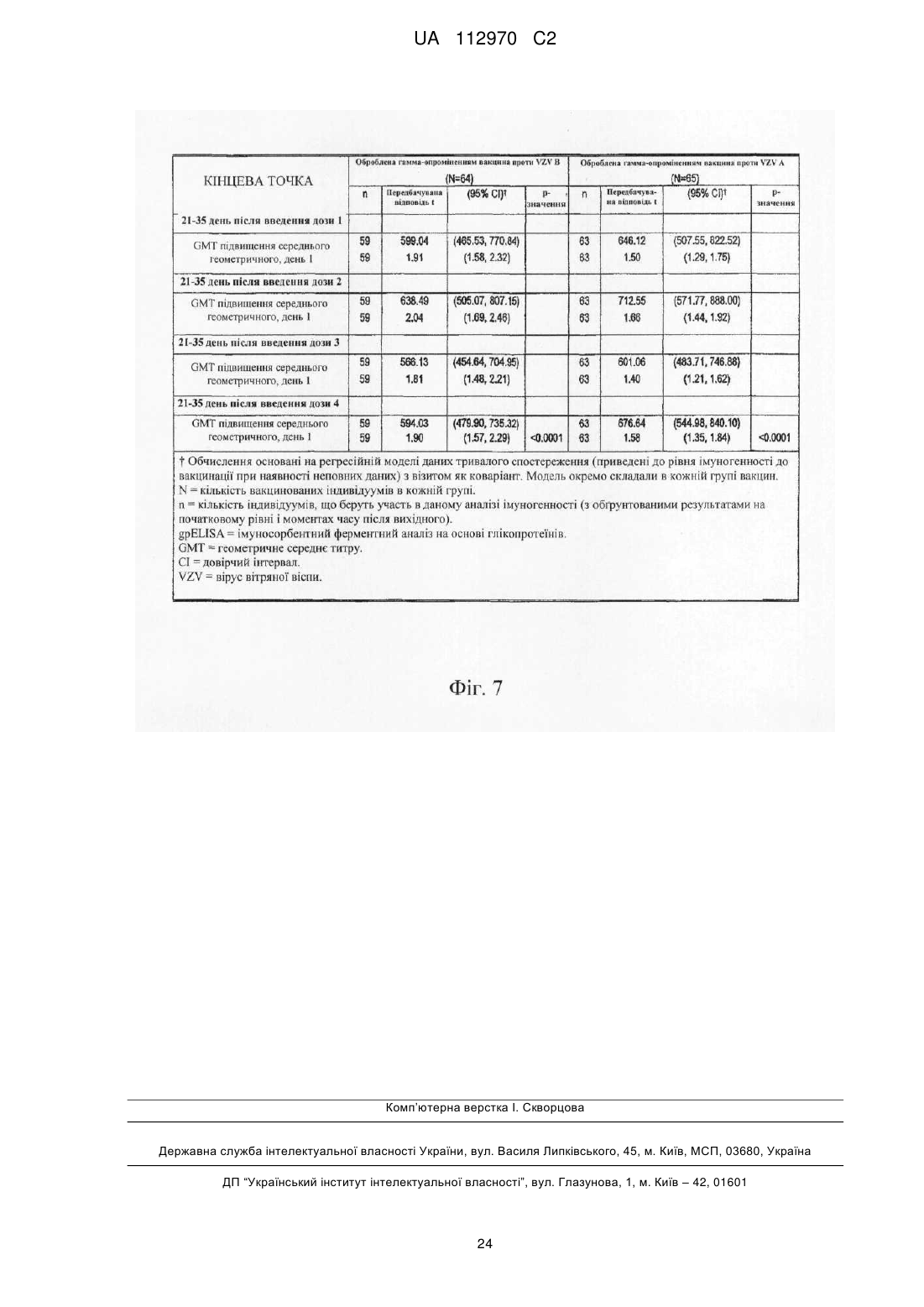
Реферат: Винахід стосується інактивованого вірусу вітряної віспи (VZV), який підходить для введення пацієнту з ослабленим імунітетом у вакцині проти VZV, де VZV інактивований з використанням від 10 до 25 кГр гамма-опромінення, де інфекційність VZV складає 0,040 бляшкоутворювальних одиниць (БУО)/мл, фармацевтичної композиції, яка містить вказаний інактивований вірус, та її застосування для лікування оперізувального лишаю. UA 112970 C2 (12) UA 112970 C2 UA 112970 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОПИС Галузь техніки, до якої належить винахід Винахід стосується композицій і способів профілактики і лікування оперізувального лишаю. Більш конкретно винахід стосується вакцинних композицій, що містять вакцину на основі інактивованого вірусу вітряної віспи (VZV), і способів одержання вказаних композицій. Передумови створення винаходу Первинна інфекція вірусом вітряної віспи (VZV) викликає вітряну віспу, як правило, у дітей і підлітків. Хоч клінічні вияви вітряної віспи, як правило, долаються самостійно протягом короткого періоду часу, VZV може зберігатися в латентному стані в сенсорних нейронах протягом багатьох років після інфекції. Реактивація і реплікація латентного VZV, як правило, через десятиріччя, може викликати оперізувальний лишай (HZ), широко відомий як оперізувальний герпес, хворобливі висипання, які, як правило, обмежені тільки дерматомом. Така реактивація VZV корелює зі зниженням клітинного імунітету, яке виникає в немолодому віці, або у осіб з ослабленим імунітетом (Weinberg et al., Journal of Infectious Diseases (2009), 200:1068-77). У деяких пацієнтів біль, асоційований з HZ, може зберігатися протягом місяців або навіть років після лікування висипів HZ, ускладнення, визначуване як постгерпетична невралгія (PHN). На даний час існує жива атенуйована вакцина (ZOSTAVAX®, Merck & Co., Inc., Whitehouse Station, NJ) для профілактики оперізувального лишаю у здорових пацієнтів немолодого віку (патенти США №№ 6214354 і 5997880). Така вакцина помітно знижує несприятливий вплив HZ в популяціях імунокомпетентних пацієнтів (Oxman MN, Clin. Infect. Dis. (2010), 51(2):197-213; Sanford and Keating, Drugs Aging (2010), 27(2):159-76; Oxman et al., N. Engl. J. Med. (2005), 352:2271-83). Однак живі атенуйовані вакцини можуть бути непридатними для пацієнтів з імунною недостатністю. Частота виникнення HZ у індивідуумів з ослабленим імунітетом, включаючи пацієнтів, що страждають гематологічними злоякісними новоутвореннями, пацієнтів, що перенесли імуносупресивну терапію, пацієнтів, яким проводили трансплантацію гематопоетичних стовбурових клітин (HCT) або трансплантацію цілого органа (SOT), ВІЛ-інфікованих пацієнтів і пацієнтів з аутоімунними захворюваннями, вище відносно загальної популяції. Крім того, такі популяції пацієнтів схильні до підвищеного ризику виникнення важких і небезпечних для життя ускладнень (Gourishankar et al. (2004), Am. J. Transplant. 4:108-115; Ragozzino et al. (1982), Medicine (Baltimore), 61:310-316; Wung et al. (2005), Am. J. Med. 118:1416. e9-1416 el8; Dworkin & Schmader (2003), Clinical Infectious Diseases, 36:877-882; Gebo et al. (2005), J. Acquir. Immune. Defic. Syndr. 40:169-174; Mattiuzzi et al. (2003), Clinical Cancer Research, 9:976-980; Dworkin et al. (2003), Neurology 60:1274-1283), таких як менінгоенцефаліти (Tauro et al. (2000), Bone Marrow Transplant, 26:795-796), поперечний мієліт, порушення зору (Walton et al. (1999), Bone Marrow Transplant, 23:1317-1320), пневмонія (Wacker et al. (1989), Bone Marrow Transplant, 4:191-194), гепатит (Rogers et al. (1995), Bone Marrow Transplant, 15:805-807; Schiller et al. (1991), Bone Marrow Transplant, 7:489-491), бактеріальна суперінфекція, рубцювання шкіри і спотворення (Schuchter et al. (1989), Blood, 74:1424-1427). Незважаючи на високий ризик захворюваності і смерті, асоційованої з HZ, у індивідуумів з ослабленим імунітетом, для цієї популяції не допускається вакцинація живою атенуйованою вакциною проти HZ, такою як ZOSTAVAX®. Таким чином, існує суттєва необхідність у вакцинах, які були б безпечними і ефективними для популяцій пацієнтів з імунною недостатністю для запобігання HZ або зменшення тяжкості або тривалості HZ або асоційованих з ним ускладнень. Питання безпеки відносно пацієнтів з імунною недостатністю підштовхнули дослідників до дослідження застосування інактивованих вакцин проти вірусних патогенів, таких як субодиничні вакцини, вакцини на основі вірусоподібних частинок і інактивованих цільних вакцин. Багато які схвалені інактивовані вакцини містять віруси, які інактивовані з використанням формаліну, включаючи вакцини проти гепатиту А, поліомієліту і японського енцефаліту. Стосовно HZ передбачають, що більш безпечну вакцину для індивідуумів з ослабленим імунітетом можна одержувати шляхом інактивації нагріванням VZV або застосуванням субодиничної вакцини (Cohen J.I. (2008), J. Infect. Dis. 197(Suppl 2):S237-S241). У Redman et al. (J. Infectious Diseases (1997), 176:578-85) описана інактивована вакцина проти VZV, яку інактивували нагріванням при 50 °C, що приводило до вмісту вірусів ≤1,2 БУО/0,5 мл. Такий рівень інфекційності не бажаний для продукту, який необхідно вводити пацієнтам з імунною недостатністю. У патентах США №№ 6214354 і 5997880 також згадується можливе використання інактивованої вакцини проти VZV і описаний приклад одержання і тестування термічно обробленої вакцини. У медицині був би суттєво запитаний спосіб інактивації VZV, в результаті якого одержать зразок VZV, який був би безпечним і ефективним для пацієнтів з імунною недостатністю, тобто 1 UA 112970 C2 5 10 15 20 25 30 35 40 45 50 55 60 не мав би залишкової інфекційності, але зберігав би імуногенність і антигенність неінактивованого зразка. Суть винаходу У даному описі показано, що зразок VZV можна інактивувати гамма-опроміненням таким чином, що інфекційність зразка знаходиться на невизначуваному рівні, однак це не приводить до суттєвої втрати в імуногенності і/або антигенності і до значних змін в структурі VZV після інактивації способами, описуваними в даному розкритті, відносно не підданого інактивації зразка VZV. У одному з аспектів винахід стосується інактивованого вірусу вітряної віспи (VZV), де інфекційність VZV не виявляється, і де при введенні пацієнту інактивований VZV викликає імунну відповідь до VZV. Винахід також стосується фармацевтичної композиції/вакцини, яка містить терапевтично ефективну кількість інактивованого VZV і фармацевтично прийнятний носій. Композиції за винаходом знаходяться в рідкому або замороженому стані, наприклад ліофілізованому. У деяких варіантах здійснення композицій, описуваних в даному розкритті, VZV інактивований гамма-опроміненням. У іншому аспекті винахід стосується способу одержання інактивованої вакцини проти VZV, де спосіб включає гамма-опромінення зразка, що містить VZV, із застосуванням від приблизно 5 кГр до приблизно 50 кГр гамма-опромінення. У переважних варіантах здійснення джерело 60 гамма-опромінення являє собою Co, хоч інші відомі в даній галузі ізотопи також можуть бути придатними в цьому відношенні. У деяких варіантах здійснення описуваного в даному розкритті способу одержання зразок до опромінення ліофілізують. У альтернативних варіантах здійснення нефасований рідкий препарат піддають гамма-опроміненню без попередньої ліофілізації. Винахід також стосується способу лікування або імунізації проти HZ або іншого захворювання, асоційованого з реактивацією VZV, де спосіб включає введення індивідууму вакцини або фармацевтичної композиції, яка містить терапевтично ефективну кількість інактивованого VZV і фармацевтично прийнятний носій, де VZV інактивований гаммаопроміненням. У деяких варіантах здійснення способів лікування, описуваних в даному розкритті, спосіб введення композиції/вакцини є підшкірним або внутрішньом'язовим. У конкретних варіантах здійснення такого аспекту винаходу вік пацієнта становить 50 років або більше і/або пацієнт страждає імунною недостатністю. Протягом всього опису і в прикладеній формулі винаходу, форми однини включають множину, якщо з контексту явно не випливає інше. Протягом всього опису і в прикладеній формулі винаходу, використовують представлені нижче визначення і скорочення. Термін "лікування" стосується терапевтичного лікування і профілактичних або превентивних заходів. До потребуючих лікування індивідуумів належать індивідууми вже з порушенням, а також схильні до порушення індивідууми або індивідууми, у яких порушення необхідно попередити. Лікування пацієнта інактивованим VZV за винаходом включає одне або декілька з перерахованого нижче: індукування/посилення імунної відповіді у пацієнта проти VZV, запобігання, поліпшення стану, усунення або зниження імовірності реактивації VZV у пацієнтів, які інфіковані вітряною віспою або одержували живу вакцину проти VZV, запобігання або зниження імовірності розвитку HZ і/або іншого захворювання або ускладнення, асоційованого з реактивацією VZV, такого як PHN, зменшення тяжкості або тривалості HZ і/або іншого захворювання або ускладнення, асоційованого з реактивацією VZV, такого як PHN. Термін "терапевтично ефективна кількість" означає достатню вакцинну композицію для надання бажаної дії, включаючи, але, не обмежуючись ними, індукування/посилення імунної відповіді у пацієнта проти VZV, запобігання, поліпшення стану або усунення реактивації VZV у пацієнтів, які інфіковані вітряною віспою або одержували живу вакцину проти VZV, запобігання HZ і/або PHN, зменшення тяжкості або тривалості HZ і/або PHN. Фахівець в даній галузі розуміє, що цей рівень може змінюватися. Термін "імунна відповідь" стосується клітинної (Т-клітина) імунної відповіді і/або утворення антитіл (В-клітина). Термін "пацієнт" стосується будь-якої людської істоти, яка повинна одержувати інактивовані вакцини проти VZV або фармацевтичні композиції, описувані в даному розкритті, включаючи імунокомпетентних індивідуумів і індивідуумів з імунною недостатністю. Як визначено в даному описі, "пацієнт" включає вже інфікованих VZV пацієнтів шляхом природної інфекції або вакцинації. Термін "нефасований" стосується рідкого складу або композиції, що містить більше однієї дози вакцини. 2 UA 112970 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "невизначувані рівні" відносно інфекційності конкретного вакцинного складу або композиції означає, що склад або композиція містить ≤0,050 інфекційних доз або бляшкоутворювальних одиниць ("БУО") вірусу інфекційної VZV на мл зразка, переважно ≤0,040 БУО/мл, ≤0,030 БУО/мл, ≤0,020 БУО/мл, ≤0,015 БУО/мл, ≤0,010 БУО/мл, ≤0,009 БУО/мл або ≤0,008 БУО/мл, більш переважно ≤0,007 БУО/мл, ≤0,006 БУО/мл, ≤0,005 БУО/мл, ≤0,004 БУО/мл, ≤0,003 БУО/мл, більш переважно ≤0,002 БУО/мл або ≤0,001 БУО/мл. БУО конкретного зразка можна визначати із застосуванням, наприклад, аналізу утворення бляшок вітряної віспи, такого як аналіз, описаний в прикладі 1, а також описаний у Krah et al. (J. Virol. Methods (1990), 27:319-26). Інфекційність зразка також можна підтверджувати способом імунозабарвлення, як описано в прикладі 1. Короткий опис креслень На фігурі 1 представлена кінетика інактивації γ-опроміненого ліофілізованого VZV (log БУО/мл в порівнянні з дозою опромінення, див. приклад 4). Флакони з VZV опромінювали при 60 60 різних рівнях Co-випромінювання з використанням Co-опромінювача Gammacell®. Залишкові БУО/мл кожного флакона на дозу опромінення (Гр) визначали з використанням аналізу утворення бляшок вітряної віспи на клітинах MRC-5. Спостережувані експериментальні значення показані у вигляді темнозабарвлених ромбиків ("спостереження"), і максимальні значення, визначені аналізом, показані у вигляді сірих ромбиків ("
ДивитисяДодаткова інформація
Назва патенту англійськоюInactivated varicella zoster virus vaccines, methods of production, and uses thereof
Автори англійськоюKrah, David, L., Dehaven, Jill, Kriss, Jennifer, A., Barr, Colleen, M., Yagodich, Mary
Автори російськоюКрах Дэвид Л., Дехавен Джилл, Крисс Джэннифер А., Барр Коллин М., Ягодич Мэри
МПК / Мітки
МПК: A61K 39/25, C12N 7/04
Мітки: вітряної, одержання, віспи, інактивований, спосіб, застосування, вірус
Код посилання
<a href="https://ua.patents.su/26-112970-inaktivovanijj-virus-vitryano-vispi-sposib-jjogo-oderzhannya-i-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Інактивований вірус вітряної віспи, спосіб його одержання і застосування</a>