Спосіб достовірної оцінки біологічної активності ембріонованих яєць trichuris
Формула / Реферат
1. Спосіб достовірної оцінки біологічної активності ембріонованих яєць Trichuris з точністю, необхідною для фармацевтичного продукту, який полягає в тому, що здійснюють щонайменше 3 з наступних аналізів:
а) оцінку і/або підтвердження стадії ембріонального розвитку яєць гельмінтів за допомогою методу кількісної ПЛР із використанням придатних маркерних послідовностей для визначення кількості копій геномної ДНК,
б) оцінку метаболічної активності ембріонованих яєць гельмінтів за допомогою біохімічних і/або молекулярно-біологічних методів,
в) оцінку індуцибельності генної експресії в ембріонованих яйцях гельмінтів,
г) оцінку за допомогою мікроскопа рухливості личинок гельмінтів, які перебувають у яйці, протягом тривалих періодів спостереження після попередньої інкубації при підвищених температурах, і/або
д) оцінку коефіцієнта вилуплюваності личинок Trichuris в організмі лабораторної тварини, при цьому здійснюють кількісне порівняння інтактних ембріонованих яєць, виділених із вмісту кишечнику, з внутрішнім стандартом.
2. Спосіб за п. 1а), у якому за допомогою методу кількісної ПЛР із використанням придатних специфічних для Trichuris suis послідовностей оцінюють кількість копій геномної ДНК.
3. Спосіб за п. 1б), який відрізняється тим, що для оцінки метаболічної активності ембріонованих яєць Trichuris вимірюють зміст АТФ.
4. Спосіб за п. 3, який відрізняється тим, що перед здійсненням вимірювань люмінесценції здійснюють попередню інкубацію яєць Trichuris у наступних умовах:
аа) при температурі від 36 до 42 °С,
бб) протягом проміжку часу, що становить від 2 до 30 год.,
вв) у суспензійному середовищі, що має значення pН від 0,1 до 3.
5. Спосіб за п. 1б), який відрізняється тим, що яйця Trichuris спочатку обробляють засобом для попередньої обробки, обраним із хлорнуватистої кислоти, хітинази та/або протеази, і потім забарвлюють солями тетразолію.
6. Спосіб за п. 1в), який відрізняється тим, що оцінюють індуцибельність білка теплового шоку.
7. Спосіб за п. 1в), який відрізняється тим, що виявлення експресії здійснюють на основі гібридизації із флуоресцентно-міченим нуклеотидним зондом.
8. Спосіб за п. 1в), який відрізняється тим, що гібридизацію виявляють за допомогою проточної цитометрії.
9. Спосіб за п. 1г), який відрізняється тим, що рухливість личинок гельмінтів, які перебувають у яйці, оцінюють за допомогою мікроскопа протягом періодів часу, що становлять від 2 хв до 8 год., з використанням уповільненої кінозйомки.
10. Спосіб за п. 1д), який відрізняється тим, що яйця гельмінтів, які підлягають аналізу, маркують флуоресцентними зондами і внутрішні стандарти маркують флуоресцентними зондами, що мають інше забарвлення.
11. Спосіб за п. 1д), який відрізняється тим, що як систему для аналізу застосовують вміст кишечників кроликів і/або свиней.
12. Спосіб за п. 1д), який відрізняється тим, що як внутрішній стандарт для визначення коефіцієнта вилуплюваності застосовують неембріоновані або інактивовані яйця Trichuris.
13. Спосіб за одним з попередніх пунктів, який відрізняється тим, що здійснюють щонайменше чотири аналізи, вибрані з аналізів, зазначених в 1а), 1б), 1в), 1г) і/або 1д).
14. Спосіб за одним з попередніх пунктів, який відрізняється тим, що перед здійсненням оцінки яйця Trichuris піддають попередній інкубації протягом періоду часу, що становить щонайменше від 30 хв до 24 год., у суворо стандартизованих умовах, причому попередня інкубація при необхідності включає також регулювання параметрів, що мають істотне значення, насамперед, температури.
15. Яйця Trichuris длязастосування як фармацевтичного препарату для лікування автоімунного захворювання, які відрізняються тим, що серед них щонайменше 50 % є біологічно активними при оцінці згідно зі способом за одним з пп. 1-14.
Текст
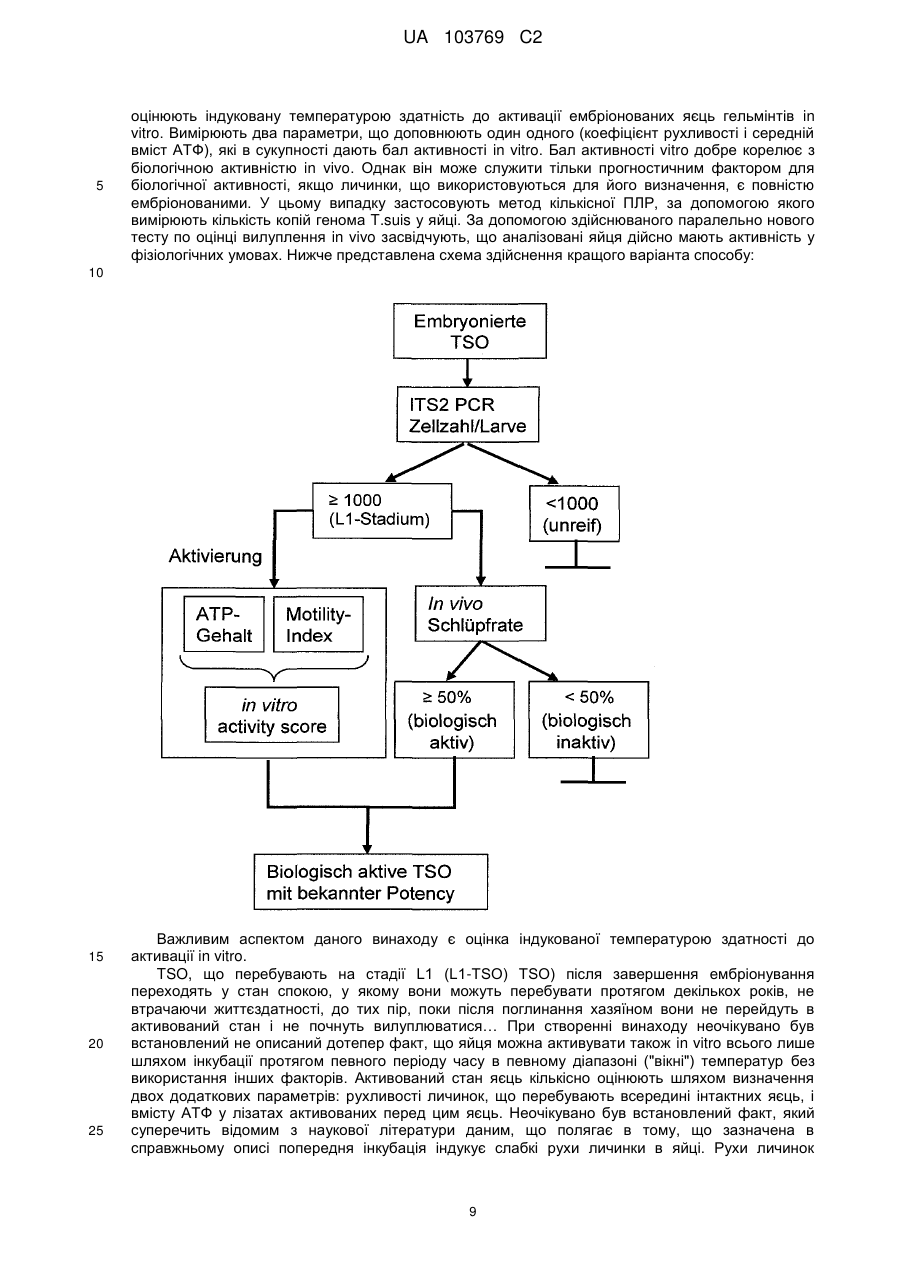
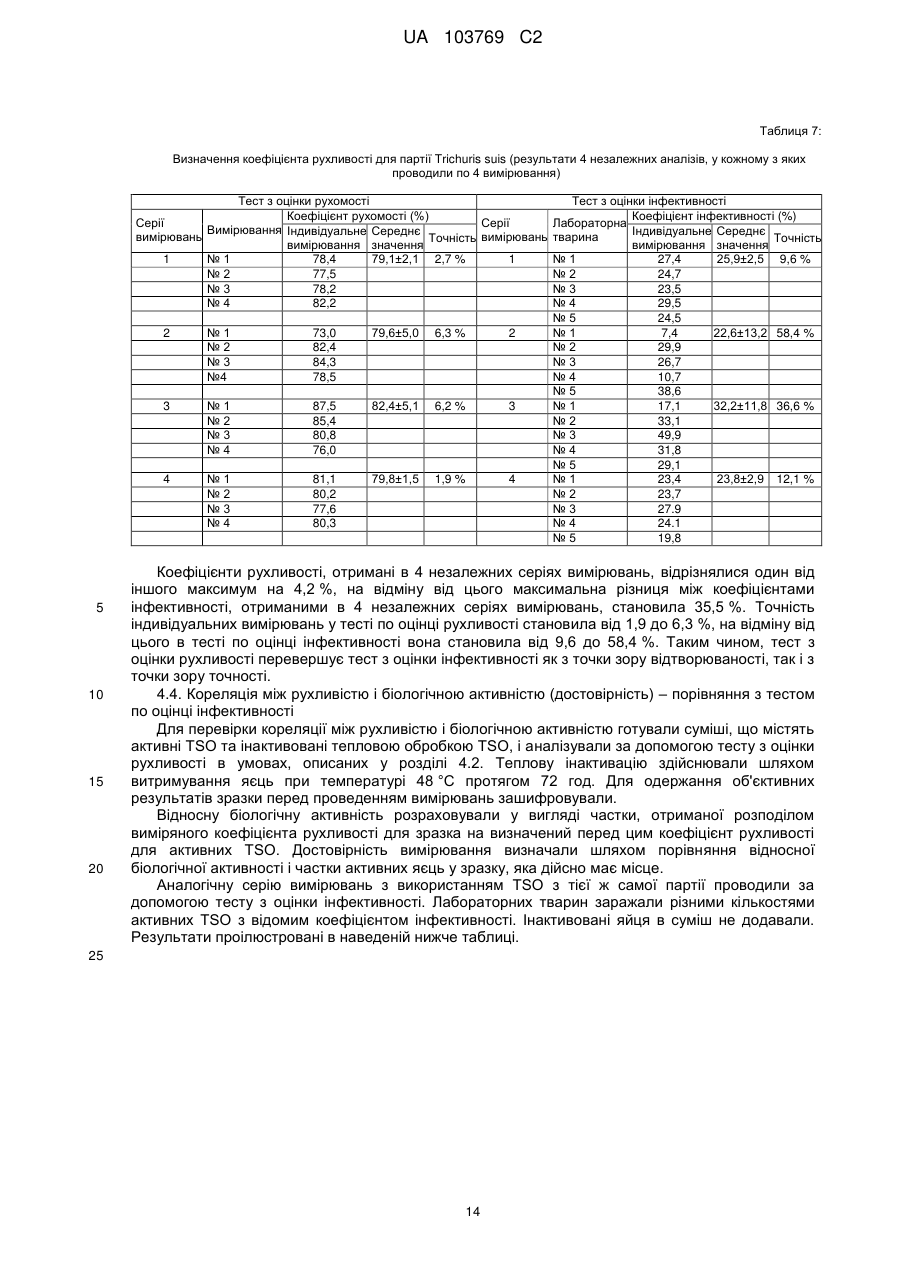
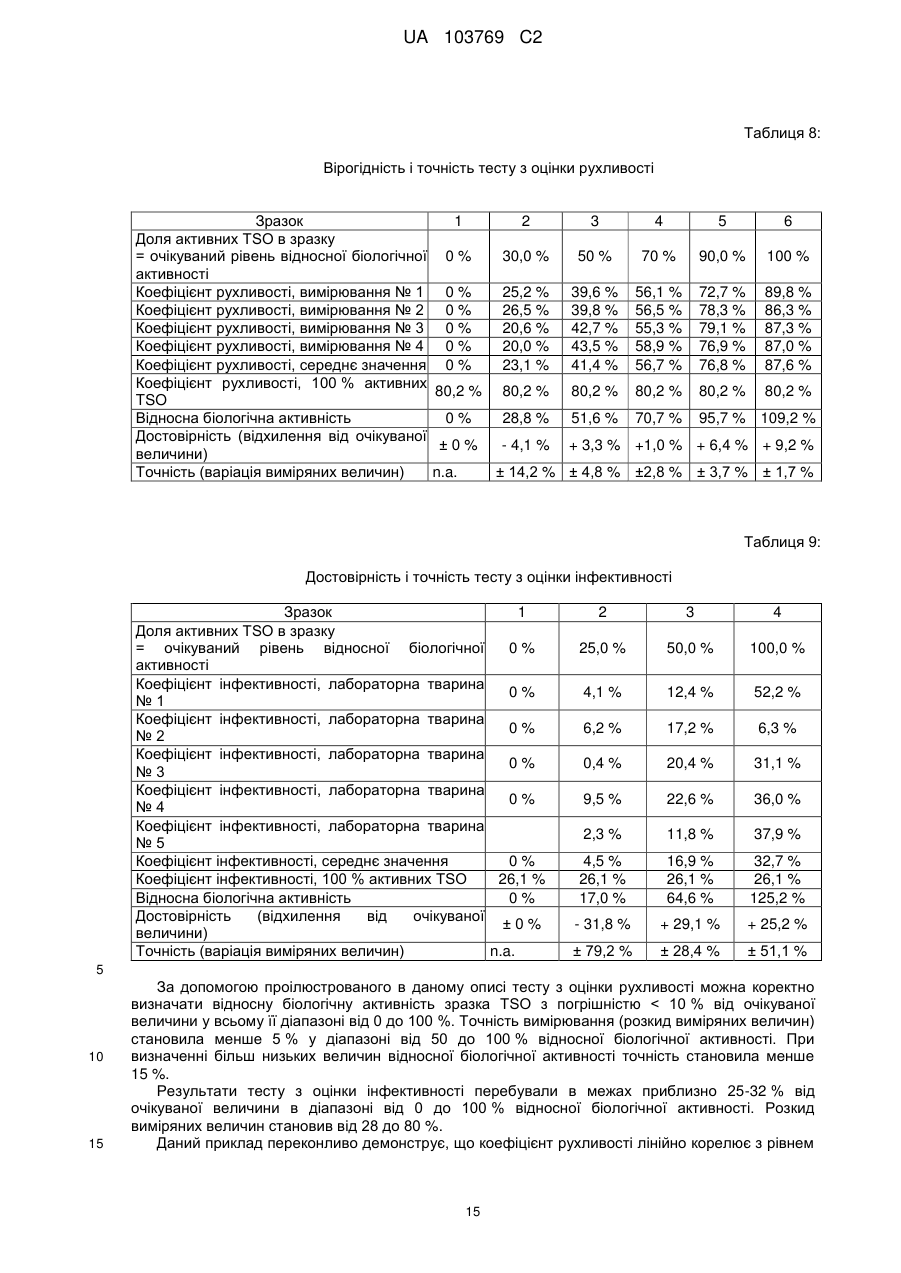
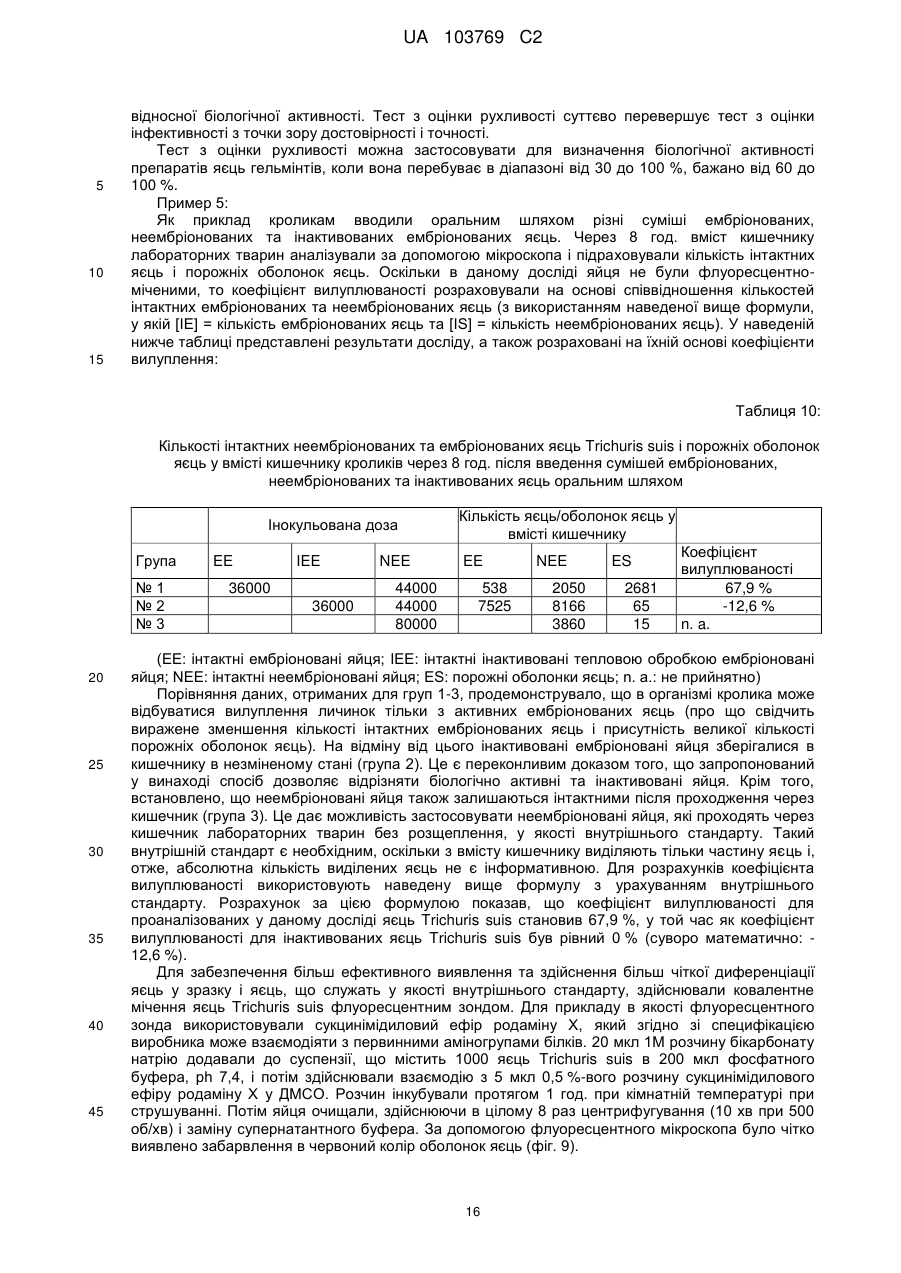
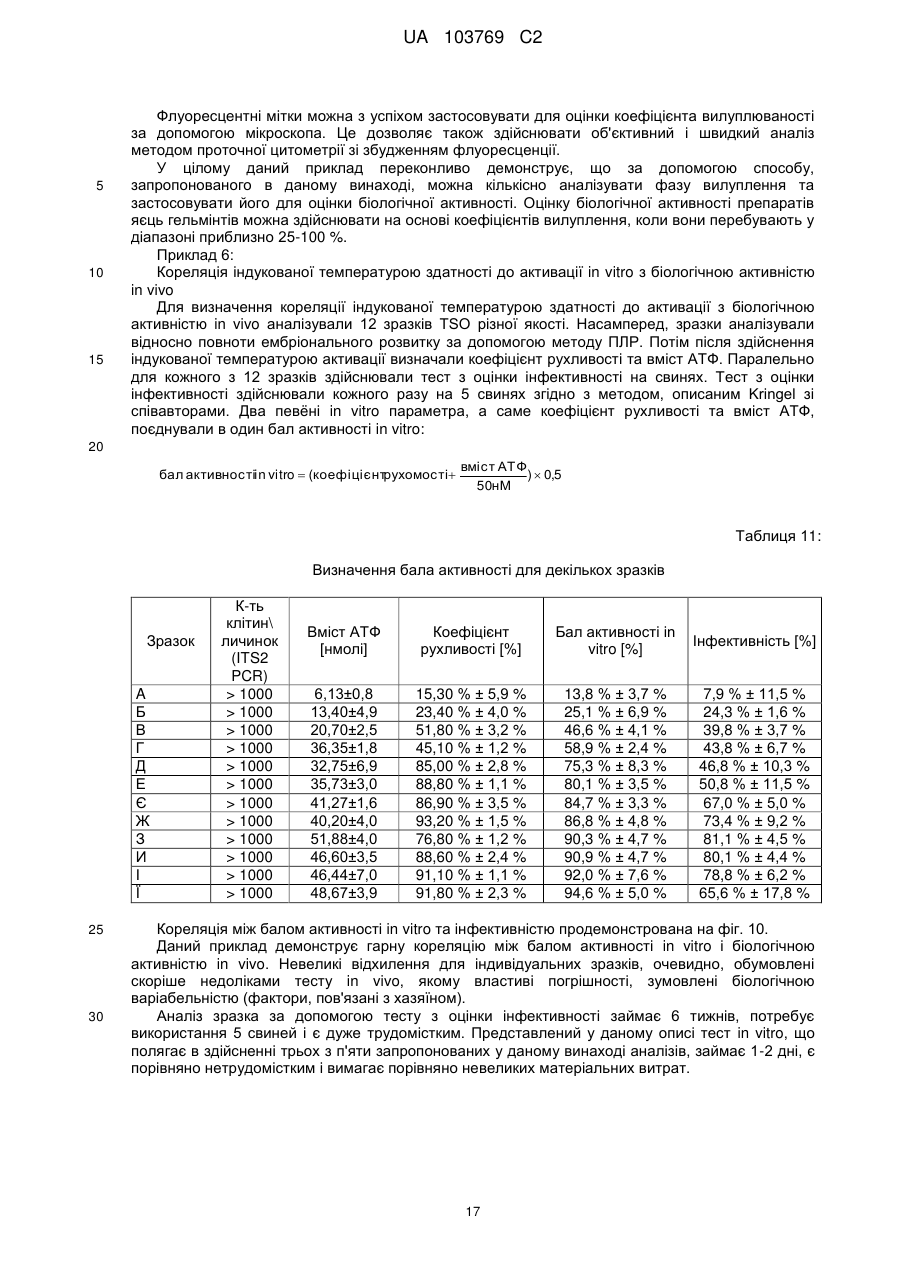
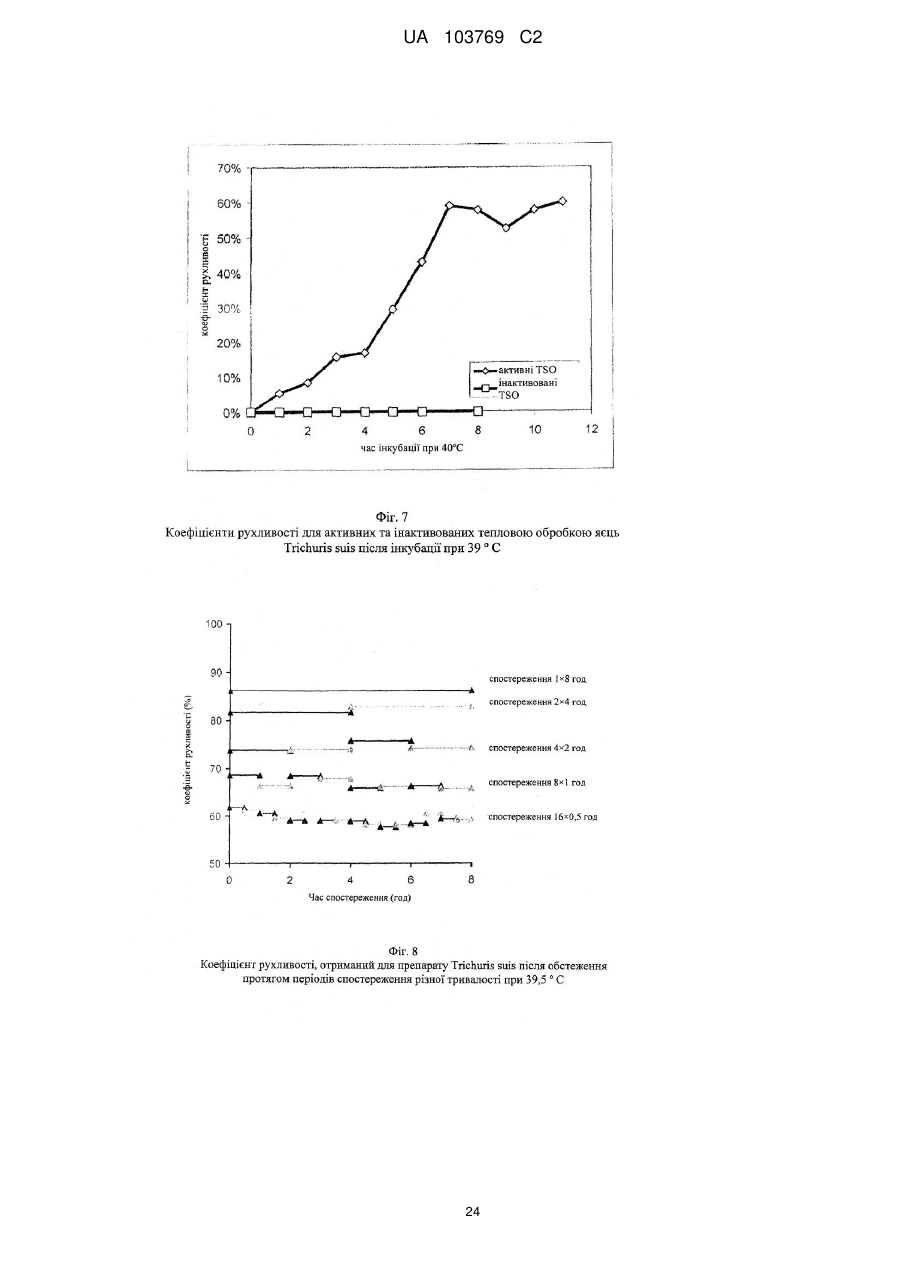
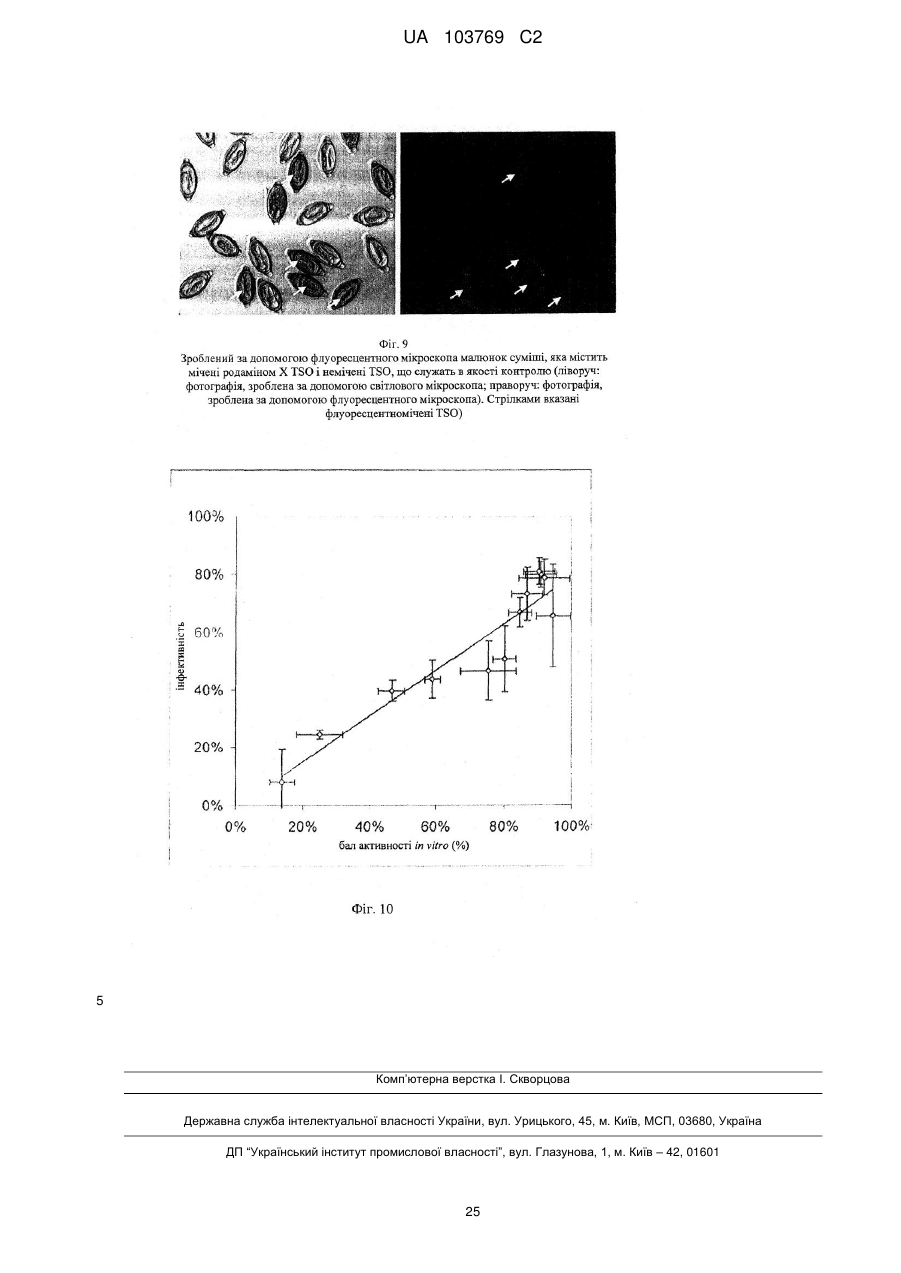
Реферат: UA 103769 C2 (12) UA 103769 C2 Винахід належить до способу достовірної оцінки біологічної активності ембріонованих яєць Trichuris, з точністю, необхідною для фармацевтичного продукту, який полягає в тому, що здійснюють щонайменше 3 з наступних аналізів: а) оцінку і/або підтвердження стадії ембріонального розвитку яєць гельмінтів за допомогою методу кількісної ПЛР із використанням придатних маркерних послідовностей для визначення кількості копій геномної ДНК, б) оцінку метаболічної активності ембріонованих яєць гельмінтів за допомогою біохімічних і/або молекулярно-біологічних методів, в) оцінку індуцибельності генної експресії в ембріонованих яйцях гельмінтів, г) оцінку за допомогою мікроскопа рухливості личинок гельмінтів, які перебувають у яйці, протягом тривалих періодів спостереження після попередньої інкубації при підвищених температурах, і/або д) оцінку коефіцієнта вилуплюваності личинок Trichuris в організмі лабораторної тварини, при цьому здійснюють кількісне порівняння інтактних ембріонованих яєць, виділених із вмісту кишечнику, з внутрішнім стандартом. UA 103769 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до способу оцінки біологічної активності яєць гельмінтів, насамперед яєць гельмінтів р. Trichuris, бажано яєць Trichuris suis, на різних стадіях їх життєвого циклу. Спосіб дозволяє здійснювати контрольоване одержання препаратів яєць гельмінтів в якості ефективних компонентів терапевтичних лікарських засобів і гарантувати їх безпечне і терапевтично ефективне застосування для людини. Відомо, що паразитарні інфекції справляють вплив на активацію імунної системи тваринихазяїна (див. огляд D. M. McKay, Parasitology, 132, 2006, сс. 1-12). Така активація впливає також на зустрічальність і протікання автоімунних захворювань яєць гельмінтів. Результати епідеміологічних досліджень показали, що в регіонах з високими коефіцієнтами зараження хробаками автоімунні захворювання є більш рідкими, ніж в регіонах, в яких коефіцієнти такого зараження є більш низькими внаслідок кращих гігієнічних умов. Вивчення профілів цитокінів в організмі пацієнтів, які страждають на хворобу Крона, що представляє собою хронічне запальне захворювання кишечнику, показало, що імунні Th2-клітини можуть піддаватися стимуляції в результаті зараження гельмінтами. Хворобу Крона, тобто Th1-домінантне автоімунне захворювання, можна попереджати або впливати на це захворювання шляхом зараження гельмінтами (Summers та ін., Am J Gastroenterol, 98, 2003, сс. 2034-2041). Вже в 1971 р. Beer (Br. Med. J., 3, 1971, сс. 41) опублікував дані про те, що Trichuris suis може служити в якості нематоди, придатної для здійснення цілеспрямованого помірного зараження людини, що не індукує патогенні дії, які супроводжують, наприклад, зараження патогенним для людини збудником Trichuris trichiura. Результати більш сучасних досліджень продемонстрували, що зараження людини Trichuris suis, мабуть, є лише короткочасним, и вочевидь, хробаки виганяються до того, як може відбутися їхнє розмноження. Однак, позитивні результати клінічних досліджень застосування Trichuris suis при хронічних запальних захворюваннях кишечнику свідчать про те, що зазначене короткочасне зараження людини може запускати таку модуляцію імунної системи, що володіє терапевтичною ефективністю (Summers та ін., Am. J. Gastroenterol., 98, 2003, сс. 2034-2041). Життєвий цикл Trichuris suis починається з відкладання неембріонованих яєць (стадія L0), які виділяються із інфікованої тварини разом з фекаліями. В ґрунті протягом періоду часу, що становить 3-6 місяців, відбувається ембріонування до утворення личинки першої стадії L1. Протягом перших декількох днів після досягнення стадії L1 в яйці можна спостерігати рухи личинки, після чого яйця переходять в стан спокою, в якому вони можуть залишатись роками, не втрачаючи при цьому своєї інфективності. Після поглинання оральним шляхом підходящим хазяїном личинки, ті, що знаходяться на стадії L1, вилуплюються з яйця, потрапляючи в порожнину кишечнику, і протягом декількох годин проникають у слизову оболонку сліпої кишки і ободової кишки. Перебуваючи в. Перебуваючи в слизовій оболонці кишечнику, личинки проходять протягом декількох наступних тижнів подальші стадії розвитку (L2-L4), після чого вони у вигляді дорослої личинки, що перебуває на стадії L5, знову виходять у порожнину кишечнику (Beer, Parasitol., 67, 1973, сс. 253-262). Для одержання яєць Trichuris suis (Trichuris suis ova=TSO) для фармацевтичних цілей неембріоновані TSO (що перебувають на стадії L0), які були відкладені in vitro або in situ, виділяють і очищують за допомогою підходящих методів (WO 1999/33479, WO 2007/076868, WO 2007/134761). Потім у лабораторних умовах, що контролюються, відбувається ембріонування з утворенням біологічно активних TSO (що перебувають на стадії L1), що являють собою компонент фармацевтичного продукту, що має фармацевтичну активність. Яйця гельмінтів, які призначені для терапевтичних застосувань, можна класифікувати як біологічні фармацевтичні продукти. Основним параметром, який необхідно тестувати при виробництві та застосуванні біологічних фармацевтичних продуктів, є біологічна активність, яка в результаті являє собою міру терапевтичної ефективності фармацевтичного продукту. Без аналізу біологічної активності не можна ні раціонально розробляти й контролювати технологічний процес, ні визначати дозу фармацевтичного продукту, необхідну для досягнення терапевтичної дії й безпечну для пацієнта у випадку його планованого застосування для людини. Тому в якості фармацевтичних продуктів можна безпечно й ефективно застосовувати тільки ті препарати яєць гельмінтів, біологічна активність яких охарактеризована в достатньому ступені. Дотепер були відомі три аналітичні методи, які можна було застосовувати для Trichuris suis, однак вони не дозволяли в достатньому ступені охарактеризувати біологічну активність. 1. Оцінка коефіцієнта ембріонування (Kringel та ін., Vet. Parasitol., 139, 2006, сс. 132-139, параграф 2.2 (Trichuris suis); а також Johnson та ін., Intl. J. Parasitol., 28, 1998, сс. 627-633 (Ascaris suum)): Дослідження проводять за допомогою мікроскопа. На основі морфологічних критеріїв оцінюють, чи містять яйця інтактні, повністю сформовані личинки, що перебувають на 1 UA 103769 C2 5 10 15 20 25 30 35 40 45 50 55 60 стадії L1. Однак, на відміну від молекулярно-біологічного способу, що пропонується в даному винаході, цей метод, заснований тільки на морфологічній оцінці, не дозволяє зробити чіткий висновок про те, що личинки дійсно повністю ембріоновані. Ще одне обмеження полягає в тому, що сам по собі коефіцієнт ембріонування не несе інформацію про життєздатність і біологічну активність ембріонованих TSO, що перебувають на стадії L1. Крім того, для проведення морфологічної оцінки потрібна наявність певного досвіду в дослідника і суб'єктивна класифікація пограничних випадків при проведенні морфологічної оцінки обмежує правильність і точність цього методу. 2. Визначення коефіцієнта зараження: У випадку Trichuris suis аналіз проводять на свинях. У певний момент часу визначають кількість личинок, що перебувають у слизовій оболонці кишечнику та зіставляють із введеною дозою TSO (Kringel та ін., Vet. Parasitol., 139, 2006, сс. 132-139, а також Summers та ін., Gastroenterology, 128, 2005, сс. 825-832 або Johnson та ін., Intl. J. Parasitol., 28, 1998, сс. 627-633 (Ascaris suum)). Проблема визначення коефіцієнта зараження полягає в тому, що він залежить не тільки від функціональної здатності яєць гельмінтів, але рівною мірою також і від індивідуальних факторів організму хазяїна, таких, наприклад, як імунна система, кишкова флора й кишкова функція лабораторних тварин. Таким чином, визначення коефіцієнта зараження на лабораторних тварин неминуче пов'язане із високою варіабельністю, і його не можна стандартизувати внаслідок того, що система тестування заснована на використанні природних об'єктів, що суттєво обмежує можливість її застосування для тестування біологічної активності. У випадку Trichuris suis проведення тесту з оцінки інфективності на свинях пов'язане із тривалим інкубаційним періодом, що становить щонайменше три тижні, і внаслідок високої варіабельності воно потребує великої кількості тварин, що як з етичної, так і з економічної точки зору робить проблематичним застосування цього тесту як стандартного. Крім того, Kringel із співавторами описали виділення яєць із фекалій тварин для доказу біологічної активності яєць гельмінтів, якими були заражені тварини. Для цього необхідно чекати протягом 7-8 тижнів після зараження тварин, щоб личинки, що вилупилися, дозріли до досягнення стадії L5, спарилися і самі відклали яйця. При цьому відсутній прямий кількісний зв'язок що дозволяє судити про коефіцієнт зараження або біологічну активність дорослих личинок по кількості яєць у фекаліях. Метод, розроблений Kringel із співавторами, суттєво відрізняється від того, що пропонується в даному винаході способу визначення коефіцієнта вилуплюваності in vivo, оскільки згідно методу Kringel із співавторами аналізують яйця наступного покоління. 3. У WO 2007/134761 описаний метод визначення життєздатності яєць Trichuris suis, в якому моделюють in vitro проходження яєць через шлунково-кишковий тракт свині й при цьому створюють умови для дозрівання яєць. Однак описані методи не є достатніми для оцінки біологічної активності препаратів яєць гельмінтів з точністю, необхідної для продуктів медичного призначення. Так, одна з основних проблем, пов'язаних з біологічним фармацевтичним продуктом, біологічну активність якого тестують на тваринах, полягає в стандартизації препарату. Моделювання на тваринах, таке як зазначене вище зараження свиней, є надзвичайно дорогим і вимагає значної кількості часу. Тому при створенні даного винаходу був розроблений спосіб, у якому здійснюють різні типи аналізів, що стосуються різних аспектів розвитку яєць гельмінтів і їх біологічної активності. Для того, щоб зробити надійний висновок, необхідно провести щонайменше один з тестів, запропонованих у винаході, для підлягаючої аналізу партії, однак бажано провести щонайменше три, більш бажано щонайменше чотири або навіть п'ять із запропонованих у даному винаході тестів, у яких визначають у кожному випадку відповідні параметри. Результати індивідуальних тестів розглядаються в сукупності, причому придатний препарат гельмінтів у кожному тесті повинен задовольняти заздалегідь певні граничні значення, для того, щоб можна було зробити висновок про те, що препарат яєць гельмінтів придатний для фармацевтичного застосування. Таким чином, існує виражена необхідність у розробці способу, підходящого для промислового застосування, який дозволяє здійснювати повний і надійний аналіз біологічної активності TSO і яєць інших гельмінтів на різних стадіях розвитку і тим самим характеризувати різні біологічні функції яєць гельмінтів. Тільки такий спосіб дозволяє здійснювати контрольоване виробництво придатного для продажу медичного продукту. Завдання даного винаходу полягає в здійсненні повного аналізу біологічної активності яєць гельмінтів за допомогою способу, більш докладно представленого нижче в даному описі, що й дозволяє, з одного боку, забезпечувати суворий контроль процесу виробництва, і, з іншого боку, забезпечувати можливість безпечного й терапевтично ефективного застосування на пацієнті. 2 UA 103769 C2 5 10 15 20 Беручи до уваги складність проблеми й недоліки відомих на сьогодні методів, стає очевидним, що надійне визначення біологічної активності не можна здійснювати за допомогою методу, що полягає в здійсненні тільки одного виду аналізу. Таким чином, об'єктом винаходу є спосіб визначення біологічної активності яєць Trichuris, які містять повністю ембріоновані личинки, що полягає в тому, що здійснюють щонайменше одну з наступних оцінок: оцінку індукованої температурою активності яєць Trichuris за допомогою біохімічних і/або молекулярно-біологічних методів, насамперед вимір вмісту АТФ, визначення індуцибельності генної експресії в ембріонованих яйцях Tricuris, оцінку за допомогою мікроскопа рухливості личинки Tricuris у яйці протягом тривалого періоду спостереження після активації за допомогою попередньої інкубації при підвищених температурах і/або оцінку коефіцієнта вилуплюваності личинок Trichuris в організмі лабораторної тварини, при цьому інтактні ембріоновані яйця, виділені із вмісту кишечнику, оцінюють кількісно шляхом порівняння із внутрішнім стандартом. Так, була розроблена система, що включає п'ять видів аналізів, згідно з якою в кожному випадку аналізують різні біологічні функції гельмінтів на певній фазі їх життєвого циклу. Хоча може виявитися достатнім використовувати лише один метод аналізу в процесі здійснення окремих стадій виробництва фармацевтичного препарату, як правило, для визначення біологічної активності кінцевого продукту слід здійснювати щонайменше 3 з перерахованих нижче в таблиці 1 видів аналізу. Таблиця 1 Стадія способу 1. оцінка кількості копій геномної ДНК Приклади параметрів біологічної активності - стадія розвитку личинок від L0 до L1 - ідентичність організму - життєздатність личинки, що перебуває на стадії L1, в 2. оцінка метаболічної активності яйці 3. аналіз індуцибельної генної - активованість личинки, що перебуває на стадії спокою експресії L1 - здатність личинки, що перебуває на стадії L1, рухатись у 4. оцінка коефіцієнта рухливості яйці (передумова для вилуплення) 5. оцінка коефіцієнта - коефіцієнт вилуплюваності личинки, що перебуває на вилуплюваності in vivo стадії L1, з яйця (передумова для колонізації хазяїна) 25 30 35 40 45 Для надійної характеризації біологічної активності придатних для фармацевтичного застосування яєць гельмінтів бажано здійснюють весь спосіб повністю, включаючи щонайменше три, бажано 4 і більш бажано всі 5 його стадій. Зокрема, може виявитися достатнім здійснювати лише окремі стадії способу для характеризації конкретних аспектів біологічної активності або для моніторингу певних підстадій процесу виробництва. П'ять окремих стадій способу засновані на принципах тестування, які вже були описані в іншому зв'язку. Адаптація способу з метою його застосування на ембріонованих яйцях гельмінтів, насамперед на ембріонованих яйцях Trichuris suis, є новою, і вона потребує розробки ряду нових підстадій, не описаних для теперішнього часу. Спосіб у цілому, заснований на дослідженні п'яти різних аспектів біологічної активності, завдяки чому дозволяє здійснювати вичерпну характеризацію, також є новим, і дотепер не було описано його застосування для яєць гельмінтів, насамперед для яєць Trichuris suis. Кращою загальною відмітною рисою трьох з п'яти описаних стадій способу є активація личинок Trichuris, що перебувають у стані спокою, шляхом попередньої інкубації при підвищеній температурі. Інша відмінна риса розглянутого способу полягає в тому, що його можна здійснювати на інтактних життєздатних яйцях гельмінтів, і в тому, що вимірювані параметри залежать тільки від активності яєць гельмінтів, а не від пов'язаних з хазяїном факторів або від індивідуальних можливостей фахівця, що здійснює тест, і внаслідок цього розглянутий спосіб є більш об'єктивним, ніж методи, що застосовувалися для теперішнього часу. Завдяки цьому виявляється можливим здійснювати стандартизацію, яка необхідна для фармацевтичного застосування За допомогою запропонованого способу виявляється можливим надійно визначати біологічну активність препаратів яєць гельмінтів з точністю, необхідної для фармацевтичного продукту. Точне визначення біологічної активності яєць гельмінтів згідно зі способом, 3 UA 103769 C2 5 10 15 20 25 30 35 40 45 50 55 60 запропонованим у даному винаході, являє собою необхідну стадію при виробництві придатного для застосування фармацевтичного продукту. Нижче більш докладно описано 5 видів аналізу, що являють собою складову частину способу. a) Оцінка кількості копій геномної ДНК При кожному поділі клітини в процесі ембріонального розвитку набір хромосом подвоюється та розділяється між двома дочірніми клітинами. Отже, кількість копій геномної ДНК у яйці можна розглядати в якості корелята кількості соматичних клітин у личинці, що розвивається. Таким чином, оцінку кількості копій геномної ДНК можна використовувати для визначення статусу ембріонального розвитку личинки, що розвивається, на будь-якій стадії. Це є очевидною перевагою в порівнянні з описаним раніше методом (оцінка коефіцієнта ембріонування за допомогою мікроскопа, див. вище), за допомогою якого можна аналізувати тільки кінцевий результат ембріонування, що триває протягом приблизно 13 тижнів, і який не дає ніякої інформації про те, чи закінчений повністю в дійсності ембріональний розвиток (тобто чи відповідає кількість клітин повністю сформованій личинці на стадії L1). Ембріонування являє собою складову частину фармацевтичного процесу одержання яєць гельмінтів. Оцінка кількості копій геномної ДНК вперше дозволяє здійснювати аналіз у режимі супроводу процесу виробництва. З одного боку, це дає можливість раціональним шляхом проводити вдосконалення процесу виробництва та аналізувати ефект змін процесу, а, з іншого боку, здійснювати стандартним шляхом моніторинг протягом фази ембріонування. За допомогою методу кількісної ПЛР можна оцінювати кількість копій певної нуклеотидної послідовності в зразку. Чим більша кількість копій певної нуклеотидної послідовності присутня в зразку, тим швидше процес ампліфікації виходить на плато. Кількість копій можна оцінювати порівняно точно з використанням каліброваних кривих. Одним з методів, який, як правило, застосовують для цієї мети, є ПЛР у реальному часі або так звана Taqman-ПЛР (ПЛР по методу Taqman). Фахівцеві в даній області відомі альтернативні методи ампліфікації нуклеїнових кислот, і їх також можна застосовувати для визначення кількості копій геномної ДНК. Точну кількість копій, як правило, визначають із використанням відповідних каліброваних кривих. Бажано в якості кращого маркера для геномної ДНК гельмінтів можна застосовувати область ITS1-5.8S-ITS2, що кодує частину рибосомної РНК. Послідовність ITS1-5.8S-ITS2 вже була описана для Trichuris suis (Cutillas та ін., Parasitol Res, 100, 2001, сс. 383-389), а також для інших видів Trichuri і інших гельмінтів. Описаний також тест з оцінки життєздатності, згідно з яким здійснюють моніторинг ембріонального розвитку Ascaris suum за допомогою кількісної ПЛР області IST-1 (Pecson та ін., Appl. Envir. Microbiol., 72, 2006, сс. 7864-7872).). Однак зазначений тест призначений для іншої мети, а саме для тестування ефективності методів інактивації гельмінтів. Кількісна ПЛР (кПЛР), за допомогою якої ампліфікують часткову послідовність із області ITS1-5.8S-ITS2, є найбільш придатною для оцінки кількості копій маркерної області і, значить, кількості копій геномної ДНК. Оскільки елементи ITS1 і ITS2 є видоспецифічними, то цей метод можна застосовувати окрім аналізу стадії ембріонування також і для якісної перевірки ідентичності організму. Такий тест не був описаний у зазначених вище прототипах, насамперед тому, що раніше не було відомо, що T.suis на стадії L1 містить приблизно 1000 клітин згідно з оцінкою на основі кількості копій генома (див. приклад 1). На фіг. представлена відповідна послідовність гена Trichuris suis, яку можна використовувати, наприклад, для оцінки кількості копій геномної ДНК. Відповідна послідовність гена представлена в SEQ ID NO: 1. Послідовність "прямого" праймера представлена в SEQ ID NO: 2, послідовність "зворотного" праймера представлена в SEQ ID NO: 3, а послідовність Taqman-зонда представлена в SEQ ID NO: 4. Фахівцеві в даній області повинно бути очевидно, що для оцінки кількості копій можна використовувати також і інші ділянки з генома Trichuris suis. Передумовою для можливості використання послідовності є те, що вона повинна являти собою нуклеотидну послідовність, яка є специфічною для Trichuris suis, і що подібні послідовності не зустрічаються в інших організмах, які можуть бути присутніми у якості домішок у зразку, призначеному для аналізу. Оцінку кількості копій геномної ДНК можна використовувати також і для іншої мети. Таким шляхом можна підтверджувати, що організм, що представляє інтерес, є присутнім у препараті та з використанням відповідних інших послідовностей можна визначати, чи присутні домішки у вигляді інших організмів. Важливим аспектом, на який потрібно зважати, при оцінці кількості копій геномної ДНК є те, що яйця гельмінтів необхідно руйнувати перед проведенням вимірів. Як проілюстровано в прикладах, для даної мети найбільш придатним виявився "гомогенізатор Поттера", причому в 4 UA 103769 C2 5 10 15 20 25 30 35 40 45 50 55 60 кращому варіанті здійснення винаходу використовують обсяг 2 мол і встановлюють ширину зазору від 0,01 до 0,03 мм. Гомогенізацію бажано здійснювати протягом періоду часу, що становить від 5 до 15 хв, краще приблизно 10 хв. Руйнування клітин завжди здійснюють тоді, коли клітинні компоненти повинні перебувати у формі, придатної для відповідної стадії аналізу. б) Оцінка метаболічної активності Багато методів оцінки життєздатності клітин засновані на аналізі метаболічної активності. Аденозинтрифосфат відіграє центральну роль у клітинному метаболізмі в якості переносника енергії і акумулятора енергії, і його можна використовувати в якості маркера при оцінці внутрішньоклітинної метаболічної активності. У даному винаході продемонстровано, що виявлення цього нуклеотиду можна використовувати також для оцінки життєздатності різних організмів, таких як личинки, що перебувають на стадіїL1 Trichuris suis. Кількісну оцінку аденозинтрифосфату в біологічних системах можна здійснювати на основі виміру люмінесценції за допомогою люциферазної реакції. Люмінесценцію визначають як випускання "холодного" світла. Люмінесцентні системи засновані на хімічній, біохімічній або електрохімічній активації субстратів, які при поверненні у свій вихідний стан випускають частину енергії збудження у формі світла. При виявленні аденозинтрифосфату застосовують люциферази, виділені зі світляків (Photinus pyralis; світляк). Еукаріотичний фермент каталізує окиснення люциферину в оксилюциферин у присутності аденозинтрифосфату, кисню та іонів магнію з випусканням світла. Рівняння реакції презентовано на фіг. 2. Передумовами для успішного здійснення виявлення аденозинтрифосфату в ембріонованих життєздатних яйцях Trichuris suis є стимуляція синтезу аденозинтрифосфату в личинках, що перебувають на стадії L1, на рівні, достатньому для виміру люмінесценції, повне руйнування яєць за допомогою придатного методу гомогенізації для вивільнення сформованого усередині клітини нуклеотиду, а також кількісне й при цьому безперешкодне вловлювання аденозинтрифосфату зі складної матриці. При створенні винаходу неочікувано був встановлений не описаний дотепер факт, що вміст АТФ у личинках, що перебувають на стадії L1, до завершення ембріонального розвитку є низьким і тільки після відповідної активації шляхом інкубації протягом тривалого періоду часу при певній температурі зростає до постійного високого рівня. Крім того, для того, щоб розрізняти живі й мертві личинки, що перебувають на стадії L1, необхідний ефективний метод інактивації, такий щоб можна було відтвореним образом визначати вихідний рівень аденозинтрифосфату у вбитих організмах. Згідно з винаходом для аналізу метаболічної активності популяцій яєць гельмінтів бажано оцінювати вміст АТФ. Для аналізу метаболічної активності індивідуальних яєць гельмінтів можна застосовувати також методи забарвлення з використанням похідних тетразолію, які спочатку були розроблені для вільно доступних клітин тварин у клітинних культурах або для гістологічних зрізів. Похідні тетразолію відновлюються в клітинах, що володіють метаболічною активністю у результаті впливу мітохондріальних ферментів з утворенням забарвлених формазанів, що відкладаються в клітинах. Вирішальне значення для можливості застосування методів забарвлення, розроблених для вільно доступних клітин тварин, для багатоклітинних личинок гельмінтів, що перебувають на стадії L1, в яйцях, має попередня обробка яєць, яка дає можливість субстрату проникати в них, не впливаючи на життєздатність личинки, що перебуває в яйці. Личинки Trichuris suis, що перебувають на стадії L1, оточені твердою оболонкою, яка значно обмежує обмін речовиною з навколишнім середовищем і перешкоджає проникненню субстанцій, необхідних для здійснення аналізу. Було встановлено, що для щадного руйнування оболонки яйця бажано застосовувати метод обробки яєць хлорнуватистою кислотою, який уже був описаний раніше (Beer, Parasitol., 67, 1973, сс. 263-278),), і ефективність зазначеної обробки при необхідності можна підвищувати шляхом наступного ферментативного розщеплення за допомогою хітинази та протеази. Для того, щоб мати можливість оцінити метаболічну активність, необхідно визначати "нульове значення". У даному випадку мова йде про величину, шляхом порівняння з якою оцінюють відповідну метаболічну активність. У кращому варіанті здійснення винаходу "нульове значення" визначають на неактивних яйцях гельмінтів. Встановлено, що кріоінактивація (швидке заморожування і зберігання при -80C протягом 24 год.) є методом, придатним для інактивації яєць. Було встановлено, що аденозинтрифосфатний сигнал від зразків, інактивованих таким шляхом, можна знижувати до рівня фонового шуму. Одержання кріоінактивованих зразків яєць здійснюють у забуференому фосфатом фізіологічному розчині хлориду натрію. Очевидно, що кріоінактивацію можна застосовувати також у комбінації з іншими методами виявлення. На фіг. 3 продемонстрований як приклад вплив кріоінактивації при кількісному виявленні 5 UA 103769 C2 5 10 15 20 25 30 35 40 45 50 55 60 аденозинтрифосфату за допомогою люциферазної реакції. З використанням кріоінактивації можна оцінювати конкретно вплив попередньої інкубації. Встановлено, що у випадку інактивованих (вбитих) яєць гельмінтів навіть після попередньої інкубації було неможливо виявити збільшення рівня аденозинтрифосфату. На відміну від цього, біологічно активні яйця гельмінтів мають активність, яку виявляли по збільшенню рівня аденозинтрифосфату після попередньої обробки при 37 °C протягом періоду часу, що становить 19 г. В одному із кращих варіантів здійснення винаходу для кожної партії використовували по 5500 яєць в 550 мкл розчину. Після попередньої інкубації яйця відокремлювали центрифугуванням (5 хв при 500 об/хв) і ресуспендували в 225 мкл буфера для лізису. Для вивільнення вмісту клітин, що включає аденозинтрифосфат, що утворився при інкубації, яйця гомогенізували з використанням гомогенізатора Поттера (об'єм 2 мол, ширина зазору 0,01-0,03 мм) протягом 10 хв. Тільки даний метод дозволяв здійснювати повне руйнування яєць і забезпечувати кількісне вивільнення нуклеотиду. Для інактивації гідролаз, що розщеплюють аденозинтрифосфат, руйнування яєць здійснювали з використанням буфера для лізису (компонент: фосфорна кислота, pH 2). З кожної індивідуальної партії відбирали за допомогою піпетки по 50 мкл і вносили в 96-лункові мікропланшети та кожну партію розводили за допомогою ще 100 мкл фосфатного буфера. Люциферазну реакцію починали шляхом додавання 100 мкл набору, що поступав у продаж для аналізу аденозинтрифосфату. Після інкубації протягом 2 хв здійснювали зчитування лунок мікропланшета за допомогою люмінометру і визначали люмінесценцію (фіг. 3). Кількісну оцінку здійснювали з використанням стандартної кривої для аденозинтрифосфату у фосфатному буфері (1,0мкМ, 0,1мкМ, 10нМ, 1нМ, 0,1нМ, 10пМ, 1,0пМ, 0,1пМ). Типова калібрована крива для АТФ проілюстрована на фіг. 4 Шляхом цілеспрямованого додавання аденозинтрифосфату до гомогенізованих кріоінактивованих зразків ембріонованих яєць можна досягати виходу, що становить 84 %, у лінійному діапазоні стандартної кривої (від 1 до 1000нМ). При цьому не було виявлено відповідного впливу складного матрикса гомогената яєць на люциферазну реакцію і люмінесценцію. Даний приклад чітко демонструє, що вимір люмінесценції можна використовувати для того, щоб відрізняти життєздатні ембріоновані яйця Trichuris suis від інактивованих і отже нежиттєздатних яєць. Однак тести можна успішно здійснювати тільки при використанні комбінації оптимізованих параметрів способу, що включає активацію зразка, гомогенізацію зразка й одержання придатних контролів за допомогою оптимізованого методу інактивації. Придатний зміст АТФ у біологічно активних яйцях гельмінтів становить щонайменше приблизно 0,01пмоля АТФ на яйце. в) Аналіз індуцибельної генної експресії Принцип, покладений в основу цього методу, полягає в здійсненні індукції генної експресії, яка може мати місце тільки в живих клітинах і яка дозволяє розрізняти живі й мертві клітини. Крім того, індуцибельність генної експресії, очевидно, є передумовою для того, щоб личинка, що знаходиться у стані спокою, і що перебуває на стадії L1, могла проходити через різні стани активації, необхідні для індукції наступних стадій життєвого циклу (вилуплення, впровадження в слизову оболонку і т.д.). Очевидно, найкращим є аналіз експресії білків теплового шоку, оскільки її можна легко індукувати шляхом підвищення температури, і матрична РНК (мРНК), що утворюється, як правило, має стабільність відносно швидкого розщеплення. При створенні даного винаходу вперше вдалося виявити в Trichuris suis послідовність гена, що володіє високим ступенем гомології з послідовністю білка теплового шоку hsp70 з гельмінта Caenorabhditis elegans. Відповідно одному із кращих варіантів здійснення даного винаходу аналізують генну експресію білка теплового шоку T.suis. На фіг. 5 наведене порівняння білкової послідовності Trichuris suis (SEQ ID NO: 5) з амінокислотною послідовністю гомологічного білка з Caenorabhditis elegans (SEQ ID NO: 6). Індуцибельну генну експресію можна виявляти шляхом оцінки вмісту матричної РНК, що кодує певний індуцибельний білок. З амінокислотної послідовності можна виводити нуклеотидну послідовність матричної РНК. Для фахівця в даній області не представляє труднощів вибір придатних "прямого" і "зворотного" праймерів і розміщення між ними послідовності Taqmanзонда. Після цього за допомогою ПЛР у реальному часі можна виявляти індукцію гена. Для інформативного виявлення необхідною передумовою є аналіз також і контрольного зразка, що містить вбиті яйця хробаків. Крім того, даний аналіз слід застосовувати для білка, який легко й надійно піддається індукції. Одним із прикладів є білок теплового шоку, однак для виявлення можна з рівним успіхом використовувати також і інші індуковані певними стимулами гени. Виявлення експресованої матричної РНК на рівні індивідуального яйця можна здійснювати 6 UA 103769 C2 5 10 15 20 25 30 35 40 45 50 55 60 також за допомогою методу флуоресцентної in situ гібридизації (FISH) з використанням придатного генного зонда. Для швидкого одержання надійних результатів найкраще потім аналізувати популяцію яєць за допомогою проточної цитометрії Послідовність зонда, придатного для гібридизації in situ представлена на фіг. 6 (SEQ ID NO: 7). г) Оцінка рухливості личинок в інтактних яйцях гельмінтів Принцип, покладений в основу цього аналізу, полягає у виявленні рухів тіла в якості параметрів функціональності личинки, що перебуває на стадії L1, в яйці. Рухливість личинки є передумовою для її вилуплення у відповідних умовах навколишнього середовища. У випадку вільно живучих личинок і хробаків, таких як C.elegans, аналіз рухливості можна використовувати для надійного доказу життєздатності і функціональної здатності. При створенні даного винаходу неочікувано і вперше на прикладі Trichuris suis було встановлено, що шляхом точного регулювання температури навколишнього середовища можна індукувати слабкі рухи також і в личинок гельмінтів, які перебувають у яйці, а не перебувають у вільному стані. Згідно відомим до теперішнього часу даним вважалося, що після завершення ембріонування личинки переходять у стан спокою та активуються і вилуплюються тільки після їхнього поглинання придатним хазяїном. Рухи личинок у яйці є дуже повільними і їх можна виявити тільки тоді, коли згідно із даним винаходом їх аналізують за допомогою цейтраферу (апарат для вповільненоїкінозйомки) під мікроскопом протягом тривалого періоду часу. Тест на виявлення рухливості за допомогою мікроскопа можна автоматизувати з використанням програмного забезпечення для аналізу зображень. Коефіцієнт рухливості, що представляє собою параметр біологічної активності яєць, розраховують за наступною формулою: Коефіцієнт рухливості = Кіл-сть рухливих личинок в полі спостереження Кіл-сть яєць в полі спостереження, які аналізуються При оцінці рухливості личинок для успішного застосування способу вирішальне значення має точне налаштування температури. Насамперед, яйця піддають попередній інкубації протягом періоду часу, що становить від 2 до 30 год., бажано від 4 до 20 год. при точно встановленій температурі, що перебуває в межах від 36 до 42 °C, бажано від 37 до 41 °C і більш бажано при 39,5 °C. Після здійснення зазначеної попередньої інкубації личинки поміщають під придатний мікроскоп, підтримуючи при цьому температуру щонайменше приблизно на встановленому рівні. Після цього здійснюють спостереження з використанням вповільненої кінозйомки протягом періоду часу, що становить від 2 хв до 4 год., бажано від 30 хв до 2 год. при температурі від 36 до 42 °C, більш бажано від 38 до 40 °C. На фіг. 7 представлені результати оцінки коефіцієнта рухливості згідно з винаходом, що свідчать про те, що у випадку інактивованих яєць рухливість повністю відсутня, а на відміну від цього у випадку активних яєць хробаків коефіцієнт рухливості збільшується із часом. На фіг. 8 представлені дані про коефіцієнт рухливості для різних періодів спостереження. д) Оцінка коефіцієнта вилуплюваності у кишечнику Принцип, покладений в основу цієї стадії способу, полягає в оцінці коефіцієнта вилуплюваності личинок гельмінтів у кишечнику лабораторних тварин або в альтернативному варіанті у вмісті кишечнику, який раніше був вилучений з організму лабораторних тварин. Згідно з одним із варіантів здійснення винаходу коефіцієнт вилуплюваності можна оцінювати у вмісті кишечнику, який вилучений з організму лабораторних тварин, як правило, краще з верхнього відділу ободової кишки або з нижнього відділу дванадцятипалої кишки. У цьому випадку можна оцінювати коефіцієнт вилуплюваності у вмісті кишечнику замість того, щоб визначати коефіцієнт вилуплюваності безпосередньо в організмі лабораторної тварини. Крім того, спосіб можна здійснювати також шляхом аналізу яєць, які пройшли через кишечник і виділені з фекалій. Це дає ту перевагу, що не потрібно вбивати лабораторну тварину і її можна використовувати кілька разів для визначення коефіцієнта вилуплюваності. На розробленій при створенні винаходу стадії способу вміст кишечнику аналізують після закінчення відносно короткого проміжку часу після інокуляції й підраховують кількість інтактних яєць, а також оболонок яєць, що залишилися після вилуплення. Важлива перевага в порівнянні з відомим з існуючого рівня техніки методом оцінки інфективності полягає в тому, що в цьому випадку по вилупленню аналізують тільки першу стадію життєвого циклу, на яку фактори, що залежать від хазяїна, виявляють лише слабкий вплив. При створенні винаходу неочікувано вперше було встановлено для Trichuris suis, що вилуплення личинок, що піддається кількісній оцінці, відбувається не тільки в організмі свині, що представляє собою придатного хазяїна, але також і в організмі кролика. Отже, наприклад, для 7 UA 103769 C2 5 10 15 20 Trichuris suis можна використовувати лабораторну тварину з меншими розмірами кишечнику, що значно полегшує виявлення мікроскопічно малих яєць і оболонок яєць. При створенні винаходу неочікувано було встановлено, що можна здійснювати стійке забарвлення оболонок яєць за допомогою флуоресцентних барвників, що поступають у продаж, розроблених для маркування білків. Зв'язування флуоресцентних барвників з оболонкою яйця суттєво полегшує виявлення яєць, оскільки вміст кишечнику можна аналізувати за допомогою флуоресцентного мікроскопа. Ще однієї технічною інновацією є застосування неембріонованих або інактивованих яєць гельмінтів у якості певного внутрішнього стандарту. Для таких яєць характерний такий самий час проходження через кишечник або час перебування в кишечнику, але на відміну від ембріонованих і біологічно активних яєць вони залишаються інтактними при проходженні через кишечник. Шляхом маркування яєць, призначених для застосування як внутрішнього стандарту, за допомогою другого (відмінного від першого) флуоресцентного барвника можна легко розрізняти внутрішній стандарт і яйця, що підлягають аналізу. Для аналізу визначають кількість інтактних яєць внутрішнього стандарту, маркованих флуоресцентним барвником 1, і порожніх оболонок яєць у призначеному для аналізу зразку і кількість інтактних яєць, маркованих флуоресцентним барвником 2, у вмісті кишечнику в певний момент часу після інокуляції. Коефіцієнт вилуплюваності в кишечнику в перерахуванні на кількість інтактних (з яких не вилупилися личинки) яєць можна розраховувати відповідно наведеній нижче формулі. Формула для розрахунку коефіцієнта вилуплюваності: Коефіцієнт [IE]i [IS]i вилуплюваності 1 [IE]0 [IS]0 25 Де: - [IE]= кількість інтактних яєць у зразку, яких підлягає аналізу (маркованих барвником 1) - [IS]= кількість інтактних яєць внутрішнього стандарту (маркованих барвником 2) - i = зразок вмісту кишечнику - 0 = зразок інокуляту У наведеній нижче таблиці 2 узагальнені дані про ПЛР-аналіз, а також кращі види оцінки й кращі одержувані при цьому значення, які являють собою граничні значення, що дозволяють судити, чи володіє аналізований препарат необхідною біологічною активністю. Таблиця 2 Бажані види оцінки Цільове значення діапазон: 50-1200 копій/яйце в день 28 (d28) (в момент початку ембріонування кількість копій складає Кількість копій геномної a) ПЛР, геномна ДНК 1 копію/яйце; після ембріонування ДНК/яйце протягом 28 днів кількість копій повинна досягати щонайменше 50 копій/яйце) б1) метаболічна активність діапазон: Середній вміст АТФ/яйце варіант 1: вміст АТФ > 1пмоль АТФ/ембріоновані яйце діапазон: ≥ 50 % б2) метаболічна активність Частка яєць з позитивним (мінімум 50 % яєць повинні мати варіант 2: забарвлення, що забарвленням, , що свідчить позитивне забарвлення, що свідчить свідчить про наявність активності про наявність активності про наявність метаболічної активності) частка яєць, що діапазон: ≥ 50 % характеризується в) індуцибельна генна експресія (мінімум у 50 % яєць повинна індуцибельною генною індукуватися генна експресія) експресією діапазон: ≥ 50 % частка яєць, які містять рухливі г) коефіцієнт рухливості (мінімум 50 % яєць повинні містити личинки рухливі личинки) діапазон ≥ 40 % частка яєць, які вилуплюються (як мінімум з 40 % внесених д) коефіцієнт вилуплюваності у кишечнику ембріонованих яєць повинні вилупитися личинки) 30 Параметр У бажаному варіанті здійснення винаходу новий спосіб тестування полягає в тому, що 8 UA 103769 C2 5 оцінюють індуковану температурою здатність до активації ембріонованих яєць гельмінтів in vitro. Вимірюють два параметри, що доповнюють один одного (коефіцієнт рухливості і середній вміст АТФ), які в сукупності дають бал активності in vitro. Бал активності vitro добре корелює з біологічною активністю in vivo. Однак він може служити тільки прогностичним фактором для біологічної активності, якщо личинки, що використовуються для його визначення, є повністю ембріонованими. У цьому випадку застосовують метод кількісної ПЛР, за допомогою якого вимірюють кількість копій генома T.suis у яйці. За допомогою здійснюваного паралельно нового тесту по оцінці вилуплення in vivo засвідчують, що аналізовані яйця дійсно мають активність у фізіологічних умовах. Нижче представлена схема здійснення кращого варіанта способу: 10 15 20 25 Важливим аспектом даного винаходу є оцінка індукованої температурою здатності до активації in vitro. TSO, що перебувають на стадії L1 (L1-TSO) TSO) після завершення ембріонування переходять у стан спокою, у якому вони можуть перебувати протягом декількох років, не втрачаючи життєздатності, до тих пір, поки після поглинання хазяїном вони не перейдуть в активований стан і не почнуть вилуплюватися… При створенні винаходу неочікувано був встановлений не описаний дотепер факт, що яйця можна активувати також in vitro всього лише шляхом інкубації протягом певного періоду часу в певному діапазоні ("вікні") температур без використання інших факторів. Активований стан яєць кількісно оцінюють шляхом визначення двох додаткових параметрів: рухливості личинок, що перебувають всередині інтактних яєць, і вмісту АТФ у лізатах активованих перед цим яєць. Неочікувано був встановлений факт, який суперечить відомим з наукової літератури даним, що полягає в тому, що зазначена в справжньому описі попередня інкубація індукує слабкі рухи личинки в яйці. Рухи личинок 9 UA 103769 C2 5 10 15 20 25 30 35 40 45 50 55 60 тривають протягом декількох годин, при цьому не спостерігається загибель личинок або вилуплення з яйця. Тому в кращому варіанті способу, запропонованого у винаході, застосовують відповідну попередню інкубацію яєць, що приводить до активації. Шляхом спостереження за допомогою мікроскопа з використанням уповільненої кінозйомки за досить великою кількістю яєць виявляється можливим надійно оцінювати частку яєць у популяції, які містять активні рухливі личинки (тобто визначати коефіцієнт рухливості). Однак, оскільки даний спосіб не дозволяє виявляти відмінності між станами з різною активністю для індивідуальної личинки, тобто різні рівні рухливості/активності, то його поєднують із визначенням вмісту АТФ, який являє собою кількісну міру загальної активності аналізованої популяції яєць. Обидва аналізованих параметри, а саме, коефіцієнт рухливості, який являє собою пряму, але дискретну змінну, і вміст АТФ, що являє собою непряму, але безперервну змінну, взаємно доповнюють один одного, дозволяючи надійно оцінювати активність in vitro, яка добре корелює з активністю in vivo. На основі обох параметрів можна розраховувати бал активності in vitro, який добре корелює з активністю яєць in vivo. Запропонований у винаході спосіб in vitro суттєво відрізняється від відомих у цей час методів. Визначення коефіцієнта ембріонування, коли яйця візуально аналізують тільки з метою визначення присутності повністю сформованих личинок (Kringel зі співавторами), на відміну від способу, запропонованого в даному винаході, не дозволяє зробити ніякого висновку про життєздатність або активність личинок. Оцінка коефіцієнта вилуплюваності in vitro шляхом моделювання проходження через шлунково-кишковий тракт представляється суттєво більш складним і підданим впливу випадкових факторів методом у порівнянні із запропонованим у даному винаході способом. Крім того, для тесту з оцінки вилуплюваності in vitro не опубліковані дані про кореляцію з активністю in vivo. У кращому варіанті здійснення винаходу оцінюють стан ембріонування. Бал активності in vitro дає значимі результати, які можна використовувати для передбачення ситуації in vivo, тільки в тому випадку, коли личинки повністю пройшли через стадію ембріонального розвитку. Не повністю розвинені личинки в певних умовах дають позитивну реакцію в тесті на індуковану температурою здатність до активації, однак вони не є функціональними й не мають здатність вилуплюватися в хазяїні і розвиватися відповідно нормальному життєвому циклу личинки. Згідно відомим до теперішнього часу методам повний ембріональний розвиток оцінюють за допомогою мікроскопа на основі морфологічних критеріїв. Така оцінка вимагає наявності великого досвіду, вона є ненадійною і по своїй природі її можна здійснювати тільки на індивідуальних яйцях. На відміну від цього спосіб, запропонований у даному винаході, дозволяє одержувати об'єктивну оцінку кількості копій генома у великій популяції яєць, на основі чого можна розраховувати середнє значення соматичних клітин на одну личинку. Результати тесту на індуковану температурою здатність до активації бажано підтверджують за допомогою нового тесту in vivo, який дозволяє надійно визначати коефіцієнт вилуплюваності у фізіологічних умовах за допомогою простої і швидкої процедури. При створенні винаходу неочікувано було встановлено, що в кишковому тракті має місце вилуплення личинок, що піддається кількісній оцінці, з біологічно активних яєць, у той час як попередньо інактивовані яйця проходять через кишечник у незміненому вигляді. Згідно з новим розробленим способом частку активних TSO у препараті оцінюють непрямим шляхом, для чого підраховують тільки неактивні яйця, що пройшли без змін через кишковий тракт лабораторної тварини. Однак кількісну оцінку можна успішно здійснювати тільки в тому випадку, коли використовують новий розроблений внутрішній стандарт, що представляє собою флуоресцентномічені неактивні яйця, які також проходять без змін через кишковий тракт. Крім того, був встановлений дивний і несподіваний факт, що вилуплення біологічно активних TSO, що піддається кількісній оцінці, може мати місце також у кишечнику кролика. Таким чином, існує тварина, яка можна використовувати в якості тваринної моделі замість свині, утримання якого вимагає менших витрат і є більш простим і яка має суттєво менший обсяг кишечнику, що робить більш легким виділення мікроскопічно малих яєць. Запропонований у винаході тест in vivo відрізняється від відомого тесту з оцінки інфективності, проведеного на свинях. Оцінка коефіцієнта вилуплюваності займає всього лише 1-3 дні, в той час як тривалість тесту з оцінки інфективності становить кілька тижнів. Крім того, при оцінці коефіцієнта вилуплюваності аналізують тільки першу стадію життєвого циклу T.suis у хазяїні, яка слабо залежить від індивідуальних факторів організму хазяїна. На противагу цьому коефіцієнт зараження на свинях бажано оцінюють через 3-4 тижні після зараження, і він схильний до природньої біологічної варіабельності, яка пояснюється, насамперед, тим, що кожний хазяїн має відмінну від інших індивідуальну сформовану імунну систему. Ще однією перевагою представленого в даному описі аналізу є те, що яйця можна виділяти 10 UA 103769 C2 5 10 15 з фекалій тварин і тому для здійснення тесту не потрібно вбивати тварин. Приклади Приклад 1: На основі послідовності ITS2 Trichuris suis був розроблений метод кількісної ПЛР із використанням Taqman-Системи. Послідовність-Мішень, праймера і Taqman-Зонд проілюстровані нижче. Послідовність-Мішень вибирали таким чином, щоб вона дозволяла відрізняти Trichuris suis від інших видів Trichuris, послідовність яких також відома. Тим самим тест, крім того, що він подає інформацію про кількість копій ITS2, забезпечує також якісний доказ того, що аналізований організм дійсно являє собою Trichuris suis. Для готування зразка яйця (1000 яєць в 500 мкл розчину) гомогенізували в гомогенізаторі Поттера (об'єм 2 мол; ширина зазору 0,01-0,03 мм) протягом 10 хв. Шляхом дослідження під мікроскопом неочікувано було встановлено, що за допомогою цього методу виявляється можливим повністю руйнувати оболонки яєць, у той час як використання інших методів, що звичайно застосовуються при виділенні генів, для руйнування яєць Trichuris suis виявлялося безуспішним. Після додавання 1,54 мкг ДНК сперми риби гомогенат яєць піддавали взаємодії з набором, що виходить у продаж, для виділення генів (набір Dneasy для виділення із крові та тканини; фірма Qiagen) згідно з інструкціями виробника. З використанням ізоляту ДНК (загальний обсяг 50 мкл) проводили ПЛР згідно з протоколом, представленим нижче в таблиці. 20 Таблиця 3: Протокол ПЛР для фрагменту-мішені з області ITS2 T.suis Прилад: ферменти: праймер, Taqman-зонд: кінцева концентрація праймера: кінцева концентрація Taqman-зонда: об'єм зразка: загальний об'єм реакційної суміші для ПЛР: програма зміни температури: 25 AB7900HT (фірма Applied Biosystems) майстер-суміш для генної експресії TaqMan (фірма Applied Biosystems) див. фіг. 1 900нМ 200нМ 5 мкл 25 мкл 50 °C/2 хв 95 °C/10 хв 40 циклів [95 °C/9 с; 60 °C/1 хв] Ефективність ампліфікації, яка забезпечується даним методом аналізу, становить від 92 до 98 %, а чутливість досить велика для того, щоб можна було визначити кількість копій ITS 2-гена в одному яйці. За допомогою методу ПЛР аналізували кількість ITS 2-копій у неембріонованих і повністю ембріонованих яйцях Trichuris suis. Результати представлені в наведеній нижче таблиці. Таблиця 4: Результати аналізу методом кількісної ПЛР ITS 2-області для неембріонованих і повністю ембріонованих яєць Trichuris suis. Зразок (в кожному випадку 1000 яєць) неембріоновані TSO (L0) ембріоновані TSO (L1) 30 35 Величина Ct 25,5 15,5 Відносна кількість ITS2-копій 1 1024 (величина Ct (граничний цикл): кількість циклів ПЛР, необхідних для одержання флуоресцентного сигналу, що значно відрізняється від фонового рівня флуоресценції) ПЛР-аналіз показав, що кількість копій ITS2 в ембріонованих TSO приблизно в 1000 вище, ніж кількість копій ITS2 у неембріонованих TSO. Оскільки неембріоноване яйце (стадія L0) можна розглядати як індивідуальну клітину, те це означає, що личинка T.suis, що перебуває на стадії L1, містить приблизно 1000 соматичних клітин. Дотепер для T.suis кількість соматичних клітин у личинці, що перебуває на стадії L1, відома не була. Для спорідненого організму C.elegans було встановлено, що кількість соматичних клітин становить 959. Це добре узгоджується з встановленою при створенні даного винаходу кількістю клітин, яка становить 11 UA 103769 C2 приблизно 1000. Для перевірки того, чи можна за допомогою розглянутого способу тестування аналізувати інші стадії розвитку личинки, проводили ембріонування TSO протягом 4 тижнів і при цьому регулярно здійснювали ПЛР-аналіз ITS2 (таблиця 5). 5 Таблиця 5: Відносна кількість копій ITS2 залежно від тривалості ембріонування Тривалість ембріонування 0 днів (стадія L0) 7 днів 14 днів 21 день 28 днів 90 днів (стадія L1) 10 15 20 25 30 35 Ct (T) – Ct (0) 0 2,52 6,04 7,37 7,76 10,0 Відносна кількість копій ITS2 1 6 66 165 216 1024 Даний приклад переконливо демонструє, що спосіб можна застосовувати для характеризації різних стадій розвитку личинки від L0 до L1 на основі кількості соматичних клітин. Отже, даний спосіб придатний насамперед для здійснення аналізу процесу ембріонування в режимі супроводу. При виробництві препаратів яєць гельмінтів, очевидно, найбільш бажаним є процес, при якому протягом перших 28 днів ембріонування відносна кількість копій досягає 50-1200. Приклад 2: Для виявлення аденозинтрифосфату можна застосовувати набори, що надходять до продажу, які крім того містять необхідні для здійснення реакції люциферази, а також застосовуваний у якості субстрату люциферин і солі магнію. Необхідно здійснювати стимуляцію утворення аденозинтрифосфату шляхом попередньої інкубації ембріонованих яєць. Вміст аденозинтрифосфату в життєздатних ембріонованих яйцях, що перебувають у стані спокою, не дозволяє досить надійно відрізняти їх від мертвих яєць (фіг. 3). Встановлено, що спосіб дозволяє здійснювати це в тому випадку, коли яйця інкубують протягом періоду часу, що становить 19 год., при 37 °C. Істотна перевага розробленого способу аналізу полягає в тому, що для такої інкубації не потрібне готування зразка. Можна безпосередньо використовувати призначені для аналізу суспензії яєць незалежно від якісного і кількісного складу середовища. Можна застосовувати навіть сильно кислі середовища, що мають значення pН
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for characterising the biological activity of helminth eggs, in particular trichuris eggs
Автори англійськоюTewes, Bernhard, Wilhelm, Rudolf
Автори російськоюВильгельм Рудольф
МПК / Мітки
МПК: C12Q 1/68, C12Q 1/66, A01K 67/033
Мітки: ембріонованих, trichuris, біологічно, яєць, активності, достовірної, спосіб, оцінки
Код посилання
<a href="https://ua.patents.su/27-103769-sposib-dostovirno-ocinki-biologichno-aktivnosti-embrionovanikh-yaehc-trichuris.html" target="_blank" rel="follow" title="База патентів України">Спосіб достовірної оцінки біологічної активності ембріонованих яєць trichuris</a>
Попередній патент: Пестицидна композиція, композиція бакової суміші та спосіб обробки рослин (варіанти)
Наступний патент: Спосіб збільшення поверхонь теплообміну та активних поверхонь металевих елементів, зокрема із поверхнями теплообміну
Випадковий патент: Пристрій для запису та зчитування інформації з магнітного носія