Композиція для контролю розвитку рослин
Формула / Реферат
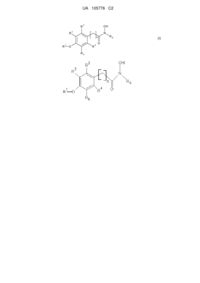
1. Спосіб стимуляції проростання насіння рослин і/або виведення зі стану спокою тканин рослин або органів рослин, що полягає в обробці насіння, рослини, органів рослин або тканин рослин сполукою формули І:
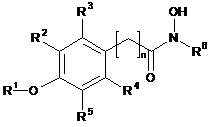 ,
,
де
R1 означає алкіл або Н,
R2, R3, R4 і R5 незалежно вибирають з групи, що включає Н, галоген, -NO2, -SO2R', -ОН, - О-алкіл, де R' означає алкіл або аміноалкіл, і/або R1 і R5 разом утворюють -О(СН2)m-, де m дорівнює 1, 2, 3 або 4,
R6 означає алкіл, необов'язково заміщений одним або більше атомів галогену, групами -ОН, -NO2 або -SO2R', і/або арил, необов'язково заміщений одним або більше атомів галогену, групами -ОН, -NO2 або -SO2R',
і n означає ціле число від 1 до 4.
2. Спосіб за п. 1, де R2, R3, R4 і R5 означають Н.
3. Спосіб за п. 1 або 2, де R1 означає С1-С4алкіл.
4. Спосіб за будь-яким із попередніх пунктів, де алкіл у складі R6 означає С1-С12алкіл.
5. Спосіб за будь-яким із попередніх пунктів, де R6 означає заміщений або незаміщений арил формули -(СН2)pарил, де р означає ціле число від 0 до 4.
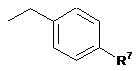
6. Спосіб за п. 5, де R6 означає групу формули II:
 ,
,
де R7 означає Н, -ОН, -NO2, -SO2R' або атом галогену.
7. Спосіб за п. 1, де R1 означає Me, a R2, R3, R4 і R5 означають Н, n дорівнює 1 і R6 означає групу формули II:
 ,
,
де R7 означає Н, -ОН, -NO2, -SO2R' або атом галогену.
8. Спосіб за будь-яким із попередніх пунктів, що полягає в обробці зазначеною сполукою однієї або більше насінин до посіву.
9. Спосіб за будь-яким із попередніх пунктів, де насіння висівають у живильне середовище, й зазначена сполука контактує з насінням у живильному середовищі.
10. Спосіб за будь-яким із попередніх пунктів, де насінням є насіння бур'янів, і зазначене насіння контактує зі зазначеною сполукою, при цьому спостерігається стимуляція проростання насіння бур'янів, і утворюються пророслі бур'яни, до обробки пророслого насіння бур'янів гербіцидами, або обробляють ґрунт із уже пророслим насінням бур'янів.
11. Спосіб за будь-яким із пп. 1-7, де зазначена сполука взаємодіє з бульбами, зернами або цибулинами, при цьому спостерігається стимуляція росту бульб, зерен або цибулин.
12. Спосіб за будь-яким із пп. 1-7, що полягає в обробці зазначеною сполукою тканин рослин, органів рослин або рослин для виведення однієї або більше тканин рослин зі стану спокою.
13. Композиція для обробки рослин, що містить сполуку формули І:
 ,
,
де
R1 означає алкіл або Н,
R2, R3, R4 і R5 незалежно вибирають з групи, що включає Н, галоген, -NO2, -SO2R', -ОН, - О-алкіл, де R' означає алкіл або аміноалкіл, і/або R1 і R5 разом утворюють -O(СН2)m-, де m дорівнює 1, 2, 3 або 4,
R6 означає алкіл, необов'язково заміщений одним або більше атомів галогену, групами -ОН, -NO2 або -SO2R', і/або арил, необов'язково заміщений одним або більше атомів галогену, групами -ОН, -NO2 або -SO2R', і/або арил формули -(СН2)p арил, необов'язково заміщений одним або більше атомів галогену, групами -ОН, -NO2 або -SO2R', де р означає ціле число від 0 до 4, та де R' означає алкіл або аміноалкіл;
і n означає ціле число від 1 до 4;
та сільськогосподарсько прийнятний допоміжний агент.
14. Композиція, призначена для нанесення покриття на насіння, що містить композицію за п. 13 і один або більше інкапсулюючих агентів або плівкоутворювальних агентів.
15. Тканина рослини й/або рослина, оброблена композицією за п. 13 або 14.
16. Насіння, бульби, зерно або цибулини, покриті композицією за п. 13 або 14.
17. Індивідуальна сполука формули І
 ,
,
де
R1 означає алкіл або Н,
R2, R3, R4 і R5 незалежно вибирають з групи, що включає Н, галоген -NO2, -SO2R', -ОН, - О-алкіл, де R' означає алкіл або аміноалкіл, і/або R1 і R5 разом утворюють -O(СН2)m-, де m дорівнює 1, 2, 3 або 4,
R6 означає -(СН2)p арил, заміщений одним або більше атомів галогену, групами -ОН, -NO2 або -SO2R', де р означає ціле число від 0 до 4, і де R' означає алкіл або аміноалкіл;
і n означає ціле число від 1 до 4.
18. Сполука за п. 17, де R6 означає групу формули II:
 ,
,
де R7 означає Н, -ОН, -NO2, -SO2R' або атом галогену.
19. Сполука за п. 17, де R1 означає Me, a R2, R3, R4 і R5 означають Н, n дорівнює 1, і R6 означає групу формули II:
 ,
,
де R7 означає Н, -ОН, -NO2, -SO2R' або атом галогену.
Текст
Реферат: Спосіб стимуляції проростання насіння рослин і/або виведення зі стану спокою тканин рослин або органів рослин, що полягає в обробці насіння, рослини, органів рослин або тканин рослин сполукою формули І, де R1 означає алкіл або Н; R2, R3, R4 і R5 незалежно вибирають з групи, що включає Н, галоген, -NO2, -SO2R', -ОН, - О-алкіл, де R' означає алкіл або аміноалкіл; і/або R 1 і R5 разом утворюють -O(СН2)m-, де m дорівнює 1, 2, 3 або 4; R6 означає алкіл, необов'язково заміщений одним або більше атомами галогену, групами -ОН, -NO2 або -SO2R', і/або арил, необов'язково заміщений одним або більше атомами галогену, групами -ОН, -NO2 або -SO2R'; n дорівнює від 1 до 4. UA 105776 C2 (12) UA 105776 C2 R R 3 OH 2 N n R 1 O R R5 4 O R6 (І) UA 105776 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до нових сполук, нових композицій, а також способів їх застосування для стимуляції проростання насіння і виведення зі спокою насіння рослин, тканин рослин і рослин. Каротиноїди, фотозахисні молекули, синтезуються рослинами й мікроорганізмами і є важливими компонентами корму тварин, прикладом яких, насамперед, є β-каротин (провітамін А). Окисне розщеплення відбувається у рослинах, організмі тварин і мікроорганізмах, у результаті відбувається вивільнення ряду каротиноїдів, що виконують функцію сигнальних молекул, а також й інші функції (1). Першим геном, що кодує фермент, який розщеплює каротиноїди, каротиндіоксигеназу (CCD)1, є ген кукурудзи Vp14, який потрібний для синтезу абсцизової кислоти (АБК), важливого гормону, який опосередковує відповідь на посуху й деякі стадії розвитку рослин, такі як стани спокою насіння і бруньок (2). Ферментом VP14, що розщеплює епоксикаротиноїди, 9′- цис-неоксантин і/або цис-віолаксантин, у положенні 11, 12 (фіг.1), є цис-епоксикаротиндіоксигеназа (NCED) (3), що відноситься до підкласу численного сімейства CCD. Після відкриття гена Vp14, також була встановлена участь й інших CCD у синтезі ряду апокаротиноїдів (фіг. 1). У комах, зоровий пігмент ретиналь утворюється у результаті окисного розщеплення β-каротину під дією β-каротин-15, 15′-діоксигенази (4). У хребетних, ретиналь утворюється під дією ортологічних ферментів і згодом перетворюється у ретиноєву кислоту, регулятор диференціації у процесі ембріогенезу (5). Припускають, що різні CCD ссавців розщеплюють каротиноїди асиметрично у положенні 9, 10 (6) і хоча даний механізм розщеплення до кінця не з'ясований, останні опубліковані дані свідчать про їхню участь у метаболізмі з харчових продуктів лікопену (7). Летучі речовини рослин, β-йонон і геранілацетон, утворюються при розщепленні молекули каротиноїду ферментами у положенні 9, 10 (8) і при розщепленні у положенні 7, 8 утворюється пігмент α-кроцин, виявлений у спеції шафрану (9). Ідентифіковані й інші CCD, біологічна активність яких на сьогоднішній день ще недостатньо досліджена, наприклад, у ціанобактеріях, для яких відома різна специфічність розщеплення (1012). В інших випадках описані апокаротиноїди з відомими функціями, але їхня ідентичність й участь ферментів CCD ще не описані: кетон із тканин коників виконує захисну функцію кобилки безкрилої (Romalea microptera) (13), мікорадицин продукується у коріннях рослин під час симбіозу з деревоподібною мікоризою (14), а стриголактони (15) є метаболітами рослин і виконують сигнальну функцію для початку проростання рослин-паразитів, таких як Striga (стрига) і Orobanche (заразиха) (16). Недавно було встановлено, що стриголактони також є рослинними гормонами, що роблять вплив на розгалуження рослин (17,18). Існування зазначеного гормону відомо вже давно, але дотепер він недостатньо вивчений. Однак, відомо, що зазначений гормон утворюється у результаті дії принаймні двох CCD, max3 і max4 (more axillary growth, переважно аксилярний ріст) (19), тому що делеція кожного з цих двох генів в арабідопсису (Arabidopsis thaliana) приводить до формування фенотипу з підвищеною гіллястістю (20,21). За даними аналізу E. coli встановлено, що AtCCD7 (max3) розщеплює β-каротин у положенні 9,10 і отриманий у результаті продукт апокаротиноїд (10-апо-β-каротин) надалі розщеплюється у положенні 13,14 діоксигеназою AtCCD8 (max4) з утворенням 13-апо-β-каротину (22). Крім того, останні дані свідчать про те, що AtCCD8 є високоспецифічним ферментом і розщеплює тільки 10-апо-βкаротин (23). Однак невідомий механізм утворення 13-апо-β-каротину, що приводить до синтезу комплексів стриголактонів. Не виключено, що ферменти можуть мати різну специфічність і активність розщеплення у польових умовах. Установлено також, що фермент цитохром P450 (24) бере участь у синтезі стриголактону й проявляє активність у шляху, розташованому за генами CCD. Припускають, що стриголактон впливає на розгалуження рослин за рахунок регуляції транспорту ауксину (25). Тому що CCD бере участь у синтезі стриголактону, існує ймовірність того, що активність CCD впливає на структуру рослини й на взаємодію з рослинамипаразитами й мікоризою. Незважаючи на значні успіхи, досягнуті у дослідженні природної функції й субстратної специфічності CCD з використанням генної інженерії, насамперед із різних видів рослин із простими генетичними системами або з генетичною системою, підданою трансгенезу, існує безліч систем, у відношенні яких застосування генетичних підходів утруднене або неможливе. Крім того, при дослідженні рекомбінантних CCD в умовах in vitro або у гетерологічних методах аналізу in vivo, таких як рекомбінантні штами E. Coli, були сконструйовані, наприклад, штами, в яких накопичуються каротиноїди (26), у більшості випадків активні відносно широкого кола субстратів (5,21,27), але щирий субстрат in vivo для конкретної CCD залишається невідомим. Отже, існує необхідність у розробці додаткових експериментальних інструментів для дослідження функцій як апокаротину, так і CCD в їх природному клітинному оточенні. 1 UA 105776 C2 5 10 15 20 25 30 35 40 Методами зворотної генетики ідентифіковані низькомолекулярні сполуки, які проявляють активність стосовно відомих білків-мішеней, та їх використовують у біологічних системах для дослідження функції білків в умовах in vivo (28,29). Такий підхід порівнянний зі загальноприйнятими генетичними методами, заснованими на використанні низькомолекулярних сполук, тому що такі низькомолекулярні сполуки можна використовувати простим способом для дослідження безлічі видів, та їхнє використання можна контролювати по концентрації, часу й розподілу у просторі, щоб забезпечити докладне дослідження біологічних властивостей, а, змінюючи специфічність низькомолекулярних сполук, можна досліджувати властивості, як індивідуальних білків, так і класів білків. Необхідно відзначити, що функції таких рослинних гормонів, як гіберелін, брасиностероїд і абсцизова кислота, успішно досліджені з використанням такого підходу при модифікації адаптування триазолів для інгібування цитохром P450 монооксигеназ, що приймають участь у метаболізмі зазначених гормонів (30). Установлено, що, у випадку сімейства CCD, третинні аміни абамін (31) і більше активний абамін SG (32) є специфічними інгібіторами NCED, причому абамін використовували для дослідження нових функцій абсцизової кислоти в утворенні бульбочок на коріннях бобових (33). У даному винаході пропонується група сполук, які стимулюють проростання й виведення тканин або органів рослин зі стану спокою. У даному винаході пропонується спосіб стимуляції проростання насіння рослин і/або виведення тканин рослин зі стану спокою, що включає обробку насіння, тканин, органів рослин або рослин сполукою формули I. де: R1 означає алкіл або H, R2, R3, R4 і R5 незалежно вибирають з H, галогену, -NO2, -SO2R", -OH, -O-алкіл, де R" означає алкіл або аміноалкіл, і/або R1 і R5 разом утворюють O(CH2)m-групу (тобто групою, приєднаною до арилу, є O(CH2)mO-група, де m дорівнює 1, 2, 3 або 4, переважно 1, приєднану до арильної групи, де, R6 означає гідрофобну групу, таку як, наприклад, заміщений або незаміщений алкіл, і/або заміщений або незаміщений арил, і n дорівнює цілому числу 1, 2, 3 або 4 і n, наприклад, дорівнює 1. Група, що зв'язує арильну групу з карбонільною групою гідроксамової кислоти, тобто група -(CH2)n-, може також містити замісники, наприклад, -OH, галоген або метил. R1 переважно означає C1-C4алкіл, такий як метил, етил, пропіл або бутил. R 1 може означати H. R2, R3, R4 і R5 всі можуть означати H. В іншому варіанті, одна, дві або три зазначені бічні групи можуть означати H, а інші бічні групи означають інші бічні групи. Алкільний залишок у складі -O-алкільної групи, переважно означає C1-C4алкіл, такий як метил, етил, пропіл або бутил. R5 означає O-метил. Інші замісники, R2, R3 і R4 означають H, а R5 означає -O-метил. R6 переважно означає гідрофобну групу. R6 може означати C1-C12алкіл, найбільше переважно C5-C10алкіл. R6 може означати будь-який з алкілів C1, C2, C3, C4, C5, C6, C7, C8, C9, C10, C11 або C12алкіл. R6 може також означати арильну групу або -(CH2)pарил, де p дорівнює цілому числу від 1 до 4, а арил є заміщеним або незаміщеним, і n переважно дорівнює 1. R6 може означати заміщений алкіл або заміщений арил. Зазначені алкільні або арильні групи можуть містити один і більше замісників, наприклад, галоген, -OH, -NO2 або -SO2R". Зазначена сполука переважно включає групу R6 формули II 2 UA 105776 C2 5 10 15 20 25 30 35 40 45 50 де R7 означає -H, -OH, -NO2, -SO2R" або галоген. Використовуваний у даному контексті термін "галоген" включає фтор, хлор, бром або йод, найбільше переважно фтор. Установлено, що довжина лінкера, що з'єднує гідроксамову кислоту з гідрофобною групою, має важливе значення й впливає на активність зазначених сполук. Зазначені способи можуть включати обробку зазначеною сполукою одного або більше насіння до посіву, причому в іншому варіанті насіння можна обробляти in situ після посіву у середовищі, такому як ґрунт, компост або перегній. Зазначену композицію можна використовувати для обробки насіння бур'янів для стимуляції проростання, для того, щоб потім їх знищити при обробці гербіцидами й очистити ґрунт від бур'янів перед посівом сільськогосподарських культур. Бур'яни також можна знищити при підготовці до посіву. Інший рослинний матеріал, такий як бульби, зерно або цибулини, також можна обробити для стимуляції росту до або після посадки. Зазначений спосіб може включати обробку тканин і органів рослин, або рослин для стимуляції плодоносіння або цвітіння. Застосування зазначених сполук характеризується рядом переваг: (1) Ріст рослин починається раніше, тому що тканини або органи рослин виведені зі стану спокою раніше звичайного, і при цьому не виявляється впливу на синтез каротиноїдів, як спостерігається у випадку використання деяких відомих сполук. (2) Можна стимулювати або рівномірно контролювати розвиток бруньок декоративних квітів і квітів плодових дерев. (3) Можна стимулювати проростання й ріст насіння, бульб, зерна, цибулин і інших посадкових матеріалів. Такий підхід можна використовувати для виведення насіння з періоду первинного спокою й скорочення тривалості періоду вторинного спокою, що викликаний несприятливими умовами, такими як підвищена температура або недостатня вологість ґрунту. (4) Рівномірність проростання збільшує врожайність і однорідність сільськогосподарської культури. Удосконалювання системи поливу поряд зі збільшенням урожайності підвищує ефективність споживання води за рахунок запобігання втрат води на полив оголеного ґрунту й придушення росту бур'янів. (5) Застосування зазначених сполук може впливати на селекцію рослин. Глибокий спокій є недоліком при необхідності швидкої й однорідної приживлюваності й розвитку культури. Однак, тривалий період спокою є позитивною ознакою для зберігання заготовленого врожаю, тому що проростання врожаю спричиняє мобілізацію резервів і метаболічні зміни, що приводить до погіршення якості й цінності продукції. Селекційні роботи часто спрямовані на скорочення природного періоду спокою (для прискорення зміни циклів між поколіннями), і згодом хімічні препарати використовують для запобігання переривання періоду спокою врожаю при зберіганні. Наприклад, тривале зберігання бульб картоплі й цибулі вимагає більше низької температури зберігання й/або використання інгібіторів мітотичного росту з метою запобігання проростання. Насіння зернових у певних умовах навколишнього середовища починають проростати у колоссях до збору врожаю (проростання до збору врожаю), що приводить до зниження якості сільськогосподарської культури. Зазначені сполуки можна застосовувати для профілактики таких ситуацій, а тривалий період спокою забезпечує зберігання у задовільних умовах без використання хімічних препаратів, причому зазначеними сполуками необхідно обробити й рослинні тканини у стані спокою (насіння, бульбоцибулини, цибулини, бруньки) для того, щоб підвищити врожайність і ріст рослин. Зазначений спосіб описаний на прикладі насіння томатів SP12 (модифіковане насіння з підвищеним вмістом АБК, див. нижче), що характеризуються тривалим періодом спокою, який скорочували з використанням вищевказаних сполук. Хімічна обробка культури на стадії розвитку, а не зберігання, дозволить знизити вплив агрохімікатів на споживача. Рослини генетично модифікують (і одержують стандартним методом селекції) з метою 3 UA 105776 C2 5 10 15 20 25 30 35 40 45 50 55 60 збільшення вмісту АБК, що приводить до підвищення ефективності споживання води й/або підвищення стійкості до посухи (Thompson A.J. та ін., Over-production of abscisic acid increases water-use efficiency and root hydraulic conductance and influences leaf expansion, Plant Physiology, т. 143, сс 1905-1917,7, (2007)). Однак такі рослини можуть характеризуватися тривалим періодом спокою. Використання зазначених сполук дозволить оптимізувати тривалість періоду спокою у рослин, що підвищить їх цінність. При селекції сільськогосподарських культур із тривалим періодом спокою зазначені сполуки можуть прискорити селекційний процес за рахунок їхньої здатності переривати період спокою й у такий спосіб скорочувати час генерації (наприклад, час від посіву до посіву) у процесі селекції. У даному винаході також пропонуються композиції для рослин, що включають сполуки формули I, а також індивідуальні сполуки формули I, де зазначена сполука означає сполуку, представлену вище. Зазначені композиції й склади за даним винаходом додатково включають одну або більше допоміжних речовин. Допоміжні речовини для використання у гербіцидних композиціях відомі у даній галузі техніки. Зазначені допоміжні речовини включають допоміжні речовини та їх суміші на масляній основі, кремнійорганічні допоміжні речовини та їх суміші, неіоногенні допоміжні речовини та їх суміші, допоміжні речовини на полімерній основі та їх суміші, допоміжні речовини на основі жирних кислот та їх суміші, а також їх комбінації. Мінеральне масло також можна використовувати як допоміжні речовини. Зазначені допоміжні речовини додають у кількості 1 мас. % - 95 мас. % у розрахунку на масу активного інгредієнта. Гербіцидна композиція може включати або додатково включати твердий матеріал, такий як глина, кремнезем або інший інертний твердий носій, загальновідомий у даній галузі техніки. Гербіцидну композицію можна використовувати у твердій або рідкій формі. Рідка форма може включати, наприклад, гас, ксилен або спирт, такий як етанол, а також їх суміші. Для посилення змочуваності насіння або рослин зазначені суміші можна використовувати у суміші з ПАР. Зазначена композиція може включати один або більше інкапсулюючих агентів або плівкоутворювальних агентів. Такі агенти є відомими у даній галузі техніки та їх можна змішувати зі зазначеною сполукою формули I або їх можна використовувати після обробки насіння. Насіння можна обробляти зазначеною сполукою при замочуванні у барабанному змішувачі при нанесенні на насіння покриття відомими методами. Інкапсулюючі й плівкоутворювальні агенти включають гіпс, діатомітову землю й бертонітовий глинопорошок у суміші зі сполучними агентами. Як такі агенти відомі полімери й гелі, такі як альгінати й співполімери полівінілпіролідону й вінілацетату або нуклеїнової кислоти й алкілвінілового ефіру. Можна також проводити дражування насіння у матрицю наповнювача й сполучного компонента. Відомі дражуючі матеріали включають суглинок, крохмаль і співполімери поліакрилату й поліакриламілу. Можна також додавати фунгіциди, пестициди й/або наповнювачі. У даному винаході також пропонуються насіння, тканини рослин, органи рослин і рослини, оброблені композицією за даним винаходом. Зазначена рослина може являти собою однодольну або дводольну рослину й переважно вибрана з групи, що включає томати, картоплю, цибулю, пшеницю, ячмінь, овес, сорго, кукурудзу, рис, качанну капусту сімейства Brassicaceae, насіння овочів і салатів, що включають пастернак, латук, шпинат, цикорій і цибулю-порей, а також будь-які види дерев і чагарників. Гербіцидний склад можна наносити безпосередньо на рослину або додавати у ґрунт. Установлено, що композиції проявляють ефективність при концентрації, наприклад, 1 мМ. Переважно не слід використовувати композиції при концентрації більше 2 мМ, тому що при цьому може знизитися ефективність композиції. Іншим об'єктом даного винаходу є індивідуальна сполука формули I, як представлено вище. Даний винахід описаний у вигляді прикладів із посиланням на наступні фігури. Підписи на фігурах Фігура 1 Реакції, які каталізовані каротиндіоксигеназою: а, 11,12 -окисне розщеплення 9'- циснеоксантину ферментом NCED, б, реакції окисного розщеплення β-каротину й зеаксантину. Фігура 2 Схема синтезу гідроксамових кислот й інгібіторів. Фігура 3 Структура інгібіторів. Протонований абамін (a), проміжний карбокатіон каротиноїдів (б) та 4 UA 105776 C2 5 10 15 20 25 30 35 40 45 50 55 60 інгібітор гідроксамової кислоти (в) приєднані до атома заліза (II) у складі коферменту CCD. Фігура 4 Відносне інгібування чотирьох CCD в E. coli. Гени CCD експресували у штами E. coli., які продукують β-каротин. Зазначені штами культивували у присутності або відсутності інгібіторів (концентрація 100 мМ) протягом 16 год. Зазначена концентрація інгібітора перебуває у лінійному діапазоні відповідної реакції E. coli. Відносне інгібування CCD кожного типу визначали по збільшенню накопичення β-каротину у присутності інгібітора, значення 0 означає рівень βкаротину під час відсутності інгібітора, а значення 100 означає максимальний рівень β-каротину, як у випадку штамів, які не продукують CCD (див. Експериментальні методи, рівняння). Відрізки на діаграмі відповідають стандартній середній помилці, n=4. Суцільна чорна лінія у верхній частині діаграми означає найменше значиме розходження (P ○ 95 %) при температурі 25 C у темряві. Щодня перевіряли проростання насіння, що визначали візуально з появою первинного корінця. Для кожної хімічної обробки використовували ідентичні чашки. Гідроксамову кислоту розчиняли у ДМСО, а водні розчини одержували при кінцевій концентрації ДМСО 1 % об./об. Контрольні розчини являли собою 1 % об./об. розчин ДМСО у воді. Готували також вихідний розчин норфлуразону в етанолі при концентрації 20 мг/мл і потім розбавляли водою до кінцевої концентрації 5 мг/л, вміст етанолу у розчині становив 0,025 % об./об. Додаткові методи Конструювання штаму 7 UA 105776 C2 5 10 15 20 25 30 35 40 45 50 55 60 Плазміди одержували, використовуючи набір (mini spin) для виділення плазмід фірми Qiaprep. Продукти ПЛР і фрагменти вектора очищали на колонках QiaQuick (фірма Qiagen) за інструкціями фірми-виробника. ПЛР проводили, використовуючи ПЛР-систему HiFi Expand (фірма Roche) і ДНК полімеразу за інструкціями фірми-виробника. Лігування проводили за ○ участю ферменту ДНК лігази фага T4 (фірма Invitrogen) протягом 1 год. при температурі 25 C. Плазмідні конструкти трансформували у клітини E. coli штаму DH10B (фірма Stratagene) і секвенували для того, щоб виключити помилки методу ПЛР. Ген LeCCD1a (AY576001) ампліфікували з cLET29I6 (наданий Інститутом Геномних Досліджень (TIGR), класифікація гена томату TIGR) з використанням праймерів LeCCD1a-FC1:TACGAATTCCATATGGGGAGAAAAGAAGATG і LeCCD1a-RC1:TAGTCTCGAGTCACAGTTTGGCTTGTTC. Отриманий продукт розщеплювали рестриктазами NdeI і Xho1 і лігували з вектором pET30c (фірма Novagen, VWR International, Ltd), розщепленим аналогічним методом. Крім того, отриманий продукт розщеплювали рестриктазами EcoR1 і Xho1 і лігували з вектором pGEX-4T (фірма GE Healthcare), розщепленим аналогічним методом. Ген AtCCD7 ампліфікували з ПЛР2.1-AtCCD7, люб'язно наданої Ottoline Leyser (Університет м. Йорка), з використанням праймерів AtCCD7-FC3 TATGCTCGAGGAGATCTGGATTAATGGCCGCAATATCAATATC і AtCCD7-RC1 TAGTCTCGAGTCAGTCGCTAGCCCATAAAC. Отриманий продукт ПЛР розщеплювали рестриктазами BglII і Xho1 і трансформували у BamHI/ Sal-фрагмент pGEX-4T. The ММBCO1 (AF294899) ампліфікували з клону IMGCLO2192191, наданого Geneservice Ltd. (Кембридж, Великобританія) з використанням праймерів ММBCO1-FC1 TACTGAATTCCATATGGAGATAATATTTGGC і ММBCO1-RC1 TACTCTCGAGTGAGTGTTAGGATTAAAG. Отриманий продукт ПЛР розщеплювали рестриктазами NdeI/XhoI і клонували у розщеплений аналогічним способом вектор pET30c. Ген ММBCO2 (AJ290392) ампліфікували з клону IMGCLO2536812 (фірма Geneservice Ltd.) з використанням праймерів ММBCO2-FC1 TATCGGATCCCATATGTTGGGACCGAAGCAGAG і ММBCO2-RC1 TATCCTCGAG TCAGATAGGCACAAAGGT. Отриманий продукт розщеплювали рестриктазами NdeI/XhoI і клонували у розщеплений аналогічним способом вектор pET30c. кДНК LeNCED1 (Z97215) була надана Ian Taylor (Університет Ноттингема) і клонована у ділянки NdeI і Bpu1102 вектора pET14b (фірма Novagen, VWR International, Ltd) для одержання гібридного білка, що містить N-кінцевий His6. Отриману плазміду експресували у клітини E. coli Rosetta (DE3) (фірма Novagen, VWR International, Ltd). Докладна інформація про штами, використані для оцінки інгібуючої активності в E.coli також представлена у Додаткових матеріалах у таблиці S1, нижче. Одержання безклітинних екстрактів Для одержання безклітинних екстрактів LeCCD1a і LeNCED1, культури вирощували до ○ оптичної щільності 0,6 при 37 C, потім додавали 0,2 мМ ізопропіл-β-D-1-тіогалактопіранозид ○ (ІПТГ) і культуральне середовище вирощували протягом ночі при 20 C. Клітини (200 мл культурального середовища) збирали центрифугуванням (5000 об/хв, 10 хв) і отриманий осад ресуспендували у 4 мл ФСБ, 0,1 % Тритон X 100. В отриманий розчин додавали лізоцим до кінцевої концентрації 25 мкг/мл, і розчин інкубували при кімнатній температурі протягом 15 хв на крижаній лазні, а потім обробляли ультразвуком (3×30 сек при 18 Ω). Потім отриманий лізат ○ центрифугували (13000 об/хв, 15 хв, температура 4 C) і супернатант використовували для проведення аналізу. Розрахунок величини лаг-фази для оцінки ефективності росту пагонів -B(t-m) Логістичну криву, y=A + C/(1+e ), будували за даними для кожного пагона з використанням програмного забезпечення GenStat (10-а версія). Потім розраховували лаг-фазу за формулою m-(2/B) і визначали значення t (час) за відрізком, який відтинається екстрапольованими лініями лінійної ділянки кривої і початкового плато. Одержання 9′- цис-неоксантину Свіжий шпинат (20 г) промивали й подрібнювали за допомогою товкачика й ступки з додаванням бутилгідрокситолуолу (0,03 г) і бікарбонату натрію (0,3 г) у крижаному метанолі (30 мл) протягом 3 хв у темряві, потім отриману суміш фільтрували у вакуумі. Процедуру повторювали 6 разів до одержання практично безбарвного фільтрату. Екстракти поєднували й розподіляли між крижаним діетиловим ефіром і насиченим розчином хлориду натрію. Отриманий ефірний екстракт відокремлювали, водну фракцію повторно екстрагували 2 рази крижаним діетиловим ефіром. Отримані ефірні екстракти поєднували, розчинник упарювали на ○ роторному випарнику при температурі не вище 32 C. Отриманий залишок гідролізували у присутності 6 % гідроксиду калію у 9 мл метанолу й 1 мл діетилового ефіру у темряві при ○ температурі 4 C протягом 16 год. Потім в отриману суміш додавали насичений водний розчин 8 UA 105776 C2 5 10 15 20 25 30 35 40 45 50 хлориду натрію (об'єм 50 мл), отриману суміш тричі екстрагували діетиловим ефіром (100 мл ×3), сушили над сульфатом натрію, і розчинник упарювали, як зазначено вище. 9′-Циснеоксантин очищали хроматографією на колонці з дезактивованим оксидом алюмінію (до 10 г оксиду алюмінію додавали 1 мл дистильованої води й 10 мл петролейного ефіру й витримували протягом 5 хв). Отриманий твердий екстракт шпинату розчиняли у суміші діетиловий ефір/ петролейний ефір (1:5), наносили на колонку, яку промивали сумішшю діетиловий ефір/петролейний ефір (1:1, 50 мл), діетиловим ефіром (50 мл), 9′-цис-неоксантин елюювали 5 % розчином етанолу у діетиловому ефірі (50 мл). Виділену фракцію 9′-цис-неоксантину сушили в атмосфері азоту й зберігали у флаконах, обгорнених у фольгу, в атмосфері азоту при ○ температурі -20 C. Дані ТШХ: Rf 0,09 (силікагель, Et2O), lмакс. 415, 439, 467 нм, МС: m/z (FAB+) знайд. для C40H56O4 600,33, розрах. 600,87. Результати Конструювання й синтез інгібітора. NCED є діоксигеназою (3), а механізм її дії включає утворення проміжного карбокатіона, з наступним утворенням діоксетанового циклу або перегрупуванням Криге перед розщепленням (41), такий механізм був підтверджений 18 результатами включення мітки O у фермент AtCCD1 (37) і практично аналогічні результати були отримані комп'ютерним моделюванням кристалічної структури ACO (42). Було встановлено, що третинний амін, абамін (див. фіг. 3a, структура сполуки) є оборотним інгібітором (Ki=39 мкМ) рекомбінантної NCED, який інгібує продукування абсцизової кислоти, що відбувається у рослинах у концентраціях 50-100 мкМ (31). Було встановлено, що абамін SG, який містить у своїй структурі додатковий лінкер із трьох атомів вуглецю між метиловим ефіром і атомом азоту, проявляв підвищену активність (Ki=18,5 мкМ) (32). Точний механізм дії абаміну невстановлений, однак, можна припустити, що протонований амін є міметиком проміжного продукту карбокатіону у каталітичному процесі, у ході якого утворюється оксигенований ароматичний цикл, приєднаний замість гідроксициклогексильного кінцевого фрагмента каротиноїдного субстрату (41), як показано на фіг. 3. Інгібування може відбуватися у результаті хелатування необхідного кофактора іона металу метиловим ефіром абаміну. Однак, похідна абаміну, що містить замість метилового ефіру кислотну групу (COOH), не проявляла активність (32), з теоретичної точки зору ця сполука повинна проявляти більшу активність при зв'язуванні такого кофактора, як залізо. Відомо, що гідроксамові кислоти за механізмом дії являють собою інгібітори металоферментів різних сімейств металопротеїназ, наприклад, матриксних металопротеїназ, і хелатують необхідний кофактор іона металу (43). Були синтезовані аналоги гідроксамової кислоти, в яких гідроксициклогексильна кінцева група каротиноїдного субстрату замінена на міметик, що являє собою зазначений вище оксигенований ароматичний цикл, а функціональна група гідроксамової кислоти розташована на різній відстані від ароматичного циклу. Таким чином, були синтезовані серії аналогів арил-C3N (D8-D13), аналогів арил-C2N (D1-D7) і аналогів арил-C1N (F1-F4), (табл.1). Було встановлено, що 4-фторбензильний замісник підвищує активність серії похідних абаміну (31), такі похідні були включені до складу серії похідних гідроксамових кислот. Спосіб синтезу, представлений на фіг. 2, включає конденсацію відповідної кислоти зі заміщеним O-бензилгідроксиламіном, і наступне видалення захисної групи. З β-йонону також синтезували гідроксамову кислоту, що містить більше довгий C 5 лінкер від циклогексильного залишку (B1). Для визначення інгібуючої активності використовували серію з 18 гідроксамових кислот, нумерація сполук зазначена у таблиці 1. Таблиця 1. Дослідження інгібуючої активності у відношенні рекомбінантних ферментів LeCCD1 і LeNCED1 в умовах in vitro. Ферментативний аналіз проводили з використанням клітинних екстрактів E. coli, що містять рекомбінантну CCD, при концентрації інгібітора 100 мкМ, ступінь інгібування LeCCD1 зазначеними сполуками склала ≥ 90 %, визначали також значення IC50, NT означає, що активність не визначали. Хімічні структури інгібіторів, а саме похідних гідроксамової кислоти, представлені нижче, замісники X і Y представлені у таблиці. Структура абаміну представлена на фіг.3. 9 UA 105776 C2 Інгібітор Клас LeCCD1a (9,10/9′,10′) Назва X Y F1 F2 F3 F4 D1 D2 4-OMe 4-OMe 3,4-(OMe)2 3,4-(OMe)2 4-OH 4-OH D3 3,4-(OH)2 H F H F H F F D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 B1 4-OMe 3,4-(OMe)2 3,4-(OMe)2 3,4-OCH2O 3,4-(OMe)2 4-OMe 3,4-(OMe)2 4-OMe 3,4-(OMe)2 4-OMe Абамін Арил-C1N Арил-C2N Арил-C3N Цикл-C5N Інгібування 100 мкМ IC50 (%) (мкм) а 20, 49 210 >95 2,0 >95 2,5 50 0 >95 0,9 >95 0,8 LeNCED1 (11,12) Інгібування 100 мкМ (%) 20 0 0 2 0 27 29 >95 4 >95 >95 >95 >95 61 >95 65 53 26 46 90 F H F F CH2Ph CH2Ph н-октил н-октил H H 0,8 2,5 8,0 9,0 3,0 33 8 18 33 40 27 14 15 11 13 5 10 20 а , у результаті двох незалежних визначень інгібуючої активності при концентрації 100 мкМ отримані значення 20 і 49 %. 5 10 15 20 25 Специфічність інгібування in vitro генів LeNCED1 і LeCCD1a томатів Для дослідження інгібуючої активності ферментів, що розщеплюють каротиноїди у положенні 9,10, використовували рекомбінантний фермент томатів LeCCD1a (44), тому що зазначений тип ферментів можна досліджувати колориметричним методом аналізу in vitro з використанням як субстрат β-aпo-8′-каротиналя (37). Для дослідження специфічності інгібіторів використовували рекомбінатний фермент томатів LeNCED1, що розщеплює цис-каротиноїди у положенні 11,12 (45). Для зазначеного ферменту, реакцію розщеплення реєстрували методом звернено-фазової РХВД на колонці C18, як субстрат використовували 9′-цис-неоксантин. Як зазначено у роботі (46), було встановлено, що ферменти характеризуються низькою стабільністю (період розпаду < 24 год.) при зберіганні й очищенні, таким чином, ферментативний аналіз проводили з використанням рекомбінантного безклітинного екстракту (в екстракті E. coli, не містить рекомбінантний CCD ген, відсутня ферментативна активність у відношенні каротиноїдів). Деякі похідні гідроксамової кислоти (а саме D8, D7, і D4) проявляють інгібуючу активність у відношенні LeNCED1, в 1,5-2 рази перевищуючу інгібуючу активність у порівнянні з інгібуючою активністю інгібітора NCED абаміну (31), що за даними авторів винаходу склала тільки 20 % при концентрації інгібітора 100 мкМ (див. табл. 1). У відношенні LeCCD1, високу інгібуючу активність проявляли всі арил-C2N-гидроксамові кислоти й деякі інші похідні гідроксамових кислот. 4Метоксіарилгідроксамові кислоти проявляють високу інгібуючу активність у кожній серії, однак найбільшу інгібуючу активність проявляли 4-гідроксіарилгідроксамові кислоти D1, D2, і D3, значення IC50 яких склало 0,8-0,9 мкМ. Абамін характеризувався тільки 50 % інгібуючою активністю у відношенні LeCCD1 при концентрації абаміну 100 мкМ. 10 UA 105776 C2 5 10 15 20 25 30 35 40 45 50 55 60 При порівнянні інгібуючої активності у відношенні LeNCED1 і LeCCD1a було встановлено, що всі активні сполуки проявляють специфічність у відношенні LeCCD1, причому найбільшою специфічністю характеризуються сполуки D3, F1, і F2, які проявляють високу ефективність інгібуючої активності у відношенні LeCCD1 і низьку або практично нульову активність у відношенні LeNCED1 (табл. 1). Визначення інгібуючої активності в умовах in vivo відносно штамів E. coli, які експресують CCD Можна конструювати пофарбовані штами E. coli, що продукують різні каротиноїди, які експресують ферменти для синтезу каротиноїдів (26). У результаті спільної експресії відповідної CCD, бактерія знебарвлюється у результаті розщеплення каротиноїдів з утворенням незабарвлених продуктів (4, 6, 27). Даний метод був використаний у даному експерименті для додаткового дослідження специфічності інгібіторів і визначення їхньої активності в умовах in vivo. Вміст каротиноїдів у кожному штамі, який експресує CCD, порівнювали зі вмістом каротиноїдів у контрольному штамі, що продукує β-каротин, але в якому відсутній ген CCD. Розходження у вмісті каротиноїдів характеризує величину активності CCD, та інгібування даної активності вимірювали після додавання інгібіторів у живильне. середовище Інгібуючу активність інгібіторів визначали у відношенні чотирьох штамів E. coli, що продукують β-каротин (Додаткові матеріали, табл. S1). Три зі зазначених штамів експресували CCD різного типу, які розщеплює каротиноїди у положенні 9,10: AtCCD7 з сімейства Arabidopsis (21) і ММBCO2 миші (6), які розщеплюють тільки в одному положенні (9,10 або 9′,10′, але не в обох положеннях), і фермент томатів LeCCD1a (44), що розщеплює за обома сайтами в одній молекулі субстрату (у положенні 9,10/9′,10′). Четвертий штам експресує інший тип CCD миші, ММBCO1 (47), що розщеплює у центральному положенні 15,15′. Авторами даного винаходу, а також групою вчених (48) було встановлено, що експресія різних CCD (й, імовірно, інших білків) приводить до втрати каротиноїдів у результаті неспецифічних взаємодій. Однак детектування продуктів розщеплення у клітинах E. coli і живильним методом середовища РХВД показало, що у всіх чотирьох штамах, які використовували у роботі, розщеплення ферментом CCD пов'язане з втратою каротиноїдів. Активність у відношенні NCED у клітинах E. coli не досліджували, тому що на даний момент не ідентифікований фермент, необхідний для продукування цис-каротину, що є субстратом NCED. Були синтезовані гени CsZCD (9) і BoLCD (49), які експресовані в E. coli, і вони були використані для вивчення ефективності розщеплення у положенні 5,6 і 7,8 як в умовах in vitro, так і у клітинах E. coli. Однак активність розщеплення не визначали, а тому не визначали активність інгібіторів у положеннях 5,6 і 7,8. Зазначені сполуки характеризувалися різним профілем інгібування у відношенні 3 зазначених ферментів, що розщеплюють у положенні 9,10 (фіг. 4). Зазначені сполуки проявляють аналогічну інгібуючу активність у відношенні LeCCD1a in vivo (фіг. 4) у порівнянні з інгібуючою активністю в умовах in vitro (табл. 1): D5 і D6 проявляли відносно слабку активність у порівнянні з іншими сполуками групи D, а сполука F3 практично не проявляє активності. Різна активність спостерігається у відношенні AtCCD7 у системі E. coli (фіг. 4), наприклад, сполуки F1 і F2, які проявляють високу активність у відношенні LeCCD1a, проявляють низьку інгібуючу активність у відношенні AtCCD7, у той час як F1 і F2 проявляють найбільше високу інгібуючу активність у відношенні ММBCO2 (фіг. 4). Було встановлено, що жодна зі зазначених сполук не інгібує розщеплення у положенні 15,15′ ферментом ММBCO1 (фіг. 4). Стимуляція розгалуження пагонів Arabidopsis з використанням інгібітора Ауксин інгібує розростання аксилярних бруньок у рослини сімейства Arabidopsis дикого типу. У нульових мутантах AtCCD7 і AtCCD8 (max3 і max4, відповідно) відповідна реакція на дію ауксину знижується, імовірно, за рахунок блокування синтезу гормону апокаротину (як показано недавно у роботах (17,18) на прикладі стриголактону або відповідної сполуки), що придушує розгалуження (19), і аксилярні бруньки розростаються раніше, що приводить до формування бічних пагонів. Був проведений аналіз in vitro, розроблений раніше, в якому мутанти max оцінювали за ростом аксилярних бруньок з виділених ділянок стебел Arabidopsis (40). За результатами аналізів було встановлено, що розростання бруньок мутанта max4-1 (AtCCD8) відбувалося на 2 доби раніше, ніж у рослини дикого типу (20) і схожий фенотип передбачається й у мутанта max3-9, що відрізняється високою гіллястістю (21). Були досліджені інгібітори на основі гідроксамової кислоти при концентрації 100 мкМ і встановлено, що всі сполуки D1-D6 і F3 значно (P < 0.05) знижують час розростання бруньок у рослин дикого типу, що відбувається у часовому діапазоні від 1 (сполуки D1) до 3 діб (сполуки D3) (фіг. 5). Раннє розростання бруньок також було аналогічно спостережуваному розростанню бруньок в AtCCD7 нульового мутанта max3-9 (фіг. 5), і вказує на інгібування AtCCD7 і/або можливе AtCCD8 у даній тканині рослини. Дія інгібіторів у даному методі аналізу тільки частково відбиває активність інгібіторів при аналізі 11 UA 105776 C2 5 10 15 20 25 30 35 40 45 50 55 60 з використанням E. coli, причому сполуки F1 і F2 характеризуються відносно низькою активністю за результатами аналізу AtCCD7 розростання бруньок (фіг. 5) і аналізу з використанням E. coli (Фіг. 4). Однак, у випадку інгібітора F3 одержали протилежні результати, тому що зазначена сполука виявилася неактивною у відношенні AtCCD7 у клітинах E. coli, але проявляла активність в аналізі на розростання бруньок. Як видно, у цьому випадку стимуляція розгалуження відбувалася за рахунок інгібування сполукою F3 ферменту AtCCD8 (не досліджували в аналізах in vitro або в E. coli), а не AtCCD7. Стимуляція розгалуження стебел цілої рослини сімейства Arabidopsis Був також досліджений вплив інгібіторів на ріст цілої рослини сімейства Arabidopsis, причому рослину вирощували у стерильних умовах в агарі. Мутанти рослин max3-9 (фіг. 6б), а також оброблені сполуками D2, D4, D5 і D6 (на фіг. 6в представлені результати обробки рослин сполукою D6) характеризувалися поліпшеним розгалуженням у порівнянні з неопрацьованими рослинами дикого типу (фіг. 6a). Таке підвищене розгалуження відбувається за рахунок збільшення числа бічних розеткових пагонів із вузлів, причому у присутності ферментів max3-9 рослини характеризуються наявністю від 3 до 4 бічних пагонів у порівнянні з рослинами дикого типу, для яких число бічних пагонів становить у середньому 0,25. Рослини, оброблені інгібіторами, займають проміжне положення (у середньому приблизно 2 пагони) і у такий спосіб характеризуються розгалуженням, аналогічним рослинам max3-9 (фіг. 6г). Такий фітогормон, як абсцизова кислота (AБК), підсилює стан спокою у багатьох структур рослин, включаючи насіння (Finch-Savage W.E. і G. Leubner-Metzger, Seed dormancy and the control of germination, New Phytologist, т. 171(3), сс 501-523 (2006)), бульби (Suttle J.C., Physiological regulation of potato tuber dormancy, American Journal of Potato Research, т. 81(4), сс 253-262 (2004)), цибулини (Chope G.A., L.A. Terry і P.J. White, Effect of controlled atmosphere storage on abscisic acid concentration and other biochemical attributes of onion bulbs, Postharvest Biology і Technology, т. 39(3), сс 233-242 (2006)) і бруньки (Le Bris M. та ін., Regulation of bud dormancy by manipulation of ABA in isolated buds of Rosa hybrida cultured in vitro, Australian Journal of Plant Physiology, т. 26(3), сс 273-281 (1999)). 9-цис-епоксикаротиндіоксигеназа (NCED) є важливим агентом, що лімітує біосинтез АБК (Thompson A.J. та ін., Ectopic expression of a tomato 9-cis-epoxycarotenoid dioxygenase gene causes over-production of abscisic acid, Plant Journal, т. 23(3), сс 363-74.5 (2000)). Результати, представлені у табл. 1, свідчать про те, що безліч похідних гідроксамової кислоти проявляють інгібуючу активність у відношенні NCED в умовах in vitro, причому сполуки D4, D7 і D8 проявляють найбільшу активність у відношенні NCED в умовах in vitro. Були отримані трансгенні насіння томатів SP12, які характеризувалися високим вмістом АБК і тривалим станом спокою (Thompson A.J. та ін., Ectopic expression of a tomato 9-cisepoxycarotenoid dioxygenase gene causes over-production of abscisic acid, Plant Journal, 23(3), сс 363-74 (2000)) і Thompson A.J. та ін., Regulation and manipulation of ABA biosynthesis in roots, Plant Cell and Environment, 30, сс 67-78 (2007)). В експериментах це насіння використовували як систему для вивчення інгібуючої активності сполук D1-D7 (додавання інгібіторів NCED повинно приводити до прискорення проростання) і було встановлено, що сполуки D4 і D7 є самими активними при стимуляції проростання. Сполука D4 прискорювала проростання насіння SP12 (фіг. 8) залежно від доданої кількості (фіг. 9). Сполукою D4 були також оброблені насіння томатів дикого типу (cv. Ailsa Craig) і встановлена залежність проростання насіння від кількості доданого D4 (фіг. 9). При додаванні D4 при концентрації менше 1 мкМ спостерігався нормальний розвиток насіння дикого типу або SP12. Незначна затримка у розвитку рослин спостерігалася при концентрації D4, рівній 2 мкМ. Комерційні гербіциди норфлуразон і флуридон придушують фітоен-десатуразу й, отже, блокують біосинтез АБК (АБК є похідною каротиноїдів) за рахунок блокування синтезу всіх каротиноїдів. Норфлуразон і флуридон не призначені для використання у комерційних потребах для виведення тканин рослин зі стану спокою, тому що у результаті повністю придушується синтез каротиноїдів (отже, їхня дія подібна передсходовим гербіцидам, тобто відбувається прискорення проростання насіння, а потім паростки гинуть внаслідок знебарвлення). Гербіциди на основі норфлуразону піразинону й флуридон піридену заборонені до застосування в Європі (з липня 2003 р.), включені у список заборонених пестицидів, не підлягають реєстрації й не виробляються. Додаткові матеріали Спектроскопічні дані для синтетичних інгібіторів D1. N-бензил-4-гідроксифенілaцетилгідроксамова кислота. Вихід 0,59 г (вихід реакції конденсації 54 %, видалення захисної групи 74 %). δH (400 МГц, CD3OD) 3,77 (2H, s, CH2CO), 4,78 (2H, s, CH2N), 6,77 (2H, d, J=8,0 Гц), 7,13 (2H, d, J=8,0 Гц), 7,25-7,35 (5H, m), δC (100 МГц, 12 UA 105776 C2 5 10 15 20 25 30 35 40 45 50 55 60 CD3OD) 39,2, 53,1, 116,3, 127,5, 128,6, 129,3, 129,5, 131,6, 137,7, 157,2, 174,7, МС (ES): 280,1 + (MNa ), МС-ВР: знайд. для C15H15NO3Na 280,0949, розрах. 280,0944. D2. N-(4-фторбензил)-4-гідроксифенілацетилгідроксамова кислота. Вихід 0,12 г (вихід реакції конденсації 93 %, видалення захисної групи 55 %), δH (400 МГц, CD3OD) 3,72 (2H, s, CH2CO), 4,78 (2H, s, CH2N), 6,73 (2H, d, J=8,0 Гц), 7,06 (2H, t, J=8,0 Гц), 7,11 (2H, d, J=8,0 Гц), 7,30 (2H, m), δC (100 МГц, CD3OD) 39,2, 52,3, 114,9, 116,0, 116,2, 128,5, 129,5, 131,3, 131,5, 142,4 + (сигнал карбонілу не детектується). МС (ES): 298,1 (MNa ), МС-ВР: знайд. 298,0860, розрах. 298,0850 для C15H14NO3Na. D3. N-(4-фторбензил)-3,4-дигідроксифенілацетилгідроксамова кислота. Вихід 0,08 г (вихід реакції конденсації 50 %, видалення захисної групи 78 %), δH (300 МГц, CD3OD) 3,68 (2H, s, CH2CO), 4,74 (2H, s, CH2N), 6,60 (1H, dd, J=2,0,8,0 Гц), 6,72 (1H, d, J=8,0 Гц), 6,78 (1H, d, J=2,0 Гц), 7,03 (2H, t, J=8,0 Гц), 7,28 (2H, m), δC (75 МГц, CD3OD) 39,4, 52,3, 116,0, 116,3, 117,7, 121,9, + 127,9, 131,3, 145,1, 146,2, 162,1, 165,3, 174,1, МС (ES): 314,3 (MNa ). D4. N-(4-фторбензил)-4-метоксифенілацетилгідроксамова кислота. Вихід 0,24 г (вихід реакції конденсації 78 %, видалення захисної групи 83 %), δH (400 МГц, CDCl3) 3,70 (2H, s, CH2CO), 3,73 (3H, s, CH3O) 4,69 (2H, s, CH2N), 6,77 (2H, d, J=8,0 Гц), 6,94 (2H, t, J=8,0 Гц), 7,13 (2H, d, J=8,0 Гц), 7,20 (2H, m). δC (100 МГц, CDCl3) 38,9, 40,4, 52,0, 114,5, 115,7, 115,9, 128,2, + 131,1, 131,3, 159,3, 163,7 (сигнал карбонілу не детектується). МС (ES): 312,2 (MNa ), МС-ВР: знайд. 312,1004, розрах. 312,1006 для C 16H16NO3FNa. D5. N-бензил-3,4-диметоксифенілацетилгідроксамова кислота. Вихід 0,23 г (вихід реакції H конденсації 62 %, видалення захисної групи 66 %), δ (300 МГц, CDCl3) 3,64 (2H, s, CH2CO), 3,70 (3H, s, OCH3), 3,76 (3H, s, OCH3), 4,65 (2H, s, CH2N), 6,63-6,73 (3H, m), 7,15-7,30 (5H, m), δC (75 МГц, CDCl3) 38,0, 51,4, 55,1, 55,2, 110,5, 111,9, 121,0, 126,9, 127,1, 127,8, 128,3, 135,4, 147,1, + 148,1, 172,1. МС (ES): 324,2 (MNa ), МС-ВР: знайд. для C17H19NO4Na 324,1216, розрах. 324,1206. D6. N-(4-фторбензил)-3,4-диметоксифенілацетилгідроксамова кислота. Вихід 0,22 г (вихід реакції конденсації 100 %, видалення захисної групи 69 %). δH (400 МГц, CD3OD) 3,40 (2H, s, CH2CO), 3,80 (3H, s, OCH3), 3,84 (3H, s, OCH3), 4,76 (2H, s, CH2N), 6,81 (1H, d, J=8,0 Гц), 6,89 (1H, d, J=8,0 Гц), 6,91 (1H, s), 7,04 (2H, t, J=8,0 Гц), 7,30 (2H, m). δ C (100 МГц, CD3OD) 39,5, 52,3, 56,4, 56,6, 113,1, 114,4, 116,3, 123,0, 129,4, 131,5, 133,9, 149,4, 162,5, 164,9, 174,3. МС (ES): + 342,2 (MNa ), МС-ВР: знайд. для C17H18NO4FNa 342,1110, розрах. 342,1112. D7. N-(4-фторбензил)-3,4-метиленоксифенілацетилгідроксамова кислота. Вихід 0,26 г (вихід реакції конденсації 51 %, видалення захисної групи 100 %). δH (400 МГц, CD3OD) 3,45 (2H, s, CH2CO), 4,86 (2H, s, CH2N), 6,05 (2H, s, OCH2O), 6,85 (2H, s), 6,91 (1H, s), 7,08 (2H, t, J=8,0 Гц), 7,33 (2H, m). δC (100 МГц, CD3OD) 39,7, 52,5, 102,4, 109,2, 111,0, 116,3, 123,7, 130,3, 131,5, + 133,6, 149,7, 162,7, 165,1, 175,0. МС (ES): 304,1 (MH ), МС-ВР: знайд. для C16H15NO4F 304,0980, розрах. 304,0980. D8. N-бензил-3,4-диметоксифенілпропіонілгідроксамова кислота. Вихід 0,15 г (вихід реакції конденсації 71 %, видалення захисної групи 94 %). δH (400 МГц, CDCl3) 2,60 (4H, m), 3,73 (6H, s, 2 x OCH3), 4,68 (2H, s, CH2N), 6,63-6,73 (3H, m), 7,15-7,30 (5H, m). δC (100 МГц, CDCl3) 30,4, 34,3, 51,9, 55,8, 55,9, 111,3, 111,9, 120,3, 126,9, 128,0, 128,8, 133,9, 136,2, 147,3, 148,8 (сигнал + карбонілу не детектується). МС (ES): 316,2 (MH ), МС-ВР: знайд. для C18H21NO4 316,1547, розрах. 316,1549. D9. N-бензил-4-метоксифенілпропіонілгідроксамова кислота. Вихід 0,13 г (вихід реакції конденсації 82 %, видалення захисної групи 82 %). δH (400 МГц, CDCl3) 2,82 (4H, m), 3,68 (3H, s, OCH3), 4,68 (2H, s, CH2N), 6,67 (2H, d, J=8,0 Гц), 7,01 (2H, d, J=8,0 Гц), 7,15-7,30 (5H, m). δC (100 МГц, CDCl3) 28,0, 32,3, 50,9, 54,2, 112,9, 120,3, 126,6, 127,5, 128,3, 134,3, 136,3, 147,5 (сигнал + карбонілу не детектується), МС (ES): 286,2 (MH ), МС-ВР: знайд. для C17H19NO3 286,1447, розрах. 286,1443. D10. N-октил-3,4-диметоксифенілпропіонілгідроксамова кислота. Вихід 0,10 г (вихід реакції конденсації 57 %, видалення захисної групи 85 %). δH (400 МГц, CDCl3) 0,88 (3H, t, J=7,0 Гц), 1,25-1,35 (12H, m), 2,61 (2H, t, J=7,0 Гц), 2,89 (2H, t, J=7,0 Гц), 3,39 (2H, t, J=7,0 Гц, CH 2N), 3,88 (6H, s, 2 × OCH3), 6,63-6,73 (3H, m), 7,15-7,30 (5H, m). δC (100 МГц, CDCl3) 14,5, 23,0, 26,9, 28,0, 29,6, 31,0, 31,4, 32,2, 32,3, 36,4, 56,2, 56,3, 111,6, 112,1, 120,6, 133,4, 148,0, 149,3 (сигнал + карбонілу не детектується), МС (ES): 338,2 (MH ), МС-ВР: знайд. для C19H31NO4 337,2262, розрах. 337,2253. D11. N-октил-4-метоксифенілпропіонілгідроксамова кислота. Вихід 0,12 г (вихід реакції конденсації 62 %, видалення захисної групи 92 %). δH (400 МГц, CDCl3) 0,78 (3H, t, J=7,0 Гц), 1,20-1,35 (12H, m), 2,60 (2H, t, J=7,0 Гц), 2,85 (2H, t, J=7,0 Гц), 3,53 (2H, t, J=7,0 Гц, CH 2N), 3,72 (3H, s, OCH3), 6,72 (2H, d, J=8,0 Гц), 7,05 (2H, d, J=8,0 Гц). δC (100 МГц, CDCl3) 13,7, 22,6, 26,8, 13 UA 105776 C2 5 10 15 20 25 30 35 40 27,0, 29,1, 29,4, 31,3, 32,3, 32,3, 36,4, 55,1, 113,7, 129,2, 137,2, 156,7, 172,7. МС (ES): 308,2 + (MH ), МС-ВР: знайд. для C18H29NO3 308,2237, розрах. 308,2226. F1. N-бензил-4-метоксибензоїлгідроксамова кислота. Вихід 55 мг (13 %). δH (300 МГц, CDCl3) 3,70 (3H, s, OCH3), 4,75 (2H, s, CH2N), 6,75 (2H, d, J=8,0 Гц), 7,20-7,30 (5H, m), 7,45 (2H, d, J=8,0 Гц), δC (100 МГц, CDCl3) 54,9, 55,4, 113,8, 124,3, 127,5, 128,6, 129,5, 130,1, 135,6, 161,8, 168,4. + МС (ES): 258,2 (MH ), МС-ВР: знайд. для C15H16NO3 258,1128, розрах. 258,1130. F2. N-(4-фторбензил)-4-метоксибензоїлгідроксамова кислота. Вихід 38 мг (вихід реакції конденсації 50 %, видалення захисної групи 60 %). δH (300 МГц, CDCl3) 3,80 (3H, s, OCH3), 4,75 (2H, s, CH2N), 6,80 (2H, d, J=8,0 Гц), 6,95 (2H, t, J=9,0 Гц), 7,15 (2H, m), 7,40 (2H, d, J=8,0 Гц). δ C (100 МГц, CDCl3) 54,5, 55,4, 113,7, 115,5, 121,3, 128,4, 129,1, 129,9, 159,9, 162,0, 169,6. МС (ES): + 276,2 (MH ), МС-ВР: знайд. для C15H15NO3F 276,1039, розрах. 276,1036. F3. N-бензил-3,4-диметоксибензоїлгідроксамова кислота. Вихід 0,23 г (53 %). δH (300 МГц, CDCl3) 3,65 (3H, s, OCH3), 3,85 (3H, s, OCH3), 4,80 (2H, s, CH2N), 6,80 (1H, d, J=8,0 Гц), 7,03 (1H, d, J=2,0 Гц), 7,10 (1H, dd, J=2,0, 8,0 Гц), 7,25-7,35 (5H, m). δC (100 МГц, CDCl3) 55,2, 55,9, 56,0, + 110,5, 111,1, 121,3, 123,9, 127,1, 128,6, 128,8, 135,6, 148,9, 151,5, 168,0. МС (ES): 288,2 (MH ), МС-ВР: знайд. для C16H18NO4 288,1242, розрах. 288,1236. F4. N-(4-фторбензил)-3,4-диметоксибензоїлгідроксамова кислота. Вихід 9 мг (35 %). δH (300 МГц, CDCl3) 3,45 (6H, s, OCH3), 4,55 (2H, s, CH2N), 6,75 (1H, d, J=8,0 Гц), 6,95 (2H, t, J=9,0 Гц), + 7,25-7,35 (4H, m). МС (ES): 306,2 (MH ), МС-ВР: знайд. для C16H17NO4F 306,1140, розрах. 306,1136. B1. (2E)-3-метил-5-(2,6,6-триметилциклогексен-1-еніл)пента-2,4-дієноїлгідроксамова кислота. 0,09 г (62 %). δH (400 МГц, CDCl3) 1,02 (3H, s), 1,08 (3H, s), 1,48 (2H, m), 1,62 (2H, m), 1,71 (3H, s, E ізомер), 1,78 (3H, s, Z ізомер), 5,68 (1H, s, Z ізомер), 5,78 (1H, s, E ізомер), 6,12 (1H, d, J=15,0 Гц), 6,62 (1H, d, J=15,0 Гц), δC (100 МГц, CDCl3) 13,7, 18,9, 20,8, 21,5, 28,7, 32,9, 39,3, 115,0, 116,8, 129,8, 133,7, 134,5, 135,8 (сигнал карбонілу не детектується). МС (ES): 273,2 + (MNa ). D12. 3,4-диметоксифенілпропеноїлгідроксамова кислота. Вихід 0,18 г (54 %). δH (400 МГц, CDCl3) 3,79 (6H, s, 2 × OCH3), 6,25 (1H, d, J=16,0 Гц), 6,85 (1H, d, J=8,0 Гц), 7,03 (2H, m), 7,42 + (1H, d, J=16,0 Гц). МС (ES): 246,1 (MNa ). D13. 4-метоксифенілпропеноїлгідроксамова кислота. Вихід 1,07 г (50 %). δH (400 МГц, CD3OD) 3,78 (3H, s, OCH3), 6,38 (1H, d, J=16,0 Гц), 6,89 (2H, d, J=8,0 Гц), 7,48 (2H, d, J=8,0 Гц), 7,56 (1H, d, J=16,0 Гц). δC (100 МГц, CD3OD) 55,9, 115,5, 118,4, 128,8, 130,8, 141,6, 145,1, 167,0. + МС (ES): 194,2 (MH ), МС-ВР: знайд. для C10H12NO3 194,0816, розрах. 194,0818. E1. Метиловий ефір N-бензил-N-(4-метоксибензил)гліцину. δH (300 МГц, CDCl3) 3,40 (2H, s, CH2N), 3,81 (3H, s, OCH3), 3,86 (2H, s, CH2N), 3,90 (3H, s, CO2CH3), 6,97 (2H, d, J=8,0 Гц), 7,25-7,50 (7H, m), δC (75 МГц, CDCl3) 50,7, 52,6, 54,6, 56,5, 57,0, + 113,1, 126,5, 127,7, 128,3, 129,5, 130,4, 135,3, 137,6, 171,4, m/z 322,1 (MNa ). Додаткові матеріали Таблиця S1 Конструкти CCD, які використовуються у штамах BL21(DE3) (pAC-BETA) E. coli, для визначення інгібуючої активності Ген (вид) AtCCD7 (Arabidopsis thaliana) LeCCD1a (Solanum lycopersicum) ММBCO2 (Mus musculus) ММBCO1 (Mus musculus) 45 50 Класифікаційний номер Розщеплення у положенні NM_130064 9,10 Вектор (маркерна послідовність) pGEX-4t (GST) AY576001 9,10/9′,10′ pET30 (відсутній) AJ290392 9,10 pET30 (відсутній) AF294899 15,15′ pET30 (відсутній) Обговорення результатів Сконструйований й досліджений новий клас інгібіторів сімейства каротиндіоксигеназ, структура яких є міметиком субстрату, що визначає положення хелатуючої залізо групи гідроксамової кислоти у складі активного центра. Положення зазначеної групи змінювали за рахунок зміни відстані між гідроксамовою кислотою й ароматичним циклом таким чином, щоб відстань всередині каротиноїдного субстрату відповідала відстані між найближчою кінцевою групою циклу й ділянкою розщеплення. Кристалічна структура ACO, ціанобактеріальної CCD, 14 UA 105776 C2 5 10 15 20 25 30 35 40 45 50 55 60 свідчить про те, що положення ділянки розщеплення, імовірно, визначається відстанню між каталітичним активним центром, що представляє собою залізо Fe(II), отвором неполярного каналу, що забезпечує доступ до каротиноїдних субстратів (11). Дана теорія підтверджується на прикладі розщеплення ферментом NosCCD (з Nostoc sp. PCC 7120) моноциклічного γ-каротину, що відбувається у положенні 7′,8′, якщо поблизу розташований кінцевий лінійний фрагмент, але у положенні 9,10, якщо сусідній кінцевий фрагмент має більше компактну циклічну групу (48). І дійсно, можна припустити, що циклічна кінцева група може не пройти через отвір у каналі (48). З урахуванням зазначеної кристалічної структури й запропонованої авторами моделі розщеплення (фіг. 3), можна припустити, що сполуки арил-C1N, арил-C2N і арил-C3N будуть проявляти селективність при розщепленні у положеннях 7,8, 9,10 і 11,12, відповідно. Зазначені сполуки досліджували відносно ферментів, що мають специфічність у положенні 9,10, 11,12 і 15,15′. Було встановлено, що деякі сполуки арил-C1N (F1, F2) є ефективними інгібіторами ферментів, що розщеплюють у положенні 9,10, і не активні відносно ферментів, що розщеплюють у положенні 11,12 або 15,15′. Сполуки арил-C2N є високоефективними інгібіторами ферментів, що розщеплюють у положенні 9,10, але проявляють помірну інгібуючу активність відносно ферментів, що розщеплюють у положенні 11,12. Сполуки арил-C3N проявляли значно меншу активність відносно ферментів, що розщеплюють у положенні 9,10, і хоча найбільш ефективним інгібітором ферментів, що розщеплюють у положенні 11,12, є сполука зі зазначеної групи (сполуки D8), всі ці сполуки проявляли трохи більшу селективність відносно положення 9,10. Для порівняння, було встановлено, що додатковий аналог, абамін SG, більше активний відносно ферментів, що розщеплюють у положенні 11,12, у порівнянні з ферментами, що розщеплюють у положенні 9,10, і при концентрації інгібітора 100 мкМ інгібуюча активність у відношенні AtNCED3 становила 78 % і у відношенні AtCCD1 ≤ 20 % (32). Жодна з досліджених сполук не інгібувала ферменти, що розщеплюють у положенні 15,15′, імовірно, через занадто малий простір. Tаким чином, можна зробити висновок, що описана стратегія зміни розташування груп гідроксамової кислоти мала успіх лише частково, тому що спостерігався деякий ступінь перекривання класів один з одним. Незважаючи на це, було встановлено, що індивідуальні сполуки проявляють надзвичайно високу специфічність відносно положення 9,10 в умовах in vitro, наприклад, значення IC50 для F1 склало 2,0 мкМ, однак інгібуюча активність у відношенні LeNCED1 не визначається. Інгібітори також характеризуються різним профілем активності у клітинах E.coli у відношенні трьох різних ферментів, що розщеплюють у положенні 9,10. Наприклад, сполуки F1 і F2 проявляли високу інгібуючу активність у відношенні LeCCD1 і ММBCO2, але відносно низьку активність у відношенні AtCCD7. Такі розходження можна пояснити, тому що амінокислотна гомологія ММBCO2 з двома рослинними ферментами, що розщеплюють у положенні 9,10 (LeCCD1a і AtCCD7), становить лише 17-23 %, і ці два рослинних ферменти значно відрізняються один від одного й характеризуються гомологією на рівні 19 %. Це означає, що варіанти інгібіторів на основі гідроксамової кислоти, здатні розпізнавати різні ферменти, що мають аналогічну активність, але відрізняються за первинною структурою. Відомо, що клітини E. coli є досить ефективною системою для вивчення активності інгібіторів в умовах in vivo. Наприклад, у дослідженнях на клітинах E. coli було встановлено, що сполуки F1 і F2 є слабкими інгібіторами у відношенні AtCCD7, що було підтверджено результатами аналізу впливу на розростання бруньок Arabidopsis (фіг. 5), що у свою чергу є мірою активності AtCCD7 і/або AtCCD8. Однак, хоча сполуки D5 і D6 характеризуються слабкою інгібуючою активністю у дослідженнях на клітинах E. coli, вони роблять значний ефект на ріст цілої рослини Arabidopsis, при цьому спостерігається найбільше число бічних відгалужень. Було також установлено, що сполуки D1 і D3 є ефективними інгібіторами ферментів, що розщеплюють у положенні 9,10 в умовах in vitro (табл. 1), за результатами аналізу з використанням клітин E. coli (фіг. 4) і дослідженні впливу на розростання бруньок (фіг. 5), однак D3 проявляє негативний вплив на ріст рослини, що суперечить результатам аналізу розгалуження рослини, у той час у рослин, оброблених D1, спостерігається нормальний ріст і без посилення ступеня розгалуження. Арильні цикли сполук D1 і D3 містять більше полярних гідроксильних груп, і, отже, зазначені сполуки більше активно проникають у рослину або швидше піддаються метаболізму. Обробка цілої рослини Arabidopsis арил-C1N інгібіторами F1 і F2, структури яких відрізняються тільки одним атомом фтору, приводила до знебарвлення листя. Відомо, що недолік фотозахисних каротиноїдів, який, наприклад, пов'язаний з обробкою гербіцидами, інгібіторами фітоендесатурази (50), приводить до фотоокисної деградації хлорофілу й, отже, до знебарвлення листя. Крім того, мутант Arabidopsis variegated 3 (var3), який, як описано, взаємодіє з AtCCD4 в умовах in vitro, характеризується фенотипом зі знебарвленими листями й уповільненням утворення хлоропластів (51). Арил-C1N сполуки, як очікувалися, інгібували 15 UA 105776 C2 5 10 15 20 25 30 35 40 45 50 55 60 ферменти CCD з активністю за положенням 7,8, а послідовність AtCCD4 є найбільше близькою послідовності ферменту CsZCD, що розщеплює у положенні 7,8 (9), отже, можливим поясненням дії сполук F1 і F2 може служити той факт, що зазначені сполуки інгібують дію комплексу Var3/AtCCD4, що у свою чергу приводить до формування фенотипу, аналогічного мутантові var3. Аналіз мутантів Arabidopsis, стійких до знебарвлення сполуками F1 або F2, дозволить ідентифікувати білок-мішень, як уже описано для інших низькомолекулярних сполук (52). У цілому, проведені дослідження й спостережувані розходження за даними різних методів аналізу свідчать про те, що такі фактори, як поглинання клітинами, метаболізм, вплив на нецільові процеси, можуть відігравати роль при визначенні придатності й ефективності інгібіторів у польових умовах. Отримані нами результати свідчать про необхідність проведення вторинних аналізів у біологічних системах із використанням сполук, описаних у даному винаході. Було встановлено, що сполуки D2, D4, D5 і D6 інгібують ферменти сімейства CCD за даними всіх проведених аналізів, включаючи дослідження у польових умовах, без прояву якогонебудь негативного ефекту на цілу рослину. Описані у даному винаході сполуки можна використовувати як генетичні агенти для дослідження функції ферментів CCD у рослинах, у тканинах тварин і мікроорганізмів. Використання інгібіторів, описаних у даному винаході, дозволить знизити активність ферментів CCD, що приймають участь у процесах розгалуження безлічі видів рослин і спостерігати за зміною вмісту каротиноїдів і апокаротинів - такий метод може стати ефективним інструментом для ідентифікації попередників стриголактону, ідентифікації інших активних стриголактон-подібних сполук, а також для додаткового вивчення шляхів біосинтезу. Інгібітори також можна використовувати для дослідження функціональних розходжень стриголактону у різних видах рослин. Сполуки, що прискорюють розгалуження, можуть знайти застосування у садівництві, де часто дуже потрібно одержати компактну форму рослини, наприклад, при вирощуванні плодових культур (53). Інші біологічні системи, в яких застосування генетичних технологій не можна застосовувати на практиці, включають виробництво шафрану (9) і біксину (49) у рослинах Crocus і Bixa, відповідно, в яких субстрати ферментів CCD in vivo, які беруть участь у цих процесах, недостатньо вивчені, а також дослідження функцій мікорадицину й стриголактону рослин при взаємодії з мікоризою (54) і бур'янами (15). Нарешті, інгібітори BCO2 можуть знайти застосування у фармацевтичній промисловості, тому що продукти, отримані у результаті розщеплення каротиноїдів у положенні 9,10, здатні руйнувати ДНК і впливати на карциногенез (55,56). Джерела інформації: 1. Auldridge M. E., McCarty D. R., і Klee H. J., Curr. Opin. Plant Biol., т. 9, сс 315-321 (2006). 2. Zeevaart J. A. D. і Creelman R. A., Annu. Rev. Рослина Physiol. Plant Mol. Biol., т. 39, сс 439473 (1988). 3. Schwartz, S. H., Tan B. C., Gage D. A., Zeevaart J. A. D. і McCarty D. R., Plant Physiol., т. 114, сс 798-798 (1997). 4. von Lintig J. і Vogt K. J., Biol. Chem., т.275, сс 11915-11920 (2000). 5. Wyss A., Wirtz G., Woggon W. D., Brugger R., Wyss M., Friedlein A., Bachmann H. і Hunziker W., Biochem. Biophys. Res. Coммun., т. 271, сс 334-336 (2000). 6. Kiefer C., Hessel S., Lampert J. M., Vogt K., Lederer M. O., Breithaupt D. E. і von Lintig J. J., Biol. Chem., т. 276, сс 14110-14116 (2001). 7. Hu K. Q., Liu C., Ernst H., Krinsky N. I., Russell R. M. і Wang X. D., J. Biol. Chem., т.281, сс 19327-19338 (2006). 8. Dudareva N., Negre F., Nagegowda D. A. і Orlova I., Crit. Rev. Plant Sci., т. 25, сс 417-440 (2006). 9. Bouvier F., Suire C., Mutterer J. і Camara B., Plant Cell, т. 15, сс 47-62 (2003). 10. Juttner F. і Hoflacher B., Arch. Microbiol., т. 141, сс 337-343 (1985). 11. Kloer D. P., Ruch S., Al-Babili S., Beyer P. і Schulz G. E., Science, т. 308, сс 267-269 (2005). 12. Marasco E. K., Vay K. і Schmidt-Dannert C., J. Biol. Chem., т. 281, сс 31583-31593 (2006). 13. Eisner T. і Meinwald J., Science, т. 53, сс 1341-1350 (1966). 14. Fester T., Schmidt D., Lohse S., Walter M. H., Giuliano G., Bramley P. M., Fraser P. D., Hause B. і Strack D., Planta, т. 216, сс 148-154 (2002). 15. Matusova R., Rani K., Verstappen F. W. A., Franssen M. C. R., Beale M. H. і Bouwmeester H. J., Plant Physiol., т. 139, сс 920-934 (2005). 16. Akiyama K. і Hayashi H., Ann. Bot., т. 97, сс 925-931 (2006). 17. Gomez-Roldan V., Fermas S., Brewer P. B., Puech-Pages V., Dun E. A., Pillot J. P., Letisse 16 UA 105776 C2 5 10 15 20 25 30 35 40 45 50 55 60 F., Matusova R., Danoun S., Portais J. C., Bouwmeester H., Becard G., Beveridge C. A., Rameau C. і Rochange S. F., Nature, т. 455, сс 189-194 (2008). 18. Umehara M., Hanada A., Yoshida S., Akiyama K., Arite T., Takeda-Kamiya N., Magome H., Kamiya Y., Shirasu K., Yoneyama K., Kyozuka J., і Yamaguchi S., Nature, т. 455,сс 195-200 (2008). 19. Ward S. P. і Leyser O., Curr. Opin. Plant Biol., т. 7, сс 73-78 (2004). 20. Sorefan K., Booker J., Haurogne K., Goussot M., Bainbridge K., Foo E., Chatfield S., Ward S., Beveridge C., Rameau C. і Leyser O., Genes Dev., т.17, сс 1469-1474 (2003). 21. Booker J., Auldridge M., Wills S., McCarty D., Klee H. і Leyser C., Curr. Biol., т. 14, сс 12321238 (2004). 22. Schwartz S. H., Qin X. Q. і Loewen M. C., J. Biol. Chem., т. 279, сс 46940-46945 (2004). 23. Alder A., Holdermann I., Beyer P. і Al-Babili S., Biochem. J. BJ20080568 (2008). 24. Booker J., Sieberer T., Wright W., Williamson L., Willett B., Stirnberg P., Turnbull C., Srinivasan M., Goddard P. і Leyser O., Dev. Cell, т. 8, сс 443-449 (2005). 25. Bennett T., Sieberer T., Willett B., Booker J., Luschnig C. і Leyser O., Curr. Biol., т. 16, сс 553-563 (2006). 26. Cunningham F. X. і Gantt E., Photosynth. Res., т. 92, сс 245-259 (2007). 27. Schwartz S. H., Qin X. Q. і Zeevaart J. A. D., J. Biol. Chem., т. 276, сс 25208-25211 (2001). 28. Stockwell B. R., Nat. Rev. Genet., т.1, сс 116-125 (2000). 29. Armstrong J. I., J. Sci. Food Agric., т. 87, сс 1985-1990 (2007). 30. Kaschani F. і van der Hoorn R., Curr. Opin. Chem. Biol., т.11, сс 88-98 (2007). 31. Han S. Y., Kitahata N., Sekimata K., Saito T., Kobayashi M., Nakashima K., YamaguchiShinozaki K., Shinozaki K., Yoshida S. і Asami T., Plant Physiol., т.135, сс 1574-1582 (2004). 32. Kitahata N., Han S. Y., Noji N., Saito T., Kobayashi M., Nakano T., Kuchitsu K., Shinozaki K., Yoshida S., Matsumoto S., Tsujimoto M. і Asami T., Bioorg. Med. Chem., т. 14, сс 5555-5561 (2006). 33. Suzuki A., Akune M., Kogiso M., Imagama Y., Osuki K., Uchiumi T., Higashi S., Han S. Y., Yoshida S., Asami T. і Abe M., Plant Cell Physiol., т. 45, сс 914-922 (2004). 34. Han S. Y., Kitahata N., Saito T., Kobayashi M., Shinozaki K., Yoshida S. і Asami, T., Bioorg. Med. Chem. Lett., т.14, сс 3033-3036 (2004). 35. Bergeron R. J. і McManis J. S., Tetrahedron, т.45, сс 4939-4944 (1989). 36. Kawase M. і Kikugawa Y., J. Chem. Soc., Perkin. Trans., т.1, сс 643-645 (1979). 37. Schmidt H., Kurtzer R., Eisenreich W. і Schwab W., J. Biol. Chem., т. 281, сс 9845-9851 (2006). 38. Cunningham F. X., Pogson B., Sun Z. R., McDonald K. A., DellaPenna D. і Gantt E., Plant Cell, т. 8, сс 1613-1626 (1996). 39. Wilson A. K., Pickett F. B., Turner J. C. і Estelle M., Mol. Gen. Genet., т. 222, сс 377-383 (1990). 40. Chatfield S. P., Stirnberg P., Forde B. G. і Leyser O., Plant J., т. 24, сс 159-169 (2000). 41. Taylor I. B., Sonneveld T., Bugg T. D. H. і Thompson A. J., J. Plant Growth Regul., т.24, сс 253-273 (2005). 42. Borowski T., Blgomberg M. R. A. і Siegbahn P. E. M., Chem. Eur. J., т.14, сс 2264-2276 (2008). 43. Kontogiorgis C. A., Papaioannou P. і Hadjipavlou-Litina D. J., Curr. Med. Chem., т. 12, сс 339355 (2005). 44. Simkin A. J., Schwartz S. H., Auldridge M., Taylor M. G. і Klee H. J., Plant J., т. 40, сс 882892 (2004). 45. Burbidge A., Grieve T. M., Jackson A., Thompson A., McCarty D. R. і Taylor I. B., Plant J., т. 17, сс 427-431 (1999). 46. Vogel J. T., Tan B. C., McCarty D. R. і Klee H. J., J. Biol. Chem., т. 283, сс 11364-11373 (2008). 47. Paik J., During A., Harrison E. H., Mendelsohn C. L., Lai K. і Blaner W. S., J. Biol. Chem., т. 276, сс 32160-32168 (2001). 48. Scherzinger D. і Al-Babili S., Mol. Microbiol., т. 69, сс 231-244 (2008). 49. Bouvier F., Dogbo O. і Camara B., Science, т. 300, сс 2089-2091 (2003). 50. Sandmann G., Schmidt A., Linden H. і Boger P., Weed Sci., т.39, сс 474-479 (1991). 51. Naested H., Holm A., Jenkins T., Nielsen H. B., Harris C. A., Beale M. H., Andersen M., Mant A., Scheller H., Camara B., Mattsson O. і Mundy J., J. Cell Sci., т.117, сс 4807-4818 (2004). 52. Walsh T. A., Bauer T., Neal R., Merlo A. O., Schmitzer P. R., Hicks G. R., Honma M., Matsumura W., Wolff K. і Davies J. P., Plant Physiol., т.144, сс 1292-1304 (2007). 53. Quinlan, J. D. і Tobutt K. R., Hortscience, т.25, сс 60-64 (1990). 54. Walter M. H., Floss D. S., Hans J., Fester T. і Strack D., Phytochemistry, т. 68, сс 130-138 17 UA 105776 C2 5 10 (2007). 55. Yeh S. L. і Wu S. H., Chem-Biol. Interact., т.163, сс 199-206 (2006). 56. Alija A. J., Bresgen N., Soммerburg O., LanghanS C. D., Siems W. і Eckl P. M., Carcinogenesis, т. 27, сс 1128-1133 (2006). Примітки Дана робота виконана за підтримкою Ради з наукових досліджень у галузі біології й біотехнології (Великобританія), ініціативний проект SCIBS (Проект BB/D005787). 1. Використані скорочення: CCD, каротиндіоксигеназа, NCED, цисепоксикаротиндіоксигеназа, max, аксилярний ріст, IC50, концентрація інгібітора, при якій інгібуюча активність становить 50 %, ДТ, дикий тип, GST, глутатіон S-трансфераза, ФСБ, фосфатно-сольовий буферний розчин, РХВД, рідинна хроматографія високого дозволу, ІПТГ, ізопропіл β-D-1-тіогалактопіранозид, НОК, α-нафталіноцтова кислота, ACO, апокаротин-15,15′оксигеназа. ФОРМУЛА ВИНАХОДУ 15 1. Спосіб стимуляції проростання насіння рослин і/або виведення зі стану спокою тканин рослин або органів рослин, що полягає в обробці насіння, рослини, органів рослин або тканин рослин сполукою формули І: R R 3 OH 2 N n R 20 25 30 35 1 O R R 4 R 6 O 5 , де R1 означає алкіл або Н, R2, R3, R4 і R5 незалежно вибирають з групи, що включає Н, галоген, -NO2, -SO2R', -ОН, - Оалкіл, де R' означає алкіл або аміноалкіл, і/або R1 і R5 разом утворюють -О(СН2)m-, де m дорівнює 1, 2, 3 або 4, R6 означає алкіл, необов'язково заміщений одним або більше атомами галогену, групами -ОН, NO2 або -SO2R', і/або арил, необов'язково заміщений одним або більше атомами галогену, групами -ОН, -NO2 або -SO2R', і n означає ціле число від 1 до 4. 2. Спосіб за п. 1, де R2, R3, R4 і R5 означають Н. 3. Спосіб за п. 1 або 2, де R1 означає С1-С4алкіл. 4. Спосіб за будь-яким із попередніх пунктів, де алкіл у складі R6 означає С1-С12алкіл. 5. Спосіб за будь-яким із попередніх пунктів, де R 6 означає заміщений або незаміщений арил формули -(СН2)pарил, де р означає ціле число від 0 до 4. 6. Спосіб за п. 5, де R6 означає групу формули II: 7 R , де R7 означає Н, -ОН, -NO2, -SO2R' або атом галогену. 7. Спосіб за п. 1, де R1 означає Me, a R2, R3, R4 і R5 означають Н, n дорівнює 1 і R6 означає групу формули II: 7 R , 40 45 де R7 означає Н, -ОН, -NO2, -SO2R' або атом галогену. 8. Спосіб за будь-яким із попередніх пунктів, що полягає в обробці зазначеною сполукою однієї або більше насінин до посіву. 9. Спосіб за будь-яким із попередніх пунктів, де насіння висівають у живильне середовище, й зазначена сполука контактує з насінням у живильному середовищі. 18 UA 105776 C2 5 10. Спосіб за будь-яким із попередніх пунктів, де насінням є насіння бур'янів, і зазначене насіння контактує зі зазначеною сполукою, при цьому спостерігається стимуляція проростання насіння бур'янів, і утворюються пророслі бур'яни, до обробки пророслого насіння бур'янів гербіцидами, або обробляють ґрунт із уже пророслим насінням бур'янів. 11. Спосіб за будь-яким із пп. 1-7, де зазначена сполука взаємодіє з бульбами, зернами або цибулинами, при цьому спостерігається стимуляція росту бульб, зерен або цибулин. 12. Спосіб за будь-яким із пп. 1-7, що полягає в обробці зазначеною сполукою тканин рослин, органів рослин або рослин для виведення однієї або більше тканин рослин зі стану спокою. 13. Композиція для обробки рослин, що містить сполуку формули І: R R 3 OH 2 N n R 1 O R 15 20 25 R O 3 , де R1 означає алкіл або Н, R2, R3, R4 і R5 незалежно вибирають з групи, що включає Н, галоген, -NO2, -SO2R', -ОН, - Оалкіл, де R' означає алкіл або аміноалкіл, і/або R1 і R5 разом утворюють -O(СН2)m-, де m дорівнює 1, 2, 3 або 4, R6 означає алкіл, необов'язково заміщений одним або більше атомами галогену, групами -ОН, NO2 або -SO2R', і/або арил, необов'язково заміщений одним або більше атомами галогену, групами -ОН, -NO2 або -SO2R', і/або арил формули -(СН2)p арил, необов'язково заміщений одним або більше атомами галогену, групами -ОН, -NO2 або -SO2R', де р означає ціле число від 0 до 4, та де R' означає алкіл або аміноалкіл; і n означає ціле число від 1 до 4; та сільськогосподарсько прийнятний допоміжний агент. 14. Композиція, призначена для нанесення покриття на насіння, що містить композицію за п. 13 і один або більше інкапсулюючих агентів або плівкоутворювальних агентів. 15. Тканина рослини й/або рослина, оброблена композицією за п. 13 або 14. 16. Насіння, бульби, зерно або цибулини, покриті композицією за п. 13 або 14. 17. Індивідуальна сполука формули І R OH 2 N n R 1 O R R 30 35 6 5 R 10 4 R 4 R 6 O 5 , де R1 означає алкіл або Н, R2, R3, R4 і R5 незалежно вибирають з групи, що включає Н, галоген -NO2, -SO2R', -ОН, - О-алкіл, де R' означає алкіл або аміноалкіл, і/або R1 і R5 разом утворюють -O(СН2)m-, де m дорівнює 1, 2, 3 або 4, R6 означає -(СН2)p арил, заміщений одним або більше атомами галогену, групами -ОН, -NO2 або -SO2R', де р означає ціле число від 0 до 4, і де R' означає алкіл або аміноалкіл; і n означає ціле число від 1 до 4. 18. Сполука за п. 17, де R6 означає групу формули II: 7 R , 40 де R7 означає Н, -ОН, -NO2, -SO2R' або атом галогену. 19. Сполука за п. 17, де R1 означає Me, a R2, R3, R4 і R5 означають Н, n дорівнює 1, і R6 означає групу формули II: 19 UA 105776 C2 7 R , де R7 означає Н, -ОН, -NO2, -SO2R' або атом галогену. 20 UA 105776 C2 21 UA 105776 C2 22 UA 105776 C2 23 UA 105776 C2 24 UA 105776 C2 Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 25
ДивитисяДодаткова інформація
Назва патенту англійськоюPlant development control composition
Автори російськоюThompson, Andrew, Bugg, Timothy
МПК / Мітки
МПК: A01C 1/06, C07C 259/06, A01N 37/18, A01P 21/00
Мітки: рослин, композиція, розвитку, контролю
Код посилання
<a href="https://ua.patents.su/27-105776-kompoziciya-dlya-kontrolyu-rozvitku-roslin.html" target="_blank" rel="follow" title="База патентів України">Композиція для контролю розвитку рослин</a>
Попередній патент: Похідні рифаміцину
Наступний патент: Фармацевтична композиція ефективного інгібітора вгс для перорального введення
Випадковий патент: Спосіб помелу силікатних матеріалів