Фармацевтична композиція ефективного інгібітора вгс для перорального введення
Номер патенту: 105777
Опубліковано: 25.06.2014
Автори: Хель Хуан Франсіско, Вільягра Марія Фернанда, Чень Фен-Цзін
Формула / Реферат
1. Рідка фармацевтична композиція, що містить
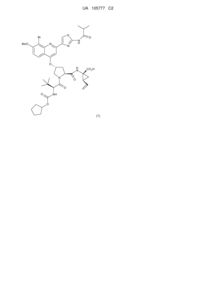
а) у кількості, рівній 4,6 мас. % або менше, сполуку 1 або її фармацевтично прийнятну сіль:
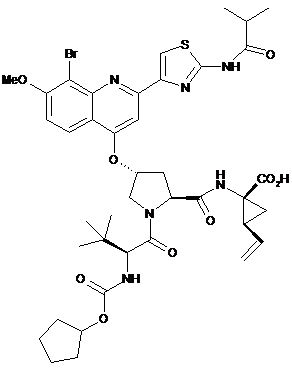 ; (1)
; (1)
б) принаймні від 10 мас. % до 30 мас. % ПАР; та
в) принаймні від 60 мас. % до 90 мас. % фармацевтично прийнятного розчинника;
при цьому масове співвідношення ПАР і сполуки 1 або її фармацевтично прийнятної солі дорівнює 2,7 або більше; і
при цьому композиція практично вільна від ліпіду, і
при цьому композиція утворює прозору дисперсію, в якій середній розмір часток становить менше 1 мкм після розведення у модельному шлунковому соку.
2. Фармацевтична композиція за п. 1, де гідрофільно-ліпофільний баланс ПАР становить більше 10.
3. Фармацевтична композиція за п. 1, де ПАР є вітамін E-TPGS, поліетоксильована касторова олія, поліоксилгідрована касторова олія, ефір поліоксіетиленсорбіту й жирної кислоти, каприлокапроїлмакроголгліцерид або їх суміші.
4. Фармацевтична композиція за п. 1, де фармацевтично прийнятним розчинником є пропіленгліколь, поліпропіленгліколь, поліетиленгліколь, гліцерин, етанол, триацетин, диметилізосорбід, глікофурол, пропіленкарбонат, вода, диметилацетамід або їх суміші.
5. Фармацевтична композиція за п. 1, де розчинником є суміш води, поліетиленгліколю з середньою молекулярною масою більше 300, але менше 600 і пропіленгліколю.
6. Фармацевтична композиція за п. 1, що не містить ліпід.
7. Фармацевтична композиція за п. 1, в якій практично відсутній пропіленгліколь.
8. Фармацевтична композиція за п. 1, в якій практично відсутній амін.
9. Рідка фармацевтична композиція, що містить
а) у кількості, рівній 6,3 мас. % або менше, сполуку 1 або її фармацевтично прийнятну сіль:
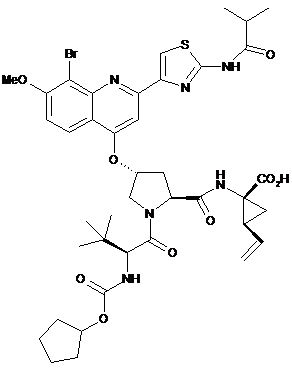 ; (1)
; (1)
б) принаймні від 10 мас. % до 30 мас. % ПАР; та
в) принаймні від 60 мас. % до 90 мас. % фармацевтично прийнятного розчинника; при цьому масове співвідношення ПАР і сполуки 1 або її фармацевтично прийнятної солі дорівнює 4,3 або більше; і
при цьому композиція практично вільна від ліпіду, і
при цьому композиція утворює прозору дисперсію, в якій середній розмір часток становить менше 1 мкм після розведення у модельному шлунковому соку.
10. Фармацевтична композиція за п. 9, де гідрофільно-ліпофільний баланс ПАР становить більше 10.
11. Фармацевтична композиція за п. 9, де ПАР є вітамін E-TPGS, поліетоксильована касторова олія, поліоксилгідрована касторова олія, ефір поліоксіетиленсорбіту й жирної кислоти, каприлокапроїлмакроголгліцерид або їх суміші.
12. Фармацевтична композиція за п. 9, де фармацевтично прийнятним розчинником є пропіленгліколь, поліпропіленгліколь, поліетиленгліколь, гліцерин, етанол, триацетин, диметилізосорбід, глікофурол, пропіленкарбонат, вода, диметилацетамід або їх суміші.
13. Фармацевтична композиція за п. 9, де розчинником є суміш води, поліетиленгліколю з середньою молекулярною масою більше 300, але менше 600 і пропіленгліколю.
14. Фармацевтична композиція за п. 9, що не містить ліпід.
15. Фармацевтична композиція за п. 9, в якій практично відсутній пропіленгліколь.
16. Фармацевтична композиція за п. 9, в якій практично відсутній амін.
Текст
Реферат: Фармацевтична композиція наступної сполуки 1 або її фармацевтично прийнятної солі, яка є ефективним інгібітором вірусу гепатиту С (ВГС), для перорального введення. UA 105777 C2 (12) UA 105777 C2 S Br N MeO N H N O O H N N CO2H O O O NH O (1) UA 105777 C2 5 У даній заявці витребовується пріоритет у зв'язку з тимчасовою заявкою США No. 61/116789, поданою 21 листопада 2008 р. Передумови створення даного винаходу 1. Галузь техніки У даному винаході пропонується фармацевтична композиція ефективного інгібітора вірусу гепатиту С (ВГС) для перорального введення. 2. Передумови створення даного винаходу Наступна сполука 1: S Br O NH MeO N N O H N N CO2H O O NH O O (1) 10 15 відома в якості селективного й ефективного інгібітора серинової протеази NS3 ВГС. Сполука 1 є цвіттеріоном і відноситься до серії ациклічних пептидів-інгібіторів ВГС, описаних у патентах США 7323180, 7514557 і 7585845. Сполука 1 докладно описана як сполука № 1055 у патенті США 7585845 і як сполука № 1008 у патенті США 7514557. Сполуку 1 можна одержати за загальними методиками, описаними у зазначених вище патентах, які включені у даний опис як посилання. Кращі форми сполуки 1 включають кристалічні форми, насамперед кристалічну форму натрієвої солі, яку одержують як описано у розділі Приклади у даному описі. Сполуку 1 можна також характеризувати наступною хімічною формулою, яка еквівалентна описаній вище структурі: 2 R 1 L 0 L N S N O O B O N H N O OH O N R H O O 20 0 1 2 N H де В означає , L означає МеО , L означає Br, а R означає . У патенті США 6531139 і відповідній міжнародній заявці WO 9906024 описана фармацевтична композиція, що містить ліпофільний фармацевтично прийнятний агент, ліпід, що являє собою суміш моно- і дигліцеридів, розчинник і ПАР. Перераховані декілька фармацевтично прийнятних розчинників, включаючи поліетиленгліколь, однак пропіленгліколь є 1 UA 105777 C2 5 10 15 20 25 30 35 40 45 50 55 60 більше кращим розчинником. Перераховані декілька фармацевтично прийнятних ПАР, причому кращі Cremophor RH 40 або Cremophor EL. Вітамін Е-ТPGS не включений у список фармацевтично прийнятних ПАР. У цих цитованих документах зазначено, що композицію, описану у даному контексті, що є рідиною, можна використовувати для заповнення капсул для перорального введення й що її можна також переробляти у рідкий розчин для перорального, парентерального, ректального або місцевого введення. У патенті США 6121313 (опублікована заявка WO 9906043), зміст якого аналогічний патенту 6531139 (опублікована заявка WO 9906024), описаному вище, але фармацевтично активний агент обмежений певними піранонами. У патенті США 6231887 (опублікована заявка WO 9906044) описана фармацевтична композиція, що містить піранон в якості фармацевтично активного агента, основний амін, розчинник, ПАР й необов'язково ліпід, що представлений моно- і дигліцеридами. Перераховані декілька фармацевтично прийнятних розчинників, включаючи поліетиленгліколь, хоча пропіленгліколь є кращим розчинником. Перераховані декілька фармацевтично прийнятних ПАР, причому кращі Cremophor RH 40 або Cremophor EL. Вітамін Е-TPGS не включений у список фармацевтично прийнятних ПАР. Зазначено, що описану у даній заявці композицію, що є рідиною, можна використовувати для заповнення капсул для перорального введення й що її можна також переробити у рідкий розчин для перорального, парентерального, ректального або місцевого введення. У патенті США 6555558 (опублікована заявка WO 0236110) описана фармацевтична композиція, що містить піраноновий інгібітор протеази (крім того включаючи, але не обмежуючись тільки ним, типранавір), ПАР, розчинник поліетиленгліколь, ліпід, що являє собою суміш моно- і дигліцеридів, і необов'язково основний амін. Композиція практично не містить етанол і пропіленгліколь. Перераховані декілька фармацевтично прийнятних ПАР, причому кращою є Cremophor EL. Вітамін Е-TPGS не включений у список фармацевтично прийнятних ПАР. Зазначено, що описана вище композиція, що є рідиною, насамперед придатна для заповнення м'яких желатинових капсул, призначених для перорального введення. Вітамін E-TPGS (сукцинат D-альфа токоферилполіетиленгліколя) є водорозчинною формою вітаміну Е та ексципієнтом для прискорення емульгування ліпофільних речовин, і за своєю дією є неіоногенним ПАР, а також поліпшує біодоступність певних лікарських речовин. Наприклад, у статті Sokol R.J. та ін., Lancet, 338, 212-214, (1991) встановлено, що спільне введення вітаміну Е-TPGS і циклоспорину поліпшує біодоступність циклоспорину. У патенті США 6193985 (опублікована заявка WO 09531217) описане використання токоферолів як розчинники й/або ПАР для лікарських препаратів, які практично нерозчинні у воді, насамперед для одержання лікарської форми для місцевого введення. Використання вітаміну Е-TPGS згадується на сторінках 7-8 і 12 в якості ПАР для одержання складів з високим вмістом альфа-токоферолу як ліпідний шар. Приклади описаних складів для місцевого введення, що містять вітамін E-TPGS, такі як приклади 1-5, звичайно включають ліпідний шар (альфа-токоферол), лікарський агент і вітамін E-TPGS в якості ПАР, у кількості менше 25 мас. % у розрахунку на масу складу. У заявці WO 9636316 зазначено, що вітамін E-TPGS можна використовувати для підвищення ефективності доставки ліпофільних сполук у вигляді самоемульгуючого преконцентрату складу, що включає а) ліпофільний лікарський засіб (насамперед циклоспорин), б) вітамін E-TPGS і в) ліпофільну фазу. У типових прикладах описаних складів, таких як приклади 2 і 4, міститься менше 14 мас. % вітаміну E-TPGS в якості ПАР, ліпідний шар і лікарський засіб. Посилання на склад інгібітора протеази ВІЛ відсутній. Нарешті, у патенті США 6730679 (опублікована заявка WO 09735587) і статті Yu та ін., Pharm Res. 16(12), 1812-1817 (1999) описані фармацевтичні композиції, що містять ампренавір, інгібітор протеази ВІЛ і вітамін E-TPGS. Таким чином, у цей час відсутні які-небудь склади сполуки 1, насамперед призначені для перорального введення у вигляді неінкапсульованої рідини. Таку лікарську форму можна було б використовувати насамперед для дітей, а також дорослих, для яких існують проблеми при проковтуванні твердих речовин. Таким чином, об'єктом даного винаходу є одержання такого рідкого складу сполуки 1. Короткий виклад сутності даного винаходу У даному винаході пропонується фармацевтично прийнятний склад сполуки 1, або його фармацевтично прийнятної солі, у вигляді розчину для перорального введення. На підставі фізико-хімічних властивостей лікарської речовини в обсяг даного винаходу включене одержання розчину, здатного утворювати емульсію, мікроемульсію або міцелярний розчин при контактуванні з водним середовищем. Склад включає принаймні один розчинник 2 UA 105777 C2 5 для підвищення розчинності лікарського засобу й принаймні одну ПАР, гідрофільно-ліпофільний баланс (ГЛБ) якого становить > 10 і яку додають для підтримки лікарської речовини у розчиненому стані після розведення у модельних рідинах шлунково-кишкового тракту. Склад за даним винаходом може додатково містити воду в якості співрозчинника й маскуючі смак компоненти, такі як підсолоджувачі й ароматизатори. Можна додавати також антиоксидант для запобігання окислювання лікарської речовини. У таблиці 1 наведені два приклади композиції такого складу у двох різних дозуваннях. Таблиця 1 Склад перорального розчину натрієвої солі сполуки 1 (F330 і F335). А 330, мас. % 2,2 36,5 5,4 29,6 22,4 1,9 2,0 100,0 Інгредієнт Натрієва сіль сполуки 1 Поліетиленгліколь 400 Пропіленгліколь Вітамін Е, сукцинат поліетиленгліколя Вода очищена Сукралоза Масло тоффі Загальна маса 10 15 20 25 А 335, мас. % 4,4 34,3 5,4 29,6 22,4 1,9 2,0 100,0 Функція Лікарська речовина Розчинник Розчинник ПАР Розчинник Підсолоджувач Ароматизатор Іноді через фізико-хімічні характеристики лікарська речовина у комбінації з ПАР затвердіває або може стати недостатньо рідким для перорального введення. В одному об'єкті даного винаходу пропонується одержання розчину, придатного для перорального введення, у неінкапсульованій формі. Переважно такий склад є текучим при кімнатній температурі, у такий спосіб його можна використовувати для перорального введення у рідкому вигляді й для спрощення дозування. Було встановлено, що додавання принаймні одного співрозчинника у комбінації з ПАР забезпечує підтримку зазначеного складу у вигляді рідкого текучого розчину при кімнатній температурі, у такий спосіб досягаються переваги, згадані вище. Концентрація лікарської речовини, яка присутня у композиції становить такий рівень, що забезпечує можливість дозування у широкому інтервалі, тобто можна змінювати дозу, що вводиться, змінюючи об'єм. Така можливість дозволяє змінювати дозування у широкому інтервалі: від низької дози для введення маленьким дітям до високої дози для введення дорослим, нездатним проковтувати тверді форми. Докладний опис винаходу Рідка композиція за даним винаходом включає: а) сполуку 1 або її фармацевтично прийнятну сіль: S Br NH MeO O N N O H N N CO2H O O NH O O (1) 3 UA 105777 C2 5 10 15 б) принаймні одну ПАР, в) принаймні один фармацевтично прийнятний розчинник, причому композиція практично не містить ліпід. Активний інгредієнт, сполука 1, або її фармацевтично прийнятна сіль, присутня у кількості від 1 до 40 мас. % у розрахунку на загальну масу композиції, переважно від 2 до 10 мас. % у розрахунку на загальну масу композиції й навіть більше переважно від 2 до 8 мас. % у розрахунку на загальну масу композиції. Кращі форми сполуки 1, які можна використовувати у складі, включають його кристалічні форми, насамперед кристалічну форму натрієвої солі сполуки 1. ПАР, придатні для застосування у композиції за даним винаходом, включають ПАР, ГЛБ яких становить більше 10. Приклади придатних ПАР включають вітамін E-TPGS, ® поліетоксильоване касторове масло (наприклад, CREMOPHOR EL), поліоксилгідроване ® касторове масло (наприклад, CREMOPHOR RH), ефір поліоксіетиленсорбіту й жирної кислоти ® (наприклад, полісорбат 80), каприлокапроїлмакроголгліцерид (наприклад, LABRASOL ) або їхня суміш. Кращою ПАР є вітамін Е-ТPGS. Вміст ПАР становить від 2 до 50 мас. % у розрахунку на загальну масу композиції, переважно від 10 до 30 мас. % у розрахунку на загальну масу композиції. Різний вміст ПАР і лікарської речовини (ЛР) дозволяють одержати різні водні дисперсії. Приклади цих композицій представлені у таблиці 2 нижче. 20 Таблиця 2 Склади перорального розчину натрієвої солі сполуки 1 з різним співвідношенням вітаміну ETPGS і ЛР Інгредієнт F 296 F 145 мас. % мас. % F 331 мас. % F 363 мас. % F 355 мас. % F 332 мас. % F 333 мас. % F 334 мас. % Співвідношення 8,1 4,3 4,1 2,9 2,7 2,0 1,4 1 вітамін E-TPGS:ЛР Натрієва сіль 2,2 6,3 4,4 4,6 4,4 4,4 4,4 4,4 сполуки 1 Поліетиленгліколь 56,1 42,7 45,9 50,2 50,4 54,9 57,6 59,4 400 Пропіленгліколь 7,1 7,2 5,4 5,4 5,4 5,4 5,4 5,4 Сукцинат вітаміну Е 17,7 26,8 18,0 13,5 13,5 9,0 6,3 4,5 поліетиленгліколя Вода очищена 13,3 13,4 22,4 22,4 22,4 22,4 22,4 22,4 Сукралоза 1,8 1,8 1,9 1,9 1,9 1,9 1,9 1,9 Масло м'яти 0,9 0,9 Масло тоффі 0,9 0,9 2,0 2,0 2,0 2,0 2,0 2,0 Загальна маса 100,0 100,0 100,0 100,0 100,0 100,0 100,0 100,0 Прозорість дисперсії після розведення у 25 разів у Незначне Незначне Прозора Прозора Прозора Прозора Прозора Мутна шлунковому соку помутніння помутніння (рН 1,2) - візуальна оцінка Таблиця 3 Склади перорального розчину натрієвої солі сполуки 1 з різним співвідношенням вітаміну ETPGS і ЛР при високому вмісті лікарського засобу. Інгредієнт Співвідношення вітамін E-TPGS:ЛР Натрієва сіль сполуки 1 Поліетиленгліколь 400 Пропіленгліколь Сукцинат вітаміну Е поліетиленгліколя F145, мас. % 4,3 6,3 42,7 7,2 F180, мас. % 2,9 6,3 51,7 7,1 F181, мас. % 1,4 6,3 60,6 7,2 26,8 17,9 8,9 4 UA 105777 C2 Таблиця 3 Склади перорального розчину натрієвої солі сполуки 1 з різним співвідношенням вітаміну ETPGS і ЛР при високому вмісті лікарського засобу. Інгредієнт F145, мас. % Вода очищена 13,4 Сукралоза 1,8 Масло м'яти 0,9 Масло тоффі 0,9 Загальна маса 100,0 Прозорість дисперсії після розведення у 25 разів у шлунковому Прозора соку (рН 1,2) - візуальна оцінка 5 10 15 20 25 30 35 40 45 F180, мас. % 13,4 1,8 0,9 0,9 100,0 Незначне помутніння F181, мас. % 13,4 1,8 0,9 0,9 100,0 Незначне помутніння Результати, представлені вище у таблиці 2, свідчать про те, що при візуальній оцінці композиції, що містять вітамін E-TPGS (ПАР) і натрієву сіль сполуки 1 (ЛР) при співвідношенні 2,7, утворюють прозору дисперсію після розведення у модельному шлунковому соку, композиції зі співвідношенням від 1,4 до 2 утворюють дисперсії з незначним помутнінням або напівпрозорі дисперсії, а композиції зі співвідношенням 1 або утворюють мутні суспензії або суспензії типу молока після розведення у модельному шлунковому соку. Результати, представлені у таблиці 3, свідчать про те, що при більше високому вмісті лікарської речовини необхідно збільшувати співвідношення ПАР і ЛР для утворення прозорого розчину. Таким чином, при збільшенні вмісту лікарської речовини до 6,3 % у розрахунку на масу композиції при співвідношенні ПАР і ЛР в інтервалі від 1,4 до 2,9, утворюються дисперсії з незначним помутнінням або напівпрозорі дисперсії й тільки при збільшенні співвідношення до 4,3 утворюється прозора дисперсія. Відповідно, додаткові варіанти здійснення даного винаходу включають: а) композиції, в яких масове співвідношення ПАР і лікарської речовини 1,4 або більше, б) композиції, в яких масове співвідношення ПАР і лікарської речовини 2,7 або більше, в) композиції, в яких масове співвідношення ПАР і лікарської речовини 4,3 або більше. Додаткові кращі варіанти відповідно до перерахованих вище варіантів а)-в) включають: г) де відповідно до варіанта б) у композиціях міститься лікарська речовина у кількості, рівній 4,6 % або менше і масове співвідношення ПАР і ЛР дорівнює 2,7 або більше й д) де відповідно до варіанта в) у композиціях міститься лікарська речовина у кількості, рівній 6,3 % і масове співвідношення ПАР і ЛР дорівнює 4,3 або більше. Додаткові кращі варіанти включають будь-які варіанти а)-д), в яких ПАР є вітамін E-TPGS. У кращому варіанті здійснення даного винаходу композиції утворюють прозору, з незначним помутнінням або напівпрозору дисперсію після розведення у модельному шлунковому соку. В іншому кращому варіанті композиції утворюють прозорі дисперсії після розведення у модельному шлунковому соку. Якщо композиції утворюють прозорі, напівпрозорі дисперсії або дисперсії з незначним помутнінням при розведенні, то це означає, що у дисперсіях відсутній або міститься тільки невелика кількість осаду сполуки 1 і що активний інгредієнт залишається практично у солюбілізованому стані. Такі системи є кращими, тому що у цьому випадку очікується підвищення біодоступності активного інгредієнта після проковтування, у порівнянні з мутними дисперсіями, в яких активний інгредієнт практично випадає в осад. Прозорість кінцевої дисперсії можна оцінювати відомими методами. Прозорість можна оцінювати за розміром крапель і часток, який вимірюють методом лазерного світлорозсіювання (наприклад, динамічне світлорозсіювання або статичне світлорозсіювання), які відомі у даній галузі. При різних співвідношеннях ПАР і лікарської речовини утворюються частки/краплі різного розміру з різним ступенем прозорості. Чим менше розмір краплі емульсії, мікроемульсії або міцелярних часток, тим більше прозорість розчину, що утворюється. Типове значення середнього розміру часток для прозорої кінцевої дисперсії становить менше 1 мкм, а для дисперсії з незначним помутнінням або мутної дисперсії розмір часток становить більше 1 мкм. Приклади композицій такого складу з різними прозорістю й розмірами краплі або часток описані у прикладі 7. Таким чином, у додатковому варіанті середній розмір часток композиції становить менше 1 мкм після розведення у модельному шлунковому соку. Фармацевтично прийнятними розчинниками, придатними для застосування у контексті даного винаходу, є пропіленгліколь, поліпропіленгліколь, поліетиленгліколь (наприклад, низькомолекулярний поліетиленгліколь, але не обмежуючись тільки ними, ПЕГ 300, 400, 600 5 UA 105777 C2 5 10 15 20 25 30 35 40 45 50 55 60 тощо), гліцерин, етанол, триацетин, диметилізосорбід, глікофурол, пропіленкарбонат, вода, диметилацетамід або їхня суміш. В одному варіанті принаймні одним розчинником є низькомолекулярний поліетиленгліколь, наприклад, поліетиленгліколь 300, поліетиленгліколь 400, поліетиленгліколь 600 або їх суміші. Кращим розчинником є суміш води, поліетиленгліколя з середньою молекулярною масою більше 300, але менше 600, і пропіленгліколя. Ще більше кращим розчинником є суміш води, пропіленгліколя й поліетиленгліколя 400. В іншому кращому варіанті розчинником є суміш води й поліетиленгліколя 400. Розчинник, або суміш розчинників, становить від 10 мас. % до 90 мас. % у розрахунку на загальну масу композиції, переважно від 60 мас. % до 90 мас. % у розрахунку на загальну масу композиції. У кращому варіанті вода в якості співрозчинника присутня у кількості від 0 до 50 мас. % у розрахунку на загальну масу композиції, більше переважно від 0 до 30 мас. % у розрахунку на загальну масу композиції, навіть більше переважно від 5 до 20 мас. % у розрахунку на загальну масу композиції. У композиціях за даним винаходом переважно практично відсутній пропіленгліколь. У даному контексті "практично відсутній" означає кількість рівну 8 мас. % або менше, більше переважно 2 мас. % або менше пропіленгліколя у композиції. У кращому варіанті у композиції за даним винаходом пропіленгліколь не міститься. У композиціях за даним винаходом також переважно практично відсутні аміни. У даному контексті "практично відсутній" означає кількість рівну 2 мас. % або менше, більше переважно 1 мас. % або менше, навіть більше переважно 0,5 мас. % або менше аміну у композиції. У кращому варіанті у композиції за даним винаходом амін не міститься. У композиціях за даним винаходом практично відсутній ліпід, оскільки такі сполуки істотно впливають на смак. Таким чином, якщо виключити додавання або значно знизити вміст таких речовин, то можна поліпшити смак, насамперед для використання у педіатрії. У даному контексті "практично відсутній" означає кількість рівну 5 мас. % або менше, більше переважно 2 мас. % або менше ліпіду у композиції. У кращому варіанті у композиції даного винаходу ліпід не міститься. Композиція за даним винаходом необов'язково включає додаткові ексципієнти, такі як антиоксиданти (наприклад, α-токоферол, пропілгалат, пальмітат аскорбінової кислоти, БГТ (бутилгідрокситолулол), БГА (бутилгідроксіанізол) або їх суміші) і/або підсолоджувачі (наприклад, сукралоза, ацесульфам калію, натрієва сіль сахарину або їх суміші) і ароматизатори (наприклад, масло тоффі, м'ятне масло, жувальна гумка, ароматизатори виноград, вишня, полуниця або їх суміші). Таким чином, наприклад, переважно, щоб підсолодити або надати аромату лікарській формі, варто додавати зазначені агенти. Фахівці у галузі фармацевтики звичайно можуть вибрати прийнятні підсолоджувачі або ароматизатори. В одному кращому варіанті фармацевтична композиція за даним винаходом включає: а) від 1 мас. % до 40 мас. % сполуки 1 або її фармацевтично прийнятної солі, б) від 2 мас. % до 50 мас. % ПАР, в) від 10 мас. % до 90 мас. % розчинника або суміші розчинників, причому у композиції практично відсутній ліпід або більше переважно ліпід не міститься. В іншому кращому варіанті фармацевтична композиція за даним винаходом містить: а) від 2 мас. % до 10 мас. % сполуки 1 або її фармацевтично прийнятної солі, б) від 10 мас. % до 30 мас. % ПАР, в) від 60 мас. % до 90 мас. % розчинника або суміші розчинників, причому у композиції практично відсутній ліпід або більше переважно ліпід не міститься. У ще одному кращому варіанті фармацевтична композиція за даним винаходом містить: а) від 2 мас. % до 10 мас. % сполуки 1 або її фармацевтично прийнятної солі, б) від 10 мас. % до 30 мас. % вітаміну E-TPGS, в) від 60 мас. % до 90 мас. % суміші води, пропіленгліколя й поліетиленгліколя 400, причому у композиції практично відсутній ліпід або більше переважно ліпід не міститься. В іншому кращому варіанті фармацевтична композиція за даним винаходом містить: а) від 2 мас. % до 10 мас. % сполуки 1 або її фармацевтично прийнятної солі, б) від 10 мас. % до 30 мас. % вітаміну E-TPGS, в) від 60 мас. % до 90 мас. % суміші води й поліетиленгліколя 400, причому у композиції практично відсутній ліпід або більше переважно ліпід не міститься. Додаткові варіанти включають будь-який з чотирьох варіантів, перерахованих вище, де у композиції: (1) практично відсутній пропіленгліколь або не міститься пропіленгліколь, і/або (2) практично відсутній амін або не міститься амін. Приклад методики одержання складів за винаходом полягає у наступному: змішують розчинники при температурі 40-50 °C, додають ПАР і перемішують. Потім додають лікарську 6 UA 105777 C2 5 10 15 20 25 30 35 40 45 50 55 60 речовину й перемішують до повного розчинення. Додають розчинений у воді підсолоджувач і перемішують. Знижують температуру аж до 35-37 °C, додають ароматизатори й перемішують. Самодиспергуючі склади за даним винаходом утворюють міцелярні розчини при змішуванні з водним середовищем. Склад перед введенням можна змішувати з водним середовищем, таким як вода, фруктовий сік тощо. Склад можна проковтувати у рідкому вигляді, при цьому він змішується зі шлунковим соком, утворюючи міцелярний розчин in situ. У певних умовах сполука 1 випадає в осад з розчину при змішуванні складу зі шлунковим соком, що приводить до утворення мутної суспензії або суспензії типу молока. Композиції за даним винаходом можна використовувати для лікування інфекції вірусу гепатиту С (ВГС) і вводити їх за відомою методикою, як описано у патенті США 7585845. Кваліфікований терапевт може вибрати відповідне дозування для кожного конкретного пацієнта з використанням загальних рекомендацій, викладених у зазначеному патенті, і думки медичних працівників з урахуванням віку, розміру, загального стану здоров'я, важкості стану й інших характеристик конкретного пацієнта, що потребує лікування. У прикладах 1-5 описане одержання різних кристалічних форм сполуки 1. Приклад 1 Одержання кристалічної форми сполуки 1 типу А. Аморфну сполуку 1 (партія 7, 13,80 г) завантажували у тригорлу колбу, об'ємом 1000 мл. У колбу додавали чистий етанол (248,9 г). При перемішуванні вміст колби нагрівали зі швидкістю 60 °C/год. до приблизно 74 °C. (Тверді речовини не розчиняються при температурі 74 °C). Потім додавали воду (257,4 г) протягом 4 год., при цьому одержували суспензію при перемішуванні при температурі 74 °C. Після завершення додавання води, температуру поступово знижували до температури навколишнього середовища зі швидкістю 8 °C/год. і потім витримували при зазначеній температурі протягом 6 год. при постійному перемішуванні. Отриману тверду речовину відокремлювали фільтруванням і промивали 50 мл розчину EtOH/вода (1:1). Вологу тверду речовину висушували на лійці протягом 30 хв, продуваючи через осад азот. (Результати порошкової рентгенівської дифракції цього зразка свідчать про те, що зразок являє собою сольват етанолу). Потім тверду речовину висушували при 65-70 °C у вакуумі (Р= 25 мм рт. ст.) у потоці азоту протягом 1,5 год. Структуру отриманої твердої речовини (12,6 г, корегований вихід 95,5 %) підтверджували методом рентгенівської порошкової дифракції, тобто підтверджували відповідність сполуки 1 типу А. Приклад 2 Одержання натрієвої солі сполуки 1 - спосіб 1 2,1 г Аморфної натрієвої солі сполуки 1 і 8,9 г ацетону завантажували у посудину й перемішували при кімнатній температурі протягом 3 год. Суспензію фільтрували (відокремлювали матковий розчин) і отриману тверду речовину висушували протягом 20 хв у потоці азоту. Одержували 1,51 г кристалічної натрієвої солі сполуки 1. Приклад 3 Одержання натрієвої солі сполуки 1 - спосіб 2 15,6 г Сполуку 1 типу А, 175 мл ацетону й 3,6 мл води завантажували у реактор об'ємом 250 мл, і нагрівали до 53 °C для розчинення твердої речовини. 900 мкл 10 н.NaOH додавали у реактор, і у розчин додавали затравку кристалів типу А. Розчин перемішували протягом 10 хв при 53 °C. Додавали другу порцію 900 мкл 10 н.NaOH, і суміш перемішували при 53 °C протягом 30 хв, при цьому утворюється суспензія, яку охолоджували до 19 °C зі швидкістю 15 °C/год. і витримували протягом ночі при 19 °C. Кінцеву отриману суспензію фільтрували й вологу тверду речовину промивали 15 мл ацетону. Тверду речовину висушували протягом 1 год. при 52 °C у вакуумі у потоці азоту, і потім сушили на повітрі протягом ще 1 год. Одержували 12,1 г кристалічної натрієвої солі сполуки 1 у вигляді твердої речовини. Приклад 4 Одержання натрієвої солі сполуки 1 - спосіб 3 25,4 кг Аморфної сполуки 1, 228 л ТГФ і 11,1 кг 10 мас. %-ого водного розчину NaOH завантажували у реактор. Компоненти перемішували при 25 °C до повного розчинення твердої речовини. Отриманий розчин фільтрували, а реактор і фільтр промивали у 23 л ТГФ. 180 л розчинника видаляли при перегонці в атмосферному тиску при 65 °C. Додавали 195 л МІБК (метилізобутилкетон) і 166 л розчинника видаляли при перегонці у вакуумі при температурі приблизно 44 °C. 161 л МІБК і 0,41 кг води знову завантажували у реактор, і вміст нагрівали до 70 °C. Додавали 255 г кристалів натрієвої солі сполуки 1 як затравку при 70 °C, а через 1,5 год. додавали 1,42 л води. Після додавання води суспензію витримували протягом 45 хв при 70 °C і потім охолоджували до 45 °C протягом 1 год. Отриману суспензію фільтрували й промивали у 64 л МІБК, що містить приблизно 0,8 мас. % води. Вологий твердий осад висушували при 55 °C і 7 UA 105777 C2 5 10 15 20 одержували приблизно 25 кг кристалічної натрієвої солі сполуки 1. Приклад 5 Одержання натрієвої солі сполуки 1 - спосіб 4 2,00 г Аморфної сполуки 1, 9,96 г ТГФ і 0,11 г води завантажували у реактор і перемішували при кімнатній температурі до розчинення твердої речовини. 0,820 мл 21 мас. %-ого розчину NaOEt в етанолі додавали по краплях при перемішуванні розчину, при цьому одержували розчин А. 15,9 г n-BuAc (н-бутилацетат) і 160 мкл води завантажували у другий реактор і нагрівали до 65 °C (розчин Б). 2,56 г розчину А додавали у розчин Б при 65 °C і в отриману суміш додавали 40 мг кристалів натрієвої солі сполуки 1 як затравку. Отриману суміш витримували протягом 45 хв при 65 °C. 2,56 г розчину Б додавали у розчин А і витримували протягом 45 хв протягом чотирьох окремих інтервалів часу. Після кінцевого додавання й витримування, суспензію охолоджували до 50 °C протягом 1 год. і фільтрували. Вологий твердий осад промивали 6 мл n-BuAc, що містить 0,5 мас. % води. Отриману тверду речовину висушували при 50 °C у вакуумі у потоці азоту. Одержували кристалічну натрієву сіль сполуки 1 у вигляді твердої речовини. У наступних прикладах представлені додаткові приклади фармацевтичних сполук за даним винаходом. Приклад 6 Фармацевтичні композиції натрієвої солі сполуки 1 Наступні інгредієнти, зазначені у таблицях 4-9, змішували й одержували рідкий склад. Таблиця 4 Композиції перорального розчину натрієвої солі сполуки 1 з різним вмістом лікарського засобу. Інгредієнт Натрієва сіль сполуки 1 Поліетиленгліколь 400 Пропіленгліколь Сукцинат вітаміну Е поліетиленгліколя Вода очищена Сукралоза Масло тоффі М'ятне масло Загальна маса F325, мас. % 2,2 36,5 5,4 F324, мас. % 4,4 34,3 5,4 F145, мас. % 6,3 42,7 7,2 29,6 29,6 26,8 22,4 1,9 2,0 100,0 22,4 1,9 2,0 100,0 13,4 1,8 0,9 0,9 100,0 Таблиця 5 Композиції перорального розчину натрієвої солі сполуки 1 з різним співвідношенням вітаміну Е-TPGS і ЛР. Інгредієнт Натрієва сіль сполуки 1 Поліетиленгліколь 400 Пропіленгліколь Сукцинат вітаміну Е поліетиленгліколя Вода очищена Сукралоза М'ятне масло Масло тоффі F 296 мас. % F 145 мас. % F 331 мас. % F 355 мас. % F 332 мас. % F 333 мас. % F 334 мас. % 2,2 6,3 4,4 4,4 4,4 4,4 4,4 56,1 42,7 45,9 50,4 54,9 57,6 59,4 7,1 7,2 5,4 5,4 5,4 5,4 5,4 17,7 26,8 18,0 13,5 9,0 6,3 4,5 13,3 1,8 0,9 0,9 13,4 1,8 0,9 0,9 22,4 1,9 2,0 22,4 1,9 2,0 22,4 1,9 2,0 22,4 1,9 2,0 22,4 1,9 2,0 8 UA 105777 C2 Продовження таблиці 5 Інгредієнт F 296 мас. % 100,0 F 145 мас. % 100,0 F 331 мас. % 100,0 F 355 мас. % 100,0 F 332 мас. % 100,0 F 333 мас. % 100,0 F 334 мас. % 100,0 Загальна маса Дисперсія, розведена у 25 разів у Незначне Незначне Прозора Прозора Прозора Прозора Мутна шлунковому соку (рН помутніння помутніння 1,2) Таблиця 6 Композиції перорального розчину натрієвої солі сполуки 1, що включають різні комбінації розчинників. Інгредієнт Натрієва сіль сполуки 1 Поліетиленгліколь 400 Пропіленгліколь Сукцинат вітаміну Е поліетиленгліколя Вода очищена Сукралоза М'ятне масло Масло тоффі Загальна маса F 305 мас. % F 304 F 327 F 336 мас. % мас. % мас. % F 299 мас. % F 326 мас. % F 213 мас. % F 212 мас. % 2,2 2,2 2,2 4,4 4,4 4,4 6,3 6,3 45,1 42,4 40,8 39,7 43,0 38,5 23,1 32,0 6,0 7,1 5,7 7,1 26,8 17,9 32,2 30,2 28,3 29,6 28,6 28,2 26,8 26,8 16,1 2,2 1,1 1,1 100,0 15,1 2,1 1,0 1,0 100,0 18,0 1,8 0,9 0,9 100,0 22,4 1,9 2,0 100,0 14,4 1,9 1,0 1,0 100,0 17,9 1,9 1,0 1,0 100,0 13,4 1,8 0,9 0,9 100,0 13,4 1,8 0,9 0,9 100,0 Таблиця 7 Композиції перорального розчину натрієвої солі сполуки 1 з низьким вмістом води. Інгредієнт Натрієва сіль сполуки 1 Поліетиленгліколь 400 Пропіленгліколь Сукцинат вітаміну поліетиленгліколя Вода очищена Сукралоза Масло тоффі Загальна маса F 343, мас. % 4,4 76,3 5,4 F 345, мас. % 4,4 66,3 5,4 5 5 10 5 1,9 2,0 100,0 Е F 344, мас. % 4,4 71,3 5,4 10 1,9 2,0 100,0 10 1,9 2,0 100,0 Таблиця 8 Композиції перорального розчину натрієвої солі сполуки 1, що містять різні ПАР. Інгредієнт Натрієва сіль сполуки 1 Поліетиленгліколь 400 Пропіленгліколь Сукцинат вітаміну поліетиленгліколя Cremophor EL Cremophor RH 40 Вода очищена F 170, мас. % 6 49,6 6,8 Е F 172, мас. % 6 49,6 6,8 F 340, мас. % 6,3 42,8 7,1 12,8 12,8 8,5 12,8 8,5 12,8 26,8 12,8 5 9 UA 105777 C2 Продовження таблиці 8 Інгредієнт Сукралоза М'ятне масло Масло тоффі Загальна маса F 170, мас. % 1,7 0,9 0,9 100,0 F 172, мас. % 1,7 0,9 0,9 100,0 F 340, мас. % 1,8 0,9 0,9 100,0 Таблиця 9 Композиції перорального розчину натрієвої солі сполуки 1, що містять аміни. Інгредієнт Натрієва сіль сполуки 1 Поліетиленгліколь 400 Пропіленгліколь Сукцинат вітаміну Е поліетиленгліколя Вода очищена Трис Сукралоза Масло тоффі Загальна маса 5 10 F 383, мас. % 4,60 54,6 5,4 13,5 17,9 0,2 1,9 2,0 100,0 F 382, мас. % 4,60 54,3 5,4 13,5 17,9 0,4 1,9 2,0 100,0 Приклад 7 Фармацевтичні композиції натрієвої солі сполуки 1. Наступні інгредієнти, перераховані у таблиці 10, змішували й одержували рідкий склад. Відбирали зразок (10 мл) такої композиції й диспергували його при перемішуванні у 250 мл шлункового соку (рН 1,2) протягом 1 год. Зразок отриманої дисперсії аналізували методом статичного світлорозсіювання або методом динамічного світлорозсіювання (інша назва методу: фотон-кореляційна спектроскопія або ФКС). Результати візуальної оцінки й розміри часток зазначені у таблиці 10. Таблиця 10 Композиції перорального розчину натрієвої солі сполуки 1 з різним співвідношенням вітамін E-TPGS і ЛР. Інгредієнт F 331 мас. % 4,4 45,9 5,4 18,0 22,4 1,9 2,0 100,0 Натрієва сіль сполуки 1 Поліетиленгліколь 400 Пропіленгліколь Сукцинат вітаміну Е поліетиленгліколя Вода очищена Сукралоза М'ятне масло Масло тоффі Загальна маса Дисперсія, розведена у 25 разів у Прозора шлунковому соку (рН 1,2) Середній розмір часток, вимірюваний методом динамічного світлорозсіювання 0,064 мкм або ФКС Середній розмір часток (вимірюваний методом статичного світлорозсіювання) 10 F 332 мас. % 4,4 54,9 5,4 9,0 22,4 1,9 2,0 100,0 незначне помутніння F 333 мас. % 4,4 57,6 5,4 6,3 22,4 1,9 2,0 100,0 незначне помутніння 19,21 мкм 16,41 мкм UA 105777 C2 ФОРМУЛА ВИНАХОДУ 1. Рідка фармацевтична композиція, що містить а) у кількості, рівній 4,6 мас. % або менше, сполуку 1 або її фармацевтично прийнятну сіль: 5 S Br NH N MeO O N O H N N CO2H O O O NH O ; (1) 10 15 20 25 б) принаймні від 10 мас. % до 30 мас. % ПАР; та в) принаймні від 60 мас. % до 90 мас. % фармацевтично прийнятного розчинника; при цьому масове співвідношення ПАР і сполуки 1 або її фармацевтично прийнятної солі дорівнює 2,7 або більше; і при цьому композиція практично вільна від ліпіду, і при цьому композиція утворює прозору дисперсію, в якій середній розмір часток становить менше 1 мкм після розведення у модельному шлунковому соку. 2. Фармацевтична композиція за п. 1, де гідрофільно-ліпофільний баланс ПАР становить більше 10. 3. Фармацевтична композиція за п. 1, де ПАР є вітамін E-TPGS, поліетоксильована касторова олія, поліоксилгідрована касторова олія, ефір поліоксіетиленсорбіту й жирної кислоти, каприлокапроїлмакроголгліцерид або їх суміші. 4. Фармацевтична композиція за п. 1, де фармацевтично прийнятним розчинником є пропіленгліколь, поліпропіленгліколь, поліетиленгліколь, гліцерин, етанол, триацетин, диметилізосорбід, глікофурол, пропіленкарбонат, вода, диметилацетамід або їх суміші. 5. Фармацевтична композиція за п. 1, де розчинником є суміш води, поліетиленгліколю з середньою молекулярною масою більше 300, але менше 600 і пропіленгліколю. 6. Фармацевтична композиція за п. 1, що не містить ліпід. 7. Фармацевтична композиція за п. 1, в якій практично відсутній пропіленгліколь. 8. Фармацевтична композиція за п. 1, в якій практично відсутній амін. 9. Рідка фармацевтична композиція, що містить а) у кількості, рівній 6,3 мас. % або менше, сполуку 1 або її фармацевтично прийнятну сіль: 30 11 UA 105777 C2 S Br NH N MeO O N O H N N CO2H O O O NH O ; (1) 5 10 15 20 б) принаймні від 10 мас. % до 30 мас. % ПАР; та в) принаймні від 60 мас. % до 90 мас. % фармацевтично прийнятного розчинника; при цьому масове співвідношення ПАР і сполуки 1 або її фармацевтично прийнятної солі дорівнює 4,3 або більше; і при цьому композиція практично вільна від ліпіду, і при цьому композиція утворює прозору дисперсію, в якій середній розмір часток становить менше 1 мкм після розведення у модельному шлунковому соку. 10. Фармацевтична композиція за п. 9, де гідрофільно-ліпофільний баланс ПАР становить більше 10. 11. Фармацевтична композиція за п. 9, де ПАР є вітамін E-TPGS, поліетоксильована касторова олія, поліоксилгідрована касторова олія, ефір поліоксіетиленсорбіту й жирної кислоти, каприлокапроїлмакроголгліцерид або їх суміші. 12. Фармацевтична композиція за п. 9, де фармацевтично прийнятним розчинником є пропіленгліколь, поліпропіленгліколь, поліетиленгліколь, гліцерин, етанол, триацетин, диметилізосорбід, глікофурол, пропіленкарбонат, вода, диметилацетамід або їх суміші. 13. Фармацевтична композиція за п. 9, де розчинником є суміш води, поліетиленгліколю з середньою молекулярною масою більше 300, але менше 600 і пропіленгліколю. 14. Фармацевтична композиція за п. 9, що не містить ліпід. 15. Фармацевтична композиція за п. 9, в якій практично відсутній пропіленгліколь. 16. Фармацевтична композиція за п. 9, в якій практично відсутній амін. Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition of a potent hcv inhibitor for oral administration
Автори російськоюChen, Feng-Jing, Gel, Juan Francisco, Villagra, Maria Fernanda
МПК / Мітки
МПК: A61K 47/10, A61K 31/44, A61K 47/14, A61K 9/08, A61K 9/10
Мітки: перорального, композиція, введення, ефективного, вгс, фармацевтична, інгібітора
Код посилання
<a href="https://ua.patents.su/14-105777-farmacevtichna-kompoziciya-efektivnogo-ingibitora-vgs-dlya-peroralnogo-vvedennya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція ефективного інгібітора вгс для перорального введення</a>
Попередній патент: Композиція для контролю розвитку рослин