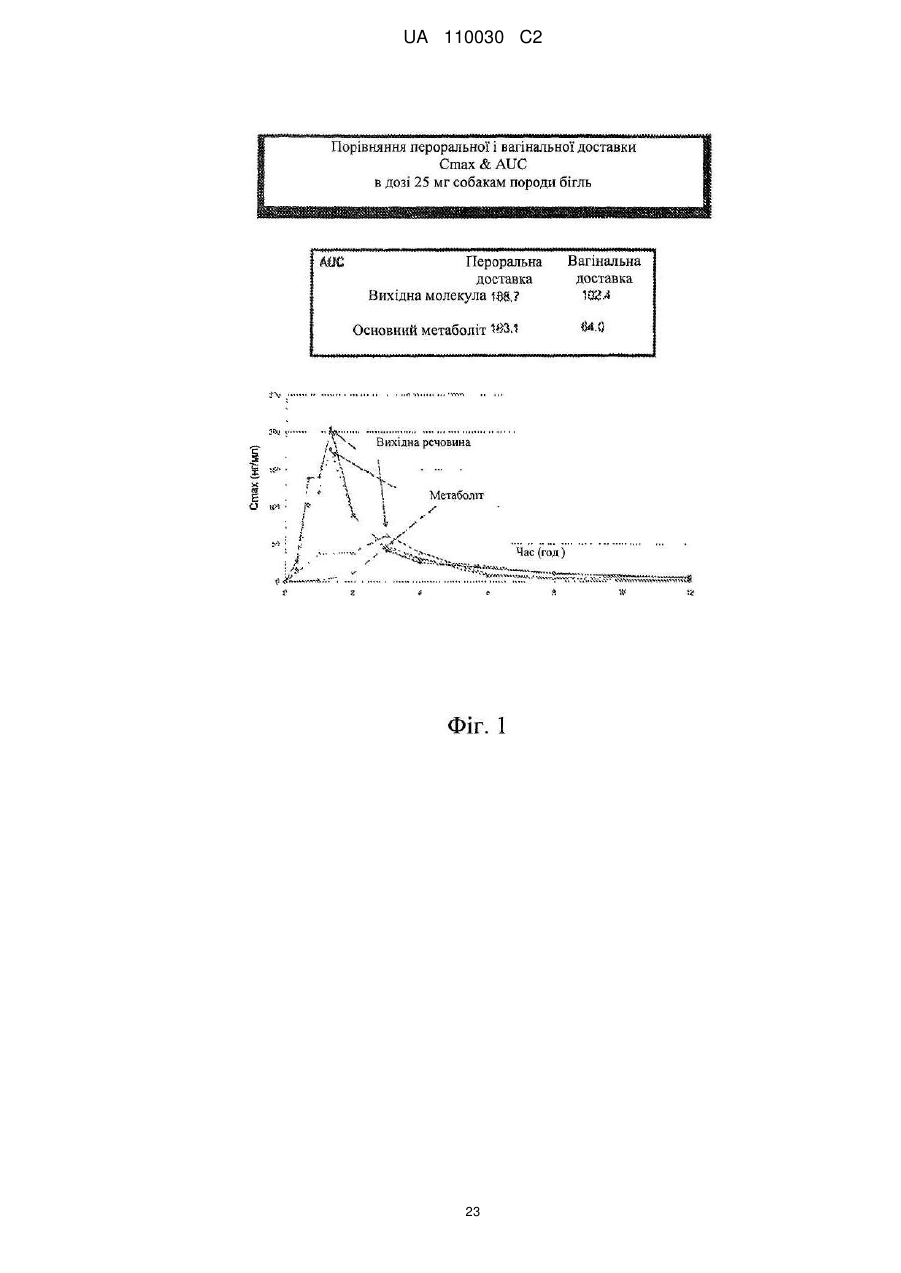
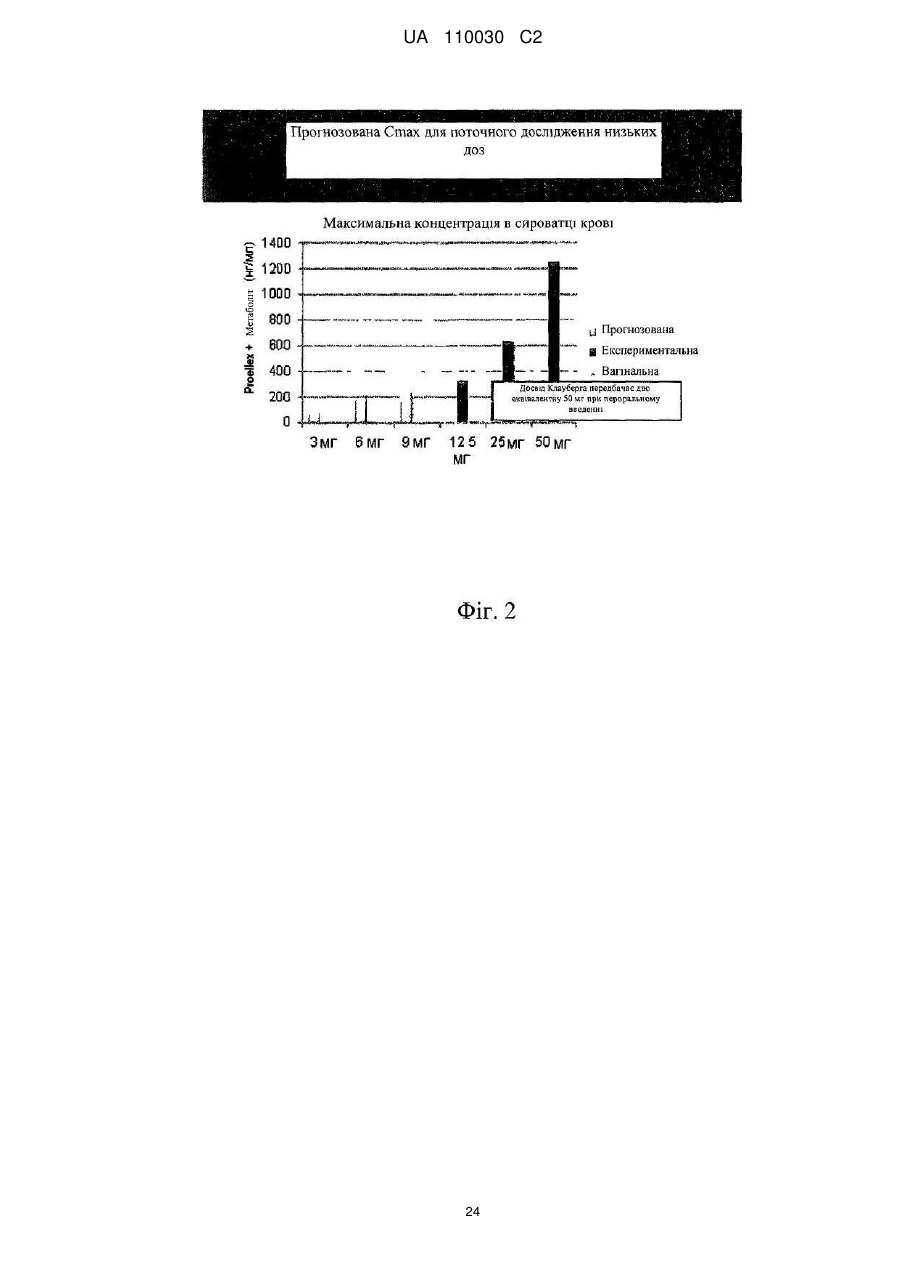
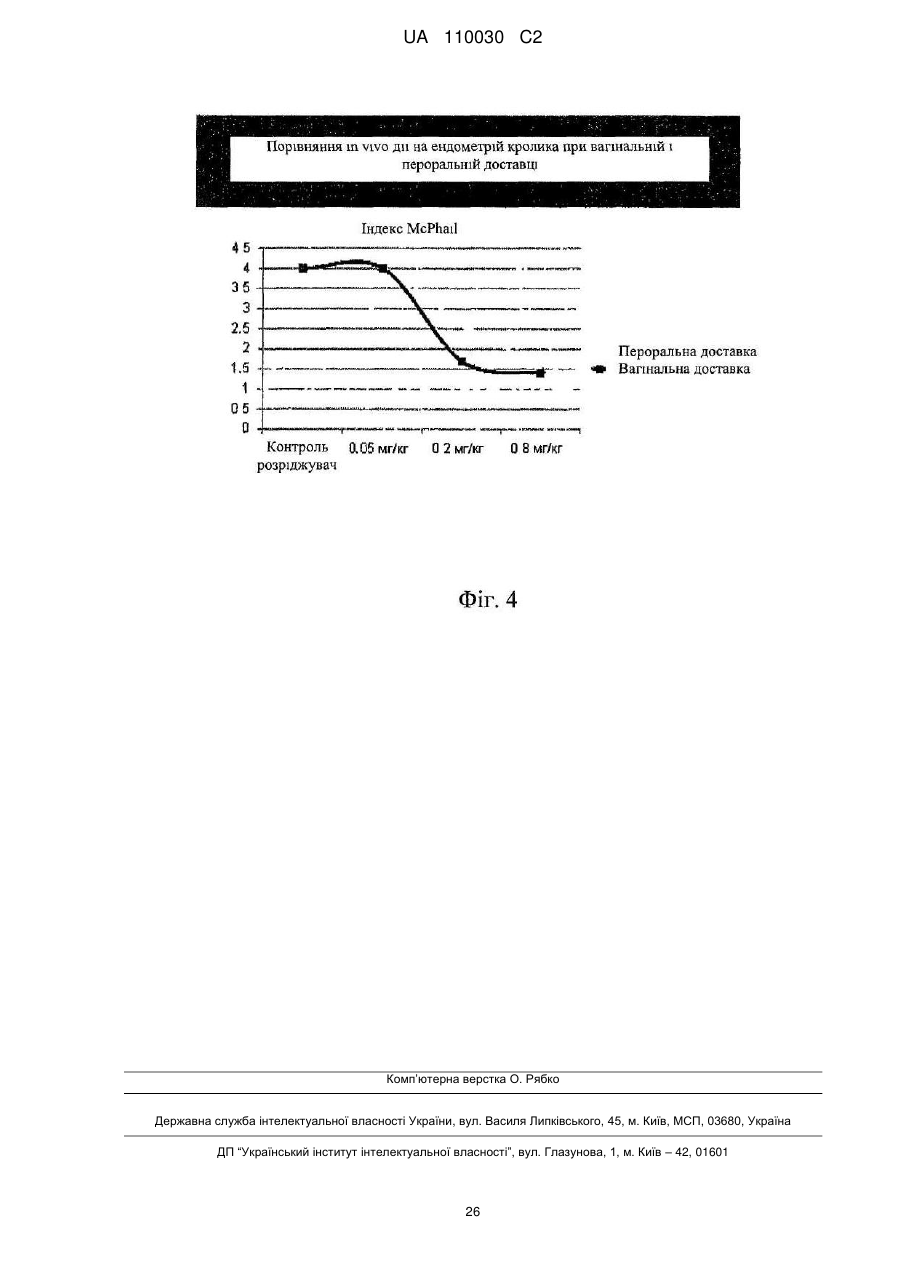
Спосіб лікування ендометріозу або міоми матки і лікарська форма для щоденного введення на слизову піхви жінки
Формула / Реферат
1. Спосіб лікування ендометріозу або міоми матки у жінки, яка потребує цього, що включає введення один раз в день на слизову піхви жінки композиції, яка містить сполуку, вибрану з 21-метоксі-17a-ацетокси-11b-(4-N,N-диметиламінофеніл)-19-норпрегна-4,9-дієн-3,20-діону і 17a-ацетокси-11b-(4-N,N-диметиламінофеніл)-19-норпрегна-4,9-дієн-3,20-діону в дозі 3,125 мг - 12,5 мг протягом періоду, який дорівнює щонайменше 4 місяцям.
2. Спосіб за п. 1, де композиція включає біоадгезивний носій і представлена в формі гелю, крему, таблетки, пігулки, капсули або супозиторія.
3. Спосіб за п. 1, де композиція вводиться щонайменше 12 місяців.
4. Спосіб за п. 1, де композиція представлена в формі твердої дозованої одиниці, вибраної з таблетки, каплети або капсули.
5. Спосіб за п. 1, де композиція включає 21-метоксі-17a-ацетокси-11b-(4-N,N-диметиламінофеніл)-19-норпрегна-4,9-дієн-3,20-діон.
6. Спосіб за п. 1, де композиція включає 17a-ацетокси-11b-(4-N,N-диметиламінофеніл)-19-норпрегна-4,9-дієн-3,20-діон.
7. Спосіб за п. 4, де композиція представлена у формі капсули.
8. Лікарська форма для щоденного введення на слизову піхви жінки, де лікарська форма включає 3,125 мг - 12,5 мг 21-метоксі-17a-ацетокси-11b-(4-N,N-диметиламінофеніл)-19-норпрегна-4,9-дієн-3,20-діону або 17a-ацетокси-11b-(4-N,N-диметиламінофеніл)-19-норпрегна-4,9-дієн-3,20-діону.
9. Лікарська форма за п. 8, де лікарська форма представлена у формі вагінального супозиторія, вагінального вкладиша, здатного плавитися, гелю, крему, таблетки, пігулки, капсули або мазі.
10. Лікарська форма за п. 8, де лікарська форма представлена у формі капсули.
Текст
Реферат: Предмет даного винаходу стосується галузі лікування гормонозалежних станів. Розкривається спосіб лікування ендометріозу або міоми матки у жінки, яка потребує цього, що включає введення один раз в день на слизову піхви жінки композиції, яка містить сполуку, вибрану з 21метоксі-17-ацетокси-11-(4-N,N-диметиламінофеніл)-19-норпрегна-4,9-дієн-3,20-діону і 17ацетокси-11-(4-N,N-диметиламінофеніл)-19-норпрегна-4,9-дієн-3,20-діону в дозі 3,125 мг - 12,5 мг протягом періоду, який дорівнює щонайменше 4 місяцям. UA 110030 C2 (12) UA 110030 C2 UA 110030 C2 5 10 15 20 25 30 35 ОПИС Дана заявка заявляє перевагу згідно з статтею 119(е) 35 Зведення законів США, за попередньою заявкою на патент США № 61/316263, поданою 22 березня 2010 року, зміст якої у всій повноті введений в даний опис у вигляді посилання. ГАЛУЗЬ ТЕХНІКИ, ДО ЯКОЇ НАЛЕЖИТЬ ВИНАХІД У різних варіантах здійснення даний винахід стосується композицій і способів лікування різних гормонозалежних станів, які дозволяють уникнути печінкової токсичності. У деяких варіантах здійснення даний винахід стосується 19-норстероїдних модуляторів прогестеронового рецептора із зниженою печінковою токсичністю. В іншому варіанті даний винахід стосується способів введення антипрогестинів пацієнту, що потребує цього, які, зокрема, діють в обхід першої стадії метаболізму антипрогестину. РІВЕНЬ ТЕХНІКИ Дія стероїдного гормонального прогестерону на репродуктивну систему була добре описана. Наприклад, прогестерон є життєво важливим під час вагітності і її збереження і чинить дію на різні тканини репродуктивної системи. Повідомлялося і про дію прогестерону на тканини за межами репродуктивної системи, але вона не так добре охарактеризована. Антипрогестини, сполуки, які інгібують дію прогестерону, мають значний потенціал для застосування в фармакологічній регуляції фертильності і різних станів і захворювань, таких як рак молочної залози і ендометріоз. Перший описаний антипрогестин, міфепристон (RU 486), є одним з представників ряду похідних 19-нортестостерону з сильною спорідненістю до прогестеронових і глюкокортикоїдних рецепторів і має антипрогестагенну і протиглюкокортикоїдну активність. На основі молекули 19-норпрогестерону були синтезовані різні антипрогестини. Застосування відомих антипрогестинів пов'язане з деякими недоліками, тому вони не ідеально підходять для тривалого застосування. Якби вказані і інші недоліки застосування антипрогестинів в лікуванні можна було б поліпшити, то був би досягнутий значний прогрес в лікуванні гормонозалежних розладів. СУТЬ ВИНАХОДУ В одному варіанті даний винахід надає нові стероїди, які мають ефективну антипрогестагенну активність, мінімальну протиглюкокортикоїдну активність і знижену печінкову токсичність. Точніше, даний винахід надає сполуки загальної формули: 1 і їх фармацевтично прийнятні солі, де R може знаходитися в пара-, орто- або метаположенні і являє собою функціональну групу, включаючи, але без обмеження, алкіл; алкеніл; циклоалкіл; циклоалкеніл; арил; Н; CH 3SO; CH3SО2; ацил (наприклад, форміл, ацетил, пропіоніл, бутирил і т. п.); алкокси (наприклад, -OCH3; - О(CH2)2CH3, О-CH2-CH=CH2); тіоалкокси; тіоалкіл (наприклад, -SCH3); ацилокси (наприклад, ацетокси, пропаноїлокси); Si(CH 3)3; 40 , 1 UA 110030 C2 де Х і Y являють собою ацил; або гетероцикл, що переважно містить щонайменше один атом азоту (наприклад, азиридиніл азириніл азетидиніл, піролідиніл, етоксипіролідиніл, метоксипіролідиніл, пірол 5 етоксиморфолініл, піперидиніл, етоксипіперидиніл, піридиніл оксазиніл, піперазиніл морфолініл, заміщений піперазиніл 2 10 15 20 25 30 35 40 діазиніл і азол, такий як піразол R являє собою функціональну групу, включаючи, але без обмеження, атом водню, атом галогену, алкіл, ацил, гідроксильну групу, алкокси (наприклад, метокси, етокси, вінілокси, етинілокси, циклопропілокси і т. д.), ацилокси (наприклад, формілокси, ацетокси, пропіонілокси, 6 гептаноїлокси, гліцинат і т. д.), алкілкарбонат, ципіонілокси, S-алкіл, S-CN, S-ацил і -OC(О)R , де 6 R являє собою функціональну групу, включаючи алкіл, алкоксіалкіл (наприклад, -CH2OCH3) або 3 алкокси (-OCH3). R являє собою функціональну групу, включаючи, але без обмеження, алкіл (наприклад, метил, метоксиметил), гідроксильну групу, алкокси (наприклад, метокси, етокси, 3 4 метоксиметил і т. д.) і ацилокси, при умові, що R не є ацетоксигрупою або пропінілом. R являє собою функціональну групу, включаючи, але без обмеження, атом водню і алкіл. І нарешті, X 5 5 являє собою функціональну групу включаючи, але без обмеження, =О, =N-OR , де R являє собою атом водню або алкіл, OH, CH2, OAlk1 і OCOAlk2, де Alk1 і Alk2 являють собою C1-C8 алкіл 1 або C7-C15 аралкіл, при умові, що якщо R знаходиться в пара-положенні і являє собою -OCH3, SCH3, -NC4H8, -NC5H10, -NC4H8О, -CHO, -CH(OH)CH3, -COCH3, -О(CH2)2NC4H8 або 5 5 O(CH2)2NC5H10, X не є =О або =N-ОR , де R являє собою водень або алкіл. В іншому варіанті здійснення даний винахід надає способи, де сполуку загальної формули I (або фармацевтичні композиції, що включають сполуки загальної формули I) застосовують для лікування різних гормонозалежних (тобто естроген- і/або прогестеронзалежних) станів у пацієнта, що потребує такого лікування. В іншому варіанті здійснення винаходу сполуки загальної формули I вводяться протягом тривалого періоду для лікування хронічного гормонозалежного стану. В іншому варіанті здійснення винаходу сполуки загальної формули I вводяться будь-яким способом, включаючи пероральне введення (тобто введення в шлунковокишковий тракт суб'єкта). У переважному варіанті здійснення винаходу сполуки загальної формули I вводяться на вагінальну слизову оболонку протягом тривалого лікування хронічного гормонозалежного стану. У ще одному варіанті здійснення даний винахід надає способи введення композицій одного або декількох антипрогестинів (або фармацевтичних композицій, що включають один або декілька антипрогестинів), які не проявляють печінкової токсичності. Антипрогестин може являти собою антипрогестоген (наприклад, антипрогестин може являти собою селективний модулятор рецептора прогестерону (SPRM), сполуку загальної формули I або будь-яку іншу сполуку, яка інгібує дію прогестерону) при умові, що антипрогестин вводиться в кількості, ефективній для лікування прогестеронзалежного стану. В іншому варіанті здійснення винаходу наданий спосіб лікування різних гормонозалежних станів у пацієнта, що потребує такого лікування, що включає введення композиції, що включає один або декілька антипрогестинів способом, який виключає перший етап метаболізму. Переважно композиція вводиться способом, вибраним з групи, що включає черезшкірний, під'язиковий/букальний, внутрішньосудинний, внутрішньом'язовий, підшкірний, інгаляційний, ректальний, вагінальний, внутрішньоматковий і місцевий способи введення. Найбільш 2 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 60 переважно композиція вводиться місцево на вагінальну слизову оболонку для лікування одного або декількох гормонозалежних станів. Гормонозалежні стани, які можна лікувати за допомогою композицій згідно з винаходом, включають, але без обмеження, ендометріоз і біль, пов'язаний з ним, аденоміоз, обмежене розростання ендометріоїдної тканини яєчника, дисменорею, ендокринні гормонозалежні пухлини, фіброму матки, гіперпроліферацію ендометрію, рак яєчника, рак шийки матки і рак молочної залози. Композиції згідно з даним винаходом також можна застосовувати для виклику менструації, для індукування скорочувальної діяльності матки, а також для контрацепції. КОРОТКИЙ ОПИС МАЛЮНКІВ На Фіг. 1 представлене порівняння Cmax (максимальних концентрацій в плазмі) і площ під кривою (AUC) при пероральному і вагінальному введенні CDB-4124 або CDB-4453 в дозі 25 мг собакам породи бігль. На Фіг. 2 представлена фактична Cmax, що спостерігається для Proellex (CDB-4124) і його монодеметильованого метаболіту CDB-4453, при пероральному введенні CDB-4124 в дозах 12,5 мг, 25 мг і 50 мг, а також Cmax, що прогнозуються для доз 3 мг, 6 мг і 9 мг. На Фіг. 2 також представлена фактична Cmax, що спостерігається для Proellex (CDB-4124) і його монодеметильованого метаболіту CDB-4453, при вагінальному введенні CDB-4124 в дозах 12,5 мг, 25 мг і 50 мг. Фіг. 3 ілюструє порівняння інгібування прогестероніндукованої проліферації ендометрію у естрадіол-сенсибілізованих незрілих кроликів після підшкірної ін'єкції і перорального введення CDB-4124. Фіг. 4 ілюструє порівняння антипрогестагенної дії CDB-4124 в трьох дозах при пероральному введенні відносно введення через слизову оболонку піхви на естрадіол-сенсибілізованих незрілих кроликах в присутності прогестерону, що визначається зниженням McPhail індексу. Лікування тільки прогестероном (контроль - розріджувач) забезпечує вимірювання базису прогестагенної активності. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Хоча даний винахід може бути втілений в різних формах, потрібно розуміти, що наведений нижче опис декількох варіантів здійснення винаходу представлений як приклади, і він не призначений для обмеження винаходу його конкретними варіантами здійснення. Заголовки надані виключно для зручності і в будь-якому випадку не повинні розглядатися як обмеження винаходу. Варіанти, представлені під будь-яким заголовком, можуть бути об'єднані з варіантами, представленими під будь-яким іншим заголовком. Потрібно розуміти, що будь-які інтервали, співвідношення і інтервали співвідношень, які можуть бути утворені будь-якими числами або даними, представляють в даному в описі додаткові варіанти здійснення даного винаходу. Це стосується інтервалів, які можуть бути утворені і які включають кінцеві верхні і/або нижні межі або не включають їх. Таким чином, фахівцям буде зрозуміло, що багато які такі відношення, інтервали і інтервали співвідношень можуть бути однозначно отримані з даних і чисел, представлених тут, і всі вони представляють варіанти здійснення винаходу. Перед розкриттям і описом сполук, композицій і способів згідно з даним винаходом потрібно розуміти, що термінологія, що використовується в цьому документі, є термінологією, призначеною для опису конкретних варіантів здійснення і не призначена для обмеження винаходу. Потрібно зазначити, що використовувані в даному описі і прикладеній формулі винаходу форми однини включають множину, якщо контекст явно не наказує інше. Визначення Термін "пероральне" введення означає, що активний агент в препараті призначений для проковтування, тобто призначений для доставки в шлунково-кишковий тракт для абсорбції. Термін "ефективна доза" означає кількість активного компонента композиції, достатню для лікування конкретного стану. Термін "селективні модулятори рецепторів прогестерону" означає сполуки, які впливають на функції рецепторів прогестерону тканиноспецифічним чином. Сполуки виступають як антагоністи рецепторів прогестерону в одних тканинах (наприклад, в тканині молочної залози) і як агоністи рецепторів прогестерону в інших тканинах (наприклад, в матці). Термін "лікувати" або "лікування", що використовується в даному описі, стосується будьякого лікування будь-якого прогестеронзалежного розладу або захворювання і включає, але без обмеження, інгібування розладу або захворювання, купування розвитку розладу або захворювання; полегшення розладу або захворювання, наприклад, виклик регресії розладу або захворювання; або полегшення стану, викликаного захворюванням або розладом, полегшення симптомів захворювання або розладу. 3 UA 110030 C2 5 10 15 20 Термін "запобігання" або "профілактика" відносно прогестеронзалежного розладу або захворювання означає запобігання початку розвитку розладу або захворювання, якщо розладу або захворювання ще немає, або запобігання подальшому розвитку розладу або захворювання, якщо розлад або захворювання вже має місце. Наприклад, композиції даного винаходу можуть застосовуватися для запобігання рецидиву пухлини. Рецидив пухлини може мати місце внаслідок залишкових мікроскопічних груп або гнізд пухлинних клітин, які згодом розвиваються в пухлини, що клінічно виявляються. Термін "агоніст прогестерону" означає сполуку, яка зв'язується з рецептором прогестерону і імітує дію природного гормону. Термін "антагоніст прогестерону" означає сполуку, яка зв'язується з рецептором прогестерону і інгібує дію прогестерону. Термін "по суті не знизилися", що використовується в даному описі з посиланням на рівні гормонів у жінки, означає, що рівні гормонів підтримуються в межах норми в процесі введення композиції згідно з даним винаходом. Таким чином, вважається, що може статися деяке зниження рівня гормонів при умові, що рівень гормонів залишається в межах норми. Термін "по суті не підвищилися", що використовується тут з посиланням на рівні гормонів у жінки, означає, що рівні гормонів підтримуються в межах норми в процесі введення композиції згідно з даним винаходом. Таким чином, вважається, що може статися деяке підвищення рівня гормонів при умові, що рівень гормонів залишається в межах норми. Сполуки В одному аспекті даний винахід стосується сполук загальної формули: , 1 25 і їх фармацевтично прийнятних солей, де R може знаходитися в пара-, орто- або метаположенні і являє собою функціональну групу, включаючи, але без обмеження, -СН(ОН)СН3; алкіл; алкеніл; циклоалкіл; циклоалкеніл; арил; Н; CH 3SO; CH3SО2; ацил (наприклад, форміл, ацетил, пропіоніл, бутирил і т. п.); алкокси (наприклад, -OCH3; -О(CH2)2CH3, -О-CH2-CH=CH2); тіоалкокси; тіоалкіл (наприклад, -SCH3); ацилокси (наприклад, ацетокси, пропаноїлокси); 30 Si(CH3)3; , де Х і Y являють собою ацил; і гетероцикл, що переважно містить щонайменше один атом азоту (наприклад, азиридиніл азириніл азетидиніл, піролідиніл (NС4Н8), заміщений піролідиніл (наприклад, метоксипіролідиніл, етоксипіролідиніл), пірол піперидиніл (-NC5H10), 35 піридиніл морфолініл заміщений піперидиніл (наприклад, (NC4H8O), етоксиморфолініл), оксазиніл, піперазиніл заміщений -О(СН2)2NC5H10), морфолініл (наприклад, заміщений піперазиніл (наприклад, 4 UA 110030 C2 2 5 10 15 20 25 30 35 40 45 50 55 діазиніл і азол, такий як піразол R являє собою функціональну групу, включаючи, але без обмеження, атом водню, атом галогену, алкіл, ацил, гідроксильну групу, алкокси (наприклад, метокси, етокси, вінілокси, етинілокси, циклопропілокси і т. д.), ацилокси (наприклад, формілокси, ацетокси, пропіонілокси, гептаноїлокси, гліцинат і т. 6 6 д.), алкілкарбонат, ципіонілокси, S-алкіл, S-CN, S-ацил і -OC(О)R , де R являє собою функціональну групу, включаючи алкіл, алкоксіалкіл (наприклад, -CH2OCH3) або алкокси (3 OCH3). R являє собою функціональну групу, включаючи, але без обмеження, алкіл (наприклад, метил, метоксиметил), гідроксильну групу, алкокси (наприклад, метокси, етокси, метоксиметил і 3 4 т. д.) і ацилокси при умові, що R не є ацетоксигрупою або пропінілом. R являє собою функціональну групу, включаючи, але без обмеження, атом водню і алкіл. І нарешті, X являє 5 5 собою функціональну групу, включаючи, але без обмеження, =О, =N-OR , де R являє собою водень або алкіл, OH, CH2, OAlk1 і OCOAlk2, де Alk1 і Alk2 являють собою C1-C8 алкіл або C7-C15 1 аралкіл при умові, що якщо R знаходиться в пара-положенні і являє собою -OCH3, -SCH3, NC4H8, -NC5H10, -NC4H8О, -CHO, -CH(OH)CH3, -COCH3, -О(CH2)2NC4H8) або -O(CH2)2NC5H10, X не 5 5 є =О або =N-ОR , де R являє собою водень або алкіл. В одному переважному варіанті здійснення винаходу надана сполука загальної формули I 1 або її фармацевтично прийнятна сіль, де R знаходиться в пара-положенні і являє собою OCH3, -SCH3, -NC4H8 (піролідино), -NC5H10 (піперидино), -NC4H8O (морфоліно), -CHO, CH(OH)CH3, -COCH3, -О(CH2)2NC4H8 (метоксипіролідино) або -О(CH2)2NC5H10 2 (етоксипіперидинофеніл); R являє собою атом водню, атом галогену, алкіл, ацил, гідроксильну групу, алкокси (наприклад метокси, етокси, вінілокси, етинілокси, циклопропілокси і т. д.), ацилокси (наприклад формілокси, ацетокси, пропіонілокси, гептаноїлокси, гліцинат і т. д.), 6 6 алкілкарбонат, ципіонілокси, S-алкіл, S-CN, S-ацил і -OC(О)R , де R являє собою функціональну групу, включаючи алкіл, алкоксіалкіл (наприклад, -CH2OCH3) або алкокси (3 OCH3); R являє собою алкіл (наприклад, метил, метоксиметил), гідроксильну групу, алкокси 3 (наприклад, метокси, етокси, метоксиметил і т. д.) або ацилокси при умові, що R не є 4 ацетоксигрупою або пропінілом; R являє собою атом водню або алкіл; і X являє собою OH, CH2, OAlk1 або OCOAlk2, де Alk1 і Alk2 являють собою C1-C8 алкіл або C7-C15 аралкіл. В іншому переважному варіанті здійснення винаходу надана сполука загальної формули I 1 або її фармацевтично прийнятна сіль, де R знаходиться в мета- або орто-положенні і являє собою -OCH3, -SCH3, -NC4H8 (піролідино), -NC5H10 (піперидино), -NC4H8О (морфоліно), -CHO, CH(OH)CH3, -COCH3, -О(CH2)2NC4H8 (метоксипіролідино) або -О(CH2)2NC5H10 2 (етоксипіперидинофеніл); R являє собою атом водню, атом галогену, алкіл, ацил, гідроксильну групу, алкокси (наприклад, метокси, етокси, вінілокси, етинілокси, циклопропілокси і т. д.), ацилокси (наприклад, формілокси, ацетокси, пропіонілокси, гептаноїлокси, гліцинат і т. д.), 6 6 алкілкарбонат, ципіонілокси, S-алкіл, S-CN, S-ацил і -OC(О)R , де R являє собою функціональну групу, включаючи алкіл, алкоксіалкіл (наприклад, -CH2OCH3) або алкокси (3 OCH3); R являє собою алкіл (наприклад, метил, метоксиметил), гідроксильну групу, алкокси 3 (наприклад, метокси, етокси, метоксиметил і т. д.) або ацилокси при умові, що R не є 4 ацетоксигрупою або пропінілом; R являє собою атом водню або алкіл; і X являє собою =О, =N5 5 OR , де R являє собою водень або алкіл, OH, CH2, OAlk1 або OCOAlk2, де Alk1 і Alk2 являють собою C1-C8 алкіл або C7-C15 аралкіл. У ще одному переважному варіанті здійснення винаходу надана сполука загальної формули 1 I або її фармацевтично прийнятна сіль, де R знаходиться в пара-положенні і являє собою алкіл; алкеніл; циклоалкіл; циклоалкеніл; арил; Н; CH 3SO; CH3SО2; тіоалкокси; Si(CH3)3; , де Х і Y являють собою ацил; азиридиніл, азириніл, азетидиніл, метоксипіролідиніл, етоксиморфолініл, оксазиніл, піперазиніл, 2 метилпіперазиніл, етилпіперазиніл або діазиніл; R являє собою атом водню, атом галогену, алкіл, ацил, гідроксильну групу, алкокси (наприклад, метокси, етокси, вінілокси, етинілокси, циклопропілокси і т. д.), ацилокси (наприклад, формілокси, ацетокси, пропіонілокси, 6 гептаноїлокси, гліцинат і т. д.), алкілкарбонат, ципіонілокси, S-алкіл, S-CN, S-ацил або -OC(О)R , 6 де R являє собою функціональну групу, включаючи алкіл, алкоксіалкіл (наприклад, -CH2OCH3) 3 або алкокси (-OCH3); R являє собою алкіл (наприклад, метил, метоксиметил), гідроксильну 3 групу, алкокси (наприклад, метокси, етокси, метоксиметил і т. д.) або ацилокси при умові, що R 4 не є ацетоксигрупою або пропінілом; R являє собою атом водню або алкіл; і X являє собою =О, 5 UA 110030 C2 5 5 10 15 20 25 30 35 40 45 50 55 5 =N-OR , де R являє собою атом водню або алкіл, OH, CH2, OAlk1 або OCOAlk2, де Alk1 і Alk2 являють собою C1-C8 алкіл або C7-C15 аралалкіл. У ще одному переважному варіанті здійснення винаходу надана сполука загальної формули 1 I або її фармацевтично прийнятна сіль, де R знаходиться в мета- або орто-положенні і являє собою алкіл; алкеніл; циклоалкіл; циклоалкеніл; арил; Н; CH 3SO; CH3SО2; тіоалкокси; Si(CH3)3;, , де X і Y являють собою ацил; азиридиніл, азириніл, азетидиніл, метоксипіролідиніл, етоксиморфолініл, оксазиніл, піперазиніл, 2 метилпіперазиніл, етилпіперазиніл або діазиніл; R являє собою атом водню, атом галогену, алкіл, ацил, гідроксильну групу, алкокси (наприклад, метокси, етокси, вінілокси, етинілокси, циклопропілокси і т. д.), ацилокси (наприклад, формілокси, ацетокси, пропіонілокси, 6 гептаноїлокси, гліцинат і т. д.), алкілкарбонат, ципіонілокси, S-алкіл, S-CN, S-ацил або -OC(О)R , 6 де R являє собою функціональну групу, включаючи алкіл, алкоксіалкіл (наприклад, -CH2OCH3) 3 або алкокси (-OCH3); R являє собою алкіл (наприклад, метил, метоксиметил), гідрокси, алкокси 3 (наприклад, метокси, етокси, метоксиметил і т. д.) або ацилокси при умові, що R не є 4 5 ацетоксигрупою або пропінілом; R являє собою водень або алкіл; і X являє собою =О, =N-OR , 5 де R являє собою атом водню або алкіл, OH, CН2, OAlk1, або OCOAlk2, де Alk1 і Alk2 являють собою C1-C8 алкіл або C7-C15 аралалкіл. 1 Особливо переважними R замісниками, які знаходяться в орто-, мета- або пара-положенні, є -CHO, -COCH3 і гетероцикл, що переважно містить щонайменше один атом азоту, зокрема NC5H10 (піперидино). 2 Особливо переважними R замісниками є алкокси (зокрема, метокси або етокси) і Н. 3 Особливо переважними R замісниками є алкокси (зокрема, метокси або етокси), пропіонілокси, формілокси і метоксиметил. 4 Особливо переважними R замісниками є алкіли, переважно метил. Сполуки загальної формули I можуть бути синтезовані стандартними методами хімічного синтезу, включаючи методи, що використовуються для синтезу сполук, розкритих в патентах США № 6861415 і 6900193, зміст яких введений в даний опис у вигляді посилань. Зокрема, для синтезу сполук згідно з даним винаходом можуть застосовуватися схеми синтезу, подані на Фіг. 1, 2 і 3 в патенті США № 6861415 і на Фіг. 1-11 в патенті США №, в поєднанні з методиками синтезу, відомими в даній галузі техніки. Сполуки загальної формули I містять фенільну групу при C11β, яка є заміщеною в орто-, 1 мета- або пара-положенні (тобто в положенні R загальної формули I) функціональною групою, яка не може метаболізуватися для отримання первинного аміну після введення сполуки. Наприклад, сполуки, що містять диметиламінофенільну групу в C11β положенні піддаються деалкілуванню при введенні з отриманням первинного аміноаніліну (-феніл-NН2) в C11β положенні. Деалкілування проходить в дві стадії: на першій стадії диметиламінофенільна група піддається монодеметилюванню відносно швидко в монометиламінофеніл; на другій стадії в процесі відносно повільної реакції алкільна група, що залишилася, віддаляється з утворенням первинного аміну. Без теоретичного обґрунтування вважається, що анілінові або заміщені анілінові групи (феніл-NRH) можуть виступати як реакційноздатні нуклеофіли, що сприяють несприятливим реакціям в печінці у пацієнтів, яким введені ці сполуки, за допомогою утворення білкових адуктів, зокрема, при довгостроковому введенні у відносно високих дозах. Відповідно, 1 1 R не є первинним, вторинним або третинним аміном. Крім того, R не є функціональною групою, що відрізняється від первинного, вторинного і третинного аміну, яка сама заміщена первинним, вторинним або третинним аміном. Таким чином, сполуки згідно з даним винаходом несподівано можуть застосовуватися для тривалого лікування гормонозалежних розладів. 3 Сполуки загальної формули I також можуть містити в положенні C17α (тобто в положенні R загальної формули I) групи, які не є ацетокси або пропінільною групами. Без теоретичного обґрунтування вважається, що ці фрагменти, коли присутні в C17α положенні, можуть метаболізуватися при введенні в спирт, що може сприяти утворенню білкових аддуктів і печінковій токсичності у пацієнтів, яким введені такі сполуки. В іншому варіанті здійснення даний винахід стосується способів лікування прогестеронзалежного стану введенням однієї або декількох сполук загальної формули I (або фармацевтичної композиції, що включає одну або декілька сполук загальної формули I), як описано вище. Очікується, що сполуки загальної формули I не сприяють несприятливим печінковим реакціям у пацієнтів, які отримують дані сполуки, і, отже, відповідно до даного аспекту даного винаходу, вони можуть вводитися будь-яким способом, включаючи, але без обмеження, пероральне (тобто введення в шлунково-кишковий тракт), під'язикове/букальне, 6 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 60 внутрішньосудинне, внутрішньом'язове, підшкірне, інгаляційне введення, введення в слизову оболонку (наприклад, ректальне або вагінальне) і місцеве введення. У переважному варіанті здійснення винаходу композиція, що включає одну або декілька сполук загальної формули I, вводиться перорально в дозі щонайменше 25 мг/добу, більш переважно щонайменше 50 мг/добу, для лікування гормонозалежного стану протягом періоду, рівного щонайменше 2, 3, 4, 5, 6, 7, 8, 9, 10 або більш місяцям. Способи Даний винахід надає також способи введення антипрогестинів для лікування гормонозалежних (наприклад, прогестеронзалежних) станів, які дозволяють уникнути печінкової токсичності. В одному варіанті здійснення даний винахід стосується способів лікування прогестеронзалежного стану пероральним введенням будь-якого стероїдного антипрогестину, що містить C11β замісник, який не є аміногрупою, N-моноалкіламіногрупою, Nдіалкіламіногрупою або функціональною групою, заміщеною аміно-, N-моноалкіламіно- або Nдіалкіламіногрупою. Наприклад, C11β замісник стероїдного антипрогестину не є N, Nдіалкіламіноарилом, N-моноалкіламіноарилом і аміноарилом. Стероїдний антипрогестин, що містить C11β замісник, який не є аміногрупою, N-моноалкіламіногрупою, N-діалкіламіногрупою або функціональною групою, заміщеною аміно-, N-моноалкіламіно- або N-діалкіламіногрупою, може вводитися перорально в дозі щонайменше 25 мг/добу, більш переважно щонайменше 50 мг/добу протягом періоду, що дорівнює щонайменше 2, 3, 4, 5, 6, 7, 8, 9, 10 або більше місяцям. Типові стероїдні антипрогестини, що містять C11β замісник, який не є аміногрупою, Nмоноалкіламіногрупою, N-діалкіламіногрупою або функціональною групою, заміщеною аміно-, N-моноалкіламіно- або N-діалкіламіногрупою, включають CDB-4119 (17α-ацетокси-11β-(4ацетилфеніл)-21-тіоацетокси-19-норпрегна-4,9-дієн-3,20-діон), CDB-4239 (17α-ацетокси-11β-(4ацетилфеніл)-21-метокси-19-норпрегна-4,9-дієн-3,20-діон), CDB-4241 (17α,21-діацетокси-11β-(4ацетилфеніл)-19-норпрегна-4,9-дієн-3,20-діон), CDB-4176 (17α-ацетокси-11β-(4-ацетилфеніл)19-норпрегна-4,9-дієн-3,20-діон), CDB-4363 (17α-ацетокси-11β-(4(N-піперидино)феніл)-19норпрегна-4,9-дієн-3,20-діон) і інші сполуки, розкриті в патентах США № 6861415 і 6900193. У ще одному варіанті здійснення даний винахід стосується неперорального введення композиції, що включає один або декілька антипрогестинів для лікування гормонозалежного (наприклад, прогестеронзалежного) стану. Антипрогестини згідно з даним аспектом винаходу можуть являти собою будь-який відомий антипрогестин, включаючи сполуки загальної формули I, описані вище. Цей аспект винаходу частково виникає з несподіваного відкриття того, що деякі 19-нортестостерон- або 19-норпрогестерон-похідні антипрогестини можуть проявляти токсичну дію відносно печінки при терапевтичних концентраціях, що обмежує їх клінічне застосування. Зокрема, було встановлено, що у пацієнтів при хронічному щоденному пероральному введенні (тобто при проковтуванні) терапевтичних доз антипрогестину/SPRM CDB-4124 проявляється печінкова токсичність. Великі кількості монодеметильованого метаболіту CDB-4124 виявлені внаслідок фармакокінетичних досліджень у пацієнтів після перорального введення CDB-4124, свідчачи про те, що CDB-4124 піддається значному метаболізму на першій стадії метаболізму в печінці, що зумовлює можливість пошкодження печінки. У переважному варіанті здійснення даний винахід стосується неперорального введення композиції, що включає стероїдний антипрогестин, що містить C11β замісник, який не є аміногрупою, N-моноалкіламіногрупою, N-діалкіламіногрупою або функціональною групою, заміщеною аміно-, N-моноалкіламіно- або N-діалкіламіногрупою, такою як, але без обмеження, CDB-4119, CDB-4239, CDB-4241, CDB-4176 і CDB-4363. Ці сполуки містять C11β замісники, які, як очікується, не утворюють білкових аддуктів в печінці, не чинять токсичної дії на печінку і, крім того, діють в обхід першої стадії метаболізму при непероральному введенні. В іншому варіанті здійснення винаходу сполуки вводяться неперорально в терапевтично ефективній дозі, яка є відносно низькою в порівнянні з терапевтично ефективною дозою сполуки, коли вона вводиться перорально. Наприклад, при введенні місцево на вагінальну слизову оболонку терапевтично ефективна доза може складати менше за 50 мг/добу, менше за 40 мг/добу, менше за 30 мг/добу, менше за 20 мг/добу, менше за 10 мг/добу, менше за 5 мг/добу, може знаходитися в інтервалі від 5 мг/добу до 50 мг/добу, в інтервалі від 5 мг/добу до 40 мг/добу, в інтервалі від 5 мг/добу до 30 мг/добу, в інтервалі від 5 мг/добу до 20 мг/добу або в інтервалі від 5 мг/добу до 10 мг/добу. В іншому варіанті здійснення винаходу ефективна кількість сполуки при місцевому введенні менше ефективної кількості, яка необхідна при системному введенні, наприклад, ефективна кількість при місцевому введенні у вагінальну слизову оболонку може бути в 2, 3, 4, 5, 6, 7, 8, 9 і навіть в 10 разів менше ефективної кількості при системному введенні для лікування ендометріозу, фіброми матки і інших захворювань в даній галузі. 7 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 60 Очікується, що сполуки загальної формули I, які описані вище, проявляють знижену печінкову токсичність або не проявляють її зовсім при доставці як пероральним, так і непероральним способом, що робить їх прийнятними для застосування в лікуванні різних прогестеронзалежних станів при введенні будь-яким способом, включаючи, але без обмеження, пероральний, під'язиковий/букальний, внутрішньосудинний, внутрішньом'язовий, підшкірний, інгаляційний або введення на слизову оболонку (наприклад, ректальне або вагінальне) і місцеве введення. Непероральне введення антипрогестинів, включаючи сполуки загальної формули I, описані вище, може знижувати печінкову токсичність в порівнянні з пероральним введенням цих же сполук. Переважно антипрогестини вводяться способом, при якому дія здійснюється в обхід першої стадії метаболізму, таким як, але без обмеження, внутрішньовенне, внутрішньом'язове, під'язикове введення і введення на слизову оболонку (наприклад, вагінальне, внутрішньоматкове або ректальне). Антипрогестин може являти собою будь-яку сполуку, яка інгібує рецептор прогестерону, таку як специфічний модулятор рецептора прогестерону (SPRM) при умові, що антипрогестин має низьку глюкокортикоїдну активність. Переважно, антипрогестин має низьку естрогенну/протиестрогенну активність, так що рівні вмісту естрогену в сироватці крові пацієнта після введення антипрогестину зберігаються на колишньому рівні. Що стосується різних варіантів здійснення винаходу, описаних нижче, композиції винаходу можуть включати одну або декілька сполук загальної формули I, описаної вище, і в цьому випадку композиція може вводитися перорально або не перорально. Альтернативно, композиція може включити будь-який антипрогестин, який не є сполукою формули I, описаною вище, і в цьому випадку композиція вводиться способом, при якому дія здійснюється в обхід першої стадії метаболізму антипрогестину. В одному варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту з раком молочної залози для лікування раку молочної залози. У переважному варіанті здійснення винаходу пацієнтом є жінка і рак молочної залози експресує рецептор естрогену людини (hER) або рецептор прогестерону людини (hPR), більш переважно експресує hER і hPR. В іншому варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту, що страждає на рак молочної залози з однією або більше пухлинами, резистентними до лікування антиестрогенами, для лікування раку молочної залози. Наприклад, композиції згідно з даним винаходом можуть бути особливо корисні для лікування у пацієнтів резистентного до тамоксифену раку молочної залози. В іншому варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту, який страждає на розлад, вибраний з групи, що включає внутрішньопротоковий рак молочної залози in situ (DCIS), слизоутворювальний (колоїдний) рак, медулярний рак молочної залози, папілярний рак молочної залози, аденоїдно-кістозний рак (ACC), хвороба Педжета соска, запальне захворювання молочної залози, фіброаденому і фіброзно-кістозну мастопатію, для лікування вказаного розладу. У ще одному варіанті здійснення композиція згідно з даним винаходом вводиться жінці, що проходить естрогенну терапію, для запобігання розвитку раку молочної залози у жінки. В іншому варіанті здійснення винаходу композиція вводиться (непероральним) способом, який діє в обхід першої стадії метаболізму і який вибраний з групи, що включає під'язикове/букальне, внутрішньосудинне, внутрішньом'язове, підшкірне, інгаляційне, введення в слизову оболонку (наприклад, ректальне, внутрішньоматкове або вагінальне) і місцеве застосування. У переважному варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту з раком молочної залози в формі черезшкірної пов'язки, гелю або мазі, які наносяться безпосередньо на молочну залозу (наприклад, на сосок або навколососковий кружок) для лікування раку молочної залози. У ще одному варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту, що потребує цього, для пригнічення проліферації ендометрію. У переважному варіанті здійснення винаходу композиція згідно з винаходом вводиться вагінально для пригнічення проліферації ендометрію. В іншому варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту, що потребує цього, для лікування ендометріозу. У переважному варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту вагінально для лікування ендометріозу. В іншому варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту жіночої статі, що потребує цього, для лікування дисменореї. У переважному варіанті здійснення винаходу композиція згідно з винаходом вводиться вагінально пацієнту, що потребує цього, для лікування дисменореї. 8 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 60 У ще одному варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту жіночої статі, що потребує цього, для лікування фіброми матки. У переважному варіанті здійснення винаходу композиція згідно з винаходом вагінально вводиться пацієнту для лікування фіброми матки. У ще одному варіанті здійснення винаходу а композиція згідно з винаходом вводиться пацієнту жіночої статі, що потребує цього, для лікування аденоміозу. У переважному варіанті здійснення винаходу композиція згідно з винаходом вагінально вводиться пацієнту для лікування аденоміозу. У ще одному варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту жіночої статі, що потребує цього, для лікування обмеженого розростання ендометріоїдної тканини. У переважному варіанті здійснення винаходу композиція згідно з винаходом вагінально вводиться пацієнту для лікування обмеженого розростання ендометріоїдної тканини. У ще одному варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту жіночої статі, що потребує цього, для лікування раку яєчника. У переважному варіанті здійснення винаходу композиція згідно з винаходом вводиться вагінально пацієнту для лікування раку яєчника. У ще одному варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту жіночої статі, що потребує цього, для лікування раку шийки матки. У переважному варіанті здійснення винаходу композиція згідно з винаходом вагінально вводиться пацієнту для лікування раку шийки матки. В особливо переважному варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту, що страждає на ендометріоз, дисменорею, фіброму матки, аденоміоз, рак яєчників або рак шийки матки, непероральним способом введення для забезпечення місцевої доставки антипрогестину в уражену область. Антипрогестин може вводитися у прийнятний препарат для такого неперорального місцевого застосування. Наприклад, антипрогестин може вводитися, але без обмеження, в препарат для депо-ін'єкції (наприклад, твердий або на масляній основі для підшкірного або внутрішньом'язового введення) для повільного вивільнення антипрогестину протягом тривалого періоду часу; препарат для внутрішньовагінального введення, такий як вагінальне кільце, що вивільняє гормон, тороїдального перетину; вагінальна свічка; вагінальна пілюля; внутрішньоматковий препарат, такий як внутрішньоматковий пристрій (IUD) або препарат у вигляді матриці; пристрій, що імплантується, для доставки лікарського засобу; гель для місцевого застосування; або черезшкірна пов'язка. Переважно антипрогестин вводиться в препарат в формі вагінального кільця, маточного препарат-депо, вагінальної свічки або т. п., який підтримує повільне, але безперервне вивільнення антипрогестину, що діє місцево, але не системно. У переважному варіанті здійснення винаходу ендометріоз, дисменорея, фіброми матки, аденоміоз, рак яєчника або рак шийки матки лікують інтравагінальним введенням препарату, що містить антипрогестин, у піхву пацієнту, що потребує такого лікування. Потрібно розуміти, що антипрогестин вбирається слизовою оболонкою піхви, яка безпосередньо контактує з інтравагінальним препаратом. Інтравагінальне кільце є переважним препаратом для інтравагінального введення і може розроблятися для забезпечення безперервного вивільнення антипрогестину у піхві. Період введення може складати, наприклад, від 1 до 3 місяців, після чого препарат може бути замінений новим препаратом для забезпечення безперервного тривалого лікування. У ще одному переважному варіанті здійснення винаходу ендометріоз, дисменорею, фіброму матки, аденоміоз, рак яєчника або рак шийки матки лікують введенням вагінальної пілюлі або вагінальної свічки, що містить антипрогестин, у піхву пацієнту, що потребує такого лікування. Вагінальна пілюля і вагінальна свічка можуть бути отримані добре відомими способами з використанням добавок, таких як розріджувач, зв'язувальний агент і основа для свічки, які традиційно застосовуються при отриманні таких препаратів. У ще одному переважному варіанті здійснення винаходу ендометріоз, дисменорею, фіброми матки, аденоміоз, рак яєчника або рак шийки матки лікують введенням внутрішньоматкового препарату, що містить антипрогестин, в порожнину матки пацієнта, що потребує такого лікування. Внутрішньоматковий препарат може являти собою препарат-матрицю, який забезпечує безперервне вивільнення антипрогестину в матку. Період введення внутрішньоматкового препарату може становити приблизно 6 місяців, після чого препарат може бути видалений і введений новий препарат, так що досягається тривале лікування розладу. Внутрішньоматковий препарат може бути отриманий стандартними способами з використанням основи матриці (наприклад, полімеру, включаючи, але без обмеження, силіконовий каучук, 9 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 етиленвінілацетат, етилцелюлозу, карбоксиметилетилцелюлозу, поліетиленгліколь, полівініловий спирт, карбоксивініловий полімер або колаген), інертного внутрішньоматкового пристрою і, необов'язково, прийнятного зшиваючого агента і/або агента, що сприяє вивільненню, такого як полісорбат 60, полісорбат 80, гліцерин, ізопропілпальмітат і ізопропілміристат. Препарат-матриця може бути одношаровим або двошаровим. Форма внутрішньоматкового препарату не обмежена, але є прийнятною для місцевого введення в матку. У ще одному варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту жіночої статі, що потребує цього, для виклику менструації. У ще одному варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту жіночої статі, що потребує цього, для стимулювання пологів. У ще одному варіанті здійснення винаходу композиція згідно з винаходом вводиться пацієнту жіночої статі, що потребує цього, як контрацептиву. Композиції, що включають сполуки загальної формули I, яка описана вище, можуть бути прийнятними для тривалого перорального введення, оскільки очікується, що ці сполуки проявляють знижену печінкову токсичність або не проявляють печінкової токсичності. Альтернативно, антипрогестини (наприклад, сполуки загальної формули I) можуть постійно вводитися способом, який виключає першу стадію метаболізму і, отже, знижує або виключає його метаболізм печінкою. Таким чином, композиції згідно з винаходом можуть вводитися постійно, не викликаючи токсичної дії на печінку. Переважно сполуки мають лише низьку зв'язувальну активність відносно глюкокортикоїдного рецептора і, отже, не впливають несприятливим чином на функції глюкокортикоїдного рецептора. Отже, композиції згідно з винаходом можуть також асоціюватися із зниженими побічними ефектами, такими як перепади настрою, втома і втрата ваги, які звичайно мають місце, коли використовуються антипрогестини з високою спорідненістю до глюкокортикоїдних рецепторів. Переважно сполуки згідно з даним винаходом мають низьку або по суті не мають естрогенної, протиестрогенної і протиандрогенної активності. В одному варіанті здійснення композиція згідно з винаходом, що включає один або декілька антипрогестинів в кількості, ефективній для лікування гормонозалежного стану, вводиться протягом періоду часу, що становить щонайменше 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 або більше днів. Композиція також може вводитися протягом періоду введення, що складає щонайменше 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 або більше місяців. Композиція також може вводитися протягом періоду, що складає щонайменше 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 або більше років. Протягом періоду введення композиція може вводитися щодня або періодично, наприклад через день, раз на місяць і т. п. Композиція також може вводитися з перервами. Наприклад, композиція може вводитися протягом періоду, що становить 1, 2, 3, 4, 5 або більше місяців з подальшою перервою введення, а потім знов вводитися протягом періоду, що становить 1, 2, 3, 4, 5 або більше місяців, і т. д. В одному варіанті здійснення композиція вводиться з перервами, так що у суб'єкта спостерігається менструація протягом щонайменше одного періоду перерви введення. Очікується, що даний підхід дозволяє уникнути несприятливих ефектів, пов'язаних з потовщеним або застійним ендометрієм, які можуть супроводжувати тривале лікування антагоністами прогестерону, таких як кров'янисті виділення, раптова кровотеча, гіперпроліферація ендометрію або рак ендометрію. Щонайменше один, і переважно кожний, період перерви введення має тривалість, достатню для настання у суб'єкта менструації. Більш переважно, у суб'єкта спостерігається менструація протягом кожного періоду переривання введення. В особливо переважному варіанті здійснення винаходу композиція вводиться щодня протягом чотирьох місяців з подальшою перервою введення, протягом якого у пацієнта наступає менструація, потім протягом ще одного періоду введення, що становить чотири місяці, і т. д. В одному варіанті здійснення будь-яка зі стероїдних сполук, розкритих в патентах США № 6861415 і 6900193, можуть вводитися пацієнту способом, який дозволяє уникнути першої стадії метаболізму. У переважному варіанті здійснення винаходу стероїдна сполука являє собою CDB-4124 (21-метоксі-17α-ацетокси-11β-(4-N, N-диметиламінофеніл)-19-норпрегна-4,9-дієн3,20-діон) структурної формули: 10 UA 110030 C2 . 5 10 15 20 25 30 35 40 45 50 Було показано, що CDB-4453 (21-метоксі-17α-ацетокси-11β-(4-N-метиламінофеніл)-19норпрегна-4,9-дієн-3,20-діон), монодеметильоване похідне CDB-4124, має навіть меншу протиглюкокортикоїдну активність, ніж його вихідна сполука (публікація: Attardi et al., 2002, Mol. Cell. Endocrin. 188:111-123, зміст якої введений в даний опис у вигляді посилання). Відповідно, 19-нортестостерон або 19-норпрогестерон-похідні антипрогестини з монометиламін-заміщеним фенільним кільцем в 11β-положенні вуглецю 11, такі як CDB-4453, представляють один тип переважної сполуки для застосування в способах згідно з винаходом; однак оскільки було несподівано встановлено, що дані сполуки і їх дидеметильовані метаболіти чинять токсичну дію на печінку при пероральному введенні, ці сполуки потрібно вводити способом, який дозволяє уникати першої стадії метаболізму. Наприклад, сполука 21-метокси-11β-(4-N-метиламінофеніл)19-норпрегна-4,9-дієн-3,20-діон є переважною сполукою при введенні способом, який дозволяє уникати першої стадії метаболізму, серед сполук, описаних в патентах США № 6861415 і 1 6900193, де R являє собою -NHCH3. Інші сполуки, застосовні у відповідності зі способами згідно з винаходом при введенні способом, який дозволяє уникнути першої стадії метаболізму, включають наступні сполуки: міфепристон (RU-486; 11β-[4-N, N-диметиламінофеніл]-17β-гідрокси-17-(1-пропініл)-естра4,9-дієн-3-он), лілопристон (11β-(4-Ν,Ν-диметиламінофеніл)-17β-гідрокси-17-((Z)-3гідроксипропеніл)екстра-4,9-дієн-3-он), онапристон (11β-(4-N, N-диметиламінофеніл)-17aгідрокси-17-(3-гідроксипропіл)-13α-екстра-4,9-дієн-3-он), асоприсніл (бензальдегід, 4-[(11β,17β)17-метокси-17-(метоксиметил)-3-оксоекстра-4,9-дієн-11-іл]-1-(Е)-оксим; J867), його метаболіт J912 (4-[17β-гідрокси-17α-(метоксиметил)-3-оксоекстра-4,9-дієн-11β-іл]бензальдегід-(1E)-оксим) і інші сполуки, описані в заявках на патент Німеччини 4332283 і 4332284, а також CDB-2914 (17α-ацетокси-11β-(4-N, N-диметиламінофеніл)-19-норпрегна-4,9-дієн-3,20-діон) і інші сполуки, описані в публікації Stratton et al., 2000, Hu. Reprod. 15: 1092-1099. Мається на увазі також, що для застосування в даному винаході прийнятними є JNJ1250132 і інші сполуки, описані в публікації Allan et al., 2006, Steroids 71:949-954; 5-арил-1,2дигідрохромено[3,4-f]хіноліни, описані в публікації Zhi et al., 1998, J. Med. Chem. 41:291-302; 1,4дигідробензо[d][1,3]оксазин-2-они, описані в патентах США № 6509334, 6566358 і 6713478 (Zhang et al.); 1,3-дигідроіндол-2-они, описані в патенті США № 6391907 (Fensome et al.); 2,3дигідро-1H-індоли, описані в патенті США № 6417214 (Ulrich et al.); бензімідазолони і їх аналоги, описані в патенті США № 6380235 (Zhang et al.); 2,1-бензізотіазолін-2,2-діоксиди, описані в патенті США № 6339098 (Collins et al.); циклокарбамати і циклоаміди, описані в патентах США № 6306851 і 6441019 (Santilli et al.); циклічні похідні сечовини і циклічні амід-похідні, описані в патенті США № 6369056 (Zhang et al.); і хіназолінон- і бензоксазин-похідні, описані в Патенті США № 6358948 (Zhang et al.). Інші антипрогестини, які можуть застосовуватися згідно з даним винаходом, включають, але без обмеження, (6α,11β,17β)-11-(4-диметиламінофеніл)-6-метил-4',5'-дигідроспіро[екстра-4,9дієн-17,2'(3'Н)-фуран]-3-он (ORG-31710) і інші сполуки, описані в патенті США № 4871724; (11β,17α)-11-(4-ацетилфеніл)-17,23-епокси-19,24-динорхолу-4,9,20-триєн-3-он (ORG-33628); (7β,11β,17β)-11-(4-диметиламінофеніл-7-метил]-4',5'-дигідроспіро[екстра-4,9-дієн-17,2'(3'Н)фуран]-3-он (ORG-31806) і інші сполуки, описані в патенті США № 4921845; ZK-112993 і інші сполуки, описані в публікації Michna et al., 1992, J. Steroid Biochem. Molec. Biol. 41:339-348; ORG31376; ORG-33245; ORG-31167; ORG-31343; RU-2992; RU-1479; RU-25056; RU-49295; RU46556; RU-26819; LG1127; LG120753; LG120830; LG1447; LG121046; CGP-19984A; RTI-3021012; RTI-3021-022; RTI-3021-020; RWJ-25333; ZK-136796; ZK-114043; ZK-230211; ZK-136798; ZK98229; ZK-98734; і ZK-137316. Крім того, мається на увазі також, що для застосування в даному винаході прийнятними є 11β-арил-4-естрени, такі як (Z)-11β-[(4-диметиламіно)феніл)]-17β-гідрокси-17α-(3-гідрокси-1пропеніл)естр-4-ен-3-он, описаний в патенті США № 5728689; 11β-арилестрен-похідні, описані в 11 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 патентах США № 5843933 і 5843931; 11-бензалдоксимекстрадієн-похідні, такі як 4-[17β-метокси17α-(метоксиметил)-3-оксоекстра-4,9-дієн-11β-іл]бензальдегід-1-(Е)-оксим, описаний в патенті США № 5693628; 11-бензальдоксим-17β-метокси-17α-метоксиметилекстрадієн-похідні, такі як 4[17β-метокси-17α-(метоксиметил)-3-оксоекстра-4,9-дієн-11β-іл]бензальдегід-1-(Е)-[О(етиламіно)карбоніл]оксим, описаний в патенті США № 5576310; S-заміщені складні тіолефіри 1-бензадоксимекстра-4,9-дієнкарбонової кислоти, такі як 4-[17β-метокси-17α-(метоксиметил)-3оксоестра-4,9-дієн-11β-іл]бензальдегід-1-(E)-[O-(етилтіо)карбоніл]оксим, описаний в WO 99/45023; складні стероїдні ефіри, такі як (Z)-6'-(4-ціанофеніл)-9,11α-дигідро-17β-гідрокси-17α-[4(1-оксо-3-метилбутокси)-1-бутеніл]-4'H-нафто[3',2',1';10,9,11]естр-4-ен-3-он, описаний в заявках на патент Німеччини 19652408, 4434488, 4216003, 4216004 і в WO 98/24803; фторовані стероїди з 17α-алкільним ланцюгом, такі як 11β-(4-ацетилфеніл)-17β-гідрокси-17α-(1,1,2,2,2пентафторетил)естра-4,9-дієн-3-он, описаний в WO 98/34947; 17-спірофуран-3'-іліденові стероїди, такі як 11β-(4-ацетилфеніл)-19,24-динор-17,23-епокси-17α-холу-4,9,20-триєн-3-он, описаний в патенті США № 5292878; (Z)-11β,19-[4-(3-піридиніл)-o-фенілен]-17β-гідрокси-17α-[3гідрокси-1-пропеніл]-4-андростен-3-он та інші сполуки, описані в Патенті США № 5439913; 13алкіл-11β-фенілгонани, такі як 11β-[4-(1-метилетеніл)феніл]-17α-гідрокси-17β-(3-гідроксипропіл)13α-естра-4,9-дієн-3-он, описаний в патенті США № 5446036; 11-арилстероїди, такі як 4',5'дигідро-11β-[4-(диметиламіно)феніл]-6β-метилспіро[естра-4,9-дієн-17β,2'(3'H)-фуран]-3-он, описаний в патенті США № 4921845; 11β-арилестрадієни, описані в патентах США № 4829060, 4814327 і 5089488; 11β-арил-4,9-гонадієни і 11β-арил-13-алкіл-4,9-гонадієни, описані в патентах США № 5739125, 5407928 і 5273971; 11β-арил-6-алкіл (або алкеніл, або алкініл) стероїди, описані в EP 289073; 10β,11β-місточкові стероїди, описані в патенті США № 5093507; 11β-арил14β-стероїди, описані в патенті США № 5244886; 19,11β-місточкові стероїди, описані в патентах США № 5095129, 5446178, 5478956 и 5232915; 1-арилсульфоніл-, арилкарбоніл- і 1арилфосфоніл-3-феніл-1,4,5,6-тетрагідропіридазини, описані в патенті США № 5684151; 1арилсульфоніл-, арилкарбоніл- і арилтіокарбонілпіридазино-похідні, описані в патенті США № 5753655; 1,2-дигідро-[1,2-g]хінолін-похідні і 1,2-дигідрохромено[3,4-f]хінолін-похідні, описані в патентах США № 5688808, 5693646, 5693647, 5696127, 5696130 і 5696133; оксастероїди-6похідні (8S, 13S, 14R)-7-оксаестра-4,9-дієн-3,17-діон-1, описані в публікації Kang et al., 2007, Bioorg. Med. Chem. Lett. 15:907-910; і 7-оксастероїди-4, описані в публікації Kang et al., 2007, Bioorg. Med. Chem. Lett. 17:2531-2534. Крім того, передбачається, що прийнятними для застосування згідно з даним винаходом є 19-норстероїди і 19-нор-D-гомостероїди, загальні формули яких розкриті в патентах США № 4386085, 4447424, 4519946 і 4634695, зміст яких у всій повноті введений в даний опис у вигляді посилання. Передбачається також, що прийнятними для застосування згідно з даним винаходом є 11βарилестрадієни, загальна формула I яких розкрита в патенті США № 4536401, зміст якого у всій повноті введений в даний опис у вигляді посилання. Передбачається також, що прийнятними для застосування згідно з даним винаходом є 13aалкілгонани, загальна формула I яких розкрита в патенті США № 4780461, зміст якого у всій повноті введений в даний опис у вигляді посилання. Передбачається також, що прийнятними для застосування згідно з даним винаходом є 11βарилестрадієни, загальна формула I яких розкрита в патенті США № 4609651, зміст якого у всій повноті введений в даний опис у вигляді посилання. Передбачається також, що прийнятними для застосування згідно з даним винаходом є 11βарил-4-естрени формули I, розкриті в патенті США № 5728689, зміст якого у всій повноті введений в даний опис у вигляді посилання. Передбачається також, що прийнятними для застосування згідно з даним винаходом є 11βарил-4-естрен-похідні формули I, розкриті в патентах США № 5843933 і 5843931, зміст яких у всій повноті введений в даний опис у вигляді посилань. Передбачається також, що прийнятними для застосування згідно з даним винаходом є 11арилстероїди, розкриті в патенті США № 4921845, зміст якого у всій повноті введений в даний опис у вигляді посилання. Передбачається також, що прийнятними для застосування згідно з даним винаходом є 11βарилгону-4,9-дієн-3-они формули I, розкриті в патенті США № 5739125, зміст якого у всій повноті введений в даний опис у вигляді посилання. Передбачається також, що прийнятними для застосування згідно з даним винаходом є 11βарилгона-4,9-дієни формули I, розкриті в патенті США № 5407928, зміст якого у всій повноті введений в даний опис у вигляді посилання. 12 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 Передбачається також, що прийнятними для застосування згідно з даним винаходом є оксастероїди сполуки 6, розкриті в публікації Kang et al., Bioorg. Med. Chem. Lett., 17(4):907-910 (2007). Антипрогестинові сполуки, які можуть застосовуватися згідно з даним винаходом, можуть синтезуватися з використанням хімічних методик синтезу, відомих в даній галузі техніки, таких як методики, розкриті в патенті США № 6861415. Потрібно розуміти, що деякі функціональні групи можуть взаємодіяти з іншими реагентам в умовах реакції і, отже, може бути потрібен їх тимчасовий захист. Застосування захисних груп описане в публікації 'Protective Groups in Organic Synthesis', 2nd edition, T.W. Greene & P.G.M. Wutz, Wiley-Interscience (1991). В одному варіанті здійснення винаходу композиції згідно з винаходом включають фармацевтично прийнятну сіль антипрогестину, наприклад, сполуку загальної формули I, яка описана вище. Залежно від технологічних умов сольова сполука може бути представлена в нейтральній або в сольовій формі. Сольові форми включають гідрати і інші сольвати, а також кристалічні поліморфи. Вільні основи, а також і солі цих кінцевих продуктів можуть застосовуватися згідно з даним винаходом. Кислотно-адитивні солі можуть відомими способами перетворюватися у вільну основу з використанням основних реагентів, таких як луги, або іонним обміном. Отримана вільна основа може також утворювати солі з органічними або неорганічними кислотами. При отриманні кислотно-адитивних солей переважно застосовуються кислоти, які утворюють прийнятні фармацевтично прийнятні солі. Прикладами таких кислот є соляна кислота, сірчана кислота, фосфорна кислота, азотна кислота, аліфатична кислота, аліциклічні карбонові або сульфонові кислоти, такі як мурашина кислота, оцтова кислота, пропіонова кислота, янтарна кислота, гліколева кислота, молочна кислота, яблучна кислота, винна кислота, лимонна кислота, аскорбінова кислота, глюконова кислота, фумарова кислота, малеїнова кислота, гідроксималеїнова кислота, пірувінова кислота, аспаргінова кислота, глютамінова кислота, п-гідроксибензойна кислота, памова кислота, етансульфонова кислота, гідроксіетансульфонова кислота, фенілоцтова кислота, мигдалева кислота, галогенбензолсульфокислота, толуолсульфонова кислота, галактарова кислота, галактуронова кислота або нафталінсульфонова кислота. Всі кристалічні поліморфи можуть застосовуватися згідно з даним винаходом. Основно-адитивні солі також можуть застосовуватися згідно з даним винаходом і можуть бути отримані контактуванням вільної кислоти з достатньою кількістю бажаної основи для отримання солі стандартним чином. Вільна кислотна форма може регенеруватися контактуванням сольової форми з кислотою і виділенням вільної кислоти стандартним чином. Фармацевтично прийнятні основно-адитивні солі утворюються з металами або амінами, такими як лужні і лужноземельні метали або органічні аміни. Прикладами металів, що застосовуються як катіони, є натрій, калій, кальцій, магній і т. п. Прикладами прийнятних амінів є амінокислоти, такі як лізин, холін, діетаноламін, етилендіамін, N-метилглюкамін і т. п. Композиції згідно з даним винаходом можуть бути отримані в лікарській формі, що включає стандартну дозу або декілька стандартних доз, що підходять для перорального (тільки у разі сполуки загальної формули I, яка описана вище), під'язикового/букального, парентерального, черезшкірного введення, введення через слизову оболонку (наприклад, вагінальне або ректальне) або місцевого введення. Парентеральне введення включає, але без обмеження, внутрішньовенне, внутрішньоартеріальне, інтраперитонеальне, підшкірне, внутрішньом'язове, інтратекальне і внутрішньосуглобове введення. У ще одному варіанті здійснення винаходу композиції згідно з даним винаходом отримані в формі свічок для ректального введення, які можуть містити основу свічки, включаючи, але без обмеження, масло какао або гліцериди. У ще одному варіанті здійснення винаходу композиції згідно з даним винаходом включають антипрогестин і біоадгезивний носій, такий як носій, описаний в патенті США № 4615697, зміст якого введений в даний опис у вигляді посилання. Біоадгезивний носій може бути в формі гелю, крему, таблетки, пілюлі, капсули, свічки або плівок або в будь-якій іншій фармацевтично прийнятній формі, яка буде прилипати до слизової оболонки піхви. Композиції згідно з даним винаходом можуть також готуватися в формі, що підходить для введення інгаляцією, яка може являти собою, але без обмеження, розчин, суспензію або емульсію, яка може вводитися у вигляді сухого порошку або в формі аерозолю з використанням газу-витискача в аерозольній упаковці, такого як дихлорфторметан або трихлорфторметан. Композиції згідно з даним винаходом можуть також готуватися в формі, що підходить для черезшкірної доставки, наприклад в формі крему, мазі, лосьйону, пасти, гелю, медичного 13 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 60 пластиру, пов'язки або мембран. Такі композиції можуть включати будь-які прийнятні наповнювачі, наприклад добавки, що підвищують проникність, і т. п. Композиції згідно з даним винаходом можуть також готуватися в формі, що підходить для парентерального введення, включаючи, але без обмеження, введення ін'єкцією або безперервним вливанням. Препарати для ін'єкції можуть бути в формі суспензій, розчинів або емульсій в масляних або водних розріджувачах. Такі композиції також можуть постачатися в формі порошку для розбавлення прийнятним розріджувачем, включаючи, але без обмеження, стерильну апірогенну воду, WFI і т. п. Композиції згідно з даним винаходом також можуть готуватися в формі депо-препарату, який може вводитися імплантацією або внутрішньом'язовою ін'єкцією. Такі композиції можуть вводитися в препарат з прийнятними полімерними або гідрофобними матеріалами (наприклад, у вигляді емульсії у відповідному маслі), іонообмінними смолами або у вигляді погано розчинних похідних (наприклад, у вигляді погано розчинної солі). Композиції згідно з даним винаходом також можуть готуватися у вигляді ліпосомного препарату. Ліпосомні препарати можуть включати ліпосоми, які проникають в задані клітини або клітини рогового шару і зливаються з клітинною мембраною, доставляючи таким чином вміст ліпосом в клітину. Наприклад, можуть застосовуватися ліпосоми, описані в патенті США № 5077211 (Yarosh), в патенті США № 4621023 (Redziniak et al.) або в патенті США № 4508703 (Redziniak et al.). Композиція згідно з винаходом може бути в твердій лікарській формі стандартної дози, такій як таблетки (наприклад, суспензійні таблетки, суспензійні таблетки для розкушування, таблетки швидкої дисперсії, жувальні таблетки, шипучі таблетки, двошарові таблетки і т. д.), таблетки у вигляді капсули, капсули (наприклад, м'які або тверді желатинові капсули), порошок (наприклад, розфасований порошок, порошок для отримання дисперсії або шипучий порошок), коржики, саше, облатки, пастилки, пелети, гранули, мікрогранули, інкапсульовані мікрогранули, порошкові аерозольні препарати або будь-яка інша тверда лікарська форма, відповідним чином адаптована для введення. Таблетки можуть бути отримані згідно з будь-яким з множини прийнятних, добре відомих фармацевтичних методів. В одному варіанті здійснення таблетки або інші тверді лікарські форми можуть бути отримані способами, в яких застосовуються один або комбінація способів, включаючи, але без обмеження, (1) сухе змішування, (2) пряму компресію, (3) розмелювання, (4) сухе або неводне гранулювання, (5) мокре гранулювання або (6) плавлення. Окремі стадії в способі мокрого гранулювання отримання таблеток звичайно включають подрібнення і просіювання інгредієнтів, змішування сухого порошку, вологе замішування, гранулювання і кінцеве шліфування. Сухе гранулювання включає компресію порошкоподібної суміші в грубу таблетку або "заготівлю" на ротаційному пресі важкого типу для отримання таблеток. Заготівлі після цього розбивають в гранульовані частинки шліфуванням, звичайно пропускаючи їх через коливний гранулятор. Окремі стадії включають змішування порошків, компресію (отримання заготівель) і шліфування (подрібнення заготівель або гранулювання). Звичайно в будь-якій з цих стадій не використовується ні вологий зв'язувальний матеріал, ні волога. У ще одному варіанті здійснення тверді лікарські форми можуть бути отримані змішуванням антипрогестину з одним або декількома фармацевтичними наповнювачами для утворення по суті гомогенної заготівельної суміші. Заготівельна суміш після цього може розділятися і необов'язково піддаватися додатковій обробці (наприклад, пресуватися, інкапсулюватися, розфасовуватися, диспергуватися і т. д.) в будь-які бажані лікарські форми. Пресовані таблетки можуть бути отримані пресуванням порошку або гранульованої композиції згідно з винаходом. Термін "пресована таблетка" звичайно стосується плоскої таблетки без покриття, що підходить для перорального проковтування, отриманої єдиною компресією або попередньою компресійною перфорацією з подальшим остаточним пресуванням. Таблетки згідно з даним винаходом можуть бути покриті оболонкою або інакше оброблені для надання лікарській формі переваги характеристики більш зручного згортання і зберігання. В одному варіанті здійснення винаходу таке покриття буде вибране таким чином, щоб по суті не затримувати терапевтичну дію композиції згідно з винаходом після введення суб'єкту. Термін "суспензійна таблетка", коли використовується в даному описі, стосується пресованої таблетки, яка швидко дезінтегрує при введенні її у воду. Прийнятні рідкі лікарські форми композиції згідно з винаходом включають розчини, водні або масляні суспензії, еліксири, сиропи, емульсії, рідкі аерозольні препарати, гелі, креми, мазі і т. д. Такі композиції також можуть готуватися в формі сухого продукту для змішування з водою або іншим прийнятним розріджувачем перед застосуванням. 14 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному варіанті здійснення рідкі або напівтверді композиції зберігаються в закритому контейнері при кімнатній температурі, при охолоджуванні (наприклад, при температурі приблизно 5-10 °C) або при температурі замерзання протягом періоду приблизно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 або 12 місяців і зберігають щонайменше приблизно 90 %, щонайменше приблизно 92,5 %, щонайменше приблизно 95 % або щонайменше приблизно 97,5 % вихідної антипрогестинової сполуки. Композиції згідно з винаходом можуть, якщо це бажано, включати один або декілька фармацевтично прийнятних наповнювачів. Термін "наповнювач" в даному описі означає будьяку речовину, яка сама по собі не є терапевтичним засобом, але використовується як носій або розріджувач для доставки терапевтичного агента суб'єкту або додається до фармацевтичної композиції для спрощення роботи з нею або поліпшення її характеристик зберігання або для полегшення процесу отримання препарату композиції стандартної дози. Приклади наповнювачів включають, але без обмеження, розріджувачі, добавки, що викликають дезінтеграцію, зв'язувальні агенти, адгезиви (наприклад, біологічні адгезиви), змочувальні агенти, змазки, добавки, що підвищують ковзання, добавки, що модифікують поверхню, або поверхнево-активні речовини, віддушки, суспендуючі агенти, емульгатори, неводні розріджувачі, консерванти, антиоксиданти, адгезиви, добавки, що регулюють pH і осмотичний тиск (наприклад, буферні добавки), захисні добавки, загусники, підсолоджувачі, смакові добавки, добавки, що приховують смак, барвники, добавки, що підвищує проникну здатність, і речовини, що додаються для поліпшення зовнішнього вигляду композиції. Наповнювачі, що необов'язково застосовуються в композиціях згідно з винаходом, можуть бути твердими, напівтвердими, рідкими або їх комбінаціями. Композиції згідно з винаходом, що містять наповнювачі, можуть бути отримані будь-яким відомим способом фармацевтики, який включає змішування наповнювача з лікарським засобом або терапевтичним засобом. Композиції згідно з даним винаходом необов'язково включають один або декілька фармацевтично прийнятних розріджувачів як наповнювачів. Прийнятні розріджувачі, наприклад, включають окремо або в комбінації, лактозу, включаючи безводну лактозу і моногідрат лактози; крохмаль, включаючи крохмаль, здатний піддаватися безпосередньо пресуванню, і гідролізовані крохмалі (наприклад, Celutab™ і Emdex™); маніт; сорбіт; ксиліт; декстрозу (наприклад, Cerelose™ 2000) і моногідрат декстрози; дигідрат двоосновного фосфату кальцію; розріджувачі на основі сахарози; цукрову пудру; моногідрат одноосновного сульфату кальцію; дигідрат сульфату кальцію; гранульований тригідрат лактату кальцію; декстрати; інозит; гідролізовані зернові крупи; амілозу; целюлози, включаючи мікрокристалічну целюлозу, джерело α- і аморфної целюлози харчових сортів (наприклад, Rexcel™) і порошкоподібну целюлозу; карбонат кальцію; гліцин; бентоніт; полівінілпіролідон; і т. п. Такі розріджувачі, якщо присутні, складають в сумі від приблизно 5 % до приблизно 99 %, від приблизно 10 % до приблизно 85 % або від приблизно 20 % до приблизно 80 % загальної маси композиції. Будьякий вибраний розріджувач або розріджувачі переважно проявляють прийнятні текучі властивості і, коли бажані таблетки, здатність піддаватися пресуванню. Екстрагранульована мікрокристалічна целюлоза (тобто, мікрокристалічна целюлоза, додана до композиції, отриманої мокрим гранулюванням, після стадії сушіння) може застосовуватися для підвищення міцності (для таблетки) і/або зменшення часу дезінтеграції. Композиції згідно з даним винаходом необов'язково включають одну або декілька фармацевтично прийнятних добавок, що викликають дезінтеграцію, як наповнювачів, особливо для таблеток, капсул або інших твердих препаратів. Прийнятні добавки, що викликають дезінтеграцію, включають, окремо або в комбінації, крохмаль, включаючи натрійкрохмалгліколят (наприклад, Explotab™ від Pen West) і прежелатиновані кукурудзяний крохмаль (наприклад, National™ 1551, National™ 1550 і Colocorn™ 1500), глини (наприклад, Veegum™ HV), целюлозу, такий як очищена целюлоза, мікрокристалічна целюлоза, метилцелюлоза, карбоксиметилцелюлоза і натрій-карбоксиметилцелюлоза, кроскармелоза натрію (наприклад, Ac-Di-Sol™ від FMC), альгінати, кросповідон, і смоли, такі як агар, гуар, ксантан, плоди ріжкового дерева, карайя, пектин і трагакантові камеді. Добавки, що викликають дезінтеграцію, можна додавати на будь-якій прийнятній стадії в процесі отримання композиції, зокрема перед стадією гранулювання або під час стадії введення добавок, що підвищують ковзання, перед стадією компресії. Такі добавки, що викликають дезінтеграцію, якщо присутні, складають в сумі від приблизно 0,2 % до приблизно 30 %, від приблизно 0,2 % до приблизно 10 % або від приблизно 0,2 % до приблизно 5 % загальної маси композиції. Композиції згідно з даним винаходом необов'язково включають один або декілька фармацевтично прийнятних зв'язувальних агентів або адгезивів як наповнювачів, зокрема для 15 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 препаратів в формі таблеток. Такі зв'язувальні агенти і адгезиви переважно додають достатню когезію порошку, який піддається таблетуванню, для забезпечення нормальних технологічних операцій, таких як калібрування, змазка, компресія і розфасування, однак не дозволяють таблетці дезінтегруватися і вбратися після проковтування. Прийнятні зв'язувальні агенти і адгезиви включають, окремо або в комбінації, гуміарабіку; трагакант; сахарозу; желатин; глюкозу; крохмаль такий як, але без обмеження, прежелатиновані крохмалі (наприклад, National™ 1511 і National™ 1500); целюлоза, така як, але без обмеження, метилцелюлоза і кармелоза натрію (наприклад, Tylose™); альгінову кислоту і солі альгінової кислоти; алюмосилікат магнію; ПЕГ; гуарову смолу; полісахаридні кислоти; бентоніти; повідон, наприклад повідон К-15, K-30 і K-29/32; поліметакрилати; HPMC; гідроксипропілцелюлозу (наприклад, Klucel™); і етилцелюлозу (наприклад, Ethocel™). Такі зв'язувальні агенти і/або адгезиви, якщо присутні, складають в сумі від приблизно 0,5 % до приблизно 25 %, від приблизно 0,75 % до приблизно 15 % або від приблизно 1 % до приблизно 10 % загальної маси композиції. Композиції згідно з даним винаходом необов'язково включають один або декілька фармацевтично прийнятних змочувальних агентів як наповнювачів. Необмежувальні приклади поверхнево-активних речовин, які можуть застосовуватися як змочувальні агенти в композиціях згідно з даним винаходом, включають четвертинні амонієві сполуки, наприклад хлорид бензалконію, хлорид бензетонію і хлорид цетилпіридинію, діоктилнатрійсульфосукцинат, простий поліоксіетиленалкілфенілові ефіри, наприклад ноноксинол 9, ноноксинол 10 і октоксинол 9, полоксамери (блокспівполімери поліоксіетилену і поліоксипропілену), гліцериди поліоксіетиленжирних кислот і масла, наприклад моно- і дигліцериди поліоксіетилен (8) каприлової/капринової кислоти (наприклад, Labrasol™ від Gattefosse), поліоксіетилен (35) касторова олія і поліоксіетилен (40) гідрована касторова олія; простий поліоксіетиленалкілові ефіри, наприклад простий поліоксіетилен (20) цетостеариловий ефір, складні ефіри поліоксіетилену і жирних кислот, наприклад поліоксіетилен (40) стеарат, складні поліоксіетиленсорбітанефіри, наприклад полісорбат 20 і полісорбат 80 (наприклад, Tween™ 80 від ICI), складний ефір пропіленгліколю і жирних кислот, наприклад пропіленглікольлаурат (наприклад, Lauroglycol™ від Gattefosse), натрійлаурилсульфат, жирні кислоти і їх солі, наприклад олеїнову кислоту, олеат натрію і триетанололеат, складні гліцеринефіри жирних кислот, наприклад гліцеринмоностеарат, складні сорбітанефіри, наприклад сорбітанмонолаурат, сорбітанмоноолеат, сорбітанмонопальмітат і сорбітанмоностеарат, тилоксапол і їх суміші. Такі змочувальні агенти, якщо присутні, складають в сумі від приблизно 0,25 % до приблизно 15 %, від приблизно 0,4 % до приблизно 10 % або від приблизно 0,5 % до приблизно 5 % загальної маси композиції. Композиції згідно з даним винаходом необов'язково включають одну або декілька фармацевтично прийнятних змазок (включаючи антиадгезиви і/або добавки, що підвищують ковзання) як наповнювачів. Прийнятні змазки включають, окремо або в комбінації, гліцерилбегапат (наприклад, Compritol™ 888); стеаринову кислоту і її солі, включаючи магнієву (стеарат магнію), кальцієву і натрієву солі стеаринової кислоти; гідровані рослинні олії (наприклад, Sterotex™); колоїдний діоксид кремнію; тальк; віск; борну кислоту; бензоат натрію; ацетат натрію; фумарат натрію; хлорид натрію; DL-лейцин; ПЕГ (наприклад, Carbowax™ 4000 і Carbowax™ 6000); олеат натрію; натрійлаурилсульфат; і магнійлаурилсульфат. Такі змазки, якщо присутні, складають в сумі від приблизно 0,1 % до приблизно 10 %, від приблизно 0,2 % до приблизно 8 % або від приблизно 0,25 % до приблизно 5 % загальної маси композиції. Прийнятні антиадгезиви включають тальк, кукурудзяний крохмаль, DL-лейцин, натрійлаурилсульфат і солі стеаринової кислоти і металів. Тальк являє собою антиадгезив або добавку, що підвищує ковзання, і використовується, наприклад, для зниження налипання препарату на поверхні обладнання, а також для зниження накопичення статичної електрики в суміші. Один або декілька антиадгезивів, якщо присутні, складають від приблизно 0,1 % до приблизно 10 %, від приблизно 0,25 % до приблизно 5 % або від приблизно 0,5 % до приблизно 2 % загальної маси композиції. Добавки, що підвищують ковзання, можуть застосовуватися для сприяння текучості порошку твердого препарату. Прийнятні добавки, що поліпшують ковзання, включають колоїдний діоксид кремнію, крохмаль, тальк, триосновний фосфат кальцію, порошкоподібні целюлозу і трисилікат магнію. Колоїдний діоксид кремнію є особливо переважним. Композиції згідно з даним винаходом можуть включати один або декілька піногасників. Симетикон являє собою приклад піногасника. Піногасники, якщо присутні, складають від приблизно 0,001 % до приблизно 5 %, від приблизно 0,001 % до приблизно 2 % або приблизно 0,001 % до приблизно 1 % загальної маси композиції. 16 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 60 Типові приклади антиоксидантів для застосування в даному винаході включають, але без обмеження, бутильований гідрокситолуол, бутильований гідроксіанізол, метабісульфат калію і т. п… Один або декілька антиоксидантів, якщо це бажано, звичайно присутні в композиції згідно з винаходом в кількості від приблизно 0,01 % до приблизно 2,5 %, наприклад від приблизно 0,01 %, приблизно 0,05 %, приблизно 0,1 %, приблизно 0,5 %, приблизно 1 %, приблизно 1,5 %, приблизно 1,75 %, приблизно 2 %, приблизно 2,25 % або приблизно 2,5 % по масі. У різних варіантах здійснення винаходу композиції згідно з даним винаходом можуть включати консервант. Прийнятні консерванти включають, але без обмеження, хлорид бензалконію, метил-, етил-, пропіл- або бутилпарабен, бензиловий спирт, фенілетиловий спирт, бензетоній, метил- або пропіл-п-гідроксибензоат і сорбінову кислоту або їх комбінації. Звичайно необов'язковий консервант присутній в кількості від приблизно 0,01 % до приблизно 0,5 % або від приблизно 0,01 % до приблизно 2,5 % по масі. В одному варіанті здійснення винаходу композиції згідно з даним винаходом необов'язково включають буферний агент. Буферні агенти включають агенти, які зменшують зміну значення рН. Типові класи буферних агентів для застосування в різних варіантах здійснення даного винаходу включають сіль металу IA групи, наприклад, бікарбонатну сіль металу IA групи, карбонатну сіль металу IA групи, буферний агент лужного або лужноземельного металу, алюмінієвий буферний агент, кальцієвий буферний агент, натрієвий буферний агент або магнієвий буферний агент. Прийнятні буферні агенти включають карбонати, фосфати, бікарбонати, цитрати, борати, ацетати, фталати, тартрати, сукцинати будь-якого з вищезгаданих агентів, наприклад, фосфат, цитрат, борат, ацетат, бікарбонат і карбонат натрію або калію. Необмежувальні приклади прийнятних буферних агентів включають гідроксид алюмінію, гідроксид магнію, гліцинат алюмінію, ацетат кальцію, бікарбонат кальцію, борат кальцію, карбонат кальцію, цитрат кальцію, глюконат кальцію, гліцерофосфат кальцію, гідроксид кальцію, лактат кальцію, фталат кальцію, фосфат кальцію, сукцинат кальцію, тартрат кальцію, дигідрофосфат натрію, дигідрофосфат калію, гідрофосфат калію, гідрофосфат натрію, двонатрієвий сукцинат, гідроксид алюмінію в формі сухого гелю, ацетат магнію, алюмінат магнію, борат магнію, гідрокарбонат магнію, карбонат магнію, цитрат магнію, глюконат магнію, гідроксид магнію, лактат магнію, метасилікаалюмінат магнію, оксид магнію, фталат магнію, фосфат магнію, силікат магнію, сукцинат магнію, тартрат магнію, ацетат калію, карбонат калію, гідрокарбонат калію, борат калію, цитрат калію, метафосфат калію, фталат калію, фосфат калію, поліфосфат калію, пірофосфат калію, сукцинат калію, тартрат калію, ацетат натрію, бікарбонат натрію, борат натрію, цитрат натрію, глюконат натрію, дигідрофосфат натрію, гідроксид натрію, лактат натрію, фталат натрію, фосфат натрію, поліфосфат натрію, пірофосфат натрію, сесквікарбонат натрію, сукцинат натрію, тартрат натрію, триполіфосфат натрію, синтетичний гідротальцит, тетрапірофосфат калію, тетрапірофосфат натрію, трифосфат калію, трифосфат натрію і трометамол (Based in part upon the list provided in The Merck Index, Merck & Co. Rahway, N.J. (2001)). Крім того, в фармацевтичних композиціях згідно з винаходом можуть застосовуватися комбінації або суміші будь-яких двох або декількох перерахованих вище буферних агентів. Один або декілька буферних агентів, якщо треба, присутні в композиціях згідно з даним винаходом в кількості від приблизно 0,01 % до приблизно 5 % або від приблизно 0,01 % до приблизно 3 % по масі. У різних варіантах здійснення винаходу композиції згідно з винаходом можуть включати одну або декілька добавок, які підвищують в'язкість. Типові приклади добавок, які підвищують в'язкість, включають, але без обмеження, метилцелюлозу, натрій-карбоксиметилцелюлозу, етилцелюлозу, карагінан, карбопол і/або їх комбінації. Звичайно одна або декілька добавок, що підвищують в'язкість, якщо це бажано, присутні в композиціях згідно з даним винаходом в кількості від приблизно 0,1 % до приблизно 10 % або приблизно 0,1 % до приблизно 5 % по масі. У різних варіантах здійснення винаходу композиції згідно з даним винаходом включають органолептичну добавку для поліпшення органолептичних властивостей композиції. Термін "органолептична добавка" в даному описі стосується будь-якого наповнювача, який може поліпшувати смак або запах або сприяти прихованню неприємного смаку або запаху композиції згідно з винаходом. Такі добавки включають підсолоджувачі, смакові добавки і/або добавки, що маскують смак. Прийнятні підсолоджувачі і/або смакові добавки включають будь-яку добавку, яка підсолоджує або надає приємного смаку фармацевтичної композиції. Необов'язкові органолептичні добавки звичайно присутні в композиції згідно з винаходом в кількості від приблизно 0,1 мг/мл до приблизно 10 мг/мл, від приблизно 0,5 мг/мл до 5 мг/мл або приблизно 1 мг/мл. 17 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 60 Типові приклади підсолоджувачів або добавок, що поліпшують смак, включають, але без обмеження, сироп акації, анетол, анісову олію, ароматичний еліксир, бензальдегід, еліксир на основі бензальдегіду, циклодекстрини, кмин, кминну олію, кардамонну олію, насіння кардамону, кардамонний лікер, кардамонну настойку, вишневий сік, вишневий сироп, корицю, коричну олію, коричну воду, лимонну кислоту, сироп лимонної кислоти, гвоздичну олію, какао, сироп какао, коріандрову олію, декстрозу, ериодиктіон, рідкий екстракт ериодиктіону, сироп ериодиктіону ароматичний, етилацетат, етилванілін, фенхелеву олію, імбир, рідкий екстракт імбиру, екстракційне імбирну олію, декстрозу, глюкозу, цукор, мальтодекстрин, гліцерин, солодку, еліксир солодки, екстракт солодки, чистий екстракт солодки, рідкий екстракт солодки, сироп солодки, мед, еліксир на основі ізоспиртів, лавандову олію, лимонну олію, лимонну настойку, маніт, метилсаліцилат, мускатну олію, апельсинову гірку настойку у вигляді еліксиру, апельсинову гірку настойку у вигляді олії, олію кольорів апельсина, флердоранжеву есенцію, апельсинове ефірне масло, гірку настойку цедри апельсину, солодку настойку цедри апельсину, спиртову настойку апельсину, апельсиновий сироп, м'яту перечную, масло м'яти перцевої, спиртову настойку м'яти перцевої, м'ятну есенцію, фенілетиловий спирт, сік малини, малиновий сироп, розмаринову олію, трояндову олію, трояндову есенцію, сахарин, сахарин кальцію, сахарин натрію, сироп сарсапарелю, сарсапарель, розчин сорбіту, м'яту кучеряву, олію кучерявої м'яти, сахарозу, сироп сукралози, тим'янову олію, толуанський бальзам, сироп толуанського бальзаму, ваніль, ванільну настойку, ванілін, черешневий сироп або їх комбінації. Типові приклади добавок, що приховують неприємний смак, включають, але без обмеження, циклодекстрини, циклодекстринові емульсії, частинки циклодекстринів, циклодекстринові комплекси або їх комбінації. Типові приклади суспендуючих агентів включають, але без обмеження, сиропсорбіту, метилцелюлозу, сироп глюкози/цукровий сироп, желатин, гідроксіетилцелюлозу, карбоксиметилцелюлозу, гель стеарату алюмінію і гідровані харчові жири. Типові приклади емульгаторів включають, але без обмеження, лецитин, сорбітанмоноолеат і аравійську камедь. Неводні розріджувачі включають, але без обмеження, харчові жири, мигдалеву олію, фракціоновану кокосову оляю, маслянистий складний ефір, пропіленгліколь і етиловий спирт. Перераховані вище наповнювачі можуть виконувати множину ролей, як відомо в даній галузі техніки. Наприклад, крохмаль може служити наповнювачем, а також як добавка, що викликає дезінтеграцію. Мається на увазі, що класифікація наповнювачів, представлена вище, не є обмежувальною. Композиції згідно з даним винаходом можуть вводитися будь-яким способом, включаючи, але без обмеження, пероральне, парентеральне, під'язикове, черезшкірне, ректальне введення, введення в слизову оболонку, місцеве введення, введення за допомогою інгаляції, букальне введення або їх комбінації. Парентеральне введення включає, але без обмеження, внутрішньовенне, внутрішньоартеріальне, інтраперитонеальне, підшкірне, внутрішньом'язове, інтратекальне, внутрішньосуглобове, інтрацистернальне і внутрішньошлуночкове введення. Терапевтично ефективна кількість композиції, необхідна для застосування в терапевтичному лікуванні, змінюється залежно від періоду часу, протягом якого бажана дана активність, віку і стану пацієнта, що підлягає лікуванню, а також деяких інших факторів, і в кінцевому результаті визначається лікуючим лікарем. Однак звичайно дози, що застосовуються для лікування людини, знаходяться в інтервалі від приблизно 0,001 мг/мг до приблизно 500 мг/кг на добу, наприклад від приблизно 1 мкг/кг до приблизно 1 мг/кг на добу або від приблизно 1 мкг/мг до приблизно 100 мкг/кг на добу. Для найбільших ссавців загальна добова доза складає від приблизно 1 до 100 мг, переважно від приблизно 2 до 80 мг. Схема лікування може коректуватися для забезпечення оптимальної терапевтичної відповіді. Бажана доза може стандартно вводитися в разовій дозі або поділятися на множину доз, що вводяться через прийнятні інтервали, наприклад, вводитися в двох, трьох, чотирьох або більшій кількості невеликих доз на добу. Звичайно композиція згідно з винаходом може вводитися суб'єкту для забезпечення суб'єкта антипрогестином в кількості від приблизно 1 мкг/кг до приблизно 1 мг/кг маси тіла, наприклад приблизно 1 мкг/кг, приблизно 25 мкг/кг, приблизно 50 мкг/кг, приблизно 75 мкг/кг, приблизно 100 мкг/кг, приблизно 125 мкг/кг, приблизно 150 мкг/кг, приблизно 175 мкг/кг, приблизно 200 мкг/кг, приблизно 225 мкг/кг, приблизно 250 мкг/кг, приблизно 275 мкг/кг, приблизно 300 мкг/кг, приблизно 325 мкг/кг, приблизно 350 мкг/кг, приблизно 375 мкг/кг, приблизно 400 мкг/кг, приблизно 425 мкг/кг, приблизно 450 мкг/кг, приблизно 475 мкг/кг, приблизно 500 мкг/кг, приблизно 525 мкг/кг, приблизно 550 мкг/кг, приблизно 575 мкг/кг, приблизно 600 мкг/кг, приблизно 625 мкг/кг, приблизно 650 мкг/кг, приблизно 675 мкг/кг, приблизно 700 мкг/кг, 18 UA 110030 C2 5 10 приблизно 725 мкг/кг, приблизно 750 мкг/кг, приблизно 775 мкг/кг, приблизно 800 мкг/кг, приблизно 825 мкг/кг, приблизно 850 мкг/кг, приблизно 875 мкг/кг, приблизно 900 мкг/кг, приблизно 925 мкг/кг, приблизно 950 мкг/кг, приблизно 975 мкг/кг або приблизно 1 мг/кг маси тіла. Пацієнти, що одержують лікування за допомогою композицій згідно з даним винаходом, повинні в плановому порядку контролювати рівні естрогену і глюкокортикоїдів в сироватці крові. Далі для кращого розуміння винаходу представлені приклади, які, однак, не обмежують галузь даного винаходу. Приклад 1. Препарати згідно з даним винаходом можуть бути отримані в формі таблеток Для отримання таблеток для практичного застосування даного винаходу в пресі для отримання таблеток спільно пресували наступні інгредієнти: 10,0 мг 140,5 мг 69,5 мг 2,5 мг 2,0 мг 9,5 мг 15 Для отримання масляних препаратів для практичного застосування даного винаходу змішували і завантажували в ампули наступні інгредієнти: 100,0 мг 343,4 мг 608,6 мг 20 25 30 35 40 45 21-метокси-11β-(4-N, N-диметиламінофеніл)19-норпрегна-4,9-дієн-3,20-діону лактози кукурудзяного крохмалю полі-N-вінілпіролідону аеросилу стеарату магнію 21-метокси-11β-(4-N, N-диметиламінофеніл) -19-норпрегна-4,9-дієн-3,20-діону касторової олії бензилбензоату Приклад 2. Кількісне визначення in vitro зв'язувальної спорідненості антипрогестинів Біологічні дослідження для визначення конкурентного зв'язування проводили з використанням цитозольних препаратів. Цитозол для кількісного визначення зв'язування з прогестероновим рецептором (PR) і глюкокортикоїдним рецептором (GR) кролика отримували з матки або вилкочкової залози, відповідно, естрадіол-сенсибілізованих незрілих кроликів. Для зв'язування з матковим PR кролика приготовляли препарат цитозолу, що містить PR матки кролика, в TEGMD буфері (10 мM Tris, pH 7,2, 1,5 мM EDTA, 0,2 мM молібдату натрію, 10 % гліцерину, 1 мM DTT) і отриманий 3 препарат інкубували з 6 нM 1,2-[ H]прогестерону (NEN Life Science Products; 52 Ci/ммоль); сполуки, що випробовується, додавали в концентраціях від 2 до 100 нM. Для зв'язування з GR вилочкової залози кролика препарат цитозолу приготовляли в TEGMD буфері і отриманий 3 препарат інкубували з 6 нM 6,7-[ H]dex (NEN; 35 або 40 Ci/ммоль); сполуки, що випробовується, додавали в концентраціях від 2 до 100 нM. Для кількісного визначення зв'язування з прогестероновим рецептором-А (rhPR-A) або прогестероновим рецептором-В (rhPR-B) людини приготовляли цитозольні екстракти Sf9 клітин комах, що інфіковані рекомбінантним бакуловірусом і експресують hPR-A або hPR-B. Sf9 цитозол (приготований в TEGMD буфері, що містить наступні інгібітори протеази: бацитрацин при 100 мкг/мл, апротинін при 2 мкг/мл, лейпептин при 94 мкг/мл, пепстатин А при 200 мкг/мл), 3 інкубували з 6,8 нM 1,2,6,7,16,17-[ H]прогестерону (NEN; 143 Ci/ммоль); сполуки, що випробовуються, додавали в концентраціях від 1 до 100 нM. 3 Після інкубування протягом ночі при 4С зв'язані і незв'язані [ H]-стероїди розділяли додаванням деревного вугілля з декстрановим покриттям і центрифугували при 2100×g протягом 15 хвилин при 4С. Супернатанти від GR аналізів декантували і обраховували в рідинному сцинтиляційному лічильнику Beckman LS-1800. Супернатанти, що містять PR, за допомогою піпеток переносили в 24-ямкові мікропланшети і обраховували в рідкому сцинтиляційному лічильнику Packard TopCount. Число одиниць в хвилину (cpm) вводять в Packard's RIASmart™ для розрахунку значень EC50. Відносну спорідненість до зв'язування для кожної сполуки, що випробовується, розраховували наступним чином: (EC 50 еталони)/(EC50 конкуренти)×100. Еталоном для дослідів PR зв'язування є P4, стандартом для дослідів GR зв'язування є dex. Приклад 3. Кількісне визначення протиглюкокортикоїдної активності і антагоністичної активності відносно прогестерону in vivo 19 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для кількісного визначення in vivo антагоністичної активності сполук, що випробовуються, відносно прогестерону T47D-CO клітини раку молочної залози, вирощені в моношаровій культурі, що не містить фенолового червоного DMEM, забезпеченій 10 % фетальною телячою сироваткою (FBS), 10 Од./мл пеніциліну G і 10 мкг/мл стрептоміцину сульфату, трансфектували чутливою до гормону плазмідою репортерного гену, наприклад PRE2-tk-LUC, що містить дві копії елемента прогестинової/глюкокортикоїдної/андрогенної відповіді, розташованого вище промоутера тимідинкінази (tk) і гену-репортера люциферази (LUC) світляка. Трансфектовані клітини T47D-CO інкубували в максимальній (попередньо визначеній) стимуляторній концентрації прогестерону (наприклад, Р4) у відсутність і в присутності досліджуваної сполуки при її різних концентраціях протягом 20 годин. LUC активність визначали з використанням системи Promega's Luciferase Assay System і обчислювали IC 50 досліджуваної сполуки. Для кількісного визначення глюкокортикоїдної антагоністичної активності in vivo HepG2 клітини гепатобластоми людини, вирощені в моношаровій культурі, що не містить фенолового червоного MEMα, забезпеченої 10 % FBS і pen/strep, котрансфектували прийнятною чутливою до гормону плазмідою репортера-гену, такої як PRE2-tk-LUC і плазміда GR екпресії. Трансфектовані HepG2 клітини інкубували в максимальній (попередньо визначеній) стимуляторній концентрації дексаметазону за відсутності або в присутності різних концентрацій досліджуваної сполуки протягом 20 годин. IC50 досліджуваної сполуки визначали зміною LUC активності. Приклад 4. Хронічне щоденне введення CDB-2124, асоційоване з токсичними печінковими ефектами Первинні дослідження, що проводяться з Proellex (аkа CDB-4124), показали ефективність препарату в кожній перевіреній добовій дозі. Розробка Proellex була зосереджена на двох самих високих дозах, 25 мг і 50 мг, на основі даних про те, що більш високі дози пригнічували потовщення ендометрію і можливість маткових кровотеч. Ні доклінічні дослідження на тваринах, ні невеликі дослідження на жінках в Європі в більш високих дозах тривалістю до шести місяців не прогнозували печінкової токсичності, яка виявилася на III фазі клінічних досліджень, проведених в США на різних представниках населення. Proellex, що доставляється перорально в добовій дозі 50 мг/день, показав сильну токсичну дію на печінку у приблизно 3-4 % жінок, що приймали дану дозу.При прийомі 12,5 мг несприятливого впливу на печінку, що відрізняється від плацебо, не спостерігалося. Максимальні концентрації CDB-4124 і його монодеметильованого метаболіту (CDB-4453) для дози 12,5 мг становили 25 % від концентрації дози 50 мг. Всі токсичні ефекти були усунені у тих жінок, які поверталися для подальшого вивчення безпеки віддалених результатів, включаючи тих пацієнтів, у яких розвинулися серйозні побічні ефекти (SAE), пов'язані з печінкою. Такі ефекти що спостерігаються, коли Proellex вводився перорально в дозі 50 мг/добу, були значно нижче по частоті і тяжкості при введенні Proellex в дозі 25 мг/добу. Це спостереження було додатково підкріплене тим фактом, що в дозі 25 мг/добу були успішно досягнуті більш тривалі експозиції, ніж при дозі 50 мг/добу, підтверджуючи, що тривала експозиція в нижчих дозах не обов'язково приводить до такої ж токсичності, що спостерігалася в дозі 50 мг/добу. У цей час проведені подвійні сліпі клінічні дослідження і дослідження з відкритою міткою, в яких взяли участь більше 600 пацієнтів, в тому числі жінки з підтвердженими випадками ендометріозу або міоми матки, яким щодня протягом місяця перорально вводили капсули CDB4124 (Proellex) з дозами 12,5 мг, 25 мг або 50 мг. Серед цих пацієнток близько 500 отримували Proellex і близько 130 отримували плацебо. З пацієнток, що одержували Proellex, близько 190 отримували дозу 50 мг CDB-4124 на добу, близько 260 отримували дозу 25 мг CDB-4124 на добу і близько 55 отримували дозу 12,5 мг на добу. У пацієнток, що брали участь у випробуванні, контролювалися ферменти печінки. Рівнем ферменту печінки, при якому клінічні дослідження повинні були припинятися, була активність печінкових амінотрансфераз, яка дорівнювала трьом верхнім межам норми (ULN) або більше (≥3ULN). Під час клінічних випробувань було виявлено тринадцять пацієнток, у яких підвищення активності печінкових ферментів складало ≥3ULN, але це було підтверджено в повторному тесті протягом 48 годин тільки у дев'яти пацієнток. Серед дев'яти пацієнток з підтвердженим підвищенням активності печінкових ферментів до рівня ≥3ULN у семи підвищення активності було досить серйозним, щоб ці результати були представлені в FDA як SAE. Одна з цих семи пацієнток отримувала дозу 25 мг CDB-4124 на добу, а інші шість отримували дозу 50 мг CDB4124 на добу. Активність печінкових ферментів на рівні ≥3ULN зберігалася у п'яти з дев'яти пацієнток з підтвердженим підвищенням активності печінкових ферментів до рівня ≥3ULN. Ці п'ять пацієнток раніше отримували дозу 50 мг в доби. Одна з цих пацієнток в цей час 20 UA 110030 C2 5 10 15 20 25 30 35 40 45 50 55 перорально отримує лікарські препарати для лікування печінки. Клінічні дослідження, що включають введення CDB-4124 у всіх дозах, добровільно припинялися після виявлення цих SAE, і пацієнтки згодом розміщувалися в клінічних умовах Управлінням по контролю за продуктами і медикаменти США по міркуваннях безпеки. Фармакокінетичні дослідження, проведені з участю пацієнтів, виявили високі C max і Тmax в 1-2 години після введення. Були також виявлені великі кількості монодеметильованого метаболіту CDB-4124, явно вказуючи на першу стадію метаболізму антипрогестину. При отриманні додаткових доказів першої стадії метаболізму було встановлено, що первинні культури гепатоцитів людини і тварин швидко дають монодеметильований метаболіт CDB-4124. Метаболізм CDB-4124 в печінці зумовлює можливість пошкодження печінки і значно знижує концентрацію антипрогестину до того, як він досягне великого кола кровообігу. Таким чином, альтернативні способи введення антипрогестинів, які дозволяють обійти першу стадію метаболізму, такі як, але без обмеження, внутрішньовенне, внутрішньом'язове і під'язикове, повинні дозволити антипрогестинам вбратися безпосередньо у велике коло кровообігу і тим самим забезпечити спосіб лікування прогестонзалежних станів без токсичності для печінки. При способах введення, які дозволяють уникнути першої стадії метаболізму, може також зажадатися менше в порівнянні з пероральним введенням лікарського засобу на дозу для досягнення такого ж терапевтичного ефекту. Доклінічні дослідження проводилися на пухлинах молочної залози, індукованих 7,12диметилбенз(а)антраценом (DMBA). Ці дослідження показали ефективність непероральних способів доставки CDB-4124. Зокрема, доставка CDB-4124 підшкірною ін'єкцією була ефективною в зниженні кількості і розміру DMBA-індукованих пухлин молочної залози, забезпечуючи доказ даної концепції. Приклад 5. Вагінальна доставка CDB-4124 і CDB-4453 знижує системні концентрації в порівнянні з пероральним введенням і діє в обхід першої стадії метаболізму Собакам породи бігль вводили CDB-4124 або CDB-4453 (монодеметильований метаболіт CDB-4124) в дозах 25 мг в препаратах в формі тонкоподрібненого порошку або в формі вагінальних супозиторіїв. Як показано на Фіг. 1, CDB-4124 і CDB-4453 при пероральному введенні у вигляді тонкоподрібненого порошку швидко метаболізувались після досягнення пікової концентрації в плазмі (Cmax). У протилежність цьому, при місцевому введенні цих же сполук в формі вагінальних супозиторіїв лікарські препарати метаболізувались повільно і пікові концентрації в плазмі (Cmax) були відносно низькими. Крім того, системний вплив лікарського засобу був значно нижчим при місцевому введенні (порівняйте AUC для CDB-4124 і CDB-4453 при вагінальному і пероральному введенні). Максимальні циркулюючі концентрація (Cmax) CDB-4124, отримані після вагінального введення біглям, екстраполювали на людей для доз 12,5 мг, 25 мг і 50 мг, що дійсно вводяться під час клінічних досліджень III фази. Як можна бачити з Фіг. 2, прогностична Cmax для вагінального введення людям CDB-4124 в дозі 12,5 мг у людей становила приблизно 6,5 % цієї же дози при пероральному введенні, і прогностична Cmax для вагінального введення CDB-4124 в дозі 50 мг у людей становила приблизно 2 % такої ж дози при пероральному введенні. Приклад 6. Біологічна доступність CDB-4124 в матці є дивно низькою при пероральному введенні Для визначення, чи можуть низькі циркулюючі рівні CDB-4124 при місцевому введенні чинити яку-небудь дію на ефективність, що прогнозується, проводили анти-клаубергівське дослідження, в якому незрілим естрадіол-сенсибілізованим кроликам вводили спільно прогестерон і CDB-4124 в різних дозах підшкірним або пероральним способами введення. Щонайменше 3 висококваліфікованих фахівця оцінювали матку кролика на ріст залози, на комплексний і загальний прогестероніндукований "розвиток". Аналізували інгібування (в процентах) прогестероніндукованої проліферації ендометрію для кожної дози. Як показано на Фіг. 3, максимальне інгібування спостерігалося в дозі менше за 1 мг/кг при підшкірному введенні CDB-4124. Проте, для максимального гальмування необхідне ~8-кратне збільшення дози при пероральному введенні (тобто 8 мг/кг). Важливо те, що 8 мг/кг близько відповідає дозі 50 мг/добу CDB-4124, що вводиться пацієнтам-жінкам, як описано в прикладі 4. Це показує, що ефективна місцева концентрація CDB-4124 на ендометрії значно знижується, коли препарат вводиться перорально, найвірогідніше через першу стадію метаболізму лікарського засобу. Відповідно, для досягнення терапевтичного ефекту, наприклад, для показів, локалізованих в області тазу і статевих шляхів, при пероральному введенні потрібні відносно високі дози CDB4124, відповідно близькі до дозування CDB-4124, при якому в прикладі 4 спостерігалися токсичні ефекти. 21 UA 110030 C2 5 10 15 20 25 Проводили ще одне анти-клауберговське дослідження, при якому незрілим естрадіолсенсибілізованим кроликам вводили тільки прогестерон (як контроль - розріджувач) або спільно вводили прогестерон і CDB-4124 в трьох різних дозах при вагінальному або пероральному введенні. Аналізували інгібування прогестероніндукованої проліферації ендометрію в кожній дозі. На Фіг. 3 представлене зниження McPhail індексу після збільшення доз CDB-4124, що вводяться кожним способом. Максимальне інгібування (тобто зниження показника McPhail до 1,5) спостерігалося при вагінальному введенні 0,2 мг/кг CDB-4124 в порівнянні з 0,8 мг/кг при пероральному введенні. Результати даного дослідження показали, що при вагінальній доставці дія CDB-4124 в чотири рази перевершувала ефект такої ж дози, введеної перорально. Загалом, дані показали, що антипрогестин можна вводити вагінально в дозі, в чотири рази меншій ефективної дози при пероральному введенні, при цьому досягається лише мала частка максимальних циркулюючих концентрацій в порівнянні з пероральним введенням, що дозволяє уникнути печінкової токсичності. Наприклад, еквівалентна антипрогестагенна активність CDB4124 на матці спостерігається в дозі 50 мг при пероральному введенні і в дозі 12,5 мг при вагінальному введенні; однак, Cmax, що спостерігається в 12,5 мг при вагінальному введенні, становить всього 2 % концентрації, що спостерігається при пероральному введенні дози 50 мг. Відносно висока місцева концентрація препарату, що досягається при місцевому введенні, дозволяє при відносно низькій дозі препарату (в порівнянні з пероральним введенням) досягти терапевтичного ефекту для показів, локалізованих в області тазу і в статевих шляхах (наприклад, ендометріоз, міома матки і рак яєчників). Внаслідок того, що висока концентрація лікарського препарату в системі кровообігу (і зв'язаній першою стадією метаболізму лікарського засобу) не досягається при місцевому введенні, усунення важкої печінкової токсичності, що спостерігається у незначного відсотка пацієнтів після перорального введення CDB-4124 в дозах 25 і 50 мг в попередніх клінічних дослідженнях III фази, є несподіваною перевагою місцевого введення препарату. Аналогічні переваги повинні мати місце при місцевому введенні інших антипрогестинів. ФОРМУЛА ВИНАХОДУ 30 35 40 45 50 1. Спосіб лікування ендометріозу або міоми матки у жінки, яка потребує цього, що включає введення один раз в день на слизову піхви жінки композиції, яка містить сполуку, вибрану з 21метоксі-17-ацетокси-11-(4-N,N-диметиламінофеніл)-19-норпрегна-4,9-дієн-3,20-діону і 17ацетокси-11-(4-N,N-диметиламінофеніл)-19-норпрегна-4,9-дієн-3,20-діону в дозі 3,125 мг - 12,5 мг протягом періоду, який дорівнює щонайменше 4 місяцям. 2. Спосіб за п. 1, де композиція включає біоадгезивний носій і представлена в формі гелю, крему, таблетки, пігулки, капсули або супозиторія. 3. Спосіб за п. 1, де композиція вводиться щонайменше 12 місяців. 4. Спосіб за п. 1, де композиція представлена в формі твердої дозованої одиниці, вибраної з таблетки, каплети або капсули. 5. Спосіб за п. 1, де композиція включає 21-метоксі-17-ацетокси-11-(4-N,Nдиметиламінофеніл)-19-норпрегна-4,9-дієн-3,20-діон. 6. Спосіб за п. 1, де композиція включає 17-ацетокси-11-(4-N,N-диметиламінофеніл)-19норпрегна-4,9-дієн-3,20-діон. 7. Спосіб за п. 4, де композиція представлена у формі капсули. 8. Лікарська форма для щоденного введення на слизову піхви жінки, де лікарська форма включає 3,125 мг - 12,5 мг 21-метоксі-17-ацетокси-11-(4-N,N-диметиламінофеніл)-19норпрегна-4,9-дієн-3,20-діону або 17-ацетокси-11-(4-N,N-диметиламінофеніл)-19-норпрегна4,9-дієн-3,20-діону. 9. Лікарська форма за п. 8, де лікарська форма представлена у формі вагінального супозиторія, вагінального вкладиша, здатного плавитися, гелю, крему, таблетки, пігулки, капсули або мазі. 10. Лікарська форма за п. 8, де лікарська форма представлена у формі капсули. 22 UA 110030 C2 23 UA 110030 C2 24 UA 110030 C2 25 UA 110030 C2 Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 26
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for treating endometriosis or uterine myoma and dosage form for daily administration onto mucosa of vagina
Автори англійськоюPodolski, Joseph, S., Wiehle, Ronald, D.
Назва патенту російськоюСпособ лечения эндометриоза или миомы матки и лекарственная форма для ежедневного введения на слизистую влагалища
Автори російськоюПодольски Джозеф С., Виле Роналд Д.
МПК / Мітки
МПК: A61K 31/57, A61P 5/36
Мітки: матки, ендометріозу, лікування, форма, слизову, лікарська, міоми, спосіб, щоденного, жінки, введення, піхви
Код посилання
<a href="https://ua.patents.su/28-110030-sposib-likuvannya-endometriozu-abo-miomi-matki-i-likarska-forma-dlya-shhodennogo-vvedennya-na-slizovu-pikhvi-zhinki.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування ендометріозу або міоми матки і лікарська форма для щоденного введення на слизову піхви жінки</a>
Попередній патент: Пригнічення сполукою камфори небажаного впливу на рецептори
Наступний патент: Гетеробіарилциклогексилтетраазабензо[е]азулени
Випадковий патент: Спосіб діагностики стану судин мікроциркуляторного русла у вагітних з цукровим діабетом