Спосіб капілярного електрофорезу для аналізу тонкої структури еноксапарину натрію
Формула / Реферат
1. Спосіб капілярного електрофорезу (КЕ) для структурного аналізу еноксапарину натрію, який складається з наступних стадій:
1) розкладання зразка еноксапарину натрію шляхом повного розщеплення сумішшю гепаринрозщеплюючих ферментів,
2) розділення олігосахаридів зразка розкладеного еноксапарину натрію за допомогою капілярного електрофорезу, де олігосахариди включають дисахариди, трисахариди, тетрасахариди і олігосахариди з 1,6-ангідроструктурою, при цьому капілярний електрофорез здійснюють при наступних умовах:
а) капілярна колонка з плавленого кварцу, що має довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм,
b) рухомий буфер, включаючи NaH2PO4-Н3РО4, Tris-Н3РО4 або LiH2PO4-Н3РО4, або їх будь-які комбінації, в концентрації від 150 до 300 мМ і рН від 1,5 до 4,0,
с) напруга розділення від -15 до -30 кВ,
d) тиск при введенні проби від 1 до 100 мбар і час введення проби від 1 до 60 сек.,
e) температура капілярної колонки - 10-40 °С,
f) довжина хвилі УФ-детектування - 230-235 нм,
3) співвідношення піків, які наявні в електроферограмі капілярного електрофорезу, з олігосахаридами у зразку розкладеного еноксапарину натрію згідно з лінійним зв'язком між електрофоретичною рухливістю та співвідношенням заряд-до-маси олігосахаридів, та
4) кількісне визначення відсотка кожного олігосахариду стосовно усіх олігосахаридів, у зразку розщепленого еноксапарину натрію шляхом вимірювання нормалізованої хроматографічної площі піка.
2. Спосіб за п. 1, де використовують суміш гепариназ на стадії 1), що містить щонайменше дві з: гепариназа І, гепариназа II і гепариназа III.
3. Спосіб за п. 2, де використовувана суміш гепариназ на стадії 1) є сумішшю гепаринази І, гепаринази II і гепаринази III.
4. Спосіб за п. 3, де використовувана суміш гепариназ на стадії 1) містить гепариназу І, гепариназу II і гепариназу III, які змішуються в співвідношенні 1:1:1.
5. Спосіб за п. 1, де олігосахариди з 1,6-ангідроструктурою отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру
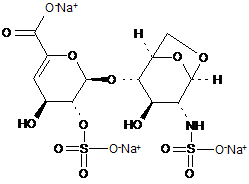 ,
,
 ,
,
1,6-Ангідро ΔIS або 1,6-ангідро ΔIS глюкоза
1,6-Ангідро ΔIIS або 1,6-ангідро ΔIIS глюкоза
 ,
,
 .
.
1,6-Ангідро ΔIIS епі або 1,6-ангідро ΔIIS маноза
1,6-Ангідро ΔIS-IS епі або 1,6-ангідро ΔIS-IS маноза
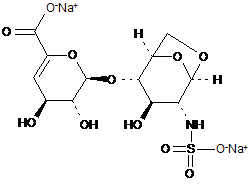
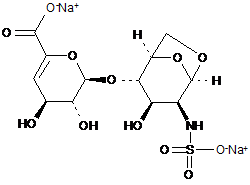
6. Спосіб за п. 1, де трисахариди, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру
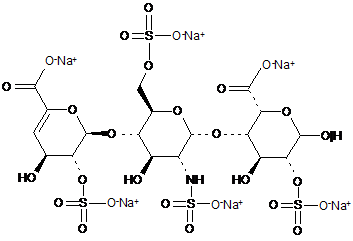 .
.
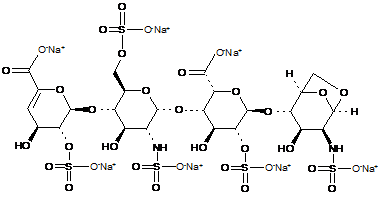
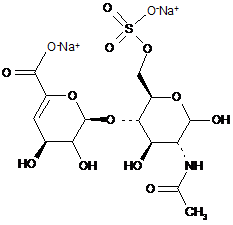
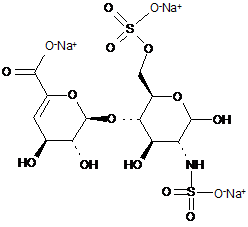
7. Спосіб за п. 1, де дисахариди, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру
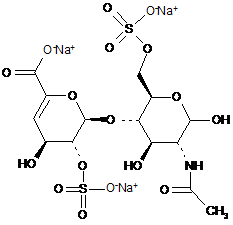 ,
,
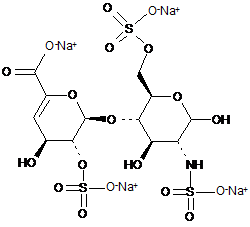 ,
,
ΔIA
ΔIS
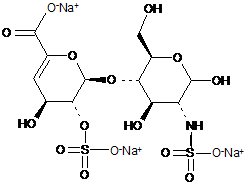
 ,
,
 ,
,
ΔIIA
ΔIIS
 ,
,
 ,
,
ΔIIIA
ΔIIIS
 ,
,
 .
.
ΔIVA
ΔIVS
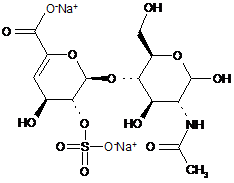
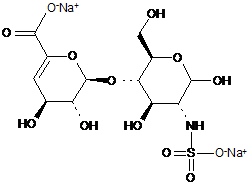
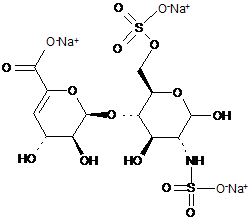
8. Спосіб за п. 1, де два інші дисахариди, ΔIISgal і ΔIVSgal, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру
 ,
,
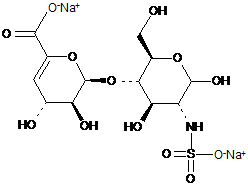
ΔIISgal
. ΔIVSgal
9. Спосіб за п. 1, де два тетрасахариди, ΔIIА - IISglu і ΔIIa-IVSglu, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру
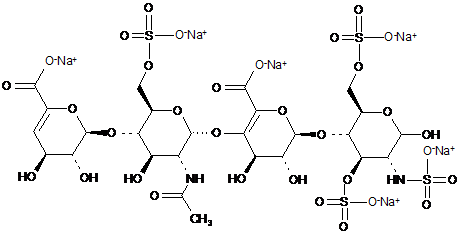 ,
,
ΔІІА-IISglu
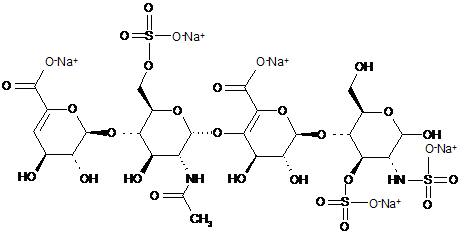 .
.
ΔІІА-IVSglu.
10. Спосіб за п. 1, де капілярна колонка з плавленого кварцу на стадії 2) має довжину від 70 до 100 см і внутрішній діаметр від 40 до 60 мкм.
11. Спосіб за п. 1, де рухомий буфер на стадії 2) вибирають з NaH2PO4-Н3РО4, Tris-Н3РО4 або LiH2PO4-Н3РО4, в концентрації від 200 до 250 мМ і рН від 2,0 до 4,0.
12. Спосіб за п. 11, де до рухомого буфера на стадії 2) додають МgСl2 або ZnCl2 в концентрації від 1 до 5 мМ, і поліетиленгліколь з молекулярною масою від 5000 до 100000 в концентрації від 0,1 до 5 % (маса/об'єм).
13. Спосіб за п. 12, де до рухомого буфера на стадії 2) додають МgСl2 або ZnCl2 в концентрації 2-4 мМ, і поліетиленгліколь з молекулярною масою від 10000 до 50000 в концентрації від 1 до 3 % (маса/об'єм).
14. Спосіб за п. 1, де напруга розділення, прикладена до капіляра на стадії 2), складає від -20 до -25 кВ.
15. Спосіб за п. 1, де тиск при введенні проби складає від 30 до 60 мбар і час введення проби від 5 до 30 сек., або тиск при введенні проби складає від 40 до 50 мбар і час введення від 10 до 20 сек.
16. Спосіб за п. 15, де після останнього елюювання сульфатованого дисахариду ΔIIА на стадії 2) прикладають певний тиск для проштовхування ΔIVA через детектор для детектування.
17. Спосіб за п. 16, де напруга на стадії 2) складає від 5 до 150 мбар.
18. Спосіб за п. 17, де тиск на стадії 2) складає від 5 до 30 мбар, від 10 до 20 мбар і від 30 до 50 мбар і т.і., залежно від типу використовуваного приладу для капілярного електрофорезу.
19. Спосіб за п. 1, де температура капілярної колонки складає 20-30 °C.
20. Спосіб за п. 1, де довжина хвилі УФ-детектування складає 230-232 нм.
21. Спосіб за п. 1, де умови розділення капілярного електрофорезу наступні: капілярна колонка з плавленого кварцу повинна мати довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм, рухомий буфер для капілярного електрофорезу вибирають з NaH2PO4-Н3РО4, Tris-Н3РО4 або LiH2PO4-Н3РО4, в концентрації від 150 до 300 мМ і рН від 1,5 до 4,0, до рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 1 до 5 мМ і ПЕГ з молекулярною масою від 5000 до 100000 в концентрації від 0,1 до 5,0 % (маса/об'єм), прикладають напругу в діапазоні від -15 до -30 кВ, тиск при гемодинамічному введенні проби складає від 1 до 100 мбар і час введення проби від 1 до 60 сек., після останнього проходу моносульфатованого дисахариду ΔIIА через детектор прикладають тиск 5-150 мбар для проштовхування ΔIVA через детектор для детектування, в процесі електрофорезу регулюють температуру капіляра на рівні 10-40 °C, і довжина хвилі при УФ-детектуванні повинна складати від 230 до 235 нм.
22. Спосіб за п. 21, де умови розділення капілярного електрофорезу наступні: капілярна колонка з плавленого кварцу має довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм, рухомий буфер може містити NaH2PO4-Н3РО4, Tris-Н3РО4 або LiH2PO4-Н3РО4 в концентрації 150-300 мМ і до вищезгаданого рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 1 до 5 мМ, рН 1,5-4,0 і ПЕГ з молекулярною масою від 5000 до 100000 в концентрації від 0,1 % до 5,0 % (маса/об'єм), прикладають напругу в діапазоні від -15 до -30 кВ, тиск при гемодинамічному введенні проби складає від 30 до 60 мбар і час введення проби від 5 до 30 сек., після останнього проходу сульфатованого дисахариду ΔIIА, через детектор прикладають тиск 5-150 мбар для проштовхування ΔІVА через детектор для детектування, і в процесі електрофорезу регулюють температуру капіляра на рівні 10-40 °C, і довжина хвилі при УФ-детектуванні повинна складати від 230 до 235 нм.
23. Спосіб за п. 21, де умови розділення капілярного електрофорезу наступні: капілярна колонка з плавленого кварцу має довжину від 70 до 100 см і внутрішній діаметр від 40 до 60 мкм, рухомий буфер для капілярного електрофорезу вибирають з NaH2PO4-Н3РО4, Tris-Н3РО4 або LiН2РО4-Н3РО4, в концентрації від 200 до 250 мМ і рН від 2 до 4, і до вищезгаданого рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 2 до 4 мМ і ПЕГ з молекулярною масою від 10000 до 50000 в концентрації від 1 до 3 % (маса/об'єм), прикладають напругу в діапазоні від -15 до -25 кВ, тиск при гемодинамічному введенні проби складає від 40 до 50 мбар і час введення проби від 10 до 20 сек., після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 10-20 мбар для проштовхування ΔІVА через детектор для детектування, і в процесі електрофорезу регулюють температуру капіляра на рівні 20-30 °C, і довжина хвилі при УФ-детектуванні повинна складати від 230 до 232 нм.
24. Спосіб за п. 21, де умови розділення капілярного електрофорезу наступні: капілярна колонка має внутрішній діаметр 50 мкм і загальну довжину 85 см, до рухомого буфера перед використанням додають 200 мМ Tris-Н3РО4 і 2 мМ МgСl2, при рН 2,5, поліетиленгліколь 1 % (маса/об'єм) з молекулярною масою 10000, тиск при введенні проби складає 50 мбар і час введення проби 15 сек., напруга при розділенні -25 кВ, після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 20 мбар для проштовхування ΔІVА через детектор для детектування, температура колонки 25 °C, і довжина хвилі при УФ-детектуванні 232 нм.
25. Спосіб за п. 21, де умови розділення при капілярному електрофорезі наступні: капілярна колонка має внутрішній діаметр 50 мкм і загальну довжину 80 см, до рухомого буфера перед використанням додають 200 мМ Tris-Н3РО4 і 2 мМ МgСl2, при рН 2,7, поліетиленгліколь 1,3 % (маса/об'єм) з молекулярною масою 10000, тиск при введенні проби складає 55 мбар і час введення проби 10 сек., напруга при розділенні -22 кВ, після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 138 мбар для проштовхування ΔІVА через детектор для детектування, тиск в колонці складає 25 °C, і довжина хвилі при УФ-детектуванні 230 нм.
26. Спосіб за п. 1, де принаймні 5 стандартів сульфатованих дисахаридів піддають електрофорезу для визначення електрофоретичної рухливості на стадії 3), потім будують графік кореляції електрофоретичної рухливості і співвідношення заряду до маси, отримують лінійну формулу зв'язку між електрофоретичною рухливістю m і співвідношенням заряду до маси Z/M з використанням аналізу лінійної регресії, електрофоретичну рухливість інших олігосахаридів прогнозують відповідно до лінійної формули, яку можна використовувати для ідентифікації інших олігосахаридів у відсутності стандартів.
27. Спосіб за п. 26, де шість стандартів сульфатованих дисахаридів (ΔIS, ΔIIIS, ΔIIS, ΔІА, ΔIIА і ΔІІІА) піддають електрофоретичному розділенню для визначення електрофоретичної рухливості на стадії 3), потім будують графік кореляції електрофоретичної рухливості і співвідношення заряду до маси, отримують лінійну формулу зв'язку між електрофоретичною рухливістю m і співвідношенням заряду до маси Z/M з використанням аналізу лінійної регресії, електрофоретичну рухливість інших олігосахаридів прогнозують відповідно до лінійної формули, яку можна використовувати для ідентифікації інших олігосахаридів у відсутності стандартів.
28. Спосіб за п. 27, де лінійний зв'язок між електрофоретичною рухливістю і співвідношенням заряду до маси олігосахаридів, отриманих від еноксапарину натрію, підданого повному розщепленню, описують за допомогою формули:
![]() ,
,
де Z/M - співвідношення заряду до маси олігосахаридів, і µ - відповідна електрофоретична рухливість цього олігосахариду.
29. Спосіб за п. 1, де масовий відсоток кожного компонента розраховують з використанням методу нормалізованої хроматографічної площі піку за формулою:
![]() ,
,
де MWn - молекулярна маса цього компонента олігосахариду, Arean - площа піку такого компонента і MWx і Areax - молекулярна маса і площа піку х, що відповідає його номеру, вказана в Таблиці 1, відповідно.
30. Спосіб кількісного визначення молярного відсотка олігосахаридних ланцюгів з 1,6-ангідроструктурою в еноксапарині натрію, який складається з наступних стадій:
1) розкладання зразка еноксапарину натрію шляхом повного розщеплення сумішшю гепаринрозщеплюючих ферментів,
2) розділення олігосахаридів зразку розкладеного еноксапарину натрію за допомогою капілярного електрофорезу, де олігосахариди включають дисахариди, трисахариди, тетрасахариди і олігосахариди з 1,6-ангідроструктурою, при цьому капілярний електрофорез здійснюють при наступних умовах:
а) капілярна колонка з плавленого кварцу, що має довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм,
b) рухомий буфер, включаючи NaH2PO4-Н3РО4, Tris-Н3РО4 або LіН2РО4-Н3РО4 або їх комбінації, в концентрації від 150 до 300 мМ, і рН від 1,5 до 4,0,
с) напруга розділення від -15 до -30 кВ,
d) тиск при введенні проби від 1 до 100 мбар і час ведення проби від 1 до 60 сек.,
e) температура капілярної колонки 10-40 °С,
f) довжина хвилі УФ-детектування 230-235 нм,
3) співвідношення піків, які наявні в електроферограмі капілярного електрофорезу з олігосахаридами у зразку розкладеного еноксапарину натрію згідно з лінійним зв'язком між електрофоретичною рухливістю та співвідношенням заряд-до-маси олігосахаридів і ідентифікація піків олігосахаридів з 1,6-ангідрокільцевою структурою,
4) кількісне визначення кількості олігосахаридів з 1,6-ангідрокільцевою структурою відповідно до їх площин піку і наступне визначення молярного відсотка 1,6-ангідрокільцевої структури в еноксапарині натрію.
31. Спосіб за п. 30, де використовувана суміш гепариназ на стадії 1) містить щонайменше дві з: гепариназа І (EC 4.2.2.7), гепариназа II (без номера EC) і гепариназа III (EC 4.2.2.8).
32. Спосіб за п. 31, де використовувана суміш гепариназ на стадії 1) є сумішшю гепаринази І, гепаринази II і гепаринази III.
33. Спосіб за п. 32, де використовувана суміш гепариназ на стадії 1) є сумішшю гепаринази І, гепаринази II і гепаринази III в співвідношенні 1:1:1.
34. Спосіб за п. 30, де олігосахариди з 1,6-ангідроструктурою отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру
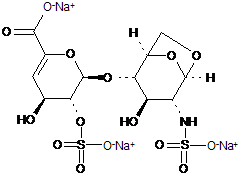 ,
,
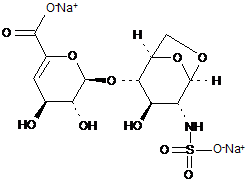 ,
,
1,6-Ангідро ΔIS або 1,6-ангідро ΔIS глюкоза
1,6-Ангідро ΔIIS або 1,6-ангідро ΔIIS глюкоза
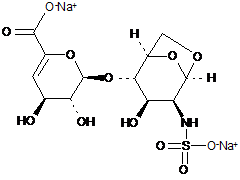 ,
,
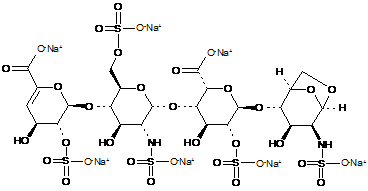 .
.
1,6-Ангідро ΔIIS епі або 1,6-ангідро ΔIIS маноза
1,6-Ангідро ΔIS-IS епі або 1,6-ангідро ΔIS-IS маноза
35. Спосіб за п. 30, де трисахариди, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру
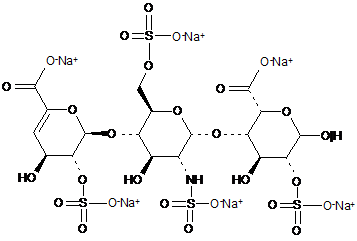 .
.
36. Спосіб за п. 30, де 8 дисахаридів, отриманих з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру
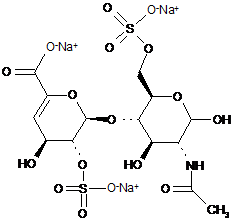 ,
,
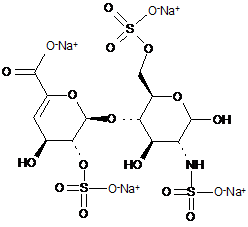 ,
,
ΔIA
ΔIS
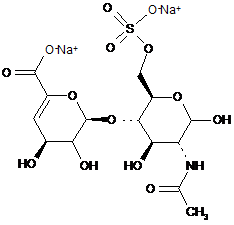 ,
,
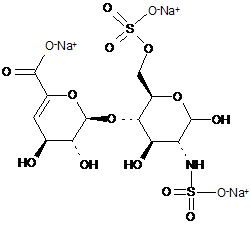 ,
,
ΔIIA
ΔIIS
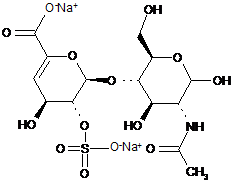 ,
,
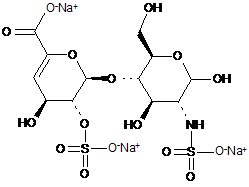 ,
,
ΔIIIA
ΔIIIS
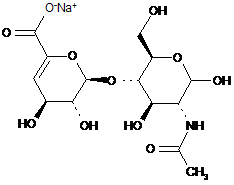 ,
,
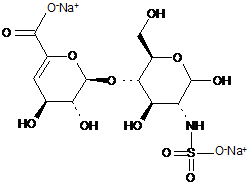 .
.
ΔIVA
ΔIVS.
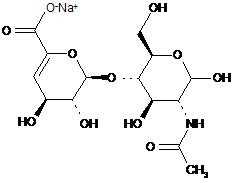
37. Спосіб за п. 30,де два інші дисахаридні компоненти, ΔIISgal i ΔIVSgal, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру
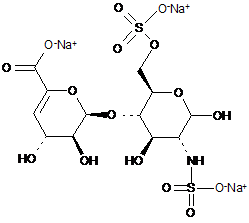 ,
,
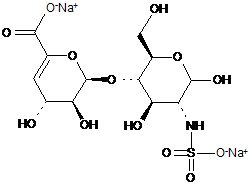 .
.
ΔIISgal
ΔIVSgal.
38. Спосіб за п. 30, де два тетрасахариди, ΔIIА - IISglu i ΔIIa-IVSglu, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру
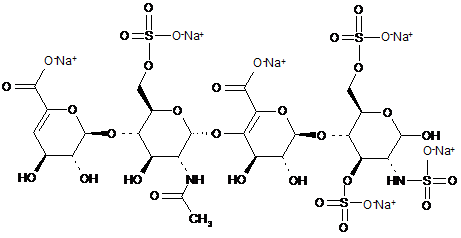 ,
,
ΔІІА-IISglu
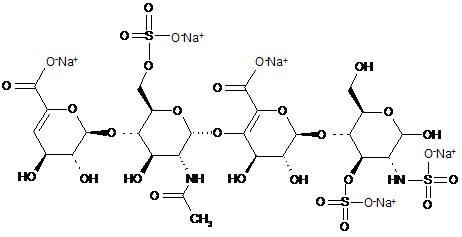 .
.
ΔІІА-IVSglu
39. Спосіб за п. 30, де капілярна колонка з плавленого кварцу на стадії 2) має довжину від 70 до 100 см і внутрішній діаметр від 40 до 60 мкм.
40. Спосіб за п. 30, де рухомий буфер на стадії 2) вибирають з NaH2PO4-Н3РО4, Tris-Н3РО4 або LiН2РО4-Н3РО4, в концентрації від 200 до 250 мМ, і рН від 2,0 до 4,0.
41. Спосіб за п. 40, де до рухомого буфера на стадії 2) додають МgСl2 або ZnCl2 в концентрації від 1 до 5 мМ, і поліетиленгліколь з молекулярною масою від 5000 до 100000 в концентрації від 0,1 до 5 % (маса/об'єм).
42. Спосіб за п. 41, де до рухомого буфера на стадії 2) додають МgСl2 або ZnCl2 в концентрації 2-4 мМ, і поліетиленгліколь з молекулярною масою від 10000 до 50000 в концентрації 1-3 % (маса/об'єм).
43. Спосіб за п. 30, де напруга при розділенні прикладена до капілярної колонки складає від -20 до -25 кВ.
44. Спосіб за п. 30, де тиск при введенні проби на стадії 2) складає від 30 до 60 мбар і час введення проби від 5 до 30 сек., або тиск при введенні проби складає 40-50 мбар, і час введення проби від 10 до 20 сек.
45. Спосіб за п. 44, де після останнього елюювання сульфатованого дисахариду ΔIIА прикладають певний тиск для проштовхування ΔIVA через детектор для детектування.
46. Спосіб за п. 45, де тиск на стадії 2) складає від 5 до 150 мбар.
47. Спосіб за п. 46, де тиск на стадії 2) складає від 5 до 30 мбар, від 10 до 20 мбар і від 30 до 150 мбар і т. і., залежно від типу використовуваного приладу для капілярного електрофорезу.
48. Спосіб за п. 30, де температура капілярної колонки складає 20-30 °C.
49. Спосіб за п. 30, де довжина хвилі УФ-детектування на стадії 2) складає 230-232 нм.
50. Спосіб за п. 30, де умови розділення при капілярному електрофорезі наступні: капілярна колонка з плавленого кварцу має довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм, рухомий буфер для капілярного електрофорезу вибирають з NaH2PO4-Н3РО4, Tris-Н3РО4 або LiH2PO4-Н3РО4, в концентрації від 150 до 300 мМ і рН від 1,5 до 4,0, до рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 1 до 5 мМ і ПЕГ з молекулярною масою від 5000 до 100000 в концентрації від 0,1 % до 5,0 % (маса/об'єм), прикладають напругу в діапазоні від -15 до -30 кВ, тиск при гемодинамічному введенні проби складає від 1 до 100 мбар і час введення проби від 1 до 60 сек., після останнього проходу моносульфатованого дисахариду ΔIIА через детектор прикладають тиск 5-150 мбар для проштовхування ΔIVA через детектор для детектування, в процесі електрофорезу регулюють температуру капіляра на рівні 10-40 °C, і довжина хвилі при УФ-детектуванні складає від 230 до 235 нм.
51. Спосіб за п. 50, де умови розділення при капілярному електрофорезі наступні: капілярна колонка з плавленого кварцу має довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм, рухомий буфер для капілярного електрофорезу вибирають з NaH2PO4-Н3РО4, Tris-Н3РО4 або LiН2РО4-Н3РО4, в концентрації від 150 до 300 мМ і рН від 1,5 до 4,0, і до вищезгаданого рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 1 до 5 мМ і ПЕГ з молекулярною масою від 5000 до 100000 в концентрації від 0,1 % до 5,0 % (маса/об'єм), прикладають напругу в діапазоні від -15 до -30 кВ, тиск при гемодинамічному введенні проби складає від 30 до 60 мбар і час введення проби від 5 до 30 сек., після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 5-150 мбар для проштовхування ΔIVA через детектор для детектування, і в процесі електрофорезу регулюють температуру капіляра на рівні 10-40 °C, і довжина хвилі при УФ-детектуванні складає від 230 до 235 нм.
52. Спосіб за п. 50, де умови розділення при капілярному електрофорезі наступні: капілярна колонка з плавленого кварцу має довжину від 70 до 100 см і внутрішній діаметр від 40 до 60 мкм, рухомий буфер може містити NaH2PO4-Н3РО4, Tris-Н3РО4 або LіН2РО4-Н3РО4 в концентрації 200-250 мМ, рН 2-4, і до вищезгаданого рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 2 до 4 мМ, і ПЕГ з молекулярною масою від 10000 до 50000 в концентрації від 1 % до 3 % (маса/об'єм), прикладають напругу в діапазоні від -15 до -25 кВ, тиск при гемодинамічному введенні проби складає від 40 до 50 мбар і час введення проби від 10 до 20 сек., після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 10-20 мбар для проштовхування ΔIVA через детектор для детектування, і в процесі електрофорезу регулюють температуру капіляра на рівні 20-30 °C, і довжина хвилі при УФ-детектуванні повинна складати від 230 до 232 нм.
53. Спосіб за п. 50, де умови розділення при капілярному електрофорезі наступні: капілярна колонка має внутрішній діаметр 50 мкм і загальну довжину 85 см, до рухомого буфера перед використанням додають 200 мМ Tris-Н3РО4 і 2 мМ МgСl2, при рН 2,5, поліетиленгліколь 1 % (маса/об'єм) з молекулярною масою 10000, тиск при введенні проби складає 50 мбар і час введення проби 15 сек., напруга при розділенні -25 кВ, після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 20 мбар для проштовхування ΔIVA через детектор для детектування, тиск в колонці складає 25 °C; і довжина хвилі при УФ-детектуванні 232 нм.
54. Спосіб за п. 50, де умови розділення при капілярному електрофорезі наступні: капілярна колонка має внутрішній діаметр 50 мкм і загальну довжину 80 см, до рухомого буфера перед використанням додають 200 мМ Tris-Н3РО4 і 2 мМ МgСl2, при рН 2,7, поліетиленгліколь 1,3 % (маса/об'єм) з молекулярною масою 10000, тиск при введенні проби складає 55 мбар і час введення проби 10 сек., напруга при розділенні - 22 кВ, після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 138 мбар для проштовхування ΔІVА через детектор для детектування, тиск в колонці складає 25 °C, і довжина хвилі при УФ-детектуванні 230 нм.
55. Спосіб за п. 30, де принаймні 5 стандартів сульфатованих дисахаридів піддають електрофорезу для визначення електрофоретичної рухливості на стадії 3), потім будують графік кореляції електрофоретичної рухливості та співвідношення заряду до маси, отримують лінійну формулу зв'язку між електрофоретичною рухливістю m і співвідношенням заряду до маси Z/M з використанням аналізу лінійної регресії, електрофоретичну рухливість інших олігосахаридів прогнозують відповідно до лінійної формули, яку можна використовувати для ідентифікації інших олігосахаридів у відсутності стандартів, визначають площі піків, що відповідають олігосахариду дисахариду 1 (1,6-ангідро ΔIIS), дисахариду 2 (1,6-ангідро ΔІІS), дисахариду 3 (1,6-ангідро ΔIS) і тетрасахариду 1 (1,6-ангідро ΔIS-IS).
56. Спосіб за п. 55, де шість стандартів сульфатованих дисахаридів (ΔIS, ΔIIIS, ΔIIS, ΔІА, ΔІІА і ΔІІІА) піддають електрофоретичному розділенню для визначення електрофоретичної рухливості на стадії 3), потім будують графік кореляції електрофоретичної рухливості і співвідношення заряду до маси, отримують лінійну формулу зв'язку між електрофоретичною рухливістю m і співвідношенням заряду до маси Z/M з використанням аналізу лінійної регресії, електрофоретичну рухливість інших олігосахаридів прогнозують відповідно до лінійної формули, яку можна використовувати для ідентифікації інших олігосахаридів у відсутності стандартів, визначають площі піків, що відповідають олігосахаридам з 1,6-ангідроструктурою, що включає дисахарид 1 (1,6-ангідро ΔIIS), дисахарид 2 (1,6-ангідро ΔІІS), дисахарид 3 (1,6-ангідро ΔIS) і тетрасахарид 1 (1,6-ангідро ΔIS-IS).
57. Спосіб за п. 56, де лінійний зв'язок між електрофоретичною рухливістю і співвідношенням заряду і маси олігосахаридів, отриманих з еноксапарину натрію, підданого повному розщепленню, описують за допомогою формули:
![]() ,
,
де Z/M - співвідношення заряду і маси олігосахариди, і m - відповідна електрофоретична рухливість цього олігосахариди, де виявляють лінійний зв'язок між електрофоретичною рухливістю і співвідношенням заряду і маси, ідентифікують олігосахариди з 1,6-ангідроструктурою, включаючи дисахарид 1 (1,6-ангідро ΔІІS), дисахарид 2 (1,6-ангідро ΔIIS), дисахарид 3 (1,6-ангідро ΔIS) і тетрасахарид 1 (1,6-ангідро ΔIS-IS), що відповідають пікам 16, 17, 15 і 14, відповідно.
58. Спосіб за п. 30, де 1,6-ангідроолігосахариди: дисахарид 1 (наприклад, (1,6-ангідро ΔІІS), дисахарид 2 (наприклад, 1,6-ангідро ΔІІS), дисахарид 3 (наприклад, 1,6-ангідро AIS) і тетрасахарид 1 (наприклад, 1,6-ангідро ΔIS-IS) відповідають пікам 16, 17, 15 і 14, відповідно, та їх масовий відсоток в еноксапарині натрію, підданому повному розщепленню, можна розрахувати за формулами:
![]() ,
,
![]() ,
,
![]() ,
,
де MWx - молекулярна маса цього компонента, Arean - площа піка кожного олігосахариду, отриманих з еноксапарину натрію, підданого повному розщепленню, а молярний відсоток олігосахаридних ланцюгів з 1,6-ангідроструктурою, в еноксапарині натрію можна розрахувати за формулами:
![]() або
або
![]() ,
,
де Wx - середньомасова молекулярна маса еноксапарину натрію.
59. Застосування способу за будь-яким з пп. 1-29 для ідентифікації тонкої структури сульфатованих полісахаридів, таких як гепарин, низькомолекулярний гепарин і ультранизькомолекулярний гепарин.
Текст
Реферат: Винахід належить до аналітичної хімії та фармацевтичного аналізу, а саме до способу капілярного електрофорезу для кількісного аналізу складу характеристичних олігосахаридів, присутніх в еноксапарині натрію. Спосіб використовують для кількісного визначення усіх структурних елементів, у тому числі і дисахаридів, трисахаридів, тетрасахаридів і особливо олігосахаридів, що мають 1,6-ангідрокільце, що є унікальними сполуками еноксапарину натрію, отриманих в результаті вичерпного ферментативного розщеплення сумішшю гепариназ І, II, III і так далі, для кількісного визначення молярного відсотка олігосахаридів, що мають 1,6ангідрокільце в еноксапарині натрію. Спосіб можна використовувати для фармацевтичного контролю якості еноксапарину натрію в процесі виробництва. UA 112070 C2 (12) UA 112070 C2 5 10 15 20 25 30 35 40 45 50 55 Сфера застосування винаходу Винахід відноситься до аналітичної хімії та фармацевтичного аналізу й зокрема стосується способу капілярного електрофорезу (КЕ) для кількісного аналізу складу еноксапарину натрію, тобто визначення компонентів еноксапарину натрію, у тому числі дисахаридів, трисахаридів, тетрасахаридів і олігосахаридів, що мають 1,6-ангідрокільцеву структуру. Передумови винаходу Гепарин є високосульфатованим мікрогетерогенним і полідисперсним полісахаридом, що складається з повторюваних дисахаридних одиниць, кожна з яких включає уронову кислоту (Lідуронова кислота, IdoA або D-глюкуронова кислота, GlcA) і глюкозамін (α-D-глюкозамін, GlacN). Це гарний антикоагулянт, що має антитромботичну дію, тому в клінічній практиці використовується для профілактики венозного тромбозу після операцій. Еноксапарин натрію є низькомолекулярним гепарином, що отримується естерифікацією гепарину, екстрагованого із слизової оболонки кишечника свиней, з отриманням бензилових естерів гепарину натрію, і наступним виділенням з гепарину лужним гідролізом. В порівнянні з іншими гепаринами, еноксапарин натрію складніший за своїм складом внаслідок структурних змін (різниця в ділянках, що сульфатуються, та їх кількості), викликаних хімічними процесами виробництва. Середньомасова молекулярна маса еноксапарину натрію варіюється від 3800 до 5000 Да; де приблизно 20% олігосахаридів мають молекулярну масу менше 2000 Да; понад 68% олігосахаридів мають молекулярну маси від 2000 до 8000 Да; не більше 18 % олігосахаридів мають молекулярну масу понад 8000 Да. Під час виробничого процесу лужна деградація включає дві основні конкурентні хімічні реакції, а саме: β-елімінування та гідроліз бензилового естеру). Після розкладання отримують низькомолекулярний гепарин, в якому олігосахаридний ланцюг має середню молекулярну масу приблизно 4500 (US5389618). Отримані олігосахаридні ланцюги еноксапарину натрію як і раніше несуть пентасахаридну структуру, яка проявляє подібну антикоагулянтну дію, властиву батьківським ланцюгам полісахаридів гепарину, і така пентасахаридна послідовність складає 15-25% еноксапарину натрію. В процесі рестриктивної деградації гепарину можуть мати десульфування і деамінування та глюкозамінова частина на відновлюваному кінці полісахариду може піддаватися наступним характерним перетворенням: (1) епімеризація між глюкозаміном та манозаміном (Т. Toida та ін., Дж. Carbohydrate. Chem. 15(13), 351-360(1996)), і (2) 6-O-десульфатування 6-O-сульфатованого глюкозаміну з утворенням так званої 1,6-ангідрокільцевої структури. Ці реакції ускладнюються структурною різноманітністю та складністю еноксапарину натрію. Окрім вищезгаданих перетворень також виникали структурні зміни в довжині цукрового ланцюга, послідовності і тонкій структурі будівельних блоків. Характеристичною ознакою структури еноксапарину натрію є наявність 1,6-ангідроструктури на відновлюваному кінці олігосахариду. Співвідношення 1,6-ангідрокільцевої структури стосується молярного відсотку олігосахаридних ланцюгів з 1,6-ангідрокільцевою структурою. Співвідношення 1,6-ангідрокільцевих структур використовувався як критерій при контролі фармацевтичної якості еноксапарину натрію відповідно до вимог Фармакопеї Сполучених Штатів Америки та Європейської фармакопеї. Згідно з Європейською фармакопеєю, вміст олігосахаридних ланцюгів з 1,6-ангідрокільцевою структурою повинен складати 15-25% усіх олігосахаридних ланцюгів. Проте у високій мірі складна структура еноксапарину натрію (значна неоднорідність і відмінність в ступеню сульфатації дисахаридної одиниці) істотно утрудняє аналіз тонкої структури. Високоефективна рідинна хроматографія на сильній аніонообмінній речовині (SAX - HPLC) є методом першого вибору при аналізі сульфатованих олігосахаридних компонентів еноксапарину натрію. Крім того, високоефективна рідинна хроматографія або гель-проникна хроматографія низького тиску (GPC) є ефективним засобом при розділенні полісахариду і знесолюванні на основі молекулярної маси. У багатьох джерелах повідомлялися методи хроматографії для аналізу продуктів еноксапарину, що піддаються повному ферментативному розкладанню (наприклад, CN03822562.X і CN200580009444.0). Проте при визначенні методом хроматографії на сильній аніонообмінній речовині (SAX) декілька дисахаридів не розділяються в початковому стані, аномери α і β на відновлюваному кінці олігосахариду підлягають видаленню борогідридом натрію, щоб уникнути розділення піку. Альтернативно широко застосовували метод капілярного електрофорезу (КЕ) для аналізу сульфатованих полісахаридів (див. US 7,575,886 B2, Ampofo, S. et al., Anal. Biochem. 199:249255 (1991); Malsch et al., J. Chromatogr. A. 716:258- 268 (1995)). Проте не повідомлялося раніше 1 UA 112070 C2 5 10 15 20 25 30 35 40 45 про застосування методу капілярного електрофорезу для розділення і визначення співвідношення утворення 1,6-ангідрокільцевої структури. Лазерна десорбція-іонізація у присутності матриці/час-пролітна мас-спектрометрія (MALDITOF-MS), які не вимагали застосування методу хроматографії, також можуть застосовуватися для аналізу гепарину і використовувалися для визначення послідовності ланцюгів олігосахаридів (Н. Sakaguchi et al., J. Biochem. 129#00107-118; A. J. Rhomberg, et al., Proc. Nalt. Acad. Sci. USA 95 #014176-4181; L. Sturiale, et al., Semin. Thromb. Hemost.27#02465-472). Проте MALDI-TOF-MS не вважається придатним способом для аналізу зразка із складним вмістом (інтактний еноксапарин) і не підходить для контролю якості продукту унаслідок високої вартості методу. Короткий огляд винаходу Одним з об‘єктів цього винаходу є новий спосіб аналізу на базі КЕ для кількісного аналізу структури еноксапарину натрію. При застосуванні цього способу можна визначити якісний і кількісний вміст усіх структурних елементів еноксапарину, включаючи дисахариди, трисахариди, тетрасахариди та чотири 1,6-ангідроолігосахариди. Іншим об‘єктом цього винаходу є новий спосіб визначення молярного відсотку олігосахаридного ланцюга з 1,6-ангідрокільцевою структурою в еноксапарині натрію (зазвичай згадуване як співвідношення 1,6-ангідрокільцевої структури). Спосіб можна використовувати для контролю якості еноксапарину натрію в процесі виробництва. Цей спосіб повністю відрізняється від способу SAX - HPLC, який використовувався для визначення співвідношення 1,6-ангідрокільцевої структури. Спосіб КЕ, використовуваний в цьому винаході, можна застосовувати для розділення й кількісного визначення дисахаридів, трисахаридів і тетрасахаридів, отриманих в результаті вичерпного ферментативного розщеплення еноксапарину натрію, зокрема для визначення відсоткового вмісту олігосахаридних ланцюгів, що мають 1,6-ангідрокільцеву структуру, що є характеристичною структурою еноксапарину натрію. Винахід забезпечує спосіб тонкого структурного аналізу еноксапарину натрію, який складається з наступних стадій: (1). Розкладання зразка еноксапарину натрію шляхом вичерпного розщеплення сумішшю гепаринрозщеплюючих ферментів; (2). Розділення олігосахаридів зразку розкладеного еноксапарину натрію за допомогою капілярного електрофорезу, де олігосахариди включають дисахариди, трисахариди, тетрасахариди і олігосахариди з 1,6-ангідро структурою; (3). Співвідношення піків, які наявні в електроферограмі капілярного електрофорезу, з олігосахаридами у зразку розкладеного еноксапарину натрію згідно з лінійним зв'язком між електрофоретичною рухливістю та співвідношенням заряд-до-маси олігосахаридів; та (4). Кількісне визначення відсотка кожного олігосахариду стосовно усіх олігосахаридів, в зразку розщепленого еноксапарину натрію шляхом вимірювання нормалізованої хроматографічної площі піку. Даний спосіб КЕ розкриває вичерпне розщеплення зразка еноксапарину натрію за допомогою суміші ферментів, які піддають деградації гепарин, з наступним розділенням і аналізом деполімеризованого продукту шляхом капілярного електрофорезу. Змішані ферменти, які піддають деградації гепарин, включають як мінімум дві з: гепариназа I (EC 4.2.2.7), гепариназа II (без номера EC) і гепариназа III (EC 4.2.2.8), з переважним включенням трьох гепариназ, ще прийнятніше, якщо гепаринази змішані у співвідношенні 1:1:1. У повністю деполімеризованому продукті еноксапарину натрію можуть бути присутніми чотири олігосахариди, що мають 1,6-ангідрокільцеву структуру: 2 UA 112070 C2 5 10 15 Якщо в уроновій кислоті відсутня 2-O-сульфатована група в дисахариді поблизу дисахаридної одиниці, що має 1,6-ангідро структуру на кінці, 1,6-ангідрокільцева структура буде присутня у вигляді дисахаридів після вичерпної деградації під дією гепариназ; і якщо 2-Oсульфатована група в уроновій кислоті дисахариду, суміжного з дисахаридною одиницею, що має 1,6-ангідро структуру на кінці, і 1,6-ангідрокільцева структура присутня у вигляді манозаміну, олігосахарид із 1,6-ангідрокільцевою структурою існуватиме у вигляді тетрасахариду (ця форма може запобігати розщепленню тетрасахариду під дією ферментів). У продуктах, підданих вичерпному розщепленню, може бути трисахарид. Трисахарид 1, який утворюється в процесі деградації, має наступну структуру: Трисахарид 1 Інші компоненти в продуктах, підданих вичерпному розщепленню, включають 8 дисахаридів. (див. нижче для ΔIS, ΔIIIS, ΔIIS, ΔIVS, ΔIA, ΔIIA, ΔIIIA, and ΔIVA). Вони не мають типової характеристики еноксапарину натрію і можуть мати наступну структуру: 3 UA 112070 C2 5 Крім того, в продуктах, підданих вичерпному розщепленню, можна виявити і два дисахариди ΔIISgal і ΔIVSgal, які містять галактуронову кислоту, одержану 2-O-десульфатуванням -IdoA(2S)GlacNS(6S) і -IdoA(2S)-GlacNS. Два дисахариди як правило не присутні в первинній структурі гепарину (U.M. Desai et al., Arch. Biochem. Biophys. 306#00461-468(1993)). 4 UA 112070 C2 5 10 15 20 25 30 Два тетрасахариди, присутні в більшості низькомолекулярних гепаринів (НМГ) показані нижче. Вони можуть бути стійкими до розщеплення під дією ферментів та можуть відображати фрагменти із спорідненістю до антитромбіну III. Два тетрасахариди представлені наступними символами: ΔIIA - IISglu і ΔIIa - IVSglu (S. Yamada, et al., J. Biol. Chem.; 270(7), 4780-4787(1993)). Структурна ідентифікація вищезгаданих дисахаридів, трисахаридів, тетрасахаридів і олігосахаридів, що мають 1,6-ангідроциклічну структуру, також можуть бути знайдені у Фармакопеї Сполучених Штатів (Друге доповнення, USP - NF, Хімічні аналізи / похідні 1,6ангідро для еноксапарину натрію). Винахід забезпечує спосіб КЕ для розділення дисахаридів, трисахаридів, тетрасахаридів і олігосахаридів, що мають 1,6-ангідрокільцеву структуру, при вичерпному розщепленні зразка еноксапарину натрію. КЕ може використовувати капіляр з плавленого кварцу, рухомий буфер, напруга розділення, тиск ін’єкції, час ін’єкції, температуру капіляра; та УФ детектування довжини хвиль. У винайденому способі застосовували капілярну колонку з плавленого кварцу, яка може мати довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм. Ефективна довжина капіляру заздалегідь відображає довжину від блоку введення до детектора та обчислюється відніманням 10 см від загальної довжини, і може злегка варіюватися залежно від типу приладу для капілярного електрофорезу. В іншому втіленні винаходу застосовували капілярну колонку з плавленого кварцу, яка може мати довжину від 70 до 100 см і внутрішній діаметр від 40 до 60 мкм. Рухомий буфер для капілярного електрофорезу вибирають з NaH 2PO4 - H3PO4, Tris - H3PO4 або LiH2PO4 - H3PO4, в концентрації від 150 до 300 мМ і pH від 1,5 до 4,0. В іншому втіленні винаходу рухомий буфер для капілярного електрофорезу може бути обраний з NaH2PO4 - H3PO4, Tris - H3PO4 або LiH2PO4 - H3PO4, в концентрації від 200 до 250 мМ і pH від 2,0 до 4,0. В іншому втіленні винаходу до вищезгаданого рухомого буфера може додаватись MgCl 2, ZnCl2 в концентрації від 1 до 5 мМ і поліетиленгліколь (ПЕГ) з молекулярною масою від 5000 до 5 UA 112070 C2 5 10 15 20 25 30 35 40 45 50 55 60 100000 в концентрації від 0,1% до 5% (маса/об'єм). Мета додавання 0,1% ~5% MgCl 2 або ZnCl2 і ПЕГ в буферний розчин - змінити електрофоретичну рухливість олігосахаридів, які можуть мати схожий час електрофоретичної рухливості, електрофорезний час міграції ΔIS, трисахарид і 1,6ангідро ΔIS-IS, таким чином покращуючи їх ступінь розділення. При іншому варіанті винаходу до вищезгаданого рухомого буфера переважно додають MgCl2, ZnCl2 в концентрації від 2 до 4 мМ і ПЕГ з молекулярною масою від 10000 до 50000 в концентрації від 1% до 3% (маса/об'єм). Напруга розділення в капілярі може складати від -15 до -30 кВ, переважно від - 0 кВ до -25 кВ і може варіюватися залежно від типу приладу для капілярного електрофорезу. У способі капілярного електрофорезу, описаному у винаході, може використовуватися гідродинамічне введення проби. Тиск при введенні проби може складати від 1 до 100 мбар і час введення проби може складати від 1 до 60 сек; переважно, тиск при введенні проби може складати від 30 до 60 мбар і час введення проби може бути від 5 до 30 сек; прийнятніше, тиск при введенні проби може складати від 40 до 50 мбар і час введення проби від 10 до 20 сек. В процесі електрофорезу, після останнього проходу сульфатованого дисахариду IIAΔ через детектор застосовують альтернативний тиск для проштовхування ΔIVA через детектор для детектування. Тиск може складати від 5 до 150 мбар, і переважно, щоб тиск складав від 5 до 30 мбар, від 10 до 20 мбар або від 300 до 150 мбар залежно від типу приладу для капілярного електрофорезу. Температура капіляра в цьому винаході може складати від 10 до 40°С, переважно від 20 до 30°С. Довжина хвилі при УФ детектуванні в цьому винаході може складати від 230 до 235 нм, переважно від 230 до 232 нм. В цілому умови розділення при капілярному електрофорезі можуть бути оптимізовані таким чином: капілярна колонка з плавленого кварцу може мати довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм; рухомий буфер для капілярного електрофорезу вибирають з NaH2PO4 - H3PO4, Tris - H3PO4 або LiH2PO4 - H3PO4, в концентрації від 150 до 300 мМ і pH від 1,5 до 4,0. До вищезгаданого рухомого буфера перед використанням можуть додати MgCl 2, ZnCl2 в концентрації від 1 до 5 мМ і ПЕГ з молекулярною масою від 5000 до 100000 в концентрації від 0,1% до 5,0% (маса/об'єм); прикладають напругу в діапазоні від -15 до -30 кВ. Тиск при гемодинамічному введенні проби може складати від 1 до 100 мбар і час введення проби від 1 до 60 сек. Після останнього проходу сульфатованого дисахариду ΔIIA через детектор можна застосовувати тиск 5-150 мбар для проштовхування ΔIVA через детектор для детектування. В процесі електрофорезу можна регулювати температуру капіляра на рівні 10-40°C, і довжину хвилі при УФ детектуванні повинна складати від 230 до 235 нм. В іншому втіленні винаходу умови розділення при капілярному електрофорезі можна оптимізувати таким чином: капілярна колонка з плавленого кварцу повинна мати довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм; рухомий буфер може містити NaH 2PO4 - H3PO4, Tris - H3PO4 або LiH2PO4 - H3PO4 в концентрації 150-300 мМ і до вищезгаданого рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 1 до 5 мМ, рН 1,5-4,0 і ПЕГ з молекулярною масою від 5000 до 100000 в концентрації від 0,1% до 5,0% (маса/об'єм); прикладають напругу в діапазоні від - 15 до - 30 кВ; тиск при гемодинамічному введенні проби складає від 30 до 60 мбар і час введення проби від 5 до 30 сек; після останнього проходу сульфатованого дисахариду ΔIIA через детектор застосовують тиск 5-150 мбар для проштовхування ΔIVA через детектор для детектування; і в процесі електрофорезу регулюють температуру капіляра на рівні 10-40°C, і довжина хвилі при УФ детектуванні повинна складати від 230 до 235 нм. В іншому втіленні винаходу умови розділення при капілярному електрофорезі оптимізують таким чином: капілярна колонка з плавленого кварцу повинна мати довжину від 70 до 100 см і внутрішній діаметр від 40 до 60 мкм; рухомий буфер може містити NaH2PO4 - H3PO4, Tris - H3PO4 або LiH2PO4 - H3PO4 в концентрації 200-250 мМ і до вищезгаданого рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 2 до 4 мМ, рН 2-4 і ПЕГ з молекулярною масою від 10000 до 50000 в концентрації від 1% до 3% (маса/об'єм); прикладають напругу в діапазоні від -15 до -25 кВ; тиск при гемодинамічному введенні проби складає від 40 до 50 мбар і час введення проби від 10 до 20 сек; після останнього проходу сульфатованого дисахариду Δ IIA через детектор застосовують тиск 10-20 мбар для проштовхування ΔIVA через детектор для детектування; і в процесі електрофорезу регулюють температуру капіляра на рівні 20-30°C, і довжина хвилі при УФ детектуванні повинна складати від 230 до 232 нм. В іншому переважному втіленні винаходу умови розділення при капілярному електрофорезі можна оптимізувати таким чином: капілярна колонка може мати внутрішній діаметр 50 мкм і 6 UA 112070 C2 5 10 15 20 25 30 35 загальну довжину 85 см; до розділяючого буфера перед використанням можна додати 200 мМ Tris - H3PO4 і 2 мМ MgCl2, при pH 2,5; поліетиленгліколь 1% (маса/об'єм) з молекулярною масою 10000; тиск при введенні проби може складати 50 мбар і час введення проби може бути 15 сек; напруга при розділенні може бути -25 кВ; після останнього проходу сульфатованого дисахариду ΔIIA через детектор застосовують тиск 20 мбар для проштовхування ΔIVA через детектор для детектування; тиск в колонці може складати 25°С; і довжина хвилі при УФ детектуванні може бути 232 нм. В іншому переважному втіленні винаходу умови розділення при капілярному електрофорезі можна оптимізувати таким чином: капілярна колонка може мати внутрішній діаметр 50 мкм і загальну довжину 80 см; до рухомого буфера перед використанням можна додати 200 мМ Tris H3PO4 і 2 мМ MgCl2, при pH 2,7; поліетиленгліколь 1,3% (маса/об'єм) з молекулярною масою 10000; тиск при введенні проби може складати 55 мбар і час введення проби може бути 10 сек; напруга при розділенні може бути -22 кВ; після останнього проходу сульфатованого дисахариду ΔIIA через детектор можна застосувати тиск 138 мбар для проштовхування ΔIVA через детектор для детектування; тиск в колонці може складати 25°С; і довжина хвилі при УФ детектуванні може бути 230 нм. В іншому втіленні винаходу електрофореграма продуктів гепарину натрію, підданих вичерпному розщепленню, показана на Фіг 3А; електрофореграма продуктів еноксапарину натрію, підданих вичерпному розщепленню, показана на Фіг. 3B; експерименти виконували на системі КЕ Agilent. В іншому втіленні винаходу електрофореграма продуктів еноксапарину натрію, підданих вичерпному розщепленню, показана на Фіг. 4; виконували експеримент на системі КЕ BECKMAN MDQ. За допомогою цього способу винаходу можна виявляти дисахариди, присутні в зразках еноксапарину натрію, підданих вичерпному розщепленню, при цьому використовуються 7 стандартів зразків дисахаридів (ΔIVA, ΔIS, ΔIIIS, ΔIIS, ΔIA, ΔIIA, ΔIIIA). Для сахаридів, відносно яких стандарти зразків відсутні, можна застосовувати електрофоретичну рухливість як якісний показник. Електрофоретична рухливість - фізико-хімічний параметр аналізованої речовини. За наявності певного рухомого буфера при цій температурі і цьому показнику рН, аналізована речовина має постійну електрофоретичну рухливість. Таким чином, електрофоретичну рухливість можна використовувати для виявлення відповідного піку на електрофореграмі. Електрофоретична рухливість кожного компонента розраховується за формулою 1 де LT і LD - загальна довжина і ефективна довжина капіляру, відповідно; V - прикладена напруга; і t час руху. За формулою 2 електрофоретична рухливість цієї аналізованої речовини лінійно корелює із співвідношенням заряду до маси. 40 45 50 55 де Z - ефективний заряд іона, η - в'язкість розчину, і r - діаметр іона. Структури усіх 17 олігосахаридів у складі зразків еноксапарину натрію, підданих вичерпному розщепленню, продемонстровані вище. Як мінімум 5 стандартів зразків олігосахаридів можуть піддаватись електрофорезу для визначення електрофоретичної рухливості (μ). Потім будують графік кореляції електрофоретичної рухливості і співвідношення заряду до маси. В результаті аналізу лінійної регресії можуть отримати формулу, яка описує зв'язок між електрофоретичною рухливістю μ і співвідношенням заряду до маси Z/M. Електрофоретична рухливість інших олігосахаридів виводиться з лінійної формули, яку можна використовувати для ідентифікації цих олігосахаридів у відсутності стандартів. Відповідно до винаходу шість сульфатованих стандартів зразків (ΔIS, ΔIIIS, ΔIIS, ΔIA, ΔIIA, ΔIIIA) піддають електрофорезу для визначення електрофоретичної рухливості (μ); потім будують графік кореляції електрофоретичної рухливості та співвідношення заряду до маси; отримують лінійну формулу зв'язку між електрофоретичною рухливістю μ і співвідношенням заряду до маси Z/M з використанням аналізу лінійної регресії; електрофоретична рухливість інших олігосахаридів прогнозується відповідно до лінійної формули, яку можна використовувати для ідентифікації інших олігосахаридів за відсутності стандартних зразків. 7 UA 112070 C2 5 10 15 20 25 30 В переважному втіленні винаходу визначалася електрофоретична рухливість 6 стандартів сульфатованих дисахаридів, потім будувався графік кореляції електрофоретичної рухливості та співвідношення заряду до маси відповідних дисахаридів, як показано на малюнку 1 (при pH 2,5, враховуються тільки сульфогрупи, тому чистий заряд кожного олігосахариду приблизно 2 еквівалентний числу сульфогруп). Нижче представлена лінійна формула (R =0,9995): де Z/M - співвідношення заряду до маси олігосахаридів; і μ - відповідна електрофоретична рухливість цього олігосахариду. Відповідна електрофоретична рухливість (теоретичне значення розраховується за формулою 3) представлена в таблиці 1. До того ж в таблиці 1 представлені фізико-хімічні параметри олігосахариду в еноксапарині натрію, підданому вичерпному розщепленню, включаючи молекулярну масу, кількість SO3 на одиницю сахариду, співвідношення заряду до маси і вимірювану електрофоретичну рухливість. Був побудований графік кореляції електрофоретичної рухливості окремого олігосахариду, як показано на Фіг. 2. Виміряний показник і теоретичний показник електрофоретичної рухливості окремого олігосахариду в основному розподілялися по лінії y=x даного винаходу, і демонстрували добру кореляцію (0,98). Тому за допомогою способу винаходу можна ідентифікувати усі піки на електрофореграмі еноксапарину натрію, підданого вичерпному розщепленню, відповідно до лінійного зв'язку між електрофоретичною рухливістю і співвідношенням заряду до маси. Даним винаходом визначаються сім зразків олігосахаридів, присутніх у зразках еноксапарину натрію. Як показано на Фіг. 3, піки 1-7 - це піки сульфатованих дисахаридів, які рухаються в порядку руху ΔIS, ΔIIIS, ΔIIS, ΔIA, ΔIVS, ΔIIIA, ΔIIA. Оскільки значення pH (2,5) рухливого буфера нижче, ніж константа іонізації (pKa) карбоксильних груп, несульфатований дисахарид ΔIVA несе карбоксильну групу і важко піддається іонізації, й не має електрофоретичної рухливості під час електрофоретичного процесу, тому необхідно застосувати альтернативний тиск для проштовхування ΔIVA до віконця для детектування (пік 8 на Фіг. 3). У цьому винаході внаслідок лінійного зв'язку між електрофоретичною рухливістю і співвідношенням заряду до маси, пік 9 вважається дисахаридом ΔIISgal, і пік 10 вважається галактозою дисахариду ΔIVSgal. Вміст ΔIVSgal дуже низький, його можна спостерігати на електрофореграмі при застосуванні тиску в процесі електрофорезу внаслідок розширення суміжного піку. В умовах нормального тиску пік 10 можна чітко спостерігати як ΔIVSgal. Таблиця 1 Фізико - хімічні параметри олігосахаридів, отриманих в результаті вичерпного ферментативного розщеплення еноксапарину натрію Електрофоретична -4 рухливість (10 ) Пік № Олігосахарид Молекулярна Кількість SO3 Співвідношення Теоретичне Виміряне маса на одиницю заряду до маси значення значення -3 сахариду (10 ) 1 ΔIS 665 3 4,51 3,102 2,941 2 ΔIIIS 563 2 3,55 2,475 2,367 3 ΔIIS 563 2 3,55 2,475 2,314 4 ΔIA 605 2 3,31 2,318 2,231 5 ΔIVS 461 1 2,17 1,574 1,481 6 ΔIIIA 503 1 1,99 1,456 1,454 7 ΔIIA 503 1 1,99 1,456 1,423 8 ΔIVA 401 0 0 0,156 9 ΔIISgal 563 2 3,55 2,475 2,277 10 ΔIVSgal 461 1 2,17 1,574 11 ΔIIA - IISglu 1168 2 3,48 2,429 2,432 12 ΔIIA - IVSglu 1066 1,5 2,81 1,991 2,057 13 Трисахарид 965 2,67 4,15 2,867 2,923 14 1,6-ангідро ΔIS-IS 1210 2,5 4,13 2,854 2,903 8 UA 112070 C2 Продовження таблиці 1 15 1,6-ангідроΔIS 16+17 1,6-ангідроΔIIS 5 10 15 20 25 30 35 40 45 50 545 443 2 1 3,67 2,26 2,553 1,632 2,612 1,693 Примітка: Кількість SO3 на одиницю сахариду дорівнює середній кількості групи SO 3 кожної одиниці дисахариду в олігосахариді та розраховується діленням загальної кількості груп SO 3 на кількість одиниць сахаридів в олігосахариді (одиниця олігосахариду представляє одиницю дисахариду, що складається з D-β-глюкуронової кислоти (або L-α-ідуронової кислоти) і Nацетилглюкозаміну). У цьому винаході піки 11 і 12 (Фіг. 3) розділяються тетрасахариди відповідно до лінійного зв'язку між електрофоретичною рухливістю і співвідношенням заряду до маси. Пік 11 вважається тетрасахаридом ΔIIA - IISglu, а пік 12 - тетрасахаридом ΔIIA - IVSglu. У цьому винаході при розділенні зразка тільки за допомогою базового буфера пік 13 елюює спільно з дисахаридом IS (пік 1), і пік 14 може частково зливатися з піком 1. Додають певну кількість ПЕГ до буфера, що забезпечує хороше розділення між піками 1 і 13. Це відбувається внаслідок того, що ПЕГ може змінити пік олігосахаридів на підставі їх молекулярного розміру та сильно покращити результати розділення. У цьому винаході до рухливого буфера додають MgCl 2, ZnCl2 для поліпшення розділення. 2+ 2+ Мета додавання Mg або Zn - змінити електрофоретичну рухливість олігосахаридів шляхом утворення тимчасових іонних пар з групами SO3, приєднаними до олігосахаридних ланцюгів. Трисахарид продукується під дією вичерпного ферментативного розщеплення еноксапарину натрію. За рівнянням 3 лінійні зв'язки електрофоретичної рухливості та співвідношення заряду до маси пік 13 вважаються трисахаридом. Так само за рівнянням 3 можна ідентифікувати чотири 1,6-ангідро олігосахариди. Співвідношення заряду до маси 1,6-ангідроΔIS-IS трохи менше, ніж такий показник для трисахариду (на 0,02). Отже пік поблизу піку 13 (трисахарид) вважається 1,6-ангідроΔIS-IS (пік 14). Крім того, співвідношення площі піку між 1,6-ангідроΔIS-IS та трисахаридом, отриманим при розділенні продуктів еноксапарину натрію за допомогою SAX - HPLC, можна використовувати для розділення піків, відповідних 1,6-ангідроΔIS-IS і трисахаридів на електрофореграмі. 1,6ангідроΔIS має співвідношення заряду до маси 3,67, і отже пік 15 на електрофореграмі можна вважати 1,6-ангідроΔIS. 1,6-ангідро ΔIIS присутній у формі аномерів, 1,6-ангідроΔIIS і 1,6ангідроΔIIS епі, тому вони повинні мати однакові площі піків і час пересування. Отже піки 16 і 17 (Фіг. 3) вважаються 1,6-ангідроΔIIS і 1,6-ангідроΔIIS епі, відповідно. Нормалізовані хроматографічні площі піку достатньою мірою узгоджуються з отриманими розділенням за допомогою SAX - HPLC. Усі піки, присутні на електрофореграмі на Фіг. 3, вказані в таблиці 1. Оскільки площа піку кожного компонента на електрофореграмі пропорційна молярній концентрації такого компонента, якісне визначення кожного компонента досягається при використанні нормалізованої хроматографічної площі піку за наступною формулою: де, Mwn - молекулярна маса цього компонента, Arean - площа піку такого компонента і Mwx і Areax - молекулярна маса і площа піку x, що відповідає його кількості вказаній в Таблиці 1, відповідно. Згідно зі втіленнями, цей винахід забезпечує спосіб визначення відсоткової маси олігосахаридів з характеристичною 1,6-ангідрокільцевою структурою в еноксапарині натрію, який складається з наступних стадій: (1). Розкладання зразка еноксапарину натрію шляхом вичерпного розщеплення сумішшю гепаринрозщеплюючих ферментів; (2). Розділення олігосахаридів зразку розкладеного еноксапарину натрію за допомогою капілярного електрофорезу, де олігосахариди включають дисахариди, трисахариди, тетрасахариди і олігосахариди з 1,6-ангідро структурою; (3). Співвідношення піків, які наявні в електроферограмі капілярного електрофорезу з олігосахаридами у зразку розкладеного еноксапарину натрію згідно з лінійним зв'язком між електрофоретичною рухливістю та співвідношенням заряд-до-маси олігосахаридів і ідентифікація піків олігосахаридів з 1,6-ангідрокільцевою структурою; 9 UA 112070 C2 5 10 (4). Кількісне визначення кількості олігосахаридів з 1,6-ангідрокільцевою структурою відповідно до їх площин піку і наступне визначення молярного відсотка 1,6-ангідрокільцевої структури в еноксапарині натрію. На цих стадіях кожен параметр відповідає описаному вище. Спосіб винаходу побудований на широко прийнятій гіпотезі: якщо усі ненасичені олігосахариди в продуктах, підданих вичерпному розщепленню, виявляються при довжині УФ -1 -1 -1 хвилі 230 ~235 нм, вони мають однаковий час поглинання (5500 моль ·л ·см ). Отже, масовий відсоток усіх компонентів у складі зразку еноксапарину натрію, підданого вичерпному розщепленню, можна визначати з використанням способу нормалізованої хроматографічної площі піку. Наприклад, 1,6-ангідродисахарид (наприклад, 1,6-ангідроΔIIS), дисахарид 2 (наприклад, 1,6-ангідроΔIIS), дисахарид 3 (наприклад, 1,6-ангідро ΔIS) і тетрасахарид 1 (наприклад, 1,6-ангідроΔIS-IS) відповідає пікам 16, 17, 15 і 14, відповідно, та їх масові відсотки можна розрахувати за формулами: 15 20 25 30 35 40 45 де Area14, Area15, Area16 і Area17 відповідає площі піків 14, 15, 16 і 17, відповідно; Молекулярна маса чотирьох компонентів 545, 1210, 443 і 443, відповідно; Mw x і Areax представляє молекулярну масу кожного компонента на електрофореграмі, відповідно. Якщо середньомасова молекулярна маса еноксапарину натрію W X, молярний відсоток олігосахаридних ланцюгів з 1,6-ангідрокільецвою структурою, можна розрахувати за формулами (7) або (8) : Молярний відсоток інших компонентів структури еноксапарину натрію також можна розрахувати з використанням того ж способу. Спосіб забезпечений винаходом можна застосовувати для ідентифікації тонкої структури або кількісного аналізу різних полісахаридів, включаючи гепарин, низькомолекулярний гепарин і ультранизькомолекулярний гепарин. Короткий опис фігур На Фіг. 1 показаний графік кореляції електрофоретичної рухливості та співвідношення заряду до маси шести сульфатованих дисахаридів. На Фіг. 2 показаний графік кореляції виміряного показника порівняно з теоретичним показником електрофоретичної рухливості усіх продуктів еноксапарину натрію. На Фіг. 3 показане електрофоретичне розділення зразків еноксапарину натрію і гепарину натрію, підданих вичерпному розщепленню, при КЕ, де на Фіг. 3А показана електрофореграма продуктів гепарину натрію, підданих вичерпному розщепленню; а на Фіг. 3В - електрофореграма зразків еноксапарину натрію, підданих вичерпному розщепленню (стандарт Фарм. США). Експерименти виконували на системі КЕ Agilent. На Фіг. 4 представлена електрофореграма продуктів еноксапарину натрію, підданих вичерпному розщепленню, (стандарт Фарм. США), і експерименти виконували на системі для КЕ BECKMAN MDQ. Приклад 1 Приготування випробовуваного розчину (1). Приготування розчину ацетату натрію / ацетату кальцію при pH 7,0: 10 мг альбуміну 10 UA 112070 C2 5 10 15 20 25 30 35 40 45 50 55 бичачої сироватки і 32 мг ацетату кальцію розчиняли в 60 мл води і потім додавали 580 мкл крижаної оцтової кислоти. Після доведення до pH 7,0 за допомогою розчину 2 M NaOH розчин переносили в мірну колбу об'ємом 100 мл і розбавляли водою до кінцевого об'єму 100 мл. Отриманий розчин фільтрували через мембранний фільтр з розміром пор 0,45 мкм перед використанням. (2). Приготування буфера фосфату калію при pH 7,0: 68 мг дигідрофосфату калію і 10 мг альбуміну бичачої сироватки розчиняли в 30 мл води, доводили до рН 7,0 розчином гідроксиду калію. Розчин переносили в мірну колбу об'ємом 50 мл і розбавляли водою до кінцевого об'єму 50 мл. (3). Приготування розчину гепаринази: кожну гепариназу (I, II і III) : окремо розчиняють в розчині калій-фосфатного буфера (pH 7,0) до отримання розчину в концентрації 0,4 МО/мл Розчин зберігають при температурі - 20°C до використання. (4). Приготування суміші гепаринази I, II і III: Розчини трьох гепариназ змішують в співвідношенні 1:1:1. (5). Приготування розчину еноксапарину натрію: 20 мг еноксапарину натрію розчиняють в 1 мл води для отримання розчину 20 мг/мл (6). Зразки, отримані в результаті вичерпного ферментативного розщеплення еноксапарину натрію: 20 мкл розчину еноксапарину натрію, 70 мкл розчину ацетату натрію / ацетату кальцію (pH 7,0) і 100 мкл суміші гепариназ (I, II, III) обережно перемішують і потім суміш інкубують при температурі 25°С на водяній бані протягом 48 годин. Згодом оброблену суміш вводять в колонку для КЕ для виконання електрофорезу. (7). Зразки, отримані в результаті вичерпного ферментативного розщеплення гепарину натрію: 20 мкл розчину гепарину натрію, 70 мкл розчину ацетату натрію / ацетату кальцію (pH 7,0) і 100 мкл суміші гепариназ (I, II, III) обережно перемішують і потім суміш інкубують при температурі 25°С на водяній бані протягом 48 годин. Згодом оброблену суміш вводять в колонку для КЕ для виконання електрофорезу. (8). Змішують по 20 мкл кожного з 7 стандартів дисахаридів (ΔIVA, ΔIS, ΔIIIS, ΔIIS, ΔIA, ΔIIA, ΔIIIA). Отриману суміш розділяють в умовах КЕ, описаних в Прикладі 2. Визначають електрофоретичну рухливість 6 стандартів сульфатованих дисахаридів. Будують графік кореляції (Фіг. 1) електрофоретичної рухливості та співвідношення заряду до маси дисахаридів і 2 отримують лінійну формулу (R =0,9995): де Z/M - співвідношення заряду до маси олігосахаридів; і μ - відповідна електрофоретична рухливість цього олігосахариду. (9). Графік кореляції виміряного показника порівняно з теоретичним показником електрофоретичної рухливості кожного олігосахариду показаний на малюнку 2. Виміряний показник і теоретичний показник електрофоретичної рухливості кожного олігосахариду загалом розподілялися по лінії y=x, і демонстрували гарну кореляцію (0,98). Приклад 2 Умови капілярного електрофорезу Розділення виконували на системі КЕ Agilent. Капілярна колонка з плавленого кварцу з внутрішнім діаметром 50 мкм, зовнішнім діаметром 370 мкм, загальною довжиною 85 см і ефективною довжиною 75 см; рухливий буфер складається з 200 мМ Tris - H3PO4 і 2 мМ MgCl2, pH 2,5; додають 1% (маса/об'єм) поліетиленгліколю з молекулярною масою 10000 до буферного розчину безпосередньо перед використанням; тиск при введенні проби складає 50 мбар і час введення проби 15 сек; напруга при розділенні склала -25 кВ; після елюювання моносульфатованого дисахариду ΔIIА (близько 34 хвилини) застосовують тиск 20 мбар для проштовхування ΔIVA через детектор для детектування; тиск в колонці складає 25°С; і довжина хвилі при УФ детектуванні 232 нм. Електрофореграма продуктів еноксапарину натрію і гепарину натрію, підданих вичерпному розщепленню, при капілярному електрофорезі показана на Фіг. 3A і 3B, відповідно. Приклад 3 Аналіз зразка 1 Як показано на Фіг. 3 тільки продукти, отримані в результаті вичерпного ферментативного розщеплення еноксапарину натрію, містили 1,6-ангідро олігосахариди. Відповідно до формули , 11 UA 112070 C2 5 або формул (4), (5) і (6) розраховується відсоток кожного олігосахариду, отриманого з еноксапарину натрію, підданого вичерпному розщепленню (як вказано в таблиці 2), при якому 1,6-ангідро олігосахариди 14, 15 і 16+17 складають 1,61%, 0,95% і 0,64%. Відомо, що еноксапарину натрій за Фарм. США, випробовуваний в нашому експерименті, має середньмасову молекулярну масу 4432. Молярний відсоток олігосахаридних ланцюгів з 1,6ангідрокільцевою структурою в еноксапарині натрію був 19,99% і розрахований за формулою (7) і (8). Таблиця 2 Масовий відсоток кожного олігосахариду, отриманого в результаті вичерпного ферментативного розщеплення еноксапарину натрію Номер піку 1 2 3 4 5 6 7 8 9 11 12 13 14 15 16+17 Олігосахарид ΔIS ΔIIIS ΔIIS ΔIA ΔIVS ΔIIIA ΔIIA ΔIVA ΔIISgal ΔIIA - IISglu ΔIIA - IVSglu Трисахарид 1,6-ангідро ΔIS - IS 1,6-ангідро ΔIS 1,6-ангідро ΔIIS Молекулярна маса 665 563 563 605 461 503 503 401 563 1168 1066 965 1210 545 443 Площа піку 331,50 41,30 59,00 9,90 25,30 18,00 26,70 32,56 4,50 9,00 2,50 4,00 4,80 6,30 5,20 Масовий відсоток (%) 61,03 6,44 9,20 1,65 3,23 2,51 3,72 3,61 0,70 2,91 0,74 1,07 1,61 0,95 0,64 Неможливо точно розрахувати масовий відсоток слідів дисахариду ΔIVSgal (пік 10), і його не можна ігнорувати внаслідок надмірно низької кількості. 10 15 20 Приклад 4 Аналіз зразка 2 Розділення виконували на системі КЕ Beckman MDQ. Капілярна колонка мала внутрішній діаметр 50 мкм і загальну довжину 80 см; до рухливого буфера перед використанням додають 200 мМ Tris - H3PO4 і 2 мМ MgCl2, при pH 2,5; поліетиленгліколь 1,3% (маса/об'єм) з молекулярною масою 10000 безпосередньо перед використанням; тиск при введенні проби складає 55 мбар і час введення проби 10 сек; напруга при розділенні склала - 25 кВ; після елюювання моносульфатованого дисахариду ΔIIА застосовують тиск 138 мбар для проштовхування ΔIVA через детектор для детектування; тиск в колонці складає 25°С; і довжина хвилі при УФ детектуванні 230 нм. Електрофореграма продуктів еноксапарину натрію і гепарину натрію, підданих вичерпному розщепленню, при капілярному електрофорезі показана на Фіг. 4. У Таблиці 3 представлені площі піків і масовий відсоток кожного олігосахариду, отриманого в результаті вичерпного ферментативного розщеплення еноксапарину натрію Таблиця 3 Масовий відсоток кожного олігосахариду, отриманого в результаті вичерпного ферментативного розщеплення еноксапарину натрію Номер піку 1 2 3 4 5 Олігосахарид ΔIS ΔIIIS ΔIIS ΔIA ΔIVS Молекулярна маса Площа піку 665 5795,12 563 643,21 563 900,13 605 147,85 461 248,91 12 Масовий відсоток (%) 66,94 6,294 8,804 1,554 1,994 UA 112070 C2 Продовження таблиці 3 6 7 8 9 11 12 13 14 15 16+17 ΔIIIA ΔIIA ΔIVA ΔIISgal ΔIIA - IISglu ΔIIA - IVSglu Трисахарид 1,6-ангідроΔIS-IS 1,6-ангідро ΔIS 1,6-ангідро ΔIIS 503 503 401 563 1168 1066 965 1210 545 443 186,49 271,85 49,84 77 172,54 33,43 105,38 85,53 132,95 48,84 1,63 2,38 0,35 0,75 3,50 0,62 1,77 1,80 1,26 0,38 Неможливо точно розрахувати масовий відсоток слідів дисахариду ΔIVSgal (пік 10), і його не можна ігнорувати внаслідок надмірно низької кількості. 5 Відповідно до формули , або формул (4), (5) і (6) розраховується відсоток кожного олігосахариду, отриманого з еноксапарину натрію, підданого вичерпному розщепленню (як вказано в таблиці 3), в якому 1,6ангідро олігосахариди 14, 15 і 16+17 складають 1,80%, 1,26% і 0,38%. Відомо, що еноксапарину натрій за Фарм. США, випробовуваний в нашому експерименті, має середньомасову молекулярну масу 4432; і молярний відсоток олігосахаридних ланцюгів з 1,6-ангідрокільцевою структурою в еноксапарині натрію був 20,58% і розрахований за формулою (7) і (8). 10 15 20 25 30 35 40 ФОРМУЛА ВИНАХОДУ 1. Спосіб капілярного електрофорезу (КЕ) для структурного аналізу еноксапарину натрію, який складається з наступних стадій: 1) розкладання зразка еноксапарину натрію шляхом повного розщеплення сумішшю гепаринрозщеплюючих ферментів, 2) розділення олігосахаридів зразка розкладеного еноксапарину натрію за допомогою капілярного електрофорезу, де олігосахариди включають дисахариди, трисахариди, тетрасахариди і олігосахариди з 1,6-ангідроструктурою, при цьому капілярний електрофорез здійснюють при наступних умовах: а) капілярна колонка з плавленого кварцу, що має довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм, b) рухомий буфер, включаючи NaH2PO4-Н3РО4, Tris-Н3РО4 або LiH2PO4-Н3РО4, або їх будь-які комбінації, в концентрації від 150 до 300 мМ і рН від 1,5 до 4,0, с) напруга розділення від -15 до -30 кВ, d) тиск при введенні проби від 1 до 100 мбар і час введення проби від 1 до 60 сек., e) температура капілярної колонки - 10-40 °С, f) довжина хвилі УФ-детектування - 230-235 нм, 3) співвідношення піків, які наявні в електроферограмі капілярного електрофорезу, з олігосахаридами у зразку розкладеного еноксапарину натрію згідно з лінійним зв'язком між електрофоретичною рухливістю та співвідношенням заряд-до-маси олігосахаридів, та 4) кількісне визначення відсотка кожного олігосахариду стосовно усіх олігосахаридів, у зразку розщепленого еноксапарину натрію шляхом вимірювання нормалізованої хроматографічної площі піка. 2. Спосіб за п. 1, де використовують суміш гепариназ на стадії 1), що містить щонайменше дві з: гепариназа І, гепариназа II і гепариназа III. 3. Спосіб за п. 2, де використовувана суміш гепариназ на стадії 1) є сумішшю гепаринази І, гепаринази II і гепаринази III. 4. Спосіб за п. 3, де використовувана суміш гепариназ на стадії 1) містить гепариназу І, гепариназу II і гепариназу III, які змішуються в співвідношенні 1:1:1. 5. Спосіб за п. 1, де олігосахариди з 1,6-ангідроструктурою отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру 13 UA 112070 C2 O-Na+ O-Na+ O O H O O O HO S O-Na+ HO NH O S O O O H O O O O O HO H OH H HO NH O O-Na+ S O-Na+ O O , , 1,6-ангідро ΔIS або 1,6-ангідро ΔIS глюкоза 1,6-ангідро ΔIIS або 1,6-ангідро ΔIIS глюкоза O O-Na+ O O H S O-Na+ O O O O O-Na+ O-Na+ O O O H O O O HO OH HO H O O O O O H NH O HO O-Na+ S O HO S O-Na+ O O , O 1,6-ангідро ΔIIS епі або 1,6-ангідро ΔIIS маноза NH O S O HO O-Na+ O O HO S O-Na+ O NH O S O O-Na+ . 1,6-ангідро ΔIS-IS епі або 1,6-ангідро ΔIS-IS маноза 6. Спосіб за п. 1, де трисахариди, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру 5 O O O-Na+ O-Na+ S O-Na+ O O O O O O O HO O O S O O HO O-Na+ NH O S O O|H HO O-Na+ O O S O O-Na+ . 7. Спосіб за п. 1, де дисахариди, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру 10 14 UA 112070 C2 O O O-Na+ S S O O-Na+ O-Na+ O-Na+ O O O O O O O O O HO O O S O O OH HO HO NH O-Na+ O O O CH3 O S HO NH O-Na+ O S O , ΔIA OH O-Na+ O , ΔIS O O O-Na+ S S O-Na+ O O-Na+ O-Na+ O O O O O O O O O HO OH O O OH HO HO NH OH OH HO NH O O CH3 S O , ΔIIA O-Na+ , ΔIIS O-Na+ OH O-Na+ OH O O O O O O HO O O S O O OH HO O-Na+ HO NH O O CH3 O-Na+ NH O S O , ΔIIIA HO S O O OH O-Na+ O , ΔIIIS O-Na+ O-Na+ OH O OH O O O O O HO OH O OH HO HO NH O OH OH HO NH O CH3 ΔIVA O S O , ΔIVS 15 O-Na+ . UA 112070 C2 8. Спосіб за п. 1, де два інші дисахариди, ΔIISgal і ΔIVSgal, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру O O-Na+ O-Na+ S O-Na+ O O O O O O O OH OH OH HO HO O O O HO OH HO NH NH O O S O-Na+ O S O O-Na+ . , ΔIISgal 5 OH ΔIVSgal 9. Спосіб за п. 1, де два тетрасахариди, ΔIIА - IISglu і ΔIIa-IVSglu, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру O O O-Na+ S O O-Na+ O O-Na+ O O O-Na+ S O O O O O O O HO OH O HO O HO NH OH O OH O-Na+ O O CH3 S HN O-Na+ S O O O , ΔІІА-IISglu 10 O O O-Na+ S O-Na+ O-Na+ O O OH O O O O O O HO OH O HO NH O HO OH O O O CH3 OH O-Na+ S O HN O-Na+ S O O . ΔІІА-IVSglu 10. Спосіб за п. 1, де капілярна колонка з плавленого кварцу на стадії 2) має довжину від 70 до 100 см і внутрішній діаметр від 40 до 60 мкм. 16 UA 112070 C2 5 10 15 20 25 30 35 40 45 50 55 11. Спосіб за п. 1, де рухомий буфер на стадії 2) вибирають з NaH 2PO4-Н3РО4, Tris-Н3РО4 або LiH2PO4-Н3РО4, в концентрації від 200 до 250 мМ і рН від 2,0 до 4,0. 12. Спосіб за п. 11, де до рухомого буфера на стадії 2) додають МgСl 2 або ZnCl2 в концентрації від 1 до 5 мМ, і поліетиленгліколь з молекулярною масою від 5000 до 100000 в концентрації від 0,1 до 5 % (маса/об'єм). 13. Спосіб за п. 12, де до рухомого буфера на стадії 2) додають МgСl 2 або ZnCl2 в концентрації 2-4 мМ, і поліетиленгліколь з молекулярною масою від 10000 до 50000 в концентрації від 1 до 3 % (маса/об'єм). 14. Спосіб за п. 1, де напруга розділення, прикладена до капіляра на стадії 2), складає від -20 до -25 кВ. 15. Спосіб за п. 1, де тиск при введенні проби складає від 30 до 60 мбар і час введення проби від 5 до 30 сек., або тиск при введенні проби складає від 40 до 50 мбар і час введення від 10 до 20 сек. 16. Спосіб за п. 15, де після останнього елюювання сульфатованого дисахариду ΔIIА на стадії 2) прикладають певний тиск для проштовхування ΔIVA через детектор для детектування. 17. Спосіб за п. 16, де напруга на стадії 2) складає від 5 до 150 мбар. 18. Спосіб за п. 17, де тиск на стадії 2) складає від 5 до 30 мбар, від 10 до 20 мбар і від 30 до 50 мбар і т. і., залежно від типу використовуваного приладу для капілярного електрофорезу. 19. Спосіб за п. 1, де температура капілярної колонки складає 20-30 °C. 20. Спосіб за п. 1, де довжина хвилі УФ-детектування складає 230-232 нм. 21. Спосіб за п. 1, де умови розділення капілярного електрофорезу наступні: капілярна колонка з плавленого кварцу повинна мати довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм, рухомий буфер для капілярного електрофорезу вибирають з NaH 2PO4-Н3РО4, Tris-Н3РО4 або LiH2PO4-Н3РО4, в концентрації від 150 до 300 мМ і рН від 1,5 до 4,0, до рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 1 до 5 мМ і ПЕГ з молекулярною масою від 5000 до 100000 в концентрації від 0,1 до 5,0 % (маса/об'єм), прикладають напругу в діапазоні від -15 до -30 кВ, тиск при гемодинамічному введенні проби складає від 1 до 100 мбар і час введення проби від 1 до 60 сек., після останнього проходу моносульфатованого дисахариду ΔIIА через детектор прикладають тиск 5-150 мбар для проштовхування ΔIVA через детектор для детектування, в процесі електрофорезу регулюють температуру капіляра на рівні 10-40 °C, і довжина хвилі при УФ-детектуванні повинна складати від 230 до 235 нм. 22. Спосіб за п. 21, де умови розділення капілярного електрофорезу наступні: капілярна колонка з плавленого кварцу має довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм, рухомий буфер може містити NaH2PO4-Н3РО4, Tris-Н3РО4 або LiH2PO4-Н3РО4 в концентрації 150300 мМ і до вищезгаданого рухомого буфера перед використанням додають MgCl 2, ZnCl2 в концентрації від 1 до 5 мМ, рН 1,5-4,0 і ПЕГ з молекулярною масою від 5000 до 100000 в концентрації від 0,1 % до 5,0 % (маса/об'єм), прикладають напругу в діапазоні від -15 до -30 кВ, тиск при гемодинамічному введенні проби складає від 30 до 60 мбар і час введення проби від 5 до 30 сек., після останнього проходу сульфатованого дисахариду ΔIIА, через детектор прикладають тиск 5-150 мбар для проштовхування ΔІVА через детектор для детектування, і в процесі електрофорезу регулюють температуру капіляра на рівні 10-40 °C, і довжина хвилі при УФ-детектуванні повинна складати від 230 до 235 нм. 23. Спосіб за п. 21, де умови розділення капілярного електрофорезу наступні: капілярна колонка з плавленого кварцу має довжину від 70 до 100 см і внутрішній діаметр від 40 до 60 мкм, рухомий буфер для капілярного електрофорезу вибирають з NaH 2PO4-Н3РО4, Tris-Н3РО4 або LiН2РО4-Н3РО4, в концентрації від 200 до 250 мМ і рН від 2 до 4, і до вищезгаданого рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 2 до 4 мМ і ПЕГ з молекулярною масою від 10000 до 50000 в концентрації від 1 до 3 % (маса/об'єм), прикладають напругу в діапазоні від -15 до -25 кВ, тиск при гемодинамічному введенні проби складає від 40 до 50 мбар і час введення проби від 10 до 20 сек., після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 10-20 мбар для проштовхування ΔІVА через детектор для детектування, і в процесі електрофорезу регулюють температуру капіляра на рівні 20-30 °C, і довжина хвилі при УФ-детектуванні повинна складати від 230 до 232 нм. 24. Спосіб за п. 21, де умови розділення капілярного електрофорезу наступні: капілярна колонка має внутрішній діаметр 50 мкм і загальну довжину 85 см, до рухомого буфера перед використанням додають 200 мМ Tris-Н3РО4 і 2 мМ МgСl2, при рН 2,5, поліетиленгліколь 1 % (маса/об'єм) з молекулярною масою 10000, тиск при введенні проби складає 50 мбар і час введення проби 15 сек., напруга при розділенні -25 кВ, після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 20 мбар для 17 UA 112070 C2 5 10 15 20 25 проштовхування ΔІVА через детектор для детектування, температура колонки 25 °C, і довжина хвилі при УФ-детектуванні 232 нм. 25. Спосіб за п. 21, де умови розділення при капілярному електрофорезі наступні: капілярна колонка має внутрішній діаметр 50 мкм і загальну довжину 80 см, до рухомого буфера перед використанням додають 200 мМ Tris-Н3РО4 і 2 мМ МgСl2, при рН 2,7, поліетиленгліколь 1,3 % (маса/об'єм) з молекулярною масою 10000, тиск при введенні проби складає 55 мбар і час введення проби 10 сек., напруга при розділенні -22 кВ, після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 138 мбар для проштовхування ΔІVА через детектор для детектування, тиск в колонці складає 25 °C, і довжина хвилі при УФ-детектуванні 230 нм. 26. Спосіб за п. 1, де принаймні 5 стандартів сульфатованих дисахаридів піддають електрофорезу для визначення електрофоретичної рухливості на стадії 3), потім будують графік кореляції електрофоретичної рухливості і співвідношення заряду до маси, отримують лінійну формулу зв'язку між електрофоретичною рухливістю і співвідношенням заряду до маси Z/M з використанням аналізу лінійної регресії, електрофоретичну рухливість інших олігосахаридів прогнозують відповідно до лінійної формули, яку можна використовувати для ідентифікації інших олігосахаридів у відсутності стандартів. 27. Спосіб за п. 26, де шість стандартів сульфатованих дисахаридів (ΔIS, ΔIIIS, ΔIIS, ΔІА, ΔIIА і ΔІІІА) піддають електрофоретичному розділенню для визначення електрофоретичної рухливості на стадії 3), потім будують графік кореляції електрофоретичної рухливості і співвідношення заряду до маси, отримують лінійну формулу зв'язку між електрофоретичною рухливістю і співвідношенням заряду до маси Z/M з використанням аналізу лінійної регресії, електрофоретичну рухливість інших олігосахаридів прогнозують відповідно до лінійної формули, яку можна використовувати для ідентифікації інших олігосахаридів у відсутності стандартів. 28. Спосіб за п. 27, де лінійний зв'язок між електрофоретичною рухливістю і співвідношенням заряду до маси олігосахаридів, отриманих від еноксапарину натрію, підданого повному розщепленню, описують за допомогою формули: Z 1,56 0,30 , M 30 де Z/M - співвідношення заряду до маси олігосахаридів, і μ - відповідна електрофоретична рухливість цих олігосахаридів. 29. Спосіб за п. 1, де масовий відсоток кожного компонента розраховують з використанням методу нормалізованої хроматографічної площі піку за формулою: Wn % 100 35 40 45 50 55 Mwn Arean , Mw x Area x де MWn - молекулярна маса цього компонента олігосахариду, Area n - площа піку такого компонента і MWx і Areax - молекулярна маса і площа піку х, що відповідає його номеру, вказана в Таблиці 1, відповідно. 30. Спосіб кількісного визначення молярного відсотка олігосахаридних ланцюгів з 1,6ангідроструктурою в еноксапарині натрію, який складається з наступних стадій: 1) розкладання зразка еноксапарину натрію шляхом повного розщеплення сумішшю гепаринрозщеплюючих ферментів, 2) розділення олігосахаридів зразку розкладеного еноксапарину натрію за допомогою капілярного електрофорезу, де олігосахариди включають дисахариди, трисахариди, тетрасахариди і олігосахариди з 1,6-ангідроструктурою, при цьому капілярний електрофорез здійснюють при наступних умовах: а) капілярна колонка з плавленого кварцу, що має довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм, b) рухомий буфер, включаючи NaH2PO4-Н3РО4, Tris-Н3РО4 або LіН2РО4-Н3РО4 або їх комбінації, в концентрації від 150 до 300 мМ, і рН від 1,5 до 4,0, с) напруга розділення від -15 до -30 кВ, d) тиск при введенні проби від 1 до 100 мбар і час ведення проби від 1 до 60 сек., e) температура капілярної колонки 10-40 °С, f) довжина хвилі УФ-детектування 230-235 нм, 3) співвідношення піків, які наявні в електроферограмі капілярного електрофорезу з олігосахаридами у зразку розкладеного еноксапарину натрію згідно з лінійним зв'язком між електрофоретичною рухливістю та співвідношенням заряд-до-маси олігосахаридів і ідентифікація піків олігосахаридів з 1,6-ангідрокільцевою структурою, 18 UA 112070 C2 5 10 4) кількісне визначення кількості олігосахаридів з 1,6-ангідрокільцевою структурою відповідно до їх площин піку і наступне визначення молярного відсотка 1,6-ангідрокільцевої структури в еноксапарині натрію. 31. Спосіб за п. 30, де використовувана суміш гепариназ на стадії 1) містить щонайменше дві з: гепариназа І (EC 4.2.2.7), гепариназа II (без номера EC) і гепариназа III (EC 4.2.2.8). 32. Спосіб за п. 31, де використовувана суміш гепариназ на стадії 1) є сумішшю гепаринази І, гепаринази II і гепаринази III. 33. Спосіб за п. 32, де використовувана суміш гепариназ на стадії 1) є сумішшю гепаринази І, гепаринази II і гепаринази III в співвідношенні 1:1:1. 34. Спосіб за п. 30, де олігосахариди з 1,6-ангідроструктурою отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру O-Na+ O-Na+ O O H O O S O HO HO NH O O-Na+ S O O H O O O O O HO H OH H HO NH O O-Na+ O-Na+ S O , , 1,6-ангідро ΔIS або 1,6-ангідро ΔIS глюкоза 1,6-ангідро ΔIIS або 1,6-ангідро ΔIIS глюкоза O O O-Na+ O O O H O O O-Na+ O O O-Na+ S O O-Na+ O O H O O O HO OH HO NH O HO S O-Na+ O 15 O O H O S HO O-Na+ O O O NH O S O O HO O-Na+ H O O HO S O-Na+ NH O S O-Na+ O O O , . 1,6-ангідро ΔIIS епі або 1,6-ангідро ΔIIS 1,6-ангідро ΔIS-IS епі або 1,6-ангідро ΔIS-IS маноза маноза 35. Спосіб за п. 30, де трисахариди, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру O O O-Na+ S O-Na+ O-Na+ O O O O O O O HO O O HO S O-Na+ O 20 O NH O S O O|H HO O-Na+ O O S O-Na+ O . 36. Спосіб за п. 30, де 8 дисахаридів, отриманих з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру 19 UA 112070 C2 O O O-Na+ S S O-Na+ O-Na+ O O-Na+ O O O O O O O O O HO O O S O O OH HO HO NH O-Na+ O CH3 O O-Na+ NH O O-Na+ S O , ΔIA HO S O O OH O , ΔIS O O O-Na+ S S O O-Na+ O-Na+ O-Na+ O O O O O O O O O HO OH O O OH HO HO NH OH OH HO NH O O CH3 S O , ΔIIA O-Na+ , ΔIIS O-Na+ OH OH O-Na+ O O O O O O HO O OH O O O HO S O-Na+ HO NH O O O CH3 O OH HO S O-Na+ NH O O O , ΔIIIA O-Na+ S , ΔIIIS O-Na+ OH O-Na+ O OH O O O O O HO OH O OH HO HO NH OH OH HO NH O O CH3 ΔIVA O S O , O-Na+ . ΔIVS 37. Спосіб за п. 30, де два інші дисахаридні компоненти, ΔIISgal i ΔIVSgal, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру 20 UA 112070 C2 O O-Na+ O-Na+ S O-Na+ O O O OH O O O O O O OH OH OH HO HO O HO OH HO NH NH O O O-Na+ S S O O , ΔIISgal O-Na+ . ΔIVSgal 38. Спосіб за п. 30, де два тетрасахариди, ΔIIА-IISglu i ΔIIa-IVSglu, отримані з еноксапарину натрію, підданого повному розщепленню, на стадії 2) мають структуру 5 O O O-Na+ S O O-Na+ O O-Na+ O O O-Na+ S O O O O O O O HO OH O HO O HO NH OH O OH O-Na+ O O CH3 S HN O-Na+ S O O O , ΔІІА-IISglu O O O-Na+ S O-Na+ O-Na+ O O OH O O O O O O O O OH O-Na+ HO OH HO NH O HO OH O O CH3 S O HN O-Na+ S O O . 10 ΔІІА-IVSglu 15 39. Спосіб за п. 30, де капілярна колонка з плавленого кварцу на стадії 2) має довжину від 70 до 100 см і внутрішній діаметр від 40 до 60 мкм. 40. Спосіб за п. 30, де рухомий буфер на стадії 2) вибирають з NaH 2PO4-Н3РО4, Tris-Н3РО4 або LiН2РО4-Н3РО4, в концентрації від 200 до 250 мМ, і рН від 2,0 до 4,0. 41. Спосіб за п. 40, де до рухомого буфера на стадії 2) додають МgСl 2 або ZnCl2 в концентрації від 1 до 5 мМ, і поліетиленгліколь з молекулярною масою від 5000 до 100000 в концентрації від 0,1 до 5 % (маса/об'єм). 21 UA 112070 C2 5 10 15 20 25 30 35 40 45 50 55 60 42. Спосіб за п. 41, де до рухомого буфера на стадії 2) додають МgСl 2 або ZnCl2 в концентрації 2-4 мМ, і поліетиленгліколь з молекулярною масою від 10000 до 50000 в концентрації 1-3 % (маса/об'єм). 43. Спосіб за п. 30, де напруга при розділенні прикладена до капілярної колонки складає від -20 до -25 кВ. 44. Спосіб за п. 30, де тиск при введенні проби на стадії 2) складає від 30 до 60 мбар і час введення проби від 5 до 30 сек., або тиск при введенні проби складає 40-50 мбар, і час введення проби від 10 до 20 сек. 45. Спосіб за п. 44, де після останнього елюювання сульфатованого дисахариду ΔIIА прикладають певний тиск для проштовхування ΔIVA через детектор для детектування. 46. Спосіб за п. 45, де тиск на стадії 2) складає від 5 до 150 мбар. 47. Спосіб за п. 46, де тиск на стадії 2) складає від 5 до 30 мбар, від 10 до 20 мбар і від 30 до 150 мбар і т. і., залежно від типу використовуваного приладу для капілярного електрофорезу. 48. Спосіб за п. 30, де температура капілярної колонки складає 20-30 °C. 49. Спосіб за п. 30, де довжина хвилі УФ-детектування на стадії 2) складає 230-232 нм. 50. Спосіб за п. 30, де умови розділення при капілярному електрофорезі наступні: капілярна колонка з плавленого кварцу має довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм, рухомий буфер для капілярного електрофорезу вибирають з NaH 2PO4-Н3РО4, Tris-Н3РО4 або LiH2PO4-Н3РО4, в концентрації від 150 до 300 мМ і рН від 1,5 до 4,0, до рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 1 до 5 мМ і ПЕГ з молекулярною масою від 5000 до 100000 в концентрації від 0,1 % до 5,0 % (маса/об'єм), прикладають напругу в діапазоні від -15 до -30 кВ, тиск при гемодинамічному введенні проби складає від 1 до 100 мбар і час введення проби від 1 до 60 сек., після останнього проходу моносульфатованого дисахариду ΔIIА через детектор прикладають тиск 5-150 мбар для проштовхування ΔIVA через детектор для детектування, в процесі електрофорезу регулюють температуру капіляра на рівні 10-40 °C, і довжина хвилі при УФ-детектуванні складає від 230 до 235 нм. 51. Спосіб за п. 50, де умови розділення при капілярному електрофорезі наступні: капілярна колонка з плавленого кварцу має довжину від 50 до 100 см і внутрішній діаметр від 25 до 75 мкм, рухомий буфер для капілярного електрофорезу вибирають з NaH 2PO4-Н3РО4, Tris-Н3РО4 або LiН2РО4-Н3РО4, в концентрації від 150 до 300 мМ і рН від 1,5 до 4,0, і до вищезгаданого рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 1 до 5 мМ і ПЕГ з молекулярною масою від 5000 до 100000 в концентрації від 0,1 % до 5,0 % (маса/об'єм), прикладають напругу в діапазоні від -15 до -30 кВ, тиск при гемодинамічному введенні проби складає від 30 до 60 мбар і час введення проби від 5 до 30 сек., після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 5-150 мбар для проштовхування ΔIVA через детектор для детектування, і в процесі електрофорезу регулюють температуру капіляра на рівні 10-40 °C, і довжина хвилі при УФ-детектуванні складає від 230 до 235 нм. 52. Спосіб за п. 50, де умови розділення при капілярному електрофорезі наступні: капілярна колонка з плавленого кварцу має довжину від 70 до 100 см і внутрішній діаметр від 40 до 60 мкм, рухомий буфер може містити NaH2PO4-Н3РО4, Tris-Н3РО4 або LіН2РО4-Н3РО4 в концентрації 200-250 мМ, рН 2-4, і до вищезгаданого рухомого буфера перед використанням додають MgCl2, ZnCl2 в концентрації від 2 до 4 мМ, і ПЕГ з молекулярною масою від 10000 до 50000 в концентрації від 1 % до 3 % (маса/об'єм), прикладають напругу в діапазоні від -15 до -25 кВ, тиск при гемодинамічному введенні проби складає від 40 до 50 мбар і час введення проби від 10 до 20 сек., після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 10-20 мбар для проштовхування ΔIVA через детектор для детектування, і в процесі електрофорезу регулюють температуру капіляра на рівні 20-30 °C, і довжина хвилі при УФ-детектуванні повинна складати від 230 до 232 нм. 53. Спосіб за п. 50, де умови розділення при капілярному електрофорезі наступні: капілярна колонка має внутрішній діаметр 50 мкм і загальну довжину 85 см, до рухомого буфера перед використанням додають 200 мМ Tris-Н3РО4 і 2 мМ МgСl2, при рН 2,5, поліетиленгліколь 1 % (маса/об'єм) з молекулярною масою 10000, тиск при введенні проби складає 50 мбар і час введення проби 15 сек., напруга при розділенні -25 кВ, після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 20 мбар для проштовхування ΔIVA через детектор для детектування, тиск в колонці складає 25 °C; і довжина хвилі при УФ-детектуванні 232 нм. 54. Спосіб за п. 50, де умови розділення при капілярному електрофорезі наступні: капілярна колонка має внутрішній діаметр 50 мкм і загальну довжину 80 см, до рухомого буфера перед використанням додають 200 мМ Tris-Н3РО4 і 2 мМ МgСl2, при рН 2,7, поліетиленгліколь 1,3 % 22 UA 112070 C2 5 10 15 20 25 (маса/об'єм) з молекулярною масою 10000, тиск при введенні проби складає 55 мбар і час введення проби 10 сек., напруга при розділенні - 22 кВ, після останнього проходу сульфатованого дисахариду ΔIIА через детектор прикладають тиск 138 мбар для проштовхування ΔІVА через детектор для детектування, тиск в колонці складає 25 °C, і довжина хвилі при УФ-детектуванні 230 нм. 55. Спосіб за п. 30, де принаймні 5 стандартів сульфатованих дисахаридів піддають електрофорезу для визначення електрофоретичної рухливості на стадії 3), потім будують графік кореляції електрофоретичної рухливості та співвідношення заряду до маси, отримують лінійну формулу зв'язку між електрофоретичною рухливістю і співвідношенням заряду до маси Z/M звикористанням аналізу лінійної регресії, електрофоретичну рухливість інших олігосахаридів прогнозують відповідно до лінійної формули, яку можна використовувати для ідентифікації інших олігосахаридів у відсутності стандартів, визначають площі піків, що відповідають олігосахариду дисахариду 1 (1,6-ангідро ΔIIS), дисахариду 2 (1,6-ангідро ΔІІS), дисахариду 3 (1,6-ангідро ΔIS) і тетрасахариду 1 (1,6-ангідро ΔIS-IS). 56. Спосіб за п. 55, де шість стандартів сульфатованих дисахаридів (ΔIS, ΔIIIS, ΔIIS, ΔІА, ΔІІА і ΔІІІА) піддають електрофоретичному розділенню для визначення електрофоретичної рухливості на стадії 3), потім будують графік кореляції електрофоретичної рухливості і співвідношення заряду до маси, отримують лінійну формулу зв'язку між електрофоретичною рухливістю і співвідношенням заряду до маси Z/M з використанням аналізу лінійної регресії, електрофоретичну рухливість інших олігосахаридів прогнозують відповідно до лінійної формули, яку можна використовувати для ідентифікації інших олігосахаридів у відсутності стандартів, визначають площі піків, що відповідають олігосахаридам з 1,6-ангідроструктурою, що включає дисахарид 1 (1,6-ангідро ΔIIS), дисахарид 2 (1,6-ангідро ΔІІS), дисахарид 3 (1,6ангідро ΔIS) і тетрасахарид 1 (1,6-ангідро ΔIS-IS). 57. Спосіб за п. 56, де лінійний зв'язок між електрофоретичною рухливістю і співвідношенням заряду і маси олігосахаридів, отриманих з еноксапарину натрію, підданого повному розщепленню, описують за допомогою формули: Z 1,56 0,30 , M 30 35 40 де Z/M - співвідношення заряду і маси олігосахариди, і - відповідна електрофоретична рухливість цього олігосахариди, де виявляють лінійний зв'язок між електрофоретичною рухливістю і співвідношенням заряду і маси, ідентифікують олігосахариди з 1,6ангідроструктурою, включаючи дисахарид 1 (1,6-ангідро ΔІІS), дисахарид 2 (1,6-ангідро ΔIIS), дисахарид 3 (1,6-ангідро ΔIS) і тетрасахарид 1 (1,6-ангідро ΔIS-IS), що відповідають пікам 16, 17, 15 і 14, відповідно. 58. Спосіб за п. 30, де 1,6-ангідроолігосахариди: дисахарид 1 (наприклад, (1,6-ангідро ΔІІS), дисахарид 2 (наприклад, 1,6-ангідро ΔІІS), дисахарид 3 (наприклад, 1,6-ангідро AIS) і тетрасахарид 1 (наприклад, 1,6-ангідро ΔIS-IS) відповідають пікам 16, 17, 15 і 14, відповідно, та їх масовий відсоток в еноксапарині натрію, підданому повному розщепленню, можна розрахувати за формулами: w16 17 % 100 w14 % 100 w15 % 100 45 433 Area16 Area17 Mw x Areax 545 Area14 Mw x Areax 1210 Area15 Mw x Areax , , , де MWx - молекулярна маса цього компонента, Area n - площа піка кожного олігосахариду, отриманих з еноксапарину натрію, підданого повному розщепленню, а молярний відсоток олігосахаридних ланцюгів з 1,6-ангідроструктурою, в еноксапарині натрію можна розрахувати за формулами: % w % w % w 16Anhydro % Wx 16 17 14 15 або , 545 1210 443 Area14 Area15 Area16 Area17 , 16Anhydro % 100 Wx , Mwx Areax де W x - середньомасова молекулярна маса еноксапарину натрію. 23 UA 112070 C2 59. Застосування способу за будь-яким з пп. 1-29 для ідентифікації тонкої структури сульфатованих полісахаридів, таких як гепарин, низькомолекулярний гепарин і ультранизькомолекулярний гепарин. 5 24 UA 112070 C2 25 UA 112070 C2 Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 26
ДивитисяДодаткова інформація
Назва патенту англійськоюFine structure determination method of enoxaparin sodium based on capillary electrophoresis
Автори англійськоюKang, Jingwu, Zhan, Xueqiang
Автори російськоюКанг Джингву, Жан Ксюкянг
МПК / Мітки
МПК: C08B 37/10, A61K 31/727, G01N 33/15, G01N 27/447
Мітки: електрофорезу, натрію, структури, спосіб, капілярного, тонкої, еноксапарину, аналізу
Код посилання
<a href="https://ua.patents.su/28-112070-sposib-kapilyarnogo-elektroforezu-dlya-analizu-tonko-strukturi-enoksaparinu-natriyu.html" target="_blank" rel="follow" title="База патентів України">Спосіб капілярного електрофорезу для аналізу тонкої структури еноксапарину натрію</a>












