Вакцина
Номер патенту: 99722
Опубліковано: 25.09.2012
Автори: Блейс Норманд, Палмантіер Ремі М., Мартін Деніс
Формула / Реферат
1. Злитий білок, що містить:
(a) PRAME;
(b) гетерологічний злитий партнерний білок, похідний від білка D, де злитий партнерний білок містить амінокислоти 20-127 білка D; та
(c) додаткові амінокислоти Met-Asp-Pro на N-закінченні послідовності злитої партнерної послідовності,
2. Злитий білок за п. 1, що містить крім того афінну мітку.
3. Злитий білок за п. 2, в якому афінною міткою є гістидинове закінчення.
4. Злитий білок за будь-яким попереднім пунктом, що містить додатково одну чи більше лінкерних послідовностей між злитим партнерним білком та PRAME, або між злитим партнерним білком та афінною міткою, або між PRAME та афінною міткою.
5. Послідовність нуклеїнової кислоти, що кодує злитий білок за будь-яким з пп. 1-4.
6. Вектор, що містить послідовність нуклеїнової кислоти за п. 5.
7. Клітина-хазяїн, трансформована вектором за п. 6.
8. Вакцина, що містить злитий білок за будь-яким з пп. 1-4 або нуклеїнову кислоту за п. 5, або вектор за п. 6.
9. Вакцина за п. 8, що додатково містить ад'ювант та/або імуностимуляторний цитокін або хемокін.
10. Вакцина за п. 9, де ад'ювант містить олігонуклеотид 3D-MPL, QS21 та/або CpG.
11. Вакцина за будь-яким з пп. 8-10 для застосування у медицині.
12. Застосування білка за будь-яким з пп. 1-4, нуклеїнової кислоти за п. 5 або вектора за п. 6, які заявлені тут, для виробництва вакцини для імунотерапевтичного лікування пацієнта, який потерпає від раку.
13. Застосування за п. 12, у котрому рак є вибраним з меланоми, раку молочної залози, сечового міхура, легень, як-то NSCLC, саркоми, раку яєчника, голови та шиї, нирок, колоректальної карциноми, плазмоцитоми, лейкемії, у тому числі гострої лейкемії та карциноми стравоходу.
Текст
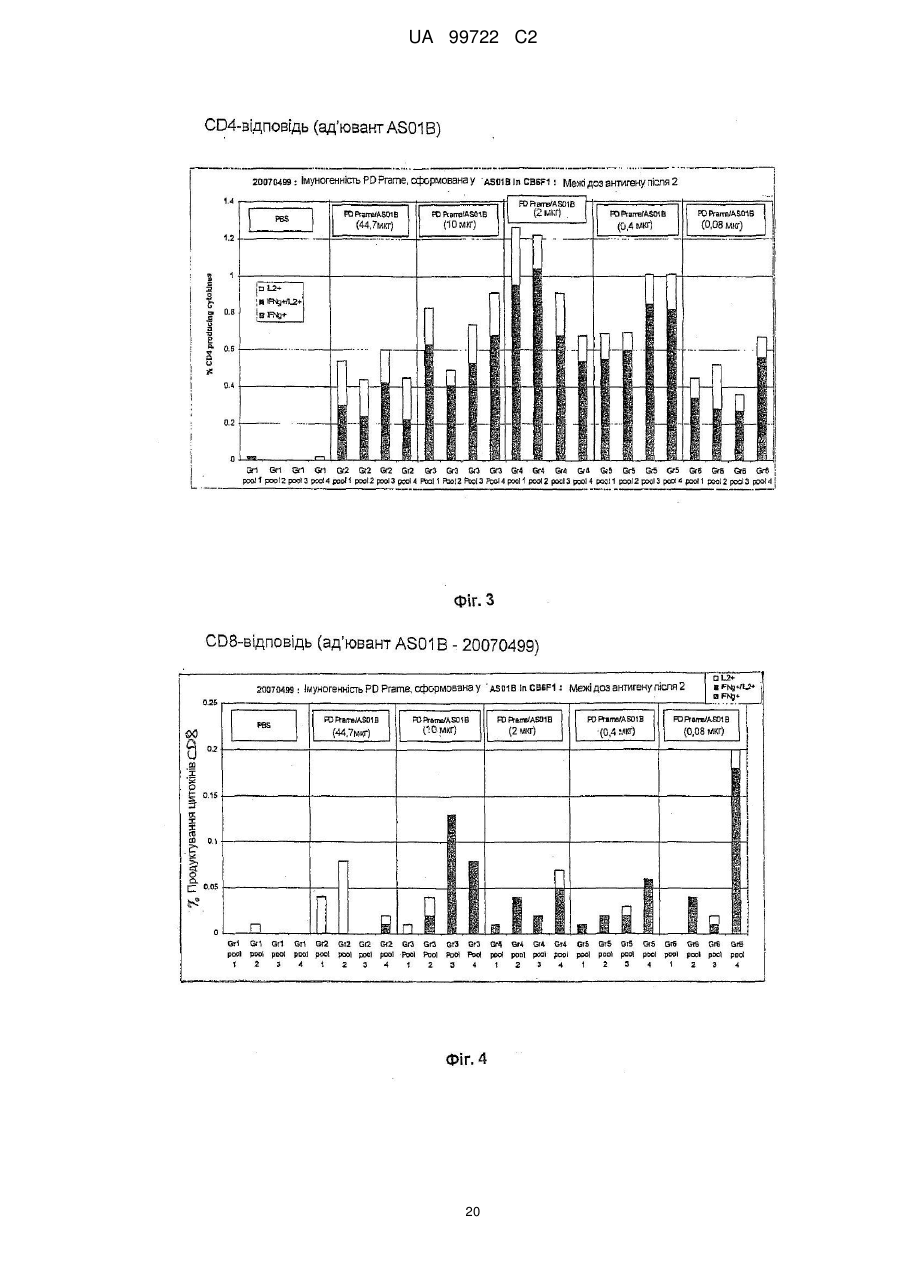
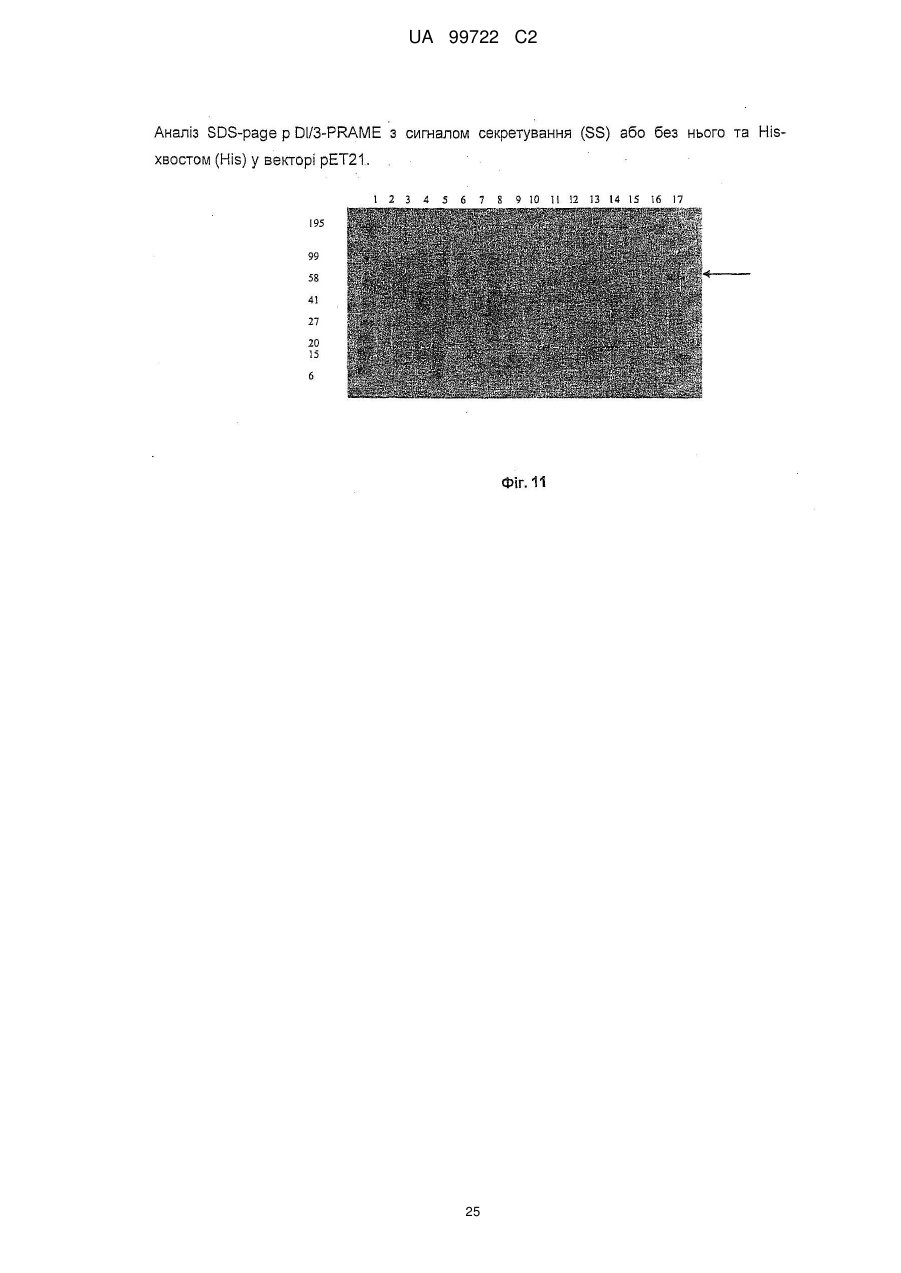
Реферат: Винахід належить до злитого білка, що містить PRAME, гетерологічний злитий партнерний білок, який походить від білка D та містить амінокислоти 20-127 білка D, а також містить додаткові амінокислоти Met-Asp-Pro на N-кінці послідовності злитої партнерної послідовності, де вказаний злитий партнерний білок не має секреційної послідовності або сигнальної послідовності білка D. Також даний винахід належить до послідовності нуклеїнової кислоти, вектора, клітини-хазяїна, вакцини, що містить даний злитий білок, та їх застосування для імунотерапевтичного лікування раку. UA 99722 C2 (12) UA 99722 C2 UA 99722 C2 5 10 15 20 25 30 35 40 45 50 Заявлений винахід стосується конденсованих білків, що містять антиген, який є похідним так званого пухлино-відторгаючого антигену РRАМЕ (також відомого як DАGЕ), приєднаного до імунологічного конденсованого партнера, котрий продукує епітопи Т-хелперів, як-то, наприклад, білок D з Наеmорhіlus іnfluеnzае В, способів їх отримання, створення вакцин та їхнього використання для лікування низки типів раку, зокрема (й не тільки), меланоми, раку грудей, сечового міхура, легень, пухлин типу NSСLС, саркоми, раку яєчнику, раку голови та шиї, раку нирок, колоректальної карциноми, множинної мієломи, лейкемії (в тому числі, гострої), та карциноми стравоходу. У подальшому використанні заявлений винахід стосується конденсованих партнерних білків, що містять похідні білку D та способів їхнього отримання. Серед різноманітних груп антигенів, асоційованих з пухлинами, антигени раку сім’яників становлять інтерес для імунотерапії з причини їх широкої пухлино-специфічної експресії та того факту, що як правило, ці антигени не експресуються у здорових клітинах. Наразі описано більше 50 антигенів раку сім’яників, і для більшості з них ідентифіковано епітопи, які розпізнаються Т-лімфоцітами. РRАМЕ є антигеном раку сім’яників, що досліджується з метою потенційного використання в імунотерапії. В імунотерапії антиген раку вводиться пацієнтам зазвичай як вакцина, що містить антиген, наприклад, як білок або його імуногенний фрагмент, чи як ДНК, що кодує даний білок, чи як вектор, який містить згадану ДНК, котрі стимулюють імунну систему пацієнта атакувати пухлини, що виробляють даний антиген. За умови стимуляції потрібної відповіді, Т-лімфоцити (Т-клітини) здійснюють пряму атаку на антигени та забезпечують контроль імунної відповіді. Розвиваються В-клітини та Т-клітини, специфічні для певного типу антигену. Коли імунна система стикається з іншим антигеном, формуються інші В-клітини та Т-клітини. У ході розвитку лімфоцити набирають здатності розрізняти власні тканини тіла (свої) від тканин та часток, що зазвичай не трапляються в тілі (чужі). Коли В-клітини та Т-клітини сформуються, деякі з цих клітин будуть розмножувати та поширювати «пам'ять» для імунної системи. Це дозволяє імунній системі відповідати швидше та ефективніше наступного разу, коли вона натрапить на той самий антиген. Певні досліди вказують на вірогідність того, що антигени раку сім’яників можуть стимулювати механізми пам’яті в імунній системі. Існує гіпотеза, що РRАМЕ бере участь у загибелі клітини або клітинному циклі. Деякими дослідницькими групами він виявлений у меланомі та різноманітних пухлинах, у тому числі пухлинах легень, нирок та шиї. Також цікаво, що він виявлений у 40-60% випадків лейкемій, якто гостра лімфоїдна лейкемія та гостра мієлоїдна лейкемія, дивіться як приклад Ехр Неmаtоl. 2000 Dес; 28(12):1413-22. Помічено, що у пацієнтів надлишкова наявність РRАМЕ вірогідно пов’язана з більш високим виживанням та більш низькою частотою рецидивів порівняно з тими, в кого надлишок даного білку не вироблявся. Даний антиген та його отримання описано у патенті США № 5, 830, 753. РRАМЕ присутній в Аnnоtаtеd Нumаn Gеnе Dаtаbаsе Н-Іnv DВ за номерами відповідно до поповнення: U65011,1, ВС022008,1, АК129783,1, ВС014974,2, СR608334,1, АF025440,1, СR591755,1, ВС039731,1, СR623010,1, СR611321,1, СR618501,1, СR604772,1, СR456549,1,аndСR620272.l. Білок D є поверхневим білком грам-негативних бактерій Наеmорhіlus іnfluеnzа В. Інформацію щодо імунологічно конденсованих партнерів, похідних від білку D, можна отримати у WО 91/18926. Конденсовані білки частин антигенів та гетерологічних конденсованих партнерів іноді отримують з метою підвищення імуногенності антигену та/або допоміжної продукції білків у відповідних кількостях та/або чистоті, дивіться як приклад, WО 99/40188, котрий описує конденсований білок МАGЕ та, як приклад, білок D – поверхневий білок грам-негативних бактерій, Наеmорhіlus іnfluеnzа В. Конденсований білок, отриманий шляхом рекомбінації та секреційна послідовність білку D можуть бути внесені до складу конденсованого білку з метою потенційно посилити секрецію та солюбілізацію кінцевого продукту. Короткий опис фігур та констрактів/ послідовностей Фіг. 1 Фіг. 2 Фіг. 3 Фіг. 4 Фіг. 5 Фіг. 6 Аналіз SDS-раgе констрактів 3 та 4 Аналіз SDS-раgе констрактів 3а та 4а СD4-відповідь. (ад´ювант АS01В) СD8-відповідь. (ад´ювант АS01В - 20070499) СD4-відповідь. (ад´ювант АS15) СD8-відповідь. (ад´ювант АS15) 1 UA 99722 C2 Фіг. 7 Фіг. 8 Фіг. 9 Фіг. 10 Фіг. 11 Фіг. 12 Констракт 1 (Приклад 1) Констракт 2 (Приклад 2) Констракт 3 (Приклад 3) Констракт 4 (Приклад 4) Констракт 3 а (Приклад 3а) Констракт 4а (Приклад 4а) Марковані послідовності амінокислот з прикладів констрактів заявленого винаходу Порівняння між LіроD-МАGЕ3-Ніs (SЕQ ІD NО:43) та рDl/3-РRАМЕ-Ніs (SЕQ ІD NО:10) Порівняння між спільними послідовностями вихідного білку D з Наеmорhіlus іnfluеnzае (SЕQ ІD NО:45) та LіроD-МАGЕ3-Ніs (SЕQ ІD NО:43) Порівняння між спільними послідовностями вихідного білку D з Наеmорhіlіа іnfluеnzае (SЕQ ІD NО:41), рD-МАGЕ3-Ніs (SЕQ ІD NО,4 5) та констрактом рDl/3-РRАМЕ-Ніs, котрий не містить амінокислоту 2-D, та 3-Р (SЕQ ІD NО:44) Аналіз SDS-раgе рDl/3-РRАМЕ з сигналом секреції (SS) та Ніsхвостом (Ніs) або без них у векторі рЕТ21. послідовність білку D 1/3 МАGЕ-А3-Ніs (SЕQ ІD NО:44) МDР- 20-127 - Білок D - РRАМЕ - ТSGНННННН (плазміда ТСМР14) (нуклеотидна послідовність SЕQ ІD NО: 1; амінокислотна послідовність SЕQ ІD NО:2) МDР- 20-127 - Білок D - РRАМЕ - без Ніs-хвоста (плазміда ТСМР14) (нуклеотидна послідовність SЕQ ІD NО: 3; амінокислотна послідовність SЕQ ІD NО:4) МDР- 20-127 - Білок D - РRАМЕ - LЕНННННН (плазміда рЕТ21) (нуклеотидна послідовність SЕQ ІD NО: 5; амінокислотна послідовність SЕQ ІD NО:6) МDР- 20-127 - Білок D - РRАМЕ - без Ніs-хвоста (плазміда рЕТ21) (нуклеотидна послідовність SЕQ ІD NО: 7; амінокислотна послідовність SЕQ ІD NО:8) МDР- 20-127 - Білок D - РRАМЕ - НННННН (плазміда рЕТ26) (нуклеотидна послідовність SЕQ ІD NО: 9; амінокислотна послідовність SЕQ ІD NО: 10) МDР- 20-127 - Білок D - РRАМЕ - без Ніs-хвоста (плазміда рЕТ26) (нуклеотидна послідовність SЕQ ІD NО: 11; амінокислотна послідовність SЕQ ІD NО:12) є ДНК-послідовністю для прикладу 1 послідовність 1 (SЕQ ІD NО:1) послідовність 2 є амінокислотною послідовністю для прикладу 1 (SЕQ ІD NО:2) послідовність 3 є ДНК-послідовністю для прикладу 2 (SЕQ ІD NО:3) послідовність 4 є амінокислотною послідовністю для прикладу 2 (SЕQІDN0:4) послідовність 5 є ДНК-послідовністю для прикладу 3 (SЕQ ІD NО:5) послідовність 6 є амінокислотною послідовністю для прикладу 3 (SЕQ ІD NО:6) послідовність 7 є ДНК-послідовністю для прикладу 4 {SЕQ ІD NО:7) послідовність 8 є амінокислотною послідовністю для прикладу 4 {SЕQ ІD NО:8) послідовність 9 є оптимізованою кодоном ДНК-послідовністю для прикладу 3 а (SЕQ ІD NО:9) послідовність 10 є амінокислотною послідовністю для прикладу 3а (SЕQ ІD NО: 10) послідовність 11 є оптимізованою кодоном ДНК-послідовністю для прикладу 4а (SЕQ ІD NО: 11) послідовність 12 є амінокислотною послідовністю для прикладу 4а (SЕQ ІD NО: 12) 100-108 SЕQ ІD NО: 13 VLDGLDVLL (РRА ) 142-151 SЕQ ІD NО: 14 SLYSFРЕРЕА (РRА ) 2 UA 99722 C2 300-309 5 10 15 20 25 30 35 40 SЕQ ІD NО: 15 АLYVDSLFFL (РRА ) 301-309 SЕQ ІD NО: 16 LYVDSLFFL (РRА ) 425-433 SЕQ ІD NО: 17 SLLQНLІGL (РRА ) SЕQ ІD NО: 18 – Олігонуклеотиди, застосовувані у прикладах заявленого винаходу 35 SЕQ ІD NО: 36 ТСС АТG АСG ТТС СТG АСG ТТ (СрG 1826;) SЕQ ІD NО: 37 ТСТ ССС АGС GТG СGС САТ (СрG 1758) SЕQ ІD NО: 38 АСС GАТ GАС GТС GСС GGТ GАС GGС АСС АСG ТСG ТСG ТТТ ТGТ СGТ ТТТ GТС GТТ (СрG 2006) SЕQ ІD NО: 39 ТСС АТG АСG ТТС СТG АТG СТ (СрG 1668) SЕQ ІD NО: 40 ТСG АСG ТТТ ТСG GСG СGС GСС G (СрG 5456) АК 1 – 127 білку D від Наеmорhіlus іnfluеnzае SЕQ ІD NО:41 SЕQ ІD NО:42 1-Меt; 2-Аsр; 3-Рrо; а потім АК 20 – 127 білку D SЕQ ІD NО:43 Амінокислотна послідовність білку D 1/3- МАGЕ-А3 -Ніs SЕQ ІD NО:44 Амінокислоти з білку D від Наеmорhіlus іnfluеnzае для використання у у рDl/3- послідовності РRАМЕ-Ніs SЕQ ІD NО:45 Амінокислоти з білку D від Наеmорhіlus іnfluеnzае для використання у послідовності рDl/3-МАGЕ-Ніs Заявлений винахід стосується конденсованого білку, що містить: a) РRАМЕ або його імуногенні фрагменти, та b) гетерологічний конденсований партнер, похідний від білку D, де зазначений конденсований білок не містить секреційну послідовність (сигнальну послідовність) білку D. Заявлений винахід крім того стосується конденсованого партнерного білку, який описаний тут як похідний від білку D, у якому конденсований партнерний білок не містить секреційну послідовність або сигнальну послідовність білку D. Заявлений винахід крім того стосується конденсованого білку який описаний тут, і антигену або його фрагменту. Заявлений винахід крім того стосується конденсованого партнерного білку, похідного від білку D, при цьому конденсований партнерний білок містить або складається з 20 - 127 амінокислот білку D. В одному втіленні заявленого винаходу, одну або більше амінокислот білку – конденсованого партнерного білку D, описаного тут, може бути видалено або замінено. Амінокислоти можуть бути замінені консервативними заміщеннями, які тут описано, або можуть бути використані інші амінокислоти. У іншому втіленні 1, 2, 3, 4, 5, 6, 7, 8, 9 або більше амінокислот можуть бути замінені. Конденсований з білком D партнерний білок, який було тут описано, може додатково або альтернативно містити делеції або інсерції в межах амінокислотної послідовності, порівняно з послідовністю білку D дикого типу. У подальшому використанні 1, 2, 3, 4, 5, 6, 7, 8, 9 або більше амінокислот можуть бути вставлені або замінені. Терміни "секреційна послідовність", або "сигнальна послідовність», або "секреційний сигнал" білку D, в контексті даної заявки, стосується амінокислот приблизно від 1 до 16, 17, 18 або 19 природного білку. В одному випадку, секреційна або сигнальна послідовність, або секреційний сигнал білку D являє собою N-кінцевих 19 амінокислот білку D. Терміни "секреційна послідовність" або "сигнальна послідовність» або "секреційний сигнал" у даному описі використовуються як взаємозамінні. Конденсований партнерний білок заявленого винаходу може містити залишок білку D повної довжини або містити біля третини N-кінцевого залишку білку D. Наприклад, третина N-кінцевого залишку білку D може містити приблизно з 20 до 127 амінокислоти білку D. Наразі послідовність білку D, використана у даному винаході містить амінокислоти від 20 до 127 білку D. В іншому втіленні даний винахід стосується будь якої послідовності, починаючи з будь якої наступної амінокислоти з послідовності білку D: 17, 18, 19, 20, 21, або 22; і закінчуючи будь якою з наступних амінокислот з послідовності білку D: 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139 або 140. Під "залишком " у даному контексті мається на увазі послідовність білку D - білку без секреційної або сигнальної послідовності, як описано тут. В одному втіленні заявленого винаходу, у якому конденсований білок містить РRАМЕ або його імуногенний фрагмент, похідне білку D заявленого винаходу містить приблизно першу 1/3 білку, більш конкретно - амінокислоти від 20 до 127. В альтернативному втіленні заявленого 3 UA 99722 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходу, у якому конденсований білок містить РRАМЕ або його імуногенний фрагмент, білок D містить приблизно першу 1/3 білку, у якому використано N-кінцеві 109 амінокислот. В одному втіленні заявленого винаходу частина білку D не містить секреційну послідовність білку. В іншому втіленні заявленого винаходу похідне білку D не пов'язане з ліпідами. В одному втіленні, заявлений винахід стосується констракту білку D, як описано тут, як конденсованого партнерного білку. Констракт білку D може бути конденсованим партнером білку для констракту, що додатково містить констракт РRАМЕ або МАGЕ-А3, як описано тут, або може бути конденсованим партнером білку для констракту, що додатково містить інший раковий антиген або будь-який інший антиген. Вірогідно, що для конденсованих білків, що містять РRАМЕ або його імуногенний фрагмент та білок D, або для конденсованих білків, що містять білок D, або для конденсованих партнерів білків, що містять білок D, наявність секреційної послідовності (або сигнальної послідовності) може негативно впливати на кількість конденсованого білку, що утворюється. РRАМЕ Згідно одного підходу конденсований білок заявленого винаходу містить конденсований партнерний білок, як описано тут, та антиген РRАМЕ або його імуногенний фрагмент. Загалом білок РRАМЕ має 509 амінокислот і в одному втіленні усі 509 амінокислоти РRАМЕ можуть бути використані. Декілька епітопів цитотоксичних Т лімфоцитів (СТL) ідентифіковані на РRАМЕ, наприклад: 100-108 VLDGLDVLL (РRА ; SЕQ ІD NО:13); 142-151 SLYSFРЕРЕА (РRА ; SЕQ ІD NО: 14); 300-309 АLYVDSLFFL (РRА ; SЕQ ІD NО:15); 301-309 LYVDSLFFL (РRА ; SЕQ ІD NО: 16) та 425-433 SLLQНLІGL (РRА ; SЕQ ІD NО: 17). Загалом бажано включити до антигену якомога більше цих епітопів з метою викликати сильну імунну відповідь та забезпечити максимальну імуногенність антигену. Хоча можливо компенсувати більш низьку імуногенність даного констракту шляхом додавання композиції із потужним імунологічним ад´ювантом. Потужні ад´юванти нижче обговорюватимуться більш детально. В одному аспекті винахід стосується РRАМЕ-частини конденсованого білку, що містить, складається повністю, або у значному ступені, з білків повної довжини. Проте, винахід також стосується РRАМЕ- констрактів з консервативних заміщень. В одному втіленні, 1, 2, 3, 4, 5, 6, 7, 8, 9 або більше амінокислот може бути замінено. РRАМЕ-констракт як описано тут, може додатково або альтернативно містити делеції або інсерції всередині амінокислотної послідовності порівняно з послідовністю РRАМЕ дикого типу. В іншому втіленні, 1, 2, 3, 4, 5, 6, 7, 8, 9 або більше амінокислот можуть бути вставлені або видалені. Консервативні заміщення є добре відомими та є загалом заснованими як матриці підрахунку відсутностей у комп’ютерній програмі порівняння послідовностей. Ці програми включають РАМ250 (Dауhоft М.О. еt аг., (1978), "А mоdеl оf еvоlutіоnаrу сhаngеs іn рrоtеіns", Іn "Аtlаs оf Рrоtеіn sеquеnсе аnd struсturе" 5(3) М.О. Dауhоft (еd.), 345-352), Nаtіоnаl Віоmеdісаl Rеsеаrсh Fоundаtіоn, Wаshіngtоn, аnd Вlоsum 62 (Stеvеn Неnіkоft аnd Jоrjа G. Неnіkоft (1992), "Аmіnо асіd substіtutіоn mаtrісіеs frоm рrоtеіn blосks"), Рrос. Nаtl. Асаd. Sсі. USА 89 (Віосhеmіstrу): 1091510919. Загалом, заміни всередині наступних груп є консервативними замінами, проте заміни між групами вважаються неконсервативним. Такими групами є: і) аспартат/аспарагін/глютамат/глютамін іі) серін/треонін ііі) лізін/аргінін іv) фенілаланін/тірозин/триптофан v) лейцин/изолейцин/валін/метіонін vі) Гліцін/аланін Загалом, РRАМЕ-послідовності/амінокислоти, використані у конденсованих білках винаходу перевищуватимуть 80%, як-то 85, 90, 95 та найбільш конкретно - 99% ідентичності природного РRАМЕ. Проте, кваліфіковані спеціалісти розуміють, що амінокислотні залишки, отримані внаслідок процесу клонування, можуть міститися у рекомбінантних білках. Для того, щоб це не погіршувало характеристики продукту, оптимальним є їхнє видалення. В одному аспекті винахід стосується конденсованих білків, як описано тут, що містять, складаються повністю або у значному ступені з білків повної довжини. В іншому аспекті РRАМЕчастини конденсованих білків заявленого винаходу містять, складаються повністю, або у значному ступені з одного або більше з наступних епітопів: 4 UA 99722 C2 100-108 5 10 15 20 25 30 35 40 45 50 55 60 VLDGLDVLL (РRА ; SЕQ ІD NО:13); 142-151 SLYSFРЕРЕА (РRА ; SЕQ ІD NО: 14); 300-309 АLYVDSLFFL (РRА ; SЕQ ІD NО:15); 301-309 LYVDSLFFL (РRА ; SЕQ ІD NО:16)та 425-433 SLLQНLІGL (РRА ; SЕQ ІD NО: 17). Конденсовані білки В іншому втіленні заявленого винаходу, пухлинний антиген замість РRАМЕ або додатково до РRАМЕ може бути використаний у конденсованих білках, як описано тут. В одному втіленні застосовано конденсований білок, що містить конденсований партнерний білок, як описано тут, та один або більше наступних пухлинних антигенів або похідних пухлинних антигенів або їхніх імуногенних часток, котрі здатні спрямовувати імунну відповідь щодо антигену: МАGЕ-антиген, наприклад антиген МАGЕ-А як-то МАGЕ 1, МАGЕ 2, МАGЕ 3, МАGЕ 4, МАGЕ 5, МАGЕ 6, МАGЕ 7, МАGЕ 8, МАGЕ 9, МАGЕ 10, МАGЕ 11, МАGЕ 12. Ці антигени іноді відомі як МАGЕ А1, МАGЕ А2, МАGЕ А3, МАGЕ А4, МАGЕ А5, МАGЕ А6, МАGЕ А7, МАGЕ А8, МАGЕ А9, МАGЕ А10, МАGЕ А11 та/або МАGЕ А12 (МАGЕ А родина). В іншому втіленні, антиген від одного чи двох МАGЕ родин можуть бути використані: МАGЕ В та МАGЕ С група. МАGЕ В родина містить МАGЕ В1 (також відома як МАGЕ Хр1, та DАМ 10), МАGЕ В2 (також відома як МАGЕ Хр2 та DАМ 6) МАGЕ В3 та МАGЕ В4 - Маgе С родина нині містить МАGЕ С1 та МАGЕ С2. МАGЕ-антиген для використання у заявленому винаході може містити МАGЕ-антиген повної довжини. Як альтернатива, МАGЕ-антиген може містити імуногенну частку МАGЕ у котрому 1,2,3, 4, 5,6, 7,8, 9, 10 або більше амінокислот можуть бути видалені або замінені у амінокислотній послідовності. В одному втіленні заявленого винаходу 2 амінокислоти можуть бути видалені з N-кінця МАGЕ-послідовності. В іншому втіленні заявленого винаходу, у котрому антигеном є МАGЕ-А3 або його імуногенна частина, послідовність МАGЕ-А3 може бути від амінокислоти 3 до 314 МАGЕ-А3. В іншому втіленні, пухлинний антиген або його похідний для використання у заявленому винаході може бути РRАМЕ, ВАGЕ, LАGЕ 1, LАGЕ 2 (також відомий як NY-ЕSО-1), SАGЕ, НАGЕ, ХАGЕ, РSА, РАР, РSСА, Р501S (також відомий як простеїн), НАSН1, НАSН2, Сrірtо, В726, NY-ВR1,1, Р510, МUС-1, простаза, SТЕАР, тірозіназа, теломераза, сюрвівін, САSВ616, Р53, та/або Неr-2/nеu або його імуногенна частина, котрі здатні спрямувати імунну відповідь щодо антигену. В одному втіленні винаходу, пухлинний антиген може містити або складатися з одного з наступних антигенів, або їх імуногенних частин, котрі є здатними спрямувати імунну відповідь щодо антигену: SSХ-2; SSХ-4; SSХ-5; NА17; МЕLАN-А; Р790; Р835; В305D; В854; САSВ618 (як описано у WО00/53748); САSВ7439 (як описано у WО01/62778); С1491; С1584; та С1585. В одному втіленні, антиген для використання у заявленому винаході може містити або складатися з Р501S. Р501S, який також називають простеїном (Хu еt аl., Саnсеr Rеs. 61,2001, 1563-1568), відомий як SЕQ ІD NО 113 з WО98/37814 та являє собою білок з 553 амінокислот. Імуногенні фрагменти та їхні частини, що містять принаймні 20, бажано 50, більш бажано 100 суміжних амінокислот, як розкрито у зазначеній заявці на патент можуть бути використанні у конденсованих білках заявленого винаходу. Бажані фрагменти виявлено у WО 98/50567 (антиген РS108) та як білок, асоційований з раком простати (SЕQ ІD NО: 9 з WО 99/67384). Іншими бажаними фрагментами є амінокислоти 51-553, 34-553 або 55-553 з білку Р501S повної довжини. В одному втіленні, антиген може містити або складатися з WТ-1, який експресується геном пухлини Вілма; або його імуногенною частиною, котрі здатні спрямувати імунну відповідь щодо антигену; або N-кінцевий фрагмент WТ-1F, що містять приблизно 1-249амінокислот з WТ-1. В іншому втіленні, антиген може містити або складатися з антигену, що експресується геном Неr-2/nеu, або його фрагменту або його імуногенної частини, котрі здатні спрямувати імунну відповідь щодо антигену. В одному втіленні, антиген Неr-2/nеu може бути одним з конденсованих білків, котрі описано у WО00/44899. Антиген для використання у заявленому винаході може містити або складатися з "НЕR2/nеu ЕСD-ІСD конденсованого білку," також відомого як "ЕСD-ІСD" або "ЕСD-ІСD конденсований білок", котрий стосується конденсованого білку (або його фрагментів), що містять позаклітинний домен (або його фрагменти) та внутрішньоклітинний домен (або його фрагменти) білку НЕR-2/nеu. В одному втіленні, цей конденсований білок ЕСD-ІСD не містить значної частини трансмембранного домену НЕR-2/nеu, або не містить будь-якого трансмембранного домену НЕR-2/nеu. В іншому втіленні, антиген може містити або складатися з "конденсованого білку НЕR-2/nеu ЕСD-РD", також відомого як "ЕСD-РD" або "конденсований білок ЕСD-РD", чи "конденсованого 5 UA 99722 C2 5 10 15 20 25 30 35 40 45 50 55 60 білок НЕR-2/nеu ЕСD-АРD", також відомого як "конденсований білок ЕСD-АРD" або "ЕСD-АРD", котрий стосується конденсованого білку (або його фрагментів), що містять позаклітинний домен (або його фрагменти) та фосфорильований домен (або його фрагменти, наприклад, АРD) білку НЕR-2/nеu. В одному втіленні, ЕСD-РD та ЕСD-АРD конденсовані білки не містять значної частини трансмембранного домену НЕR-2/nеu, або не містять будь-якого трансмембранного домену НЕR-2/nеu. Конденсовані білки РRАМЕ-антигену та конденсований партнерний білок білку D, як описано тут, можуть бути хімічно конденсовані, але переважно вони експресуються як рекомбінантно конденсовані білки, які дозволяють знизити рівень МАGЕ-білку з метою продукції у системах експресії, порівняно з одним РRАМЕ без конденсованого партнера, як-то білок D або модифікований білок D. Додатково або альтернативно, пухлинні антигени, описані тут, та конденсований партнерний білок заявленого винаходу можуть бути хімічно конденсовані або експресовані як рекомбінантні конденсовані білки, котрі можуть сприяти збільшенню рівня МАGЕ-білку або іншого пухлинного антигену, що продукується у експрес-системі порівняно з РRАМЕ або іншим пухлинним антигеном без конденсованого партнера, як-то білок D або модифікований білок D. Конденсовані білки заявленого винаходу, як описано тут, можуть додатково містити одну або більше лінкерних послідовностей між конденсованим партнером білку та пухлинним антигеном або його імуногенною частиною; чи між конденсованим партнером білку та Ніsхвостом або іншим афінним кінцем (у разі його наявності); чи між пухлинним антигеном або його імуногенною часткою та Ніs-хвостом або іншим афінним кінцем (у разі його наявності). Амінокислоти у лінкерних послідовностях можуть бути неспорідненими до послідовностей антигену та/або конденсованого партнера. Конденсовані білки заявленого винаходу, як описано тут, можуть додатково містити амінокислоти Меt-Аsр-Рrо при N-кінці послідовності конденсованого білку. Меt амінокислота може бути від вихідної послідовності білку D, або від неспорідненої послідовності. Конденсований партнер може бути допоміжним у експресії білку (енхансером експресії) за більшої продуктивності, ніж природний рекомбінантний білок. Конденсований партнерний білок D, завдяки своїй чужинній природі, може бути частково імуногенним іn vіvо та сприяти конденсованому білку, що містить РRАМЕ або іншому пухлинному антигену, шляхом утворення епітопів Т-хелперів, бажано епітопів Т-хелперів, що розпізнаються Т-клітинами СD4. Так, вважається, що клітини СD4-Т залучені до генерації імунної відповіді, зокрема, відповіді цитотоксичних Т-клітин СD8. В одному втіленні, конденсований партнер може функціонувати як енхансер-партнер та імунологічно конденсований партнер. В іншому аспекті винахід стосується конденсованого білку, в якому N-кінцева частина білку D (як описано вище або тут) конденсована з N-кінцем РRАМЕ або його імуногенного фрагменту. У більш конкретному випадку, конденсація пухлинного антигену з фрагментом білку D та Nкінцем або іншою частиною може призвести до того, що РRАМЕ або інший пухлинний антиген або його похідний, як описано тут, заміщує С-кінець білку D, який вирізається. Таким чином, Nкінець білку D стає N-кінцем конденсованого білку. Інші конденсовані партнери або їхні фрагменти можуть бути включені у конденсовані білки винаходу, або можуть заміняти складові білку D заявленого винаходу, наприклад, у втіленнях, що містять РRАМЕ-антиген або його фрагмент чи частину, як описано тут. Приклади інших конденсованих партнерів містять: - неструктурований білок від вірусу грипу, NS1 (гемаглютинін) – зазвичай використовують 81 N-кінцевих амінокислот, проте можуть бути використані інші фрагменти, за умови, що вони містять епітопи Т-хелперів; - LYТА, похідний від Strерtососсus рnеumоnіае, котрий синтезує N-ацетіл-L-аланін амідазу, амідазу LYТА, (кодовану геном lуtА {Gеnе, 43 (1986) 265-272} як-то частина молекули Lуtа, що повторюється, знайдена у С-кінці, наприклад, починаючи з залишку 178 як-то залишків 188 305. Очищення гібридних білків, що містять С-LYТА фрагмент при їхніх амінних кінцях, описано {Віоtесhnоlоgу: 10, (1992) сторінки 795-798. Конденсований білок винаходу може містити афінний кінець, наприклад, гістидинові хвости, що містять від 5 до 9, як-то 6, гістидінових залишків. Ці залишки можуть, наприклад бути на кінцевій частині білку D (як-то N-кінець білку D) та/або можуть бути конденсовані з кінцевою частиною РRАМЕ-антигену або його похідного, чи пухлинним антигеном або його похідним, як описано тут. Проте загалом гістидіновий хвіст розташовується на кінцевій частині РRАМЕантигену або його похідних, чи пухлинному антигені або його похідному, як описано тут, як-то С 6 UA 99722 C2 5 10 15 20 25 30 35 40 45 50 55 60 кінці РRАМЕ-антигену або його похідного, або пухлинного антигену або його похідного, як описано тут. Гістидіновий хвіст може бути корисним з метою сприяння очищенню. Заявлений винахід також стосується нуклеїнових кислот, що кодують білки заявленого винаходу. Так, послідовності можуть бути вставлені до відповідного вектору експресії та використані для ДНК/РНК-вакцинації або експресовані у відповідних хазяйських клітинах. Мікробні вектори, які експресують нуклеїнові кислоти, можуть бути використані як вакцини. Такі вектори, що містять наприклад, поксивірус, аденовірус, альфавірус, лістерію та монофаг Послідовності ДНК, що кодують білки заявленого винаходу, можуть бути синтезовані за допомогою стандартної техніки синтезу ДНК, як-то шляхом ферментативної лігації, як описано D.М. Rоbеrts еt аl у Віосhеmіstrу 1985, 24, 5090-5098, шляхом хімічного синтезу, шляхом ферментативної полімеризації іn vіtrо, або шляхом ПЛР-технології з використанням, наприклад, жаростійкої полімерази, або шляхом комбінації цих методик. Ферментативна полімеризація ДНК може бути здійснена іn vіtrо з використанням ДНК полімерази (Кlеnоw фрагмент) у відповідному буфері, що містить нуклеозидтрифосфатази dАТР, dСТР, dGТР та dТТР відповідно до вимог, при температурі 10°-37°С, загалом у об’ємі 50 мкл або меншому. Ензиматична лігація фрагментів ДНК може бути здійснена за допомогою ДНК-лігази, як-то Т4 ДНК-лігази у відповідному буфері, як-то 0,0 5М Трис (рН 7,4 ), 0,0 1М МgСl2, 0,0 1М дитіотреїтол, 1 мМ спермідін, 1 мМ АТФ та 0,1 мМ/мл альбуміну коров’ячої сироватки, при температурі від 4°С до кімнатної, загалом у об’ємі 50 мл або меншому. Хімічний синтез полімеру або його фрагментів може бути здійснений звичайною хімією фосфотриестерів, фосфітів або фосфортриамідів, застосовуючи твердофазні способи як-то описані у 'Сhеmісаl та Еnzуmаtіс Sуnthеsіs оf Gеnе Frаgmеnts - А Lаbоrаtоrу Маnuаl' (еd. Н.G. Gаssеn та А. Lаng), Vеrlаg Сhеmіе, Wеіnhеіm (1982), або у інших наукових публікаціях, наприклад М.J. Gаіt, Н.W.D. Маtthеs, М. Sіngh, В.S. Sрrоаt, та R.С. Тіtmаs, Nuсlеіс Асіds Rеsеаrсh, 1982, 10, 6243; В.S. Sрrоаt, та W. Ваnnwаrth, Теtrаhеdrоn Lеttеrs, 1983,24, 5771; М.D. Маttеuссі та М.Н. Саruthеrs, Теtrаhеdrоn Lеttеrs, 1980,21, 719; М.D. Маttеuссі та М.Н. Саruthеrs, Jоurnаl оf Аmеrісаn Сhеmісаl Sосіеtу, 1981,103, 3185; S.Р. Аdаms еt аl, Jоurnаl оf Аmеrісаn Сhеmісаl Sосіеtу, 1983, 105, 661; N.D. Sіnhа, J. Віеrnаt, J. МсМаnnus, та Н. Коеstеr, Nuсlеіс Асіds Rеsеаrсh, 1984, 12, 4539; та Н.W.D. Маtthеs еt аl, ЕМВО Jоurnаl, 1984, 3, 801. Спосіб винаходу може бути здійснений за допомогою традиційної методики рекомбінації, якто описано у Маnіаtіs еt аl, Моlесulаr Сlоnіng - А Lаbоrаtоrу Маnuаl; Соld Sрrіng Наrbоr, 19821989. Зокрема, спосіб може полягати у нижченаведеному: і) отримання реплікабельного або інтегрувального вектору експресії, здатного у хазяйській клітині до експресії полімеру ДНК, що містить нуклеотидну послідовність, яка кодує білок або його імуногене похідне; іі) трансформація хазяйських клітин зазначеним вектором; ііі) культивація зазначених хазяйських клітин за умов, що дозволяють експресію зазначеного ДНК полімеру у зазначений білок; та іv) отримання зазначеного білку. Термін «трансформація» означає введення чужинної ДНК до хазяйських клітин. Це може бути досягнуто, наприклад, шляхом трансформації, трансфекції до плазмід або вірусних векторів використовуючи, наприклад, традиційну методику, як описано у Gеnеtіс Еngіnееrіng; Еds. S.М. Кіngsmаn та А.J. Кіngsmаn; Вlасkwеll Sсіеntіfіс Рublісаtіоns; Охfоrd, Еnglаnd, 1988. Термін «трансформовані» або 'трансформант’ далі означатиме отримані хазяйські клітини, що містять та експресують необхідні чужинні гени. Вектори експресії також є інноваційною частиною винаходу. Вектори експресії, які здатні до реплікації, можуть бути отримані згідно з винаходом шляхом розщеплення вектору, сумісного з хазяйськими клітинами, з метою отримання лінійного сегменту ДНК, що має цілий реплікон, та поєднання зазначеного лінійного сегменту з однією або більшою кількістю молекул ДНК, котрі разом із зазначеним лінійним сегментом кодують бажаний продукт, як-то полімер ДНК, який кодує білок винаходу, або його похідний, в умовах лігування. Так, полімер ДНК може бути сформований заздалегідь, або під час конструювання бажаного вектору. Вибір вектору визначається, зокрема, хазяйською клітиною, котра може бути прокаріотичною або еукаріотичною, але, зазвичай, клітиною Е. соlі або СНО. Відповідні вектори можуть містити плазміди, наприклад, ТМСР14 або рЕТ21 або рЕТ26, рсДНК3, бактеріофаги, косміди та рекомбінантні віруси. Отримання реплікаційного вектору експресії може бути традиційно здійснено за допомогою відповідних ферментів рестрикції, полімерізації та лігування ДНК, за допомогою методики 7 UA 99722 C2 5 10 15 20 25 30 35 40 45 50 55 60 описаної, наприклад, Маnіаtіs еt аl., що згадувалась вище. Рекомбінантну хазяйську клітину отримують, згідно з винаходом, шляхом трансформації хазяйської клітини реплікабельним вектором експресії винаходу, у необхідних для трансформації умовах. Відповідні умови для трансформації є загальновідомими та описаними у, наприклад, Маnіаtіs еt аl, що згадувалась вище, або "DNА Сlоnіng " Vоl. ІІ, D.М. Glоvеr еd., ІRL Рrеss Ltd, 1985. Вибір умов трансформації визначається хазяйською клітиною. Так, бактеріальна хазяйська клітина, як-то Е. Соlі, може бути оброблена розчином СаСl2 (Соhеn еt аl., Рrос. Nаt. Асаd. Sсі., 1973, 69, 2110) або розчином, що містить суміш RbСl, МnСl2 ацетату калію та гліцерину, а потім - 3-[N-морфоліно]-пропан-сульфоновою кислотою, RbСl та гліцерином. Клітини ссавців у культурі можуть бути трансформовані калієвим копреципітатом вектору ДНК у клітини. Винахід також стосується хазяйських клітин трансформованих реплікабельним вектором експресії винаходу. Кодони ДНК можуть бути оптимізовані за допомогою стандартних способів для подальшого полегшення експресії релевантного хазяїна. В одному втіленні заявленого винаходу застосована ДНК, що кодує конденсований білок, який містить РRАМЕ-антиген або його частину чи фрагмент, як описано тут, у котрій нуклеотидна послідовність РRАМЕ-антигену або його частини чи фрагменту мають оптимізовані кодони. В одному втіленні, нуклеотидна послідовність, що кодує білок D, не має оптимізованих кодонів. Культивація трансформованих хазяйських клітин в умовах, що дозволяють експресію полімеру ДНК, зазвичай здійснюють, як описано, наприклад, у вищезгаданих Маnіаtіs еt аl. та "DNА Сlоnіng". Так, бажано, щоб клітина знаходилась у поживному середовищі та культивувалась при температурі нижче 50°С. Білки заявленого винаходу можуть бути експресовані у прокаріотах та еукаріотах, як-то дріжджі, проте зазвичай вони експресуються у Е. соlі. Можуть бути використані такі різновиди штамів Е. Соlі як АR58 та ВLR DЕ3. Загалом селекційні маркери, наприклад, стійкі до канаміцину або ампіциліну, запроваджуються для полегшення ідентифікації успішного введення рекомбінантного гену/констракту до системи експресії. Продукт отримують традиційними способами з хазяйських клітин та відповідно до локалізації продукту експресії (внутрішньоклітинний, або секретований у культурному середовищі, або у периплазмі клітини). В одному втіленні заявленого винаходу продукт експресії є внутрішньоклітинним. В іншому втіленні заявленого винаходу продукт експресії є нерозчинним білком. Так, коли хазяйською клітиною є бактеріальна, як-то Е. Соlі, вона може, наприклад, бути виділена фізично, хімічно або ферментативно, а білковий продукт виділяють з кінцевого лізату. Коли хазяйською клітиною є клітина ссавця, продукт може бути взагалі виділений з культиваційного середовища або з екстрактів без клітин. Традиційні методики виділення білку передбачають селективну преципітацію, абсорбційну хроматографію та афінну хроматографію, у тому числі з колонкою, афінною стосовно моноклональних антитіл. В одному втіленні винаходу запропоновано спосіб отримання конденсованого білку, як описано тут, що має етап експресії у клітині конденсованого білку, що містить конденсований партнерний білок, як описано тут. Клітина може бути бактеріальною. В іншому втіленні, у котрому клітина є бактеріальною, бактерією може бути Е. соlі. Спосіб заявленого винаходу може мати етап експресії у клітині конденсованого білку, як описано тут, у вигляді нерозчинного білку. Спосіб може подалі мати етап лізації клітин та очищення експресованого конденсованого білку від лізованих клітин. В одному втіленні винаходу запроваджено конденсований білок, отриманий або досяжний для отримання у способі, як описано тут. Білки заявленого винаходу можна отримувати у рідинно-розчинній формі або у ліофілізованій формі. Очікується, що кожна доза для людини буде містити від 1 до 1000 мкг білку, бажано 30 - 300 мкг. Заявлений винахід також стосується фармацевтичних композицій, як-то вакцин, що містять конденсований білок заявленого винаходу у фармацевтично придатному наповнювачі. У оптимальному варіанті вакцина може містити один або більше інших пухлинноасоційованих антигенів або поліпептидів, або ще краще, бути поєднаною з іншими раковими вакцинами, основаними на пухлинно-асоційованому антигені. Наприклад, ці пухлинноасоційовані антигени можуть бути антигенами, описаними тут, та/або членами родин МАGЕ, LАGЕ та GАGЕ чи WТ-1. В одному втіленні пухлинно-асоційований антиген може містити або складатися з антигену МАGЕ-А3. Отримання вакцин в загальних рисах описано у Vассіnе Dеsіgn ("Тhе subunіt аnd аdjuvаnt 8 UA 99722 C2 5 10 15 20 25 30 35 40 45 50 55 60 аррrоасh" fеds. Роwеll М.F. & Nеwmаn М.J). (1995) Рlеnum Рrеss Nеw Yоrk). Інкапсуляція у ліпосоми описана Fullеrtоn, патент США 4,235,877. Білки заявленого винаходу можуть бути ад´ювантами у вакцинній композиції винаходу. Відповідні ад´юванти можуть містити сіль алюмінію, як-то гель гідроксиду алюмінію, або фосфат алюмінію, але можуть також бути солями кальцію, феруму або цинку, або можуть бути нерозчинною суспензією ацетильованого тирозину, або ацетильованих вуглеводів, катіонними або аніонними похідними полісахаридів, чи поліфосфазенів. Інші відомі ад´юванти мають СрG-вмісні олігонуклеотиди. Для олігонуклеотидів характерним є те, що СрG-динуклеотид є неметильованим. Такі нуклеотиди добре відомі та описані, наприклад, у WО 96/02555. У композиції винаходу також бажано, щоб композиція ад´юванту викликала імунну відповідь переважно ТН1-типу. В одному втіленні застосовано систему ад´юванту, що містить, наприклад, комбінацію монофосфорильного ліпіду А, бажано 3-де-О-ацетильованого монофосфорильного ліпіду А (3D-МРL) із сіллю алюмінію. Ад´ювант також може іноді містити СрG-олігонуклеотиди, для того, щоб викликати бажану ТН1-відповідь. Система посилення, що може бути використана у заявленому винаході, містить комбінацію монофосфорил ліпіду А та похідного сапоніну, зокрема, комбінацію QS21 та 3D-МРL, як описано у WО 94/00153, або, наприклад, менш реактогенну композицію, де QS21 послаблено холестерином, як описано у WО 96/33739. Композиція, що може бути використана у заявленому винаході, містить QS21 3D-МРL і токоферол, наприклад, емульсію олії у воді, описану в WО 95/17210. Іншою композицією ад´ювантів, що може бути використана у композиції заявленого винаходу, є QS21, 3D-МРL і СрG або його еквівалент, наприклад емульсія олії у воді, чи як ліпосомна композиція. Відповідно, в одному втіленні заявленого винаходу застосовано вакцину, що містить конденсований білок або конденсований партнерний білок, як описано тут, та ад´ювант, наприклад, описаний вище. Комбінація РRАМЕ та МАGЕ В одному втіленні заявленого винаходу застосовано композицію, що містить: (а) компонент антигену, що містить РRАМЕ-антиген або конденсований білок, як описано тут, та (b) компонент антигену, що містить МАGЕ-антиген або конденсований білок, як описано тут. В іншому втіленні, композиція може містити ад´ювант, як описано тут. МАGЕ-антиген, призначений для використання у комбінації, може містити МАGЕ-антиген повної довжини. Як альтернатива, МАGЕ-антиген може містити імуногенну частку МАGЕ у котрій 1,2, 3,4, 5, 6, 7, 8, 9,10 або більше амінокислот можуть бути видалені або замінені в амінокислотній послідовності. В одному втіленні заявленого винаходу, дві амінокислоти можуть бути видалені з N-кінця МАGЕпослідовності. В іншому втіленні заявленого винаходу, у котрій антигеном є МАGЕ-А3 або його імуногенна частина, послідовність МАGЕ-А3 може бути з 3 – 3l4 амінокислот МАGЕ-А3. Для комбінації, описаної вище, РRАМЕ- та/або МАGЕ-антигени можуть бути частиною конденсованого білку або білків, описаних тут, або антигени можуть бути присутніми у інших конденсованих білках, або можуть бути представлені лише антигеном. В одному втіленні заявленого винаходу застосовано композицію, що містить конденсований білок, що містить РRАМЕ-антиген та конденсований партнерний білок, як описано тут, та конденсований білок, що містить антиген МАGЕ-А3 та конденсований партнерний білок, як описано тут. У альтернативному втіленні, конденсований білок, що містить МАGЕ-А3 антиген, містить або складається з МАGЕ-А3 антигену та конденсованого партнерного білку, що містить приблизно перші 109 амінокислот білку D, у котрому одна, дві або більше амінокислот білку D замінено оптимальним чином, та у котрій сигнальні послідовності білку D представлено оптимальним чином, додатково до перших 109 амінокислот білку D. Конденсований білок заявленого винаходу може додатково містити одну або більше амінокислот у якості "лінкерів" між послідовностями антигену та конденсованим партнером білку, або між антигеном та Ніs-хвостом, у разі його наявності. Амінокислоти може бути неспорідненими з послідовностями антигену та/або конденсованого партнера. Конденсований білок заявленого винаходу, як описано тут, може додатково містити амінокислоти Меt-Аsр-Рrо при N-кінці конденсованого білку послідовності. Меt-амінокислота може походити від послідовності вихідного білку D або від неспорідненої послідовності. В одному втіленні, послідовності конденсованого білку, що містять МАGЕ-А3 та білок D для використання у заявленому винаході, зображено у Фіг. 12 та SЕQ ІD NО:43. Заявлений винахід також стосується способів отримання зазначених вакцин/ композицій. ПРИКЛАДИ 9 UA 99722 C2 5 Чотири конденсованих констракти були отримані та представлені тут як Приклади/констракти 1, 2, 3 та 4. Констракт з оптимізованими кодонами був отриманий з прикладу 3 та позначений тут як приклад 3а. Констракт з оптимізованими кодонами був отриманий з прикладу 4 та позначений тут як приклад 4а. У прикладах 3а та 4а послідовність щодо частини молекули білку D є такою самою. Проте, деякі кодони у районі РRАМЕ були модифіковані з метою подальшого вдосконалення експресії та, у Прикладі 3а, лінкер між РRАМЕ та його хвостом видалено. Таблиця А Структури конденсованого білку і деталі плазмід прикладів /констрактів 1–4 N-кінець --------------------------------------------------------------------С - кінець Приклад/ амінокислоти, Констракт вставлені № клонуванням 1 2 і 3 4 20 25 30 35 40 МDР 4а 15 МDР 3а 10 МDР МDР МDР МDР конденсований раковий антиген партнер 20-127 білок D 20-127 білок D 20-127 білок D 20-127 білок D 20-127 білок D 20-127 білок D РRАМЕ амінокислотна послідовність лінкер/Ніs-хвіст використана плазміда ТSGНННННН ТСМР14 РRАМЕ ТСМР14 РRАМЕ РRАМЕ LЕНННННН рЕТ21 рЕТ21 РRАМЕ НННННН рЕТ26 РRАМЕ рЕТ26 Конденсовані білки наведених прикладів містять 20-127 амінокислот білку D. Амінокислоти Меt, Аsр та Рrо були вбудовані на N-кінці фрагмента білку D (тобто амінокислоти МDР 20-127 білку D). Вважають, що ці три додаткові амінокислоти можуть сприяти стабілізації білку та/або посилити рівень експресії білку. Амінокислота 127 білку D є конденсована до N-кінця РRАМЕ повної довжини (тобто амінокислота 127 білку D, конденсована до N-кінця РRАМЕ). Гістидіновий вільний хвіст, з метою сприяння очищенню, був включений до трьох з шести білків. Точна послідовність хвоста залежить від застосовуваної плазміди. Три різних типи плазмід, ТСМР14 та рЕТ21 або рЕТ26 були сконструйовані для кожної плазміди; ДНК, що кодує конденсований білок, була включена з гістидіновим хвостом та без нього. Якщо не визначено іншим чином, то загальна стратегія, що описана нижче, використовується для отримання кожного прикладу. Стратегія клонування для генерування РР1/3-РRАМЕ (з Ніs-кінцем або без нього) рекомбінантного білку з використанням вектору ТСМР14. Ампліфікація послідовностей, представлених у плазміді ТСМР14, була здійснена за допомогою трьох етапів стратегії ПЛР. Вектор рНІС348, що містить ДНК послідовність, яка містить ген повного білку D, отримано від Dr. А. Fоrsgrеn, Dераrtmеnt оf Меdісаl Місrоbіоlоgу, Unіvеrsіtу оf Lund, Маlmо Gеnеrаl Ноsріtаl, Маlmо, Swеdеn. ДНК-послідовність білку D оприлюднена у Jаnsоn еt аl. (1991) { Jаnsоn Н, LОНеdеn, АGrubb, М Ruаn, & А Fоrsgrеn, 1991. Іnfесt Іmmun 59:119-125}. Вектор експресії рМG81 є похідним рВR322, у котрому бактеріофаг Х виробляє контрольні елементи для транскрипції та трансляції чужинних вставлених генів представлено у (Shаtzmаn еt аl., 1983) { Shаtzmаn А, YS Но, & М Rоsеnbеrg. 1983. Ехреrіmеntаl Маnірulаtіоn оf Gеnе Експрес. Іnоuуа (еd) рр 1-14. Асаdеmіс NY}. Додатково, ген стійкості до ампіциліну та ген стійкості до канаміцину поміняли місцями. Кодувальна послідовність частини білку NS1 (амінокислоти від 4 до 81) були замінені множинними сайтами клонування з метою отримання рМG81 МСS. Кодувальна послідовність 1/3 білку D (амінокислоти від 20 до 127) була клонована у рМG81 МСS за допомогою сайтів рестрикції ВаmНІ та Nсоl з метою отримання рМG81-l/3РD. По-перше, ПЛР-ампліфікація сектору, що відповідає 20-127 амінокислотам білку D, була здійснена за допомогою вектору рМG81 - 1/3РD в якості матриці та олігонуклеотидної смислової послідовності: 10 UA 99722 C2 5 10 15 20 25 30 35 40 45 50 55 60 5' АТА ТАА САТ АТG GАТ ССА АGС АGС САТ ТСА ТСА ААТ 3' (САN008; SЕQ ІD NО: 18) та антисмислової послідовності: 5' ССА САА АСG ССТ ТСG ТТС САТ GGТ ТТС ААА GТТ ТТС ТGТ С 3' (САN037; SЕQ ІD NО: 19). РRАМЕ кДНК, отримана від Ludwіg Іnstіtutе, Вrussеls, Веlgіum була введена до Вstхl-Nоtl сайту вектору рСДНКl (Іnvіtrоgеn) для отримання рекомбінантного вектору рСДНК-1-РRАМЕ. ПЛР-ампліфікація сектору, відповідного до амінокислот МАGЕ-білку, була здійснена за допомогою вектору рсДНК-1 -РRАМЕ (GSКВіо) в якості матриці та олігонуклеотидної смислової послідовності: 5' GАС АGА ААА СТТ ТGА ААС САТ GGА АСG ААG GСG ТТТ GТG G 3' (САN036; SЕQ ІD NО: 20) та анти смислової послідовності: 5' АGА GАG АСТ АGТ СТА GТТ АGG САТ GАА АСА GGG GСА САG 3' (САN029; SЕQ ІD NО: 21) або 5' GGА GGА АСТ АGТ GТТ АGG САТ GАА АСА GGG GСА САG 3' (САN002; SЕQ ІD NО: 22) в залежності чи був доданий його хвіст (САN002), чи не був (САN029). Кінцева РRАМЕ послідовність, вставлена у плазміду ТСМР14, була отримана шляхом подальшої ПЛРампліфікації за допомогою матриць генів 1/3РD та РRАМЕ, що були отримані у попередніх кроках для матриці та олігонуклеотидної смислової послідовності САN008 та антисмислової послідовності: САN029 або САN002 в залежності чи є її хвіст (САN002), чи немає (САN029). Ndеl при 5' кінці та Sреl при 3' кінці сайтів також були додані для клонування фрагментів до вектору ТСМР14. Конструкція вектору для експресії рекомбінантного білку 1/3РD-РRАМЕ (з Ніs-хвостом або без нього) у векторі рЕТ21: Були використані рекомбінантна кДНК-плазміда під назвою рсДНКl-РRАМЕ (як описано у попередній стратегії) що містить кодувальну послідовність для гену РRАМЕ та вектор РМG811/3РD (як описано у попередній стратегії), що містить N-кінцеву частину кодувальної послідовності білку D. Стратегія клонування включає наступні етапи: а) по-перше, послідовності 1/3РD без секреторного сигналу (секреційної або сигнальної послідовності) були ПЛР-ампліфіковані від плазміди РМG81-1/3РD за допомогою олігонуклеотидної смислової послідовності: r 5 АGАGАGСАТАТGАGСАGССАТТСАТСАААТАТGGСG (САN040; SЕQ ІD NО: 22), та антисмислової послідовності: 5' АСGТGGGСGGССGСGGТТТСАААGТТТТСТGТСАТТТСТАА (САN032; SЕQ ІD NО: 23); Ndеl при 5' та Nоtl при 3' кінці сайтів були також додані для клонування фрагменту до рЕТ21b(+) вектору. b) РRАМЕ-послідовності були ПЛР-ампліфіковані від плазміди рсДНКl-РRАМЕ за допомогою олігонуклеотидної смислової послідовності: 5' ttgttggсggссgсааtggаасgааggсgtttgtggggt (САN033; SЕQ ІD NО: 25), та антисмислової послідовності: 5' ggаggасtсgаggtкінцемgсаtgааасаggggсасаg (САN034; SЕQ ІD NО: 26); Nоtl при 5' кінці та Хhоl при 3' кінці сайтів були також додані для клонування фрагменту до рЕТ2Іb вектору. Ця ампліфікація призвела до додавання при С-кінці білку двох амінокислот, Lеu та Glu, за якими знаходиться 6 Ніs у плазміді рЕТ21b(+). Для продукування білку без Ніs-хвоста стоп-кодон (ТАG) був доданий при 3' кінці гену РRАМЕ з використанням САN033 та САN035 (антисмислової послідовності): 5' ggаggасtсgаgскінцемtкінцемgсаtgааасаggggсасаg (САN035; SЕQ ІD NО: ХХ) замість САN033 та САN034. c) Клонування до плазміди рЕТ2lb(+) (Іnvіtrоgеn) зазначених ампліфікованих фрагментів. d) видалення сайту Nоtl між 1/3РD та РRАМЕ за допомогою QuіkСhаngе ІІ Sіtе-Dіrесtеd Мutаgеnеsіs Кіt (Strаеndеmеnе) та олігонуклеотидної смислової послідовності: 5' саgаааасtttgааассаtggаасgааggсg (САN106; SЕQ ЕD NО: ХХ), та антисмислової послідовності: 5' сgссttсgttссаtggtttсаааgttttсtg (САN107; SЕQ ІD NО: ХХ). е) Додавання двох амінокислот Аsр та Рrо після Меt у позиції 1 при N-кінці білку D 1/3 шляхом мутагенезу та використання олігонуклеотидної смислової послідовності: 5' ggаgаtаtасаtаtggаtссааgсаgссаttсаtсаааtаtgg (САN104; SЕQ ІD NО: ХХ) та антисмислової послідовності: 5' ссаtаtttgаtgааtggсtgсttggаtссаtаtgtаtаtсtсс (САN105; SЕQ ІD NО: ХХ). Конструювання вектору для експресії рекомбінантного білку 1/3РD-РRАМЕ з 11 UA 99722 C2 5 10 15 20 25 30 35 40 45 50 55 60 оптимізованими кодонами (без Ніs-кінця або з ним) до вектору рЕТ26: Ген РRАМЕ був оптимізований щодо кодонів та клонований в основу рGА4 із додаванням сайтів Nоtl та Хhоl до 5' кінця та 3' кінця оптимізованого гену відповідно. Ця плазміда, що називається 0606420рGА4, була використана для клонування гену у конденсаті з РD1/3 до вектору рЕТ26 за допомогою наступних етапів. a) видалення відповідного Nоtl/Хhоl фрагменту до оптимізованої РRАМЕ послідовності зі стоп кодоном при 3'кінці гену від плазміди 0606420рGА4. b) Клонування оптимізованого фрагменту РRАМЕ до плазміди рЕТ26b(+), котра містить 1/3РD1 попередньо клоновану Ndеl/Nоtl із олігонуклеотидами САN040 та САN032, як описано вище, де амінокислоти Аsр та Рrо були додані у N-кінець мутагенезом з олігонуклеотидами САN104 та САN105. c) видалення сайту Nоtl шляхом мутагенезу з олігонуклеотидами: смислова послідовність 5' gасаgаааасtttgааассаtggаасgtсgtсgtсtgtgg (САN123; SЕQ ІD NО: ХХ) та антисмислова послідовність: 5' ссасаgасgасgасgttссаtggtttсаааgttttсtgtс (САN124; SЕQ ІD NО: ХХ). Це призвело до отримання конденсованого білку 1/3РD-РRАМЕ з оптимізованими кодонами без Ніs-хвоста. d) плазміда була потім використана як матриця для продукування 1/3РD-РRАМЕ з оптимізованими кодонами із 6 Ніs-плазмідою. Була здійснена ПЛР-ампліфікація конденсованого білку із олігонуклеотидною смисловою послідовністю 5' ggааttссаtаtggаtссааgсаgссаttс (МОЖЕ 199; SЕQ ІD NО: ХХ) та антисмисловою послідовністю: 5' GАGСТСТСGАGТСАGТGGТGGТGGТGGТGGТGGТТСGGСАТАААGСАСGGGС (САN198; SЕQ ІD NО: ХХ); сайти Ndеl при 5'- кінці, Хhоl при 3' -кінці, 6 Ніs після них, та стоп кодон були також додані для клонування фрагменту до рЕТ26b(+) вектору. е) Клонування ампліфікованого фрагменту у плазміду рЕТ26b(+) від Іnvіtrоgеn. Для продукування конденсованого білку, ДНК-констракт був клонований до вектору експресії ТСМР14. Ця плазміда використовує сигнали від фагу лямбда для керування транскрипцією та трансляцією введених чужинних генів. Запропоновані вектор, що містить промотор РL лямбда РL, оператор ОL та два сайти утилізації (NutL та NutR) для полегшення ефектів транскрипційної полярності, у разі застосування N-білку (Grоss еt аl., 1985. Моl. & Клітин. Віоl. 5:1015). Плазміда, що експресує рD-РRАМЕ конденсований білок, була сконструйована так, щоб РRАМЕ амінокислоти були додані до С-кінця 108-ми амінокислотного похідного рD без його сигнальної послідовності (секреційної або сигнальної послідовності) (тобто залишки 20-127). Для цієї конструкції три неспоріднені амінокислоти (Меt, Аsр та а пролін) були додані до N-кінця похідного рD, а для деяких конструкцій до С-кінця амінокислот РRАМЕ додано гістидіновий хвіст (дивись таблицю А вище). Цей констракт може бути альтернативно описаний як той, що містить 109-ти амінокислотне похідне рD, якщо вважати, що N-кінцевий Меt походить з послідовності рD. Хазяйські штами та трансформація Хазяйські клітини з штаму Е. Соlі АR58 (Моtt еt аl, Рrос. Nаtl. Асаd. Sсі. USА, vоl 82, рр 88-92, Jаnuаrу 1985, Віосhеmіstrу) були трансформовані плазмідою ДНК для Прикладів/констрактів 1 та 2. Лізогенний штам Е. соlі АR58, який використано для отримання Прикладів/констрактів 1 та 2 є похідним стандартного штаму NІН Е.соlі К12 N99 (F-su- gаlК2, lасZ- thr-). Він містить дефектний лізогенний фаг лямбда (gаlЕ::ТN10,1 Кіl- сІ857 DН1). Кіl-фенотип попереджує припинення макромолекулярного синтезу у хазяйській клітині. Мутація сІ857надає чутливості до температурного пошкодження репресору сl. Делеція DН1 переміщує правий оперон лямбда фагу і локуси bіо, uvr3, та сhlА. хазяйської клітини. Штам АR58 був створений шляхом трансдукції N99 за допомогою фагу лямбда Р, попередньо вирощеного на похідному SА500 (gаlЕ::ТN10,1 Кіl- сІ857 DН1). Інтродукція дефектного лізогену до N99 обрана за допомогою тетрацикліну за наявності транспозону ТNІ 0, відповідального за резистентність до тетрацикліну у сусідньому гені gаlЕ. N99 та SА500 є штамами Е.соlі К12 отриманими у лабораторії Dr. Маrtіn Rоsеnbеrg's у Nаtіоnаl Іnstіtutеs оf Неаlth. Вектори, що містять промотор РL, введені до лізогенних хазяйських клітин Е. соlі з метою стабілізації плазмідної ДНК. Лізогенні хазяйські штами містять реплікаційно дефектну ДНК фагу лямбда, інтегровану до геному (Shаtzmаn еt аl., 1983; Y Ехреrіmеntаl Маnірulаtіоn оf Gеnе Експрес. Іnоuуа (еd) рр 1-14. Асаdеmіс Рrеss NY). ДНК фагу лямбда спрямовує синтез репресорного білку сl, котрий приєднується до вектору репресору ОL та попереджує 12 UA 99722 C2 5 10 15 20 25 30 35 40 45 50 55 60 приєднання РНК-полімерази до промотору РL і наступну транскрипцію введеного гену. Сl-ген експресійного штаму АR58 містить мутацію, чутливу до температури, таким чином транскрипція, спрямована РL може бути регульованою температурним шифтом, наприклад, через підвищення культуральної температури репресор інактивується і починається синтез чужинного білку. Ця система експресії уможливлює контрольований синтез чужинних білків, особливо тих, які можуть бути токсичними для клітини. (Shіmаtаkа & Rоsеnbеrg, 1981. Nаturе 292:128). Хазяйські клітини від штаму Е. Соlі ВLR (DЕ3) Nоvаgеn, WІ, USА (саtаlоguе numbеr: 69053-4) ВLR (DЕ3) Nоvаgеn, WІ, USА (саtаlоguе numbеr: 69053-4) ВLR є rесА-похідними ВL21, що збільшує продукцію плазмідного мономеру та може сприяти стабілізації плазміди-мішені, що містить повтори послідовностей, або чиї продукти можуть спричинити втрату профагу DЕ3 (1, 2), були трансформовані плазмідною ДНК з прикладів/констрактів 3 та 4. Кожна трансформація була здійснена стандартними способами за допомогою оброблених СаСl2 клітин (Наnаhаn D. «Рlаsmіd trаnsfоrmаtіоn bу Sіmаnіs. »Іn Glоvеr, D. М. (Еd), DNА сlоnіng. ІRL Рrеss Lоndоn. (1985): р. 109-135.). Вирощування та індукування штаму бактеріального хазяїна - Культура Бактерії вирощували на 20 мл середовища Lurіа-Веrtаnі (LВ) (ВD) + 1 мас./об.% глюкози (Lаbоrаtоіrе МАТ, №: GR-0101) + антибіотик (Саrbеnісіllіn 100 мкг/мл для рЕТ21b, канаміцин 40 нг/мл для ТСМР14). Культури інкубували при 33°С, для клітин АR58 та при 37°С для клітин ВLR (DЕ3) до О600 нм приблизно 0,8. - Індукування При ОГ600 нм приблизно 0,8, культури ВLR (DЕ3) були індукованими при 1 мМ ізопропіл-β-Dтіогалактопіранозиду (ІРТG; ЕМD Сhеmісаls Іnс., №: 5815) та інкубували протягом 2 годин або 3 годин при 37°С, хоча розчинність може бути збільшеною, якщо є застосовуваною нижча температура. При ОГ600 нм приблизно 0,8, культури АR58 були індукованими активацією теплом при 37°С та інкубували протягом 7 годин. Бактеріальний розвиток був адекватним для двох систем експресії. - Екстракція та очистка білку Після експресії поліпептиду у культурі клітини звичайно збирають центрифугуванням тоді руйнують фізичними або хімічними засобами (якщо експресований поліпептид не є секретованим у середовище) та утворений сирий екстракт зберігали для виділення потрібного поліпептиду. Реагент екстракції білку ВugВustеr™ є застосовуваним в умовах, рекомендованих постачальником (Nоvаgеn). Очистка білку РDl/3-Рrаmе-hіs Пасту клітин Е. соlі ресуспендували у 20 мМ Трис-буферу з рН 8,5 тоді пропускали крізь гомогенізатор (Раndа від Nіrо Sоаvі S.р.А. - 2 пропускання - 750 бар). Після додавання 2 мМ МgСl2 та бензонази (50 од/мл), гомогенат інкубували 1 годину при кімнатній температурі при обережному перемішуванні, тоді центрифугували 30 хвилин при 15900 g та при кімнатній температурі. Утворену гранулу ресуспендували у 20 мМ Трис-буферу з рН 8,5, що містить 1 % натрій додецилсульфату та 60 мМ Глютатіону та інкубували 30 хвилин при кімнатній температурі при обережному перемішуванні. Після центрифугування 30 хвилин при 15900 g та при кімнатній температурі гранулу викидали. Супернатант від центрифугування 10-кратно розбавляли у 20 мМ Трис-буфері, що містить 6,6 6 М сечовину, 0,3 33 М натрій хлориду (NаСl) та 11,1 1 мМ Імідазолу та тоді хроматографічно відокремлювали на колонці з Nі-афінністю (ІМАС Sерhаrоsе 6 FF - GЕ Неаlthсаrе) урівноваженій у 20 мМ Трис-буфері з рН 8,5, що містить 0,1 % натрій додецилсульфат, 6,0 М сечовину, 0,3 М NаСl та 10 мМ імідазол. Після промивання колонки із 20 мМ Трис-буфер з рН 8,5, що містить 0,5 % саркозил, 6,0 М сечовину, 0,3 М NаСl та 10 мМ Імідазол, антиген елювали з колонки збільшенням концентрації імідазолу до 40 мМ у тому ж промивальному буфері. Після додавання фосфату до 50 мМ, антиген-позитивний елюат пропускали крізь колонку Масrо-Рrер Сеrаmіс з гідроксіапатитом типу ІІ (Віо-Rаd) урівноважену у 20 мМ Трис-буфері з рН 8,5, що містить 50 мМ фосфат, 0,5 % саркозил, 6,0 М сечовину та 0,3 М NаСl. Потік крізь гідроксіапатит, що містить антиген тоді діафільтрували проти 5 мМ боратного буферу з рН 9,8, що містить 3,1 5% сахароз на мембрані Оmеgа 30 кДа (Раll). Залишок від ультрафільтрування стерилізували фільтруванням крізь мембрану з ацетату целюлози 0,4 5/0,2 2 мкм (Sаrtоrіus). Очищений матеріал зберігали при-70°С. Альтернативний спосіб очистки також застосовувано, він відрізняється від вищенаведеного способу нижченаведеними етапами: 13 UA 99722 C2 5 10 15 20 25 30 35 40 45 50 55 60 - Нема обробки бензоназою - Нема зміни натрій додецилсульфату на саркозил на колонці ІМАС (натрій додецилсульфат від екстракції до етапу НА) - Буфером, застосовуваним для діафільтрування був 5 мМ Трис-буфер з рН 8,5 - 0,5 М Аргінін. Цей альтернативний спосіб очистки призводив до неповного видалення натрій додецилсульфату із залишковим значенням приблизно 0,0 5 та 0,0 85%. - Очистка Експресовані рекомбінантні білки очищали від супернатанту фракції після центрифугування індукованої Е. соlі, застосовуючи Ніs-хелатовану смолу (QІАgеn, Сhаtswоrth, СА) згідно із інструкціями виробника смоли. Охарактеризування білку SDS-Раgе: Гель: NuРАGЕ 4-12 % Біс-Трис Гель 1,0 мм 15 або 26 лунки (Іnvіtrоgеn №: NР0323ВОХ) Дивись Фіг. 1 та 2 нижче, котрі показують аналіз SDS-раgе прикладів 3 та 4 та 3а та 4а відповідно, де відмінні рекомбінантні білки l/3рD-РRАМЕ з hіs-хвостом або без нього мігрує на гель при уявній молекулярній мас приблизно 70 кДа. Рекомбінантні білки знайдені як тіла включення у лізаті клітин Е соlі, після індукування. Отримання зразків, буферів та умов мігруваня робили в умовах, рекомендованих постачальником (Іnvіtrоgеn). 10 мкл усіх препаратів завантажували (перед індукуванням (ДІ) та після індукування (ПІ)) у лунки відповідно 100 мкл еквіваленту культури. Фіг. 1: Аналіз SDS-раgе після проявлення кумасі-блакитним рекомбінантного 1/3РD-РRАМЕ після ІРТG-індукування штаму Е. соlі ВLR DЕ3, трансформованого рекомбінантним рЕТ21. Еквівалент 100 мкл культури через 2 години індукування у штамі ВLR DЕ3 із 1 мМ ІРТG при 25, 30 або 37°С завантажено на гель. Клон №3 (1/3РD-РRАМЕ / рЕТ21) та Клон №4 (1/3РD-РRАМЕНіs / рЕТ21) є представленими на гелі до (ДІ) та після (ПІ) індукування у розчинній (супернатант) та нерозчинній (гранули) фракціях. Шлях 1 та 10: стандартне попереднє фарбування у широких межах (ВіоRаd Саt№161-0318), шлях 2 (клон №3, ДІ, супернатант), шлях 3 (клон №3, ДІ, гранули), шлях 4 (клон №3, ПІ, 25°С, супернатант), шлях 5 (клон №3, ПІ, 25°С, гранули), шлях 6 (клон №3, ПІ, 30°С, супернатант), шлях 7 (клон №3, ПІ, 30°С, гранули), шлях 8 (клон №3, ПІ, 37°С, супернатант), шлях 9 (клон №3, ПІ, 37°С, гранули), шлях 11 (клон №4, ДІ, супернатант), шлях 12 (клон №4, ДІ, гранули), шлях 13 (клон №4, ПІ, 25°С 3 супернатант), шлях 14 (клон №4, ПІ, 25°С, гранули), шлях 15 (клон №4, ПІ, 30°С, супернатант), шлях 16 (клон №4, ПІ, 30°С, гранули), шлях 17 (клон №4, ПІ, 37°С, супернатант), шлях 18 (клон №4, ПІ, 37°С, гранули). Фіг. 2: Аналіз SDS-раgе після проявлення кумасі-блакитним рекомбінантного 1/3РD-РRАМЕ після ІРТG індукування штаму Е. соlі ВLR DЕ3, трансформованого рекомбінантним рЕТ26. Еквівалент 100 мкл культури через 2 години індукування у штамі ВLR DЕ3 із 1 мМ ІРТG при 25, 30 або 37°С завантажено на гель. Клон №3а (1/3РD-РRАМЕ, оптимізований кодоном / рЕТ26) та Клон №4а (1/3РD-РRАМЕ-Ніs, оптимізований кодоном / рЕТ26) є представленими на гелі до (ДІ) та після (ПІ) індукування у розчинній (супернатант) та нерозчинній (гранули) фракціях. Шлях 2 та 10: стандартне попереднє фарбування у широких межах (ВіоRаd Саt№161-0318), шлях 1 (клон №3а, ДІ, супернатант), шлях 3 (клон №3а, ДІ, гранули), шлях 4 (клон №3а, ПІ, 25°С, D супернатант), шлях 5 (клон №3а, ПІ, 25 С, гранули), шлях 6 (клон №3а, ПІ, 30°С, супернатант), шлях 7 (клон №3а, ПІ, 30°С, гранули), шлях 8 (клон №3а, ПІ, 37°С, супернатант), шлях 9 (клон №3а, ПІ, 37°С, гранули), шлях 11 (клон №4а, ДІ, супернатант), шлях 12 (клон №4а, ДІ, гранули), шлях 13 (клон №4а, ПІ, 25°С, супернатант), шлях 14 (клон №4а, ПІ, 25°С, гранули), шлях 15 (клон №4а, ПІ, 30°С, супернатант), шлях 16 (клон №4а, ПІ, 30°С, гранули), шлях 17 (клон №4а, ПІ, 37°С, супернатант), шлях 18 (клон №4а, ПІ, 37°С, гранули). Вестерн-блотування Мембрани були блокованими протягом 30 хвилин при 37°С, 60 об/хвил, застосовуючи 3% свіжий розчин молоко/БФФР ІХ. Після блокування інкубування додавали первинні антитіла (кролів анти-РRАМЕ; GSК Віоlоgісаls SА) при розбавленні 1:5000, або α-6Х Ніs-хвост (АbСаm) при розбавленні 1:3000 у 3% свіжому розчині молоко/БФФР протягом 1 години при 37°С, 60 об/хвил. Після цього мембрани промивали три рази по 5 хвилин при кімнатній температурі, застосовуючи 0,0 2% Тwееn20/БФФР ІХ. Вторинні антитіла додавали (віслюків анти-ІgG (Н+L) кролів (Jасksоn lаbоrаtоrу) при розбавленні 1:20 000, застосовуючи 3% свіжий розчин молоко/БФФР. Мембрани інкубували протягом 1 години при 37°С, 60 об/хвил. Після цього мембрани промивали три рази 5 хвилин при кімнатній температурі, застосовуючи 0,0 2% Тwееn20/БФФР ІХ перед піддаванням мембран дії субстрату пероксидази (КН 2РО4, 10 мМ; (NН4SО4 10 мМ; О-діанізидин, 0,0 1%..гідроген пероксид 0,0 45%) або субстрат лужної фосфатази (Sіgmа Fаst) за рекомендаціями постачальника. 14 UA 99722 C2 Молекулярний аналіз: Приклад/констракт 1 5 10 15 Аналіз Суцільний білок Довжина 629 АК Молекулярна маса 71629,9 6 мол.мас. 1 мкг = 13,9 61 пмоль Коефіцієнт молярної 67680 екстинкції 1А[280] відповідний 1,0 6 мг/мл А[280] 1 мкг/мл 0,9 4 АU Ізоелектрична точка 6,4 1 заряд при рН 7 -5,8 4 Ізоелектрична точка 6,4 1 заряд при рН 7 -5,8 4 Приклад/констракт 2 Аналіз Суцільний білок Довжина 620 АК Молекулярна маса 70561,9 0 мол.мас. 1 мкг = 14,1 72 пмоль Коефіцієнт молярної екстинкції 67680 1А[280] відповідний 1,0 4 мг/мл А[280] 1 мг/мл 0,9 6 АU Ізоелектрична точка 6,2 8 заряд при рН 7 -6,3 6 Приклад/констракт 3 Аналіз Суцільний білок Довжина 628 АК Молекулярна маса 71627,0 1 мол.мас. 1 мкг = 13,9 61 пмоль Коефіцієнт молярної екстинкції 67680 1 А[280] відповідний 1,0 6 мг/мл А[280] 1 мг/мл 0,9 4 АU Ізоелектрична точка 6,3 4 заряд при рН 7 -6,8 4 Приклад/констракт 4 Аналіз Суцільний білок Довжина 620 АК Молекулярна маса 70561,9 0 мол.мас. 1 мкг = 14,1 72 пмоль Коефіцієнт молярної екстинкції 67680 1 А[280] відповідний 1,0 4мг/мл А[280] 1 мкг/мл 0,9 6 АU Ізоелектрична точка 6,2 8 заряд при рН 7 -6,3 6 Приклад 5 Оцінка продукування білків з сигналом секреції або без нього (секреційна або сигнальна послідовність) білку D 1/3 у конденсованому білку. Таблиця В Білок Рівень експресії РD1 /3-РRАМЕ з сигналом секреції + РD1/3-РRАМЕ сигналу секреції +++ Фіг. 11: Аналіз SDS-раgе після проявлення кумасі-блакитним рекомбінантного 1/3РD-РRАМЕ з сигналом секреції або без нього після ІРТG індукування штаму Е. соlі ВLR DЕ3, трансформованого рекомбінантним рЕТ21. Еквівалент 100 мкл культури після 3 годин індукування у штамі ВL21 DЕ3 із 1 мМ ІРТG при 37°С завантажено на гель. Ці констракти є представленими на гелі до (ДІ) та після (ПІ) індукування у розчинній (супернатант) та нерозчинній (гранули) фракціях. Шлях 1: стандартне попереднє фарбування у широких межах 15 UA 99722 C2 5 10 15 20 25 30 35 40 45 50 55 60 (ВіоRаd Саt№161-0318), шлях 2 (рDl/3-РRАМЕ + SS, ДІ, супернатант), шлях 3 (рDl/3-РRАМЕ + SS, ДІ, гранули), шлях 4 (рDl/3-РRАМЕ + SS, ПІ, супернатант), шлях 5 (рDl/3-РRАМЕ + SS, ПІ, гранули), шлях 6 (рDl/3-РRАМЕ + SS + Ніs, ДІ, супернатант), шлях 7 (рDl/3-РRАМЕ + SS + Ніs, ДІ, гранули), шлях 8 (рDl/3-РRАМЕ + SS + Ніs, ПІ, супернатант), шлях 9 (рDl/3-РRАМЕ + SS + Ніs, ПІ, гранули), шлях 10 (рDl/3-РRАМЕ w/о SS, ДІ, супернатант), шлях 11 (рDl/3-РRАМЕ w/о SS, ДІ, гранули), шлях 12 (рDl/3-РRАМЕ w/о SS, ПІ, супернатант), шлях 13 (рDl/3-РRАМЕ w/о SS, ПІ, гранули), шлях 14 (рDl/3-РRАМЕ w/о SS + Ніs, ДІ, супернатант), шлях 15 (рDl/3-РRАМЕ w/о SS + Ніs, ДІ, гранули), шлях 16 (рDl/3-РRАМЕ w/о SS + Ніs, ПІ, супернатант), шлях 17 (рDl/3РRАМЕ w/о SS + Ніs, ПІ, гранули). Приклад 6: Імуногенність РD-РRАМЕ-Ніs, сформованого у АSО1В або АS15: межі доз антигену у постійній дозі ад’юванту. Призначення: межі доз антигену для вибору найкращої дози для застосування у доклінічних експериментах Протокол: 6 групи з 12 мишей СВ6F1 отримували внутрішньом’язові (ІМ) ін’єкції на добу 0 та 14: 1. БФФР 2. РRАМЕ (50* мкг) у АSО1В або АS15 3. РRАМЕ (10 мкг) у АSО1В або АS15 4. РRАМЕ (2 мкг) у АSО1В або АS15 5. РRАМЕ (0,4 мкг) у АSО1В або АS 15 6. РRАМЕ (0,0 8 мкг) у АSО1В або АS 15 * фактично застосовувано 44,7 мкг замість 50 мкг призначеної дози АSО1В є ліпосомна композиція ад’юванту, що містить QS21 та 3D-МРL; АS 15 є ліпосомна композиція ад’юванту, що містить QS21, 3D-МРL та СрG. Констрактом, застосовуваним у цьому прикладі був Приклад/Констракт 3а (рЕТ26 з Ніsхвостом) у 5 мМ Трис-буфері з рН 8,5 - 0,5 М Аргінін. Білок у боратному буфері з сахарозою можна застосовувати також. Зчитування: • Внутрішньоклітинне проявлення цитокінів (ВПЦ) через 14 діб після 2 ін’єкцій після іn vіtrо рестимулювання клітин селезінки (4 об’єднання по 3 миші на групу) з об’єднанням пептидів РRАМЕ при 1 нг/мл/пептид (15-мер) Реакції СD4 (ад’ювант АSО1В) Результати ВПЦ для СD4-цитокінів для ад’юванту АSО1В є показаними у Фіг. 3. З цього експерименту можна зробити висновок, що найкраща доза антигену РRАМЕ для індукування реакції СD4 у АSО1В у цих умовах є 2 мкг. Реакції СDS (ад’ювант АSО1В) Результати ВПЦ для СD8-цитокінів для ад’юванту АSО1В є показаними у Фіг. 4. Дані показують дуже низькі реакції СD8 та гетерогенність реакцій інтрагрупи. Реакції СD4 (АS15 ад’ювант) Результати ВПЦ для СD4-цитокінів для ад’юванту АS 15 є показаними у Фіг. 5. Ці дані показують, що подібні СD4 реакції були індуковані 44 мкг, 10 мкг, 2 мкг та 0,4 мкг РRАМЕ, сформованого у АS15; зі зменшеними реакціями, індукованими 0,0 8 мкг РRАМЕ Реакції СD8 (АS15 ад’ювант) Результати ВПЦ для СD8-цитокінів для ад’юванту АS15 є показаними у Фіг. 6. Ці дані о показують відсутність СD8 реакції (фон у БФФР груп) Приклад 7 Взагалі, для винаходів, описаних тут, нижченаведене можна застосовувати для опису певних констрактів РD1/3-РRАМЕ, що створено: Констракти, застосовувані для РD1/3-РRАМЕ - Нема сигнальних послідовностей білку D (амінокислоти 2 – 19 білку D) - Є метіонін білку D (АК 1 білку D) - Дві неспоріднених АК (Аsр та Рrо) є заміщеними на амінокислоти 2-Lуs та 3-Lеu білку D - Є перші 109 АК білку D після сигнальної послідовності білку D (109 амінокислот, у тому числі перший Меt у N-закінченні + АК20 – 127 білку D) - Є АК 1 - 509 РRАМЕ (вихідна послідовність РRАМЕ повної довжини) - З hіs-хвостом, що складається щ нижченаведеного, або без нього: - Три неспоріднених АК (Тhr, Sеr та Glу) + 6 Ніs-залишків для клонування у плазміду ТСМР14; або - Дві неспоріднених АК(Lеu та GІu) + 6 Ніs-залишків для клонування у плазміду рЕТ21; або - 6 Ніs-залишків для клонування у плазміду рЕТ26. 16 UA 99722 C2 рDl/3 - РRАМЕ +/- білок з Ніs-хвостом: рDl/3 20 - 127 N термін МDР 20 25 30 35 40 45 50 С закінч. рDl/3 РRАМЕ ТSG 6хНіs (у ТСМР14) С закінч. рDl/3 РRАМЕ LЕ 6хНіs(у рЕТ21) С закінч. N термін МDР 15 РRАМЕ N термін МDР 10 рDl/3 N термін МDР 5 РRАМЕ 1 - 509 рDl/3 РRАМЕ 6хНіs (у рЕТ26) С закінч. Посилена послідовність амінокислот прикладів констрактів заявленого винаходу є показаною у Фіг. 7 Порівняння нижченаведених констрактів є показаними у Фіг.фіг. 8, 9 та 10: Порівняння між LіроD-МАGЕ3-Ніs та Dl/3-РRАМЕ-Ніs (Фіг. 8) Порівняння між спільною послідовністю вихідного білку D від Наеmорhіlus іnfluеnzае та LіроD-МАGЕ3-Ніs (Фіг. 9) Порівняння між спільною послідовністю вихідного білку D від Наеmорhіlus іnfluеnzае, LіроDМАGЕ3-Ніs та рDl/3-РRАМЕ-Ніs (Фіг. 10) Композиція препарату вакцини, застосовуючи конденсовані білки: Конденсовані білки винаходу можна формувати у вакцини, котрі є з ад’ювантом або ні. В одному втіленні як ад’ювант композиція може містити суміш 3 дез-О-ацилованого монофосфорил-ліпіду А (3D-МРL) та QS21 в емульсії олива/вода. Ад’ювантна система SВАS2 раніше описана у WО 95/17210. Ад’ювант для застосування у заявленому винаході може альтернативно містити 3 дез-О-ацилований монофосфорил-ліпід А (3D-МРL), QS21 та СрG у композиції олива у воді або у композиції ліпосом. 3D-МРL: є імуностимулятором, похідним від ліпополісахариду (LРS) грам-негативної бактерії Sаlmоnеllа mіnnеsоtа. МРL є деацилованим та не має фосфатної групи на ліпідній частині А. Ця хімічна обробка дуже зменшує токсичності, зберігаючи імуностимуляторні властивості (Rіbі, 1986). Можна вважати, що 3D-МРL, комбінований з різними носіями, може сильно підсилювати гуморальний та ТН1-клітинний імунітет. QS21: є природною молекулою сапоніну з кори Quіllаjа sароnаrіа Моlіnа. Спосіб очистки, розроблений для певних сапонінів з сирих екстрактів кори, дозволяє виділення конкретного сапоніну, QS21, котрий є тритерпеновим глікозидом, що демонструє сильнішу ад’ювантну активність та нижчу токсичність порівняно з вихідним компонентом. QS21, як показано, активує клас І МНС, обмежений СТL кількома субодиницями Аg, а також стимулювати Аg-специфічну проліферацію лімфоцитів (Кеnsіl, 1992). Вважають, що може бути синергічна дія комбінацій МРL та QS21 в індукуванні гуморальної та ТН1-клітинної імунної реакції. Емульсія олива/вода містить органічну фазу з 2 олив (токоферол та сквален), та водну фазу з БФФР, що містить Тwееn 80 як емульгатор. Емульсія містила 5% сквалену 5% токоферолу 0,4 % Тwееn 80 та мала середній розмір частинок 180 нм і є відомою як SВ62 (дивись WО 95/17210). Утворені крапельки оливи повинні мати розмір приблизно 180 нм. Ад’ювант для застосування у заявленому винаході можна формувати як комбінацію МРL та QS21, в емульсії олива/вода або у композиції ліпосом. Цей препарат слід постачати у склянки 0,7 мл для змішування із ліофізованим антигеном або конденсованим білком (склянки, що містять від 30 до 300 мкг антигену). Імуностимуляторні олігонуклеотиди можна застосовувати також. Приклади олігонуклеотидів для застосування у ад’ювантах або вакцинах заявленого винаходу охоплюють СрG, що містить олігонуклеотиди, загалом містить два або більше динуклеотидих мотифів СрG, відокремлених принаймні трьома, більш часто принаймні шістьма або більше нуклеотидами. Мотиф СрG є нуклеотидом цитозину, з наступним нуклеотидом гуаніну. СрG-олігонуклеотиди є звичайно дезоксинуклеотидами. В одному втіленні інтернуклеотидом в олігонуклеотиді є фосфородитіоат, або краще фосфоротіоатний зв’язок, хоча фосфодіестер та інші інтернуклеотидні зв’язки є у рамках винаходу. Також охопленими у рамках винаходу є олігонуклеотиди зі змішаними інтернуклеотидними зв’язками. Способи створення фосфоротіоатних олігонуклеотидів або фосфородитіоату є описаними у US 5,666,153, US 5,278,302 та WО 95/26204. Приклади олігонуклеотидів нижченаведено: 17 UA 99722 C2 5 10 15 20 25 ТСС АТG АСG ТТС СТG АСG ТТ (СрG 1 826; SЕQ ІD NО: 36) tсt ссс аgс gtg сgс саt (СрG 1758; SЕQ ІD NО: 37) АСС GАТ GАС GТС GСС GGТ GАС GGС АСС АСG ТСG ТСG ТТТ ТGТ СGТ ТТТ GТС GТТ (СрG 2006; SЕQ ІD NО: 38) ТСС АТG АСG ТТС СТG АТG СТ (СрG 1668; SЕQ ІD NО: 39) ТСG АСG ТТТ ТСG GСG СGС GСС G (СрG 5456; SЕQ ІD NО: 40), послідовності можуть містити модифіковані фосфоротіоатом інтернуклеотидні зв’язки. Альтернативні СрG-олігонуклеотиди можуть містити одну або більше вищенаведених послідовностей недоречними делеціями або добавками до цього. Олігонуклеотиди СрG можна синтезувати будь-яким способом, відомим у рівні техніки (наприклад, дивись ЕР 468520). Зручно, такі олігонуклеотиди можна синтезувати, застосовуючи автоматизований синтезатор. В одному втіленні заявленого винаходу комбінація ад’юванту для застосування у винаході охоплює один або більше нижченаведених компонентів: 3D-МРL та QS21 (ЕР 0 671 948 В1); емульсії олива у воді, що містять 3D-МРL та QS21 (WО 95/17210, WО 98/56414); або 3D-МРL, сформовані із іншими носіями (ЕР 0 689 454 В1). Інші системи ад’ювантів, що можна застосовувати у заявленому винаході, містять комбінацію 3D-МРL, QS21 та СрGолігонуклеотид, як описано у US6558670 та US6544518. Кінцеву вакцину можна отримувати після відтворення ліофілізованої композиції. Посилання: 1. А. Rоса (U. оf Wіsсоnsіn), особисте листування. 2. Studіеr, F.W. (1991) /. Моl Віоl. 219, 37-14. а 3. Jаn Н. Кеsslеr еt аl Тhе Jоurnаl оf Ехреrіmеntаl Меdісіnе, Vоlumе 193, Numbеr 1, Jаnuаrу 11,2001 73-88, 4. Ikeda H et al Immunity, Feb; 6(2): 1997, 199-208 ФОРМУЛА ВИНАХОДУ 30 35 40 45 50 55 1. Злитий білок, що містить: (a) PRAME; (b) гетерологічний злитий партнерний білок, похідний від білка D, де злитий партнерний білок містить амінокислоти 20-127 білка D; та (c) додаткові амінокислоти Met-Asp-Pro на N-закінченні послідовності злитої партнерної послідовності, 2. Злитий білок за п. 1, що містить крім того афінну мітку. 3. Злитий білок за п. 2, в якому афінною міткою є гістидинове закінчення. 4. Злитий білок за будь-яким попереднім пунктом, що містить додатково одну чи більше лінкерних послідовностей між злитим партнерним білком та PRAME, або між злитим партнерним білком та афінною міткою, або між PRAME та афінною міткою. 5. Послідовність нуклеїнової кислоти, що кодує злитий білок за будь-яким з пп. 1-4. 6. Вектор, що містить послідовність нуклеїнової кислоти за п. 5. 7. Клітина-хазяїн, трансформована вектором за п. 6. 8. Вакцина, що містить злитий білок за будь-яким з пп. 1-4 або нуклеїнову кислоту за п. 5, або вектор за п. 6. 9. Вакцина за п. 8, що додатково містить ад'ювант та/або імуностимуляторний цитокін або хемокін. 10. Вакцина за п. 9, де ад'ювант містить олігонуклеотид 3D-MPL, QS21 та/або CpG. 11. Вакцина за будь-яким з пп. 8-10 для застосування у медицині. 12. Застосування білка за будь-яким з пп. 1-4, нуклеїнової кислоти за п. 5 або вектора за п. 6, які заявлені тут, для виробництва вакцини для імунотерапевтичного лікування пацієнта, який потерпає від раку. 13. Застосування за п. 12, у котрому рак є вибраним з меланоми, раку молочної залози, сечового міхура, легень, як-то NSCLC, саркоми, раку яєчника, голови та шиї, нирок, колоректальної карциноми, плазмоцитоми, лейкемії, у тому числі гострої лейкемії та карциноми стравоходу. 18 UA 99722 C2 19 UA 99722 C2 20 UA 99722 C2 21 UA 99722 C2 22 UA 99722 C2 23 UA 99722 C2 24 UA 99722 C2 25 UA 99722 C2 Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 26
ДивитисяДодаткова інформація
Назва патенту англійськоюVaccine
Автори англійськоюBlais, Normand, Martin, Denis, Palmantier, Remi, M.
Назва патенту російськоюВакцина
Автори російськоюБлейс Норманд, Мартин Денис, Палмантиер Реми М.
МПК / Мітки
МПК: C07K 14/47, C12N 15/62, A61K 39/102, A61P 35/00, C07K 14/285, C07K 19/00
Мітки: вакцина
Код посилання
<a href="https://ua.patents.su/28-99722-vakcina.html" target="_blank" rel="follow" title="База патентів України">Вакцина</a>
Попередній патент: Контейнер з відкидною кришкою та футляром
Наступний патент: Піноутворювальні композиції і способи їх одержання
Випадковий патент: Солі s-похідних 1,2,4-триазолів, що стимулюють ріст льону