Стент з полімерним покриттям на основі хінолінових і хінаксолінових сполук
Номер патенту: 76935
Опубліковано: 16.10.2006
Автори: Майерс Майкл Р., Хе Вей, Спада Альфред П., Магвайєр Мартін П.
Формула / Реферат
1. Стент, з полімерним покриттям на основі сполуки формули І, у кількості, ефективній для інгібування рестенозу:
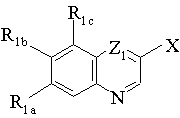 (I)
(I)
де: Х представляє L1H або L2Z2;
L1 представляє (СR3aR3b)r або (СR3aR3b)m-Z3-(СR3’aR3’b)n;
L2 представляє (СR3aR3b)p-Z4-(СR3’aR3’b)q або етеніл;
Z1 представляє СН або N;
Z2 представляє необов’язково заміщений циклоалкіл, необов’язково заміщений циклоалкеніл, необов’язково заміщений гетероцикліл або необов’язково заміщений гетероцикленіл;
Z3 являє собою О, NR4, S, SO або SO2;
Z4 являє собою О, NR4, S, SO, SO2 або зв’язок;
m дорівнює 0 або 1;
n дорівнює 2 або 3, a n+m=2 або 3;
p i q незалежно дорівнюють 0, 1, 2, 3 або 4, a p+q=0, 1, 2, 3 або 4, якщо Z4 являє зв’язок, і p+q=0, 1, 2 або 3, якщо Z4 не є зв’язком;
r дорівнює 2, 3 або 4;
R1a і R1b незалежно представляють необов’язково заміщений C1-C10алкіл, необов’язково заміщений арил, необов’язково заміщений гетероарил, гідрокси, ацилокси, необов’язково заміщений C1-C10алкокси, необов’язково заміщений циклоалкілокси, необов’язково заміщений гетероциклілокси, необов’язково заміщений гетероциклілкарбонілокси, необов’язково заміщений арилокси, необов’язково заміщений гетероарилокси, ціано, R5R6N- або ацил-R5N-, або один з R1a і R1b представляє водень або галоген, а інший представляє необов’язково заміщений C1-C10алкіл, необов’язково заміщений арил, необов’язково заміщений гетероарил, гідрокси, ацилокси, необов’язково заміщений C1-C10алкокси, необов’язково заміщений циклоалкілокси, необов’язково заміщений гетероциклілокси, необов’язково заміщений гетероциклілкарбонілокси, необов’язково заміщений арилокси, необов’язково заміщений гетероарилокси, ціано, R5R6N- або ацил-R5N-,
R1c представляє водень, необов’язково заміщений C1-C10алкіл, необов’язково заміщений арил, необов’язково заміщений гетероарил, гідрокси, ацилокси, необов’язково заміщений C1-C10алкокси, необов’язково заміщений циклоалкілокси, необов’язково заміщений гетероциклілокси, необов’язково заміщений арилокси, необов’язково заміщений гетероарилокси, галоген, ціано, R5R6N- або ацил-R5N-;
R3a, R3b, R3’a i R3’b незалежно представляють водень або C1-C10алкіл;
R4 представляє водень, C1-C10алкіл або ацил; і
R5 і R6 незалежно представляють водень або C1-C10алкіл, або R5 і R6, взяті разом з атомом азоту, з яким вони зв’язані, утворюють азагетероцикліл, де
арил являє собою ароматичний карбоциклічний радикал, що містить від 6 до 10 атомів вуглецю,
гетероарил являє собою 5-10-членну ароматичну моно- або поліциклічну вуглеводневу кільцеву систему, у якій один або декілька атомів відмінні від атома вуглецю й вибрані з азоту, кисню або сірки,
циклоалкіл являє собою неароматичну моно- або поліциклічну кільцеву систему,
що має від 3 до 10 атомів вуглецю,
гетероцикліл являє собою 4-10-членну моно- або поліциклічну вуглеводневу кільцеву систему, у якій один або декілька атомів відмінні від атома вуглецю й вибрані з азоту, кисню або сірки,
циклоалкеніл являє собою неароматичну моноциклічну або мультициклічну кільцеву систему, яка містить вуглець-вуглецевий подвійний зв’язок, що має від 3 до 10 атомів вуглецю,
гетероцикленіл являє собою 4-10-членну моноциклічну або мультициклічну систему, яка є частково ненасиченою, і в якій один або декілька атомів не є атомами вуглецю і вибрані з азоту, кисню або сірки, де C1-C10алкіл, необов’язково заміщений C1-C10алкокси, галогеном, карбокси, гідрокси або R5R6N-,
C1-C10алкокси, необов’язково заміщений одним або декількома замісниками, вибраними з аміно, C1-C10алкокси, карбокси, C1-C10алкоксикарбонілу, карбоксіарилу, карбамоїлу, гетероциклілу,
арил і гетероарил необов’язково заміщені одним або декількома замісниками, вибраними з гідрокси, галогену, C1-C10алкілу, C1-C10алкокси, карбокси, C1-C10алкоксикарбонілу або Y1Y2NCO-, де Y1 і Y2 незалежно являють собою водень або C1-C10алкіл,
циклоалкіл, циклоалкеніл, гетероцикленіл і гетероцикліл, необов’язково заміщені одним або декількома замісниками, вибраними з C1-C10алкілу, гідрокси, ацилокси, C1-C10алкокси, галогену, R5R6N-, ацил-R5N-, карбокси або R5R6NCO-, або двовалентним киснем (-О-) у двох суміжних атомів вуглецю з утворенням епоксиду,
або
її N-оксиду, гідрату, сольвату, її проліків або її фармацевтично прийнятної солі.
2. Стент за п. 1, на основі сполуки формули І, де
L2 являє собою (СR3aR3b)р-Z4-(СR3’aR3’b)q;
Z2 являє собою необов’язково заміщений циклогексил, необов’язково заміщений норборніл або необов’язково заміщений гетероцикленіл;
р дорівнює 0;
q дорівнює 0 або 1;
R1a і R1b незалежно являють собою необов’язково заміщений C1-C10алкіл, необов’язково заміщений C1-C10алкокси, необов’язково заміщений циклоалкілокси, або необов’язково заміщений гетероциклілокси, або один з R1a і R1b являє собою водень або галоген;
R1c являє собою водень;
R3’a i R3’b незалежно являють собою водень;
R4 являє собою водень; або
її N-оксиду, гідрату, сольвату, проліків або її фармацевтично прийнятної солі.
3. Стент за п. 1, де
Z2 являє собою метилциклопентил, метилциклогексил, [2.2.1]біциклогептаніл, [2.2.2]біциклооктаніл, циклопентеніл, циклогексеніл, [2.2.1]біциклогептеніл, [2.2.2]біциклооктеніл.
4. Стент за п. 1, де Z4 являє собою О.
5. Стент за п. 1, де Z4 являє собою NR4.
6. Стент за п. 1, де Z4 являє собою S.
7. Стент за п. 1, де сполука за формулою І являє собою
2-циклогексиламіно-6,7-диметоксихіноксалін;
екзобіцикло[2.2.1]гепт-2-ил-(6-хлор-7-метоксихіноксалін-2-іл)амін;
екзобіцикло[2.2.1]гепт-2-ил-(7-хлор-6-метоксихіноксалін-2-іл)амін;
біцикло[2.2.1]гепт-2-ил-(6,7-диметилхіноксалін-2-іл)амін;
3-аміно-циклогексил-6,7-диметоксихінолін;
(6,7-диметоксихінолін-3-іл)-цис-(3-(R)-метилциклогексил)амін;
(6,7-диметоксихінолін-3-іл)-цис/транс-(3-(R)-метилциклогексил)амін;
(6,7-диметоксихінолін-3-іл)-транс-(3-(R)-метилциклогексил)амін;
(6,7-диметоксихінолін-3-іл)-цис-(3-(R)-метилциклогексил)амін;
(±)-біцикло[2.2.1]гепт-2-ил-(6,7-диметоксихіноксалін-2-іл)амін;
екзобіцикло[2.2.1]гепт-5-ен-2-іл-(6,7-диметоксихіноксалін-2-іл)амін;
ендобіцикло[2.2.1]гепт-2-ил-(6,7-диметоксихіноксалін-2-іл)амін;
екзобіцикло[2.2.1]гепт-2-ил-(6-метоксихіноксалін-2-іл)амін;
екзо-2-(біцикло[2.2.1]гепт-2-илокси)-6,7-диметоксихіноксалін;
2-(біцикло[2.2.2]окт-2-илокси)-6,7-диметоксихіноксалін;
ендо-2-(біцикло[2.2.1]гепт-2-илокси)-6,7-диметоксихіноксалін;
екзо-2-(біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7-диметоксихіноксалін;
2-(біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7-диметоксихіноксалін;
2-циклогексилокси-6,7-диметоксихіноксалін;
екзо, екзо-6,7-диметокси-2-(5,6-епоксибіцикло[2.2.1]- гептан-2-ілокси)хіноксалін;
6,7-диметокси-2-(4-метоксициклогексилокси)хіноксалін;
(1R, 2R, 4S)-(+)-біцикло[2.2.1]гепт-2-ил-(6,7-диметоксихіноксалін-2-іл)амін;
(1S, 2S, 4R)-(-)-біцикло[2.2.1]гепт-2-ил-(6,7-диметоксихіноксалін-2-іл)амін;
цис/транс-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанкарбонової кислоти метиловий ефір;
цис-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанкарбонової кислоти метиловий ефір;
транс-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанкарбонової кислоти метиловий ефір;
(6,7-диметоксихіноксалін-2-іл)-цис/транс-(3-(R)-метилциклогексил)амін;
(6,7-диметоксихіноксалін-2-іл)-транс-(3-(R)-метилциклогексил)амін;
(6,7-диметоксихіноксалін-2-іл)-цис-(3-(R)-метилциклогексил)амін; метил-цис/транс-4-(6,7-диметоксихіноксалін-2-ілокси)циклогексанкарбоксилат, або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль.
8. Стент за п. 1, де полімерне покриття містить один або більше полімерів, вибраних із групи, що складається з полікапролактону, співполімеру полі(етиленвінілацетат), полі(вінілацетату) і силіконової ненаповненої гумової суміші.
9. Стент за п. 1, де полімерне покриття містить один або більше полімерів, вибраних із групи, що складається з латексів, уретанів, полісилоксанів і блокспівполімерів стиролу-етилену/бутилену-стиролу.
10. Стент за п. 1, де полімерне покриття містить один або більше полімерів, вибраних із групи, що складаєься з полі-DL-молочної кислоти, полі-L-молочної кислоти, складних поліортоефірів, поліімінокарбонатів, аліфатичних полікарбонатів і поліфосфазенів.
11. Стент за п. 1, де полімерне покриття додатково містить пороутворювач.
12. Стент за п. 11, де пороутворювач вибраний із групи, що складається з мікрогранул хлориду натрію, лактози або натрійвмісного гепарину.
13. Стент за п. 11, де пороутворювач вибраний із групи, що складається з поліетиленгліколю і співполімерів поліетиленоксиду/поліпропіленоксиду.
14. Стент за п. 1, де на полімерне покриття нанесена мембрана, що контролює швидкість вивільнення, для обмеження швидкості вивільнення сполуки формули І з полімерного покриття.
15. Стент за п. 14, де мембрана, що контролює швидкість вивільнення, містить пороутворювач, вибраний із групи, що складається з хлориду натрію, лактози, натрійвмісного гепарину, поліетиленгліколю, співполімерів поліетиленоксиду/поліпропіленоксиду і їхніх сумішей.
16. Стент за п. 1, де сполука формули І включена в полімерне покриття нанесенням сполуки формули І, принаймні, на одну поверхню стенту з утворенням біологічно активного шару з наступним нанесенням одного або декількох покриттів пористого полімерного матеріалу поверх біологічно активного шару.
17. Стент за п. 16, де пористий полімерний матеріал містить поліамід, парилен або похідне парилену.
18. Стент за п. 16, де пористий полімерний матеріал наносять осадженням плазми.
19. Стент за п. 18, де пористий полімерний матеріал вибирають із групи, що складається з полі(етиленоксиду), полі(етиленгліколю), полі(пропіленоксиду), і полімерів метану, силікону і тетрафторетилентетраметилдисилоксану.
20. Стент за п. 1, де полімерне покриття одержане додаванням поліетиленненасиченого складного ефіру акрилової або метакрилової кислоти, який фотополімеризується, що містить дві або більше акрилатних і метакрилатних груп на молекулу або їхні суміші.
21. Стент за п. 20, де мономер вибирають із групи, що складається з діакрилату етиленгліколю, диметакрилату етиленгліколю, триакрилату триметилпропану, триметакрилату триметилпропану, тетраакрилату пентаеритриту, тетраметакрилату пентаеритриту, диметакрилату 1,6-гександіолу і диметакрилату діетиленгліколю.
22. Стент за п. 20, де мономер вибирають із групи, що складається з н-бутилакрилату, н-бутилметакрилату, 2-етилгексилакрилату, лаурилакрилату і 2-гідроксипропілакрилату.
23. Стент за п. 1, де полімерне покриття містить полімер, вибраний із групи, що складається з полі(L-молочної кислоти), полікапролактону, співполімеру полі(лактидгліколід), полі(гідроксибутирату), співполімеру полі(гідроксибутиратвалерат), полідіоксанону, поліортоефіру, поліангідриду, полі(гліколевої кислоти), полі(D,L-молочної кислоти), співполімеру полі(гліколева кислота-триметиленкарбонат), поліфосфоефіру, поліфосфоефіруретану, полі(амінокислот), ціаноакрилатів, полі(триметиленкарбонату), полі(імінокарбонату), полі(простий ефір-складні ефіри), поліалкіленоксалатів, поліфосфазенів, фібрину, фібриногену, целюлози, крохмалю, колагену і гіалуронової кислоти.
24. Стент за п. 1, де полімерне покриття містить полімер, вибраний із групи, що складається з поліуретанів, силіконів, поліефірів, поліолефінів, поліізобутилену і співполімеру етилен-альфаолефін, полімерів і співполімерів акрилової кислоти, полімерів і співполімерів вінілгалогеніду, таких як полівінілхлорид, полівінілових простих ефірів, таких як полівініловий етиловий ефір, полівініліденгалогенідів, таких як полівініліденфторид і полівініліденхлорид, поліакрилонітрилу, полівінілкетонів, полівінілових ароматичних сполук, таких як полістирол, полівінілових складних ефірів, таких як полівінілацетат, співполімерів вінілових мономерів один з одним і олефінами, таких як співполімери етилену-метилметакрилату, співполімери акрилонітрилу-стиролу, смоли ABS і співполімери етилену-вінілацетату, поліамідів, таких як Nylon 66 і полікапролактам, алкілових смол, полікарбонатів, поліоксиметиленів, поліімідів, поліефірів, епоксидних смол, поліуретанів, штучного волокна, триацетатного штучного волокна, целюлози, ацетату целюлози, бутирату целюлози, ацетатбутирату целюлози, целофану, нітрату целюлози, пропіонату целюлози, простих ефірів целюлози і карбоксиметилцелюлози.
25. Застосування стенту за п. 1 для лікування рестенозу у пацієнта, у заздалегідь визначеному місці.
26. Застосування за п. 25, де зазначеним заздалегідь визначеним місцем є місце механічного ушкодження артеріальної стінки, викликаного лікуванням атеросклеротичного ушкодження ангіопластикою.
27. Застосування сполуки формули І за п. 1 для виробництва стенту для інгібування рестенозу, де сполука формули І включена в полімерне покриття, нанесене на зазначений стент.
28. Застосування за п. 27, де рестеноз знаходиться в місці механічного ушкодження артеріальної стінки, викликаного лікуванням атеросклеротичного ушкодження ангіопластикою.
Текст
1. Стент, з полімерним покриттям на основі сполуки формули І, у кількості, ефективній для інгібування рестенозу: C2 2 (19) 1 3 необов’язково заміщений циклоалкілокси, необов’язково заміщений гетероциклілокси, необов’язково заміщений гетероциклілкарбонілокси, необов’язково заміщений арилокси, необов’язково заміщений гетероарилокси, ціано, R5R6N- або ацил-R5N-, R1c представляє водень, необов’язково заміщений C1-C10алкіл, необов’язково заміщений арил, необов’язково заміщений гетероарил, гідрокси, ацилокси, необов’язково заміщений C1-C10алкокси, необов’язково заміщений циклоалкілокси, необов’язково заміщений гетероциклілокси, необов’язково заміщений арилокси, необов’язково заміщений гетероарилокси, галоген, ціано, R5R6Nабо ацил-R5N-; R3a, R3b, R3’a i R3’b незалежно представляють водень або C1-C10алкіл; R4 представляє водень, C1-C10алкіл або ацил; і R5 і R6 незалежно представляють водень або C1C10алкіл, або R5 і R6, взяті разом з атомом азоту, з яким вони зв’язані, утворюють азагетероцикліл, де арил являє собою ароматичний карбоциклічний радикал, що містить від 6 до 10 атомів вуглецю, гетероарил являє собою 5-10-членну ароматичну моно- або поліциклічну вуглеводневу кільцеву систему, у якій один або декілька атомів відмінні від атома вуглецю й вибрані з азоту, кисню або сірки, циклоалкіл являє собою неароматичну моно- або поліциклічну кільцеву систему, що має від 3 до 10 атомів вуглецю, гетероцикліл являє собою 4-10-членну моно- або поліциклічну вуглеводневу кільцеву систему, у якій один або декілька атомів відмінні від атома вуглецю й вибрані з азоту, кисню або сірки, циклоалкеніл являє собою неароматичну моноциклічну або мультициклічну кільцеву систему, яка містить вуглець-вуглецевий подвійний зв’язок, що має від 3 до 10 атомів вуглецю, гетероцикленіл являє собою 4-10-членну моноциклічну або мультициклічну систему, яка є частково ненасиченою, і в якій один або декілька атомів не є атомами вуглецю і вибрані з азоту, кисню або сірки, де C1-C10алкіл, необов’язково заміщений C1C10алкокси, галогеном, карбокси, гідрокси або R5R6N-, C1-C10алкокси, необов’язково заміщений одним або декількома замісниками, вибраними з аміно, C1-C10алкокси, карбокси, C1-C10алкоксикарбонілу, карбоксіарилу, карбамоїлу, гетероциклілу, арил і гетероарил необов’язково заміщені одним або декількома замісниками, вибраними з гідрокси, галогену, C1-C10алкілу, C1-C10алкокси, карбокси, C1C10алкоксикарбонілу або Y1Y2NCO-, де Y1 і Y2 незалежно являють собою водень або C1-C10алкіл, циклоалкіл, циклоалкеніл, гетероцикленіл і гетероцикліл, необов’язково заміщені одним або декількома замісниками, вибраними з C1-C10алкілу, гідрокси, ацилокси, C1-C10алкокси, галогену, R5R6N-, ацил-R5N-, карбокси або R5R6NCO-, або двовалентним киснем (-О-) у двох суміжних атомів вуглецю з утворенням епоксиду, або її N-оксиду, гідрату, сольвату, її проліків або її фармацевтично прийнятної солі. 2. Стент за п.1, на основі сполуки формули І, де 76935 4 L2 являє собою (СR3aR3b)р-Z4-(СR3’aR3’b)q; Z2 являє собою необов’язково заміщений циклогексил, необов’язково заміщений норборніл або необов’язково заміщений гетероцикленіл; р дорівнює 0; q дорівнює 0 або 1; R1a і R1b незалежно являють собою необов’язково заміщений C1-C10алкіл, необов’язково заміщений C1-C10алкокси, необов’язково заміщений циклоалкілокси, або необов’язково заміщений гетероциклілокси, або один з R1a і R1b являє собою водень або галоген; R1c являє собою водень; R3’a i R3’b незалежно являють собою водень; R4 являє собою водень; або її N-оксиду, гідрату, сольвату, проліків або її фармацевтично прийнятної солі. 3. Стент за п.1, де Z2 являє собою метилциклопентил, метилциклогексил, [2.2.1]біциклогептаніл, [2.2.2]біциклооктаніл, циклопентеніл, циклогексеніл, [2.2.1]біциклогептеніл, [2.2.2]біциклооктеніл. 4. Стент за п.1, де Z4 являє собою О. 5. Стент за п.1, де Z4 являє собою NR4. 6. Стент за п.1, де Z4 являє собою S. 7. Стент за п.1, де сполука за формулою І являє собою 2-циклогексиламіно-6,7-диметоксихіноксалін; екзобіцикло[2.2.1]гепт-2-ил-(6-хлор-7метоксихіноксалін-2-іл)амін; екзобіцикло[2.2.1]гепт-2-ил-(7-хлор-6метоксихіноксалін-2-іл)амін; біцикло[2.2.1]гепт-2-ил-(6,7-диметилхіноксалін-2іл)амін; 3-аміно-циклогексил-6,7-диметоксихінолін; (6,7-диметоксихінолін-3-іл)-цис-(3-(R)метилциклогексил)амін; (6,7-диметоксихінолін-3-іл)-цис/транс-(3-(R)метилциклогексил)амін; (6,7-диметоксихінолін-3-іл)-транс-(3-(R)метилциклогексил)амін; (6,7-диметоксихінолін-3-іл)-цис-(3-(R)метилциклогексил)амін; (±)-біцикло[2.2.1]гепт-2-ил-(6,7диметоксихіноксалін-2-іл)амін; екзобіцикло[2.2.1]гепт-5-ен-2-іл-(6,7диметоксихіноксалін-2-іл)амін; ендобіцикло[2.2.1]гепт-2-ил-(6,7диметоксихіноксалін-2-іл)амін; екзобіцикло[2.2.1]гепт-2-ил-(6-метоксихіноксалін-2іл)амін; екзо-2-(біцикло[2.2.1]гепт-2-илокси)-6,7диметоксихіноксалін; 2-(біцикло[2.2.2]окт-2-илокси)-6,7диметоксихіноксалін; ендо-2-(біцикло[2.2.1]гепт-2-илокси)-6,7диметоксихіноксалін; екзо-2-(біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7диметоксихіноксалін; 2-(біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7диметоксихіноксалін; 2-циклогексилокси-6,7-диметоксихіноксалін; екзо, екзо-6,7-диметокси-2-(5,6епоксибіцикло[2.2.1]- гептан-2-ілокси)хіноксалін; 5 6,7-диметокси-2-(4метоксициклогексилокси)хіноксалін; (1R, 2R, 4S)-(+)-біцикло[2.2.1]гепт-2-ил-(6,7диметоксихіноксалін-2-іл)амін; (1S, 2S, 4R)-(-)-біцикло[2.2.1]гепт-2-ил-(6,7диметоксихіноксалін-2-іл)амін; цис/транс-4-(6,7-диметоксихіноксалін-2іламіно)циклогексанкарбонової кислоти метиловий ефір; цис-4-(6,7-диметоксихіноксалін-2іламіно)циклогексанкарбонової кислоти метиловий ефір; транс-4-(6,7-диметоксихіноксалін-2іламіно)циклогексанкарбонової кислоти метиловий ефір; (6,7-диметоксихіноксалін-2-іл)-цис/транс-(3-(R)метилциклогексил)амін; (6,7-диметоксихіноксалін-2-іл)-транс-(3-(R)метилциклогексил)амін; (6,7-диметоксихіноксалін-2-іл)-цис-(3-(R)метилциклогексил)амін; метил-цис/транс-4-(6,7диметоксихіноксалін-2ілокси)циклогексанкарбоксилат, або її N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль. 8. Стент за п.1, де полімерне покриття містить один або більше полімерів, вибраних із групи, що складається з полікапролактону, співполімеру полі(етиленвінілацетат), полі(вінілацетату) і силіконової ненаповненої гумової суміші. 9. Стент за п.1, де полімерне покриття містить один або більше полімерів, вибраних із групи, що складається з латексів, уретанів, полісилоксанів і блокспівполімерів стиролу-етилену/бутиленустиролу. 10. Стент за п.1, де полімерне покриття містить один або більше полімерів, вибраних із групи, що складаєься з полі-DL-молочної кислоти, полі-Lмолочної кислоти, складних поліортоефірів, поліімінокарбонатів, аліфатичних полікарбонатів і поліфосфазенів. 11. Стент за п.1, де полімерне покриття додатково містить пороутворювач. 12. Стент за п.11, де пороутворювач вибраний із групи, що складається з мікрогранул хлориду натрію, лактози або натрійвмісного гепарину. 13. Стент за п.11, де пороутворювач вибраний із групи, що складається з поліетиленгліколю і співполімерів поліетиленоксиду/поліпропіленоксиду. 14. Стент за п.1, де на полімерне покриття нанесена мембрана, що контролює швидкість вивільнення, для обмеження швидкості вивільнення сполуки формули І з полімерного покриття. 15. Стент за п.14, де мембрана, що контролює швидкість вивільнення, містить пороутворювач, вибраний із групи, що складається з хлориду натрію, лактози, натрійвмісного гепарину, поліетиленгліколю, співполімерів поліетиленоксиду/поліпропіленоксиду і їхніх сумішей. 16. Стент за п.1, де сполука формули І включена в полімерне покриття нанесенням сполуки формули І, принаймні, на одну поверхню стенту з утворенням біологічно активного шару з наступним нанесенням одного або декількох покриттів пористого 76935 6 полімерного матеріалу поверх біологічно активного шару. 17. Стент за п.16, де пористий полімерний матеріал містить поліамід, парилен або похідне парилену. 18. Стент за п.16, де пористий полімерний матеріал наносять осадженням плазми. 19. Стент за п.18, де пористий полімерний матеріал вибирають із групи, що складається з полі(етиленоксиду), полі(етиленгліколю), полі(пропіленоксиду), і полімерів метану, силікону і тетрафторетилентетраметилдисилоксану. 20. Стент за п.1, де полімерне покриття одержане додаванням поліетиленненасиченого складного ефіру акрилової або метакрилової кислоти, який фотополімеризується, що містить дві або більше акрилатних і метакрилатних груп на молекулу або їхні суміші. 21. Стент за п.20, де мономер вибирають із групи, що складається з діакрилату етиленгліколю, диметакрилату етиленгліколю, триакрилату триметилпропану, триметакрилату триметилпропану, тетраакрилату пентаеритриту, тетраметакрилату пентаеритриту, диметакрилату 1,6-гександіолу і диметакрилату діетиленгліколю. 22. Стент за п.20, де мономер вибирають із групи, що складається з н-бутилакрилату, нбутилметакрилату, 2-етилгексилакрилату, лаурилакрилату і 2-гідроксипропілакрилату. 23. Стент за п.1, де полімерне покриття містить полімер, вибраний із групи, що складається з полі(L-молочної кислоти), полікапролактону, співполімеру полі(лактидгліколід), полі(гідроксибутирату), співполімеру полі(гідроксибутиратвалерат), полідіоксанону, поліортоефіру, поліангідриду, полі(гліколевої кислоти), полі(D,L-молочної кислоти), співполімеру полі(гліколева кислота-триметиленкарбонат), поліфосфоефіру, поліфосфоефіруретану, полі(амінокислот), ціаноакрилатів, полі(триметиленкарбонату), полі(імінокарбонату), полі(простий ефір-складні ефіри), поліалкіленоксалатів, поліфосфазенів, фібрину, фібриногену, целюлози, крохмалю, колагену і гіалуронової кислоти. 24. Стент за п.1, де полімерне покриття містить полімер, вибраний із групи, що складається з поліуретанів, силіконів, поліефірів, поліолефінів, поліізобутилену і співполімеру етилен-альфаолефін, полімерів і співполімерів акрилової кислоти, полімерів і співполімерів вінілгалогеніду, таких як полівінілхлорид, полівінілових простих ефірів, таких як полівініловий етиловий ефір, полівініліденгалогенідів, таких як полівініліденфторид і полівініліденхлорид, поліакрилонітрилу, полівінілкетонів, полівінілових ароматичних сполук, таких як полістирол, полівінілових складних ефірів, таких як полівінілацетат, співполімерів вінілових мономерів один з одним і олефінами, таких як співполімери етилену-метилметакрилату, співполімери акрилонітрилу-стиролу, смоли ABS і співполімери етилену-вінілацетату, поліамідів, таких як Nylon 66 і полікапролактам, алкілових смол, полікарбонатів, поліоксиметиленів, поліімідів, поліефірів, епоксидних смол, поліуретанів, штучного волокна, триаце 7 76935 8 татного штучного волокна, целюлози, ацетату целюлози, бутирату целюлози, ацетатбутирату целюлози, целофану, нітрату целюлози, пропіонату целюлози, простих ефірів целюлози і карбоксиметилцелюлози. 25. Застосування стенту за п.1 для лікування рестенозу у пацієнта, у заздалегідь визначеному місці. 26. Застосування за п.25, де зазначеним заздалегідь визначеним місцем є місце механічного ушкодження артеріальної стінки, викликаного лікуван ням атеросклеротичного ушкодження ангіопластикою. 27. Застосування сполуки формули І за п.1 для виробництва стенту для інгібування рестенозу, де сполука формули І включена в полімерне покриття, нанесене на зазначений стент. 28. Застосування за п.27, де рестеноз знаходиться в місці механічного ушкодження артеріальної стінки, викликаного лікуванням атеросклеротичного ушкодження ангіопластикою. Дана заявка є частковим продовженням заявки [на патент США №09/198718, поданої 24 листопада 1998], яка, в свою чергу, є частковим продовженням [Міжнародної патентної заявки РСТ/США 98/11036, поданої 28 травня 1998], яка, в свою чергу, є частковим продовженням [заявки на патент США 08/972614, поданої 18 листопада 1997], яка, в свою чергу, є частковим продовженням [заявки на патент США 08/864455, поданої 18 травня 1997] і в цей час відкликаної. 1. Область, до якої відноситься винахід Даний винахід направлений на інгібування проліферації клітин, і/або продукування клітинного матрикса, і/або міграції клітин (хемотаксису), і/або активації і проліферації Т-клітин з використанням хінолінових/хіноксалінових сполук, які можуть бути використані як інгібітори протеїн-тирозинкінази (ТКІ). Передача клітинного сигналу опосередковується системою взаємодій, яка включає контактування клітин одна з одною, контактування клітин з матриксом або позаклітинне контактування рецептора з субстратом. Позаклітинний сигнал часто передається іншим частинам клітини завдяки опосередковуаному тирозинкіназою події фосфорилювання, яка впливає на білки субстрату, розташовані нижче від передаючого сигнал комплексу, асоційованого з клітинною мембраною. Прикладами тирозинкіназних ферментів, що беруть участь в процесі передачі клітинного сигналу, є специфічна серія рецепторів-ферментів, таких як інсуліновий рецептор, рецептор епідермального фактора росту (EGF-R) або рецептор тромбоцитарного фактора росту (PDGF-R). Для ефективного опосередкованого ферментом фосфорилювання субстратних білків, що містять тирозиновв залишки, необхідне автофосфорилювання ферменту. Відомо, що вказані субстрати відповідальні за різні клітинні події, включаючи, серед інших, клітинну проліферацію, продукування клітинного матрикса, міграцію клітин і апоптоз. При цьому, потрібно зазначити, що велике число патологічних станів викликається репродукуванням клітин, що не контролюється або понад продукуванням клітинного матрикса, або поганою регуляцією запрограмованої загибелі клітин (аиоптоза). Такі патологічні стани асоціюються з різними типами клітин, і прикладами таких станів є лейкоз, рак, гліобластома, псоріаз, запальні розлади, хво роби кісток, фіброзні хвороби, атеросклероз і рестеноз, виникаючий після ангіопластики коронарних, стегнових або ниркових артерій, або фібропроліферативні захворювання, таких як артрит, фіброз легенів, нирок і печінки. Крім того, порушення регуляції клітинних проліферативних станів відбувається внаслідок хірургічної операції по коронарному шунтуванню. Очевидно, що інгібування тирозинкіназної активності є ефективним способом для регуляції репродукування клітин, що не контролюється, або понад продукування клітинного матрикса, або поганої регуляції запрограмованої загибелі клітин (апоптоза). Відомо також, що деякі інгібітори тирозинкінази можуть взаємодіяти з більш, ніж одним типом тирозинкіназних ферментів. Деякі тирозинкіназні ферменти мають важливе значення для нормального функціонування організму. Так, наприклад, інгібування дії інсуліну було б небажаним в абсолютно нормальних умовах. Тому, сполуки, які інгібують тирозинкіназну активність PDGF-R при концентраціях, менших, ніж концентрації, ефективні для інгібування кіназної активності рецептора інсуліну, є цінними агентами для ефективного лікування захворювань, що характеризуються клітинною проліферацією і/або продукуванням клітинного матрикса, і/або міграцією клітин (хемотаксисом), таких як рестеноз. Даний винахід відноситься до модуляції і/або інгібування передачі клітинного сигналу, проліферації клітин, продукуванню позаклітинного матрикса, хемотаксису; і до регуляції аномального росту клітин і клітинної запальної відповіді. Більш конкретно, даний винахід відноситься до використання заміщених хіноксалінових сполук, які селективно інгібують диференціювання, проліферацію або вивільнення медіатора шляхом ефективного інгібування тирозинкіназної активності рецептора тромбоцитарного фактора росту (PDGF-R) і/або тирозинкіназної активності Lck. 2. Відомі розробки У ряді літературних джерел описані інгібітори тирозинкінази, які є селективними для тирозинкіназних рецепторів-ферментів, таких як EGF-R і PDGF-R і не-рецепторних цитозольних тирозинкіназних ферментів, таких як v-abi, p561ck або c-src. Нещодавно в літературі, [Spada & Myers, Exp.Opin. Ther. Patents. 1995, 5(8), 805 і Bridges, Exp. Opin. Ther. Patents 1995, 5(12), 1245] були стисло описа 9 ні інгібітори тирозинкінази і селективні інгібітори EGF-R, відповідно. Крім того, в роботах Law і Lydon приводиться короткий опис протиракової дії інгібіторів тирозинкінази [Emerging Drags: The Prospect For Improved Medicines 1996, 241-260]. Відомими інгібіторами тирозинкіназної активності PDGF-R є інгібітори на основі хіноліну, про які повідомлялося в роботі [Maguire et al., J.Med.Chem. 1994, 37, 2129 і Dolle et al., J.Med.Chem. 1994, 37, 2627]. Клас інгібіторів на основі феніламіно-піримідину був нещодавно описаний в роботі [Traxler et al. в ЕР 564409 і Zimmerman J.; і Traxler P. et al., Biorg.& Med.Chem. Lett. 1996, 6(11), 1221-1226 і Buchdunger Ε. et al., Proc. Natl. Acad. Sci. 1995, 92, 2528]. Незважаючи на досягнутий прогрес в цій області, ще не існує агентів вказаних класів сполук, які були б дозволені для їх використання з метою лікування проліферативного захворювання у людини. Кореляція між багатофакторним захворюванням рестеноза, що викликається PDGF і PDGF-R, добре документована в науковій літературі. Однак, нещодавно досягнуті успіхи у вивченні фіброзних захворювань легенів [Antoniades H.N. et al., J.Clin.Invest. 1990, 86, 1055], нирок і печінки [Peterson, T.C. Hepatology, 4 1993, 17, 486] також дозволяє зробити висновок про те, що PDGF і PDGF-R грають певну роль в даному процесі. Так, наприклад, гломерулонефрит є основною причиною ниркової недостатності, a PDGF був ідентифікований як сильний мiтоген для мезангіальних клітин in vitro, як було продемонстровано [Shultz і ін. Am. J. Physiol. 1988, 255, F674 і Floege et al. Clin. Exp. Immun. 1991, 86, 334]. У роботі [Thornton S.C. et al. Clin. Exp. Immun. 1991, 86, 79] повідомлялося, що TNF-альфа і PDGF (отримані від пацієнтів з ревматоїдним артритом) є головними цитокінами, що беруть участь в проліферації синовіальних клітин. Крім того, були ідентифіковані специфічні типи пухлинних клітин [див. Silver, B.J., BioFactors, 1992, 3, 217], таких як клітини гліобластоми і саркоми Капоши, які сприяють над експресії або білка, або рецептора PDGF, що приводить до росту ракових клітин, що не контролюється по аутокринному або паракринному механізму. Отже, очікується, що інгібітор тирозинкінази PDGF може бути використаний для лікування ряду, на перший погляд, не пов'язаних один з одним патологічних станів людини, які, по своїй етіології, можуть характеризуватися участю PDGF і/або PDGF-R. Роль різних не-рецепторних тирозинкіназ, таких як р561ск (які далі називаються "Lck"), в станах, асоційованих із запаленнями, яка полягає в активації і проліферації Т-клітин, [описана Hanke і ін. Inflamm. Res. 1995, 44, 357 і Bolen & Brugge Ann.Rev.Immunol., 1997, 15, 371]. Цими запальними станами є алергія, аутоімунні захворювання, ревматоїдний артрит і відторгнення трансплантата. В іншому нещодавно опублікованому огляді стисло описані різні класи інгібіторів тирозинкінази, включаючи сполуки, що володіють Lck-інгібуючою активністю [Groundwater et al.. Progress in Medicinal Chemistry, 1996, 33, 233]. До інгібіторів Lckтирозинкіназної активності відносяться деякі при 76935 10 родні сполуки, які, в основному, є неселективними інгібіторами тирозинкінази, такі як стауроспорин, геністеїн, деякі флавони і ербстатин. Нещодавно повідомлялося, що дамнакантол є інгібітором Lck при низьких нМ-концентраціях [Faltynek et al., Biochemistry, 1995, 34, 12404]. Прикладами синтетичних інгібіторів Lck є ряд дигідроксиізохінолінових інгібіторів, які, як повідомлялося, мають низьку активність при концентраціях в мікромолярному-субмікромолярному діапазоні [Burke et al., J.Med.Chem., 1993, 36, 425]; і хінолінове похідне, яке, як виявлено, володіє набагато меншою активністю, тобто, його інгібуюча концентрація для Lck складає ІС50=610мкМ. Дослідниками був також описаний ряд 4-заміщених хіназолінів, які інгібують Lck при низьких мікромолярних-субмікромолярних концентраціях [Myers et al., WO 95/15758 і Myers et al., Bioorg Med. Chem. Lett. 1997, 7, 417]. Дослідниками в Пфітце [Hanke et al., J.Biol. Chem., 1996, 271, 695] були описані два специфічних піразолопіримідинових інгібітора, відомих як РР1 і РР2, які володіють низькою наномолярною активністю проти Lck і Fyn (іншої кінази сімейства Src). Що стосується хінолінових або хіноксалінових сполук, то про їх Lck-інгібуючу активність нічого не повідомлялося. Отже, очікується, що хіноліновий або хіноксаліновий інгібітор тирозинкіназної активності Lck може бути використаний для лікування ряду, на перший погляд, не пов'язаних один з одним патологічних станів людини, які, по своїй етіології, можуть характеризуватися передачею сигналу тирозинкінази Lck. Даний винахід відноситься до сполуки формули І: (І) де: X представляє L1H або L2Z2; L1 представляє (CR3aR3b)r або (CR3aR3b)m-Z3(CR3'aR3'b)n; L2 представляє (CR3aR3b)p-Z4-(CR3'aR3'b)q або етеніл; Z1 представляє СН або Ν; Ζ2 представляє необов'язково замещений циклоалкіл, необов'язково заміщений циклоалкеніл, необов'язково заміщений гетероцикліл або необов'язково заміщений гетероцикленіл; Ζ3 представляє О, NR4, S, SO або SO2; Z4 представляє О, NR4, S, SO, SO2 або зв'язок; m дорівнює 0 або 1; n дорівнює 2 або 3, a n+m=2 або 3; p і q незалежно дорівнюють 0, 1, 2, 3 або 4, а р+q=0, 1, 2, 3 або 4, якщо Z4 представляє зв'язок, і p+q=0, 1, 2 або 3, якщо Z4 не є зв'язком; r дорівнює 2, 3 або 4; R1a i R1b незалежно представляють необов'язково заміщений алкіл, необов'язково заміщений арил, необов'язково заміщений гетероарил, гідрокси, ацилокси, необов'язково заміщений алкоксі, необов'язково заміщений циклоалкілокси, необов'язково заміщений гетероциклілокси, необов'язково заміщений гетероциклілкарбонілокси, необо 11 в'язково заміщений арилокси, необов'язково заміщений гетероарилокси, ціано, R5R6N- або ацил R5N-, або один з R1a і R1b представляє водень або галоген, а інший представляє необов'язково заміщений алкіл, необов'язково заміщений арил, необов'язково заміщений гетероарил, гідрокси, ацилокси, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений гетероциклілокси, необов'язково заміщений гетероциклілкарбонілокси, необов'язково заміщений арилокси, необов'язково заміщений гетероарилокси, ціано, R5R6N- або ацил R5N-, R1c представляє водень, необов'язково заміщений алкіл, необов'язково заміщений арил, необов'язково заміщений гетероарил, гідрокси, ацилокси, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений гетероциклілокси, необов'язково заміщений арилокси, необов'язково заміщений гетероарилокси, галоген, ціано, R5R6N- або ацил R5N-, R3a, R3b, R3'a і R3'b незалежно представляють водень або алкіл; R4 представляє водень, алкіл або ацил; і R5 і R6 незалежно представляють водень або алкіл, або R5 і R6, взяті разом з атомом азоту, з яким вони пов'язані, утворять азагетероцикліл, або його N-оксид, його гідрат, його сольват, його проліки або його фармацевтично прийнятну сіль. В іншому своєму аспекті, даний винахід відноситься до фармацевтичної композиції, що містить ефективну кількість сполуки формули І або її фармацевтично прийнятної солі і фармацевтично прийнятний носій. Даний винахід також відноситься до проміжних сполук, що використовуються для отримання сполук формули І, до способів отримання цих проміжних сполук і сполук формули І, і до застосування сполуки формули І для лікування пацієнтів, що страждають від розладів/станів або схильних до розладів/станів, що викликаються клітинним диференціюванням, проліферацією, продукуванням позаклітинного матрикса або вивільненням медіатора і/або активацією і проліферацією Т-клітин. Терміни, що використовуються вище і протягом всього опису винаходу, мають, якщо це не обумовлене особливо, нижченаведені значення: Визначення "Пацієнт" означає людина і інша тварина. "Ефективна кількість" означає кількість сполуки даного винаходу, ефективну для інгібування тирозинкіназної активності PDGF-R і тирозинкіназної активності Lck, і тим самим, для продукування потрібного терапевтичного ефекту. "Алкіл" означає аліфатичну вуглеводневу групу, яка може бути розгалуженою або прямою і містити приблизно від 1 до 10 атомів вуглецю. Переважним алкілом є "нижчий алкіл", що має приблизно від 1 до 6 атомів вуглецю, а більш переважно, приблизно від 1 до 4 атомів вуглецю. Термін "розгалужений" означає, що одна або декілька нижчих алкільних груп, таких як метил, етил або пропіл пов'язані з лінійним алкільним ланцюгом. Алкільна група також необов'язково заміщена 76935 12 алкокси, галогеном, карбокси, гідрокси або R5R6N-. Прикладами алкілу є метил, фторметил, дифторметил, трифтор-метил, етил, н-пропіл, ізопропіл, бутил, втор-бутил, трет-бутил, аміл і гексил. "Алкеніл" означає аліфатичну вуглеводневу групу, яка містить вуглець-вуглецевий подвійний зв'язок, і яка може бути прямою або розгалуженою групою, що має приблизно від 2 до 10 атомів вуглецю в ланцюгу. Переважні алкенільні групи мають приблизно від 2 до 6 атомів вуглецю в ланцюгу, а більш переважно, приблизно від 2 до 4 атомів вуглецю в ланцюгу. Термін "розгалужений" означає, що одна або декілька нижчих алкільних груп, таких як метил, етил або пропіл пов'язані з лінійним алкенільним ланцюгом. "Нижчий алкеніл" означає алкеніл, що має приблизно від 2 до 4 атомів вуглецю в ланцюгу, який може бути прямим або розгалуженим. Алкенільна група може бути заміщена карбалкокси. Прикладами алкенільних груп є етеніл, пропеніл, н-бутеніл, ізобутеніл, 3метілбут-2-еніл, н-пентеніл, гептеніл, октеніл, циклогексилбутеніл і деценіл. "Етиленіл" означає -СН=СН-групу. "Циклоалкіл" означає неароматичну моно- або мульти-циклічну кільцеву систему, що має приблизно від 3 до 10 атомів вуглецю. Циклоалкільна група як частина радикалів R1a, R1b або R1c необов'язково заміщена одним або декількома, а переважно, одним-трьома, а більш переважно, одним або двома заступниками, вибраними з нижчевказаних "заступників для циклоалкіла", алкільних, гідрокси-, ацилокси-, алкокси-, галогенових, R5R6N, aura-R5N-, карбокси- або R5R6NCO-заступників, або двовалентним киснем (-О-) у двох суміжних атомів вуглецю з утворенням епоксиду; причому, більш переважними заступниками є алкіл, гідрокси, ацилокси, алкокси, двовалентний кисень і R5R6NCO-. Циклоалкільна група як частина радикалів Z2 необов'язково заміщена одним або декількома, а переважно, одним-трьома, а більш переважно, одним або двома заступниками, вибраними з нижчевказаних "заступників для циклоалкіла", алкільних, алкокси-, галогенових, R5R6N-, ацил-R5N-, карбокси- або R5R6COзаступників, або двовалентним киснем (-О-) у двох суміжних атомів вуглецю з утворенням епоксида; причому, більш переважними заступниками є алкіл, гідрокси, ацилокси, алкокси, двовалентний кисень і R5R6NCO-. Крім того, якщо циклоалкільная група заміщена, принаймні, двома гідроксизаступниками, то, принаймні, два з цих гідроксизаступників можуть бути кетальовані або ацетальовані альдегідом або кетоном, що має одиншість атомів вуглецю, з утворенням відповідного кеталю або ацеталю. Кеталізація гем-діолу приводить до утворення спіро-конденсованої кільцевої системи. Переважним спіро-циклоалкільним кільцем є 1,4-діоксаспіро[4,5]дек-8-іл. Переважними незаміщеними або заміщеними моноциклічними циклоалкільними кільцями є циклопентил, фторциклопентил, циклогексил і циклогептил; більш переважними є циклогексил і циклопентил. Прикладами мультициклічних циклоалкільних кілець є 1 -декалін, адамант(1 або 2-)-іл, [2.2.1]біциклогептаніл (норборніл) і 13 [2.2.2]біциклооктаніл; при цьому, більш переважними є [2.2.1]біциклогептаніл і [2.2.2]біциклооктаніл. "Циклоалкеніл" означає неароматичну моноциклічну або мультициклічну кільцеву систему, що містить вуглець-вуглецевий подвійний зв'язок, що має приблизно від 3 до 10 атомів вуглецю. Циклоалкенільна група як частина радикалів R1a, R1b або R1c необов'язково заміщена одним або декількома, а переважно, одним-трьома, а більш переважно, одним або двома заступниками, описаними вище. Циклоалкенільна група як частина радикалів Z2 необов'язково заміщена одним або декількома, а переважно, одним-трьома, а більш переважно, одним або двома заступниками, описаними вище. Переважними незаміщеними або заміщеними моноциклічними циклоалкенільними кільцями є циклопентеніл, циклогексеніл і циклогептеніл; більш переважними є циклогептеніл і циклогексеніл. Переважними мультициклічними циклоалкенільними кільцями є [2.2.1]біциклогептеніл (норборненіл) і [2.2.2]біциклооктеніл. "Арил" означає ароматичний карбоциклічний радикал, що містить приблизно від 6 до 10 атомів вуглецю. Прикладами арила є феніл або нафтил, або феніл або нафтил, заміщені одним або декількома заступниками арильної групи, які можуть бути однаковими або різними, де "заступником арильної групи" є водень, гідрокси, галоген, алкіл алкокси, карбокси, алкоксикарбоніл або Υ1Υ2NCO-, де Υ1 і Υ2 незалежно представляють водень або алкіл. Переважними заступниками арильної групи є водень, галоген і алкокси. "Гетероарил" означає приблизно 5-10-членну ароматичну моноциклічну або мультициклічну вуглеводневу кільцеву систему, в якій один або декілька атомів вуглецю на вказаній кільцевій системі є не атомами вуглецю, а наприклад, атомами азоту, кисню або сірки. Префікси "аза", "окса" або "тіа" перед гетероарилом означають, що в даній кільцевій системі присутній, принаймні, один атом азоту, кисню або сірки, відповідно, як кільцевий атом. Тетероарил" може бути також заміщений одним або декількома вищезазначеними "заступниками для арильної групи". Прикладами гетероарильних груп є заміщений піразиніл фураніл, тієніл, піридил, піримідиніл, ізоксазоліл, ізотіазоліл, оксазоліл тіазоліл, піразоліл, фуразаніл, піроліл, імідазо-[2,1b]тіазоліл, бензофуразаніл, індоліл, азаіндоліл, бензімідазоліл, бензотієніл, хінолініл, імідазоліл і ізохінолініл. "Гетероцикліл" означає приблизно 4-10-членну моноциклічну або мультициклічну вуглеводневу кільцеву систему, в якій один або декілька атомів вуглецю на вказаній кільцевій системі є не атомами вуглецю, а атомами, вибраними з атомів азоту, кисню або сірки. Гетероциклільна група як частина радикалів R1a, R1b або R1c необов'язково заміщена одним або декількома, а переважно, однимтрьома, а більш переважно, одним або двома заступниками, описаними вище. Гетероциклільна група як частина радикалів Z2 необов'язково заміщена одним або декількома, а переважно, однимтрьома, а більш переважно, одним або двома заступниками, описаними вище. Префікси "аза", "ок 76935 14 са" або "тіа" перед гетероциклілом означають, що в даній кільцевій системі присутній, принаймні, один атом азоту, кисню або сірки, відповідно, як кільцевий атом. Прикладами гетероциклільних груп є піперидил, піролідиніл, піперазиніл, морфолініл, тіоморфолініл, тіазолідиніл, 1,3-діоксоланіл, 1,4-діоксоланіл, 1,4-діоксаніл, тетрагідрофураніл, тетрагідротіофеніл, тетрагідротіопіраніл і т.п.Прикладами гетероциклільних груп є хінуклідил, пентаметиленсульфід, тетрагідропіраніл, тетрагідротіофеніл, піролідиніл, тетрагідрофураніл, 7оксабіцикло[2.2.1]гептаніл або 4піперидинопіперидин. "Гетероциклілкарбонілокси" означає гетероцикліл-С(О)О-групу, де гетероцикліл визначений в даному описі. Прикладом гетероциклілкарбонілокси-групи є [1,4']-біперидиніл-1'-карбонілокси-(4піперидинопіперид-1-илкарбонілокси). "Гетероцикленіл" означає приблизно 4-10членну ароматичну моноциклічну або мультициклічну-кільцеву систему, яка є частково ненасиченою, і в якій один або декілька атомів вуглецю на вказаній кільцевій системі є не атомами вуглецю, а атомами, вибраними з атомів азоту, кисню або сірки. Гетероцикленільна група як частина радикалів R1a, R1b або R1c необов'язково заміщена одним або декількома, а переважно, одним-трьома, а більш переважно, одним або двома заступниками для циклоалкілів, описаними вище. Гетероцикленільна група як частина радикалів Z2 необов'язково заміщена одним або декількома, а переважно, одним-трьома, а більш переважно, одним або двома заступниками для циклоалкілів, описаними вище. Префікси "аза", "окса"' або "тіа" перед гетероцикленілом означають, що в даній кільцевій системі присутній, принаймні, один атом азоту, кисню або сірки, відповідно, як кільцевий атом. Прикладами моноциклічних азагетероцикленільних груп є 1, 2,3,4-тетрагідрогідропіридил, 1,2дигідропіридил, 1,4-дигідропіридил, 1,2,3,6тетрагідропіридил, 1,4,5,6-тетра-гідропіримідил, 2піролініл, 3-піролініл, 2-імідазолініл, 2-піразолініл і т.п.Прикладами оксагетероцикленільних груп є 3,4-дигідро-2Н-піран, дигідрофураніл і фтордигідрофураніл. Прикладом мультициклічної оксагетероцикленільної групи є 7оксабіцикло[2.2.1]гептеніл. Прикладами моноциклічних тіагетероцикленільних груп є дигідротіофеніл і дигідротіопіраніл. "Ацил" означає групу Η-CO- або алкіл-СО-, де алкільна група описана вище. Переважні ацили містять нижчий алкіл. Прикладами ацильних груп є форміл, ацетил, пропаноїл, 2-метилпропаноїл, бутаноїл і капроїл. "Ароїл" означає групу арил-СО-, де арильна група описана вище. Прикладами таких груп є бензоїл і 1- і 2-нафтоїл. "Алкокси" означає групу алкіл-О-, де алкільна група описана вище. Переважним алкокси є "нижчий алкокси", що має від близько 1 до близько 6 атомів вуглецю. Алкокси може бути необов'язково заміщений однією або декількома аміно, алкокси, карбокси, алкоксикарбонільною, карбоксіарильною, карбамоїльною або гетероциклільною групами. Прикладами алкокси-груп є метокси, етокси, н 15 пропокси, ізопропокси, н-бутокси, гептокси, 2(морфолін-4-іл)етокси, 2-(етокси)етокси, 2-(4метилпіперазин-1-іл)етокси, карбамоїл, Nметилкарбамоїл, Ν,Ν-диметилкарбамоїл, карбоксиметокси і метоксикарбонілметокси. "Циклоалкілокси" означає циклоалкіл-О-групу, де циклоалкільна група описана вище. Прикладами циклоалкілокси-груп є циклопентилокси і циклогексилокси. "Гетероциклілокси" означає групу гетероцикліл-О-, де вказана гетероциклільна група описана вище. Прикладами гетероциклілокси-груп є хінуклідилокси, пентаметиленсульфідокси, тетрагідропіранілокси, тетрагідротіофенілокси, піролідинілокси, тетрагідрофуранілокси і 7оксабіцикло[2.2.1]гептанілокси. "Арилокси" означає групу арил-О-, де арильна група описана вище. "Гетероарилокси" означає групу гетероарил-О, де гетероарильна група описана вище. "Ацилокси" означає групу ацил-О-, де ацильна група описана вище. "Карбокси" означає групу НО(О)С-(карбонова кислота)-. "R5R6N-" означає заміщену або незаміщену аміногрупу, де R5 і R6 описані вище. Прикладами таких груп є аміно (H2N-), метиламіно, етилметиламіно, диметиламіно і діетиламіно.) "R5R6NCO-" означає заміщену або незаміщену карбамоїльну групу, де R5 і R6 визначені вище. Прикладами таких груп є карбамоїл (H2NCO-), Nметилкарбамоїл (MeNHCO-) і Ν,Nдиметиламінокарбамоїл (Me2NCO-). "Ацил- R5N-" означає ациламіногрупу, де R5 і ацил визначені в даному описі. "Галоген" означає фтор, хлор, бром або йод. Переважними є фтор, хлор або бром, а більш переважними є фтор або хлор. "Проліки" означає форму сполуки формули І, відповідну для введення пацієнту і що не надає небажаної токсичної, дратівливої, алергічної і тому подібної дії, а також ефективну для цілей її використання, включаючи кеталеві, складноефірні і цвітеріонні форми. Проліки трансформуються in vivo, наприклад, шляхом гідролізу в крові, з утворенням початкової сполуки вищезгаданої формули. Докладне обговорення приводиться [в роботі Т. Higuchi & V.Stella, Prodrugs as Novel Delivery Systems. Vol. 14 of the A.C.S. Symposium Series і в роботі Edward В. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987], які вводяться в даний опис за допомогою посилання. "Сольват" означає фізичну асоціацію сполуки даного винаходу з однією або декількома молекулами розчинника. Ця фізична асоціація має різні міри іонного і ковалентного скріплення, включаючи водневе скріплення. У деяких випадках, сольват може бути виділений, наприклад, якщо одна або декілька молекул розчинника включені в кристалічні грати кристалічної твердої речовини. Термін "сольват" включає сольват в розчиненій фазі і виділений сольват. Прикладами сольватів є етаноляти, метаноляти і т.п."Гідрат" означає сольват, де молекула(и) розчинника являє(ють) собою Н2О. 76935 16 У своєму переважному аспекті, даний винахід відноситься до сполуки формули І, де: L1 представляє (CR3aR3b)m-Z3-(CR3'aR3'b)n; L2 представляє (CR3aR3b)p-Z4-(CR3'aR3'b)q; Z2 представляє необов'язково заміщений циклоалкіл, необов'язково заміщений циклоалкеніл або необов'язково заміщений гетероцикліл; Z4 представляє О або NR4; m дорівнює 0; n дорівнює 2 або 3; p+q=0 або 1; R1a і R1b незалежно представляють необов'язково заміщений алкіл, .необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений гетероциклілокси або R5R6N-, або один з R1a і R1b представляє водень або галоген, а інший представляє необов'язково заміщений алкіл, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений гетероциклілокси або R5R6N-; R1c представляє водень, необов'язково заміщений алкіл або необов'язково заміщений алкокси; R3a, R3b, R3'a і R3'b незалежно представляють водень або нижчій алкіл; R4 представляє водень; і R5 і R6, взяті разом з атомом азоту, з яким вони пов'язані, утворять азагетероцикліл; або його N-оксид, гідрат, сольват, проліки або його фармацевтично прийнятну сіль. В іншому переважному аспекті даного винаходу, вказаною сполукою є сполука формули І, де: X представляє L2Z2; L2 представляє (CR3aR3b)p-Z4-(CR3'aR3'b)q; Z2 представляє необов'язково заміщений циклоалкіл або необов'язково заміщений циклоалкеніл; Z3 представляє О або NR4; p дорівнює 0; q дорівнює 0 або 1; R1a і R1b незалежно представляють необов'язково заміщений алкіл, необов'язково заміщений алкокси, необов'язково заміщений циклоалкілокси, необов'язково заміщений гетероциклілокси, або один з R1a і R1b представляє водень або галоген; R1c представляє водень; R3'a і R' незалежно представляють водень; і R4 представляє водень, або його N-оксид, гідрат, сольват, проліки або фармацевтично прийнятну сіль. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де L1H представляє нижчий алкіл. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z1 представляє СН. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Ζ1 представляє N. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z2 представляє необов'язково заміщений циклоалкіл. 17 В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z2 представляє алкіл-заміщений моноциклічний циклоалкіл; а більш переважно, метилциклопентил або метилциклогексил. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z2 представляє мультициклічний циклоалкіл; а більш переважно, [2.2.1]біциклогептаніл (норборніл) і [2.2.1]біциклооктаніл. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z2 представляє необов'язково заміщений циклоалкеніл; а більш переважно, циклопентеніл і циклогексеніл. Переважними мультициклічними циклоалкенільними кільцями є [2.2.1]біциклогептеніл (норборненіл) і [2.2.1]біциклооктеніл. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z2 представляє циклопентеніл або циклогексеніл. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z2 представляє мультициклічний циклоалкеніл; а більше переважно, [2.2.1]біциклогептеніл (норборненіл) і [2.2.1]біциклооктеніл. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де p і q рівні 0. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де p+q=1. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z4 представляє О. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Ζ4 представляє О, а р і q рівні 0. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z4 представляє О, а р+q=1. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z4 представляє NR4. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z4 представляє NR4, a p і q рівні 0. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z4 представляє NR4, a m+n=1. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z4 представляє S. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z4 представляє S, а р і q рівні 0. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z4 представляє S, а р+q=1. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де R1a і R1b незалежно представляють необов'язково гідроксизаміщений нижчий алкіл, гідрокси, нижчий алкокси, циклоалкілокси, гетероциклілокси, або один з R1a і R1b представляє водень або галоген. 76935 18 В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де R1a і R1b незалежно представляють гетероциклілкарбонілокси або необов'язково заміщений нижчий алкокси; а більш переважно, нижчий алкокси представляє метокси або етокси. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де один з R1a і R1b представляє нижчий алкіл; більш переважним нижчим алкілом є метил або етил. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де один з R1a і R1b представляє нижчий алкокси, а інший з R1a і R1b представляє галоген; більш переважним нижчим алкокси є метокси або етокси, а галогеном є хлор або бром. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де один з R1a і R1b представляє нижчий алкіл, а інший з R1a і R1b представляє нижчий алкокси; більш переважно, нижчий алкокси представляє метокси або етокси, а нижчий алкіл представляє метил або етил. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де один з R1a і R1b представляє нижчий алкокси, а інший з R1a і R1b представляє циклоалкілокси; більш переважно, нижчий алкокси представляє метокси або етокси, а циклоалкілокси представляє циклопентилокси або циклогексилокси. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де один з R1a і R1b представляє водень, а інший з R1a і R1b представляє нижчий алкокси, циклоалкілокси або гетероциклоалкілокси; більш переважно, нижчий алкокси представляє метокси або етокси, а циклоалкілокси представляє циклопентилокси або циклогексилокси, а гетероциклілокси представляє фуранілокси. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де R1c представляє водень, нижчий алкіл або нижчий алкокси; більш переважно, нижчий алкокси представляє метокси або етокси. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де Z2 представляє (гідрокси або алкіл)-заміщений гідроксициклоалкіл, а більш переважно, (нижчий алкіл)гідроксициклоалкіл. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де R1a і R1b представляють нижчий алкокси, де вказаний нижчий алкокси необов'язково заміщений алкокси, гетероциклілом, карбокси, алкоксикарбонілом або карбамоїлом. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де один з R1a і R1b представляє незаміщений нижчий алкокси, а інший з R1a і R1b представляє нижчий алкокси, заміщений алкокси, гетероциклілом, карбокси, алкоксикарбонілом або карбамоїлом. В іншому переважному своєму аспекті, даний винахід відноситься до сполуки формули І, де один з R1a і R1b представляє метокси, а інший з R1a і R1b представляє [1,4']-біпіперадин-1' 19 ілкарбонілокси, 2-(етокси)етокси, 2-(4-морфолініл)етокси, 2-(4-метилпіперазин-1-іл)етокси, карбоксиметокси, метоксикарбонілметокси, амінокарбонілметокси, N-метиламіно-карбонілметокси або Ν,Ν-диметиламінокарбонілметокси. Переважні сполуки даного винаходу вибрані з наступних типів сполук, таких як: 3-Циклогексилокси-6,7-диметоксихінолін; 2-Циклогексиламіно-6,7-диметоксихіноксалін; екзо-біцикло[2.2.1]гепт-2-іл-(6-хлор-7метоксихіноксалін-2-іл)амін; екзо-біцикло[2.2.1]гепт-2-іл-(7-хлор-бметоксихіноксалін-2-іл)амін; біцикло[2.2.1]гепт-2-іл-(6,7-диметилхіноксалін2-іл)амін; 2-циклогептиламіно-6,7-диметоксихіноксалін; 2-циклопентиламіно-6,7-диметоксихіноксалін; 2-Циклогексиламіно-6-метоксихіноксалін; 3-Аміноциклогексил-6,7-диметоксихінолін; (6,7-диметоксихінолін-3-іл)-цис-(3-(R)-метилцикл огексил)-амін; 2-Циклогексиламіно-6-метокси-7-бромхіноксаліна гідрохлрид; (6,7-диметоксихінолін-3-іл)-цис/транс-(3-(R)метилциклогексил)амін; (6,7-диметоксихінолін-3-іл)-транс-(3-(R)метилциклогексил)-амін; (6,7-диметоксихінолін-3-іл)-цис-(3-(R)метилциклогексил)-амін; (6,7-диметоксихінолін-3-іл)-(3метилциклопентил)амін; циклогекс-3-еніл-(6,7-диметоксихіноксалін-2-іл) амін; 2,7-бис-циклогексилокси-6-метокси-хіноксалін; циклогексил-(6,7-диметоксихіноксалін-2ілметил)амін; (6,7-диметоксихінолін-3-іл)ізобутиламін; циклогексил-(6-метокси-7-морфолін-4-илхіноксалін-2-іл)-амін; (±)-біцикло[2.2.1]гепт-2-іл-(6,7диметоксихіноксалін-2-іл)амін; екзо-біцикло[2.2.1]гепт-5-ен-2-іл-(6,7диметоксихіноксалін-2-іл)амін; циклогексил-(6,8-диметилхіноксалін-2-іл)амін; ендо-біцикло[2.2.1]гепт-2-іл-(6,7диметоксихіноксалін-2-іл)амін; (6,7-диметоксихіноксалін-2-іл)-(4метоксициклогексил)амін; екзо-біцикло[2.2.1]гепт-2-іл-(6метоксихіноксалін-2-іл)-амін; екзо-2-(біцикло[2.2.1]гепт-2-ілокси)-6,7диметоксихіноксалін; 2-(Біцикло[2.2.2]окт-2-ілокси)-6,7диметоксихіноксалін; ендо-2-(біцикло[2.2.1]гепт-2-ілокси)-6,7диметоксихіноксалін; екзо-2-(біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7диметоксихіноксалін; 2-(Біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7диметоксихіноксалін; 2-Циклогексилокси-6,7-диметоксихіноксалін; 2-Циклопентилтіо-6,7-диметоксихіноксалін; 6,7-диметокси-2-циклопентилокси-хіноксалін; 2-Циклопентилметилокси-6,7диметоксихіноксалін; 76935 20 6,7-диметокси-2-тетрагідропіран-4оксихіноксалін; Екзо, екзо-6,7-диметокси-2-(5,6-епоксибіцикло[2.2.1]-гептан-2-ілокси)хіноксалін; цис/транс-4-(6,7-диметоксихіноксалін-2ілокси)циклогексан-карбонова кислота (6,7диметокси-2-(4метоксициклогексилокси)хіноксалін; 3-Циклогексилокси-6,7-диметоксихіноксаліна 1-оксид; (1R,2R,4S)-(+)-біцикло[2.2.1]гепт-2-іл-(6,7диметокси-хіноксалін-2-іл)амін; (1S,2S,4R)-(-)-біцикло[2.2.1]гепт-2-іл-(6,7диметокси-хіноксалін-2-іл)амін; 2-(6,7-диметоксихіноксалін-2-іл)-2-азабіцикло[2.2.2]-октан-3-он; Цис/транс-4-(6,7-диметоксихіноксалін-2іламіно)цикло-гексанкарбонової кислоти метиловий ефір Цис/транс-4-(5,7-диметоксихіноксалін-2іламіно)цикло-гексанкарбонова кислота; Цис-4-(6,7-диметоксихіноксалін-2іламіно)циклогексанкарбонової кислоти метиловий ефір; Транс-4-(6,7-диметоксихіноксалін-2іламіно)цикло-гексанкарбонової кислоти метиловий ефір; (6,7-диметоксихіноксалін-2-іл)-цис/транс-(3(R)- метил-циклогексил)амін; (6,7-диметоксихіноксалін-2-іл)-транс-(3-(R)метилцикло-гексил)амін; (6,7-диметоксихіноксалін-2-іл)-цис-(3-(R)метилцикло-гексил)амін; і метил-цис/транс-4-(6,7-диметоксихіноксалін-2ілокси)-циклогексанкарбоксилат, або їх N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль. Більш переважними є наступні сполуки: 2-Циклогексиламіно-6,7-диметоксихіноксалін; екзо-біцикло[2.2.1]гепт-2-іл-(6-хлор-7метоксихіноксалін-2-іл)амін; екзо-біцикло[2.2.1]гепт-2-іл-(7-хлор-6метоксихіноксалін-2-іл)амін; біцикло[2.2.1]гепт-2-іл-(6,7-диметилхіноксалін2-іл)амін; 2-циклогептиламіно-6,7-диметоксихіноксалін; 2-циклопентиламіно-6,7-диметоксихіноксалін; 3-Аміноциклогексил-6,7-диметоксихінолін; (6,7-диметоксихінолін-3-іл)-цис-(3-(R)метилциклогексил)-амін; (6,7-диметоксихінолін-3-іл)-цис/транс-(3-(R)метилциклогексил)-амін; (6,7-диметоксихінолін-3-іл)-транс-(3-(R)метилциклогексил)-амін; (6,7-диметоксихінолін-3-іл)-цис-(3-(R)метилциклогексил)-амін; циклогекс-3-еніл-(6,7-диметоксихіноксалін-2іл)амін; 2,7-біс-циклогексилокси-6-метоксихіноксалін; (6,7-диметоксихінолін-3-іл)ізобутиламін; (±)-біцикло[2.2.1]гепт-2-іл-(6,7диметоксихіноксалін-2-іл)амін; екзо-біцикло[2.2.1]гепт-5-ен-2-іл-(6,7диметоксихіноксалін-2-іл)амін; 21 ендо-біцикло[2.2.1]гепт-2-іл-(6,7диметоксихіноксалін-2-іл)амін; екзо-біцикло[2.2.1]гепт-2-іл-(6метоксихіноксалін-2-іл)-амін; екзо-2-(біцикло[2.2.1]гепт-2-ілокси)-6,7диметоксихіноксалін; 2-(Біцикло[2.2.2]окт-2-ілокси)-6,7диметоксихіноксалін; ендо-2-(біцикло[2.2.1]гепт-2-ілокси)-6,7диметоксихіноксалін; екзо-2-(біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7диметоксихіноксалін; 2-(біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7диметоксихіноксалін; 2-Циклогексилокси-6,7-диметоксихіноксалін; 2-Циклопентилтіо-6,7-диметоксихіноксалін; 6,7-диметокси-2-циклопентилоксихіноксалін; 2-Циклопентилметилокси-6,7диметоксихіноксалін; 6,7-диметокси-2-тетрагідропіран-4оксихіноксалін; Екзо, екзо-6,7-диметокси-2-(5,6-епоксибіцикло[2.2.1]-гептан-2-ілокси)хіноксалін; (6,7-диметокси-2-(4-метоксициклогексилокси)хіноксалін; (1R, 2R, 4S)-(+)-біцикло[2.2.1]гепт-2-іл-(6,7диметокси-хіноксалін-2-іл)амін; (1S,2S,4R)-(-)-біцикло[2.2.1]гепт-2-іл-(6,7диметокси-хіноксалін-2-іл)амін; Цис/транс-4-(6,7-диметоксихіноксалін-2іламіно)цикло-гексанкарбонової кислоти метиловий ефір Цис-4-(6,7-диметоксихіноксалін-2іламіно)цикло-гексанкарбонової кислоти метиловий ефір; Транс-4-(6,7-диметоксихіноксалін-2іламіно)циклогексан-карбонової кислоти метиловий ефір; (6,7-диметоксихіноксалін-2-іл)-цис/транс-(3(R)-метилциклогексил)амін; (6,7-диметоксихіноксалін-2-іл)-транс-(3-(R)метилциклогексил)амін; (6,7-диметоксихіноксалін-2-іл)-цис-(3-(R)метилциклогексил)амін; і метил-цис/транс-4-(6,7-диметоксихіноксалін-2ілокси)-циклогексанкарбоксилат, або їх N-оксид, гідрат, сольват, проліки або фармацевтично прийнятна сіль. Потрібно зазначити, що в об'єм даного винаходу входять всі відповідні комбінації конкретних і переважних груп, вказаних в даній заявці. Сполуки даного винаходу можуть бути утворені з відомих сполук або з проміжних сполук, що легко отримуються стандартними методами, описаними в літературі. Приклади загальних методів приводяться нижче. Крім того, сполуки формули І отримують відповідно до нижченаведених схем I-VIII, де вказані радикали визначені вище, за винятком тих радикалів, які, по визначенню фахівців, не відповідають описаному методу. 76935 22 23 1. Загальні методи: Реакція поєднання 2-хлор-заміщеного хіноксаліну з амінами або анілінами. Суміш 2-хлор-6,7-диметоксихіноксаліну (1екв.) і аміну (від близько 1 до близько 5екв.) нагрівають при температурі від близько 160 до близько 180°С протягом періоду часу від трьох годин і більше або протягом ночі. Темно-коричневий залишок розчиняють в суміші метанол/метиленхлорид (0%-10%) і хроматографують на силікагелі, елююючи суміш 76935 24 шю гексан/етилацетат або метанол/метиленхлорид (0%-100%) з отриманням потрібного продукту. Цей потрібний продукт може бути потім очищений шляхом перекристалізації в метанолі, метиленхлориді або в суміші метанол/вода. 2. Реакція поєднання 2-хлор-заміщеного хіноксаліну зі спиртами або фенолами. Суспензію спирту або меркаптану (1екв.) і гідриду натрію (від близько 1 до близько 3екв.) в безводному ДМФ/ТГФ (0%-50%) кип'ятять із зворотним холодильником протягом 1 години, а потім додають 2-хлор-6,7-диметоксихіноксалін (1екв.). Отриману суміш кип'ятять із зворотним холодильником від близько однієї до близько чотирьох годин. Суспензію нейтралізують до рН приблизно 58 і розподіляють між метиленхлоридом і насиченим розчином солі. Після концентрування метиленхлориду, залишок хроматографують на силікагелі, елююючи сумішшю гексан/етилацетат або сумішшю метанол/метиленхлорид (0%-100%) з отриманням потрібного продукту. 3. Реакція відновного амінування з амінохінолінами і з альдегідами або кетонами. Відповідним чином заміщений 3-амінохінолін (1екв.) перемішують з 1екв. відповідного альдегіду або кетону в метанолі (або з іншою відповідною сумішшю розчинника) доти, поки ТШХ не буде вказувати на утворення іміну. Потім додають надлишок NaCNBH4 або NaBH4 або іншого відповідного відновника і суміш перемішують доти, поки ТШХ не буде вказувати на витрачення проміжного іміну. Отриману суміш концентрують і залишок хроматографують на силікагелі, елююючи сумішшю гексан/етилацетат (0-100%) або хлороформом/метанол (0-20%), з отриманням потрібного продукту. 4. Реакція поєднання 3-аміно-заміщених хінолінів і бром-фенілових сполук. Відповідним образом заміщений 3амінохінолін (1екв.) перемішують прибл. з 1,4екв. сильної основи, такої як трет-бутоксид натрію, з 1екв. відповідної бромфенілової сполуки і підмішують каталітичну кількість 2,2'біс(дифенілфосфіно)-1,1'-бінафтил(S-BINAP) і біс(дибензиліденацетон)паладію (Pd(dba)2) в інертному органічному розчиннику, такому як толуол, в інертній атмосфері, такій як атмосфера аргону, і нагрівають протягом ночі до близько 80°С. Суміш охолоджують, розбавляють розчинником, таким як ефір, фільтрують, концентрують і хроматографують, елююючи сумішшю 50% EtOAc/гексан, з отриманням потрібного продукту. 5. Утворення ефіру з 3-гідрокси-заміщених хінолінів в умовах Мітцунобу. ТГФ-розчин відповідним образом заміщеного гідроксихіноксаліну (від близько 0 до близько 25°С) обробляють 1екв. (кожного) потрібного спирту, трифенілфосфіну і нарешті, діетилазодикарбоксилату (DEAD) або відповідного еквівалента. За ходом реакції стежать по ТШХ і після завершення реакції (від близько 1 до близько 24 годин), суміш концентрують і залишок хроматографують на силікагелі з отриманням потрібного продукту. 25 6. Деалкілування хіноліну або хіноксаліну, заміщеного нижчим алкокси, і подальше алкілування. Відповідним образом заміщений нижчим алкокси хінолін або хіноксалін (1екв) в ДМФ обробляють надлишком етантіолату натрію (звичайно близько 2 або більше екв.) і реакційну суміш перемішують при нагріванні від близько 1 до близько 24 годин. Суміш розподіляють між водою і етилацетатом. Після екстракції, а потім хроматографії, якщо це необхідно, отримують відповідний потрібний гідрокси-заміщений хіноліновий або хіноксаліновий продукт. Отриманий гідрокси-заміщений хіноліновий або хіноксаліновий продукт може бути алкілований в умовах реакції Мітцунобу, детально описаних вище. Альтернативно, просте алкілування добре відомими методами з реакційним алкіл- або бензилгалогенідом з використанням NaH або іншої відповідної основи у відповідному розчиннику дає потрібний алкілований продукт. 7. Окислення азоту в хіноліні або в хіноксаліні з утворенням відповідного N-оксиду. Хінолінову або хіноксалінову сполуку формули (І), що має імінову (=N-) групу, може бути перетворено у відповідну сполуку, де вказана імінова група окислена в N-оксид, переважно, шляхом реакції з перкислотою, наприклад, пероцтовою кислотою в оцтовій кислоті або м-хлорпероксибензойній кислоті в інертному розчиннику, такому як дихлорметан, при температурі приблизно від кімнатної температури до температури перегонки розчинника, а переважно, при підвищеній температурі. Сполуки даного винаходу можуть бути використані в формі вільної основи або кислоти або в формі їх фармацевтично прийнятної солі. Всі ці форми входять в об'єм даного винаходу. Якщо сполука даного винаходу заміщена основною групою, то утворяться кислотно-адитивні солі, які є просто більш зручною формою для використання; а на практиці, використання вказаної сольової форми, по суті, еквівалентне використанню форми вільної основи. Кислотами, які можуть бути використані для отримання кислотноадитивних солей, є, переважно, кислоти, які, при їх об'єднанні з вільною основою, утворять фармацевтично прийнятні солі, тобто, солі, аніони яких є нетоксичними для пацієнта в фармацевтичних дозах цих солей, такими, що сприятлива інгібуюча дія на PDGF, властива вільній основі, не послабляється побічними ефектами, що приписуються цим аніонам. Хоч фармацевтично прийнятні солі вказаних основних сполук є переважними, всі кислотно-адитивні солі можуть бути використані як джерела вільної основи, навіть якщо конкретна сіль, per se, необхідна тільки як проміжний продукт, наприклад, якщо цю сіль отримують лише з метою очищення і ідентифікації, або якщо вона використовується як проміжна сполука при отриманні фармацевтично прийнятної солі шляхом іонообмінних реакцій. Фармацевтично прийнятні солі, що входять в об'єм даного винаходу, отримують з наступних кислот, таких як мінеральні кислоти, такі як хлористоводнева кислота, сірчана кислота, фосфорна кислота або сульфамінова 76935 26 кислота; і органічні кислоти, такі як оцтова кислота, лимонна кислота, молочна кислота, винна кислота, малонова кислота, метансульфонова кислота, етансульфонова кислота, бензолсульфонова кислота, п-толуолсульфонова кислота, циклогексилсульфамінова кислота, хінна кислота і т.п.Відповідними кислотно-адитивними солями є наступні солі: гідрогалогеніди, наприклад, гідрохлорид і гідробромід, сульфат, фосфат, нітрат, сульфамат, ацетат, цитрат, лактат, тартрат, малонат, оксалат, саліцилат, пропіонат, сукцинат, фумарат, малеат, метилен-біс- гідроксинафтоати, гентизати, мезилати, ізетіонати і ди-п-толуоїлтартрати, метансульфонат, етансульфонат, бензолсульфонат, п-толуолсульфонат, циклогексилсульфамат і хинат, відповідно. Відповідно до іншої відмітної ознаки даного винаходу, кислотно-адитивні солі даних сполук даного винаходу отримують шляхом реакції вільної основи з відповідною кислотою із застосуванням або адаптацією відомих методів. Так, наприклад, кислотно-адитивні солі даного винаходу отримують або шляхом розчинення вільної основи у водному або водно-спиртовому розчині або в інших відповідних розчинниках, що містять відповідну кислоту, і виділення солі шляхом випаровування розчину, або шляхом реакції вільної основи і кислоти в органічному розчиннику, причому, в цьому випадку, сіль виділяють безпосередньо, або вона може бути отримані шляхом концентрування розчину. Сполуки даного винаходу можуть бути отримані з кислотно-адитивних солей шляхом застосування або адаптації відомих методів. Так, наприклад, вихідні сполуки даного винаходу можуть бути отримані з їх кислотно-адитивних солей обробкою лугом, наприклад, водним розчином бікарбонату натрію або водним розчином аміаку. Якщо сполука даного винаходу заміщена кислотною групою, то можуть бути утворені основноадитивні солі, які є просто більш зручними для використання; а на практиці, використання цієї сольової форми по суті еквівалентне використанню форми вільної кислоти. Основами, які можуть бути використані для отримання основноадитивних солей, є, переважно, основи, які, при їх об'єднанні з вільною кислотою, утворять фармацевтично прийнятні солі, тобто, солі, катіони яких є не токсичними для пацієнта в фармацевтичних дозах цих солей, такими, що сприятлива інгібуюча дія на PDGF, властива вільній кислоті, не ослабляється побічними ефектами, властивими цим катіонам. Фармацевтично прийнятними солями, наприклад, солями лужних і лужноземельних металів, що входять в об'єм даного винаходу, є солі, отримані з наступних основ: гідриду натрію, гідроксиду натрію, гідроксиду калію, гідроксиду кальцію, гідроксиду алюмінію, гідроксиду літію, гідроксиду магнію, гідроксиду цинку, аміаку, триметиламіаку, триетиламіаку, етилендіаміну, н-метилглюкаміну, лізину, аргініну, орнітину, холіну, N,N'дибензилетилендіаміну, хлорпрокаїну, діетаноламіну, прокаїну, н-бензилфенетиламіну, діетиламіну, піперазину, трис-(гідроксиметил)амінометану, гідроксиду тетраметиламонію і т.п. 27 Металеві солі сполук даного винаходу можуть бути отримані шляхом контактування гідриду, гідроксиду, карбонату або аналогічного реакційноздатної сполуки вибраного металу у водному або органічному розчиннику з даною сполукою в формі вільної кислоти. Розчинником, що використовується може бути вода або суміш води з органічним розчинником, а переважно, спиртом, таким як метанол або етанол, кетон, таким як ацетон, аліфатичним ефіром, таким як тетрагідрофуран або складним ефіром, таким як етилацетат. Такі реакції звичайно проводять при кімнатній температурі, але, при необхідності, вони можуть бути проведені при нагріванні. Амінові солі сполук даного винаходу можуть бути отримані шляхом контактування аміна у водному або органічному розчиннику з даною сполукою в формі вільної кислоти. Придатними водними розчинниками є вода і суміші води зі спиртами, такими як метанол або етанол, з ефіром, таким як тетрагідрофуран, нітрилами, такими як ацетонітрил або кетонами, такими як ацетон. Аналогічним образом можуть бути отримані солі амінокислот. Сполуки даного винаходу можуть бути отримані з основно-адитивних солей із застосуванням або адаптацієювідомих методів. Так, наприклад, початкові сполуки даного винаходу можуть бути отримані з їх основно-адитивних солей шляхом обробки кислотою, наприклад, хлористоводневою кислотою. При їх застосуванні як активних сполук, солі сполук даного винаходу можуть бути використані для очищення сполук, наприклад, завдяки відмінностям в розчинності між вказаними солями і початковими сполуками, побічних продуктів і/або початкових продуктів методами, добре відомими фахівцям. Сполуки даного винаходу можуть містити асиметричні центри. Ці асиметричні центри можуть незалежно знаходиться або в R-, або в Sконфігурації. Потрібно також зазначити, що деякі сполуки формули І можуть володіти геометричною ізомерією. Геометричні ізомери включають цис- і транс-форми сполук даного винаходу, тобто, сполук, що мають алкенільні групи або заступники на кільцевих системах. Крім того, кільцеві біциклосистеми включають ендо-і екзо-ізомери. Даний винахід відноситься до окремих геометричних ізомерів, стереоізомерів, енантіомерів і до їх сумішей. Вказані ізомери можуть бути виділені з їх сумішей із застосуванням або адаптацією відомих методів, наприклад, хроматографічних методів і методів перекристалізації, або вони можуть бути окремо отримані з відповідних ізомерів їх проміжних сполук, наприклад, із застосуванням або адаптацією описаних тут методів. Початкові і проміжні сполуки отримують із застосуванням або адаптацією відомих методів, наприклад, методів, описаних в Порівняльних прикладах або з їх очевидних хімічних еквівалентів, або із застосуванням описаних методів даного винаходу. Даний винахід, крім того, проілюстрований, але не обмежений, нижченаведеними прикладами, 76935 28 в яких описане отримання сполук даного винаходу. Крім того, в нижченаведених прикладах представлені способи, що використовуються для синтезу сполук даного винаходу. Приклад 1: 3-Циклогексилокси-6,7диметоксихінолін До розчину ТГФ (30мл) при 0°С додають 3гідрокси-6,7-диметоксихінолін (0,237г, 1,15ммоль), циклогексанол (0,347г, 3,46ммоль), Ph3P (0,908г, 3,46ммоль). Потім порціями додають діетилазодикарбоксилат доти, поки розчин не набуде темночервоне забарвлення (0,663г, 3,81ммоль). Через 4 години розчин концентрують і залишок хроматографують (50% EtOAc в гексані). Продукт перекристалізовують з суміші ізопропанол/гексан у вигляді НСІ-солі з отриманням білої твердої речовини (т.пл. 229-232°С, розкл.). Приклад 2: 2-аніліно-6-ізопропокси-хіноксаліну гідрохлорид До NaH (0,033г, 0,84ммоль) в атмосфері аргону додають 1мл ДМФ. Потім порціями додають 2аніліно-6-хіноксалінол (0,1г, 0,42ммоль) в 1,5мл ДМФ. Через 30 хвилин по краплях додають 2бромпропан і розчин нагрівають до 50°С протягом 1,5 години. Охолоджену реакційну суміш гасять водою і розподіляють між EtOAc і Н2О, промивають Н2О (3X), насиченим розчином солі, сушать (MgSО4) і концентрують. Отриманий залишок хроматографують (30% EtOАс/гексани) з отриманням 0,05г діалкілованого продукту і 0,1г вказаної в заголовку сполуки. Аналітичний зразок НСІ-солі отримують шляхом додання суміші ІРА (3пропанол)/НСl до Еt2О/ІРА-розчину вільної основи з отриманням НСІ-солі (т.пл. 205-210°С, розкл.). Аналіз для C17H17N3O-НСl: обчислено С, 64,65; Н, 5,74; N, 13,31; знайдено: С, 64,51; Н, 5,90; N, 13,09. Приклад 3: 2-циклогексиламіно-6,7диметоксихіноксалін До 0,3г (1,34ммоль) 2-хлор-6,7диметоксихіноксаліну додають прибл.1мл циклогексиламіну. Отриману суміш нагрівають протягом ночі при 105°С, а потім протягом 10 годин при 135°С. Суміш розподіляють між СН2Сl2 і насиченим NаНСО3. Органічний шар сушать (MgSO4) і концентрують. Отриманий сироп хроматографують (1:1, EtOAc: СН2Сl2) з отриманням 0,265г продукту у вигляді ясно-коричневої твердої речовини з виходом 69% (т.пл. 188-189,5°С). Аналіз для C16H21N3O2: обчислено С, 66,88; Н, 7,37; N, 14,62; знайдено: С, 66,82; Н, 7,28; N, 14,45. З використанням стандартної вищеописаної схеми поєднання і з використанням відповідних початкових сполук були отримані наступні сполуки: екзо-біцикло[2.2.1]гепт-2-іл-(6-хлор-7метоксихіноксалін-2-іл) амін (т.пл. 171-173°С). Аналіз для C16H18N3OCl: обчислено С, 35 63,26; Н, 5,97; N, 13,83; знайдено: С, 63,37; Н, 5,91; N,13,83. екзо-біцикло[2.2.1]гепт-2-іл-(7-хлор-6метоксихіноксалін-2-іл)амін (т.пл. 146-147,5°С). Аналіз для C16H18N3OCl: обчислено С, 63,26; Η, 5,97; Ν, 13,83; знайдено: С, 63,34; Η, 5,93; Ν, 13,77. 29 біцикло[2.2.1]гепт-2-іл-(6,7-диметилхіноксалін2-іл)амін (т.пл. 155-157°С). Аналіз для C17H21N3: обчислено С, 76,37; Н, 7,92; Ν, 15,72; знайдено: С, 75,58; Н, 7,55; Ν, 15,38. 2-циклогептиламіно-6,7-диметоксихіноксалін (т.пл. 134-136°С). Аналіз для C17H23N3O2: обчислено С, 67,75; Н, 7,69; Ν, 13,94; знайдено: С, 67,80; Н, 7,61; Ν, 13,77. 2-циклопентиламіно-6,7-диметоксихіноксалін (т.пл. 149-151 °С). Аналіз для C15H19N3O2: обчислено С, 65,91; Н, 7,01; N, 15,37; знайдено: С, 66,04; Н, 6,96; N, 15,47. 2-циклогексиламіно-6-метоксихіноксалін (т.пл. 242-248°С). Приклад 4: 3 -аміноциклогексил-6,7диметоксихінолін До розчину МеОН (3мл) і порошкоподібних молекулярних сит 4А (0,11г) в атмосфері аргону додають 3-аміно-6,7-диметоксихіноліну гідрохлорид (0,17г, 0,68ммоль) і NaOMe (0,039г, 0,71ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 30 хвилин і порціями додають циклогексанон (0,074мл, 0,71ммоль), а потім комплекс пірідин-боран (0,072мл, 0,071ммоль). Суміш перемішують протягом 4,5 години, а потім порціями додають 5н НСl (1,4мл, 6,8ммоль). Реакційну суміш перемішують протягом 45 хвилин, а потім підлужують сильною основою 5н NaOH. Суміш розподіляють між EtOAc і Н2О і водний шар промивають EtOAc (2X). Об'єднані органічні шари промивають насиченим розчином солі (1Х), сушать (MgSO4), хроматографують (50% ЕtOАс/гексан) і перекристалізовують з EtOAc/гексану з отриманням 0,112г ясно-жовтої твердої речовини з виходом 57% (т.пл. 164-165). Аналіз для C17H22N2O2: обчислено С, 71,30; Н, 7,74; N, 9,78; знайдено: С, 71,45; Н, 7,49; N, 9,80. Приклад 5: 2-циклогексиламіно-6-метокси-7бром-хіноксаліну гідрохлорид До 0,75г (2,7ммоль) суміші 7-бром-6метоксихіноксалін-2-ол: 6-бром-7метоксихіноксалін-2-ол, 7:1, в герметично закритій пробірці додають 5мл циклогексиламіну. Реакційну суміш нагрівають до 120°С протягом 2 годин. Циклогексиламін видаляють при зниженому тиску і залишок розподіляють між ЕtOАс/Н2О. Органічний шар промивають Н2О (2Х), насиченим розчином солі (1Х) і сушать (MgSO4). Отриманий продукт хроматографують (20%, а потім 30% EtOАс/гексан) з отриманням 0,81г головного продукту з виходом 88%. Аналітичний зразок отримують шляхом перетворення приблизно 0,13г вільної основи в його гідрохлоридну сіль (т.пл.280°С, розкл.). Аналіз для C15H18N3Obr-HCl: обчислено С, 48,34; Н, 5,14; N, 11,27; знайдено: С, 48,51; Н, 4,98; N, 11,09. Приклад 6: (6,7-диметоксихінолін-3-іл)-цис-(3(R)-метил-цикло-гексил)аміну дигідрохлорид і (6,7диметоксихінолін-3-іл)-транс-(3-(R)метилциклогексил)аміну дигідрохлорид Цис/транс-суміш (6,7-диметоксихінолін-3-іл)(3-(R)-метилциклогексил)аміну, отриману шляхом відновного амінування 3-аміно-6,7диметоксихіноліну і 3-(R)-метилциклогексанону, розділяють ОФ-ВЕРХ. Обидва зразки знов хроматографують (70% EtOАс/гексан) з отриманням чи 76935 30 стої вільної основи. Аналітичний зразок кожного ізомеру отримують шляхом окремого перетворення вільних основ в аморфні і до деякої міри гігроскопічні дигідрохлоридні солі. 500МГц 1Н-ЯМР відповідав даному продукту і РХ/МС і FAB підтвердив М+Н=301 для кожного ізомеру. Приклад 7: Циклогекс-3-еніл-(6,7диметоксихіноксалін-2-іл)амін До розчину транс-4-(6,7-диметоксихіноксалін2-іламіно)- циклогексанолу (303мг, 1ммоль) в 10мл ТГФ при -78°С додають трифенілфосфін (524мг, 2ммоль) і діетилазодикарбоксилат (1мл). Суміш перемішують при -78°С протягом 1 години, а потім додають 4-нітробензойну кислоту (334мг, 2ммоль). Після перемішування при -78°С протягом 1 години, суміш залишають для перемішування при кімнатній температурі ще на одну годину, а потім концентрують. Залишок хроматографують на силікагелі (ефір) з отриманням 250мг (87,7%) циклогекс-3еніл-(6,7-диметокси-хіноксалін-2-іл)аміну. Приклад 8: 2-анміно-6-хіноксалінол Методом, [описаним Feutrill, G.I.; Mirrington R.N. Tet.Lett. 1970, 1327], арилметиловий ефір перетворюють в феноловое похідне. До 2-анілино6-метокси-хіноксаліну (0,27г, 1,07ммоль) в атмосфері аргону в ДМФ додають натрієву сіль етантіолу (0,19г, 2ммоль). Реакційну суміш нагрівають до 110°С протягом ночі. Суміш концентрують і розподіляють між EtOAc і Н2О/5% винною кислотою, так, щоб рН водного шара становив приблизно 4. Органічний шар промивають Н2О (4Х), а потім 2,5% NaOH (4X). Основні шари об'єднують, промивають EtOAc (2X), знов підкисляють 5% винною кислотою і промивають безліччю порцій EtOAc. Органічні шари об'єднують, промивають насиченим розчином солі, сушать (Na2SO4) і концентрують. Отримана тверда речовина хроматографують (50% EtOАс/гексан). Аналітичний зразок отримують шляхом розтирання продукту з Еt2О з отриманням жовтого порошку (т.пл.211-213°С). Аналіз для C14H11N3O: обчислено С, 70,88; Н, 4,67; N, 17,71; знайдено: С, 70,64; Н, 4,85; N, 17,58. Приклад 9: Феніл-[6-(тетрагідрофуран-3-(R)-ілокси)хіноксалін-2-іл]амін До розчину ТГФ при 0°С в атмосфері аргону додають 2-аніліно-6-хіноксалінол (0,23г, 0,97ммоль), (3)-(+)-3-гідрокситетрагідрофуран (0,086мл, 1,3ммоль) і трифенілфосфін (0,31г, 1,2ммоль). Потім порціями додають DEAD (0,18мл, 1,2ммоль). Реакційну суміш залишають для нагрівання до кімнатної температури і переміщують протягом 1,5 годин. Суміш концентрують і розподіляють між EtOAc і Н2О. Органічний шар промивають Н2О, насиченим розчином солі, сушать (MgSO4) і концентрують. Отримане жовте масло хроматографують (50% EtOAc/гексан) і розчиняють в Еt2О/ІРА. Потім по краплях додають розчин HCl/Et2O і отриманий червоно-оранжевий порошок сушать у вакуумі. Цей порошок отримують у вигляді вільної основи шляхом перемішування в МеОН з промитою (3 Н2О, 5 МеОН) основною іонообмінною смолою. Суміш перемішують 30 хвилин, фільтрують, концентрують і перекристалізовують з EtOAc/гексана з отриманням, в двох зборах, даного продукту (т.пл. 173-175°С). Аналіз 31 для C18H17N3O2: обчислено С, 70,35; Н, 5,57; Ν, 13,67; знайдено: С, 70,19; Н, 5,60; Ν, 13,66. Приклад 10: 2,7-Біс-циклогексилокси-6метоксихіноксалін До розчину ДМФ (5мл) і NaH (0,32г, 8ммоль) в атмосфері аргону по краплях додають циклогексанол (0,7мл, 6,7ммоль). Отриману суміш перемішують при кімнатній температурі протягом 25 хвилин, а потім порціями додають 2-хлор-6,7диметоксихіноксалін. Реакційну суміш перемішують протягом 15 хвилин при кімнатній температурі, при 90°С протягом 2 годин і при 110°С протягом 1 години. Суміш охолоджують, гасять Н2О і розподіляють між EtOAc і Н2О. Органічний шар промивають Н2О і насиченим розчином солі, сушать (MgSO4) і хроматографують (10% EtOAc/гексан) з отриманням воскоподібної білої твердої речовини (т.пл. 75-78°С). Аналіз для C21H28N2O3: обчислено С, 70,76; Н, 7,92; N, 7,86; знайдено: С, 70,81; Н, 7,79; N, 7,70. Приклад 11: Циклогексил-(6,7диметоксихіноксалін-2-ілметил)амін До 0,067 Μ розчину карбоксальдегіду 6,7диметокси-2-хіноксаліну в суміші МеОН/1,2дихлоретану, 2:1 (7,5мл, 0,5ммоль) додають циклогексиламін (0,11мл, 0,9ммоль). Реакційну суміш перемішують при кімнатній температурі протягом ночі, додають NaBH4 (0,038г, 1ммоль) і реакційну суміш перемішують протягом ночі. Потім суміш концентрують і хроматографують (суміш 50% ЕtOАс/гексан - приблизно 5% МеОН в суміші 50% EtOАс/гексан). Отримане масло розчиняють в суміші EtOАс/гексан і обробляють НСl в EtOH. Отриманий розчин концентрують і тверді речовини розтирають з ізопропанолом і після сушки у вакуумі при 60°С отримують білу тверду речовину (т.пл. 185-190°С, розкл.). Аналіз для C17H23N3O2-HCI: обчислено С, 60,44; Н, 7,16; N, 12,44; знайдено: С, 60,48; Н, 6,88; N, 12,07. Приклад 12: (6,7-Диметоксихінолін-3-іл)-транс(3-(R)-метил-циклогексил)амін і (6,7диметоксихінолін-3-іл)-цис-(3-(R)-метилциклогексил)-амін Реакцію проводять як описано вище в препаративному прикладі з використанням 3-аміно-6,7диметоксихіноліну у вигляді вільної основи (0,32г, 1,6ммоль) і (R)-(+)-3-метилциклогексанону (0,23мл, 1,9ммоль). Отриману суміш продуктів хроматографують (70% EtOAc/гексан) і перекристалізовують з EtOAc/гексана з отриманням білої твердої речовини (суміш цис- і транс-ізомерів, 1:1) (т.пл.153-160°С). Аналіз для C18H24N2O2: обчислено С, 71,97; Н, 8,05; N, 9,33; знайдено: С, 72,12; Н, 7,85; N, 9,29. Нижченаведену сполуку отримують з використанням стандартної схеми поєднання із застосуванням відповідного початкового продукту. (6,7-диметокси-хінолін-3-іл)-(3-метилциклопентил)амін (т.пл.106-109°С). Аналіз для C17H22N2O2: обчислено С, 71,30; Н, 7,74; N, 9,78; знайдено: С, 71,24; Н, 7,56; N, 9,61. Приклад 13: 3-(6,7-диметоксихінолін-3-іламіно)-2,2-диметилпропан-1-ол Реакцію здійснюють як описано в препаративному прикладі 11. До розчину МеОН і порошкопо 76935 32 дібних молекулярних сит 4Å (0,35г) в атмосфері аргону додають 3-аміно-6,7-диметоксихінолін (0,32г, 1,6ммоль) і 2,2-диметил-3гідроксипропіональдегід (0,19г, 1,9ммоль). Суміш продуктів хроматографують (суміш 3% МеОН/СНСl3) з отриманням 0,10г продукту, який розподіляють між СН2Сl2/10% NaOH. Органічний шар промивають 10% NaOH, H2O і насиченим розчином солі, а потім сушать (MgSO4) і перекристалізовують з суміші EtOAc/гексан з отриманням яснооранжевої твердої речовини (т.пл.170-173,5°С). Аналіз для C16H22N2O3: обчислено С, 66,18; Н, 7,64; N, 9,65; знайдено: С, 66,19,; Н, 7,49; N,9,33. Нижченаведену сполуку отримують з використанням стандартної схеми поєднання із застосуванням відповідного початкового продукту. (6,7-диметоксихінолін-3-іл)-ізобутил амін (т.пл.158-162°С). Аналіз для C15H20N2O2: обчислено С, 69,20; Н, 7,74; N, 10,76; знайдено: С, 69,06; Н, 7,82; N, 11,01. Приклад 14: Циклогексил-(6-метокси-7морфолін-4-іл-хіноксалін-2-іл) амін Отримання вказаної сполуки проводять шляхом адаптації методу, [описаного Buchwald et al. J.Am.Chem.Soc.1996, 118, 7215]. До толуолового розчину 2-циклогексиламіно-6-метокси-7-бромхіноксаліну (0,1г, 0,3ммоль) в атмосфері аргону додають морфолін (0,1г, 0,3ммоль), трет-бутоксид натрію (0,04г, 0,42ммоль), S-(-)-BINAP (кат., 0,001г) і біс(дибензиліденацетон)паладій (кат., 0,001г). Реакційну суміш нагрівають до 80°С протягом ночі. Суміш охолоджують, розбавляють Et2O, фільтрують, концентрують і хроматографують (50% ЕtOАс/гексан). Продукт перекристалізовують з суміші ЕtOАс/гексан і отримують, в двох зборах, жовту тверду речовину (т.пл.194-196°С). Аналіз для C19H26N4O2: обчислено С, 66,64; Н, 7,65; N, 16,36; знайдено: С, 66,60; Н, 7,60; N,16,51. Приклад 15: транс-4-( 7-хлор-6-метоксихіноксалін-2-аміно)- циклогексанол і транс-4-( 6хлор-7-метокси-хіноксалін-2-іламіно)циклогексанол У реакційну колбу, забезпечену пасткою Старка і холодильником, в атмосфері аргону додають суміш (6:1) 2,7- дихлор-6-метокси-хіноксаліну; 2,6дихлор-7-метокси-хіноксаліну (0,30г, 1,3ммоль) і хранс-4-аміно-циклогексанол (0,35г, 3ммоль). Реакційну суміш нагрівають до 170°С приблизно протягом 10 годин, а потім концентрують і двічі хроматографують (7% МеОН/СНСl3, а потім 5% МеОН/СНСl3). Продукт перекристалізовують з суміші EtOAc/гексана і отримують ясно-жовту тверду речовину (т.пл. 144-147°С). Аналіз для C19H26N4O24H2O: обчислено С, 57,20; Н, 6,02; N, 13,34; знайдено: С, 57,21; Н, 5,97; N, 13,08. 1Н-ЯМР-аналіз показав, що отриманий продукт являє собою суміш (2:1) транс-4-(7-хлор-6-метокси-хіноксалін-2аміно)циклогексанолу:транс-4-(6-хлор-7-метоксихіноксалін-2-іл-аміно)-циклогексанолу. Приклад 16: транс-4-(6,7-Диметоксихіноксалін2-іламіно)циклогексанол транс-4-Аміноциклогексанол (0,11г, 2екв.) і 2хлор-6,7-диметоксихіноксалін (0,1г, 1екв.) об'єднують і нагрівають до 160-180°С протягом 4-8 годин. Темно-коричневу суспензію фільтрують і кон 33 центрують. Залишок очищають на флеш-колонці, елююючи сумішшю 3% метанол/метиленхлорид з отриманням продукту у вигляді жовтого порошку з т.пл. 119-123°С. Аналіз для C16H21N3O3: обчислено С, 62,33; Н, 7,05; N, 13,63; знайдено: С, 62,35; Н, 7,09; N,13,18. Отримана сполука може бути перекристалізована наступним способом. Виходячи з 0,2г жовтого порошку в суміші 2,5мл води і 1,25мл метанолу отримують, після кип'ятіння із зворотним холодильником, прозорий оранжевий розчин. Гарячий розчин залишають і поступово охолоджують. Оранжеві голкоподібні кристали збирають шляхом фільтрації і сушать в умовах високого вакууму з отриманням жовтої твердої речовини (т.пл. 119120°С). Альтернативно, НСІ-сіль сполуки, вказаної в заголовку, отримують таким чином: до розчину транс-4-(6,7-диметоксихіноксалін-2іламіно)циклогексанолу в ізопропанолі додають розчин НСl при 0°С. Суміш перемішують протягом 15 хвилин, а потім фільтрують. Зібрану тверду речовину сушать у високому вакуумі з отриманням гідрохлоридної солі транс-4-(6,7диметоксихіноксалін-2-іламіно)циклогексанолу. Аналіз для C16H22ClN3O3-1,2 Н2О: обчислено С, 53,19; Н, 6,80; N, 11,63, СІ 9,81; знайдено: С, 53,14; Н, 6,85; N,11,24, СІ 10,28. Альтернативно, сульфатну сіль сполуки, вказаної в заголовку, отримують таким чином: в звичайній процедурі, транс-4-(6,7диметоксихіноксалін-2-іламіно)циклогексанол розчиняють в ацетоні або в іншому відповідному органічному розчиннику з нагріванням до 45°С, якщо це необхідне. До отриманого розчину обережно додають водну H2SO4 (1екв., 1М розчин) швидко перемішуючи при цьому. Сіль збирають, сушать і отримують сульфат з виходом >80%. Приклад 17: (±)- Біцикло[2.2.1]гепт-2-іл(6,7диметоксихіноксалін-2-іл)амін Процедура А: Суміш 2-хлор-6,7диметоксихіноксаліну (5г, 22,3ммоль) і (±)-екзонорборніл-2-аміну (10г, 90ммоль) нагрівають протягом ночі при 160-180°С. Темно-коричневий залишок розчиняють в 200мл метиленхлориду і промивають 1н NaOH (50мл). Органічний шар сушать над сульфатом магнію, а потім фільтрують. Після концентрування, залишок хроматографують на силікагелі сумішшю гексан/етилацетат (80%) з отриманням потрібного продукту у вигляді жовтої твердої речовини, яка може бути перекристалізована в метанолі. Процедура В: Суміш 2-хлор-6,7диметоксихіноксаліну (9г, 40,1ммоль) і (±)-екзонорборніл-2-аміну (5,77г, 52ммоль), трет-бутоксид натрію (4,22г, 44ммоль), 2,2'-біс(дифенілфосфіно)1,1'-бінафтил (BINAP, 120мг) і біс(дибензиліденацетон)-паладій (Pd(dba)2, 40мг) в 80мл толуолу нагрівають при 80°С протягом восьми годин. Потім додають іншу частину BINAP (60мг) і Pd(dba)2 (20мг) і суміш нагрівають при 100°С протягом ночі. Після розбавлення 200мл метиленхлориду, реакційну суміш промивають 1н NaOH (100мл). Органічний шар сушать над сульфатом магнію і фільтрують. Після концентрування, 76935 34 залишок хроматографують на силікагелі, елююючи сумішшю гексан/етилацетат (80%) з отриманням потрібного продукту у вигляді ясно-жовтої твердої речовини (т.пл. 188-189°С). Аналіз для C17H21N3O3: обчислено С, 68,20; Н, 7,07; N, 14,04; знайдено: С, 68,18; Н, 7,03; N, 14,03. Нижченаведені сполуки отримували аналогічним образом з відповідної початкової сполуки (процедура А). екзо-біцикло[2.2.1]гепт-5-ен-2-іл-(6,7диметоксихіноксалін-2-іл) амін (т.пл.175-177°С). Аналіз для C17H19N3O2-0,4 Н2О: обчислено С, 60,94; Н, 6,56; N, 13,78; знайдено: С, 66,98; Н, 6,62; N,12,73. циклогексил-(6,8-диметилхіноксалін-2-іл)амін [МС m/z: 255 (М+)]. Аналіз для C16H21N3: обчислено С, 75,26; Н, 8,29; N, 16,46; знайдено: С, 75,08; Н, 8,28; N, 15,86. ендо-біцикло[2.2.1]гепт-2-іл-(6,7диметоксихіноксалін-2-іл)амін (т.пл.79-82°С). (6,7диметоксихіноксалін-2-іл)-(4-метоксициклогексил)амін (т.пл.58-68°С). Аналіз для C17H23N3O3-0,5 Н2О: обчислено С, 62,56; Н, 7,41; N, 12,87; знайдено: С, 62,53; Н, 7,22; N, 12,22. екзо-біцикло[2.2.1]гепт-2-іл-(6метоксихіноксалін-2-ш)амін (т.пл. 98-100°С). Аналіз для C16H19N3O: обчислено С, 71,35; Н, 7,11; N, 15,60; знайдено: С, 70,38; Н, 7,03; N, 15,05. Приклад 18: екзо-2-(біцикло[2.2.1]гепт-2ілокси)-6,7- диметокси-хіноксалін Суміш екзо-2-норборнеолу (223мг, 2ммоль) і NaH (60%, 100мг, 2,5ммоль) в 10мл безводного ТГФ кип'ятять із зворотним холодильником протягом 0,5 години, а потім додають 2-хлор-6,7диметоксихіноксалін (336мг, 1,5ммоль). Отриману суміш продовжують кип'ятити із зворотним холодильником протягом двох годин. Після фільтрації і концентрування, залишок хроматографують на силікагелі (суміш 50% ефір/гексан) з отриманням потрібного продукту у вигляді білої твердої речовини (т.пл.135-137°С). Аналіз для C17H20N2O3: обчислено С, 67,98; Н, 6,71; N, 9,33; знайдено: С, 67,96; Н, 6,762; N,9,19. Нижченаведені сполуки отримують по стандартній вищеописаній схемі поєднання з використанням відповідних початкових продуктів. 2-(біцикло[2.2.1]окт-2-ілокси)-6,7диметоксихіноксалін (т.пл. 147-148°С). ендо-2-(біцикло[2.2.1]гепт-2-ілокси)-6,7диметоксихіноксалін (т.пл.110-111°С). екзо-2-(біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7диметоксихіноксалін (т. пл. 108-110°С). Анализ для C17H18N2O3: обчислено С, 68,44; Н, 6,08; N, 9,39; знайдено: С, 68,54; Н, 6,23; N, 9,27, 2-(біцикло[2.2.1]гепт-5-ен-2-ілокси)-6,7диметоксихіноксалін (т. пл. 93-95°С). Анализ для C17H18N2O3: обчислено С, 68,44; Н, 6,08; N, 9,39; знайдено: С, 68,32; Н, 5,98; N, 9,25. 2-циклогексилокси-6,7-диметоксихіноксалін (т.пл.104-106°С). 2-циклопентилтіо-6,7-диметоксихіноксалін (т.пл.123-124°С). Аналіз для C15H18N2O2S: обчислено С, 62,04; Н, 6,25; N, 9,65; знайдено: С, 61,90; Н, 6,02; N, 9,48. 6,7-диметокси-2-циклопентилоксихіноксалін (т.пл.87-89°С). Аналіз для C15H18N2O3: обчислено 35 С, 65,68; Н, 6,61; N, 10,21; знайдено: С, 65,63; Н, 6,52; N, 10,13. 2-циклопентилметилокси-6,7диметоксихіноксалін (т.пл.99-102°С). Аналіз для C16H20N2О3: обчислено С, 66,65; Н, 6,99; N, 9,72; знайдено: С, 66,66; Н, 7,03; N, 9,70. 6,7-диметокси-2-тетрагідропіран-4оксихіноксалін (т.пл. 155-158°С). Аналіз для C15H18N2O4: обчислено С, 62,06; Н, 6,25; N, 9,65; знайдено: С, 62,26; Н, 6,27; N, 9,67. екзо,екзо-6,7-диметокси-2-(5,6-епоксибіцикло[2.2.1]гептан-2-ілокси)хіноксалін (т.пл.173175°С). Приклад 19: цис/транс-4-(6,7диметоксихіноксалін-2-ілокси)циклогексанкарбонова кислота Суміш цис/транс-4-гідрокси-циклогексанкарбонової кислоти (144мг, 1ммоль) i NaH (60%, 160мг, 4ммоль) в безводному ТГФ/ДМФ (10мл/2мл) кип'ятять із зворотним холодильником протягом 1 години, а потім додають 2-хлор-6,7диметоксихіноксалін (225мг, 1ммоль). Отриману суміш кип'ятять із зворотним холодильником ще чотири години. Реакційну суміш нейтралізують до рН=5 і екстрагують етилацетатом (2 50мл). Об'єднані органічні розчини сушать над сульфатом магнію і фільтрують. Після концентрування, залишок хроматографують на силікагелі (елююючи етилацетатом, а потім метанолом) з отриманням потрібного продукту у вигляді білої твердої речовини (т.пл.90-93°С). Аналіз для C17H20N2O5-0,5H2O: обчислено С, 59,89; Н, 6,19; N, 8,22; знайдено: С, 59,91; Н, 6,62; N, 7,90. Приклад 20: 6,7диметокси-2-(4метоксициклогексилокси)хіноксалін Суміш цис/транс-4-(6,7-диметоксихіноксалін-2ілокси)циклогексанолу (170мг, 0,56ммоль) і NaH (60%, 22,4мг, 0,56ммоль) в безводному ТГФ/ДМФ (10мл/2мл) перемішують при 0°С протягом 10 хвилин, а потім додають метилиодид (50мкл, 0,56ммоль). Після перемішування при кімнатній температурі протягом чотирьох годин, реакцію гасять водою (0,5мл) і суміш концентрують. Водний шар екстрагують метиленхлоридом (2 20мл) і об'єднані органічні розчини промивають насиченим розчином солі (5мл). Після концентрування, залишок хроматографують на силікагелі (суміш 30% етилацетат/гексан) з отриманням 80мг (45%) потрібного продукту (т.пл.85-90°С). Приклад 21: 3-циклогексилокси-6,7диметоксихіноксалшу 1-оксид Суміш 2-циклогексилокси-6,7диметоксихіноксаліну (110мг, 0,38ммоль) і метахлорбензойної перкислоти (70%, 113мг, 0,46ммоль) в 10мл метиленхлориду перемішують при кімнатній температурі протягом одного дня. Після фільтрації, розчин концентрують і залишок хроматографують на силікагелі (суміш 20% етилацетат/гексан) з отриманням потрібного продукту (т.пл.167-169°С). Аналогічним образом отримують транс-4-(6,7-диметокси-4-оксихіноксалін-2-іламіно)циклогексанол (т.пл. 220222°С). Аналіз для C16H21N3O4-0,2 Н2О: обчислено С, 59,42; Н, 6,69; N, 12,99; знайдено: С, 59,43; Н, 6,64; N, 12,95. 76935 36 Приклад 22: (1R, 2R, 4S)-(+)-біцикло[2.2.1]гепт2-іл-(6,7-диметоксихіноксалін-2-іл)амін (±)-біцикло [2.2.1] гепт-2-іл-(6,7диметоксихіноксалін-2-іл)амін Прикладу 17 розділяють на хіральній ВЕРХ-колонці (Chiralpac AD, 25 2см, 60% гептан/40% етанол з 10мМ (1S)-)((+)камфорсульфоновою кислотою, 12мл/хвилина) і отримують вказаний в заголовку продукт в якості першого елюату. Зібрані фракції об'єднують і промивають 50мл 1н NaOH, а потім сушать (MgSO4). Після фільтрації, розчин концентрують на роторному випарнику, а потім сушать в умовах високого вакууму. У результаті отримують жовту тверду речовину. [ ]d20+19,5° (с=0,20, СН2Сl2), т.пл. 184186°С. Аналіз для C17H21N3O2 0,3 Н2О: обчислено С, 66,90; Н, 7,15; N, 13,77; знайдено: С, 66,86; Н, 7,01; N,13,86. Приклад 23: (1S,2S,4R)-(-)-біцикло[2.2.1]гепт-2іл-(6,7-диметоксихіноксалін-2-іл)амін (і) (±)-біцикло[2.2.1]гепт-2-іл-(6,7-диметоксихіноксалін-2-іл)амін Прикладу 17 розділяють на хіральній ВЕРХ-колонці (Chiralpac AD, 25 2см, 60% гептан/40% етанол з 10мМ (13)-(+)камфорсульфоновою кислотою, 12мл/хвилина) як другий елюат. Зібрані фракції об'єднують і промивають 50мл 1н NaOH, а потім сушать сульфатом магнію. Після фільтрації, розчин концентрують на роторному випарнику, а потім сушать в умовах високого вакууму. У результаті отримують жовту тверду речовину, [ ]d20-19,5° (с=0,22, СН2Сl2), т.пл. 185-187°С. (іі) Суміш 2-хлор-6,7-диметоксихіноксаліну (462мг, 2,06ммоль) і (1S, 2S, 4R)-норборніл-2аміну (300мг, 2,7ммоль), трет-бутоксида натрію (220мг, 2,3ммоль), BINАР (9мг) і Pd(dba)2 (3мг) в 10мл толуолу нагрівають протягом ночі при 80100°С. Отриману суспензію хроматографують на силікагелі, елююючи сумішшю гексан/етилацетат (60%), з отриманням 370мг (60%) потрібного продукту у вигляді жовтої твердої речовини, яка має той же самий час втримання, що і перший елюат у вищезгаданій хіральній ВЕРХ-умові. [ ]d20-19° (с=0,19, СН2Сl2). Приклад 24: 2-(6,7-диметоксихіноксалін-2-іл)2-азабіцикло-[2.2.2]октан-3-он 2-Азабіцикло[2.2.2]октан-3-он (228мг, 2,3ммоль) розчиняють в суміші ТГФ/ДМФ (5мл/3мл) і обробляють NaH (60%, 184мг, 4,6ммоль). Отриману суміш нагрівають при 60°С протягом 0,5 години, а потім додають 2-хлор-6,7диметоксихіноксалін (344мг, 1,5ммоль). Після нагрівання при 80°С протягом ночі, реакційну суміш концентрують. Залишок хроматографують на силікагелі (елююючи сумішшю 50% етилацетат/гексан) з отриманням 164мг (23%) жовтої твердої речовини (т.пл. 158-159°С). Приклад 25: Цис/транс-4-(6,7диметоксихіноксалін-2-іламіно)циклогексанкарбонової кислоти метиловий ефір До розчину 2-(6,7-диметоксихіноксалін-2-іл)-2азабіцикло-[2.2.2]октан-3-ону (100мг, 0,32ммоль) в 10мл метанолу додають свіжоприготований розчин NaOMe/метанола (54мг, 1ммоль) і суміш перемішують при кімнатній температурі протягом 0,5 години, а потім концентрують. Після екстракції 37 метиленхлоридом, суміш сушать сульфатом магнію. Після фільтрації і концентрування, залишок хроматографують на силікагелі (40% етил-ацетат) і отримують 85мг (77%) цис/транс-4-(6,7диметоксихіноксалін-2-іламіно)циклогексанкарбонової кислоти метилового ефіру у вигляді ясно-жовтої твердої речовини (т.пл.6880°С). Приклад 26: Цис/транс-4-(6,7диметоксихіноксалін-2-іламіно)циклогексанкарбонова кислота 2-(6,7-Диметокси-хіноксалін-2-іл)-2азабіцикло[2.2.2]октан-3-он перетворюють в цис/транс-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанкарбонову кислоту вищезгаданим методом, за винятком того, що замість NaOMe використовують NaOH. Приклад 27: Цис-4-(6,7-диметоксихіноксалін-2іламіно)циклогексанкарбонової кислоти метиловий ефір і транс-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанкарбонової кислоти метиловий ефір Цис-4-(6,7-диметоксихіноксалін-2-іламіно)циклогексанкарбонової кислоти метиловий ефір [МС m/z: 345 (М+)] і транс-4-(6,7диметоксихіноксалін-2-іламіно)циклогексанкарбонової кислоти метиловий ефір [МС m/z: 345 (М+)] розділяють препаративною ТШХ з ефіру цис/транс-4-(6,7-диметоксихіноксалін2-іламіно)-циклогексанкарбонової кислоти, елююючи сумішшю 65% етилацетат/гексан, як першого і другого елюатів, відповідно. Приклад 28: транс-4-[7-метокси-6-(2-морфолін4-іл-етокси)хіноксалін-2-іламіно] циклогексанол і транс-4-[6-метокси-7-(2-морфолін-4-ілетокси)хіноксалін-2-іламіно]циклогексанол Вказану в заголовку сполуку отримують реакцією поєднання по Мітцунобу суміші 6-гідрокси-7метокси-2-хлорхіноксаліну: 7-(2-морфолін-4ілетокси)-6-метокси-2-хлорхіноксаліну і 2(морфолін-4-іл) етанолу методом, описаним в прикладі 1, і реакцією отриманої суміші 6-(2морфолін-4-ілетокси)-7-метокси-2хлорхіноксаліну:7-(2-морфолін-4-ілетокси)-6метокси-2-хлорхіноксаліну і транс-4аміноциклогексанолу методом, описаним в Прикладі 11. Приклад 29: 2-[2-(транс-4гідроксициклогексиламіно)-7-метоксихіноксалін-6ілокси]-1-оцтова кислота і 2-[2-(транс-4-гідроксициклогексиламіно)-6-метоксихіноксалін-7-ілокси]-1оцтова кислота Вказану в заголовку сполуку отримують шляхом деалкілування 4-(6,7-диметоксихіноксалін-2іламіно)циклогексанолу з використанням натрієвої солі етантіолу в ДМФ, як описано в Прикладі 8, з подальшим алкілуванням бромоцтовою кислотою в присутності основи, як описано в загальній методиці 6. Приклад 30: 2-[2-(транс-4-гідроксициклогексиламіно)-7-метокси-хіноксалін-6-ілокси]N,N-диметилацетамид і 2-[2-(транс-4-гідроксициклогексиламіно)-6-метоксихіноксалін-7-ілокси]N,N-диметилацетамід 76935 38 Вказану в заголовку сполуку отримують шляхом амінолізу сполуки Прикладу 29 з використанням диметиламіну. Приклад 31: (6,7-диметокси-хіноксалін-2-іл)-(3(R)-метилцикло-гексил)амін і його цис- і трансізомери Спочатку вказані сполуки отримують у вигляді суміші цис- і транс-ізомерів. Вказані ізомери отримують з циклогексил аміну шляхом відновлення оксима 3-(R)-метилциклогексанону з подальшою реакцією поєднання аміну з 2-хлор-6,7-диметоксихіноксаліном в стандартних умовах. Аналітичний зразок кожного ізомеру отримують шляхом проведення препаративной ОФ-ВЕРХ. 300МГц 1Н-ЯМР і МС відповідають обом структурам, хоч близька стереохімія не може бути точно віднесена до циклогексил-вуглецю, що несе атом азоту. Приклад 32: Метил-цис/транс-4-(6,7диметоксихіноксалін-2-іл-окси) циклогексанкарбоксилат Вказану в заголовку сполуку отримують етерифікацією продукту Прикладу 19 стандартними методами. Т.пл.130-132°С. Аналіз для C18H22N2O5: обчислено С, 62,42; Н, 6,40; N, 8,09; знайдено: С, 62,60; Н, 6,55; N, 7,89. Приклад 1 проміжної сполуки: 4-бром-5метокси-бензол-1,2-діаміну дигідрохлорид До розчину ЕtOАс (50мл) і 5-бром-4-метокси-2нітро-феніламіну (2,5г, 10ммоль) в атмосфері аргону додають 5% Pd/C (0,5г). Реакційну суміш гідрують при 50фунт/кв.дюйм (3,515кг/см2) протягом 1 години. Отриману суміш фільтрують через целіт в розчин НСІ/lРА/EtOAc і шар промивають додатковою кількістю ЕtOАс. Отриманий осадок відфільтровують і отримують білу тверду речовину. Приклад 2 проміжної сполуки: 7-бром-6метоксихіноксалін-2-ол і 6-бром-7-метоксихіноксалін-2-ол До розчину МеОН (15мл) в атмосфері аргону додають порошкоподібні гранули NaOH (0,86г, 21ммоль) і дигідрохлорид 4-бром-5-метоксибензол-1,2-діаміну (2,7г, 9,3ммоль). Суміш перемішують протягом 10 хвилин, а потім порціями додають розчин 45% етилгліоксилату в толуолі (2,7г, 12ммоль). Реакційну суміш кип'ятять із зворотним холодильником протягом 1 години, а потім охолоджують. Після додання води, суспензію фільтрують. Отриману тверду речовину послідовно промивають Н2О, МеОН, ІРА і Еt2О з отриманням жовтого порошку. Приклад 3 проміжної сполуки: 7- бром-2-хлор6-метокси-хіноксалін і 6-бром-2-хлор-7метоксихіноксалін До суміші 7-бром-6-метокси-хіноксалін-2-олу і 6-бром-7-метокси-хіноксалін-2-олу (1г, 3,9ммоль) додають РОСl3 (5мл). Реакційну суміш кип'ятять із зворотним холодильником протягом 1 години, виливають в крижану воду, фільтрують і промивають водою з отриманням ясно-коричнюватої твердої речовини. Відношення 7-бром-2-хлор-6метоксихіноксаліну:6-бром-2-хлор-7метоксихіноксаліну становить приблизно 7:1, на що вказує 1H-ЯМР. Приклад 4 проміжної сполуки: 5-хлор-4метокси-2-нітро-анілін 39 До розчину N-(5-хлор-4-метокси-2нітрофеніл)ацетаміду (2г, 8,2ммоль) в 5н НСl (20мл) додають 1,4-діоксан (10мл) і суміш перемішують при 60°С протягом 1,5 годин. Реакційну суміш концентрують і розподіляють між EtOAc/2H NaOH. Водні шари промивають EtOAc (3Х), насиченим розчином солі, сушать (MgSO4), адсорбують на силікагелі і хроматографують (суміш 70% EtOAc/гексан) з отриманням оранжевого порошку. Приклад 5 проміжної сполуки: 4-хлор-5метокси-бензол-1,2-діаміну дигідрохлорид До розчину ЕtOАс (25мл) і 5-хлор-4-метокси-2нітрофеніламіну (1,6г, 1,9ммоль) в атмосфері аргону додають 5% Pd/C (0,5г). Реакційну суміш гідрируют при 50фунт/кв.дюйм (3,515кг/см2) протягом 1 години. Отриману суміш фільтрують через целіт в атмосфері N2 в розчин 1н НСІ/Еt2О в ЕtOАс і шар промивають додатковою кількістю ЕtOАс. Отриманий осадок відфільтровують і отримують білу тверду речовину. Приклад 6 проміжної сполуки: 7-хлор-6метоксихіноксалін-2-ол і 6-хлор-7метоксихіноксалін-2-ол До розчину дигідрохлориду 4-хлор-5-метоксибензол-1,2-діаміну (1,8г, 7,2ммоль) в ЕtOН (15мл) в атмосфері аргону додають TEA (2,5мл, 18ммоль) при 0°С. Суміш перемішують протягом 20 хвилин, а потім порціями додають розчин 45% етилгліоксилату в толуолі (2,1г, 9,3ммоль). Реакційну суміш нагрівають до кімнатної температури, кип'ятять із зворотним холодильником протягом 1,5 годин, а потім охолоджують, додають воду і суспензію фільтрують і послідовно промивають Н2О, ІРА і Et2O з отриманням ясно-жовтого порошку. Отриманий продукт декілька разів піддають азеотропній перегонці з толуолом і сушать у вакуумі перед використанням. Приклад 7 проміжної сполуки: 2,7-дихлор-6метоксихіноксалін і 2,6-дихлор-7-метоксихіноксалін До суміші 7-хлор-6-метоксихіноксалін-2-олу і 6хлор-7-метокси-хіноксалін-2-олу (1г, 4,7ммоль) в осушеній СаСl2 пробірці додають РОСl3 (5мл). Реакційну суміш кип'ятять із зворотним холодильником протягом ЗО хвилин, виливають в холодний насичений розчин NаНСО3, фільтрують, а потім промивають водою з отриманням твердої речовини. Відношення 2,7-дихлор-6метоксихіноксаліну:2,6-дихлор-7метоксихіноксаліну становить приблизно 6:1, на що вказує 1Н-ЯМР. Приклад 8 проміжної сполуки: (1S, 2S, 4R)норборніл-2-амін (3а): До розчину R-(+)-ендо-норборнеолу (2,24г, 20ммоль) в 20мл ТГФ при -78°С додають трифенілфосфін (6,55г, 25ммоль), фталімід (3,68г, 25ммоль) і діетилазодикарбоксилат (4,4мл, 28ммоль). Суміш перемішують при кімнатній температурі протягом ночі, а потім концентрують. Залишок хроматографують на силікагелі (суміш 20% етилацетат/гексан) з отриманням 4,6г (95%) (1S,2S,4R)-2-біцикло[2.2.1]гепт-2-іл-ізоіндол-1,3діону. (3b): Суміш (1S,2S,4R)-2-біцикло[2.2.1]гепт-2іл-ізоіндол-1,3-діону (1,2г, 5ммоль) і моногідратованого H2NNH2 (300мг, 6ммоль) в 10мл метанолу 76935 40 кип'ятять із зворотним холодильником протягом чотирьох годин, а потім концентрують досуху. Після екстракції метиленхлоридом (2 100мл), тверду речовину видаляють шляхом фільтрації. Після випаровування метиленхлориду отримують 300мг (54%) (1S,2S,4R)-норборніл-2-аміну. Приклад проміжної сполуки 9: екзобіцикло[2.2.1]гепт-5-ен-2-амін Екзо-біцикло[2.2.1]гепт-5-ен-2-амін отримують відповідно до процедур, описаних в прикладі проміжної сполуки 12, з 5-норборнен-2-олу через універсальну проміжну сполуку екзо-2біцикло[2.2.1]гепт-2-іл-ізоіндол-1,3-діону. Приклад проміжної сполуки 10: 2-метил-6,7диметокси-хіноксалін Вказану в заголовку сполуку отримують шляхом адаптації опублікованого методу [Tamao et al.. Tetrahedron, 1982, 38, 3347-3354]. До розчину ТГФ в атмосфері аргону додають 2-хлор-6,7диметоксихіноксалін (5г, 26ммоль) і NiCl2 (dppp)(0,14г, 0,26ммоль). Реакційну суміш охолоджують до 0°С і порціями додають 3М розчин MeMgBr в Εt2Ο (13мл, 39ммоль). Реакційну суміш нагрівають до кімнатної температури, перемішують протягом 1 години, а потім кип'ятять із зворотним холодильником протягом 1,5 годин. Суміш охолоджують, гасять 10% НСl, перемішують протягом 10 хвилин, а потім підлужують 5% NaOH. До реакційної суміші додають СН2Сl2 і Н2О і суміш перемішують протягом ночі. Потім додають ще СН2Сl2, Н2О і NaCl і суміш фільтрують. Отриманий розчин виливають в ділільну склянку і водні шари промивають СН2СІ2 (3X). Органічні шари об'єднують, промивають насиченим розчином солі, сушать (MgSO4), концентрують на силікагелі і хроматографують (суміш 50%-80% ЕtOАс/гексан) з отриманням оранжевої твердої речовини (вихід 49%). Приклад проміжної сполуки 11: 6,7-диметокси2-хіноксаліну карбоксальдегід У реакційну колбу в атмосфері аргону додають 1,4-діоксан (20мл), 2-метил-6,7диметоксихіноксалін (1,09г, 5,3ммоль) і SeO2 (1,8г, 16ммоль). Суміш нагрівають до 100°С протягом 2 годин 45 хвилин, охолоджують і фільтрують через целіт. Шар промивають порціями EtOAc і СН2СІ2. Отриманий розчин концентрують, розчиняють в суміші МеОН/СН2Сl2, завантажують на колонку з силікагелем і хроматографують (суміш 30% ЕtOАс/СН2Сl2) з отриманням не зовсім білої твердої речовини (вихід 73%). Приклад проміжної сполуки 12: (2-екзо, 5екзо)-5-аміно-біцикло[2.2.1]гептан-2-ацетат Екзо-5-ацетоксибіцикло[2.2.1]гептан-2-он і екзо-6-ацето-ксибіцикло[2.2.1]гептан-2-он отримують з біцикло[2.2.1]гепта-2,5-дієну відповідно до методу [R.Gagnon J.Chem.Soc.Perkin trans. I, 1505, 1995] з невеликими модифікаціями. До розчину екзо-5-ацетоксибіцикло[2.2.1] гептан-2-ону (350мг, 2,08ммоль) в 10мл ТГФ при кімнатній температурі додають розчин 1М борану/ТГФ (1,2мл, 1,2ммоль). Суміш перемішують протягом 0,5 години, а потім гасять при 0°С метанолом (3мл) і 1н НСl (1,5мл). Потім суміш екстрагують етилацетатом (3 30мл) і сушать сульфатом 41 магнію. Після фільтрації і концентрування, залишок хроматографують на силікагелі з отриманням (2-ендо, 5-екзо)-5- ацетоксибіцикло[2.2.1]гептан-2олу. До розчину (2-ендо, 5-екзо)-5-ацетоксибіцикло[2.2.1]-гептан-2-олу (350мг, 2,06ммоль) в ТГФ (10мл) додають фталімід (454мг, 3,09ммоль), трифенілфосфін (810мг, 3,09ммоль) і діетилазодикарбоксилат (0,49мл, 3,09ммоль) при 0°С. Реакційну суміш залишають на ніч для перемішування, а потім конденсують на роторному випарнику і залишок очищають колонковою хроматографією (суміш 20% етилацетат/гексан) з отриманням необхідного продукту у вигляді жовтої твердої речовини. Суміш вищезгаданої твердої речовини (300мг, 1ммоль) і гідразину (0,126мл, 2,2ммоль) в 5мл метанолу нагрівають із зворотним холодильником протягом шести годин. Після видалення метанолу, залишок екстрагують дихлорметаном (3 30мл). Після концентрування розчинників отримують (екзо, екзо)-5-амінобіцикло[2.2.1]гептан-2-ацетат (127мг, 75%), який використовують в реакції поєднання без додаткового очищення. Аналогічним образом, з відповідної початкової сполуки отримують (2-ендо, 5-екзо)-5амінобіцикло[2.2.1]гептан-2-ацетат, (2-ендо, 6екзо)-6-амінобіцикло[2.2.1]гептан-2-ацетат і (2екзо, 6-екзо)-6-амінобіцикло[2.2.1]гептан-2-ацетат. Приклад проміжної сполуки 13: 2- метокси-4,5діамінофенолу дигідрохлорид Вказану в заголовку сполуку отримують шляхом гідрування 2-метокси-4,5-динітрофенолу методом, [описаним Ehrlich et al., J.Org.Chem. 1947, 12, 522]. Приклад проміжної сполуки 14: 7-гідрокси-6метокси-хіноксалін-2-ол і 6-гідрокси-7метоксихіноксалін-2-ол Вказану в заголовку сполуку отримують з дигідрохлориду 4-метокси-5-гідроксибензол-1,2діаміну за допомогою реакції з NaOH і з етилгліоксилатом відповідно до процедури, описаної в Прикладі проміжної сполуки 2. Приклад проміжної сполуки 15: 7-гідрокси-6метокси-2-хлорхіноксалін і 6-гідрокси-7-метокси-2хлорхіноксалін Вказану в заголовку сполуку отримують з 7гідрокси-6-метокси-хіноксалін-2-олу і 6-гідрокси-7метокси-хіноксалін-2-олу реакцією з РОСl3 відповідно до процедури, описаної в Прикладі проміжної сполуки 3. Сполуки формули (І), описані в даний заявці, інгібують проліферацію клітин і/або продукування клітинного матрикса, і/або міграції клітин (хемотаксиса) за допомогою інгібування тирозинкіназної активності PDGF-R. Велике число патологічних станів викликається репродукуванням клітин, що неконтролюється, або над продукуванням клітинного матрикса, або поганою регуляцією запрограмованої загибелі клітин (апоптоза). Такі патологічні стани викликаються різними типами клітин, і прикладами таких станів є лейкоз, рак, гліобластома, псоріаз, запальні розлади, захворювання кісток, фіброзні захворювання, атеросклероз і порушення, виникаючі після ангіопластики коронарних, 76935 42 стегнових або ниркових артерій, або фібропроліферативні захворювання, такі як артрит, фіброз легенів, нирок і печінки. Зокрема, повідомлялося, що PDGF і PDGF-R беруть участь в індукуванні конкретних типів ракових захворювань і пухлин, таких як рак головного мозку, рак яєчника, рак товстої кишки, рак передміхурової залози, рак легенів, саркома Капоші і злоякісна меланома. Крім того, порушення регуляції клітинних проліферативних станів відбувається внаслідок хірургічної операції по коронарному шунтуванню. Очевидно, що інгібування тирозинкіназної активності виявиться ефективним для регуляції репродукування клітин, що неконтролюється або продукування клітинного матрикса, або поганого регулювання запрограмованої загибелі клітин (апоптоза). Даний винахід відноситься до модуляції і/або інгібуванню передачі клітинного сигналу, проліферації клітин і/або продукування позаклітинного матрикса, і/або міграції клітин (хемотаксиса); до регуляції аномального росту клітин і клітинної запальної відповіді. Більш конкретно, даний винахід відноситься до використання заміщених хінолінових і хиноксалінових сполук, які селективно інгібують диференціювання, проліферацію, продукування матрикса, хемотаксис або вивільнення медіатора шляхом ефективного інгібування тирозинкіназної активності рецептора тромбоцитарного фактора росту (PDGF-R). Ініціація самофосфорилювання, тобто, фосфорилювання самого рецептора фактора росту і фосфорилювання господаря внутрішньоклітинних субстратів являє собою деякі біохімічні процеси, які беруть участь в передачі клітинного сигналу, проліферації клітин, продукуванні клітинного матрикса, хемотаксисі і вивільненні медіатора. Завдяки ефективному інгібуванню Lckтирозинкіназної активності, сполуки даного винаходу можуть бути також використані для лікування резистентності до трансплантації і аутоімунних хвороб, таких як ревматоїдний артрит, неуважний склероз і системний червоний вовчак, відторгнення трансплантату, реакція "трансплантат проти господаря"; гіперпроліферативних порушень, таких як пухлини і псоріаз; і захворювань, при яких клітини отримують прозапалювальні сигнали, таких як астма, запальні захворювання кишечнику і панкреатит. При лікуванні резистентності до трансплантації, сполука даного винаходу може бути використана або в профілактичних цілях, або при продукуванні відповіді людського організму на небажану реакцію при трансплантації органа або тканині. При профілактичному використанні, сполуку даного винаходу вводять пацієнту або в тканину або орган перед операцією по трансплантації. Профілактичне лікування може також передбачати введення лікарського засобу після операції по трансплантації, але до вияву якихнебудь ознак небажаної відповіді на трансплантат. При введенні у відповідь на небажану реакцію, сполуку даного винаходу вводять безпосередньо пацієнту для придушення у нього резистентності до трансплантації після виявлення у нього зовнішніх ознак такої резистентності. 43 Відповідно до іншої своєї відмітної ознаки, даний винахід відноситься до способу інгібування тирозинкіназной активності PDGF, що передбачає контактування сполуки за п.1 формули винаходу з композицією, що містить тирозинкіназу PDGF. Відповідно до іншої своєї відмітної ознаки, даний винахід відноситься до способу інгібування тирозинкіназной активності Lck, що передбачає контактування сполуки за п.1 формули винаходу з композицією, що містить тирозинкіназу Lck. Відповідно до іншої своєї відмітної ознаки, даний винахід відноситься до способу лікування пацієнта, страждаючого розладом, або схильного до розладу, який може бути послаблений або попереджений шляхом введення інгібітору тирозинкіназної активності PDGF-R і/або тирозинкіназної активності Lck, і приклади якого приведені вище, де вказаний спосіб передбачає введення даному пацієнту ефективної кількості сполуки формули І або композиції, що містить сполуку формули І або її фармацевтично прийнятну сіль. Поняття "лікування", що використовується тут, потрібно розуміти як профілактичну терапію, а також як лікування вже встановлених розладів. В об'єм даного винаходу також входять фармацевтичні композиції, які включають фармацевтично прийнятну кількість, принаймні, однієї із сполук формули І в поєднанні з фармацевтично прийнятним носієм, наприклад, ад'ювантом, розріджувачем, покриттям і наповнювачем. На практиці, сполуки або композиції, призначені для лікування відповідно до даного винаходу, можуть бути введені в будь-якій відповідній формі, наприклад, шляхом інгаляції, місцево, парентерально, ректально або перорально, а більш переважно, перорально. Більш конкретними способами введення є внутрішньовенне введення, внутрішньом'язове введення, підшкірне введення, внутрішньоокове введення, інтрасиновіальне введення, введення через ободкову кишку, внутрішньочеревне введення, трансепителіальне введення, включаючи крізьшкірне введення, офтальмічне введення, введення під язик, трансбукальне введення, нанесення на шкіру, закапування в очі, інгаляцію через ніс шляхом інсуфляції і аерозольного введення. Сполуки формули І можуть бути отримані в формах, прийнятних для введення найбільш відповідним способом, а тому, даний винахід також відноситься до фармацевтичних композицій, що містять, принаймні ,одну сполуку даного винаходу, яка є відповідною для її використання як лікарський засіб для пацієнта. Такі композиції можуть бути отримані стандартними методами з використанням одного або декількох фармацевтично прийнятних ад'ювантів або наповнювачів. Такими ад'ювантами є, inter alia, розріджувачі, стерильні водні середовища, і різні нетоксичні органічні розріджувачі. Для отримання фармацевтично прийнятних препаратів, вказані композиції можуть бути присутніми в формі таблеток, драже, гранул, порошків, водних розчинів або суспензій, розчинів для ін'єкцій, еліксирів або сиропів, і можуть містити один або декілька агентів, вибраних з групи, що включає підсолоджувачі, такі як сахароза, лактоза, 76935 44 фруктоза, сахарин або Nutrasweet®, ароматизатори, такі як масло перцевої м'яти, вінтергренове масло, або вишнева або апельсинова віддушка, барвники або стабілізатори, таке як метил-або пропіл-парабен. Вибір носія і вмісту активної речовини в даному носії звичайно визначають в залежності від розчинності і хімічних властивостей даного продукту, конкретного способу введення і запобіжних заходів, що застосовуються в фармацевтичній практиці. Так, наприклад, для виготовлення таблеток, пастилок, драже, капсул і т.п.можуть бути використані наповнювачі, такі як лактоза, цитрат натрію, карбонат кальцію, дифосфат кальцію, і дезінтегратори, такий як крохмаль, альгінові кислоти і деякі комплексні силікагелі, об'єднані із замаслювачами, такими як стеарат магнію, лаурилсульфат натрію і тальк. Для виготовлення капсул переважно використати лактозу і рідкий носій, такий як високомолекулярні поліетиленгліколи. Різні інші матеріали можуть бути присутніми як покриття або для якої-небудь іншої модифікації фізичної форми стандартної дози. Так, наприклад, таблетки, драже або капсули можуть бути покриті шелаком, цукром або тим і іншим. Якщо використовуються водні суспензії, то вони можуть містити емульгатори або агенти, сприяючі суспендуванню. Можуть бути також використані розріджувачі, такі як сахароза, етанол, поліоли, такі як поліетиленгліколь, пропіленгліколь і гліцерин, і хлороформ або їх суміші. Крім того, активна сполука може бути введена в препарати і композиції пролонгованого вивільнення. Для перорального введення, активна сполука може бути приготована, наприклад, з інертним розріджувачем або відповідним харчовим носієм, або вона може бути включена в жорсткі або м'які желатинові капсули, або вона може бути спресована в таблетки, або вона може бути включена безпосередньо в їжу, або вона може бути включена разом з наповнювачем і використана в формі таблеток для прийому всередину, таблеток для повільного розчинення в щічній кишені, пастилок, капсул, еліксирів, суспензій, сиропів, облаток і т.п. Для парентерального введення використовують емульсії, суспензії або розчини сполук даного винаходу в рослинному маслі, такому як, наприклад, кунжутне масло, арахісове масло або оливкова олія, або у водно-органічних розчинах, таких як вода і пропіленгліголь, в органічному складному ефірі для ін'єкції, такому як етилолеат, а також в стерильних водних розчинах фармацевтично прийнятних солей. Форми для ін'єкції повинні бути рідкими до тієї міри, при якій вони можуть бути легко введені шприцом, і відповідна текучість може підтримуватися, наприклад, за допомогою покриття, такого як лецетин, шляхом збереження необхідного розміру часток у випадку дисперсії і шляхом використання поверхово-активних речовин. Пролонгована абсорбція композицій для ін'єкції може бути досягнута шляхом використання агентів, що сповільнюють абсорбцію, наприклад, моностеарату алюмінію і желатину. Розчини солей вказаних продуктів даного винаходу є особливо придатними для введення шляхом внутрішньом'я 45 зової або підшкірної ін'єкції. Розчини активної сполуки у вигляді вільної основи або фармакологічно прийнятної солі можуть бути отримані у воді, відповідним чином змішаної з поверхово-активною речовиною, такою як гідроксипропілцелюлоза. Дисперсії можуть бути також отримані в гліцерині, в рідких поліетиленгліколях і їх сумішах і в маслах. Водні розчини, також що містять розчини солей в чистій дистильованій воді, можуть бути використані для внутрішньовенного введення при умові, що їх рН відповідним чином скоригований, що вони відповідним чином забуферені і зроблені ізотонічними з використанням достатньої кількості глюкози або хлориду натрію, і що вони є стерилізованими нагріванням, опроміненням, мікрофільтрацією і/або різними антибактерійними і протигрибковими агентами, наприклад, парабенами, хлорбутанолом, фенолом, сорбіновою кислотою, тимерозалом і т.п. Стерильні розчини для ін'єкції отримують шляхом включення активної сполуки в необхідній кількості у відповідний розчинник з різними іншими інгредієнтами, перерахованими вище, якщо це необхідне, з подальшою стерилізацією шляхом фільтрації. Звичайно, дисперсії отримують шляхом включення різних стерилізованих активних інгредієнтів в стерильний носій, що містить основне дисперсійне середовище і необхідні інші інгредієнти з числа інгредієнтів, перерахованих вище. У випадку стерильних порошків для отримання стерильних розчинів для ін'єкції, переважними методами такого отримання є сушка у вакуумі і ліофілізація, внаслідок яких отримують порошок активного інгредієнта в поєднанні з яким-небудь іншим потрібним інгредієнтом, отриманим з його заздалегідь відфільтрованого в стерильних умовах розчину. Для місцевого застосування можуть бути використані гелі (на основі води або спирту), креми або мазі, що містять сполуки даного винаходу. Сполуки даного винаходу можуть бути також включені в гель або в основу-підкладку для нанесіння у вигляді пластиру, який дозволяє регулювати вивільнення сполуки через трансдермальний бар'єр. Для введення шляхом інгаляції, сполуки даного винаходу можуть бути розчинені або суспендовані в носії, відповідному для використання в аерозольному інгаляторі, в суспензії або в розчині, приготованих у вигляді аерозолю, або вони можуть абсорбовані або адсорбовані на відповідному твердому носії для використання в інсуфляторі. Твердими композиціями для ректального введення є супозиторії, приготовані відомими методами і що містять, принаймні, одну сполуку формули І. Сполуки даного винаходу можуть бути також приготовані так, щоб вони не могли бути швидко виведені через стінку судин (артеріальних або венозних) шляхом конвекції і/або дифузії, що буде сприяти збільшенню часу знаходження вірусних часток в потрібній дільниці дії. Для пролонгованого вивільнення може бути використане періадвентиціальне депо, що містить сполуки даного винаходу. Одним з таких депо, відповідних для введення сполук даного винаходу, може бути співполімерна 76935 46 матриця, така як співполімер етиленувінілацетату, або гель на основі полівінілового спирту, оточений оболонкою з силастику. Альтернативно, сполука даного винаходу може бути введена шляхом локального постачання з силіконового полімеру, імплантованого в адвентицію. Альтернативний спосіб мінімізації виведення сполуки даного винаходу під час крізьшкірної, трансваскулярної доставки передбачає використання недифундованих мікрочасток, що вивільняють лікарський засіб. Ці мікрочастки можуть бути включені в різні синтетичні полімери, такі як, наприклад, полілактид, або природні речовини, включаючи білки або полісахариди. Такі мікрочастки можуть бути піддані стратегічній зміні параметрів, включаючи загальну дозу лікарського засобу і кінетику його вивільнення. Мікрочастки можуть бути ефективно ін'єковані в стінки артерій або вен через пористий балонний катетер або балон, встановлений на стенті і утримуватися в стінці судини або в періадвентиціальній тканині протягом, принаймні, приблизно двох тижнів. Композиції і методика для локальної, внутрішньовенної місцеспецифічної доставки терапевтичних агентів обговорюється [в роботі Reissen et al., J.Am.Coll.Cardiol. 1994; 23: 1234-1244], повний вміст якої вводиться в даний опис за допомогою посилання. Композиція даного винаходу може також містити гідрогель, який отримують з будь-якого біологічно сумісного або не-цитотоксичного (гомо- або гетеро)-полімеру, такого як полімер гідрофільної полікрилової кислоти, який може функціонувати як губка, що абсорбує лікарський засіб. Такі полімери були описані, [наприклад, в заявці WO93/08845], повний вміст якої вводиться в даний опис за допомогою посилання. Деякі з цих полімерів, а зокрема, полімери, що отримуються з етилен- і/або пропіленоксиду, є коммерційно доступними. При використанні сполук даного винаходу для лікування патологій, асоційованих з гіперпроліферативними розладами, вказані сполуки даного винаходу можуть бути введені різними способами. Для лікування рестенозу, сполуки даного винаходу вводять безпосередньо в стінки кровоносних судин за допомогою балона для ангіопластики, покритого гідрофільною плівкою (наприклад, гідрогелем), яку насичують вказаною сполукою, або за допомогою якого-небудь іншого катетера, що містить інфузійну камеру для даної сполуки, який, таким чином, може бути введений безпосередньо в дільницю, що j піддається лікуванню, і який дозволяє даній сполуці локально і ефективно вивільнятися в місці знаходження клітин, що піддаються лікуванню. Перевага даного способу введення полягає в тому, що він дає можливість вказаній сполуці швидко контактувати з клітинами, потребуючими лікування. Спосіб лікування відповідно до даного винаходу передбачає введення сполуки даного винаходу в дільницю, що піддається лікуванню. Так, наприклад, гідрогель, що містить композицію, може бути нанесений безпосередньо на поверхню тканини, що піддається лікуванню, наприклад, в процесі хірургічного втручання. Гідрогель, переважно, 47 вводять в потрібну внутрішньосудинну дільницю шляхом покриття їм катетера, наприклад, балонного катетера, і доставки в стінку судини, переважно, під час ангіопластики. В особливо переважному способі, насичений гідрогель вводять в дільницю, що піддається лікуванню, за допомогою балонного катетера. Оскільки катетер проштовхують в напрямі до потрібної судини, то для мінімізації втрати лікарського засобу після того, як цей катетер буде введений в кровоток, вказаний балон може бути покритий захисною оболонкою. В інших варіантах свого здійснення, даний винахід відноситься до сполуки, що вводиться за допомогою балонів для перфузії. Ці балони для перфузії, які дають можливість підтримувати кровоток і таким чином, знижувати ризик виникнення ішемії міокарда, після роздування балона, також дозволяють вказаній сполуці безпосередньо взаємодіяти з потрібною дільницею при нормальному тиску протягом відносно тривалого проміжку часу, тобто, більше, чим двадцять хвилин, який може виявитися необхідним для її оптимальної дії. Альтернативно, може бути використаний балонний катетер з системою каналів ["каналізований балонний катетер для ангіопластики", Mansfield Medical, Boston Scientific Corp., Watertown, MA]. Цей катетер складається з стандартного балона, покритого шаром з 24 перфорованих каналів, якими перфузуються за допомогою незалежної порожнини через додатковий отвір для інфузії. Різні типи балонних катетерів, подвійний балонний катетер, пористий балонний катетер, мікропористий балонний катетер, канальний балонний катетер, балонний катетер на стенті і гідрогелевий катетер, кожний з яких може бути використаний для здійснення даного винаходу, описані в [роботі Reissen і інш. (1994)], повний вміст якої вводиться в даний опис за допомогою посилання. Використання перфузійного балонного катетера є особливо переважним, оскільки він має ту перевагу, що при його застосуванні одночасно досягається підтримання балона в роздутому стані протягом тривалого періоду часу при збереженні властивостей, що полегшують ковзання, і місцеспецифічність гідрогелю. В іншому своєму аспекті, даний винахід відноситься до фармацевтичної композиції, що містить сполуки даного винаходу і полоксамер, такий як Полоксамер 407, який є комерційно доступним нетоксичним біологічно сумісним поліолом (BASF, Parsippany, NJ). Полоксамер, просочений сполукою даного винаходу, може бути нанесений безпосередньо на поверхню тканини, що піддається лікуванню, наприклад, в процесі хірургічного втручання. Полоксамер володіє, в основному, тими ж перевагами, що і гідрогель, але має більш низьку в'язкість. Особливо переважним є використання канального балонного катетера з полоксамером, просоченим сполукою даного винаходу. У цьому випадку, він має ту перевагу, що при його використанні одночасно досягається підтримання балона в роздутому стані протягом тривалого періоду часу при збереженні властивостей, що поле 76935 48 гшують ковзання, і місце-специфічність полоксамеру. Процентний вміст активного інгредієнта у вказаних композиціях даного винаходу може варіюватися, але при цьому, необхідно, щоб цей вміст був таким, який дозволяв би отримати потрібну дозу. Очевидно, що деякі разові лікарські форми можуть бути введені приблизно в один і той же час. Доза, що використовується може бути визначена лікарем або кваліфікованим фахівцем-медиком і залежить від бажаного терапевтичного ефекту, способу введення, тривалості лікування і стану пацієнта. Для дорослих, вказані дози, що вводяться шляхом інгаляції, звичайно, складають від близько 0,001 до близько 50, а переважно, від близько 0,001 до близько 5мг/кг маси тіла на день, дози, що вводяться перорально складають від близько 0,01 до близько 100, переважно, від близько 0,1 до близько 70 а більш переважно, від 0,5 до 10мг/кг маси тіла на день, а дози, що вводяться внутрішньовенно складають від близько 0,001 до близько 10, а переважно, від 0,01 до 10мг/кг маси тіла на день. У кожному конкретному випадку, вказані дози визначають в залежності від чинників, індивідуальних для кожного пацієнта, що піддається лікуванню, такого як вік, вага, загальний стан здоров'я і інші характеристики, які впливають на ефективність сполуки даного винаходу. Сполуки/композиції даного винаходу можуть бути введені з частотою, необхідною для отримання потрібного терапевтичного ефекту. Деякі пацієнти можуть швидко реагувати на більш високі або більш низькі дози і можуть набагато гірше витримувати адекватні дози. Для інших пацієнтів, може виявитися необхідним тривалий курс лікування при частоті введення 1-4 доз на день відповідно до фізіологічної потреби для кожного конкретного пацієнта. В основному, активний продукт може бути введений перорально 1-4 рази на день. Само собою зрозуміло, що для інших пацієнтів може бути необхідне призначення не більше за одну або двох доз на день. Сполуки даного винаходу можуть бути також приготовані для їх використання в поєднанні з іншими терапевтичними агентами, або разом із застосуванням терапевтичних методів, направлених на фармакологічні стани, які можуть бути поліпшені з використанням сполуки формули І, як це описано нижче. Сполуки даного винаходу можуть бути використані для лікування рестенозу після ангіопластики з використанням будь-якого пристрою, такого як балонний, абляційний або лазерної техніки. Сполуки даного винаходу можуть бути використані для лікування рестенозу після вміщення стешу в судинну систему або як 1) попереднє лікування для блокування судин, або 2) у випадку, коли ангіопластика з використанням якого-небудь пристрою не ефективна для артерій пацієнта. Сполуки даного винаходу можуть бути використані або перорально, або парентерально, або дана сполука може бути використана місцево шляхом її включення в спеціальний пристрій або шляхом її застосування у вигляді композиції, нанесеної на стент як покриття. 49 В одному з аспектів даного винаходу, покриття на стент здійснюють шляхом нанесення полімерного матеріалу, в який вводять сполуки даного винаходу, принаймні, на одну поверхню даного стенту. Полімерними матеріалами, придатними для введення сполуки даного винаходу, є полімери, що володіють відносно низькими технологічним температурами, такі як полікапролактон, співполімер полі(етилен-вінілацетат) або полі(вінілацетат) або силіконова ненаповнена гумова суміш і полімери, що має аналогічні відносно низькі технологічні температури. Іншими придатними полімерами є полімери, що не розкладаються, здатні перенести і доставляти терапевтичні лікарські засоби, такі як латекси, уретани, полісилоксани, блокспівполімери стиролу-етилену/бутилену-стиролу (SEBS) і біологічно розкладальні полімери, полімери, що біологічно абсорбуються, здатні здійснювати перенесення і доставку терапевтичних лікарських засобів, такі як полі-DL-молочна кислота (DL-PLA) і полі-L-молочна кислота (L-PLA), складні поліортоефіри, поліімінокарбонати, аліфатичні полікарбонати і поліфосфазени. У полімер, навантажений лікарським засобом, може бути також введений і пороутворювач шляхом його додання в полімер разом з терапевтичним лікарським засобом з метою утворення пористої навантаженої лікарським засобом полімерної мембрани. "Пороутворювач" означає будь-яку частку, таку як, наприклад, мікрогранула з хлориду натрію, лактози або натрій-утримуючого гепарину, яка буде розчинятися або яким-небудь іншим способом розкладатися при її - зануренні в фізіологічну рідину, створюючи при цьому пористу сітку в даному полімерному матеріалі. Звичайно, пори, залишені такими пороутворювачами, можуть складати до 10 мікрон. Пори, що утворюються пороутворювачами, такими як, наприклад, поліетиленгліколь (ПЕГ), співполімери поліетиленоксиду/поліпропіленоксиду (ПЕО/ППО), можуть бути також меншими, ніж один мікрон, хоч для утворення пір, менших одного мікрона можуть бути також використані і інші подібні матеріали, які сприяють розділенню фаз в безперервно навантаженому лікарським засобом полімерному матриксі і можуть бути потім виведені з фізіологічною рідиною організму. Даний полімерний матеріал може бути нанесений на, стент, а терапевтичний лікарський засіб і пороутворюючий матеріал містяться в полімерному матеріалі, що дозволяє вказаному пороутворювачу розчинятися або розкладатися під дією фізіологічних рідин, якщо стент вміщений в кровоносній судині, або альтернативно, вказаний пороутворювач може бути розчинений і видалений з полімерного матеріалу з утворенням пір в цьому полімерному матеріалі безпосередньо перед вміщенням цього полімерного матеріалу, об'єднаного зі стентом, в кровоносну судину. Якщо необхідно, то для обмеження швидкості вивільнення сполуки даного винаходу, зверху навантаженого лікарським засобом полімеру може бути нанесена мембрана, регулююча швидкість вивільнення. Вказана швидкість-регулююча мембрана може бути додана шляхом нанесення пок 76935 50 риття з утворенням розчину або шляхом ламінування. Мембрана, що обмежує швидкість, нанесена зверху полімерного матеріалу, може бути сформована так, щоб вона включала в себе однорідну дисперсію пороутворювача, а пороутворювач в даній мембрані, що обмежує швидкість може бути розчинений з утворенням в ній пір, що складають, наприклад, максимум 10 мікрон, або, принаймні, 1 мікрон, хоча ці пори можуть мати розмір менший, ніж 1 мікрон. Пороутворювачем у вказаній мембрані, що обмежує швидкість може бути, наприклад, хлорид натрію, лактоза, що натрій-вмісний гепарин, поліетиленгліколь, співполімери поліетиленоксиду/поліпропіленоксиду і їх суміші. В іншому аспекті, покриття на стенті може бути утворене шляхом нанесення сполуки даного винаходу, принаймні, на одну поверхню даного стенту з утворенням біологічно активного шару з подальшим нанесенням одного або декількох покриттів пористого полімерного матеріалу зверху цього біоактивного шару, так, щоб цей пористий полімерний матеріал мав адекватну товщину для забезпечення регульованого вивільнення вказаної сполуки. Вказаний пористий полімерний матеріал може складатися з поліаміду, парилену або париленового похідного, нанесеного шляхом осадження з парової фази, що не містить каталізатора. Термін "парилен" означає полімер на основі п-ксилілену, отриманий шляхом полімеризації в паровій фазі, як описано [в патенті США №5824049], що вводиться в даний опис за допомогою посилання. Альтернативно, вказаний пористий полімерний матеріал може бути нанесений осадженням з плазми. Характерними полімерами, придатними для осадження з плазми, є полі (етиленоксид), полі(етиленгліколь), полі(пропіленоксид) і полімери метану, силікону, тетрафторетилентетраметилдисилоксана і т.п. Іншими придатними полімерними системами є полімери, що походять від мономерів, що фотополімеризуються таких як рідкі мономери, переважно, що мають, принаймні, два перехреснозшиті СС (вуглець-вуглецеві) подвійні зв'язки, і що являють собою негазоподібну етилено-ненасичену сполуку, що ступінчасто полімеризується, яка має температуру кипіння вище за 100°С при атмосферному тиску, і молекулярну масу приблизно 1001500, і здатну легко утворювати високомолекулярний полімер при ступінчастій полімеризації. Більш переважним мономером є поліетиленоненасичений складний ефір акрилової або метакрилової кислоти, що отримується шляхом ступінчастої фотополімеризації і що містить дві або декілька акрилатних або метакрилатних груп на молекулу, або його суміші. Характерними прикладами таких багатофункціональних акрилатів є діакрилат етиленгліколю, диметакрилат етиленгліколю, триакрилат триметилпропану, триметилакрилат триметилпропану, тетраакрилат пентаеритриту або тетраметакрилат пентаеритриту, диметакрилат 1,6-гександіолу і диметакрилат діетиленгліколю. У деяких конкретних випадках можуть бути також використані моноакрилати, такі як н 51 бутилакрилат, н-бутилметакрилат, 2етилгексилакрилат, лаурил-акрилат і 2-гідроксипропілакрилат. Можуть бути також використані невеликі кількості амідів (мет)акрилової кислоти, таких як бутиловий ефір N-метилолметакриламіду. Придатними також є N-вінілові сполуки, такі як Nвінілпіролідон, вініловий ефір аліфатичних монокарбонових кислот, таких як вінілолеат, вініловий ефір діолів, такий як бутандіол-1,4-дивініловий ефір і аліловий ефір, і аліловий складний ефір. Можуть бути також використані і інші мономери, такі як продукти реакцій ди- або поліепоксидів, таких як бутандіол-1,4-дигліцидилового ефіру або дигліцидилового ефіру бісфенолу А, з (мет)акриловою кислотою. Параметри середовища для диспергування рідини, що фотополімеризується можуть бути модифіковані для конкретних цілей шляхом відповідного вибору мономерів або їх сумішей. Інші відповідні полімерні системи включають полімери, які є біологічно сумісними і мінімізують роздратування стінок судин при імплантуванні стенту. Цей полімер може бути біологічно стабільним або полімером, що біологічно абсорбується в залежності від потрібної швидкості вивільнення або від потрібної міри стабільності полімеру. Полімерами, що біологічно абсорбуються, які можуть бути використані, є полі(L-молочна кислота), полікапролактон, полі(лактид-спів-гліколид), полі(гідроксибутират), полі(гідроксибутират-співвалерат), полідіоксанон, поліортоефір, поліангідрид, полі(гліколева кислота), полі(D,L-молочна кислота), полі(гліколева кислота-співтриметиленкарбонат), поліфосфоефір, поліфосфоефіруретан, полі(амінокислоти), ціаноакрилати, полі(триметилен-карбонат), полі(імінокарбонат), співполімер простого ефіру-складного ефіру (наприклад, PEO/PLA), поліалкіленоксалати, поліфосфазени і біомолекули, такі як фібрин, фібриноген, целюлоза, крохмаль, колаген і гіалуронова кислота. Можуть бути також використані біологічно стабільні полімери з відносно низьким і постійним рівнем впливу на тканини, такі як поліуретани, силікони і поліефіри, і можуть бути також використані інші полімери, в тому випадку, якщо вони можуть розчинятися і затверджуватися або полімеризуватися на стенті, такі як поліолефіни, поліізобутилен і співполімери етилену-альфа-олефіну; полімери і співполімери акрилової кислоти, полімери і співполімери вінілгалогеніду, такі як полівінілхлорид; полівінілові ефіри, такі як полівінілметиловий ефір; полівініліденгалогеніди, такі як полівініліденфторид і полівініліденхлорид; поліакрилонітрил, полівінілкетони, полівінілові ароматичні сполуки, такі як полістирол, полівінілові ефіри, такі як полівінілацетат; співполімери вінілових мономерів один з одним і олефінами, такі як співполімери етиленуметилметакрилату, співполімери акрилонітрилстиролу, смоли ABS і співполімери етиленувінілацетату; поліаміди, такі як Найлон 66 і полікапролактам; алкілові смоли, полікарбонати; поліоксиметилени; полііміди, поліефіри; епоксидні смоли, поліуретани; штучне волокно, триацетатне штучне волокно; целюлоза, ацетат целюлози, бутират целюлози; бутират-ацетат целюлози; цело 76935 52 фан, нітрат целюлози; пропіонат целюлози; ефіри целюлози; і карбоксиметилцелюлоза. Крім осадження з плазми і осадження з парової фази, для нанесення різних покриттів на поверхню стентау можуть бути застосовані інші методи. Так, наприклад, полімерний розчин може бути нанесений на стент, який потім залишають для випаровування розчинника, внаслідок чого на поверхні стенту буде утворюватися покриття з вказаного полімеру і терапевтичної речовини. Звичайно розчин може бути нанесений на стент або шляхом напилювання розчину на цей стент, або шляхом занурення цього стенту в розчин. Сполуки даного винаходу можуть бути використані для лікування рестенозу в комбінації з будьким з протизгортальних, антитромбоцитарних, антитромботичних або профібрінолітичних агентів. У більшості випадків, для безпечного здійснення процедури хірургічного втручання або для попередження небажаних ефектів внаслідок утворення тромбів, пацієнтам до, під час і після хірургічної операції, вводять агенти вказаних класів. Деякими прикладами відомих класів протизгортальних, антитромбоцитарних, антитромботичних і профібрінолітичних агентів є будь-які композиції гепарину, низькомолекулярних гепаринів, пентасахаридів, антагоністів рецептора фібріногену, інгібіторів тромбіну, інгібіторів фактора Ха або інгібіторів фактора Vlla. Сполуки даного винаходу можуть бути використані в комбінації з будь-яким гіпотензивним агентом або агентом, що знижує рівень холестерину або ліпіду, для лікування рестенозу або атеросклерозу одночасно з лікуванням станів, що характеризуються високим кров'яним тиском або атеросклерозом. Деякими прикладами агентів, які можуть бути використані для лікування станів, що характеризуються високим кров'яним тиском, є сполуки нижченаведених класів: бета-блокатори, інгібітори АСОВІ, антагоністи кальцієвих каналів і антагоністи альфа-рецепторів. Деякими прикладами агентів, які можуть бути використані для лікування станів, що характеризуються підвищеним рівнем холестерину або порушенням рівнів ліпідів, є сполуки, відомі як інгібітори HMGCoA-редуктази, сполуки класів фібратів. Сполуки даного винаходу можуть бути використані для лікування різних форм рака, або окремо, або в комбінації із сполуками, про які відомо, що вони можуть бути використані для лікування рака. Потрібно зазначити, що даний винахід включає комбінації сполук даного винаходу з одним або декількома вищезазначеними терапевтичними агентами даного класу. Сполуки, що входять в об'єм даного винаходу, володіють помітною фармакологічною активністю відповідно до тестів, описаних в літературі, які з всією очевидністю вказують на кореляцію з фармакологічною активністю у людини і інших ссавців. Результати описаних нижче фармакологічних in vitro і in vitro-тестів є типовими для репрезентативних сполук даного винаходу. Отримання фармацевтичних композицій і зрізів для фармакологічних тестів 53 Сполуки, що входять в об'єм даного винаходу, володіють значною активністю як інгібітори протеїнтирозинкінази і терапевтичною цінністю як агенти, що запобігають проліферації клітин, і можуть бути використані для лікування деяких станів, включаючи псоріаз, атеросклероз і пошкодження при рестенозі. Сполуки, що входять в об'єм даного винаходу, виявляють модуляцію і/або інгібування передачі клітинного сигналу і/або проліферації клітин і/або продукування позаклітинного матрикса і/або хемотаксиса і/або клітинної запальної відповіді, і можуть бути використані для попередження або сповільнення виникнення або рецидиву таких станів або якого-небудь іншого терапевтичного впливу на даний стан. Для визначення ефективності сполуки даного винаходу були використані фармакологічні тести, описані нижче, які застосовуються фахівцями і які, як відомо, корелюють з фармакологічною активністю у ссавців. Сполуки, що входять в об'єм даного винаходу, були піддані вказаним різним тестам, і отримані результати явно корелювали з потрібною активністю медіатора клітинного диференціювання. Результати вказаних тестів, очевидно, дають інформацію, достатню для того, щоб фахівці в області фармакології і медичної хімії могли визначити параметри для використання сполук, що досліджуються в одному або декількох типів терапії, описаних в даний заявці. 1. ELISΑ-аналіз на самофосфорилювання тирозинкінази PDGF-R Вказаний в заголовку аналіз здійснюють як описано в [роботі Dolle і ін., J.Med.Chem. 1994, 37, 2627], яка вводиться в даний опис за допомогою посилання, за винятком того, що в цьому випадку використовують клітинні лізати, що походять від клітин гладкого м'яза аорти людини (HAMSC), як описано нижче. 2. Загальна методика аналізу на мітогенез a. Культивування клітин Клітини гладкого м'яза аорти людини (пасаж 49) висівали в 96-лункові планшети в середовищі, підтримуючому ріст клітин, при 6000 клітин/лунка і залишали для росту на 2-3 дні. Після досягнення приблизно 85% конфлюентності, ріст клітин припиняли шляхом додавання безсироваткового середовища (SFM). b. Аналіз на мітогенез Через 24 години, при виснаженні сироватки, середовище видаляли і замінювали сумішшю сполуку/носій, що тестується в SFM (200мкл/лунка). Сполуки солюбілізували в клітинній культурі в ДМСО при концентрації 10мМ, а подальше розведення здійснювали в SFM. Після 30-хвилинного попереднього інкубування із сполукою, клітини стимулювали PDGF при концентрації 10нг/мл. Визначення проводили в дублікаті зі стимульованими і нестимульованими лунками при кожній концентрації сполуки. Через чотири години додавали 1мкКи 3Нтімідину/лунка. Культивування припиняли через 24 години після додавання фактора росту. Клітини відділяли трипсином і збирали на фільтрувальний мат з використанням автоматичного збірника клітин 76935 54 (Wallac MachII96). Клітини на цьому фільтрувальному маті підраховували в сцинтиляційному лічильнику (Wallac Betaplate) для визначення мітки з включеною ДНК. 3. Аналіз на хемотаксис Клітини гладкого м'яза аорти людини (HASMC) при більш ранніх пасажах отримували з АТСС. Клітини культивували в Clonetics SmGM 2 SingleQuots (використали середовища і клітини в пасажах 4-10). При досягненні клітинами 80% конфлюентності, в середовище додавали флуоресцентний зонд, кальцеїн ДМ (5мМ, Molecular Probe) і клітини інкубували протягом 30 хвилин. Після промивки фізіологічним розчином, забуференим HEPES, клітини відділяли трипсином і нейтралізували буфером MCDB 131 (Gibco) з 0,1% BSA, 10мМ глютаміном і 10% фетальною бичачою сироваткою. Після центрифугування клітини промивали ще один раз і ресуспендували в тому ж самому буфері без фетальної бичачої сироватки при концентрації 30000 клітин/50мл. Клітини інкубували з різними концентраціями сполуки формули І (кінцева концентрація ДМСО =1%) протягом 30 хвилин при 37°С. Для дослідження хемотаксису використали 96-лункові модифіковані камери Бойдена (Neuroprobe, Inc.) і полікарбонатну мембрану з розміром пір 8 mm (Poretics, CA). Вказану мембрану сенсибілізували колагеном (Sigma С3657, 0,1мг/мл). У нижню частину камери вміщували PDGF-PP (3нг/мл) в буфері із сполукою формули І і без неї. У верхню частину камери вміщували клітини (30000) з інгібітором і без інгібітору. Клітини інкубували протягом 4 годин. Фільтрувальну мембрану знімали і клітини на верхній стороні мембрани видаляли. Після сушки флуоресценцію на мембрані визначали з використанням Cytofluor II (Millipore) при довжинах хвиль збудження/випромінювання 485/530нм. У кожному експерименті середню міграцію клітин отримували від шести повторень. Визначали процент інгібування по відношенню до ДМСО-обробленого контролю. ІС5о обчислювали по п'яти точках для величин інгібування в залежності від концентрації. Результати представлені як середнє ± ср.кв.ош. для п'яти таких експериментів. 4. Очищення EGF-рецептора Очищення EGF-рецептора здійснювали відповідно до методики Yarden & Schlessinger. Клітини А431 культивували в 80см2-судинах до конфлюентності (2 107клітин на судину). Ці клітини двічі промивали PBS і збирали з використанням PBS, що містить 11,0ммоль EDTA (1 година при 37°С), і центрифугували при 600г протягом 10 хвилин. Потім клітини солюбілізували в 1мл на 2 107клітин холодного буфера для солюбілізації (50ммоль буферу Hepes, рН7,6, 1% Тритон Х-100, 150ммоль NaCl, 5ммоль EGTA, 1ммоль PMSF, 50мг/мл апротиніну, 25ммоль бензамідину, 5мг/мл лейпептину і 10мг/мл інгібітору соєвого трипсину) протягом 20 хвилин при 4°С. Після центрифугування при 100000г протягом 30 хвилин, супернатант завантажували на колонку з WGA-агарозою (100мл упакованої смоли на 2 107клітин) і струшували протягом 2 годин при 4°С. Неабсорбований матеріал видаляли і смолу двічі промивали буфером ΗΤΝ 55 (50ммоль Hepes, рН7,6, 0,1% Тритон Х-100, 150ммоль NaCl), двічі промивали буфером HTN, що містить 1М NaCl, і двічі промивали буфером HTNG (50мМ Hepes, рН7,6, 0,1% Тритон Х-100, 150ммоль NaCl і 10% гліцерину). Рецептор EGF піддавали періодичному елююванню буфером HTNG, що містить 0,5Μ N-ацетил-D-глюкозамін (200мл на 2 107 клітин). Проелюйований матеріал зберігали в аліквотах при -70°С і перед використанням розводили буфером TMTNG (50мМ TpисMes-буфер, рН7,6, 0,1% Тритон Х-100, 150ммоль NaCl, 10% гліцерину). 5. Інгібування автофосфорилювання EGF-R Клітини А431 культивували до конфлюентності в чашках для культивування тканин, сенсибілізованих фібронектином людини. Після промивки (2 рази) охолодженим льодом PBS, клітини лізували додаванням 500мл/чашка буфера для лізісу (50ммоль Hepes, рН7,5, 150ммоль NaCl, 1,5ммоль MgCl2, 1ммоль EGTA, 10% гліцерину, 1% Тритон ΦΘ 00, 1ммоль PMSF, 1мг/мл апротиніну, 1мг/мл лейпептину) і інкубуванням протягом 5 хвилин при 4°С. Після стимуляції EGF (500мг/мл, 10 хвилин при 37°С), імунопреципітацію здійснювали з використанням антитіла проти EGF-R (Ab 108) і реакцію автофосфорилювання зразка (50мл-аліквоти, 3мКи [g-32P]ATP) проводили в присутності 2 або 10мМ сполуки даного винаходу протягом 2 хвилин при 4°С. Реакцію припиняли додаванням гарячого буфера для електрофорезу зразка. Проводили аналіз методом електрофорезу в ПААГ з ДСН (7,5%) з подальшою авторадіографією, і реакцію кількісно оцінювали шляхом денситометричного сканування рентгенівських плівок. а. Культивування клітин Клітини, позначені HER 14 і К721А, отримували шляхом трансфекції клітин NIH3T3 (клон 2.2)(від C.Fryling, NCI, NIH), в яких були відсутні ендогенні EGF-рецептори, кДНК-конструкцією EGF-рецептора дикого типу або мутантного EGFрецептора, у якої була відсутня тирозинкіназна активність (де Lys 721 в АТР-зв'язуючому сайті замінений на залишок Ala, відповідно). Всі ці клітини культивували в DMEM з 10% сироваткою теляти (Hyclone, Logan, Utah). 6. Селективнсть по відношенню до РКА і РКС визначали з використанням комерційних наборів: a. Набір для колориметричного аналізу РКА, Pierce Colorimetric РКА Assay Kit, Spinzyme Format Короткий протокол: 1од. ферменту РКА (бичачого серця)/аналітична пробірка Пептидний субстрат Кемпептид (мічений барвником) 45 хвилин при 30°С оптична щільність при 570нм b. Набір для колориметричного аналізу РКА, Pierce Colorimetric PKC Assay kit, Spinzyme Format Короткий протокол: 0,025 од. ферменту РКС (головного мозку пацюка)/аналітична пробірка Пептидний субстрат Нейрогранін (мічений барвником) 30 хвилин при 30°С оптична щільність при 570нм. 76935 56 7. Визначення інгібування тирозинкіназної активності р56lсk Інгібування тирозинкіназної активності р56lсk визначали відповідно до процедури, описаної [в патенті США № 5714493], який вводиться в даний опис за допомогою посилання. В альтернативному варіанті, інгібування тирозинкіназної активності визначали наступним методом. Субстрат (тирозин-утримуючий субстрат, Biot- P-ala)3-Lys-Val-Glu-Lys-IIe-Gly-Glu-Gly-Thr-TyrG-(NH2), що пізнається p56lck, 1мкМ) спочатку фосфорилювали в присутності або у відсутність даної концентрації сполуки, що тестується відповідною кількістю ферменту (фермент отримували шляхом експресії гена р56lсk в дріжджовій конструкції), виділеним з клонованих дріжджів (очищення ферменту проводять нижченаведеними класичними методами), в присутності АТР (10мкМ), MgCl2 (2,5мМ), МnСl2 (2,5мМ), NaCl (25мМ), DTT (0,4мМ) в Hepes, 50мМ, рН7,5, протягом 10 хвилин при кімнатній температурі. Повний об'єм реакційної суміші становив 50мкл, і реакції проводили в чорному 96-лунковому флуоресцентному планшеті. Реакцію припиняли додаванням 150мкл буфера, що використовується для припинення реакції (100мМ Hepes, рН7,5, KF 400мМ, EDTA 133мМ, BSA 1г/л), що містить вибране антитіло проти тирозину, помічене криптатом європію (PY20-K) при 0,8мкг/мл, і стрептавидин, помічений алофікоціаніном (XL665), при 4мкг/мл. Мічення стрептавидину і антитіл проти тирозину здійснювали за допомогою набору Cys-Bio International (France). Суміш аналізували шляхом підрахунку з використанням лічильника Packard Discovery, на якому можна вимірювати гомогенне перенесення флуоресценції з розрізненням за часом (збудження при 337нм, прочитання при 620нм і 665нм). Відношення 665нм-сигнал/620нм-сигнал є мірою концентрації фосфорильованого тирозину. Контроль отримують шляхом заміни ферменту буфером. Специфічний сигнал являє собою різницю між відношенням, отриманим без інгібітору, і відношенням, отриманим для контролю. Потім обчислювали процент специфічного сигналу. ІС50 обчислювали для 10 концентрацій інгібітору в дублікаті з використанням Xifit soft. Еталонною сполукою є стауроспорин (Sigma), і ця сполука давала IC50, що складала 30±6нМ (n=20). 8. Визначення інгібування пухлини in vitro Інгібування росту пухлини in vitro сполуками даного винаходу визначали таким чином: Клітинну лінію гліоми пацюка С6 (отриману від АТСС) культивували у вигляді моношарів в модифікованому за способом Дульбекко середовищі Ігла, що містить 2мМ L-глютаміну, 200од./мл пеніциліну, 200мкг/мл стрептоміцину і доповненому 10%(об./об.) термоінактивованою фетальною телячою сироваткою. Клітини в експонентній фазі росту трипсинізували, промивали PBS і розводили до кінцевої концентрації 6500клітин/мл в повному середовищі. Лікарський засіб, що тестується або контрольний розчинник додавали до клітинної суспензії (2,5мл) при об'ємі 50мкл, а потім додавали 0,4мл 2,4% агару Noble Difco, що підтримується при 45°С, і перемішували. Отриману суміш відразу 57 76935 виливали в чашки Петрі і залишали на 5 хвилин при 4°С. Число клітинних клонів (>60 клітин) вимірювали після 12-денного інкубування при 37°С в атмосфері 5% СО2. Кожний лікарський засіб тестували при концентрації 10, 1, 0,1 і 0,01мкг/мл (кінцева концентрація в агарі) в дублікаті. Результати виражали як процент інгібування клоногенності по відношенню до необробленого контролю. IC50 визначали графічно, виходячи з графіка, побудованого в логарифмічному масштабі тільки по одній осі для середньої величини, визначеної для кожної концентрації лікарського засобу. 9. Вимірювання інгібування пухлин in vivo Інгібування росту пухлини in vivo сполуками даного винаходу визначали з використанням моделі підшкірного ксенотрансплантату, як описано [в патентах США №№ 5700823 і 5760066], де ми Комп’ютерна верстка Т. Чепелева 58 шам імплантували клітини гліоми С6, і ріст пухлини вимірювали з використанням штангельциркуля з ноніусом. Результати, отримані описаними вище експериментальними методами, свідчать про те, що сполуки, що входять в об'єм даного винаходу, володіють ефективною здатністю інгібувати протеїнтирозинкіназну активність рецептора PDGF або протеїн-тирозинкіназну активність р56lсk, і отже, володіють терапевтичними властивостями. Результати описаних вище фармакологічних тестів можуть бути використані з метою визначення дози і способу введення сполук для терапії, що конкретно розглядається. Даний винахід може бути здійснений в інших конкретних варіантах, що не виходять, однак, за рамки його суті і основних принципів. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюStent with polymeric coating based on quinoline/quinoxaline compounds
Автори англійськоюHe Wei
Назва патенту російськоюСтент с полимерным покрытием на основе хинолиновых/хиноксалиновых соединений
Автори російськоюХе Вей
МПК / Мітки
МПК: A61K 31/5377, A61P 43/00, C07D 215/38, A61P 35/00, C07D 241/42, A61F 2/84, A61K 31/498, C07D 405/12, C07D 471/08, A61P 9/10, C07D 453/00, C07D 215/20, C07D 241/44, A61K 31/47, A61M 25/00, A61P 29/00
Мітки: сполук, стент, полімерним, основі, покриттям, хінаксолінових, хінолінових
Код посилання
<a href="https://ua.patents.su/29-76935-stent-z-polimernim-pokrittyam-na-osnovi-khinolinovikh-i-khinaksolinovikh-spoluk.html" target="_blank" rel="follow" title="База патентів України">Стент з полімерним покриттям на основі хінолінових і хінаксолінових сполук</a>
Випадковий патент: Спосіб сушіння газопроникних матеріалів












