Спосіб імунодетекції раку
Номер патенту: 18181
Опубліковано: 01.07.1997
Автори: Горбань Лев Миколайович, Новиченко Наталія Леонідівна
Формула / Реферат
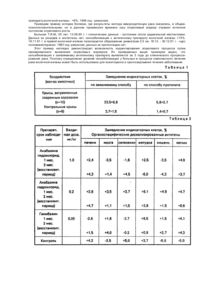
Способ иммунодетекции рака, заключающийся в заборе крови, инкубации лимфоцитов исследуемой крови с органоспецифическим опухолевым десиалированным антигеном, отделении инкубационной среды, введении индикаторных клеток и определении их электрофоретической подвижности, отличающийся тем, что инкубацию проводят вместе со всем комплексом форменных элементов крови, обработку ведут антигенной смесью на основе гомогената нормальной исходной ткани и нейраминидазы миксовирусов при следующих соотношениях, мас.%:
а в качестве индикаторных клеток используют сенсибилизированные и стабилизированные эритроциты мыши.
Текст
Изобретение относится к методам иммунологического анализа, а именно, к иммунологическим способам раннего обнаружения опухолевого процесса и может быть использовано в онкологии и гигиене. Известен иммунологический способ раннего обнаружения опухолевого процесса путем мониторинга пренеопластического антигена [Патент США №455804, кл. С 12 Q 1/00, 1985]. Способ осуществляется путем определения в сыворотке крови пренеопластического антигена - микросомальной эпоксидгидролазы. Недостатком способа является ограниченная область применения - выявление неопластических и пренеопла-стических поражений печени Известен способ определения клеточного иммунитета, заключающийся в инкубации лимфоцитов с энцефалитогенным фактором, обработке инкубационной средой индикаторных частиц и определении их электрофоретической подвижности [Патент ФРГ №2441536, кл. G 01 N 27/26, 33/16, 1977]. Недостатком способа является отсутствие органной специфичности, так как использование "общего" опухолевого антигена - энцефалитогенного фактора - не позволяет определять органную локализацию опухолевого процесса. Известен способ определения клеточного иммунитета при опухолевой болезни, заключающийся в заборе крови, инкубации лимфоцитов исследуемой крови с опухолевым органоспецифическим антигеном, отделении инкубационной среды, введении индикаторных клеток и определении их электрофоретической подвижности [см. KCI carcinoma extracts as tumor antigens In the electrophoretlc mobility test: clinical evaluation, K.Muhrer, K.Link "Cancer Detection and Prevention", 1983, 6, 101-106]. Способ применим в качестве лабораторного метода дифференциальной диагностики первичного опухолевого узла при диссеми-нированном опухолевом процессе. Недостатком способа является невысокая точность иммунодетекции: средний показатель замедления индикаторных клеток не превышает 20%. Кроме того, использование "позднего" опухолевого антигена не позволяет определять опухолевый процесс в организме до его клинической манифестации, то есть выявлять пренеопластическое состояние. Задачей изобретения является разработка способа иммунодетекции рака, в котором путем использования органоспеци-фических десиализированных антигенных препаратов достигалась бы органная и/или тканевая специфичность, повышалась разрешающая способность метода и тем самым увеличивалась чувствительность и точность способа иммунодетекции рака. Поставленная задача достигается в способе иммунодетекции рака путем забора крови, инкубации лимфоцитов исследуемой крови с органоспецифическим опухолевым десиалированным антигеном, отделении инкубационной среды, введении индикаторных клеток и определении их электрофоретической подвижности, в котором, согласно изобретения, отбирают 0,1 мл венозной крови, инкубацию проводят вместе со всем комплексом форменных элементов крови, обработку ведут антигенной смесью на основе гомогената нормальной исходной ткани и нейраминидазы миксови-русов при следующи х соотношениях, маc. %: а в качестве индикаторных клеток используют стабилизированные и сенсибилизированные эритроциты мыши. Небольшой объем (0,1 мл) венозной крови, необходимый для выполнения способа, позволяет проводить прижизненное много--кратное исследование опухолевого процесса в динамике у мелких лабораторных животных. Инкубация лимфоцитов вместе со всем комплексом форменных элементов крови позволяет избежать потери вспомогательных клеток, необходимых для протекания иммунологической реакции, и тем самым повысить точность способа. Предложенная антигенная смесь позволяет обнаруживать опухолевых процесс в определенном органе на ранних стадиях. Использование антигенной смеси на основе гомогената нормальной исходной ткани и нейраминидазы миксовирусов позволяет сохранить органоспецифические антигены, утрачиваемые на определенных стадиях опухолевого роста при злокачественном перерождении ткани органа и, наряду с этим, избежать введения в антигенную смесь перекрестно реагирующих антигенов, свойственных опухолевой ткани, что также повышает точность способа. Обработка нейраминидазой миксовирусов позволяет демаскировать "скрытые" антигены, которые появляются на ранней стадии канцерогенеза - промоции. Добавление стабилизатора в указанной концентрации стабилизирует антигенную смесь и разрушает антигены гистосовместимости, препятствующие выполнению способа. Приготовленную таким образом антигенную смесь легко отделить от инкубационной среды, ее можно хранить при комнатной температуре в течение 2-3 лет без потери антигенных свойств. Применение в качестве индикаторных клеток эритроцитов мыши вместо используемых до настоящего времени эритроцитов барана увеличивает показатели реакции (% замедления индикаторных клеток). Способ иммунодетекции поясняется следующими примерами выполнения. Пример 1. Белых беспородных крыс подвергают ингаляционной затравке сварочным аэрозолем, содержащим хром, никель, марганец в концентрации 10 мг/куб. м при ежедневной (кроме выходных) 4-х часовой экспозиции на протяжении 4-х месяцев (условия проведения эксперимента по определению хронического токсического действия). После окончания воздействия берут по 0,1 мл крови из хвостовой вены, отмывают 4 раза от сыворотки, инкубируют с равным объемом антигенной смеси, отмытой от стабилизатора, при 20-25°С в течение 60 минут. В качестве стабилизатора в примере используют формальдегид. Контрольную пробу инкубируют с буферным раствором Затем форменные элементы и антигенную смесь отделяют, например, центрифугированием, а надосадочную жидкость инкубируют с равным объемом индикаторных клеток - форма-линиэированных и таннизированных эритроцитов мыши в концентрации 7x10000000 клеток/мл в течение 20-30 минут, после чего измеряют их электрофорети-ческую подвижность. Замедление электрофоретической подвижности (К) рассчитывают по формуле: где Топыт - время перемещения эритроцитов через определенный отрезок расстояния при постоянной силе тока в опыте; Тконтроля - время перемещения эритроцитов в контроле. Результат считается положительным при К>10%. При исследовании легочного канцерогенеза применяют антигенную смесь на основе гомогената нормального легкого (при ингаляционном воздействии металлосодержащим сварочным аэрозолем) и нейраминидазы миксовирусов. Для приготовления антигенной смеси ткань легкого гомогенизируют любым известным способом. Навеску гомогената 0,8 г разбавляют 10 мл физиологического фосфатного буфера (ФФВ). В полученную суспензию добавляют 0,00005 г нейраминидазы миксовирусов и инкубируют 60 мин при 37°С. Затем при комнатной температуре в смесь вводят нейтральный формалин до 2% концентрации формальдегида. Перед употреблением антигенную смесь отмывают от формальдегида четырехкратным центрифугированием по 15 мин со скоростью 3000 об./мин. Конечная концентрация антигена 1-5 мг/мл. Результаты выполнения опыта представлены в табл.1. Из данных табл. 1 видно, что предложенный способ позволяет специфически выявлять канцерогенную активность химического фактора (сварочного аэрозоля) в доклинической стадии (через 4 месяца после начала воздействия) при индукции опухолей легких. Использование заявляемой антигенной смеси увеличивает разрешающую способность метода; тем самым повышает его точность. Пример 2. Белых беспородных крыс подвергали воздействию анабазина гидрохлорида и гамибазинас целью исследования потенциальных канцерогенных свойств указанных препаратов. Анабазин гидрохлорид вводят животным перорально ежедневно на протяжении 1 мес. в дозах 1,0 и 0,2 мг/кг массы тела. Одновременно группа животных подвергается воздействию водной вытяжки из лекарственной формы гамибази-на. В каждой группе используется 15 животных. Выявление канцерогенной активности указанных препаратов производят непосредственно после окончания воздействия и через 2 месяца восстановительного периода. В качестве критерия оценки канцерогенной активности используют определение пренеопластического состояния способом иммунодетекции рака с органо-специфическими десиалированными антигенами органов, кумулирующих указанные препараты (печень, головной мозг, селезенка, тонкий кишечник, желудок, легкие). В указанные сроки берут кровь из хвостовой вены и выполняют операции способа (очистка форменных элементов крови, инкубации с антигенной смесью, отделение инкубационной среды, внесение эритроцитов, определение их электрофоретической подвижности) аналогично примеру 1. Используют антигенные смеси на основе гомо-генатов печени, головного мозга, селезенки, тонкого кишечника, желудка, легких и ней-раминидазы миксовирусов. Навеску гомогената ткани 0,1 г разбавляют 10 мл буферного раствора (например, трис-буфером с рН 7,27,4). В полученную суспензию добавляют 0,0000005 г нейрами-нидазы миксовирусов и инкубируют 60 минут при 37°С. Затем при комнатной температуре в смесь вводят глютаральдегид до 3% концентрации глютаральдегида. В дальнейшем способ приготовления антигенной смеси выполняется по примеру 1. Полученные результаты представлены в табл.2. На основании проведенных исследований потенциальная канцерогенная активность анабазина гидрохлорида и гамибазина при хроническом 1-месячном внутрижелудочном введении препаратов белым крысам в дозах 0,2 и 1,0 мг/кг не выявлена. Пример 3. Пациенты с установленным диагнозом рака молочной железы подвергались комплексному лечению (операция, полихимиотерапия, облучение) в клинике заболеваний молочной железы (УНИИОР МЗУ). Через 2 месяца после окончания лечения производят забор крови из локтевой вены и выполняют операции способа (очистка форменных элементов, инкубация с антигенной смесью, отделение инкубационной среды, внесение эритроцитов, определение их электрофоретической подвижности) аналогично примеру 1. Используют антигенную смесь на основе гомогената нормальной молочной железы человека и нейраминидазы миксовирусов. Навеску гомогената молочной железы 0,12 г разбавляют 10мл ФФБ. В полученную суспензию добавляют 0,000005 г нефраминидазы миксовілрусов и инкубируют 60 мин при37°С. Затем при комнатной температуре в смесь вводят нейтральный формалин до 4% концентрации формальдегида. В дальнейшем способ приготовления антигенной смеси выполняют по примеру 1. Было обследовано 26 больных. У 50% больных констатировали положительную реакцию, которая варьировала от 13% до 82%. 16 больных удалось проследить в течение 4 лет, у 13 из них показатели способа иммунодетекции рака совпадали с течением заболевания. Полученные данные можно проиллюстрировать следующими примерами из историй болезни. Больная Л.В.С, 51 год, после радикальной мастэктомии и химиотерапии 28.02.90 г. - пролонгация заболевания. 14.03. - сенсибилизация к антигенному препарату молочной железы +30%. 14..03. - 30.03. - курс полихимиотерапии. 15.10.-23.12.91 г. - стабилизация процесса. 21.02.91 г. клиническая ремиссия, 26.04.91 г. данных за прогресси-рование нет. 25.07.91 г. - прогрессия опухоли. Больная П.П.С., 53 года. 12.06.90 г. -рецидив рака молочной железы после радикальной мастэктомии. Сенсибилизация к антигенному препарату молочной железы +40%. 1994 г. - метастазы в надключичную область и под лопатку. Больная К.Т.М., 39 лет. 19.06.90 г. - клинические данные - ремиссия. Сенсибилизация к антигенному препарату молочной железы +6%. Данные до 1993 года - ремиссия. Больная В.И.А., 53 года. Была прооперирована по поводу рака молочной железы, диагноз низкодифференцированный рак скиррозного типа T2N0 M0 о т 2.08.90 г. Сенсибилизация к антигенному препарату молочной железы - +8%. 1994 год - ремиссия. Приводим пример истории болезни, где результаты метода иммунодетекции рака оказались, в общем, ложноположительными, но в данном промежутке времени наш опухолевый маркер отражал истинное состояние опухолевого роста. Больная Т.И.М., 55 лет. 13.09.90 г. г клинические данные - состояние после радикальной мастэктомии. Данных за рецидив и метастазы нет, сенсибилизация к антигенному препарату молочной железы +15%. 18.11.91 г. в правой молочной железе пальпируется образование диаметром 2,5 см. 18.12. - 30.12.91 г. - курс полихимиотерапии. 1993 год- ремиссия, данных за пролонгацию нет. Этот пример наглядно демонстрирует возможность корректирования опухолевого процесса путем своевременного выявления опухолевы х маркеров. Из приведенных выше примеров видно, что сенсибилизация к заявляемому антигенному препарату выявляется за 3 года до клинического прогрессирования рака. Поэтому определение уровней сенсибилизации у больных в процессе комплексного лечения рака молочной железы может быть использовано для мониторинга и прогнозирования течения заболевания.
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for immunodetection of cancer
Автори англійськоюHorban Lev Mykolaiovych
Назва патенту російськоюСпособ иммунодетекции рака
Автори російськоюГорбань Лев Николаевич
МПК / Мітки
МПК: G01N 33/574, G01N 33/556, C12Q 1/37
Мітки: раку, спосіб, імунодетекції
Код посилання
<a href="https://ua.patents.su/3-18181-sposib-imunodetekci-raku.html" target="_blank" rel="follow" title="База патентів України">Спосіб імунодетекції раку</a>
Попередній патент: Ортодонтичний апарат для лікування зубощелепних аномалій та деформацій
Наступний патент: Спосіб визначення похибок датчиків систем автоматичного регулювання параметрів технологічних процесів та пристрій для його здійснення
Випадковий патент: Закупорювальний пристрій з індикацією першого відкривання