Сполука 3-децилоксикарбонілметил-4-метил-5-(2-гідроксіетил) тіазолій хлорид, яка має блокувальний ефект на іонну провідність каналів, утворених амфотерицином в
Номер патенту: 22875
Опубліковано: 25.04.2007
Автори: Гіммельрейх Ніна Германівна, Шатурський Олег Ярославович, Вовк Андрій Іванович, Романенко Олександр Вікторович
Формула / Реферат
Сполука 3-децилоксикарбонілметил-4-метил-5-(2-гідроксіетил) тіазолій хлорид, яка має блокувальний ефект на іонну провідність каналів, утворених амфотерицином В, загальної формули:
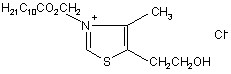 .
.
Текст
Корисна модель відноситься до медицини, а саме до фармакології. Завданням корисної моделі є дослідження дії сполуки 3-децилоксикарбонілметил-4-метил-5-(2гідроксиетил)тіазолій хлориду (ДМГТ) на іонні канали, утворені амфотерицином В в штучній пласкій бішаровій мембрані. Вивчення дії ДМГТ на іонні канали, сформовані амфотерицином В в штучній пласкій фосфоліпідній мембрані проводилось в відділі нейрохімії Інституту біохімії імені О.В.Паладіна НАН України і на кафедрі біології Національного медичного університету імені О.О.Богомольця. ДМГТ синтезовано у відділі механізмів біоорганічних реакцій Інституту біоорганічної хімії та нафто хімії НАН України. Відомо, що вітамін В1 (тіамін) відіграє важливу роль в забезпеченні функціонування нервової і м'язової систем людини і тварин. Нестача вітаміну В1 в їхньому організмі може призводити до порушення координації рухів, рефлекторної діяльності, моторики шлунково-кишкового тракту, паралічу та атрофії м'язів кінцівок. Після проникнення в клітину тіамін може фосфорилюватися і у формі тіаміндифосфату брати участь в залежних від нього як кофермента ферментативних реакціях. Крім того, тіамін у фізіологічному діапазоні концентрацій чинить безпосередню дію на механізм квантової секреції медіаторів з нервових закінчень в синапсах різних типів, викликаючи посилення цього процесу [1-3]. Обговорюється можливість впливу тіаміну та його фосфорильованих форм на проникність іонних каналів збудливих мембран нервових клітин [4], а також на іонні струми, викликані активацією ацетилхоліном нікотинових та мускаринових холінорецепторів [5]. Серед природних сполук тільки тіамін, його похідні та деякі продукти його метаболізму вміщують в структурі молекули тіазолієвий цикл. Під час пошуку потенційних лікарських засобів серед структурних аналогів вітаміну В1 раніше було синтезовано нову сполуку - ДМГТ - та встановлено ряд її властивостей [6-8]. При цьому, аналізуючи будову ДМГТ, ви ходили з того, що присутність в складі молекули тіазолієвого циклу передбачає можливість її впливу на один із шляхів реалізації біологічної активності вітаміну В1, а довголанцюгового вуглевоводневого радикалу може сприяти взаємодії ДМГТ з мембранними структурами. Було встановлено, що ДМГТ викликає у лабораторних тварин седативну, центральну міорелаксантну, протисудомну та снотворну дію, підвищує поріг больової чутливості, знижує агресивність, орієнтувальні реакції та пошукову діяльність лабораторних тварин, а також нейротоксичний вплив на них a-латротоксину (a-LT)-білкового токсину з отрути павука каракурта (Latrodectus mactans tradecimguttatus). ДМГТ є ефективним блокатором спонтанної та викликаної подразненням нервових волокон квантової секреції ацетилхоліну із нервових закінчень. Причому навіть на фоні дії aлатротоксину, який посилює вивільнення нейромедіатора в ізольованих нервово-м'язових препаратах хребетної тварини в сотні і тисячі разів, ДМГТ швидко блокує квантову секрецію ацетилхоліну з нервових закінчень. a-Латротоксин також здатний підвищува ти іонну проникненість нервових закінчень та формувати в мембрані білкові пори, проникні для катіонів. Зважаючи на згадане вище, було досліджено вплив ДМГТ на іонні струми, що обумовлюються встроюванням a-латротоксину в штучн у фосфоліпідну мембрану [9]. В основу корисної моделі поставлено те, що блокуюча дія ДМГТ здійснюється завдяки його проникненню в порожнину локалізованого в БЛМ каналоформеру, причому ступінь блокуючого ефекту зростає при збільшенні співпадіння гідродинамічного радіусу ДМГТ та радіусу о твору пори, утвореної каналоформером в БЛМ. З'ясувалося, що ДМГТ в концентрації 0,1мМ зменшував трансмембранний струм через іонні канали, утворені a-LT в бішарових ліпідних мембранах (БЛМ) на 31,6 ± 3% на отворі пори з ефективним радіусом 0,9нм. При вивченні впливу ДМГТ на трансмембранні іонні струми, обумовлені встроюванням в БЛМ токсину морської актинії Radianthus macrodactilus (RTX) та a-латроінсектотоксину (a-LIT ) із отрути павука каракурта Latrodectus mactans tradecimguttatus зі схожими ефективними радіусами пор 0,53нм і 0,55нм, відповідно, встановлено, що ДМГТ, доданий в комірку з боку цих вхідних отворів, викликав в обох випадках пригнічення трансмембранного іонного струму на 50-52% [9,10]. Отримані результати узгоджуються з припущенням про залежність інгібуючого впливу ДМГТ на іонну провідність каналів в БЛМ від розмірів отвору пори, причому інгібуюча дія ДМГТ на трансмембранний іонний струм через іонні канали була більш виразною у випадку прикладання цієї сполуки на отворах каналів меншого розміру. Тому можна було очікувати підсилення ефективності такої дії ДМГТ на трансмембранний іонний струм у випадку прикладання ДМГТ до іонних каналів, утворених амфотерицином В, здатним формувати в БЛМ іонні канали з приблизним радіусом пори 0,35нм [11]. Методика формування БЛМ та ви вчення іон-провідних властивостей каналів, утворених амфотерицином В. Приготування розчину Амфотерицину В. Амфотерицин В ("Sigma", США) розчиняли спочатку в диметилсульфоксиді (ДМСО), а потім доводили водним розчином 100мМ КС1 (рН 7,4) до концентрації 100мкг/мл при кінцевій концентрації ДМСО 1-4%. Розчин амфотерицину В озвучували 1 хв. при 22кГц за допомогою ультразвукового диспергатора УЗДН-2Т (Сумське Виробниче Об'єднання "Електрон", Україна). Формування БЛМ та вимірювання їх іон-провідних властивостей Пласкі фосфоліпідні мембрани формували із розчину фосфатидилхоліну (ФХ) (ЗАТ „Біолек", Україна) або 1,2дифітаноїл-sn-гліцеро-3-фосфо холіну (ДОФХ) (Avanti Polar Lipids, США) та холестерину („Calbiochem", Німеччина) в н-гептані на отворі діаметром 0,6мм в тефлоновому стаканчику, розміщеному в скляній комірці. Співвідношення ФХ:холестерин або ДОФХ:холестерин у розчиннику становило 2:1 при загальній концентрації ліпідів 20мг/мл. Формування ліпідного бішару спостерігали візуально у відображеному світлі за допомогою бінокулярного мікроскопа. Водно-сольовий розчин, який оточував мембрану, містив 10мМ трис-НСІ ("Sigma", США) та задану кількість хлориду калію кваліфікації „особлива ступінь чистоти" (о.с.ч.). Для вимірів провідності мембрани використовували хлор-срібні електроди, занурені в розчин 2М КС1 з агаровими містками, розміщеними з різних боків БЛМ. Потенціал зовні тефлонового стаканчика (цис-сторона) задавали відносно потенціалу внутрішнього об'єму (транс-сторона), який приймали рівним віртуальному 0мВ. Поляризаційний потенціал між електродами не перевищував 1,5мВ. Різниця потенціалів прикладалась до мембрани від джерела напруги, що дозволяло отримувати постійну (від -100мВ до 100мВ) або лінійно змінювану напругу з швидкістю 100мВ/хв., використовуючи той же діапазон амплітуд. Трансмембранні струми записували за допомогою двокоординатного самописця Н307/1 (Краснодарський завод вимірювальних приладів, Російська Федерація). Розчин, оточуючий мембрану, перемішували за допомогою магнітної мішалки. Усі експерименти проводились при кімнатній температурі (2224°С). Через 1-2хв. після введення амфотерицину В з цис-боку БЛМ в симетричному розчині 100мМ КС1 спостерігалось зростання трансмембранного струму, яке свідчить про формування іон-провідних каналів у ліпідному бішарі. Беручи до уваги незначні провідності поодиноких каналів, сформованих амфотерицином В в БЛМ [11], вплив ДМГТ на їх іон-провідну властивість ми визначали на БЛМ з великою кількістю вбудованих каналів. Стаціонарну провідність БЛМ, індуковану амфотерицином В, використовували як контроль для подальшого вивчення впливу ДМГТ на трансмембранний іонний струм через утворені амфотерицином В канали в БЛМ. В якості еталону приймали блокуючий ефект тетраетил амонію. Він є найефективнішим із застосованих раніше сполук метонієвого ряду, які блокують іонний струм через канали, утворені амфотерицином В в БЛМ, з ефективним радіусом отвору 0,35нм [11]. На Фіг.1 показано блокуючий ефект 0,1мМ ДМГТ на вхідний струм через іонні канали, сформовані амфотерицином В в БЛМ. С таціонарний струм був індукований іонними каналами, сформованими амфотерицином В в симетричному розчині 100мМ КС1. Потенціал на мембрані становив 50мВ. Стрілкою позначено уведення ДМГТ в комірку з БЛМ. Амфотерицин В вводили з цис-сторони мембрани в кінцевій концентрації 0,09мкг/мл. Переривчасті лінії позначають нульовий струм. Після введення 0,1мМ ДМГТ в симетричному розчині 100мМ КС1 трансмембранний струм через утворені амфотерицином В канали знижувався на 84 ± 4% за 7-8хв. при постійному перемішуванні оточуючого мембрану водно-сольового розчину (Фіг.1). Блокуючий ефект ДМГТ на канали, утворені амфотерицином В в БЛМ залежить від концентрації блокатора і може описуватись кривою насичення Ленгмюра. Зменшення струму через канали, утворені амфотерицином В, відбувається за експоненціальною залежністю при зростаючих концентраціях ДМГТ і досягає початку насичення при концентрації 0,02мМ. Швидкість блокування визначали як зміну провідності амфотерицинових каналів після введення кожної концентрації ДМГТ. Блокування струму через канали, утворені амфотерицином В в БЛМ на 50% досягалось при концентрації ДМГТ 7,5мкМ, що лише незначною мірою відрізнялося від такої, визначеної для a-LT каналу в БЛМ (4мкМ). Наведені дані свідчать про присутність схожого високоафінного центру зв'язування ДМГТ в каналах, утворених амфотерицином В та a-LT в БЛМ. Інгібуюча дія ДМГТ не залежала від знаку потенціалу, прикладеного до мембрани, і була зворотною: за 2530хв. перфузії комірки з БЛМ розчином 100мМ КС1 (80мл) повністю відновлювалась вихідна іонна провідність каналів, утворених амфотерицином В в БЛМ. Треба відзначити, що інгібуюча дія ДМГТ на іонну провідність через a-LT, a-LIT та RTX канали в БЛМ також має зворотний характер [9,10]. Ці результати дозволяють припустити, що ДМГТ не утворює стійких зв'язків з зарядженими групами, які формують селективні центри в порожнині іонних каналів. Виходячи з припущення, що ефективний радіус пори іонного каналу близький до мінімального гідродинамічного розміру непроникаючої в нього молекули або ассоціату молекул блокатора, отримані дані дозволяють вважати наступне - збільшення блокуючого ефекту ДМГТ має місце при проникненні ДМГТ в порожнину каналу завдяки зростанню подібності гідродинамічного розміру блокатора до розмірів пор, утворених цими каналами в БЛМ. Треба окремо відзначити наступне: 1. ДМГТ на відміну від еталону (тетраетиламонію) належить до гетероциклічних сполук. 2. ДМГТ в концентрації 7,5мкМ зменшує трансмембранний струм через іонні канали, сформовані амфотерицином В в БЛМ на 50%, а еталон (тетраетиламоній), за даними літератури [11], зменшує трансмембранний струм через іонні канали, сформовані амфотерицином В в БЛМ на 50% при концентрації 4мМ. Список посилань 1. Романенко А.В. Действие тиамина на нервно-мышечную передачу у лягушки // Нейрофизиология. - 1985. 17, №6. - С. 794-800. 2. Романенко А.В. Действие тиамина на различные типы синаптических соединений // Нейрофизиология.1986. -18, №5.- С. 621-629. 3. Романенко А.И., Гнатенко В.М., Владимирова И.А.. Действие тиамина на нервно- мышечную передачу в гладких мышцах // Нейрофизиология. - 1994. - 26, №6. - С. 449-457. 4. Bettendorff L. Thiamine in excitable tissues: reflections on a non-cofactor role // Metab. Brain Dis. - 1994. - 9, №3. - P. 183-209. 5. Дятлов В.А., Романенко А.В. Модуляторная роль тиамина в синаптической передаче у пресноводного моллюска // Гидробиол. Журн. - 1995. - 31, №6. - С. 66-70. 6. Вовк А.И., Романенко А.В., Муравьева И.В., Зайцев Л.М. 3-децоксикарбонилметил-4-метил-5-bгидроксиэтилтиазолий хлорид или децоксикарбонилметил-4-метилтиазолий хлорид, угнетающие нервномышечную передачу и обладающие транквилизирующей активностью // Авторское свидетельство 1547267 СССР, МКИ 4 С 07 D 277/24, А 61 К 31/425. Заявлено 18.07.88. Зарегистрировано 01.11.89. 7. Романенко А.В., Вовк А.И., Шатурский О.Я. Действие тиазолевых аналогов витамина В1 на нервномышечную передачу и вызванную a-латротоксином секрецию медиатора в скелетной мышце // Нейрофизиология.-1995.- 27, №5/6.-С. 368-374. 8. Романенко А.И., Гнатенко В.М., Владимирова И.А., Вовк А.И. Пре- и постсинаптическая модуляция нервномышечной передачи в гладких мышцах тиазолевыми аналогами витамина В1 // Нейрофизиология.-1995.-27, №5/6.-С.375-386. 9. Шатурский О.Я., Романенко А.В, Производное тиазолия уменьшает трансмембранный ток через ионные каналы, образованные a-латротоксином и токсином морской актинии в бислойных липидных мембранах // Укр. биохим. журн.- 2005.-74, №4.-С.48-55. 10. Шатурський О.Я., Волкова Т.М., Романенко О.В., Гіммельрейх Н.Г.,. Грішин Є.В. Інгибуюча дія тіазолевого аналога вітаміну В1 на іонні канали, що утворені a-латроінсектотоксином з отрути каракурта в бішарових фосфоліпідних мембранах // Доп. HAH України.-2006.- №5, С. 158-162. 11. Борисова М.П., Ермишкин Л.Н., Зильберштейн А.Я. Блокаторы ионных каналов, образуемых в липидном бислое полиеновыми антибиотиками // Биофизика-1978.-23, №7.- С.1093-1094.
ДивитисяДодаткова інформація
Назва патенту англійською3-decyloxycarbonylmethyl-4-methyl-5-(2-hydroxyethyl) thiasolium chloride blocks ionic conductivity of canals generated by amphotericin b
Автори англійськоюRomanenko Oleksandr Viktorovych, Vovk Andrii Ivanovych, Gimmelreikh Nina Germanivna, Shaturskyi Oleg Yaroslavovych
Назва патенту російською3-децилоксикарбонилметил-4-метил-5-(2-гидроксиетил) тиазолий хлорид блокирует ионную проводимость каналов, образованных амфотерицином в
Автори російськоюРоманенко Александр Викторович, Вовк Андрей Иванович, Гиммельрейх Нина Германовна, Шатурский Олег Ярославович
МПК / Мітки
МПК: A61K 47/12, C07C 255/00
Мітки: має, тіазолій, амфотерицином, каналів, блокувальний, яка, 3-децилоксикарбонілметил-4-метил-5-(2-гідроксіетил, провідність, утворених, іонну, сполука, хлорид, ефект
Код посилання
<a href="https://ua.patents.su/3-22875-spoluka-3-deciloksikarbonilmetil-4-metil-5-2-gidroksietil-tiazolijj-khlorid-yaka-maeh-blokuvalnijj-efekt-na-ionnu-providnist-kanaliv-utvorenikh-amfotericinom-v.html" target="_blank" rel="follow" title="База патентів України">Сполука 3-децилоксикарбонілметил-4-метил-5-(2-гідроксіетил) тіазолій хлорид, яка має блокувальний ефект на іонну провідність каналів, утворених амфотерицином в</a>
Попередній патент: Спосіб отримання сполуки з потенційними фізіологічними властивостями 1,1-діетилкарбокси-2-метокси-2-трифторметилетилен
Наступний патент: Довгостроковий запам`ятовуючий пристрій
Випадковий патент: Гібридний підвищуючий трифазний випрямляч







