Похідні 5-аміно-8-метил-7-піролідинілхінолін-3-карбонової кислоти, спосіб їх одержання (варіанти), фармацевтична композиція, спосіб лікування інфекційних захворювань, проміжна сполука
Номер патенту: 39859
Опубліковано: 16.07.2001
Автори: Іто Яшіо, Йошіда Тошіхіко, Ямамото Йоічі, Кадо Норіюкі, Като Хідео, Ясуда Сінго
Формула / Реферат
1. Производные 5-амино-8-метил-7-пирролидинилхинолин-3-карбоновой кислоты общей формулы (I):
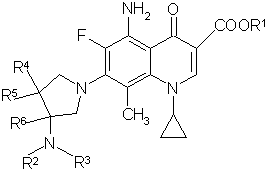 , (I)
, (I)
где
R1 выбирают из группы, включающей атом водорода и низший алкил,
R2 выбирают из группы, включающей атом водорода, низший алкил, низший алканоил, галогенированный низший алканоил и остаток эфира карбоновой кислоты,
R3 выбирают из группы, включающей атом водорода и низший алкил,
R4, R5 и R6 каждый независимо выбирают из группы, включающей атом водорода и низший алкил, или два из R4, R5 и R6 могут совместно образовать
-(СH2)n-группу, где n=1 или 2, или их стереоизомеры, или их фармакологически приемлемые соли.
2. Соединение по п. 1, отличающееся тем, что R1, R2 и R3 каждый представляет атом водорода, или его стереоизомеры, или его фармакологически приемлемые соли.
3. Соединение по пп. 1 или 2, отличающееся тем, что R4, R5 и R6 каждый независимо выбирают из группы, включающей атом водорода и низший алкил, или его стереоизомеры, или его фармакологически приемлемые соли.
4. Соединение по п. 3, отличающееся тем, что низший алкил представлен метилом, или его стереоизомеры, или его фармакологически приемлемые соли.
5. Соединение по п. 3, отличающееся тем, что R4, R5 и R6 каждый представляет атом водорода, или его стереоизомеры, или его фармакологически приемлемые соли.
6. Соединение по п. 3, отличающееся тем, что R4 — метил, и R5 и R6 каждый — водород, или его стереоизомеры, или его фармакологически приемлемые соли.
7. Соединение по пп. 1 или 2, отличающееся тем, что два из R4, R5 и R6 совместно образуют -(СН2)n-группу, где n=1 или 2, или его стереоизомеры, или его фармакологически приемлемые соли.
8. Соединение по п. 7, отличающееся тем, что R4 и R5 совместно образуют -(СH2)n-группу, где n=1 или 2, или его стереоизомеры, или его фармакологически приемлемые соли.
9. Соединение по п. 8, отличающееся тем, что n=2, или его стереоизомеры, или его фармакологически приемлемые соли.
10. Соединение по п. 1, представляющее собой 5-амино-7-(3-амино-1-пирролидинил)-1 -циклопропил-6-фтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновую кислоту или ее стереоизомеры, или ее фармакологически приемлемые соли.
11. Соединение по п. 1, представляющее собой 5-амино-7-(3-амино-4-метил-1-пирролидинил)-1-циклопропил-6-фтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновую кислоту или ее стереоизомеры, или ее фармакологически приемлемые соли.
12. Соединение по п. 1, представляющее собой 5-амино-7-(7-амино-5-азаспиро/2.4/гепт-5-ил)-1 -циклопропил-6-фтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновую кислоту или ее стереоизомеры, или ее фармакологически приемлемые соли.
13. Фармацевтическая композиция для лечения инфекционных заболеваний, отличающаяся тем, что содержит эффективное количество одного или нескольких соединений, указанных в пп. 1-12, их стереоизомеров или их фармакологически приемлемых солей, в смеси с фармакологически приемлемыми добавками.
14. Способ лечения инфекционных заболеваний, отличающийся тем, что вводят больному эффективное количество одного или нескольких соединений, указанных в пп. 1-12, их стереоизомеров или их фармакологически приемлемых солей, либо содержащих их препаратов.
15. Способ получения соединений, указанных в п. 1, их стереоизомеров или их фармакологически приемлемых солей, отличающийся тем, что осуществляют реакцию производного 7-галогенированной хинолин-3-карбоновой кислоты общей формулы (III):
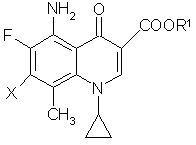 , (III)
, (III)
где Х представляет атом галогена, и R1 принимает вышеуказанные значения, с производным пирролидина общей формулы (IV):
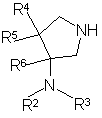 , (IV)
, (IV)
где R2, R3, R4, R5 и R6 принимают вышеуказанные значения, с последующим, если необходимо, гидролизом.
16. Способ по п. 15, отличающийся тем, что полученное соединение общей формулы (І), в котором R2 представляет низший алканоил или галогенированный низший алканоил, гидролизом превращают в соединение формулы (I), где R2 означает водород, или если R2 означает остаток эфира карбоновой кислоты, обрабатывают это соединение кислотой.
17. Способ получения соединений, указанных в п. 1, их стереоизомеров или их фармакологически приемлемых солей, отличающийся тем, что осуществляют реакцию соединений общей формулы (V):
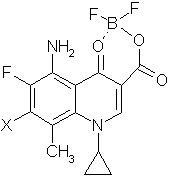 , (V)
, (V)
где Х представляет атом галогена, с производным пирролидина общей формулы (IV):
 , (IV)
, (IV)
где R2, R3, R4, R5 и R6 принимают вышеуказанные значения, с последующим, если необходимо, разрушением хелата.
18. Способ по п. 17, отличающийся тем, что полученное соединение общей формулы (I), в котором R2 представляет низший алканоил или галогенированный низший алканоил, гидролизом превращают в соединение формулы (I), где R2 означает водород, или если R2 означает остаток эфира карбоновой кислоты, обрабатывают это соединение кислотой.
19. Производное 7-галогенированной хинолин-3-карбоновой кислоты общей формулы (III):
 , (III)
, (III)
где
Х представляет атом галогена и R1 выбирают из группы, включающей атом водорода и низший алкил, которое может использоваться как промежуточное соединение в способе получения соединений, указанных в пп. 1-12.
Текст
1. Производные 5-амино-8-метил-7-пирролидинилхинолин-3-карбоновой кислоты общей формулы (I): C2 (54) ПОХІДНІ 5-АМІНО-8-МЕТИЛ-7-ПІРОЛІДИНІЛХІНОЛІН-3-КАРБОНОВОЇ КИСЛОТИ, СПОСІБ ЇХ ОДЕРЖАННЯ (ВАРІАНТИ), ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ, СПОСІБ ЛІКУВАННЯ ІНФЕКЦІЙНИХ ЗАХВОРЮВАНЬ, ПРОМІЖНА СПОЛУКА 39859 что содержит эффективное количество одного или нескольких соединений, указанных в пп. 1-12, их стереоизомеров или их фармакологически приемлемых солей в смеси с фармакологически приемлемыми добавками. 14. Способ лечения инфекционных заболеваний, отличающийся тем, что вводят больному эффективное количество одного или нескольких соединений, указанных в пп. 1-12, их стереоизомеров или их фармакологически приемлемых солей, либо содержащих их препаратов. 15. Способ получения соединений, указанных в п. 1, их стереоизомеров или их фармакологически приемлемых солей, отличающийся тем, что осуществляют реакцию производного 7-галогенированной хинолин-3-карбоновой кислоты общей формулы (III): NH2 F NH2 O O X N CH3 , R 4 NH 5 R 6 R X 2 1 N N , (III) где Х представляет атом галогена, и R1 принимает вышеуказанные значения, с производным пирролидина общей формулы (IV): R 4 NH 5 R R 6 2 N R 3 , R 3 , (IV) где R2, R3, R4, R5 и R6 принимают вышеуказанные значения с последующим, если необходимо, разрушением хелата. 18. Способ по п. 17, отличающийся тем, что полученное соединение общей формулы (I), в котором R2 представляет низший алканоил или галогенированный низший алканоил, гидролизом превращают в соединение формулы (I), где R2 означает водород или, если R2 означает остаток эфира карбоновой кислоты, обрабатывают это соединение кислотой. 19. Производное 7-галогенированной хинолин-3карбоновой кислоты общей формулы (III): CH3 R (V) где Х представляет атом галогена, с производным пирролидина общей формулы (IV): O COOR O F R F F B (IV) NH2 где R2, R3, R4, R5 и R6 принимают вышеуказанные значения с последующим, если необходимо, гидролизом. 16. Способ по п. 15, отличающийся тем, что полученное соединение общей формулы (І), в котором R2 представляет низший алканоил или галогенированный низший алканоил, гидролизом превращают в соединение формулы (I), где R2 означает водород или, если R2 означает остаток эфира карбоновой кислоты, обрабатывают это соединение кислотой. 17. Способ получения соединений, указанных в п. 1, их стереоизомеров или их фармакологически приемлемых солей, отличающийся тем, что осуществляют реакцию соединений общей формулы (V): O COOR 1 F X N CH3 , (III) где Х представляет атом галогена и R1 выбирают из группы, включающей атом водорода и низший алкил, которое может использоваться как промежуточное соединение в способе получения соединений, указанных в пп. 1-12. Настоящее изобретение относится к новым производным 5-амино-8-метил-7-пирролидинилхинолин-3-карбоновой кислоты, их стереоизомерам и их фармакологически приемлемым солям, обладающим прекрасной антибактериальной активностью, а также к способам их получения. Изобретение, кроме того, относится к фармацевтическому препарату, содержащему эффективное количество производного, и применимому для лечения инфекционных заболеваний, к способу лечения и к промежуточным соединениям для синтеза производных. Описание прототипов. Ципрофлоксацин относится к хорошо документированному антибактериальному средству с хинолиновым ядром, замещенным в положении I циклопропильной группой (Каталог фирмы Мерк, II-ое издание, 2315). 2 39859 Попытки улучшить ципрофлоксацин были направлены на введение разнообразных заместителей в положения 5, 7 и 8, однако настоящее изобретение относится к впервые полученным производным хинолина с аминогруппой в 5 положении и метильной группой в 8 положении в сочетании с пирролидинильной группой в 7 положении. В настоящее время антибактериальная активность производных хинолона либо недостаточна, а если и достаточна, то сопровождается тяжелыми нежелательными эффектами, такими как фототоксичность, хромосомная аберрация, судороги и т.д., в силу чего последние средства создают проблему безопасности. Следующие ссылки документально подтверждают вышеуказанные проблемы, связанные с хинолиновыми антибактериальными средствами. 1) "Хинолиновые противомикробные средства", 2-ое издание, глава 26, ред. D.C. Hooper, J.S. Walfson, Американское общество микробиологии, Вашингтон Д.К., 1993, стр. 489 (речь идет о фототоксичности, хромосомной аберрации, судорогах и т.д.). 2) Анализ на мутагенность, 2 (3), стр. 154 (1993) (хромосомная аберрация и т.д.). 3) Environ, Мої. Mutagen., 13, стр. 238 (1989) (хромосомная аберрация и т.д.). Нижеследующим подчеркивается связь конкретных показателей применяемых заместителей в отдельных положениях с указанными затруднениями. К примеру, известно, что введение сравнительно объемистого заместителя, такого как атом хлора или метильная группа в 8 положении хинолинового ядра желательны для противомикробной активности, однако многие соединения, имеющие в 8 положении в качестве заместителя атом хлора, создают тяжелые нежелательные эффекты, такие как фототоксичность, хромосомная аберрация и т.д., а соединения с метильным заместителем также создают тяжелые нежелательные эффекты, такие как хромосомная аберрация и т.д. Применение подобных соединений связано с большими затруднениями с точки зрения их безопасности. К широко применяемым в 5 положении заместителям относятся аминогруппа, атом галогена или метальная группа и т.д., но указанные заместители обладают недостатком, заключающимся в понижении противомикробной активности, а кроме того, создают тяжелые нежелательные эффекты, такие как фототоксичность, хромосомная аберрация и т.д., вследствие чего возникает проблема безопасности. Кроме того, ведение в 7 положение пиперазинильной группы не создает достаточной противомикробной активности, а введение 3-аминопирролидинильной группы, обладающей достаточной противомикробной активностью, приводит к возникновению тяжелых нежелательных эффектов, таких как хромосомная аберрация и т.д., т.е. снова возникает проблема безопасности. Исследования, направленные на решение вышеуказанной проблемы, привели к настоящему изобретению, а именно: созданию производных 1-циклопропил-6-фтор-1,4-дигидро-4-оксохинолин 3-карбоновой кислоты с 5-аминогруппой, 8-метилом и 7-пирролидинилом в хинолиновом ядре. Соединения настоящего изобретения обладают очень эффективной антибактериальной активностью, более того, их применение не приводит к тяжелым нежелательным эффектам фототоксичности, хромосомной аберрации, судорогам и т.д., вопреки тому, что можно было ожидать на основе ранее предпринятых попыток. Кроме того, соединения настоящего изобретения характеризуются прекрасным тканевым распределением, что позволяет быстро достигать высокой концентрации соединения в целевых тканях легких, почек и т.д., являющихся объектом лечения. Согласно настоящему изобретению, даются новые производные 5-амино-8-метил-7-пирролидинилхинолин-3-карбоновой кислоты общей формулы (I): NH2 O 4 R F COOR 1 R R R 2 5 N N 6 CH3 N R 3 , (I) где: R1 представляет водород или низший алкил; R2 представляет водород, низший алкил, низший алканоил, галогенированный низший алканоил или остаток эфира карбоновой кислоты; R3 представляет водород или низший алкил; R4, R5 и R6, каждый независимо, представляет водород или низший алкил, или двое из R4, R5 и R6 могут совместно образовать -(СН2)n-группу, где n=1 или 2, их стереоизомеры или их фармакологически приемлемые соли. Дается также способ получения таких соединений, фармацевтические препараты, содержащие эффективные количества этих соединений и способы лечения инфекционных заболеваний путем введения больным эффективного количества указанных соединений. Согласно еще одному воплощению настоящего изобретения, даются новые производные 8-метилхинолин-3-карбоновой кислоты формулы (II): R 8 O COOR 7 F X N CH3 , (II) где: R7 представляет низший алкил; R8 представляет нитрогруппу или аминогруппу; Х представляет атом галогена, являющиеся эффективными промежуточными соединениями для получения вышеупомянутых соединений формулы (I). Рекомендуемыми воплощениями настоящего изобретения даются следующие соединения общей формулы (I): 3 39859 1) где R1, R2 и R3, каждый, представляет атом водорода; 2) где R4 и R5, совместно, образуют -(СН2)2группу; 3) где R4, R5 и R6, каждый, представляет атом водорода; 4) где R4 - метил; R5 и R6, каждый, представляет атом водорода. Кроме того, рекомендуемые воплощения настоящего изобретения включают способ получения указанных соединений, фармацевтические препараты, содержащие эффективное количество таких соединений, и способы лечения инфекционных заболеваний путем введения больным эффективного количества этих соединений, а также промежуточные соединения для их получения. В вышеприведенных формулах (I) и (II) низший алкил, представленный R1, R2, R3, R4, R5, R6 и R7, содержит 1-4 атома углерода, например: метил, этил, n-пропил, изопропил, n-бутил, изобутил, втор-бутил, или трет-бутил и т.д.; R2 представляет также низший алканоил, галогенированный низший алканоил или остаток эфира карбоновой кислоты. Если R2 представляет низший алканоил, то такая группа содержит 1-6 атомов углерода, например: формил, ацетил, пропаноил, бутирол или триметилацетил и т.д.; если R2 представляет галогенированный низший алканоил, то такая группа состоит из 1-4 атомов углерода и 1-5 атомов галогена, причем отдельные атомы галогена включают атомы фтора, хлора, брома и т.д., примеры таких групп включают: фторацетил, дифторацетил, трифторацетил, хлорацетил, дихлорацетил, трихлорацетил и т.д.; если R2 представляет остаток эфира карбоновой кислоты, такой остаток является алкоксикарбонилом или арилоксикарбонилом, например: бензилоксикарбонилом, этоксикарбонилом, метоксикарбонилом, трет-бутоксикарбонилом и т.д.; атом галогена, представленный X, может быть, например: атомом фтора, атомом хлора, атомом брома и т.д. Кроме того, двое из R4, R5 и R6, совместно, образуют -(СН2)n-группу (где n=1 или 2), например, R4 и R5 объединяются с образованием –СН2-группы или -(СН2)2-группы, точно также R5 и R6 соединяются вместе с образованием –СН2-группы или -(СН2)2-группы. Соединения настоящего изобретения общей формулы (I) при желании могут быть превращены в фармакологически приемлемые соли, и полученные соли могут быть затем вновь переведены в свободные соединения формулы (I). Фармакологически приемлемые соли соединений настоящего изобретения общей формулы (I) могут быть солями, образованными добавлением кислот, и солями, образованными добавлением щелочей. Примеры солей с кислотами включают соли минеральных кислот, например: гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, фосфат и т.д., и соли органических кислот, например: ацетат, малеат, фумарат, цитрат, оксалат, малат, метансульфонат, n-толуолсульфонат, манделат, 10-камфорсульфонат, тартрат, лактат и т.д. Примеры солей с щелочами включают соли неорганических щелочей, например: соли натрия, калия, кальция, магния, аммония и т.д., и соли органических оснований, например: соли этаноламина, N,N-диалкиламина и т.д. Соединения вышеприведенной общей формулы (I) имеют один или несколько асимметричных атомов углерода, такая молекула соединения, любые стереоизомеры или смеси стереоизомеров охватываются объемом изобретения. Следующие соединения могут быть приведены в качестве реальных примеров производных 5-амино-8-метил-7-пирролидинилхинолин-3карбоновой кислоты, но ими не исчерпываются примеры возможных соединений настоящего изобретения. (1) 5-амино-7-(7-амино-5-азаспиро/2,4/гепт-5ил)-1-циклопропил- 6-фтор-1,4-дигидро-8-метил-4оксохинолин-3-карбоновая кислота, (2) 5-амино-1-циклопропил-6-фтор-1,4-дигидро-8-метил-7-(7 -метиламино- 5 -азаспиро/2,4/гепт5-ил)-4-оксохинолин-3-карбоновая кислота, (3) 5-амино-1-циклопропил-7-(7-диметиламино- 5-азаспиро/2,4/-гепт-5 -ил)-6-фтор-1,4-дигидро8-метил-4-оксохинолин-3-карбоновая кислота, (4) 5-амино-7-(3-амино-1-пирролидинил)-1-циклопропил- 6 - фтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновая кислота, (5) 5-амино-7-(3-амино-4-метил-1-пирролидинил)-1-циклопропил-6-фтор-1,4-дигидро- 8 -метил4-оксохинолин-3-карбоновая кислота, (6) 5-амино-7-(3-амино-4,4-диметил-1-пирролидинил)-1-циклопропил-6-фтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновая кислота, (7) 5-амино-7-(3-амино-3-метил-1-пирролидинил)-1-циклопропил- 6 -фтор-1,4-дигидро-8-метил4-оксохинолин-3-карбоновая кислота, (8) 5-амино-7-(3-амино-4-метилен-1-пирролидинил)-1-циклопропил- 6 -фтор-1,4-дигидро -8- метил-4-оксохинолин-3-карбоновая кислота, (9) 5-амино-7-(1-амино-3-азабицикло/3.1.0/гекс- 3 - ил)- 1 -циклопропил-6-фтор-1,4-дигидро-8метил-4-оксохинолин-3-карбоновая кислота, (10) 5-амино-1-циклопропил-7-(3-диметиламино-1-пирролидинил)-6 -фтор- 1,4-дигидро-8-метил4-оксохинолин-3-карбоновая кислота, (11) 5-амино-1-циклопропил-6-фтор-1,4-дигидро-8-метил- 7 -(3-метиламино-1-пирролидинил)-4оксохинолин-3-карбоновая кислота, их стереоизомеры или их фармакологически приемлемые соли. Из перечисленных соединений особенно рекомендуются соединения (1), (4) и (5), их стереоизомеры и их фармацевтически приемлемые соли. Согласно настоящему изобретению, даются разнообразные способы получения новых производных 5-амино-8-метил-7-пирролидинилхинолин3-карбоновой кислоты вышеприведенной общей формулы (І), в том числе и разъясняемые ниже способы. Нижеследующие способы получения не следует рассматривать как исчерпывающие. Согласно одному из примеров способа получения настоящего изобретения, соединения общей формулы (І) могут быть получены реакций в растворителе производного 7-галогенированной хинолин-3-карбоновой кислоты общей формулы (III): 4 39859 NH2 Согласно второму примеру препаративного способа настоящего изобретения соединения вышеприведенной формулы (I) могут быть получены реакцией в растворителе производного борной кислоты общей формулы (V): O COOR F X 1 N CH3 F , (III) B NH2 где R1 и Х принимают вышеуказанные значения, с производным пирролидина общей формулы (IV): R R R R 2 O O 4 X N CH3 NH , N R O F 5 6 F где Х принимает вышеуказанные значения с производным пирролидина вышеприведенной формулы (IV) в присутствии или отсутствие основания с последующим, если необходимо, разрушением хелата в протонном полярном растворителе в присутствии или отсутствие основания. В реакции соединений общей формулы (V) с соединениями общей формулы (IV) может быть использован любой приемлемый растворитель. Примеры инертных растворителей включают: спирты, например: метанол, этанол, n-пропанол, изопропанол, n-бутанол и т.д.; апротонные полярные растворители, например: ацетонитрил, N,Nдиметилформамид, N-метил-2-пирролидон, диметилсульфоксид, гексаметилфосфоротриамид и т.д.; ароматические углеводороды, например, бензол, толуол и т.д.; органические основания, например,: пиридин, пиколин, лутидин, коллидин и т.д.; галогенированные углеводороды, например: дихлорметан, 1,2-дихлорэтан, хлороформ и т.д. или смеси любых из перечисленных растворителей. Могут применяться следующие основания: триэтиламин, N,N-диизопропилэтиламин, 1,3-диазабицикло/5.4.0/-7-ундецен, 1,2,2,6,6-пентаметилпиперидин, 1,4-диазабицикло/2.2.2/октан, карбонат натрия, карбонат калия, бикарбонат натрия, бикарбонат калия и т.д. Кроме того, при использования органического основания в качестве растворителя такое основание может применяться вместо вышеупомянутых. Реакция может быть осуществлена в температурном интервале - от температуры бани со льдом до температуры кипения применяемого в реакции растворителя. Применяемые в разрушении хелата протонные полярные растворители включают: спирты, например: метанол, этанол, n-пропанол, изопропанол, n-бутанол и т.д., воду или смеси указанных растворителей, или смеси апротонных растворителей, например: ацетонитрила, N,N-диметилформамида, N-метил-2-пирролидона, диметилсульфоксида, гексаметилфосфортриамида, бензола, толуола, пиридина, пиколина, лутидина, коллидина, дихлорметана, 1,2-дихлорэтана, хлороформа и т.д. с протонным полярным растворителем, например: спиртом, водой и т. д. Реакция может быть проведена в температурном интервале - от температуры бани со льдом до температуры кипения применяемого в реакции растворителя. 3 , (V) (IV) где R2, R3, R4, R5 и R6 принимают вышеуказанные значения в присутствии или отсутствие основания с последующим, если необходимо, гидролизом. В способе настоящего изобретения может быть использован любой приемлемый растворитель. Примеры инертных растворителей включают: спирты, например: метанол, этанол, n-пропанол, изопропанол, трет-бутанол и т.д.; апротонные полярные растворители, например: ацетонитрил, N,N-диметилформамид, N-метил-2-пирролидон, диметилсульфоксид, гексаметилфосфоротриамид и т.д.; ароматические углеводороды, например: бензол, толуол и т.д.; органические основания, например: пиридин, пиколин, лутидин, коллидин и т.д.; или смеси указанных растворителей. Могут быть использованы следующие основания: триэтиламин, N,N-диизопропилэтиламин, 1,8-диазабицикло/5.4.0/-7-ундецен, 1,2,2,6,6-пентаметилпиперидин, 1,4-диазабицикло/2,2,2/-октан, карбонат натрия, карбонат калия, бикарбонат натрия, бикарбонат калия и т.д. Кроме того, если органическое основание применяют в качестве растворителя, такое основание может быть использовано вместо вышеперечисленных. Реакция может быть проведена в температурном интервале - от температуры бани со льдом до температуры кипения применяемого в реакции растворителя. Гидролиз может быть осуществлен известными способами в присутствии кислоты или щелочи. В реакции кислотного гидролиза могут применяться такие кислоты, как соляная кислота, серная кислота и т.д., а в реакции щелочного гидролиза могут применяться такие основания, как гидроксид натрия, гидроксид калия и т.д. Указанные кислоты или основания могут применяться в виде водных растворов или же в виде раствора в органическом растворителе, например: метаноле, этаноле, n-бутаноле, втор-бутаноле, трет-бутаноле и т.д., возможно, с добавлением воды. Реакция гидролиза может быть осуществлена в температурном интервале - от комнатной температуры до температуры кипения применяемого в реакции растворителя. 5 39859 Согласно третьему примеру препаративного способа настоящего изобретения, соединения вышеприведенной формулы (I), где R2 - атом водорода, могут быть получены гидролизом соединения формулы (I), где R2 представляют низший алканоил или галогенированный низший алканоил, или обработкой соединения формулы (I), где R2 представляет остаток эфира карбоновой кислоты, в растворителе или без растворителя кислотой в присутствии или отсутствие отщепляющего катион агента. Гидролиз может быть проведен известными методами в присутствии кислоты или щелочи. В реакции кислотного гидролиза могут быть использованы такие кислоты, как соляная кислота, серная кислота и т.д., а в реакции щелочного гидролиза могут применяться такие основания, как гидроксид натрия, гидроксид калия и т.д. Указанные кислоты или основания могут применяться в виде водного раствора или же в виде раствора в органическом растворителе, например: метаноле, этаноле, n-бутаноле, втор-буганоле, трет-бутаноле и т.д., возможно, с добавлением воды. Реакция гидролиза может быть проведена в температурном интервале - от комнатной температуры до температуры кипения применяемого в реакции растворителя. Удаление остатка эфира карбоновой кислоты может быть осуществлено в таком растворителе, как, например, уксусная кислота, этилацетат, диоксан, вода, метанол, этанол или их смеси; в качестве отщепляющего катион агента возможно применение, например: анизола, тиоанизола и т.д.; в качестве кислоты возможно применение хлористоводородной кислоты, бромистоводородной кислоты, трифторуксусной кислоты и т.д. Удаление остатка эфира карбоновой кислоты может быть проведено в температурном интервале - от температуры бани со льдом до температуры кипения применяемого растворителя. Согласно четвертому примеру препаративного способа настоящего изобретения, соединения настоящего изобретения общей формулы (I), где R2 и/или R3, каждый, представляет низший алкил, могут быть получены реакцией соединения формулы (I), где R2 и/или R3, каждый, представляет атом водорода с галогенированным низшим алкилом в растворителе в присутствии или отсутствие основания или с альдегидом нижеследующей общей формулы (VI): дегида, желательно их применение в нитробензоле в качестве растворителя. Все указанные реакции могут быть проведены в температурном интервале - от комнатной температуры до температуры кипения применяемого в реакции растворителя. В препаративном способе настоящего изобретения исходные соединения вышеприведенных формул (III) и (V) могут быть синтезированы нижеследующим способом, подробности которого приведены в последующих примерах. Кроме того, соединения общей формулы (VII), приведенной ниже, являются известными соединениями (см. нерассмотренную патентную публикацию Японии № 62-215572: step – стадия base – основание reduction – восстановление), где X принимает вышеуказанные значения и V представляет атом галогена. Стадия 1) 3-метил-2,4,5-тригалогенбензойную кислоту (VII) нитруют с образованием соединения (VIII). На данной стадии в качестве нитрующего средства возможно применение азотной кислоты, нитрата калия, нитрата аммония и т.д., а в качестве растворителя можно применять серную кислоту, уксусную кислоту, уксусный ангидрид, трифторуксусную кислоту и т.д. Стадия 2) Соединение (VIII) обрабатывают хлорирующим средством, например: тионилхлоридом, оксалилхлоридом и т. д. в растворителе или без оного, например: хлороформе, хлористом метилене, 1,2-дихлорэтане и т. д. в присутствии R9-CHO где R9 представляет атом водорода или низший алкил в присутствии муравьиной кислоты. В данном препаративном способе в случае применения галогенированного низшего алкила могут применяться такие растворители, как, например: N,N-диметилформамид, ацетон, этанол, тетрагидрофуран, бензол, хлороформ и т.д. и такие основания, как, например: триэтиламин, карбонат калия и т.д. В случае применения альдегида общей формулы (VI) примеры таких альдегидов включают: формальдегид, ацетальдегид, пропиональдегид и т.д., и желательно применение формальдегида в виде водного раствора (формалина), а в случае ацетальдегида или пропиональ 6 39859 или отсутствие N,N-диметилформамида с образованием хлорангидрида (IX). Стадия 3) Соединение (IX) и диэтиловый эфир этоксимагниймалоновой кислоты (получен отдельно из этанола, диэтилмалоната и магния) конденсируют в растворителе, например: бензоле, толуоле и т. д. с получением, соответственно, соединения (X). Стадия 4) Соединение (X) гидролизуют и декарбоксилируют нагреванием с водой в присутствии кислоты, например: соляной кислоты, серной кислоты, р-толуолсульфокислоты и т. д. с получением, соответственно, соединения (XI). Стадия 5) Проводят реакцию соединения (XI) с этилортоформатом в присутствии или отсутствие кислоты Льюиса, например: хлорида цинка и т. д. в уксусном ангидриде с получением, соответственно, соединения (XII). Стадия 6) Реакцией соединения (XII) с циклопропиламином в растворителе получают соединение (XIII). На данной стадии может применяться любой приемлемый инертный растворитель, в том числе: спирты, например: метанол, этанол и т. д.; галогенированные углеводороды, например: хлороформ, 1,2-дихлорэтан и т.д.; ароматические углеводороды, например: бензол, толуол и т. д.; ароматические углеводороды, например: бензол, толуол и т. д. или апротонные полярные растворители, например: ацетонитрил, N,N-диметилформамид и т. д. Стадия 7) Соединение (XIII) циклизуют действием основания в растворителе в присутствии или отсутствие катализатора с получением, соответственно, соединения (XIV (II)). На данной стадии в качестве основания возможно применение карбоната калия, гидрата натрия, трет-бутоксида калия и т. д.; в качестве растворителя могут применяться простые эфиры, например: диоксан, тетрагидрофуран и т. д. или апротонные полярные растворители, например: ацетонитрил N,N-диметилформамид и т. д.; в качестве катализатора можно применять краун-эфиры, тетрабутиламмонийбромид, бензилтриэтиламмонийбромид и т. д. Стадия 8) Соединение (XIV (II)) восстанавливают в присутствии катализатора, например: никеля Ренея, палладия на угле, оксида платины и т.д. или восстанавливают в кислотных условиях металлами, например: железа, олова, цинка и т. д. с получением, соответственно, соединения (III-a (II)). На данной стадии в качестве растворителя могут применяться уксусная кислота, вода, метанол, этанол, N,N-диметилформамид и т. д., а в реакции с металлами могут применяться такие кислоты, как хлористоводородная кислота, уксусная кислота, бромистоводородная кислота и т. д. Стадия 9) Соединение (III-a (II)) гидролизуют в растворителе, например: воде, уксусной кислоте, спирте, водном спирте и т. д. в кислотных условиях, в присутствии, например: хлористоводородной кислоты, уксусной кислоты, бромистоводородной кислоты и т.д. с получением, соответственно, соединения (III-b). Стадия 10) Реакцией соединения (III-b) с эфиратом трехфтористого бора в растворителе, например: эфире, ацетоне, метилизобутилкетоне и т.д. получают, соответственно, соединение (V). Фармацевтический препарат, содержащий эффективное количество нового производного 5-амино-8-метил- 7-пирролидинилхинолин-3-карбоновой (одного или нескольких) вышеприведенной формулы (I), его стереоизомере или его фармакологически приемлемой соли, полученных вышеприведенным способом, может иметь вид капсул, таблеток, мелких гранул, просо гранул, порошка, сиропа и т.д. для перорального введения или иметь вид инъекций, суппозитория, глазных капель, глазной мази, ушного раствора или дерматологической дозированной формы. Фармацевтический препарат настоящего изобретения может быть приготовлен смешиванием фармацевтически приемлемой добавки с производным 5-амино-8метил-7-пирролидинилхинолин-3-карбоновой кислоты, его стереоизомером или его фармакологически приемлемой солью с последующей обычной обработкой смеси. При получении фармацевтического препарата, пригодного для перорального введения, или суппозитория добавка может представлять собой разбавитель, например: лактозу, D-маннит, кукурузный крахмал, кристаллическую целлюлозу и т.д.; структуратор, например: карбоксиметилцеллюлозу, кальций карбоксиметилцеллюлозу и т.д.; связующее средство, например: гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон и т.д.; смазку, например: стеарат магния, тальк и т.д.; кроющее средство, например: гидроцилцеллюлозу, сахарозу, оксид титана и т.д.; пластификатор, например: полиэтиленгликоль и т.д. или основу, например: полиэтиленгликоль или твердый жир и т.д. Фармацевтический препарат, пригодный для инъекций, или применяемый в виде глазных капель или ушных капель может содержать носители, например: солюбилизирующее средство или растворитель, например: дистиллированную воду для инъекций, солевой раствор, пропиленгликоль и т.д., применяемые для приготовления водных препаратов или препаратов для приготовления водного раствора перед употреблением; регулирующее рН средство, например: неорганические и органические кислоты и основания; придающие изотоничность средства, например: хлорид натрия, глюкозу, глицерин и т.д.; стабилизаторы и т.д. При изготовлении фармацевтического препарата, применяемого в виде глазной мази или дерматологического средства, могут применяться добавки, например, приемлемые фармацевтические ингредиенты, такие как белый петролатум, макроголь, глицерин, жидкий парафин, ткань и т.д., применяемые при получении мазей, кремов или припарок. Применение фармацевтического препарата настоящего изобретения заключается во введении больному вышеописанного препарата перорально или парентерально. Доза препарата для взрослого больного, как правило, составляет 10-1000 мг в день при пероральном введении или 1-500 мг при парентеральном введении; доза может быть увеличена или уменьшена в зависимости от состояния подлежащего лечению больного. Фармакологическое действие. Соединения настоящего изобретения считаются 5-аминированными, 8-метилированными или 7-пирролидированными аналогами следующих ссылочных сое 7 39859 динений. Превосходство соединений настоящего изобретения над ссылочными соединениями превосходит ожидания, основанные на известном уровне техники. Создатели настоящего изобретения обнаружили, что одновременное введение аминогруппы, метильной или пирролидинильной групп, соответственно, в 5-, 8- и 7- положении хинолонового ядра снижает хромосомную аберрационную активность таких соединений. Подобное влияние заместителей до сего времени не было известно, и его невозможно было ожидать на основе известного уровня техники, а именно: на основе структурного превращения ссылочных соединений. Это показано следующими результатами анализа хромосомной аберрации (методика анализа приводится ниже). Полученные результаты приведены в таблицах 1-3. Следующие соединения применялись в качестве ссылочных. Ссылочное соединение А: 7-((S)-7-амино-5азаспиро/2,4/гепт-5-ил)-1-циклопропил-6-фтор-1,4дигидро-4-оксохинолин-3-карбоновой кислоты гидрохлорид (известное соединение, нерассмотренная патентная публикация Японии № 95176/1991). Ссылочное соединение В: 5-амино-7-((S)-7амино-5 -азаспиро/2,4/гепт-5-ил)-1-циклопропил-6фтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты гидрохлорид (новое соединение). Ссылочное соединение С: 7-((S)-7-амино-5азаспиро/2,4/гепт-5-ил)-1-циклопропил-6-фтор-1,4дигидро-8-метил-4-оксохинолин-3-карбоновая кислота (известное соединение, нерассмотренная патентная публикация Японии № 95176/1991). Ссылочное соединение D: 7-((S)-3-амино-1пирролидинил)- 1 -циклопропил-6-фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота (известное соединение, нерассмотренная патентная публикация Японии № 258855/1988). Ссылочное соединение Е: 5-амино-7-((S)-3амино- 1 -пирролидинил)-1-циклопропил- 6-фтор1,4-дигидро-4-оксохинолин-3-карбоновая кислота (новое соединение). Ссылочное соединение F: 7-((S)-3-амино-1пирролидинил)-1-циклопропил-6-фтор- 1,4 -дигидро-8-метил-4-оксохинолин-3-карбоновая кислота (новое соединение). Ссылочное соединение G: 5-амино-1-циклопропил- 6-фтор-1,4-дигидро-4-оксо-7-пиперазинилхинолин-3-карбоновая кислота (известное соединение, нерассмотренная патентная публикация Японии № 28157/1990). Ссылочное соединение Н: 1-циклопропил-6фтор-1,4-дигидро- 8 -метил-4-оксо-7-пиперазинилхинолин-3-карбоновой кислоты гидрохлорид (известное соединение, нерассмотренная патентная публикация Японии № 215572/1987). Ссылочное соединение I: 5-амино-1-циклопропил- 6 -фтор-1,4-дигидро-8-метил-4-оксо-7-пипера зинил-3-карбоновой кислоты гидрохлорид (известное соединение, нерассмотренная патентная публикация Японии № 215572/1987). 1) 5-Амидирование (5-Н Þ 5 NH2). Таблица 1 показывает следующее. Наблюдение относительной активности ссылочных соединений А и В ((-) Þ (+)), D и Е ((-)Þ (3+)) должно привести к заключению о том, что введение аминогруппы в 5-положение хинолонового ядра должно увеличивать хромосомную аберрационную активность. Таким образом, следует сказать, что соединения настоящего изобретения (примеры 10 и 12), рассматриваемые, как 5-аминированные аналоги ссылочных соединений С и F, должны проявлять более высокую активность, чем ссылочные соединения С и F, соответственно, характеризующиеся высокой хромосомной аберрационной активностью. Вопреки таким ожиданиям, соединения настоящего изобретения характеризуются (-). Подобные результаты не могли быть предсказаны на основе прототипа. 2) 5-Метилирование (8-Н Þ 8 Me). Таблица 2 показывает следующее. На основе рассмотрения относительной активности ссылочных соединений А и С ((+) Þ (3+)), D и F ((-) Þ (3+)) можно ожидать, что введение метильной группы в 8-положение хинолонового ядра должно увеличить хромосомную аберрационную активность. Таким образом, можно ожидать, что соединения настоящего изобретения (примеры 10 и 12), рассматриваемые, как 8-метилированные аналоги ссылочных примеров В и Е, будут обладать более высокой активностью по сравнению с ссылочными примерами В и Е, соответственно, проявляющими хромосомную аберрационную активность. Вопреки таким ожиданиям, соединения настоящего изобретения характеризуются (-). Подобные результаты не могли быть предвидены на основе прототипа. 3) 7-Пирролидинилирование (7-пиперазинил Þ 7-пирролидинил). Из таблицы 3 следует. На основе рассмотрения относительной активности ссылочных соединений G и В ((-) Þ (+)), Н и С ((-)Þ (3+)), G и Е ((-)Þ (3+)), Н и F ((-)Þ (3+)) можно ожидать, что замена пиперазинильной группы в 7-положении хинолонового ядра пирролидинильной группой должно повысить хромосомную аберрационную активность. Таким образом, ожидается, что соединения настоящего изобретения (примеры 10 и 12), рассматриваемые, как 7-пирролидинилированные аналоги ссылочного соединения I, будут давать положительные результаты при более высокой активности, чем у ссылочного соединения I. Вопреки таким ожиданиям, соединения настоящего соединения характеризуются (-). Подобные результаты невозможно предвидеть на основе прототипа. 8 39859 Таблица 1 5-Амидирование (5-Н Þ 5 NH2) Z 1 O F Z COOH 2 N Z Испытуемое соединение Z1 А Строение Z2 Z3 (Прототип) Н N 3 Хромосомная Испытуемое соединение Z1 аберрация (-)1) H D NH2 N (+)1) H Е N NH2 H (3+) СН3 (Настоящее изобретение) (3+) F N СН3 (3+) N Н СН3 (-) H2N N СН3 (-) Пример 12 NH2 H2N H2N 1) N NH2 H2N Пример 10 (-) H2N (Настоящее изобретение) Н H H2N H2N С Хромосомная аберрация N Н H2N В Строение Z2 Z3 (Прототип) Частота хромосомной аберрации на CHL клетках, обработанных 30 мкг/мл испытуемого соединения. В других случаях приведены данные обработки 100 мкг/мл испытуемого соединения. (-:50%). Таблица 2 5-Метилирование (8-Н Þ 8-СН3) 1 Z O F Z COOH 2 N Z Испытуемое соединение Z1 А Н Строение Z2 Z3 (Прототип) N H 3 Хромосомная Испытуемое аберрация соединение Z1 (+) D Строение Z2 Z3 (Прототип) N Н H2N H2N 9 Н Хромосомная аберрация (-) 39859 Продолжение таблицы 2 Испытуемое соединение Z1 С Строение Z2 H N Z3 Хромосомная Испытуемое аберрация соединение Z1 СН3 (3+) F N NH2 (+)1) H E СН3 (3+) N H (3+) N NH2 СН3 (-) H2N N СH3 (-) Пример 12 NH2 H2N H2N 1) Хромосомная аберрация (Настоящее изобретение) H2N Пример 10 Z3 H2N (Настоящее изобретение) NH2 N H H2N B Строение Z2 Частота хромосомной аберрации на CHL клетках, обработанных 30 мкг/мл испытуемого соединения. В других случаях приведены данные обработки 100 мкг/мл испытуемого соединения. (-:50%). Таблица 3 7-Пирролидинилирование (7-пиперазинил Þ 7-пирролидинил) Z 1 O F Z COOH 2 N Z Испытуемое соединение Z1 G NH2 В Строение Z2 Z3 (Прототип) NH2 HN N N 3 Хромосомная Испытуемое аберрация соединение Z1 H (-) G NH2 H (+)1) Е NH2 Н С Н HN N N СН3 (-) Н Н СН3 (3+) F HN H (-) H (3+) HN N СН3 (-) N СН3 (3+) H2N (Настоящее изобретение) NH2 N N Н H2N I HN Хромосомная аберрация H2N H2N Н Строение Z2 Z3 (Прототип) N СН3 (Настоящее изобретение) (-) I 10 NH2 HN N СН3 (-) 39859 Продолжение таблицы 3 Испытуемое соединение Z1 Пример 10 Строение Z2 NH2 N Z3 СН3 Строение Z2 Хромосомная Испытуемое аберрация соединение Z1 (-) N Пример 12 NH2 Z3 Хромосомная аберрация СН3 (-) H2N H2N A. Частота хромосомной аберрации на CHL клетках, обработанных 30 мкг/мл испытуемого соединения. В других случаях приведены данные обработки 100 мкг/мл испытуемого соединения. (-:50%). терапии (Chemotherapy (Токио), 29, L, 76 (1981)). Применялись следующие штаммы: Staphylococcus aureus (S. Aureus), Enterococcus faecalis (E. Faecalis), Escherichia coli (E. Coli), Klebsiella pneumoniae (K. Pneumoniae), Serratia marcescens (S. Marcescens), Enterobacter cloacae (E. Cloacae), Acinetobacter calcoaceticus (A. Calcoaceticus). Полученные результаты приведены в таблицах 4-А и 4-В. Соединения настоящего изобретения проявляют прекрасную антибактериальную активность по отношению к выделенным клиническим штаммам, и полученные результаты превосходят результаты для ссылочного соединения (ципрофлоксацина). В частности, отмечается заметная разница в активности относительно грам-положительных бактерий. (Особые характеристики соединений настоящего изобретения). Прекрасное действие соединений настоящего изобретения суммировано в таблицах 4-6, в которых приведены результаты анализа следующих показателей: антибактериальной активности пролабораторных стандартных штаммов и клинически выделенных штаммов, реально вызывающих инфекционные заболевания, хромосомной аберрации, индуцирование микронуклеуса, фототоксичность, индуцирование судорог и тканевое распределение. Ссылочным соединением служил ципрофлоксацин (Каталог фирмы Мерк, 11-ое издание, № 2315). A. Антибактериальная активность. Минимальную ингибирующую концентрацию (МИК) испытуемых соединений определяют по методике с разбавлением агара, приведенной в стандартном методе Японского общества химио Таблица 4-А Антибактериальная активность (лабораторные стандартные штаммы, МИК мкг/мл) Штамм Грам Пример 10 Пример 12 Пример 14 Пример 16 Пример 18 Ципрофлоксацин S. aureus FDA 209P + 0,025 0,025 0,012 0,025 0,025 0,20 JC-1 E. coli NIHJ JC-2 0,012 0,025 0,012 0,05 0,025 0,025 K. pneumoniae PCI-602 0,003 0,006 0,006 0,003 0,006 0,012 S. marcescens IAM 1184 0,10 0,10 0,20 0,39 0,20 0,10 E. cloacae 963 0,025 0,025 0,05 0,05 0,05 0,05 Таблица 4-В Антибактериальная активность (выделенные клинически штаммы, МИК мкг/мл) Штамм S. aureus HPC527 S. aureus HPC308 S. aureus HPC292 E. faecalis HPC984 E. faecalis HPC948 E. faecalis HPC975 E. cloacae HNR1939 E. cloacae HNR1946 E. cloacae HNR1941 А.calcoaceticus HNR916 А.calcoaceticus HNR939 A. calcoaceticus HNR904 Грам + + + Пример 10 0,025 0,39 1,56 0,10 0,39 1,56 0,10 0,20 3,13 0,012 0,20 1,56 Пример 12 0,025 0,78 1,56 0,10 0,39 1,56 0,20 0,20 6,25 0,05 0,78 12,5 11 Пример 14 0,025 0,39 1,56 0,20 0,39 1,56 0,20 0,20 6,25 0,025 0,20 3,13 Пример 16 0,025 0,39 1,56 0,20 0,39 1,56 0,39 0,39 12,5 0,025 0,39 6,25 Пример Ципрофлоксацин 18 0,05 0,39 0,78 25 6,25 50 0,20 0,39 0,78 3,13 3,13 50 0,39 0,78 0,39 0,78 12,5 25 0,05 0,39 0,78 6,25 12,5 100 39859 Продолжение таблицы 4-В Штамм K. pneumoniae HNR858 K. pneumoniae HNR869 K. pneumoniae HNR828 S. marcescens HNR1544 S. marcescens HNR1792 S. marcescens HNR1767 Грам Пример 10 0,20 1,56 3,13 0,05 3,13 6,25 Пример 12 0,20 1,56 3,13 0,05 1,56 12,5 Пример 16 0,39 3,13 12,5 0,10 6,25 25 Пример Ципрофлоксацин 18 0,39 0,78 3,13 3,13 6,25 12,5 0,10 0,10 3,13 6,25 25 50 Таблица 5-В 2. Анализ хромосомной аберрации. Анализ хромосомной аберрации проводят на клеточной линии легких китайского хомячка (CHL). В качестве положительного контроля используют 2-(2-фурил)-3-(5-нитро-2-фурил)акриламид. Клетки, обработанные испытуемыми соединениями, культивируют 6 ч при 37°С в увлажненном воздухе с 5% СО3. После обработки в течение 6 ч клетки промывают. К промытым клеткам добавляют свежую среду, и культивирование продолжают еще 18 ч. Для сбора метафазных клеток за 2 ч до фиксации хромосомного препарата к культуре добавляют кольцемид. Частота хромосомной аберрации на CHL клетках, обработанных 100 мкг/мл испытуемых соединений приведена в таблице 5-А. Анализ микронуклеуса Испытуемое соединение Солевой раствор Пример 10 Пример 12 Ципрофлоксацин 1) Вероятность МНПХЭ1), (%) 0,18 0,18 0,16 2,9 Процент числа МНПХЭ на 1000 ПХЭ. Соединения настоящего изобретения не создают статистически значимого повышения вероятности возникновения МНПХЭ в сравнении с контролем (солевой раствор). 4. Фототоксичность. Самцам морских свинок линии Хартли вводят внутривенно испытуемые соединения в дозе 10 мг/кг и сразу же облучают со спины УФ-излучением в течение 90 минут. Через 24 ч после УФ облучения исследуют эритемы на спинках. Число морских свинок с эритемами указано в таблице 5-С. Ни одно соединение настоящего изобретения не отличается фототоксичностью. 5. Судороги. 1) Внутрибрюшинное (в.б.) введение. Закрепленным самцам мышей ICR в возрасте пяти недель перорально вводят фенбуфен в дозе 100 мг/кг. Тридцатью минутами позже мышам инъектируют внутрибрюшинно испытуемые соединения в дозе 100 мг/кг. После этого регистрируют наступление судорог. Число мышей с судорогами указано в таблице 5-С. Ни одно соединение настоящего изобретения не вызывает каких-либо судорог. 2) Интрацеребральновентрикулярное (и.ц.в.) введение Самцов крыс линии Вистар весом 180-220 г анестезируют пентобарбиталом натрия (45 мг/кг, в.б.) и фиксируют в стереотаксичном аппарате. Для интрацеребральновентрикулярной инъекции каждой крысе имплантируют направляющую канюлю из нержавеющей стали диаметром 0,6 мм, канюля расположена на 1,5 мм выше левого бокового желудочка головного мозга (А: 6,2, R: 1,0, Н: +1,0), по атласу De Groot (1959). Направляющую канюлю закрепляют на черепе зубным цементом и замыкают тонким зондом из нержавеющей стали диаметром 0,3 мм. Для предотвращения инфекции внутримышечно инъектируют 10000 единиц калийпенициллина G. Крыс оставляют на несколько дней в покое, чтобы оправиться от хирургической операции. Таблица 5-А Анализ хромосомной аберрации Испытуемое соединение Пример 10 Пример 12 Пример 14 Пример 16 Пример 18 Ципрофлоксацин Пример 14 0,20 1,56 3,13 0,05 3,13 6,25 Частота хромосомной аберрации 1) (-) (-) (-) (-) (-) (-) 1) Частота хромосомной аберрации на CHL клетках, обработанных 100 мкг/мл испытуемого соединения. (-:50%). Полученные для всех соединений настоящего изобретения данные во всех случаях характеризуются (-). 3. Анализ микронуклеуса. В данном анализе используют BDF 1 мышей в возрасте 9 недель. Испытуемые соединения инъектируют внутрибрюшинно в дозе 250 мг/кг. Спустя 24 ч мышей умерщвляют, и собирают костный мозг бедренной кости. Мазки костного мозга фиксируют на слайдах метанолом и по обычной методике окрашивают Гиемза. Для каждого зверька под микроскопом подсчитывают число микроядерных полихроматических эритроцитов (МНПХЭ) на 1000 полихроматичных эритроцитов (ПХЭ). В качестве положительного контроля применяют циклофосфамид. Вероятность возникновения МНПХЭ (% числа МНПХЭ на 1000 ПХЭ) показана в таблице 5-В. 12 39859 6. Тканевое распределение. В экспериментах используются крысы фермы Спраг-Доули в возрасте семи недель. Зафиксированным на ночь крысам вводят перорально испытуемые соединения в дозе 5 мг/кг. С интервалом 0,083, 0,25, 0,5, 1, 2, 4, 6, 8, 12 и 24 ч после введения крыс анестезируют эфиром и из брюшной аорты отбирают образцы крови. Из образцов крови обычным путем получают образцы плазмы. После сбора крови удаляют легкие и почки и гомогенируют с 4 мл и 7 мл, соответственно, 1 М НСІцитратного буфера (рН 4). Концентрацию испытуемых соединений в биологических жидкостях (плазма и каждая анализируемая ткань) определяют методом ЖХВД. К 0,5 мл плазмы или 0,5 г каждого тканевого гомогената добавляют соляную кислоту и эфир. Смесь встряхивают и центрифугируют. После удаления органической фазы к водной фазе добавляют водный раствор NaOH, фосфатный буфер (рН 7) и хлороформ. Смесь встряхивают и центрифугируют. Органическую фазу затем концентрируют. Остаток растворяют и подвергают ЖХВД. Концентрации испытуемых соединений в каждой биологической жидкости при Тмакс (время максимальной концентрации в плазме) приведены в таблице 6. Условия ЖХВД: Колонка - TSK-гель ODS 80™ Подвижная фаза - 0,03 М фосфатный буфер – CH3CN (3:1, рН 2,5) Скорость потока - 1,2 мл/мин Инъектируемый объем - 100 мкл Детектирование - УФ при 308 нм Концентрация соединения настоящего изобретения в легких и почках (подлежащие лечению органы) была, соответственно, в 16 и 7,4 раза выше концентрации ципрофлоксацина. Кроме того, отношения концентраций (ткань/плазма) для соединения настоящего изобретения также были выше, соответственно, в 8,6 и 4,2 раза отношений для ципрофлоксацина. Полученные данные указывают на то, что соединения настоящего изобретения отличаются хорошим тканевым распределением. Для определения судорог 30 минут спустя после внутрибрюшинной инъекции 50 мг/кг фенбуфена, вводят 20 мкг испытуемого соединения. Соединения вводят через канюлю из нержавеющей стали диаметром 0,3 мм с полиэтиленовым катетером, который на 1,5 мм длиннее направляющей канюли, с тем, чтобы катетер попадал в правый желудочек головного мозга (Н: +1). В каждом исследовании испытаниям подвергают трех крыс, и отсутствие или появление признаков судорог наблюдают, по меньшей мере, четыре часа. Положение интрацеребровентрикулярной канюли подтверждают инъектированием 10 мкл 1% голубого эванса с последующим рассечением головного мозга каждой участвующей в опытах крысы. Число подверженных судорогам крыс указано в таблице 5-С. Таблица 5-С Фототоксичность, судороги Испытуемое соединение Пример 10 Пример 12 Пример 14 Ципрофлоксацин Фототоксичность 1) 0/5 0/5 0/5 3/5 Судороги2) в.б. и.ц.в. 0/6 0/3 0/6 0/3 0/6 0/3 3/6 3/3 1) Число животных с эритемой/число животных в опыте. 2) Число животных с судорогами/число животных в опыте. Ни одно соединение настоящего изобретения не вызывает каких-либо судорог (De Groot, J. (1959). Передний мозг крыс в стереотоксичных координатах. Ver. Kon. Ned. Acad. Wet., Natuurkunde 52: 1-40). Таблица 6 Тканевое распределение Тмакс1) (ч) Испытуемое соединение Пример 10 Ципрофлоксацин a/b а b Концентрация в биологических жидкостях (мкг/мл, мкг/г)2) плазма легкие почки 0,58 4 (6,9) 8,5 (15) 0,32 0,25 (0,8) 1,15 (3,6) 16 (8,6) 7,4 (4,2) 0,25 1 1) Время максимальной концентрации испытуемого соединения в плазме. Концентрация испытуемого соединения в каждой биологической жидкости при Тмакс. Приведенные величины в скобках являются отношением концентраций (ткань/плазма). Приведенные для ципрофлоксацина величины цитируются по буклету, посвященному ципрофлоксацину и распространяемому во время Симпозиума I по новым лекарственным средствам (32-ое общее собрание Западно-Японского отделения общества химиотерапии Японии). 2) ниях настоящего изобретения. Результаты сравнения приведены в таблицах 7 и 8. Все данные по антибактериальной активности, хромосомной аберрационной активности, фототоксичности и индуцированию судорог получены Сравнение с аналогичными соединениями. Прекрасное действие соединений настоящего изобретения сравнивалось с действием аналогичных соединений, имеющих только один отличающийся заместитель из 5-, 7- и 8-заместителей в соедине 13 39859 теми же методами анализа, что и приведенные выше. Из этих результатов данные по антибактериальной активности, приведенные в таблицах 7 и 8, представлены величинами МИК (минимальной ингибирующей концентрации) относительно выделенных клинически штаммов (НРС527, НРС308 и НРС292) S. aureus, являющейся характерной грам-положительной бактерией. Таблица 7 Сравнительные данные 1 Z 1 O F Z COOH 2 N Z Испытуемое соединение Z1 Пример 10 NH2 Строение Z2 Z3 (-) 0/5 0/6 N H 0,025 0,78 3,13 (+)1) 3/5 0/6 N NH2 Н NH2 Судороги В.б. и.ц.в. 0,025 0,39 1,56 СН3 0,025 0,39 1,56 (3+) 0/4 (одна морская свинка погибла) 0/6 СН3 0,10 6,25 25 (-) 0/5 0/62) H2N I Хромосомная Фототоксичность аберрация СН3 H2N С Антибактериальная активность N H2N В 3 HN N 0/3 3/3 1) Частота хромосомной аберрации на CHL клетках, обработанных 30 мкг/мл испытуемого соединения. Поскольку после обработки 100 мкг/мл испытуемого соединения все клетки погибли, частота хромосомной аберрации не могла наблюдаться. 2) Все участвующие в экспериментах мыши имели симптомы седативного эффекта, считающегося предшественником судорог. сичность (хромосомная аберрация и фототоксичность), наблюдаемая у соединения В. Соединение настоящего изобретения (пример 10) проявляет прекрасную антибактериальную активность, столь же высокую, что и у аналогичного ссылочного соединения С (имеет только один отличающийся заместитель в 5-положении, чем и отличается от соединения настоящего изобретения), и, кроме того, не показывает токсичности (хромосомная аберрация), наблюдаемой у ссылочного соединения С. Хотя ссылочное соединение С, как и соединение настоящего изобретения, не проявляет фототоксичности, введение ссылочного соединения С вызвало смерть одной из пяти морских свинок. Полученные результаты показывают, что ссылочное соединение С более токсично, чем соединение настоящего изобретения. Соединение настоящего изобретения (пример 10) проявляет гораздо более высокую антибактериальную активность, чем аналогичное ссылочное соединение I (имеет только один отличающийся заместитель в 7-положении, чем и отличается от Антибактериальная активность: МИК (мкг/мл) испытуемого соединения по отношению к 3 штаммам S. aureus: НРС527, НРС308 и НРС292 (верхние величины: НРС527, средние величины: НРС308, нижние величины: НРС292). Хромосомная аберрация: частота хромосомной аберрации на CHL клетках, обработанных 100 мкг/мл испытуемого соединения. (-:50%). Фототоксичность: Морские свинки, 10 мг/кг, в.б. Судороги: мыши, 100 мг/кг, в.б. и крысы, 20 мкг, и.ц.в. Из таблицы 7 следует: Соединение настоящего изобретения (пример 10) проявляет более высокую антибактериальную активность, чем аналогичное ссылочное соединение В (содержит только один отличающийся заместитель в 8-положении, чем и отличается от соединения настоящего изобретения). У соединений настоящего изобретения отсутствует также ток 14 39859 соединения настоящего изобретения), и, кроме того, не показывает токсичности (судороги), наблюдаемой у ссылочного соединения I. Уже состоялась презентация на ICAAC (31-ая Международная конференция по антибактериаль ным средствам и химиотерапии, Чикаго, Иллинойс, реферат № 1507 (1991)), касающаяся высокой хромосомной аберрационной активности ссылочного соединения С. Таблица 8 Сравнительные данные 2 Z 1 O F Z COOH 2 N Z Испытуемое соединение Z1 Строение Z2 Z3 0,025 0,78 1,56 (-) 0/5 0/6 0/3 N H 0,05 3,13 50 (3+) 0/3 (две морских свинки погибли) 0/6 - N NH2 CH3 0,05 0,78 3,13 (3+) 4/5 0/6 - CH3 0,10 6,25 25 (-) 0/5 0/61) 3/3 H2N H H2N I NH2 Судороги в.б. и.ц.в. CH3 H2N F Антибактериальная Хромосомная Фототоксичность активность аберация N Пример 12 NH2 E 3 HN N 1) Все участвующие в экспериментах мыши имели симптомы седативного эффекта, считающегося предшественником судорог. Антибактериальная активность: МИК (мкг/мл) испытуемого соединения по отношению к 3 штаммам S. aureus: НРС527, НРС308 и НРС292 (верхние величины: НРС527, средние величины: НРС308, нижние величины: НРС292). Хромосомная аберрация: частота хромосомной аберрации на CHL клетках, обработанных 100 мкг/мл испытуемого соединения. (-:50%). Фототоксичность: морские свинки, 10 мг/кг, в.б. Судороги: мыши, 100 мг/кг, в.б. и крысы, 20 мкг, и.ц.в. Таблица 8 иллюстрирует следующее. Соединение настоящего изобретения (пример 12) проявляет гораздо более высокую антибактериальную активность, чем ссылочное соединение Е (имеет только один отличающийся заместитель в 8-положении, чем и отличается от соединения настоящего изобретения), и, кроме того, не показывает токсичности (хромосомная аберрация), наблюдаемой у ссылочного соединения Е. Хотя ссылочное соединение Е, как и соединение на стоящего изобретения, не проявляет фототоксичности, введение ссылочного соединения Е привело к гибели двух из пяти морских свинок. Полученные результаты показывают, что ссылочное соединение Е гораздо более токсично, чем соединение настоящего изобретения. Соединение настоящего изобретения (пример 12) проявляет более высокую антибактериальную активность, чем ссылочное соединение F (имеет только один отличающийся заместитель в 5положении, в чем и состоит его отличие от соединения настоящего изобретения), и, кроме того, не показывает токсичности (хромосомная аберрация и фототоксичность), наблюдаемой у ссылочного соединения. Соединение настоящего изобретения (пример 12) проявляет гораздо более высокую антибактериальную активность, чем аналогичное ссылочное соединение I (имеет только один отличающийся заместитель в 7-положении, чем и отличается от соединения настоящего изобретения), и, кроме того, не показывает токсичности (судороги), наблюдаемой у ссылочного соединения I. 15 39859 Токсичность (например: хромосомная аберрация, фототоксичность и судороги), характерная для некоторых антибактериальных средств с хинолиновым ядром, создает серьезные затруднения климатическому применению таких средств. Соединения настоящего изобретения решают эту проблему, вследствие чего обладают большим потенциалом в качестве следующего поколения антибактериальных средств. Примеры. Настоящее изобретение далее иллюстрируется следующими примерами. Примеры приведены лишь с целью иллюстрации, и их не следует рассматривать как исчерпывающие. Пример 1. 2.4.5-триФтор-3-метил-6-нитробензойная кислота. К перемешиваемой смеси 370 мл концентрированной серной кислоты и 61,2 мл 70% азотной кислоты добавляют при перемешивании порциями при 55-70°C 36,6 г 2,4,5-трифтор-3-метилбензойной кислоты. После выдерживания в течение 2 часов при комнатной температуре реакционную смесь вливают в лед и экстрагируют изопропиловым эфиром. Объединенные экстракты промывают рассолом, сушат, выпаривают и получают в виде желтых кристаллов 30,6 г целевого соединения. ЯМР-спектр d (CD3CD) ч/млн: 2,29 (3Н, t, J= =2 Гц). Пример 2. Диэтиловый эфир (2,4,5-трифтор-3-метил-6нитробензоил)малоновой кислоты. Суспензию 27 г 2,4,5,-трифтор-3-метил-6-нитробензойной кислоты, 19,5 мл оксалилхлорида и нескольких капель N,N-диметилформамида в 270 мл хлористого метилена перемешивают 2 часа при комнатной температуре. Испарением реакционной смеси получают 2,4,5-трифтор-3-метил-6-нитробензоилхлорид. Отдельно к суспензии 3,08 г магния и нескольких капель четыреххлористого углерода в 6,4 мл абсолютного этанола при 50°С по каплям прибавляют раствор 19,2 мл диэтилмалоната в 12 мл абсолютного этанола и затем перемешивают 1,5 часа при той же температуре. Реакционную смесь испаряют, растворяют в толуоле и вновь испаряют. К раствору полученного остатка в 30 мл толуола при охлаждении льдом прибавляют по каплям раствор 2,4,5-трифтор-3-метил-6-нитробензоилхлорида, полученного ранее, в 30 мл толуола. После выдерживания в течение 2 часов при комнатной температуре к реакционной смеси добавляют 100 мл 5%-ой серной кислоты и полученный раствор экстрагируют диэтиловым эфиром. Объединенные органические экстракты промывают рассолом, сушат и после испарения получают в виде коричневого масла 47,3 г целевого соединения. ЯМР-спектр d (СDСІ3) ч/млн: 1,12 (3Н, t, J= =7,5 Гц), 1,38 (3Н, t, J=7,5 Гц), 2,33 (3Н, t, J=2 Гц), 3,36 14,18 (в целом 1Н, каждый s), 4,07 (2H, q, J=7,5 Гц), 4,38 (2H, q, J=7,5 Гц). Пример 3. Этиловый эфир (2,4,5-трифтор-3-метил-6-нитробензоил)уксусной кислоты. Суспензию 45,3 г этилового эфира (2,4,5-трифтор-3-метил-6-нитробензоил)малоновой кислоты и 30 мг р-толуолсульфокислоты в 120 мл воды кипятят 50 минут. После охлаждения реакционную смесь экстрагируют диэтиловым эфиром. Объединенные органические экстракты сушат после промывания рассолом и испарением получают в виде коричневого масла 34,2 г целевого соединения. ЯМР-спектр d (CDCI3) ч/млн: 1,26, 1,34 (всего 3Н, каждый t, J=7 Гц), 2,33, 2,35 (всего 3Н, каждый t, J=2,5 Гц), 3,91, 5,48, 12,34 (всего 2H, каждый s), 4,2, 4,28 (всего 2H, каждый q, J=7 Гц). Пример 4. Этиловый эфир 3-циклопропиламино-2-(2,4,6трифтор-3-метил-6-нитробензоил)акриловой кислоты. Смесь 31,9 г этилового эфира (2,4,5-трифтор-3-метил-6-нитробензоил)уксусной кислоты, 26,2 мл этилортоформата и 23,8 мг уксусного ангидрита кипятят 1 час. Испарением реакционной смеси получают 46,2 г этилового эфира 3-этокси2-(2,4,5-трифтор-3-метил- 6-нитробензоил)акриловой кислоты в виде коричневого масла. К раствору 45,4 г полученного соединения в 328 мл этанола при охлаждении льдом и перемешивании по каплям прибавляют 9,6 мл циклопропиламина. После выдерживания 30 минут при комнатной температуре реакционную смесь испаряют и очисткой остатка колоночной хроматографией (силикагель, nгексан-хлористый метилен (1:1)) получают в виде желтых кристаллов 28,8 целевого соединения. Перекристаллизацией из изопропилового эфира получают желтые иглы с температурой плавления 115-115,5°С. Анализ для С16Н15F3N2О5: Вычислено, %: С, 51,62; Н, 4,06; N, 7,52. Найдено, %: С, 51,57; Н, 3,92; N, 7,53. Пример 5. Этиловый эфир 1-циклопропил-6,7-дифтор1,4-дигидро-8-метил-5-нитро-4-оксохинолин-3-карбоновой кислоты К раствору 27,1 г этилового эфира 3-циклопропиламино-2-(2,4,5-трифтор-3-метил-6-нитробензоил)акриловой кислоты в 270 мл 1,4-диоксана порциями прибавляют 3,2 г гидрида натрия (60%-ая дисперсия в минеральном масле) и перемешивают один час при комнатной температуре. К реакционной смеси добавляют 300 мл воды, выпавшие в осадок кристаллы отделяют фильтрованием и получают в виде бесцветных кристаллов 19,5 г целевого соединения, перекристаллизацией которого из N,N-диметилформамида получают бесцветные иглы с температурой плавления 260-26З°С. Анализ для С16Н14F2N2O5: Вычислено, %: С, 54,55; Н, 4,01; N, 7,95. Найдено, %: С, 54,51; Н, 4,00; N, 7,90. Пример 6. Этиловый эфир 5-амино-1-циклопропил-6,7дифтор-1,4-дигидро-8-метил- 4-оксохинолин-3-карбоновой кислоты. Суспензию 18,5 г этилового эфира 1-циклопропил-6,7-дифтор-1,4-дигидро-8-метил-5-нитро-4оксохинолин-3-карбоновой кислоты, 10 мл никеля Ренея в 300 мл уксусной кислоты гидрируют 1,5 часа при комнатной температуре и атмосферном давлении. Катализатор отфильтровывают и полученный фильтрат испаряют. К остатку добавляют 150 мл 10%-го водного раствора карбоната 16 39859 калия и смесь экстрагируют хлористым метиленом. Объединенные органические экстракты сушат и испарением получают 14,8 г целевого соединения в виде слегка желтых кристаллов, перекристаллизацией которых из ацетонитрила получают слегка желтые иглы с температурой плавления 182,5-185,5°С. Анализ для C16H16F2N2O3: Вычислено, %: С, 59,62; Н, 5,00; N, 8,69. Найдено, %: С, 59,74; Н, 5,06; N, 8,60. Пример 7. 5-амино-1-циклопропйл- 6,7-дифтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновая кислота. Смесь 14,8 г этилового эфира 5-амино-1-циклопропил-6,7-дифтор- 1,4-дигидро-8-метил-4-оксохинолин-3-карбоновой кислоты, 37,2 мл соляной кислоты и 150 мл 90%-ой уксусной кислоты кипятят 2 часа. После охлаждения осадившиеся кристаллы отфильтровывают и промывают водой с получением 11,8 г целевого соединения в виде желтых кристаллов. Последующей перекристаллизацией из N,N-диметилформамида получают желтые кристаллы с температурой плавления 290,5°С (разл.). Анализ для C14H12F2N2O3: Вычислено, %: С, 57,15; Н, 4,11; N, 9,52. Найдено, %: С, 57,10; Н, 4,03; N, 9,53. Пример 8. /5-амино-1-циклопропил - 6,7- дифтор- 1,4 -дигидро- 8 -метил-4-оксохинолин-3-карбоксилато-О3, О4/дифторборон(5-амино- 1 -циклопропил)- 6,7-дифтор-1,4-дигидро-8-метил-4-оксохинолин- 3-карбоновой кислоты BF2 хелат). Смесь 5 г 5-амино-1-циклопропил-6,7-дифтор1,4-дигидро-8-метил- 4 -оксохинолин-3-карбоновой кислоты, 3,13 мл эфирата трехфтористого бора и 75 мл метилизобутилкетона кипятят 1 час. После охлаждения осадившиеся кристаллы отфильтровывают и промыванием диэтиловым эфиром получают 5,38 г целевого соединения в виде желтых кристаллов. ЯМР-спектр d (диметилсульфоксид-d6) ч/млн: 1,08-1,15 (2Н, m), 1,21-1,3 (2Н, m), 2,67 (3Н, d, J=2,5 Гц), 4,52-4,59 (1Н, m), 7,28 (2Н, br s), 9,1 (1H, s). Пример 9. 5-амино-1-цикдопропил- 6-фтор-1,4-дигидро-8метил- 4-оксо-7-((S)-7-трифторацетиламино-5-азаспиро/2,4/гепт-5-ил)хинолин-3-карбоновая кислота. Смесь 2,13 /5-амино-1-циклопропил-6,7-дифтор-1,4- дигидро-8-метил-4-оксохинолин-3-карбоксилато-О3,О4/дифторборона, 2,28 г гидрохлорида (S)-7-трифторацетиламино- 6 -азаспиро/2,4/-гептана ([a]D20 -54,1° (с=0,1, Н2О)), 3,12 мл триэтиламина и 8,5 мл диметилсульфоксида перемешивают 4 дня при 30°С. К реакционной смеси при охлаждении льдом добавляют воду. Полученную смесь подкисляют 10%-ой соляной кислотой до рН 3, экстрагируют хлористым метиленом, объединенные органические экстракты промывают рассолом, сушат над сульфатом натрия и после испарения получают 2,04 г темно-коричневых кристаллов. Очисткой кристаллов колоночной хроматографией (силикагель, хлористый метилен-метанол (50:1-10:1)) получают 0,38 г желтых кристаллов. Смесь 0,38 г полученных кристаллов, 0,38 мл триэтиламина и 8 мл метанола кипятят 9 часов и затем испаряют. К остатку добавляют воду, выпавшие в осадок кристаллы отфильтровывают и после промывания водой, изопропанолом и диэтиловым эфиром получают 0,26 г целевого соединения в виде желтых кристаллов. Последующей перекристаллизацией из смеси хлористого метилена с метанолом получают желтые кристаллы с температурой плавления 246,5-248°С. Анализ для C22H22F4N4O4: Вычислено, %: С, 54,77; Н, 4,6; N, 11,61. Найдено, %: С, 54,57; Н, 4,7; N, 11,56. Удельное вращение [a]D20 -135,6° (с=0,1, ДМФА). Пример 10. 5-амино-7-((S)-7-амино- 5 -азаспиро/2,4,гепт-5ил)-1-циклопропил-6-фтор- 1,4-дигидро-8-метил-4оксохинолин-3-карбоновая кислота. Смесь 0,26 г 5-амино-1-циклопропил-6-фтор1,4-дигидро- 8 -метил- 4-оксо-7-((S)-7-трифторацетиламино-5-азаспиро/2,4/-гепт-5-ил)хинолин-3-карбоновой кислоты, 0,18 г гидроксида калия и 1,8 мл воды перемешивают 0,5 часа при комнатной температуре. Реакционную смесь нейтрализуют 10%-ой соляной кислотой до рН 8, выпавшие в осадок кристаллы отфильтровывают и после промывания водой получают 0,21 г целевого соединения, перекристаллизацией которого из ацетонитрила получают 0,16 г желтых призм с температурой плавления 216,5-218°С. Анализ для C20H22FN4O3: Вычислено, %: С, 62,16; Н, 6,00; N, 14,50. Найдено, %: С, 62,13; Н, 6,00; N, 14,64. Удельное вращение [a]D20 -48° (с=0,05, ДМФА). Пример 11. 5-амино-1-циклопропил-6-фтор-1,4 -дигидро-8метил- 4-оксо-7-((S)-3-трифторацетиламино-1-пирролидинил)хинолин-3-карбоновая кислота. Смесь 2,5 г (5-амино-1-циклопропил-6,7-дифтор-1,4-дигидро-8-метил- 4-оксохинолин-3-карбоксилато-О3,О4)дифторборона, 3,2 г гидрохлорида (S)-3-трифторацетиламинопирролидина ([a]D20 28,1° (с=1, МеОН)), 3,26 мл триэтиламина и 10 мл диметилсульфоксида перемешивают 3 дня при 30°С. Реакционную смесь подкисляют 10 мл 10%-ой соляной кислоты, экстрагируют хлористым метиленом, объединенные органические экстракты сушат и после испарения получают 3,66 г желтых кристаллов. Смесь 3,66 г полученных кристаллов, 3,8 мл триэтиламина и 30 мл метанола кипятят 3,5 часа. Выпавшие в осадок кристаллы отфильтровывают и получают 0,72 г целевого соединения в виде желтых кристаллов. Последующей перекристаллизацией из ацетонитрила получают 0,41 г желтых кристаллов с температурой плавления 238,5-240°С. Анализ для C20H20F4N4O4: Вычислено, %: С, 52,63; Н, 4,42; N, 12,28. Найдено, %: С, 52,64; Н, 4,37; N, 12,35. Удельное вращение [a]D20 -28,1° (с=0,1, ДМСО). Пример 12. 5-амино-7-((S)-3-амино-1-пирролидинил)-1-циклопропил-6-фтор-1,4-дигидро - 4 - оксохинолин-3карбоновой кислоты гидрохлорид. Смесь 0,62 г 5-амино-1-циклопропил-6-фтор1,4-дигидро-8-метил- 4 - оксо-7-((S)-3-трифтораце 17 39859 тиламино-1-пирролидинил)хинолин- 3 -карбоновой кислоты, 0,57 г гидроксида калия и 10 мл воды перемешивают 1 час при комнатной температуре. Реакционную смесь нейтрализуют 10%-ой соляной кислотой и испаряют. Остаток разбавляют этанолом, нерастворимые вещества отфильтровывают и полученный фильтрат испаряют. К раствору остатка в ацетоне добавляют этанольный раствор хлористого водорода и отфильтровыванием образовавшихся кристаллов получают 0,53 г желтого кристаллического продукта. Последующей перекристаллизацией продукта из метанола получают 40 мг целевого соединения в виде желтых кристаллов с температурой плавления 263,5°С (разл.). Анализ для C18H21FN4O3 HCl: Вычислено, %: С, 54,48; Н, 5,59; N, 14,12. Найдено, %: С, 54,22; Н, 5,61; N, 13,88. Удельное вращение [a]D20 -37,4° (с=0,1, Н2О). Пример 13. 5-амино-1-циклопропил-6-фтор- 1,4-дигидро-8метил- 7 -(цис- 4 -метил-3-трифторацетиламино-1пирролидинил)-4-оксохинолин-3-карбоновая кислота. Смесь 4 г (5-амино-1-циклопропил-6,7-дифтор-1,4-дигидро-8-метил-4 -оксохинолин-3-карбоксилато-О3,О4)дифторборона, 4,08 г гидрохлорида цис-4-метил-3 -трифторацетиламинопирролидина, 5,09 мл N,N-диизопропилэтиламина и 16 мл диметилсульфоксида перемешивают 3 дня при 30°С. К реакционной смеси при охлаждении льдом добавляют воду и хлористый метилен и полученную смесь перемешивают при комнатной температуре. Выпавшие в осадок кристаллы отфильтровывают и промыванием хлористым метиленом получают 0,99 г желтовато-коричневых кристаллов (А). Слой хлористого метилена в фильтрате промывают водой и рассолом, сушат над сульфатом натрия и испаряют. Обработкой остатка хлористым метиленом получают 1,15 г желтовато-коричневых кристаллов (В). Фильтрат испаряют и остаток очищают колоночной хроматографией (силикагель, хлористый метилен-метанол (110:1) с получением 0,25 г желтовато-коричневых кристаллов (С). Смесь 2,39 г полученных кристаллов (А, В и С), 2,42 мл триэтиламина, 48 мл метанола и 24 мл 1,2-дихлорэтана кипятят 9 часов и затем испаряют. К остатку добавляют воду и смесь подкисляют 10%-ой соляной кислотой до рН 4. Выпавшие в осадок кристаллы отфильтровывают и после промывания водой, изопропанолом и диэтиловым эфиром получают 2,24 г целевого соединения в виде желтых кристаллов. Последующей перекристаллизацией кристаллов из смеси N,N-диметилформамида с этанолом получают желтые иглы с температурой плавления 253-254,5°С. Анализ для C21H22F4N4O4: Вычислено, %: С, 53,62; Н, 4,71; N, 11,91. Найдено, %: С, 53,41; Н, 4,92; N, 11,70. Пример 14. 5-амино-7-(цис-3-амино-4-метил-1-пирролидинил)-1-циклопропил-6-фтор- 1,4 -дигидро-8-метил4-оксохинолин-3-карбоновая кислота. Смесь 2 г 5-амино-1-циклопропил-6-фтор-1,4дигидро-8-метил-7-(цис-4-метил-3-трифторацетиламино-1-пирролидинил)-4-оксохинолин-3-карбоновой кислоты, 1,4 г гидроксида калия и 14 мл воды перемешивают 1 час при комнатной температуре и затем нейтрализуют 10%-ой водной соляной кислотой до рН 8. Выпавшие в осадок кристаллы отфильтровывают и после промывания водой, изопропанолом и диэтиловым эфиром получают 1,65 г целевого соединения в виде желтых кристаллов. Последующей перекристаллизацией кристаллов из смеси хлористого метилена с метанолом получают 1,32 г желтых призм с температурой плавления 213,5-215°С. Анализ для С19Н23FN4O3: Вычислено, %: С, 60,95; Н, 6,19; N, 14,96. Найдено, %: С, 60,83; Н, 6,35; N, 14,83. Пример 15. 5-амино- 1 -циклопропил-7-((S)-4.4-диметил-3трифторацетиламино- 1 -пирролидинил)- 6 - фтор1,4-дигидро-8-метил-4-оксохинолин- 3-карбоновая кислота. Смесь 4 г (5-амино-1-циклопропил-6,7-дифтор- 1,4-дигидро-8-метил-4-oкcoxинoлин-3-кapбoкcилaтo-O3,O4)дифтopбopoнa, 4,32 г гидрохлорида (S)- 4,4 - диметил-3-трифторацетиламинопирролидина ([a]D20 +25,6° (c=1, MeOH)), 5,09 мл N,N-диизoпpoпилэтилaминa и 16 мл диметилсульфоксида перемешивают 3 дня при 30°С. Реакционную смесь при охлаждении льдом разбавляют водой, подкисляют 10%-ой соляной кислотой до рН 3 и экстрагируют хлористым метиленом. Объединенные органические экстракты промывают водой и рассолом, сушат над сульфатом натрия и испаряют. Остаток очищают колоночной хроматографией (силикагель, хлористый метилен-метанол (100:1) и получают желтовато-коричневые кристаллы, промыванием которых диэтиловым эфиром получают 0,68 г желтовато-коричневых кристаллов. Смесь 0,68 г полученных кристаллов, 0,67 мл триэтиламина, 14 мл метанола и 11 мл 1,2-дихлорэтана кипятят 10 часов и затем испаряют. К остатку добавляют воду, образовавшиеся кристаллы отфильтровывают и после промывания водой получают 0,57 г целевого соединения в виде желтых кристаллов. Перекристаллизацией кристаллов из метанола получают желтые столбики с температурой плавления 253,5-255°С. Анализ для C22H24F4N4О4: Вычислено, %: С, 54,54; Н, 4,99; N, 11,57. Найдено, %: С, 54,33; Н, 4,88; N, 11,63. Удельное вращение [a]D20 +42,6° (с=0,1, MeOH). Пример 16. 5-амино-7-((S)- 3 -амино- 4,4-диметил-1-пирролидинил)-1-циклопропил-6-фтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновая кислота. Смесь 0,47 г 5-амино-1-циклопропил-7-((S)4,4-диметил-3-трифторацетиламино-1-пирролидинил)-6-фтор-1,4-дигидро-8-метил-4-оксохинолин-3карбоновой кислоты, 0,32 г гидроксида калия и 3,2 мл воды перемешивают 1 час при комнатной температуре. Реакционную смесь нейтрализуют 10%-ой соляной кислотой до рН 8 э экстрагируют хлористым метиленом. Объединенные органические экстракты промывают водой и рассолом, сушат над сульфатом натрия и испаряют. Обработкой остатка смесью ацетона с диэтиловым эфиром получают 0,3 г целевого соединения в виде желтых кристаллов. Последующей перекристаллизацией кристаллов из ацетонитрила получают 18 39859 0,18 г желтых игл с температурой плавления 191,5-193°С. Анализ для C20H25FN4O3: Вычислено, %: С, 61,84; Н, 6,49; N, 14,42. Найдено, %: С, 61,70; Н, 6,51; N, 14,32. Удельное вращение [a]D20 -190,9° (с=0,1, 0,1 N NaOH). Пример 17. 5-амино- 7 -(3 -трет-бутоксикарбониламино- 3метил - 1 - пирролидинил)- 1-циклопропил-6-фтор1,4-дигидро-8-метил- 4- оксохинолин-3-карбоновая кислота. Смесь 3 г (5-амино-1-циклопропил-6,7-дифтор-1,4-дигидро-8-метил- 4-оксохинолин-3-карбоксилато-О3,О4)-дифторборона, 2,11 г 3-трет-бутоксикарбониламино-3-метилпирролидина, 1,53 мл N,N-диизопропилэтиламина и 12 мл диметилсульфоксида перемешивают 2,5 дня при 30°С. Реакционную смесь разбавляют водой и экстрагируют хлористым метиленом. Объединенные органические экстракты промывают рассолом, сушат над сульфатом натрия и испаряют. Остаток очищают колоночной хроматографией (силикагель, хлористый метилен-метанол (99:1)) и получают 0,97 г желтых кристаллов. Смесь 0,97 г полученных кристаллов, 1 мл триэтиламина и 40 мл метанола кипятят 2,5 часа и затем испаряют. К остатку добавляют воду, выпавшие в осадок кристаллы отфильтровывают и после промывания водой получают 0,84 г целевого соединения в виде желтых кристаллов, перекристаллизацией которых из ацетонитрила получают 0,76 г желтых игл с температурой плавления 198-201°С. Анализ для C24H21FN4O5: Вычислено, %: С, 60,75; Н, 6,58; N, 11,81. Найдено, %: С, 60,43; Н, 6,66; N, 11,56. Пример 18. 5-амино-7-(3-амино-3-метил-1-пирролидинил)1-циклопропил - 6 -фтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновая кислота К 0,76 г 5-амино-7-(3-трет-бутоксикарбониламино-3-метил-1-пирролидинил)-1-циклопропил-6фтор-1,4-дигидро-8- метил-4-оксохинолин-3-карбоновой кислоты добавляют 1,1 мл соляной кислоты и затем перемешивают 2 часа при комнатной температуре. К реакционной смеси при охлаждении льдом добавляют 0,89 г гидроксида калия в 1,8 мл воды, и образовавшуюся смесь нейтрализуют 10%-ой соляной кислотой до рН 8. Выпавшие в осадок кристаллы отфильтровывают и промыванием водой получают 0,33 г целевого соединения в виде желтых кристаллов. Последующей перекристаллизацией продукта из смеси хлористого метилена с метанолом получают 0,3 г желтых кристаллов с температурой плавления 217-221°С. Анализ для C19H23FN4O31/4 Н2О: Вычислено, %: С, 60,23; Н, 5,26; N, 14,79. Найдено, %: С, 59,98; Н, 6,25; N, 14,53. Пример 19. 5-амино-7-((S)-7-трет - бутоксикарбониламино5-азаспиро/2,4/-гепт - 5-ил)-1-циклопропил-6-фтор1,4-дигидро-8-метил- 4-оксохинолин-3-карбоновая кислота. Смесь 6 г (5-амино-1-циклопропил-6,7-дифтор-1,4-дигидро-8- метил-4-oкcoxинoлин-3-кapбoкcилaтo-О3,О4)дифтopбopoнa, 5,59 г (S)-7-трет-бутоксикарбониламино-5-азаспиро/2.4/гептана ([a]D20 -46,6° (с=1, МеОН)), 3,06 мл N,N-диизопропилэтиламина и 24 мл диметилсульфоксида перемешивают 3 дня при 30°С. Реакционную смесь разбавляют водой, нейтрализуют 10%-ой соляной кислотой до рН 7 и экстрагируют хлористым метиленом. Объединенные органические экстракты промывают водой и рассолом, сушат над сульфатом натрия и испаряют. Остаток очищают колоночной хроматографией (силикагель, хлористый метилен-метанол (100:1)) с получением желтых кристаллов, которые промывают смесью хлористого метилена с диэтиловым эфиром. Получено 3,17 г бледно-желтых кристаллов. Смесь 3,14 г полученных кристаллов, 3,09 мл триэтиламина, 62 мл метанола и 31 мл 1,2-дихлорэтана кипятят 14 часов и затем испаряют. Остаток разбавляют водой и нейтрализуют 10%-ой соляной кислотой до рН 7. Образовавшиеся кристаллы отфильтровывают и после промывания водой, изопропанолом и диэтиловым эфиром получают 2,79 г целевого соединения в виде бледно-желтых кристаллов, перекристаллизацией которых из смеси хлористого метилена получают бледно-желтые иглы с температурой плавления 217,5-219°С. Анализ для C25H31FN4O5: Вычислено, %: С, 61,72; Н, 6,42; N, 11,52. Найдено, %: С, 61,71; Н, 6,48; N, 11,39. . Удельное вращение [a]D20 -96,6° (с=0,1, ДМФА). Пример 20. 5-амино-7-((S)- 7- амино-5-азаспиро/2,4/гепт-5ил)-1-циклопропил- 6-фтор-1,4-дигидро-8-метил-4оксохинолин-3-карбоновая кислота К 8,8 г 5-амино-7-((S)-7-трет-бутоксикарбониламино-5-азаспиро/2,4/гепт- 5-ил)-1-циклопропил-6фтор- 1,4-дигидро-8-метил-4-оксохинолин-3-карбоновой кислоты добавляют 11 мл соляной кислоты и затем перемешивают 1,5 часа при комнатной температуре. К реакционной смеси при охлаждении льдом добавляют раствор 10,5 г гидроксида калия в 32 мл воды и полученную смесь нейтрализуют 10%-ой соляной кислотой до рН 8. Образовавшиеся кристаллы отфильтровывают и промывают водой. Кристаллы разбавляют хлористым метиленом, неорганические вещества отфильтровывают и полученный фильтрат испаряют. Ополаскиванием диэтиловым эфиром получают 5,53 г целевого соединения в виде желтых кристаллов. Перекристаллизацией из ацетонитрила получают желтые призмы, идентифицированные, как соединение примера 10. По обычной методике получены следующие соли: Метансульфонат: внешний вид - желтые иглы (ЕtOН-Н2О) температура плавления - 263-264°С (разл.) анализ для С20Н23FN4O3 СH4О3S: вычислено, %: С, 52,27; Н, 5,64; N, 11,61. найдено, %: С, 52,02; Н, 5,54; N, 11,53. удельное вращение [a]D20 -93,6° (с=0,1, МеОН); р-толуолсульфонат: внешний вид - желтые кристаллы (EtOH) температура плавления - 188-189,5°C анализ для С20Н23FN4O3 C7H8O3S 1/2 H2O: вычислено, %: С, 57,13; Н, 5,68; N, 9,87 найдено, %: С, 56,95; Н, 5,85; N, 9,77 19 39859 удельное вращение [a]D20 -73,1° (c=0,05, MeOH); Гидрохлорид: внешний вид - желтые кристаллы (ЕtOН-Н2О) температура плавления - 276-280°С (разл.) анализ для C20H23FN4O3 HCl: вычислено, %: С, 56,80; Н, 5,72; N, 13,25 найдено, %: С, 56,72; Н, 5,79; N, 13,04. Пример 21. 5-амино-7-(3 - трет - бутоксикарбониламино-3метил - 1 - пирролидинил)- 1-циклопропил-6-фтор1,4-дигидро-8-метил- 4 -оксохинолин-3-карбоновая кислота (изомер А). Смесь 3,00 г (5-амино-1-циклопропил-6,7-дифтор-1,4-дигидро- 8-метил-4-оксохинолин-3-карбоксилато-О3,О4)дифторборона, 2,11 г 3-трет-бутоксикарбониламино-3-метилпирролидина (изомер А, ([a]D20 +7,4° (с=0,5, MeOH)), 1,53 мл N,N-диизопропилэтиламина и 12 мл диметилсульфоксида перемешивают 1,5 дня при 30°С. Затем реакционную смесь переносят в 60 мл ледяной воды. К реакционной смеси добавляют 60 мл хлористого метилена. После перемешивания при комнатной температуре нерастворимые вещества отфильтровывают, водный слой отделяют и экстрагируют хлористым метиленом. Объединенные слои хлористого метилена промывают рассолом, сушат над сульфатом натрия и испаряют. Остаток очищают колоночной хроматографией (силикагель, хлористый метилен и хлористый метилен-метанол (100:1)) и получают 1,18 г желтых кристаллов. Смесь 1,18 г полученных кристаллов, 1,19 мл триэтиламина и 24 мл метанола кипятят 3 часа и затем испаряют. К остатку добавляют воду, выпавшие в осадок кристаллы отфильтровывают и после промывания водой получают 0,96 г целевого соединения в виде желтых кристаллов, перекристаллизацией которых из ацетонитрила получают бледно-желтые иглы с температурой плавления 213,5-214,5°С. Анализ для C24H31FN4O5: Вычислено, %: С, 60,75; Н, 6,58; N, 11,81. Найдено, %: С, 60,63; Н, 6,55; N, 11,80. Удельное вращение [a]D20 +47° (с=0,1, МеОН). Пример 22. 5-амино-7-(3-амино-3-метил-1-пирролидинил)1-циклопропил- 6 - фтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновой кислоты (изомер А) метансульфонат К 0,8 г 5-амино-7-(3-трет-бутоксикарбониламино-3-метил-1-пирролидинил)-1-циклопропил-6фтор- 1,4-дигидро-8-метил-4-оксохинолин-3-карбоновой кислоты (изомер А, получение - см. пример 21) при охлаждении льдом добавляют 0,98 мл соляной кислоты, после чего перемешивают 2 часа при комнатной температуре. К реакционной смеси добавляют 0,93 г гидроксида калия в 3,1 мл воды и перемешивают 1 час при комнатной температуре. Образовавшуюся смесь нейтрализуют 10%-ой соляной кислотой до рН 8. Выпавшие в осадок кристаллы отфильтровывают и после промывания водой получают 0,55 г желтых кристаллов, которые по обычной методике превращают в метансульфонат. Перекристаллизацией из смеси этанола с водой (9:1) получают 0,43 г целевого соединения в виде желтых игл с температурой плавления 261-262,5°С. Анализ для С19Н23FN4O3 CH4O3S: Вычислено, %: С, 51,05; Н, 5,78; N, 11,91. Найдено, %: С, 50,89; Н, 5,93; N, 11,78. Удельное вращение [a|D20 -50,6° (с=0,1, МеОН). Пример 23. 5-амино - 7 - (3-трет-бутоксикарбониламино-3метил - 1 - пирролидинил)- 1-циклопропил-6-фтор1,4-дигидро-8-метил -4- оксохинолин-3-карбоновая кислота (изомер В). Смесь 3,00 г (5-амино-1-циклопропил-6,7-дифтор- 1,4-дигидро-8-метил-4-оксохинолин-3-карбоксилато-О3,О4)дифторборона, 3-трет-бутоксикарбониламино-3-метилпирролидина (2,11 г, изомер В, [a]D20 -8,2° (с=0,5, МеОН)), 1,53 мл N,N-диизопропилэтиламина и 12 мл диметилсульфоксида перемешивают 2 дня при 30°С. Реакционную смесь переносят в 60 мл ледяной воды и добавляют 60 мл хлористого метилена. После перемешивания при комнатной температуре нерастворимые вещества отфильтровывают, водный слой отделяют и экстрагируют хлористым метиленом. Объединенные слои хлористого метилена промывают рассолом, сушат над сульфатом натрия и испаряют. Остаток очищают колоночной хроматографией (силикагель, хлористый метилен и хлористый метилен-метанол (100:1)) и получают 0,91 г желтовато-оранжевых кристаллов. Смесь 0,91 г полученных кристаллов, 0,92 мл триэтиламина и 18 мл метанола кипятят 3 часа и затем испаряют. К остатку добавляют воду, образовавшиеся кристаллы отфильтровывают и после промывания водой получают 0,86 г целевого соединения в виде желтых кристаллов с температурой плавления 214,5-215,5°С. Анализ для С24Н31FN4O5: Вычислено, %: С, 60,75; Н, 6,58; N, 11,81. Найдено, %: С, 60,85; Н, 6,57; N, 11,76. Удельное вращение [a]D20 -47,8° (с=0,1, МеОН). Пример 24. 5-амино-7-(З-амино-3-метил-1-пирролидинил)1-циклопропил - 6 -фтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновой кислоты (изомер В) метансульфонат. К 0,7 г 5-амино-7-(3-трет-бутоксикарбониламино-3-метил-1-пирролидинил)-1-циклопропил-6фтор-1,4-дигидро- 8-метил-4-оксохинолин-3-карбоновой кислоты (изомер В, получение - см. пример 23) при охлаждении льдом добавляют 0,86 мл соляной кислоты, после чего перемешивают 2 часа при комнатной температуре. К реакционной смеси добавляют раствор 0,82 г гидроксида калия в 2,7 мл воды и затем перемешивают 1 час при комнатной температуре. Образовавшуюся смесь нейтрализуют 10%-ой соляной кислотой до рН 8. Выпавшие в осадок кристаллы отфильтровывают и после промывания водой получают 0,48 г желтых кристаллов, которые по обычной методике превращают в метансульфонат. Перекристаллизацией из смеси этанола с водой (9:1) получают 0,31 г целевого соединения в виде желтых игл с температурой плавления 200,5-262°С. Анализ для С19Н23FN4O3 СН4O3S: Вычислено, %: С, 51,05; Н, 5,78; N, 11,91. Найдено, %: С, 50,75; Н, 5,88; N, 11,69. 20 39859 Удельное вращение [a]D20 +46,6° (с=0,1, МеОН). Пример 25. 5-амино - 7-((S)-3-трет-бутоксикарбониламино1-пирролидинил) - 1 - циклопропил- 6-фтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновая кислота. Смесь 2,00 г (5-амино-1-циклопропил-6,7-дифтор-1,4-дигидро-8- метил-4-oкcoxинoлин-3-кapбoкcилaтo-О3,О4)дифтopбopoнa, 1,63 г (S)-3-трет-бутоксикарбониламинопирролидина ([a]D20 -25° (с=0,1, МеОН)), 1,02 мл N,N-диизопропилэтиламина и 8 мл диметилсульфоксида перемешивают 22 часа при 30°С. Реакционную смесь разбавляют водой и экстрагируют хлористым метиленом. Объединенные органические экстракты промывают водой и рассолом и испаряют. Остаток очищают колоночной хроматографией (силикагель, хлористый метилен-метанол (100:1)) с получением желтовато-коричневого масла, ополаскиванием которого смесью ацетона с диэтиловым эфиром получают 1,07 г желтовато-коричневых кристаллов. Смесь 1,07 г полученных кристаллов, 1,11 мл триэтиламина, 22 мл метанола и 11 мл 1,2-дихлорэтана кипятят 10 часов и затем испаряют. Остаток разбавляют водой, образовавшуюся смесь нейтрализуют 10%-ой соляной кислотой до рН 7, осадившиеся кристаллы отфильтровывают и после промывания водой получают 0,95 г целевого соединения в виде желтых кристаллов, перекристаллизацией которых из метанола получают желтые иглы с температурой плавления 135-136,5°С. Анализ для C23H29FN4O5: Вычислено, %: С, 59,99; Н, 6,35; N, 12,17. Найдено, %: С, 59,98; Н, 6,45; N, 11,99. Удельное вращение [a]D20 -33,3° (с=0,1, ДМФА). Пример 26. 5-амино-7-((S)-3-амино-1-пирролидинил)-1-циклопропил- 6 - фтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновая кислота. К 4,07 г 5-амино-7-((S)-3-трет-бутоксикарбониламино - 1 - пирролидинил)- 1-циклопропил-6фтор-1,4-дигидро-8- метил-4-оксохинолин-3-карбоновой кислоты при комнатной температуре добавляют 5,2 мл соляной кислоты, после чего перемешивают 30 минут при комнатной температуре. К реакционной смеси при охлаждении льдом добавляют раствор 4,9 г гидроксида натрия в 16 мл воды с добавлением рН 11, после чего полученную смесь нейтрализуют 10%-ой соляной кислотой до рН 8. Водный слой декантируют, а масло ополаскивают небольшим количеством метанола. Кристаллы отфильтровывают и после промывания изопропанолом получают 3,05 г желтых кристаллов. Кристаллы разбавляют этанолом, нерастворимые вещества отфильтровывают и полученный фильтрат испаряют. Остаток разбавляют смесью хлористого метилена с метанолом (19:1), нерастворимые вещества отфильтровывают и после испарения фильтрата получают 2,58 г целевого соединения в виде желтого кристаллического продукта, перекристаллизацией которого из смеси хлористого метилена с метанолом получают бледно-желтые кристаллы с температурой плавления 202-204°С (разл.). Анализ для C18H21FN4O3 H2O: Вычислено, %: С, 57,13; Н, 6,13; N, 14,81. Найдено, %: С, 57,36; Н, 5,91; N, 14,70. Удельное вращение [a]D20 -11° (с=0,1, ДМФА). По обычной методике получены следующие соли. Метансульфонат: внешний вид - желтые иглы (МеОН) температура плавления - 280-281,5°С (разл.) анализ для C18H21FN4O3 СН4O3S 1/4 Н2О: вычислено, %: С, 49,50; Н, 5,58; N, 12,15. найдено, %: С, 49,50; Н, 5,58; N, 12,03. удельное вращение [a]D20 -27,7° (с=0,1, H2O). р-Толуолсульфонат: внешний вид - желтые иглы (изо-РrОН-Н2О) температура плавления - 238-241°С (разл.) анализ для C18H21FN4O3 C7H8O8S 1/2 Н2О: вычислено, %: С, 55,44; Н, 5,58; N, 10,34. найдено, %: С, 55,47; Н, 5,56; N, 10,22. удельное вращение [a]D20 -24° (с=0,1, Н2О). Пример 27. 5-амино- 1 -циклопропил-7-((S)-3-диметиламино-1-пирролидинил)- 6 -фтор-1,4-дигидро-8-метил4-оксохинолин-3-карбоновая кислота. Смесь 3,00 г (5-амино-1-циклопропил-6,7-дифтор- 1,4-дигидро-8-метил-4-оксохинолин-3-карбоксилато-О3,О4)дифторборона, 1,20 г (S)-3-диметиламинопирролидина ([a]D20 -13,4° (с=10, EtOH)), 1,53 мл N,N-диизопропилэтиламина и 12 мл диметилсульфоксида перемешивают 2 дня при 30°С. Реакционную смесь разбавляют водой и экстрагируют хлористым метиленом. Реакционную смесь разбавляют водой и экстрагируют хлористым метиленом. Объединенные органические экстракты промывают водой, сушат над сульфатом натрия и испаряют. Остаток очищают колоночной хроматографией (силикагель, хлористый метилен и хлористый метилен-метанол 30:1) и получают 1,18 г желтовато-оранжевых кристаллов. Смесь 1,18 г полученных кристаллов, 1,42 мл триэтиламина, 24 мл метанола и 12 мл 1,2-дихлорэтана кипятят 4 часа и затем испаряют. Остаток разбавляют водой и нейтрализуют 10%-ым водным раствором гидроксида натрия до рН 8. Выпавшие в осадок кристаллы отфильтровывают и после промывания водой получают 0,96 г целевого соединения в виде желтых кристаллов. Перекристаллизацией из ацетонитрила получают желтые иглы с температурой плавления 204-205,5°С. Анализ для С20H25FN4О3: Вычислено, %: С, 61,84; Н, 6,49; N, 14,42. Найдено, %: С, 61,72; Н, 6,49; N, 14,44. Удельное вращение [a]D20 +156° (с=0,1, МеОН). Пример 28. 5-амино-1-циклопропил- 6-фтор-1,4-8-метил-4оксо - 7-/3- (трифторацетил)(метил)амино-1-пирролидинил/хинолин-3-карбоновая кислота. Смесь 3,00 г (5-амино-1-циклопропил-6,7-дифтор-1,4- дигидро-8-метил-4-оксохинолин-3-карбоксилато-О3,О4/дифторборона, 2,44 г гидрохлорида 3-(трифторацетил)(метил)аминопирролидина, 3,36 мл N,N-диизопропилэтиламина и 12 мл диметилсульфоксида перемешивают 4 дня при 30°С. Осадок отфильтровывают, полученный фильтрат разбавляют водой и образовавшиеся кристаллы отфильтровывают. Промыванием кристаллов водой и этилацетатом получают желтовато-корич 21 39859 невый кристаллический продукт, очисткой которого колоночной хроматографией (силикагель, хлористый метилен и хлористый метилен-метанол (50:1)) получают 0,92 г желтовато-оранжевых кристаллов. Смесь 0,9 г полученных кристаллов, 0,91 мл триэтиламина, 18 мл метанола и 9 мл 1,2дихлорэтана кипятят 5 часов и затем испаряют. К остатку добавляют воду и фильтрованием выпавших в осадок кристаллов получают 0,77 г желтого кристаллического продукта, перекристаллизацией которого из метанола получают желтые кристаллы с температурой плавления 189-190°С. Анализ для C21H22F4N4O4: Вычислено, %: С, 53,62; Н, 4,71; N, 11,91. Найдено, %: С, 53,50; Н, 4,42; N, 11,84. Пример 29. 5-амино-1-циклопропил-6-фтор - 1,4 - дигидро1,4-8-метил- 7 -(3-метиламино-1-пирролидинил)-4оксохинолин-3-карбоновая кислота. Смесь 0,60 г 5-амино-1-циклопропил-6-фтор1,4-дигидро-8-метил- 4-оксо-7-/3-(трифторацетил)метил)амино-1- пирролидинил/хинолин-3-карбоновой кислоты, 0,38 г гидроксида калия и 3,8 мл воды перемешивают 1 час при комнатной температуре. Реакционную смесь нейтрализуют 10%-ой соляной кислотой до рН 8-9, выпавшие в осадок кристаллы отфильтровывают и после промывания водой получают 0,47 г целевого продукта в виде желтых кристаллов, перекристаллизацией которых из метанола получают желтые столбики с температурой плавления 200,5-202°С. Анализ для С19Н23FN4O3: Вычислено, %: С, 60,95; Н, 6,19; N, 14,96. Найдено, %: С, 60,78; Н, 6,17; N, 15,01. Пример 30. 5-амино-7-((S)- 7 -трет-бутоксикарбониламино7-азаспиро/2,4/-гепт-5-ил)- 1 -циклопропил-6-фтор1,4-дигидро- 8 -метил-4-оксохинолин-3-карбоновая кислота. Смесь 20,0 г 5-амино-1-циклопропил-6,7-дифтор- 1,4-дигидро-8-метил-4-оксохинолин-3-карбоновой кислоты, 28,9 г (S)-7-трет-бутоксикарбониламино-5-азаспиро/2,4/гептана ([a]D20 -47,2° (с=1, МеОН)) и 80 мл диметилсульфоксида нагревают 36 часов при 100°С. Реакционную смесь переносят в 500 мл ледяной воды, образовавшиеся кристаллы отфильтровывают, промывают водой и изопропанолом и после перекристаллизации из смеси хлористого метилена с метанолом получают 14,7 г целевого соединения, идентичного соединению примера 19. Пример 31. Этиловый эфир 1-циклопропил-6,7-дифтор1,4-дигидро-8-метил-5-нитро-4-оксохинолин-3-карбоновой кислоты. К раствору 10,0 г этилового эфира 3-циклопропиламино-2-(2,4,5-трифтор-3-метил - 6 - нитробензоил)акриловой кислоты и 0,1 г 18-краун-6эфира в 100 мл тетрагидрофурана добавляют 8,04 г карбоната калия и полученную смесь перемешивают 23 часа при комнатной температуре. Образовавшиеся кристаллы отфильтровывают и после промывания тетрагидрофураном, водой и ацетоном получают 8,56 г целевого соединения. Перекристаллизацией из N,N-диметилформамида получают бесцветные иглы, идентифицированные как соединения примера 5. Пример 32. Фармацевтический препарат настоящего изобретения в виде таблеток получают по обычной методике использованием следующих компонентов: Соединение примера 10 110 мг Лактоза сколько необходимо Кукурузный крахмал 34 мг Стеарат магния 2 мг Гидроксипропилметилцеллюлоза 8 мг Полиэтиленгликоль 6000 0,5 мг Оксид титана 0,5 мг 210 мг Пример 33. Фармацевтический препарат настоящего изобретения получают обычным образом в виде капсул использованием следующих компонентов: Соединение примера 10 110 мг Лактоза сколько необходимо Карбоксиметилцеллюлоза 15 мг Гидроксипропилцеллюлоза 2 мг Стеарат магния 2 мг 160 мг Пример 34. Фармацевтический препарат настоящего изобретения в виде порошка получают обычным способом использованием следующих компонентов: Соединение примера 10 110 мг Лактоза сколько необходимо D-Маннит 500 мг Гидроксипропилцеллюлоза 5 мг Тальк 5 мг 1000 мг Пример 35. Фармацевтический препарат настоящего изобретения получают в виде инъекций обычным способом использованием следующих компонентов: Соединение примера 10 50 мг Глюкоза 1000 мг Соляная кислота сколько необходимо Дистиллированная вода для инъекций сколько необходимо 20 мл Пример 36. Фармацевтический препарат настоящего изобретения получают обычным способом в виде суппозитория использованием следующих компонентов: Соединение примера 10 100 мг Твердый жир 1300 мг 1400 мг Пример 37. Фармацевтический препарат настоящего изобретения получают обычным способом в виде мази использованием следующих компонентов: Соединение примера 10 5 мг Белый петролатум сколько необходимо Жидкий парафин 70 мг 1000 мг Ссылочные соединения (A-I) синтезированы по методикам, приведенным в примерах 9 и 10. 22 39859 Ссылочное соединение А. 7-((S)-7-амино- 5 -азаспиро/2,4/гепт-5-ил)-1-циклопропил-6-фтор- 1,4 - дигидро-4-оксохинолин-3карбоновой кислоты гидрохлорид. Внешний вид: бледно-желтые иглы. Температура плавления - 284-288°С (разл.). Ссылочное соединение В. 5-амино-7-((S)-7-амино-5-азаспиро/2,4/гепт- 5 ил)-1-циклопропил- 6 - фтор-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты гидрохлорид. Внешний вид: бледно-желтые кристаллы. Температура плавления - 276-279°С (разл.). Ссылочное соединение С. 7-((S)-7-амино- 5 - азаспиро/2,4/гепт-5-ил)-циклопропил - 6 - фтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновой кислоты гидрохлорид. Внешний вид: бесцветные кристаллы. Температура плавления - 176,5-178°С. Ссылочное соединение D. 7-((S)-3-амино - 1 - пирролидинил)-1-циклопропил-6 -фтор-1,4-дигидро-4-оксохинолин-3-карбоновая кислота. Внешний вид: бесцветные кристаллы. Температура плавления - 253-254°С (разл.). Ссылочное соединение Е. 5-амино-7-((S)-3-амино-1-пирролидинил)-1-циклопропил-6-фтор - 1,4 - дигидро-4-оксохинолин-3карбоновая кислота. Внешний вид: бледно-желтовато-коричневые кристаллы. Температура плавления - 226-228,5°С (разл.). Ссылочное соединение F. 7-((S)-3-амино - 1 - пирролидинил)-1-циклопропил-6-фтор-1,4-дигидро- 8-метил-4-оксохинолин-3карбоновая кислота. Внешний вид: бледно-коричневые кристаллы. Температура плавления 192-193,5°С (разл.). Ссылочное соединение G. 5-амино-1-циклопропил-6-фтор- 1,4-дигидро-4оксо-7-пиперазинилхинолин-3-карбоновая кислота. Внешний вид: бледно-желтые иглы. Температура плавления - 213-214,5°С (разл.). Ссылочное соединение Н. 1-циклопропил-6-фтор- 1,4-дигидро-8-метил-4оксо-7-пиперазинилхинолин-3-карбоновой кислоты гидрохлорид. Внешний вид: бледно-коричневые иглы. Температура плавления 279-281°С (разл.). Ссылочное соединение I. 5-амино-1-циклопропил-6- фтор-1,4-дигидро-8метил-4-оксо-7-пиперазинилхинолин-3-карбоновой кислоты гидрохлорид. Внешний вид: желтые иглы Температура плавления >300°С. __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 23
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 215/56, C07D 401/04
Мітки: композиція, похідні, інфекційних, варіанти, сполука, спосіб, кислоти, одержання, захворювань, фармацевтична, 5-аміно-8-метил-7-піролідинілхінолін-3-карбонової, лікування, проміжна
Код посилання
<a href="https://ua.patents.su/23-39859-pokhidni-5-amino-8-metil-7-pirolidinilkhinolin-3-karbonovo-kisloti-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-sposib-likuvannya-infekcijjnikh-zakhvoryuvan-promizhna.html" target="_blank" rel="follow" title="База патентів України">Похідні 5-аміно-8-метил-7-піролідинілхінолін-3-карбонової кислоти, спосіб їх одержання (варіанти), фармацевтична композиція, спосіб лікування інфекційних захворювань, проміжна сполука</a>
Попередній патент: Спосіб виготовлення безбаластної верхньої споруди шляху та безбаластна верхня споруда шляху, одержана цим способом
Наступний патент: 10-дезацетокситаксол та його похідні
Випадковий патент: Спосіб боротьби з бур'янами












