Спосіб одержання клітин різних типів біологічних тканин зі стромальних клітин кісткового мозку ссавців
Номер патенту: 67602
Опубліковано: 15.06.2004
Автори: Щегельська Олена Анатоліївна, Кульшин Володимир Євгенович, Микулинський Юрій Юхимович, Омельченко Олена Анатоліївна
Формула / Реферат
Спосіб одержання клітин різних типів біологічних тканин з стромальних клітин кісткового мозку ссавців шляхом культивування в специфічних кондиційних середовищах з додаванням у середовище специфічних індукторів, який відрізняється тим, що як специфічні індуктори використовують фактори, що виділяють з відповідних біологічним тканинам клітин ембріонального походження.
Текст
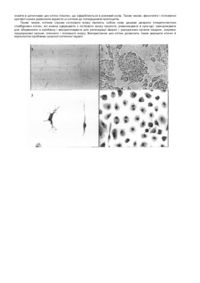
Винахід відноситься до медицини, а саме до трансплантаційної медицини і може бути використаний для одержання клітин різних тканин для репарації хворих і ушкоджених органів людини. Останнім часом з'явилися відомості про те, що клітини строми кісткового мозку (КСКМ) є плюрипотентними і під дією специфічних індукторів можуть диференціюватися у різні види клітин, наприклад, у нервові клітини (Sanchez-Ramos et al. Adult bone marrow stromal cells differentiate into neural cells in vitro. // Experimental Neurology. 2000, V. 164, N2, P.247-256.), кардіоміоцити (Makino et al. Cardiomyocytes can be generated from marrow stromal cells in vitro. // J. Clin Invest. 1999, V.103, Ν5, Ρ.697-705), гепатоцити (Petersen et al. Bone marrow as a potential source of hepatic oval cells. // Science. 1999. V.284, N 5417. P.1168-1170). Усі перераховані способи одержання клітин різних типів біологічних тканин зі стромальних клітин кісткового мозку мають недолік, який виражається в тому, що диференціювання стромальних клітин кісткового мозку для кожного типу клітин, є результатом випадкового підбору індукторів. Не існує закономірності, що дозволяє прогнозувати спрямовану індукцію стромальних клітин кісткового мозку. Найбільш близьким і обраний, як прототип є спосіб диференціювання клітин строми кісткового мозку миші в клітини-попередники нервової тканини при культивуванні в специфічному кондиційному середовищі і при додаванні в середовище індуктора (Щегельськая О.О., Микулинский Ю.Ю., Ревищин А.В. і ін. Індуковане диференціювання клітин строми кісткового мозку миші в нервові клітини // Цитологія. - 2000. - Т.44, №7. - С.637641). Кістковий мозок одержували з гомілкової кістки лабораторних мишей шляхом промивання їх розчином Хенкса (Sigma). Тканини ресуспендували і двічі відмивали в розчині Хенкса центрифугуванням протягом 5 хвилин при 1000об/хв. Відмиті клітини ресуспендували в культуральному середовищі DMEM/F12(1/1) (Sigma) с 10% фетальної бичої сироватки (Sigma) і розсіювали по 5 мільйонів клітин на культуральний флакон (25см 2, Nunc). Через 24 години культивування середовище з не прикріпленими до субстрату клітинами кісткового мозку видаляли, додавали свіже середовище і продовжували культивувати прикріплені фібробластоподібні клітини ще тиждень для одержання первинної культури КСКМ. Для диференціювання КСКМ у нейробласти (попередники нервових клітин) використовували кондиційне середовище, отримане в результаті тридобового культивування первинної культури ембріональних фібробластів миші, виділених по методу Фрешні (Freshny R.I. Culture of animal cells. A manual of basic technique. Alan R Liss, Inc., New York. - 1987. - P.397 р.), а також середовище DMEM/F12 (1/1) с 2% фетальної бичої сироватки і 20 ng/ml LIF (Leukemia Inhibitory Factor, Sigma, cat. n. L5283), або 10-6М ретиноєвої кислоти, відомими нейроіндукторами, які використовують для нейродиференціювання ембріональних і нервових стовбурови х клітин миші і людини. Морфологію кліток вивчали як у живій культурі, так і після фіксації метанолом і фарбування специфічними барвниками. Фіксацію і фарбування проводили прямо в культуральному посуді (25см 2, Nunc). Нейробласти офарблювали 0,03% розчином амидо чорного 10Б по Альцгеймеру в модифікації авторів, а також 1% розчином метилового фіолетового. Клітинні культури і пофарбовані препарати вивчали за допомогою інвертованого мікроскопа “Биолам” П2-1 (ЛОМО, Санкт-Петербург) і відеокамери, що з'єднує мікроскоп з комп'ютером. Для запису кадрів використовували програму ASUS Live 3000 2.10. Недоліком відомого способу є можливість спрямованого диференціювання клітин кісткового мозку тільки в один вид клітин, вибір індуктора в результаті широкого скринінгу. В основу винаходу поставлена задача удосконалення способу одержання клітин різних типів біологічних тканин зі стромальних клітин кісткового мозку ссавців, у якому за рахунок зміни застосованих індукторів, досягається можливість спрямовано індукціювати стромальні клітини кісткового мозку в задані типи тканин. Поставлена задача зважується в способі одержання клітин різних типів біологічних тканин зі стромальних клітин кісткового мозку ссавців шляхом культивування в специфічних кондиційних середовищах з додаванням у середовище специфічних індукторів, відповідно до винаходу, як специфічні індуктори використовують фактори, що виділяють з відповідних біологічним тканинам, клітин ембріонального походження. За рахунок того, що, додаються до культуральних середовищ фактори, виділені з відповідних ембріональних тканин, досягається спрямована індукція стромальних клітин кісткового мозку в задані типи тканин (печінки, підшлункової залози, серця, репродуктивної системи). Сутність винаходу пояснюють малюнки, де зображено індуковане диференціювання клітин строми кісткового мозку (КСКМ) миші в клітини різних тканин (підшлункової залози, нервової тканини, печінки) 1. Інтактні клітини строми кісткового мозку миші на 10 добу культивування. 2. Острівець Лангерганса утворений з КСКМ на 7 добу культивування в специфічному кондиційному середовищі. 3. Нейрон та клітина глії на 4 добу культивування КСКМ в кондиційному середовищі. 4. Клітини-попередники гепатоцитів на 5 добу культивування КСКМ в кондиційному середовищі. Спосіб, що заявляється, проілюструємо на прикладах диференціювання КСКМ миші в клітини підшлункової залози, печінки та нервової тканини. Приклад 1. 1. Одержання культури клітин строми кісткового мозку. Первинну культуру кліток строми кісткового мозку одержують із суспензії кісткового мозку миші, вимитої зі стегнової кістки. Клітини відмивають у розчині Хенкса і розсіюють у культуральні флакони в концентрації 4x105кл/cм 2 y середовищі DMEM/F12 (1/1) с 2m L-глютаміну і 20% фетальної бичої сироватки (Sigma). Значну частину клітин, що не прикріпилися до дна флакону, через 24 години інкубації видаляють разом із середовищем. Фибробластоподібні клітини строми, які залишилися прикріпленими, продовжують культивувати 7-10 днів, змінюючи середовище кожні три дні. Таким чином, одержують первинну культур у клітин строми кісткового мозку, що потім використовують для індукції диференціювання клітин підшлункової залози (мал.1). Ідея про те, що розчинні фактори, які продуцюються клітинами ембріональної підшлункової залози, можуть відігравати важливу роль у диференціюванні клітин острівців Лангерганса, була вже висловлена раніше (Scharfmann et al., 1996). Тому ми вирішили використовувати кондиційне середовище, збагачене цими факторами в результаті триденного культивування в ній ембріональних клітин підшлункової залози, для індукції КСКМ миші в острівці з бета клітинами. 2. Готування кондиційного середовища. Підшлункові залози витягають з 18-денних плодів миші і переносять у розчин Хенкса з гентаміцином (100мкг/мол). Після дворазового відмивання в цьому розчині залози інкубують у 0,25% розчині трипсину протягом 1 години при 37°С. Трипсин видаляють і тканину залоз ресуспендують у середовищі ДМЕМ/F12 (1/1) з 10% фетальної бичої сироватки. Після осадження кліток центрифугуванням при 1000об/хв протягом 10 хвилин осад ресуспендують у свіжому культуральному середовищі і розсіюють клітини в культуральні флакони (80см 2, Nunc) у 10мл середовища. Через 24 години культивування середовище разом із клітинною суспензією видаляють, а до острівців клітин, що прикріпилися, додають свіже середовище і культивують їх ще три доби. Отримане кондиційне середовище центрифугують і фільтрують через 0,22 mm фільтр (Millipor). 3. Індукція диференціювання клітин підшлункової залози. До 10-денної первинної культури клітин строми кісткового мозку додають кондиційне середовище, отримане на клітинах ембріональної підшлункової залози миші, і культивують їх у ній 5-7 діб, змінюючи середовище кожні 23 дні. Диференціювання клітин у культурі аналізують щодня за допомогою інвертованого мікроскопа. Експресію інсуліну в бета-клітинах виявляють імуноцитохімічним методом на 5 добу після початку індукції. 4. Імуноцитохімічний аналіз. Культуру з бета-клітинами, що диференціюються, промивають розчином Хенкса і фіксують у 4% розчині параформальдегіду або метанолу не менш 30 хвилин безпосередньо в культуральних флаконах. Промивають тричі в розчині Хенкса і проводять імуноцитохімічну реакцію з антитілами до інсуліну. Зафіксовані клітини послідовно інкубують у 0,3% розчині перекису водню (30 хвилин) і 5% БСА (1 година) на розчині Хенкса для того, щоб уникнути неспецифічного зв'язування антитіл. Потім препарати інкубують з мишачими моноклональними антитілами до інсуліну (ICN) при 4°С протягом ночі, далі з вторинними поліклональними антимишачими біотинілірованими кінськими антитілами (Vector laboratories) і Авс-комплексом (авидин-біотин-пероксидазний комплекс) (Vector laboratories) по 1 годині при кімнатній температурі. Між інкубаціями з антитілами препарати ретельно промивають у розчині Хенкса. Як барвник використовують розчин діамінобензидину (ДАБ). Острівці Лангерганса з підшлункової залози плодів миші мають сферичну форму і складаються з різної кількості клітин (від 10 до 100). Бета-клітини складають близько 70-80% усіх клітин острівця і продукують інсулін, що виявляється в цитоплазмі цих клітин у результаті імуноцитохімічної реакції з антитілами до інсуліну й офарблюється в коричневий колір. Через дві доби культивування в кондиційному середовищі серед фібробластоподібнихклітин строми миші були виявлені перші круглі клітини з темними гранулами в цитоплазмі. Ці клітини групувалися в острівці, які складалися спочатку з 3-5 клітин. До 4-5 дня індукції їхнє число збільшувалося до 10-30 клітин. Очевидно, ці клітини диференцюються з веретеновидних клітин строми, що поступово коротшають і округляються. Такі клітини, на проміжних стадіях диференціювання, часто зустрічалися в культурі. Серед клітин строми й острівців, що утворяться з них, на 5 день індукції можна знайти також великі, схожі на епітеліальні, клітини з одним-двома ядрами. За допомогою імуноцитохімічної реакції з антитілами до інсуліну ми підтвердили, що серед клітин, що організуються в острівці, є клітини, які експресують інсулін. Їхня цитоплазма в результаті реакції офарблюється ДАБ у коричневий колір. Число інсулін-позитивних клітин в острівцях варіює. Частина клітин у них залишається незабарвленою. Це можуть бути клітини-попередники бета-клітин, ще не здатні експресувати інсулін, або альфаклітини, які продукують глюкагон, чи дельта-клітки, які секретують соматостатин. На різних стадіях індукції в культурі КСКМ зустрічаються також одиничні бета-клітини, у цитоплазмі яких виявляється інсулін. Отримані результати були відтворені нами 6 разів. При цьому були використані первинні культури КСКМ і кондиційні середовища від різних мишей. І щоразу, на 4-7 день індукції спостерігали диференціювання КСКМ в острівці Лангерганса (мал.2). Приклад 2 Нейродиференціювання. Для спрямованого диференціювання клітин строми кісткового мозку (КСКМ) миші в нервові клітини використовували кондиційне середовище, отримане в результаті тридобового культивування середовища ДМЕМ на первинній культурі ембріональних фібробластів миші. Культур у ембріональних фібробластів одержували по методу Фрешні (Freshny R.I., 1987) з нервово-м'язової тканини плодів миші на 16 добу гестації. Після культивування КСКМ миші протягом 2 тижнів у кондиційному середовищі, яке змінювали кожні 3-4 доби, близько 80% клітин знаходилися на різних стадіях диференціювання в клітини нервової тканини: нейрони і клітини глії (мал.3). У культурі виявлялися три типи нейронів: веретеноподібні, пірамідні і зірчасті. Очевидно, кондиційне середовище, отримане на культурі ембріональної нервово-м'язової тканини, містить комплекс ростових факторів, необхідних не тільки для індукції КСКМ у нервові клітини, але і для нормального їх росту в культурі. Мор фологію клітин вивчали як у живій культурі, так і після фіксації метанолом і фарбування специфічними барвниками (по Альцгеймеру і 1% метиловим фіолетовим). Приклад 3. Диференціювання клітин-попередників гепатоцитів. Для індукції диференціювання КСКМ миші в клітини-попередники гепатоцитів використовували кондиційне середовище, отримане після тридобового культивування середовища ДМЕМ на первинній культурі клітин ембріональної печінки з плодів миші 16-добової гестації. Кондиційні середовища фільтрували через фільтри з діаметром пір 0,22мкм. Після 3-5 діб культивування КСКМ миші в кондиційному середовищі були виявлені великі, круглі клітини, іноді двуядерні, з численними цитоплазматичними включеннями. Клітини розрізнялися між собою по розміру, числу ядер і включень (мал.4). Метод фарбування йодною кислотою і реактивом Шиффа по Мак-Манусу дозволив знайти в цитоплазмі цих кліток глікоген, що офарблюється в рожевий колір. Таким чином, фенотипічі і гістохімічні критерії оцінки дозволили віднести ці клітини до попередників гепатоцитів. Таким чином, клітини строми кісткового мозку являють собою нове дешеве джерело плюрипотентних стовбурови х клітин, які можна одержувати з кісткового мозку пацієнта, розмножувати в культурі, заморожувати для збереження в кріобанку і використовува ти для регенерації хворих і ушкоджених органів людини, зокрема, підшлункової залози, спинного і головного мозку. Використання цих клітин дозволить також вирішити етичні й імунологічні проблеми сучасної клітинної терапії.
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for producing cells of different types of biological tissues from stromal cells of mammals bone marrow
Автори англійськоюMykulynskyi Yurii Yukhymovych, Kulshyn Volodymyr Yevhenovych, Omelchenko Olena Anatoliivna
Назва патенту російськоюСпособ получения клеток различных типов биологических тканей из стромальных клеток костного мозга млекопитающих
Автори російськоюМикулинский Юрий Юхимович, Кульшин Владимир Евгеньевич, Омельченко Елена Анатолиевна
МПК / Мітки
МПК: A61K 35/28, C12N 5/08
Мітки: клітин, біологічних, мозку, тканин, кісткового, ссавців, спосіб, різних, типів, стромальних, одержання
Код посилання
<a href="https://ua.patents.su/3-67602-sposib-oderzhannya-klitin-riznikh-tipiv-biologichnikh-tkanin-zi-stromalnikh-klitin-kistkovogo-mozku-ssavciv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання клітин різних типів біологічних тканин зі стромальних клітин кісткового мозку ссавців</a>
Попередній патент: Спосіб стимуляції консолідації переломів кісток
Наступний патент: Спосіб лікування хворих на деструктивний туберкульоз легень
Випадковий патент: Спосіб утримання молодняку свиней