Спосіб діагностики ураження стволових клітин червоного кісткового мозку несприятливими факторами зовнішнього та внутрішнього середовища
Номер патенту: 10182
Опубліковано: 25.12.1996
Автори: Кайдашев Ігор Петрович, КАТРУШОВ ОЛЕКСАНДР ВАСИЛЬОВИЧ, Грицай Наталія Миколаївна, Цебржинський Олег Ігорович, Міщенко Віталій Петрович, Михайлець Марина Станіславівна
Формула / Реферат
Способ диагностики повреждения стволовых клеток красного костного мозга неблагоприятными факторами внешней и внутренней среды путем исследования клеток крови, отличающийся тем, что исследованию подвергают эритроциты, которые отмывают 0.9%-ным раствором хлористого натрия, с последующим приготовлением суспензии, определяют степень взаимодействия мембранных гилкопротеидов, содержащихся на эритроцитах, с углевод-специфическими лектинами и, если значение балла гемагглютинации эритроцитов больше или меньше нормы донорской группы, судят о повреждении стволовых клеток красного костного мозга.
Текст
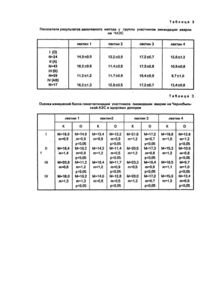
Изобретение относится к области биологии и медицины и может быть использовано для установления факта и степени выраженности повреждения стволовых клеток красного костного мозга неблагоприятными факторами среды. Способ осуществляется следующим образом: 1.Берут в стерильных условиях кровь из вены (2 мл); 2.Выделяют суспензию лейкоцитов (стерильно); 3.Инкубируют полученные лейкоциты в питательной среде 72 часа при 37°С с добавлением одного из митогенов, например фитогемагглютинин (стерильно); 4,Вводят в культуральную жидкость колхицин (канцерогенное вещество); 5.Центрифугируют культуральную жидкость; 6.Осадок клеток обрабатывают гипотоническим раствором и смесью метанолледяная уксусная кислота (токсичные вещества); 7.Обработанный осадок капают с высоты 0,5-1,0 м на предметное стекло; 8.Препарат фиксируют и окрашивают; 9.Визуально под микроскопом оценивают количество и качество хромосомных аберраций по которым судят о повреждении генного аппарата. Недостатком способа является его низкая достоверность, обусловленная следующими обстоятельствами: при данном способе используется визуализация повреждения хромосом (инверсии, делеции, транслокации и т.д.), что наблюдается при тяжелых деструктивных повреждениях хромосомного аппарата. При легких стадиях поражения генома мы можем не наблюдать визуально данных нарушений, однако это вовсе не свидетельствует о функциональной полноценности генома. Определение хромосомных аберраций проводится по единичным лимфоцитам, которые могут не отражать поражение всего пула стволовых клеток красного костного мозга, а лишь единичных клонов стволовых клеток. Согласно теории мишеней происходит выборочное поражение стволовых клеток, которые дают клоны с поврежденным геномом. Параллельно работают здоровые стволовые клетки, которые дают клоны с нормальным геномом. Вероятность обнаружения в периферической крови лимфоцитов клональных по поврежденному геному колеблется в широких пределах, в зависимости от степени поражения. Кроме того, реализация данного способа связана с использованием токсичных и канцерогенных реактивов, довольно сложного оборудования и субъективностью в оценке степени поражения генома. В основу изобретения поставлена задача повышения достоверности диагностики повреждения стволовых клеток красного костного мозга при одновременном сокращении времени на ее проведение и затрат. Поставленная задача решается в известном способе диагностики повреждения стволовых клеток красного костного мозга неблагоприятными факторами внешней и внутренней среды путем исследования клеток крови, в котором согласно изобретению, исследованию подвергают эритроциты, которые отмывают 0,9% раствором хлористого натрия с последующим приготовлением суспензии и определяют степень взаимодействия мембранных гликопротеидов, содержащихся на эритроцитах с углеводспецифическими лектанами, по которой судят о степени повреждения стволовых клеток красного костного мозга. Наиболее оптимальным является определение степени взаимодействия мембранных гликопротеидов по реакции агглютинации с балльной системой оценки. В предлагаемом способе используется изучение генотипа стволовых клеток красного костного мозга по фенотипическим проявлениям эритроцитов. Рецепторный профиль концевых гликопротеидов эритроцитарных мембран формируется генетической системой стволовых клеток красного костного мозга при их дмфференцировке. Таким образом, логично предположить, что даже минимальное повреждение соответствующих генов найдет свое отражение в характеристике выраженности и степени гликозилирования данных рецепторных белков на мембране эритроцита. Эритроциты являются безъядерными форменными элементами, не имеющими полноценно функционирующего генетическоего аппарата и, соответственно, не способны самостоятельно изменять рецепторный профиль. При этом рецепторный аппарат эритроцита отражает состояние ферментных систем посттрансляционной модификации белков и степень гликозилирования последних в пролифелирующих клетках красного костного мозга. Поврежедние носителей наследственной информации может реализоваться в нарушении процессинга белков (в том числе рецепторных). Точечные мутации, не носящие летального характера, однако способны вызвать состояние нестабильности генома или замену 1,2 азотистых оснований ДНК, что приводит к изменению хотя бы одной аминокислоты в белковой цепи. Такие аминокислотные подмены могут вызывать изменения активности белков-ферментов или сопровождаться конформационными изменениями, ведущими к нарушению физико-химических свойств белков.. Как правило, изменение активности ферментативных систем в клетке (чаще снижение специфической активности) сопровождается ошибками в посттрансляционной модификации белков. Белки, имеющие незаконченную или неправильную конформацию склонны к образованию агрегатов, плохо растворимы. Одним из путей преодоления таких состояний является или дополнительное гликозилирование, или наоборот, удаление углеводных остатков. Предлагаемый способ осуществляется следующим образом: Кожу пальца протирают спиртом и высушивают. Осуществляют прокол кожи пальца скарификатором и набирают 0,1 мл крови, стабилизируя ее 0,05 мл 4,5% раствором цитрата натрия. Полученную пробу крови трижды отмывают 0.15М NaCI, центрифугируя в течение 10 минут при 300g. Затем 0,05 мл осадка эритроцитов ресуспендируют в 2 мл 0.15М NaCI. Определяют группу крови в оставшемся осадке эритроцитов. Берут стандартный планшет для иммунологических реакций (ТУ 64-2-278-79) и вносят в каждую лунку по 0,05 мл 0,15М NaCI (одного планшета достаточно для одновременного исследования 3 проб крови). Готовят ex tempore растворы 4 лектинов: семян лимской фасоли (1), семян чечевицы (2), зародышей пшеницы (3), бобовника анагиролистного (4) (НПКО "Лектинотест"). Для этого навеску лектина 1 мг растворяют в 2 мл 0.15М NaCI. Затем в первые лунки вертикальных рядов вносят по 0,05 мл раствора соответствующего лектина. После чего производят кратные разведения, перенося 0,05 содержимого 1 лунки во вторую лунку и т.д. (см.схему). Примечание 1: при кратных разведениях производить тщательное перемешивание содержимого лунок. Вносят в каждую лунку четырех вертикальных рядов 0,05 мл суспензии эритроцитов пробы. После чего планшет с пробами инкубируют при комнатной температуре 35-45 минут. Учет результатов производят визуально, суммируя количество баллов агглютинации в лунках каждого вертикального ряда. Нами была исследована заявляемым методом группа здоровых доноров из числа студентов Полтавского государственного медицинского стоматологического института. Выборка представлена следующим образом; Статистическая обработка производилась методом вариационной статистики с использованием критерия Стьюдента. Полученные результаты представлены в таблице 1. Испытуемую группу составили участники ликвидации аварии на Чернобыльской АЭС с фиксированной дозой облучения в пределах 6-32 БЭР (см. таблицу 2). Оценка изменений балла гемагглютинации участников ликвидации аварии на Чернобыльской АЭС и здоровых доноров (см.таблицу 3). Из таблицы 3 видно, что бал гемагглютинации в группе облученных существенно отличается от контроля. Таким образом, диагностическое значение имеет балл гемаглютинации эритроцитов испытуемого человека, если он менее следующих значений (см.табл.1). Таким образом, заявляемый способ диагностики повреждения стволовых клеток красного костного мозга неблагоприятными факторами внешней и внутренней среды позволяет· регистрировать не визуализируемые формы повреждения генотипа (например, точечные мутации, повреждения отдельных нуклеотидов и т.д.) по изменению фенотипа эритроцитов, что значительно повышает достоверность диагностики. Кроме того, способ исключает использование токсичных и канцерогенных реактивов и субъективность в оценке степени поражения генома.
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for diagnostics of insult to red marrow stem cells by the unfavorable factors of outdoor and internal environment
Автори англійськоюKardashiev Ihor Petrovych, Katrushov Oleksandr Vasyliovych, Mishchenko Vitalii Petrovych, Mykhailets Maryna Stanislavivna, Tsebrzhynskyi Oleh Ihorovych
Назва патенту російськоюСпособ диагностики повреждения стволовых клеток красного костного мозга неблагоприятными факторами внешней и внутренней среды
Автори російськоюКайдашев Игорь Петрович, Катрушов Александр Васильевич, Мищенко Виталий Петрович, Михайлец Марина Станиславовна, Цебржинский Олег Игоревич
МПК / Мітки
МПК: A61B 10/00, G01N 33/50
Мітки: зовнішнього, мозку, внутрішнього, червоного, несприятливими, кісткового, факторами, діагностики, спосіб, стволових, ураження, середовища, клітин
Код посилання
<a href="https://ua.patents.su/3-10182-sposib-diagnostiki-urazhennya-stvolovikh-klitin-chervonogo-kistkovogo-mozku-nespriyatlivimi-faktorami-zovnishnogo-ta-vnutrishnogo-seredovishha.html" target="_blank" rel="follow" title="База патентів України">Спосіб діагностики ураження стволових клітин червоного кісткового мозку несприятливими факторами зовнішнього та внутрішнього середовища</a>
Попередній патент: Сталь
Наступний патент: Спосіб комбінованого лікування раку ендометрію
Випадковий патент: Пристрій для випарного охолодження повітря