Діагностикум для визначення протеаз в розчині
Номер патенту: 9621
Опубліковано: 30.09.1996
Автори: Геращенко Ігор Іванович, Ільченко Олександр Володимирович
Формула / Реферат
Діагностикум для визначення протеаз в розчині, що являє собою шар забарвленого субстрату на інертному носії, який відрізняється тим, що носій виконаний у вигляді пластинки, а шар субстрату рівномірний по товщині.
Текст
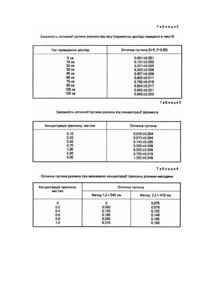
Винахід відноситься до хімічної ензімології та біохімії. Відомий діагностикум, який являє собою шар субстрату на носії, причому носій виконано у вигляді гранул. Субстрат одержано шляхом забарвлення казеїну, желатини або інших білків барвником з подальшим імобілізуванням його на синтетичних дисперсних гомополімерах так, що субстрат являє собою сухий забарвлений порошок. При дії протеаз частина субстрату розкладається, а барвник переходить в розчин. При центрифугуванні залишки порошку переходять в осад, в інтенсивність забарвлення розчину визначають колориметруванням [1]. При проведенні визначення цим методом залишаються невирішеними питання необхідності зупинки процесу протеолізу та нелінійність його кінетики. Крім того труднощі, пов'язані з диспергуванням порошку субстрату, погано впливають на його вартість. Недоліком виявляється необхідність зважувати (дозувати) субстрат при його застосуванні. Задачею винаходу є спрощення виготовлення субстрату, збільшення його стабільності в розчині, полегшення зупинки процесу протеолізу, доведення кінетики протеолізу до дійсно лінійної, значне прискорення та спрощення процедури визначення, що досягається утворенням шару забарвленого білка на поверхні макропідложки товщиною 0,001 - 1мм. Цих вад позбавлений запропонований нами діагностикум для визначення протеаз в, розчині (в подальшому - діагностикум), що являє собою макроносій будь-якої форми (плоска смужка, кулька та ін.), з визначеною площиною поверхні, на який нанесено шар незворотньо забарвленого казеїну, желатини, альбуміну або іншого білка, причому барвник відповідає вимогам, наведеним вище. В ході процесу протеолізу відбувається розщеплення білка з переходом барвника в розчин, причому накопичення барвника в розчині відповідає лінійній кінетиці. Міцний зв'язок білка з поверхнею підложки забезпечує високу стабільність субстрату в розчині. Надійна зупинка процесу досягається простим вилученням діагностикум з розчину. 1. Приклади приготування субстрату Приклад 1 - 1. Готується розчин желатини у воді з концентрацією 10%. На целулоїдну плівку наносять тонкий шар желатини, виливаючи підігрітий розчин, та, після того, як він покриє плівку тонким шаром, охолоджує її до 10°C. Товщина утвореного шару становить близько 0,1 - 0,3мм. Після того, як желатинна плівка застигне, целулоїд заливають розчином барвника Кумасі Ж з концентрацією 8мг/100мл (0,008%), яка утворює міцний зв'язок з молекулами желатини в усьому її об'ємі (по всій її товщині). Час находження плівки в розчині складає 0,5 - 24 години. Після цього плівку відмивають водою від надлишків барвника, висушують при обмеженій температурі (щоб запобігти розплавленню желатинного шару) та розрізають на фрагменти стандартного розміру, який зручний для проведення лабораторних досліджень. Приклад 1 - 2. Готується розчин желатини у воді з концентрацією 10%. В цей розчин добавляється барвник Кумасі Р до концентрації 0,01%. На целулоїдну плівку наносять сумісний підігрітий розчин желатини та барвника, та, після того, як він покриє плівку тонким шаром, охолоджує її при 10°C. Товщина утвореного шару становить близько 0,1 - 0,3мм. Після того, як желатинна плівка застигне, її відмивають водою від надлишків барвника, сушать при обмеженій температурі (щоб запобігти розплавленню желатинного шару) та розрізають на фрагменти стандартного розміру, який зручний для проведення лабораторних досліджень. Приклад 1 - 3. Виготовлення діагностикуму велося за прикладом 1 - 1, але шар розплавленого желатинового розчину наносився на металеву кульку діаметром 6мм. 2. Приклади визначення активності протеаз Приклад 2 - 1. Фрагменти розміром 10 ´ 10мм, які було виготовлено за прикладом 1 - 1, уміщають в серію пробірок та додають буферні розчини (0,1М бікарбонату амонію, pH - 7,8), з різним вмістом трипсину. Пробірки з розчинами інкубують при 37°C на протязі 30 хвилин при періодичному перемішуванні. Відтак фрагменти вилучують з пробірок, а рідину колориметрують при довжині хвилі світла 540нм. При вимірюванні було застосовано колориметр фотоелектричний з мікропроцесором КФК-2МП. Товщина кювети становила 10мм. Приклад 2 - 2. Подібний до прикладу 2 - 1, але фрагменти не вилучають з пробірок, а залишають в них, але розчин зливається в інші чисті пробірки з метою визначення точності результатів вимірювання. З використанням пропонованого діагностикуму проведено досліди для 15 стандартних фрагментів розміром 10 ´ 10мм, які було одержано за прикладом 1 - 1. Одержані статистичні параметри наведені в табл.1. Лінійність кінетикипротеолізу було досліджено витримуванням фрагментів розміром 10 ´ 10мм в розчині, склад якого наведено вище. При цьому було взято 50 проб, та в кожний момент часу визначалась оптична густина розчину в 5 пробірках, по яким було розраховано середні значення. Результати вимірів наведено в табл.2. Таким чином встановлено, що лінійна залежність оптичної густини від часу чітко зберігається поки оптична густина розчину не досягне близько 0,91. Після 90 хвилин інкубації, вочевидь, весь шар білка було розщіплено ферментом, оптична густина розчину стала постійною, тобто незалежною від часу. Дослідження залежності оптичної густини розчину від концентрації протеази було проведено на фрагментах, які було одержано за прикладом 1 - 2. Використано трипсин виробництва "Sigma". Умови проведення досліджень стандартні. Для кожної концентрації ферменту проведено по 5 паралельних дослідів. Результати наведено в табл.3. Таким чином продемонстровано, що існує лінійна залежність між концентрацією протеолітичного ферменту в розчині та його оптичною густиною після певного часу інкубації ферменту та діагностикуму. Використання діагностикуму, який виготовлено за прикладом 1 - 2, дозволило збільшити максимально можливу оптичну густину розчину завдяки тому, що в шар білку на підложці проникла більша кількість барвника. Для порівняння працездатності запропонованого діагностикуму з відомими способами визначення активності протеаз наводимо результати визначення активності трипсину за допомогою запропонованого діагностикуму та з використанням способу, який базується на ферментативному розкладі синтетичного субстрату бензоіл-L-аргінин-n-нітроаніліду з подальшим фотоколориметричним визначенням кількості n-нітроаніліну, який з'явився внаслідок реакції (Современные методы в биохимии / Под ред. В.Н. Ореховича. - М.: Медицина, 1968. - С.124). В табл.4 наведено оптичну густину забарвлених розчинів, які були одержані внаслідок каталітичної дії рівних концентрацій трипсину на субстрати при дотримуванні умов нашого (1) та наведеного в літературі методу (2): Аналіз наведених даних дозволяє зробити такі висновки: 1) Оптична густина та концентрація ферменту пов'язані лінійною залежністю лише при використанні запропонованого діагностикуму; 2) Мінімальна концентрація ферменту, яку можна визначити за умов застосування запропонованого діагностикуму знижено в 2 рази. Наведені приклади переконують в тому, що запропоноване діагностикуму дозволяє чітко визначати активність протеолітичних ферментів, воно є зручним в експлуатації та легким в виготовленні, значно скорочує та спрощує процедуру експериментального дослідження. Діагностикум дозволяє визначати активність протеаз в розчині з рівнем чутливості не гіршим, як в разі використання Існуючих методів, воно є придатним для чутливого визначення протеолітичних ферментів, дозволяє проводити визначення при концентрації від 0,1 до 4,0мкг/мл при часі інкубації 30хв та розмірі діагностикуму 10 ´ 10мм, але при інших параметрах процесу можливо збільшення чутливості методу. Застосування флуоресцентних барвників та визначення флуоресценції дає можливість додатково збільшити чутливість визначення. Значно полегшено дозування субстрату в порівнянні з прототипом - замість зважування дослідник обмежується простим вимірюванням геометричних розмірів діагностикуму та обчислюванням його площини, а в разі промислового виготовлення діагностикума значно полегшується стандартизація його фрагментів.
ДивитисяДодаткова інформація
Назва патенту англійськоюDiagnosticum for determination of proteases in solution
Автори англійськоюIlchenko Oleksandr Volodymyrovych, Heraschenko Ihor Ivanovych
Назва патенту російськоюДиагностикум для определения протеаз в растворе
Автори російськоюИльченко Александр Владимирович, Геращенко Игорь Иванович
МПК / Мітки
МПК: G01N 31/10
Мітки: визначення, протеаз, розчині, діагностикум
Код посилання
<a href="https://ua.patents.su/3-9621-diagnostikum-dlya-viznachennya-proteaz-v-rozchini.html" target="_blank" rel="follow" title="База патентів України">Діагностикум для визначення протеаз в розчині</a>
Попередній патент: Спосіб визрівання алкогольних напоїв
Наступний патент: Спосіб передсадивного пророщування бульб картоплі
Випадковий патент: Препарат для обприскування фруктових дерев