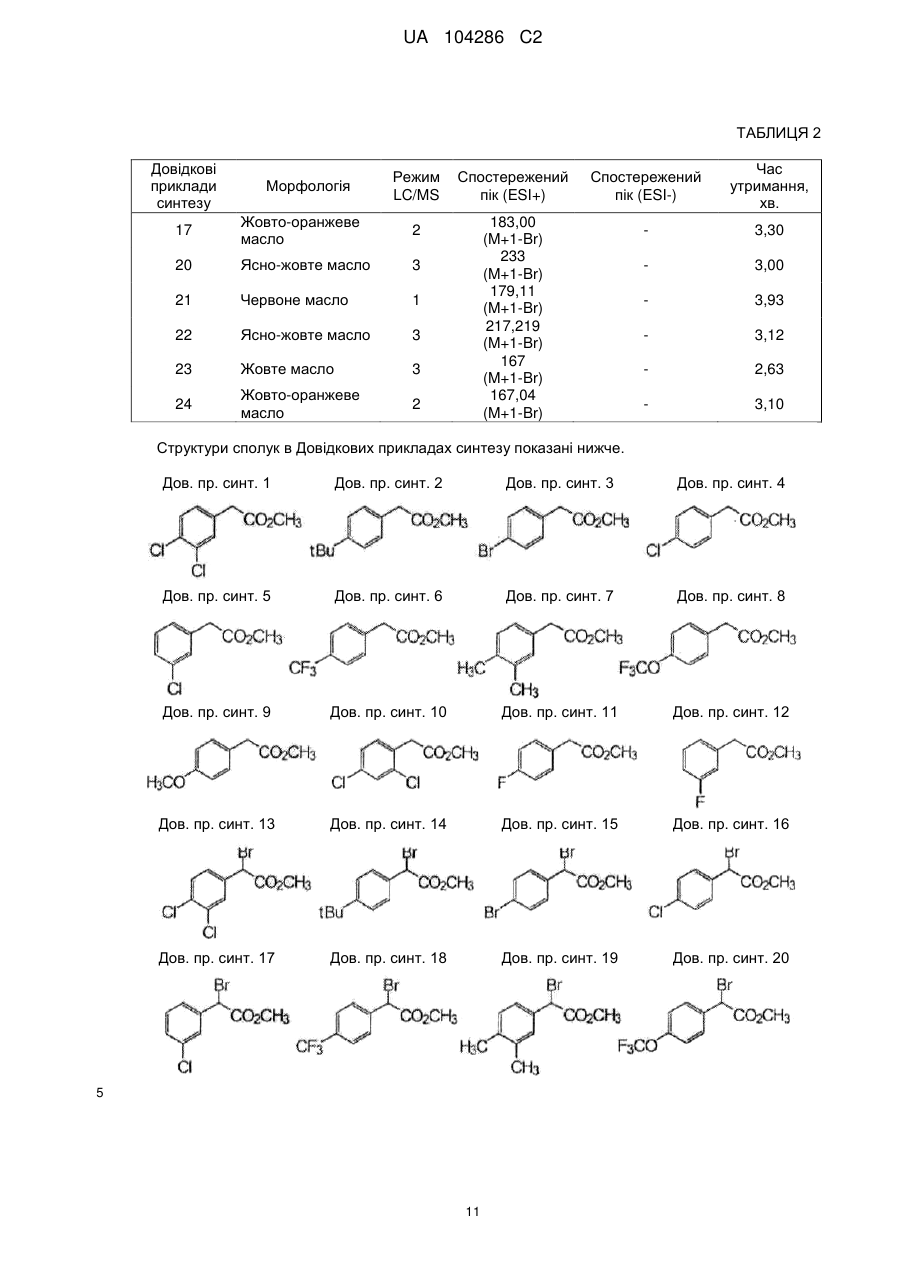
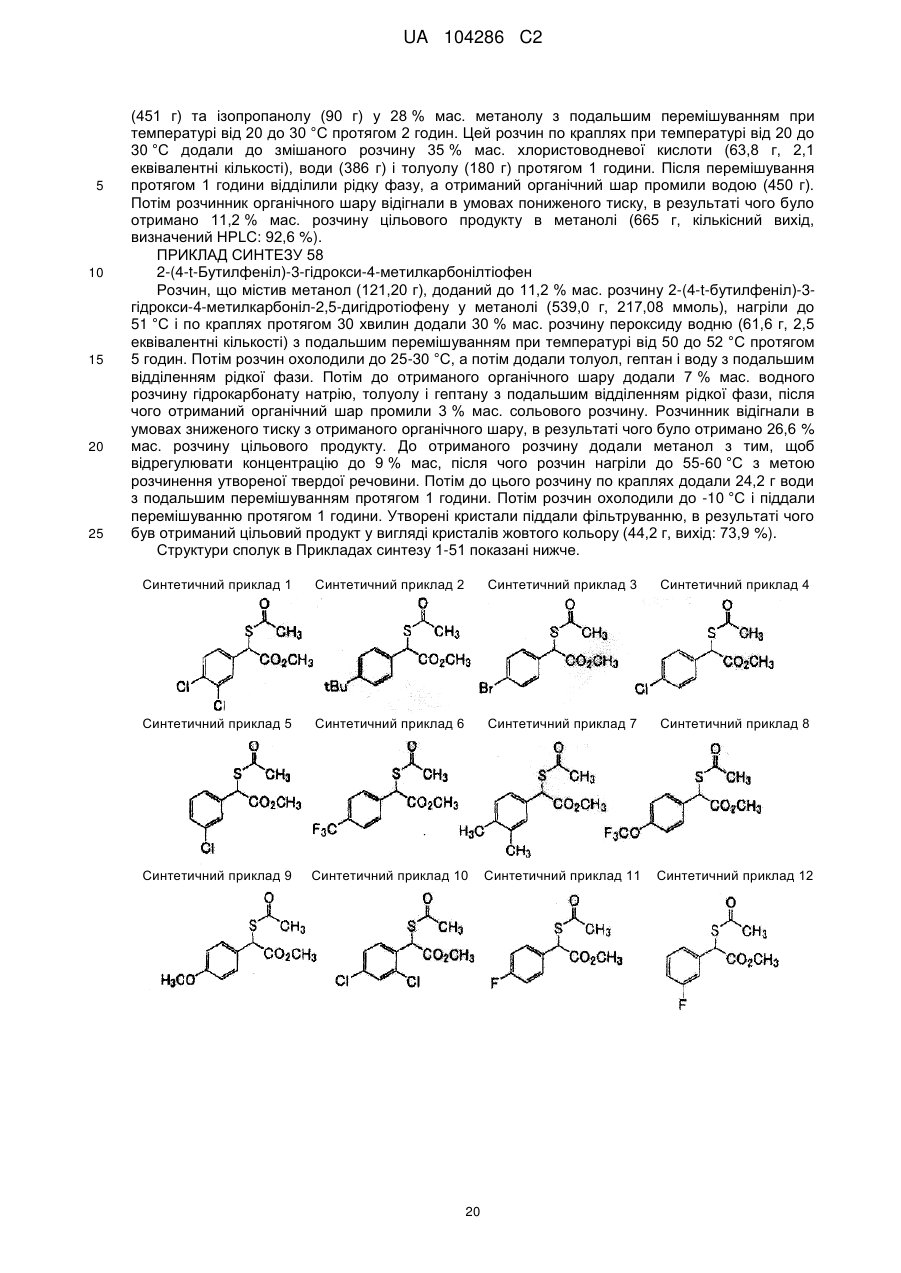
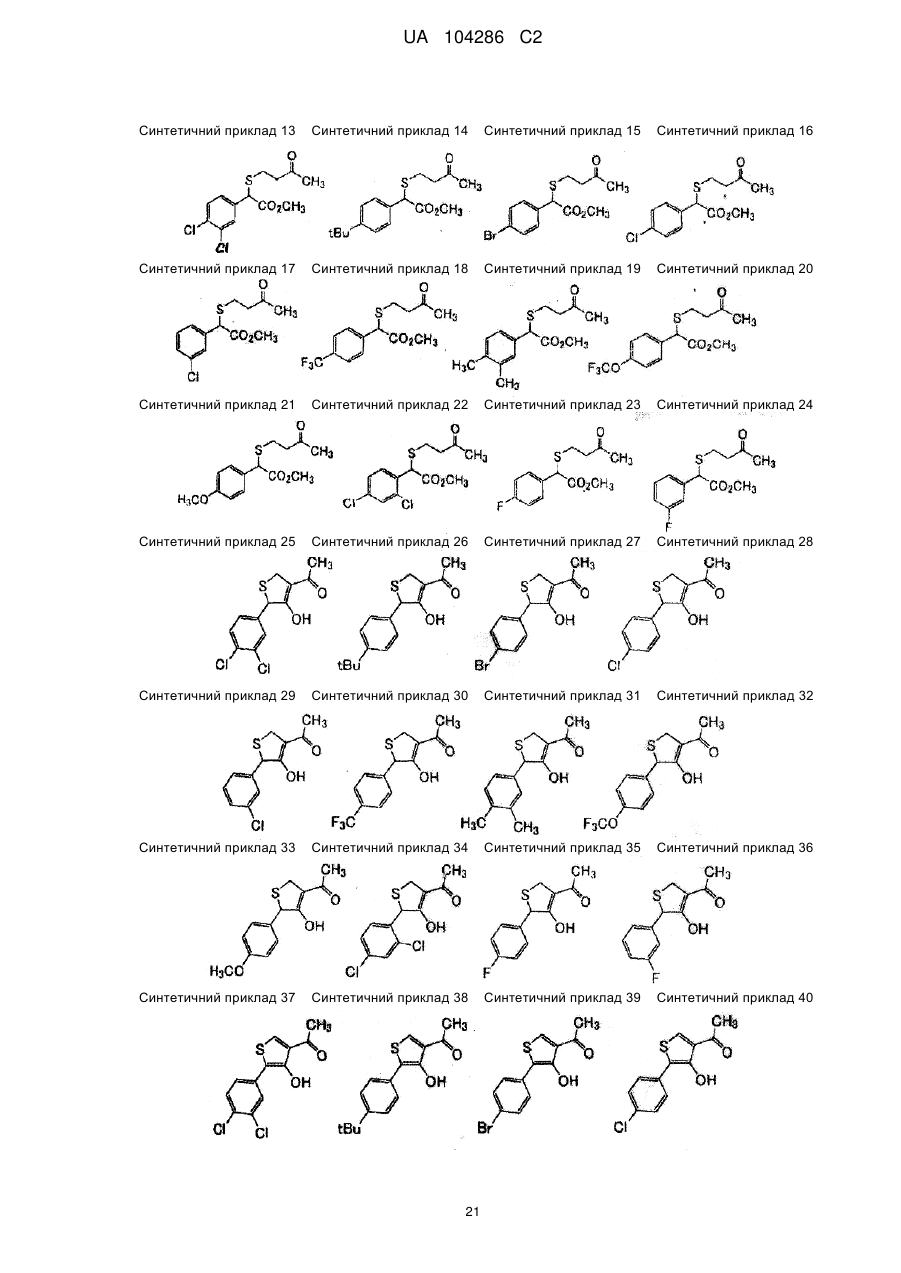
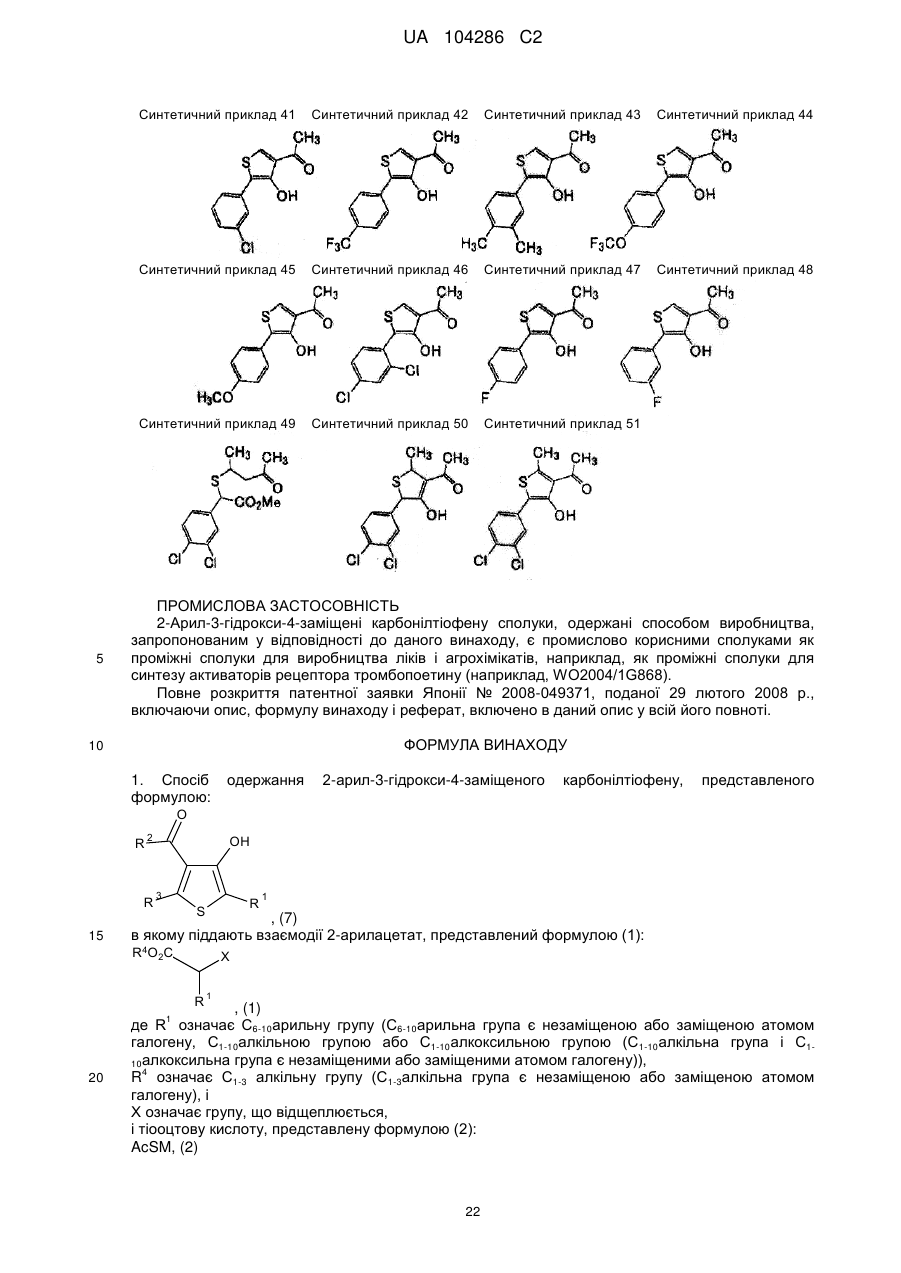
Спосіб одержання тіофенової сполуки та її проміжних сполук (варіанти)
Номер патенту: 104286
Опубліковано: 27.01.2014
Автори: Овада Шінго, Міяджі Кацуакі, Янаджіхара Казуфумі
Формула / Реферат
1. Спосіб одержання 2-арил-3-гідрокси-4-заміщеного карбонілтіофену, представленого формулою:
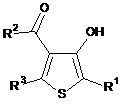 , (7)
, (7)
в якому піддають взаємодії 2-арилацетат, представлений формулою (1):
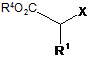 , (1)
, (1)
де R1 означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)),
R4 означає С1-3 алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену), і
X означає групу, що відщеплюється,
і тіооцтову кислоту, представлену формулою (2):
AcSM, (2)
де Ас означає ацетильну групу (ацетильна група є незаміщеною або заміщеною С1-3алкільною групою (С1-3алкільна група є незаміщеною або заміщеною атомом галогену) або атомом галогену), і
М означає атом водню або метал,
з утворенням тіоацетильної сполуки, представленої формулою (3):
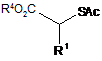 , (3)
, (3)
яку піддають гідролізу і отриманий тіол після його відділення або без відділення піддають взаємодії з вінілкетоном, представленим формулою (4):
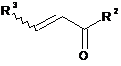 , (4)
, (4)
де кожний з R2 і R3, які є незалежними один від одного, означає атом водню або C1-6алкільну групу (C1-6алкільна група є незаміщеною або заміщеною атомом галогену),
з утворенням g-кетосульфіду, представленого формулою (5):
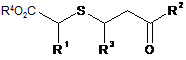 , (5)
, (5)
який циклізують в основному середовищі з утворенням дигідротіофену, представленого формулою (6):
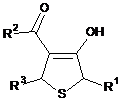 , (6)
, (6)
який окислють, використовуючи окислювач.
2. Спосіб одержання 2-арил-3-гідрокси-4-заміщеного карбонілдигідротіофену, представленого формулою (6):
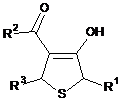 , (6)
, (6)
в якому піддають гідролізу тіоацетил формули (3):
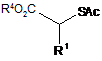 , (3)
, (3)
де R1 означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)),
R4 означає С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену), і
Ас означає ацетильну групу (ацетильна група є незаміщеною або заміщеною С1-3алкільною групою (С1-3алкільна група є незаміщеною або заміщеною атомом галогену) або атомом галогену),
і одержаний тіол після його відділення або без відділення піддають взаємодії з вінілкетоном, представленим формулою (4):
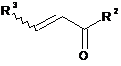 , (4)
, (4)
де кожний з R2 і R3, які є незалежними один від одного, означає атом водню або С1-6алкільну групу (С1-6алкільна група є незаміщеною або заміщеною атомом галогену),
з утворенням g-кетосульфіду, представленого формулою (5):
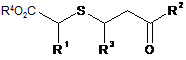 , (5)
, (5)
який циклізують в основному середовищі.
3. Спосіб одержання g-кетосульфіду, представленого формулою (5):
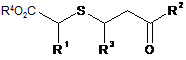 , (5)
, (5)
в якому піддають гідролізу тіоацетил формули (3):
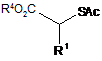 , (3)
, (3)
де R1 означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)),
R4 означає С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену), і
Ас означає ацетильну групу (ацетильна група є незаміщеною або заміщеною С1-3алкільною групою (С1-3алкільна група є незаміщеною або заміщеною атомом галогену) або атомом галогену),
і одержаний тіол після його відділення або без відділення піддають взаємодії з вінілкетоном, представленим формулою (4):
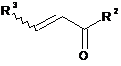 , (4)
, (4)
де кожний з R2 і R3, які є незалежними один від одного, означає атом водню або С1-6алкільну групу (С1-6алкільна група є незаміщеною або заміщеною атомом галогену).
4. Спосіб одержання g-кетосульфіду, представленого формулою (5):
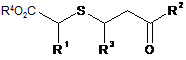 , (5)
, (5)
в якому піддають гідролізу тіоацетил формули (3):
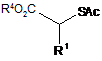 , (3)
, (3)
де R1 означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)),
R4 означає С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену), і
Ас означає ацетильну групу (ацетильна група є незаміщеною або заміщеною С1-3алкільною групою (С1-3алкільна група є незаміщеною або заміщеною атомом галогену) або атомом галогену),
в кислому середовищі, і одержаний тіол після його відділення або без відділення піддають взаємодії з вінілкетоном, представленим формулою (4):
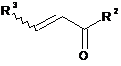 , (4)
, (4)
де кожний з R2 і R3, які є незалежними один від одного, означає атом водню або С1-6алкільну групу (С1-6алкільна група є незаміщеною або заміщеною атомом галогену).
5. Спосіб одержання 2-арил-3-гідрокси-4-заміщеного карбонілдигідротіофену, представленого формулою (6):
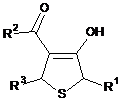 , (6)
, (6)
в якому піддають циклізації g-кетосульфід, представлений формулою (5):
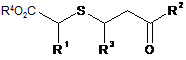 , (5)
, (5)
де R1 означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і C1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)),
кожний з R2 і R3, які є незалежними один від одного, означає атом водню або С1-6алкільну групу (С1-6алкільна група є незаміщеною або заміщеною атомом галогену), і
R4 означає С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену),
в основному середовищі.
6. Спосіб одержання за будь-яким із згаданих вище пунктів 1-5, де R1 являє собою С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)).
7. Спосіб одержання за будь-яким із згаданих вище пунктів 1-6, де R2 являє собою С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену).
8. Спосіб одержання за будь-яким із згаданих вище пунктів 1-7, де R3 являє собою атом водню або метильну групу.
9. Спосіб одержання за будь-яким із згаданих вище пунктів 1-8, де R4 являє собою метильну групу.
10. Спосіб одержання за будь-яким із згаданих вище пунктів 1-9, де R1 являє собою фенільну групу (фенільна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)).
11. g-Кетосульфід, представлений формулою (5):
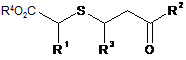 , (5)
, (5)
де R1 означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)),
кожний з R2 і R3, які є незалежними один від одного, означає атом водню або С1-6алкільну групу (С1-6алкільна група є незаміщеною або заміщеною атомом галогену), і
R4 означає C1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену).
12. g-Кетосульфід за пунктом 11, де
R1 означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)),
R2 означає С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену),
R3 означає атом водню або метильну групу, і
R4 означає метильну групу.
13. g-Кетосульфід за пунктом 12, де R1 означає фенільну групу (фенільна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)).
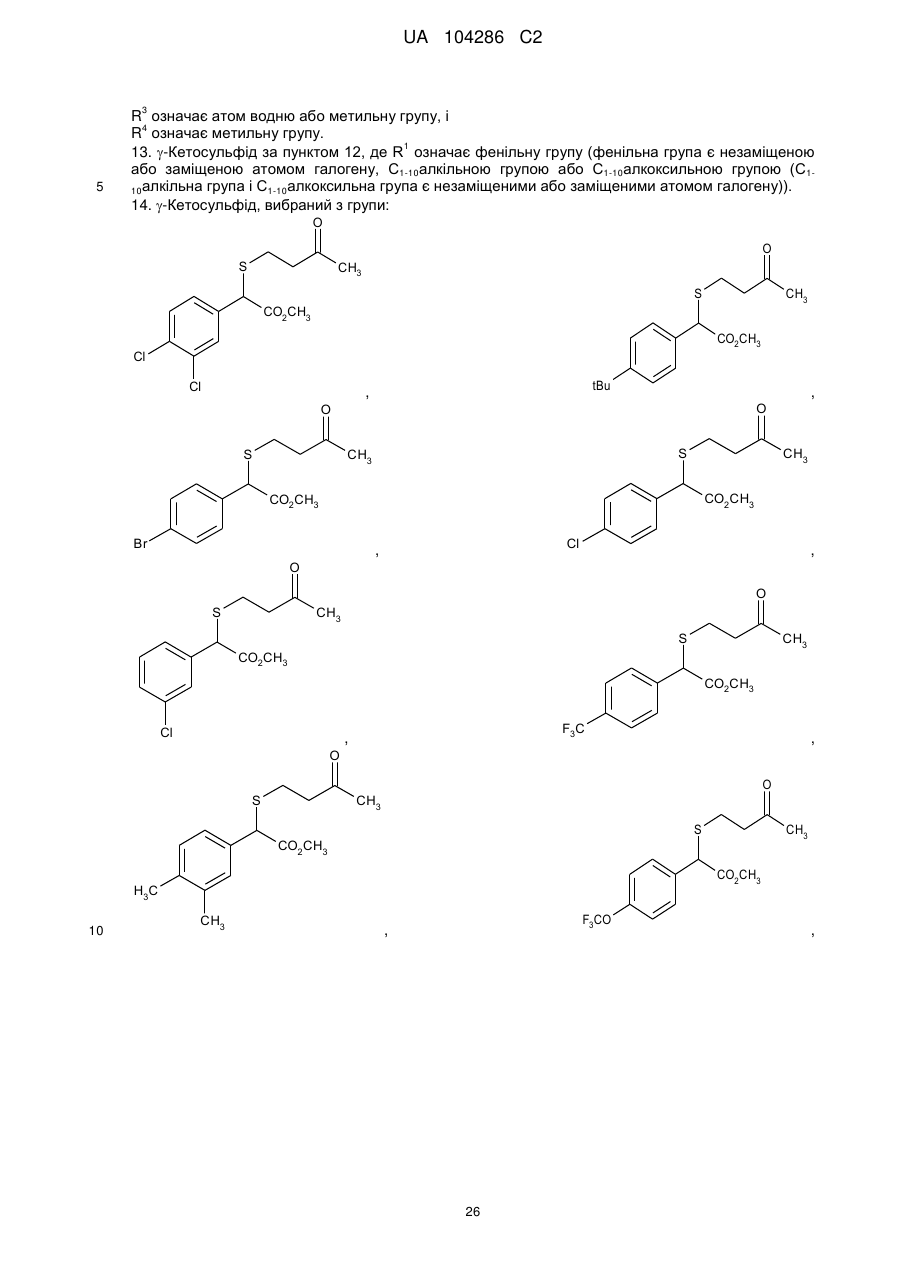
14. g-Кетосульфід, вибраний з групи:
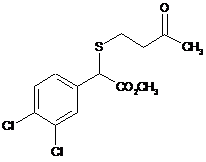 ,
,  ,
, 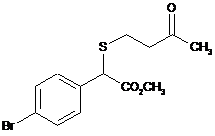 ,
, 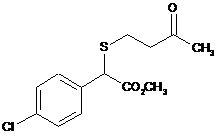 ,
, 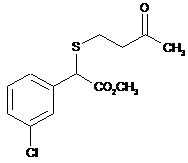 ,
, 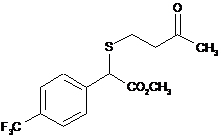 ,
, 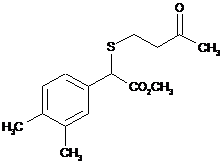 ,
,  ,
, 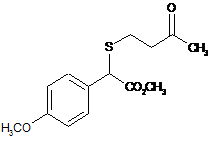 ,
, 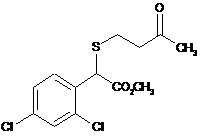 ,
, 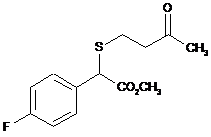 ,
,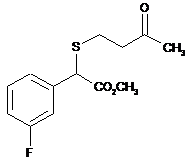 .
.
15. Дигідротіофен, представлений формулою (6):
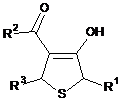 , (6)
, (6)
де R1 означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)), і
кожний з R2 і R3, які є незалежними один від одного, означає атом водню або С1-6алкільну групу (С1-6алкільна група є незаміщеною або заміщеною атомом галогену).
16. Дигідротіофен за пунктом 15, де
R1 означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)),
R2 означає С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену), і
R3 означає атом водню або метильну групу.
17. Дигідротіофен за пунктом 16, де
R1 означає фенільну групу (фенільна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)).
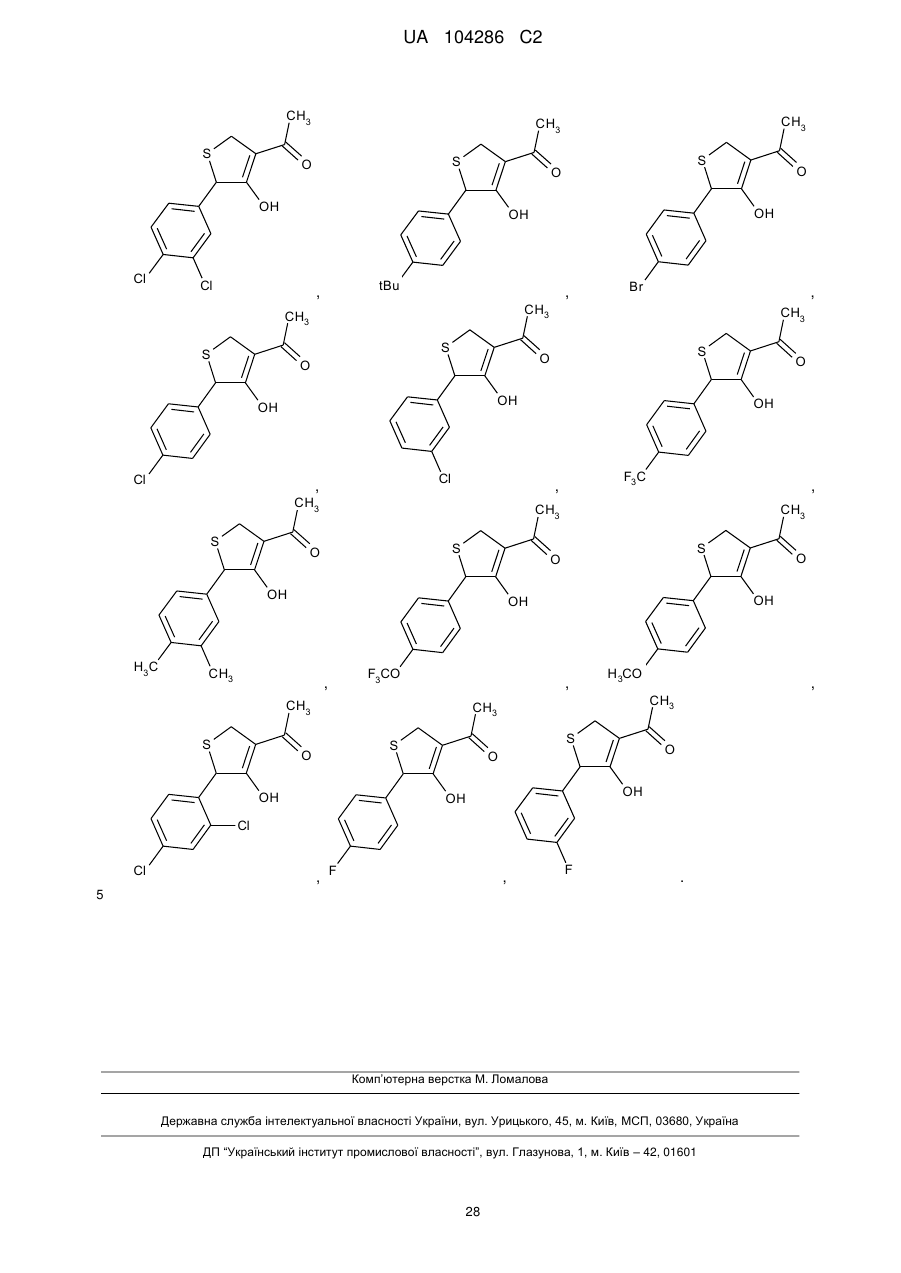
18. Дигідротіофен, вибраний з групи:
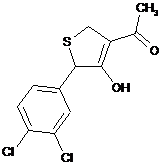 ,
,  ,
, 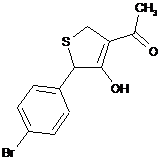 ,
, 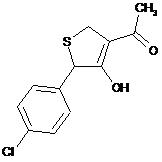 ,
, 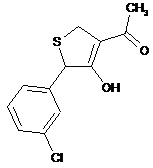 ,
, 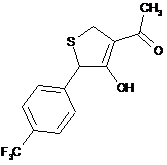 ,
, 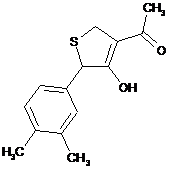 ,
,  ,
, 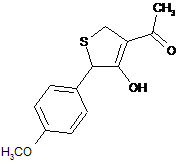 ,
, 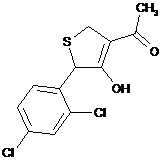 ,
, 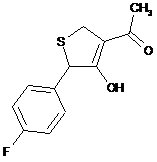 ,
,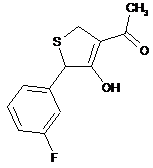 .
.
Текст
Реферат: O R4O2C X R (1) 1 R4O2C SAc R (3) 1 R4O2C S R 1 R R (5) 3 O 2 R O 2 R OH 3 S (6) R R 1 2 R OH 3 S R 1 (7) Розкрито спосіб виробництва сполуки 2-арил-3-гідрокси-4-заміщеного карбонілтіофену, що є корисною як проміжна сполука для виробництва фармацевтичного засобу або агрохімічного засобу, або проміжної сполуки для виробництва сполуки 2-арил-3-гідрокси-4-заміщеного карбонілтіофену. Сполука 2-арил-3-гідрокси-4-заміщеного карбонілтіофену (7) може бути одержана шляхом: взаємодії сполуки складного ефіру 2-арилоцтової кислоти, яка представлена формулою (1) [де 1 4 R являє собою арильну групу або тому подібне; R являє собою алкільну групу С1-3 або тому подібне; а X являє собою групу, що відщеплюється], зі сполукою тіооцтової кислоти для одержання тіоацетильної сполуки (3); введення тіоацетильної сполуки (3) в реакцію з вінілкетоновою сполукою для одержання γ-кетосульфідної сполуки (5); циклізації γ UA 104286 C2 (12) UA 104286 C2 кетосульфідної сполуки (5) в умовах основного середовища для одержання дигідротіофенової сполуки (6); окислення дигідротіофенової сполуки (6) окислювачем для одержання сполуки 2арил-3-гідрокси-4-заміщеного карбонілтіофену (7). UA 104286 C2 5 10 15 20 25 30 35 ОБЛАСТЬ ТЕХНІКИ Даний винахід належить до способу виробництва зі сполуки 2-арилацету відповідно сполуки 2-арил-3-гідрокси-4-заміщеного карбонілтіофену або її проміжної сполуки. ПОПЕРЕДНІЙ РІВЕНЬ ТЕХНІКИ Сполуки 2-арил-3-гідрокси-4-заміщеного карбонілтіофену є корисними сполуками, наприклад, як проміжні сполуки для синтезу активаторів рецептора тромбопоетину (наприклад, патентний документ 1). Як спосіб виробництва сполуки 2-арил-3-гідрокси-4-заміщеного карбонілтіофену відомі тільки спосіб синтезу тіофенової сполуки 2-арил-3-гідрокси-4-ефіру з використанням відомого виробничого процесу (наприклад, патентний документ 2) і перетворення ефірної групи в 4положенні в алкілкарбонільну групу (наприклад, патентний документ 1). Проте перетворення ефірної групи в алкілкарбонільну групу є багатоетапним процесом, і, таким чином, існує потреба у створенні виробничого процесу з меншим числом етапів. Як виробничий процес, який здається придатним для виробництва сполуки 2-арил-3гідрокси-4-заміщеного карбонілтіофену, можуть бути здійснюваними спосіб виробництва сполуки 2-метилкарбоніл-3-гідрокси-4-заміщеного карбонілтіофену, де 2-положення заміщено метилкарбонілом, а не арилом (непатентний документ 1), спосіб виробництва сполуки 3гідрокси-4-метил-карбонілтіофену, де 2-положення не заміщено арилом, або тому подібне. Проте в цих непатентних документах не розкритий спосіб виробництва сполуки 2-арил-3гідрокси-4-заміщеного карбонілтіофену. Патентний документі: WO2004/108683 Патентний документ 2: JP-A-48-26755 Не патентний документ 1: J. Chem. Research (s), 12, 386, 1985 Не патентний документ 2: J. Chem. Research (M), 4135, 1985 РОЗКРИТТЯ ВИНАХОДУ ЗАДАЧА, ЯКА МАЄ БУТИ ВИРІШЕНА ВИНАХОДОМ Метою даного винаходу є створення нового способу виробництва сполуки 2-арил-3-гідрокси4-заміщеного карбонілтіофену або її проміжної сполуки, корисної як проміжна сполука для виробництва ліків і агрохімікатів. ЗАСОБИ ВИРІШЕННЯ ЗАДАЧІ Авторами даного винаходу були проведені широкі дослідження для досягнення вказаної вище мети, і в результаті був знайдений новий спосіб виробництва сполуки 2-арил-3-гідрокси-4заміщеного карбонілтіофену або її проміжної сполуки, завдяки чому і був створений даний винахід. Тобто, даний винахід забезпечує наступне. (І) Спосіб виробництва тіофенової сполуки або її проміжної сполуки, який включає введення сполуки 2-арилацетату, яка представлена формулою (1): 1 40 45 50 де R означає арильну групу С6-10, гетероарильну групу С1-5 (арильна група С6-10 і гетероарильна група С1-5 не заміщені або заміщені атомом галогену, карбоксильною групою, нітрогрупою, формільною групою, ціаногрупою, гідроксильною групою, захищеною гідроксильною групою, тіольною групою, аміногрупою, алкІльною групою С 1-10, алкенільною групою С2-6, алкінільною групою С2-6, алкоксильною групою С1-10, алкілкарбонільною групою С110, алкілкарбоксильною групою С 1-10, алкоксикарбонільною групою С1-10 або арильною групою С610 (алкільна група С1-10, алкенільна група С2-6, алкінільна група С2-6, алкоксильна група С1-10, алкілкарбонільна група С1-10, алкілкарбоксильна група С1-10, алкоксикарбонільна група С1-10 і 4 арильна група С6-10 не заміщені або заміщені атомом галогену)), R означає алкільну групу С 1-3 (алкільна група С1-3 не заміщена або заміщена атомом галогену), а X означає групу, що відщеплюється, в реакцію зі сполукою тіооцтової кислоти, яка представлена формулою (2): AcSM (2) де Ас означає ацетильну групу (ацетильна група не заміщена або заміщена алкільною групою С1-3 (алкільна група С1-3 не заміщена або заміщена атомом галогену) або атомом галогену), а М означає атом водню або металеву сіль, для одержання тіоацетильної сполуки, яка представлена формулою (3): 1 UA 104286 C2 гідроліз тіоацетильної сполуки, введення отриманої тіолової сполуки після її відділення або без відділення в реакцію з вінілкетоновою сполукою, яка представлена формулою (4): 5 10 15 2 3 де кожний з R і R , які є незалежними один від одного, означає атом водню, алкільну групу С1-6 або арильну групу С6-10 (алкільна група С1-6 і арильна група С6-10 не заміщені або заміщені атомом галогену, нітрогрупою, ціаногрупою, гідроксильною групою, захищеною гідроксильною групою, тіольною групою, аміногрупою, алкільною групою С 1-10, алкенільною групою С2-6, алкінільною групою С2-6, алкоксильною групою С1-10 або арильною групою С6-10 (алкільна група С1-10, алкенільна група С2-6, алкінільна група С2-6, алкоксильна група С1-10 і арильна група С6-10 не заміщені або заміщені атомом галогену)) для одержання γ-кетосульфідної сполуки, яка представлена формулою (5): циклізацію γ-кетосульфідної сполуки в умовах основного середовища для одержання дигідротіофенової сполуки, яка представлена формулою (6): і її окислення шляхом використання окислювача для одержання сполуки 2-арил-3-гідрокси4-заміщеного карбонілтіофену, яка представлена формулою (7): 20 (II) Спосіб виробництва тіофенової сполуки або її проміжної сполуки, який включає гідроліз тіоацетильної сполуки (3): 1 4 де R і R - як це визначено в (І), і введення одержаної тіолової сполуки після її відділення або без відділення в реакцію з вінілкетоновою сполукою, яка представлена формулою (4): 25 2 3 де R і R - як це визначено в (І), для одержання γ-кетосульфідної сполуки, яка представлена формулою (5): 2 UA 104286 C2 і циклізацію γ-кетосульфідної сполуки в умовах основного середовища для одержання сполуки 2-арил-3-гідрокси-4-заміщеного карбонілдигідротіофену, яка представлена формулою (6): 5 (III) Спосіб виробництва тіофенової сполуки або її проміжної сполуки, який включає гідроліз тіоацетильної сполуки (3): 1 4 де R і R - як це визначено в (І), і введення одержаної тіолової сполуки після її відділення або без відділення в реакцію з вінілкетоновою сполукою, яка представлена формулою (4): 10 15 2 3 де R і R - як це визначено в (І), для одержання γ-кетосульфідної сполуки, яка представлена формулою (5): (IV) Спосіб виробництва тіофенової сполуки або її проміжної сполуки, який включає гідроліз тіоацетильної сполуки (3): 1 4 де R і R - як це визначено в (І), в умовах кислотного середовища і введення одержаної тіолової сполуки без її відділення в реакцію з вінілкетоновою сполукою, яка представлена формулою (4): 20 25 2 3 де R і R - як це визначено в (І), для одержання γ-кетосульфідної сполуки, яка представлена формулою (5): (V) Спосіб виробництва тіофенової сполуки або її проміжної сполуки, який включає циклізацію γ-кетосульфідної сполуки, яка представлена формулою (5): 1 2 3 4 де R , R , R і R - як це визначено в (І), в умовах основного середовища для одержання сполуки 2-арил-3-гідрокси-4-заміщеного карбонілдигідротіофену, яка представлена формулою (6): 3 UA 104286 C2 5 10 15 20 25 30 35 40 45 50 55 (VI) Спосіб виробництва тіофенової сполуки або її проміжної сполуки у відповідності до 1 будь-якого із згаданих вище пунктів (І) - (V), де R означає арильну групу С6-10 (арильна група С610 не заміщена або заміщена атомом галогену, алкільною групою С 1-10 або алкоксильною групою С1-10 (алкільна група С1-10 і алкоксильна група С1-10 не заміщені або заміщені атомом галогену)). (VII) Спосіб виробництва тіофенової сполуки або її проміжної сполуки у відповідності до 2 будь-якого із згаданих вище пунктів (І) - (VI), де R означає алкільну групу С1-3 (алкільна група С1-3 не заміщена або заміщена атомом галогену). (VIII) Спосіб виробництва тіофенової сполуки або її проміжної сполуки у відповідності до 3 будь-якого із згаданих вище пунктів (І) - (VII), де R означає атом водню або метальну групу. (IX) Спосіб виробництва тіофенової сполуки або її проміжної сполуки у відповідності до 4 будь-якого із згаданих вище пунктів (І) - (VIII), де R означає метильну групу. (X) Спосіб виробництва тіофенової сполуки або її проміжної сполуки у відповідності до будь1 якого із згаданих вище пунктів (І) - (IX), де R означає фенільну групу (фенільна група не заміщена або заміщена атомом галогену, алкільною групою С 1-10 або алкоксильною групою С1-10 (алкільна група С1-10 і алкоксильна група С1-10 не заміщені або заміщені атомом галогену)). КРАЩИЙ ВАРІАНТ ЗДІЙСНЕННЯ ВИНАХОДУ Нижче представлений більш докладний опис даного винаходу. В даному винаході, "n" означає нормальний, "і" означає ізо, "s" або "sec" означає вторинний, "t" або "tert" означає третинний, "с" означає цикло, "о" означає орто, "m" означає мета, "р" означає пара, "Me" означає метильну групу, "Bu" означає бутильну групу, a "tBu" означає третинну бутильну групу. Алкільна група С1-10 в даному винаході означає нерозгалужену, розгалужену або циклічну алкільну групу, що містить 1-10 атомів вуглецю, і може, наприклад, бути метальною групою, етильною групою, n-пропільною групою, n-бутильною групою, n-пентильною групою, nгексильною групою, n-гептильною групою, n-октильною групою, n-децильною групою, іпропільною групою, і-бутильною групою, t-бутильною групою, s-бутильною групою, і-пентильною групою, неопентильною групою, t-пентильною групою, с-пропільною групою або с-бутильною групою, причому більш переважною є метильна група, етильна група або і-пропільна група. Алкільна група С1-3 в даному винаході означає нерозгалужену, розгалужену або циклічну алкільну групу, що містить 1-3 атомів вуглецю, і може, наприклад, бути метальною групою, етильною групою, n-пропільною групою, і-пропільною групою або с-пропільною групою, причому більш переважною є метильна група, етильна група або і-пропільна група. Алкенільна група С2-6 в даному винаході означає нерозгалужену, розгалужену або циклічну алкенільну групу, що містить 2-6 атомів вуглецю, і може, наприклад, бути етинільною, 1пропенільною, 2-пропенільною, 1-метил-1-етинільною, 1-бутенільною, 2-пентенільною, 3гексенільною, 4-метил-2-пентенільною або 3-с-пентенільною групою, причому більш переважною є етинільна, 1-пропенільна або 2-пропенільна група. Алкінільна група С2-6 в даному винаході означає нерозгалужену, розгалужену або циклічну алкінільну групу, що містить 2-6 атомів вуглецю, і може, наприклад, бути етинільною, 1пропенільною, 2-пропенільною, 1-метил-1-етинільною, 1-бутинільною, 2-пентенільною, 3гексильною, 4-метил-2-пентенільною або 3-е-пентенільною групою, причому більш переважною є етинільна, 1-пропінільна або 2-пропінільна група. Алкоксильна група С1-10 в даному винаході означає нерозгалужену або розгалужену алкоксильну групу, що містить 1-10 атомів вуглецю, і може, наприклад, бути метоксильною групою, етоксильною групою, n-пропоксильною групою, і-пропоксильною групою, nбутоксильною групою, і-бутоксильною групою, s-бутоксильною групою, t-бутокснльною групою, n-пентилоксильною групою, і-пентилоксильною групою або n-гексилоксильною групою, причому більш переважною є метоксильна група або етоксильну група. Алкілкарбонільна група С1-10 в даному винаході означає карбонільну групу, заміщену алкільною групою С1-10, і може, наприклад, бути метилкарбонільною групою, етилкарбонільною групою, n-пропілкарбонільною групою, n-бутилкарбонільною групою, n-пентилкарбонільною групою, n-гексилкарбонільною групою, n-октилкарбонільною групою, n-децилкарбонільною групою, і-пропілкарбонільною групою, і-бутилкарбонільною групою, t-бутилкарбонільною групою, s-бутилкарбонільною групою, і-пентилкарбонільною групою, неопентилкарбонільною групою, tпентилкарбонільною групою, с-пропілкарбонільною групою або с-бутилкарбонільною групою, 4 UA 104286 C2 5 10 15 20 25 30 35 40 45 50 55 60 причому більш переважною є метилкарбонільна група, етилкарбонільна група або іпропілкарбонільна група. Алкілкарбонілоксильна група С1-10 в даному винаході означає карбонілоксильну групу, заміщену алкільною групою С1-10 і може, наприклад, бути метилкарбонілоксильною групою, етилкарбонілоксильною групою, n-пропілкарбонілоксильною групою, n-бутилкарбонілоксильною групою, n-пентилкарбонілоксильною групою, n-гексилкарбонілоксильною групою, nоктилкарбонілоксильною групою, n-децилкарбонілоксильною групою, іпропілкарбонілоксильною групою, і-бутилкарбонілоксильною групою, t-бутилкарбонілоксильною групою, s-бутилкарбонілоксильною групою, і-пентилкарбонілоксильною групою, неопентилкарбонілоксильною групою, t-пентилкарбонілоксильною групою, спропілкарбонілоксильною групою або с-бутилкарбонілоксильною групою, причому більш переважною є метилкарбонілоксильна група, етилкарбонілоксильна група або іпропілкарбонілоксильна група. Алкоксикарбонільна група С1-10 в даному винаході означає карбонільну групу, заміщену алкоксильною групою С1-10, і може, наприклад, бути метоксикарбонільною групою, етоксикарбонільною групою, n-пропоксикарбонільною групою, і-пропоксикарбонільною групою, n-бутоксикарбонільною групою, і-бутоксикарбонільною групою, s-бутоксикарбонільною групою, tбутоксикарбонільною групою, n-пентилоксикарбонільною групою, і-пентилоксикарбонільною групою або n-гексилоксикарбонільною групою, причому більш переважною є метоксикарбонільна група або етоксикарбонільна група. Арильна група С6-10 в даному винаході означає вуглеводень ароматичного ряду, що містить 6-10 атомів вуглецю, і як її конкретні приклади можуть бути згадані фенільна група, αнафтильна група і β-нафтильна група. Гетероарильна група С1-5 в даному винаході означає 5-7-членне гетеромоноциклічне кільце ароматичного ряду, що містить 1-5 атомів вуглецю і що містить 1-3 атомів кисню, атомів азоту або атомів сірки окремо або в комбінації, і як її конкретні приклади можуть бути згадані піридильна група, пірамідинільна група, піролільна група, фурильна група, тіенильна група, тіазолільна група, тетразольна група і тріазольна група. Атом галогену являє собою атом фтору, атом хлору, атом брому, атом йоду або тому подібне. 1 2 3 4 Нижче представлений опис R , R , R , R , X, Ас і Μ в сполуках у відповідності до даного винаходу. 1 R є переважно арильною групою С6-10 (арильна група С6-10 не заміщена або заміщена атомом галогену, алкільною групою С1-10 або алкоксильною групою С1-10 (алкільна група С1-10 і 1 алкоксильна група С1-10 не заміщені або заміщені атомом галогену)). Більш переважно R є фенільною групою (фенільна група не заміщена або заміщена атомом галогену, алкільною групою С1-10 або алкоксильною групою С1-10 (алкільна група С1-10 і алкоксильна група С1-10 не заміщені або заміщені атомом галогену)), крім того, більш переважною є 3,4-дихлорфенільна група, 4-хлорфенільна група, 4-бромфенільна група, 4-трифторметилфенільна група, 4трифторметоксифенільна група, 3,4-диметилфенільна група або 4-t-бутилфенільна група. 2 R являє собою переважно атом водню або алкільну групу С1-3 (алкільна група С1-3 може 2 необов'язково бути замішена атомом галогену). Більш переважно R є алкільною групою С1-3, а особливо переважною - метальною групою. 3 R являє собою переважно атом водню або метальну групу, більш переважно - атом водню. 4 4 R являє собою переважно алкільну групу С1-3. Більш переважно R являє собою метильну групу або етильну групу, а ще більш переважно - метальну групу. Як група X, що відщеплюється, може, наприклад, бути використаний атом галогену, такий як, наприклад, атом хлору, атом брому або атом йоду, метилсульфонілоксильна група, трифторметилсульфонілоксильна група або р-толуолсульфонілоксильна група. Група, що відщеплюється, являє собою переважно атом галогену, а більш переважно - атом брому. Група Ас конкретно не обмежена в тій мірі, поки зберігається можливість тіоацетилування і подальшого гідролізу тіоацетильної групи, але переважно вона є не заміщеною або заміщеною ацетильною групою. Більш переважною є ацетильна група (ацетильна група не заміщена або заміщена алкільною групою С1-3 (алкільна група С1-3 не заміщена або заміщена атомом галогену) або атомом галогену), ще більш переважною є трифторметилкарбонільна група або метилкарбонільна група, а особливо переважною є метилкарбонільна група. В способі виробництва у відповідності до даного винаходу без яких-небудь особливих обмежень може бути використаний будь-який реакційний розчинник, який зберігає стабільність в умовах проведення реакції і є достатньо інертним, щоб не перешкоджати реакції. Таким розчинником може, наприклад, бути вода, спирт (наприклад, метанол, етанол, пропанол, 5 UA 104286 C2 5 10 15 20 25 30 35 40 45 50 55 бутанол або октанол), целозольв (наприклад, метоксіетанол або етоксіетанол), апротонний полярний органічний розчинник (наприклад, диметилформамід, диметилсульфоксид, диметилацетамід, тетраметилсечовина, сульфолан, N-метилпіролідон або Ν,Νдиметилімідазолідинон), простий ефір (наприклад, діетиловий ефір, діізопропіловий ефір, tбутилметиловий ефір, тетрагідрофуран або діоксан), вуглеводень аліфатичного ряду (наприклад, пентан, гексан, с-гексан, гептан, октан, декан, декалін або нафтовий ефір), вуглеводень ароматичного ряду (наприклад, бензол, хлорбензол, о-дихлорбензол, нітробензол, толуол, ксилол, мезитилен або тетралін), галогенізований вуглеводень (наприклад, хлороформ, дихлорметан, дихлоретан або тетрахлорид вуглецю), кетон (наприклад, ацетон, метилетилкетон, метилбутилкетон або метилізобутилкетон), складний ефір нижчої кислоти аліфатичного ряду (наприклад, метилацетат, етилацетат, бутилацетат або метилпропіонат), алкоксіалкан (наприклад, диметоксіетан або діетоксіетан) або нітрил (наприклад, ацетонітрил, пропіонітрил або бутиронітрил. Один або більше з цих розчинників відповідним чином вибирають у відповідності до реакційної здатності і використовують окремо або у вигляді суміші. Крім того, в деяких випадках розчинник використовують як неводний розчинник з використанням відповідного зневоднюючого агента або осушувального агента. Описані вище розчинники є прикладами здійснення даного винаходу, і даний винахід не обмежений цими умовами. Як приклади сполуки тіооцтової кислоти (2) для тіоацетилування 2-арилацетатної сполуки (1) можуть бути згадані тіооцтова кислота, тіоацетат калію і тіоацетат натрію, причому особливо переважним є тіоацетат калію. Крім того, як розчинник для реакції тіоацетилування може бути використаний вказаний вище реакційний розчинник. Реакційний розчинник переважно є спиртом, а більш переважно метанолом. Використовувана кількість сполуки тіооцтової кислоти становить від 1 до 10 молярних еквівалентів, з розрахунку використовуваної кількості 2-арилацетатної сполуки (1), і становить переважно від 1 до 2 молярних еквівалентів, більш переважно - від 1,1 до 1,6 молярних еквівалентів, з урахуванням ефективності роботи з реактивами і економічної ефективності. Температура реакції тіоацетилування становить переважно від -20 °C до 60 °C, більш 1 переважно - від 0 °C до 40 °C. У випадку, коли R являє собою арильну групу С6-10, що заміщена групою, яка забирає електрони, температура реакції тіоацетилування становить більш 1 переважно від 0 °C до 29 °C, а особливо переважно - від 0 °C до 10 °C. У випадку, коли R являє собою арильну групу С6-10, що заміщена групою-донором електронів, температура реакції тіоацетилування становить більш переважно від 30 °С до 40 °C. Реакція гідролізу тіоацетильної сполуки (3) у відповідності до даного винаходу може бути здійснена у відсутності кислоти або основи, проте гідроліз здійснюють переважно у присутності кислоти або основи з урахуванням ефективності роботи з реактивами і тому подібне. Зокрема, гідроліз здійснюють у присутності кислоти. Кислота, що має бути використана для здійснення реакції гідролізу тіоацетильної сполуки (3), може, наприклад, бути неорганічною кислотою, такою як, наприклад, хлористоводнева кислота, бромістоводнева кислота, йодистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота або поліфосфорна кислота, або органічною кислотою, такою як, наприклад, р-толуолсульфонова кислота, метансульфонова кислота, трифтороцтова кислота, мурашина кислота або оцтова кислота. Кислота є більш переважно неорганічною кислотою, а ще більш переважно - хлористоводневою кислотою або сірчаною кислотою, а особливо переважно хлористоводневою кислотою. Використовувана кількість кислоти становить від 0,1 до 10 молярних еквівалентів, з розрахунку використовуваної кількості тіоацетильної сполуки (3), і становить переважно від 0,1 до 2 молярних еквівалентів, більш переважно – від 0,25 до 1,5 молярних еквівалентів, з урахуванням ефективності роботи з цими реактивами і економічної ефективності. Температура реакції гідролізу тіоацетильної сполуки (3) з кислотою становить переважно від 25 °C до температури перегонки розчинника, більш переважно - від 55 °C до 70 °C, а ще більш переважно - від 60 °C до 65 °C. Як розчинник, який використовується для реакції гідролізу тіоацетильної сполуки (3) з кислотою, може бути використаний описаний вище реакційний розчинник. Реакційний розчинник є більш переважно спиртом, а ще більш переважно - метанолом. Основа, яка має бути використана для реакції гідролізу тіоацетильної сполуки (3), може, наприклад, бути гідроксидом лужного металу, таким як, наприклад, гідроксид літію, гідроксид натрію, гідроксид калію, гідроксид магнію, гідроксид кальцію або гідроксид барію. Особливо переважним є гідроксид натрію. 6 UA 104286 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовувана кількість основи становить від 1 до 5 молярних еквівалентів, з розрахунку використовуваної кількості тіоацетильної сполуки (3), і становить переважно від 1 до 2 молярних еквівалентів з урахуванням ефективності роботи з цими реактивами і економічної ефективності. Як розчинник, який має бути використаний для реакції гідролізу тіоацетильної сполуки (3) з основою, може бути використаний описаний вище реакційний розчинник. Реакційний розчинник є більш переважно спиртом, а ще більш переважно - метанолом. Тіолова сполука, одержана в результаті гідролізу тіоацетильної сполуки (3), може бути введена в реакцію з вінілкетоновою сполукою (4) після її відділення або без відділення, але переважно вводиться в реакцію з вінілкетоновою сполукою (4) без відділення з тим, щоб усунути неприємний запах тіолової сполуки і можливість виникнення побічної реакцію в процесі подальшої обробки. Основа, яка має бути використана для проведення реакції тіолової сполуки, одержаної в результаті реакції гідролізу тіоацетильної сполуки (3) з вінілкетоновою сполукою (4), може, наприклад, являти собою амін, такий як, наприклад, діетиламін, тріетиламін, діізопропілетиламін, три-n-пропіламін, три-n-бутиламін, DBN (діазабіциклононан), DBU (діазабіциклоундецен), N-метилморфолін або Ν,Ν-диметиланілін; піридин, такий як, наприклад, піридин, метилетилпіридин, лутидин або 4-N,N-диметиламінопіридин; імідазол; піразол; гідроксид лужного металу або лужноземельного металу, такий як, наприклад, гідроксид літію, гідроксид натрію, гідроксид калію, гідроксид магнію, гідроксид кальцію або гідроксид барію; карбонат лужного металу або лужноземельного металу, такий як, наприклад, карбонат натрію, карбонат калію, карбонат цезію, карбонат магнію, карбонат кальцію або карбонат барію; алкоксид металу, такий як, наприклад, метоксид натрію, етоксид натрію або t-бутоксид калію; амід лужного металу, такий як, наприклад, амід натрію або амід літію; або гідрид лужного металу, такий як, наприклад, гідрид натрію або гідрид літію. Основа є більш переважно аміном, ще більш переважно - тріетиламіном або діізопропілетиламіном, а особливо переважно тріетиламіном. Використовувана кількість основи становить від 0,5 до 10 молярних еквівалентів, з розрахунку використовуваної кількості тіолової сполуки, і становить переважно від 0,5 до 3 молярних еквівалентів, більш переважно - від 0,75 до 2 молярних еквівалентів, з урахуванням ефективності роботи з цими реактивами і економічної ефективності. Крім того, у випадку, коли кислота використовується для реакції гідролізу тіоацетильної сполуки (3), переважно додавати надлишок основи до еквівалентної кількості використовуваної кислоти. Використовувана кількість вінілкетонової сполуки (4), яка має бути використана для реакції з тіоловою сполукою, одержаною в результаті гідролізу тіоацетильної сполуки (3), становить від 1 до 10 молярних еквівалентів, з розрахунку використовуваної кількості тіолової сполуки, і становить переважно від 1 до 2 молярних еквівалентів, більш переважно - від 1,0 до 1,5 молярних еквівалентів, з урахуванням ефективності роботи з цими реактивами і економічної ефективності. Температура реакції тіолової сполуки, одержаної в результаті гідролізу тіоацетильної сполуки (3) з вінілкетоновою сполукою (4), становить переважно від 0 °C до 60 °C, більш переважно - від 10 °C до 20 °C. Як розчинник в реакції тіолової сполуки, одержаної в результаті гідролізу тіоацетильної сполуки (3) з вінілкетоновою сполукою (4), може бути використаний описаний вище реакційний розчинник. Реакційним розчинником є переважно апротонний полярний органічний розчинник, більш переважно - етилацетат або толуол. У випадку, коли тіолова сполука вводиться в реакцію з вінілкетоновою сполукою (4) без її відділення, реакційний розчинник являє собою розчинник, змішаний з реакційним розчинником на етапі гідролізу. Нижче надано опис циклізації γ-кетосульфідної сполуки (5), одержаної в результаті реакції тіолової сполуки, у свою чергу, одержаної в результаті гідролізу тіоацетильної сполуки (3), з вінілкетоновою сполукою (4). В циклізації γ-кетосульфідної сполуки (5) основою може, наприклад, бути амін, такий як, наприклад, діетиламін, тріетиламін, діізопропілетиламін, три-n-пропіламін, три-n-бутиламін, DBN (діазабіциклононан), DBU (діазабіциклоундецен), N-метилморфолін або Ν,Νдиметиланілін; піридин, такий як, наприклад, піридин, метилетилпіридин, лутидин або 4-Ν,Νдиметиламінопіридин; імідазол; піразол; гідроксид лужного металу або лужноземельного металу, такий як, наприклад, гідроксид літію, гідроксид натрію, гідроксид калію, гідроксид магнію, гідроксид кальцію або гідроксид барію; карбонат лужного металу або лужноземельного металу, такий як, наприклад, карбонат натрію, карбонат калію, карбонат цезію, карбонат магнію, карбонат кальцію або карбонат барію; алкоксид металу, такий як, наприклад, метоксид натрію, етоксид натрію або t-бутоксид калію; амід лужного металу, такий як, наприклад, амід натрію або 7 UA 104286 C2 5 10 15 20 25 30 35 40 45 50 55 60 амід літію; або гідрид лужного металу, такий як, наприклад, гідрид натрію або гідрид літію. Основою є переважно алкоксид металу, такий як, наприклад, метоксид натрію, етоксид натрію або t-бутоксид калію; амід лужного металу, такий як, наприклад, амід натрію або амід літію; або гідрид лужного металу, такий як, наприклад, гідрид натрію або гідрид літію, більш переважно амід лужного металу, такий як, наприклад, амід натрію або амід літію, або алкоксид металу, такий як, наприклад, метоксид натрію, етоксид натрію або t-бутоксид калію, а особливо переважно - амід натрію або метоксид натрію. Використовувана кількість основи становить від 1 до 10 молярних еквівалентів, з розрахунку використовуваної кількості γ-кетосульфідної сполуки (5), і становить переважно від 1 до 2 молярних еквівалентів, більш переважно - від 1,5 до 2,0 молярних еквівалентів, з урахуванням ефективності роботи з цими реактивами і економічної ефективності. В реакції циклізації γ-кетосульфідної сполуки (5) як розчинник може бути використаний описаний вище реакційний розчинник. Реакційний розчинник є переважно спиртом, більш переважно - етанолом або ізопропанолом. У випадку, коли розчинник не відганяється після подальшої обробки на попередньому етапі, реакція може бути здійснена в розчиннику, змішаному з розчинником, використовуваним на попередньому етапі. В утворенні тіофену з дигідротіофенової сполуки (6) як окислювач може, наприклад, бути використаний пероксид водню, сульфурилхлорид, гіпохлорит натрію або Охоnе (виробник DuPont, торгове найменування). Окислювачем є переважно пероксид водню або сульфурилхлорид. Використовувана кількість окислювача становить від 1 до 10 молярних еквівалентів, з розрахунку використовуваної кількості дигідротіофенової сполуки (6), а більш переважно - від 0,9 до 3,0 молярних еквівалентів. У випадку, коли як окислювач використовують сульфурилхлорид, використовувана кількість становить переважно від 0,9 до 1,1 молярних еквівалентів з метою придушення утворення побічних продуктів. У випадку, коли як окислювач використовують пероксид водню, використовувана кількість становить переважно від 2 до 4 молярних еквівалентів, більш переважно - від 2 до 2,5 молярних еквівалентів. Як розчинник в утворенні тіофену може бути використаний описаний вище реакційний розчинник. Реакційний розчинник є переважно галогенізованим вуглеводнем або спиртом. У випадку, коли як окислювач використовують сульфурилхлорид, реакційний розчинник є більш переважно хлороформом або дихлорметаном, особливо переважно - хлороформом. У випадку, коли як окислювач використовують пероксид водню, реакційний розчинник є більш переважно спиртом, особливо переважно - метанолом. У випадку, коли сполуки, одержані проміжні сполуки або використовувані продукти включають ізомери, такі як, наприклад, таутомери, геометричні ізомери і оптичні ізомери, спосіб виробництва у відповідності до даного винаходу включає способи виробництва з використанням або одержанням таких ізомерів або суміші ізомерів. ПРИКЛАДИ Нижче надано більш докладний опис даного винаходу з посиланням на Приклади, але треба розуміти, що даний винахід у жодному випадку не обмежується такими конкретними Прикладами. 1 H-ЯМР-аналіз здійснювали на частоті 300 МГц, a LC/MS вимірювали при вказаних нижче режимах. Крім того, ЯМР означає ядерний магнітний резонанс, LC/MS - рідинна хроматографія/масспектрометрія, a ESI - іонізація електронною пульверизацією. Режим LC/MS 1 Колонка: SunFire C18, виробник Waters (середній розмір частинок наповнювача: 3,5 мкм, внутрішній діаметр колонки × довжина колонки = 4,6 мм × 30 мм, це ж застосовне нижче) Елюент: Ацетонітрил/0,1 % об. водного розчину мурашиної кислоти (10/90→60/40 (% об.), це ж застосовується нижче) Режим LC/MS 2 Колонка: SunFire С18, виробник Waters (3,5 мкм, 4,6 мм × 30 мм) Елюент: Ацетонітрил/0,1 % об. водного розчину мурашиної кислоти (10/90→85/15) Режим LC/MS 3 Колонка: SunFire С18, виробник Waters (3,5 мкм, 4,6 мм × 30 мм) Елюент: Ацетонітрил/0,1 % об. водного розчину мурашиної кислоти (20/80→100/0) Режим LC/MS 4 Колонка: Terra MSC18, виробник Waters (5 мкм, 4,6 мм × 50 мм) Елюент: Ацетонітрил/0,1 % об. водного розчину мурашиної кислоти (10/90→60/40) Режим LC/MS 5 8 UA 104286 C2 5 10 15 20 25 30 35 Колонка: XTerra MSC18, виробник Waters (3,5 мкм, 2,1 мм × 20 мм) Елюент: Ацетонітрил/0,2 % об. водного розчину мурашиної кислоти (20/80→90/10) Режим LC/MS 6 Колонка: XTerra MSC18, виробник Waters (3,5 мкм, 2,1 мм × 20 мм) Елюент: Ацетонітрил/0,2 % об. водного розчину мурашиної кислоти (20/80→90/10) ДОВІДКОВИЙ ПРИКЛАД СИНТЕЗУ 1 Метил 2-(3,4-дихлорфеніл)ацетат Метанол (59 мл, 3,0 еквівалентні кількості) додали до розчину 2-(3,4-дихлорфеніл)оцтової кислоти (100 г, 0,488 моль) в 1,2-дихлоретані (400 мл). Розчин нагріли до 50 °C, після чого до нього по краплях протягом 15 хвилин додали концентровану сірчану кислоту (10 мл) з подальшим перемішуванням при 50 °C протягом 1,5 годин. Реакційний розчин охолодили до кімнатної температури з подальшим відділенням рідкої фази, а отриманий органічний шар послідовно промили водою, насиченим водним розчином гідрокарбонату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був одержаний цільовий продукт у вигляді безбарвного масла (105 г, вихід: 98 %). 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 3,59 (с, 2Н), 3,71 (с, 3Н), 7,12 (дд, J=8,4 Гц, 1,8 Гц, 1Н), 7,38-7,41 (м, 2Н). ДОВІДКОВІ ПРИКЛАДИ СИНТЕЗУ 2, 3, 4 і 6 Сполуки були синтезовані у відповідності до Довідкового прикладу синтезу 1. Дані ЯМРаналізу сполук показані нижче. ДОВІДКОВИЙ ПРИКЛАД СИНТЕЗУ 2 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 1,32 (с, 9Н), 3,60 (с, 2Н), 3,70 (с, 3Н), 7,19-7,22 (м, 2Н), 7,33-7,36 (м, 2Н). ДОВІДКОВИЙ ПРИКЛАД СИНТЕЗУ 3 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 3,58 (с, 2Н), 3,70 (с, 3Н), 7,16 (дд, J=8,4 Гц, 2,1 Гц, 2Н), 7,45 (J=8,4 Гц, 2,1 Гц, 2Н). ДОВІДКОВИЙ ПРИКЛАД СИНТЕЗУ 4 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 3,58 (с, 2Н), 3,70 (с, 3Н), 7,20-7,31 (м, 4Н). ДОВІДКОВИЙ ПРИКЛАД СИНТЕЗУ 6 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 3,58 (с, 2Η), 3,71 (с, 3Н), 7,40 (д, J=8,6 Гц, 2Н), 7,59 (д, J=8,6 Гц, 2Н). ДОВІДКОВІ ПРИКЛАДИ СИНТЕЗУ 5, 7, 8, 10 і 12 Сполуки були синтезовані у відповідності до Довідкового прикладу синтезу 1. Морфологія і дані LC/MS-аналізу сполук показані нижче. ТАБЛИЦЯ 1 Довідкові приклади синтезу 5 7 8 10 12 40 45 Морфологія Безкольорове масло Ясно-жовте масло Безкольорове масло Безкольорове масло Безкольорове масло Режим LC/MS Спостережений пік (ESI+) Спостережений пік (ESI-) Час утримання, хв. 2 185,01 3,02 1 118,96 (М+1-СО2Ме) 3,77 3 235 • 2,77 3 221,223 2,82 2 108,97 (М+1-СО3Ме) 2,77 ДОВІДКОВИЙ ПРИКЛАД СИНТЕЗУ 13 Метил 2-(3,4-дихлорфеніл)-2-бромацетат N-бромсукцинімід (116 г, 1,4 еквівалентні кількості) при кімнатній температурі додали до розчину метил 2-(3,4-дихлорфеніл)ацетату (106,8 г, 0,446 моль) в 1,2-дихлоретані (320 мл) з подальшим нагріванням до 85 °C. До цього розчину по краплях роздільно по 10 разів через кожні 10 хвилин додали розчин бензоїлпероксиду (2,26 г, 2,0 %мол.) у 1,2-дихлоретані (22,6 мл) з подальшим перемішуванням при 85 °C протягом 3 годин. Реакційний розчин охолодили до 9 UA 104286 C2 5 10 15 20 25 30 35 40 45 кімнатної температури, послідовно промили 2 н. водним розчином гідроксиду натрію, змішаним водним розчином вода/тіосульфат натрію (2:1 (об'єм/об'єм)), насиченим водним розчином хлориду амонію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий цільовий продукт у вигляді масла коричневого кольору (142 г, вихід: 103 %). 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 3,81 (с, 3Н), 5,27 (с, 1H), 7,37-7,47 (м, 2H), 7,66 (д, J=2,1 Гц, 1Н). ДОВІДКОВИЙ ПРИКЛАД СИНТЕЗУ 19 Метил 2-(3,4-диметил феніл)-2-бромацетат В атмосфері газоподібного азоту розчин 1,56 н. n-бутиллітій/n-гексан (56,77 мл, 88,57 ммоль) по краплях протягом 30 хвилин при температурі приблизно -40 °C додали розчин 1,1,1,3,3,3-гексаметилдисилазану (15,60 г, 92,78 ммоль) у зневодненому тетрагідрофурані (150 мл). Потім до реакційного розчину по краплях протягом 20 хвилин додали розчин метил 2-(3,4диметидфеніл)ацетату (15,03 г, 84,35 ммоль) у зневодненому тетрагідрофурані (150 мл). Цей реакційний розчин по краплях протягом 1 години при температурі приблизно -35 °C в атмосфері газоподібного азоту додали до розчину брому (4,54 ммоль, 88,57 ммоль) у зневодненому тетрагідрофурані (150 мл). Після перемішування при температурі приблизно -35 °C протягом 1 години температуру підвищили до 0 °C і до реакційного розчину додали змішаний водний розчин рідини вода/тіосульфат натрію (1:1 (об'єм/об'єм)) і екстрагували етилацетатом. Потім екстракт промили насиченим водним розчином хлориду амонію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий цільовий продукт у вигляді масла червоного кольору (18,23 г, вихід: 84 %). LC/MS: Режим 1, час утримування 4,10 (хв.) LC/MS (ESI+) m/z; 177,05 [M+1-Br] 1 Н-ЯМР (частин па мільйон в CDCl3, 300 МГц) δ: 2,25 (с, 3Н), 2,27 (с, 3Н), 3,78 (с, 3Н), 5,33 (с, 1H), 7,12 (д, J=8,1Гц, 1H), 7,25-7,28 (мульти, 1Н), 7,3 (шир. с, 1H). ДОВІДКОВІ ПРИКЛАДИ СИНТЕЗУ 14, 15, 16 і 18 Сполуки були синтезовані у відповідності до Довідкового прикладу синтезу 13 Дані ЯМР-аналізу сполук показані нижче. ДОВІДКОВИЙ ПРИКЛАД СИНТЕЗУ 14 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 1,32 (с, 9Н), 3,79 (с, 3Н), 5,36 (с, III), 7,37-7,40 (м, 2Н), 7,45-7,49 (м, 1H). ДОВІДКОВИЙ ПРИКЛАД СИНТЕЗУ 15 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 3,79 (с, 3Н), 5,30 (с, 1H), 7,40-7,57 (м, 4Н). ДОВІДКОВИЙ ПРИКЛАД СИНТЕЗУ 16 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 3,80 (с, 3Н), 5,32 (с, 1 Н), 7,29-7,64 (м, 4Н). ДОВІДКОВИЙ ПРИКЛАД СИНТЕЗУ 18 1 Н-ЯМР (300 МГц, частим на мільйон в CDCl3) δ: 3,80 (с, 3Н), 5,37 (с, 1H), 7,57-7,69 (м, 4Н). ДОВІДКОВІ ПРИКЛАДИ СИНТЕЗУ 17 і 20-24 Сполуки були синтезовані у відповідності до Довідкового прикладу синтезу 13. Морфологія і дані LC/MS-аналізу сполук показані нижче. 10 UA 104286 C2 ТАБЛИЦЯ 2 Довідкові приклади синтезу Морфологія Режим LC/MS 17 Жовто-оранжеве масло 2 20 Ясно-жовте масло 3 21 Червоне масло 1 22 Ясно-жовте масло 3 23 Жовте масло 3 24 Жовто-оранжеве масло Спостережений пік (ESI+) 2 Спостережений пік (ESI-) Час утримання, хв. 3,30 3,00 3,93 3,12 2,63 3,10 183,00 (M+1-Br) 233 (M+1-Br) 179,11 (M+1-Br) 217,219 (M+1-Br) 167 (M+1-Br) 167,04 (M+1-Br) Структури сполук в Довідкових прикладах синтезу показані нижче. Дов. пр. синт. 1 Дов. пр. синт. 2 Дов. пр. синт. 3 Дов. пр. синт. 4 Дов. пр. синт. 5 Дов. пр. синт. 6 Дов. пр. синт. 7 Дов. пр. синт. 8 Дов. пр. синт. 9 Дов. пр. синт. 10 Дов. пр. синт. 11 Дов. пр. синт. 12 Дов. пр. синт. 13 Дов. пр. синт. 14 Дов. пр. синт. 15 Дов. пр. синт. 16 Дов. пр. синт. 17 Дов. пр. синт. 18 Дов. пр. синт. 19 Дов. пр. синт. 20 5 11 UA 104286 C2 Дов. пр. синт. 21 5 10 15 20 25 30 Дов. пр. синт. 22 Дов. пр. синт. 23 Дов. пр. синт. 24 ПРИКЛАД СИНТЕЗУ 1 Метил 2-тіоацетил-2-(3,4-дихлорфеніл)ацетат Розчин метил 2-(3,4-дихлорфеніл)-2-бромацетату (134г, 0,451 моль) у толуолі (403 мл) по краплях протягом 15 хвилин при 5 °C додали до розчину тіоацетату калію (67,7 г, 0,586 моль, 1,3 еквівалентних кількостей, з розрахунку кількості вихідного матеріалі) у метанолі (403 мл) з подальшим перемішуванням при 5 °C протягом 1 години. Отриману тверду речовину піддали фільтруванню, а фільтрат змішали з толуолом (403 мл), послідовно промили водою, насиченим водним розчином гідрокарбонату натрію, насиченим водним розчином хлориду амонію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий цільовий продукт у вигляді масла жовтого кольору (136 г, вихід: 103 %) 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 2,37 (с, 3Н), 3,77 (с, 3Н), 5,26 (с, 1H), 7,19-7,26 (м, 1H), 7,39-7,43 (м, 1H), 7,51 (с, 1Н). ПРИКЛАДИ СИНТЕЗУ 2, 3 і 6 Сполуки були приготовані у відповідності до Прикладу синтезу 1. Дані ЯМР-аналізу сполук показані нижче. ПРИКЛАД СИНТЕЗУ 2 1 Н-ЯМP (300 МГц, частин на мільйон в CDCl3) δ: 1,31 (с, 9Н), 2,36 (с, 3Н), 3,74 (с, 3Н), 5,30 (с, 1H), 7,28-7,37 (м, 4Н). ПРИКЛАД СИНТЕЗУ 3 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 2,35 (с, 3Н), 3,76 (с, 3Н), 5,27 (с, 1H), 7,25-7,29 (м, 2Н), 7,45-7,48 (м, 2Н). ПРИКЛАД СИНТЕЗУ 6 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 2,37 (с, 3Н), 3,76 (с, 3Н), 5,38 (с, 1Н), 7,42-7,62 (м, 4Н). ПРИКЛАДИ СИНТЕЗУ 4, 5 і 7-12 Сполуки були синтезовані у відповідності до Прикладу синтезу 1. Морфологія і дані LC/MSаналізу сполук показані нижче. ТАБЛИЦЯ 3 Довідкові приклади синтезу 4 5 7 8 9 10 11 12 35 Режим LC/MS Спостережений пік (ESI+) Червоне масло Жовте масло Жовте масло Безкольорове масло Жовте масло 2 1 1 3 259,03 258,90 252,96 309 2 Ясно-жовте масло Ясно-жовте масло Жовте масло 3 276,85 (M+1+Na+) 293,295 Морфологія 3 1 265 (M+1+Na+) 242,99 Спостережений Час пік (ESI-) утримання, хв. 256,95 250,95 307 3,29 3,92 4,00 2,97 2,45 291,293 3,00 241 2,59 241,04 3,67 ПРИКЛАД СИНТЕЗУ 13 (МЕТОД СИНТЕЗУ 1) Метил 2-(3-оксобутилтіо)-2-(3,4-дихлорфеніл)ацетат Розчин 2-тіоацетил-2-(3,4-дихлорфеніл)метилацетату (100 г, 341 ммоль) у метанолі (400 мл) нагріли до 60 °C і додали 35 % мас. хлористоводневої кислоти (42,6 мл, 1,5 еквівалентні 12 UA 104286 C2 5 10 15 20 25 30 35 40 кількості) з подальшим перемішуванням при 60 °C протягом 4 годин. Після того, як реакційний розчин охолодили до кімнатної температури, його по краплях протягом 25 хвилин при кімнатній температурі додали до розчину метилвінілкетону (58,3 мл, 1,2 еквівалентні кількості) в етилацетаті (400 мл) і тріетиламіні (95,1 мл, 2,0 еквівалентні кількості) з подальшим перемішуванням при кімнатній температурі протягом 1 години. До реакційного розчину додали етилацетат (200 мл) з подальшим відділенням рідкої фази з використанням змішаного рідкого насиченого водою сольового розчину (1:1) (об'єм/об'єм)), а водний шар знову екстрагували етилацетатом (100 мл). Екстракт об'єднали з органічним шаром, промили насиченим водним розчином хлориду амонію і насиченим сольовим розчином І просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий цільовий продукт у вигляді масла (103 г, вихід; 94 %). 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 2,20 (с, 3Н), 2,70-2,79 (м, 4Н), 3,70 (с, 3Н), 4,57 (с, 1Н), 7,30-7,58 (м, 3Н). (МЕТОД СИНТЕЗУ 2) Розчин метил 2-тіоацетил-2-(3,4-дихлорфеніл)ацетату (70 г, 239 ммоль) у метанолі (280 мл) нагріли до 60 °C і додали 35 % мас. хлористоводневої кислоти (29,9 мл, 1,5 еквівалентні кількості) з подальшим перемішуванням при 60 °C протягом 3,5 годин. Після охолоджування реакційного розчину до кімнатної температури його по краплях протягом 30 хвилин при кімнатній температурі додали до розчину метилвінілкетону (24,1 мл, 1,2 еквівалентні кількості) в етилацетаті (280 мл) і тріетиламіні (66,6 мл, 2,0 еквівалентні кількості) з подальшим перемішуванням при кімнатній температурі протягом 0,5 годин. Реакційний розчин змішали з етилацетатом (140 мл), послідовно промили змішаною рідиною насиченого водою сольового розчину (1:2 (об'єм/об'єм)), насиченого водного розчину хлориду амонію і насиченого сольового розчину і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, розчинник відігнали, а отриманий напівфабрикат змішали з етилацетатом (140 мл), активованим вугіллям і силікагелем і профільтрували крізь целіт, а розчинник фільтрату відігнали, в результаті чого був отриманий цільовий продукт у вигляді масла жовтого кольору (70,8 г, вихід: 92 %). ПРИКЛАДИ СИНТЕЗУ 14 і 15 Сполуки були приготовані у відповідності до Прикладу синтезу 13 (Метод синтезу 2). Дані ЯМР-аналізу сполук показані нижче. ПРИКЛАД СИНТЕЗУ 14 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 1,30 (с, 9Н), 2,11 (с, 3Н), 2,64-2,75 (м, 4Н), 3,73 (с, 3Н), 4,60 (с, 1H), 7,36 (с, 4Н). ПРИКЛАД СИНТЕЗУ 15 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 2,20 (с, 3Н), 2,66-2,76 (м, 4Н), 3,69 (с, 3Н), 4,57 (с, 1H), 7,33-7,50 (м, 4Н). ПРИКЛАДИ СИНТЕЗУ 16-24 Сполуки були приготовані у відповідності до Прикладу синтезу 13 (Метод синтезу 2). Морфологія і дані LC/MS-аналізу сполук показані нижче. ТАБЛИЦЯ 4 Довідкові приклади синтезу Морфологія Режим LC/MS 3,75 285,07 3,74 3,97 3,82 3 337 2,85 1 1 282,94 321,323 293 (М+1+Na+) 292,88 (М+1+Na+) 3,35 2,87 2,47 3,52 Червоне масло 1 17 18 1 4 21 22 Коричневе масло Коричневе масло Червонуватокоричневе масло Безкольорове масло Коричневе масло Ясно-жовте масло 23 Ясно-жовте масло 3 24 Коричневе масло 1 20 Спостережений Час утримання, пік (ESI-) хв. 308,79 (М+1+Na+) 286,84 320,85 302,88 (М+1+Na+) 16 19 Спостережений пік (ESI+) 1 13 UA 104286 C2 5 10 15 20 25 30 35 40 ПРИКЛ АД СИНТЕЗУ 25 2-(3,4-Дихлорфеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофен (МЕТОД СИНТЕЗУ 1) Розчин аміду натрію (19,2 г, чистота: 90 %, 1,5 еквівалентні кількості, з розрахунку кількості вихідного матеріалу) у метанолі (500 мл) нагріли до 40 °C і до цього розчину по краплях протягом 12 хвилин додали розчин метил 2-(3,4-дихлорфеніл)-2-(3-оксобутилтіо)ацетату (100 г, чистота: 95 %, 296 ммоль) у метанолі (200 мл) з подальшим перемішуванням при 40 °C протягом 1 години. Реакційний розчин охолодили до 5 °C, по краплях протягом 10 хвилин додали воду (300 мл), а потім розчинник відігнали. До отриманого напівфабрикату додали хлороформ і насичений водний розчин хлориду амонію з подальшим відділенням рідкої фази, а органічний шар промили насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був одержаний цільовий продукт у вигляді масла (59,3 г, вихід; 65 %). 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) 5: 2,17 (с, 3Н), 3,79-3,92 (м, 2Н), 4,95 (с, 1H), 7,22-7,25 (м, 1H), 7,37-7,43 (м, 1H), 7,50-7,5 1 (м, 1H). (МЕТОД СИНТЕЗУ 2) Розчин аміду натрію (13,2 г, 325 ммоль) у метанолі (325 мл) нагріли до 40 °C і до цього до розчину по краплях протягом 20 хвилин додали розчин метил 2-(3,4-дихлорфеніл)-2-(3оксобутилтіо)ацетату (65 г, 202 ммоль) у метанолі (130 мл) з подальшим перемішуванням при 40 °C протягом І години. Після того, як реакційну суміш охолодили до кімнатної температури, до неї по краплях протягом 3 хвилин додали воду (13 мл), а потім розчинник відігнали. До отриманого напівфабрикату додали хлороформ і насичений водний розчин хлориду амонію з подальшим відділенням рідкої фази, а органічний шар промили насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий цільовий продукт у вигляді масла коричневого кольору (46,4 г, вихід: 79 %). ПРИКЛАД СИНТЕЗУ 26 Сполука була приготована у відповідності до Прикладу синтезу 25 (Метод синтезу 2). Продукт був використаний для наступного етапу без структурного аналізу. ПРИКЛАДИ СИНТЕЗУ 27 і 33 Сполуки були приготовані у відповідності до Прикладу синтезу 25 (Метод синтезу 2). Дані ЯМР-аналізу сполук показані нижче. ПРИКЛАД СИНТЕЗУ 27 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 2,16 (с, 3Н), 3,79-3,91 (м, 2Н), 4,97 (с, 1H), 7,25-7,29 (м, 2Н), 7,46-7,52 (м, 2Н). ПРИКЛАД СИНТЕЗУ 33 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 2,14 (с, 3Н), 3,80-3,91 (м, 5Н), 4,99 (с, 1H), 6,67-6,92 (м, 2Н), 7,29-7,34 (м, 2Н). ПРИКЛАДИ СИНТЕЗУ 28-32 і 34-36 Сполуки були синтезовані у відповідності до Прикладу Синтезу 25 (Метод синтезу 2). Морфологія і дані LC/MS-аналізу сполук показані нижче. ТАБЛИЦЯ 5 Довідкові приклади синтезу 28 29 30 31 32 34 35 36 Морфологія Червоне масло Червоне масло Коричневе масло Жовтуватокоричневе масло Коричневе масло Коричневе масло Коричневе масло Червоне масло Режим LC/MS Спостережений Спостережений пік (ESI+) пік (ESI-) Час утримання, хв. 6 1 4 254,93 254,88 288,90 252,98 252,93 286,96 2,88 4,14 4,39 1 248,97 247,02 4,27 3 3 3 1 305 289, 291 239 238,97 303 287, 289 237 237,02 3,10 3,22 2,74 3,85 45 14UA 104286 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПРИКЛАД СИНТЕЗУ 37 2-(3,4-Дихлорфеніл)-3-гідрокси-4-метилкарбонілтіофен Розчин 2-(3,4-дихлорфеніл)-3-гідрокси-4-метилкарбоніл-2,5-дихлортіофену (96,7 г, 221 ммоль, чистота: 63 %) у хлороформі (967 мл) охолодили до -18 °C і до цього розчину по краплях протягом 20 хвилин додали розчин сульфурилхлориду (19,5 мл, 1,15 еквівалентні кількості) у хлороформі (193 мл) з подальшим перемішуванням при -20 °C протягом 1 години. Температуру розчину підвищили до 0 °C, після чого до нього по краплях протягом 5 хвилин додали воду (193 мл) з подальшим відділенням рідкої фази. Отриманий розчин у хлороформі послідовно промили водою, насиченим сольовим розчином, насиченим водним розчином гідрокарбонату натрію, насиченим водним розчином тіосульфату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий напівфабрикат. До отриманого напівфабрикату додали 2-пропанол (967 мл) з подальшим перемішуванням при 5 °C протягом 1 години. Утворені кристали були піддані фільтруванню, в результаті чого був отриманий цільовий продукт у вигляді твердої речовини палевого кольору (49,4 г, вихід: 51 %). 1 Н-ЯМР (300 МГц, частин на мільйон в СПСl3) δ: 2,56 (с, 3Н), 7,44 (д, J=8,4 Гц, 1H), 7,62 (дд, J=8,4 Гц, 1,2 Гц, 1H), 7,91-7,93 (м, 2Н), 10,51 (с, 1H). ПРИКЛАД СИНТЕЗУ 38 2-(4-t-Бутилфеніл)-3-гідрокси-4-метилкарбонілтіофен Розчин 2-(4-t-бутилфеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофену (24,94 г, 64,6 ммоль, чистота: 78 %) у хлороформі (250 мл) охолодили до -23 °C і до цього розчину по краплях протягом 27 хвилин додали розчин сульфурилхлориду (5,45 мл, 1,05 еквівалентні кількості) у хлороформі (50 мл) з подальшим перемішуванням при температурі від -22 до -24 °C протягом 33 хвилин. Температуру розчину підвищили до -3 °С і по краплях протягом 2,5 хвилин додали воду (50 мл) з подальшим відділенням рідкої фази. Отриманий розчин хлороформу послідовно промили водою, насиченим сольовим розчином, водним розчином гідроксиду натрію, насиченим водним розчином тіосульфату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий напівфабрикат. Отриманий напівфабрикат відігнали в хлороформі (80 мл) при 45 °C, розчин охолодили до 0 °C і по краплях додали ізопропанол (375 мл) з подальшим перемішуванням при 0 °C протягом 40 хвилин. Утворені кристали були піддані фільтруванню, в результаті чого був отриманий цільовий продукт у вигляді твердої речовини жовтого кольору (15,5 г, вихід: 63 %). LC/MS: Режим 2, час утримування 4,54 (хв.) LC/MS (ESI+) m/z; 297,299 [М+1] LC/MS (ESI-) m/z; 295,297 [М-1] ПРИКЛАД СИНТЕЗУ 39 2-(4-Бромфеніл)-3-гідрокси-4-метилкарбонілтіофен Розчин 2-(4-бромфеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофену (24,9 г, 64,6 ммоль, чистота: 78 %) у хлороформі (249 мл) охолодили до -23 °C і по краплях протягом 27 хвилин додали розчин сульфурилхлориду (5,45 мл, 1,05 еквівалентні кількості) у хлороформі (50 мл) з подальшим перемішуванням при -20 °C протягом 1 години. Температуру розчину підвищили до -5 °C і по краплях протягом 3 хвилин додали воду (50 мл) з подальшим відділенням рідкої фази. Отриманий розчин хлороформу послідовно промили водою, насиченим сольовим розчином, водним розчином гідроксида натрію, насиченим водним розчином тіосульфату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий напівфабрикат. До отриманого напівфабрикату протягом 40 хвилин додали 2-пропанол (374 мл) з подальшим перемішуванням при 0 °C. Утворені кристали видалили фільтруванням, в результаті чого був отриманий цільовий продукт у вигляді твердої речовини жовтого кольору (15,7 г, вихід: 63 %). LC/MS: Режим 1, час утримування 4,54 (хв.) LC/MS (ESI+) m/z: 297,299 [М+1] ПРИКЛАД СИНТЕЗУ 40 2-(4-Хлорфеніл)-3-гідрокси-4-метилкарбонілтіофен Розчин 2-(4-хлорфеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофену (10,00 г, 37,29 ммоль, чистота: 95 %) у хлороформі (100 мл) охолодили до -40 °C і до цього розчину по краплях протягом 50 хвилин додали розчин сульфурилхлориду (3,6 мл, 1,2 еквівалентні кількості) у хлороформі (150 мл) з подальшим перемішуванням при -35 °C протягом 40 хвилин. 15 UA 104286 C2 5 10 15 20 25 30 35 40 45 50 55 60 Температуру розчину підвищили до -3 °С і по краплях додали воду (20 мл) з подальшим відділенням рідкої фази. Отриманий розчин хлороформу послідовно промили водою, насиченим сольовим розчином, насиченим водним розчином гідрокарбонату натрію, насиченим водним розчином тіосульфату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий напівфабрикат. Отриманий напівфабрикат суспендували в ізопропіловому спирті (100 мл) при кімнатній температурі з подальшим перемішуванням при 0 °C протягом 15 хвилин. Утворені кристали піддали фільтруванню, в результаті чого був отриманий цільовий продукт у вигляді твердої речовини жовтого кольору (7,26 г, вихід: 77 %). LC/MS: Режим 6, час утримування 3,17 (хв.) LC/MS (ESI+) m/z; 252,92, 254,87 [М+1] LC/MS (ESI-) m/z; 250,97, 252,92 [М-1] ПРИКЛАД СИНТЕЗУ 41 2-(3-Хлорфеніл)-3-гідрокси-4-метилкарбонілтіофен Розчин 2-(3-хлорфеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофену (2,49 г, 8,02 ммоль, чистота: 82 %) у хлороформі (25 мл) охолодили до -43 °C і до цього розчину по краплях протягом 32 хвилин додали розчин сульфурилхлориду (0,77 мл, 1,1 еквівалентні кількості) у хлороформі (50 мл) з подальшим перемішуванням при -15 °C протягом 1 години. Температуру розчину підвищили до 0 °C і по краплях додали воду (5 мл) з подальшим відділенням рідкої фази. Отриманий розчин хлороформу послідовно промили водою, насиченим сольовим розчином, водним розчином гідроксида натрію, насиченим водним розчином тіосульфату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був одержаний цільовий продукт у вигляді твердої речовини жовтого кольору (2,0 г, вихід: 99 %). LC/MS: Режим 1, час утримування 4,49 (хв.) LC/MS (ESI+) m/z; 252,87 254,82 [М+1] LC/MS (ESI-) m/z; 250,92 252,93 [М-1] ПРИКЛАД СИНТЕЗУ 42 2-(4-Трифторметилфеніл)-3-гідрокси-4-метилкарбонілтіофен Розчин 2-(4-трифторметилфеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофену (22,25 г, 69,46 ммоль, чистота: 90 %) у хлороформі (223 мл) охолодили до -46 °C і до цього розчину по краплях додали протягом 10 хвилин розчин сульфурилхлориду (6,70 мл, 1,2 еквівалентні кількості) у хлороформі (334 мл) з подальшим перемішуванням при -4 °C протягом 10 хвилин. Температуру розчину підвищили до 0 °C і протягом 15 хвилин по краплях додали воду (45 мл) з подальшим відділенням рідкої фази. Отриманий розчин хлороформу послідовно промили водою, насиченим сольовим розчином, насиченим водним розчином гідрокарбонату натрію, насиченим водним розчином тіосульфату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий напівфабрикат. Отриманий напівфабрикат відділили і очистили методом колонкової хроматографії на силікагелі (елюент:гексан/хлороформ = 1/1 (об'єм/об'єм)), в результаті чого був отриманий цільовий продукт у вигляді твердої речовини жовтого кольору (14,78 г, вихід: 69 %). LC/MS: Режим 2, час утримування 3,70 (хв.) LC/MS (ESI+) m/z; 286,90 [М+1] LC/MS (ESI-) m/z; 284,95 [М-1] ПРИКЛАД СИНТЕЗУ 43 2-(3,4-Диметилфеніл-3-гідрокси-4-метилкарбонілтіофен Розчин 2-(3,4-диметилфеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофену (2,44 г, 9,82 ммоль, чистота: 72 %) у хлороформі (24 мл) охолодили до -40 °C і до цього розчину по краплях додали протягом 55 хвилин розчин сульфурилхлориду (0,79 мл, 1,0 еквівалентні кількості) у хлороформі (37 мл) з подальшим перемішуванням при -40 °C протягом 60 хвилин. Температуру розчину підвищили до 0 °C і по краплях протягом 1 хвилини додали воду (5 мл) з подальшим відділенням рідкої фази. Отриманий розчин хлороформу послідовно промили водою, насиченим сольовим розчином, насиченим водним розчином гідрокарбонату натрію, насиченим водним розчином тіосульфату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий напівфабрикат. Отриманий напівфабрикат суспендували в ізопропіловому спирті (37 мл) при кімнатній температурі з подальшим перемішуванням при 0 °С протягом 30 хвилин. Утворені кристали піддали фільтруванню, в 16 UA 104286 C2 5 10 15 20 25 30 35 40 45 50 55 результаті чого був отриманий цільовий продукт (0,47 г, вихід: 20 %) у вигляді твердої речовини жовтого кольору. Крім того, фільтрат відділили і очистили методом колонкової хроматографії на силікагелі (елюент:гексан/етилацетат = 3/1 (об'єм/об'єм)), в результаті чого був отриманий цільовий продукт (0,81 г, вихід: 33 %) у вигляді твердої речовини жовтого кольору (1,28 г, вихід: 53 %) LC/MS: Режим 1, час утримування 4,52 (хв.) LC/MS (ESI+) m/z; 246,95 [М+1] LC/MS (ESI-) m/z; 245,00 [М-1] ПРИКЛАД СИНТЕЗУ 44 2-(4-Трифторметоксифеніл)-3-гідрокси-4-метилкарбонілтіофен Розчин 2-(4-трифторметоксифеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофену (4,5 г, 12,6 ммоль, чистота: 85 %) у хлороформі (45 мл) охолодили до -5 °C і до цього розчину по краплях протягом 30 хвилин додали розчин у хлороформі (90 мл) сульфурилхлориду (1,1 мл, 1,1 еквівалентні кількості) з подальшим перемішуванням при -15 °C протягом 1 години. Температуру розчину підвищили до 0 °C і по краплях додали воду (11 мл) з подальшим відділенням рідкої фази. Отриманий розчин хлороформу послідовно промили водою, насиченим сольовим розчином, водним розчином гідроксида натрію, насиченим водним розчином тіосульфату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий напівфабрикат. Отриманий напівфабрикат очистили методом колонкової хроматографії на силікагелі (елюент:гексан/етилацетат), в результаті чого був отриманий цільовий продукт у вигляді твердої речовини жовтого кольору (3,15 г, вихід: 83 %). LC/MS (ESI+) m/z; 303 [М+1] LC/MS (ESI-) m/z; 301 [М-1] ПРИКЛАД СИНТЕЗУ 45 2-(4-Метоксифеніл)-3-гідрокси-4-метилкарбонілтіофен Розчин 2-(4-метоксифеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофену (6,67 г, 18,45 ммоль, чистота: 80 %) у хлороформі (67 мл) охолодили до -16 °C і до цього розчину по краплях протягом 20 хвилин додали розчин сульфурилхлориду (1,78 мл, 1,2 еквівалентні кількості) у хлорофермі (13 мл) з подальшим перемішуванням при -12 °C протягом 42 хвилин. Температуру розчину підвищили до -3 °С і протягом 5 хвилин по краплях додали воду (13 мл) з подальшим відділенням рідкої фази. Отриманий розчин хлороформу послідовно промили водою, насиченим сольовим розчином, насиченим водним розчином гідрокарбонату натрію, насиченим водним розчином тіосульфату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий напівфабрикат. Отриманий напівфабрикат відділили і очистили методом колонкової хроматографії на силікагелі (елюент: гексан/етилацетат/хлороформ = 7,5/2,5/1 (об'єм/об'єм/об'єм)), в результаті чого був отриманий цільовий продукт у вигляді твердої речовини жовтого кольору (4,83 г, вихід: 73 %). 1 Н-ЯМР (300 МГц, частин на мільйон в CDCl3) δ: 2,56 (с, 3Н), 3,83 (с, 3Н), 4,99 (с, 1H), 6,92-6,95 (м, 2Н), 7,69-7,72 (м, 2Н), 7,83 (с, 1H), 10,23 (с, 1H). ПРИКЛАД СИНТЕЗУ 46 2-(2,4-Дихлорфеніл-3-гідрокси-4-метилкарбонілтіофен Розчин 2-(2,4-дихлорфеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофену (0,3 г, 0,93 ммоль, чистота: 90 %) у хлороформі (3 мл) охолодили до -36 °C і до цього розчину по краплях протягом 10 хвилин додали розчин сульфурилхлориду (0,082 мл, 1,2 еквівалентні кількості) у хлороформі (5 мл) з подальшим перемішуванням при -25 °C протягом 40 хвилин. Температуру розчину підвищили до 5 °C і по краплях додали воду (0,6 мл) з подальшим відділенням рідкої фази. Отриманий розчин хлороформу послідовно промили водою, насиченим сольовим розчином, водним розчином гідроксида натрію, насиченим водним розчином тіосульфату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий цільовий продукт у вигляді твердої речовини жовтого кольору (0,27 г, вихід: 91 %). LC/MS: Режим 3, час утримування 3,29 (хв.) LC/MS (ESI+) m/z; 287, 289, 291 [М+1] LC/MS (ESI-) m/z; 285,287,289 [М-1] ПРИКЛАД СИНТЕЗУ 47 2-(4-Фторфеніл)-3-гідрокси-4-метилкарбонілтіофен 17 UA 104286 C2 5 10 15 20 25 30 35 40 45 50 55 60 Розчин 2-(4-фторфеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофену (0,63 г, 2,38 ммоль, чистота: 90 %) у хлороформі (6,3 мл) охолодили до -12 °C і до цього розчину по краплях протягом 6 хвилин додали розчин сульфурилхлориду (0,23 мл, 1,2 еквівалентні кількості) у хлороформі (1,3 мл) з подальшим перемішуванням при -11 °C протягом 2 годин. Температуру розчину підвищили до 3 °С і по краплях додали воду (1,3 мл) з подальшим відділенням рідкої фази. Отриманий розчин хлороформу послідовно промили водою, насиченим сольовим розчином, водним розчином гідроксида натрію, насиченим водним розчином тіосульфату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий цільовий продукт у вигляді твердої речовини жовтого кольору (0,28 г, вихід: 50 %). LC/MS: Режим 3, час утримування 2,99 (хв.) LC/MS (ESI+) m/z; 237 [М+1] LC/MS (ESI-) m/z; 235 [М-1] ПРИКЛАД СИНТЕЗУ 48 2-(3-Фторфеніл)-3-гідрокси-4-метилкарбонілтіофен Розчин 2-(3-фторфеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофену (0,61 г, 2,58 ммоль, чистота: 78 %) у хлороформі (6,2 мл) охолодили до -40 °C і до цього розчину по краплях протягом 3 хвилин додали розчин сульфурилхлориду (0,21 мл, 1,0 еквівалентні кількості) у хлороформі (1,2 мл). Температуру розчину підвищили до 0 °C і по краплях протягом 1 хвилини додали воду (1,2 мл) з подальшим відділенням рідкої фази. Отриманий розчин хлороформу послідовно промили водою, насиченим сольовим розчином, насиченим водним розчином гідрокарбонату натрію, насиченим водним розчином тіосульфату натрію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий напівфабрикат. Отриманий напівфабрикат відділили і очистили методом колонкової хроматографії (елюент: гексан/етил ацетат = 5/1 (об'єм/об'єм)), в результаті чого був отриманий цільовий продукт у вигляді твердої речовини зеленого кольору (0,27 г, вихід: 44 %). LC/MS: Режим 1, час утримування 4,22 (хв.) LC/MS (ESI+) m/z; 236,95 [М+1] LC/MS (ESI-) m/z; 235,00 [М-1] ПРИКЛАД СИНТЕЗУ 49 Метил 2-(3,4-дихлорфеніл)-2-(3-оксо-1-метилбутилтіо)ацетат Розчин метил 2-тіоацетил-2-(3,4-дихлорфеніл)ацетату (1,0 г, 3,4 ммоль), який синтезували у відповідності до Прикладу синтезу 1, у метанолі (6,8 мл) нагріли до 60 °C і до цього розчину додали 35 % мас. хлористоводневої кислоти (0,43 мл) з подальшим перемішуванням при температурі від 52-56 °C протягом 4 годин. Після того, як реакційний розчин охолодили до кімнатної температури, його по краплях протягом 8 хвилин при кімнатній температурі додали до розчину 3-бутен-2-ону (0,67 мл, 2 еквівалентні кількості) і триетиламіну (0,95 мл, 2,0 еквівалентні кількості) у Ν,Ν-диметилформаміді (6,8 мл) з подальшим перемішуванням при кімнатній температурі протягом 2 годин. Реакційний розчин змішали з етилацетатом (50 мл), послідовно промили змішаною рідиною з насиченого водою сольового розчину (1:1, (об'єм/об'єм)), насиченого водного розчину хлориду амонію і насиченого сольового розчину і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий цільовий продукт у вигляді масла палевого кольору (1,08 г, вихід: 95 %). ПРИКЛАД СИНТЕЗУ 50 2-(3,4-Дихлорфетл)-3-гідрокси-4-метиларбоніл-5-метил-2,5-дигідротіофен Розчин метил 2-(3,4-дихлорфеніл)-2-(3-оксо-1-метилбутилтіо)ацетату (1,07 г, 3,20 ммоль) і аміду натрію (0,17 г, чистота: 90 %, 1,2 еквівалентні кількості, з розрахунку кількості вихідного матеріалу) у 2-пропанолі (8 мл) піддали перемішуванню при кімнатній температурі протягом 1,5 годин. Реакційний розчин змішали з насиченим водним розчином (15 мл) хлориду амонію, а потім з водою, а розчинник відігнали. Отриманий напівфабрикат, що містив воду, екстрагували етилацетатом, а екстракт просушили над осушувальним агентом. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був одержаний цільовий продукт у вигляді масла червоного кольору (0,92 г, вихід: 95 %). ПРИКЛАД СИНТЕЗУ 51 2-(3,4-Дихлорфеніл)-3-гідрокси-4-метилкарбоніл-5-метилтіофен Розчин 2-(3,4-дихлорфеніл)-3-гідрокси-4-метилкарбопіл-5-метил-2,5-дигідротіофену (806 мг, 2,66 ммоль) у дихлорметані (13 мл) охолодили до -72 °C і до цього розчину по краплях протягом 3 хвилин додали розчин сульфурилхлориду (0,11 мл, 0,5 еквівалентні кількості) у дихлорметані 18 UA 104286 C2 5 10 15 20 25 30 35 40 45 50 55 60 (2,7 мл). Після того, як температуру розчину підвищили до кімнатної температури, розчин змішали з водою (16 мл) і насиченим водним розчином хлориду натрію (16 мл) і екстрагували дихлорметаном. Розчин дихлорметану просушили над осушувальним агентом і очистили методом колонкової хроматографії на силікагелі (елюент: гексан/етилацетат = 85/15, а потім 4/1 (об'єм/об'єм)), в результаті чого був одержаний цільовий продукт у вигляді твердої речовини жовтого кольору (0,25 г, вихід; 31 %). ПРИКЛАД СИНТЕЗУ 52 Ту ж реакцію, що і в Прикладі синтезу 1, здійснили з використанням тих же матеріалів і в тих же режимах реакції за винятком того, що еквівалентна кількість тіоацетату калію була замінена на 1,6 еквівалентні кількості, з розрахунку кількості вихідного матеріалу. Вихід становив 91 %. ПРИКЛАД СИНТЕЗУ 53 Ту ж реакцію, що і в Прикладі синтезу 1, здійснили з використанням тих же матеріалів І в тих же режимах реакції за винятком того, що температура реакції була змінена на 29 °C. Вихід становив 92 %. ПРИКЛАД СИНТЕЗУ 54 Метил 2-(3,4-дихлорфеніл)-2-(3-оксобутилтіо)ацетат До розчину метил-1-тіоацетил-1-(3,4-дихлорфеніл)ацетату (0,50 г, 1,7 ммоль) у метанолі (2 мл) додали концентровану сірчану кислоту (0,050 мл, 0,55 еквівалентних кількостей) з подальшим перемішуванням при 60 °C протягом 3 годин. Після того, як реакційний розчин охолодили до кімнатної температури, його по краплях при кімнатній температурі додали до розчину метилвінілкетону (0,17 мл, 1,2 еквівалентні кількості) і триетиламіну (0,36 мл, 1,5 еквівалентні кількості) в етилацетаті (2 мл). Реакційний розчин змішали з етилацетатом (1 мл) з подальшим відділенням рідкої фази змішаною рідиною насиченого водою сольового розчину. (1:1 (об'єм/об'єм)), а потім органічний шар промили насиченим водним розчином хлориду амонію і насиченим сольовим розчином і просушили над безводним сульфатом магнію. Осушувальний агент видалили фільтруванням, а розчинник відігнали, в результаті чого був отриманий цільовий продукт у вигляді безбарвного масла (0,42 г, вихід: 76 %) ПРИКЛАД СИНТЕЗУ 55 Метил 2-тіоацетил-2-(4-t-бутилфеніл)ацетат До розчину тіоацетату калію (70,4 г, 0,616 моль, 1,3 еквівалентні кількості, з розрахунку кількості вихідного матеріалу) у метанолі (203 г) по краплях протягом 1 години і 20 хвилин Додали змішаний розчин 33 % мас. Метил 2-(4-t-бутилфеніл)-2-бромацетату і метанолу (270 г) у метанолі (408,5 г, 0,473 моль) з подальшим перемішуванням при температурі від 30 до 40 °C протягом 1 години. Потім реакційний розчин змішали з гептаном (674 г) і водою (675 г) і піддали перемішуванню протягом 20 хвилин з подальшим відділенням рідкої фази. Розчинник відігнали з отриманого органічного шару в умовах зниженого тиску при 40 °C, поки загальна кількість не стала дорівнювати 382 г. Отриманий розчин охолодили до 30 °C протягом 1 години, після чого до нього додали 0,13 г кристалів-центрів кристалізації. Потім розчин піддали перемішуванню протягом 1 години з подальшим охолоджуванням протягом 3 годин до -10 °C. Потім розчин піддали перемішуванню протягом 1 години і піддали фільтруванню, а отримані кристали просушили, в результаті чого був одержаний цільовий продукт (110,7 г, вихід: 83,3 %). ПРИКЛАД СИНТЕЗУ 56 Метил 2-(4-t-бутил феніл)-2-(3-оксобутилтіо)ацетат До розчину метил 2-тіоацетил-2-(4-t-бутилфеніл)ацетату (100 г, 0,357 моль) у метанолі (200 г) додали 35 % мас. хлористоводневої кислоти (9,29 г, 0,25 еквівалентні кількості), розчин нагріли до 63 °C і піддали перемішуванню протягом 5 годин і 27 хвилин. Потім реакційну рідину охолодили приблизно до 30 °С. Отриманий розчин по краплях протягом 1 години і 37 хвилин при температурі від 25 до 26 °C додали до змішаного розчину толуолу (400 г), триетиламіну (27,1 г, 0,75 еквівалентні кількості) і метилвінілкетону (30,3 г, 1,2 еквівалентні кількості) з подальшим перемішуванням при 25 °C протягом 1 години і 43 хвилин. До реакційного розчину додали 35 % мас. хлористоводневої кислоти (22,3 г, 0,60 еквівалентні кількості), толуол (500 г) і воду (502 г) з подальшим відділенням рідкої фази, а отриманий органічний шар промили водою (500 г). Потім розчинник органічного шару відігнали в умовах зниженого тиску і додали толуол (378 г), в результаті чого було отримано 16,7 % мас. розчину цільового продукту в толуолі (618 г, кількісний вихід, визначений HPLC: 93,9 %). ПРИКЛАД СИНТЕЗУ 57 2-(4-t-Бутилфеніл)-3-гідрокси-4-метилкарбоніл-2,5-дигідротіофен Метил 2-(4-t-бутилфеніл)-2-(3-оксобутилтіо)ацетат (540 г, 16,7 % мас. розчину в толуолі) по краплях протягом 31 хвилин при температурі від 20 до 30 °C додали до розчину метоксиду натрію (112,6 г, 2,0 еквівалентні кількості, з розрахунку кількості вихідного матеріалу), толуолу 19 UA 104286 C2 5 10 15 20 25 (451 г) та ізопропанолу (90 г) у 28 % мас. метанолу з подальшим перемішуванням при температурі від 20 до 30 °C протягом 2 годин. Цей розчин по краплях при температурі від 20 до 30 °C додали до змішаного розчину 35 % мас. хлористоводневої кислоти (63,8 г, 2,1 еквівалентні кількості), води (386 г) і толуолу (180 г) протягом 1 години. Після перемішування протягом 1 години відділили рідку фазу, а отриманий органічний шар промили водою (450 г). Потім розчинник органічного шару відігнали в умовах пониженого тиску, в результаті чого було отримано 11,2 % мас. розчину цільового продукту в метанолі (665 г, кількісний вихід, визначений HPLC: 92,6 %). ПРИКЛАД СИНТЕЗУ 58 2-(4-t-Бутилфеніл)-3-гідрокси-4-метилкарбонілтіофен Розчин, що містив метанол (121,20 г), доданий до 11,2 % мас. розчину 2-(4-t-бутилфеніл)-3гідрокси-4-метилкарбоніл-2,5-дигідротіофену у метанолі (539,0 г, 217,08 ммоль), нагріли до 51 °C і по краплях протягом 30 хвилин додали 30 % мас. розчину пероксиду водню (61,6 г, 2,5 еквівалентні кількості) з подальшим перемішуванням при температурі від 50 до 52 °C протягом 5 годин. Потім розчин охолодили до 25-30 °C, а потім додали толуол, гептан і воду з подальшим відділенням рідкої фази. Потім до отриманого органічного шару додали 7 % мас. водного розчину гідрокарбонату натрію, толуолу і гептану з подальшим відділенням рідкої фази, після чого отриманий органічний шар промили 3 % мас. сольового розчину. Розчинник відігнали в умовах зниженого тиску з отриманого органічного шару, в результаті чого було отримано 26,6 % мас. розчину цільового продукту. До отриманого розчину додали метанол з тим, щоб відрегулювати концентрацію до 9 % мас, після чого розчин нагріли до 55-60 °C з метою розчинення утвореної твердої речовини. Потім до цього розчину по краплях додали 24,2 г води з подальшим перемішуванням протягом 1 години. Потім розчин охолодили до -10 °C і піддали перемішуванню протягом 1 години. Утворені кристали піддали фільтруванню, в результаті чого був отриманий цільовий продукт у вигляді кристалів жовтого кольору (44,2 г, вихід: 73,9 %). Структури сполук в Прикладах синтезу 1-51 показані нижче. Синтетичний приклад 1 Синтетичний приклад 2 Синтетичний приклад 3 Синтетичний приклад 4 Синтетичний приклад 5 Синтетичний приклад 6 Синтетичний приклад 7 Синтетичний приклад 8 Синтетичний приклад 9 Синтетичний приклад 10 Синтетичний приклад 11 Синтетичний приклад 12 20 UA 104286 C2 Синтетичний приклад 13 Синтетичний приклад 14 Синтетичний приклад 15 Синтетичний приклад 16 Синтетичний приклад 17 Синтетичний приклад 18 Синтетичний приклад 19 Синтетичний приклад 20 Синтетичний приклад 21 Синтетичний приклад 22 Синтетичний приклад 23 Синтетичний приклад 24 Синтетичний приклад 25 Синтетичний приклад 26 Синтетичний приклад 27 Синтетичний приклад 28 Синтетичний приклад 29 Синтетичний приклад 30 Синтетичний приклад 31 Синтетичний приклад 32 Синтетичний приклад 33 Синтетичний приклад 34 Синтетичний приклад 35 Синтетичний приклад 36 Синтетичний приклад 37 Синтетичний приклад 38 Синтетичний приклад 39 Синтетичний приклад 40 21 UA 104286 C2 Синтетичний приклад 41 Синтетичний приклад 43 Синтетичний приклад 44 Синтетичний приклад 45 Синтетичний приклад 46 Синтетичний приклад 47 Синтетичний приклад 48 Синтетичний приклад 49 5 Синтетичний приклад 42 Синтетичний приклад 50 Синтетичний приклад 51 ПРОМИСЛОВА ЗАСТОСОВНІСТЬ 2-Арил-3-гідрокси-4-заміщені карбонілтіофену сполуки, одержані способом виробництва, запропонованим у відповідності до даного винаходу, є промислово корисними сполуками як проміжні сполуки для виробництва ліків і агрохімікатів, наприклад, як проміжні сполуки для синтезу активаторів рецептора тромбопоетину (наприклад, WO2004/1G868). Повне розкриття патентної заявки Японії № 2008-049371, поданої 29 лютого 2008 p., включаючи опис, формулу винаходу і реферат, включено в даний опис у всій його повноті. ФОРМУЛА ВИНАХОДУ 10 1. Спосіб формулою: одержання 2-арил-3-гідрокси-4-заміщеного карбонілтіофену, представленого O R 2 R 15 OH 3 R S , (7) в якому піддають взаємодії 2-арилацетат, представлений формулою (1): R 4 O2 C X R 20 1 1 , (1) 1 де R означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С110алкоксильна група є незаміщеними або заміщеними атомом галогену)), 4 R означає С1-3 алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену), і X означає групу, що відщеплюється, і тіооцтову кислоту, представлену формулою (2): AcSM, (2) 22 UA 104286 C2 5 де Ас означає ацетильну групу (ацетильна група є незаміщеною або заміщеною С 1-3алкільною групою (С1-3алкільна група є незаміщеною або заміщеною атомом галогену) або атомом галогену), і М означає атом водню або метал, з утворенням тіоацетильної сполуки, представленої формулою (3): R4O2C SAc R 1 , (3) яку піддають гідролізу і отриманий тіол після його відділення або без відділення піддають взаємодії з вінілкетоном, представленим формулою (4): 3 R R 2 O 10 , (4) 2 3 де кожний з R і R , які є незалежними один від одного, означає атом водню або C 1-6алкільну групу (C1-6алкільна група є незаміщеною або заміщеною атомом галогену), з утворенням -кетосульфіду, представленого формулою (5): S R4O2C R 15 R 1 R 3 2 O , (5) який циклізують в основному середовищі з утворенням дигідротіофену, представленого формулою (6): O R 2 R OH 3 R S 1 , (6) який окислють, використовуючи окислювач. 2. Спосіб одержання 2-арил-3-гідрокси-4-заміщеного карбонілдигідротіофену, представленого формулою (6): O R 2 R 20 OH 3 SAc R 30 1 , (6) в якому піддають гідролізу тіоацетил формули (3): R4O2C 25 R S 1 , (3) 1 де R означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С110алкоксильна група є незаміщеними або заміщеними атомом галогену)), 4 R означає С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену), і Ас означає ацетильну групу (ацетильна група є незаміщеною або заміщеною С 1-3алкільною групою (С1-3алкільна група є незаміщеною або заміщеною атомом галогену) або атомом галогену), і одержаний тіол після його відділення або без відділення піддають взаємодії з вінілкетоном, представленим формулою (4): 23 UA 104286 C2 R 3 R 2 O , (4) 2 3 де кожний з R і R , які є незалежними один від одного, означає атом водню або С 1-6алкільну групу (С1-6алкільна група є незаміщеною або заміщеною атомом галогену), з утворенням -кетосульфіду, представленого формулою (5): S R4O2C 5 R 1 R R 3 2 O , (5) який циклізують в основному середовищі. 3. Спосіб одержання -кетосульфіду, представленого формулою (5): S R4O2C R 1 R R 3 2 O , (5) в якому піддають гідролізу тіоацетил формули (3): R4O2C 10 15 20 SAc R 1 , (3) 1 де R означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С110алкоксильна група є незаміщеними або заміщеними атомом галогену)), 4 R означає С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену), і Ас означає ацетильну групу (ацетильна група є незаміщеною або заміщеною С 1-3алкільною групою (С1-3алкільна група є незаміщеною або заміщеною атомом галогену) або атомом галогену), і одержаний тіол після його відділення або без відділення піддають взаємодії з вінілкетоном, представленим формулою (4): R 3 R 2 O , (4) 2 3 де кожний з R і R , які є незалежними один від одного, означає атом водню або С 1-6алкільну групу (С1-6алкільна група є незаміщеною або заміщеною атомом галогену). 4. Спосіб одержання -кетосульфіду, представленого формулою (5): S R4O2C 25 R 1 R R 3 2 O , (5) в якому піддають гідролізу тіоацетил формули (3): R4O2C SAc R 1 , (3) де R означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С110алкоксильна група є незаміщеними або заміщеними атомом галогену)), 4 R означає С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену), і Ас означає ацетильну групу (ацетильна група є незаміщеною або заміщеною С 1-3алкільною групою (С1-3алкільна група є незаміщеною або заміщеною атомом галогену) або атомом галогену), в кислому середовищі, і одержаний тіол після його відділення або без відділення піддають взаємодії з вінілкетоном, представленим формулою (4): 1 30 35 24 UA 104286 C2 3 R 5 R 2 O , (4) 2 3 де кожний з R і R , які є незалежними один від одного, означає атом водню або С 1-6алкільну групу (С1-6алкільна група є незаміщеною або заміщеною атомом галогену). 5. Спосіб одержання 2-арил-3-гідрокси-4-заміщеного карбонілдигідротіофену, представленого формулою (6): O R 2 R OH 3 R S 1 , (6) в якому піддають циклізації -кетосульфід, представлений формулою (5): S R4O2C R 1 R R 3 2 O , (5) де R означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і C110алкоксильна група є незаміщеними або заміщеними атомом галогену)), 2 3 кожний з R і R , які є незалежними один від одного, означає атом водню або С 1-6алкільну групу (С1-6алкільна група є незаміщеною або заміщеною атомом галогену), і 4 R означає С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену), в основному середовищі. 1 6. Спосіб одержання за будь-яким із згаданих вище пунктів 1-5, де R являє собою С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С 1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)). 2 7. Спосіб одержання за будь-яким із згаданих вище пунктів 1-6, де R являє собою С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену). 3 8. Спосіб одержання за будь-яким із згаданих вище пунктів 1-7, де R являє собою атом водню або метильну групу. 4 9. Спосіб одержання за будь-яким із згаданих вище пунктів 1-8, де R являє собою метильну групу. 1 10. Спосіб одержання за будь-яким із згаданих вище пунктів 1-9, де R являє собою фенільну групу (фенільна група є незаміщеною або заміщеною атомом галогену, С 1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)). 11. -Кетосульфід, представлений формулою (5): 1 10 15 20 25 30 S R4O2C R 1 R R 3 2 O , (5) де R означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С110алкоксильна група є незаміщеними або заміщеними атомом галогену)), 2 3 кожний з R і R , які є незалежними один від одного, означає атом водню або С1-6алкільну групу (С1-6алкільна група є незаміщеною або заміщеною атомом галогену), і 4 R означає C1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену). 12. -Кетосульфід за пунктом 11, де 1 R означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або алкоксильною групою (С 1-10алкільна група і С110алкоксильна група є незаміщеними або заміщеними атомом галогену)), 2 R означає С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену), 1 35 40 45 25 UA 104286 C2 3 5 R означає атом водню або метильну групу, і 4 R означає метильну групу. 1 13. -Кетосульфід за пунктом 12, де R означає фенільну групу (фенільна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С110алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)). 14. -Кетосульфід, вибраний з групи: O O S CH3 S CH3 CO2CH3 CO2CH3 Cl Cl tBu , , O O S S CH3 CH3 CO2CH3 CO2CH3 Br Cl , , O O S CH3 S CH3 CO2CH3 CO2CH3 Cl F3C , , O O S CH3 S CH3 CO2CH3 CO2CH3 H3C 10 CH3 F3CO , 26 , UA 104286 C2 O S O CH3 S CO2CH3 CH3 CO2CH3 H3CO Cl , Cl , O O S S CH3 CH3 CO2CH3 CO2CH3 F , 15. Дигідротіофен, представлений формулою (6): F . O R 2 R 5 10 15 20 OH 3 S R 1 , (6) 1 де R означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або С1-10алкоксильною групою (С1-10алкільна група і С110алкоксильна група є незаміщеними або заміщеними атомом галогену)), і 2 3 кожний з R і R , які є незалежними один від одного, означає атом водню або С 1-6алкільну групу (С1-6алкільна група є незаміщеною або заміщеною атомом галогену). 16. Дигідротіофен за пунктом 15, де 1 R означає С6-10арильну групу (С6-10арильна група є незаміщеною або заміщеною атомом галогену, С1-10алкільною групою або алкоксильною групою (С 1-10алкільна група і С110алкоксильна група є незаміщеними або заміщеними атомом галогену)), 2 R означає С1-3алкільну групу (С1-3алкільна група є незаміщеною або заміщеною атомом галогену), і 3 R означає атом водню або метильну групу. 17. Дигідротіофен за пунктом 16, де 1 R означає фенільну групу (фенільна група є незаміщеною або заміщеною атомом галогену, С 110алкільною групою або С 1-10алкоксильною групою (С1-10алкільна група і С1-10алкоксильна група є незаміщеними або заміщеними атомом галогену)). 18. Дигідротіофен, вибраний з групи: 27 UA 104286 C2 CH3 S S O Cl tBu , , , CH3 S O O OH OH Cl S F3C , CH3 , CH3 CH3 S O S O OH , F3CO , CH3 H3CO S S OH , CH3 CH3 O O O OH OH Cl Cl , F , F . 5 Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28 O OH OH CH3 O OH Cl , S Br CH3 S S O OH OH CH3 H3C S O OH Cl CH3 CH3
ДивитисяДодаткова інформація
Автори англійськоюYanagihara, Kazufumi, Owada, Shingo, Miyaji, Katsuaki
Автори російськоюЯнаджихара Казуфуми, Овада Шинго, Мияджи Кацуаки
МПК / Мітки
МПК: C07D 333/32, C07C 327/00, C07C 319/20, C07C 323/56
Мітки: спосіб, одержання, варіанти, сполуки, проміжних, сполук, тіофенової
Код посилання
<a href="https://ua.patents.su/30-104286-sposib-oderzhannya-tiofenovo-spoluki-ta-promizhnikh-spoluk-varianti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання тіофенової сполуки та її проміжних сполук (варіанти)</a>
Попередній патент: Контейнер, призначений для вміщення і зберігання біологічного матеріалу, зокрема днк
Наступний патент: Олігосахаридний інгредієнт
Випадковий патент: Пристрій для збирання плодів фруктів або горіхів