Стероїдні сполуки, застосування цих сполук для одержання лікарських засобів, які регулюють мейоз, і спосіб одержання цих сполук (варіанти)
Номер патенту: 75130
Опубліковано: 15.03.2006
Автори: Есперлінг Петер, Хегеле-Хартунг Хріста, Блюме Торстен
Формула / Реферат
1. Стероїдна сполука, яка має загальну формулу Х:
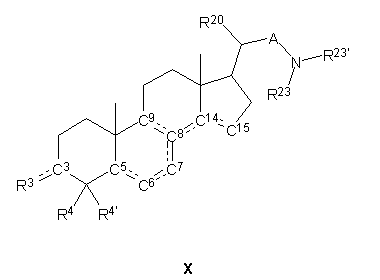 ,
,
де у фрагменті ХА:
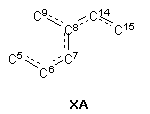
подвійний зв’язок присутній у 8 і/або 14 позиції;
C3R3 означає
а) C=O,
б) CH-OR3', де R3' вибирають із групи, яка включає водень, незаміщений або заміщений, лінійний або розгалужений (С1-С10)алкіл або C(O)-R3'', приєднаний до частини СН-О через С(О)-групу, де
R3'' вибирають із групи, яка включає
i) заміщений або незаміщений, лінійний або розгалужений (C1C10)алкіл,
ii) заміщений або незаміщений, лінійний або розгалужений (C1C10)фторалкіл,
iii) незаміщений або заміщений (C6-C10)арил,
iv) незаміщений або заміщений (C5-C10)гетероарил,
v) незаміщений або заміщений, лінійний або розгалужений (C1-C10)алкілокси, або
vi) незаміщений або заміщений, лінійний або розгалужений (C1-C10)алкіламіно,
в) CH-SO2-R3'' або C=NOR3'', де R3'' має значення, зазначені вище, або
г) CH-O-R3''', де R3''' означає незаміщений або заміщений, лінійний або розгалужений (С2-С10)алкілен і утворює з С3 атомом стероїдного скелета та атомом О циклічний простий ефір,
д) циклічну кільцеву структуру з С3 атомом, де R3 означає незаміщений або заміщений, лінійний або розгалужений (С2-С10)алкілен, або
е) CH-Hal, де Hal означає F, Cl, Br або I, та
R4, R4' і R20 вибирають незалежно з групи, яка включає водень і незаміщений або заміщений, лінійний або розгалужений (С1-С4)алкіл,
R23 і R23¢ утворюють разом
а) незаміщену або заміщену, лінійну або розгалужену (С2-С7)алкіленову групу, або
б) незаміщену або заміщену, лінійну або розгалужену (С2-С7)алкіленову групу, причому принаймні один з алкіленових атомів вуглецю замінений будь-яким з атомів О, N або S, і
А означає простий зв’язок або незаміщену або заміщену метиленову або етиленову групу.
2. Стероїдна сполука за п. 1, де подвійні зв’язки фрагмента ХА спряжені.
3. Стероїдна сполука за п. 1, де фрагмент ХА має одну з загальних формул:
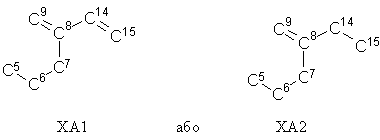 .
.
4. Стероїдна сполука за п. 1, де C3R3 означає СН-ОН або СН-О-С(О)-R3², R3 означає складноефірний радикал монокарбонової кислоти, дикарбонової кислоти або неорганічної кислоти і/або R3² означає (СН2)n-COOH, де n дорівнює 1, 2, 3, 4, 5 або 6, або фторметил.
5. Стероїдна сполука за п. 1, де R3¢ означає ацетил, пропіоніл, півалоїл, бутаноїл, бензоїл, нікотиніл, ізонікотиніл, гемісукциноїл і геміглутароїл.
6. Стероїдна сполука за п. 1, де R4 і R4¢ незалежно означають водень або (С1-С4)алкіл, заміщений галогеном, гідрокси, алкілокси або арилокси.
7. Стероїдна сполука за п. 1, де R20 означає водень або метил.
8. Стероїдна сполука за п. 1, де R23 і R23' разом з азотом аміногрупи утворюють азотовмісне гетероциклічне кільце, що являє собою піперидин-1-іл, морфолін-4-іл, піперазин-1-іл, піролідин-1-іл, пірол-1-іл, індол-1-іл, піразол-1-іл, імідазол-1-іл, тіазолідин-1-іл і оксазолідин-3-іл або їх заміщені похідні.
9. Стероїдна сполука за п. 8, де гетероциклічне кільце заміщене алкілом, алкенілом, алкінілом, циклоалкілом, циклоалкенілом, алкілциклоалкілом, арилом, алкіларилом, гідрокси, алкокси, алкілциклоалкілокси, алкілоксициклоалкілом, алкіларилокси, алкілоксіарилом, галогеном або ацилом.
10. Стероїдна сполука за п. 1, де А означає етиленову групу.
11. Стероїдна сполука за п. 1, де фрагмент ХА має загальну формулу:
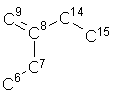 .
.
12. Стероїдна сполука за п. 1, де C3R3 означає СН-ОН або СН-О-С(О)-R3².
13. Стероїдна сполука за п. 1, де R3 означає складноефірний радикал монокарбонової кислоти, дикарбонової кислоти або неорганічної кислоти.
14. Стероїдна сполука за п. 1, де R3² означає (СН2)n-COOH, де n дорівнює 1, 2, 3, 4, 5 або 6.
15. Стероїдна сполука за п. 1, де R3² означає фторметил.
16. Стероїдна сполука за п. 1, де R4 і R4¢ незалежно означають водень або метил.
17. Стероїдна сполука за п. 1, де R4 і R4¢ незалежно означають (С1-С4)алкіл, заміщений галогеном, гідрокси, алкілокси або арилокси.
18. Стероїдна сполука за п. 1, де R20 означає водень.
19. Стероїдна сполука за п. 1, де R23 і R23' разом з азотом аміногрупи утворюють азотовмісне гетероциклічне кільце, що являє собою піперидин-1-іл, морфолін-4-іл, піперазин-1-іл, піролідин-1-іл, піридин-1-іл, хінолін-1-іл, ізохінолін-1-іл, піридазин-1-іл, піримідин-1-іл, піразин-1-іл, пірол-1-іл, індол-1-іл, хіноксалін-1-іл, піразол-1-іл, імідазол-1-іл, тіазол-1-іл або оксазол-3-іл або їх заміщені похідні.
20. Стероїдна сполука за п. 1, де R23 і R23' разом з азотом аміногрупи утворюють азотовмісне гетероциклічне кільце, що являє собою піперидин-1-іл, морфолін-4-іл, піперазин-1-іл або піролідин-1-іл.
21. Стероїдна сполука за п. 19, де кільце заміщене алкілом, алкенілом, алкінілом, циклоалкілом, циклоалкенілом, алкілциклоалкілом, арилом, алкіларилом, гідрокси, алкокси, алкілциклоалкілокси, алкілоксициклоалкілом, алкіларилокси, алкілоксіарилом, галогеном або ацилом.
22. Стероїдна сполука за п. 1, де А означає метилен.
23. Стероїдна сполука за п. 1, яку вибирають з групи, яка включає:
(20S)-20-[(3,3-диметилпіперидин-1-іл)метил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
(20S)-20-[(піперидин-1-іл)метил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
(20S)-20-[(4,4-диметилпіперидин-1-іл)метил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
(20S)-20-[(4-метилпіперазин-1-іл)метил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
(20S)-20-[(4-фенілпіперазин-1-іл)метил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
(20S)-20-[(морфолін-4-іл)метил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
(20S)-20-[(4-(піримідин-2-іл)піперазин-1-іл)метил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
(20S)-20-[(піролідин-1-іл)метил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
гемісукцинат (20S)-20-[(3,3-диметилпіперидин-1-іл)метил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -олу,
-олу,
(20S)-20-[(4-(піридин-2-іл)піперазин-1-іл)етил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
(20S)-20-[(4-фенілпіперазин-1-іл)етил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
(20S)-20-[(4-метилпіперазин-1-іл)етил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
(20S)-20-[(морфолін-4-іл)етил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
(20S)-20-[(піролідин-1-іл)етил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол,
-ол,
(20S)-20-[(піперидин-1-іл)етил]-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол.
-ол.
24. Фармацевтична композиція, яка містить принаймні одну стероїдну сполуку загальної формули Х за будь-яким з пп. 1-23 і принаймні один фармацевтично прийнятний наповнювач.
25. Фармацевтична композиція за п. 24, де стероїдна сполука загальної формули Х міститься в ефективній кількості.
26. Застосування стероїдної сполуки загальної формули Х за будь-яким з пп. 1-23 для одержання фармацевтичної композиції, яка є корисною при регуляції відтворення, особливо мейозу.
27. Застосування стероїдної сполуки загальної формули Х за п. 26 для використання non-in-vivo.
28. Застосування стероїдної сполуки загальної формули Х за будь-яким з пп. 1-23 для одержання контрацептиву або профертильного препарату.
29. Спосіб регуляції відтворення, особливо мейозу, який включає введення суб'єкту, який потребує такої регуляції, ефективної кількості принаймні однієї стероїдної сполуки загальної формули Х за будь-яким з пп. 1-23.
30. Спосіб удосконалення можливості здатності овоцитів розвиватися в ссавця, який включає контакт овоцита, вилученого в ссавця, зі стероїдною сполукою за будь-яким з пп. 1-23.
31. Спосіб одержання стероїдних сполук загальної формули Х за будь-яким з пп. 1-23, де R4 і R4¢ означають незаміщений або заміщений, лінійний або розгалужений (С1-С4)алкіл, який включає
(а) виходячи з (20S)-20-метилпрегна-8,14-дієн-3![]() ,21-діолу,
,21-діолу,
(б) заміщення шляхом нуклеофільної атаки за С21,
(в) заміщення нуклеофільної групи при С21 ціанідом з утворенням нового вуглець-вуглецевого зв'язку при С21,
(г) відновлення одержаного нітрилу з утворенням альдегіду,
(д) відновне амінування нітрилу з утворенням різних амінів.
32. Спосіб одержання стероїдних сполук загальної формули Х за будь-яким з пп. 1-23, де R4 і R4¢ означають незаміщений або заміщений, лінійний або розгалужений (С1-С4)алкіл, який включає
(а) виходячи з (20S)-20-гідроксиметилпрегна-4-ен-3-ону,
(б) введення шляхом алкілування двох алкільних груп у положення 4,
(в) відновлення кетогрупи в гідроксигрупу,
(г) введення подвійного зв'язку ![]() 7 шляхом бромування/дегідробромування,
7 шляхом бромування/дегідробромування,
(д) ізомеризація дієну ![]() 5,7 у дієн
5,7 у дієн ![]() 8,14 нагріванням у присутності кислоти,
8,14 нагріванням у присутності кислоти,
(е) окислення 17-гідроксигрупи в альдегідну групу і
(ж) відновне амінування альдегідної групи.
33. Проміжні сполуки при одержанні стероїдних сполук за будь-яким з пп. 1-23, а саме:
(20S)-4,4-диметил-20-гідроксиметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол і
-ол і
(20S)-4,4-диметил-5![]() -прегна-8,14-дієн-3
-прегна-8,14-дієн-3![]() -ол-20-карбальдегід.
-ол-20-карбальдегід.
Текст
1. Стероїдна сполука, яка має загальну форА означає простий зв’язок або незаміщену або мулу Х: заміщену метиленову або етиленову групу. 2. Стероїдна сполука за п. 1, де подвійні зв’язки R20 фрагмента ХА спряжені. A 3. Стероїдна сполука за п. 1, де фрагмент ХА має R23' N одну з загальних формул: R23 C9 C14 C8 C3 C5 R3 C9 C15 C5 C7 C6 C 8 C14 C9 C15 C7 C5 C6 R4 ХА1 R4' або C6 C 8 C14 C15 C7 XA2 . 4. Стероїдна сполука за п. 1, де C R3 означає СНОН або СН-О-С(О)-R3 , R3 означає складноефірний радикал монокарбонової кислоти, дикарбонової кислоти або неорганічної кислоти і/або R3 означає (СН2)n-COOH, де n дорівнює 1, 2, 3, 4, 5 або 6, або фторметил. 5. Стероїдна сполука за п. 1, де R3 означає ацетил, пропіоніл, півалоїл, бутаноїл, бензоїл, нікотиніл, ізонікотиніл, гемісукциноїл і геміглутароїл. 6. Стероїдна сполука за п. 1, де R4 і R4 незалежно означають водень або (С1-С4)алкіл, заміщений галогеном, гідрокси, алкілокси або арилокси. 7. Стероїдна сполука за п. 1, де R20 означає водень або метил. 8. Стероїдна сполука за п. 1, де R23 і R23' разом з азотом аміногрупи утворюють азотовмісне гетероциклічне кільце, що являє собою піперидин-1-іл, морфолін-4-іл, піперазин-1-іл, піролідин-1-іл, пірол-1-іл, індол-1-іл, піразол-1-іл, імідазол-1-іл, тіазолідин-1-іл і оксазолідин-3-іл або їх заміщені похідні. 9. Стероїдна сполука за п. 8, де гетероциклічне кільце заміщене алкілом, алкенілом, алкінілом, циклоалкілом, циклоалкенілом, алкілциклоалкілом, арилом, алкіларилом, гідрокси, алкокси, алкілциклоалкілокси, алкілоксициклоалкілом, алкіларилокси, алкілоксіарилом, галогеном або ацилом. 10. Стероїдна сполука за п. 1, де А означає етиленову групу. 11. Стероїдна сполука за п. 1, де фрагмент ХА має загальну формулу: 3 X , де у фрагменті ХА: C9 C14 C8 C5 C15 C7 C6 XA подвійний зв’язок присутній у 8 і/або 14 позиції; C3R3 означає а) C=O, б) CH-OR3', де R3' вибирають із групи, яка включає водень, незаміщений або заміщений, лінійний або розгалужений (С1-С10)алкіл або C(O)-R3'', приєднаний до частини СН-О через С(О)-групу, де R3'' вибирають із групи, яка включає i) заміщений або незаміщений, лінійний або розгалужений (C1C10)алкіл, ii) заміщений або незаміщений, лінійний або розгалужений (C1C10)фторалкіл, iii) незаміщений або заміщений (C6-C10)арил, iv) незаміщений або заміщений (C5C10)гетероарил, v) незаміщений або заміщений, лінійний або розгалужений (C1-C10)алкілокси, або vi) незаміщений або заміщений, лінійний або розгалужений (C1-C10)алкіламіно, в) CH-SO2-R3'' або C=NOR3'', де R3'' має значення, зазначені вище, або г) CH-O-R3''', де R3''' означає незаміщений або заміщений, лінійний або розгалужений (С2С10)алкілен і утворює з С3 атомом стероїдного скелета та атомом О циклічний простий ефір, д) циклічну кільцеву структуру з С3 атомом, де R3 означає незаміщений або заміщений, лінійний або розгалужений (С2-С10)алкілен, або е) CH-Hal, де Hal означає F, Cl, Br або I, та R4, R4' і R20 вибирають незалежно з групи, яка включає водень і незаміщений або заміщений, лінійний або розгалужений (С1-С4)алкіл, R23 і R23 утворюють разом C9 C6 C 8 C14 C15 C7 . 12. Стероїдна сполука за п. 1, де C3R3 означає СНОН або СН-О-С(О)-R3 . 13. Стероїдна сполука за п. 1, де R3 означає складноефірний радикал монокарбонової кислоти, дикарбонової кислоти або неорганічної кислоти. 14. Стероїдна сполука за п. 1, де R3 означає (СН2)n-COOH, де n дорівнює 1, 2, 3, 4, 5 або 6. 15. Стероїдна сполука за п. 1, де R3 означає фторметил. 5 75130 6 4 4 (20S)-20-[(піперидин-1-іл)етил]-4,4-диметил-5 16. Стероїдна сполука за п. 1, де R і R незалежно означають водень або метил. прегна-8,14-дієн-3 -ол. 17. Стероїдна сполука за п. 1, де R4 і R4 незалеж24. Фармацевтична композиція, яка містить прино означають (С1-С4)алкіл, заміщений галогеном, наймні одну стероїдну сполуку загальної формули гідрокси, алкілокси або арилокси. Х за будь-яким з пп. 1-23 і принаймні один фарма20 18. Стероїдна сполука за п. 1, де R означає воцевтично прийнятний наповнювач. день. 25. Фармацевтична композиція за п. 24, де стерої19. Стероїдна сполука за п. 1, де R23 і R23' разом з дна сполука загальної формули Х міститься в азотом аміногрупи утворюють азотовмісне гетероефективній кількості. циклічне кільце, що являє собою піперидин-1-іл, 26. Застосування стероїдної сполуки загальної морфолін-4-іл, піперазин-1-іл, піролідин-1-іл, піриформули Х за будь-яким з пп. 1-23 для одержання дин-1-іл, хінолін-1-іл, ізохінолін-1-іл, піридазин-1фармацевтичної композиції, яка є корисною при іл, піримідин-1-іл, піразин-1-іл, пірол-1-іл, індол-1регуляції відтворення, особливо мейозу. іл, хіноксалін-1-іл, піразол-1-іл, імідазол-1-іл, тіа27. Застосування стероїдної сполуки загальної зол-1-іл або оксазол-3-іл або їх заміщені похідні. формули Х за п. 26 для використання non-in-vivo. 23 23' 20. Стероїдна сполука за п. 1, де R і R разом з 28. Застосування стероїдної сполуки загальної азотом аміногрупи утворюють азотовмісне гетероформули Х за будь-яким з пп. 1-23 для одержання циклічне кільце, що являє собою піперидин-1-іл, контрацептиву або профертильного препарату. морфолін-4-іл, піперазин-1-іл або піролідин-1-іл. 29. Спосіб регуляції відтворення, особливо мейо21. Стероїдна сполука за п. 19, де кільце заміщене зу, який включає введення суб'єкту, який потребує алкілом, алкенілом, алкінілом, циклоалкілом, циктакої регуляції, ефективної кількості принаймні лоалкенілом, алкілциклоалкілом, арилом, алкілаоднієї стероїдної сполуки загальної формули Х за рилом, гідрокси, алкокси, алкілциклоалкілокси, будь-яким з пп. 1-23. алкілоксициклоалкілом, алкіларилокси, алкілоксіа30. Спосіб удосконалення можливості здатності рилом, галогеном або ацилом. овоцитів розвиватися в ссавця, який включає кон22. Стероїдна сполука за п. 1, де А означає метитакт овоцита, вилученого в ссавця, зі стероїдною лен. сполукою за будь-яким з пп. 1-23. 23. Стероїдна сполука за п. 1, яку вибирають з 31. Спосіб одержання стероїдних сполук загальної групи, яка включає: формули Х за будь-яким з пп. 1-23, де R4 і R4 (20S)-20-[(3,3-диметилпіперидин-1-іл)метил]-4,4означають незаміщений або заміщений, лінійний диметил-5 -прегна-8,14-дієн-3 -ол, або розгалужений (С1-С4)алкіл, який включає (20S)-20-[(піперидин-1-іл)метил]-4,4-диметил-5 (а) виходячи з (20S)-20-метилпрегна-8,14-дієн3 ,21-діолу, прегна-8,14-дієн-3 -ол, (б) заміщення шляхом нуклеофільної атаки за С21, (20S)-20-[(4,4-диметилпіперидин-1-іл)метил]-4,4(в) заміщення нуклеофільної групи при С21 ціанідиметил-5 -прегна-8,14-дієн-3 -ол, дом з утворенням нового вуглець-вуглецевого (20S)-20-[(4-метилпіперазин-1-іл)метил]-4,4зв'язку при С21, диметил-5 -прегна-8,14-дієн-3 -ол, (г) відновлення одержаного нітрилу з утворенням (20S)-20-[(4-фенілпіперазин-1-іл)метил]-4,4альдегіду, диметил-5 -прегна-8,14-дієн-3 -ол, (д) відновне амінування нітрилу з утворенням різ(20S)-20-[(морфолін-4-іл)метил]-4,4-диметил-5 них амінів. прегна-8,14-дієн-3 -ол, 32. Спосіб одержання стероїдних сполук загальної формули Х за будь-яким з пп. 1-23, де R4 і R4 (20S)-20-[(4-(піримідин-2-іл)піперазин-1-іл)метил]означають незаміщений або заміщений, лінійний 4,4-диметил-5 -прегна-8,14-дієн-3 -ол, або розгалужений (С1-С4)алкіл, який включає (20S)-20-[(піролідин-1-іл)метил]-4,4-диметил-5 (а) виходячи з (20S)-20-гідроксиметилпрегна-4-енпрегна-8,14-дієн-3 -ол, 3-ону, гемісукцинат (20S)-20-[(3,3-диметилпіперидин-1(б) введення шляхом алкілування двох алкільних іл)метил]-4,4-диметил-5 -прегна-8,14-дієн-3 груп у положення 4, олу, (в) відновлення кетогрупи в гідроксигрупу, (20S)-20-[(4-(піридин-2-іл)піперазин-1-іл)етил]-4,4(г) введення подвійного зв'язку 7 шляхом бромудиметил-5 -прегна-8,14-дієн-3 -ол, вання/дегідробромування, 5,7 8,14 (д) ізомеризація дієну у дієн нагріван(20S)-20-[(4-фенілпіперазин-1-іл)етил]-4,4ням у присутності кислоти, диметил-5 -прегна-8,14-дієн-3 -ол, (е) окислення 17-гідроксигрупи в альдегідну групу і (20S)-20-[(4-метилпіперазин-1-іл)етил]-4,4(ж) відновне амінування альдегідної групи. диметил-5 -прегна-8,14-дієн-3 -ол, 33. Проміжні сполуки при одержанні стероїдних (20S)-20-[(морфолін-4-іл)етил]-4,4-диметил-5 сполук за будь-яким з пп. 1-23, а саме: прегна-8,14-дієн-3 -ол, (20S)-4,4-диметил-20-гідроксиметил-5 -прегна(20S)-20-[(піролідин-1-іл)етил]-4,4-диметил-5 8,14-дієн-3 -ол і прегна-8,14-дієн-3 -ол, (20S)-4,4-диметил-5 -прегна-8,14-дієн-3 -ол-20карбальдегід. 7 Винахід стосується фармацевтично активних стероїдних сполук, фармацевтичних композицій, які включають ці сполуки, застосування цих сполук для одержання фармацевтичної композиції, придатної для регуляції репродукції, особливо мейозу, застосування для одержання контрацептиву або як профертильного препарату, способу регуляції репродукції, наприклад мейозу, способу удосконалення можливості притаманної овоцитам здатності розвиватися в ссавці, а також способів одержання нових стероїдних сполук. Мейоз є унікальною і завершальною подією ембріональних клітин, на якому засноване статеве відтворення. Мейоз включає два мейотичних поділи. При першому поділі відбувається обмін між материнськими і батьківськими генами до розділення пар хромосом у дочірніх клітинах. Вони містять лише половину числа (1n) хромосом і подвоєну ДНК 2с. Другий мейотичний поділ проходить без синтезу ДНК. Тому цей поділ приводить до утворення гаплоїдних зародкових клітин тільки з ДНК 1с. Мейотичні події подібні в чоловічий і жіночий зародкових клітинах, але до жіночих ембріональних клітин і сперматозоїдів, відрізняються часовий режим і процеси диференціювання, які приводять ґрунтовно. Усі жіночі зародкові клітини входять у профазу першого мейотичного поділу в ранній період життя, часто до народження, але усі вони пізніше зупиняються у вигляді овоцитів у профазі (діктіатний стан) доти, поки після періоду статевої зрілості не відбудеться овуляція. Таким чином, починаючи з раннього періоду життя, жінка має запас овоцитів, які витрачаються поки запас не вичерпаний. Мейоз у жінок не завершується доти, поки не відбудеться запліднення, і приводить тільки до однієї зародкової клітини і двох абортивних полоцитів на зародкову клітину. На відміну від цього, лише деякі чоловічі зародкові клітини входять у мейоз після настання статевого дозрівання і залишають популяцію зародкових клітин протягом усього життя. Один раз ініційований, мейоз у чоловічій клітині проходить без значної затримки і дає чотири сперматозоїди. Зовсім мало відомо про механізми, які контролюють ініціацію мейозу в чоловіка й у жінки. Нові дослідження вказують на те, що пурини, які знаходяться у фолікулі, гіпоксантин і аденозин можуть відповідати за зупинку мейозу в овоциті [S.M. Downs і ін., Dev. Biol., 82, 454-458 (1985); J.J. Epplg. і ін., Dev. Biol., 119, 313-321 (1986); S.M. Downs, Mol. Reprod. Dev., 35, 82-94 (1993)]. Присутність здатної дифундувати речовини, яка регулює мейоз, вперше описана Byskov і ін. на культурі ембріональних мишиних гонад [A.G. Byskov і ін., Dev. Biol., 52, 193-200 (1976)]. Речовина (MAS), яка активує мейоз, секретується ембріональним мишиним яєчником, у якому відбувається мейоз, а речовина (MPS), яка запобігає мейозу, виділяється з морфологічно диференційованого яєчка із спочиваючими клітинами, які не входять у мейоз. Було висловлене припущення про те, що відносні 75130 8 концентрації MAS і MPS регулюють початок, зупинку і відновлення мейозу в чоловічій і жіночій зародкових клітинах [A.G. Byskov і ін. у: Thе Physiology of Reproduction (ред. Ε. Knobil і J.D. Neill), Raven Press, New York (1994)]. Зрозуміло, що якщо мейоз може бути регульованим, то відтворення може бути контрольованим. У недавній статті [A.G. Byskov et al., Nature, 374, 559-562 (1995)] описане виділення деяких стеринів, які активують мейоз овоцитів з бичачих яєчок і з людської фолікулярної рідини [T-MAS (стерин, який активує мейоз у яєчках) і FF-MAS (стерин, що активує мейоз у фолікулярній рідині): 4,4-диметил5 -холеста-8,144,24-триен-3 -ол]. Було також продемонстровано, що мікромолярні концентрації синтетичного FF-MAS здатні індукувати відновлення мейозу дозозалежним способом в овоцитах щура, який зупинений інгібітором фосфодіестерази ІВМХ (3-ізобутил-1метилксантином) [С. Hegele-Hartung і ін., Biol., Reprod., 64, 418-424 (2001)]. Було показано, що даний ефект може спостерігатися, коли множинні екрановані овоцити (СЕО) і оголені овоцити (DO) культивують in vitro у присутності FF-MAS. Додаткові речовини, які регулюють мейоз, описані в WO 96/00235 A1, WO 96/27658 A1, WO 97/00884 A1, WO 98/28323 A1, WO 98/52965 A1, WO 99/58549 A1 і WO 00/68245 A1. У заявці WO 98/52965 A1 описані похідні 20аралкіл-5 -прегнану, які активують мейоз. У заявці WO 00/68245 A1 розкриті стероїдні похідні, які здатні пригнічувати мейоз, так що ці сполуки застосовні як контрацептиви у жінок і чоловіків. Ці сполуки є насамперед ненасиченими похідними холестану, які відрізняються тим, що 3 aтом водню зв'язаний із С14-атомом вуглецю холестанового скелета. У заявці WO 96/00235 A1 описані стерини, які індукують мейоз, відомі як проміжні речовини в біосинтезі холестерину, а також деякі структурно споріднені синтетичні стерини. Було знайдено, що ці речовини регулюють мейоз. Подібно до холестерину, дані стерини містять боковий ланцюжок при С17 скелета стерину і додатково до цього, принаймні, один подвійний зв'язок 7, 8 або 8(14). У заявці WO 96/27658 A1 розкритий спосіб стимуляції мейозу зародкової клітини, який включає введення в клітину in vivo, eх vivo або in vitro ефективної кількості сполуки, яка викликає нагромадження ендогенної речовини, яка активує мейоз, до рівня, при якому індукується мейоз. Розкривається, що такими сполуками, які викликають нагромадження речовини, яка активує мейоз, є амфотерицин В, аміногуанідин, 3р,5 ,6 тригідроксихолестан, мелатонін, 6-хлормелатонін і 5-метокситриптамін, а також інші похідні і їх агоністи. Повідомляється також, що серед інших речовинами, які активують мейоз, є 5 -холестан-3 -ол, D-гомохолеста-8,14-дієн-3 -ол і 22,25діазахолестерин, 25-аза-24,25-дигідроланостерин, 24,25-іміноланостерин, 23- і 24-азахолестерин, а 9 75130 10 також похідні 25-азахолестанолу. конкретно, у людини. У заявках WO 97/00884 A1 і WO 98/28323 A1 Інша мета за даним винаходом полягає в заописані речовини, які можуть бути використані для безпеченні фармацевтичної композиції, яка вклюстимуляції мейозу in vitro, in vivo або ex vivo. Отже, чає нові речовини. розкриті сполуки є агоністами існуючих у природі Інша переважна мета за даним винаходом поактиваторів мейозу і тому можуть застосовуватися лягає в забезпеченні застосування нових речовин для лікування безплідності, яка зумовлена недопри одержанні фармацевтичної композиції, придастатньою стимуляцією мейозу в чоловіків і жінок. У тної для регуляції відтворення, особливо мейозу. цьому документі розкриті також деякі сполуки, які Інша переважна мета за даним винаходом поможуть бути антагоністами існуючих у природі аклягає в забезпеченні нового способу регуляції відтиваторів мейозу, так що ці сполуки можуть бути творення, наприклад, мейозу. придатні для застосування як контрацептиви. РозДодаткова мета за даним винаходом полягає в забезпеченні способу лікування людської безкриті серед інші сполуки включають 5 -холест-8плідності. ен-3 -оли і 5 -холест-8,14-дієн-3 -оли, які, зокреДодаткова мета за даним винаходом полягає ма, можуть містити аміногрупу в боковому ланцюв удосконаленні дозрівання людських овоцитів. зі, зв'язаної з С17 холестеринового скелета, приЩе одна мета за даним винаходом полягає в чому аміногрупа приєднана до стеринового поліпшенні синхронності дозрівання ядерних, цискелета через С4-спейсер. З аміногрупою зв'язані топлазматичних і/або мембранних овоцитів. (С1-С4)алкіл або (С3-С6)циклоалкіл. Ще одна мета за даним винаходом полягає в Додатково в заявці WO 99/58549 A1 розкриті удосконаленні швидкості імплантації овоцитів при похідні стерину, які ефективні для регуляції мейодозріванні в людини і заплідненні in vitro. зу. Описується, що дані сполуки мають властиЩе одна додаткова мета за даним винаходом вість ослабляти безплідність особин чоловічої і полягає в зменшенні випадків появи людських пежіночої статі, особливо людини. Похідними стериредембріонів із хромосомними аномаліями (анеуну, ефективними як регулюючі речовини, серед плодія). інших є (20R)-20-метил-23-диметиламіно-5 Ще одна додаткова мета за даним винаходом прегна-8,14-дієн-3 -ол, (20R)-20-метил-23полягає в підвищенні швидкості розщеплення диметиламіно-5 -прегна-5,7-дієн-3 -ол, 4,4людських передембріонів. диметил-24-феніл-аміно-5 -хола-8,14-дієн-3 -ол, Ще одна додаткова мета за даним винаходом 4,4-диметил-24-(N,N-диметиламіно)-24-ціано-5 полягає в поліпшенні якості людських передембріхолеста-8,14-дієн-3 -ол і, крім того, багато похідонів. них стеринів з амідами кислот у положенні 24, які Інша мета за даним винаходом полягає в замають один подвійний зв'язок або декілька подвійбезпеченні способу одержання нових речовин. них зв'язків у стериновому скелеті. Відповідно до даного винаходу стероїдні споНенасичені похідні стерину, які мають аміноглуки загальної формули X можуть бути з користю 17 рупу в боковому ланцюзі при С , описані також застосовані в регуляції відтворення, наприклад, [J.J. Sheets і L.E. Vickery, "Active Site-directed мейозу в ссавців, наприклад у чоловічих і жіночих Inhibitors of Cytochrome P-450scc", J. Biol. Chem., особин, і, зокрема, у людини: том 258 (19), 1983, стор.11446-11452], у відношенні впливу цих стеринів на цитохром Р-450 (P450scc), який розщеплює боковий ланцюг бичачого аденокортикального холестерину. У даному документі серед інших сполук розкриті 22-аміно23,24-біснорхол-5-ен-3 -ол і 23-аміно-24-норхол-5ен-3 -ол. Додаткові ненасичені похідні, які мають аміногрупу в боковому ланцюзі при С17, описані [А.Т. Mangla і W.D. Nes: „Sterol C-methyl Transferase from Рrоtоtheca wickerhamii, Mechanism, Sterol SpeciHcity and Inhibition", Bioorg. and Med. Chem. (2000), 8 (5), 925-936]. У даному документі розкритий, зокрема, 32-азазимостерин. При використанні описаних раніше компонентів, які регулюють мейоз, було виявлено, що відновлення мейозу відбувається в оголених овоциде у фрагменті тах in vitro. Однак ці сполуки мали тільки пограничну ефективність при стимуляції мейозу в овоцитах, оточених зернистими клітинами яєчника (СЕО - множинними екранованими овоцитами). Розкриття наведених вище документів включено шляхом цитування. Одна мета за даним винаходом полягає у виявленні речовин, які застосовні для регуляції відтворення, особливо мейозу, в особин жіночої і чоловічої статі, головним чином, у ссавців і, більш кожен зв'язок між С5 і С6, між С6 і C7, між С7 і 11 75130 12 С8, між С8 і С9, між С8 і С14 і між С14 і С15 означає А означає метиленову або етиленову групу, незалежно одинарний зв'язок або подвійний зв'япричому група є незаміщеним або заміщеним мезок, причому, принаймні, один з цих зв'язків є потиленом або етиленом; у переважному варіанті двійним зв'язком, і втілення винаходу А означає метилен або етилен, де кожен атом вуглецю С5, С6, С7, С8, С9, С14 і за умови відмови від прав на наступні сполуки: 15 С зв'язаний із сусіднім атомом вуглецю одинар(20R)-20-метил-23-диметиламіно-5 -прегна-8,14ним зв'язком або, якнайбільше, одним подвійним дієн-3 -ол і (20R)-20-метил-23-диметиламіно-5 зв'язком і де між всіма іншими атомами вуглецю прегна-5,7-дієн-3 -ол, 23-азазимостерин, 22-аміностероїдного скелета є одинарні зв'язки, і 23,24-біснорхол-5-ен-3 -ол, 23-аміно-24-норхол-5С3R3 означає ен-3 -ол. 3 а) С =О або Переважно винахід стосується стероїдних 3 3' 3' б) C H-OR , де R вибирають із групи, яка сполук, у яких, принаймні, один подвійний зв'язок включає водень, незаміщений або заміщений, ліприсутній в стероїдному скелеті між атомами вугнійний або розгалужений (С1-С10)алкіл і C3(O)-R3", лецю С6, С7, С8, С9, С14 і С15, відповідно. В одному приєднаний до частини СН-O через С(О)-групу, де додатковому варіанті втілення за даним винахоR3" вибирають із групи, яка включає дом подвійний зв'язок може знаходитися між С5 і і) заміщений або незаміщений, лінійний або С6 додатково, принаймні, до одного подвійного розгалужений (С1-С10)алкіл, зв'язку між С6, С7, С8, С9, С14 і С15, відповідно. іі) заміщений або незаміщений, лінійний або Особливо переважно, коли в стероїді подвійні розгалужений (С1-С10)фторалкіл, зв'язки спряжені один з одним, якщо стероїдний ііі) незаміщений або заміщений (С6-С10)арил, скелет містить більше одного подвійного зв'язку. iv) незаміщений або заміщений (C5Усі вказівки на Сn-алкіл, Cn-фторалкіл, СnС10)гетероарил, алкілокси, Сn-алкіламіно, Сn-циклоалкіл, Сnν) незаміщений або заміщений, лінійний або алкілен, Сn-алкеніл, Сn-арил, Сn-гетероарил тощо розгалужений (С1-С10)алкілокси і стосуються радикалів з n атомами вуглецю в заvi) незаміщений або заміщений, лінійний або лишку, причому число n атомів вуглецю включає розгалужений (С1-С10)алкіламіно або усі вуглецеві атоми в бокових ланцюгах, напри3 3" 3 3" 3" в) C H-SO2-R або C =NOR , де R має такі ж клад, розгалужених радикалів. Якщо в контексті не значення, як вище, або описано інакше, алкільна, алкокси, алкіленова або 3 3''' 3''' г) С Н-O-R , де R означає незаміщений або ацильна групи містять 1-10 атомів вуглецю, вклюзаміщений, лінійний або розгалужений (С2чаючи вуглецеві атоми бокового ланцюга, якщо ці С10)алкілен і утворює циклічний простий ефір як з групи є розгалуженими; алкенільна або алкінільна атомом вуглецю стероїдного скелета, так і атомом група містить 2-10 вуглецевих атомів, включаючи кисню, або вуглецеві атоми бокового ланцюга, якщо ці групи є 3 3' д) циклічну структуру з атомом С , у якій R розгалуженими; крім того, циклоалкіл містить 4-7 означає незаміщений або заміщений, лінійний або вуглецевих атомів; арил містить 6-10 вуглецевих розгалужений (С2-С10)алкілен, або атомів; і гетероциклічне кільце або гетероарил 3 e) С Н-Hal, де Hal означає F, СІ, Вr або І, і містить 6-10 кільцевих атомів. Крім того, арил R4, R4' і R20 вибирають незалежно з групи, яка означає також алкіларил; гетероарил означає тавключає водень і незаміщений або заміщений, кож алкілгетероарил; і циклоалкіл означає також лінійний або розгалужений (С1-С4)алкіл, і алкілциклоалкіл. 23 23' R і R вибирають незалежно з групи, яка Нові стероїдні сполуки мають декілька хіральвключає: них центрів, так що ці сполуки існують у декількох а) водень, ізомерних формах. Усі ці ізомерні форми охоплюб) незаміщений або заміщений, лінійний або ються обсягом за даним винаходом, якщо в конрозгалужений (С1-С8)алкіл, тексті не описано інакше. в) незаміщений або заміщений, лінійний або Стероїдна сполука з наступною загальною розгалужений (С2-С8)алкеніл, формулою є переважною: г) незаміщений або заміщений, лінійний або розгалужений (С1-С8)алкіл, причому, принаймні, один з вуглецевих атомів алкілу заміщений будьяким з атомів кисню, азоту і сірки, д) незаміщений або заміщений, лінійний або розгалужений (С2-С8)алкеніл, причому, принаймні, один з вуглецевих атомів алкенілу заміщений будь-яким з атомів кисню, азоту і сірки, і e) незаміщений або заміщений, лінійний або розгалужений (С6-С10)арил, або R23 i R23' утворюють разом а) незаміщений або заміщений, лінійний або розгалужений (С2-С7)алкілен, особливо (С5Особливо переважні похідні 5-прегнену, похіС7)групу або дні 8,14-прегнадієну, похідні 8-прегнену і похідні 5,7 б) незаміщений або заміщений, лінійний або -прегнадієну застосовні як фармацевтично акрозгалужений (С2-С7)алкілен, особливо (С5тивні стероїдні сполуки для регуляції відтворення, С7)групу, де, принаймні, один з алкіленових атомів наприклад, мейозу, тобто сполуки, які мають такі вуглецю замінений киснем, азотом або сіркою, і загальні формули: 13 75130 14 фосфорна кислота, сірчана кислота і сульфамінова кислота, крім того, з монокарбонової кислоти, такої, як оцтова кислота, пропіонова кислота, нбутанова кислота, триметилоцтова кислота, бензойна кислота, нікотинова кислота і ізонікотинова кислота. Зокрема, ефірний радикал може бути утворений з дикарбонової кислоти, такої, як янтарна кислота і глутарова кислота. Додаткові стероїдні сполуки за даним винаходом можуть також включати похідні, у яких С-O-R3 означає циклічний ефір, який включає атом С3 стероїдного скелета. Замісник R3 може також утворювати циклічну кільцеву структуру разом з атомом С3, причому R3 означає незаміщений або заміщений, лінійний або розгалужений (С2-С10)алкілен. Наприклад, група C3R3 може означати циклопропіленовий, циклобутиленовий, циклопентиленовий або циклогексиленовий радикал. Вона може також означати ненасичену циклічну кільцеву структуру, таку, як циклопропенілен, циклобутенілен, циклопентеніНесподівано було знайдено, що сполуки за лен і циклогексенілен. Кільцева структура може даним винаходом мають сильний стимулювальний бути також заміщена будь-яким галоїдом, гідроксимейоз ефект в овоцитах, особливо в СЕО, хоча ці групою, алкоксигрупою, арилоксигрупою і тому сполуки структурно сильно відрізняються від степодібним. рину FF-MAS. У цьому відношенні сполуки за даРечовини за даним винаходом з користю моним винаходом перевершують цю раніше описану жуть бути також сполуками, у яких R3" вибирають речовину, яка регулює мейоз [наприклад: A.G. із групи, яка включає фторметил, арил, гетероарил Byskov і ін., Nature, 374, 559-562 (1995)]. Переважі (СН2)nСООН, де n означає 1, 2, 3, 4, 5 або 6, осоними сполуками загальної формули X є такі сполубливо сполуками, у яких R3' (=C(O)-R3") означає ки, які викликають руйнування ембріональних веацетил, пропіоніл, півалоїл, бутаноїл, бензоїл, нізикул, принаймні, на 40%, переважно, принаймні, котиніл, ізонікотиніл, геміглутароїл, бутилкарбамона 60 і особливо, принаймні, на 80% при досліїл, фенілкарбамоїл, етоксикарбоніл і трет.дженні в пробі з овоцитами, як описано в прикладі бутоксикарбоніл. В особливо переважній стероїд23. ній сполуці R3' може бути гемісукциноїлом. Сполуки за даним винаходом перевершують Крім того, у нових стероїдних сполуках R4 і R4' раніше описані сполуки і за іншим аспектом: у той означають незалежно переважно водень або лічас як FF-MAS не здатний викликати дозрівання в нійну або розгалужену (С1-С4)алкільну групу, тобто культуральній системі фолікул, сполуки за даним метил, етил, пропіл, бутил і особливо метил. винаходом мають здатність активувати мейоз у Крім того, R4 і R4' незалежно можуть бути таданих умовах. кож (С1-С4)алкілом, заміщеним галоїдом, гідрокси, З цієї причини нові стероїдні сполуки можуть алкокси або арилокси. бути використані, наприклад, для застосування in R20 означає переважно водень або лінійний vivo, а також для застосування non in vivo, яке, або розгалужений (С1-С4)алкіл, тобто метил, етил, зокрема, включає застосування in vitro. Стероїдні пропіл і бутил. R20 означає, головним чином, месполуки особливо придатні для запліднення in vitro тил. і in vitro ссавців, особливо людини. R23 i R23' незалежно можуть бути, зокрема, воВиняткові властивості нових сполук можуть днем або (С1-С8)алкільною групою, такою, як мебути приписані аміногрупі в боковому ланцюзі, тил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, зв'язаної з атомом вуглецю С17 у стероїдному скетрет.-бутил, н-пентил, ізопентил, трет.-пентил, леті через (С2-С3)алкіленовий спейсер (включаючи неопентил, крім того, гексил, циклогексил тощо. групу C20-R20). Потім R23 і R23’ незалежно можуть бути також (С2Особливо переважними є сполуки, у яких часС6)алкенільною групою, тобто ненасиченою алкільною групою, наприклад, вінільною, алільною, тина C3R3 означає СН-ОН, зокрема, 3 ізопропенільною і фенільною, потім (С6гідроксирадикал, зв'язаний з атомом С3 стероїдноС10)арильною, такий, як феніл і 1-нафтил, ця груго скелета. Частина може також означати CH-Oпа, включаючи також алкіларил, зв'язується через C(O)-R3" (=CH-O-R3', де R3' означає C(O)-R3"), де арильну частину або через алкільну частину з R3" має наведені вище значення. Зокрема, R3" моатомом азоту, наприклад, бензил і толіл. R23 і R23’ же бути ефірним радикалом монокарбонової кисможуть бути переважно алкілом або алкенілом, які лоти, дикарбонової кислоти або неорганічної кисзаміщаються, принаймні, одним радикалом, виблоти, або якої-небудь іншої кислоти, зв'язаним з раним із групи, яка включає лінійний або розгалуатомом С3 стероїдного скелета. Зокрема, для R3, жений (С1-С4)алкіл і (С1-С4)алкокси. Фенільний і 1який означає ефірний радикал дикарбонової киснафтильний радикал можуть бути також заміщені лоти, R3" може бути (СН2)n-СОООН, де n означає галоїдом, (С1-С4)алкокси, гідрокси або (С11, 2, 3, 4, 5 або 6. Ефірний радикал може бути таС4)алкілом, включаючи похідні фторалкокси і фтокож утворений з неорганічної кислоти, такої, як 15 75130 16 ралкілу. Потім R23 і R23’ незалежно можуть бути яких визначено вище. Крім того, R24 може бути надалі, наприклад, 4-гідроксифенілом, 4гетероциклічною кільцевою структурою, у якій чисметоксифенілом, 2,4,6-триметилфенілом, 2,4ло кільцевих атомів таке, як визначено вище. дихлорфенілом, 4-фторфенілом, 4Атом азоту групи N(R23)(R23’) не зв'язаний безтрифторметилфенілом і 2-пентафторетилфенілом. посередньо з атомом C20, a зв'язаний з ним через 23 23’ Крім того, R і R незалежно можуть також А, який означає незаміщену або заміщену метилеозначати алкіл і алкеніл, причому, принаймні, один нову або етиленову спейсерну групу, таку, як, наз алкільних і алкенільних вуглецевих атомів відпоприклад (незаміщений) метилен і (незаміщений) відно заміщений будь-яким з атомів кисню, азоту і етилен і, крім того, ізопропілен, трет.-бутилен тосірки, наприклад, метоксиметилен, метоксіетилен, що. Переважно А означає метилен і етилен. метоксипропілен, етоксипропілен тощо. Особливо переважними є сполуки, у яких R3 23 23’ R i R разом можуть також утворювати геозначає гідрокси або гемісукцинатну групу, де R4, тероциклічну кільцеву структуру, зв'язану з бокоR4’ і R20 означають кожний метил і де гетероциклівим ланцюгом через атом азоту в боковому ланчна кільцева структура N(R23)(R23’), включаючи цюзі, причому атом азоту зв'язаний з вуглецевим атом азоту аміногрупи, є незаміщеним або заміатомом С20 стероїдного скелета через спейсерну щеним морфолін-4-ілом, піперидин-1-ілом, піперагрупу А. Гетероциклічна кільцева структура, утвозин-1-ілом або піролідин-1-ілом. Група N(R23)(R23’) рена N(R23)(R23’), може бути, зокрема, вибрана з означає, зокрема, 3-гідроксипіперидин-1-іл, 4групи, яка включає піперидин-1-ільну, морфолін-4гідроксипіперидин-1-іл, 3-кетопіперидин-1-іл, 4ільну, піперазин-1-ільну, піролідин-1-ільну, пірол-1кетопіперидин-1 -іл, 4-диметиламінопіперидин-1ільну, індол-1-ільну, піразол-1-ільну, імідазол-1іл, 3,3-диметилпіперидин-1-іл, 4,4ільну, тіазолідин-1-ільну й оксазолідин-3-ільну кідиметилпіперидин-1-іл, 3-карбоксипіперидин-1-іл, льцеві структури і їх похідні. Особливо переваж4-карбоксипіперидин, 4-фенілпіперидин-1-іл, 4ними гетероциклічними кільцевими структурами є бензоїлпіперидин-1-іл, 4-(піперидин-1насичені радикали, а саме піперидин-1-іл, морфоіл)піперидин-1-іл, 4-метилпіперазин-1-іл, 4лін-4-іл, піперазин-1-іл і піролідин-1-іл. Гетероцикацетилпіперазин-1-іл, 4-фенілпіперазин-1-іл, 4лічні кільцеві структури можуть бути заміщені гідбензилпіперазин-1-іл, 4-бензоїлпіперазин-1-іл, 4рокси, карбокси, аміно, алкіламіно, діалкіламіно, (піридин-2-іл)піперазин-1-іл, 4-(піридин-4алкілом, алкенілом, алкінілом, циклоалкілом, цикіл)піперазин-1-іл, 4-(піримідин-2-іл)піперазин-1-іл. лоалкенілом, алкілциклоалкілом, арилом, алкілаАтоми водню можуть бути з'єднані з всіма інрилом, алкокси, алкілциклоалкілокси, алкілоксицишими вуглецевими атомами стероїдної сполуки, клоалкілом, алкіларилокси, алкілоксіарилом, тобто з С1, С2, С6, С7, С8, С9, С11, С12, С14, С15 і С16. галоїдом і ацилом, де алкіл, алкеніл, алкініл, цикПереважно фармацевтично прийнятними сполоалкіл, арил, алкокси й ацил містять таку кільлуками за даним винаходом є солі стероїдних кість атомів вуглецю, як вказано вище. Гетероциксполук загальної формули X. Приклади даних солічна кільцева структура може бути також лей наведені в [Journal of Pharmaceutical Science, заміщена гетероциклічними радикалами, такими, 66, 2 і подальш. (1977)], які тим самим включені як гетероциклічні кільцеві структури, з якими вони шляхом цитування. Приклади таких солей вклюможуть бути зв'язані, додатково до них як додатчають солі органічних кислот, таких, як мурашина кові радикали, наприклад, піридиніл, хінолініл, кислота, фумарова кислота, оцтова кислота, проізохінолініл, піридазиніл, піримідиніл, піразиніл, піонова кислота, гліколева кислота, молочна кисхіноксалініл, тіазоліл і оксазоліл, включаючи, крім лота, виноградна кислота, щавлева кислота, янтатого, всі інші ізомери даних радикалів, наприклад, рна кислота, яблучна кислота, винна кислота, піридин-2-іл, піридин-3-іл і піридин-4-іл. Далі, якщо лимонна кислота, бензойна кислота, саліцилова N(R23)(R23’) означає гетероциклічну кільцеву струккислота, метансульфонова кислота тощо. Відповітуру, то ця кільцева структура може також містити дні неорганічні кислоти для утворення фармацевв кільці оксогрупу. тично прийнятних солей включають хлористоводЯкщо N(R23)(R23’) означає піперазин-1-іл, то ця неву кислоту, бромистоводневу кислоту, сірчану частина може бути, зокрема, заміщена піридиномкислоту, фосфорну кислоту тощо. 2-ілом, піридином-3-ілом і піридином-4-ілом, щоб Наступні сполуки за даним винаходом особлипереважно утворити відповідні групи N(R23)(R23’), у во переважні: яких залишок піперазин-1-іла заміщений у паря1) (20S)-20-[(3,3-диметилпіперидин-1положенні, наприклад, 4-(піридин-3-іл)піперазин-1іл)метил]-4,4-диметил-5 -прегна-8,14-дієн-3 -ол іл. 2) (20S)-20-[(піперидин-1-іл)метил]-4,4Група N(R23)(R23’) може бути також будь-якою з диметил-5 -прегна-8,14-дієн-3 -ол частини 3) (20S)-20-[(4,4-диметилпіперидин-1іл)метил]-4,4-диметил-5 -прегна-8,14-дієн-3 -ол 4) (20S)-20-[(4-метилпіперазин-1-іл)метил]-4,4диметил-5 -прегна-8,14-дієн-3 -ол 5) (20S)-20-[(4-фенілпіперазин-1-іл)метил]-4,4диметил-5 -прегна-8,14-дієн-3 -ол 6) (20S)-20-[(морфолін-4-іл)метил]-4,4зв'язаної з С20 у боковому ланцюзі стероїдного диметил-5 -прегна-8,14-дієн-3 -ол скелета через атом азоту даної частини, де Ζ 7) (20S)-20-[(4-(піримідин-2-іл)піперазин-1означає О, S, N-R24, N-C(O)-R24, де R24 означає іл)метил]-4,4-диметил-5 -прегна-8,14-дієн-3 -ол алкіл, алкеніл, алкініл, арил, число атомів вуглецю 8) (20S)-20-[(піролідин-1-іл)метил]-4,4 17 75130 18 диметил-5 -прегна-8,14-дієн-3 -ол іл)метил]-5 -прегна-5а-ен-3 -ол 9) гемісукцинат (20S)-20-[(3,339) (20S)-20-[(4-піперазин-1-іл)метил]-5 диметилпіперидин-1-іл)метил]-4,4-диметил-5 прегна-5-ен-3 -ол прегна-8,14-дієн-3 -олу 40) (20S)-20-[(4-фенілпіперазин-1-іл)метил]10) (20S)-20-[N-(3-метоксипропіл)амінометил]5 -прегна-5-ен-3 -ол 4,4-диметил-5 -прегна-8,14-дієн-3 -ол 41) (20S)-20-[(4-метилпіперазин-1-іл)метил]11) (20S)-20-амінометил-4,4-диметил-5 5 -прегна-5-ен-3 -ол 42) (20S)-20-[(4-бензилпіперазин-1-іл)метил]прегна-8,14-дієн-3 -ол 12) (20S)-20-[N,N-ди-(25 -прегна-5-ен-3 -ол 43) (20S)-20-[(4-ацетилпіперазин-1-іл)метил]метоксіетил)амінометил]-4,4-диметил-5 -прегна5 -прегна-5-ен-3 -ол 8,14-дієн-3 -ол 44) (20S)-20-[(4-бензоїлпіперазин-1-іл)метил]13) (20S)-20-[М-(2,25 -прегна-5-ен-3 -ол диметилетилен)амінометил]-4,4-диметил-5 45) (20S)-20-[{4-(2-піридил)піперазин-1прегна-8,14-дієн-3 -ол іл}метил]-5 -прегна-5-ен-3 -ол 14) (20S)-20-[(піперидин-1-іл)метил]-4,446) (20S)-20-[{4-(3-піридил)тперазин-1диметил-5 -прегна-5,7-дієн-3 -ол іл}метил]-5 -прегна-5-ен-3 -ол 15) (20S)-20-[(4-(піридин-2-іл)піперазин-147) (20S)-20-[{4-(4-піридил)піперазин-1іл)етил]-4,4-диметил-5 -прегна-8,14-дієн-3 -ол іл}метил]-5 -прегна-5-ен-3 -ол 16) (20S)-20-[(4-фенілпіперазин-1-іл)етил]-4,448) (20S)-20-[{4-(2-піримідил)піперазин-1диметил-5 -прегна-8,14-дієн-3 -ол іл}метил]-5 -прегна-5-ен-3 -ол 17) (20S)-20-[(4-метилпіперазин-1-іл)етил]-4,449) (20S)-20-[(піперидин-1-іл)метил]-4,4диметил-5 -прегна-8,14-дієн-3 -ол диметил-5 -прегна- 8(14)-ен-3 -ол 18) (20S)-20-[(N,N-диметиламіно)етил]-4,4Структурні формули даних стероїдних сполук диметил-5 -прегна-8,14-дієн-3 -ол показані на Фіг.1А-1К. 19) (20S)-20-[(морфолін-4-іл)етил]-4,4Додатковою метою за даним винаходом є фадиметил-5 -прегна-8,14-дієн-3 -ол рмацевтичні композиції, які включають, принаймні, 20) (20S)-20-[(піролідин-1-іл)етил]-4,4одну стероїдну сполуку загальної формули X і, диметил-5 -прегна-8,14-дієн-3 -ол принаймні, один фармацевтично прийнятний на21) (20S)-20-[(піперидин-1-іл)етил]-4,4повнювач, добре відомий у даній галузі, напридиметил-5 -прегна-8,14-дієн-3 -ол клад, принаймні, один носій, розріджувач, підси22) (20S)-20-[(4-фенілпіперидин-1-іл)метил]лювач поглинання, консервант, буфер, агент для 5 -прегна-5-ен-3 -ол підтримання осмотичного тиску і реологічних влас23) (20S)-20-[(піперидин-1-іл)метил]-5 -прегнативостей лікарського засобу, якщо це буде рідина, 5-ен-3 -ол поверхнево-активний агент, розчинник, дезінтегра24) (20S)-20-[(морфолін-4-іл)метил]-5 -прегнатор для таблеток, мікрокапсули, заповнювач, ковз5-ен-3 -ол на добавка, барвник, ароматизатор і інші інгредіє25) (20S)-20-[(піролідин-1-іл)метил]-5 -прегнанти. Ці речовини звичайно використовуються в 5-ен-3 -ол даній галузі техніки. Стероїдні сполуки за винахо26) (20S)-20-[(4-карбоксіетилпіперидин-1дом переважно включають у фармацевтичні коміл)метил]-5 -прегна-5-ен-3 -ол позиції в ефективній кількості. 27) (20S)-20-[(3-гідроксипіперидин-1-іл)метил]Прикладами твердих носіїв є карбонат магнію, 5 -прегна-5-ен-3 -ол стеарат магнію, декстрин, лактоза, цукор, тальк, 28) (20S)-20-[(4-бензоїлпіперидин-1-іл)метил]желатин, пектин, крохмаль, силікагель, трагакант, 5 -прегна-5-ен-3 -ол метилцелюлоза, карбоксиметилцелюлоза в натрі29) (20S)-20-[(4-(піперидин-1-іл)піперидин-1євій формі, низькоплавкий віск і олія какао. Рідкі композиції включають стерильні розчини, іл)метил]-5 -прегна-5-ен-3 -ол суспензії й емульсії, які можуть бути введені перо30) (20S)-20-[(4-тіоморфолініл)метил]-5 рально, назальним шляхом або як мазь. Такі рідкі прегна-5-ен-3 -ол композиції можуть бути також застосовні для ін'єк31) (20S)-20-[(4-диметиламінопшеридин-1ції або для використання в зв'язку з застосуванням іл)метил]-5 -прегна-5-ен-3 -ол ex vivo або in vivo. Для перорального введення 32) (20S)-20-[(4-кетопіперидин-1-іл)метил]-5 рідина може містити фармацевтично прийнятне прегна-5-ен-3 -ол масло і/або ліпофільну речовину, поверхнево33) (20S)-20-[(3-кетопіперидин-1-іл)метил]-5 активний агент і/або розчинник, який змішується з прегна-5-ен-3 -ол водою. У цьому зв'язку робиться посилання на 34) (20S)-20-[(4-карбоксилпіперидин-1заявку WO 97/21440 A1, яка тим самим включена іл)метил]-5 -прегна-5-ен-3 -ол шляхом цитування. 35) (20S)-20-[(3-карбоксилпіперидин-1Рідкі композиції можуть також містити й інші ініл)метил]-5 -прегна-5-ен-3 -ол гредієнти, які звичайно використовують у даній 36) (20S)-20-[(4-гідроксипіперидин-1-іл)метил]галузі, деякі з яких згадані в переліку вище. Крім 5 -прегна-5-ен-3 -ол того, композиція для трансдермального введення 37) (20S)-20-[(3,3-диметилпіперидин-1сполуки за даним винаходом може бути передбаіл)метил]-5 -прегна-5-ен-3 -ол чена у формі пластиру. Композиція для назально38) (20S)-20-[(4,4-диметилпіперидин-1го введення може бути передбачена у формі на 19 75130 20 зального розпилювача в рідкій або порошкоподібнових стероїдних сполук загальної формули X для ній формі. одержання контрацептивного або профертильного Для того щоб збільшити біодоступність стеропрепарату. їдних сполук дані сполуки можуть бути також розДаний винахід стосується далі застосування роблені у вигляді циклодекстринових клатратів. З стероїдної сполуки загальної формули X для застосування non-in-vivo. цією метою сполуки змішують з -, -або Даний винахід стосується також способу регуциклодекстрином або його похідними. ляції відтворення, наприклад, мейозу, який вклюКреми, мазі, лосьйони й інші рідини, які ввочає введення суб'єкту, який потребує такої регулядяться зовнішньо, повинні бути в такому стані, ції, ефективної кількості, принаймні, однієї щоб стероїдні сполуки за даним винаходом могли стероїдної сполуки загальної формули X. бути доставлені в достатній кількості пацієнту, Крім того, даний винахід стосується способу який потребує регуляції мейозу. З цією метою ліудосконалення здатності овоцитів розвиватися в карський засіб містить наповнювачі для регуляції ссавці, який включає контакт овоциту, взятого в його реологічних властивостей, поверхневоссавця, зі стероїдною сполукою загальної формуактивні речовини, консерванти, розчинники, розріли X. джувачі, речовини для посилення здатності прониРегуляція відтворення, наприклад, мейозу, викнення через шкіру, крім того, ароматизатори і користовується в контексті, щоб показати, що споречовини, які захищають шкіру, такі, як кондиціолуки за даним винаходом особливо придатні для нери і регулятори вологості. стимуляції відтворення, наприклад, мейозу в ссавЛікарський засіб може також містити додаткові ців, особливо в людини, овоцитів, так що дані споактивні агенти, щоб підсилити або регулювати луки, які є агоністичними аналогами природних ефективність стероїдних сполук або одержати інші активаторів мейозу, можуть застосовуватися при потрібні ефекти лікарського засобу. лікуванні безплідності, яка виникає через недостаДля парентерального введення стероїдні спотню стимуляцію мейозу в жінок і чоловіків. луки можуть бути розчинені або суспендовані у Шляхом введення композицій, які містять спофармацевтично прийнятному розріджувачі. Дуже луку за даним винаходом, може бути будь-який часто використовують олії в комбінації з розчиннишлях, який ефективно транспортує активну стероками, поверхнево-активними агентами, суспензійїдну сполуку до ділянки її дії. ними або емульсійними агентами, наприклад, маТак, коли стероїдні сполуки повинні вводитися слинову олію, олію земляного горіха, рицинову ссавцю, вони звичайно забезпечуються у формі олію тощо. Для одержання ін'єкованого лікарськофармацевтичної композиції, яка включає, принайго засобу може бути використаний будь-який рідмні, одну стероїдну сполуку за даним винаходом в кий носій. Ці рідини часто містять також агенти для сполученні з фармацевтично прийнятним носієм. регуляції їх в'язкості, а також агенти для регуляції Для перорального застосування такі композиції є ізотонічних властивостей рідини. переважними у формі таблеток або капсул. Стероїдна сполука за даним винаходом, крім Даний винахід стосується також способу одетого, може бути введена у вигляді ін'єкованої держання стероїдних сполук загальної формули X, по-форми або у вигляді імплантату, який може, де R4 і R4' означають незаміщений або заміщений, наприклад, бути введений підшкірно, так що стає лінійний або розгалужений (С1-С4)алкіл, а не воможливим уповільнене вивільнення стероїдних день. сполук. З цією метою можуть використовуватися Згадані вище стероїдні сполуки можуть бути різні технічні прийоми, наприклад, введення депосинтезовані аналогічно до одержання відомих форм, які включають мембрану, що містить активсполук. Отже, синтез стероїдних сполук формули ну сполуку, або депо-форми, які повільно розчиX може відбуватися за загальноприйнятими синтеняються. Імплантати можуть містити, наприклад, тичними методиками, описаними у численній літебіологічно деградовані полімери або синтетичні ратурі із стеринів і стероїдів. Наступна література силікони як інертний матеріал. може бути використана як основне джерело для Доза застосовуваної стероїдної сполуки буде синтезу: [L.F. Fieser і М. Fieser: Steroids, Reinhold визначатися лікарем і залежати серед іншого від Publishing Corporation, Ν.Υ., 1959; Rood's Сhemistrу конкретної використовуваної стероїдної сполуки, оf Сarbon Соmpounds (ред. S. Coffrey): Elsevier шляху введення і мети застосування. Звичайно Publishing Company, 1971; і особливо Dictionary of композиції за даним винаходом одержують шляSteroids (ред. R.A. Hill, D.N. Kirk, H.L.J. Makin і G.M. хом введення в тісний контакт активної сполуки з Murphy), Chapman і Hall, тим самим дана літературідиною або допоміжними інгредієнтами і потім, ра включена шляхом цитування. Останнє джерело якщо необхідно, формуванням продукту в необмістить численний перелік посилань на оригінальні хідну композицію. статті, охоплюючи період до 1990 року]. Звичайно не більше ніж 3000 мг, переважно не Зокрема, стероїдні сполуки можуть бути синбільше ніж 350мг і в деяких переважних випадках тезовані, наприклад, відповідно до загального не більше ніж 30мг стероїдної сполуки на добу способу, який включає наступні етапи: вводять ссавцям, наприклад, людині. (а) виходячи з (20S)-20-гідроксиметилпрегнаДаний винахід стосується також застосування 4-ен-3-ону, стероїдних сполук загальної формули X для одер(б) введення двох алкільних груп у положення жання композиції, застосовної для регуляції відт4 алкілуванням, ворення, наприклад, мейозу. Переважно дана (в) відновлення кетогрупи в гідроксигрупу, композиція застосовна як лікарський засіб. Даний винахід стосується далі застосування (г) введення подвійного зв'язку 7 бромуван 21 75130 22 ням/дегідробромуванням, рил 3 відновлюють діізобутилалюмінійгідридом з утворенням альдегіду 4. Альдегід 4 потім взаємо(д) ізомеризація дієну 5,7 у дієн 8,14 нагрівандіє з аміном за реакцією відновного амінування в ням у присутності кислоти, присутності трис(ацетокси)боргідриду натрію. (e) окислення 17-гідроксигрупи в альдегідну Утворений кінцевий продукт 5 може бути очищегрупу і ний стандартною колонковою хроматографією або (ж) відновне амінування альдегідної групи. ВЕРХ. Відповідна схема синтезу цього першого синПриклади наведені для більш докладного опитетичного способу наведена на Фіг.2. Відповідно су даного винаходу. до схеми спочатку гідроксильну групу в боковому Приклад 1: (20S)-20-[(піперидин-1-іл)метил]ланцюзі (20S)-20-гідроксиметилпрегна-4-ен-3-ону 4,4-диметил-5 -прегна-8,14-дієн-3 -ол (сполука 1 захищають у вигляді силілового ефіру, наприклад, у вигляді триізопропілсилілового (TIPS) ефі№2) ру, одержуючи сполуку 2. Для того, щоб одержати (а) (20S)-20сполуку 3, дві метильні групи вводять у положення [((Триізопропілсиліл)окси)метил]прегна-4-ен-3-он 4 стероїдного скелету за допомогою алкілування з До розчину 30г (20S)-20йодистим метилом у присутності такої основи, як [(гідроксиметил)]прегна-4-ен-3-ону і 13,5г імідазолу трет.-бутилат калію. На наступному етапі 3в 300мл дихлорметану при кімнатній температурі кетогрупу відновлюють звичайним відновлювальдодавали по краплях 26мл триізопропілсилілхлоним агентом, таким, як алюмогідрид літію або борриду. Реакційну суміш перемішували протягом 20 гідрид натрію. Утворений спирт 4 потім захищагод при тій же температурі і потім виливали у воду. ють, перетворюючи, наприклад, в ацетат (сполука Водний шар екстрагували етилацетатом. Органічні 5). Згодом вводять другий подвійний зв'язок за шари об'єднували, промивали насиченим сольодопомогою послідовності реакцій бромуваннявим розчином, сушили над сульфатом натрію, фільтрували і концентрували при зниженому тиску, дегідробромування. Утворену 5,7-дієнову систему одержуючи 45,4г неочищеного (20S)-20в сполуці 6 потім ізомеризують у 8,14-дієнову сис[((триізопропілсиліл)окси)метил]прегна-4-ен-3-ону тему за допомогою нагрівання в присутності хлоу вигляді коричневого масла, яке використовували ристоводневої кислоти, щоб одержати сполуку 7. без подальшого очищення. На даному етапі, який каталізується кислотою, МС [хімічна іонізація з утворенням позитивних обидві гідроксильні групи деблокуються, і може іонів (СІ+)]: 487 (М+Н). бути отриманий діол 7. М'яке вибірне окислення (б) (20S)-4,4-диметил-20триацетоксиперйодинаном за Десс-Мартином гід[((триізопропілсиліл)окси)метил]прегна-5-ен-3-он роксильної групи в боковому ланцюзі приводить до Розчин 45,4г неочищеного (20S)-20альдегіду 8, який служить як основна проміжна [((триізопропілсиліл)окси)метил]прегна-4-ен-3-ону сполукадля введення різних амінів у боковий ланв 320мл тетрагідрофурану додавали до розчину цюг за допомогою відновного амінування. З цією 42,3г трет.-бутилату калію в 950мл трет.-бутанолу метою можуть застосовуватися різні відновлювапри температурі 50°С. Суміш перемішували протяльні агенти, як боргідрид натрію або гом 10хв. при тій же температурі. Потім додавали трис(ацетокси)боргідрид натрію. У результаті оде50мл йодистого метилу і продовжували перемішуржують стероїдні сполуки 9 за даним винаходом. вання протягом 1год. Реакційну суміш виливали у За способом одержання стероїдних сполук за воду й екстрагували етилацетатом. Органічні шари даним винаходом одержують нові сполуки, а саме: об'єднували, промивали насиченим сольовим роз(20S)-4,4-диметил-20-гідроксиметил-5 -прегначином, сушили над сульфатом натрію, фільтрува8,14-дієн-3 -ол і (20S)-4,4-диметил-5 -прегна-8,14ли і концентрували при зниженому тиску. Залишок дієн-3 -ол-20-карбальдегід. Отже, даний винахід очищали колонковою хроматографією, одержуючи стосується також і даних проміжних сполук. 27,3г (20S)-4,4-диметил-20Альтернативно стероїдні сполуки можуть бути [((триізопропілсиліл)окси)-метил]прегна-5-ен-3-ону також синтезовані в такий спосіб: у вигляді блідо-жовтої твердої речовини. (а) виходячи з (20S)-20-триметилпрегна-8,14МС(СІ+):515(М+Н). дієн-3 ,21-діолу, зокрема, з (20S)-4,4,20(в) (20S)-4,4-диметил-20триметилпрегна-8,14-дієн-3 ,21-діолу, 21 [((триізопропілсиліл)окси)метил1прегна-5-ен-3 -ол (б) нуклеофільне заміщення при С , переважДо розчину 27,3г (20S)-4,4-диметил-20но з толуолсульфоновою кислотою, [((триізопропілсиліл)окси)метил]прегна-5-ен-3-ону (в) заміщення нуклеофільної групи (тозилату) в 500мл тетрагідрофурану обережно невеликими при С21 ціанідом з утворенням нового вуглецьпорціями додавали 1,24г алюмогідриду літію при вуглецевого зв'язку при С21, кімнатній температурі. Реакційну суміш перемішу(г) відновлення отриманого нітрилу з утворенвали протягом 1год., потім охолоджували до 0°С. ням альдегіду, Додавали послідовно 2,5мл води, 2,5мл 0,1н. роз(д) відновне амінування нітрилу з утворенням чину гідроксиду натрію і 7,5мл води. Суміш фільтрізних амінів. рували через целіт. Фільтрат концентрували при Відповідна схема синтезу цього другого синтезниженому тиску. Залишок очищали колонковою тичного способу наведена на Фіг.3. Тозилують nхроматографією, одержуючи 18,2г (20S)-4,4толуолсульфохлоридом (20S)-4,4,20диметил-20-[((триізопропілтриметилпрегна-8,14-3 р,21-діол 1 по боковому силіл)окси)метил]прегна-5-ен-3 Р-олу у вигляді ланцюзі. Потім тозилат 2 заміщають ціанідом як блідо-жовтої твердої речовини. будівельний блок С1. Після цього утворений нітМС (СІ+): 517 (М+Н). 23 75130 24 (г) Ацетат (20S)-4,4-диметил-20натрію, екстрагували етилацетатом і промивали насиченим сольовим розчином. Органічний шар [((триізопропілсиліл)окси)метил]прегна-5-ен-3 -олу сушили над сульфатом натрію, фільтрували і конДо розчину 18,2г (20S)-4,4-диметил-20центрували при зниженому тиску. Залишок очи[((триізопропілсиліл)окси)метил]-прегна-5-ен-3 щали колонковою хроматографією, одержуючи олу в 175мл піридину додавали 6,24мл оцтового 230мг (20S)-3 -гідрокси-4,4,20-триметилпрегнаангідриду при кімнатній температурі. Реакційну 8,14-дієн-21-алю у вигляді білої твердої речовини. суміш перемішували протягом 20год. і потім вилиMC (ES+): 356 (Μ). вали в суміш лід/хлористоводнева кислота. Отри(з) (20S)-20-[(піперидин-1-іл)метил]-4,4ману суміш екстрагували етилацетатом. Органічні шари об'єднували, промивали насиченим сольодиметил-5 -прегна-8,14-дієн-3 -ол вим розчином, сушили над сульфатом натрію і Додавали 38мг трис(ацетокси)боргідриду наконцентрували при зниженому тиску, одержуючи трію до розчину 42мг (20S)-3 -гідрокси-4,4,2016,2г ацетату (20S)-4,4-диметил-20триметилпрегна-8,14-дієн-21-алю і 10мкл піпери[((триізопропілсиліл)окси)-метил]прегна-5-ен-3 дину в 3мл тетрагідрофурану при кімнатній темпеолу у вигляді білої твердої речовини, яку викорисратурі. Суміш перемішували протягом 2год., вилитовували без подальшого очищення. вали в насичений розчин бікарбонату натрію, MC (CI+): 559 (М+Н). екстрагували етилацетатом і промивали насиче(д) Ацетат (20S)-4,4-диметил-20ним сольовим розчином. Органічний шар сушили над сульфатом натрію, фільтрували і концентру[((триізопропілсиліл)окси)метил]прегна-5,7-дієн-3 вали при зниженому тиску. Залишок очищали коолу лонковою хроматографією, одержуючи 15мг (20S)До розчину 16,2г ацетату (20S)-4,4-диметил20-[((триізопропілсиліл)окси)-метил]прегна-5-ен20-[(піперидин-1-іл)метил]-4,4-диметил-5 -прегна3 -олу в суміші 100мл бензолу і 100мл гексану 8,14-дієн-3 -олу у вигляді білої твердої речовини. додавали порціями 4,93г 1,3-дибром-5,5MC (EI+): 425 (Μ). диметилгідантоїну при 70°С. Через 30хв. суміш Приклад 2: (20S]-20-[(3,3-диметилпіперидин-1охолоджували до 0°С і фільтрували. Фільтрат упаіл)метил]-4,4-диметил-5 -прегна-8,14-дієн-3 -ол рювали у вакуумі. Обробляли (20S)-3 -гідрокси-4,4,20До отриманої суміші додавали 160мл толуолу і триметилпрегна-8,14-дієн-21-аль 3,37,8мл 2,4,6-триметилпіридину. Суміш нагрівали диметилпіперидином і трис(ацетокси)боргідридом при кипінні протягом 2,5год. Після охолодження натрію, як описано в прикладі 1з. Виділяли (20S)реакційну суміш промивали 1н. хлористоводневою 20-[(3,3-диметилпіперидин-1-іл)метил]-4,4кислотою, насиченим розчином бікарбонату натрію диметил-5 -прегна-8,14-дієн-3 -ол у вигляді білої і насиченим сольовим розчином. Органічний шар твердої речовини. сушили над сульфатом натрію, фільтрували й MC (EI+): 453 (Μ). упарювали у вакуумі. Залишок очищали колонкоПриклад 3: (20S)-20-[(4-фенілпіперазин-1вою хроматографією, одержуючи 12,5г ацетату іл)метил]-4,4-диметил-5 -прегна-8,14-дієн-3 -ол (20S)-4,4-диметил-20-[((триізопропілсиліл)(сполука №5) окси)метил]прегна-5,7-дієн-3 -олу у вигляді білої Обробляли (20S)-3 -гідрокси-4,4,20твердої речовини. триметилпрегна-8,14-дієн-21-аль NMC (CI+): 557 (М+Н). фенілпіперазином і трис(ацетокси)боргідридом (e) (20s)-4,4,20-Триметилпрегна-8,14-дієннатрію, як описано в прикладі 1з. Виділяли (20S)3 ,21-діол 20-[(4-фенілпіперазин-1-іл)метил]-4,4-диметил-5 Суміш 16, 1г ацетату (20S)-4,4-диметил-20прегна-8,14-дієн-3 -ол у вигляді білої твердої ре[((триізопропілсиліл)окси)метил]-прегна-5,7-дієнчовини. 3 -олу, 210мл етанолу, 28мл бензолу і 28мл конMC (EI+): 502 (Μ). центрованої хлористоводневої кислоти нагрівали Приклад 4: (20S)-20-[(морфолін-4-іл)метил]при кипінні протягом 6год. Після охолодження су4,4-диметил-5 -прегна-8,14-дієн-3 -ол (сполука міш виливали в насичений розчин бікарбонату №6) натрію, екстрагували етилацетатом і промивали Обробляли (20S)-3 -гідрокси-4,4,20насиченим сольовим розчином. Органічний шар триметилпрегна-8,14-дієн-21-аль морфоліном і сушили над сульфатом натрію, фільтрували і контрис(ацетокси)боргідридом натрію, як описано в центрували при зниженому тиску. Залишок перекприкладі 1з. Виділяли (20S)-20-[(морфолін-4ристалізовували з дихлорметану і метанолу, одеіл)метил]-4,4-диметил-5 -прегна-8,14-дієн-3 -ол у ржуючи 4,48г (20S)-4,4,20-триметилпрегна-8,14вигляді білої твердої речовини. дієн-3 ,21-діолу. MC (EI+): 427 (Μ). MC [іонізація з електророзпиленням з утвоПриклад 5: (20S)-20-[(4-(тримідин-2ренням позитивних іонів (EІ+)]: 358 (М). іл)піперазин-1-іл)метил]-4,4-диметил-5 -прегна(ж) (20S)-3 -гідрокси-4,4,20-триметилпрегна8,14-дієн-3 -ол (сполука №7) 8,14-дієн-21-аль Обробляли (20S)-3 -гідрокси-4,4,20До розчину 1г (20S)-4,4,20-триметилпрегнатриметилпрегна-8,14-дієн-21-аль N-(піримідин-28,14-дієн-3 ,21-діолу в 10мл дихлорметану додаіл)піперазином і трис(ацетокси)боргідридом навали при кімнатній температурі 5,4мл 0,5Μ розчитрію, як описано в прикладі 1з. Виділяли (20S)-20ну триацетоксиперйодинану для окислення за [(4-(піримідин-2-іл)піперазин-1-іл)метил]-4,4Десс-Мартином. Суміш перемішували протягом диметил-5 -прегна-8,14-дієн-3 -ол у вигляді білої 1год., виливали в насичений розчин бікарбонату твердої речовини. 25 75130 26 MC (EI+): 504 (Μ). нковою хроматографією, одержуючи 1,17г 3Приклад 6: (20S)-20-[(піролідин-1-іл)метил]бензоату (20S)-4,4,20-триметилпрегна-5,7-дієн4,4-диметил-5 -прегна-8,14-дієн-3 -ол (сполука 3 ,21-діолу. 1 №8) H-ЯМР (CDCl3, ): 8,06 (2Н, d); 7,56 (1Н, t); Обробляли (20S)-3 -гідрокси-4,4,207,45 (2Н, t); 5,94 (1Н, d); 5,56 (1Н, m); 4,85 (1Н, m); триметилпрегна-8,14-дієн-21-аль піролідином і 3,66 (1Н, m); 3,41 (1Н, m). трис(ацетокси)боргідридом натрію, як описано в (г) Бензоат (20S)-4,4-диметил-20-[((толуол-4прикладі 1з. Виділяли (20S)-20-[(піролідин-1сульфоніл)окси)метил!прегна-5,7-дієн-3 -олу іл)метил]-4,4-диметил-5 -прегна-8,14-дієн-3 -ол у Розчин 0,573г толуол-4-сульфонілхлориду в вигляді білої твердої речовини. 4мл піридину додавали по краплях до розчину МС(ЕІ+): 411(М). 0,926г 3-бензоату (20S)-4,4,20-триметилпрегнаПриклад 7: (20S)-20-[N-(35,7-дієн-3 ,21-діолу в 15мл піридину при охолометоксипропіл)амінометил]-4,4-диметил-5 дженні в бані з льодом. Реакційну суміш перемішували протягом 1год. при 0-3°С і впродовж ночі прегна-8,14-дієн-3 -ол (сполука №10) при кімнатній температурі. Реакційну суміш вилиОбробляли (20S)-3 -гідрокси-4,4,20вали в суміш льоду з водою й екстрагували етилатриметилпрегна-8,14-дієн-21-аль 3цетатом. Органічні шари об'єднували, промивали метоксипропіламіном і трис(ацетокси)боргідридом 1н. хлористоводневою кислотою, насиченим рознатрію, як описано в прикладі 1з. Виділяли (20S)чином бікарбонату натрію і насиченим сольовим 20-[N-(3-метоксипропіл)амінометил]-4,4-диметилрозчином. Органічний шар сушили над сульфатом 5 -прегна-8,14-дієн-3 -ол у вигляді білої твердої натрію, фільтрували і концентрували при знижеречовини. ному тиску, одержуючи 1,0г бензоату (20S)-4,4MC (EI+): 429 (Μ). диметил-20-[((толуол-4-сульфоніл)окси)Приклад 8: (20S)-20-[(піперидин-1-іл)метил]метил]прегна-5,7-дієн-3 -олу, який надалі міг бути 4,4-диметил-5 -прегна-5,7-дієн-3 -ол (сполука очищений кристалізацією з метанолу. №14) 1 H-ЯМР (CDCl3, ): 8,05 (2Н, d); 7,8 (1Н, d); 7,56 (а) Бензоат (20S)-4,4-диметил-20(1Н, t); 7,45 (2Н, t); 7,34 (2Н, d); 5,94 (1Н, d); 5,55 [((триізопропілсиліл)окси)метил]прегна-5-ен-3 -олу (1Н, m); 4,85 (1Н, m); 4,0 (1Н, dd); 3,81 (1Н, m); 2,45 Додавали 34,4мл бензоїлхлориду до розчину (3Н, s). 70г неочищеного (20S)-4,4-диметил-20(д) Бензоат (20S)-20-[(піперидин-1-іл)метил][((триізопропілсиліл)окси)метил]прегна-5-ен-3 -олу 4,4-диметил-5 -прегна-5,7-дієн-3 -олу (приклад 1в) (не очищений хроматографією) у Додавали 0,625мл піперидину до розчину 670мл піридину при 0-3°С. Реакційну суміш пере0,154г бензоату (20S)-4,4-диметил-20-[((толуол-4мішували протягом 2год. при кімнатній температусульфоніл)окси)метил]прегна-5,7-дієн-3 -олу в рі і виливали на суміш льоду з водою. Осад відо3мл Ν,Ν-диметилформаміду. Реакційну суміш пекремлювали фільтруванням, промивали водою і ремішували протягом 48год. при кімнатній темпеперекристалізовували з ацетону, одержуючи 42г ратурі і концентрували при зниженому тиску. Забензоату (20S)-4,4-диметил-20лишок розчиняли в дихлорметані і тричі [((триізопропілсиліл)окси)-метил]прегна-5-ен-3 промивали водою. Органічний шар сушили над олу. 1 сульфатом натрію, фільтрували й упарювали у H-ЯМР (CDCl3, ): 8,05 (2Н, d); 7,56 (1Н, t); вакуумі. 7,45 (2H, t); 5,60 (1Н, t); 4,74 (1H, m); 3,68 (1H, dd); Залишок (125мг) кристалізували з метанолу, 3,36 (1H, m). одержуючи 45мг бензоату (20S)-20-[(піперидин-1(б) Бензоат (20S)-4,4-диметил-20іл)метил]-4,4-диметил-5 -прегна-5,7-дієн-3 -олу. [((триізопропілсиліл)окси)метил]прегна-5,7-дієн-3 1 H-ЯМР (CDCl3, ): 8,05 (2Н, d); 7,57 (1Н, t); олу 7,46 (2H, t); 5,94 (1H, d); 5,56 (1H, m); 4,88 (1H, t); Обробляли 42г бензоату (20S)-4,4-диметил2,43 (2H, m). 20-[((триізопропілсиліл)окси)-метил]прегна-5,7(e) (20S)-20-[(піперидин-1-іл)метил]-4,4дієн-3 -олу з 13,7г 1,3-дибром-5,5диметил-5 -прегна-5,7-дієн-3 -ол диметилгідантоїну і 18мл 2,4,6-триметилпіридину, Розчин 45мг бензоату (20S)-20-[(піперидин-1як описано в прикладі 1д, одержуючи (без очиіл)метил]-4,4-диметил-5 -прегна-5,7-дієн-3 -олу в щення колонковою хроматографією) 41,9г бензоа2,5мл тетрагідрофурану додавали до суспензії ту (20S)-4,4-диметил-20-[((триізопропілсиліл)окси)45мг алюмогідриду літію в 2мл тетрагідрофурану. метил]прегна-5,7-дієн-3 -олу. 1 Після перемішування протягом 2год. при кімнатній H-ЯМР (CDCl3, ): 8,05 (2Н, d); 7,57 (1Н, t); температурі додавали 3мл насиченого розчину 7,45 (2H, t); 5,95 (1H, d); 5,56 (1H, m); 4,85 (1H, m); сульфату натрію і 5мл 1н. розчину гідроксиду на3,7 (1H, dd); 3,39 (1H, m). трію. Суміш тричі екстрагували 10мл дихлормета(в) 3-Бензоат (20S)-4,4,20-триметилпрегна-5,7ну. Органічні шари об'єднували, промивали 1н. дієн-3 ,21-діолу розчином гідроксиду натрію і водою, сушили над Додавали 2г розмелених молекулярних сит сульфатом натрію, фільтрували і концентрували (4Å) і 1,27г гідрату тетрабутиламонійфториду до при зниженому тиску. Залишок (35мг) очищали розчину 2,0г (20S)-4,4-диметил-20колонковою хроматографією, одержуючи 22мг [((триізопропілсиліл)окси)метил]прегна-5,7-дієн-3 (20S)-20-[(піперидин-1-іл)метил]-4,4-диметил-5 олу в 50мл тетрагідрофурану. Суміш перемішувапрегна-5,7-дієн-3 -олу. ли протягом ночі при кімнатній температурі, кон1 H-ЯМР (CDCl3, ): 5,93 (1Н, d); 5,53 (1H, m); центрували при зниженому тиску й очищали коло 27 75130 28 3,4 (1H, t); 2,42 (2H, m); 1,22 (3H, s); 1,13 (3H, s); твердої речовини. 1,02 (3H, d); 0,98 (3H, s); 0,6 (3H, s). MC(EI+):517(M). Приклад 9: (20S)-20-[(4-(піридин-2Приклад 10: (20S)-20-[(4-фенілпіперазин-1іл)піперазин-1-іл)етил]-4,4-диметил-5 -прегнаіл)етил]-4,4-диметил-5 -прегна-8,14-дієн-3 -ол (сполука №16) 8,14-дієн-3 -ол (сполука №15) (а) (20S)-4,4,20-Триметил-21-тозилоксипрегнаОбробляли (20S)-3 -гідрокси-4,4,20триметилпрегна-8,14-дієн-21-карбальдегід N8,14-дієн-3 -ол фенілпіперазином і трис(ацетокси)боргідридом Додавали 4,7г тозилхлориду невеликими порнатрію, як описано в прикладі 9г. Виділяли (20S)ціями до розчину 4,5г (20S)-4,4,2020-[(4-фенілпіперазин-1-іл)етил]-4,4-диметил-5 триметилпрегна-8,14-дієн-3 ,21-діолу в 91мл піридину при кімнатній температурі. Суміш перемішупрегна-8,14-дієн-3 -ол у вигляді білої твердої ревали протягом 3год. при кімнатній температурі і човини. потім концентрували при зниженому тиску. ЗалиМС(ЕІ+):516(М). шок розчиняли в етилацетаті, промивали водою і Приклад 11: (20S)-20-[(4-метилпіперазин-1розчином хлористого натрію. Органічний шар суіл)етил]-4,4-диметил-5 -прегна-8,14-дієн-3 -ол шили над сульфатом натрію, фільтрували і конце(сполука №17) нтрували при зниженому тиску. Залишок очищали Обробляли (20S)-3 -гідрокси-4,4,20колонковою хроматографією, одержуючи 3,2г триметилпрегна-8,14-дієн-21-карбальдегід 1(20S)-4,4,20-триметил-21-тозилоксипрегна-8,14метилпіперазином і трис(ацетокси)боргідридом дієн-3 -олу у вигляді білої твердої речовини. натрію, як описано в прикладі 9г. Виділяли (20S)MC (EI+): 512 (Μ). 20-[(4-метилпіперазин-1-іл)етил]-4,4-диметил-5 б) (20S)-3 -Гідрокси-4,4,20-триметилпрегнапрегна-8,14-дієн-3 -ол у вигляді білої твердої ре8,14-дієн-21-карбонітрил човини. Додавали 1,7г ціаністого калію до розчину 4,7г MC (EI+): 454 (Μ). (20S)-4,4,20-триметил-21-тозилоксипрегна-8,14Приклад 12: (20S)-20-[(N,Nдієн-3 -олу в 90мл ДМСО при кімнатній темперадиметиламіно)етил]-4,4-диметил-5 -прегна-8,14турі. Суміш перемішували протягом 2год. при дієн-3 -ол (сполука №18) 90°С, виливали у воду, екстрагували етилацетаОбробляли (20S)-3 -гідрокси-4,4,20том і промивали водою. Органічний шар сушили триметилпрегна-8,14-дієн-21-карбальдегід Ν,Νсульфатом натрію, фільтрували і концентрували диметиламіном і трис(ацетокси)боргідридом напри зниженому тиску, одержуючи 2,8г (20S)-3 трію, як описано в прикладі 9г. Виділяли (20S)-20гідрокси-4,4,20-триметилпрегна-8,14-дієн-21[(N,N-диметиламіно)етил]-4,4-диметил-5 -прегнакарбонітрилу у вигляді білої твердої речовини, яку 8,14-дієн-3 -ол у вигляді білої твердої речовини. використовували без подальшого очищення. MC (EI+): 399 (Μ). MC (EI+): 367 (М). Приклад 13: (20S)-20-[(морфолін-4-іл)етил](в) (20S)-3 -Гідрокси-4,4,20-триметилпрегна4,4-диметил-5 -прегна-8,14-дієн-3 -ол (сполука 8,14-дієн-21-карбальдегід №19) Додавали 16мл діізобутилалюмінійгідриду Обробляли (20S)-3 -гідрокси-4,4,20(20% у толуолі) по краплях до розчину 920мг триметилпрегна-8,14-дієн-21-карбальдегід мор(20S)-3 -гідрокси-4,4,20-триметилпрегна-8,14-дієнфоліном і трис(ацетокси)боргідридом натрію, як 21-карбонітрилу в 60мл толуолу при температурі описано в прикладі 9г. Виділяли (20S)-2072°С. Суміш перемішували протягом 2год. при тій [(морфолін-4-іл)етил]-4,4-диметил-5 -прегна-8,14же температурі, виливали в розчин 2н. сірчаної дієн-3 -ол у вигляді білої твердої речовини. кислоти, екстрагували етилацетатом, промивали МС (ЕІ+): 441(М). 2н. сірчаною кислотою і потім промивали напівнаПриклад 14: (20S)-20-[(піролідин-1-іл)етил]-4,4сиченим розчином хлористого натрію. Органічний диметил-5 -прегна-8,14-дієн-3 -ол (сполука №20) шар сушили над сульфатом натрію, фільтрували і Обробляли (20S)-3 -гідрокси-4,4,20концентрували при зниженому тиску, одержуючи триметилпрегна-8,14-дієн-21-карбальдегід піролі750мг (20S)-3 -гідрокси-4,4,20-триметилпрегнадином і трис(ацетокси)боргідридом натрію, як опи8,14-дієн-21-карбальдегіду у вигляді білої твердої сано в прикладі 9г. Виділяли (20S)-20-[(піролідинречовини, яку використовували без подальшого 1-іл)етил]-4,4-диметил-5 -прегна-8,14-дієн-3 -ол у очищення. вигляді білої твердої речовини. MC (EI+): 370 (М). MC (EI+): 425 (Μ). (г) (20S)-20-[(4-(Піридин-2-іл)піперазин-1Приклад 15: (20S)-20-[(піперидин-1-іл)етил1іл)етил1-4,4-диметил-5 -прегна-8,14-дієн-3 -ол 4,4-диметил-5 -прегна-8,14-дієн-3 -ол (сполука Додавали 107мг трис(ацетокси)боргідриду на№21) трію до розчину 125мг (20S)-3 -гідрокси-4,4,20Обробляли (20S)-3 -гідрокси-4,4,20триметилпрегна-8,14-дієн-21-карбальдегіду і триметилпрегна-8,14-дієн-21-карбальдегід піпери82,6мг N-(2-піридил)-піперазину в 2мл тетрагідродином і трис(ацетокси)боргідридом натрію, як опифурану при кімнатній температурі. Суміш перемісано в прикладі 9г. Виділяли (20S)-20-[(піперидиншували протягом 20год., виливали у воду і конце1-іл)етил]-4,4-диметил-5 -прегна-8,14-дієн-3 -ол у нтрували при зниженому тиску. Залишок очищали вигляді білої твердої речовини. колонковою хроматографією, одержуючи 84мг MC (EI+): 439 (Μ). (20S)-20-[(4-(піридин-2-іл)піперазин-1-іл)етил]-4,4Приклад 16: (20S)-20-[(4-фенілпіперидин-1диметил-5 -прегна-8,14-дієн-3 -олу у вигляді білої 29 75130 30 рбонату натрію, сушили над сульфатом магнію і іл)метил]-5 -прегна-5-ен-3 -ол (сполука №22) концентрували при зниженому тиску, одержуючи (а) Метиловий ефір 3 -трет.вказану у заголовку сполуку. бутилдиметилсилілоксибіснорхоленової кислоти MC (EI+): 478 (Μ). Перемішували 3 -гідроксибіснорхоленову кисПриклади 17-22: лоту (10г), бікарбонат калію (12г), йодистий метил Відтворювали етапи (г) і (д) із прикладу 16 на (10мл) і диметилформамід протягом 3 діб при кім3 -трет.-бутилдиметилсилілокси-(20S)-20-метилнатній температурі і виливали у воду (1,5мл). Бі5 -прегна-5-ен-21-алі, одержуючи наступні приклий осад відокремлювали фільтруванням. Додалади сполук. вали діетиловий ефір до білого осаду, і Приклад 17: (20S)-20-[(піперидин-1-іл)метил]нерозчинний матеріал відфільтровували. Концентрація ефірної фази у вакуумі дала неочищений 5 -прегна-5-ен-3 -ол (сполука №23) силіловий ефір, який розчиняли в диметилформаВикористовуючи піперидин на етапі відновного міді (400мл). Додавали трет.амінування (г) з наступним деблокуванням етапу бутилдиметилсилілхлорид (6г) і імідазол (6г), і су(д), одержували вказану в заголовку сполуку. міш концентрували у вакуумі й очищали флешMC (EI+): 400 (Μ). хроматографією, одержуючи 5,3г метилового ефіПриклад 18: (20S)-20-[(морфолін-4-іл)метил]ру 3 -трет.5 -прегна-5-ен-3 -ол (сполука №24) бутилдиметилсилілоксибіснорхоленової кислоти. Використовуючи морфолін на етапі відновного амінування (г) з наступним деблокуванням етапу (б) 3 -трет.-Бутилдиметилсилілокси-(20S)-20(д), одержували вказану в заголовку сполуку. метил-5 -прегна-5-ен-21-ол MC (EI+): 402 (Μ). Додавали 2,2екв. діізобутилалюмінійгідриду Приклад 19: (20S)-20-[(піролідин-1-іл)метил](2М) у толуолі до метилового ефіру 3 -трет.5 -прегна-5-ен-3 -ол (сполука №25) бутилдиметилсилілоксибіснорхоленової кислоти, і Використовуючи піролідин на етапі відновного реакційну суміш перемішували при кімнатній темамінування (г) з наступним деблокуванням етапу пературі. Реакційну суміш додавали до води, екст(д), одержували вказану в заголовку сполуку. рагували, використовуючи діетиловий ефір, конMC (EI+): 386 (Μ). центрували у вакуумі й очищали флешПриклад 20: (20S)-20-[(4хроматографією, одержуючи 3,3г 3 -трет.карбоксіетилпіперидин-1-іл)метил]-5 -прегна-5-енбутилдиметилсилілокси-(20S)-20-метил-5 -прегна3 -ол (сполука №26) 5-ен-21-олу. Використовуючи 4-карбоксіетилпіперидин на (в) 3 -трет.-Бутилдиметилсилілокси-(20S)-20етапі відновного амінування (г) з наступним деметил-5 -прегна-5-ен-21-аль блокуванням етапу (д), одержували вказану в заРозчин Десс-Мартину (триацетоксиперйодиголовку сполуку. нану) (1,9г у 30мл дихлорметану ) додавали до MC (ЕЇ+): 472 (Μ). 1,6г 3 -трет.-бутилдиметилсилілокси-(20S)-20Приклад 21: (20S)-20-[(3-гідроксипіперидин-1метил-5 -прегна-5-ен-21-олу в дихлорметані іл)метил]-5 -прегна-5-ен-3 -ол(сполука №27) (30мл), і реакційну суміш перемішували протягом Використовуючи 3-гідроксипіперидин на етапі 24год., потім виливали в діетиловий ефір і екстравідновного амінування (г) з наступним деблокугували 1н. гідроксидом натрію. Органічний шар ванням етапу (д), одержували вказану в заголовку сушили сульфатом магнію і концентрували у вакусполуку. умі, одержуючи 1,6г 3 -трет.МС(ЕІ+):416(М). бутилдиметилсилілокси-(20S)-20-метил-5 -прегнаПриклад 22: (20S)-20-[(4-бензоїлпіперидин-15-ен-21-алю. іл)метил]-5 -прегна-5-ен-3 -ол (сполука №28) (г) 3 -трет.-Бутилдиметилсилілокси-(20S)-20Використовуючи 4-бензоїлпіперидин на етапі [(4-фенілпіперидин-1-іл)метил]-5 -прегна-5-ен відновного амінування (г) з наступним деблокуДодавали 4-фенілпіперидин (0,16г) до 0,26г ванням етапу (д), одержували вказану в заголовку 3 -трет.-бутилдиметилсилілокси-(20S)-20-метилсполуку. 5 -прегна-5-ен-21-алю в ТГФ (20мл) з наступним MC (EI+): 504 (Μ). додатком трис(ацетокси)боргідриду натрію (0,38г). Приклад 23: дослідження речовин, які активуЧерез 5год. реакційну суміш виливали в насичений ють мейоз, в аналізі мишиних овоцитів розчин бікарбонату натрію, екстрагували етилацеТварини татом, сушили і концентрували у вакуумі. ФлешОвоцити одержували від незрілих самок михроматографія дала 76мг 3 -трет.шей (C57BI/6J x DBA/2J F1-гібриди, Bomholtgaard, бутилдиметилсилілокси-(20S)-20-[(4Denmark) вагою 13-16г, які містилися при контрофенілпіперидин-1-іл)метил]-5 -прегна-5-ену. льованих освітленні і температурі. Миші одержу(д) (20S)-20-[(4-Фенілпіперидин-1-іл)метил]-5 вали внутріочеревинну ін'єкцію 0,2мл гонадотропіпрегна-5-ен-3 -ол нів [що містить 10 міжнародних одиниць (МО) Додавали 6н. хлористоводневу кислоту сироваткового гонадотропіну жеребної кобили (0,2мл) до суміші 100мг 3 -трет.(PMSG), Sigma Cat. No. G-4877)] і через 48год. бутилдиметилсилілокси-(20S)-20-[(4тварин забивали шляхом зміщення шийних хребців. фенілпіперидин-1-іл)метил]-5 -прегна-5-ену в Збір і культивування овоцитів 10мл етанолу, і суміш перемішували протягом 4 Яєчники розтинали й овоцити виділяли в Нхднів при кімнатній температурі. Додавали дихлорсередовищі (дивися нижче) під стереомікроскопом метан, і органічну фазу промивали розчином біка 31 75130 32 шляхом ручного розриву фолікул, використовуючи Нх означає гіпоксантин пару голок 27 розміру. Сферичні множинні екраноGV означає зародковий пухирець вані овоцити (СЕО), які мають інтактний зародкоGVB означає розщеплення зародкового пухивий пухирець (GV), поміщали в мінімальне есенцірця РВ означає полярне тільце альне середовище в модифікації ( -MEM без n означає число овоцитів рибонуклеозидів, Gibco BRL, Cat. No. 22561) з додаванням 3мМ гіпоксантину (Нх) (Sigma Cat. No. HПриклад 24: дослідження речовин, які активу9377), 8мг/мл людського сироваткового альбуміну ють мейоз, у культуральній системі мишиних фолі(HAS, State Serum Institute, Denmark), 0,23мМ пірукул вату (Sigma, Cat. No. S-8636), 2мМ глутаміну (Flow Тварини Cat. No. 16-801), 100МО/мл пеніциліну і 100мкг/мл Фолікули одержували від незрілих 19-21стрептоміцину (Flow Cat. No. 16-700). Дане середенних самок мишей (C57B1/6J x CBA/J), які місдовище позначили Нх-середовище. тилися при контрольованих освітленні і темпераОвоцити промивали три рази в Нх-середовищі турі. і культивували в 4-коміркових багатолункових Збір сироватки і культивування фолікул планшетах (Nunclon, Denmark), у яких кожна комірТваринам давали ефірний наркоз, і збирали ка містила 0,4мл Нх-середовища і приблизно 25 кров шляхом видалення очей. Після згортання овоцитів. Один контроль (тобто приблизно 25 овокров центрифугували протягом 15хв. при 4000g, цитів, культивованих у Нх-середовищі без додазбирали сироватку і зберігали при -20° до викорисвання досліджуваної сполуки) завжди проводили тання. Яєчники видаляли і поміщали в середовиодночасно з аналізованими культурами, які були ще Лейбовіца L-15 (Gibco Cat. No. 41300) з додаприготовлені з різними концентраціями досліджуванням глутаміну 1ммоль/л, BSA 3мг/мл, ваних сполук. Культури функціонували при 37°С і людського трансферину (без заліза) 5мкг/мл, інсувологості 100% в атмосфері з 5% вуглекислого ліну 5мкг/мл (ступінь чистоти - реагенти для кульгазу. Час культивування становив 22год. тур, Sigma, St. Louis, МО) при 37°С. Дослідження овоцитів Преантральні фолікули діаметром 170-190мкм Овоцити зупиняли в мейозі і характеризували виділяли механічно з двома голками 27 розміру, за допомогою інтактних ядер з опуклими ядерцяприєднаними до шприца на 1мл. Їх поміщали в 4ми, відомими як зародкові пухирці (GV). При покоміркові культуральні планшети (Nunclon, вторній ініціації мейозу ядерця і ядерні оболонки Denmark) і після цього тричі промивали мінімальзникають, і це характеризується за допомогою розщеплення GV, яке у такому випадку називають ним есенціальним середовищем у модифікації розщепленням зародкових пухирців (GVB). Декіль( -MEM, Gibco Cat. No. 11900) з додаванням глукома годинник пізніше овоцит завершує відновлетаміну 2ммоль/л, трансферину 10мкг/мл, інсуліну ний поділ і виявляється перше, так зване, полярне 10мкг/мл і BSA 3мг/мл. тільце (РВ). Фолікули 170-190мкм нормального морфологіНаприкінці культурального періоду число овочного виду, тобто центральний сферичний овоцит, цитів із зародковим пухирцем (GV) або розщепвисока щільність гранулоцитів і оболонковий шар, ленням зародкових пухирців (GVB) і овоцитів з який оточує фолікул повністю, відбирали і окремо полярним тільцем (РВ) підраховували, використокультивували в 96-комірковому культуральному вуючи стереомікроскоп або інвертований мікроспланшеті (Nunclon, Denmark) із введеннями 40мкл коп з диференціальним інтерференційним контракультурального середовища -MEM з додаванням стним обладнанням. В аналізованих культурах незрілої мишиної сироватки 50мкл/мл, інсуліну розраховували відсоток овоцитів з GVB від зага5мкг/мл, глутаміну 2ммоля/л, людського трансфельного числа овоцитів і відсоток овоцитів із РВ від рину 10мкг/мл і 0,2 міжнародних одиниць фолікузагального числа овоцитів і порівнювали з даними лостимулювального гормону (FSH) (Gonal F, контрольної культури. Serono, Solna, Sweden). Без якого-небудь масляного покриття фолікули культивували у зволожеТаблиця 1 ному термостаті, наповненому повітрям з 5% СO2 при 37°С. Активація мейозу в множинних Початок культивування був визначений як екранованих мишиних овоцитах день 0. Культуральне середовище змінювали щодня. Діаметр фолікул вимірювали щодня, викорисОвоцити (n) Активація (%) товуючи 100-кратне збільшення і калібрований Сполуки GV GVB РВ GVB+PB мікрометр. Крім того, виживання фолікул контролювали шляхом оцінки деградації (потемніння фоКонтроль (Нх) 19 1 4 21 лікула) і розриву (втрати овоцита). Час культиву10мкМ MFF-MAS 13 6 5 46 вання становив 4 дні. 0,1мкМ сполуки при14 7 2 39 У день 2 і 3 культивування досліджувану спокладу 1 луку або пухирець з об'ємом 1,72мкл додавали в 1мкМ сполуки прик6 12 6 75 культуральне середовище. Досліджувану сполуку ладу 1 розчиняли в етанолі (пухирець). 10мкМ сполуки при1 14 7 95 Дослідження фолікул кладу 1 Овоцити зупиняли в мейозі і характеризували за допомогою інтактних ядер з опуклими ядерцями, відомими як зародкові пухирці (GV). При по 33 75130 34 вторній ініціації мейозу ядерця і ядерні оболонки надати матці більшої сприйнятливості. зникають, і це характеризується за допомогою Сполука, додана в культуральне середовище, розщеплення GV, яке у такому випадку називають значно поліпшувала якість дозрівання овоцитів, розщепленням зародкових пухирців (GVB). що привело до більш високих показників заплідУ день 4, наприкінці культурального періоду нення, більш інтенсивного розвитку перед імпланфолікули контролювали на відновлення мейозу. тацією, більш високих показників імплантації і в Число фолікул, які мають овоцити з зародковим остаточному підсумку до більш високого показника пухирцем (GV) або розщепленням зародкових пународжених здоровими людських немовлят. хирців (GVB), підраховували, використовуючи стеПриклад 26: лікування жіночої безплідності з реомікроскоп або інвертований мікроскоп з дифезастосуванням агоніста MAS in vivo ренціальним інтерференційним контрастним Сполука вводили пацієнтці перорально двічі в обладнанням. В аналізованих культурах розраходень у дозі 10мг/кг із моменту остаточного дозрівували відсоток фолікул з GVB від загального чисвання овоцитів, викликаного ін'єкцією hCG ла фолікул і порівнювали з контрольною культу(10000МО людського хоріонічного гонадотропіну, рою пухирців. підшкірно). Людський хоріонічний гонадотропін міг бути введений протягом нормального циклу. Цикл Таблиця 2 міг бути індукований синдромом відміни прогестерону, який вводиться мінімум 10 днів перед відміАктивація дозрівання овоцитів ною, щоб викликати кровотечу і циклічну активу системі культури мишиних фолікул ність у пацієнтки з аменореєю або синдромом полікістозних яєчників. Або hCG міг бути введений як інтегрована частина гормональної стимуляції Фолікули (n) Активація (%) Сполуки нормальної тривалості за протоколом IVF (викориGV GVB GVB стовуючи понижуючу регуляцію антагоністом гонаКонтроль (1,72мкл 16 2 11 дотропіну, наприклад, спреєм для носа сінарелла, етанолу) потім через 14 днів шляхом щоденної ін'єкції фолі10мкМ FF-MAS 9 0 0 кулостимулювального гормону 150-225МО/день). 1мкМ сполуки прик2 7 78 Пацієнтка одержувала лікування або як дополаду 1 внення до звичайної терапії IVF з відбором яйцек3мкМ сполуки прик0 9 100 літин, IVF і переносом ембріона, або альтернативладу 1 но було застосоване лікування в комбінації з 10мкМ сполуки прик0 8 100 заплідненням яйцеклітини, використовуючи осімеладу 1 ніння або природні статеві акти. Лікування підвищило рівень агоністів MAS у GV означає овоцити з зародковими пухирцями сироватці пацієнтки безпосередньо перед овуляціGVB означає овоцити з розщепленням зародєю, тим самим було отримано поліпшену якість кових пухирців дозрівання овоцитів. Якість яйцеклітини, підданої n означає число фолікул овуляції, було поліпшено шляхом індукції мейозу сполукою, яка вводиться щодня, що привело до Приклад 25: лікування безплідності з застосубільш високих показників запліднення, більш інтеванням агоніста MAS in vitro нсивного розвитку перед імплантацією, більш виЯйцеклітини витягали за допомогою трансвасоких показників імплантації і в остаточному підгінальної аспірації, яка направляється ультразвусумку до більш високого показника народжених ком, з яєчника жінки-пацієнта, або стимульованої здоровими людських немовлят. гормоном або не стимульованої гормоном. Приклад 27: лікування чоловічої безплідності з Гормональна стимуляція могла здійснюватися застосуванням агоніста MAS in vivo за протоколом запліднення in vitro (IVF) стандартСполуку вводили перорально пацієнту чоловіної тривалості, який включає понижуючу регуляцію чої статі двічі в день у дозі 10мг/кг послідовно проантагоністом гонадотропіну, наприклад, спреєм тягом, принаймні, 60 (шістдесяти) днів. для носа сінарелла, потім через 14 днів щоденну Лікування підвищувало рівень агоніста MAS у ін'єкцію фолікулостимулювального гормону (FSH) сироватці пацієнта, що позитивно стимулювало (Gonal-F, підшкірно) 150МО/день. За 36год. до перебіг мейозу в яєчку і, отже, з часом показники збору яйцеклітин пацієнту давали людський хоріоякості сперми. Показники якості сперми (число нічний гонадотропін (hCG) (10000 МОпідшкірно), сперматозоїдів, морфологія, прогресуюча рухощоб викликати остаточне дозрівання фолікула й мість і т.д.) окремо або разом зумовлювали поліповоцита. шену фертильність сперми згаданого пацієнта. Сполуку додавали в культуральне середовиЦе виражалося в тому, що можна було уникнуще в концентрації 3мкМ і давали взаємодіяти з ти запліднення шляхом інтрацитоплазматичної статевою клітиною до запліднення або для опосеін'єкції сперми (ICSI) і домогтися запліднення тільредкування, або для поліпшення процедури мейоки шляхом IVF або в іншому прикладі, що заплідтичного дозрівання. Овоцити запліднювали in vitro, нення IVF/ICSI відмінялося, і можна було домогтикультивували in vitro і повертали в матку пацієнтки ся запліднення шляхом осіменіння або природного звичайно на день 3 після збору овоцитів. Пацієнтці запліднення яйцеклітини. давали прогестерон (кринон у вигляді вагінального Приклад 28: терапевтична схема жіночої контгелю, 1 доза в день) і/або естрадіол (валерат естрацепції, яка використовує агоніст MAS і раннє радіолу, 2мг/день), щоб поліпшити імплантацію і дозрівання овоцитів 35 75130 36 Сполуку вводили перорально пацієнтці двічі в овуляції проходив нормально, і циклова активність день у дозі 50мг/кг щодня протягом усього нормазалишалася не зміненою. Однак під час овуляції льного циклу. Пацієнтка одержувала терапію або мейоз зупинявся, і тому відбувався вихід незрілих і як додавання до звичайного лікування за протоконезапліднених овоцитів. Нормальні рівні і динаміка лом IVF з відбором яйцеклітин, IVF і перенесення стероїдних гормонів залишалися не порушеними, ембріона, або альтернативно терапію проводили в так само як залишалися непорушеними природна комбінації з заплідненням, досягнутим шляхом циклова активність і місячна менструація. осіменіння або природних статевих актів. Приклад 30: терапевтична схема чоловічої коТерапія підвищувала рівень агоністів MAS у нтрацепції, яка використовує антагоніст MAS, який сироватці пацієнтки задовго до того, як відбувалаблокує перебіг мейозу в яєчку ся овуляція й опосередковувала дозрівання овоСполуку вводили перорально пацієнту чоловіцитів задовго до овуляції. У результаті овуляції чої статі двічі в день у дозі 50мг/кг послідовно провиникаючі перезрілі овоцити більше не були життягом, найменше, 60 (шістдесяти) днів. Здійснення тєздатними або здатними до запліднення. Нормасперматогенезу в чоловіка займає приблизно 60льний менструальний цикл не піддався впливу, не 65 днів. змінилися також нормальний рівень і динаміка Терапія індукувала в суб'єкта, який підданий стероїдних гормонів. обробці, рівень антагоністів MAS у сироватці, який Приклад 29: терапевтична схема жіночої контефективно пригнічував природний хід мейозу і рацепції, яка використовує антагоніст MAS, який диференціацію, яка приводила до утворення заблокує перебіг мейозу в яєчниках пліднюючих зрілих сперматозоїдів у яєчку суб'єкта. Сполуку вводили перорально пацієнтці двічі в Перебіг сперматогенезу пригнічувався, і утворюдень у дозі 50мг/кг щодня протягом усього нормавалися і виділялися винятково не запліднюючі льного циклу. сперматозоїди. Однак ендокринологія яєчка не Терапія підвищувала в сироватці пацієнтки ріпорушувалися, і нормальний рівень і динаміка вень агоністів MAS, які ефективно інгібували простероїдних гормонів залишалися не зміненими. ходження природного дозрівання овоцитів. Етап 37 75130 38 39 75130 40 41 Комп’ютерна верстка О. Гапоненко 75130 Підписне 42 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSteroid compounds, use of these compounds for obtaining medicament regulating meiosis and a method for producing these compounds (variants)
Автори англійськоюBlume Thorsten, Esperling Peter
Назва патенту російськоюСтероидные соединения, применение этих соединений для получения лекарственных средств, регулирующих мейоз, способ получения этих соединений (варианты)
Автори російськоюБлюме Торстен, Эсперлинг Петер
МПК / Мітки
МПК: A61P 15/08, C07J 41/00, A61P 15/00, A61K 31/58, A61P 43/00, C07J 43/00
Мітки: застосування, лікарських, стероїдні, мейоз, спосіб, цих, засобів, одержання, сполуки, регулюють, сполук, варіанти
Код посилання
<a href="https://ua.patents.su/21-75130-sterodni-spoluki-zastosuvannya-cikh-spoluk-dlya-oderzhannya-likarskikh-zasobiv-yaki-regulyuyut-mejjoz-i-sposib-oderzhannya-cikh-spoluk-varianti.html" target="_blank" rel="follow" title="База патентів України">Стероїдні сполуки, застосування цих сполук для одержання лікарських засобів, які регулюють мейоз, і спосіб одержання цих сполук (варіанти)</a>
Попередній патент: Спосіб наведення лінії прицілювання для системи керування озброєнням об’єктів бронетанкової техніки
Наступний патент: Пристрій подавання безперервної, навитої по спіралі стрічки матеріалу в машині для голкопробивння текстильної конструкції
Випадковий патент: Кліть прокатного стана з пристроєм зміщення












