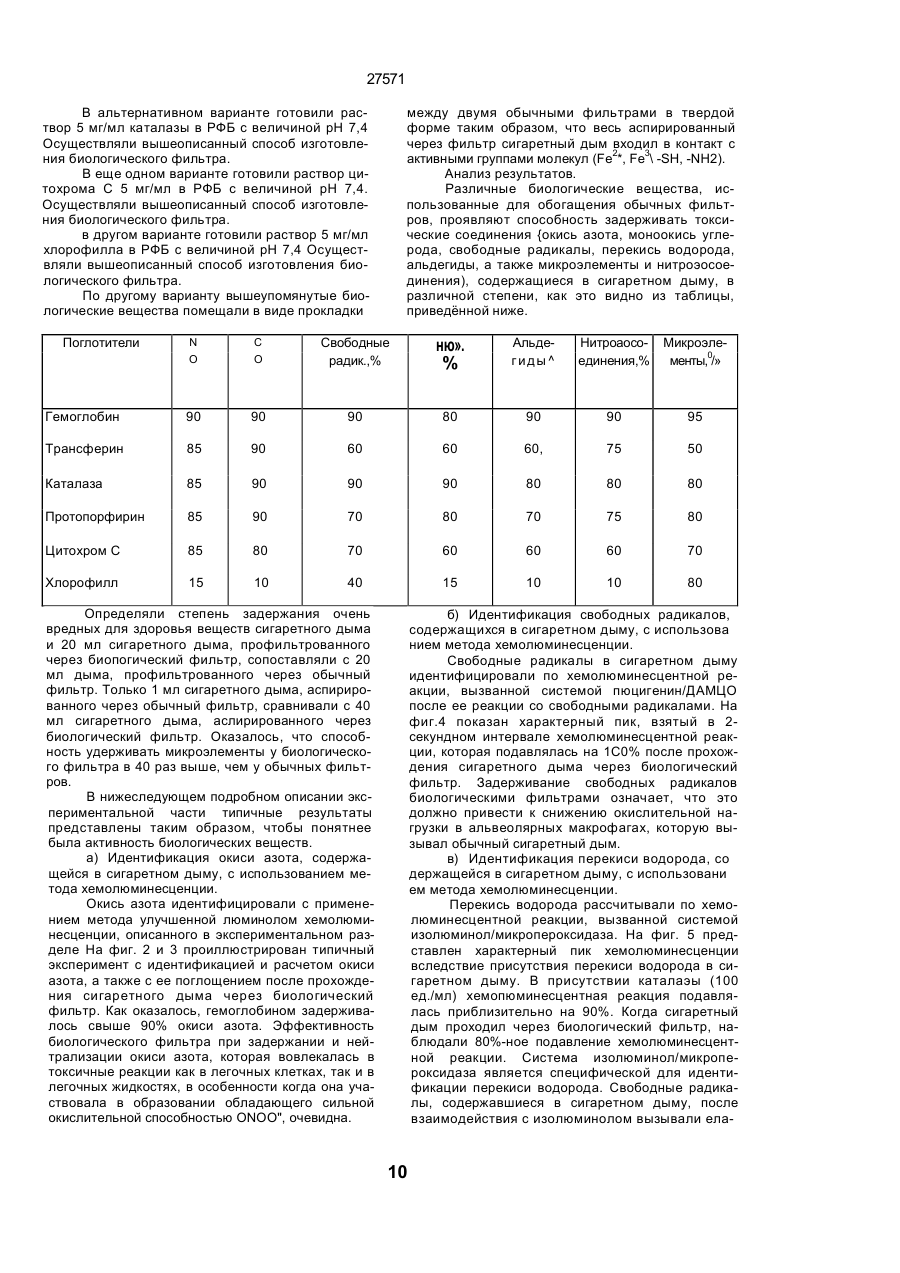
Фільтр для видалення шкідливих окисників і канцерогенних летких нітрозосполук з тютюнового диму, сигарета з фільтром, спосіб виготовлення фільтра і спосіб видалення шкідливих окисників і канцерогенних летких н
Текст
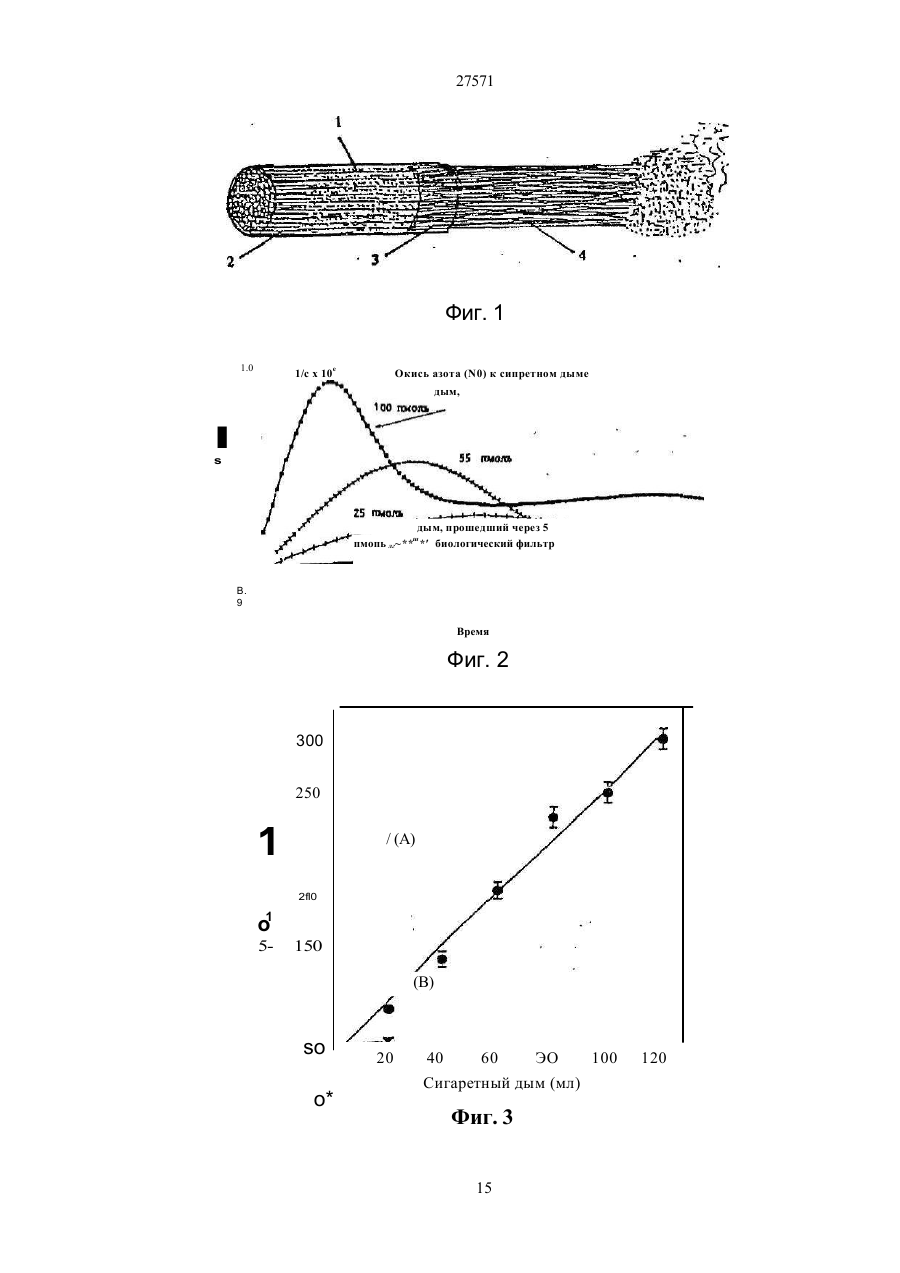
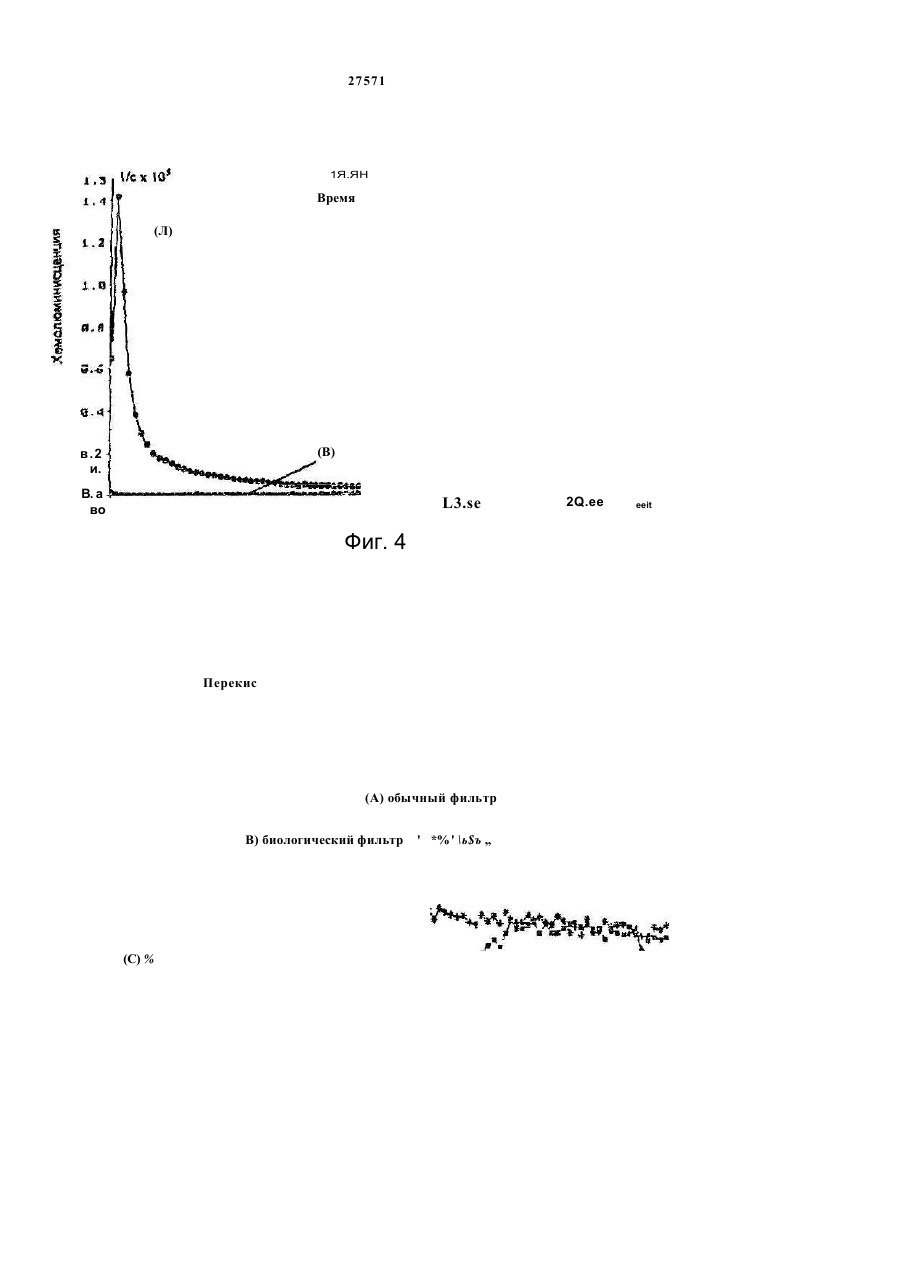
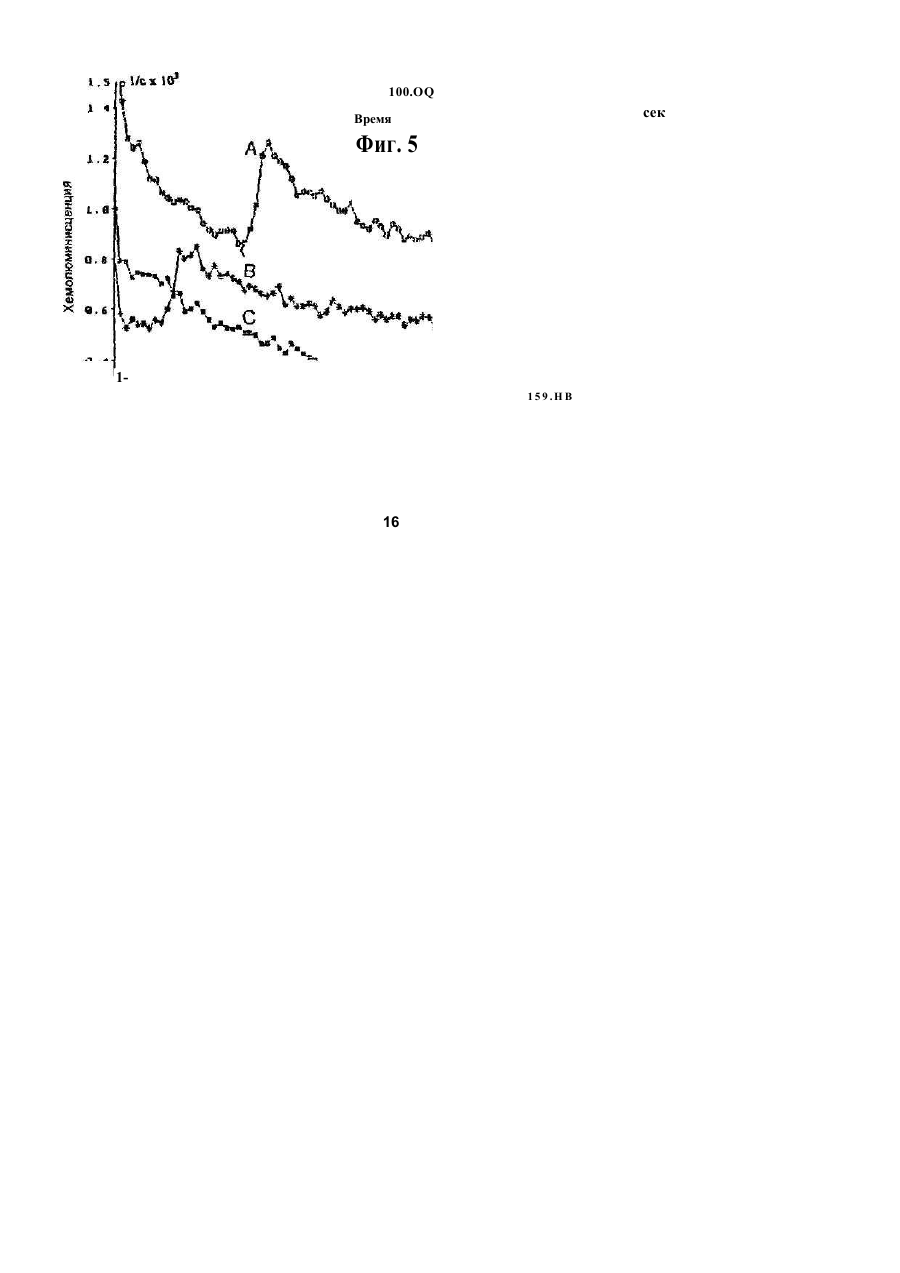
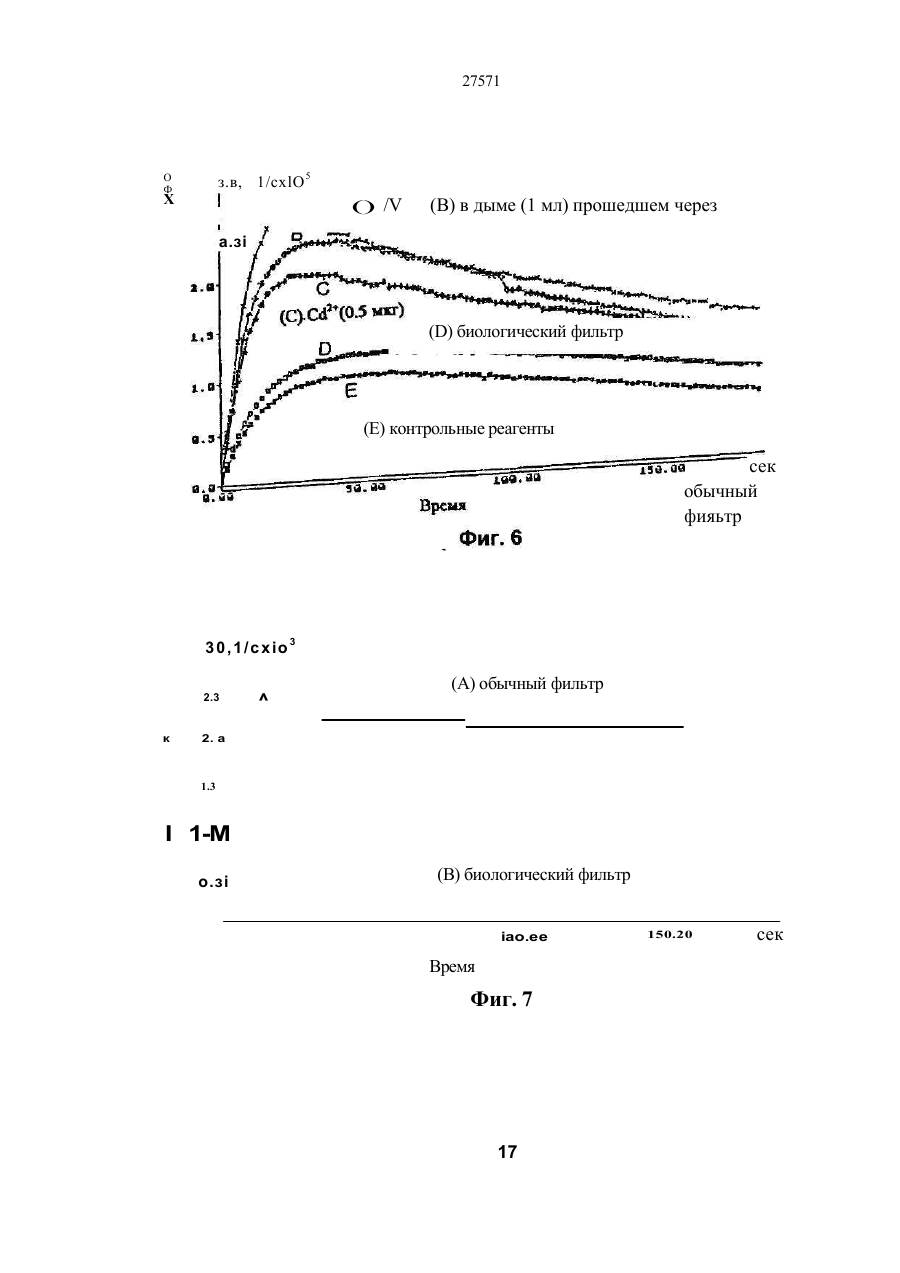
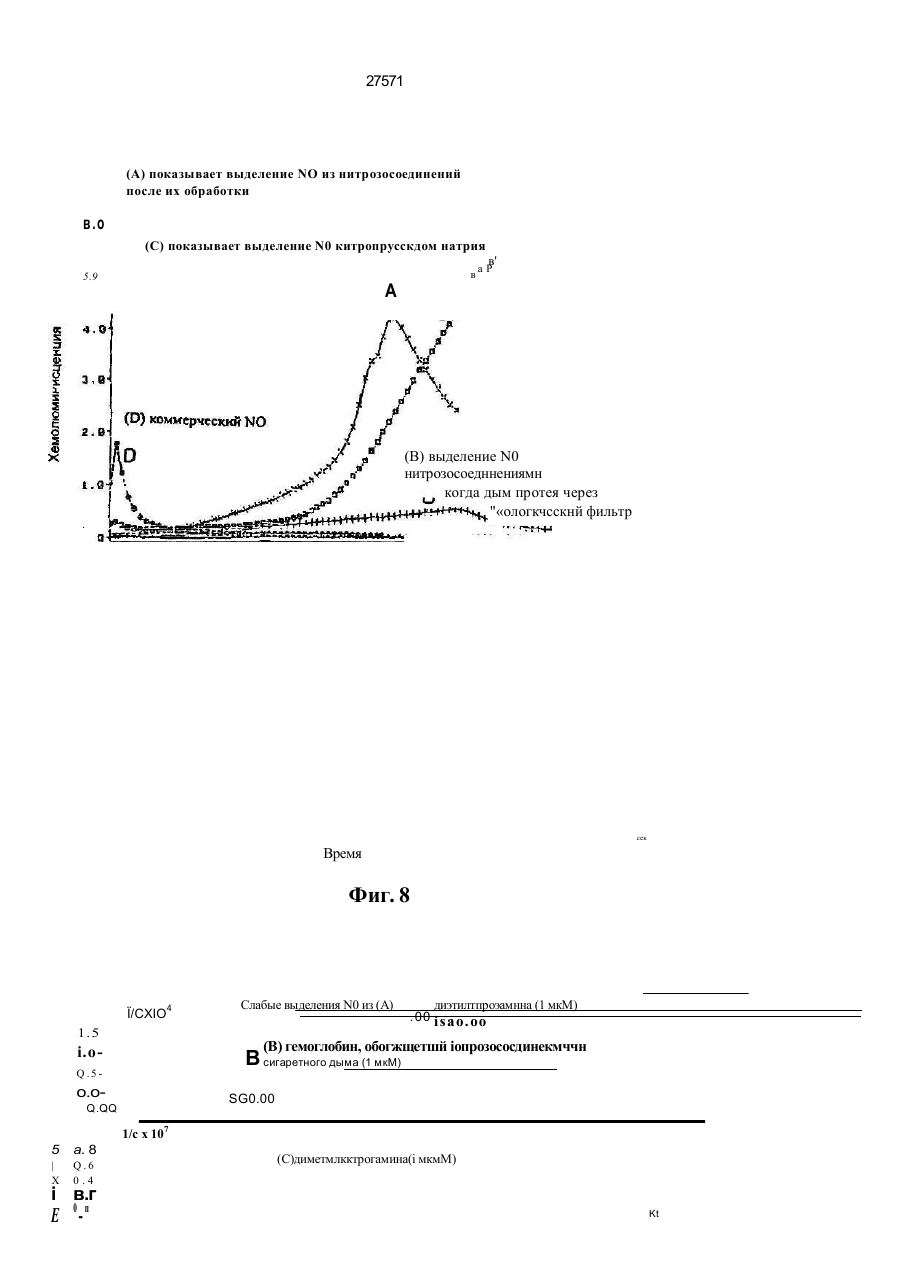
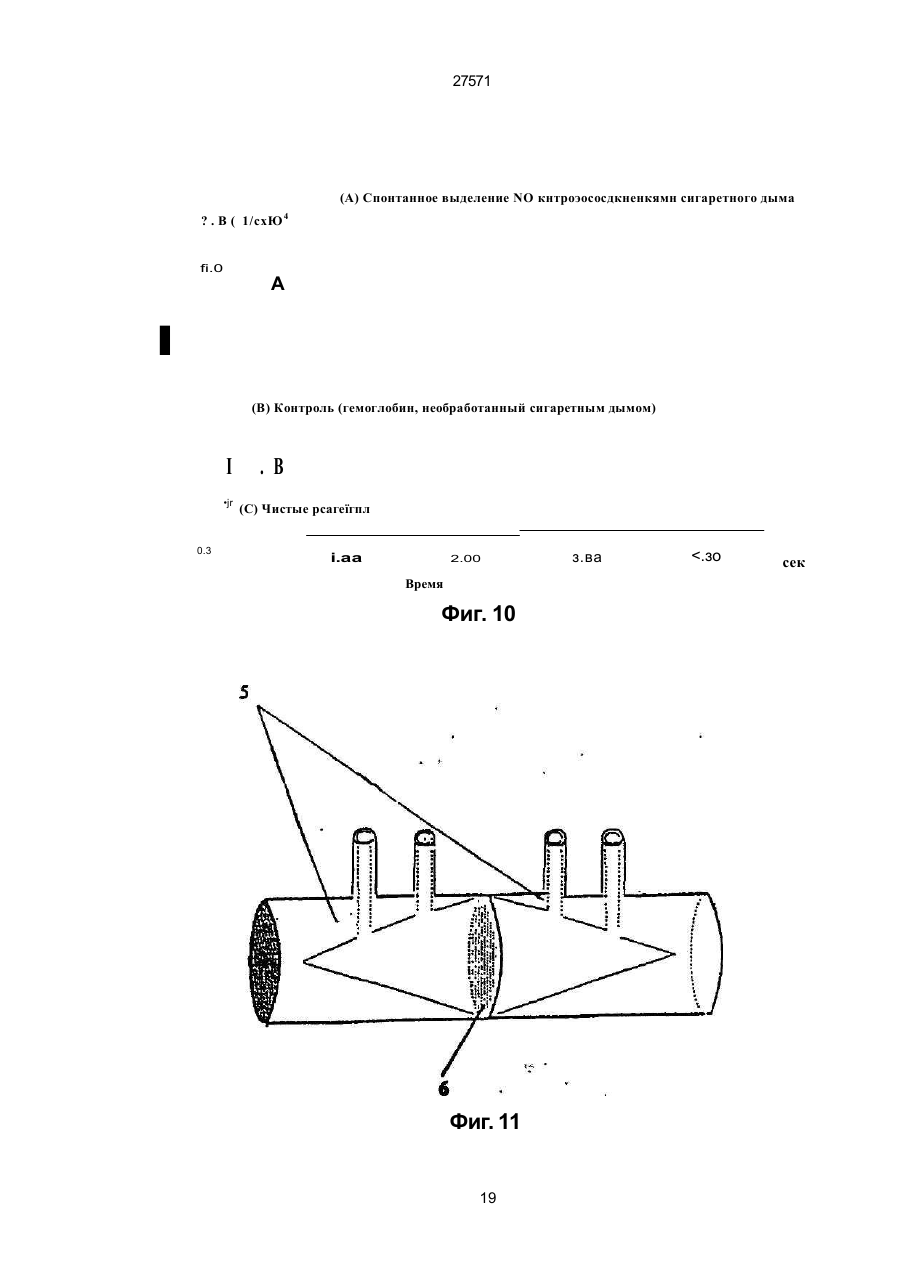
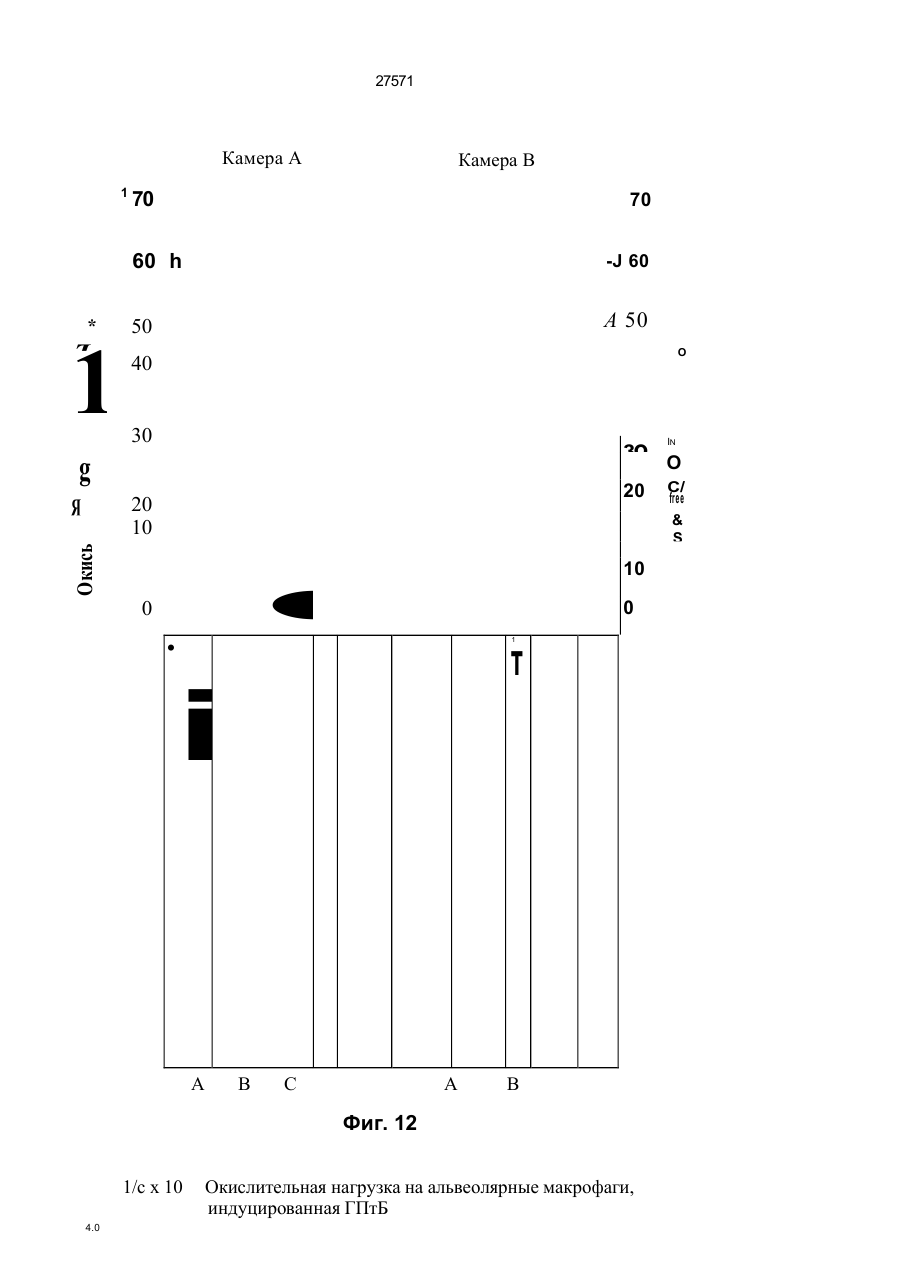
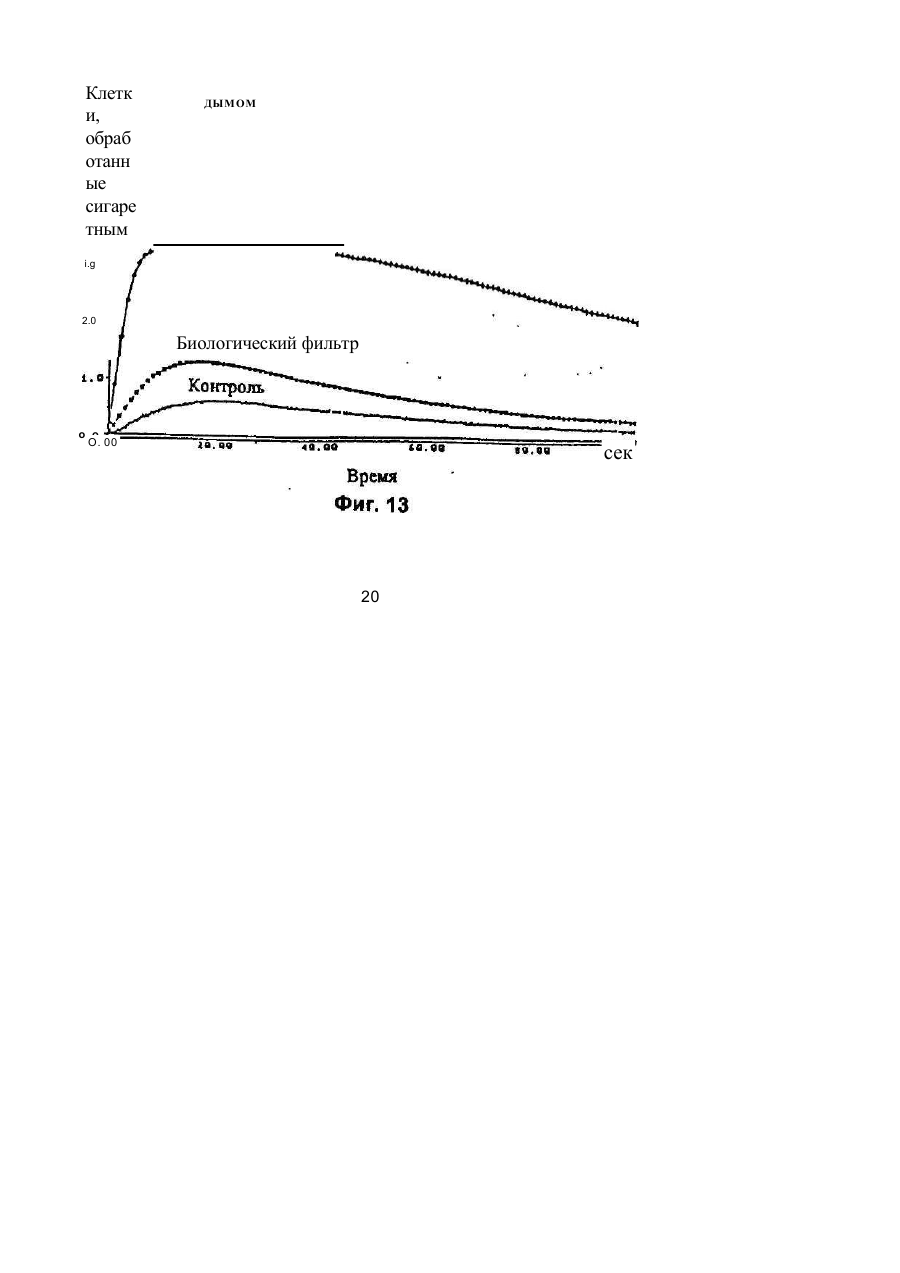
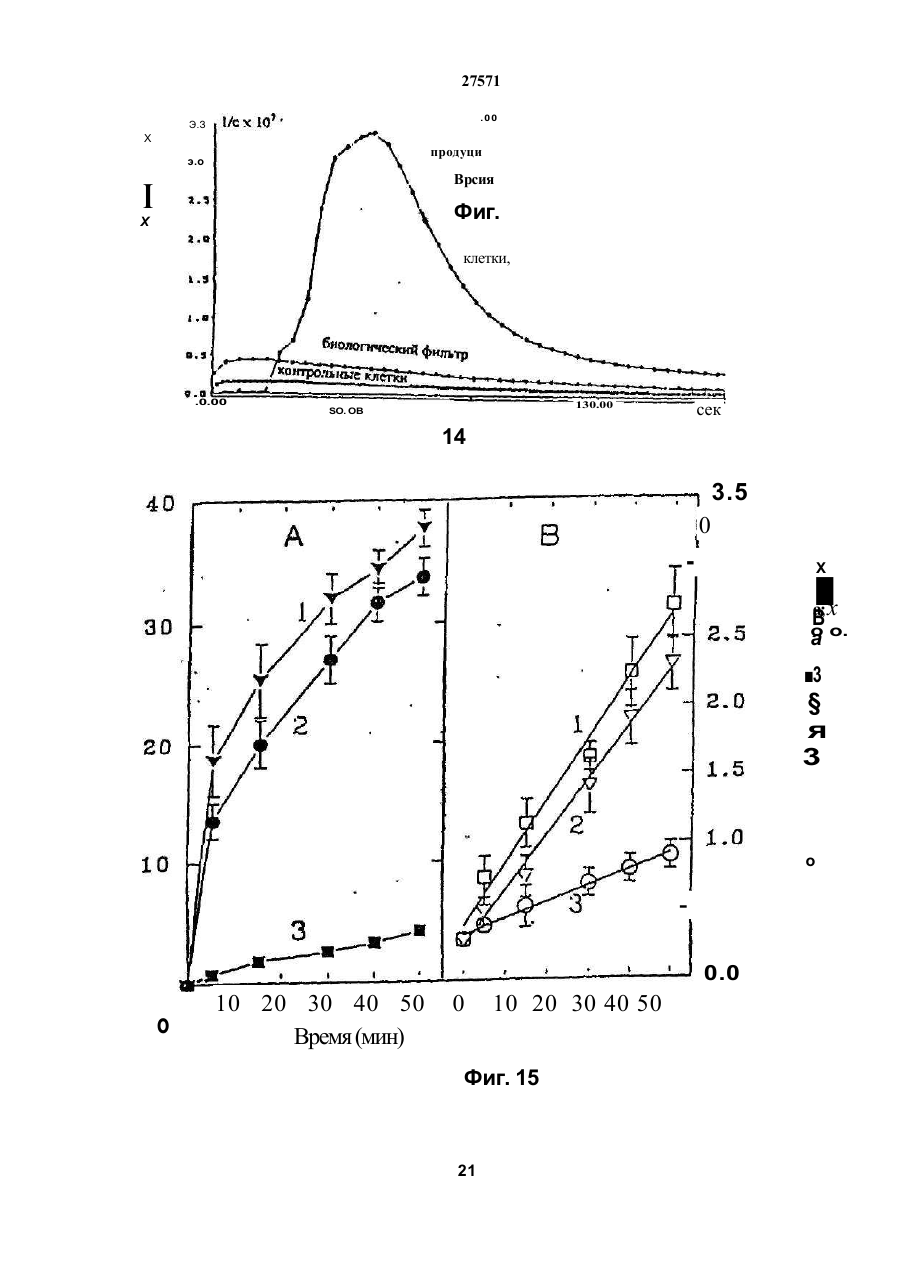
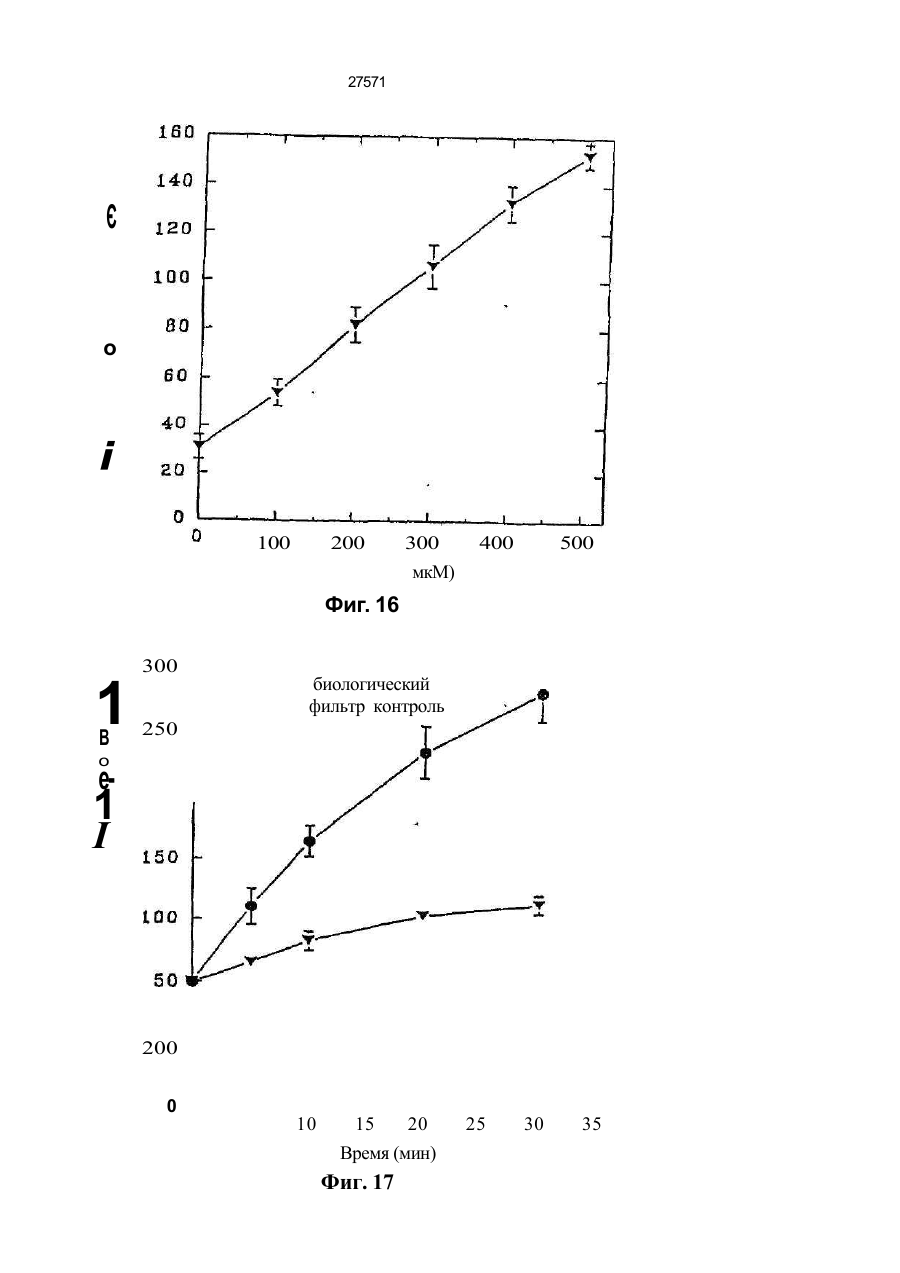
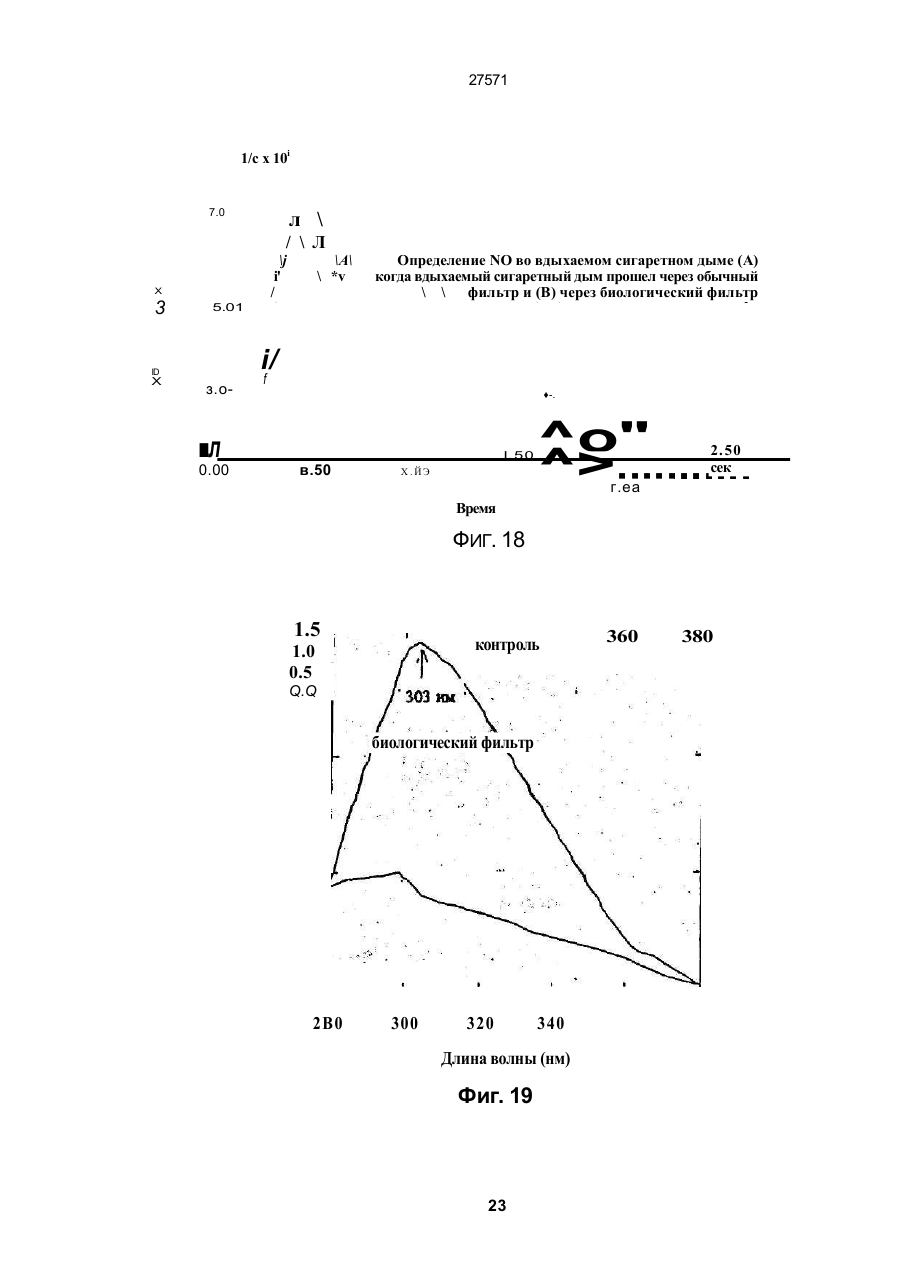
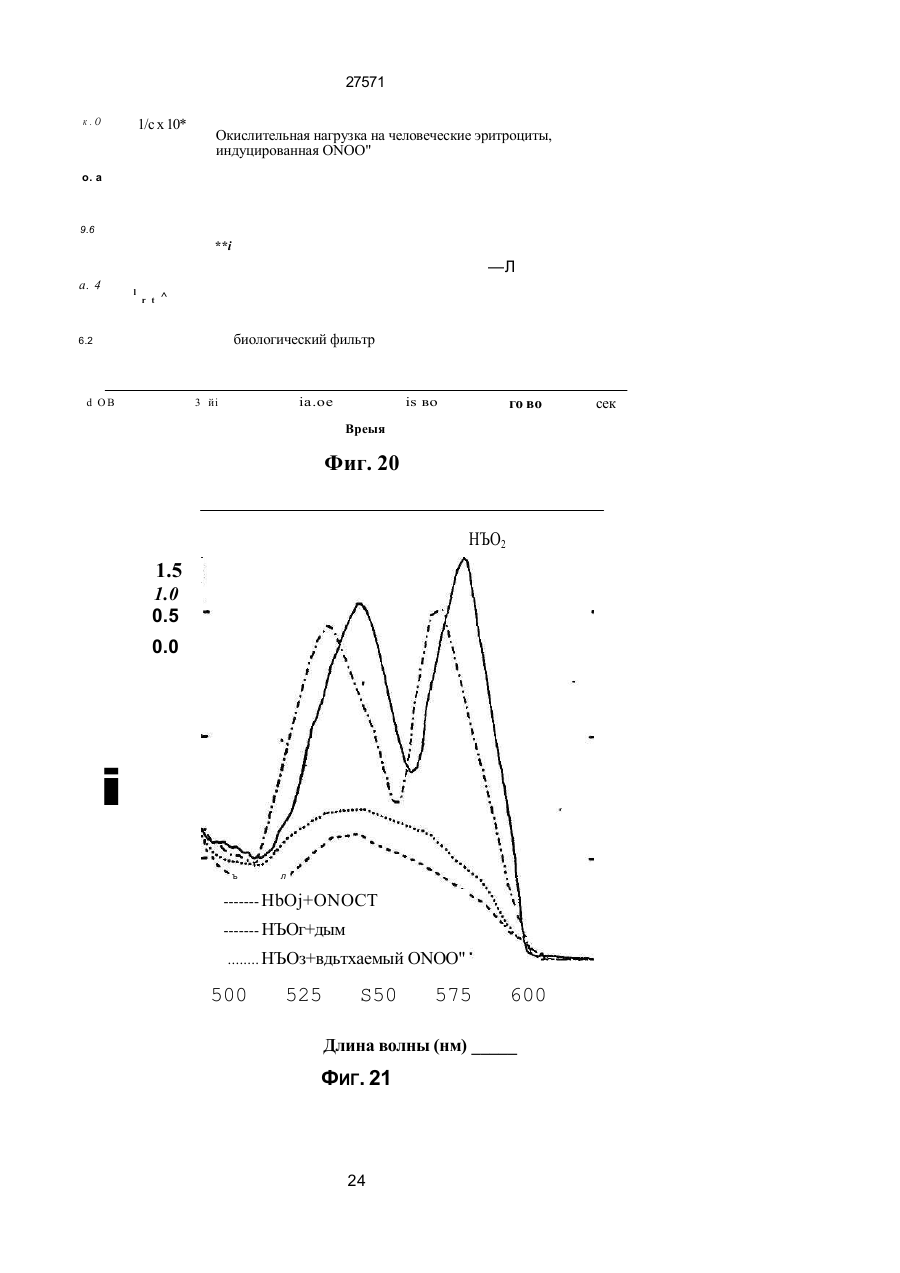
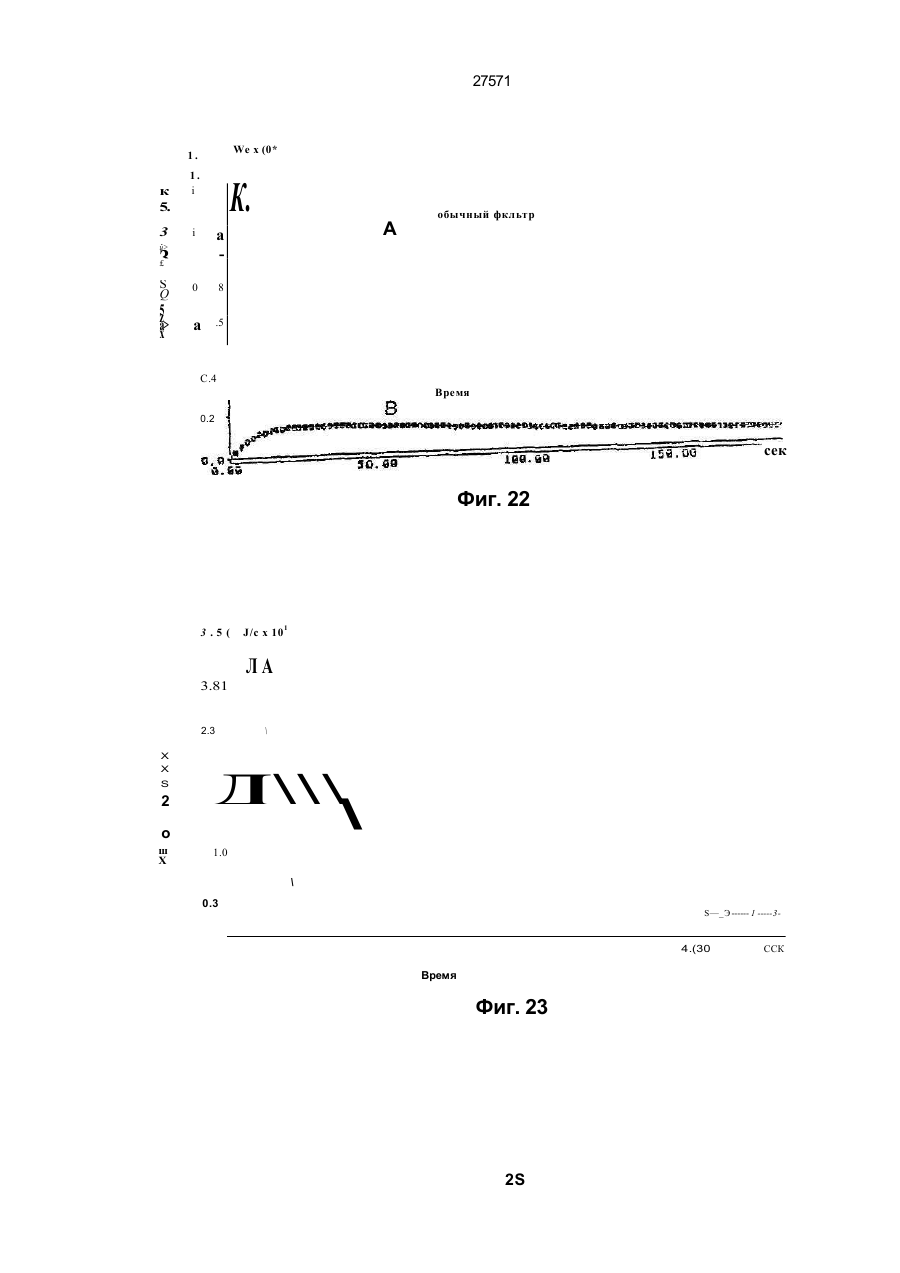
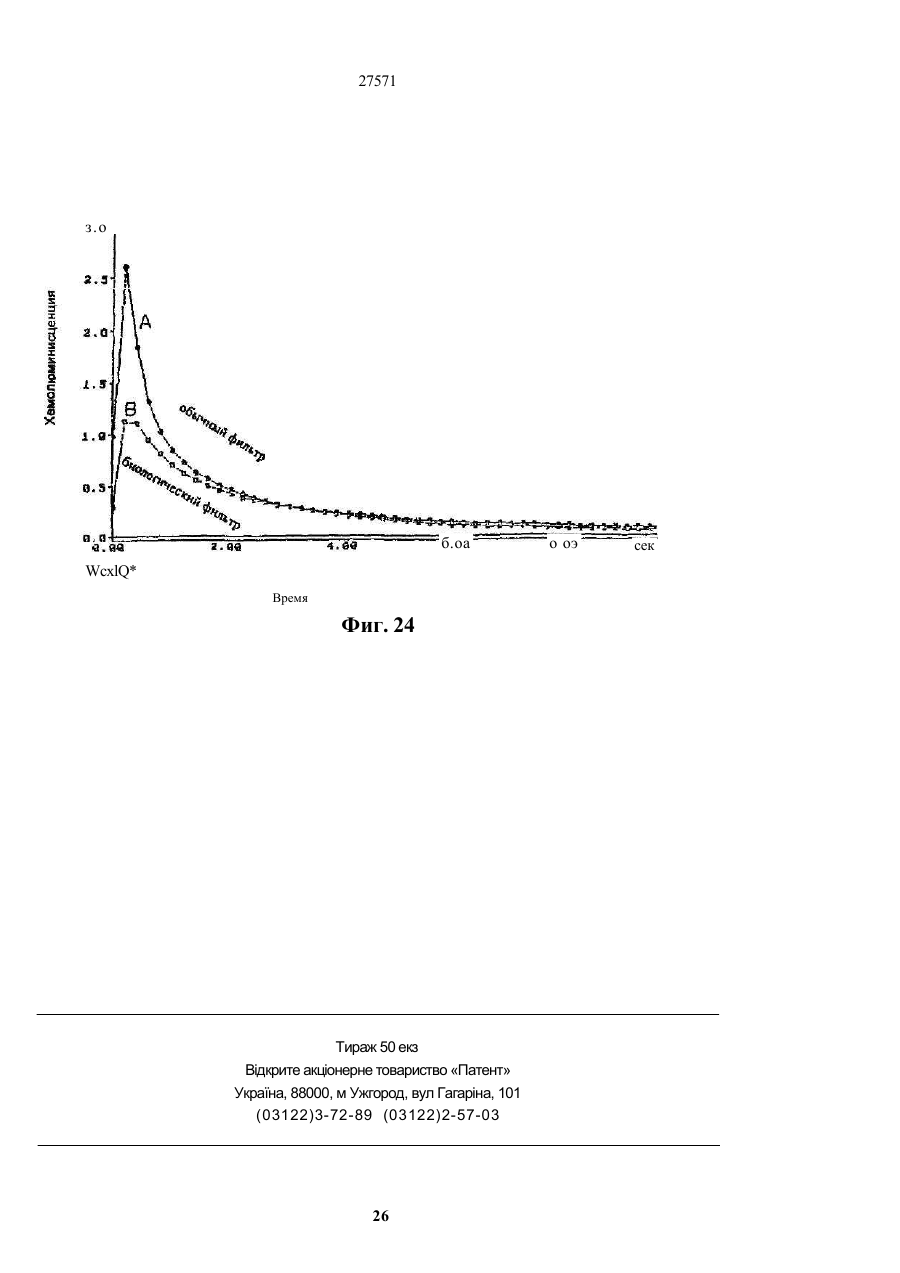
1. Фильтр для удаления вредных окислителей и канцерогенных летучих нитрозосоединений из табачного дыма, содержащий волокнистую матри цу, отличающийся тем, что волокнистая матрица обогащена биологическим веществом, выбранным из одного или нескольких веществ, содержащих железо, медь и/или магний, образующих ком плексные соединения с порфириновым кольцом, и железо стереоспецифически связанное в белко вых молекулах. 2. Фильтр по п.1, отличающийся тем, что он со держит активированный уголь, обогащенный био логическим веществом. 3. Фильтр по п.1 или 2, отличающийся тем, что упомянутая обогащенная волокнистая матрица при соединена встык к волокнистой матрице, которая не обогащена указанным биологическим веществом 4 Фильтр по любому из пп. 1-3, отличающийся тем, что биологическое вещество включает в себя гемоглобин и/или лизат эритроцитов. 5. Фильтр по любому из пп. 1-3, отличающийся тем, что биологическое вещество выбрано из ве ществ, содержащих ионы железа Fe2*, стереоспе цифически связанные с одним или несколькими такими материалами, как трансферрин, каталаза, протопорфирин, цитохром С и хлорофилл. 6. Фильтр по любому из пп. 1-5, отличающийся тем, что биологическое вещество находится в твердом состоянии. 7. Сигарета с фильтром, содержащая тонкостен ную цилиндрическую оболочку, по крайней мере частично заполненную табаком, и соосный с обо лочкой фильтр для удаления вредных окислите лей и канцерогенных летучих нитрозосоединений из табачного дыма, включающий волокнистую матрицу, отличающаяся тем, что волокнистая матрица фильтра обогащена биологическим веществом, выбранным из одного или нескольких веществ, содержащих железо, медь и/или магний, образующих комплексные соединения с порфириновым кольцом, и железо, стереоспецифически связанное в белковых молекулах. 8. Сигарета по п 7, отличающаяся тем, что фильтр выполнен по любому из пп 2 - 6. 9 Способ изготовления фильтра для удаления вредных окислителей и канцерогенных летучих нитрозосоединений из табачного дыма, включающий его формование из волокнистой матрицы, отличающийся тем, что фильтр пропитывают биологическим веществом, выбранным из одного или нескольких веществ, содержащих железо, медь и/или магний, образующих комплексные соединения с порфириновым кольцом, и железо, стереоспецифически связанное в белковых молекулах 10. Способ, по п. 9, отличающийся тем. что в фильтр вводят активированный уголь и пропиты вают фильтр, содержащий активированный уголь. 11. Способ пр п 9 или 10. отличающийся тем, что биологическое вещество включает е себя ге моглобин и/или лизат эритроцитов. 12 Способ по любому из пп 9-11, отличающийся тем, что биологическое вещество используют в виде раствора 1-Ю мг/мл в физиологическом растворе с фосфатным буфером, характеризующимся величиной рН 7,4. 13. Способ удаления вредных окислителей и кан церогенных летучих нитрозосоединений из табач ного дыма путем пропускания табачного дыма через фильтр, содержащий волокнистую матрицу, отличающийся тем, что перед пропусканием та бачного дыма через фильтр, волокнистую матрицу обогащают биологическим веществом, выбран ным из одного или нескольких веществ, содержа щих железо, медь и/или магний, образующих ком плексные соединения с порфириновым кольцом, и железо, стереоспецифически связанное в белко вых молекулах 14. Способ по п 13, отличающийся тем, что та бачный дым пропускают через фильтр, выполнен ный по любому из пп. 2-6. о in см 27571 Настоящее изобретение относится к предотвращению вдыхания вредных материалов, а именно, окислов азота, свободных радикалов, альдегидов, перекиси водорода, моноокиси углерода, микроэлементов и канцерогенных летучих нитрозосоединеиий, во время курения сигарет, то есть таких материалов, которые до настоящего времени неудовлетворительно задерживают применением обычных сигаретных фильтров. Во множестве публикаций, помещенных в международные журналы, высказывается предположение, что сигаретный дым разделяется на две фазы: а) твердая фаза (смола) и б) газовая фаза. Такое разделение производят с использованием типичного фильтра из кембриджского стекловолокна, который задерживает 99,9% частиц с размерами более 0.1 мкм. Смола сигаретного дыма содержит в исключительно высоких концентрациях очень стойкие свободные радикалы, которые можно классифицировать по меньшей мере на четыре различные категории. Частичные хиноны в равновесии с хиноном и гидроксихинонэми рассматривают как свободные радикалы, обладающие большинством интересных химических свойств. Хиноновая система восстанавливает молекулярный кислород с образованием высшего окисла (Оа~), который затем, при самопроизвольной дисмутации образуют перекись водорода (Н2О2). С каждой затяжкой в газовой фазе вдыхают более 10 органических радикалов с периодом полураспада менее 1с. Однако парадоксально то, что несмотря на столь незначительный период полураспада, такие радикалы в газовой фазе способны сохранять высокий уровень активности в течение более 10 мин. В самом деле, по мере приближения к снабженному фильтром концу сигареты концентрация этих радикалов значительно возрастает. Объяснение этому парадоксу следует искать в сохранении устойчивости ситуации благодаря непрерывному образованию свободных радикалов (Ргуог W.A., Stone К., Ann. N. Y. Acad. Sci 686:12-28, 1993). В газовой фазе сигаретного дыма самым важным свободным радикалом является окись азота (N0), которая в процессе курения принимает участие в последовательности реакций, в результате которой образуются двуокись азота, изопреновые радикалы, перекисные радикалы и алкоксильные радикалы. Сигаретный дым включает в себя также существенное число альдегидов, которые вносят свою лепту в его вредные токсические эффекты. Было показано, что незначительные количества альдегидов, экстрагированных из сигаретного дыма, вызывают как катаболизм белка, так и окисление тиоловых групп белков плазмы. Эти свойства, приписываемые альдегидам, являются результатом реакций между карбонильной группой альдегидов и -SH- и -NHa группами белков плазмы. Так, например, акролеин, содержащийся в сигаретном дыме, быстро реагирует с -SH группами с образованием карбонильных соединений (Alving К., Forhem С и Landberg J. М., Вг. J. Pharmacol. 110: 739746). В смоле сигаретного дыма находятся микроэлементы, например железо, медь, марганец и кадмий, которые вовлекаются во многие реакции с образованием свободных радикзпов и обуславливают образование очень активных вторичных радикалов (например, перекисных радикалов, алкоксирадикалов, высших окислов, цитотоксичных альдегидов и тому подобного). Попадание таких микроэлементов в легкие во время курения сигарет ведет к ряду окислительно-восстановительных реакций как в легочных жидкостях, так и в альвеолярных макрофагах, в результате чего образуются очень активные гидроксильные радикалы (ОН"). Эти гидроксильные радикалы образуются главным образом в присутствии железа вследствие реакции Фентона Медь также способна образовывать в легких гидроксильные радикалы благодаря реакции с перекисью водорода. В низких концентрациях (10' 7 М) марганец усиливает деятельность растворимой гуанилатциклазы эндотелиальных клеток легкого, вызывая образование окиси азота и высшего окисла благодаря механизму позитивной ответной реакции (Youn Y.K, Lalonde С. и Demling R., Free Rad. Biol. Med. 12: 409-415. 1992). Во время сгорания табака образуется моноокись углерода. Некоторое количество моноокиси углерода задерживается в легких даже после выдоха, что приводит к усилению деятельности растворимой гуанилатциклазы после ее взаимодействия с гемовым остатком энзимов эндотелиальных клеток и других клеток легочной ткани Повышенное содержание циклического ГМФ внутри клеток в сочетании с механизмом позитивной ответной реакции усиливает образование окиси азота и высшего окисла (Watson A., Joyce H., Hopper L, и Pride N.B., Thorax 48: 119-124, 1993). Газообразная окись азота, которая может продуцироваться клетками многих типов, включая сюда зндотепиальные клетки сосудов и сетчатые эндотелиальные клетки, вызывает расслабление гладкой мышцы (Lowenstetn С. J., Dinerman J.L., Snyder S.H., Ann. Intern. Med. 120: 227-237, 1994). Существуют также экзогенные источники окиси азота, которые аналогично'вышеуказанным считают ответственными за повреждение кровеносных сосудов и других тканей. Было с уверенностью установлено, что вторичные и третичные амины способны вступать в реакцию с нитритом и другими агентами нитрозирования с образованием Nнитроэоаминов (Lowenstein С. X, Dinerman J.L., Snyder S.H., Ann. Intern. Med. 120: 227-237, 1994). С 1974 г. результаты ряда исследований продемонстрировали, что во время сбора урожая, обработки табака и курения алкалоиды подвергаются нитрозированию до специфических для табака Nнитрозаминов ЇСТНА). Из идентифицированных в табаке и/или его дыме СТНА N-нитрозононикотин (NHH), 4-(метилнитрозамино)-1-{3-пиридил)-1-бутанон (НПБ) и 4-(метилнитрозамино)-1-(3-пиридил)1-бутанол (НАПБ) являются сильными канцерогенами для животных NHH индуцирует образование опухоли легких у мышей, опухоли трахей у хомяков и опухолей носовой полости и пищевода у крыс. НПБ индуцирует новообразования в легких у мышей, хомяков и крыс, а также новообразования в печени, носовой полости и поджелудочной железе у крыс. Тампонада слизистой оболочки рта с использованием смеси NHH и НПБ вызывает у 27571 крыс образование опухолей в полости рта и легких. Типичное количество как НРБ, так и NHH у большинства сигарет составляет 200 нг/сигарету (Hecht S S., Spratt Т.Е. и Trushin N Carctnogenesis, 9: 161-165, 1938) Проведенное авторами изобретения в настоящее время исследование, касающееся влияния сигаретного дыма на легочную ткань, позволило установить, что окись азота вступает в реакцию с высшим окислом с образованием радикала пероксинитрита {ONOO") с сильной окислительной способностью, который вызывает в ключевых биомолекулах вторичные вредоносные реакции Как метаболическое, так и поражающее действие окиси азота иа клетки было изучено в лаборатории авторов изобретения in vitro и в экспериментах с живыми существами. Окись азота в присутствии кислорода окисляется до двуокиси аэота (NOz) Скорость такого окисления зависит от концентрации кислорода и квадрата концентрации окиси азота. Цитотоксичность двуокиси аэота очевидна, а в водных растворах она превращается в нитрит и нитрат. Более того, окись аэота образует с микроэлементами и/или металлобелками, например с гемоглобином, комплексы (Wink D.A., Derbyshire J.F., Nims R.W., Saavedra J.E. и Ford P.E., Chem. Res. ToxicoL, 6: 23-27, 1993). Токсичность высших окислов некоторых типов объясняется тем, что окись азота реагирует с этими высшими окислами с образованием вредного соединения ONOO'. ONOO" является необычайно стойким соединением, принимая во внимание его сильный окислительный потенциал (+1,4В). В процессе его разложения оно образует сильноокислительные производные, включая сюда гидроксильную группу, двуокись аэота и нитрониевый ион. Таким образом, любая модификация в процессе образования тканями окиси азота и высшего окисла может привести к образованию вторичных сильноокислительных радикалов (Delikonstantinos, G; Villiotou, V., Stavrides, J.C., Cancer Мої. Bid. 1: 77-86, 1994). Наконец ONOO' и его сложные эфиры (RO-ONO или RO-ONO2) проявляют тенденцию к инактивации ингибитора альфа1-протеинаэы (Иа1П). Это может быть подтверждено тем фактом, что: а) одна перекись водорода не вызывает быстрой инактивации Иа1П, но действует только в присутствии окиси азота, в результате чего образуется ONOO" и происходит быстрая инактивация Иа1П, б) растворы трет, бутилпероксинитрила (RO-O-O-NO2) или ONOO" сам вызывает инактивацию Иа1П и е) амины и аминокислоты защищают ИаіП-протеиназу от быстрой инактивации (Moreno, J J. и Ргуог, W.A., Chem Res. Toxicol., 5: 425-431, 1992). Помимо свободных радикалов, содержащихся в сигаретном дыму, активированные альвеолярные макрофаги составляют другой важный источник продуцирования курильщиками свободных радикалов. Альвеолярные макрофаги, активированные сигаретным дымом, испытывают респираторный импульс, что приводит к увеличению образования кислородсодержащих свободных радикалов (главным образом О2', NO и НгОг)- У курильщиков, повидимому, имеется увеличенное число как альвеолярных макрофагов, так и циркулирующих ней трофилоа Кислородсодержащие свободные радикалы сигаретного ДЫУЗ также участвуют э развитии рака легких Вдыхаемый сигаретный дым оказывает на легочные клетки усиленную окислительную нагрузку, приводящую к снижению концентрации внутриклеточных антиоксидантов. Через образование гидроксильных групп перекись водорода вступает в реакцию с ДНК клеток и вызывает разрыв двойной нити Поскольку этот разрыв может быть предотвращен присоединением каталаэы, это косвенно подтверждает повреждающее действие перекиси водорода и гидроксильных групп на клеточную ДНК (Leanderson, P., Ann. N.Y. Acad. Sci. 686. 249-261, 1993). Более того, перекись водорода способна вызывать преобразования в трахейном эпителии легкого, и с ней связано развитие бронхогенной карциномы у курильщиков Таким образом, вредная для здоровья роль перекиси водорода (содержащейся в сигаретном дыму), которую она играет в легочных клетках и в развитии рака легких занимает прочное положение в сознании. Смола сигаретного дыма содержит как семихиноновые радикалы, так и железо, образующие, таким образом, систему для продуцирования гидроксильных радикалов. Различные микроэлементы, содержащиеся в смоле сигаретного дыма (железо, медь, марганец, кадмий) могут оказывать как внутриклеточное, так и внеклеточное действие Fe?* в ходе протекания хорошо известной реакции Фентона 2+ Fe + Н2Ог FeJ + ОН + ОН" благодаря гидроксильным группам вызывает множество окислительных реакций. Аналогичным образом продуцирование гидроксильной группы может быть достигнуто посредством Cd3*. Mn2+ является характерным стимулятором активности растворимой гуанилатциклазы. Содержащийся в сигаретном дыму Cd'* исключительно токсичен для легких. Курильщики содержат в своих легких Cd2+ в концентрации, которая, по-видимому, вдвое превышает обычную. Полагают, что Cd2* вытесняет Zn2*, который в обычном состоянии присутствует а эндотелии легочных сосудов (Kostial, К., в работе "Trace Elements in Human and Animal Nutrition" (под редакцией W. Mertz , издание пятое, том 2: 319345, издательство Academic Press, Inc., Орландо, штат Флорида, 1986). Альдегиды, содержащиеся в сигаретном дыму, вступают в реакцию с группами -SH и -NH2 белков, становясь в конечном итоге инертными. Кротоновый альдегид (а, (Іненасыщенный альдегид), содержащийся в сигаретном дыму, снижает концентрацию -SH групп и , повышает концентрацию карбонилсодержащих белков (Stadtman, E.R., Science 257:1220-1224, 1991). Сегодня применение сигаретных фильтров настоятельно рекомендуется. Первичной целью добавления фильтров к сигаретам является достижение максимальной степени задержания вредных соединений, присутствующих как в газовой, так и твердой фазах сигаретного дыма. Эпидемиологическое изучение курильщиков показало, что независимо от того, вводили ли сигаретный дым в организм в газовой фазе, твердой фазе или в комбинированной фазе, наблюдалась завися 27571 щая от дозы реакция (Surgeon General of the U. S. Public Health Service. The health consequences of using smokeless tobacco, N. H. Pub/. № 86: 2874, Бетезда, штат Мэриленд, 1986г.) Было доказано, что уже сама по себе модификация сигареты является практическим шагом к решению проблемы снижения содержания вредных соединений в сигаретном дыму. Этого первоначально достигали с использованием обычных фильтров, а затем изменением состава табака в процессе химической обработки. В процесс изготовления сигарет изменения были также внесены с использованием пористой бумаги или бумаги, изготовленной из табачных листьев. За последние 15 лет было сделано множество попыток сделать курение менее вредным для здоровья путем уменьшения количества дыма на сигарету, изменения диаметра сигареты и применения перфорированных фильтров Перфорированные фильтры позволяют разбавлять сигаретный дым воздухом в степени, достигающей 50%. В сочетании с перфорированными фильтрами используют также активированный уголь. Это содействует резкому снижению содержания в дыме смолы и никотина. К таким техническим приемам прибегают, в частности, в таких промышленно развитых странах, как Австрия, Канада, Франция, Германия, Швеция, Англия и США. Средний выход смолы и никотина в дыму американской сигареты был снижен соответственно с 38 и 2,7 мг в 1955г. до 13 и 1 мг в 1991 г В странах Европейского сообщества эта тенденция к снижению выхода смолы и никотина в сигаретном дыму все еще продолжается. В январе 1993 г. верхний допустимый предел для смолы составлял 15 мг, а к началу января 1998 г. он должен быть снижен до 12 мг. Тем не менее в других странах выход смолы в сигаретном дыму составляет г2 мг (Mitacek, E. J., Brunneman, K.D., Pollednak. A P., Hoffman, D. и Suttajit, M., Prev. Med. 20: 764-773, 1993). Изменения, внесенные в процесс изготовления сигарет, привели к удалению из сигаретного дыма некоторых конкретных токсических веществ; более конкретно были внедрены фильтры из ацетата целлюлозы, что обеспечило, таким образом, частичное удаление полулетучих фенолов и летучих N-нитроэаминов (Brunnemann, K.D., Hoffman, d , Recent. Adv. Tobacco Res. 17: 71-112, 1989). Количество моноокиси углерода селективно снижают применением перфорированных фильтров. Концентрацию канцерогенных полициклических ароматических углеводородов (ПАУ) селективно снизили использованием табака, обогащенного нитритом. Однако снижение ПАУ е табаке с использованием высоких концентраций нитрита привело к нежелательному повышению концентрации канцерогенных N-. нитрозаминов, поэтому оказалось необходимым уменьшать содержание ПАУ другими средствами (Hoffman, D., Hoffman. L, Wynder, E. 1., Lung Cancer and the Changing Cigarette in Relevance to Human Cancer of N-Nitroso-cornpounds, Tobacco Smoke and Mycotoxins. (под редакцией O'Neil, I.K., Chen, J. и Bartsch, H ), том 105:449-459,1991r.) Из вышеизложенного ясно, что существует необходимость в создании фильтра, способного "задерживать вредные окислы азота, свободные радикалы, перекись водорода, альдегиды и кан церогенные нитрозосоединения, которые ответственны за вредные эффекты сигаретного дыма на дыхательную и сердечнососудистую системы. Для идентификации вредных соединений, содержащихся в сигаретном дыму, авторы изобретения провели химические и биологические эксперименты. Проведенные химические эксперименты включает в себя следующее; а) Идентификация и количественное опре деление N0 и NOx с помощью нового химического и биологического метода (этот метод был разработан в лаборатории авторов изобретения). б) Идентификация свободных радикалов с применением методов хемолюминесценции в за висимости от люцигенина. в) Идентификация альдегидов и хинона пу тем стимулирования энзиматичегкой системы люциферин-люциферазы (этот метод также был разработан в лаборатории авторов изобретения). г) Идентификация и количественное опре деление микроэлементов с применением метода окисления люциферина люциферазой в присутст вии АТФ (этот метод был разработан в лаборато рии авторов изобретения). д) Идентификация и количественное опре деление перекиси водорода с использованием метода хемолюминесценции в зависимости от изолюминолмикропероксидазы. е) Идентификация и количественное опре деление ONOO" спектрофотометрическим анали зом и по методу усиленной люминолом хемолю минесценции. ж) Идентификация канцерогенного нитрозо соединения усиленной пюминолом хемолюминесценции Проведенные биологические эксперименты охватывают следующее: а) Идентификация окиси азота с использо ванием изолированной активности растворимой гуанилатциклэзы в качестве функционального параметра. б) Идентификация ONOO" путем расчета окислительной нагрузки на эритроциты человека, вызванной ONOO*. в) Идентификация моноокиси углерода с ис пользованием изолированной активности раство римой гуанилатциклазы в качестве функциональ ного параметра. Более того, авторы изобретения в лабораторных условиях провели нижеследующие эксперименты: з) Изоляция альвеолярных макрофагов из легких крыс. б) Расчет окислительной нагрузки на альве олярные макрофаги, индуцированной гидропере кисью трет.бутила (ГПтБ). в) Определение NO/ N02*/ONOO\ продуци рованных альвеолярными макрофагами. г) Определение перекиси водорода, проду цированной альвеолярными макрофагами. д) Влияние экзогенной перекиси водорода на продуцирование окиси азота альвеолярными макрофагами На добровольцах провели эксперименты in vivo для определения нижеследующих соединений: а) Определение окиси азота а воздухе, выдыхаемом обычными людьми. 27571 б) Определение окиси азота в воздухе, вы дыхаемом курильщиками. в) Определение окиси азота а выдыхаемом сигаретном дыму. г) Определение ONOO" в выдыхаемом сига ретном дыму. д) Определение свободных радикалов в вы дыхаемом сигаретном дыму. е) Определение альдегидов в выдыхаемом сигаретном дыму. Для определения NO, NOx, а) содержавшихся в сигаретном дыму, б) выделенных альвеолярными макрофагами после введения сигаретного дыма и в) содержавшихся в сигаретном дыму, выдыхаемом добровольцами, авторами изобретения была сконструирована и изготовлена камера диаметром от 2,5 см, образованная твердыми Стержнями из прозрачного плексигласа, с одного конца каждого из которых на механическом токарном станке выполнили отверстия для создания идентичных конических полостей в каждом из таких плексигласовых стержней Далее их открытые концы подвергали дополнительной механической обработке и полировке, выполнив соединение между сопряженными коническими элементами, которое позволяло очень плотно подгонять и соединять друг с другом обе конические попости. Между соединяемыми элементами в качестве прокладки проложили квадрат из тонкого листового тефлона (политетрафторэтилена толщиной 0,0015 дюйма, 0,038 мм), после чего элементы прижали друг к другу с помощью винтоа с накатанными головками По две трубчатые детали, обеспечивающие доступ с любой из сторон мембраны, позволяли в ходе протекания биологических реакций вводить внутрь, извлекать или модифицировать с любой из сторон мембраны биологически активные образцы и реакционноспособные вещества, А. Определение окиси азота хемопюминесценцией. В соответствии с литературными рекомендациями (Delikonstantmos. G'., Villiotou, V., Fassitsas, С, (1992) J. Cardiovasc. Pharmacol. 12, S63- S65) и (Delikonstantinos, G., Vitliotou, V., Stavndes, J.C., (1994) в работе "Biology of Nitric Oxide", под редакцией Feelisch M., Busse, R,. Moncada, S., Portland Press, в печати) готовили стандартный раствор окиси азота. Реакционный раствор содержал сбалансированный солевой раствор Хэнка (ССРХ) с величиной рН 7,3; 500 м:сМ перекиси водорода; 30 мкМ люминола, а его общий объем составлял 500 мкл. Содержимое склянки подвергали интенсивному перемешиванию, а выделявшийся материал фиксирова ли с помощь ю люминометра Bedrthotd AutoLumat LB953. Б. Химическое определение NO/NO2'. Химическое определение окиси азота было основано на диазолизации сульфаноламида окисью азота при кислой величине рН и последующем окислении скополетина, которое может быть определено флуорометрическим путем согласно описанному выше (Delikonstantinos, G., Villiolou, V., Fassitsas, С,(1992) J. Cardiovasc. Pharmacol. 12, S63-S65,1992). Альвеолярные макрофаги s ССРХ (no 10Б клеток/мл) смешивали со 1О0 мкл реаген та, который состоял из 20% сульфаниламида в 20% ортофосфорной кислоты и 25 мкМ скополетина. За затуханием флуоресценции следили при комнатной температуре (22°С) с помощью спектрофотометра флуоресценции Aminco SPF-500. За флуоресценцией следили непрерывно в течение всего времени до тех пор, пока можно было измерять тангенс угла наклона линии (приблизительно 8 мин). Далее результаты измерения тангенса угла наклона трансформировали в нмоли окиси азота с помощью стандартной кривой, построенной для различных концентраций чистой окиси азота Нитрит (NOj), конечный продукт синтеза окиси азота определяли на основе его накопления в супернатантах культивированных клеток по его реакции с реактивом Грисса. 8. Спектроскопическое определение пероксинитрита ONOO". ONOO" синтезировали, титровали и хранили в соответствии с ранее описанным (Delikonstantinos, G . Villiotou, V , Stavrides, J.C., (1994) в работе "Biology of Nitric Oxide", под редакцией Feelisch M, Busse, R,. Moncada, S., Portland Press, в печати). Вследствие нестабильности ONOO" при величине рН 7,4 УФ-спектрограмму фиксировали непосредственно после смещения перекиси водорода с раствором окиси азота. Концентрацию ONOO" определяли на основе величины эпсилон-302 нм для 1670 М"1 см1. УФ-спектрограмма показана после вычитания базальной УФ-спектрограммы для соответствующих концентраций перекиси водорода. Г. Расчет свободных радикалов. Расчет свободных радикалов производили с использованием хемолюминесценции, индуцированной люцигенином/ДАМЦО (1,4-диазадицикло(2,2,2)-октаном в соответствии с ранее изложенным (Delikonstantinos, G , Krueger, G.R.F., J. Viral Dis., 1: 22-27, 1993). Реакционная смесь содержала ССРХ с величиной рН 74; 30 мкМ люцигенина; •100 мкМ ДАМЦО. Содержимое склянки подвергали интенсивному перемешиванию, а выделявшийся материал фиксировали с помощью люминометра Bedrthold AutoLumat. Использовали поглотители кислородсодержащих свободных радикалов (ПОД.'маннит, гистидин, метионин). Д Расчет микроэлементов и альдегидов. Испытания были основаны на катализируемом люциферазой окислении D-люциферина в присутствии АТФ-магниевой соли в соответствии со схемой реакции г Ш2+АТФМд гО 2 О 2 люцифераза оксилюциферин + АТФ + +О2+ неорганический пирофосфат+ + Мд2 + свет Микроэлементы Cda\ Cu2*, Fea* повышают активность люциферазы. и максимальная хемолюминесцентная реакция возрастает пропорционально концентрации микроэлементов вплоть до 10 мкг. Такие реакции проводят в ССРХ с величиной рН 7,4 при общем объеме 0,5 мл. Для расчета альдетдов использовали ту же энзиматическую систему люциферин/люцифераза, но без АТФ Альдегиды вступают в реакцию с этой энзим этической системой, производя хемолюминесценцию в отсутствии АТФ, Используемые 27571 реактивы брали из комплекта для АТФ анализа (Calbiochem-Novabiochem CA, U.S.A.). Ё. Изолирование альвеолярных макрофагов. Вкратце, крыс убивали внутривенной инъекцией пентобарбитала натрия, вскрывали грудную клетку, легкие перфузировали для освобождения от крови свободным от Са2* холодным (4вС) физиологическим раствором, содержавшем фосфатный буфер (РФБ: рН -7,4), и удаляли в неповрежденном виде из полости грудной клетки. Повторным извлечением ткани через шприц и затем ее пропусканием через установленные последовательно, в порядке уменьшения размера ячеек, сетки из нержавеющей стали с числом отверстий на дюйм соответственно 32, 62 и 68 в условиях постоянного потока сбалансированного солевого раствора Фиикелылтейна (ССРФ; с величиной рН 7,4) готовили гомогенат легкого крысы. Конечную суспензию альвеолярных макрофагов отстаивали, фильтровали и центрифугировали при 300 g в течение 10 мин до образования в пробирке осадка клеток. Осадок из клеток, который содержал более 98% макрофагов, промывали и повторно суспендировали в растворе Рингера. Далее эту процедуру повторяли дважды На каждую крысу приходилось приблизительно по 10 х 10fl изолированных макрофагов. Жизнеспособность определяли по методу исключения с трипаном голубым. Ж. Идентификация нитрозосоединений. Нитрозосоединения идентифицировали по медленному выделению окиси азота (N0) после их обработки перекисью водорода. Реакционный раствор содержал 1 мкМ диметилнитрозамина и/или диэтилнитрозамина; 500 мкМ перекиси водорода; 30 мкМ люминола в ССРХ при величине рН 7,4, а его общий объем составлял 0,5 мл. Содержимое склянки подвергали интенсивному перемешиванию, а выделявшийся материал фикси- . ровали с помощью люминометра Bedrthold Auto Lumat LB953. Для идентификации образования ONOO" использовали 100 мМ маннита; 100 мМ ДМСО и 3,0 мМ цистеина. 3. Изолирование альвеолярных макрофагов. Вкратце, крыс убивали внутривенной инъекцией пентобарбитала натрия, вскрывали грудную клетку, легкие лерфузировали для освобождения от крови свободным от Са холодным (4°С) физиологическим раствором, содержавшем фосфатный буфер (РФБ; рН - 7,4), и удаляли в неповрежденном виде из полости грудной клетки. Повторным извлечением ткани через шприц и затем ее пропусканием через установленные последовательно, в порядке уменьшения размера ячеек, сетки из нержавеющей стали с числом отверстий на дюйм соответственно 32, 62 и 68 в условиях постоянного потока сбалансированного солевого раствора Финкелыптейна (ССРФ; с величиной рН 7,4) готовили гомогенат легкого крысы. Конечную суспензию альвеолярных макрофагов отстаивали, фильтровали и центрифугировали при 300 g в течение 10 мин до образования в пробирке осадка клеток. Осадок из клеток, который содержал более 98% макрофагов, промывали и повторно суспендировали в растворе Рингера. Далее эту процедуру повторяли дважды. На каждую крысу приходилось приблизительно по 10 х 10е изолированных макрофагов. Жизнеспо собность определяли по методу исключения с трипаном голубым. И. Окислительная нагрузка на альвеолярные макрофаги, индуцированная гидроперекисью трет, бутила (ГПтБ). Продуцирование кислородсодержащих свободных радикалов альвеолярными макрофагами, индуцированное 2,5 мМ ГПтБ, определяли с использованием метода люминольной хемолюминесценции Хемолюминесцентную реакцию фиксировали с помощью люминометра Bedrthold AutoLumat LB953 согласно изложенному ранее (Detikonstantinos, G., Krueger, G.R F., J. Viral Dis.. 1: 22-27,1993). К. Определение перекиси водорода (Н2О2). Готовили изолюминол/микропероксидазную смесь (100 нМ бората натрия, 1 мМ чзолюминола. 0,01 мМ микропероксидазы в 70% воды и 30% метанола при величине рН 8). 50 мкл этого реактива смешивали с изолированными альвеолярными макрофагами (106 клеток) в ССРХ при общем объеме 0,5 мл, Данные хемолюминесцентной реакции конвертировали в нмоли перекиси водорода с использованием стандартной кривой, построенной для различных концентраций чистой перекиси водорода. Л Получение и очистка растворимой гуанилатциклазы (рГЦ) для определения моноокиси углерода. рГЦ из эндотелиальных клеток человека очищали ГТФ-агарозной хроматографией. Цитозоли (10 мг белка) вводили в ГТФ-агароэную колонку (1.8 х 9 см) после предварительного приведения в состояние равновесия 25 мМ трис-НСІ буфером с величиной рН 7,6, содержащим 250 мМ сахарозы и 10 мМ MnCfe. Затем рГЦ элюировзли из колонки 5 мл уравновешивающего буфера плюс 10 мМ ГТФ. М. Определение циклического ГМФ. Концентрацию цГМФ определяли радиоиммунным анализом после ацетилирования образцов уксусным ангидридом изложенным (Delikonstantinos, G., и Kopeikina, L, Anticancer Res. 9: 753760, 1989). Реакционная смесь содержала 50 мМ триэтаноламина/HCl, 5 мМ креатинфосфата; 3 мМ хлорида магния; 1 мМ иэобутилметилксатина; 0,6 ед. креатинкиназы; 1 мМ ГТФ и растворимую гуанилатциклазу (1 мкг белка) при общем объеме 150 мкл. Добавлением ГТФ инициировали реакции и инкубировали 10 мин при 37"С. Питательную среду аспирировали и цГМФ экстрагировали добавлением охлажденной льдом 0.1М соляной кислоты. По истечении 10 мин образцы переносили в новую чашку Петри, сушили и для определения цГПФ вновь восстанавливали влагосодержание добавлением 5 мМ ацетата натрия (при величине рН 4,75). Образовавшуюся цГМФ определяли с использованием комплекта для цГМФ анализа (Amersham). Известен фильтр, содержащий волокнистую матрицу из пористого фильтрующего материала, который свернут в короткий стержень и сигарета с фильтром, содержащая соосную ему, тонкостенную цилиндрическую оболочку частично заполненную табаком, и фильтр для удаление вредных окислителей и канцерогенных летучих нитрозосоединений и* табачного дыма, включающий во 27571 локнистую матрицу ( см патент США № 5927287 от 30 05 1997г) Применение упомянутых фильтров содействует снижению уровня смол, никотина и частичному удалению из табачного дыма других вредных веществ Однако они не обеспечивают необходимый уровень очистки табачного дыма от вредных окислителей и канцерогенных летучих нитрозосоединений. Известен способ изготовления фильтра, который включает его формование из волокнистой матрицы, например, путем скручивания пористого листового волокнистого материала в короткий с т ер ж ен ь ( с м п а т е н т C L J A № 5 9 2 7 2 8 7 о т 30 05 1997г) Из практики и этого патента известен также способ удаления вредных окислителей и канцерогенных летучих нитрозосоединений из табачного дыма, который заключается в том, что табачный дым пропускают через фильтр, содержащий волокнистую матрицу Недостатком является то, что не обеспечивается получение фильтра, в котором достигается необходимый уровень очистки табачного дыма от вредных окислителей и канцерогенных летучих нитрозосоединений В основу настоящего изобретения поставлена задача разработать конструкцию фильтра, сигареты с фильтром, а также способ изготовления фильтра и способ удаление вредных окислителей и канцерогенных летучих нитрозосоединений из табачного дыма при осуществлении которых используют биологические вещества, вступающие э специфические реакции и обеспечивающие поглощение нижеследующих материалов а) NO и NOx, б) моноокиси углерода, , в) перекиси водорода, г) свободных радикалов, д) альдегидо-хинонов, е) канцерогенных нитрозосоединений, и ж) задерживающие микроэлементы кадмий, медь, марганец, железо и тому подобное, которые вдыхают при курении Поставленная задача решается тем, что в известном фильтре для удаления вредных окислителей и канцерогенных летучих нитрозосоединений из табачного дыма, содержащий волокнистую матрицу, указанная волокнистая матрица обогащена биологическим веществом, выбранным из одного или нескольких веществ, содержащих железо, медь и/или магний, образующих комплексные соединения с порфириновым кольцом, и железо, стереоспецифически связанное в белковых молекулах Предпочтительно, фильтр содержит активированный уголь, обогащенный биологическим веществом При этом упомянутая обогащенная волокнистая матрица может быть присоединена встык к волокнистой матрице, которая не обогащена указанным биологическим веществом Целесообразно, если биологическое вещество включает в себя гемоглобин и/или лизат эритроцитов Биологическое вещество предпочтительно выбрано из веществ, содержащих ионы железа Fe + стереоспецифически связанные с одним или несколькими такими материалами, как трансферрин, каталаза, протопорфирин. цитохром С и хло рофилл * Биологическое вещество может находиться в твердом состоянии Для решения поставленной задачи сигарета содержит тонкостенную цилиндрическую оболочку частично заполненную табаком, и соосный с оболочкой фильтр включающий волокнистую матрицу, обогащенную биологическим веществом, выбранным из одного или нескольких веществ, содержащих железо, медь и/или магний, образующих комплексные соединения с порфириновым кольцом, и железо стереоспецифически связанное в белковых молекулах При этом сигарета может содержать фильтр с активированным углем, обогащенный биологическим веществом Целесообразно, если в сигарете упомянутая обогащенная волокнистая матрица присоединена в стык к волокнистой матрице, которая не обогащена указанным биологическим веществом Причем биологическое вещество в упомянутой сигарете с фильтром может включать в себя гемоглобин и/или лизат эритроцитов. Кроме того, биологическое вещество целесообразно выбирать из ионов железа Fe2*, стереоспецифичесри связанных с одним или несколькими такими материалами, как трансферрин, каталаза, протопорфирин, цитохром С и хлорофилл Упомянутое биологическое вещество может находиться а сигарете в твердом состоянии Поставленная задача решается также тем, что способ изготовления фильтра для удаления вредных окислителей и канцерогенных летучих нитрозосоединений из табачного дыма, включает его формование из волокнистой матрицы, а фильтр содержащий волокнистую матрицу пропитывают биологическим веществом, выбранным из ! одного или нескольких веществ, содержащих же- ' лезо, медь и/или магний, образующих комплексные соединения с порфириновым кольцом, и железо стереоспецифически связанное в белковых молекулах Предпочтительно, пропитывают фильтр, содержащий активированный уголь В качестве биологического вещества предпочтительно используют гемоглобин и/или пизат > эритроцитов, при этом оно может быть в виде рас( твора 1-10 мі/мл s физиологическом растворе с s фосфатным буфером, характеризующимся величиной рН 7,4 Кроме того, поставленная задача решается тем, что в способе удаления вредных окислителей и канцерогенных летучих нитрозосоединений из та бачного дыма перед пропусканием табачного дыма через фильтр, волокнистую матрицу обогащают биологическим веществом, выбранным из одного или нескольких веществ, содержащих железо, медь і и/или магний, образующих комплексные соединения ' с порфириновым кольцом, и железо стереоспеци фически связанное в белковых молекулах , Предпочтительно пропускать табачный дым I через фильтр, который содержит в себе активированный уголь, обогащенный Биологическим веществом. 27571 При этом упомянутая обогащенная волокнистая матрица может быть присоединена в стык к волокнистой матрице, которая не обогащена указанным биологическим веществом. Целесообразно чтобы биологическое вещество включало в себя гемоглобин и/или лизат эритроцитов, однако оно может быть выбрано также из ионов железа Fe3*, стереоспецифически связанных с одним или несколькими такими материалами, как трансферрин, каталаза, протопорфирин, цитохром С и хлорофилл. При этом биологическое вещество может находиться в твердом состоянии. Сущность настоящего изобретения объясняется с помощью прилагаемых графических материалов. На фиг. 1 показано устройство заявляемого фипьтра в составе заявляемой сигареты. На фиг. 2 и 3 показаны результаты типичного эксперимента с идентификацией и расчетом окиси азота, а также с ее поглощением после прохождения сигаретного дыма через биологический фильтр. На фиг.4 показан характерный лик, взятый в 2-секундном интервале хемолюминесцентной реакции, которая подавлялась на 100% после прохождения сигаретного дыма через биологический фильтр. На фиг. 5 представлен характерный пик хемолюминесценции вследствие присутствия перекиси водорода в сигаретном дыму. На фиг, 6 представлена зависимость хемолюминесцентной реакции от времени. На фиг. 7 представлена хемолюминесцентная реакция, которая могла бы продолжаться в течение более часа. На фиг. 8 представлена идентификация нитрозоссздинений содержавшихся в сигаретном дыму, путем оценки медленного выделения окиси азота из нитрозосоединений после их обработки перекисью водорода. На фиг. 9 проиллюстрировано медленное выделение окиси азота как нитрозосоединениями - дизтнлнитрозамином и диметилнятрозамином, так и из гемоглобина, обогащенного нитрозосоединениями, из сигаретного дыма, обработанными перекисью водорода. На фиг. 10 представлено выделение окиси азота нитрозосоединениями сигаретного дыма, которые с гемоглобином образовывали аддукты, после облучения аддуктов гемоглобин/нитрозосоединения пучком ультрафиолетовых лучей (100 мДж/кв.см) в течение одной минуты. На фиг. 11 изображена камера для лабораторных экспериментов с легочными макрофагами и реактивом Грисса, На фиг. 12 показаны результаты исследований количества окиси азота (NO) и нитрата (N02*) при участии в эксперименте легочных макрофагов и реактива Грисса. На фиг. 13 проиллюстрированы результаты влияния сигаретного дыма на окислительную нагрузку легочных макрофагов. На фиг. 14 изображены результаты продуцирования перекиси водорода легочными макрофагами. На фиг. 15 изображены результаты эксгериментов по определению количества циклического ГМФ с использованием растворимой гуанилатциклазы и альвеолярных макрофагов. На фиг. 16 показано 5-ти кратное аккумулирование окиси азота. На фиг. 17 изображены результаты идентификации моноокиси углерода (СО) в сигаретном дыму. На фиг. 18 изображены результаты исследований количества окиси азота (N0) во вдыхаемом сигаретном дыме, который прошел через обычный фильтр и через биологический. На фиг. 19 показаны результаты исследований концентрации ONOO", определяемой с использованием 1,2 М раствора гидроокиси натрия. На фиг. 20 показаны результаты исследований окислительной нагрузки на человеческие эритроциты, которая была индуцирована ONOO". На фиг.21 показаны результаты исследований смещений пиков с 540 и 575 до 525 и 555 им, согласующиеся с образованием нитрозилгемоглобина. На фиг.22 изображены результаты идентификации альдегидов в выдыхаемом добровольцами сигаретном дыму по их характерному хемолюминесцентному пику. На фиг. 23 изображены результаты идентификации свободных радикалов в выдыхаемом добровольцами сигаретном дыму по их характерному хемолюминесцентному пику. На фиг. 24 изображены результаты идентификации свободных радикалов, когда насыщенный выдыхаемым дымом кислый раствор оставляли на час. Фильтр состоит из волокнистой матрицы 1, обогащенной биологическим веществом, выбранным из одного или нескольких веществ, содержащих железо, медь и/или магний, образующих комплексные соединения с порфирииовым кольцом, и железо стереоспецифически связанное в белковых молекулах. К волокнистой матрице 1 присоединены встык части обычного фильтра 2 и 3. Кроме того волокнистая матрица 1 может содержать активированный уголь, обогащенный биологическим веществом из той же группы веществ, которая определена выше для обогащения волокнистой матрицы 1. Заявляемая сигарета содержит табак 4, сформованный а виде продолговатого цилиндра, который присоединен к торцу описанного выше фильтра. Табак и фильтр заключены в оболочку из папиросной бумаги (на фиг. не показана). Удаление вредных окислителей и канцерогенных летучих нитрозосоединений из табачного дыма, который образуется, например, при куре' нии, происходит следующим образом. Дым от горения табака 4 проходит через часть обычного фильтра 3, где происходит предварительная очистка дыма главным образом от смол и никотина. Затем предварительно очищенный дым проходит через волокнистую матрицу 1, где происходит его дальнейшая очистка преимущественно от вредных окислителей и канцерогенных летучих нитрозосоединений, после чего дым проходит через часть обычного фильтра 2, который является ви 27571 димым и служит для эстетического оформления внешнего конца сигареты. Способ изготовления фильтра заключается в том, что фильтр, содержащий волокнистую матрицу 1 (Фиг 1), пропитывают биологическим веществом, выбранным из одного или нескольких веществ, содержащих железо, медь и/или магний, образующих комплексные соединения с порфириновым кольцом, и железо стереослецифически связанное s белковых молекулах. Предварительно в фильтр ЕВОДЯТ активированный уголь, после чего фильтр, содержащий активированный уголь, подвергают пропитке указанным выше биологическим веществом. Изготовление фильтра может быть включено в единый технологический процесс производства сигарет или выделено в самостоятельное производство с последующей поставкой на сигаретный автомат. Существо настоящего изобретения в значительной мере основано на знании того, что: а) имеется выбор соответствующих погло тителей, подобных гемоглобину или лизатам эритроцитов, или любому веществу, которое со держит стереоспецифически связанное железо, б) существует выбор поглотителей, которые содержат порфириновое кольцо с железом (на пример, лротопорфирин), в) существует выбор поглотителей, вклю чающих в себя порфириновое кольцо, которое устраняет необходимости в присутствии железа, г) имеется выбор поглотителей, которые со держат порфириновое кольцо в комплексе с дру гими металлами, например с Мд2+, Си2*, д) должен быть разработан биотехнический способ обогащения обычных материалов, исполь зуемых в настоящее время для изготовления си гаретных фильтров, которые в результате должны содержать вышеупомянутые биологические вещества-погл отител и. Основная идея настоящего изобретения заключается в концепции, согласно которой пропитка обычно применяемых сигаретных фильтров и/или фильтров, содержащих активированный уголь, может быть обогащена биологическими веществами, характеризующимися присутствием металлических ионов Fe \ Си2*, Мд , образующих комплекс с порфириновым кольцом, а также Fe2+. стереоспецифически связанного с белковыми молекулами, благодаря чему обеспечивается задержание вредных соединений, содержащихся в сигарете, до вдыхания курильщиком сигаретного дыма. Этот факт является основной характеристикой настоящего изобретения и составляет неоспоримое нововведение с большой вероятностью промышленного применения. Настоящее изобретение создавали, следуя путем, который позволил бы ему найти применение на уровне промышленного производства. Готовили раствор 1 мг/мл гемоглобина и/или лизата эритроцитов в физиологическом растворе с фосфатным буфером (РФБ) с величиной рН 7,4 и его добавляли к 100 мг активированного угля. Смесь инкубировали а течение 30 мин при комнатной температуре и фильтровали через фильтровальную бумагу S&S Carl Schleicher & SchueJI Co. U.S.A По данным спектрофотометрического анализа фильтрата рассчитывали количество неабсорбировэнного гемоглобина Уголь, обогащенный гемоглобином, оставляли сохнуть при комнатной температуре. 200-миллиграммовое количество угля, обогащенного гемоглобином, в виде прокладки помещали между двумя обычными фильтрами таким образом, что весь сигаретный дым, который через них аспирировали, входил в контакт с активными группами молекул (Fe2+, Fe3*, SH, -NH2) (фиг 2). После этого такие совместимые материалы были готовыми к использованию для изготовления новых сигаретных фильтров, которые авторы изобретения с данного момента называют биологическими фильтрами. В другом варианте гемоглобин может быть заменен биологическими веществами, характеризующимися присутствием металлических ионов Fe2*, Си2*, Мдг* , образующих комплекс с лорфириновым кольцом, а также Fe2*, стереослецифически связанного с белковыми молекулами, в частности такими, как трансферин, катапаза, протопорфирин, цитохром С, хлорофилл. В другом варианте готовили раствор 5 мг/мл гемоглобина и/или лизата эритроцитов в физиологическом растворе с фосфатным буфером (РФБ) с величиной рН 7,4 и его сканировали при 25°С с использованием самопишущего спектрофотометра Ada Beckman. Пики поглощения наблюдали соответственно при 540 и 575 им (Smith, R. Р., Kruszyma, Н J Pharmacol Exper. Ther. 191, 557-563, 1974) Обычно применяемые сигаретные фильтры пропитывали этими растворами и сушили на воздухе при 25-35°С После этого такие совместимые материалы были ютовыми к использованию для изготовления новых сигаретных фильтров, па которые авторы изобретения с данного момента ссылаются как на биологические фильтры. Эти новые биологические фильтры обеспечивают прохождение вдыхаемого дыма в полном контакте с активными группами молекул гемоглобина и/или лиэатов, находящихся в фильтре, без изменения физических свойств или вкуса сигаретного дыма. По эстетическим причинам видимый конец биологического фильтра можно нарастить небольшим участком (3 мм) обычного фильтра. В соответствии с применяемыми для промышленного изготовления альтернативными способами предусмотрено нижеследующее: Готовили раствор 5 мг/мл протопорфирина в растворе с фосфатным буфером (РФБ) с величиной рН 7,4 и его сканировали при 25"С с использованием самопишущего спектрофотометра Acta Вескмап. Возбуждение протопорфирина ультрафиолетовым облучением (498-408) вызывало оранжево-фасную флуоресценцию с длиной волны в диапазоне 620630 нм. Затем сбыч'ные фильтры пропитывали (вымачивали) вышеуказанным раствором к сушили нагретым воздухом (25-35°С) В другом варианте раствор 5 мг/мл трансферина в РФБ с величиной рН 7,4 сканировали с использованием самопишущего спектрофотометра Acta BecKman. Трансферин с трехвалентным железом проявлял характерный спектр 470 нм. Для пропитки используемых в настоящее время обычных фильтров применяли вышеописанные слосо&ы. 27571 В альтернативном варианте готовили раствор 5 мг/мл каталазы в РФБ с величиной рН 7,4 Осуществляли вышеописанный способ изготовления биологического фильтра. В еще одном варианте готовили раствор цитохрома С 5 мг/мл в РФБ с величиной рН 7,4. Осуществляли вышеописанный способ изготовления биологического фильтра. в другом варианте готовили раствор 5 мг/мл хлорофилла в РФБ с величиной рН 7,4 Осуществляли вышеописанный способ изготовления биологического фильтра. По другому варианту вышеупомянутые биологические вещества помещали в виде прокладки Поглотители между двумя обычными фильтрами в твердой форме таким образом, что весь аспирированный через фильтр сигаретный дым входил в контакт с активными группами молекул (Fe2*, Fe3\ -SH, -NH2). Анализ результатов. Различные биологические вещества, использованные для обогащения обычных фильтров, проявляют способность задерживать токсические соединения {окись азота, моноокись углерода, свободные радикалы, перекись водорода, альдегиды, а также микроэлементы и нитроэосоединения), содержащиеся в сигаретном дыму, в различной степени, как это видно из таблицы, приведённой ниже. N О С О Свободные радик.,% ню». % Альдег ид ы ^ Гемоглобин 90 90 90 80 90 90 95 Трансферин 85 90 60 60 60, 75 50 Каталаза 85 90 90 90 80 80 80 Протопорфирин 85 90 70 80 70 75 80 Цитохром С 85 80 70 60 60 60 70 Хлорофилл 15 10 40 15 10 10 80 Определяли степень задержания очень вредных для здоровья веществ сигаретного дыма и 20 мл сигаретного дыма, профильтрованного через биопогический фильтр, сопоставляли с 20 мл дыма, профильтрованного через обычный фильтр. Только 1 мл сигаретного дыма, аспирированного через обычный фильтр, сравнивали с 40 мл сигаретного дыма, аслирированного через биологический фильтр. Оказалось, что способность удерживать микроэлементы у биологического фильтра в 40 раз выше, чем у обычных фильтров. В нижеследующем подробном описании экспериментальной части типичные результаты представлены таким образом, чтобы понятнее была активность биологических веществ. а) Идентификация окиси азота, содержащейся в сигаретном дыму, с использованием метода хемолюминесценции. Окись азота идентифицировали с применением метода улучшенной люминолом хемолюминесценции, описанного в экспериментальном разделе На фиг. 2 и 3 проиллюстрирован типичный эксперимент с идентификацией и расчетом окиси азота, а также с ее поглощением после прохождения сигаретного дыма через биологический фильтр. Как оказалось, гемоглобином задерживалось свыше 90% окиси азота. Эффективность биологического фильтра при задержании и нейтрализации окиси азота, которая вовлекалась в токсичные реакции как в легочных клетках, так и в легочных жидкостях, в особенности когда она участвовала в образовании обладающего сильной окислительной способностью ONOO", очевидна. Нитроаосо- Микроэлеединения,% менты,0/» б) Идентификация свободных радикалов, содержащихся в сигаретном дыму, с использова нием метода хемолюминесценции. Свободные радикалы в сигаретном дыму идентифицировали по хемолюминесцентной реакции, вызванной системой пюцигенин/ДАМЦО после ее реакции со свободными радикалами. На фиг.4 показан характерный пик, взятый в 2секундном интервале хемолюминесцентной реакции, которая подавлялась на 1С0% после прохождения сигаретного дыма через биологический фильтр. Задерживание свободных радикалов биологическими фильтрами означает, что это должно привести к снижению окислительной нагрузки в альвеолярных макрофагах, которую вызывал обычный сигаретный дым. в) Идентификация перекиси водорода, со держащейся в сигаретном дыму, с использовани ем метода хемолюминесценции. Перекись водорода рассчитывали по хемолюминесцентной реакции, вызванной системой изолюминол/микропероксидаза. На фиг. 5 представлен характерный пик хемолюминесценции вследствие присутствия перекиси водорода в сигаретном дыму. В присутствии каталаэы (100 ед./мл) хемопюминесцентная реакция подавлялась приблизительно на 90%. Когда сигаретный дым проходил через биологический фильтр, наблюдали 80%-ное подавление хемолюминесцентной реакции. Система изолюминол/микропероксидаза является специфической для идентификации перекиси водорода. Свободные радикалы, содержавшиеся в сигаретном дыму, после взаимодействия с изолюминолом вызывали ела 10 27571 бую хемопюминесцентную реакцию Как оказалось, эта слабая хемопюминесценция составляла приблизительно 10% от всей хемопюминесценции, вызванной перекисью водорода в присутствии свободных радикалов, поскольку катала за подавляла максимальную хемолюминесцентную реакцию вплоть до 90% Задерживание перекиси водорода очевидно ослабляет как окислительную нагрузку, так и продуцирование окиси азота альвеолярными макрофагами г) Идентификация микроэлементов и альде гидов, содержащихся в сигаретном дыму, с ис пользованием энзиматической системы люциферин/люфицераэа Микроэлементы, содержавшиеся в сигаретном дыму, идентифицировали по их способности стимулировать активность люциферазы На фиг б представлены 1) хемолюминесцентная реакция, вызванная окислением люциферазы в присутствии АТФ, 2) улучшенная хемолюминесцентная реак ция в присутствии ионов Cd24 (0,5 мкг), 3) улучшенная хемолюминесцентная реак ция в присутствии ионов Си2* (0,5 мкг), 4) улучшенная хемолюминесцентная реак ция, вызванная сигаретным дымом (1 мл), и 5) подавление хемолюминесцентной реак ции (в сравнении с той, что вызвана сигаретным дымом), обусловленной 40 мл сигаретного дыма, когда его пропускали через биологический сига ретный фильтр Очевидно, что хемо люминесцент ная реакция, вызванная микроэлементами, со державшимися в обычном сигаретном дыму, бо лее чем в 40 раз превышает вызванную после прохождения через биологический фильтр За держивание микроэлементов биологическими фильтрами может обусловить как кратковремен ные, так и долговременные эффекты Кратковре менные эффекты могли бы повлечь за собой по давление окислительно-восстановительных реак ций в легких (Fe, Mn), а долговременные эффекты могли бы привести к подавлению вредного воз действия на компоненты и вещества крови (Cd) Альдегиды, содержавшиеся в сигаретном дыму, идентифицировали и рассчитывали с использованием той же самой энзи^тической системы люциферин/люцифераза в отсутствии АТФ Альдегиды способны вызывать окисление люциферазы На фиг 7 представлена хемолюминесцентная реакция, которая могла бы продолжаться & течение более часа Эта хемолюминесцентная реакция подавлялась на 100%, когда использованный сигаретный дым пропускали через биологический фильтр, из чего можно предположить, что эффективность биологического фильтра при задерживании токсичных альдегидов является существенной д) Идентификация нитрозосоединений в си гаретном ДЫМу Нитроэосоединения, содержавшиеся в сигаретном дыму, идентифицировали оценкой медленного выделения окиси азота из нитрозосоединений после их обработки перекисью водорода Как показано на фиг 8, пиковой хемолюминесцентной реакции достигали приблизительно при 900 с Пропускание сигаретного дыма через биологический фильтр демонстрировало 90%-ное подавление наблюдаемой хемолюминесцентной реакции, а ее пик приходился на момент примерно 1200 с Представлено также медленное выделение окиси азота нитропруссидом натрия (НПН) после его обработки перекисью водорода На фиг 9 проиллюстрировано медленное выделение окиси азота как нитрозосоединениями - диэтипнитрозамином и диметилнитрозамином, так и из гемоглобина, обогащенного нитрозоеоединениями из сигаретного дыма, обработанными перекисью водорода Ясно, что выделение окиси азота нитрозосоединениями сигаретного дыма, которые с гемоглобином образовывали аддукты, следовало тому же шаблону выделения окиси азота такими нитрозоеоединениями, как диэтилнитрозамин и диметилнитрозамин Фиг 10 показывает выделение окиси азота нитрозоеоединениями сигаретного дыма, которые с гемоглобином образовывали аддукты, после облучения аддуктов гемоглобин/нитроэосоединения пучком ультрафиопетовых лучей (100 мДж/кв см) а течение одной минуты Выделение окиси азота оценивали в присутствии перекиси водорода, получив хемо люминесцентную реакцию при 1 с Показанный на фиг 10 постепенный рост обусловлен воздействием перекиси водорода на гемоглобин (реакция Фентона) е) Продуцирование окиси азота легочными макрофагами Эксперименты в лабораторных условиях проводили с помощью особой камеры, которая была создана в лаборатории авторов изобретения и которая показана на фиг 11 Диаметр камеры от 2,5 см Камера образованна твердыми стержнями из прозрачного плексигласа 5, с одного конца каждого из которых на механическом токарном станке выполнили отверстия для создания идентичных конических полостей в каждом из таких плексигласовых стержней Далее их открытые концы подвергали дополнительной механической обработке и полировке, выполнив соединение между сопряженными коническими элементами, которое позволяло очень плотно подгонять и соединять друг с другом обе конические полости- камеры А и Б Между соединяемыми элементами в качестве прокладки проложили квадрат из тонкого листово- , го тефлона (политетрафторэтилена толщиной 0,0015 дюйма, 0,038 мм) 6, после чего элементы прижали друг к другу с помощью винтов с накатанными головками По две трубчатые детали, обеспечивающие доступ с любой из сторон мембраны, позволяли в ходе протекания биологических реакций вводить внутрь, извлекать или модифицировать с любой из сторон мембраны биологически активные образцы и реакционноспособ-ные вещества Тефлоновая мембрана, разделявшая две секции камеры, была проницаема для газообразной окиси азота и непроницаема для NO 2 и ONOO Не вызывающие сомнений легочные макрофаги, изолированные согласно изложенному в экспериментальном разделе, суспендировали в , ССРХ-буферном растворе (1 х Ю 6 клеток/мл) и помещали в секцию А этой камеры В секцию Б > камеры помещали 2,5 мл реактива Грисса или сульфанилами/ускополетинового реактива Окись j азота, выделяемая макрофагами в секции А, 11 27571 диффундировала через тефлоновую мембрану в секцию Б и связывалась реактивом Грисса и/или сульфаниламид/скополетиновым реактивом и задерживалась там в связанном состоянии. Это указывало на продуцирование макрофагами газообразной окиси азота. Затем спектрофотометрическим или флуорофотометрическим анализом определяли количество окиси азота, находившейся в секции Б. С использованием реактива Грисса и/или сул ьфа нил амид/скоп о лети ново го реактива определяли также количества ONOO' и NOs", содержавшиеся в секции А камеры. Вышеописанные эксперименты повторяли после обработки макрофагов сигаретным дымом до их введения в секцию А. Результаты, представленные на фиг. 12, показывали, что сигаретный дым уменьшал количество продуцированной окиси азота, но усиливал продуцирование в легочных макрофагах 0NO0", что косвенно указывало на интенсивное продуцирование как окиси азота, так и 0Y. которые взаимодействовали с образованием 0N00". Повторение вышеописанных экспериментов с применением биологических, фильтров (то есть экспериментов, в ходе которых сигаретный дым аспирировали через биологический фильтр) показывало, что использованные биологические вещества продуцировали те же самые количества NO2" и 0N00' в секции А и количества окиси азота в секции Б, аналогичные тем, что могли бы продуцировать макрофаги, не обработанные сигаретным дымом. В этой ситуации компоненты реактива Грисса использовали также для изучения кинетики нитрозирования полупродуктом (полупродуктами), образовавшимся во время реакции окиси азота/Оэ" в водном растворе при физиологической величине рН. Добавление 50 мл сигаретного дыма к 100 мМ фосфатного раствора с величиной рН 7,4, содержавшего 25 мМ супьфаниламина и 2,5 мМ N - (1-нафтияэтилендиамин)-дигидрохлорида (НЭДД), обуславливало поглощение при Хмакс == =496 мм, указывавшее на характерный азопродукт, который был результатом нитрования. Имеет смысл учитывать значения данных наблюдений в отношении ожидаемой реакционной способности окиси азота в соответствующих физиологических условиях, где максимальные концентрации окиси азота в клеточной микросреде оценивали как находившиеся в интервале 0,5-10 мкМ. В процессе курения сигарет концентрации окиси азота резко возрастапи, оказывая вредное действие на легочные клетки. ж) Окислительная нагрузка на легочные макрофаги. Результаты влияния сигаретного дыма на окйслитепьную нагрузку легочных макрофагов проиллюстрированы на фиг. 13. Расчеты окислительной нагрузки с использованием ГПтБ показывали, что сигаретный дым приводил к удвоенной окислительной нагрузке в сравнении с той, что испытывали необработанные макрофаги. Когда сигаретный дым пропускали через биологический фильтр, наблюдаемая окислительная нагрузка оказывалась аналогичной той, что испытывали необработанные легочные макрофаги. Это, таким образом, ясно указывало на устранение окислительной нагрузки, индуцированной воздействием сигаретного дыма на макрофаги. В этом случае сигаретный дым был свободен от веществ, которые оказывали на легочные макрофаги окислительную нагрузку. э) Перекись водорода, продуцированная легочными макрофагами. Перекись водорода, продуцированная макрофагами, обработанными сигаретным дымом, провоцировала более чем 10-кратное повышение скорости ее продуцирования в сравнении со скоростью продуцирования необработанными макрофагами. Использование биологического фильтра проявлялось в снижении скорости продуцирования перекиси водорода на 90% (фиг. 14) в сравнении с достигаемой в случаях обычных фильтров. Очевидно, что поскопьку сигаретный дым индуцировап окислительную нагрузку в макрофагах, он увеличивал продуцирование этими кпетками токсичной перекиси водорода. и) Эксперименты с восстановлением. Количество циклического ГМФ, образованного окисью азота, выделенного альвеолярными макрофагами, определяли с помощью камеры, показанной на фиг.11, где растворимую гуанилатциклазу помещали в секцию А, а альвеолярные макрофаги помещали в секцию Б. Количества окиси азота, продуцированной макрофагами, определяпи в течение 50-минутного периода с клетками, обработанными и необработанными сигаретным дымом. Макрофаги, обработанные 10 мл сигаретного дыма, выделяли прибпизитепьно в десять раз меньшее количество окиси азота в сравнении с тем, что выделяли необработанные клетки, что указывало, таким образом, на 10-кратное ослабление продуцирования циклического ГМФ. Вышеописанную процедуру повторяли с использованием сигаретного дыма, который пропускали через биологический фильтр. Была показана не статистически заметная разница в сравнении с необработанными (контрольными) макрофагами (фиг. 15). Когда альвеолярные макрофаги обрабатывали 5 мМ перекиси водорода аккумулирование окиси азота в секции Б возрастало более чем в 5 раз. (фиг. 16). Это позволяло предположить, что перекись водорода усиливала продуцирование окиси азота по механизму позитивной ответной реакции. Путь 1-аргинина/окиси азота в макрофаги согласуется с концепцией, состоящей в том, что сигаретный дым вызывает выделение NO/ ONOO". к) Идентификация моноокиси угперода (СО) в сигаретном дыму. Присутствие моноокиси угперода в сигаретном дыму опредепяпи с использованием биологического метода, основанного на стимулировании растворимой гуанилатциклазы моноокисью углерода. Введение ССРХ. насыщенного сигаретным дымом, в секцию А камеры в присутствии высшего окисла с цепью нейтрализации окиси азота и введение растворимой гуанилатциклазы в секцию Б приводили к увеличению продуцирования циклического ГМФ вследствие диффузии моноокиси углерода из секции А в секцию Б. Пропускание сигаретного дыма через биологический фильтр уменьшало количество продуцированного циклического ГМФ приблизительно на 80% (фиг. 17). 12 27571 Вышеприведенная величина указывала на то. что вредные вещества NOx и СО, содержавшиеся в сигаретном дыму, задерживались и нейтрализовались биологическими фильтрами. Эксперименты in vivo. а) Вначале авторы изобретения убеждались в присутствии окиси азота и ONOO' в выдыхаемом сигаретном дыму. У добровольцев, куривших си гареты, снабженные обычными фильтрами, нали чие окиси азота в выдыхаемом сигаретном дыму устанавливали после введения выдыхаемого ды ма в 50 мл кислого раствора с величиной рН 4. Концентрацию окиси азота рассчитывали по опи санному в экспериментальном разделе методу хемолюминесценции. усиленной люминолом, с использованием стандартных кривых, построен ных по технической окиси азота. Было установле но, что концентрация окиси азота составляла 0,045 мМ. Эти эксперименты повторяли с исполь зованием биологических фильтров , и концентра ция окиси азота во вдыхаемом дыму оказывалась приблизительно на 70% ниже, чем в случае обыч ного фильтра (фиг. 18). Концентрацию ONOO" оп ределяли с использованием 1,2 М раствора гид роокиси натрия, который демонстрировал усиле-* ние поглощения при 303 нм (фиг. 19) (езоэ»« =1670 М"1 см'1). Проведенные авторами изобрете ния эксперименты показывали, что в процессе курения выдыхаемый дым содержал большие ко личества ONOO" (в результате прохождения 50 мл выдыхаемого дыма через 5 мл 1,2 М гидроокиси натрия образовывался 0,9 мМ раствор О NO О У Как установили, соотношение NO/ONOO' в выды хаемом дыму составляло 1.20.Таким образом ока залось, что NOx при взаимодействии с высшим окислом в легких трансформировались в ONOO'. Высший окисел образовывался как макрофагами, так и вследствие окислительно-восстановитель ных реакций, протекавших в легких во время куре ния. Сигаретный дым, аслирированный насосом, не содержал ONOO', однако некоторое количество NOx вступало в реакцию с высшим окислом или кислородом с образованием нитритных ионов (NO2~). ONOO" образовывался, только когда сига ретный дым входил в легкие. Применение биоло гических фильтров уменьшало выдыхаемые коли чества NO и ONOO" на 70%. б) ONOO' вступает в реакцию с бикарбонатными ионами эритроцитов человека в соответст вии с уравнением реакции вдыхаемым сигаретным дымом, вызывало резкое увеличение окислительной нагрузки в эритроцитах, что определяли по хемолюминесцентной реакции, протекающей в течение 5 с. Тот же самый эксперимент, проводимый с использованием биологического фильтра, обуславливал почти 100%ное подавление окислительной нагрузки в эритроцитах человека (фиг 20). Гемоглобин или эритроцитные лиэаты, на которые воздействовал ONOO' (содержавшийся в выдыхаемом сигаретном дыму), обуславливали исчезновение двух пиков при 540 и 575 нМ, которые обычно наблюдали у гемоглобина. Результаты типичного эксперимента, подобного тому, что описан выше, были получены с помощью 12 добровольцев и представлены на фиг. 21. Когда на гемоглобин и/или лизат воздействовали небольшим количеством дыма (10 мл), наблюдали смещение пиков с 540 и 575 до 525 и 555 нм, согласующееся с образованием нитроэилгемоглобина. Эти эксперименты повторяли с использованием биологических фильтров. Наблюдаемые пики сохраняли свои характерные длины волн. в) Альдегиды идентифицировали в выды хаемом добровольцами сигаретном дыму по их характерному хемолюминесцентному пику. Эти эксперименты повторяли с использованием био логических фильтров и наблюдали 90%-ное ос лабление хемолюминесцентной реакции в срав нении с максимальной хемопюминесцектной ре акцией, которую наблюдали в случае использова ния обычного фильтра (фиг.22). Очевидно, что биологические фильтры задерживали и нейтрали зовали альдегиды сигаретного дыма, одновре менно удерживая окислители, явно подавляя, та ким образом, инициирование окислительновосстановительных реакций в легких, в результате которых могли бы образовываться эндогенные альдегиды.' г) Свободные радикалы идентифицировали в выдыхаемом добровольцами сигаретном дыму по их характерному хемолюминесцентному пику. Эти добровольцы пользовались сигаретами, снабженными обычными и биологическими фильтрами. Им рекомендовали выдыхать 50 мл сигаретного дыма в 50 мл кислого раствора (0,01 н. соляная кислота) с величиной рН 6, а хемолюминесцентную реакцию изучали по истечении 5 и 60 мин. При величине рН 6 ONOO" самопроиз вольно разлагался. В течение 5 мин происходило 160%-ное усиление хемолюминесцентной реакции . в выдыхаемом дыму, пропущенном через обыч ный фильтр, в сравнении с тем, что происходило в сигаретном дыму, пропущенном через биологиче ский фильтр (фиг. 23). Когда насыщенным выды хаемым дымом кислый раствор оставляли на час, разница между хемолюминесцентными реакциями возрастала со 160 до 250% (фиг.24). Это согласо вывалось с концепцией того, что окислительновосстановительные реакции благодаря хиноновым радикалам протекают в сигаретном дыму не прерывно и приводят к образованию ряда активи рованных кислородсодержащих материалов, ко торые способны наносить биологический вред. Комментарии. Проведенные авторами изобретения исследования показали, что альвеолярные макрофаги ONOO' + НСОэ* HCO3+N02 +OH' Бикарбонатный радикал окисляет люминол, а такжеароматические и гетероциклические молекулы. В другом варианте ONOO' способен лереокислять бикарбонат до пероксибикарбоната, другого материала с сильным окислительным действием. С другой стороны, пероксид-дисмутаэа (ПОД) катализирует нитрование ONOO' и обширный ряд фенолов, включая сюда тирозин, с образованием белков. Таким образом, существует несколько потенциальных механизмов, посредством которых бикарбонат и ПОД могли бы оказывать влияние на общую реакционную способность ONOO' в клетках. Присутствие ONOO", образованного в легких 13 27571 подобно другим клеткам обладают эндогенной N0 синтазой и под воздействием сигаретного дыма способны в течение длительных периодов времени выделять NO/ 0N00". Более того, после начала выделения этими клетками окиси азота продуцирование окиси азота становится независимым даже после устранения этого стимула. Такая реакция объясняет способность дериаатизированной сигаретным дымом окиси азота стимулировать выделение окиси азота и ОМОО'альвеолярными макрофагами в течение периода в несколько часов после устранения стимула. Эта реакция может быть инициирована продуцированием перекиси водорода в легких при стимулировании сигаретным дымом альвеолярных макрофагов. Перекись водорода может стимулировать деятельность N0 синтазы легочных клеток по продуцированию окиси азота и ONOCT в течение периода времени более часа после устранения стимула. Эксперименты авторов изобретения действительно показали, что результатом пропускания сигаретного дыма через биологический фильтр является 90%-ное уменьшение (в сравнении со случаем обычного фильтра) окислительной нагрузки в альвеолярных макрофагах крысьи Образующийся в легких радикал ONOO' способен воздействовать на ингибитор альфа-1протеиназы (ИаШ) и инактивировать его. Подавление Иа1П в легких человека часто вызывает эмфизему, в результате которой уменьшается жизненная емкость легких. Статистические данные показывают, что курение провоцирует развитие эмфиземы (Southon, P.A., Pwis, G., Free Radicals in Medicine. Involvement in human Disease. Mayo Cfin. Proc. 63: 390-408, 1988). В экспериментах in vivo, проведенных на 12 добровольцахкурильщиках, когда вдыхаемый сигаретный дым пропускали через биологический фильтр, наблюдали 90%-ное уменьшение количеств выдыхаемых NO/ 0N0O". Кислородсодержащие свободные радикалы также участвуют в патогенезе ІдА-иммунного комплекса, индуцированном альвеолитом. Предварительная обработка животных пероксид-дисмутазой, каталазой, связывающим железо в комплекс десфериоксамином или поглотителем гидросильных групп ДМСО подавляет развитие заболевания легких. В противоположность этому легкие достоверно необработанных, контрольных животных характеризуются присутствием увеличенного числа альвеолярных макрофагов. Происходит также интерститиапьный отек и кровоизлияние. Более того, в такой модели заболевания легких ' высокоэащищенным оказывается также Iаргинин, как об этом свидетельствуют пониженные сосудистая проницаемость, сосудистое кровоизлияние и повреждение сосудистых эндотелиальных и альвеолярных эпителиальных клеток. Установление таких фактов позволяет предположить, что макрофаги являются источником повреждения, вызываемого окисью азота, Ог", перекисью водорода и гидроксильными группами (Mulligan, M.S., Jonhson, K.J., Ward, P.A. в работе "Bio logical Oxtdants' Generation and Injurious Consequences" (под редакцией Cochrane, C.G. и Gilbrone, M.A.), Jr. Academic Press 157-172, 1992) Задерживание и нейтрализация окислителей, содержащихся в сигаретном дыму, биологическими фильтрами может сыграть заметную роль в снижении активности окислительно-восстановительных энзимов, которые непосредственно связаны с окислительной нагрузкой в легочных клетках. Биологические фильтры резко ослабляют окислительную нагрузку, вызванную вдыхаемым сигаретным дымом. Окислительная нагрузка в легочных макрофагах и эндотелиальных клетках легочных сосудов может быть индуцирована кислородсодержащими радикалами NO, NOx и/или альдегидами, содержащимися в сигаретном дыму. Более того, задерживание альдегидов и микроэлементов (в особенности кадмия) биологическими фильтрами может обусловить значительные долговременные эффекты в сохранении антиоксидантов плазмы и в подавлении развития атеросклероза. Гемоглобин содержит несколько нейтрофильных центров, которые вступают в ковалентные реакции с электрофилами. Эти центры индуцируют N-концевые аалиновые остатки альфа- и бета-цепи, и N1- и ЫЗ-атомы гистидиновых остатков и сульфидрильную группу цистеиновых остатков. Канцерогенное нитрозосоединение 4(метилнитрозамино)-1-(3-пиридил)-1-бутанон (НПБ), содержащееся в табаке, во время горения сигареты переходит в дым, и его содержание в основной струе дыма могло бы варьироваться от 4 до 1700 нг на каждую сигарету. НПБ способен образовывать с гемоглобином аддукты (Hecht, S.S., Кагап, S. и СагтеПа, S.G. в работе "Human carcinogen expose", под редакцией Gamier, R.C., Fanner, P,B., Steel, G. I. и Wricht, A. S., издательство !RL Press, cc. 267-274, 1991). Очевидно, что единственный путь избежать связанных с табаком заболеваний состоит в том, чтобы воздержаться от жевания и курения табака. Однако статистика, охватывающая современных курильщиков, указывает на то, что необходимо предпринять серьезные меры для ослабления воздействия табачных канцерогенов и модификации манеры их воздействия. Принципиальными путями достижения этой цели являются: 1) модификация табачной продукции, 2) подавление метаболической активации табачных канцерогенов и их эндогенного продуцирования некоторыми микро- и малопитательными веществами и химиопревентивными агентами и 3) задерживание табачных канцерогенов с использованием особых фильтров, которые должны быть соединены с сигаретным табаком. Изобретение его авторов, при осуществлении которого для изготовления биологических фильтров используются биологические вещества, относится, наконец, к открытию того факта, что нитрозосоединения, содержащиеся во вдыхаемом сигаретной дыму, задерживаются этими биологическими веществами, защищая здоровье не только курильщиков, но также и некурящих. 14 27571 Фиг. 1 1.0 1/с х 10е Окись азота (N0) к сипретном дыме дым, прошед I s дым, прошедший через 5 пмопь лг~**ш*' биологический фильтр В. 9 Время Фиг. 2 300 250 1 / (А) обычный 2fl0 1 о 5 150 (В) биологичес so о* 20 40 60 ЭО 100 Сигаретный дым (мл) Фиг. 3 15 120 27571 1Я.ЯН Время (Л) (В) в.2 и. В. а во L3.se Фиг. 4 Перекис ь (А) обычный фильтр В) биологический фильтр ' *%' \ь$ъ „ (С) % 2Q.ee eeit 100.OQ сек Время Фиг. 5 1159.НВ 16 27571 з.в, 1/cxlO 5 О Ф X () /V (В) в дыме (1 мл) прошедшем через а.зі (D) биологический фильтр (E) контрольные реагенты сек обычный фияьтр 30,1/схіо 3 2.3 к ^ (А) обычный фильтр 2. а 1.3 I 1-М о.зі (В) биологический фильтр iao.ee Время Фиг. 7 17 150.20 сек 27571 (А) показывает выделение NO из нитрозосоединений после их обработки в.о (С) показывает выделение N0 китропрусскдом натрия 5.9 в А в' аР (В) выделение N0 нитрозосоедннениямн когда дым протея через "«ологкчсскнй фильтр . сек Время Фиг. 8 Ї/СХІО4 1.5 Слабые выделения N0 из (А) диэтилтпроэамнна (1 мкМ) .00 i sao. oo (В) гемоглобин, обогжщетшй іопрозососдинекмччн i.o В сигаретного дыма (1 мкМ) Q .5 о.о SG0.00 Q.QQ 1/с х 107 5 а. 8 | X Q.6 0.4 (С)диметмлкктрогамина(і мкмМ) і в.г Е 0-п Kt а.з 1533.оа Q-ЙО Время Фиг. 9 18 сек 27571 (А) Спонтанное выделение NO кнтроэососдкненкямн сигаретного дыма ? . В ( 1/схЮ fi.0 4 А І (В) Контроль (гемоглобин, необработанный сигаретным дымом) І •jr 0.3 .В (С) Чистые рсагеїгпл і.аа 2.00 Время Фиг. 10 Фиг. 11 19 з.ва
ДивитисяДодаткова інформація
Назва патенту англійськоюFilter for removal of noxious oxidants and carcinogenic volatile nitrosocompounds from cigarette smoke, filter cigarette and method for removal of noxious oxidants and carcinogenic volatile nitrosocompounds from cigarette smoke
Автори англійськоюStavridis Ioannis, Deliconstantinos George
Назва патенту російськоюФильтр для удаления вредных окислителей и канцерогенных летучих нитрозосоединений из табачного дыма, сигарета с фильтром, способ изготовления фильтра и способ удаления вредных окислителей и канцерогенных летучих нитрозосоединений из табачного дыма
Автори російськоюСтавридис Иоаннис, Деликонстантинос Георг
МПК / Мітки
Мітки: фільтром, сигарета, спосіб, летких, шкідливих, фільтр, окисників, виготовлення, фільтра, диму, тютюнового, видалення, нітрозосполук, канцерогенних
Код посилання
<a href="https://ua.patents.su/30-27571-filtr-dlya-vidalennya-shkidlivikh-okisnikiv-i-kancerogennikh-letkikh-nitrozospoluk-z-tyutyunovogo-dimu-sigareta-z-filtrom-sposib-vigotovlennya-filtra-i-sposib-vidalennya-shkidlivik.html" target="_blank" rel="follow" title="База патентів України">Фільтр для видалення шкідливих окисників і канцерогенних летких нітрозосполук з тютюнового диму, сигарета з фільтром, спосіб виготовлення фільтра і спосіб видалення шкідливих окисників і канцерогенних летких н</a>
Попередній патент: Фармакологічно активні похідні катехіну
Наступний патент: Одноканальний радіометр
Випадковий патент: Пристрій формування активної модульованої перешкоди оптико-електронним пристроям