Біологічноактивний засіб, що має імуномодулюючу властивість, спосіб його одержання, препарат на його основі та спосіб нормалізації фізіологічного стану організму людини та тварин при захворюваннях, що породжені
Номер патенту: 2164
Опубліковано: 26.12.1994
Автори: Ніколаєнко Олександр Миколаєвич, ШОРОХ Дмитро Бориславович, ШЕВЧЕНКО Олександр Олександрович
Формула / Реферат
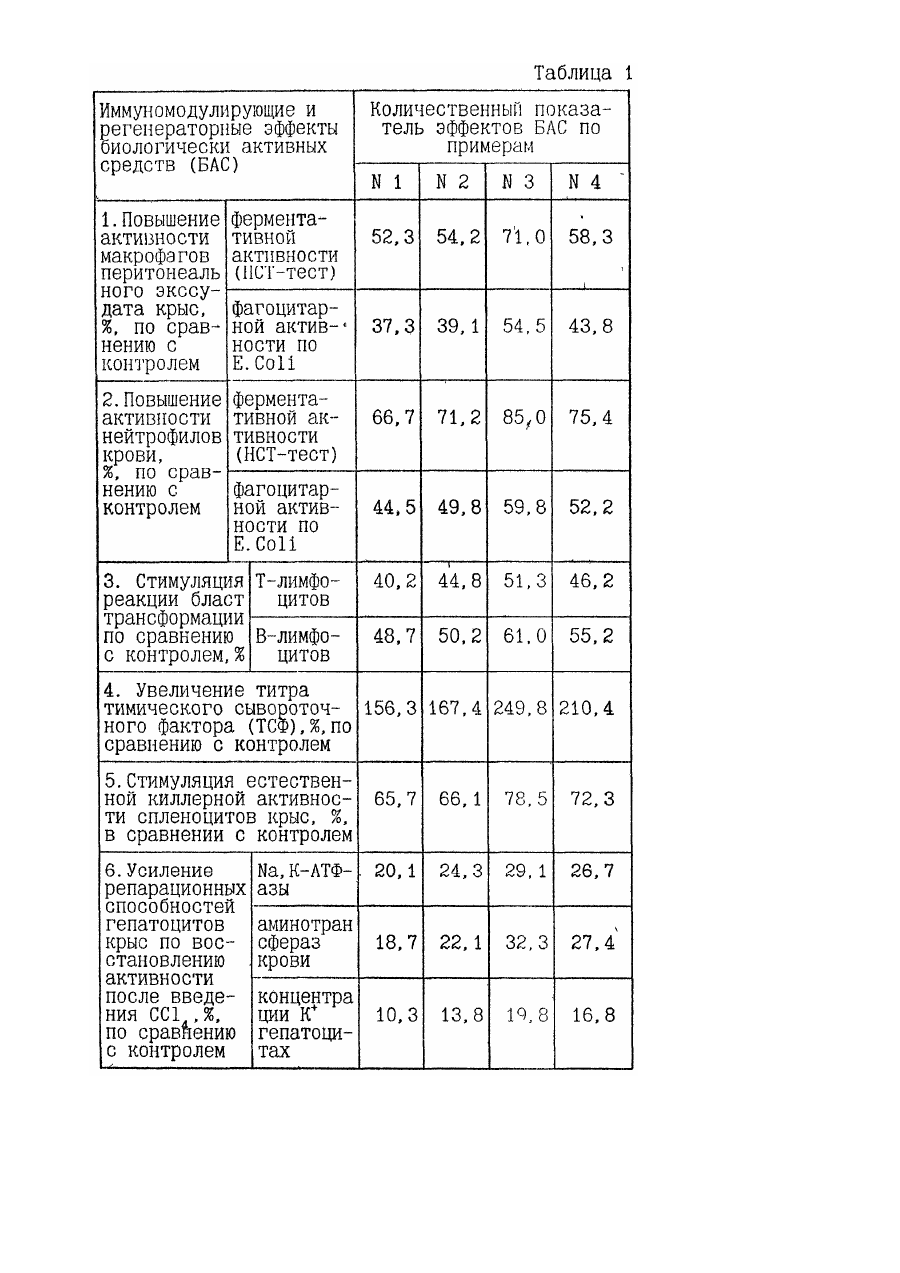
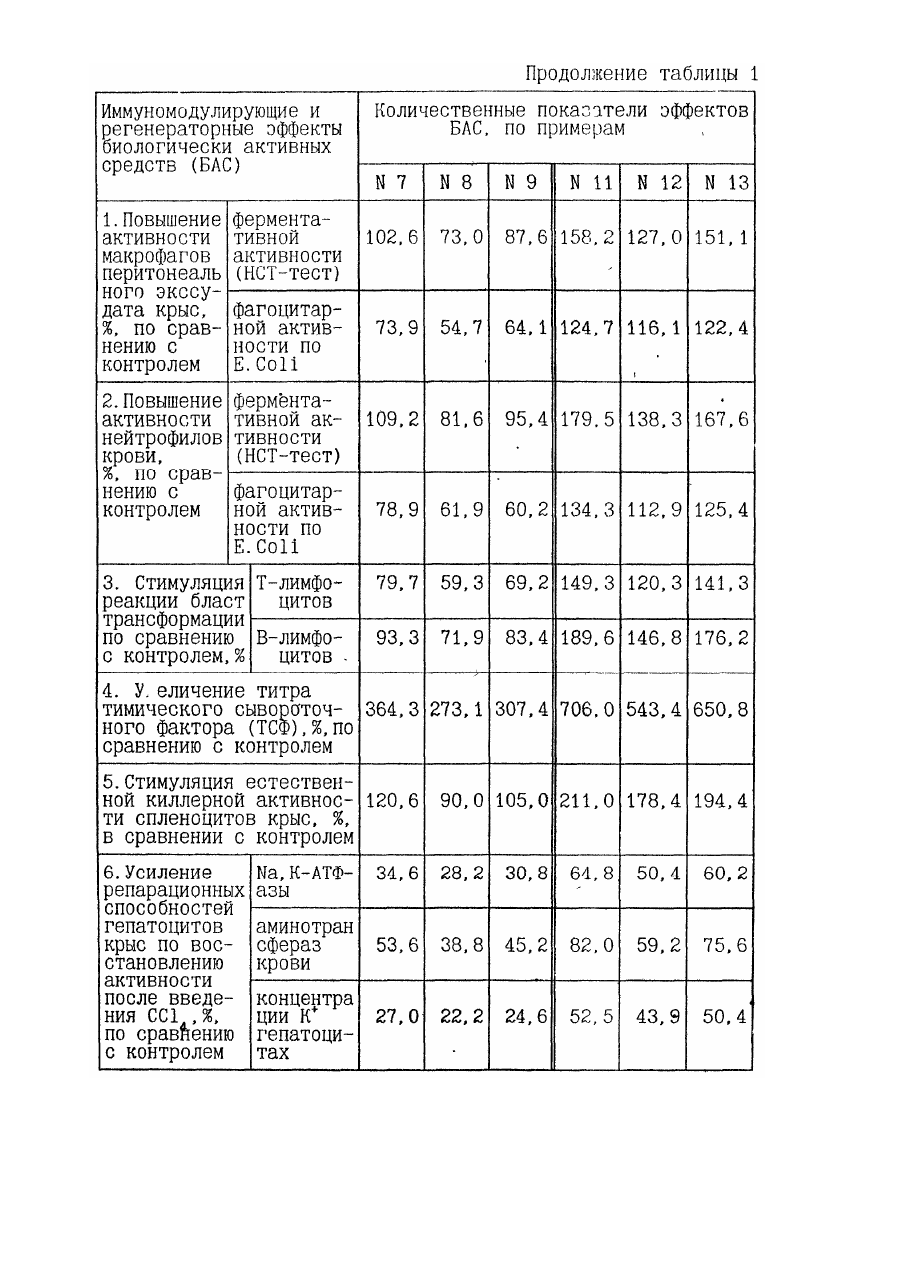
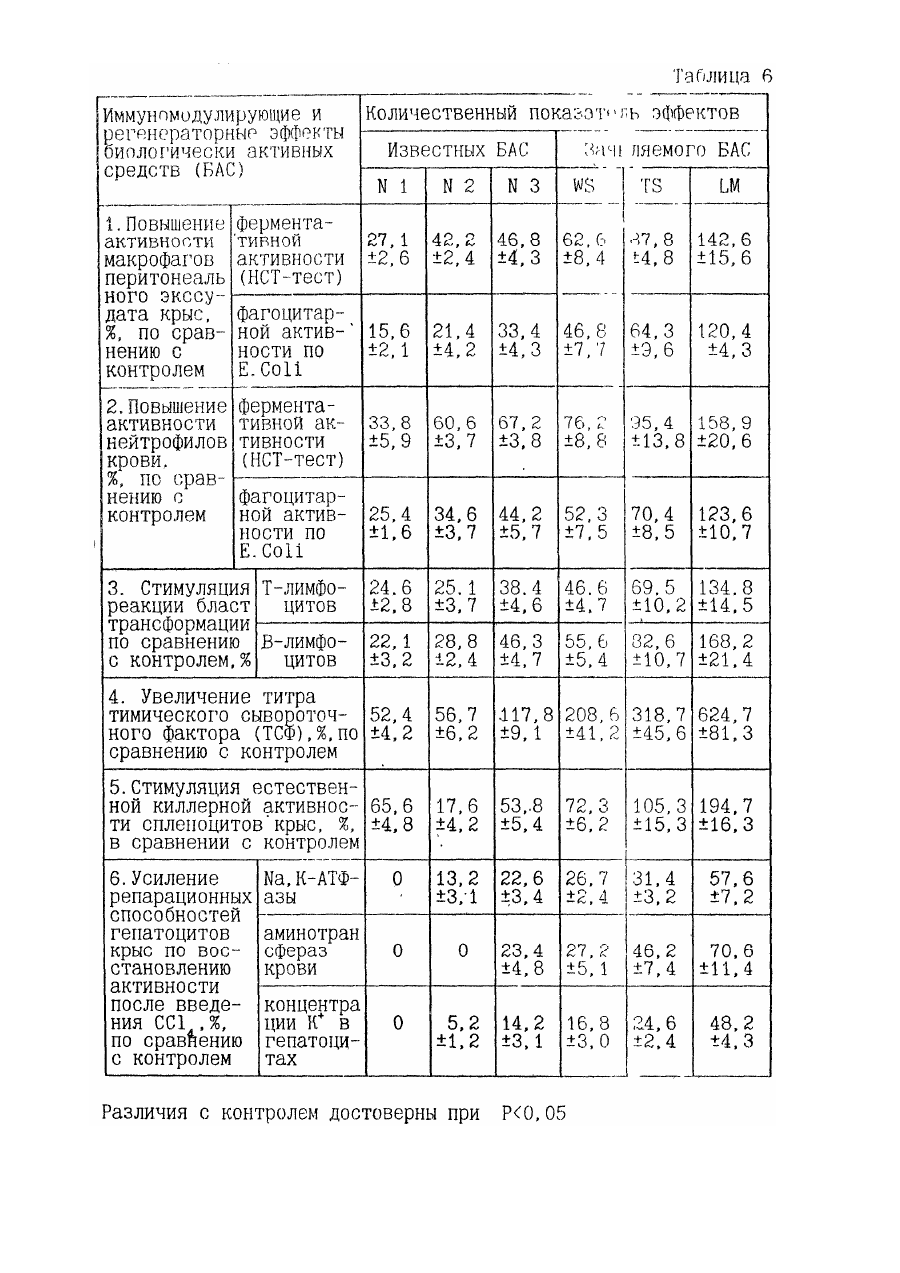
1. Биологически активное средство, обладающее иммуномодулирующим свойством, на основе продуктов гидролиза игредиентов измельченной животной ткани, отличающееся тем, что оно содержит в составе продуктов гидролиза компоненты морфоплазмы и гликокаликса клеток, модифицированные при процессах эмбриогенеза и/или пролиферации, и/или дифференцировки клеток, и/или патологии, предшествовавшей и/или сопутствовавшей регенерации и/или репарации ткани.
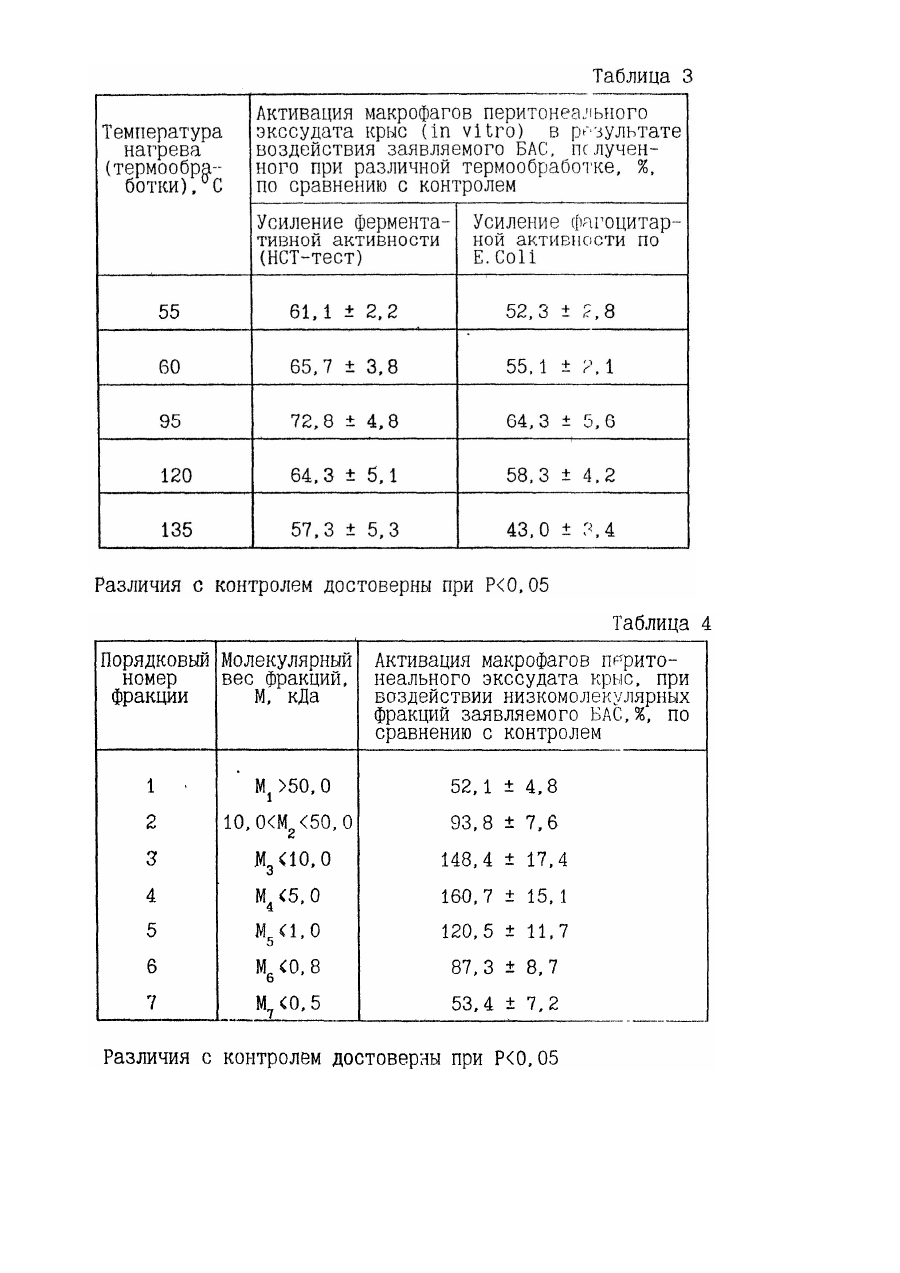
2. Средство по п. 1, отличающееся тем, что оно содержит в составе модифицированных компонентов морфоплазмы и гликокаликса клеток термостабильные при компоненты.
3. Средство по п.2, отличающееся тем, что оно содержит термостабильные компоненты в количестве 30-100 мас.%.
4. Средство по п.1, отличающееся тем, что оно содержит в составе модифицированных компонентов морфоплазмы и гликокалмкса клеток низкомолекулярные компоненты с молекулярной массой
5. Средство по п.2, отличающееся тем, что оно содержит в составе модифицированных компонентов морфоплазмы и гликокаликса клеток низкомолекулярные компоненты с молекулярной массой
С. Средство по п.4, отличающееся тем, что оно содержит низкомолеклярные компоненты в количестве 30-100 мас.%.
7. Средство по п.5, отличающееся тем, что оно содержит низкомолекулярные компоненты в количестве 30-100 мас.%.
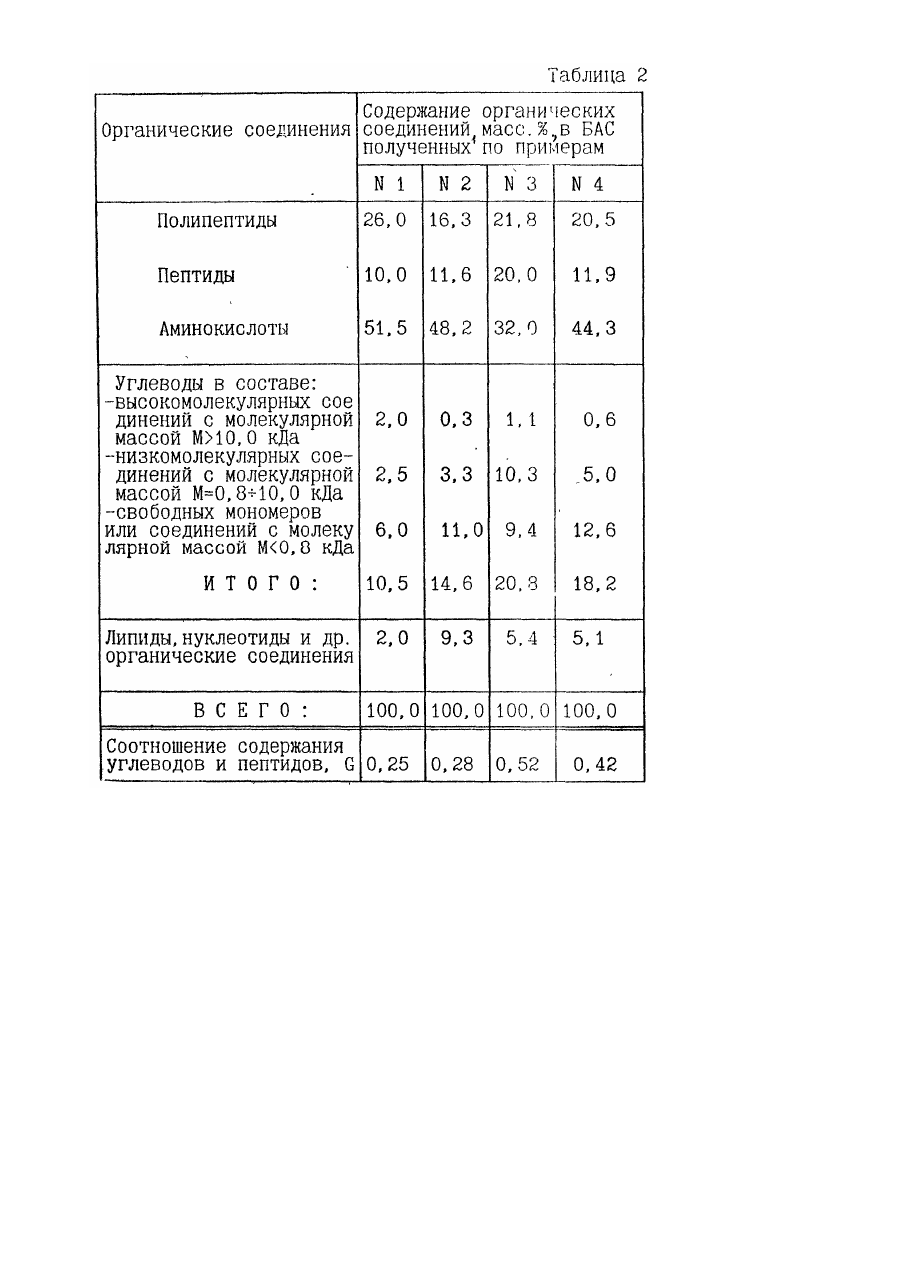
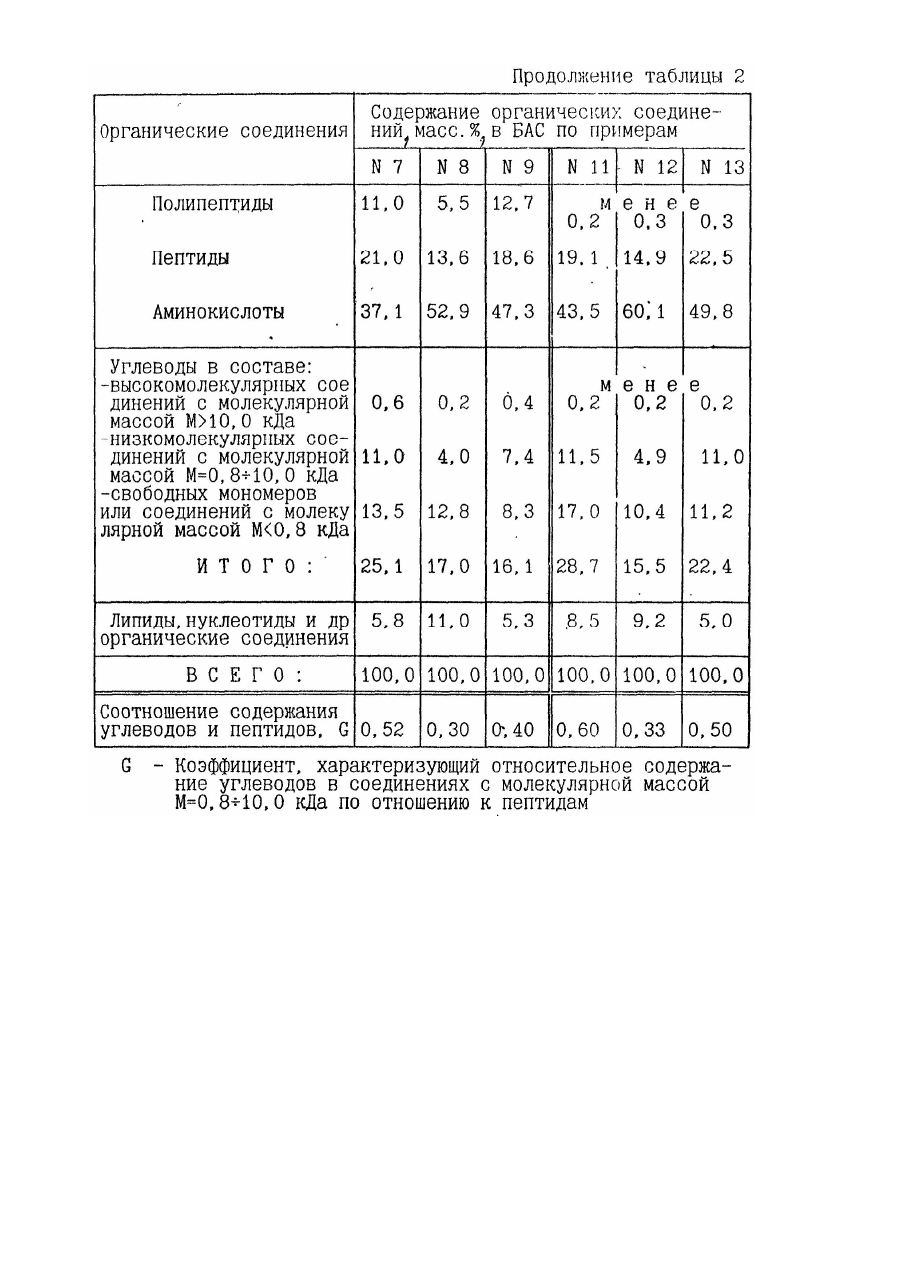
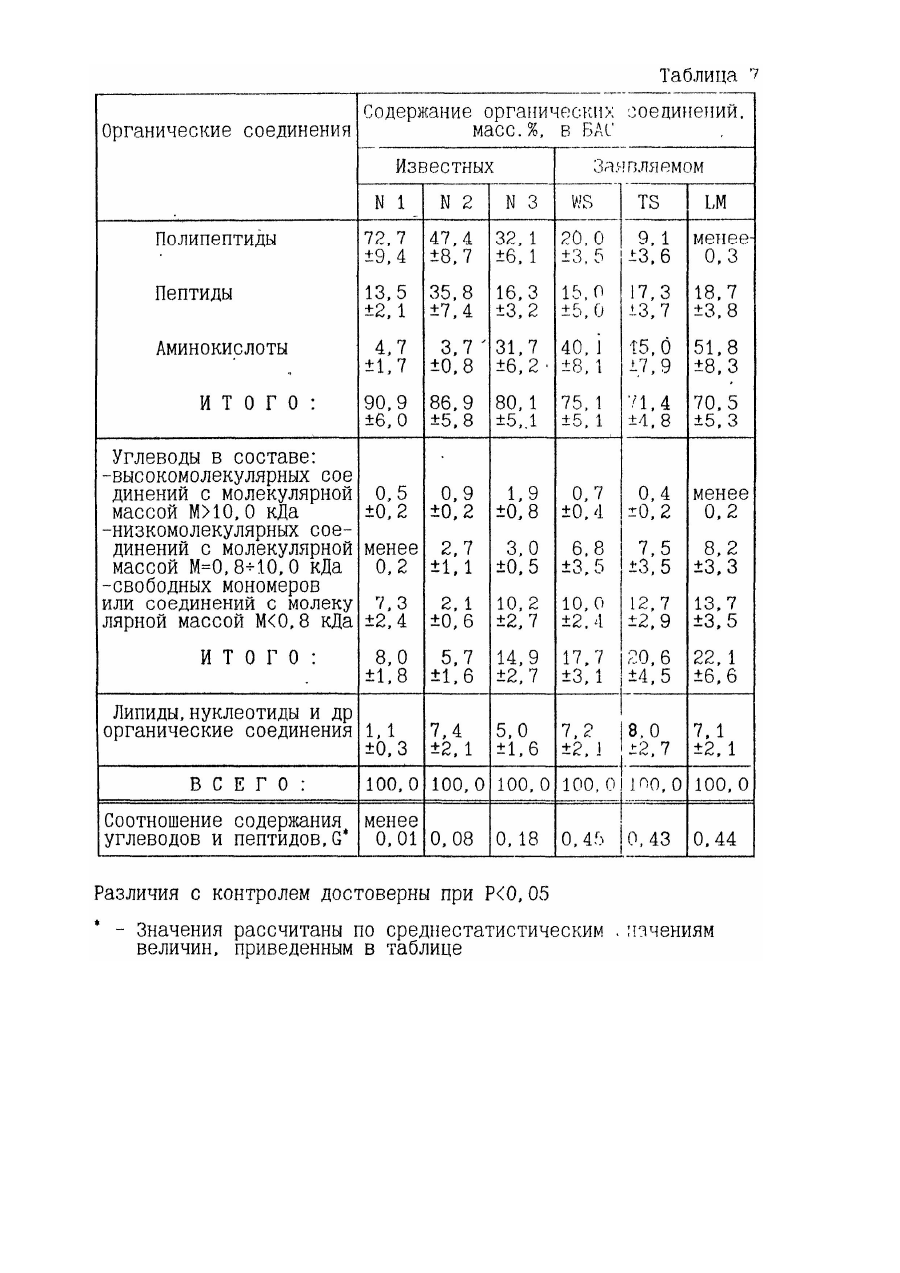
8. Средство по пп.1 или 2, или 3, или 4, или 5, или 6, или 7, отличающееся тем, что оно содержит в составе продуктов гидролиза с модифицированными компонентами морфоплазмы и гликокаликса клеток органические соединения в следующем соотношении, мас.%:
9. Средство по п.8, отличающееся тем, что оно содержит углеводы в составе органических соединений в следующем соотношении, мас.%, в составе:
10. Средство по п.п.1 или 2, или 3, или 4, или 5, или 6, или 7, отличающееся тем, что соотношение массовых содержаний углеводов и пептидов в составе продуктов гидролиза с молекулярной массой Мун = 0,8-10,0 кДа лежит в пределах G = 0,25-0,6.
11. Средство по п.п.1 или 2, или 3, или 4, или 6, отличающееся тем, что оно содержит в составе продуктов гидролиза с модифицированными компонентами морфоплазмы и гликокаликса клеток органические соединения в следующем соотношении, мас. %:
12. Средство по п.п.2, или 3, или 5, или 7, отличающееся тем, что оно содержит в составе продуктов гидролиза с модифицированными компонентами морфоплазмы и гликокаликса клеток органические соединения в следующем соотношении, мас. %:
13. Средство по п.п.4 или 5, или 6, или 7, отличающееся тем, что оно содержит в составе продуктов гидролиза с модифицированными компонентами морфоплазмы и гликокаликса клеток органические соединения в следующем соотношении, мас. %:
14. Способ получения биологически активного средства, обладающего иммуномодулирующим свойством, при котором осуществляют измельчение промытого сырья из животной ткани, гидролиз полученных ингредиентов с последующим отделением продуктов гидролиза, их фильтрацией и выделением супернатанта в качестве целевого продукта, отличающееся тем, что в качестве сырья используют животную ткань, модифицированную при процессах эмбриогенеза и/или пролиферации, и/или дифференцировки клеток, и/или патологии, предшествовавшей и/или сопутствовавшей регенерации и/или репарации ткани, и перед гидролизом проводят ее гомогенизацию и очистку от неразрушенных элементов ткани с выделением супернатанта, содержащего ингредиенты с компонентами морфоплазмы и гликокаликса клеток.
15. Способ по п.14, отличающийся тем, что в качестве сырья используют эмбриональную ткань, дифференцирующуюся ткань тимоцитов тимуса, сперматогонии и сперматоциты семенников, плацентарную ткань, эпителиальную ткань кишечника, клетки костного мозга, регенерирующую кожную ткань, ткань регенерирующей печени, ткань регенерирующих конечностей земноводных, патологически измененную ткань, взятую до стадии регенерации.
16. Способ по п.14, отличающийся тем, что очистку от неразрушенных элементов ткани после гомогенизации в физиологическом и/или буферном растворе осуществляют путем фильтрации и/или центрифугирования при ускорении 150-250 g в течение 10-15 мин.
17. Способ по п.14, отличающийся тем, что измельчение сырья из животной ткани осуществляют перед гомогенизацией и ведут до повреждения целостности клеток с последующей экстракцией их содержимого путем дополнительной промывки с фильтрацией и/или центрифугированием при ускорении 300-15000g в течение 10-20 мин с выделением экстрагированной измельченной ткани.
18. Способ по п.п.14 или 15, или 16, или 17, отличающийся тем, что в составе ингредиентов, подвергаемых гидролизу, содержание компонентов морфоплазмы и гликокаликса клеток составляет 30-60% от общей массы органических соединений.
19. Способ по п.14, отличающийся тем, что гидролиз проводят при температуре Тр = 4-45°С.
20. Способ по п.14, отличающийся тем, что гидролиз проводят в присутствии консерванта.
21. Способ по п.п.14 или 15, или 16, или 17, или 19, или 20, отличающийся тем, что продукты гидролиза ингредиентов подвергают термообработке при температуре Тн = 60-120°С до полной денатурации термолабильных соединений и фильтруют и/или центрифугируют их при ускорении свыше 1500 g в течение 20-40 мин с выделением супернатанта, содержащего термостабильные компоненты в качестве целевого продукта.
22. Способ по п.п.14 или 15, или 16, или 17, или 19, или 20, отличающийся тем, что продукты гидролиза ингредиентов подвергают фракционированию путем диализг через полупроницаемую пленку и/или ультрафильтрации, и/или гельфильтрации с выделением фракции низкомолекулярных компонентов с молекулярной массой в качестве целевого продукта.
23. Способ по п.21, отличающийся тем, что продукты гидролиза ингредиентов подвергают фракционированию путем диализа через полупроницаемую пленку и/или ультрафильтрации, и/или гельфильтрации с выделением фракции низкомолекулряных компонентов с молекулярной массой в качестве целевого продукта.
24. Препарат для нормализации физиологического состояния организма человека и животных, содержащий биологически активное средство на основе продуктов гидролиза ингредиентов животной ткани, и наполнитель, отличающийся тем, что в качестве биологически активного средства он содержит в составе продуктов гидролиза компоненты морфоплазмы и гликокаликса клеток, модифицированные при процессах эмбриогенеза и/или пролиферации, и/или дифференцировки клеток, и/или патологии, предшествовавшей и/или сопутствовавшей регенерации и/или репарации ткани, при его содержании в препарате в количестве 0,001-85,0 мас. %, остальное - наполнитель.
25. Препарат по п.24, отличающийся тем, что биологически активное средство содержит органические соединения в соотношении, мас. %:
26. Препарат по п.25, отличающийся тем, что биологически активное средство содержит органические соединения в соотношении, мас. %:
27. Препарат по п.25, отличающийся тем, что биологически активное средство содержит органические соединения в соотношении, мас. %:
28. Препарат по п.25, отличающийся тем, что биологически активное средство содержит органические соединения в соотношении, мас. %:
29. Препарат по п.п.25 или 26, или 27, или 28, отличающийся тем, что в качестве наполнителя содержит физиологический раствор натрия хлористого и/или солевой буферный раствор, и/или углеводные соединения, и/или жиры минерального, животного, растительного или синтетического происхождения и их смеси.
30. Препарат по п.п.25 или 26, или 27, или 28, отличающийся тем, что он дополнительно содержит консервант.
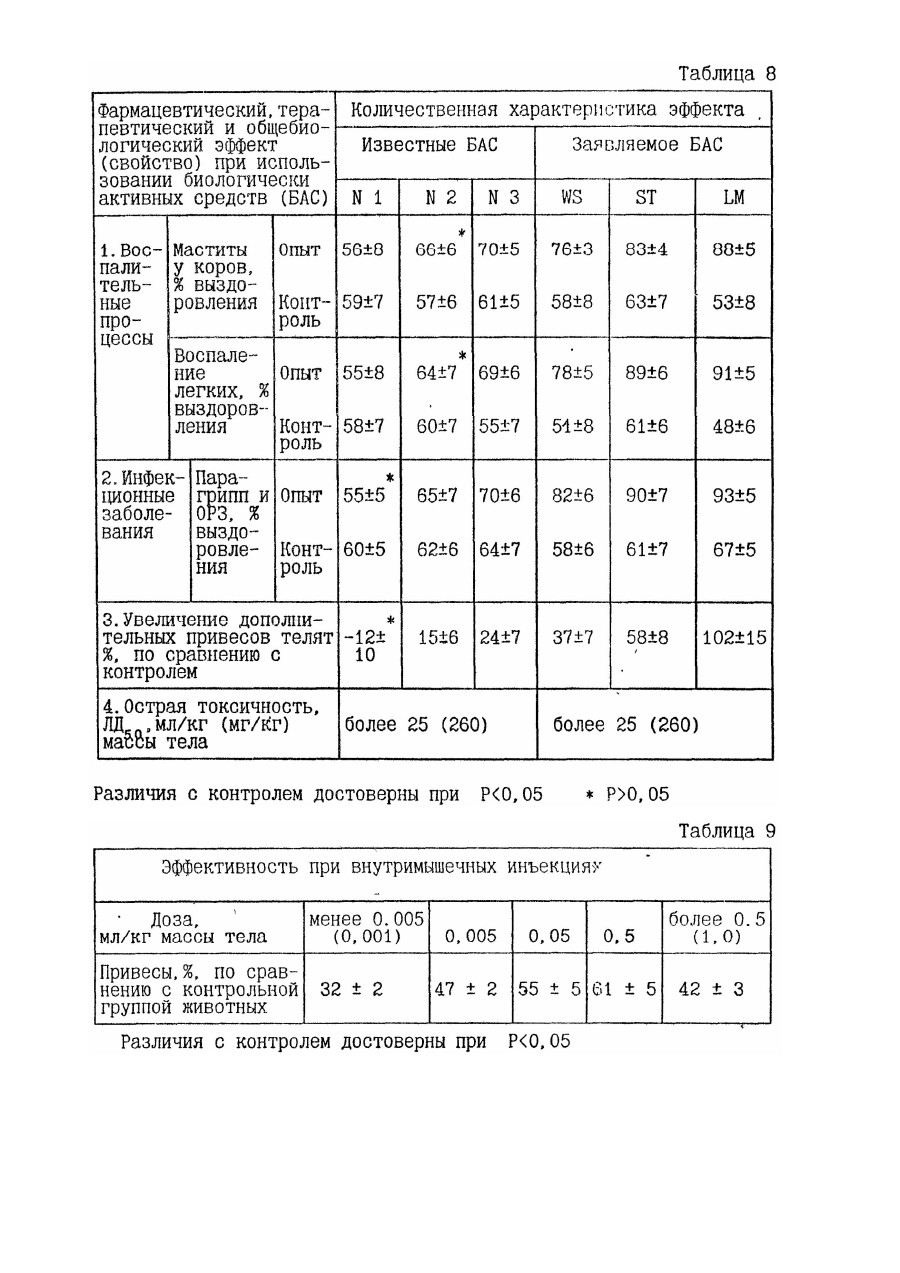
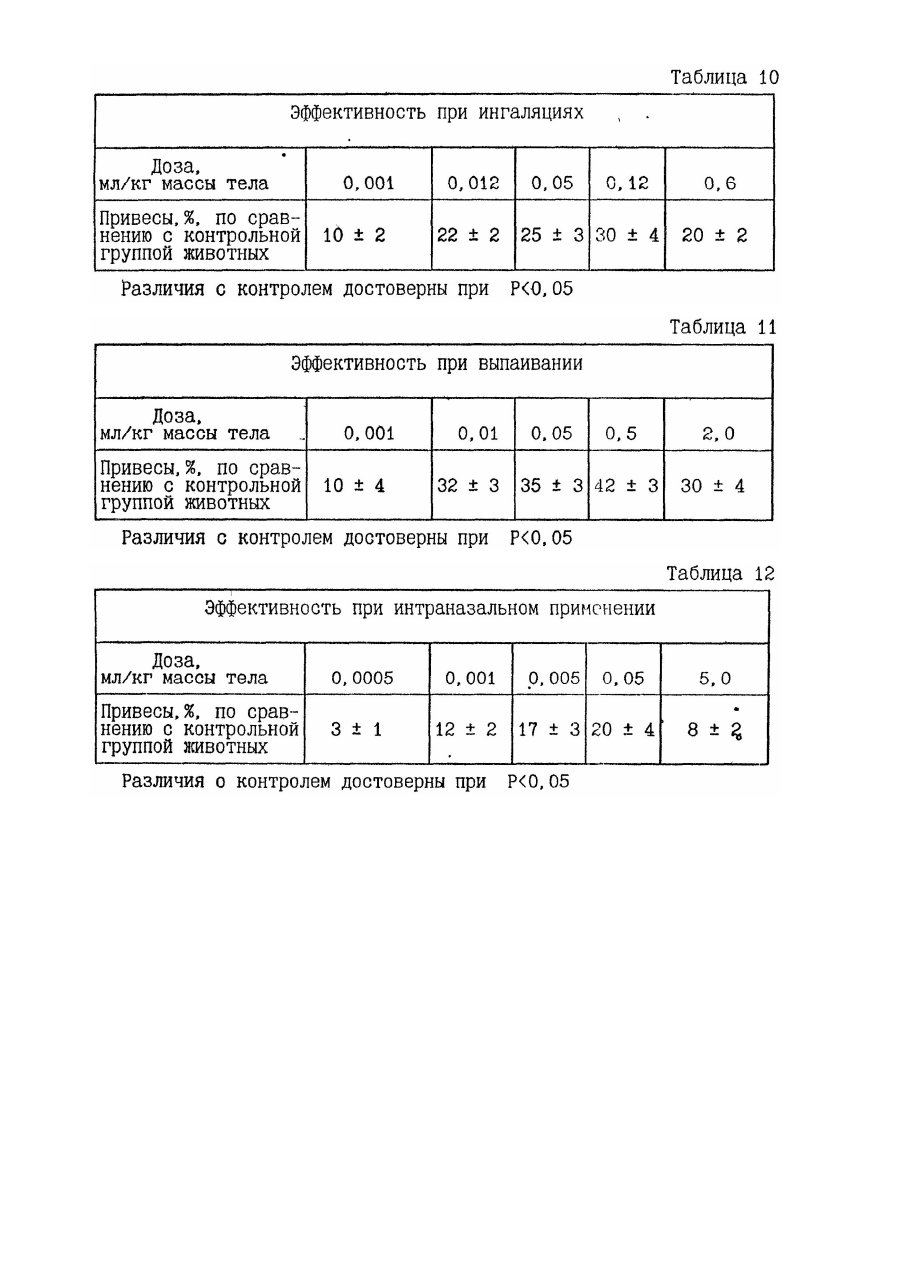
31. Способ нормализации физиологического состояния человека и животных при заболеваниях, вызванных преимущественно патологически измененными и/или чужеродными клетками, микроорганизмами и/или продуктами их жизнедеятельности, предусматривающий введение в организм препарата на основе продуктов гидролиза ингредиентов животной ткани, отличающийся тем, что в качестве препарата используют композицию из 0,001-85,0 мас. % биологически активного средства, содержащего в составе продуктов гидролиза компоненты морфоплазмы и гликокаликса клеток, модифицированные при процессах эмбриогенеза и/или пролиферации, и/или дифференцировки клеток, и/или патологии, предшествовавшей и/или сопутствовавшей регенерации и/или репарации ткани, и 15,0-99,999 мас. % наполнителя, а введение препарата в организм осуществляют путем внутримышечных инъекций в дозе 0,005-0,5 мг упомянутого средства на кг массы тела с интервалом между инъекциями 1-7 дней и/или ингаляций в дозе 0,012-0,12 мг средства на кг массы тела с интервалом между ингаляциями 4-48 часов, и/или сублингвального введения в дозе 0,012-0,12 мг средства на кг массы тела с интервалом между введениями 4-48 часов, и/или выпаивания в дозе 0,02-1,0 мг средства на кг массы тела с интервалом между выпаиваниями 1-10 дней и/или интегрального введения в пилюлях в дозе 0,02-1,0 мг средства на кг массы тела с интервалом между введениями 1-10 дней, и/или интраназального введения в суточной дозе 0,001-0,05 мг средства на кг массы тела с интервалом между введениями 2-24 часа, и/или аппликации на слизистую или раневую поверхность в виде компрессов, свечей, присыпок, мазей и гелей с интервалами между применениями 1-10 дней, - до нормализации параметров физиологического состояния.
Текст
Группа изобретений относится к химико-фармацевтической промышленности, а именно к области получения биологически активных средств, обладающих иммуномодулирующим действием, для использования в медицине и ветеринарии с целью нормализации физиологического состояния организма человека и животных, в частности, для повышения резистентности и продуктивности животных. Биологически активное средство, в соответствии с настоящим изобретением, относится к веществам животного происхождения и включает в себя органические соединения. Различного рода патологические нарушения в организме человека и животных вызывают отклонения от нормы параметров физиологического состояния в этих случаях лечебное воздействие на организм, в том числе профилактическое воздействие, заключается в стабилизации, то есть поддержании в норме, указанных параметров, либо (при отклонениях их от нормы) в таком воз действии на организм, при котором эти параметры нормализуются. Нормализацию физиологического состояния организма человека и животных можно осуществлять по двум направлениям: во-первых путем непосредственного воздействия на патологию и, во-вторых, путем опосредованного воздействия на системы, органы и ткани организма, отвечающие за поддержание в норме параметров гомеостаза. Введение гормональных препаратов, медиаторов, ростовых факторов, химиотерапия и тому подобные средства обеспечивают непосредственное воздействие на клетки-мишени путем рецепции. Например, при лечении диабета вводят инсулин, восполняющий функциональный недостаток поджелудочной железы; при нарушениях функциональной активности нервной системы вводят нейромедиаторы, способствующие нормализации пороговой чувствительности нейронов и, соответственно, улучшению передачи нервных импульсов; при нарушениях функциональной активности иммунной системы организма используют иммуномедиаторы, коррелирующие иммунный ответ, и так далее. При опосредованном воздействии на организм лечение заболеваний обеспечивается за счет мобилизации внутренних ресурсов организма. Так, при протекании процессов, связанных с регенерацией органов и тканей, с их реабилитацией или восстановлением их функций, а также при воспалительных и инфекционных процессах стимулируют иммунную систему организма. Благодаря этому обеспечивают улучшение иммунологического и, как следствие, общего состояния организма. Известно биологически активное средство на основе зародышевой ткани, обладающее иммуномодулирующим свойством, восстанавливающее физиологическое состояние организма и регулирующее обмен клеток (1) Указанное биологически активное средство (далее по тексту - БАС) выполнено на основе ингредиентов измельченной и гомогенизированной животной ткани, выделенной из зародыша, в смеси с физиологической сывороткой. Вследствие наличия в составе данного средства иммуномодулирующего фактора оно обладает сравнительно высоким иммуномодулирующим свойством, благодаря чему его использование обеспечивает нормализацию физиологического состояния организма, в том числе лечение, и повышение продуктивности животных на 1-15% по сравнению с контрольной группой. Эффективность известного БАС все же недостаточна вследствие того, что наряду с иммуномодулирующими факторами оно содержит в своем составе иммунодепрессанты, которые препятствуют полному проявлению иммуномодулирующего эффекта. Иммуномодулирующее свойство указанного средства, по сути дела является суммарным результатом, который обеспечивается одновременным присутствием в нем иммуностимулирующих факторов и дспрессантов. Таким образом, фактически специфическая активность известного БАС, зависящая от соотношения концентраций иммуностимулирующих факторов и депрессантов, сравнительно невелика вследствие значительной концентрации депрессантов в его составе. Другим недостатком указанного БАС является повышенное содержание в его составе высокомолекулярных соединений, являющихся иммуногенами, приводящее к появлению побочных иммунных реакций (аллергия, гиперчувствительность замедленного типа и тому подобное). В значительной степени недостатки вышеописанного БАС зависят от способа его получения, в котором технологический процесс заканчивается операцией измельчения и гомогенизации сырья из животной ткани, что приводит к обязательному присутствию значительного количества депрессантов и высокомолекулярных соединений в его составе. Известно также БАС, обладающее иммуномодулирующим свойством, для нормализации физиологического состояния организма, выполненное на основе ингредиентов измельченной и гомогенизированной ткани, выделенное в виде экстракта зародышевых тканей органов животных (2). Способ его получения заключается в измельчении и гомогенизации сырья из животной ткани, последующем удалении нерастворимых соединений и использовании экстрагированных растворенных веществ в качестве целевого продукта (2). Специфическая активность средств, полученных описанным методом, определяемая результирующим соотношением эффектов иммуностимуляции и иммуноингибированин, также недостаточна. Это объясняется тем, что в способе получения известного БАС в виде экстракта использованы только растворимые белки, а структурные белки удаляют, что существенно снижает содержание иммуностимулирующих факторов в составе средства. Кроме того, известное БАС также содержит в своем составе высокомолекулярные соединения, вызывающие побочные иммунные реакции организма. Известно также БАС на основе ингредиентов измельченной и гомогенизированной животной ткани, полученное в виде экстракта термостабильных компонентов ткани иммунокомпетентных органов (тимус, селезенка, лимфоузлы) или гормонопродуцирующих тканей (плацента) для нормализации физиологического состояния организма, в том числе для повышения резистентности и продуктивности сельскохозяйственных животных (3). Известное БАС предназначено для регулирования иммунной Т-системы, и практически не вызывает побочных иммунных реакций при его использовании (аллергии, гиперчувствительности замедленного типа и так далее). Его специфическая активность, в сравнении с уже рассмотренными БАС, выше за счет более высокого содержания иммуностимулирующих факторов. Однако использование этого средства для нормализации физиологического состояния организма ограничено в связи с его медиаторной и/или гормональной природой, которая не допускает передозировок из-за опасности нарушения параметров гомеостаза организма. Более безопасным в применении, является БАС для нормализации физиологического состояния организма, полученное в виде экстракта термостабильных компонентов измельченной животной ткани, в которой медиаторная или гормонопродуцирующая активность не столь существенна (4) Данное БАС обладает такими же достоинствами, что и ранее рассмотренные БАС, однако не проявляет медиаторной и/или гормональной активности, хотя при этом несколько теряет в своей иммуномодулирующей активности. Эти свойства известного БАС связаны со способом его получения, заключающемся в измельчении животной ткани, ее двухкратной термообработке и расфасовке в асептических условиях (4). Другое БАС, обладающее иммуномодулирующим свойством, для нормализации физиологического состояния организма, в том числе для заживления травмированных участков тела, выполнено на основе продуктов гидролиза ингредиентов измельченного сырья из животной ткани, взятого предпочтительно от недоразвитых животных (5). При этом в его состав входят минеральные вещества, растворимые органические соединения, такие как полипептиды, аминокислоты и минеральные вещества, полученные в результате гидролиза ткани. Данное средство обладает высокой эффективностью соотношении нормализации параметров физиологического состояния организма. Это объясняется тем, что известное БАС характеризуется высоким соотношением эффектов иммуностимуляции и иммуноингибирования в связи с более высоким содержанием в его составе иммуностимулирующих факторов. Однако эффективность описанного БАС все же недостаточна, что связано с содержаниєм в его составе относительно большого количества балластных веществ и иммунодепрессантов. Кроме того, известное БАС также может вызывать побочные эффекты, проявляющиеся при его использовании (аллергия и другие). Недостатком известного БАС является и то, что состав получаемого целевого продукта непостоянен и колеблется от партии к партии, вследствие чего затруднена его стандартизация. Свойства известного БАС, прежде всего его иммуномодулирующая активность, прямо связаны со способом ею получения. В известном способе получения БАС, обладающего иммуномодулирующим свойством, для нормализации физиологического состояния организма осуществляют гидролиз ингредиентов промытого измельченного сырья из животной ткани с последующим центрифугированием, фильтрацией продуктов гидролиза и выделением целевого продукта в виде порошка или геля. Гидролиз при этом проводят в растворе разбавленной слабой органической кислоты при pH, равном 3,6-6,5 и температуре около 68°С, а в качестве сырья используют ноги недоразвитой домашней птицы не более, чем 9-недельного возраста. Применяемое сырье, а также отсутствие перед гидролизом операций, предназначенных для его гомогенизации и очистки от неразрушенных элементов ткани с выделением супернатанта, содержащего ингредиенты с компонентами морфоплазмы и гликокаликса клеток, не позволяет получить конечный продукт с высокой (более 30%) концентрацией упомянутых компонентов, а также понизить в нем содержание иммунодепрессантов, нейтральных и балластных соединений. Известен лекарственный препарат для нормализации физиологического состояния организма человека и животных на основе продуктов гидролиза ингредиентов животной ткани, который накладывают на пораженные участки тела (5). Кроме указанных недостатков, недостатком известного лекарственного препарата на основе БАС является то, что стимуляция иммунной системы организма возможна только путем локальной его аппликации на травмированные участки тела. Поэтому эффективность такого препарата сравнительно невелика. Указанные недостатки частично устранены в известном препарате, обладающем иммуномодулирующим действием, для нормализации физиологического состояния организма человека и животных, содержащем действующее начало, представляющее собой биологически активное средство на основе продуктов гидролиза ингредиентов животной ткани, и наполнитель, который вводится в организм путем внутримышечной инъекции в дозе 0,75-1,0 мл/кг массы тела с интервалом 3 дня и, таким образом, используется нелокально (6). Недостатком этого лекарственного препарата является его сравнительная невысокая эффективность вследствие наличия в нем иммунодепрессантов, а также то, что его использование вызывает побочные аффекты из-за присутствия в его составе иммуногенов, вызывающих аллергию, гиперчувствительность замедленного типа и другое. Использование в качестве сырья животной ткани, содержащей сравнительно большое количество иммунодепрессантов, и невозможность улучшить состав БАС, на основе которого выполняется лекарственный препарат, с помощью выполняемых в известном способе операций, существенно снижает эффективность известного БАС и препарата на его основе. Существенным недостатком известного препарата является и то, что для обеспечения достаточной эффективности он содержит в своем составе большое количество биологически активных веществ, что обусловливает с одной стороны опасность передозировок, а с другой - увеличивает стоимость препарата. Известен способ нормализации физиологического состояния человека и животных при заболеваниях, вызванных преимущественно патологически измененными и/или чужеродными клетками, микроорганизмами и/или продуктами их жизнедеятельности, предусматривающий введение в организм препарата на основе продуктов гидролиза ингредиентов животной ткани (6). Известный способ малоэффективен вследствие наличия описанных выше недостатков препарата, в том числе из-за того, что при его использовании требуется введение больших доз, содержащих до 10 мг биологически активного средства на 1 кг массы тела, что также увеличивает опасность передозировок и возникновения побочных эффектов. Указанные выше недостатки устранены в заявленном биологически активном средстве, обладающем иммуномодулирующим свойством, в заявляемом способе получения этого средства и препарате на основе этого средства для нормализации физиологического состояния организма человека и животных, а также в способе нормализации физиологического состояния организма человека и животных при заболеваниях, вызванных преимущественно патологически измененными и/или чужеродными клетками, микроорганизмами и/или продуктами их жизнедеятельности, с использованием такого препарата. В основу изобретения положена задача создания биологически активного средства с иммуномодулирующим свойством, способа его получения и препарата на основе этого средства, и, способа его использования, которые бы обеспечивали высокую биологическую активность без проявлений токсичности и различных побочных эффектов, а также возможность получения целевого продукта заданного состава и с заданными свойствами. Поставленная задача решается тем, что биологически активное средство, обладающее иммуномодулирующим свойством, на основе продуктов гидролиза ингредиентов измельченной животной ткани, содержит в составе продуктов гидролиза компоненты морфоплазмы и гликокаликса клеток, модифицированные при процессах эмбриогенеза и/или пролиферации, и/или дифференцировки клеток, и/или патологии, предшествовавшей и/или сопутствовавшей регенерации и/или репарации ткани. Следует иметь в виду, что слово "морфоплазма", употребляемое здесь в широком смысле, охватывает здесь структурированную часть цитоплазмы клеток, представленную клеточными органелами, мембранами, цитоскелетом и т.п. клеточными структурами (7), а слово "гликокаликс" употребляется для обозначения углеводсодержащего слоя, примыкающего к внешней стороне плазматической мембраны клетки (8). Задача решается и тем, что в составе модифицированных компонентов морфоплазмы и гликокаликса клеток заявляемое БАС содержит термостабильные при температуре Tн £ 120o С компоненты. При этом относительное содержание термостабильных компонентов среди модифицированных компонентов составляет 30-100% по массе. Кроме того, в составе модифицированных компонентов морфоплазмы и гликокаликса клеток оно содержит низкомолекулярные компоненты с молекулярной массой M £ 10,0 кДа . При этом относительное содержание низкомолекулярных компонентов среди модифицированных компонент морфоплазмы и гликокаликса клеток составляет 30-100% по массе. Поставленная задача решается также и тем, что заявляемое средство содержит в составе продуктов гидролиза с модифицированными компонентами морфоплазмы и гликокаликса клеток органические соединения в следующем соотношении, мас. %: При этом заявляемое средство содержит углеводы в составе органических соединений в следующем соотношении мас. % в составе: В заявляемом БАС соотношение массовых содержаний углеводов и пептидов в составе органических соединений с молекулярной массой Мун = 0,8-10,0 кДа лежит в пределах G = 0,25-0,60. Задача решается и тем, что заявляемое средство содержит в составе продуктов гидролиза с модифицированными компонентами морфоплазмы и гликокаликса клеток органические соединения в следующем соотношении, мас. %: Кроме того, заявляемое средство содержит в составе продуктов гидролиза с модифицированными компонентами морфоплазмы и гликокаликса клеток органические соединения в следующем соотношении, мас. %: Заявляемое средство содержит также в составе продуктов гидролиза с модифицированными компонентами морфоплазмы и гликокаликса клеток органические соединения в следующем соотношении, мас. %: Поставленная задача решается также и тем, что в способе получения БАС, обладающего иммуномодулирующим свойством, при котором осуществляют измельчение промытого сырья из животной ткани, гидролиз полученных ингредиентов с последующим выделением продуктов гидролиза, их фильтрацией и выделением супернатанта в качестве целевого продукта, в качестве сырья используют животную ткань, модифицированную при процессах эмбриогенеза и/или пролиферации, и/или дифференцировки клеток, и/или патологии, предшествовавшей и/или сопутствовавшей регенерации и/или репарации ткани, и перед гидролизом проводят ее гомогенизацию и очистку от неразрушенных элементов ткани с выделением супернатанта, содержащего ингредиенты с компонентами морфоплазмы и гликокаликса клеток. В качестве сырья используют эмбриональную ткань, сперматогонии и сперматоциты семенников, плацентарную ткань, эпителиальную ткань кишечника, клетки костного мозга, дифференцирующуюся ткань тимоцитов тимуса, регенерирующую кожную ткань, ткань регенерирующей печени, ткань регенерирующих конечностей земноводных, патологически измененную ткань, взятую до стадии регенерации. При этом очистку от неразрушенных элементов ткани после гомогенизации в физиологическом и/или буферном растворе осуществляют путем фильтрации и/или центрифугирования при ускорении 150-250д в течение 10-15 мин. Кроме того, измельчение сырья из животной ткани осуществляют перед гомогенизацией и ведут до повреждения целостности клеток с последующей экстракцией их содержимого путем дополнительной промывки с фильтрацией и/или центрифугированием при ускорении 300-15000g в течение 10-20 мин с выделением экстрагированной измельченной ткани. Задача решается и тем, что в составе ингредиентов, подвергаемых гидролизу, содержание компонентов морфоплазмы и гликокаликса клеток составляет 30-60% от общей массы органических соединений. Гидролиз проводят при температуре Т р = 4-45°С. При этом гидролиз может быть осуществлен в присутствии консерванта. Поставленная задача решается еще и тем, что продукты гидролиза ингредиентов подвергают термообработке при температуре Тн = 60-120°С до полной денатурации термолабильных соединений и фильтруют и/или центрифугируют их при ускорении свыше 1500g в течение 20-40 мин с выделением супернатанта, содержащего термостабильные компоненты в качестве целевого продукта. Кроме того, продукты гидролиза ингредиентов подвергают фракционированию путем диализа через полупроницаемую пленку и/или ультрафильтрации, и/или гельфильтрации с выделением фракции, содержащей низкомолекулярные компоненты морфоплазмы и гликокаликса клеток с молекулярной массой M £ 10,0 кДа в качестве целевого продукта. Поставленная в изобретении задача решается и тем, что известный препарат для нормализации физиологического состояния организма человека и животных, содержащий биологически активное средство на основе продуктов гидролиза ингредиентов животной ткани, и наполнитель, в качестве биологически активного средства, содержит в основе продуктов гидролиза компоненты морфоплазмы и гликокаликса клеток, модифицированные при процессах эмбриогенеза и/или пролиферации, и/или дифференцировки клеток, и/или патологии, предшествовавшей и/или сопутствовавшей регенерации и/или репарации ткани, при его содержании в препарате 0,001-85,0 мас.%, остальное - наполнитель. Задача решается и тем, что препарат в качестве действующего начала содержит биологически активное средство, содержащее в составе продуктов гидролиза с модифицированными компонентами морфоплазмы и гликокаликса клеток органические соединения в следующем соотношении, мас. %: Кроме того, поставленная задача может быть решена и тем, что БАС содержит органические соединения в соотношении, мас. %: Поставленная в изобретении задача может быть решена так же и гем, что БАС содержит органические соединения в соотношении, мас. %: В заявленном препарате может быть также использовано биологически активное средство, содержащее в своем составе, мас. %: В качестве наполнителя может быть использован физиологический раствор натрия хлористого и/или солевой буферный раствор, и/или углеводные соединения, и/или жиры минерального, животного, растительного или синтетического происхождения и их смеси. Препарат может дополнительно содержать консервант. Поставленная задача решается и тем, что в известном способе нормализации физиологического состояния человека и животных при заболеваниях, вызванных преимущественно патологически измененными и/или чужеродными клетками, микроорганизмами и/или продуктами их жизнедеятельности, предусматривающий введение в организм препарата на основе продуктов гидролиза ингредиентов животной ткани, что в качестве препарата используют композицию из 0,001-85,0 мас.% биологически активного средства, содержащего в составе продуктов гидролиза компоненты морфоплазмы и гликокаликса клеток, модифицированные при процессах эмбриогенеза и/или пролиферации, и/или дифференцировки клеток, и/или патологии, предшествовавшей и/или сопутствовавшей регенерации и/или репарации ткани, и 15,0-99,999 мас.% наполнителя, а введение препарата в организм осуществляют путем внутримышечых инъекций в дозе 0,005-0,5 мг упомянутого средства на кг массы тела с интервалом между инъекциями 1-7 дней и/или ингаляций в дозе 0,012-0,12 мг средства на кг массы тела с интервалом между ингаляциями 4-48 часов, и/или сублингвального введения в дозе 0,012-0,12 мг средства на кг массы тела с интервалом между введениями 4-48 часов, и/или выпаивания в дозе 0,02-1,0 мг средства на кг массы тела с интервалом между выпаиваниями 1-10 дней и/или интегрального введения в пилюлях в дозе 0,02-1,0 мг средства на кг массы тела с интервалом между введениями 1-10 дней, и/или интраназального введения в суточной дозе 0,001-0,05 мг средства на кг массы тела с интервалом между введениями 2-24 часа, и/или аппликации на слизистую или раневую поверхность в виде компрессов, свечей, присыпок, мазей и гелей с интервалами между применениями 1-10 дней, - до нормализации параметров физиологического состояния. При этом нормализацию физиологического состояния человека и животных осуществляют путем стимуляции иммунной системы, преимущественно активацией ретикулоэндотелиальной системы. Т-, В-систем, нойтрофилов и/или популяции естественных киллеров. Установлено, что практическая эффективность заявляемого БАС, полученного заявляемым способом, заключается в его высокой биологической активности, и прежде всего, в повышенном иммуномодулирующим эффекте (свойстве). В значительной степени этим и определяется стратегия воздействия на организм заявляемого БАС при нормализации параметров гомеостаза. Направлено активируя иммунную систему, и прежде всего клетки макрофагально-гранулоцитарного ряда, заявляемое БАС и препарат на его основе обеспечивает: 1) воздействие не па конкретную патологию, а на улучшение общего статуса физиологического состояния организма, мобилизуя внутренние резервы, направленные на нормализацию всех параметров гомеостаза, в том числе и на данную патологию. При этом корректируют и сопутствующие или вызванные патологией отклонения от нормы без побочных явлений. Нормализуя измененные параметры, заявляемое БАС, в отличие от многих других лекарственных средств, не ухудшает остальных параметров гомеостаза организма; 2) комплексное воздействие, которое позволяет расширить область применения БАС для целого ряда заболеваний, контроль над которыми лежит в рамках компетенции иммунной системы организма; 3) степень эффективности воздействия, направленную на нормализацию параметров гомеостаза, которая коррелирует со степенью отклонения их от нормы. В случае отсутствия отклонений или нормализации параметров в процессе лечения активность стимулированных препаратом клеток иммунной системы нормализуется уже через несколько суток после введения заявляемого БАС без каких-либо последствий для организма и, таким образом, эффект воздействия БАС прекращается. При этом реализуется принцип обратной связи: чем меньше отклонение, тем меньше эффект воздействия, и наоборот. Указанные результаты достигнуты благодаря особым свойствам заявляемого БАС и препарата на его основе, отсутствующим у аналогов, проявление которых обеспечено наличием в составе БАС продуктов гидролиза, содержащих компоненты морфоплазмы и гликокаликса клеток, модифицированные при процессах эмбриогенеза и/или пролиферации и/или дифференцировки, и/или патологии, предшествовавшей и/или сопутствовавшей регенерации и/или репарации ткани. Установлено, что повышенное содержание модифицированных компонентов морфоплазмы и гликокаликса клеток обеспечивается использованием животных тканей, взятых на стадии протекания в них указанных выше процессов эмбриогенеза и/или пролиферации, и/или дифференцировки, и/или патологических процессов, которые предшествовали и/или сопутствовали регенерации и/или репарации ткани. Таковыми тканями являются: - дифференцирующиеся тимоциты тимуса; - сперматогонии и сперматоциты семенников, клетки костного мозга, эпителиальная ткань кишечника; - эмбриональная ткань, плацентарная ткань; - ткань регенерирующих конечностей земноводных, регенерирующая печень после частичной гепатэктомии или после поражения отравляющими веществами, например, четыреххлористым углеродом (ССl4), регенерирующая кожная ткань, а также ткань с патологией в ней, например при гангрене, химическом или термическом поражении. Использование описанных животных тканей в качестве сырья в заявляемом способе обеспечивает получение БАС с ожидаемыми свойствами. Установлено, что характерной особенностью перечисленных выше разновидностей тканей является наличие в них модифицированных компонентов морфоплазмы и гликокаликса клеток, позволяющее отдифференцировать их от интактных или покоящихся клеток тканей взрослых особей. Эта особенность модифицированных компонентов морфоплазмы и гликокаликса клеток указанных тканей позволяет использовать их в заявленном БАС и препарате на его основе, при введении которого в организм животного или человека обеспечивается возможность стимулирования специфической ответной реакции организма на собственную патологию. Ключевую роль в этом процессе играет иммунная система организма. Материальными носителями информации в перечисленных выше патологических процессах и/или отклонениях от нормы в указанных выше тканях являются специфические компоненты, которые входят в структуру морфоплазмы и гликокаликса клеток. подвергающуюся модификации при изменении физиологического статуса клеток. Заявленное БАС и препарат на его основе содержат модифицированные компоненты морфоплазмы и гликокалмкса клеток, что позволяет при их использовании стимулировать указанную выше ответную реакцию организма. Выполнение перед гидролизом процесса промывки измельченной ткани от компонентов экстракта ткани и крови в сочетании с гомогенизацией, после которой осуществляют очистку от неразрушенных элементов ткани, обеспечивает в заявляемом БАС и препарате на его основе высокую концентрацию компонентов морфоплазмы и гликокаликса клеток (30-60%), а также значительное снижение содержания иммунодепрессантов, нейтральных (в отношении специфической активности) и балластных соединений, составляющих остаток массы в целевом продукте. Это усиливает специфический иммунный ответ организма. Ответная реакция организма существенно усиливается при введении заявляемого средства, которое содержит в своем составе компоненты морфоплазмы и гликокаликса клеток в виде термостабильных компонентов (стабильных при температуре нагревания Tн £ 120o С), в виде низкомолекулярных компонентов с молекулярной массой M £ 10,0 кДа . Заявляемое БАС используют в качестве действующего начала в препарате, в котором в зависимости от предназначения применяются различные наполнители. Для внутреннего применения препарат назначается в виде инъекций и наполнителем служит физиологический раствор натрия хлористого или буферный солевой раствор. Для наружного применения, помимо перечисленных растворов, в качестве наполнителя могут быть использованы также и составные компоненты гелей - углеводные соединения как животного, так и растительного происхождения, например, мед, соки, мякоть растений и тому подобное, или мазей - жиры минерального, животного, растительного или синтетического происхождения и их смеси. При этом обнаружена неочевидная зависимость между эффективностью препарата и содержанием БАС. Это позволило значительно снизить в препарате действующего начала при сохранении необходимой эффективности препарата и тем самым предотвратить возможность передозировок, возникновения побочных эффектов, а также существенно снизить его стоимость. Кроме того, обнаружено, что описанные выше новые свойства препарата позволяют использовать его для нормализации физиологического состояния организма при введении его в организм практически в любых дозах, а именно от 0,001 до нескольких граммов на 1 кг массы тела. Указанные свойства иллюстрируются ниже в примерах конкретной реализации изобретения, в частности в примерах 1,2,4,8,9,12,16,18-25 и других В вышеупомянутом способе благодаря совокупным факторам использования нового препарата, конкретных его дозировок, кратности его введения в организм, а также способов введения его в организм человека и животных обеспечивается лечение заболеваний, вызванных преимущественно патологически измененными и/или чужеродными клетками, микроорганизмами и/или продуктами их жизнедеятельности, что проиллюстрировано ниже в примерах конкретного использования изобретения, в частности в примерах 3,4,7,8,11-13, 15-17 и других. Согласно изобретению, биологически активное средство, обладающее иммуномодулирующим свойством, для нормализации физиологического состояния организма получают следующим образом. В качестве сырья берут животную ткань, модифицированную при эмбриогенезе и/или пролиферации, и/или дифференцировке, и/или патологии, предшествующей и/или сопутствующей регенерации и/или репарации ткани. Указанную животную ткань промывают и измельчают, после чего гомогенизируют в физиологическом и/или буферном растворе до полного разрушения клеток, а гомогенизированную смесь очищают от неразрушенных элементов ткани фильтрацией и/или центрифугированием с выделением ингредиентов, содержащих компоненты морфоплазмы и гликокаликса клеток, и подвергают гидролизу. Продукты гидролиза после центрифугирования и/или фильтрации используют в качестве целевого продукта для нормализации физиологического состояния организма, в частности, при наружном применении (ингаляции, аппликации, интраназально, в составе мази и так далее). Эффективность целевого продукта зависит от содержания в нем модифицированных компонентов морфоплазмы и гликокаликса клеток. Увеличения их содержания добиваются выбором сырья с повышенной интенсивностью процессов модификации в тканях и выбором оптимальных условий осуществления способа его обработки. Выбор сырья определяется тем обстоятельством, что компоненты морфоплазмы и гликокаликса клеток достаточно специфично реагируют на изменение физиологического состояния клеток изменением всей структурной организации, которые приводят к изменению иммуногенности ткани, и тем самым вызывают соответствующие реакции иммунной системы организма. Установлено, что иммуногенность модифицированной структуры обеспечивается на стадии протекания указанных выше процессов (эмбриогенез и тому подобное). В качестве животной ткани используют, в частности: - дифференцирующиеся тимоциты тимуса (процесс дифференцировки клеток); - сперматогонии и сперматоциты семенников, клетки костного мозга, эпителиальную ткань кишечника (процессы пролиферации и дифференцировки клеток); - эмбриональную ткань, плацентарную ткань (процессы пролиферации, дифференцировки, эмбриогенеза); - ткани регенерирующих конечностей земноводных, регенерирующую печень крыс после частичной гепатектомии или после поражения четыреххлористым углеродом (ССl4), регенерирующую кожную ткань, а также ткань с патологией в ней, например, при гангрене, химическом или термическом поражении (комбинация в различном сочетании вышеперечисленных процессов). Использование описанных животных тканей в качестве сырья в заявляемом способе изготовления обеспечивает получение биологического активного средства с ожидаемыми свойствами. Установлено, что характерной особенностью перечисленных выше разновидностей тканей является изменение в них структуры компонентов морфоплазмы и гликокаликса клеток ткани, позволяющее отдифференцировать их от иитактных или покоящихся клеток тканей взрослых особей. Эта особенность модифицированных компонентов морфоплазмы и гликокаликса клеток указанных тканей позволяет использовать их в заявляемом БАС, при введении которого в организм животного или человека обеспечивается возможность стимулирования специфической ответной реакции организма на собственную патологию. Ключевую роль в этом процессе играет иммунная система организма. Предпочтительнее использовать животную ткань, взятую на стадии инкремента процесса модификации. Эту стадию определяют эмпирически по характеру изменения иммуногенности. Так, в случае использования эмбриональной ткани этот период составляет первую половину эмбриогенеза. Регенерирующую печень крыс используют на 4-12 часу после частичной гепатэктомии, а в случае использования регенерирующих конечностей земноводных - на стадии образования бластемы. Увеличение относительного содержания компонентов морфоплазмы и гликокаликса клеток достигается благодаря осуществлению такого режима заявленного способа, одним из непременных условий осуществления которого является удаление неразрушенных элементов ткани, представленных в основном соединительной тканью. Очистку от неразрушенных элементов ткани обеспечивают в процессе центрифугирования в диапазоне ускорений 150-250g в течение 10-15 мин, что объясняется тем, что при более высоких ускорениям и большей продолжительности процесса происходит осаждение элементов морфоплазмы и гликокаликса клеток, а при ускорениях менее 150 g очистка малоэффективна. Очистку от неразрушенных элементов обеспечивают также фильтрованием на крупнопористом фильтре, например через несколько слоев марли, через хлопчатобумажную ткань (бязь) или через капроновые сетки. Для усиления иммуномодулирующих свойств целевого продукта перед гомогенизацией ткань измельчают до повреждения целостности клеток с последующей экстракцией их содержимого дополнительным промыванием физиологическим раствором и/или раствором органической кислоты путем фильтрования и/или центрифугирования при ускорении 300-15000g в течение 10-20 мин м выделяют экстрагированную измельченную ткань, которую подвергают гомогенизации. При этом, с одной стороны, добиваются удаления значительной части иммунодепрессантов, присутствующих в составе сыворотки крови и экстракта ткани, а с другой стороны - увеличения относительного содержания компонентов морфоплазмы и гликокаликса клеток, что существенно для тканей с низким их содержанием. Дополнительная промывка используемой измельченной животной ткани перед гомогенизацией путем центрифугирования при 300-15000g в течение 10-20 мин позволяет наиболее качественно отделить экстрагируемую ткань от экстракта в промышленных условиях. Аналогичный эффект достигается фильтрованием на крупнопористом фильтре, например, через несколько слоев марли, через хлопчатобумажную ткань (бязь) или через капроновые сетки. Относительное содержание компонентов морфоплазмы и гликокаликса клеток в ингредиентах ткани, выделенных для проведения гидролиза, определяют по содержанию белков и углеводов в клеточных структурах, освобожденных от неразрушенных элементов ткани. Эффективность целевого продукта а значительной степени возрастает при использовании компонентов морфоплазмы и гликокаликса клеток в виде низкомолекулярных компонентов. Это позволяет с одной стороны избежать проявления нежелательных побочных явлений, а с другой - получить препарат широкого профиля действия без ограничений на видоспецифичность животных и отвечающих требованиям медицины. С этой целью ингредиенты ткани, содержащие модифицированные компонентов морфоплазмы и гликокаликса клеток подвергали гидролизу, расщепляющему высокомолекулярные структурные образования морфоплазмы и гликокаликса клеток на продукты, содержащие компоненты с меньшей молекулярной массой. Эффективность продуктов гидролиза будет зависеть от специфичности гидролиза, которая в значительной степени зависит от температурно-временных характеристик. Установлено, что иммуномодулирующее свойство заявляемого средства, в частности повышение активности макрофагов перитонеального экссудата крыс in vitro максимально в случае проведения гидролиза в диапазоне рабочих температур Тр = 4-45°С. Отклонения от него нежелательны, так как: - при Тр 45°С происходит снижение эффективности ферментов, обеспечивающих гидролиз сырья, и ускоряются процессы распада активных компонентов. В результате снижается его качество. Продолжительность гидролиза устанавливают по достижению максимального уровня иммуностимулирующего эффекта (свойств) заявляемого средства, в частности, по активации макрофагов перитонеального экссудата согласно НСТ-тесту. Продолжительный гидролиз проводят в присутствии консерванта. Повышение относительного содержания (относительной концентрации) низкомолекулярных компонентов в продуктах гидролиза по отношению к содержанию высокомолекулярных термолабильных соединений обеспечивают термообработкой гидролизата до полной денатурации термолабильных соединений, которые затем удаляют в виде осадка центрифугированием при ускорении не менее 1500g в течение 20-40 мин и/или фильтрацией. Супернатант, содержащий термостабильные компоненты, используют в качестве целевого продукта. Термообработку продуктов гидролиза ведут в диапазоне температур Тн = 60-120°С, так как выход за пределы этого диапазона приводит к уменьшению специфической активности средства. Так, при температуре Т н 120°С происходит скачкообразное увеличение скорости структурных изменений в пептидных и углеводных компонентах целевого продукта, что также снижает его качество. После термообработки выделение термостабильных компонентов осуществляют центрифугированием при ускорении не менее 1500g, в течение 20-40 мин, так как при уменьшении этой величины существенно снижается степень удаления денатурированных термолабильных соединений, а проведение его в течение 20-40 мин является наиболее оптимальным. Коагулированные денатурированные термолабильные соединения можно отделить от супернатанта фильтрованием через бумажный фильтр. Целевой продукт, содержащий термостабильные компоненты морфоплазмы и гликокаликса клеток, обладает большей специфической активностью и позволяет решать более широкий спектр задач. Он может быть применен в качестве инъекционного средства как в ветеринарии, так и в медицине. Дальнейшее повышение специфической активности БАС достигается выделением низкомолекулярных компонентов с молекулярной массой M £ 10,0 кДа из продуктов гидролиза путем диализа через полунепроницаемую пленку и/или ультрафильтрацией. и/или гельфильтрацией, что позволяет полностью удалить высокомолекулярные соединения, способные вызывать побочные эффекты. Достигаемая таким образом величина эффективности позволяет широко использовать полученный целевой продукт в медицине. Заявляемое БАС в качестве действующего начала используется для приготовления лекарственного препарата, где его концентрация зависит от цели использования. В препаратах для выпойки и подкормки животных концентрация БАС невысока и возрастает в препаратах для инъекционного применения, а также в мазях, гелях и порошках. В зависимости от назначения в препаратах используют различные наполнители. Так, в препаратах для инъекций, ингаляций, аппликаций и интраназального использования применяют физиологический раствор натрия хлористого или солевой буферный раствор. Углеводные соединения в качестве наполнителя применяют в препаратах, предназначенных для подкормки пчел (например, 10%-ный сахарный сироп) или для приготовления гелей (например, мед, соки и мякоть растений). Для мазей в качестве наполнителя применяют жиры минерального, животного, растительного или синтетического происхождения и их смеси. Ниже приведены примеры конкретного выполнения и использования заявленной группы изобретений, а также изложены использованные методы определения состава биологически активных средств и их свойств. Пример 1. Для получения заявляемого БАС была использована эмбриональная ткань, взятая на стадии первой половины беременности коров. Из эмбрионов после дезинфицирования в слабом растворе перманганата калия (КМn7O4) вырезали мышечную и кожную ткань, печень, селезенку, поджелудочную железу, почки, легкие и сердце, которые подвергали грубому измельчению на мясорубке. Затем 10 кг фарша смешивали с 30 кг физиологического раствора и гомогенизировали на гомогенизаторе с ножевыми блендерами до получения однородной массы Очистку смеси от неразрушенных элементов ткани осуществляли декантацией, а полученную надосадочную жидкость с ингредиентами ткани, содержащими компоненты морфоплазмы и гликокаликса клеток, подвергали аутолизу при Тн = 45°С в течение 48 часов. Полученный гидролизат фильтровали на бумажном фильтре, а фильтрат использовали в качестве целевого продукта, состав органических соединений которого и вызываемая им специфическая активность представлены в таблицах 1 и 2. Целевой продукт, содержащий БАС в количестве 1,0 мас. %, а остальное - наполнитель, смешивали с 9 объемами огуречногрушевой мякоти и использовали в качестве лекарственного препарата в виде геловой маски для лица в косметических целях. При длительном хранении в гель добавляли консервант (нипагин и нипазол в соотношении массовых частей 5:1) в конечной концентрации 0,1 мас.%. Гель накладывали на лицо на 2-3 часа. Процедуру повторяли 1-2 раза в неделю. Лечебный эффект проявлялся после 4-10 сеансов и его контролировали по состоянию кожи. Пример 2. Эмбриональную ткань, полученную так же, как и в примере 1, подвергали измельчению. Затем 10 кг фарша смешивали с 30 кг физиологического раствора и гомогенизировали до получения однородной массы. Для удаления неразрушенных элементов ткани, в том числе элементов соединительной ткани, гомогенизированную массу центрифугировали при ускорении 250 g в гечение 10 мин. Поело ценрифугирования осадок удаляли, а супернатант фильтровали через хлопчатобумажную ткань (бязь) с целью удаления флотированного жира. В фильтрат очищенного таким образом гомогената, содержащего в ингредиентах 30 мас.% компонентов морфоплазмы и гликокаликса клеток, добавляли консервант (хинозол) до конечной концентрации 0,08 мас.%. После смешивания гомогенат подвергали гидролизу при температуре. поддерживаемой в диапазоне Тр = 4°С в течение 6 недель. Полученный гидролизат центрифугировали при ускорении 15000g в течение 20 мин с выделением супернатанта в качестве целевого продукта, состав органических соединений которого и вызываемая им специфическая активность представлены в таблицах 1 и 2. Целевой продукт, содержащий БАС в количестве 1,0 мас. %, а остальное - наполнитель, использовали в качестве лекарственного препарата для повышения сохранности ослабленного молодняка пушного зверя, а также цыплят домашней птицы в виде ингаляций в специальной камере, где животные находились 15-20 мин в камере препарат распыляли аэрозольно из расчета 0,5 мл на 1 м в течение 1 мин. Процедуру повторяли каждые 7 суток. Контроль эффекта осуществляли по уменьшению величины падежа молодняка, который уменьшился на 30-40%. Пример 3. Эмбриональную ткань, полученную так же, как в примере 1, подвергали измельчению. Полученный фарш заливали двойным объемом физиологического раствора и перемешивали. Смесь центрифугировали при ускорении 1500g в течение 20 мин. Осадок извлекали, вновь перемешивали в двойном объеме физиологического раствора и центрифугировали при тех же условиях. Операцию промывки фарша проводили 3 раза. Затем 10 кг промытого фарша смешивали с 30 кг сантимолярного фосфатного солевого буферного раствора (0,01 M PBS) pH 7,2, содержащего сантимолярный двузамещенный фосфат натрия и пятнадцатисантимолярный раствор натрия хлористого (0,01 M Na2HPО4 и 0,15 NaCl), и подвергали гомогенизации на коллоидной мельнице до получения однородной массы. Неразрушенные элементы ткани удаляли в виде осадка после центрифугирования при ускорении 150 g в течение 15 мин. Супернатант после удаления флотированного жира фильтрованием через хлопчатобумажную ткань (бязь) обрабатывали консервантом с конечной концентрацией 0,08 мас.%. После смешивания гомогенат, содержащий 60 мас.% компонентов морфоплазмы и гликокаликса клеток, подвергали гидролизу при температуре Тр = 4°C в течение 6 недель. Полученный гидролизат центрифугировали при ускорении 1500g в течение 40 мин с выделением супернатанта в качестве целевого продукта, состав органических соединений которого и вызываемая им специфическая активность представлены в таблицах 1 и 2. Целевой продукт, содержащий БАС в количестве 1,0 мас. %, а остальное - наполнитель, использовали в качестве лекарственного препарата для лечения телят, больных парагриппом в виде инъекций, которые осуществляли внутримышечно в дозе 0,05 мл/кг массы тела каждый третий день. Лечебный эффект проявлялся после 1-5 инъекций и его контролировали по температуре тела и наличию вируса в крови. Пример 4. Грубо измельченный на мясорубке фарш, полученный так же, как и в примере 1, заливали двойным объемом 3%-ной уксусной кислоты и перемешивали. Смесь фильтровали через хлопчатобумажную ткань под вакуумом на нутч-фильтре. Осадок извлекали, вновь перемешивали в двойном объеме физиологического раствора и центрифугировали при ускорении 300 g в течение 20 мин, 10 кг промытого фарша смешивали с 30 кг сантимолярного фосфатного солевого буферного раствора (0,01 M PBS) pH 7,2, содержащего сантимолярный двузамещенный фосфат натрия и пятнадцатисантимолярный раствор натрия хлористого (0,01 M Na2HPО4 и 0,15 NaCl) и подвергали гомогенизации на коллоидной мельнице до получения однородной массы. Для удаления неразрушенных элементов ткани гомогенизированную массу фильтровали через хлопчатобумажную ткань (бязь). В полученный фильтрат добавляли консервант в конечной концентрации 0,08 мас. %. После смешивания гомогенат, содержащий 50 мас. % компонентов морфоплазмы и гликокаликса клеток, подвергали гидролизу при температуре Тр = 20°C в течение 8 дней. Дальнейшие операции проводили, как в примере 3. Содержание органических соединений в целевом продукте и показатели его специфической активности, определенные экспериментально, приведены в таблицах 1 и 2. Целевой продукт, содержащий БАС в количестве 1,0 мас. %, а остальное - наполнитель, использовали в качестве лекарственного препарата для лечения дерматозов в виде мази, которую готовили путем смешивания ланолина, вазелина и целевого продукта БАС в соотношении 1:3:1 массовых частей. Мазь втирали в коже ежедневно. Лечебный эффект проявлялся через 4-12 дней и контролировали по состоянию кожи. Пример 5. Относительное содержание компонентов морфоплазмы и гликокаликса клеток в процентном отношении (по массе) к компонентам соединительной ткани и экстракта в ингредиентах ткани, выделенных для проведения гидролиза, определяли по содержанию белков и углеводов в клеточных структурах, освобожденных от неразрушенных элементов ткани. С этой целью очищенный так же, как и в примерах 1-4, от неразрушенных элементов ткани гомогенат подвергали ультрацентрифугированию при ускорении 100000g в течение 60 мин. Соотношение количества белка во всем осадке и во всем супернатанте указывает на соотношение по белку компонентов морфоплазмы и гликокаликса клеток к белкам экстракта. Определение содержания белка в осадке и супернатанте проводили после ультрацентрифугирования гомогената. После удаления супернатанта к 0,1 мл осадка добавляли 4,9 мл физиологического раствора и после суспендирования отбирали 0,1 мл для определения количества белка фотометрически по интенсивности окраски раствора, согласно методу SDS-Лоури (U.K.Laemmil. -Nature, - 1970, - v. 227, - 5259, - p. 680-685). Для определения количества белка в супернатанте к 0,1 мл супернатанта добавляли 0,9 мл физиологического раствора и после размешивания отбирали 0,1 мл для определения количества белка по SDSЛоури. Содержание компонентов соединительной ткани определяли аминокислотным анализом по наличию окснлизина и оксипролина. В отличие от известных заявляемые БАС при проверке не содержали данные аминокислоты. Содержание компонентов гликокаликса клеток определяли по количеству в гомогенате углеводов, входящих в состав соединений с молекулярной массой свыше 0,8 кДа, согласно антроновой реакции после удаления из гомогената гликогеновых гранул (S.Seifter, S.Dayton, C.Hovic. - Arch. Biochemistry and Biophysical, - 1950, - 25, -1, p. 191-200). С этой целью 20 мл гомогената ткани наслаивали в ультрацентрифужных пробирках емкостью 30 мл на 5 мл сахарозы с плотностью d = 1,40 и подвергали ультрацентрифугированию при ускорении 100000g в течение 60 мин. Гликоген, осевший на дно пробирки, удаляли, а элементы морфоплазмы и гликокаликса клеток отбирали на интерфазе и после отмывки от сахарозы центрифугированием в физиологическом растворе использовали для анализа. При определении количества углеводов в исследуемых образцах учитывали общее содержание углеводов после гидролиза м содержание свободных углеводов в виде мономеров. По разнице значений величины в этих измерениях определяли количество свободных углеводов в составе различных соединений. Для проведения общего гидролиза брали 1,0 мл исследуемого образца и смешивали с 1 мл четырехнормального раствора соляной кислоты (4,0 N НСl). Гидоролиз осуществляли при температуре 105°С в течение 2 часов, после чего гидролизат упаривали в эксикаторе с сухим едким натром (NaOH) под вакуумом. Высушенную пробу растворяли в 1,0 мл дистиллированной воды и использовали для анализа. Определение количества свободных углеводов неопосредственно в БАС или после кислотного гидролиза проводили следующим образом: 1 мл пробы смешивали с 1 мл дистиллированной воды, после чего при постоянном перемешивании при температуре -5°С добавляли 4 мл 0,2%-ного антронового реактива, приготовленного на 95%-ной серной кислоте (H2SO4). Полученную смесь кипятили при температуре 95°С в течение 10 мин и после охлаждения определяли оптическую плотность на длине волны 620 нм. В качестве стандарта применяли глюкозу в концентрации 20 мкг/мл. При белковом анализе БАС, полученного в примерах 1 и 2, содержание компонентов морфоплазмы и гликокаликса клеток составляло 37,6 ± 7,4%, а для БАС в примерах 3 и 4 - 51,8 ± 8,2%. Здесь и далее по тексту и в приведенных таблицах значение экспериментально определенных величин выражено их средними значениями с пределами отклонений от среднего, вычисленными с учетом критерия Стьюдента. Пример 6. Супернатант гидролиза, полученный в примере 3, подвергали термообработке при температурах нагрева (термообработки): Тн1 = 55°С, Тн2 = 60°С, Тн3 = 95°С, Тн4 = 120°С и Тн5 = 135°С. Нагрев вели до полной денатурации термолабильных соединений в составе продуктов гидролиза, затем центрифугировали при ускорении свыше 1500g в течение 30 мин с выделением супернатанта, содержащего термостабильные компоненты в качестве целевого продукта. Полученный целевой продукт в каждом случае обладал своим иммуномодулирующим эффектом свойством), значения которых указаны в таблице 3, в которой представлено распределение значений специфической активности заявляемого БАС в зависимости от выбранного диапазона температуры нагрева гидролизата и за пределами этого диапазона. При этом оптимальной является температура нагрева Тн = 95°С, при которой получаемый целевой продукт обеспечивал максимальное усиление ферментативной и фагоцитарной активности, которое соответственно составляло 72,8% и 64,3%. При Т н = 55°С повышение величины специфической активности в сравнении с контролем составляет в среднем 61,1% - по НСТ-тесту и 52,3% - по фагоцитозу. При Т н > 120°С происходит скачкообразное увеличение скорости разложения пептидов и белков, вызывающее изменения в углеводных компонентах, приводящие к структурным изменениям компонентов целевого продукта, что отражается на снижении величины специфической активности БАС. Так при Тн = 135°С повышение специфической активности заявляемого БАС по сравнению с контролем составляет в среднем 57,3% - по НСТ-тесту и 43,0% - по фагоцитозу. Максимальная величина специфической активности БАС по сравнению с контролем обеспечивается в диапазоне температур Т н = 60120°С, при котором повышение активности макрофагов перитонеального экссудата крыс (in vitro) составляет в среднем 72,8% - по усилению ферментативной активности (НТС-тест), а по усилению фагоцитарной активности (по E.coli) - 64,3%. Пример 7. Супернатант гидролизата, полученный в примере 3, подвергали термообработке кипячением при температуре нагрева Тн = 95°C до полной денатурации термолабильных соединений и после охлаждения центрифугировали при ускорении 1500g в течение 40 мин. Осадок в виде денатурированных соединений удаляли, а в качестве целевого продукта использовали супернатант, который содержал термостабильные компоненты в количестве 60 мас. % по пептидам в продуктах гидролиза водорастворимых соединений до термообработки. Содержание органических соединений в продуктах гидролиза и показатели специфической активности полученного средства, определенные экспериментально, указаны в таблицах 1 и 2. Целевой продукт, содержащий БАС в количестве 0,5 мас.%, а остальное - наполнитель, использовали в качестве лекарственного препарата для лечения маститов коров в виде инъекций, которые препарата осуществляли внутримышечно в дозе 0,05 мл/кг массы тела каждый третий день. Лечебный эффект проявлялся после 1-4 инъекций и его контролировали по состоянию вымени и количеству гнойных выделений из сосков. Пример 8. Супернатант гидролизата, полученный в примере 2, подвергали термообработке при Т р = 95°С до полной денатурации термолабильных соединений и после охлаждения центрифугировали при ускорении 50000g в течение 20 мин. Осадок удаляли, а в качестве целевого продукта использовали супернатант, который до термообработки содержал термостабильные компоненты в количестве 30 мас. % по пептидам в продуктах гидролиза водорастворимых соединений. Содержание органических соединений в продуктах гидролиза и показатели специфической активности полученного средства, определенные экспериментально, указаны в таблицах 1 и 2. Полученный целевой продукт, содержащий БАС в количестве 0,5 мас. %, а остальное - наполнитель, использовали в качестве лекарственного препарата для профилактики заболеваемости телят парагриппом в виде инъекций, которые осуществляли внутримышечно в дозе 0,05 мл/кг массы тела два раза с интервалом 14 дней. Эффективность применения препарата регистрировали по количеству заболевших в течение месяца животных, количество которых в опытной группе не превышало 10%, тогда как в контроле достигало 22-28%. Пример 9. Гидролизат, полученный в примере 4, подвергали термообработке при температуре Тн = 95°С до полной денатурации термолабильных соединений и после охлаждения фильтровали через фильтровальную бумагу на нутч-фильтре. Фильтрат, содержащий термостабильные компоненты в количестве 45% от массы пептидов в продуктах гидролиза до термообработки водорастворимых соединений, использовали в качестве целевого продукта, Содержание органических соединений в продуктах гидролиза и показатели специфической активности полученного средства, определенные экспериментально, указаны в таблицах 1 и 2. Целевой продукт лиофильно высушивали и использовали сублингвально в качестве лекарственного препарата для лечения маститов у женщин. Процедуру выполняли ежедневно. Лечебный эффект проявлялся через 1-4 дня и его контролировали по состоянию груди (по наличию уплотнений, гнойных выделений) и анализу крови. Пример 10. Супернатантгидролизата, полученный в примере 3, подвергали фракционированию на ультрафильтрационной установке "Amicon" с использованием ультрафильтров пропускающих соединения с молекулярной массой меньшей или равной: 50,0 кДа; 10,0 кДа, 5,0 кДа; 1,0 кДа; 0,8 кДа и 0,5 кДа. Биологическую активность полученных фракций, содержащих соединения с молекулярной массой; 1) M1 > 50,0 кДа; 2) 10,0 кДа< М2 < 50,0 кДа; 3) М3 < 10,0 кДа; 4) М4 < 5,0 кДа; 5) М5 < 1,0 кДа; 6) М6 < 0,8 кДа и 7) M7 10,0 кДа связано с усилением влияния ингибиторов в целевом продукте и снижением концентрации активной субстанции; 3) снижение специфической активности при молекулярной массе М0,8 кДа. Пример 11. Супернатант гидролизата, полученный в примере 3, подвергали ультрафильтрации на полых волокнах ВПУ-15-ПА (ТУ 6-12-151-87) аппарата АР-2,0. Полученный ультрафильтрат, содержащий низкомолекулярные компоненты с молекулярной массой M £ 10,0 кДа , использовали в качестве целевого продукта, который содержал низкомолекулярные компоненты с M £ 10,0 кДа в количестве 60 мас. % по пептидам в продуктах гидролиза водорастворимых соединений до ультрафильграции. Содержание органических соединений в продуктах гидролиза и показатели специфической активности полученного средства, определенные экспериментально, указаны в таблицах 1 и 2. Целевой продукт, содержащий БАС в количестве 0,1 мас. %, а остальное - наполнитель, использовали в качестве лекарственного препарата для лечения экспериментального гепатита крыс в виде инъекций, которые осуществляли внутримышечно в дозе 0,05 мл/кг массы тела через день (характер и результаты лечения более подробно изложены в примерах 34 и 35). Пример 12. Супернатант гидролизата, полученный в примере 2, подвергали диализу в течение 16-24 часов через целлофановую пленку против физиологического раствора, 1 кг которого содержал 0,8 г консерванта Полученный диализат использовали в качестве целевого продукта, который содержал низкомолекулярные компоненты с M £ 10,0 кДа в количестве 30 мас. % по пептидам в продуктах гидролиза водорастворимых соединений до диализа. Содержание органических соединений в продуктах гидролиза и показатели специфической активности полученного средства, определенные экспериментально, указаны в таблицах 1 и 2. Целевой продукт, содержащий БАС в количестве 0,1 мас. %, а остальное - наполнитель, использовали в качестве лекарственного препарата в виде инъекций телятам для нормализации параметров гомеостаза. Инъекции препарата телятам, с отклонениями от нормы, осуществляли внутримышечно в дозе 0,05 мл/кг массы тела каждые 1-2 месяца. Контроль эффекта осуществляли ежемесячным взвешиванием животных, результаты которого свидетельствовали в повышении на 45-70% среднесуточных привесов по сравнению с контрольной группой необработанных препаратом животных. Пример 13. Супернатант гидролизата, полученный в примере 7, подвергали гельфильтрации в сефадексе G25 на колонке диаметром d = 26 мм и длиной h = 600 мм, уравновешенной децимолярным (0,01 M) фосфатным буферным раствором pH 7,2, содержащим пятнадцатисантимолярный хлористый натрий (0,15 M NaCl). Фракционирование супернатанта гидролизата по молекулярным массам осуществляли путем элюирования колонки тем же буферным раствором и хроматографический профиль элюата контролировали спектрометрически при длине волны 280 нм. Фракцию низкомолекулярных компонентов гидролизата элюировали в качестве целевого продукта. Содержание органических соединений в продуктах гидролиза и показатели специфической активности полученного средства, определенные экспериментально, указаны в таблицах 1 и 2. Целевой продукт, содержащий БАС в количестве 0,1 мас. %, а остальное - наполнитель, использовали в качестве лекарственного препарата для лечения телят, больных воспалением легких или острыми респираторными заболеваниями (ОРЗ), в виде инъекций, которые осуществляли внутримышечно в дозе 0,05 мл/кг массы тела каждый третий день. Лечебный эффект, который проявлялся после 1-7 инъекций, контролировали по температуре тела. Пример 14. Зависимость эффективности заявляемого БАС от содержания в нем модифицированных компонентов морфоплазмы и гликокаликса клеток определяли использованием сырья из животных тканей, в которых проходили процессы эмбриогенеза и/или пролиферации, и/или дифференцировки клеток, и/или патологии, предшествовавшей и/или сопутствовавшей регенерации и/или репарации ткани. Полученные ткани обрабатывали так же, как и в примере 7. Свойства целевого продукта полученного при этом, то есть с использованием ткани каждого из указанных видов модификаций клеточных структур, а именно морфоплазмы и гликокаликса клеток, сведены в таблицу 5. Анализ таблицы 5 показывает, что наличие иммуномодулирующего эффекта у заявляемого БАС и существенное усиление этого эффекта зависит от используемого сырья, из которого получали продукты гидролиза, содержащие модифицированные компоненты морфоплазмы и гликокаликса клеток. Так, в качестве сырья из животной ткани, взятого именно на стадии пролиферации и дифференцировки клеток, были использованы сперматогонии и сперматоциты семенников крыс. клетки костного мозга, эпителиальная ткань кишечника крыс, а в качестве сырья с процессами эмбриогенеза была использована эмбриональная ткань крыс. В качестве сырья с процессами патологии, предшествовавшей регенерации, была использована ткань регенерирующих конечностей аксолотля, печеночная ткань крыс после частичной гепатэктомии, а в качестве сырья с патологией, сопутствующей регенерации печеночная ткань крыс после подкожного введения четыреххлористого углерода (ССl4). Одновременно с полученными экспериментальными данными в таблице 5 для сравнения отражены также сведения по иммуномодулирующему эффекту, полученному при использовании в качестве сырья щечной и печеночной интактной ткани взрослых особей крыс-самцов. Анализ данных таблицы 5 показывает, что иммуномодулирующий эффект заявляемого БАС при использовании тканей, взятых на стадии протекания в них процесса эмбриогенеза, пролиферации и патологии, которая предшествовала и/или сопутствовала регенерации и/или репарации, существенно выше, чем у известных средств, использующих сырье из животной ткани, в котором указанные процессы отсутствовали. Кроме того, можно также сделать вывод в том, что из тканей, в которых наблюдаются указанные процессы, наибольшим иммуномодулирующим эффектом обладают регенерирующая печеночная ткань, эмбриональная ткань и регенерирующая ткань конечностей земноводных. Пример 15. В качестве сырья использовали регенерирующую печень крыс на 4-12 часу после гепатэктомии, выполненной согласно известному методу (G.M.Higgins, R.M.Anderson Experimental pathology of the liver. - Arch. Pathology. - 1931-N 12-p. 186). Печеночную ткань мелко нарезали и смешивали с трехкратным объемом физиологического раствора, после чего центрифугировали при ускорении 15000g в течение 10 мин, а полученный осадок смешивали с трехкратным объемом физиологического раствора и центрифугировали при тех же условиях. Операцию промывки измельченной печеночной ткани повторяли 3 раза и затем дальнейшие стадии получения целевого продукта выполняли так же, как в примерах 3, 7 и 11. Специфическую активность полученных целевых продуктов определяли экспериментально по активации репарационных способностей гепатоцитов печени крыс после поражения четыреххлористым углеродом (ССl4), при котором активность Na, К-АТФазы восстанавливалась, соответственно, на 32,7 ± 3,1%; 43,6 ± 3,9% и 85,4 ±7,8%, по сравнению с контрольной группой животных, которым заявляемое средство не вводили, Активность аминотрансфераз в крови восстанавливалась, соответственно, на 37,4 ± 2,8%. 47,2 ± 3,4% и 98,3 ± 1,7%, а концентрация калия в гепатоцитах печени - на 22,6 ± 1,8%; 28,9 ± 2,5% и 59,1 ± 4,7%. Целевой продукт, содержащий БАС в количестве 0,1 мас. %, а остальное - наполнитель, использовали в качестве лекарственного препарата для лечения телят, больных гепатитом, в виде инъекций, которые осуществляли внутримышечно в дозе 0,05 мл/кг массы тела каждый 3-й день. Лечебный эффект проявлялся через 7-14 инъекций и его контролировали по активности аминотрансфераз в крови. Пример 16. В качестве сырья использовали жмых семенников быков, полученный после выделения из них лидазы путем экстракции 3%-ной уксусной кислотой гомогената ткани. Полученный жмых семенников, являющийся отходом производства лидазы, повторно гомогенизировали в тройном объеме физиологического раствора на ножевых гомогенизаторах и центрифугировали при ускорении 250 g в течение 15 мин для удаления неразрушенных элементов ткани. При помощи децинормального водного раствора едкого натра (0,1 N NaOH) доводили кислотность среды до значения pH 7,4 и добавляли консервант в гомогенат в количестве 0,8 г/л, содержащий ингредиенты с компонентами морфоплазмы и гликокаликса клеток, модифицированных при процессах пролиферации и дифференцировки клеток, который после смешивания подвергали гидролизу и последующей обработке так же, как в примерах 3, 7 и 11. Специфическую активность полученных целевых продуктов определяли экспериментально по активации макрофагов перитонеального экссудата и нейтрофилов крови крыс. При использовании целевого продукта, полученного так же, как в примере 11, ферментативная активность макрофагов увеличивалась на 108,3 ± 13,2%, а фагоцитарная активность по E.coli - на 92,2 ± 10,2%, Для нейтрофилов крови эти показатели увеличивались на 99,2 ± 14,1% и 72,4 ± 8,3% соответственно. Целевой продукт, содержащий БАС в количестве 1,0 мас. %, а остальное - наполнитель, смешивали с 50 объемами воды и использовали в качестве лекарственного препарата в виде выпойки для нормализации параметров гомеостаза кур. Выпойку препаратом кур с отклонениями указанных параметров от нормы осуществляли в дозе 5 мл/кг массы тела каждые 2-6 недель. Контроль эффекта осуществляли подсчетом яйценоскости, результаты которого свидетельствовали в ее повышении на 15-30% по сравнению с контрольной группой птиц, необработанных препаратом. Пpимеp 17. В качестве сырья использовали плацентарную ткань коров, которую обрабатывали так же, как и в примерах 3, 7 и 11, с получением целевых продуктов, специфическую активность которых определяли экспериментально по активации макрофагов перитонеального экссудата и нейтрофилов крови крыс в сравнении с контролем. При использовании целевого продукта, полученного так же, как в примере 11, ферментативная активность макрофагов увеличивалась на 150,6 ± 17,4%, а фагоцитарная активность макрофагов увеличивалась на 109,3 ± 12,7%. Для нейтрофилов крови соответствующие показатели составляли 137,6 ± 16,8% и 95,7 ± 11,3%. Целевой продукт, содержащий БАС в количестве 0,5 мас. %, а остальное - наполнитель, использовали в качестве лекарственного препарата для лечения коров, больных эндометритом в виде инъекций, которые осуществляли внутримышечно в дозе 0,05 мл/кг массы тела каждый 3-й день. Лечебный эффект проявлялся через 6-10 инъекций и его контролировали по показателям воспалительной реакции, гистологическим исследованиям и гнойным выделениям. Пример 18. Для изготовления заявляемого БАС в качестве сырья использовали жмых тимуса, полученный после выделения из гомогената нерастворимых компонентов ткани, которые являются отходом производства тимозина. Жмых тимуса обрабатывали так же, как и в примерах 3,7 и 11, с получением целевых продуктов, специфическую активность которых определяли экспериментально по стимуляции реакции бласттрасформации Т-лимфоцитов, которая увеличивалась на 165,6 ± 13,7% по сравнению с контролем при использовании целевого продукта, полученного так же, как и в примере 11. Целевой продукт содержащий БЛС в количестве 0,5 мас. %, а остальное наполнитель, использовали интраназально в качестве лекарственного препарата для профилактики инфекционных заболеваний человека. В каждую ноздрю вносили по 2 капли препарата с последующим массажем для растекания по слизистой. Такую процедуру повторяли 2 раза в день. Контроль эффекта осуществляли по общему состоянию организма и температуре тела. Пример 19. Лекарственный препарат на основе БАС, полученного так же, как указано в примерах 1-4, 7-9, 1113 и 15-17, изготовляли с содержанием указанного БАС в препарате в количестве 0,001 мас. %. Наполнителем служил 10%-ный раствор сахарозы. Препарат использовали для подкормки пчел. Одноразовая подкормка в количестве 1 литра препарата на пчелиную семью обеспечивала по сравнению с контролем повышение: - выживаемости на 85-140%; - количества вылетов на 100-160%; - медосбора на 27-64%. Пример 20. Лекарственный препарат на основе БАС, полученного так же, как указано в примерах 1-4; 7-9, 1113 и 15-17, изготовляли после лиофильного высушивания указанного БАС с содержанием его в препарате в количестве 85,0 мас. %. Наполнителем служил натрий хлористый (NaCl). Препарат в виде присыпки из лиофильно высушенного порошка использовали для лечения открытых ран при ожогах, травмах и эрозии слизистой. Использование препарата ускоряло регенераторные процессы в 2-7 раз по сравнению с контролем. Пример 21. Лекарственный препарат на основе БАС, полученного так же, как указано в примерах 1-4, 7-9, 1113 и 15-17, изготовляли с содержанием указанного БАС в препарате в количестве 1,0 мас. %. Наполнителем служил гель из растительной мякоти типа огуречного, яблочного, персикового пюре. Препарат использовали для косметических целей. Лечебный эффект проявлялся после 4-8 сеансов и его контролировали по эластичности кожи. Пример 22, Лекарственный препарат на Основе БАС, полученного так же, как указано в примерах 1-6; 9-11; 16-21 и 23-26, изготовляли с содержанием указанного БАС в препарате в количестве 1,0 мас. %. Наполнителем служил гель на основе меда (15 частей), сока лука репчатого (3 части), сока чеснока (1 часть) її репейного масла (1 часть). Препарат использовали в качестве маски для укрепления волосяного покрова. Гель накладывали на голову на 2-3 часа. Процедуру повторяли 1 раз в неделю Лечебный эффект проявлялся после 5-12 сеансов и его контролировали по состоянию волосяного покрова. Пример 23. Лекарственный препарат на основе БАС, полученного так же, как указано в примерах 1-6; 9- 14; 16-21 и 23-26, изготовляли с содержанием указанного БАС в препарате в количестве 0,1 мас. %. Наполнителем служил ланолин в смеси со спермацетом в соотношении 1:3. Препарат использовали в виде мази для восстановления кожного покрова после дерматоза. Использование препарата способствовало ускорению восстановительных процессов в 2-5 раз по сравнению с контролем. Пример 24. Лекарственный препарат на основе БАС, полученного так же, как указано в примерах 1-6; 9-14; 16-21 и 23-26, изготовляли с содержанием указанного БАС в препарате в количестве 0,1 мас. %. Наполнителем служило масло какао. Препарат использовали в виде свечей для лечения эндометритов. Лечебный эффект при использовании препарата проявлялся на 14-21 день, что контролировали по показателям воспалительной реакции, гистологическим исследованиям, анализу крови и выделений. Пример 25. Лекарственный препарат на основе БАС, полученного так же, как указано в примерах 1-6; 9-14; 16-21 и 23-26, изготовляли с содержанием указанного БАС в препарате в количестве 1,0 мас. %. Наполнителем служила смесь ланолина с вазелином в соотношении 1:3. Препарат использовали в виде мази для лечения эрозии слизистой и способствовал ускорению восстановительных процессов в 3-5 раз по сравнению с контролем. Материалы и методы исследования Пример 26. Аминокислотный анализ состава БАС, полученного так же, как в примерах 1-18, проводили в трех направлениях, при которых определяли; - Общий аминокислотный состав: - Аминокислотный состав пептидов и свободных аминокислот в отсутствие кислотонераствориых белков; - Состав свободных аминокислот. 1) Общий аминокислотный анализ БАС, полученною так же, как в примерах 1-18, проводили путем гидролиза средства в 6-ти нормальной соляной кислоте (6N НСl) при температуре 110°С в течение 24 часов по вакуумом. По окончании гидролиза пробы упаривали под вакуумом над сухим едким натром (NaOH). Сухой остаток разводили в двудецинормэльном (0,2 N) натрий-цитратном буферном растворе pH 2,2 и наносили на ионнообменные колонки анализаторов аминокислот. 2) Для удаления кислотонерастворимых белков в 0,5 мл пробы добавляли 0,5 мл 3%-ной сульфосалициловой кислоты, оставляли на 1 час, в течение которого состав периодически помешивали. Денатурированные белки удаляли центрифугированием при ускорении 8000 g в течение 15-20 мин. Полученный супернатант подвергали общему аминокислотному анализу. 3) Содержание свободных аминокислот в БАС, полученном так же, как в примерах 1-18, определяли после уравновешивания проб двудецинормальным (0,2 N) натрий-цитратным буферным раствором при pH 2,2 и после фильтрации через бумажный обеззоленный фильтр наносили на ионнообменные колонки анализаторов аминокислот. Элюцию аминокислот из колонок проводили натрий-цитратными буферными растворами с pH 3,25; pH 4,25 и pH 5,28. Фракционированные аминокислоты обрабатывали нингидриновым реактивом и определяли оптическую плотность на проточном фотометре на длине волны 440 и 570 нм. Пример 27. Содержание общих липидов в БАС, полученном так же, как в примерах 1-18, определяли следующим образом. 0,5 мл БАС смешивали с 1,5 мл концентрированной серной кислоты (H2SО4) и кипятили при температуре 95°С в течение 15 мин. После остывания к 0,1 мл гидролизата добавляли 1,5 мл фосфованилинового реактива фирмы "Хемапол" (Чехо-Словакия) согласно известному методу определения общих липидов по специфической окраске (J.M.Knight, S.Anderson, J.M'.Rawle.-Clinical Chemistry - 1972, - 18. p.199). Оптическую плотность раствора определяли на длине волны 530 нм. Пример 28. Анализ нуклеотидного состава БАС, полученного так же, как в примерах 1-18, проводили следующим образом. Кислоторастворимые пуриновые и пиримидиновые нуклеотиды экстрагировали из 1,5-5,5 мл пробы 5%-ной охлажденной хлорной кислотой (НClО4). Пробы после 20 мин экстракции на холоду центрифугировали при ускорении 2500g в течение 10 мин, осадок трижды промывали 5%-ной хлорной кислотой (НClO4), супернатанты объединяли и использовали для выделения кислоторастворимых нуклеотидов. Кислоторастворимую фракцию гидролизировали одномолярной хлорной кислотой (1М HClO4) при температуре 100°С в течение 1 часа до пиримидиновых монофосфатов и пуриновых оснований. Растворы нейтрализовали едким калием (КОН) и продукты гидролиза разделяли на катионообменнике "ДАУЭКС" 50х4, используя ступенчатую элюцию: дистиллятом (Н2О) - для мочевой кислоты и уридинмонофосфата (УМФ); двудецимолярной хлорной кислотой (0,2 M HclO4) - для ксантина и цитозин монофосфата (ЦМФ); четырехдецимолярной хлорной кислотой (0,4 M HClO4) - для гипоксантина; одномолярной хлорной кислотой (1,0 M НClO4) - для гуанина; двумолярной хлорной кислотой (2,0 M HClO4) для аденина. Нуклеотиды идентифицировали по хроматографической подвижности на катионообменнике в сравнении со стандартами, а также по спектрам поглощения в области 200-300 нм. Количество нуклеотидов определяли, используя величины коэффициентов молярной экстинции. Пример 29. Иммуномодулирующую активность (свойства) БАС, полученного так же, как в примерах 1-18, определяли по активации макрофагов перитонеального экссудата крыс линии Wister в опытах in vitro, по усилению ферментативной активности в восстановлении нитро-синего тетразолия в диформазан (НСТ-тест) и по усилению фагоцитарной активности к E.coli. В брюшную полость декапитированных животных с помощью иглы со шприцом вводили 20 мл бесцветного раствора Хенкса, содержащего 20 ед/мл гепарина. После 2-3 мин массажа живота делали надрез и тем же шприцем отсасывали из полости введенную жидкость, которую после фильтрации через нейлоновый фильтр центрифугировали при ускорении 150-200g в течение 15 мин. Полученный осадок суспендировали в половинном объеме свежей порции раствора Хенкса и вновь центрифугировали при тех же условиях. Промывку выделенных клеток осуществляли 3-4 раза, после чего концентрацию клеток в суспензии доводили до 80х106 клеток/мл. Содержание макрофагов в тканевом экссудате всех клеток составляло 25-35%. Определение ферментативной активности макрофагов перитонеального экссудата крыс проводили спектрофотометрически по восстановлению нитро-синего тетразолия в диформазан. Осадок клеток перитонеального экссудата крыс разводили бесцветным раствором Хенкса до концентрации 80х10 клеток/мл. К 50 мкл клеточной суспензии добавляли 50 мкл пробы с pH 7,4 и концентрацией пептидов 1,0 мг/мл. Смесь ставили на инкубирование при температуре 37°С а водяную баню при постоянном встряхивании в течение 30 мин, после чего добавляли 50 мкл насыщенного при температуре 20°С раствора нитро-синего тетразолия фирмы "Reanal" (Венгрия) м продолжали инкубировать еще 30 мин. Затем вносили 3 мл ацетона и центрифугировали при ускорении 2000g в течение 20 мин. Надосадочную ацетоновую вытяжку фотометрировали при длине волны 515 нм. В качестве контроля сравнения ферментативной активности использовали пробу с консервантом на физиологическом растворе. Фагоцитарную активность клеток перитонеального экссудата крыс определяли по их способности захватывать E.coli. К 50 мкл клеточной суспензии добавляли 50 мкл пробы с pH 7,4 и концентрацией пептидов 1,0 мг/мл. Смесь ставили на инкубирование при температуре 37°С в водяную баню при постоянном встряхивании в течение 30 мин. По окончанию инкубации смесь суспендировали в 10 мл бесцветного раствора Хенкса при температуре 4°C и центрифугировали при ускорении 150-200g в течение 15 мин. Осадок клеток перитонеального экссудата крыс разводили раствором Хенкса до концентрации 2,5х106 клеток/мл. Полученную суспензию в количестве 0,2 мл наносили на стекло размером 18х18 мм и инкубировали при температуре 37°С в течение 30 мин в атмосфере с 5%-ми углекислого газа (СО2) для прикрепления к стеклу макрофагов. После инкубации для удаления неприкрепившихся клеток стекло ополаскивали 3 раза в стаканах со средой Хенкса. К оставшимся на стекле клеткам добавляли 0,2 мл суспензии E.coli при концентрации 20х106 клеток/мл и инкубировали в тех же условиях 45 мин. В дальнейшем стекло вновь трижды ополаскивали, фиксировали метанолом и окрашивали по Романовскому - Гимзе. Индекс фагоцитоза (ИФ) определяли по формуле; ИФ = (0 + 2,5n + 6т + 9р + 10R)/ количество клеток, (1) где: 0 - количество клеток, не фагоцитирующих E.coli; n - количество клеток, поглотивших 1-4 клетки; т - количество клеток, поглотивших 5-7 клеток; p - количество клеток, поглотивших 8-9 клеток; R - количество клеток, поглотивших 10 и более клеток E.coli. Идентификацию макрофагов проводили по окраске неспецифической эстеразы. Пример 30. Иммуномодулирующую активность (свойство) БАС, полученного так же, как в примерах 1-18, определяли по активации нейтрофилов крови крыс линии Wistar в опытах in vitro по усилению ферментативной активности в восстановлении нитро-синего тетразолия в диформазан (НСТ-тест) и по усилению фагоцитарной активности к E.coli. Кровь из хвостовой артерии крысы сразу же собирали в пробирки с бесцветным раствором Хенкса на гепарине и перемешивали. К полученной смеси добавляли 6%-ный декстрак Т-500 в соотношении 3:1 и пробирки на один час ставили в холодильник. После оседания эритроцитов надосадочный слой лейкоцитов отбирали пипеткой и центрифугировали при ускорении 250g в течение 15 мин. Удаление эритроцитов из лейкоцитарной массы осуществляли гемолизированием путем суспендирования осадка лейкоцитов в дистиллированной воде, после чего добавляли раствор Хенкса и смесь центрифугировали. Осадок лейкоцитов вновь суспендировали свежим раствором Хенкса и центрифугировали при тех же условиях. Операцию промывки лейкоцитов осуществляли 3 раза. Определение ферментативной активности нейтрофилов крови проводили спектрофотометрически по восстановлению нитро-синего тетразолия в диформазан. Осадок лейкоцитов крови крыс разводили бесцветным раствором Хенкса до концентрации 80х10 клеток/мл. К 100 мкл клеточной суспензии добавляли 300 мкл БАС, полученного согласно примерам 1-26, pH которого было доведено до 7,4 и концентрация пептидов - до 1,0 мг/мл. Смесь ставили на инкубирование при температуре 37°С в водяную баню при постоянном встряхивании в течение 30 мин, после чего добавляли 400 мкл раствора нитросинего тетразолия фирмы "Reanal" (Венгрия) и дальнейшие операции проводили в той же последовательности, что и в примере 29. Фагоцитарную активность лейкоцитов крови крыс определяли по их способности захватывать E.coli. После инкубации 50 мкл лейкоцитов с 50 мкл БАС, полученного так же, как в примерах 1-18, к суспензии клеток добавляли 10 мл бесцветного раствора Хенкса при температуре 4°C и центрифугировали при ускорении 150-200 g в течение 15 мин. Осадок лейкоцитов разводили в 0,3 мл раствора Хенкса и добавляли 0,05 мл суспензии E.coli при концентрации 500х106 клеток/мл, а затем инкубировали 30 мин при температуре 37°С. После инкубации делали мазки, в которых после окраски количество фагоцитирующих клеток и индекс фагоцитоза (ИФ) подсчитывали так же, как указано в примере 29. Пример 31. Иммуномодулирующую активность (свойства) БАС, полученного так же, как в примерах 1-18, определяли в опытах in vitro на мышах линии BALB/C. Животным делали две подкожные инъекции препарата с интервалом два дня в дозе по 0,5 мл/кг массы животного при концентрации пептидов 1,0 мг/мл. Анализ иммуномодулирующих свойств проводили через двое суток после последней инъекции. В каждом опыте использовали не менее 10 животных. Контролем служили животные, обработанные по указанной схеме 0,08%ным консервантом, растворенным в физиологическом растворе. Для определения реакции бласттрансформации лимфоцитов в качестве Т-клеточного митогена был использован фитогемаглютинин (ФГА), а в качестве В-клеточного митогена - липополисахарид Е.соіі (ЛПС). Лимфоциты, выделенные из селезенки мышей, инкубировали с данными митогенами в течение 72 часов при температуре 37°С в атмосфере с 5%-ми углекислого газа (CO2). Уровень пролиферации клеток оценивали радиометрически по включению 3Н-тимидина. Для этого к культурам добавляли 3Н-тимидин (3,7х10 Бк/пробу) и инкубировали в течение 3 часов. Затем пробы наносили на миллипоровые фильтры ("Сын-пор" № 5, ЧССР), трижды промывали средой 199, затем - 5%-ным раствором трихлоруксусной кислоты (ТХУ) и этанолом. Фильтры высушивали, помещали во флаконы со сцинтилляционной жидкостью ЖС-106 и определяли радиоактивность проб с помощью счетчика "Mark-111". Пример 32. Иммуномодулирующую эффективность (свойства) БАС, полученного так же, как в примерах 1-18, определяли по стимуляции естественной киллерной активности спленоцитиов мышей в опытах in vivo. Животным делали в течение двух дней две подкожные инъекции препарата в дозе по 0,05 мл/кг массы животного при концентрации в них пептидов 1,0 мг/мл. Анализ иммуномодулирующих свойств проводили на следующие сутки после последней инъекции. В каждом опыте использовали не менее 10 животных. Контролем служили животные, обработанные по указанной схеме 0,07%-ным консервантом, растворенным в физиологическом растворе. Состояние естественной киллерной активности спленоцитов определяли на клетках лимфомы мышей YAC12, меченных изотопом хрома 51Cr. Инкубацию проводили в течение 18 часов при соотношении клеток-мишеней и клеток эффекторов 1:25 (1х105:2,5х106 клеток). Специфическое высвобождение изотопа хрома 51Сr, соответствующее цитотоксической активности эффекторных клеток, вычисляли по следующей формуле: где максимальное высвобождение обозначает радиоактивность, при которой все клетки лизированы. В качестве контроля для определения усиления естественной киллерной активности предлагаемыми БАС применяли консервант, растворенный в физиологическом растворе. Пример 33. Иммуномодулирующую эффективность (свойства) БАС, полученного так же, как в примерах 1-18, определяли по функциональной активности тимуса мышей в опытах in vivo в условиях, аналогичных примеру 31. Эффект воздействия оценивали по титру тимического сывороточного фактора (ТСФ). Метод основан на способности гормонов вилочковой железы восстанавливать чувствительность спонтанных розеткообразующих клеток селезенки взрослых тимэктомированных мышей к антитимоцитной сыворотке. Сыворотку крови опытных мышей пропускали через ультрафильтр системы CENTRIFLO CF-50A фирмы "Amicon". В реакции использовали по 0,1 мл цельной и серийно разбавленной средой 199 сыворотки. Контролем служила среда 199. Селезенку брали у мышей через 10-14 дней после тимэктомирования. Из нее извлекали клетки путем разволокнения ткани препаративными иглами в среде 199. После фильтрования через капроновое сито их двухкратно отмывали средой 199 центрифугированием при ускорении 4000g. Осадок ресуспендировали в среде до концентрации 4х107 клеток/мл и получали таким образом взвесь в объеме 0,1 мл, которую прибавляли в пробирки с сывороткой и со средой 199. Содержимое пробирок перемешивали пипетированием и инкубировали при температуре 37°С в течение 60 мин. После инкубации во все пробирки вносили по 0,1,мл антитимоцитной сыворотки и комплемента морской свинки в разбавлении 1:10. Взвесь инкубировали при температуре 37°С еще 30 мин. Затем к смеси прибавляли по 0,1 мл суспензии эритроцитов барана (12х10 клеток/мл), перемешивали, центрифугировали при ускорении 250g в течение 5 мин и инкубировали 60 мин при температуре 4-8°C. Осадок в пробирках ресуспендировали в течение 5 мин. Подсчет розеток проводили в камере Горяева. За розетку принимали лимфоцит, присоединивший четыре и более эритроцитов. Титром ТСФ считали последнее разведение сыворотки, вызывающее 50%-ную редукцию числа розеткообразующих клеток (РОК) по отношению к контролю. Результаты выражали в виде логарифма титра при основании 2, то есть в виде log А, где А - значение титра. Пример 34. Эффективность БАС, полученного так же, как и в примерах 1-18, которая проявляет в усилении репарационных способностей гепатоцитов печени крыс in vivo после подкожного введения четыреххлористого углерода (ССl4), определяли по восстановлению активности Na, К-АТФазы следующим образом. Крысам-самцам весом 230-250 г линии Wistar ежедневно в течение 4 дней подкожно вводили четыреххлористый углерод (ССl4) в смеси с растительным маслом в соотношении 1:1 в дозе 4,0 мл/кг массы животного. Через 4 часа после первой инъекции четыреххлористого углерода (ССl4) опытным животным осуществляли первую из 4-х подкожных инъекций средства с интервалом в один день в дозе по 0,05 мл/кг массы тела животного. Эффективность средства регистрировали на следующий день после последней его инъекции. При этом в качестве контроля сравнения, использовали печень животных аналогично пораженную четыреххлористым углеродом (ССl4), но без применения исследуемых БАС, а также печень интактных животных. Для определения активности Na, К-АТФазы, использовали фракции клеточных мембран гепатоцитов. С этой целью 15 г охлажденной печени трех крыс гомогенизировали в 150 г одномиллимолярного боратного буферного раствора (1 мМ Na2B4О7) с pH = 7,5 в присутствии пятидецимиллимолярного раствора хлористого кальция (0,5 мМ СаСl2), используя ручной стеклянный гомогенизатор с тефлоновым пестиком. Гомогенизированную смесь центрифугировали с ускорением 150g при температуре 4°C в течение 10-12 мин. Супернатант подвергали повторному центрифугированию при ускорении 100000g в течение 20 мин, а полученный осадок 3 раза отмывали в 130 мл буфера при тех же условиях центрифугирования. По окончанию отмывки осадок ресуспендировали в буферном растворе, доводя концентрацию белка, согласно методу SDS-Лоури, до 3,0 мг/мл, которую использовали в анализах. Все операции получения фракции мембран проводили на холоду. Активность Na, К-АТФазы плазматической мембраны гепатоцитов определяли в стандартной среде, состоящей из: шестидесятишестимиллимолярного хлористого натрия (66 мМ NaCl), тридцатичетырехмиллимолярного хлористого калия (34 мМ KCl), пятимиллимолярного хлористого магния (5 мМ MgCl2), двадцатипятимиллимолярного (25 мМ) Трис-НСl, в которую перед началом опыта добавляли пятимиллимолярную-аденозинтрифосфорную кислоту (5 мМ АТФ). К 1,8 мл указанной стандартной среды добавляли 0,2 мл суспензии фракции мембран с концентрацией по белку 3,0 мг/мл и инкубировали при температуре 37°С в течение 15 мин, после чего реакцию останавливали, добавляя 0,6 мл 50%-ного раствора трихлоруксусной кислоты (ТХУ). Смесь центрифугировали при ускорении 300-500g в течение 15 мин. К 1,0 мл полученного супернатанта добавляли 4 мл двудецимолярного (0,2 M) ацетатного буферного раствора с pH - 4,0, 0,5 мл 1%-ного раствора молибдатаммония в 1 %-ном растворе серной кислоты (H2SO4), 0,5 мл аскорбиновой кислоты в 0,16%-ном растворе медного купороса (CuSO4) и после перемешивания инкубировали 10 мин при температуре 25°С. Оптическую плотность определяли спектрометрически при длине волны 700 нм. Активность Na, К-АТФазы вычисляли по разнице между активностями общей АТФа-зы и Мд-АТФазы. Для определения активности Мg-АТФазы проводили аналогичные исследования, однако вместо 0,6 мл трихлоруксусной кислоты (ТХУ) в смесь вносили 0,3 мл 0,05%-го раствора строфантина, Установлено, что при токсическом поражении печени четыреххлористым углеродом (ССl4) активность Na, КАТФазы снижается в 3,5 раза, однако при использовании заявляемого БАС, как в примере 11, ее активность восстанавливается в эксперименте не менее, чем на 50%, по сравнению с нормой. Пример 35. Эффективность БАС, полученного так же, как и в примерах 1-18, которая проявляется в усилении репарационных способностей гепатоцитов печени крыс (in vivo) после подкожного введения четыреххлористого углерода (ССl4), определяли по восстановлению активности в крови аминотрасфераз и концентрации калия (К+) в гепатоцитах печени крыс следующим образом. У животных, обработанных так же, как в примере 34, активность аминотрансфераз в крови проверяли по тест-системе фирмы "Хемапол" (Чехо-Словакия) согласно фотометрическому методу по специфической окраске (S.Reitman, S.Frankel. - American Journal of Clinical Pathology, - 1957-28-56). К 0,25 мл раствора, содержащего децимолярный раствор (0,1 M) L-аспартата, двумиллимолярный (0,002 M) 2-оксоглутарата и децимолярный (0,1 M) фосфатный буферный раствор с pH 7,4, добавляли 0,05 мл сыворотки крови крыс и инкубировали при температуре 37°С в течение 60 мин. По окончании инкубации в раствор добавляли 0,25 мл миллимолярного (0,001 M) 2,4-динитрофенил-гидразина, растворенного в одномолярной соляной кислоте (1 M HCl) и пробу оставляли на 20 мин при комнатной температуре, после чего добавляли 2,5 мл четырех децимолярного (0,4 M) едкого натра (NaOH) перемешивали и через 10 мин измеряли оптическую плотность на длине волны 520 нм против контрольного раствора, где вместо 0,05 мл сыворотки крови вносили 0,05 мл физиологического раствора. При токсическом поражении печени четыреххлористым углеродом (ССl4), сопровождающемся разрушением гепатоцитов и соответственно выходом аминотрасфераз, в связи с чем их активность в сыворотке крови повышается в 2 раза. В то же время использование заявляемого БАС, как в примере 11, позволяет восстанавливать в эксперименте такую активность не менее, чем на 59%, по сравнению с нормой. Концентрацию калия (К+) в гепатоцитах печени экспериментальных крыс определяли стандартным методом пламенной фотометрии, по Бриккеру, на пламенном фотометре марки ПФМ-1 (В.Н.Бриккер. Определение содержания К, Na методом пламенной фотометрии. - Лабораторное дело -1961-7-с. 3-6). Установлено, что при токсическом поражении печени четыреххлористым углеродом (ССl4) активность Na, КАТФазы снижается в 3,5 раза, что сопровождается снижением концентрации К+ в гепатоцитах печени крыс на 40%. В то же время использование заявляемого БАС, полученного так же, как в примере 11, позволяет восстанавливать концентрацию K+ не менее, чем на 43%. Изобретение не ограничивается изложенными конкретными вариантами выполнения. Различные варианты могут быть осуществлены в пределах сущности и объема, охватываемых формулой изобретения. Анализ состава и свойств заявляемого биологически активного средства. Идентификация заявляемого БАС среди других биологически активных средств возможна непосредственно по биохимическому анализу состава и опосредованно - по величине иммуномодулирующего эффекта, который проявляет заявляемое средство. Установлено, что именно содержание модифицированных компонентов морфоплазмы и гликокаликса клеток с модифицированной структурой в составе заявляемого БАС обеспечивает существенное усиление иммунной реакции организма по сравнению с контролем. Это позволяет идентифицировать заявляемое БАС по следующему комплексу показателей: а) По повышению активности макрофагов перитонеального экссудата крыс, а именно по усилению ферментативной активности макрофагов, контролируемому с помощью НСТ-теста, - не менее, чем на 54% (при использовании в опытах нитро-синего тетрозолия - НСТ венгерской фирмы "Reanal"), и по усилению фагоцитарной активности E.coli - не менее, чем на 39%; б) По повышению активации нейтрофилов крови крыс, а именно по усилению ферментативной активности, контролируемого по МСТ-тесту, - не менее, чем на 67% (при использовании в опытах нитро-синего тетрозолия НСТ венгерской фирмы "Reanal") и по усилению фагоцитарной активности E.coli - не менее, чем на 44%; в) По усилению реакции бласттрансформации Т-лимфоцитов- не менее, чем на 42% и В-лимфоцитов - не менее, чем на 50%; г) По усилению функциональной активности тимуса - согласно содержанию в крови крыс тимического сывороточного фактора (ТСФ) - не менее, чем на 167%; д) По увеличению естественной киллерной активности спленоцитов крыс - не менее, чем на 66%; е) По увеличении способности стабилизировать плазматические мембраны гепатоцитов печени крыс после введения четыреххлористого углерода (ССl4): - по восстановлению активности Na, К-АТФазы - не менее, чем на 24%; - по восстановлению активности трас-феразы в крови крыс - не менее, чем на 22 %; - по восстановлению соотношения калия (К) и натрия (Na) в гепатоцитах печени крыс - не менее, чем на 14%. При этом в качестве базы сравнения использовали контроль в виде вводимого в организм консерванта, растворенного в физиологическом растворе. Приведенная система показателей иммуномодулирующих и регенераторных эффектов (свойств) заявляемого БАС позволяет идентифицировать его по проявляемой биологической активности, а именно в качестве иммуномодулятора. Для заявляемого БАС и препарата на его основе наблюдается тенденция к проявлению эффекта стимуляции защитных функций иммунной системы организма, направленных как на элиминацию внутренней патологии (стимуляция активности естественных киллеров), так и на повышение общей резистентности организма к инфекционным заболеваниям, которая в значительной степени превосходит аналогичные показатели у рассмотренных выше известных БАС. Экспериментально определены иммуномодулирующие свойства различных биологически активных средств в соответствии с комплексом показателей, идентифицирующих исследуемые объекты. Результаты эксперимента сведены в таблицу 6, в которой указаны количественные показатели эффектов известного БАС №1, №2, №3, полученных по технологии, описанной в ЕР-А-02499563, SU-A-139404 и US-A-4455302 соответственно, и заявляемого БАС, представленного в виде групп: WS - обобщенных по результатам примеров 1-4 (компоненты морфоплазмы и гликокаликса клеток); TS - по результатам примеров 7-9 (термостабильные компоненты морфоплазмы и гликокаликса клеток); LM - примеров 11-13 (низкомолекулярные компоненты морфоплазмы и гликокаликса клеток M £ 10,0 кДа ), соответственно. В качестве контрольного объекта использовали физиологический раствор натрия хлористого, содержащий консервант. Полученные результаты сведены в таблицу 6 и сравнительно характеризуют заявляемое и известные БАС. Приведенные результаты касаются характеристик заявляемого БАС полученного в виде смеси неустановленной структуры, и необходимых для его идентификации данных по эффекту, обуславливающему его назначение. Анализ данных таблицы 6 наряду с возможностью идентифицировать заявляемое средство позволяет оценить также конкретный результат, обеспечиваемый заявляемым БАС и заключающийся в существенном улучшении свойств биологической активности за счет наличия в нем продуктов гидролиза, содержащих модифицированные компоненты морфоплазмы и гликокаликса клеток с модифицированной структурой, влияние которых в известных БАС не выявлено. Свойства заявленного БАС и препарата на его основе находятся в тесной зависимости от его состава. Как показывают результаты биохимического анализа (таблица 7), БАС содержит в своем составе в основном такие органические соединения, как полипептиды, пептиды, аминокислоты, связанные и свободные углеводы, липиды, нуклеотиды и другие соединения. Данные таблицы 7 показывают распределение по массе органических соединений в составе БАС при использовании в качестве исходного сырья эмбриональной ткани крупного рогатого скота. Кроме того, в таблице 7 отражены результаты получения различных групп заявленного БАС (WS, TS и LM) последовательно всеми заявленными способами. Помимо результатов осуществления способа, который обеспечивает получение БАС-WS и при осуществлении которого в качестве сырья используют животную ткань, взятую на стадии процесса модификации компонентов морфоплазмы и гликокаликса клеток с приведенными выше процессами, таблица 7 включает также результаты осуществления способа получения заявленного БАС в виде термостабильных компонентов (БАС-ST) и в виде низкомолекулярных компонентов (БАС-LM). Данные таблицы 7 позволяют провести сравнительный анализ результатов осуществления заявленного и известного способов получения БАС, а именно сравнительный анализ заявляемого и известного БАС с учетом того обстоятельства, что из известных БАС №3 (5), БАС №2 (4) и БАС №1 (2) являются наилучшими по своим характеристикам. Сравнительный анализ специфической активности заявляемого и известных БАС показывает (таблицы 6 и 7), что их специфическая активность зависит от состава ингредиентов, соотношение которых существенно влияет на величину специфической активности. Характерной особенностью биохимического состава заявленного БАС является наличие в нем углеводсодержащих компонентов, модификация которых в значительной степени и определяет его свойства. При этом содержание углеводов в наиболее активных фракциях (фракции 3, 4 и 5, таблица 4) низкомолекулярных компонентов с молекулярной массой M = 0,8-10,0 кДа (олигоуглеводы, гликопептиды, гликолипиды, нуклеотиды) являются определяющим при идентификации и характеризации заявленного БАС. Так, сравнительный анализ специфической активности и состава ингредиентов (таблицы 6 и 7) показывает, что более высокая активность заявляемого БАС в сравнении с аналогами коррелирует с более высоким содержанием углеводов в составе компонентов с молекулярной массой M = =0,8-10,0 кДа. Для заявляемого средства эти значения соответствуют величинам: 6,8 ± 3,5%; 7,5 ± 3,5% и 8,2 ± 3,3% тогда как для аналогов БАС №1; №2 и №3 они составляют; не более 0,2%; 2,7 ± 1,1% и 3,0 ± 0,5% соответственно. В еще большей степени данная зависимость коррелирует с удельным содержанием углеводов по отношению к другим органическим соединениям этой фракции. В этом отношении существенным показателем является соотношение содержания углеводов и пептидов в компонентах с молекулярной массой M = 0,8-10,0 кДа (таблицы 2 и 7), которое определяют по формуле: где Су и Сп - концентраций соответственно углеводов и пептидов в компонентах с молекулярной массой M = 0,8-10,0 кДа. Для заявляемого БАС величина этого показателя лежит в пределах GЗ = 0,25-0,60, в то время как для известных БАС величина этого показателя не превышает значения Gиз < 0,25. Таким образом, величина показателя G обобщенно характеризует свойство продуктов гидролиза и зависит от применяемого в заявляемом способе сырья, от совокупности операций способа обработки указанного сырья и режимов осуществления процессов гидролиза и является одним из характерных показателей биохимической идентификации заявляемого БАС. Совокупность признаков заявляемого биологически активного средства и связанная с ней единым творческим замыслом совокупность признаков заявляемого способа его получения и заявляемого лекарственного препарата на основе этого средства находятся в причинно-следственной связи со специфической активностью БАС. Изобретения, касающиеся биологически активного средства, способа его получения и лекарственного препарата на основе заявляемого БАС, основаны на выборе исходного сырья, выбора условий протекания процесса получения БАС и препарата с гарантированной высокой специфической активностью. При этом выбранная технология полученная БАС обеспечивает воспроизводимость результатов, то есть позволяет стандартизировать получение заявленного БАС с заданными свойствами, а именно с заданной фиксированной иммуномодулирующей активностью, определяющей фармакологический, терапевтический и общебиологический эффекты при использовании изобретения. Получаемые целевые продукты в общем и частных случаях выполнения заявляемого способа получения БАС равноценны по характеру своего биологического воздействия, но отличаются по своей специфической активности. Поэтому целесообразность использования того или иного конкретного БАС определяется требованиями, предъявляемыми объектом, для которого они предназначены, то есть требованиями ветеринарии и/или медицины. В связи с этим в каждом конкретном случае использования целевого продукта выбор того или иного варианта БАС определяется соотношением требований к его иммуномодулирующей активности и эффективности в целом со стоимостью (экономичностью) его получения. В частности, высокая эффективность средства, содержащего низкомолекулярные компоненты с молекулярной массой M £ 10,0 кДа заявляемого (БАСLM) в полной море проявляется в повышении активности макрофагов, нейтрофилов, лимфоцитов, естественных киллеров, что обеспечивает усиление регенераторных процессов (таблица 6). Для сельскохозяйственных животных такие эффекты сопровождаются увеличением дополнительных привесов животных при интенсивном откорме (таблица 8). При лечении респираторных и инфекционных заболеваний (парагрипп) такое преимущество не столь существенно, и здесь экономически целесообразно применять средство, содержащее водорастворимые компоненты морфоплазмы и гликокаликса клеток (БАС-WS). При лечении воспалительных процессов (маститы) выгоднее использовать средство, содержащее термостабильные компоненты (БАС-ST). При приготовлении препаратов для наружного использования в виде мазей, свечей, гелей, компрессов, интраназально или для выпойки животных вместо (БАС-LM) экономически целесообразно применять БАС, содержащее термостабильные компоненты (БАС-ST). При этом для получения максимального эффекта целесообразнее использовать заявляемое средство для стимуляции защитных функций иммунной системы организма, направленных как на элиминацию внутренней патологии (стимуляция активности естественных киллеров), так и на повышение общей резистентности организма к инфекционным заболеваниям, которое в значительной степени превосходит аналогичные показатели у рассмотренных выше известных БАС. Применение заявляемого БАС при инфекционных заболеваний молодняка крупного рогатого скота (парагрипп, ОРЗ у телят и другие) обеспечивало выздоровление животных в 82-93% случаев. В то же время при использовании известных средств в тех же условиях выздоровление животных наблюдалось не более, чем в 70% случаев, а при спонтанном излечивании в контрольной группе - в пределах 58-67% случаев; Использование заявляемого препарата дало положительные результаты при введении в организм животных при лечении воспалительных процессов. Использование заявляемого БАС с профилактической целью снижало уровень заболевания телят парагриппом до 10%, в то время как при использовании известных средств уровень заболеваемости животных достигал 12-17%, а в контрольной группе - 22-28%. Использование заявляемого препарата повышало резистентность животных к инфекционным заболевания, снижая тем самым уровень падежа поголовья. Нормализация препаратом общебиологического состояния сельскохозяйственных животных способствовала улучшению производственных показателей и, в частности, увеличению дополнительных привесов живой массы без снижения качества мяса, приближая эти показатели к генетически запрограммированному уровню при интенсивном откорме. Данная особенность выгодно отличает заявляемое БАС и препарат на его основе от гормональных и других стимуляторов роста, которые, повышая количественные показатели, негативно влияют на гомеостаз животных и снижают качество продукции. Введение заявляемого БАС и препаратов на его основе в организм животного, имеющего отклонения параметров гомеостаза от нормы, обеспечивало при интенсивном откорме увеличение дополнительного привеса в среднем на 37-100% от привеса в контрольной группе, не обработанной заявляемым БАС. В то время, как при использовании известных БАС-аналогов (№1; 2 и 3) в тех же условиях дополнительный привес по сравнению с привесом в контрольной группе в среднем составлял 12-24%. Нормализация параметров гомеостаза способствует также увеличению - надоев молока крупного и мелкого рогатого скота; - яйценоскости домашней птицы, - качества меха пушного зверя, - выживаемости молодняка; - медосбора пчел и тому подобное, Заяпляемое БАС нетоксично, не вызвало побочных эффектов (аллергии и тому подобное). Заявляемый препарат вызывал повышенную стимуляцию регенераторных процессов, а именно восстановление функциональной активности печеночной ткани при гепатите и регенерацию печени после частичной гепатэктомии, заживление язв, ран и кожного покрова при ранениях и травмах, восстановление формулы крови при больших кровопотерях и в других случаях. Сравнительные данные по фармакологическому, терапевтическому и общебиологическому эффекту от использования на животных заявленного БАС и препарата на его основе приведены в таблице 8. Анализ данных этой таблицы показывает, что биологическая активность заявленного БАС значительно превышает величину биологической активности аналогов. Таким образом, заявляемое БАС и препарат на его основе обладают широким спектром применения в ветеринарии и медицине, и могут быть использованы для нормализации физиологического состояния организма при лечении заболеваний, контроль над которыми осуществляется в рамках компетенции иммунной системы организма. Согласно изобретению, заявляемое средство и препарат на его основе используют следующим образом. Определяют параметры гомеостаза, затем, в случае их отклонения от нормы, осуществляют стимуляцию иммунной системы введением БАС до нормализации указанных параметров гомеостаза. Указанную стимуляцию иммунной системы осуществляют путем активации ретикулоэндотелиальной системы, Т- и В-систем, нейтрофилов и/или популяции естественных киллеров организма, что обеспечивает повышение активности макрофагов перитонеального экссудата и нейтрофилов крови in vitro, повышение стимуляции реакции бласттрансформации лимфоцитов in vivo, повышением стимуляции функциональной активности тимуса, повышение стимуляции естественной киллерной активности спленоцитов in vivo, а также усиление репарационных способностей гепатоцитов печени после введения отравляющих веществ или частичной гепатэктомии и тому подобное. С этой целью способ введения в организм заявляемого БАС и препарата на его основе выбирается из ряда: - внутримышечные инъекции в дозе 0,005-0,5 мл/кг массы тела с интервалом между инъекциями в 1-7 дней, - ингаляции в дозе 0,012-0,12 мл/кг массы тела с интервалом между ингаляциями 4-48 часов; - сублингвально в дозе 0,012-0,12 мг/кг массы тела с интервалом между введением 4-48 часов; - выпаивания в дозе 0,02-1,0 мл/кг массы тела интервалом между выпаиваниями в 1-10 дней; - интерально в пилюлях в дозе 0,02-1,0 мл/кг массы тела с интервалом в 1-10 дней; - интраназально в суточной дозе 0,001-0,05 мл/кг массы тела с интервалом между закапываниями 2-24 часа; - аппликации на слизистую или раневую поверхность в виде компрессоров, свечей, присыпок, мазей, а также гелей; - и их комбинации, - до нормализации параметров гомеостаза. Сведения, подтверждающие эффективность использования способа применения заявленного БАС в виде термостабильных компонентов (БАС-ST) и препарата на его основе, в котором в качестве наполнителя использовали физиологический раствор натрия хлористого, представлены в таблицах 9-12. В таблицах приведена зависимость эффекта нормализации параметров гомеостаза от указанных выше дозовых пределов и способа применения заявляемого препарата, что контролировалось по величине привесов телят, изначально имевших отклонение от нормы в параметрах гомеостаза. В таблицах 9-12 представлены результаты эффективности заявляемого препарата при: - внутримышечных инъекциях с интервалом 1-7 дней (таблица 9); - при ингаляциях с интервалом 4-49 часов (таблица 10); - выпаивании с интервалом в 1-10 дней (таблица 11); - при интраназальном применении с интервалом 2-24 часа (таблица 12). Введение в организм заявляемого БАС в виде заявляемого препарата позволяет стимулировать. - извлечение инфекционных заболеваний (парагрипп, ОРЗ); - извлечение воспалительных заболеваний, (маститы, воспаление легких, эндометриты); - повышение резистентности животных к инфекционным и воспалительным процессам; - улучшение общебиологического состояния организма; - увеличение привесов животных; - функциональную активность печеночной ткани при гепатите; - регенерацию печени после частичной гепатэктомии; - заживление язв, ран, кожного покрова при ранениях и травмах; - восстановление формулы-крови при кровопотерях. Отсутствие побочных эффектов при использовании БАС и лекарственного препарата на его основе и данные по фармакологическому, терапевтическому и общебиологическому воздействию на организм животного определили возможность клинической апробации БАС и препарата на его основе. При обследовании группы пациентов определено положительное воздействие на физиологическое состояние организма, а также практически полная аналогия экспериментальным доклиническим исследованиям на животных. Способ получения заявляемого биологически активного средства может быть реализован как в промышленных, так и в лабораторных условиях.
ДивитисяДодаткова інформація
Автори англійськоюShorokh Dmytro Boryslavovych, Shevchenko Oleksandr Oleksandrovych
Автори російськоюШорох Дмитрий Бориславович, Шевченко Александр Александрович
МПК / Мітки
МПК: A61K 35/12, A61K 9/00, A61P 43/00
Мітки: стану, одержання, тварин, має, препарат, людини, захворюваннях, спосіб, нормалізації, породжені, біологічноактивний, організму, фізіологічного, властивість, засіб, основі, імуномодулюючу
Код посилання
<a href="https://ua.patents.su/31-2164-biologichnoaktivnijj-zasib-shho-maeh-imunomodulyuyuchu-vlastivist-sposib-jjogo-oderzhannya-preparat-na-jjogo-osnovi-ta-sposib-normalizaci-fiziologichnogo-stanu-organizmu-lyudini-ta.html" target="_blank" rel="follow" title="База патентів України">Біологічноактивний засіб, що має імуномодулюючу властивість, спосіб його одержання, препарат на його основі та спосіб нормалізації фізіологічного стану організму людини та тварин при захворюваннях, що породжені</a>
Попередній патент: Засіб здобування ефірної олії з рослинної сировини, переважно хмелю, і пристрій для його здійснення
Наступний патент: Спосіб вторинного охолодження безперервнолитого злитку
Випадковий патент: Виїмковий ланцюг для транспортування щебеню баластової постелі