Заміщені дигідрохіназоліни, які мають антивірусні властивості
Номер патенту: 82519
Опубліковано: 25.04.2008
Автори: Ніколік Сузанне, Хеннінгер Керстін, Ціммерманн Хольгер, Лампе Томас, Хьюлетт Гай, Бетц Ульріх, Нелль Петер, Гроссер Рольф, Баумайстер Юдіт, Єске Маріо, Зюссмаєр Франк, Кельденіх Йорг, Ланг Дітер, Шое-Лооп Рудольф, Реєфшлєгер Юрген, Вунберг Тобіас
Формула / Реферат
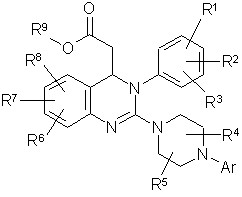
1. Сполука формули:  (I),
(I),
в якій
Аr означає арил, де арил може бути заміщений 1-3 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає алкіл, алкокси, форміл, карбоксил, алкілкарбоніл, алкоксикарбоніл, трифторметил, галоген, ціано, гідрокси, аміно, алкіламіно, амінокарбоніл та нітро,
в якій алкіл може бути заміщений 1-3 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає галоген, аміно, алкіламіно, гідрокси та арил,
або два із замісників арилу разом з атомами вуглецю, до яких вони приєднані, утворюють 1,3-діоксолан, циклопентанове кільце або циклогексанове кільце, а, в разі необхідності, наявний третій замісник незалежно від двох попередніх вибирають із згаданої групи,
R1 означає водень, аміно, алкіл, алкокси, алкіламіно, алкілтіо, ціано, галоген, нітро або трифторметил,
R2 означає водень, алкіл, алкокси, алкілтіо, ціано, галоген, нітро або трифторметил,
R3 означає аміно, алкіл, алкокси, алкіламіно, алкілтіо, ціано, галоген, нітро, трифторметил, алкілсульфоніл або алкіламіносульфоніл
або
один із залишків R1, R2 та R3 означає водень, алкіл, алкокси, ціано, галоген, нітро або трифторметил, а інші два залишки разом з атомами вуглецю, до яких вони приєднані, утворюють 1,3-діоксолан, циклопентанове або циклогексанове кільце,
R4 означає водень або алкіл,
R5 означає водень або алкіл,
або
залишки R4 та R5 у піперазиновому кільці приєднані до чітко протилежних атомів вуглецю та утворюють метиленовий місток, в разі необхідності, заміщений 1-2 метиловими групами,
R6 означає алкіл, алкокси, алкілтіо, форміл, карбоксил, амінокарбоніл, алкілкарбоніл, алкоксикарбоніл, трифторметил, галоген, ціано, гідрокси або нітро,
R7 означає водень, алкіл, алкокси, алкілтіо, форміл, карбоксил, алкілкарбоніл, алкоксикарбоніл, трифторметил, галоген, ціано, гідрокси або нітро
та
R8 означає водень, алкіл, алкокси, алкілтіо, форміл, карбоксил, алкілкарбоніл, алкоксикарбоніл, трифторметил, галоген, ціано, гідрокси або нітро,
та їх солі, їх сольвати та сольвати їх солей.
2. Сполука за п. 1, яка відрізняється тим, що
Аr означає феніл, де феніл може бути заміщений 1-3 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає С1-С6-алкіл, С1-С6-алкокси, карбоксил, С1-С6-алкілкарбоніл, С1-С6-алкоксикарбоніл, трифторметил, фтор, хлор, бром, ціано, гідрокси, аміно, С1-С6-алкіламіно та нітро,
або два із замісників фенілу разом із атомами вуглецю, до яких вони приєднані, утворюють 1,3-діоксолан та, в разі необхідності, наявний третій замісник незалежно вибраний із вказаної групи,
R1 означає водень, С1-С3-алкіл, С1-С3-алкокси, С1-С3-алкілтіо, фтор або хлор,
R2 означає водень, С1-С3-алкіл, С1-С3-алкокси, С1-С3-алкілтіо, фтор або хлор,
R3 означає С1-С4-алкіл, ціано, фтор, хлор, нітро, трифторметил або С1-С3-алкілсульфоніл,
або
один із залишків R1, R2 та R3 означають водень, С1-С3-алкіл, С1-С3-алкокси, ціано, галоген, нітро або трифторметил, а інші обидва залишки разом з атомами вуглецю, до яких вони приєднані, утворюють циклопентанове або циклогексанове кільце,
R4 означає водень або метил,
R5 означає водень,
R6 означає С1-С3-алкіл, С1-С3-алкокси, карбоксил, амінокарбоніл, трифторметил, фтор, хлор, ціано, гідрокси або нітро,
R7 означає водень, С1-С3-алкіл, С1-С3-алкокси, фтор, хлор, ціано або гідрокси
та
R8 означає водень, С1-С3-алкіл, С1-С3-алкокси, фтор, хлор, ціано або гідрокси.
3. Сполука за п. 1 або 2, яка відрізняється тим, що
Аr означає феніл, в якому феніл може бути заміщений 1 або 2 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає метил, метокси, фтор та хлор,
R1 означає водень, метил, метокси, метилтіо, фтор або хлор,
R2 означає водень,
R3 означає метил, iзопропіл, тpeт-бутил, ціано, фтор, хлор, нітро або трифторметил,
R4 означає водень,
R5 означає водень,
R6 означає амінокарбоніл, фтор, хлор, ціано або гідрокси,
R7 означає водень
та
R8 означає водень, фтор або хлор.
4. Сполука за одним із пп. 1-3, яка відрізняється тим, що R1 означає водень, метил, метокси або фтор.
5. Сполука за одним із пп. 1-4, яка відрізняється тим, що R1 означає метокси.
6. Сполука за одним із пп. 1-5, яка відрізняється тим, що R1 знаходиться у орто-положенні відносно місця приєднання фенільного кільця.
7. Сполука за одним із пп. 1, 2 та 4-6, яка відрізняється тим, що R2 означає водень.
8. Сполука за одним із пп. 1-7, яка відрізняється тим, що R3 означає трифторметил, хлор, метил, iзопропіл або тpeт-бутил.
9. Сполука за одним із пп. 1-8, яка відрізняється тим, що R3 означає трифторметил, хлор або метил.
10. Сполука за одним із пп. 1-9, яка відрізняється тим, що R1 знаходиться у орто-положенні відносно місця приєднання фенільного кільця, a R3 знаходиться у протилежному R1 мета-положенні відносно місця приєднання фенільного кільця.
11. Сполука за одним із пп. 1, 2 та 4-10, яка відрізняється тим, що R4 та R5 означають водень.
12. Сполука за одним із пп. 1-11, яка відрізняється тим, що R6 означає фтор.
13. Сполука за одним із пп. 1, 2 та 4-12, яка відрізняється тим, що R7 означає водень.
14. Сполука за одним із пп. 1, 2 та 4-13, яка відрізняється тим, що R8 означає водень, метил або фтор.
15. Сполука за одним із пп. 1, 2 та 4-14, яка відрізняється тим, що Аr означає феніл, де феніл може бути заміщений 1-2 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає метил, метокси, фтор та хлор.
16. Спосіб одержання сполуки формули (І) за п. 1, який відрізняється тим, що сполуку формули
 (II),
(II),
в якій
Аr, R1, R2, R3, R4, R5, R6, R7 та R8 мають вказані в п. 1 значення та
R9 означає алкіл, переважно метил або етил або трет-бутил, піддають взаємодії з основою або кислотою.
17. Сполука за одним із пп. 1-15 для лікування та/або профілактики захворювань.
18. Лікарський засіб, який містить сполуку за одним із пп. 1-15 у комбінації із однією інертною нетоксичною фармацевтично придатною допоміжною речовиною.
19. Застосування сполуки за одним із пп. 1-15 для одержання лікарського засобу для лікування та/або профілактики вірусних інфекцій.
20. Застосування за п. 19, яке відрізняється тим, що вірусною інфекцією є інфекція, викликана цитомегаловірусом людини (ЛЦМВ) або іншим представником групи Herpes viridae.
21. Лікарський засіб за п. 18 для лікування та/або профілактики вірусних інфекцій.
22. Спосіб боротьби з вірусними інфекціями у людей та тварин шляхом введення антивірусно ефективної кількості сполуки за одним із пп. 1-15 або лікарського засобу за п. 18.
Текст
1.Сполука формули: C2 2 (19) 1 3 82519 тил, фтор, хлор, бром, ціано, гідрокси, аміно, С1С6-алкіламіно та нітро, або два із замісників фенілу разом із атомами вуглецю, до яких вони приєднані, утворюють 1,3діоксолан та, в разі необхідності, наявний третій замісник незалежно вибраний із вказаної групи, R1 означає водень, С1-С3-алкіл, С1-С3-алкокси, С1С3-алкілтіо, фтор або хлор, R2 означає водень, С1-С3-алкіл, С1-С3-алкокси, С1С3-алкілтіо, фтор або хлор, R3 означає С1-С4-алкіл, ціано, фтор, хлор, нітро, трифторметил або С1-С3-алкілсульфоніл, або один із залишків R1, R2 та R3 означають водень, С1-С3-алкіл, С1-С3-алкокси, ціано, галоген, нітро або трифторметил, а інші обидва залишки разом з атомами вуглецю, до яких вони приєднані, утворюють циклопентанове або циклогексанове кільце, R4 означає водень або метил, R5 означає водень, R6 означає С 1-С3-алкіл, С1-С3-алкокси, карбоксил, амінокарбоніл, трифторметил, фтор, хлор, ціано, гідрокси або нітро, R7 означає водень, С1-С3-алкіл, С1-С3-алкокси, фтор, хлор, ціано або гідрокси та R8 означає водень, С1-С3-алкіл, С1-С3-алкокси, фтор, хлор, ціано або гідрокси. 3. Сполука за п. 1 або 2, яка відрізняється тим, що Аr означає феніл, в якому феніл може бути заміщений 1 або 2 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає метил, метокси, фтор та хлор, R1 означає водень, метил, метокси, метилтіо, фтор або хлор, R2 означає водень, R3 означає метил, iзопропіл, тpeт-бутил, ціано, фтор, хлор, нітро або трифторметил, R4 означає водень, R5 означає водень, R6 означає амінокарбоніл, фтор, хлор, ціано або гідрокси, R7 означає водень та R8 означає водень, фтор або хлор. 4. Сполука за одним із пп. 1-3, яка відрізняється тим, що R1 означає водень, метил, метокси або фтор. 5. Сполука за одним із пп. 1-4, яка відрізняється тим, що R1 означає метокси. 6. Сполука за одним із пп. 1-5, яка відрізняється тим, що R1 знаходиться у орто-положенні відносно місця приєднання фенільного кільця. 7. Сполука за одним із пп. 1, 2 та 4-6, яка відрізняється тим, що R2 означає водень. 8. Сполука за одним із пп. 1-7, яка відрізняється тим, що R3 означає трифторметил, хлор, метил, iзопропіл або тpeт-бутил. Винахід стосується заміщених дигідрохіназолінів та способу їх одержання, а також їх застосування для одержання лікарських засобів для ліку 4 9. Сполука за одним із пп. 1-8, яка відрізняється тим, що R3 означає трифторметил, хлор або метил. 10. Сполука за одним із пп. 1-9, яка відрізняється тим, що R1 знаходиться у орто-положенні відносно місця приєднання фенільного кільця, a R3 знаходиться у протилежному R1 мета-положенні відносно місця приєднання фенільного кільця. 11. Сполука за одним із пп. 1, 2 та 4-10, яка відрізняється тим, що R4 та R5 означають водень. 12. Сполука за одним із пп. 1-11, яка відрізняється тим, що R6 означає фтор. 13. Сполука за одним із пп. 1, 2 та 4-12, яка відрізняється тим, що R7 означає водень. 14. Сполука за одним із пп. 1, 2 та 4-13, яка відрізняється тим, що R8 означає водень, метил або фтор. 15. Сполука за одним із пп. 1, 2 та 4-14, яка відрізняється тим, що Аr означає феніл, де феніл може бути заміщений 1-2 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає метил, метокси, фтор та хлор. 16. Спосіб одержання сполуки формули (І) за п. 1, який відрізняється тим, що сполуку формули O R1 R9 R8 O R2 N R7 R6 N (II), R3 N R4 N Ar R5 в якій Аr, R1, R2, R3, R4 , R5 , R6 , R7 та R8 мають вказані в п. 1 значення та R9 означає алкіл, переважно метил або етил або трет-бутил, піддають взаємодії з основою або кислотою. 17. Сполука за одним із пп. 1-15 для лікування та/або профілактики захворювань. 18. Лікарський засіб, який містить сполуку за одним із пп. 1-15 у комбінації із однією інертною нетоксичною фармацевтично придатною допоміжною речовиною. 19. Застосування сполуки за одним із пп. 1-15 для одержання лікарського засобу для лікування та/або профілактики вірусних інфекцій. 20. Застосування за п. 19, яке відрізняється тим, що вірусною інфекцією є інфекція, викликана цитомегаловірусом людини (ЛЦМВ) або іншим представником групи Herpes viridae. 21. Лікарський засіб за п. 18 для лікування та/або профілактики вірусних інфекцій. 22. Спосіб боротьби з вірусними інфекціями у людей та тварин шляхом введення антивірусно ефективної кількості сполуки за одним із пп. 1-15 або лікарського засобу за п. 18. вання та/або профілактики захворювань, зокрема для застосування як антивірусні засоби, зокрема проти цитомегаловірусів. 5 82519 Синтез дигідрохіназолінів описаний [в посібнику під редакцією Saito Т. та інш., Tehahedron Lett., 1996, 37, 209 - 212 та під редакцією Wang F. Та інш., Tetrahedron Lett., 1997, 38, 8651 – 8654]. У продажу існують стр уктурно відмінні засоби, які проявляють антивірусну активність, однак вони регулярно можуть призводити до виникнення резистентності. Тому нові засоби є бажаними для ефективного лікування. Таким чином задача даного винаходу полягає у одержанні нових сполук із такою з самою або покращеною антивірусною активністю для лікування вірусних інфекційних захворювань людей та тварин. Несподівано з'ясували, що описані у даному винаході заміщені дигідрохіназоліни проявляють антивірусну активність. Тому об'єктом даного винаходу є сполуки формули (I) в якій Аr означає арил, де арил може бути заміщений 1 - 3 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає алкіл, алкокси, форміл, карбоксил, алкілкарбоніл, алкоксикарбоніл, трифторметил, галоген, ціано, гідрокси, аміно, алкіламіно, амінокарбоніл та нітро, в якій алкіл може бути заміщений 1 - 3 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає галоген, аміно, алкіламіно, гідрокси та арил, або два із замісників арилу разом з атомами вуглецю, до яких вони приєднані, утворюють 1,3діоксолан, циклопентанове кільце або циклогексанове кільце, а, в разі необхідності, наявний третій замісник незалежно від двох попередніх вибирають із згаданої групи, R1 означає водень, аміно, алкіл, алкокси, алкіламіно, алкілтіо, ціано, галоген, нітро або трифторметил, R2 означає водень, алкіл, алкокси, алкілтіо, ціано, галоген, нітро або трифторметил, R3 означає аміно, алкіл, алкокси, алкіламіно, алкілтіо, ціано, галоген, нітро, трифторметил, алкілсульфоніл або алкіламіносульфоніл або один із залишків R1, R2 та R3 означає водень, алкіл, алкокси, ціано, галоген, нітро або трифторметил, а інші два залишки разом з атомами вуглецю, до яких вони приєднані, утворюють 1,3діоксолан, циклопентанове або циклогексанове кільце, R4 означає водень або алкіл, R5 означає водень або алкіл або залишки R4 та R5 у піперазиновому кільці приєднані до чітко протилежних атомів вуглецю та 6 утворюють метиленовий місток, в разі необхідності, заміщений 1 - 2 метиловими групами, R6 означає алкіл, алкокси, алкілтіо, форміл, карбоксил, амінокарбоніл, алкілкарбоніл, алкоксикарбоніл, трифторметил, галоген, ціано, гідрокси або нітро, R7 означає водень, алкіл, алкокси, алкілтіо, форміл, карбоксил, алкілкарбоніл, алкоксикарбоніл, трифторметил, галоген, ціано, гідрокси або нітро та R8 означає водень, алкіл, алкокси, алкілтіо, форміл, карбоксил, алкілкарбоніл, алкоксикарбоніл, трифторметил, галоген, ціано, гідрокси або нітро, та їх солі, їх сольвати та сольвати їх солей. Сполуками згідно з винаходом є сполуки формули (І) та їх солі, сольвати та сольвати ци х солей, які далі названі як вихідні сполуки та їх солі, сольвати та сольвати цих солей, якщо під сполуками формули (І) вже не мають на увазі солі, сольвати та сольвати цих солей. Сполуки згідно з винаходом залежно від їх структури можуть існувати у ізомерних формах (енантіомери, діастереомери). Таким чином винахід стосується також енантіомерів або діастереомерів та їх відповідних сумішей. Із таких сумішей енантіомерів та/або діастереомерів можуть бути ізольовані стереоізомерні компоненти. Якщо сполуки згідно з винаходом можуть існувати у таутомерних формах, то даний винахід стосується також таутомерних форм. Як солі в рамках даного винаходу мають на увазі всі фізіологічно прийнятні солі сполук згідно з винаходом. Крім того винахід охоплює також солі, які самі є неприйнятними для фармацевтичного застосування, але, наприклад, можуть бути застосовані для ізолювання або очищення сполук згідно з винаходом. Фізіологічно прийнятні солі сполук згідно з винаходом включають кислотно-адитивні солі мінеральних, карбонових або сульфонових кислот, наприклад, солі хлорводневої, бромводневої, сірчаної, фосфорної, метансульфонової, етансульфонової, толуолсуль фонової, бензолсульфонової, нафталіндисульфонової, оцтової, трифтороцтової, пропіонової, молочної, винної, яблучної, лимонної, фумарової, малеїнової та бензойної кислоти. Фізіологічно прийнятні солі сполук згідно з винаходом включають також солі звичайних основ, такі як, наприклад, солі лужних металів (наприклад, солі натрію та калію), солі лужноземельних металів (наприклад, солі кальцію та магнію) та солі амонію, похідні від аміаку або органічні амінів, що містять від 1 до 16 атомів вуглецю, такі як, наприклад, переважно етиламін, діетиламін, триетиламін, етилдіізопропіламін, моноетаноламін, діетаноламін, триетаноламін, дициклогексиламін, диметиламіноетанол, прокаїн, дибензиламін, Nметилморфолін, аргінін, лізин, етилендіамін та Nметилпіперидин. Як сольвати в рамках винаходу мають на увазі такі форми сполук згідно з винаходом, які у твердій або рідкій формі шляхом координації із молекулами розчинника утворюють комплекс. Гідратами є 7 82519 спеціальна форма сольватів, в яких відбувається координація із водою. В рамках даного винаходу, якщо не вказано іншого, замісники мають такі значення: Алкіл сам по собі та "алк" або "алкіл" в алкокси. алкіламіно. алкілкарбонілі. алкілсульФонілі. алкіламіносульфонілі та алкоксикарбонілі означають лінійний або розгалужений алкільний залишок, який, як правило, містить від 1 до 6, переважно від 1 до 4, особливо переважно від 1 до 3 атомів вуглецю, наприклад, та переважно метил, етил, нпропіл, ізопропіл, трет-бутил, н-пентил та н-гексил. Алкокси означає, наприклад, та переважно метокси, етокси, н-пропокси, ізопропокси, третбутокси, н-пентокси та н-гексокси. Алкіламіно означає алкіламінозалишок, що має один або два (вибрані незалежно один від одного) алкільні замісники, наприклад, та переважно метиламіно, етиламіно, н-пропіламіно, ізопропіламіно, трет-бутиламіно, н-пентиламіно, нгексиламіно, Ν,Ν-диметиламіно, Ν,Ν-діетиламіно, N-етил-N-метиламіно, N-метил-N-н-пропіламіно, Νізопропіл-N-н-пропіламіно, N-трет-бутил-Nметиламіно, N-етил-N-н-пентиламіно та N-wгексил-N-метиламіно. С1-С3-алкіламіно означає, наприклад, моноалкіламінозалишок, що містить від 1 до 3 атомів вуглецю, або діалкіламінозалишок, що містить відповідно від 1 до 3 атомів вуглецю на кожен алькільний замісник. Алкілсульфоніл означає, наприклад, та переважно метилсульфоніл, етилсульфоніл, нпропілсульфоніл, ізопропілсульфоніл, третбутилсульфоніл, н-пентилсульфоніл та нгексилсульфоніл. АлкіламіносульФоніл означає алкіламіносульфонільний залишок, що має один або два (вибрані незалежно один від одного) алкільні замісники, наприклад, та переважно метиламіносульфоніл, етиламіносульфоніл, н-пропіламіносульфоніл, ізопропіламіносульфоніл, третбутиламіносульфоніл, н-пентиламіносульфоніл, нгексил-аміносульфоніл, Ν,Νдиметиламіносульфоніл, Ν,Νдіетиламіносульфоніл, N-етил-Nметиламіносульфоніл, N-метил-N-нпропіламіносульфоніл, N-ізопропіл-N-н-пропіламіносульфоніл, N-трет-бутил-Nметиламіносульфонт, N-етил-N-н-пентиламіносульфоніл та N-н-гексил-N-метиламіносульфоніл. С1-С3-алкіламіносульфоніл означає, наприклад, моноалкіламіносульфонільний залишок, що містить від 1 до 3 атомів вуглецю, або діалкіламіносульфонільний залишок, що містить від 1 до 3 атомів вуглецю на кожен алкільний замісник. Алкілкарбоніл означає, наприклад, та переважно ацетил або пропаноїл. Алкоксикаобоніл означає, наприклад, та переважно метоксикарбоніл, етоксикарбоніл, нпропоксикарбоніл, ізопропоксикарбоніл, третбутоксикарбоніл, н-пентоксикарбоніл та нгексоксикарбоніл. Арил означає моно- - трициклічний ароматичний, карбоциклічний залишок, який, як правило, містить від 6 до 14 атомів вуглецю; наприклад, та переважно феніл, нафтил та фенантреніл. 8 Галоген означає фтор, хлор, бром та йод, переважно фтор та хлор. Символ * у атомі вуглецю означає, що сполука з огляду на конфігурацію цього атома вуглецю існує у чистій енантіомерній формі, під цим в рамках даного винаходу розуміють, що енантіомерний надлишок становить більше 90% (> 90% е.н.). Перевагу надають таким сполукам формули (І), в якій Аr означає феніл, де феніл може бути заміщений 1 - 3 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає С1-С6-алкіл, С1-С6-алкокси, карбоксил, С1-С6-алкіл карбоніл, С1-С6-алкоксикарбоніл, трифторметил, фтор, хлор, бром, ціано, гідрокси, аміно, С1-С6алкіламіно та нітро, або два із замісників фенілу разом із атомами вуглецю, до яких вони приєднані, утворюють 1,3діоксолан та, в разі необхідності, наявний третій замісник незалежно вибраний із вказаної групи, R1 означає водень, С1-С3-алкіл, С1-С3-алкокси, С1-С3-алкілтіо, фтор або хлор, R2 означає водень, С1-С3-алкіл, С1-С3-алкокси, С1-С3-алкілтіо, фтор або хлор, R3 означає С 1-С4-алкіл, ціано, фтор, хлор, нітро, трифторметил або С1-С3-алкілсульфоніл, або один із залишків R1, R2 та R3 означають водень, С1-С3-алкіл, С1-С3-алкокси, ціано, галоген, нітро або трифторметил, а інші обидва залишки разом з атомами вуглецю, до яких вони приєднані, утворюють циклопентанове або циклогексанове кільце. R4 означає водень або метил, R5 означає водень, R6 означає С 1-С3-алкіл, С1-С3-алкокси, карбоксил, амінокарбоніл, трифторметил, фтор, хлор, ціано, гідрокси або нітро, R7 означає водень, С1-С3-алкіл, С1-С3-алкокси, фтор, хлор, ціано або гідрокси та R8 означає водень, С1-С3-алкіл, С1-С3-алкокси, фтор, хлор, ціано або гідрокси. Особливу перевагу надають таким сполукам формули (І), в якій Аr означає феніл, в якому феніл може бути заміщений 1 або 2 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає метил, метокси, фтор та хлор, R1 означає водень, метил, метокси, метилтіо, фтор або хлор, R2 означає водень, R3 означає метил, ізо-пропіл, трет-бутил, ціано, фтор, хлор, нітро або трифторметил, R4 означає водень, R5 означає водень, R6 означає амінокарбоніл, фтор, хлор, ціано або гідрокси, R7 означає водень та R8 означає водень, фтор або хлор. Крім того особливу перевагу надають таким сполукам формули (І), в якій Аr означає феніл, в якому феніл може бути заміщений 1 або 2 замісниками, причому замісни 9 82519 ки незалежно один від одного вибрані із групи, яка включає метил, метокси, фтор та хлор, R1 означає водень, метил, метокси, метилтіо, фтор або хлор, R2 означає водень, R3 означає метил, трет-бутил, ціано, фтор, хлор, нітро або трифторметил, R4 означає водень, R5 означає водень, R6 означає амінокарбоніл, фтор, хлор, ціано або гідрокси, R7 означає водень та R8 означає водень, фтор або хлор. Найбільшу перевагу при цьому надають таким сполукам формули (І), в якій Аr означає феніл, в якому феніл може бути заміщений 1 або 2 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає метил, метокси, фтор та хлор, R1 означає водень або метокси, R2 означає водень, R3 означає метил, трет-бутил, хлор або трифторметил, R4 означає водень, R5 означає водень, R6 означає амінокарбоніл або фтор, R7 означає водень та R8 означає водень або фтор. При цьому перевагу надають таким сполукам формули (І), в якій R1 означає водень, метил, метокси або фтор. Серед них особливу перевагу надають таким сполукам формули (І), в якій R1 означає метокси. Перевагу при цьому надають також таким сполукам формули (І), в якій R1 знаходиться у ортоположенні відносно місця приєднання фенільного кільця. Під місцем приєднання фенільного кільця, заміщеного залишками R1, R2 та R3, в рамках даного винаходу розуміють атом вуглецю фенільного кільця, який згідно з формулою (І) приєднаний до одного із двох атомів азоту дигідрохіназоліну. Особливу перевагу надають таким сполукам формули (І), в якій R1 означає метокси та R1 знаходиться у орто-положенні відносно місця приєднання фенільного кільця. Крім того перевагу надають таким сполукам формули (І), в якій R2 означає водень. Перевагу надають також таким сполукам формули (І), в якій R3 означає трифторметил, хлор, метил, ізо-пропіл або трет-бутил. Серед них особливу перевагу надають сполука формули (І), в якій R3 означає трифторметил, хлор або метил. Найбільшу перевагу при цьому надають таким сполукам формули (І), в якій R3 означає трифторметил. Крім того перевагу надають таким сполукам формули (І), в якій R1 знаходиться у ортоположенні відносно місця приєднання фенільного кільця, a R 3 знаходиться у протилежному R1 метаположенні відносно місця приєднання фенільного кільця. 10 Особливу перевагу надають таким сполукам формули (І), в якій R1 знаходиться у ортоположенні відносно місця приєднання фенільного кільця, R3 означає трифторметил, хлор або метил та R3 знаходиться у протилежному R1 метаположенні відносно місця приєднання фенільного кільця. Серед них особливу перевагу надають таким сполукам формули (І), в якій R1 знаходиться у орто-положенні відносно місця приєднання фенільного кільця, R3 означає трифторметил та R3 знаходиться у протилежному R1 мета-положенні відносно місця приєднання фенільного кільця. Перевагу надають також таким сполукам формули (І), в якій R4 та R5 означають водень. Крім того перевагу надають таким сполукам формули (І), в якій R6 означає фтор. Особливу перевагу надають таким сполукам формули (І), в якій R6 означає фтор та R6, як описано у формулі (Iа) приєднаний до ароматичною частини дигідрохіназоліну. Перевагу надають також таким сполукам формули (І), в якій R7 означає водень. Серед них особливу перевагу надають таким сполукам формули (І), в якій R8 означає водень, метил або фтор. При цьому найбільшу перевагу надають сполукам формули (І), в якій R8 означає водень. Крім того перевагу надають таким сполукам формули (І), в якій Аr означає феніл, в якому феніл може бути заміщений 1 або 2 замісниками, причому замісники незалежно один від одного вибрані із групи, яка включає метил, метокси, фтор та хлор. Вказані у відповідних комбінаціях або переважних комбінаціях залишків їх визначення незалежно від вказаних комбінацій можуть бути у будь-якій послідовності замінені визначеннями залишків інших комбінацій. Найбільшу перевагу при цьому надають комбінаціям двох або більше вказаних вище переважних залишків. Таким чином об'єктом даного винаходу є спосіб одержання сполук формули (І), причому сполуки формули (IІ) в якій 11 82519 Аr, R1 , R2, R3, R4, R5 , R6, R7 та R8 мають вказані вище значення та R9 означає алкіл, переважно метил або етил або трет-бутил, піддають взаємодії з основами або кислотами. Взаємодію у випадку метилу та етилу з основами здійснюють у інертних розчинниках переважно при температурі від кімнатної до температури кипіння розчинників при нормальному тиску. Як основи застосовують, наприклад, гідроксиди лужних металів, такі як гідроксид натрію, літію або калію, або карбонати лужних металів, такі як карбонат цезію, натрію або калію, в разі необхідності, у вигляді водного розчину, наприклад, гідроскид натрію у воді. Інертними розчинниками є, наприклад, етери, такі як 1,2-диметоксиетан, діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленглікольдиметиловий етер, спирти, такі як метанол, етанол, н-пропанол, iзо-пропанол, н-бутанол або трет-бутанол, або суміші розчинників, такі як переважно діоксан або тетрагідрофуран. У випадку трет-бутилу взаємодію здійснюють загалом із кислотами в інертних розчинниках переважно при температурі від 0°С до 40°С при нормальному тиску. Придатними кислотами є при цьому хлороводень в діоксані, бромоводень в оцтовій кислоті або трифтороцтова кислота в метиленхлориді. Сполуки формули (II) є відомими або можуть бути одержані шляхом взаємодії сполук формули (I) 12 снюють переважно разом із переробкою між першою та др угою стадіями. Інертними розчинниками є, наприклад, галогенвуглеводні, такі як метиленхлорид, трихлорметан, тетра хлорметан, трихлоретан, тетрахлоретан, 1,2-дихлоретан або трихлоретилен, етери, такі як діетиловий етер, метил-трет-бутиловий етер, 1,2диметоксиетан, діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленглікольдиметиловий етер, вуглеводні, такі як бензол, ксилол, толуол, гексан, циклогексан або фракції нафти, або інші розчинники, такі як диметилформамід, диметилацетамід, ацетонітрил або етилацетат, або суміші розчинників, перевагу надають метиленхлориду. Сполуки формули (IV) є відомими або можуть бути синтезовані відомими способами із відповідних едуктів. Сполуки формули (V) є відомими або можуть бути синтезовані відомими способами із відповідних едуктів, наприклад, при здійсненні реакції Бухвальда-Хартвіга за такою схемою синтезу [огляд в: С. G. Frost, P.Mendonca, J Chena. Soc, Perkin Transl, 1998, 2615 - 2623]: Реакції Бухвальда-Хартвіга: Необхідні для цього едукти є відомими або можуть бути синтезовані відомими способами із відповідних едуктів. Сполуки формули (III) є відомими або можуть бути одержані шляхом взаємодії сполук формули (VI) в якій R6, R7, R8 та R9 мають вказані вище значення, при здійсненні двоступеневої реакції спочатку зі сполуками формули (V) в якій R1, R2 та R3 мають вказані вище значення, та після цього зі сполуками формули (V) в якій Аr, R 4 та R5 мають вказані вище значення. На двох стадіях взаємодію здійснюють загалом в інертних розчинниках переважно при температурі від кімнатної до 100°С при нормальному тиску. На другій стадії до реакційної суміші, в разу необхідності, додають силікагель. Взаємодію здій в якій Re, R7, R8 та R9 мають вказані вище значення, з трифенілфосфіном та тетрахлорвуглецем. Взаємодію загалом здійснюють в інертних розчинниках в присутності основи переважно при температурі від кімнатної до 50°С при нормальному тиску. Інертними розчинниками є, наприклад, етери, такі як діетиловий етер, метил-трет-бутиловий етер, 1,2-диметоксиетан, діоксан, тетрагідрофуран, глікольдиметиловий етер або діетиленглікольдиметиловий етер, вуглеводні, такі як бензол, ксилол, толуол, гексан, циклогексан або фракції нафти, або інші розчинники, такі як диметилформамід, диметилацетамід, ацетонітрил або піридин, перевагу надають ацетонітрилу. Основами є, наприклад, карбонати лужних та лужноземельних металів, такі як карбонат цезію, карбонат натрію або калію, або аміни, такі як триетиламін, діізопропілетиламін, N-метилморфолін або піридин, перевагу надають триетиламіну. 13 82519 Сполуки формули (VI) є відомими або можуть бути синтезовані відомими способами із відповідних едуктів, наприклад, при здійсненні реакції Хека або реакції Віттіга-Хорнера за такою схемою синтезу: Реакції Хека: Реакція Віттіга-Хорнера: Необхідні для цього едукти є відомими або можуть бути синтезовані відомими способами із відповідних едуктів. Одержання сполук згідно з винаходом можна пояснити на основі такої схеми синтезу. Сполуки загальної формули (І) згідно з винаходом мають несподівано широкий спектр дії. Вони проявляють антивірусну активність проти представників групи Herpes viridae (віруси герпесу), передусім проти цитомегаловірусів (ЦМВ), зокрема проти цитомегаловірусу людини (ЛЦМВ). До сфер застосування належать, наприклад: 1) лікування та профілактика ЛЦМВ-інфекцій у пацієнтів, хворих на СНІД (ретиніт, пневмонія, шлунково-кишкові інфекції); 2) лікування та профілактика цитомегаловірусних інфекцій у пацієнтів із пересадженим кісним мозком та органами, які хворіють на ЛЦМВпневмонію, ЛЦМВ-енцефаліт, а також мають шлунково-кишкові та систематичні ЛЦМВ-інфекції, що дуже часто загрожує їх життю; 3) лікування та профілактика ЛЦМВ-інфекцій у новонароджених та дітей молодшого віку; 4) лікування та профілактика ЛЦМВ-інфекцій у вагітних; 14 5) лікування ЛЦМВ-інфекцій у пацієнтів з пригніченою імунною системою, хворих на рак, та при лікуванні раку; 6) лікування ЛЦМВ-позитивних хворих на рак з метою уповільнення розвитку пухлини, спричиненої ЛЦМВ [див. J. Cinatl, та інш., FEMC Microbiology Reviews 2004, 28, 59 - 77]. Іншим об'єктом даного винаходу є застосування сполук згідно з винаходом для лікування та/або профілактики захворювань, передусім вірусних інфекцій, зокрема вказаних вище вірусів, а також спричинених цими вірусами інфекційних захворювань. Під вірусною інфекцією розуміють як спричинену вірусами інфекцію, так і захворювання викликані інфекцією, спричиненою вірусами. Крім того об'єктом даного винаходу є також застосування сполук згідно з винаходом для лікування та/або профілактики захворювань, зокрема названих ви ще захворювань. Крім того об'єктом даного винаходу є також застосування сполук згідно з винаходом для одержання лікарського засобу для лікування та/або профілактики захворювань, зокрема названих вище захворювань. Переважно сполуки згідно з винаходом застосовують для одержання лікарських засобів, які є придатними для профілактики та/або лікування інфекцій, викликаних представниками групи Herpes viridae, зокрема цитомегаловірусом, а саме цитомегаловірусом людини. Іншим об'єктом даного винаходу є спосіб лікування та/або профілактики захворювань, зокрема названих вище захворювань, при застосуванні антивірусно ефективної кількості сполук згідно з винаходом. Крім того об'єктом даного винаходу є також лікарські засоби, які містять щонайменше одну сполуку згідно з винаходом та щонайменше одну або кілька інших активних речовин, зокрема для лікування та/або профілактики названих вище захворювань. Придатними для комбінування активними речовинами є, наприклад, та переважно: антивірусні активні речовини, такі як ганцикловір або ацикловір. Сполуки згідно з винаходом можуть проявляти систематичну та/або локальну дію. З цією метою вони можуть бути нанесені відповідним чином, наприклад, орально, парентерально, легенево, назально, під язик, за щоку, ректально, дермально, трансдермально, кон'юктівально, у вухо або у вигляді імплантату або стенту. Для таких видів застосування сполуки згідно з винаходом можуть бути застосовані у відповідних формах. Для орального застосування згідно з рівнем техніки придатними є швидко функціонуючі та/або модифіковані форми застосування, які вивільнюють сполуки згідно з винаходом, які містять сполуки згідно з винаходом у кристалічній та/або аморфній та/або розчиненій формі, такі як, наприклад, таблетки (не покриті або покриті оболонками, наприклад, оболонками, стійкими до шлункового соку, або оболонками, які повільно розчиняються чи не розчиняються взагалі, які контролюють вивільнення сполуки згідно з винаходом), таблетки 15 82519 або плівки/облатки, плівки/ліофілізати, капсули, які швидко розчиняються у ротовій порожнині (наприклад, тверді або м'які желатинові капсули), драже, грануляти, гранули, порошки, емульсії, суспензії, аерозолі або розчини. Парентеральне застосування може відбуватися без стадії всмоктування (наприклад, внутрівенно, внутріартеріально, внутрісердечно, інтраспінально або інтралюмбально) або за умови включення стадії всмоктування (наприклад, внутрім'язово, підшкірно, у шкіру, перкутанно або внутрібрюшинно). Придтними для парентерального застосування є такі форми, як ін'єкційні або інфузійні композиції у формі розчинів, суспензій, емульсій, ліофілізатів або стерильних порошків. Для інших видів застосування придатними є, наприклад, лікарські засоби для інгаляції (а саме порошкові інгалятори, розпилювачі), краплі, розчини, спреї в ніс; таблетки під язик або за щоку, плівки/облатки або капсули, супозиторії, композиції для вух або очей, вагінальні капсули, водні суспензії (лосьйони, мікстури «бовтушки»), ліпофільні суспензії, мазі, креми, трансдермальні системи, молочко, пасти, піни, присипки, імплантати або стенти. Сполуки згідно з винаходом можуть бути переведені у згадані форми застосування. Це можна здійснювати відомими способами шляхом змішування з інертними нетоксичними фармацевтично придатними допоміжними речовинами. До таких допоміжних речовин належать носії (наприклад, мікрокристалічна целюлоза, лактоза, маніт), розчинники (наприклад, рідкі поліетиленгліколі), емульгатори та диспергатори або змочувальні агенти (наприклад, додецилсульфат натрію, олеат поліоксисорбіту), зв'язувальні агенти (наприклад, полівінілпіролідон), синтетичні та натуральні полімери (наприклад, альбумін), стабілізатори (наприклад, антиоксиданти, такі як аскорбінова кислота), барвники (наприклад, неорганічні пігменти, такі як оксиди заліза) та речовини, що коригують смак та/або запах. Іншим об'єктом даного винаходу є лікарські засоби, які містять щонайменше одну сполуку згідно з винаходом, зазвичай разом із однією або кількома інертними нетоксичними фармацевтично придатними допоміжними речовинами, а також їх застосування для вказаних вище цілей. Загалом виявили, що при внутрівенному застосуванні для досягнення необхідних результатів кількість активної речовини переважно становить приблизно 0,001 - 10 мг/кг, зокрема приблизно 0,01 - 5мг/кг ваги тіла, а при оральному застосуванні дозування становить приблизно 0,01 - 25мг/кг, зокрема 0,1 -10мг/кг ваги тіла. Крім того, в разі необхідності, можна відступати від вказаних кількостей в залежності від ваги тіла, форми застосування, індивідуальної реакції на активну речовину, виду композиції та моменту або інтервалу її застосування. Так, наприклад, у деяких випадках достатнім може виявитися застосування меншої кількості, ніж вказана вище мінімальна гранична кількість, а у інших випадках необхідно перевищувати максимальну граничну кількість. У випадку застосування більших кількос 16 тей варто розподілити цю кількість на кілька окремих доз для застосування протягом дня. Показники в% у наведених нижче тестах та прикладах, якщо не вказано нічого іншого, стосуються ваг. %; частини означають вагові частини. Співвідношення розчинників, коефіцієнти розрідження та показники концентрації розчинів рідина/рідина відповідно залежать від об'єму. А. Приклади Скорочення: прибл. приблизно, БІНАФ 2,2'-біс-(Дифенілфосфіно)-1,1'бінафтил, CDCI3 деуретохлороформ, ТХ тонкошарова хроматографія, ПХІ пряма хімічна іонізація (при МС), ДХМ дихлорметан, DIEA N,N-діізопропілетиламін, ДМСО диметилсульфоксид, ДМФ Ν,Ν-диметилформамід, від теор. від теоретичного, ЕА етилацетат (етиловий естер оцтової кислоти), ЕІ іонізація електронним ударом (при МС), ЕСІ електроспрей-іонізація (при МС), Т.пл. температура плавлення, насич. насичений, год. година, РХВТ рідинна хроматографія високого тиску, конц. концентрований, РХ-МС рідинна хроматографія при масспектроскопії, ЛДА діізопропіламід літію, хв. хвилини, МС мас-спектроскопії, МТБЕ метил-трет-бутиловий етер, ЯМР ядерний магнітний резонанс, Пд-С паладій на вугіллі, проц. процентний, ОФ-РХВТ РХВТ з оберненою фазою, КТ кімнатна температура, Уч час утримування (при РХВТ), ТГФ тетрагідрофуран Загальні методи РХ-МС та РХВТ: Метод 1 (аналітична РХВТ): колона: Symmetry Kromasil C18 60мм´2мм; температура: 30°С; потік: 0,75мл/хв.; елюент А: 0,005Μ НСlO4, елюент В: ацетонітрил; градієнт: ®0,5хв. 98% А, ®4,5хв. 10% А, ®6,5 хв. 10% А. Метод 2 (препаративна РХВТ): колона: GromSil C18, 250мм χ 30мм; потік: 50мл/хв.; час: 38хв.; індикація: 210мм; елюент А: вода, елюент В: ацетонітрил, градієнт 10% В (3хв.) ®90% В (31хв.) ®90% В (34хв.) ®10% В (34,01хв.). Метод 3 (РХ-МС): колона: GromSil 120 ODS-4 НЕ, 50мм´2,0мм, 3мкм; елюент А: 1л води+ 1мл 50%-ної мурашиної кислоти, елюент В: 1л ацетонітрилу+ 1мл 50%-ної мурашиної кислоти; градієнт: 0,0хв. 100% А®0,2 хв. 100% А®2,9 хв. 30% А®3,1 хв. 10%®4,5хв. 10% А; піч: 55°С; потік: 0,8мл/хв.; УФ-визначення: 208-400нм. 17 82519 Метод 4 (препаративна РХВТ, виділення енантіомеру, карбонова кислота): колона: ущільнювальний матеріал: хіральний силікагелевий селектор KВО 8361 (420мм´100мм) на основі селектору полі(N-метакрилоїл-L-лейцинІ-ментиламід); температура: 23°С; елюент: метилтрет-бутиловий етер; потік: 100мл/хв.; сполука розчинена в метил-трет-бутиловому е тері/етилацетаті (9:1). Метод 5 (препаративна РХВТ): колона: GromSil C18, 250мм´30мм; потік: 50мл/хв.; час: 38хв.; індикація: 210нм; елюент А: вода з 0,1% мурашиної кислоти, елюент В: ацетонітрил, градієнт: 10% В (3хв.) ®90% В (31хв.) ®90% В (34хв.) ®10% В (34,01хв.). Метод 6 (аналітична РХВТ): інструмент: HP 1100 з DAD-індикацією; колона: Kromasil RP18,60мм´2мм, 3,5мкм;елюент А: 5мл НСІО4/л води, елюент В: ацетонітрил; градієнт: 0хв. 2% В, 0,5хв. 2% В, 4,5хв. 90% В, 9хв. 90% В; потік: 0,75мл/хв.; температура: 30°С, індикація: УФ 210нм. Метод 7 (РХ-МС): інструмент: Micromass Platform LCZ з РХВТ Agilent серії 1100; колона: Grom-SIL120 ODS-4 HE, 50мм´2,0мм, 3мкм; елюент А: 1л води+ 1мл 50%-ної мурашиної кислоти, елюент В: 1л ацетонітрилу+ 1мл 50%-ної мурашиної кислоти; градієнт: 0,0хв. 100%®0,2хв. 100%®2,9хв. ЗО% А®3,1 хв. 10% А®4,5хв. 10% А; піч: 55°С; потік: 0,8мл/хв.; УФ-індикація: 210нм. Метод 8 (РХ-МС): інструмент: Micromass Platform LCZ, HP1100; колона: Symmetry C18, 50мм´2,1мм, 3,5мкм; елюент А: ацетонітрил+ 0,1% мурашиної кислоти, елюент В: вода+ 0,1% мурашиної кислоти; градієнт: 0,0хв. 10% А®4,0хв. 90% А®6,0 хв. 90% А; піч: 40°С; потік: 0,5мл/хв.; УФіндикація: 208-400нм. Метод 9 (РХ-МС): тип приладу МС: Micromass ZQ; тип приладу РХВТ: Waters Alliance 2795; колона: MerckChromolith SpeedROD RP-18e 50мм´4,6мм; елюент А: вода+ 500л 50%-ної мурашиної кислоти/л; елюент В: ацетонітрил+ 500л 50%-ної мурашиної кислоти/л; градієнт: 0,0хв. 10% В®3,0хв. 95% В®4,0хв. 95% В; піч: 35°С; потік: 0,0хв. 1,0мл/хв.®3,0хв. 3,0мл/хв.®4,0 хв. 3,0мл/хв.; УФ-визначення: 210нм. Метод 10 (РХ-МС): тип приладу МС: Micromass ZQ; тип приладу РХВТ: серія HP 1100; УФ DAD; колона: Grom-Sil 120 ODS-4 HE 50мм´2мм, 3,0мкм; елюент А: вода+ 500мкм 50%-ної мурашиної кислоти/л, елюент В: ацетонітрил+ 500мкл 50%-ної мурашиної кислоти/л; градієнт: 0,0хв. 0% В®2,9хв. 70% В®3,1хв. 90% В®4,5хв. 90% В; піч: 50°С; потік: 0,8мл/хв.; УФ-індикація: 210нм. Метод 11 (препаративна РХВТ, виділення енантіомеру): колона: ущільнювальний матеріал: хіральний силікагелевий селектор KBD 8361 (250мм´20мм) на основі селектору полі(Nметакрилоїл-L-лейцин-I-ментиламід); температура: 23°С; елюент: метил-трет-бутиловий етер+ 5% етилацетату; потік: 25мл/хв. Метод 12 (препаративна РХВТ, виділення енантіомеру): колона: ущільнювальний матеріал: хіральний силікагелевий селектор KBD 5326 18 (250мм´20мм) на основі селектору полі(Nметакрилоїл-L-лейцин-І-ментиламід); температура: 23°С; елюент: метил-трет-бутиловий етер+ 5% етилацетату; потік: 25мл/хв. Метод 13 (препаративна РХВТ, виділення енантіомеру): колона: ущільнювальний матеріал: хіральний силікагелевий селектор KBD 8361 (250мм´20мм) на основі селектору полі(Nметакрилоїл-L-лейцин-І-ментиламід); температура: 23°С; елюент: метил-трет-бутиловий етер+ 5% етилацетату; потік: 25мл/хв. Метод 14 (препаративна РХВТ, виділення енантіомеру, естер): колона: ущільнювальний матеріал: хіральний силікагелевий селектор KBD 8361 (420мм´100мм) на основі селектору полі(Nметакрилоїл-L-лейцин-І-ментиламід); температура: 23°С; елюент: і-гексан/етилацетат 85/15об./об.; потік: 100мл/хв.; сполука розчинена в ігексані/етилацетаті (85:15). Метод 15 (препаративна РХВТ, виділення енантіомеру, естер): колона: ущільнювальний матеріал: хіральний силікагелевий селектор KBD 8361 (420мм´100мм) на основі селектору полі(Nметакрилоїл-L-лейцин-І-ментиламід); температура: 23°С; елюент: метил-трет-бутиловий етер; потік: 100мл/хв.; сполука розчинена в метил-третбутиловому е тері. Метод 16 (РХ-МС): інструмент: Micromass Platform LCZ з РХВТ Agilent серії 1100; колона: Grom-SIL120 ODS-4 НЕ, 50мм´2,0мм, 3мкм; елюент А: 1л води+ 1мл 50%-ної мурашиної кислоти, елюент В: 1л ацетонітрилу+ 1мл 50%-ної мурашиної кислоти; градієнт: 0,0хв. 100% А®0,2хв. 100% А®2,9 хв. 30%®3,1хв. 10%®4,5хв. 10% А; піч: 55°С; потік: 0,8мл/хв.; УФ-індикація: 208-400нм. Метод 17 (РХ-МС): тип приладу МС: Micromass ZQ; тип приладу РХВТ: Waters Alliance 2790; колона: Grom-Sil 120 ODS-4 HE 50мм´2мм, 3,0мкм; елюент А: вода+ 500мкл 50%-ної мурашиної кислоти/л; елюент В: ацетонітрил+ 500л 50%-ної мурашиної кислоти/л; градієнт: 0,0 хв. 0% В®0,2 хв. 0% В®2,9хв. 70% В®3,1хв. 90% В®4,5хв. 90% В; піч: 45°С; потік: 0,8мл/хв.; УФ-індикація: 210нм. Вихідні сполуки Загальна робоча методика [А]: синтез заміщених похідних 2-амінокоричної кислоти при здійсненні реакції Хека із 2-галогензаміщених анілінів У одногорлій колбі змішують 1,0 еквівалент арилгалогеніду з 1,6 еквівалентом метилового або трет-бутилового естеру акрилової кислоти, 2,0 еквіваленти триетиламіну, 0,03 еквіваленти ацетату паладію (II) та 0,03 еквіваленти три-отолілфосфін у в ацетонітрилі (приблизно 1Nрозчин). Розчин протягом 48 годин перемішують при кип'ятінні із зворотнім холодильником. Після завершення реакції (контроль реакції за допомогою ТХ) розчинник видаляють. Залишок очищують хроматографом на силікагелі за допомогою суміші циклогексан/етилацетат =8:2об./об. Приклад 1А Метиловий естер (2Е)-3-[2-аміно-3фтор феніл]пропенової кислоти 19 82519 20 Виходячи із 2,00г (8,69ммоль) метилового естеру 2-аміно-3-бромбенйної кислоти згідно із загальною робочою методикою [А] одержують 1,29г (60% від теор.) продукту. РХВТ (методі): У ч=4,42хв. МС (ESI-поз.): m/z=236 (М+Н)+ Приклад 3А Метиловий естер (2Е)-3-(2-аміно-3,5дифторфеніл)-2-пропенової кислоти Виходячи із 1,90г (9,64ммоль) 3-бром-4амінобензонітрилу згідно із загальною робочою методикою [А] 1,28г (50% від теор.) продукту. РХВТ (метод 1): У ч=2,85хв. МС (DCI-поз): m/z=220 (M+NH 4)+ Загальна робоча методика [Β]: синтез заміщених похідних 2-нітрокоричної кислоти при здійсненні реакції Віттіга-Хорнера з 2-галогензаміщених бензальдегідів У 100мл одногорлій колбі суспендують 27,5ммоль метилдіетилфосфонацетату, 25,0ммоль бензальдегіду та 27,5ммоль гідроксиду у те трагідрофурані. Після завершення реакції (контроль реакції за допомогою ТХ) у суміш додають таку ж кількість води. Водну фаз у тричі екстрагують етилацетатом. Об'єднані органічні фази промивають насиченим розчином хлориду натрію, сушать над сульфатом натрію, а розчинник видаляють. Продукт без подальшого очищення сушать у високому вакуумі при кімнатній температурі. В разі необхідності, при наявності великої кількості домішок продукт очищують хроматографом на силікагелі за допомогою суміші циклогексан/етилацетат. Приклад 6А Метиловий естер (2Е)-3-(3-метокси-2нітрофеніл)-2-пропенової кислоти Виходячи із 3,00г (14,42ммоль) 2-бром-4,6дифтораніліну згідно із загальною робочою методикою [А] одержують 1,41г (45% від теор.) продукту. РХВТ (метод 1): У ч=4,23хв. МС (ESI-поз.): m/z=214 (М+Н)+ Приклад 4А Метиловий естер 4-аміно-3-[(1Е)-3-метокси-3оксо-1-пропеніл]бензойної кислоти Виходячи із 2,00г (11.04ммоль)3-метокси-2нітробензальдегід згідно із загальною робочою методикою [В] одержують 2,46г (92% від теор.) продукту. РХВТ (метод 1): У ч=4,37хв. МС (ESI-поз.): m/z=238 (М+Н)+ Приклад 7А Метиловий естер (2Е)-3-(5-фтор-2нітрофеніл)-2-пропенової кислоти Виходячи із 42,00г (221,04ммоль) 2-бром-6фтораніліну згідно із загальною робочою методикою [А] одержують 29,66г (68% від теор.) продукту. РХВТ (метод 1): У ч=4,14хв. МС (ESI-поз.): m/z=196 (М+Н)+ Приклад 2А Метиловий естер 2-аміно-3-[(1Е)-3-метокси-3оксо-1-пропеніл]бензойної кислоти Виходячи із 25,00г (90,23ммоль) метилового естеру 4-аміно-3-йодбензойної кислоти згідно із загальною робочою методикою [А] одержують 24,31г (92% від теор.) продукту. РХВТ (метод 1): У ч=4,71хв. МС (ESI-поз.): m/z=278 (М+Н)+ Приклад 5А Метиловий естер (2Е)-3-[2-аміно-5ціанофеніл]-2-пропенової кислоти Виходячи із 20,0г (118,3ммоль) 5-фтор-2нітробензальдегіду згідно із загальною робочою методикою [В] одержують 7,25г (27% від теор.) продукту. МС (П ХІ): m/z=243(M+NH 4)+ Загальна робоча методика ГСТ: одержання 2нітробензальдегіду із бензил галогеніду 10,0ммоль бензилгалогеніду за допомогою 4,1г молекулярного сита 4А та 20,0ммоль Nоксиду N-метилморфоліну суспендують в 45мл ацетонітрилу. Суміш перемішують при кімнатній температурі до початку взаємодії (контроль реакції 21 82519 за допомогою ТХ). Після завершення реакції молекулярне сито відфільтровують, розчинник згущують, а залишок поміщають у етилацетат. Цей розчин спочатку промивають 1N розчином соляної кислоти, а після цього - насиченим розчином хлориду натрію. Відділену органічну фазу сушать над сульфатом натрію, а розчинник знову згущують. За теорією чистота сировини є достатньої для її подальшого застосування у реакції. Приклад 8А 2-фтор-6-нітробензальдегід Виходячи із 2,00г (8,55ммоль) 3-фтор-6нітробензилброміду згідно із загальною робочою методикою [С] одержують 1,09г (75% від теор.) продукту. РХВТ (метод 1): У ч=3,58хв. Загальна робоча методика [D]: відновлення нітрогрупи похідних 2-нітрокоричної кислоти У 250мл двогорлу колбу в атмосфері аргону в 60мл абсолютного етанолу поміщають 25ммоль нітросполуки та 125ммоль гідрату хлориду олова (II). Цю суспензію протягом 30 хвилин перемішують при кип'ятінні зі зворотнім холодильником, та одержують прозорий розчин. Потім розчин залишають охолоджуватися до кімнатної температури та виливають його у крижану воду. За допомогою твердого гідрокарбонату натрію або насиченого розчину карбонату натрію встановлюють значення рН=7 - 8. Після цього додають 60мл етилацетату, а солі олова, що випали в осад, відфільтровують через кізельгур (через шар товщиною приблизно 1см). Органічну фаз у відділяють, а водн у фазу екстрагують етилацетатом. Органічні фази об'єднують та промивають розчином хлориду натрію, сушать над сульфатом натрію, а розчинник згущують приблизно наполовину. Потім додають активоване вугілля, відповідно 1% від ваги нітросполуки, та протягом 30 хвилин нагрівають при кип'ятінні зі зворотнім холодильником (знебарвлення розчину). Активоване вугілля відфільтровують, а розчинник згущують. Як залишок залишається масло, яке при сушінні при кімнатній температурі у високому вакуумі утворює кристали. Без подальшого очищення на наступній стадії здійснюють безпосередню взаємодію. Приклад 9А Метиловий естер 3-[2-аміно-6фтор феніл]пропенової кислоти Виходячи із 7,25г (32,2ммоль) нітросполуки із прикладу 7А згідно із загальною робочою методикою [D] одержують 5,0г (58% від теор.) продукту. РХВТ (метод 1): У ч=3,33хв. 22 Загальна робоча методика [Ε]: синтез імінофосфоранів при здійсненні реакції Аппеля із заміщених анілінів У 50мл одногорлій колбі розчиняють 10,0ммоль аміну естеру 2-амінокоричної кислоти, 20,0ммоль трифенілфосфіну, 100,0ммоль тетрахлорвуглецю та 100,0ммоль триетиламін в 20мл ацетонітрилу. Розчин протягом 2 годин перемішують при кімнатній температурі. Після завершення реакції (контроль реакції за допомогою ТХ або аналітичної РХВТ) розчинник видаляють у вакуумі, а залишок очищують колонковою хроматографією на силікагелі сумішшю циклогексан/етилацетат =7:3. Приклад 10А Метиловий естер (2Е)-3-{3-фтор-2[(трифенілфосфораніліден)аміно]феніл}пропенової кислоти Виходячи із 29,3г (150,1ммоль) аміносполуки із прикладу 1А згідно із загальною робочою методикою [Е] одержують 55,0г (80% від теор.) продукту. РХВТ (метод 1): У ч=4,46хв. МС (ESI-поз.): m/z=456 (М+Н)+ Приклад 11А Метиловий естер (2Е)-3-{5-фтор-2[(трифенілфосфораніліден)аміно]феніл}пропеновоїкислоти Виходячи із 50,0г (256,2ммоль) аміносполуки із прикладу 9А згідно із загальною робочою методикою [Е] одержують 89,6г (77% від теор.) продукту. РХВТ (метод 1): У ч=4,36хв. МС (ESI-поз.): m/z=456 (М+Н)+ Приклад 12А Метиловий естер (2Е)-3-{5-ціано-2[(трифенілфосфораніліден)аміно]феніл}пропеновоїкислоти 23 82519 Виходячи із 1,24г (4,60ммоль) аміносполуки із прикладу 5А згідно із загальною робочою методикою [Е] одержують 2,12г (92% від теор.) продукту. РХВТ (метод 1): У ч=4,42хв. МС (ESI-поз.): m/z=463 (М+Н)+ Загальна робоча методика [F]: синтез фенілпіперазинів при здійсненні реакції БухвальдаХартвіга Підготовка до реакції: реакційну колбу ретельно нагрівають у високому вакуумі та шляхом обдуву наповнюють аргоном. У колбу поміщають 1,0 еквівалент бромарилосполуки та 6,0 еквівалентів піперазину у абсолютному толуолі (0,2 - 0,3Μ розчин бромосполуки). Після цього додають 0,01 еквівалент тріс-(дибензиліденацетон)-дипаладію, а також 0,03 еквіваленти БІНАФ. Реакційну суміш протягом 16 годин перемішують при кип'ятінні із зворотнім холодильником. Після цього суміш екстрагують водою, органічну фазу двічі екстрагують 1N розчином соляної кислоти, у водній фазі за допомогою 1Ν розчину їдкого натру встановлюють значення рН8 та тричі екстрагують дихлорметаном. Об'єднані органічні фази сушать над сульфатом натрію, фільтрують, розчинник видаляють у вакуумі, а продукт протягом ночі сушать у високому вакуумі. Приклад 13А N-(4-фтор-3-метилфеніл)піперазин Виходячи із 5,0г (26,5ммоль) 4-фтор-3-метил1-бромбензолу згідно із загальною робочою методикою [F] одержують 4,52г (83% від теор.) продукту. РХВТ (метод 1): У ч=3,54хв. МС (ESI-поз.): m/z=195 (М+Н)+ Приклад 14А N-(4-фторфеніл)-3-метилпіперазин Виходячи із 1,0г (5,71ммоль) 4-фтор-3-метил1-бромбензолу згідно із загальною робочою методикою [F] одержують 0,57г (49% від теор.) продукту. РХВТ (метод 1): У Ч=3,37хв. МС (DCI-поз.): m/z=195 (М+Н)+ Приклад 15А 1-(3-фторфеніл)піперазин У 20мл толуолу розчиняють 1г (5,71ммоль) 3фторбромбензолу та 2,95г (34,29ммоль) піперазину та додають 0,77г (8ммоль) трет-бутилату натрію. Після цього суміш в присутності 0,11г 24 (0,17ммоль) БІНАФ та 0,05г (0,06ммоль) тріс(дибензиліденацетон)-дипаладій протягом ночі перемішують при кип'ятіння зі зворотнім холодильником. Після охолодження додають етилацетат та промивають водою. Потім екстрагують 1N розчином соляної кислоти, а водну фазу промивають етилацетатом. Після встановлення рівня рН=8 - 9 суміш екстрагують дихлорметаном. Після сушіння органічної фази над сульфатом магнію та видалення розчинника одержують цільову сполук у. Вихід: 0,8г (78% від теор.) РХВТ (метод 1):У ч=3,4хв. МС (ESI-поз.): m/z=181 (М+Н)+ Приклад 16А 1-(3,4-дифторфеніл)піперазин У 100мл толуолу додають 5г (25,91ммоль) 3,4дифторбромбензолу, 13,39г (155,45ммоль) піперазину, 3,49г (36,27ммоль) трет-бутилату натрію, 0,24г (0,26ммоль) тріс(дибензиліденацетон)дипаладію та 0,48г (0,78ммоль) БІНАФ та протягом ночі перемішують при кип'ятінні зі зворотнім холодильником. Після додавання етилацетату промивають водою, а органічну фазу екстрагують 1N розчином соляної кислоти. Водну фазу промивають етилацетатом та встановлюють значення рН=8. Продукт екстрагують дихлорметаном із водної фази. Потім сушать над сульфатом магнію, розчинник видаляють, а цільову сполук у сушать у вакуумі. Вихід: 3,85г (75% від теор.) РХВТ (метод 1): У ч=3,4хв. MC(DCI): m/z=199(M+H)+ Приклад 17А 2-ізоціанато-1-метокси-4(трифторметил)бензол В 100мл дихлорметану розчиняють 3г (15,69ммоль) 2-метокси-5-трифторметиланіліну та додають 6,73г (31,39ммоль) 1,8-біс(диметиламіно)нафталіну. При 0-5°С по краплях додають 2,24г (11,3ммоль) трихлорметилового естеру хлормурашиної кислоти, розчиненого в 50мл дихлорметану, та протягом 30 хвилин перемішують при 0°С, а також протягом 60 хвилин при кімнатній температурі. При 0°С суміш промивають 1N розчином соляної кислоти, крижаною водою та розчином гідрокарбонату натрію. Після сушіння над сульфатом магнію та віддистилювання розчинника одержують продукт. Після цього ізоціанат без подальшого очищення використовують у подальших реакціях. Вихід: 3,00г (88% від теор.) Приклад 18А Метиловий естер (2Е)-3-{3-фтор-2-[({[2метокси-5-(трифторметил)феніл]іміно}метилен)аміно]феніл}-2-пропенової кислоти 25 82519 26 тодикою [G] одержують 50мг (45% від теор.) продукту. РХВТ (метод 1): У ч=4,81хв. Приклад 20А Метиловий естер {8-фтор-2-[4-(4-фтор феніл)1-піперазиніл]-3-[3-(трифторметил)-феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти В 50мл дихлорметану додають 5,0г (10,98ммоль) метилового естеру (2Е)-3-{3-фтор-2[(трифенілфосфораніліден)аміно]-феніл}-2пропенової кислоти (приклад 10А) та протягом ночі при кімнатній температурі перемішують із 2,5г (11,53ммоль) 2-ізоціанато-1-метокси-4(трифторметил)бензолу (приклад 17А). Після віддистилювання розчинника продукт очищують хроматографом на силікагелі (ізогексан/дихлорметан 2:1) та викристалізовують із ізогексану. Вихід: 2,69г (62% від теор.) РХВТ (метод 1):У ч=5,6хв. МС (ESI-поз.): m/z=395 (М+Н)+ Загальна робоча методика TGI: взаємодія імінскфосфорану та ізоціанату та подальша взаємодія із аміном до одержання похідної дигідрохіназоліну 1,0 еквівалент імінофосфорану розчиняють в 20мл дихлорметану (0,1 - 0,2Μ розчин). Після цього додають 1,05 еквіваленту заміщеного ізоціанату та до завершення реакції перемішують при кімнатній температурі. Контроль реакції здійснюють згідно з ТХ або аналітичною РХВТ. У одержаний таким чином розчин карбодііміду у дихлорметані додають 1,0 еквівалент аміну, а також незначну кількість силікагелю та при кімнатній температурі перемішують до повної взаємодії. Після завершення реакції (контроль реакції згідно з ТХ або РХВТ) продукт згущують та очищують препаративною РХВТ на ОФ-фазі. Згідно з ЯМР реакційний продукт має певну кількість нециклізованих речовин. У цих випадках суміш із циклізованого та нециклізованого продукту поміщають у діоксан, додають незначну кількість силікагелю та 30хв. - 16 год. перемішають при кип'ятінні зі зворотнім холодильником. Силікагель відфільтровують, а розчин застосовують у подальших реакціях. Якщо суміш містить енантіомерні сполуки, то на цій стадії здійснюють її хроматографічне розділення. Приклад 19А Метиловий естер {8-фтор-2-[4-(4-фтор феніл)1-піперазиніл]-3-[3-(трифторметил)-феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти Виходячи із 92,5мг (0,2ммоль) імінофосфорану із прикладу 10А згідно із загальною робочою ме Цю сполуку (715мг, 14% від теор.) як енантіомер А одержують внаслідок виділення енантіомеру із 3,84г сполуки із прикладу 19А. РХВТ (метод 1): У ч=4,81хв. МС (ESI-поз.): m/z=544,9 (М+Н)+ Приклад 21А Метиловий естер {6-фтор-2-[4-(4-фтор феніл)1-піперазиніл]-3-[3-(трифторметил)-феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти Виходячи із 100мг (0,28ммоль) імінофосфорану із прикладу 11А згідно із загальною робочою методикою [G] одержують 58мг (39% від теор.) продукту. РХВТ (метод 1): У ч=4,80хв. Метиловий естер {6-фтор-2-[4-(4-фтор феніл)1-піперазиніл]-3-[3-(трифторметил)-феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти Цю сполуку (368мг, 17% від теор.) як енантіомер А одержують внаслідок виділення енантіомеру із 832мг сполуки із прикладу 21А. РХВТ (метод 1): У ч=4,77хв. МС (ESI-поз.): m/z=544,9 (М+Н)+ Приклад 23А Метиловий естер {8-фтор-2-[4-(3-метилфеніл)1-піперазиніл]-3-[3-(трифторметил)-феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти 27 82519 Виходячи із 93мг (0,2ммоль) імінофосфорану із прикладу 10А згідно із загальною робочою методикою [G] одержують 43мг (39% від теор.) продукту. РХВТ (метод 1): У ч=4,80хв. МС (ESI-поз.): m/z=541,0 (М+Н)+ Приклад 24А Метиловий естер {8-фтор-2-[4-(3-метилфеніл)1-піперазиніл]-3-[3-(трифторметил)-феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти Цю сполуку (1,18г, 22% від теор.) як енантіомер А одержують внаслідок виділення енантіомеру із 3,31г сполуки із прикладу 23А. РХВТ (метод 1): У ч=4,80хв. МС (ESI-поз.): m/z=541,0 (М+Н)+ Приклад 25А Метиловий естер {8-фтор-2-[4-(3метоксифеніл)-1-піперазиніл]-3-[3(трифторметил)феніл]-3,4-дигідро4хіназолініл}оцтової кислоти Виходячи із 93мг (0,2ммоль) імінофосфорану із прикладу 10А згідно із загальною робочою методикою [G] одержують 51мг (45% від теор.) продукту. РХВТ (метод 1): У ч=4,62хв. МС (ESI-поз.): m/z=556,7 (М+Н)+ Приклад 26А Метиловий естер {8-фтор-2-[4-(3метоксифеніл)-1-піперазиніл]-3-[3(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти 28 Цю сполуку (0,49г, 9% від теор.) як енантіомер А одержують внаслідок виділення енантіомеру із 5,11г сполуки із прикладу 25А. РХВТ (метод 1): У ч=4,71хв. МС (ESI-поз.): m/z=556,8 (М+Н)+ Приклад 27 А Метиловий естер {8-фтор-2-[4-(4-фтор-3метилфеніл)-1-піперазиніл]-3-[6-метокси-3(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти Виходячи із 1,0г (2,2ммоль) імінофосфорану із прикладу 10А, 500мг (2,31ммоль) 2-ізо-ціанато-1метокси-4-(трифторметил)бензолу (приклад 17А) та 427мг (2,2ммоль) фенілпіперазину із прикладу 13А після фільтрування через силікагель (циклогексан/етилацетат 2:1 (об./об.)) одержують 1,03г (79% від теор.) сировини. Її без подальшого очищення застосовують у подальших реакціях. РХ-МС (метод 3): У ч=2,55хв., 2,66 хв. МС (ESI-поз.): m/z=589,3 (М+Н)+ Приклад 28А Метиловий естер {8-фтор-2-[4-(4-фтор-3метилфеніл)-1-піперазиніл]-3-[6-метокси-3-метилфеніл]-3,4-дигідро-4-хіназолініл}оцтової кислоти Виходячи із 0,60г (1,76ммоль) імінофосфорану із прикладу 10А, 376мг (2,31ммоль) 2-метокси-5метилфенілізоціанату та 342мг (1,76ммоль) фенілпіперазину із прикладу 13А після очищення препаративною РХВТ (метод 5) одержують 183мг (16% від теор.) продукту. РХВТ (метод 1): У ч=4,77хв. МС (ESI-поз.): m/z=535,2 (М+Н)+ Приклад 29А Метиловий естер {8-фтор-2-[4-(4-фтор феніл)1-піперазиніл]-3-[6-метокси-3-хлорфеніл]-3,4дигідро-4-хіназолініл}оцтової кислоти Виходячи із 1,0г (2,2ммоль) імінофосфорану із прикладу 10А, 423мг (2,31ммоль) 2-метокси-5 29 82519 хлорфенілізоціанату та 396мг (2,2ммоль) 4фтор фенілпіперазину після очищення препаративною РХВТ (метод 5) одержують 621мг (52% від теор.) продукту. РХВТ (метод 1): У ч=4,75хв. МС (ESI-поз.): m/z=541,2 (М+Н)+ Приклад 30А Метиловий естер {8-фтор-2-[4-(4-фтор феніл)1-піперазиніл]-3-[2-метокси-5-(трифторметил)феніл]-3,4-дигідро-4-хіназолінілоцтової кислоти В 15мл дихлорметану додають 550мг (1,39ммоль) метилового естеру (2Е)-3-{3-фтор-2[({[2-метокси-5(трифторметил)феніл]іміно}метилен)аміно]феніл}2-пропенової кислоти (приклад 18А) та 251мг (1,39ммоль) 1-(4-фторфеніл)піперазину та в присутності незначної кількості силікагелю перемішують протягом 1 години. Через 90 годин перемішування при кип'ятінні зі зворотнім холодильником продукт очищують хроматографом на силікагелі (дихлорметан, дихлорметан/етилацетат 10:1). Вихід: 769мг (96% від теор.) РХВТ (метод 1):У ч=4,8хв. МС (ESI-поз.): m/z=575 (М+Н)+ Приклад 31А Метиловий естер {8-фтор-2-[4-(3метоксифеніл)-1-піперазиніл]-3-[2-метокси-5(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти В 20мл дихлорметану додають 700мг (1,78ммоль) метилового естеру (2Е)-3-{3-фтор-2[({[2-метокси-5(трифторметил)феніл]іміно}метилен)аміно]феніл}2-пропенової кислоти (приклад 18А), 341мг (1,78ммоль) 1-(3-метоксифеніл)піперазину та незначну кількість силікагелю та протягом однієї години перемішують при кімнатній температурі, а після цього протягом 35 годин при кип'ятінні зі зворотнім холодильником. Після очищення на силікагелі (дихлорметан, дихлорметан/етилацетат 10:1) одержують цільову сполуку. Вихід: 1012мг (97% від теор.) РХВТ (метод 6): У ч=4,8хв. МС (ESI-поз.): m/z=587 (М+Н)+ Приклад 32А 30 Метиловий естер {8-фтор-2-[4-(3,4дифторфеніл)-1-піперазиніл]-3-[2-метокси-5(трифторметил)феніл-3,4-дигідро-4хіназолініл}оцтової кислоти В 20мл дихлорметану додають 700мг (1,78ммоль) метилового естеру (2Е)-3-{3-фтор-2[({[2-метокси-5(трифторметил)феніл]іміно}метилен)аміно]феніл}2-пропенової кислоти (приклад 18А), 352мг (1,78ммоль) 1-(3,4-дифторфеніл)піперазин (приклад 16А) та незначну кількість силікагелю та протягом 1 години перемішують при кімнатній температурі та протягом 20 годин при кип'ятіння зі зворотнім холодильником. Після цього цільову сполуку очищують хроматографом на силікагелі (дихлорметан, дихлорметан / етилацетат 10:1). Вихід: 1027мг (97% від теор.) РХВТ (метод 1): У ч=4,8хв. МС (ESI-поз.): m/z=593 (М+Н)+ Приклад 33А Метиловий естер {8-фтор-2-[4-(3-метилфеніл)1-піперазиніл]-3-[2-метокси-5(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти В 300мл дихлорметану додають 11,5г (29,16ммоль) метилового естеру (2Е)-3-{3-фтор-2[({[2-метокси-5(трифторметил)феніл]іміно}метилен)аміно]феніл}2-пропенової кислоти (приклад 18А), 5,14г (29,16ммоль) 1-(3-метилфеніл)піперазину та незначну кількість силікагелю та протягом 1 години перемішують при кімнатній температурі, а протягом наступних 20 годин при кип'ятінні зі зворотнім холодильником. Після очищення хроматографом на силікагелі (дихлорметан, дихлорметан/етилацетат 10:1,5:1) одержують продукт. Вихід: 15,8г (95% від теор.) РХВТ (метод 1):У ч=4,8хв. МС (ESI-поз.): m/z=571 (М+Н)+ Приклад 34А Метиловий естер {8-фтор-2-[4-(3-фтор феніл)1-піперазиніл]-3-[2-метокси-5(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти 31 82519 32 Приклад 37А Метиловий естер 4-аміно-3-[(1Е)-3-третбутокси-3-оксопроп-1-ен-1-іл]бензойної кислоти В 15мл дихлорметану додають 100мг (0,25ммоль) метилового естеру (2Е)-3-{3-фтор-2[({[2-метокси-5(трифторметил)феніл]іміно}метилен)аміно]феніл}2-пропенової кислоти (приклад 18А), 45,7мг (0,25ммоль) 1-(3-фторфеніл)піперазину (приклад 15А) та незначну кількість силікагелю та протягом однієї години перемішують при кімнатній температурі, а протягом наступних 20 годин при кип'ятінні зі зворотнім холодильником. Після очищення хроматографом на силікагелі (дихлорметан, дихлорметан/етилацетат 10:1) цільову сполук у. Вихід: 139,2мг (96% від теор.) РХВТ (метод 1): У ч=4,8хв. МС (ESI-поз.): m/z=575 (М)+ Приклад 3SA Метиловий естер {8-фтор-2-[4-(3-хлорфеніл)1-піперазиніл]-3-[3-(трифторметил))-феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти Виходячи із 93мг (0,2ммоль) імінофосфорану із прикладу 10А згідно із загальною робочою методикою [G] одержують 51мг (45% від теор.) продукту. РХ-МС (метод 3): У ч=4,78хв. МС (ESI-поз.): m/z=561 (М+Н)+ Приклад 36 А Метиловий естер {8-фтор-2-[4-(1,3бензодіоксол-5-іл)-1-піперазиніл]-3-[3(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти Виходячи із 4,19г (9,2ммоль) імінофосфорану із прикладу 10А згідно із загальною робочою методикою [G] одержують 3,67г (70% від теор.) продукту. РХВТ (метод 1): У ч=4,67хв. МС (ESI-поз.): m/z=571 (М+Н)+ Виходячи із 25,0г (90,2ммоль) метилового естеру 4-аміно-3-йодбензойної кислоти згідно із загальною робочою методикою [А] одержують 24,3г (88% від теор.) продукту. РХВТ (метод 1): У ч=4,71хв. МС (П ХІ-поз.): m/z=295 (M+NH 4)+ Приклад 38А Метиловий естер (2Е)-3-(4-ціано-2нітрофеніл)-2-пропенової кислоти Виходячи із 3,00г (17,0ммоль) 4-ціано-2нітробензальдегіда згідно із загальною робочою методикою [В] та перекристалізації із метанолу одержують 2,51г (63% від теор.) продукту. РХВТ (метод 1): У ч=4,06хв. МС (ESI-поз.): m/z=233 (М+Н)+ Приклад 39А Метиловий естер 3-[2-аміно-7ціанофеніл]пропенової кислоти Виходячи із 1,0г (4,31ммоль) нітросполуки із прикладу 38А згідно із загальною робочою методикою [D] (але без кип'ятіння в присутності активованого вугілля) одержують 793мг (89% від теор.) продукту. РХВТ (метод 1): У ч=3,99хв. Приклад 40 А Метиловий естер (2Е)-3-{6-ціано-2[(трифенілфосфораніліден)аміно]феніл}пропенової кислоти Виходячи із 0,75г (3,71ммоль) аміносполуки із прикладу 39А згідно із загальною робочою методикою [Е] одержують 1,09г (62% від теор.) продукту. РХВТ (метод 1): У ч=4,30хв. МС (ESI-поз.): m/z=463 (М+Н)+ Приклад 41А Метиловий естер 3-[(1Е)-3-трет-бутокси-3оксопроп-1-ен-1-іл]-4 33 82519 34 [(трифенілфосфораніліден)аміно]бензойної кислоти Виходячи із 19,0г (68,5ммоль) аміносполуки із прикладу 37А згідно із загальною робочою методикою [Е] одержують 31,4г (85% від теор.) продукту. РХВТ (метод 1): У ч=4,69хв. МС (ESI-поз.): m/z=538 (М+Н)+ Приклад 42А Метиловий естер {8-фтор-2-[4-(4-фтор феніл)1-піперазиніл]-3-[2-метокси-5(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти Сполуку одержують як енантіомер А шляхом хроматографічного розділення рацемату із прикладу 30А згідно з методом 15 на енантіомери. Виходячи із 231г рацемату одержують 120г цільового продукту, який безпосередньо застосовують у подальших реакціях. МС (ESI-поз.): m/z=575 (М+Н)+ Приклад 43А Метиловий естер {8-фтор-2-[4-(3метоксифеніл)-1-піперазиніл]-3-[2-метокси-5(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти Сполуку одержують як енантіомер А шляхом хроматографічного розділення рацемату із прикладу 31А згідно з методом 15 на енантіомери. Виходячи із 231г рацемату одержують 111г (48% від теор.) цільового продукту. МС (ESI-поз.): m/z=587 (М+Н)+ Приклад 44А Метиловий естер {6-ціано-2-[4-(4-фторфеніл)1-піперазиніл]-3-[3-(трифторметил)-феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти Виходячи із 400мг (0,6ммоль) імінофосфорану із прикладу 12А згідно із загальною робочою методикою [G] одержують 166мг (48% від теор.) продукту. РХВТ (метод 1): У ч=4,65хв. МС (ESI-поз.): m/z=552 (М+Н)+ Приклад 45А Метиловий естер {7-ціано-2-[4-(4-фторфеніл)1-піперазиніл]-3-[3-(трифторметил)-феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти Виходячи із 1,0г (2,16ммоль) імінофосфорану із прикладу 40А згідно із загальною робочою методикою [G] одержують 1,07г (98% від теор.) продукту. РХВТ (метод 1): У ч=4,72хв. МС (ESI-поз.): m/z=552 (М+Н)+ Приклад 46А Метиловий естер 4-(2-трет-бутокси-2оксоетил)-2-[4-(4-фторфеніл)піперазин-1-іл]-3-[3(трифторметил)феніл]-3,4-дигідрохіназолін-6карбонової кислоти Виходячи із 4,2г (9,3ммоль) імінофосфорану із прикладу 41А згідно із загальною робочою методикою [G] одержують 3,9г (51% від теор.) продукту. РХВТ (метод 1):У ч=5,03хв. МС (ESI-поз.): m/z=627 (М+Н)+ Приклад 47А Метиловий естер {8-фтор-2-[4-(4-фтор феніл)1-піперазиніл]-3-[3-(трифторметил)-феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти 35 82519 Ці сполуки (1,4мг, 20% від теор.) одержують як енантіомер А згідно зі способом виділення енантіомеру із 3,5г сполуки із прикладу 46А. РХВТ (метод 1): У ч=4,91хв. МС (ESI-поз.): m/z=627 (М+Н)+ Приклад 48А 4-(2-трет-бутокси-2-оксоетил)-2-[4-(4фтор феніл)піперазин-1-іл]-3-[3(трифторметил)феніл]-3,4-дигідрохіназолін -6карбонова кислота 1,3г (2,0ммоль) метилового естеру карбонової кислоти із прикладу 47А розчиняють в 12мл діоксану, додають 2,4мл 1 N водного розчину гідроксиду калію та перемішують протягом 5 годин при 60°С. 1N водним розчином соляної кислоти встановлюють значення рН=4, реакційну суміш згущують та очищують препаративною РХВТ. Одержують 580мг (48% від теор.) продукту. РХВТ (метод 1): У ч=4,85хв. МС (ESI-поз.): m/z=613 (М+Н)+ Приклад 49А Трет-бутиловий естер {6-(амінокарбоніл)-2-[4(4-фторфеніл)піперазин-1-іл]-3-[3(трифторметил)феніл]-3,4-дигідрохіназолін -4іл}оцтової кислоти 560мг (0,9ммоль) карбонової кислоти із прикладу 48А, 2,6ммоль хлориду алюмінію, 1,1ммоль1-гідрокси-1Н-бензотриазолгідрату та 1,1ммоль N-(3-диметиламінопропіл)-Nетилкарбодііміду суспендують в ДМФ. Додають 2,6ммоль Ν,Ν-діізопропіламіну та протягом 16 го 36 дин перемішують при кімнатній температурі. У реакційну суміш додають 20мл етилацетату та промивають насиченим водним розчином гідрокарбонату натрію та насиченим водним розчином хлориду натрію. У об'єднаних водних фазах встановлюють значення рН=8 та екстрагують етилацетатом. Після цього об'єднані органічні фази промивають насиченим водним розчином хлориду натрію, сушать над сульфатом натрію та згущують. Одержують 548мг (97% від теор.) продукту. РХВТ (метод 1): У ч=4,73хв. МС (ESI-поз.): m/z=612 (М+Н)+ Сполуки із прикладів 50А - 112А, вказані в таблиці 1, можуть бути одержані згідно із загальними робочими методиками [А] - [G] із відповідних вихідних сполук. 37 82519 38 39 82519 40 41 82519 42 оберненій фазі (метод 2 або метод 5) або на силікагелі сумішшю циклогексан/етилацетат. Приклад 1 {8-фтор-2-[4-(4-фторфеніл)-1-піперазиніл]-3-[3(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтова кислота Виходячи із 37мг (0,07ммоль) метилового естеру із прикладу 19А згідно із загальною робочою методикою [Н] одержують 29мг (80% від теор.) продукту. РХВТ (метод 1): У ч=4,49хв. МС (ESI-поз.): m/z=530,7 (М+Н)+ 1 Н-ЯМР (400МГц, CD3CN): δ [м.ч.]=7,59 (с, 1Н); 7,45 (т, 1Η); 7,37 (т, 2Η); 7,02-6,95 (м, 3Н); 6,936,85 (м, 4Н); 5,24 (дд, 1Н); 2,98 (дш, 4Н); 2,91 (дш, 4Н); 2,73 (дд, 1Н); 2,54 (дд, 1Н). Приклад 2 {8-фтор-2-[4-(4-фторфеніл)-1-піперазиніл]-3-[3(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти Приклади виконання Загальна робоча методика ΓΗΊ: омилення естеру хіназолілоцтової кислоти 1,0 еквівалент естеру хіназолілоцтової кислоти розчиняють в діоксані та додають 5,0 еквівалент 1N розчину їдкого натру. Суміш перемішують протягом 16 годин при 80°С та після завершення реакції (контроль реакції за допомогою аналітичної РХВТ) суміш згущують. Після цього залишок поміщають у воду та 1N розчином соляної кислоти встановлюють значення рН=5. Осад, що утворився, відфільтровують, промивають незначною кількістю води та діетилового етеру та сушать у високому вакуумі при кімнатній температурі. В разі необхідності, осад можна фільтрувати картриджем Extrelut, промивають етилацетатом, а фільтрат згущують. Якщо чистота продукту є не досить високою, його очищують препаративною РХВТ на Виходячи із 695мг (1,27ммоль) метилового естеру із прикладу 20А згідно із загальною робочою методикою [Н] одержують 488мг (64% від теор.) продукту. РХВТ (метод 1): У ч=4,59хв. МС (ESI-поз.): m/z=530,8 (М+Н)+ 1 Н-ЯМР (400МГц, CD3CN): δ [м.ч.]=7,60 (с, 1Н); 7,47-7,40 (м, 3Н); 7,03-6,86 (м, 7Н); 5,26-5,23 (м, 1Н); 3,60-3,52 (м, 4Н); 2,99-2,90 (м, 4Н); 2,75 (дд, 1Н); 2,56 (дд, 1Н). Приклад 3 {8-фтор-2-[4-(3-метилфеніл)-1-піперазиніл]-3[3-(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтова кислота Виходячи із 34мг (0,06ммоль) метилового естеру із прикладу 23А згідно із загальною робочою методикою [Н] одержують 30мг (90% від теор.) продукту. 43 82519 РХВТ (метод 1): У ч=4,56хв. МС (ESI-поз.): m/z=526,9 (М+Н)+ 1 Н-ЯМР (200МГц, ДMCO-d6): δ [м.ч.]=7,64 (с, 1Н); 7,53 (т, 1Н); 7,44-7,34 (м, 2Н); 7,11-6,90 (м, 3Н); 6,72-6,59 (м, 4Н); 5,33-5,25 (м, 1Н); 3,52 (дш, 4Н); 3,02 (дш, 4Н); 2,69-2,55 (м, 2Н, частково під ДМСО-сигналом); 2,23 (с, 3Н). Приклад 4 {8-фтор-2-[4-(3-метоксифеніл)-1-піперазиніл]3-[3-(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтова кислота Виходячи із 36мг (0,07ммоль) метилового естеру із прикладу 25А згідно із загальною робочою методикою [Н] та після хроматографії (метод 2) одержують 28мг (77% від теор.) продукту. РХВТ (метод 1): У ч=4,46хв. МС (ESI-поз.): m/z=542,9 (М+Н)+ 1 Н-ЯМР (200МГц, ДМСО-d6): δ [м.ч.]=7,67 (с, 1Н); 7,54 (т, 1Н); 7,45-7,38 (м, 2Н); 7,14-6,94 (м, 3Н); 6,51-6,35 (м, 4Н); 5,35-5,25 (м, 1 Н); 3,69 (с, 3Н); 3,50 (дш, 4Н); 3,06 (дш, 4Н); 2,58-2,52 (м, 2Н). Приклад 5 {8-фтор-2-[4-(3-хлорфеніл)-1-піперазиніл]-3-[3(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтова кислота Виходячи із 38мг (0,07ммоль) метиловий естер із прикладу 35А згідно із загальною робочою методикою [Н] одержують 25мг (66% від теор.) продукту. РХВТ (метод 1): У ч=4,64хв. МС (ESI-поз.): m/z=546,9 (М+Н)+ 1 Н-ЯМР (200МГц, ДMCO-d6): δ [м.ч.]=7,66 (с, 1Н); 7,52 (т, 1Н); 7,38 (дд, 2Н); 7,20 (т, 1Н); 7,106,78 (м, 6Н); 5,33-5,26 (м,1Н); 3,51 (дш,4Н); 3,11 (дш, 4Н); 2,61-2,55 (м, 2Н). Приклад 6 {8-фтор-2-[4-(1,3-бензодіоксол-5-іл)-1піперазиніл]-3-[3-(трифторметил)феніл]-3,4дигідро-4-хіназолініл}оцтова кислота 44 Виходячи із 173мг (0,30ммоль) метилового естеру із прикладу 36А згідно із загальною робочою методикою [Н] одержують 79мг (46% від теор.) продукту. РХВТ (метод 1): У ч=4,44хв. МС (ESI-поз.): m/z=557,2 (М+Н)+ 1 Н-ЯМР (300МГц, CDCI3): δ [м.ч.]=7,47 (с, 1Н); 7,42-7,34 (м, 3Н); 7,03-6,89 (м, 2Н); 6,79 (д, 1Н); 6,64 (д, 1Н); 6,41 (д, 1Н); 6,22 (дд, 1Н); 5,87 (с, 2Н); 5,20-5,15 (м, 1Н); 3,59 (с,, 3Н); 2,94-2,85 (м, 5Н); 2,59 (дд, 1Н). Приклад 7 {6-фтор-2-[4-(4-фторфеніл)-1-піперазиніл]-3-[3(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтова кислота Виходячи із 42мг (0,08ммоль) метилового естеру із прикладу 21А згідно із загальною робочою методикою [Н] одержують 34мг (76% від теор.) продукту. РХВТ (метод 1): У ч=4,63хв. МС (ESI-поз.): m/z=530,9 (М+Н)+ Приклад 8 Гідрохлорид {6-фтор-2-[4-(4-фторфеніл)-1піперазиніл]-3-[3-(трифторметил)феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти Виходячи із 350мг (0,64ммоль) естеру із прикладу 22А згідно із загальною робочою методикою [Н] одержують 284мг (83% від теор.) продукту. РХВТ (метод 1): У ч=4,53хв. МС (ESI-поз.): m/z=530,8 (М+Н-НСІ)+ 1 Н-ЯМР (400МГц, CD3CN): δ [м.ч.]=7,62 (с, 1Н); 7,51-7,48 (м, 1Н); 7,43-7,41 (д, 1Н); 7,26-7,23 (м, 1Н); 7,04-6,95 (м, 2Н); 6,91-6,85 (м, 3Н); 5,23 (дд, 1Н); 3,55 (сь,, 3Н); 3,02-2,9 (м, 1Н); 2,94 (сШ) 4Н); 2,80 (дд, 1Н). Приклад 9 Гідрохлорид {8-фтор-2-[4-(3-метилфеніл)-1піперазиніл]-3-[3-(трифторметил)феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти 45 82519 Виходячи із 1,10г (1,93ммоль) естеру із прикладу 24А згідно із загальною робочою методикою [Н] одержують 1,04г (91% від теор.) продукту. Виділення енантіомерів за методом 4 одержують продукт як енантіомер А. РХВТ (метод 1): У ч=4,68хв. МС (ESI-поз.): m/z=526,9 (М+Н-НСІ)+ 1 Н-ЯМР (400МГц, CD3CN): δ [м.ч.]=7,61 (с, 1Н); 7,49-7,38 (м, 3Н); 7,10-6,89 (м, 4Н); 6,71-6,65 (м, 3Н); 5,26 (дд, 1Н); 3,60-3,52 (м, 4Н); 3,03-2,95 (м, 4Н); 2,76 (дд, 1Н); 2,57 (дд, 1Н); 2,25 (с, 3Н). Приклад 10 Гідрохлорид [8-фтор-2-[4-(3-метоксифеніл)-1піперазиніл]-3-[3-(трифторметил)-феніл]-3,4дигідро-4-хіназолініл}оцтової кислоти Виходячи із 437мг (0,79ммоль) естеру із прикладу 26А згідно із загальною робочою методикою [Н] одержують 344мг (72% від теор.) продукту. РХВТ (метод 1): У ч=4,48хв. МС (ESI-поз.): m/z=543,0 (М+Н-НСІ)+ 1 Н-ЯМР (400МГц, CD3CN): δ [м.ч.]=7,61 (с, 1Н); 7,49-7,38 (м, 3Н); 7,14-6,89 (м, 4Н); 6,47-6,39 (м, 3Н); 5,26 (дд, 1Н); 3,72 (с, 1Н); 3,60-3,54 (м, 4Н); 3,07-3,00 (м, 4Н); 2,77 (дд, 1Н); 2,57(дд, 1Н). Приклад 11 Гідрохлорид {8-фтор-2-[4-(4-фтор-3метилфеніл)-1-піперазиніл]-3-[6-метокси-3(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти Виходячи із 1,03г (1,75ммоль) сировини естеру із прикладу 27А згідно із загальною робочою методикою [Н] та після хроматографії за методом 5, а також розчинення продукту у суміші метанол/1N розчин соляної кислоти та подальшого випаровування розчинника одержують 283мг (22% від теор.) гідрохлориду. РХВТ (метод 1): У ч=4,58хв. МС (ESI-поз.): m/z=575,2 (М+Н-НСІ)+ 1 Н-ЯМР (400МГц, CD3CN): δ [м.ч.]=8,17 (с, 0,66Н); 7,69 (д, 1Н); 7,55-7,30 (м, 1Н); 7,27-7,24 (м,2Н); 7,16 (д, 0,6Н); 7,09-7,04 (м, 2Н); 5,33-5,27, 5,12-5,06 (2 х м, 1Н); 4,08-3,35 (м, 4Н); 3,69 (с, 3Н); 3,30-3,22 (м, 1Н); 2,80-2,76 (м, 1Н); 2,25 (с, 3Н). Приклад 12 Гідрохлорид {8-фтор-2-[4-(4-фтор-3метилфеніл)-1-піперазиніл]-3-[6-метокси-3 46 (трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти Перед виділенням енантіомеру 268мг гідрохлориду із прикладу 11 поміщають у дихлорметан, а органічну фазу двічі екстрагують насиченим розчином гідрокарбонату натрію. Об'єднані водні фази екстрагують дихлорметаном, об'єднані органічні фази сушать над сульфатом натрію, фільтрують, а розчинник відганяють у вакуумі. Одержують 204мг (86% від теор.) вільної основи. Після виділення енантіомеру (метод 4) та очищення препаративною РХВТ (метод 5), а також подальшого розчинення продукту в суміші метанол/1N розчин соляної кислоти та випаровування розчинника одержують 80мг (78% від теор.) енантіомеру А. РХВТ (метод 6): У ч=4,66хв. МС (ESI-поз.): m/z=575,2 (М+Н-НСІ)+ 1 Н-ЯМР (400МГц, CD3CN): δ [м.ч.]=8,17 (с, 0,66Н); 7,69 (д, 1Н); 7,45-7,30 (м,1Н); 7,24 (д, 2Н); 7,15 (д, 0,7Н); 7,08-7,01 (м, 2Н); 5,32-5,27, 5,115,07 (2 х м, 1Н); 4,06-3,50 (м, 4Н); 3,68 (с, 3Н); 3,333,24 (м, 1Н); 2,77-2,72 (м, 1Н); 2,24, 2,23 (2 х с, 3Н). Приклад 13 Гідрохлорид {8-фтор-2-[4-(4-фтор-3метилфеніл)-1-піперазиніл]-3-[6-метокси-3метилфеніл]-3,4-дигідро-4-хіназолініл}оцтової кислоти Виходячи із 183мг (0,34ммоль) сировини естеру із прикладу 28А згідно із загальною робочою методикою [Н] та після хроматографії за методом 5, а також подальшого розчинення продукту у суміші метанол/1N розчин соляної кислоти та випаровування розчинника одержують 135мг (67% від теор.) гідрохлориду. РХВТ (метод 1): У ч=4,67хв. MC(ESI-no3.): m/z=521,2 ( М+Н-НСІ)+ 1 Н-ЯМР (400МГц, CD3CN): δ [м.ч.]=7,69-7,42 (м, 4Н); 7,25-7,06 (м, 5Н); 6,93-6,78 (м, 1Н); 5,245,21, 5,06-5,03 (2 х м, 1Н); 4,00-3,35 (м, 8Н); 3,213,08 (м, 1Н); 3,01-2,77 (м, 1Н); 2,34, 2,20 (2 х с, 3Н); 2,26 (с, 3Н). Приклад 14 {8-фтор-2-[4-(3-метоксифеніл)-1-піперазиніл]3-[2-метокси-5-(трифторметил)-феніл]-3,4-дигідро4-хіназолініл}оцтова кислота 47 82519 В 40мл діоксану при кімнатній температурі додають 878мг (1,5ммоль) метилового естеру {8фтор-2-[4-(3-метоксифеніл)-1-піперазиніл]-3-[2метокси-5-(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти (приклад 31А) та 179,6мг (4,49ммоль) гідро хлориду натрію та протягом 2 годин перемішують при 50°С. Після цього встановлюють значення рН=4 - 5. Продукт відфільтровують, промивають водою та сушать у вакуумі. Вихід: 801мг (93% від теор.) РХВТ (метод 1):У ч=4,5хв. МС (ESI-поз.): m/z=573 (M+H)+ Приклад 15 {8-фтор-2-[4-(3-метоксифеніл)-1-піперазиніл]3-[2-метокси-5-(трифторметил)-феніл]-3,4-дигідро4-хіназолініл}оцтова кислота Після енантіомерного виділення (метод 11) 500мг рацемату (приклад 14) сировину очищують хроматографом на силікагелі, після цього розчиняють в 1N розчині їдкого натру та екстрагують діетиловим етером. Після підкислення 1N розчином соляної кислоти продукт відфільтровують та сушать у вакуумі. Вихід: 105мг (21% від теор.) МС (ESI-поз.): m/z =573 (М+Н)+ 1 Н-ЯМР (300МГц, ДМСО-d 6): δ [м.ч.]=2,4-2,5 (м, 1Н); 2,7-3,1 (м, 5Н); 3,3-3,6 (м, 4Н); 3,7 (с, 3Н); 3,73,9 (сш, 3Н); 4,8-5,05 (сш, 1Н); 6,3-6,4 (м, 2Н); 6,46,5 (м, 1Н); 6,8-7,65 (м, 6Н); 12,5 (сш, 1Н). В разі необхідності, цільовий продукт одержують шляхом перетворення естеру, що не містить енантіомери, із прикладу 43А згідно із загальною робочою методикою [Н]. Виходячи із 111г (0,19моль) естеру одержують 69г (63% від теор.) цільового продукту. Приклад 16 {8-фтор-2-[4-(3,4-дифторфеніл)-1-піперазиніл]3-[2-метокси-5-(трифторметил)-феніл]-3,4-дигідро4-хіназолініл}оцтова кислота 48 В 40мл діоксану поміщають 881мг (1,49ммоль) метилового естеру {8-фтор-2-[4-(3,4дифторфеніл)-1-піперазиніл]-3-[2-метокси-5(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтової кислоти (приклад 32А) та 178мг (4,46ммоль) гідрохлориду натрію та протягом 2 годин перемішують при 50°С. Після підкислення 1N розчином соляної кислоти продукт відсмоктують, промивають водою та сушать у вакуумі. Вихід: 775мг (90% від теор.) РХВТ (метод 1): У ч=4,5хв. МС (ESI-поз.): m/z=579 (М+Н)+ Приклад 17 {8-фтор-2-[4-(3,4-дифторфеніл)-1-піперазиніл]3-[2-метокси-5-(трифторметил)-феніл]-3,4-дигідро4-хіназолініл}оцтова кислота Після енантіомерного виділення (метод 12) 500мг (0,86ммоль) рацемату (приклад 16) сировину очищують хроматографом на силікагелі (дихлорметан, дихлорметан/метанол 20:1, 10:1), після цього розчиняють в 1N розчині їдкого натру та екстрагують діетиловим етером. Після підкислення 1N розчином соляної кислоти продукт відфільтровують та сушать у вакуумі. У водній фазі за допомогою 1N розчину соляної кислоти встановлюють значення рН=4 - 5, продукт відфільтровують, промивають водою та суша ть у вакуумі. Вихід: 86мг (17% від теор.) МС (ESI-поз.): m/z=579 (М+Н)+ 1 Н-ЯМР (300МГц, ДМСО-d 6): δ [м.ч.]=2,6-3,1 (м, 6Н); 3,25-3,6 (м, 4Н); 3,75 (сш, 3Н); 4,85 (сш, 1Н); 6,6-6,7 (м, 1Н); 6,7-7,7 (м, 9Н); 12,5 (сш, 1Н). Приклад 18 {8-фтор-2-[4-(4-фторфеніл)-1-піперазиніл]-3-[2метокси-5-(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтова кислота В 800мл діоксану поміщають 15г (26,11ммоль) метилового естеру {8-фтор-2-[4-(4-фтор феніл)-1піперазиніл)-3-[2-метокси-5-(трифторметил)феніл]3,4-дигідро-4-хіназолініл} оцтової кислоти (приклад 30А) та 3,13г (78,32ммоль) гідроксиду натрію та протягом 4 годин перемішують при 50°С. Після віддистилювання розчинника залишок розчиняють в 500мл води, підкислюють, а осад відсмоктують. Продукт промивають водою та сушать у вакуумі. Вихід: 14,5г (99% від теор.) РХВТ (метод 1):У ч=4,5хв. МС (ESI-поз.): m/z=561 (М+Н)+ 49 82519 50 Приклад 19 {8-фтор-2-[4-(4-фторфеніл)-1-піперазиніл]-3-[2метокси-5-(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтова кислота Виділяють 14,2г (25,33ммоль) рацемату (приклад 18) (метод 13). Сировину розчиняють в 250мл 0,5N розчину гідроксиду натрію та при екстрагуванні очищують діетиловим етером. Після підкислення водної фази соляною кислотою продукт відфільтровують, промивають водою та сушать у вакуумі. Вихід: 5,85г (41% від теор.) МС (ESI-поз.): m/z=561 (М+Н)+ РХВТ (метод 1): У ч=4,5хв. 1 Н-ЯМР (400МГц, ДМСО-d 6): δ [м.ч.]=2,6-3,0 (м, 6Н); 3,3-3,6 (м, 4Н); 3,6-4,0 (сш, 3Н); 4,8-5,2 (сш, 1Н); 6,7-7,75 (м, 10Н); 12,2-12,8 (сш, 1Н). В разі необхідності, цільовий продукт одержують шляхом перетворення естеру, що не містить енантіомери, із прикладу 42А згідно із загальною робочою методикою [Н]. Виходячи із 120г (0,21моль) естеру одержують 96г (81% від теор.) цільового продукту. Приклад 20 {8-фтор-2-[4-(3-метилфеніл)-1-піперазиніл]-3[2-метокси-5-(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтова кислота В 40мл діоксану поміщають 892мг (1,56ммоль) метилового естеру {8-фтор-2-[4-(3-метилфеніл)-1піперазиніл]-3-[2-метокси-5-(трифторметил)феніл]3,4-дигідро-4-хіназолініл}оцтової кислоти (приклад 33А) та 187,6мг (4,69ммоль) гідроксиду натрію та протягом 2 годин перемішують при 50°С. Після видалення розчинника залишок поміщають у воду та 1N розчином соляної кислоти встановлюють значення рН=4 - 5. Після від фільтрування продукт промивають водою та сушать у вакуумі. Вихід:788мг (91% від теор.) МС (ESI-поз.): m/z=557 (М+Н)+ РХВТ (метод 6): У ч=4,5хв. Приклад 21 {8-фтор-2-[4-(3-метилфеніл)-1-піперазиніл]-3[2-метокси-5-(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтова кислота Виділення енантіомеру (метод 13) відбувається із 500мг (0,9ммоль) рацемату (приклад 20). Після цього сировину розчиняють в 1N розчині їдкого натру, екстрагують діетиловим етером, а у водній фазі 1N розчином соляної кислоти встановлюють значення рН=4 - 5. Продукт відсмоктують, промивають водою та суша ть у вакуумі. Вихід: 104мг (21% від теор.) MC (ESI-поз.): m/z=557 (М+Н)+ 1 Н-ЯМР (400МГц, ДМСО-d6): δ [м.ч.]=2.2 (сш, 3Н); 2,35-2,5 (м, 1Н); 2,6-3,1 (м, 5Н); 3,3- 3,6 (м, 4 Н); 3,8 (сш, 3Н); 4,9 (сш,1Н); 6,5-6,7 (м, 3 Н); 6,8-7,7 (м, 7Н); 12,6 (сш, 1Н). Приклад 22 Гідрохлорид {8-фтор-2-[4-(4-фторфеніл)-1піперазиніл]-3-[6-метокси-3-хлорфеніл]-3,4дигідро-4-хіназолініл}оцтової кислоти Виходячи із 621мг (1,15ммоль) естеру із прикладу 29А згідно із загальною робочою методикою [Н] та після очищення препаративною РХВТ (метод 5) та упарювання із сумішшю метанол/1N розчин соляної кислоти одержують 330мг (51% від теор.) продукту. РХВТ (метод 1): У ч=4,58хв. МС (ESI-поз.): m/z=527,0 (М+Н-НСІ)+ Приклад 23 Гідрохлорид {8-фтор-2-[4-(4-фторфеніл)-1піперазиніл]-3-[6-метокси-3-хлорфеніл]-3,4дигідро-4-хіназолінілоцтової кислоти Виходячи із 320мг (0,06ммоль) рацемату із прикладу 22 після хроматографічного виділення енантіомеру (метод 4), а також розчинення продукту у суміші метанол/1N розчин соляної кислоти та подальшого випаровування розчинника одержують 174мг (50% від теор) гідрохлориду. РХВТ (метод 1): У ч=4,51хв. МС (ESI-поз.): m/z=527,1 (М+Н-НСІ)+ 1 Н-ЯМР (400МГц, CD3CN): δ [м.ч.]=7,29 (дд,1Н); 7,19-7,11 (м, 2Н); 7,01-6,94 (м, 4Н); 6,87 51 82519 6,83 (м, 2Н); 5,08 (т, 1Н); 3,67 (с, 3Н); 3,56 (с, 4Н); 3,03-2,92 (м, 5Н); 2,72 (дд, 1Н). Приклад 24 (8-фтор-2-[4-(3-фторфеніл)-1-піперазиніл]-3-[2метокси-5-(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтова кислота В 15мл діоксану поміщають 117мг (0,2ммоль) метилового естеру {8-фтор-2-[4-(3-фтор феніл)-1піперазиніл]-3-[2-метокси-5-(трифторметил)феніл]3,4-дигідро-4-хіназолініл} оцтової кислоти (приклад 34А) та 0,61мл 1N розчину їдкого натру та протягом 3 годин перемішують при 50°С. Після видалення розчинника залишок поміщають у воду та 1N розчином соляної кислоти встановлюють значення рН=3-4. Осад відсмоктують, промивають водою та сушать у вакуумі. Вихід: 76мг (67% від теор.) РХВТ (метод 1):У ч=4,6хв. МС (ESI-поз.): m/z=561 (М+Н)+ Приклад 25 {8-фтор-2-[4-(3-фторфеніл)-1-піперазиніл]-3-[2метокси-5-(трифторметил)феніл]-3,4-дигідро-4хіназолініл}оцтова кислота 52мг (0,09ммоль) рацемату (приклад 24) розділяють на енантіомери (метод 13). Після цього сировину очищують хроматографом на силікагелі (оцтова кислота, дихлорметан/метанол 10:1) та сушать у вакуумі. Вихід: 12,3мг (24% від теор.) РХ-МС (метод 7): У ч=2,50хв. МС (ESI-поз.): m/z=561 (М+Н)+ 1 Н-ЯМР (400МГц, ДМСО-d6): δ [м.ч.]=2,35-2,5 (м, 1Н); 2,7-3,1 (м, 5Н); 3,3-3,6 (м, 4Н); 3,8 (сш, 3Н); 4,8-4,9 (м, 1Н); 6,45-6,6 (м, 1Н); 6,6-6,7 (м, 2Н); 6,86,9 (м, 2Н); 6,98-7,1 (м, 1Н); 7,1-7,6 (м, 4Н); 12, 4 (сш, 1Н). Сполуки із прикладів 26 - 34, вказані в таблиці 2, можуть бути одержані згідно із загальними робочими методиками [А] - [Н] із відповідних вихід 52 них сполук, а сполука із прикладу 35 - як описано у додатку до таблиці 2. 53 82519 54 55 82519 56 57 82519 58 100мг (0,16ммоль) естеру із прикладу 45А суспендують у напівконцентрованому розчині соляної кислоти, та реакційну суміш перемішують протягом 42 годин при 90°С. Після охолодження 20%ним розчином їдкого натру встановлюють значення рН=4, утворений залишок відфільтровують, промивають водою та сушать у вакуумі. Вихід: 64мг (66% від теор.) РХВТ (метод 1): У ч=4,38хв. МС (ESI-поз.): m/z=557 (М+Н)+ Приклад 91 Гідрохлорид {6-(амінокарбоніл)-2-[4-(4фтор феніл)піперазин-1-іл]-3-[3(трифторметил)феніл]-3,4-дигідрохіназолін-4іл}оцтової кислоти Приклад 35 {2-[4-(4-фторфеніл)піперазин-1-іл]-8-гідрокси3-[3-(трифторметил)феніл]-3,4-дигідрохіназолін-4іл}оцтова кислота 80мг (0,14ммоль) метилового етеру (приклад 89) розчиняють в 2мл дихлорметану та при 0°С додають 0,41ммоль 1Μ розчину триброміду бору в дихлорметані. Суміш перемішують протягом 16 годин при кімнатній температурі, додають наступні 0,82ммоль розчину триброміду бору та через 24 години додають ще 1,23ммоль. Суміш перемішують протягом 24 годин при кімнатній температурі, виливають реакційну суміш на лід та додають 5мл 1N водного розчину соляної кислоти. Суміш екстрагують 25мл етилацетату. Органічну фазу промивають насиченим водним розчином хлориду натрію, суша ть над сульфатом натрію, згущують та очищують препаративною РХВТ. Одержують 50мг (63% від теор.) продукту. РХВТ (метод 1): У ч=4,47хв. МС (ESI-поз.): m/z=529 (М+Н-НСІ)+ Приклад 90 {7-гідроксикарбоніл-2-[4-(4-фторфеніл)-1піперазиніл]-3-[5-(трифторметил)феніл]-3,4дигідро-4-хіназолінілоцтова кислота 500мг (0,8ммоль) трет-бутилового естеру із прикладу 49А та 8мл 4Μ розчину хлороводню суспендують в діоксані, та реакційну суміш протягом 16 годин перемішують при кімнатній температурі. Суспензію згущують та сушать у вакуумі. Вихід: 564мг (99% від теор.) РХВТ (метод 1): У ч=4,25хв. МС (ESI-поз.): m/z=556 (М+Н-НСІ)+ 1 Н-ЯМР(300МГц, ДМСО-d6): δ [м.ч.]=12,94 (сш, 1Н); 8,11 (с, 1Н); 8,03-7,95 (м, 2Н); 7,92-7,65 (м, 4Н); 7,09-6,91 (м, 4Н); 5,50 (дд, 1Н); 4,38-4,12 (м, 4Н); 3,17-3,06 (м, 5Н); 2,81 (дд, 1Н)! В. Оцінка Фізіологічної ефективності Дію in vitro сполук згідно з винаходом можна визначити при проведенні такого дослідження: Дослідження цитопатогенної дії проти ЛЦМВ (цитомегаловірусу людини) Досліджувані сполуки застосовують як 50 мілімолярний (мМ) розчин у диметилсульфоксиді (ДМСО). Ganciclovir®, Foscarnet® та Cidofovir® використовують як сполуки для порівняння. Після додавання відповідно 2мкл 50, 5, 0,5 та 0,05мМ розчину ДМСО у кожні 98мкл середовища культур з ряду 2А-Н суміш розріджують у співвідношенні 1:2 відповідно 50мкл середовища до ряду 11 планшету, що містить 96-лунок. Лунки ряду 1 та 2 містять відповідно по 50мкл середовища. Після цього у лунки піпеткою додають відповідно 150мкл суспензії 1´104 клітин (фібробластів крайньої плоті людини [ФКПЛ]) (ряд 1= контрольна група), а в ряди 2 - 12 - суміш ФКПЛ-клітин, інфікованих та неінфікованих ЛЦМВ (M.O.I.=0,001 - 0,002), тобто 1 - 2 інфіковані клітини на 1000 неінфікованих клітин. Ряд 12 (без речовини) застосовують як вірусну контрольну групу. Кінцева концентрація становить 250 - 0,0005мкМ. Планшети протягом 6 днів інкубують при 37°С/5% СО2, тобто до повного зараження всіх клітин у вірусній контрольній групі (100% цитопатогенний ефект [ЦПЕ]). Після цього лунки фіксують та підфарбовують шля хом додавання суміші формаліну та барвника Гімзи (30хв.), 59 82519 промивають бідистильованою водою та при 50°С сушать у сушильній шафі. Потім планшети візуально оцінюють за допомогою мікроскопу (Plaque Multiplier фірми Technomara). Дослідження планшетів дають такі показники: СС50 (ФКПЛ)=концентрація речовини в мкМ, при якій у порівнянні із необробленою контрольною групою клітин не спостерігається видимого цитостатичного впливу на клітини; EC50 (ЛЦМВ)=концентрація речовини в мкМ, яка призупиняє ЦПЕ (цитопатичний ефект) на 50% у порівнянні із необробленою вірусною контрольною групою; ПС (показник селективності)=CC50 (ФКПЛ)/ЕС50 (ЛЦ МВ) Показники дослідження in vitro для сполук згідно з винаходом наведені нижче в таблиці А: Таблиця А Приклад № ФКПЛ СС50 ЛЦМВ ЕС 50 ПС ЛЦМВ [мкМ] [мкМ] 2 12 0,016 750 9 15 0,02 750 15 31 0,002 15500 19 17 0,002 8947 23 24 0,002 12632 29 47 0,07 671 Придатність сполук згідно з винаходом для лікування інфекцій ЛЦМВ можна продемонструвати на основі такої моделі: ЛЦМВ, модель Xenoqraft-Gelfoam® Тварини: У комерційних тваринників закуповують мишей жіночої статі віком 3 - 4 тижні (16 - 18г), які страждають на імунодефіцит, Fox Chase SCID, або Fox Chase SCID-NOD, або SCID-бежеві (Taconic M+B, Jackson, USA). Тварин тримають у стерильних умовах (включаючи корм) в ізоляторах. Вирощування вірусу: Цитомегаловірус людини (ЛЦМВ), Stamm Davis або AD169, вирощують in vitro на ембріональних фібробластах крайньої плоті людини (клітини ФКПЛ). Після зараження клітин ФКПЛ різними інфекціями (М. О. І) 0,01 - 0,03 заражені клітини через 5 - 10 днів збирають та в присутності мінімального ессенціального середовища (MEM), 10% фетальної сироватки теляти (ФСТ) та 10% ДМСО зберігають при -40°С. Після кількаразового розрідження заражених клітин здійснюють оцінку титрів на планшетах, що мають 24 лунки, до злиття клітин ФКПЛ після інтравітального зафарбовування нейтральним червоним. Підготовка губок, трансплантація, обробка та оцінка: 1´1´1см колагенові губки [Gelfoam®; фірма Peasel & Lorey, Best. -Nr. 407534; K. Т. Chong et al., Abstracts of 39th Interscience Conference on Antimicrobial Agents and Chemotherapy, 1999, S.439] спочатку зволожують саліном, забуференим фосфатом (ЗФС), пухирці повітря видаляють деаерацією та зберігають у MEM+ 10% ФСТ. 1´106 заражених вірусом клітин ФКПЛ (зараження ЛЦМВ-Девіса або ЛЦМВ AD169 М. О. 60 І=0.03) через 3 години після зараження відділяють та по краплях додають в 20мкл MEM, 10% ФСТ на вологу губку. Через приблизно 16 годин заповнені інфікованими клітинами губки інкубують в 25мкл PBS/0,1% BSA/1мМ DTT 5нг/мкл основного Фактору Росту Фібробласту (оФРФ). Для трансплантації хворих на імунодефіцит мишей наркотизують авертином або сумішшю кетамін/ксилазин/азепромазин, волосяний покрів на спині вибривають, епідерміс надрізають на 1 - 2см та під шкіру трансплантують вологі гумки. Операційні рани обробляють спеціальним клеєм. Через 6 годин після трансплантації можна здійснювати першу обробку мишей (у день операції мишей обробляють лише один раз). У наступні дні мишей обробляють протягом 8 днів тричі на день (у 7.00, 14.00 та 19.00 годин), двічі на день (у 8.00 та 18.00 годин) або один раз на день (у 14 годин) шляхом перорального застосування речовини. Добова доза становить, наприклад, 3, або 10, або 30, або 60, або 100 мг/кг ваги тіла тварини, об'єм нанесення 10мл/кг ваги тіла. Речовини застосовують у формі 0,5%-ної суспензії тилози та 2% ДМСО або 0,5%-ної суспензії тилози. Через 9 днів після трансплантації та 16 годин після останньої обробки речовиною тварин безболісно умертвляють, а гумку видаляють. Інфіковані вірусом клітини вивільняють із губки перетравлюванням колагеназою (330од./1,5мл) та зберігають в присутності MEM, 10% фетальної сироватки теляти та 10% ДМСО при -140°С. Оцінку здійснюють після кількаразового розрідження заражених клітин при титруванні на планшетах, що мають 24 лунки, до злиття клітин ФКПЛ після інтравітального зафарбовування нейтральним червоним. Визначають кількість інфікованих клітин або інфекційних частин вірусу після обробки речовиною у порівнянні із обробленою плацебо контрольною групою. Дослідження інгібувальної активності по відношенню до CYP Для дослідження механізму (незворотного) інгібування CYP3A4 досліджувану речовину у різних концентраціях разом із мікросомами печінки людини (2мг/мл мікросомального протеїну) інкубують у буферному розчині фосфату калію рН7,4 при застосуванні системи, яка генерує NADPH, (NADP+, 6-фосфат глюкози та глюкоза-6фосфа тдигідрогеназа) при 37°С. У різні проміжки часу беруть 2 різні аліквоти інкубованої речовини. Першу аліквоту у співвідношенні 1:50 інкубують у новому інкубаційному розчині (буферний розчин фосфа ту, система, яка генерує NADPH, та 10мкм мідазоламу) протягом 10 хвилин при 37°С. Після цього інкубовану аліквоту разом із ацетонітрилом поміщають на лід, гранулюють у центрифузі у присутності 15000г протеїну, а залишок за допомогою РХВТ/МС аналізують на утворення 1'гідроксимідазоламу. Другу аліквоту разом із ацетонітрилом поміщають на лід та за допомогою РХВТ/УФ/МС аналізують на вміст досліджуваної речовини. На основі результаті двох аналітичних досліджень визначають типові для незворотного інгібування параметри (kінертне, Ki та показник розподілу
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted dihydrochinazolines having antiviral properties
Автори англійськоюWunberg Tobias, Baumeister Judith, Betz Ulrich, Jeske Mario, Lampe Thomas, Nikolic Susanne, Reefschlaeger Juergen, Schohe-Loop Rudolf, Suessmeier Frank, Zimmermann Holger, Grosser Rolf, Henninger Kerstin, Hewlett Guy, Keldenich, Jorg, Lang Dieter
Назва патенту російськоюЗамещенные дигидрохиназолины, которые имеют антивирусные свойства
Автори російськоюВунберг Тобиас, Баумайстер Юдит, Бетц Ульрих, Еске Марио, Лампэ Томас, Николик Сузанне, Реефшлегер Юрген, Шоэ-Лооп Рудольф, Зюссмаєр Франк, Циммерманн Хольгер, Гроссер Рольф, Хеннингер Керстин, Хьюлетт Гай, Ланг Дитер
МПК / Мітки
МПК: C07D 239/84, A61P 31/22
Мітки: властивості, дигідрохіназоліни, мають, антивірусні, заміщені
Код посилання
<a href="https://ua.patents.su/31-82519-zamishheni-digidrokhinazolini-yaki-mayut-antivirusni-vlastivosti.html" target="_blank" rel="follow" title="База патентів України">Заміщені дигідрохіназоліни, які мають антивірусні властивості</a>
Попередній патент: Сполуки азетидину, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі
Наступний патент: Шихта для виготовлення вібролитих карбідкремнієвих виробів
Випадковий патент: Спосіб синтезу цифрового фільтра












