Сполуки азетидину, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі
Формула / Реферат
1. Сполуки азетидину загальної формули (І)
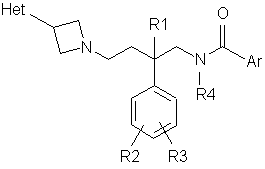 , (I)
, (I)
де
Het - піперидин, заміщений гідрокси, гідроксіалкілом, оксо, метилтіо, метилсульфінілом, метилсульфонілом, ціано, 1,3-діоксолан-2-ілом, С1-С4алкокси, аміно, як варіант, моно- або дизаміщеним С1-С4алкілом, С3-С4циклоалкілом, С2-С4алкенілом, С2-С4алкінілом, ациламіно, як варіант, N-заміщеним С1-С4алкілом, С3-С4циклоалкілом, С2-С4алкенілом, С2-С4алкінілом, (С1-С4алкілсульфоніл)аміно, як варіант, N-заміщеним С1-С4алкілом, С3-С4циклоалкілом, С2-С4алкенілом, С2-С4алкінілом, одним або двома атомами флуору або дизаміщеним С1-С4алкілом і гідроксилом; або
Het - морфолін або тіоморфолін, як варіант, заміщений на атомі сульфуру одним або двома оксигенами; або
Het - піперазин, як варіант, заміщений на 4 атомі нітрогену С1-С4алкілом, С2-С4алкенілом, С2-С4алкінілом, С3-С4циклоалкілом, С1-С4алкілсульфонілом або С1-С4ацилом;
R1 - гідроген;
R2 - флуор, приєднаний у 4-й позиції;
R3 - гідроген;
R4 - С1-С4алкіл, С3-С4циклоалкіл, С2-С4алкеніл або С2-С4алкініл;
Аr - феніл, заміщений у 3-й і 5-й позиціях групами, незалежно вибраними з галогену, С1-С4алкілу, С1-С4алкокси, ціано і нітро;
або її енантіомер, або будь-яка її сіль.
2. Сполука за п. 1, яка відрізняється тим, що R4 є С1-С4алкілом;
або її енантіомер, або будь-яка її сіль.
3. Сполука за будь-яким з пп. 1,2, яка відрізняється тим, що гетероциклічне кільце Het має зв'язок з рештою молекули через один з атомів нітрогену кільця.
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що R4 є метилом.
5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що є S-енантіомером.
6. Сполука за п. 1, яка відрізняється тим, що вибрана з таких сполук:
3,5-дибром-N-[(2S)-2-(4-флуорфеніл)-4-{3-морфолін-4-ілазетидин-1-іл)бутил]-N-метилбензамід;
N-[2-(4-флуорфеніл)-4-(3-тіоморфолін-4-ілазетидин-1-іл)бутил]-N-метил-3,5-біс(трифлуорметил)бензамід;
3-флуор-N-[(2S)-2-(4-флуорфеніл)-4-(3-морфолін-4-ілазетидин-1-іл)бутил]-N-метил-5-(трифлуорметил)бензамід;
N-[4-[3-(1,4-діокса-8-азаспіро[4,5]дек-8-іл)азетидин-1-іл]-2-(4-флуорфеніл)бутил]-N-метил-3,5-біс(трифлуорметил)бензамід;
N-{(2S)-2-(4-флуорфеніл)-4-[3-(4-флуорпіперидин-1-іл)азетидин-1-іл]бутил]}-N-метил-3,5-біс(трифлуорметил)бензамід;
N-[(2S)-2-(4-флуорфеніл)-4-[3-(4-гідроксипіперидин-1-іл)азетидин-1-іл]бутил}-N-метил-3,5-біс(трифлуорметил)бензамід;
3,5-дихлор-N-[(2S)-2-(4-флуорфеніл)-4-(3-морфолін-4-ілазетидин-1-іл)бутил]-N-метилбензамід;
3,5-дибром-N-{(2S)-2-(4-флуорфеніл)-4-[3-(4-гідроксипіперидин-1-іл)азетидин-1-іл]бутил}-N-метилбензамід;
3-бром-N-[(2S)-2-(4-флуорфеніл)-4-(3-морфолін-4-іл)азетидин-1-іл)бутил]-5-йодо-N-метилбензамід;
N-{2-(4-флуорфеніл)-4-[3-(1-оксидотіоморфолін-4-іл)азетидин-1-іл]бутил}-N-метил-3,5-біс(трифлуорметил)бензамід;
N-{2-(4-флуорфеніл)-4-[3-(4-оксопіперидин-1-іл)азетидин-1-іл]бутил}-N-метил-3,5-біс(трифлуорметил)бензамід;
або їх енантіомери, або будь-які їх солі.
7. Сполука за будь-яким з пп. 1-6, призначена для застосування у терапії.
8. Сполука за п. 7, яка відрізняється тим, що призначена для застосування у профілактиці або лікуванні респіраторних, серцево-судинних, неврологічних, болісних, онкологічних, запальних і/або шлунково-кишкових розладів.
9. Сполука за п. 8, яка відрізняється тим, що призначена для застосування у профілактиці або лікуванні астми, алергічного риніту, легеневих хвороб, кашлю, застуди, запалення, хронічної обструктивної легеневої хвороби, реактивності дихальних шляхів, уртикарії, гіпертонії, ревматоїдного артриту, набряку, ангіогенезу, болю, мігрені, гіпертонічного головного болю, психозів, депресії, тривожності, хвороби Альцгеймера, шизофренії, хвороби Хантингтона, надмоторності міхура, нетримання сечі, розладів вживання їжі, маніакальної депресії, залежностей, розладу руху, розладу розпізнавання, ожиріння, стресових розладів, розладу сечовипускання, маній, гіпоманії і агресії, біполярного розладу, раку, карциноми, фіброміалгії, несерцевого грудного болю, шлунково-кишкової гіпермоторності, гастричної астми, хвороби Крона, розладів випорожнення шлунка, виразкового коліту, синдрому подразнення кишечнику, запальної кишкової хвороби, блювання, розладів гастромоторності або гастро-стравохідного рефлюксу.
10. Спосіб одержання сполуки за будь-яким з пп. 1-6, згідно з яким:
a) піддають взаємодії сполуку формули (III) з сполукою формули (IV):
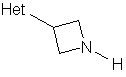 , (ІІІ)
, (ІІІ)
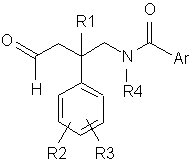 , (IV)
, (IV)
де R1-R4, Het і Аr є такими, що були визначені вище, і в таких умовах, що відновлювальне алкілування сполук формули (ІІI) створює N-C-зв'язок між атомом нітрогену азетидинової групи сполук формули (III) і атомом карбону альдегідної групи сполук формули (ІV); або
b) піддають взаємодії сполуку формули (III) з сполукою формули (V):
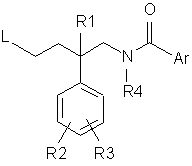 , (V)
, (V)
де R1-R4, Het і Аr є такими, що були визначені вище, a L є такою групою, що алкілування сполук формули (III) створює N-C-зв'язок між атомом нітрогену азетидинової групи сполук формули (III) і тим атомом карбону сполук формули (V), який є суміжним до групи L; і
і) видаляють будь-які захисні групи;
іі) як варіант, окислюють будь-який придатний для цього атому;
ііі) як варіант, утворюють фармацевтично прийнятну сіль.
11. Спосіб одержання сполуки за будь-яким з пп. 1-6, згідно з яким:
піддають взаємодії сполуку формули (VI) з сполукою формули (VII):
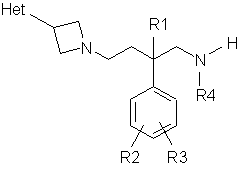 , (VI)
, (VI)
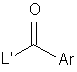 , (VII)
, (VII)
де R1-R4, Het і Аr є такими, що були визначені вище, a L' є відщеплюваною групою, причому будь-яка інша функціональна група, якщо необхідно, є захищеною; і:
і) видаляють будь-які захисні групи;
іі) як варіант, окислюють будь-який придатний для цього атому;
ііі) як варіант, утворюють фармацевтично прийнятну сіль.
12. Сполука, вибрана з таких сполук:
[2-(4-флуорфеніл)-4-(3-тіоморфолін-4-ілазетидин-1-іл)бутил]метиламін;
[(2S)-2-(4-флуорфеніл)-4-(3-морфолін-4-ілазетидин-1-іл)бутил]метиламін;
1-{1-[3-(4-флуорфеніл)-4-(метиламіно)бутил]азетидин-3-іл}піперидин-4-ол;
[4-[3-(1,4-діокса-8-азаспіро[4,5]дек-8-іл)азетидин-1-іл]-2-(4-флуорфеніл)бутил]метиламін;
3,5-дихлор-N-[(2S)-2-(4-флуорфеніл)-4-оксобутил]-N-метилбензамід;
3,5-дибром-N-[(2S)-2-(4-флуорфеніл)-4-оксобутил]-N-метилбензамід;
3-бром-N-[(2S)-2-(4-флуорфеніл)-4-оксобутил]-5-йод-N-метилбензамід; або їх енантіомери, або будь-які їх солі.
13. Фармацевтична композиція, яка включає як активний інгредієнт сполуку за будь-яким з пп. 1-6 як одиночний енантіомер, рацемат або їх суміш у формі вільної основи, або її фармацевтично прийнятну сіль, або сольват, як варіант, разом з розріджувачами, ексципієнтами або інертними носіями.
14. Застосування сполуки за будь-яким з пп. 1-6 як одиночного енантіомера, рацемату або їх суміші у формі вільної основи, або її фармацевтично прийнятної солі, або сольвату у виготовленні медикаменту, призначеного для профілактики або лікування респіраторних, серцево-судинних, неврологічних, болісних, онкологічних, запальних і/або шлунково-кишкових розладів.
15. Застосування за п. 14, яке відрізняється тим, що медикамент, який виготовляють, призначений для профілактики або лікування астми, алергічного риніту, легеневих хвороб, кашлю, застуди, запалення, хронічної обструктивної легеневої хвороби, реактивності дихальних шляхів, уртикарії, гіпертонії, ревматоїдного артриту, набряку, ангіогенезу, болю, мігрені, гіпертонічного головного болю, психозів, депресії, тривожності, хвороби Альцгеймера, шизофренії, хвороби Хантингтона, надмоторності міхура, нетримання сечі, розладів вживання їжі, маніакальної депресії, залежностей, розладу руху, розладу розпізнавання, ожиріння, стресових розладів, розладу сечовипускання, маній, гіпоманії і агресії, біполярного розладу, раку, карциноми, шлунково-кишкової гіпермоторності, гастричної астми, хвороби Крона, розладів випорожнення шлунка, виразкового коліту, синдрому подразнення кишечнику, запальної кишкової хвороби, блювання, розладів гастромоторності або гастро-стравохідного рефлюксу.
16. Застосування за п. 15, яке відрізняється тим, що медикамент, який виготовляють, призначений для профілактики або лікування синдрому подразнення кишечнику.
17. Застосування за п. 15, яке відрізняється тим, що медикамент, який виготовляють, призначений для профілактики або лікування запальної кишкової хвороби.
18. Застосування за п. 15, яке відрізняється тим, що медикамент, який виготовляють, призначений для профілактики або лікування нетримання сечі.
19. Спосіб профілактики або лікування респіраторних, серцево-судинних, неврологічних, болісних, онкологічних і/або шлунково-кишкових розладів, який включає введення пацієнту ефективної кількості сполуки за будь-яким з пп. 1-6 як одиночного енантіомера, рацемату або їх суміші у формі вільної основи, або її фармацевтично прийнятної солі, або сольвату.
20. Спосіб за п. 19, який відрізняється тим, що включає профілактику або лікування шлунково-кишкової гіпермоторності, гастричної астми, хвороби Крона, розладів випорожнення шлунка, виразкового коліту, синдрому подразнення кишечнику, запальної кишкової хвороби, блювання, розладів гастромоторності або гастро-стравохідного рефлюксу.
21. Спосіб за п. 20, який відрізняється тим, що включає профілактику або лікування синдрому подразнення кишечнику.
22. Спосіб за п. 20, який відрізняється тим, що включає профілактику або лікування запальної кишкової хвороби.
23. Спосіб за п. 20, який відрізняється тим, що включає профілактику або лікування нетримання сечі.
Текст
1. Сполуки азетидину загальної формули (І) 2 (19) 1 3 R1 - гідроген; R2 - флуор, приєднаний у 4-й позиції; R3 - гідроген; R4 - С1-С4алкіл, С3-С4циклоалкіл, С2-С4алкеніл або С2-С4алкініл; Аr - феніл, заміщений у 3-й і 5-й позиціях групами, незалежно вибраними з галогену, С1-С4алкілу, С1С4алкокси, ціано і нітро; або її енантіомер, або будь-яка її сіль. 2. Сполука за п. 1, яка відрізняється тим, що R4 є С1-С4алкілом; або її енантіомер, або будь-яка її сіль. 3. Сполука за будь-яким з пп. 1,2, яка відрізняється тим, що гетероциклічне кільце Het має зв'язок з рештою молекули через один з атомів нітрогену кільця. 4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що R4 є метилом. 5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що є S-енантіомером. 6. Сполука за п. 1, яка відрізняється тим, що вибрана з таких сполук: 3,5-дибром-N-[(2S)-2-(4-флуорфеніл)-4-{3морфолін-4-ілазетидин-1-іл)бутил]-Nметилбензамід; N-[2-(4-флуорфеніл)-4-(3-тіоморфолін-4ілазетидин-1-іл)бутил]-N-метил-3,5біс(трифлуорметил)бензамід; 3-флуор-N-[(2S)-2-(4-флуорфеніл)-4-(3-морфолін4-ілазетидин-1-іл)бутил]-N-метил-5(трифлуорметил)бензамід; N-[4-[3-(1,4-діокса-8-азаспіро[4,5]дек-8іл)азетидин-1-іл]-2-(4-флуорфеніл)бутил]-N-метил3,5-біс(трифлуорметил)бензамід; N-{(2S)-2-(4-флуорфеніл)-4-[3-(4-флуорпіперидин1-іл)азетидин-1-іл]бутил]}-N-метил-3,5біс(трифлуорметил)бензамід; N-[(2S)-2-(4-флуорфеніл)-4-[3-(4гідроксипіперидин-1-іл)азетидин-1-іл]бутил}-Nметил-3,5-біс(трифлуорметил)бензамід; 3,5-дихлор-N-[(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-ілазетидин-1-іл)бутил]-Nметилбензамід; 3,5-дибром-N-{(2S)-2-(4-флуорфеніл)-4-[3-(4гідроксипіперидин-1-іл)азетидин-1-іл]бутил}-Nметилбензамід; 3-бром-N-[(2S)-2-(4-флуорфеніл)-4-(3-морфолін-4іл)азетидин-1-іл)бутил]-5-йодо-N-метилбензамід; N-{2-(4-флуорфеніл)-4-[3-(1-оксидотіоморфолін-4іл)азетидин-1-іл]бутил}-N-метил-3,5біс(трифлуорметил)бензамід; N-{2-(4-флуорфеніл)-4-[3-(4-оксопіперидин-1іл)азетидин-1-іл]бутил}-N-метил-3,5біс(трифлуорметил)бензамід; або їх енантіомери, або будь-які їх солі. 7. Сполука за будь-яким з пп. 1-6, призначена для застосування у терапії. 8. Сполука за п. 7, яка відрізняється тим, що призначена для застосування у профілактиці або лікуванні респіраторних, серцево-судинних, неврологічних, болісних, онкологічних, запальних і/або шлунково-кишкових розладів. 9. Сполука за п. 8, яка відрізняється тим, що призначена для застосування у профілактиці або лікуванні астми, алергічного риніту, легеневих 82518 4 хвороб, кашлю, застуди, запалення, хронічної обструктивної легеневої хвороби, реактивності дихальних шляхів, уртикарії, гіпертонії, ревматоїдного артриту, набряку, ангіогенезу, болю, мігрені, гіпертонічного головного болю, психозів, депресії, тривожності, хвороби Альцгеймера, шизофренії, хвороби Хантингтона, надмоторності міхура, нетримання сечі, розладів вживання їжі, маніакальної депресії, залежностей, розладу руху, розладу розпізнавання, ожиріння, стресових розладів, розладу сечовипускання, маній, гіпоманії і агресії, біполярного розладу, раку, карциноми, фіброміалгії, несерцевого грудного болю, шлунково-кишкової гіпермоторності, гастричної астми, хвороби Крона, розладів випорожнення шлунка, виразкового коліту, синдрому подразнення кишечнику, запальної кишкової хвороби, блювання, розладів гастромоторності або гастро-стравохідного рефлюксу. 10. Спосіб одержання сполуки за будь-яким з пп. 1-6, згідно з яким: a) піддають взаємодії сполуку формули (III) з сполукою формули (IV): Het N H , (ІІІ) O R1 O N H Ar R4 R2 R3 , (IV) де R1-R4, Het і Аr є такими, що були визначені вище, і в таких умовах, що відновлювальне алкілування сполук формули (ІІI) створює N-Cзв'язок між атомом нітрогену азетидинової групи сполук формули (III) і атомом карбону альдегідної групи сполук формули (ІV); або b) піддають взаємодії сполуку формули (III) з сполукою формули (V): L O R1 N Ar R4 R2 R3 , (V) де R1-R4, Het і Аr є такими, що були визначені вище, a L є такою групою, що алкілування сполук формули (III) створює N-C-зв'язок між атомом нітрогену азетидинової групи сполук формули (III) і тим атомом карбону сполук формули (V), який є суміжним до групи L; і і) видаляють будь-які захисні групи; іі) як варіант, окислюють будь-який придатний для цього атому; 5 82518 ііі) як варіант, утворюють фармацевтично прийнятну сіль. 11. Спосіб одержання сполуки за будь-яким з пп. 1-6, згідно з яким: піддають взаємодії сполуку формули (VI) з сполукою формули (VII): Het R1 N N H R4 R2 R3 , (VI) O L' Ar , (VII) де R1-R4, Het і Аr є такими, що були визначені вище, a L' є відщеплюваною групою, причому будь-яка інша функціональна група, якщо необхідно, є захищеною; і: і) видаляють будь-які захисні групи; іі) як варіант, окислюють будь-який придатний для цього атому; ііі) як варіант, утворюють фармацевтично прийнятну сіль. 12. Сполука, вибрана з таких сполук: [2-(4-флуорфеніл)-4-(3-тіоморфолін-4-ілазетидин1-іл)бутил]метиламін; [(2S)-2-(4-флуорфеніл)-4-(3-морфолін-4ілазетидин-1-іл)бутил]метиламін; 1-{1-[3-(4-флуорфеніл)-4(метиламіно)бутил]азетидин-3-іл}піперидин-4-ол; [4-[3-(1,4-діокса-8-азаспіро[4,5]дек-8-іл)азетидин-1іл]-2-(4-флуорфеніл)бутил]метиламін; 3,5-дихлор-N-[(2S)-2-(4-флуорфеніл)-4-оксобутил]N-метилбензамід; 3,5-дибром-N-[(2S)-2-(4-флуорфеніл)-4-оксобутил]N-метилбензамід; 3-бром-N-[(2S)-2-(4-флуорфеніл)-4-оксобутил]-5йод-N-метилбензамід; або їх енантіомери, або будь-які їх солі. 13. Фармацевтична композиція, яка включає як активний інгредієнт сполуку за будь-яким з пп. 1-6 як одиночний енантіомер, рацемат або їх суміш у формі вільної основи, або її фармацевтично прийнятну сіль, або сольват, як варіант, разом з розріджувачами, ексципієнтами або інертними носіями. 14. Застосування сполуки за будь-яким з пп. 1-6 як одиночного енантіомера, рацемату або їх суміші у формі вільної основи, або її фармацевтично прийнятної солі, або сольвату у виготовленні медикаменту, призначеного для профілактики або лікування респіраторних, серцево-судинних, Винахід стосується нових сполук формули І, фармацевтичних композицій, що містять зазначені сполуки, і використання зазначених сполук у 6 неврологічних, болісних, онкологічних, запальних і/або шлунково-кишкових розладів. 15. Застосування за п. 14, яке відрізняється тим, що медикамент, який виготовляють, призначений для профілактики або лікування астми, алергічного риніту, легеневих хвороб, кашлю, застуди, запалення, хронічної обструктивної легеневої хвороби, реактивності дихальних шляхів, уртикарії, гіпертонії, ревматоїдного артриту, набряку, ангіогенезу, болю, мігрені, гіпертонічного головного болю, психозів, депресії, тривожності, хвороби Альцгеймера, шизофренії, хвороби Хантингтона, надмоторності міхура, нетримання сечі, розладів вживання їжі, маніакальної депресії, залежностей, розладу руху, розладу розпізнавання, ожиріння, стресових розладів, розладу сечовипускання, маній, гіпоманії і агресії, біполярного розладу, раку, карциноми, шлунково-кишкової гіпермоторності, гастричної астми, хвороби Крона, розладів випорожнення шлунка, виразкового коліту, синдрому подразнення кишечнику, запальної кишкової хвороби, блювання, розладів гастромоторності або Застосування за п. 15, яке відрізняється тим, 16. гастро-стравохідного рефлюксу. що медикамент, який виготовляють, призначений для профілактики або лікування синдрому подразнення кишечнику. 17. Застосування за п. 15, яке відрізняється тим, що медикамент, який виготовляють, призначений для профілактики або лікування запальної кишкової хвороби. 18. Застосування за п. 15, яке відрізняється тим, що медикамент, який виготовляють, призначений для профілактики або лікування нетримання сечі. 19. Спосіб профілактики або лікування респіраторних, серцево-судинних, неврологічних, болісних, онкологічних і/або шлунково-кишкових розладів, який включає введення пацієнту ефективної кількості сполуки за будь-яким з пп. 1-6 як одиночного енантіомера, рацемату або їх суміші у формі вільної основи, або її фармацевтично прийнятної солі, або сольвату. 20. Спосіб за п. 19, який відрізняється тим, що включає профілактику або лікування шлунковокишкової гіпермоторності, гастричної астми, хвороби Крона, розладів випорожнення шлунка, виразкового коліту, синдрому подразнення кишечнику, запальної кишкової хвороби, блювання, розладів гастромоторності або гастростравохідного рефлюксу. 21. Спосіб за п. 20, який відрізняється тим, що включає профілактику або лікування синдрому подразнення кишечнику. 22. Спосіб за п. 20, який відрізняється тим, що включає профілактику або лікування запальної кишкової хвороби. 23. Спосіб за п. 20, який відрізняється тим, що включає профілактику або лікування нетримання сечі. терапії. Крім того, винахід стосується способів приготування сполук формули І і нових інтермедіатів, що використовуються при їх 7 приготуванні. Нейрокініни, відомі також як тахикініни, включають клас пептидних нейротрансмітерів, які знаходяться у периферійній і центральній нервових системах. Трьома головними тахикінінами є субстанція Р (SP), нейрокінін A (NKA) і нейрокінін В (НКВ). Для цих трьох головних тахикінінів відомі щонайменше три типи рецепторів. Згідно з їх відносною селективністю до агоністів SP, NKA і НКВ, ці рецептори класифікують як рецептори нейрокініну 1 (NK1), нейрокініну 2 (NK2) і нейрокініну 3 (NK3), відповідно. потреба в перорально активному Існує подвійному антагоністі рецептора NK1/NK2, здатному проходити через крово-мозковий бар'єр, для лікування, наприклад, респіраторних, серцевосудинних, неврологічних, болісних, онкологічних, запальних і/або шлунково-кишкових розладів. Для підвищення терапевтичного індексу такої терапії бажано отримати сполуку з мінімальною токсичністю і селективністю до зазначених рецепторів НК. Крім того, вважається необхідним, щоб зазначений медикамент мав сприятливі фармакокінетичні і метаболічні якості і, отже, поліпшений терапевтичний і безпечний профіль, наприклад, знижену здатність інгібувати ензим печінки. Відомо, що виникають серйозні проблеми, пов'язані з токсичністю, якщо рівні плазми, створені однією терапією, змінюються в результаті одночасного введення інших ліків. Таке явище називають взаємодією ліків, яке може трапитись, якщо метаболізм одних ліків, викликаний одночасним введенням іншої речовини, може інгібувати ензим печінки CYP (цитохром P45G) 3А4, що є найбільш важливим ензимом у печінці людини, оскільки більшість окислених речовин біотрансформуються саме цим ензимом. Тому є небажаним застосовувати терапію, яка суттєво інгібує цей ензим. Було виявлено, що будь-які відомі антагоністи рецептора НК до певної міри інгібують ензим CYP3A4 і тому застосування таких сполук у терапії створює певний ризик. Отже, існує потреба у нових антагоністах рецепторів NK1/NK2 подвійної дії з поліпшеними фармакокінетичними якостями. Винахід стосується сполук з низьким рівнем інгібування ензиму CYP3A4 і з порівняно високими значеннями IC50, отриманими у дослідженнях інгібування CYP3A4. Метод визначення інгібування описаний у Варіrо et al; Drug Metab. Dispcs.ЕР 0630887, WO 95/05377, WO У ЕР 0625509, 29, 30-35 (2001). 95/12577, WO 95/15961, WO 96/24582, WO 00/02859, WO 00/20003, WO 00/20389, WO 00/25766, WO 00/34243, WO 02/51807 і WO 03/037889 описані похідні піперидинбутиламіду, які є антагоністами тахикініну. У "4-Amino-2-(aryl)-butylbenzamides and Their Conformationally Constrained Analogues. Potent Antagonists of the Human Neurokinin-2 (NK2) Receptor", Roderick MacKenzie. A., et al, Bioorganic & Medicinal Chemistry Letters, In Press, online з 15/05/2003, описано сполуку N-[2-(3,4дихлорфеніл)-4-(3-морфолін-4-ілацетидин-1іл)бутил]-N-метилбензамід, яка має функціональні якості антагоніста рецептора NK2. У WO 96/05193, WO 97/27185 і ЕР 0962457 82518 8 описано похідні ацетидинілалкіллактаму, активні як антагоністи тахикініну. У ЕР 0790248 описано ацетидинілалкілазапіперидони і ацетидинілалкілоксапіперидони, які є антагоністами тахикініну. 97/25322 описано похідні WO 99/01451 і WO ацетидинілалкілпіперидину, заявлені як антагоністи тахикініну. ЕР 0791592 описано ацетидинілалкілглутаріміди з антагоністичними до тахикініну якостями. Об'єктом винаходу є нові антагоністи тахикініну, які можуть бути використані у терапії. Ще одним об'єктом винаходу є нові сполуки, які здатні проходити через крово-мозковий бар'єр і мають поліпшені фармакокінетичні і метаболічні якості і/або поліпшену селективність до рецепторів NK1/NK2. Винахід стосується сполуки загальної формули (І) де Het є, як варіант, заміщеним 4-, 5-, 6- або 7членним гетероциклічним кільцем з щонайменше одним атомом нітрогену; R1 - гідроген, гідрокси, С1-С4алкіл, С3С4циклоалкіл, С1-С4алкеніл або С2-С4алкініл; R2 і R3 кожна незалежно вибрана з гідрогену, С1-С4 алкілу, С3-С4циклоалкілу, С1-С4алкенілу, С2С4алкінілу, С1-С4 алкокси, галогену і ціано, за умови, що R2 і R3 не є обидві гідрогеном; R4 - С1-С4 алкіл, С3-С4 циклоалкіл, С1-С4 алкеніл або С1-С4 алкініл; Ar є, як варіант, заміщеною ароматичною кільцевою системою, вибраною з піридинілу; 1нафтилу; 5,6,7,8-тетрагідро-1-нафтилу; хінолінілу; 2,3-дигідро-1,4-бензодіоксинілу; 1,3бензодіоксолілу; 5,6,7,8-тетрагідрохінолінілу; 5,6,7,8-тетрагідрохінолінілу; 5,6,7,8тетрагідрохіназолін-4-ілу; 1-бензо[b]тіофен-7-ілу; 1-бензо[b]тіофен-4-ілу; 1-бензо[b]тіофен-3-ілу; ізохінолінілу; хіназолінілу; і індан-4-ілу; або Ar є заміщеним фенілом або його енантіомером, або будь-якою його сіллю. В одному з втілень винаходу гетероциклічне кільце Het має зв'язок з рештою молекули на одному з атомів нітрогену кільця. Прикладами таких гетероциклічних кілець є, як варіант, заміщений 1,4-діокса-8-азаспіро[4,5]декан; як варіант, заміщений піперидин, як варіант, заміщений азепан; як варіант, заміщений піролідин; як варіант, заміщений морфолін; як варіант, заміщений оксазепан; як варіант, заміщений тіоморфолін; як варіант, заміщений тіазепан; і, як варіант, заміщений піперазин. 9 В інших втіленнях винаходу Het є піперидином, як варіант, заміщеним гідрокси, гідроксиалкілом, оксо, метилтіо, метилсульфінілом, метилсульфонілом, ціано, 1,3діоксолан-2-ілом, С1-С4 алкокси, аміно, як варіант, моно або дизаміщеним С1-С4алкілом, С3С4циклоалкілом, С1-С4алкенілом, С2-С4алкініл, ациламіно, як варіант, N-заміщеним С1-С4алкілом, С3-С4циклоалкілом, С2-С4алкенілом, С1С4алкінілом, (С1-С4алкілсульсроніл)аміно, як варіант, N-заміщеним С1-С4алкілом, С3С4циклоалкілом, С1-С4алкенілом, С1-С4алкінілом, одним або двома атомами флуору або дизаміщеним С1-С4алкілом і гідрокси; піролідином, як варіант, заміщеним у трьох позиціях флуором, гідрокси або оксо; морфоліном або тіоморфоліном, як варіант, заміщеним на атомі сульфуру одним або двома оксигенами; або піперазином, як варіант, заміщеним на 4-атомі нітрогену С1-С4алкілом. Аr, як варіант, може бути заміщена на одному або більше атомах карбону однією або більше групами, незалежно вибраними з ціано, галогену, С1-С4алкілу, С3-С4циклоалкілу, С2-С4алкенілу, С2С4алкінілу, С1-С4алкокси, нітро, трифлуорметокси, дифлуорметокси, трифлуорметилу, С1С4алкілсульфінілу, С1-С4алкілсульфонілу, С1С4алкілтіо, трифлуорметилсульфонілокси, С1С4алкілсульфонілу або С 1-С4ацилу. В одному з втілень винаходу Ar є фенілом, заміщеним однією або більше групами, незалежно вибраними з ціано, галогену, С1-С4алкілу, С3С4циклоалкілу, С2-С4алкенілу, С2-С4алкінілу, С1С4алкокси, нітро, трифлуорметокси, дифлуорметокси, C1-С4алкілсульфінілу, С1С4алкілсульфонілу, С1-С4алкілтіо, трифлуорметилсульфонілокси, С1С4алкілсульфонілу або С 1-С4ацилу. В одному з втілень винаходу Ar є фенілом, заміщеним у 3-й і 5-й позиціях групами, незалежно вибраними з галогену, С1-С4алкілу, С1-С4алкокси, ціано і нітро. Як варіант, Ar може бути додатково заміщена у 2-й і/або 4-й позиціях групою, незалежно вибраною з галогену, С1-С4алкілу і С1С4алкокси. В одному з втілень винаходу R1 є гідрогеном.: В одному з втілень винаходу, R2 і R3 є обидві хлором або одна є флуором, а інша гідрогеном. В іншому втіленні винаходу, R2 і R3 є обидві хлором і приєднані у 3-й і 4-й позиціях фенільного кільця, або R2 є флуором, приєднаним у 4-й позиції, a R3 є гідрогеном. В одному з втілень винаходу R4 є метилом. В одному з втілень винаходу сполука формули І є S-енантіомером або рацематом. В іншому втілені сполука формули І є S-енантіомером. В іншому аспекті винахід стосується сполук формули І, в яких Het тіоморфолін, морфолін або оксидотіоморфолін; R1 - H; R2 - флуор, a R3 - гідроген, причому флуор знаходиться, бажано, у пара-позиції; Ar - 3-ціано-5,6,7,8-тетрагідро-1-нафтил; і R4 визначена вище. 82518 10 У ще одному втіленні винахід включає такі сполуки: 3,5-дихлор-N-(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-Nметилбензамід; 3,5-дибром-N-[(2S)-2-(4-флуорфеніл)-4-{3морфолін-4-ілацетидин-1-іл)бутил]-Nметилбензамід; N-[(2S)-2-(3,4-дихлорфеніл)-4-(3-тіоморфолін4-ілацетидин-1-іл)бутил]-3,5-дифлуор-Nметилбензамід; N-[(2S)-2-(3,4-дихлорфеніл)-4-(3-тіоморфолін4-ілацетидин-1-іл)бутил]-N-метил-3,5біс(трифлуорметил)бензамід; 5-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-N-метил-1бензотіофен-7-карбоксамід; 3-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-Nметилбензамід; 3-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-N-метил5,6,7,8-тетрагідронафталін-1-карбоксамід; 2-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4-{3тіоморфолін-4-ілацетидин-1-іл)бутил]-Nметилхінолін-4-карбоксамід; 3-ціано-N-[2-(4-флуорфеніл)-4-(3-тіоморфолін4-ілацетидин-1-іл)бутил]-N-метил-5,6,7,8тетрагідронафталін-1-карбоксамід; N-[2-(4-флуорфеніл)-4-(3-тіоморфолін-4ілацетидин-1-іл)бутил]-N-метил-3,5біс(трифлуорметил)бензамід; 7-хлор-N-[(2S)-2-(3,4-дихпорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-N-метил-2,3дигідро-1,4-бензодіоксин-5-карбоксамід; N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил}-2метокси-N-метилхінолвн-4-карбоксамід; 3-флуор-N-[(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]-N-метил-5(трифлуорметил)бензамід; 3-ціано-N-{2-(4-флуорфеніл)-4-[3-(4гідроксипіперидин-1-іл)ацетидин-1-іл]бутил}-Nметил-5,6,7,8-тетрагідронафталін-1-карбоксамід; N-[4-[3-(1,4-діокса-8-азаспіро[4,5]дек-8іл)ацетидин-1-іл]-2-(4-флуорфеніл)бутил]-N-метил3,5-біс(трифлуорметил)бензамід; N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(4флуорпіперидин-1-іл)ацетидин-1-іл]бутил}-Nметил-3,5-біс(трифлуорметил)бензамід; N-{(2S)-2-(3,4-дихлорфеніл)-4-{3-(4гідроксипіперидин-1-іл)ацетидин-1-іл]бутил}-Nметил-3,5-біс(трифлуорметил)бензамід; 3-ціано-N-4(2S)-2-(3,4-дихлорфеніл)-4-[3-(3гідроксипіролідин-1-іл)ацетидин-1-іл)бутил]-Nметил-1-нафтамід; N-{(2S)-2-(4-флуорфеніл)-4-[3-(4флуорпіперидин-1-іл)ацетидин-1-іл]бутил]}-Nметил-3,5-біс(трифлуорметил)бензамід; 3-цiано-N-[(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-тацетидин-1-іл)бутил}-N-метил5,6,7,8-тетрагідронафталін-1-карбоксамід; N-{(2S)-2-(4-флуорфеніл)-4-[3-(4гідроксипіперіадин-1-іл)ацетидин-1-іл]бутил}-Nметил-3,5-біс(трифлуорметил)бензамід; 11 3,5-дихлор-N-[(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]-Nметилбензамід; 3-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]-N-метил-1нафтамід; 3-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-N-метил-1нафтамід; 3-ціано-N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(1)4діокса-8-азаспіро[4,5]дек-8-іл)ацетидин-1 іл]бутил}-N-метил-1-нафтамід; 3-ціано-N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(4гідроксипіперидин-1-іл)ацетидин-1-іл)бутил-1-Nметил-1-нафтамід; 3-цiaнo-N-[2-(4-флyopфeнiл)-4-(3-тioмopфoлiн4-iлaцeтидин-1-iл]бyтил]-N-мeтил-1-нафтамід; 3-ціано-N-[2-{4-ціанофеніл)-4-(3-тіоморфолін4-ілацетидин-1-іл)бутил]-N-метил-1-нафтамід; 3-ціано-N-{(2S)-2-(3,4-дифлуорфеніл)-4-[3-(1,1діоксидотіоморфолін-4-іл)ацетидин-1-іл]бутил}-Nметил-1-нафтамід; 3-ціано-N-{(2S)-2-(4-флуорфеніл)-4-[3-(4гідроксипіперидин-1-іл)ацетидин-1-іл)бутил}-Nметил-5,6,7,8-тетрагідронафталін-1-карбоксамід; 3-ціано-N'-етил-N-[(2S)-2-(4-флуорфеніл)-4-(3морфоліні-4-ілацетидин-1-іл)бутил]-5,6,7,8тетрагідронафталін-1-карбоксамід; 3-ціано-N-[(2S)-4-[3-(1,4-діокса-8азаспіро[4,5]дек-8-іл)ацетидин-1-іл]-2-(4флуорфеніл)бутил]-N-метил-5,6,7,8тетрагідронафталін-1-карбоксамід; 3-ціано-N-[(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]-N-метил-1 нафтамід; 3-ціано-N-{(2S)-2-(4-флуорфеніл)-4-[3-(1,4оксазепан-4-іл)ацетидин-1-іл]бутил}-N-метил5,6,7,8-тетрагідронафталін-1-карбоксамід; 3-флуор-N-[(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]-N-метил5,6,7,8-тетрагідронафталін-1-карбоксамід; 3,5-дибром-N-{(2S)-2-(4-флуорфеніл)-4-[3-(4гідроксипіперидин-1-іл)ацетидин-1-іл)бутил}-Nметилбензамід; 3-бром-N-[(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-іл)ацетидин-1-іл)бутил]-5-йодо-Nметилбензамід; 3-ціано-N-[2-(4-флуор-2-метилфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]-N-метил5,6,7,8-тетрагідронафталін-1-карбоксамід; 6-ціано-N-[(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]-N-метиліндан4-карбоксамід; 3-ціано-N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил}-Nметил-1-карбоксамід; 3-ціано-N-{2-(4-ціанофеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил}-Nметил-1-нафтамід; 3,5-дихлор-N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил]-Nметилбензамід; N-[(2S)-2-(3,4-дихлорфеніл)-4-(3оксидотіоморфолін-4-ілацетидин-1-іл)бутил]-Nметил-3,5-біс(трифлуорметил)бензамід; 82518 12 3-ціано-N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил}-Nметил-5,6,7,8-тетрагідронафталін-1-карбоксамід; 3-ціано-N-{2-(4-флуорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил}-Nметил-1-нафтамід; 3-ціано-N-{2-(4-флуорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацедитин-1-іл]бутил}-Nметил-5,6,7,8-тетрагідронафталін-1-карбоксамід; N-{2-(4-флуорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил}-Nметил-3,5-біс(трифлуорметил)бензамід; 3-ціано-N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(4оксопіперидин-1-іл)ацетидин-1-іл]бутил}-N-метил1-нафтамід; N-{2-(4-флуорфеніл)-4-[3-(4-оксопіперидин-1іл)ацетидин-1-іл]бутил}-N-метил-3,5біс(трифлуорметил)бензамід; 3-ціано-N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(4флуорпіперидин-2-іл)ацетидин-1-іл]бутил}-Nметил-1-нафтамід; 3-ціано-N-{2-(4-флуорфеніл)-4-[3-(4флуорпіперидин-1-іл)ацетидин-1-іл]бутил}-Nметил-5,6,7,8-тетрагідронафталін-1-карбоксамід; 3-ціано-N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(4метилпіперазин-1-іл)ацетидин-1-іл]бутил}-Nметил-1-нафтамід; N-[(2S)-4-[3-(4-Ацетилпіперазин-1-іл)ацетидин1-іл]-2-{3,4-дихлорфеніл)бутил]-3-ціано-N-метил-1нафтамід; 3-ціано-N-[(2S)-4-[3-(4-ціанопіперидин-1іл)ацетидин-1-іл]-2-(3,4-дихлорфеніл)бутил]-Nметил-1-нафтамід; або їх енантіомери, або будь-які солі. Винахід стосується використання сполук формули I 1 визначених вище, і їх солей. Солями, придатними для використання у фармацевтичних композиціях є фармацевтично прийнятні соли, хоча у виготовленні сполук формули І можуть бути використані і інші солі. Сполуки винаходу можуть утворювати солі з різними неорганічними і органічними кислотами, і винахід включає такі солі. Приклади таких кислотоадитивних кислот є ацетат, адипат, аскорбат, бензоат, бензолсульфонат, бісульфат, бутират, камфорат, камфорсульфонат, цитрат, циклогексилсульфамат, етансульфонат, фумарат, глютамат, гліколат, гемісульфат, 2гідроксиетилсульфонат, гептаноат, гексаноат, гідрохлорид, гідробромід, гідройодид, гідроксималеат, лактати, малат, малеат, метансульфонат, 2-нафталінсульфонат, нітрат, оксалат, пальмоат, персульфат, феніласетат, фосфат, пікрат, півалат, пропіонат, хінат, саліцилат, стеарат, сукцинат, сульфамат, сульфанілат, сульфат, тартрат, тозилат (ртолуолсульфонат) і ундеканоат. Бажаними є нетоксичні фізіологічно прийнятні солі, хоча можуть бути використані і інші солі, наприклад, Фармацевтично прийнятні солі можна приготувати з відповідних кислот відомими для ізолювання і очищення продуктів. методами. Фармацевтично неприйнятні солі можна використовувати як інтермедіати і такі солі також включені у винахід. Кислотоадитивні солі можуть мати форму 13 полімерних солей, наприклад, полімерних сульфонатів. Солі можна утворювати звичайними методами, наприклад, реакцією продукту у формі вільної основи з одним або більше еквівалентами відповідної кислоти у розчині або середовищі, в якому ця сіль є нерозчинною, наприклад, у воді, яку видаляють у вакуумі або виморожуванням або іонообміном аніонами даної солі з іншим аніоном на придатній іонообмінній смолі. Сполуки формули І мають один або більше хіральних центрів, і винахід включає всі оптичні ізомери, енантіомери і діастереомери. Сполуки формули (І) можуть існувати у формі одиночних стереоізомерів, тобто одиночних енантіомерів (Rабо S-енантіомерів) і/або діастереомерів. Сполуки формули (І) можуть мати форму рацемічної суміші, тобто еквімолярної суміші енантіомерів. Винахід також включає будь-які і всі таутомерні форми сполук формули І. Деякі сполуки можуть існувати як суміш конформаційних ізомерів. Сполуки винаходу включають як суміші, так і індивідуальні конформаційні ізомери. Далі наведено визначення термінів, використаних в описі і Формулі винаходу. Якщо у даному описі якась з груп характеризована як "визначена раніше" або "раніше визначена", це означає, що зазначена група включає перше визначення і ширші визначення, а також кожне і всі бажані визначення цієї Якщо не визначено інше, термін "алкіл" групи. включає лінійні і розгалужені ланцюгові алкільні групи, наприклад, метил, етил, n-пропіл, і-пропіл, n-бутил, і-бутил, s-бутил або t-бутил. Один або більше атомів гідрогену алкільної групи можуть бути заміщені атомом флуору, як, наприклад, у дифлуорметилі або трифлуорметилі. С3-С4циклоалкіл є циклічним алкілом, наприклад, циклопропілом або циклобутилом. Циклоалкіл може бути ненасиченим. Один або більше атомів гідрогену циклоалкільної групи можуть бути заміщені атомом флуору. С2-С4алкеніл є лінійною або розгалуженою алкенільною групою, наприклад, вінілом. Один або більше атомів гідрогену алкенільної групи можуть бути заміщені атомом флуору. С2-С4алкініл є лінійною або розгалуженою алкінільною групою, наприклад, етинілом. Один або більше атомів гідрогену алкінільної групи можуть бути заміщені атомом флуору. С1-С4гідроксиалкіл є гідроксиалкільною групою, яка має 1-4 атоми карбону і гідроксильну групу. Один або більше атомів гідрогену гідроксиалкільної групи можуть бути заміщені атомом флуору. Термін "алкокси", якщо не визначено інше, включає С1-С4алкоксигрупи, наприклад, метокси, етокси, n-пропокси, і-пропокси, n-бутокси, ібутокси, s-бутокси або t-бутокси. Один або більше атомів гідрогену алкоксигрупи можуть бути заміщені атомом флуору. Термін "алкілтіо", якщо не визначено інше, включає С1-С4алкілтіогрупи, наприклад, метилтіо, етилтіо, n-пропілтіо, і-пропілтіо, n-бутилтіо, ібутилтіо, s-бутилтіо або t-бутилтіо. Один або 82518 14 більше атомів гідрогену алкілтіогрупи можуть бути заміщені атомом флуору. Якщо не визначено інше, термін "галоген" включає хлор, бром, флуор і йод. У цьому описі, якщо не визначено інше, термін "алкілсульфоніл" включає С1-С4алкілсульфонільні групи, наприклад, метилсульфоніл, етилсульфоніл, n-пропілсульфоніл, іпропілсульфоніл, n-бутилсульфоніл, ібутилсульфоніл, s-бутилсульфоніл або tбутилсульфоніл. Якщо не визначено інше, термін "алкілсульфініл" включає С1-С4алкілсульфінільні групи, наприклад, метилсульфініл, етилсульфініл, n-пропілсульфініл, і-пропілсульфініл, nбутилсульфініл, і-бутилсульфініл, sбутилсульфініл або t-бутилсульфініл. Якщо не визначено інше, термін "ацил" включає С1-С4ацильні групи, наприклад, форміл, ацетил, пропіоніл, бутурил і ізобутурил. Термін "вільна основа" означає сполуку у нейтральній формі, тобто не сіль цієї сполуки. Фармацевтичні рецептури Згідно з одним з аспектів, винахід включає фармацевтичну рецептуру, яка включає сполуку формули І як одиночний енантіомер, рацемат або їх суміші як вільну основу, або її фармацевтично прийнятні солі, і яка призначена для профілактики і/або лікування респіраторних, серцево-судинних, неврологічних, болісних, онкологічних, запальних і/або шлунково-кишкових розладів. Фармацевтичні композиції згідно з винаходом можна вводити пацієнту стандартними шляхами згідно з захворюванням, яке потребує лікування, наприклад, перорально, локально, парентерально, букально, через ніс, вагінально або ректально, або інгаляцією, або інсуфляцією. Для цього сполуки згідно з винаходом можуть бути введені у рецептури, які можуть мати форму, наприклад, таблеток, гранул, капсул, водних або олійних розчинів, суспензій, емульсій, кремів, мазей, желе, носових аерозолів, супозиторіїв, тонкоподрібнених порошків або аерозолів, або розпилювачів для інгаляції, і для парентерального застосування (включаючи внутрішньовенне, внутрішньом'язове або інфузією) стерильні водні або олійні розчини або суспензії, або стерильні емульсії. Крім сполук винаходу, фармацевтична композиція згідно з винаходом може також містити або вводитись сумісно (одночасно або послідовно) з одним або більше фармакологічними агентів, придатних для лікування одного або більше згаданих тут хворобливих станів. Фармацевтичні композиції згідно з винаходом можна вводити людині денними дозами від 0,01 до 25мг/кг маси тіла (бажано, від 0,1 до 5мг/кг маси тіла). Цю денну дозу можна вводити частковими дозами. Точна доза і спосіб введення пацієнту залежать від маси, віку і статі пацієнта і від конкретного захворювання, згідно з принципами, прийнятими у галузі. Звичайно одиничні дозовані форми містять приблизно від 1мг до 500мг сполуки винаходу, наприклад, таблетка або капсула для перорального введення може містити до 250мг 15 (звичайно 5-100мг) сполуки формули (І) або її фармацевтично прийнятної солі. При введенні інгаляцією сполуки формули (І) або її фармацевтично прийнятної солі денна доза становить 5-100мг, одиночною дозою, або частинами денної дози, розділеної на 2-4 частини. При введенні внутрішньовенною або внутрішньо м'язовою ін'єкцією або інфузією стерильний розчин або суспензія може містити до 10% (за масою) (звичайно 5% (за масою)) сполуки формули (І) або її фармацевтично прийнятної солі. Медичне і Фармацевтичне застосування Винахід включає спосіб лікування або профілактики хворобливого стану, коли сприятливим є антагонізм тахикінінів, що діють на рецепторах NK1 і NK2, який включає введення пацієнту ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. Винахід також включає застосування сполуки формули (І) або її фармацевтично прийнятної солі у приготуванні медикаменту, призначеного для використання у випадках, коли сприятливим є антагонізм тахикінінів, що діють на рецепторах NK1 і NK2. Сполуки формули (І) або їх фармацевтично прийнятні солі або сольвати можуть бути використані у виготовленні медикаменту, призначеного для профілактики і/або лікування респіраторних, серцево-судинних, неврологічних, болісних, онкологічних, запальних і/або шлунковокишкових розладів. Прикладами таких розладів є астма, алергічний риніт, легеневі хвороби, кашель, застуда, запалення, хронічна обструктивна легенева хвороба, реактивність дихальних шляхів, головний біль, психози, депресія, тривожність, хвороба Альцгеймера, шизофренія, хвороба Хантингтона, надмоторність міхура, нетримання сечі, розлади вживання їжі, маніакальна депресія, залежність, розлад руху, розлад розпізнавання, ожиріння, стрес, розлад сечовипускання, манія, гіпоманія і агресія, біполярний розлад, рак, карцинома, фіброміалгія, несерцевий грудний біль, шлунково-кишкова гіпермоторність, гастрична астма, хвороба Крона, розлади випорожнення шлунку, виразковий коліт, синдром подразнення кишечнику (IBS), запальна кишкова хвороба, блювання, розлади шлунково-кишкової моторності або гастро-стравоходний рефлюкс (GERD). Фармакологія Трансфекція і культивування клітин для FLJPR і в аналізі на зв'язування Клітини К1 яєчника китайського хом'яка (CHO) (від ATCC) були стабільно трансфектовані рецептором людського NK2 (сДНК hNK2R у pRc/CMV, Invitrogen) або рецептором людського NK3 (hNK3R у рсДНК 3,1/Hygro (+)/IRES/CD8, вектор Invitrogen, модифікований у AstraZeneca EST-Bio UK, Alderley Park). Клітини були транфектовані катіонним ліпідним реагентом LIPOAFECTAMIH™ (Invitrogen) і селекцію виконували за допомогою Geneticin (G418, Invitrogen) при 1мг/мл для клітин, трансфектованих hNKaR і ygromycin (Invitrogen) при 500мкг/мл для клітин, трансфектованих hNKsR. Одиночні клітинні клони збирали за допомогою Fluorescence 82518 16 Activated Cell Sorter (FACS), випробували на функціональність в аналізі FLIPR (див нижче), розповсюджували у культурі і зберігали на холоді для подальшого використання. Клітини CHO стійко трансфектували рецепторами людського NK1 від AstraZeneca R&D, Wilmington USA. сДНК рецептора людського NK1 (від легеневої тканини PHK-PCR) клонували у pRcCMV (Invitrogen). Трансфекцію проводили фосфатом кальцію і селекцію - 1мг/мл G418. Клітини CHO стійко трансфектовані hNK1R, hNK2R і hNK3R культивували у вологому інкубаторі під 5% CO2 у Nut Mix F12 (НАМ) з Glutamax I, 10% сироватки бичачого зародка (F3S), 1% пеніцилін/стрептоміцин (PEST) з доданням 20мкг/мл Geneticin для клітин, що експресують hNK1R і hNK2R, і 500мкг/мл Hygromycin для клітин, що експресують hNK3R. Клітини вирощували у колбах Т175 і пасажували при конфлюенції 70-80% до 20-25 проходів. Оцінювання активності вибраних випробуваних сполук на інгібування людського Активування рецептора NK1/NK2/NK3 (аналіз FLIPR) Активність сполуки винаходу на інгібування активування рецептора NK1/NK2/NK3 як опосередкованого рецептором NK1/NK2/NK3 підвищення міжклітинного Ca2+ оцінювали за такою процедурою: Клітини CHO, стійко трансфектовані рецепторами людського NK1, NK2 або NK3, вносили у 96-коміркові планшети з чорними стінками і прозорим дном (Costar 3904), а саме, 3,5 х 104 клітин на комірку і вирощували протягом приблизно 24 год. у нормальному вирощувальному середовищі при 37°C в інкубаторі у CO2. Перед проведенням аналізу FLIPR до клітин у кожному 96-комірковому планшеті додавали чутливий до Ca2+ забарвлювач Fluo-3 (TEFLABS 0116) при 4мкМ у середовищі, яку складають Nut Mix F12 (НАМ) з Glutamax I, 22мM HEPES, 2,5мM Probenicid (Sigma Р-8761) і 0,04% Pluronic F-127 (Sigma P-2443) і протягом 1 год. витримували у темряві при 37°C в інкубаторі з CO2. Потім клітини промивали тричі в аналітичному буфері (збалансований сольовий розчин Генкса (HBSS)), який містив 20мМ HEPES, 2,5мM Probenicid і 0,1% BSA) за допомогою багатоканальної піпетки, залишаючи їх у 150мкл після останнього промивання. Були поведені автоматичні послідовні розведення випробуваної сполуки в аналітичному буфері (кінцева концентрація DMSO нижче 1%) за допомогою FLIPR (Fluormetric Imaging Plate Reader) у кожній комірці і інтенсивність флуоресценції була зареєстрована (збудження на 488нм і емісія на 530нм) камерою FLIPR CCD протягом 2хвилинного передінкубаційного периоду. За допомогою FLIPR у кожну комірку, що вже містила 200мкл аналітичного буфера (з випробуваною сполукою або носієм), вносили розчин агоніста у кількості 50мкл Субстанції P (специфічної до NK1), NKA (специфічного до NK2) або Pro-7-NKB (специфічного до NK3) (фінальна концентрація приблизно еквівалентна концентрації EC50) і вели постійний моніторинг флуоресценції протягом ще 17 2 хвил. Реакцію виміряли як пік відносної флуоресценції після додання агоніста і IC50 обчислювали на кривій залежності реакції від концентрації для кожної сполуки. Значення IC50 перетворювали у значення рКB за формулою: KB = ІС50/1+(конц. EC60 агоніста, використаного в аналізі/ЕС50 агоніста) рКg = - log KB Визначення константи дисоціації (Ki) сполук для рецепторів людського NK1/NK2/NK3 (аналіз на зв'язування) Мембрани були приготовлені з клітин CHO, стійко трансфектованих рецепторами людського NK1, NK2 або NK3 згідно з наведеним далі методом. Клітини були відділені розчином Accutase®, зібрані у PBS з 5% FBS центрифугою, промиті двічі у PBS і суспендовані до концентрації 1x108 клітин/мл у Tris-HCI 50мМ, KCI 300мМ, EDTA-N2 10мМ, рН 7,4 (4°C). Клітинні суспензії гомогенізували UltraTurrax 30 при 12000об./хвил. Гомогенати були центрифуговані при 38000 х г (4°С) і гранули суспендували у Tris-HCI 50мМ, рН 7,4. Гомогенізацію повторювали і гомогенати інкубували на льоду протягом 45 хвил. Гомогенати знову центрифугували, як було описано, і суспендували у Tris-HCI 50мМ, рН 7,4. Центрифугування повторювали тричі. Після останнього центрифугування гранули ресуспендували у Tris-HCI 50мM і гомогензували у Dual Potter, 10 циклів, до отримання гомогенного розчину; для визначення протеїну були взяті аліквоти. Мембрани аліквотували і заморожували при -80°С до використання. Аналіз на зв'язування радіоліганду проводили при кімнатній температурі у 96-коміркових мікротитрувальних планшетах (No-binding Surface Plates, Corning 3600) з кінцевим об'ємом аналізу 200мкл на комірку в інкубаційному буфері (50мM буфер Tris (рН 7,4, кімнатна температура) з 0,1% BSA, 40мг/л Bacitracin, повністю вільні від EDTA таблетки інгібітору протеази (20табл./л (Roche)) і 3мM MnCI 2). Порівняльні криві зв'язування були отримані доданням з підвищенням додаткових кількостей випробуваної сполуки, які послідовно розчиняли у DMSO до кінцевої концентрації 1,5% в аналізі. Були додані 50мкл неміченого ZD 6021 (неселективний антагоніст NK, кінцева концентрація 10мкМ) для вимірювання неспецифічного зв'язування. Для повного зв'язування були використані 50мкл 1,5% DMSO (у кінцевій концентрації) в інкубаційному буфері. В експериментах на зв'язування на hNK1r була використана [3 H-Sar, Меt(О2)-Субстанція P] (кінцева концентрація 4нМ). В експериментах на зв'язування на hNK2r була використана [3 HSR48968] (кінцева концентрація 3нМ) і в експериментах на зв'язування на hNK3r і 3мкл У DMSO розчиняли 50мкл радіоліганду була випробуваної сполуки, і 47мкл концентрація використана [3H-SR142801] (кінцева інкубаційного буфера змішували з 5-10мкг мембран клітин у 3нМ). 100мкл інкубаційного буфера і інкубували 30 хвил. при кімнатній температурі у мікроплатному шейкері. Мембрани були зібрані швидким фільтруванням на Filtermat B (Wallac), просоченому у 0,1% BSA і 0,3% поліетиленаміні 82518 18 (Sigma P-3143) з використанням Micro 96 Harvester (Skatron instruments, Norway), фільтри промивали збирачем з льодяним промивним буфером (50мM Tris-HCI, рН 7,4, при 4°С, з 3мM MnCI 2) і сушили при 50°C 30-60 хвил. Листи сцинтилятора Meltilex були наплавлені на фільтри з використанням Microsealer (Wallac, Finland) і фільтри були перелічені у p-Liquid Scintillation Counter (1450 Microbeta, Wallac, Finland). Значення Ki для неміченого ліганду було обчислене за рівнянням Cheng-Prusoff (Bio-chem. Pharmacol. 22:3099-3108, 1973): де L концентрація радіоактивного ліганду Kd спорідненість радіоактивного ліганду до рецептора, визначена через насичене зв'язування. Дані підставляли у чотирипараметричне рівняння, використовуючи Excel Fit. Ki = IC50/(1+(L/Kd). Результати Взагалі випробувані сполуки винаходу показали статистично значущу антагоністичну активність на рецепторі NK1 в інтервалі 7-9 для рКB. Для рецептора NK2 інтервал для рКB становив 7-9. Антагоністічна активність на рецепторі NK3 була менше 7,5 для рКB. Взагалі випробувані сполуки винаходу показали статистично значуще інгібування CYP3A4 на низькому рівні. Значення IC50 перевіряли згідно з Варіrо et al; Drug Metab. Dispos. 29, 30-35 (2001) і вони взагалі перевищували 2мкМ. сполуки згідно з винаходом Отже, випробувані показали селективний і подвійний антагонізм до рецептора NK1/NK2 і низький рівень інгібування CYP3A4. Біологічні оцінки Смикання лап піщанки (Тест-модель для NK1) Самці монгольської піщанки (60-80г) були придбані від Charles River, Germany. Після прибуття вони були розміщені групами по 10 у приміщеннях з контрольованими вологістю і температурою і отримували їжу і воду без обмежень. Акліматизація продовжувалась 7 днів. Кожну тварину використовували одноразово, після чого вбивали проколюванням серця або ін'єкцією смертельної дози пентобарбіталу натрію. Піщанок анестезують ізофлураном. Внутрішньовенно, внутрішньочеревно і підшкірно вводять потенційно здатні проникати у ЦНС антагоністи рецептора NK1. Сполуки вводять у різні моменти часу (звичайно 30-120 хвил.) перед стимуляцією агоністом. Піщанок анестезують ізофлуораном і роблять невеликі надрізи на шкірі над брегмою. Шприцом Гамільтона з голкою довжиною 4мм підшкірно вводять 10пмоль ASMSP, селективного агоніста рецептора NK1. Ранку закривають і тварину переносять у невелику пластмасову клітку і залишають прокинутись. Клітку ставлять на пластмасову трубку з водою і через датчик тиску під'єднують комп'ютер і реєструють кількість смикань задніх лап. кульок (тест-модель для NK2) Вихід Фекальних Дію in vivo (на NK2) сполук формули І можна визначити вимірюванням виходу фекальних кульок у піщанки, викликаного агоністом рецептора NK2 (див., наприклад, The Journal of 19 82518 20 Pharmacology i Experimental Therapeutics (2001) 559-564). Згідно з іншим аспектом, винахід включає спосіб приготування сполуки формули (І) або її солей, який включає: a) реакцію сполуки формули (III) з сполукою формули (IV): де R1-R4, Het і Ar є такими, що були визначені вище, в таких умовах, що відновлювальне алкілування сполук формули (III) створює N-Cзв'язок між атомом нітрогену ацетидинової групи сполук формули (III) і атомом карбону альдегідної групи сполук формули (І); або b) реакцію сполуки формули (III) з сполукою формули (V): де R1-R4, Het і Ar є такими, що були визначені вище; a L є такою групою, що алкілування сполук формули (III) створює N-C-зв'язок між атомом нітрогену ацетидинової групи сполук формули (III) і атомом карбону сполук формули (V), який є суміжним до групи L; або с) реакцію сполуки формули (Vl) з сполукою формули (VII): де R1-R4, Het і Ar є такими, що були визначені вище; a L є відщеплюваною групою; причому будьяка інша функціональна група, якщо необхідно, є захищеною, і: і) видалення будь-яких захисних груп; іі) як варіант, окислення будь-якого придатного для цього атома; ііі) як варіант, утворення фармацевтично прийнятної солі. Захисні групи взагалі можуть бути будь-якими з груп, описаних у літературі, або відомих фахівцям. Вони можуть бути введені і видалені звичайними методами (див., наприклад, Protecting Groups in Organic Chemistry; Theodora W. Greene). Методи видалення вибирають такими, щоб це видалення створювало мінімум впливу на інші групи молекули. Деякі необов'язкові замісники у сполуках формули (І) можуть бути введені через стандартні реакції ароматичного заміщення або створені через модифікування звичайних функціональних груп перед або негайно після описаних вище процедур. Реагенти і реакційні умови для таких процедур добре відомі фахівцям. Сполуки формули (III) і (IV) реагують в умовах відновлювального алкілування. Реакцію звичайно проводять при помірних температурах, наприклад, 0-100°C, у суттєво інертному розчині, наприклад, ДХМ. Типові відновлювапьні агенти включають боргідриди, наприклад, ціаноборгідрид натрію. Сполуки формул (III) і (V) реагують в умовах алкілування. Звичайно у сполуках формули (V) L є відщеплюваною групою, наприклад, галогеном або алкілсульфонілокси. Реакцію звичайно проводять при підвищеній температурі, наприклад, 30-130°C, у суттєво інертному розчиннику, наприклад, DMP. Сполуки формули (III) є відомими або можуть бути приготовлені відомими методами. Сполуки формули (IV) можна приготувати, наприклад, через реакцію сполуки формули (VII) з сполукою формули (VIII): 21 де R1-R4 є такими, що були визначені вище, у звичайних умовах ацилювання. Сполуки формули (V) можна приготувати, наприклад, реакцією сполуки формули (VII) з сполукою формули (IX): де R1-R4 і L є такими, що були визначені вище, у звичайних умовах ацилювання. Сполуки формул (Vl) і (VII) можуть реагувати у звичайних умовах ацилювання, причому є кислотою або активованою кислотною похідною. Такі похідні добре відомі з літератури. Вони можуть бути утворені in situ з кислоти або приготовлені, ізольовані і введені у реакцію. L' є звичайно хлором і тому утворює кислотний хлорид. Звичайно реакцію ацилювання проводять у присутності ненуклеофільної основи, наприклад, N,N-діізопропілетиламіну, у суттєво інертному розчиннику, наприклад, ДХМ при помірній температурі. формули (VIII) і (IX) є відомими або Сполуки можуть бути приготовлені відомими методами. Деякі сполуки формул (III), (IV), (V), (Vl), (VII), (VIII) і (IX) є новими і входять в об'єм винаходу. Отже, іншим аспектом винаходу є інтермедіати: [(2S)-2-(3,4-дихлорфеніл)-4-(3-тіоморфолін-4ілацетидин-1-іл)бутил]метиламін; [(2S)-2-(3,4-дихлорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил]метиламін; [2-(4-флуорфеніл)-4-(3-тіоморфолін-4ілацетидин-1-іл)бутил]метиламін; [(2S)-2-(4-флуорфеніл)-4-(3-морфолін-4ілацетидин-1-іл)бутил]метиламін; 1-{1-[3 -(4-флуорфеніл)-4(метиламіно)бутил]ацетидин-3-іл} піперидин-4-ол; [4-[3-(1,4-діокса-8-азаспіро[4,5]дек-8іл)ацетидин-1-іл]-2-(4-флуорфеніл)бутил] 82518 22 метиламін; {(2S)-2-(3,4-дихлорфеніл)-4-[3-(4флуорпіперидин-1-іл)ацетидин-3іл]бутил}метиламін; 1-(1-[(3S)-3-(3,4-дихлорфеніл)-4(метиламіно)бутил]ацетидин-3-іл}піперидин-4-ол; 1-[(3S)-4-[(3-ціано-1-нафтоїл)(метил)аміно]-3(3,4-дихлорфеніл)бутил]ацетидин-3-іл; 3-ціано-N-[2-(4-флуорфеніл)-4-оксобутил]-Nметил-1-нафтамід; 3-ціано-N-[2-(4-ціанофеніл)-4-оксобутил]-Nметил-1-нафтамід; 3-ціано-N-[(2S)-2-(4-флуорфеніл)-4-оксобутил]N-метил-5,6,7,8-тетрагідронафталін-1карбоксамід; 3,5-дихлор-N-[(2S)-2-(4-флуорфеніл)-4оксобутил]-N-метилбензамід; 3-ціано-N-етил-N-[(2S)-2-(4-флуорфеніл)-4оксобутил]-5,6,7,8-тетрагідронафталін-1карбоксамід; 3-ц!ано-N-[(2S)-2-(4-флуорфеніл)-4оксобутил]-N-метил-1-нафтамід: 3,5-дибром-N-[(2S)-2-(4-флуорфеніл)-4оксобутил]-N-метилбензамід; 3-бром-N-[(2S)-2-(4-флуорфеніл)-4-оксобутил]5-йод-N-метилбензамід; 3-ціано-N-[2-(4-флуор-2-метилфеніл)-4оксобутил]-N-метил-5,6,7,8-тетрагідронафталін-1карбоксамід; 6-ціано-N-[(2S)-2-(4-флуорфеніл)-4-оксобутил]N-метиліндан-4-карбоксамід; 3-флуор-N-[(2S)-2-(4-флуорфеніл)-4оксобутил]-N-метил-5,6,7,8-тетрагідронафталін-1карбоксамід; або їх енантіомери, або будь-які солі. ПРИКЛАДИ Слід зауважити, що сполуки винаходу найчастіше мають дуже складні спектри ЯМР завдяки існуванню конформаційних ізомерів. Вважається, що це є результатом повільного повертання навколо амідного і/або арильного зв'язка. В описі спектра ЯМР застосовані такі абревіатури: s - синглет; d - дублет; t - триплет; qt квартет; qn - квінтет; m - мультиплет; b - широкий; cm - комплексний мультиплет, який може включати наведено приклади, які, не обмежуючи, Далі широкі піки. ілюструють винахід. Абревіатури: DCC - (1,3-Дициклогексилкарбодіімід), DIPEA - N,N-діізопропілетиламіну, ДМФ - (N,N-диметилформамід), TBTU тетрафлуорборат N,N,N’,N’тетраметил-O-(бензотриазол-1-іл)уронію, NMO - (4-метилморфолін-N-оксид) і ТГФ - тетрагідрофуран. Приклад 1 Ацетат 3,5-дихлор-N-[(2S-2-(3,4-дихлорфеніл)4-(3-тіоморфолін-4-ілацетидин)-1-іл)бутил]-Nметилбензаміду 23 Гідрохлорид [(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-метил-аміну (див. Метод 1; 89мг, 0,21ммоль) розчиняють у ДМФ (2мл) і до розчину додають 3,5дихлорбензойну кислоту (44мг, 0,23ммоль), TBTU (80мг, 0,25ммоль) і DIPEA (108мг, 0,84ммоль). Розчин перемішують при кімнатній температурі 1,5 год., розбавляють водою і нейтралізують доданням NaHCO3. Суміш екстрагують двічі етилацетатом і об'єднані органічні розчини сушать над MgSO4. Розчинник видаляють випарюванням, отримуючи 79мг сирого продукту, який очищають зворотно-фазовою хроматографією, використовуючи суміш ацетонітрилу і 0,1М водн. ацетату амонію. Вихід - 43мг (37%) зазначеної сполуки як білої твердої речовини. 1 H ЯМР (500MГц, CD3CN): 1,3-1,8 (cm, 3H), 2,0-4,6 (cm, 23Н), 6,8-7,7 (cm, 5Н), 8,0 (d, 1H); LCMS: m/z 560 (М+1)+. Приклад 2 Дигідрохлорид 3,5-дибром-N-[(2S)-2-(4флуорфеніл)-4-(3-морфолін-4-ілацетидин-1іл)бутил]-N-метиламіду Дигідрохлорид [(2S)-2-(флуорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]метиламіну (див. Метод 4; 292мг, 0,68ммоль), 3,5дибромбензойну кислоту (215мг, 0,77ммоль) і DIPEA (350мг, 2,71ммоль) розчиняють у ДМФ (20мл) і до розчину додають TBTU (250мг, 0,78ммоль) при 0°C. Суміш перемішують при кімнатній температурі 2 год. і розчинник видаляють випарюванням. Залишок розбавляють етилацетатом і потім промивають тричі водним розчином NaHCO3. Органічні розчини об'єднують з іншим препаратом зазначеної сполуки (вільної основи), приготовленим таким же методом (68мг). Об'єднані органічні розчини сушать над MgSO4 і розчинник видаляють випарюванням, отримуючи 344мг. Продукт очищають зворотно-фазовою хроматографією, використовуючи суміш ацетонітрилу і 0,1M водн. ацетату амонію. Зібрані фракції сушать виморожуванням і залишок розчиняють у суміші води і ацетонітрилу. Розчин підкислюють гідрохлорною кислотою (2M) і знову сушать виморожуванням. Вихід - 267мг (55%) зазначеної сполуки як сірої твердої речовини. 1H ЯМР (500MГц, CD3OD): 1,8-2,1 (cm, 2H), 2,7-4,8 82518 24 (cm, 21 H), 6,9-7,8 (cm, 7Н); LCMS: m/z 584 (М+1)+. Приклади 3-18 Ці сполуки (див. табл.) синтезують, як це описано у Прикладах 1 і 2, використовуючи відповідні амінові і кислотні інтермедіати: Ацетат N-[(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-3,5дифлуор-N-метилбензаміду (Приклад 3), ацетат N[(2S)-2-(3,4-дихлорфеніл)-4-(3-тіоморфолін-4ілацетидин-1-іл)бутил]-N-метил-3,5біс(трифлуорметил)бензаміду (Приклад 4), ацетат 5-ціанол-N-[(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутилі-N-метил-1бензотіофен-7-карбоксаміду (Приклад 5), ацетат 3ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-Nметилбензаміду (Приклад 6), ацетат 3-ціаноN[(2S)-2-(3,4-дихлорфеніл)-4-(3-тіоморфолін-4ілацетидин-1-іл)бутил]-N-метил-5,6,7,8тетрагідронафталін-1-карбоксаміду (Приклад 7), ацетат 2-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-Nметилхінолін-4-карбоксаміду (Приклад 8), діацетат 3-ціано-N-[2-(4-флуорфеніл)-4-(3-тіоморфолін-4ілацетидин-1-іл)бутил]-N-метил-5,6,7,8тетрагідронафталін-1-карбоксаміду (Приклад 9), діацетат N-[2-(4-флуорфеніл)-4-(3-тіоморфолін-4ілацетидин-4-іл)бутіл]-N-метил-3,5біс(трифлуорметил}бензаміду (Приклад 10), ацетат 7-хлор-N-[(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-N-метил-2,3дигідро-1,4-бензодіоксин-5-карбоксаміду (Приклад 11), N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил}-2метокси-N-метилхінолін-4-карбоксамід (Приклад 12), 3-флуор-N-[(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]-N-метил-5(трифлуорметил)бензамід (Приклад 13), ацетат 3ціано-N-{2-(4-флуорфеніл)-4-[3-(4гідроксипіперидин-1-іл)ацетидин-1-іл]бутил}-Nметил-5,6,7,8-тетрагідронафталін-1-карбоксаміду (Приклад 14), N-[4-[3-(1,4-діокса-8-азаспіро[4,5]дек8-іл)ацетидин-1-іл]-2-(4-флуорфеніл)бутил]-Nметил-3,5-біс(трифлуорметил)бензамід (Приклад 15), N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(4флуорпіперидин-1-іл)ацетидин-1-іл]бутил}-Nметил-3,5-біс-(трифлуорметил)бензамід (Приклад 16), діацетат N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(4гідроксипіперидин-1-іл)ацетидин-1-іл]бутил}-Nметил-3,5-біс(трифлуорметил)бензаміду (Приклад 17). Амінові і кислотні інтермедіати, використані у прикладах, є часто комерційно доступними і описані у згаданих Методах (Мет.) або у документах: Приклад 3 (див. Мет. 1), Приклад 4 (див. Мет. 1), Приклад 5 (див. Мет. 1 і Мет. 9), Приклад 6 (див. Мет. 1), Приклад 7 (див. Мет. 1 і WO 00/34243), Приклад 8 (див. Мет. 1 і J Prakt Chem; 1902; 264), Приклад 9 (див. Мет. З і WO 00/34243), Приклад 10 (див. Мет. 3), Приклад 11 (див. Мет. 1 і Мет. 10), Приклад 12 (див. Мет. 2 і J Med Chem; 1992: 4893), Приклад 13 (див. Мет. 4), Приклад 14 (Мет. 5 і WO 00/34243), Приклад 15 (див. Мет. 6), Приклад 16 (див. Мет. 7) і Приклад 17 (див. Мет. S). 25 82518 26 27 82518 28 Приклад 18 Ацетат 3-ціано-N-{(2S)-2-(3,4-дихлорфеніл)-4[3-(3-гідроксипіролідин-1-іл)ацетидин-1-іл]бутил)N-метил-1-нафтаміду 3-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4оксобутил]-N-метил-1-нафтамід (див. WO 00/02859; 38мг, 0,089ммоль) розчиняють у CH2CI 2 29 (3мл) і до розчину додають дигідрохлорид 1ацетидин-3-ілпіролідин-3-олу (див. Метод 12; 20мг, 0,093ммоль), розчинений у декількох краплях метанолу. Додають триацетоксиборгідрид натрію (25мг, 0,118ммоль) і розчин перемішують при кімнатній температурі протягом ночі. Суміш розбавляють CH2O2, промивають розсолом і сушать над MgSO4. Розчин видаляють випарюванням і залишок хроматографують на зворотно-фазовій колонці, використовуючи суміш ацетонітрилу і 0,1M водн. ацетату амонію. Вихід 19мг (35%) зазначеної сполуки як білої твердої речовини. 1H ЯМР (400MГц, CD3OD): 0,8-4,9 (cm, 25Н), 6,4-7,9 (cm, 7Н), 7,9-8,1 (m, 1H), 8,4 (s, 1H); LCMS: m/z 551(M+1)+. Приклад 19 N-{(2S)-2-(4-флуорфеніл)-4-[3-(4флуорпіперидин-1-іл)ацетидин-1-іл]бутил}-Nметил-3,5-біс(трифлуорметил)бензамід N-[(2S)-2-(4-флуорфеніл)-4-оксобутил]-Nметил-3,5-біс(трифлуорметил)бензамід (див. Метод 20; 189мг, 0,43ммоль), дигідрохлорид 1ацетидин-3-іл-4-флуорпіперидину (див. WO 97/27185; 139мг, 0,56ммоль) і триетиламін (154мг, 1,52ммоль) розчиняють у метанолі (10мл). Додають метанольний розчин (5мл) ціаноборгідриду натрію (191мг, 3,04ммоль) і хлорид цинку (178мг, 1,30ммоль) і суміш перемішують при кімнатній температурі 20 хвил. Розчинник видаляють випарюванням і залишок розподіляють між водою і етилацетатом. Органічний розчин промивають водним NaHCO3 (1M) і потім розсолом. Розчин сушать над Na2SO4 і розчинник видаляють випарюванням. Продукт хроматографують на силікагелі, використовуючи градієнт метану і CH2CI 2: (0% МеОЕ - 20% MeOH). Вихід - 120мг (48%) зазначеної сполуки у вигляді смоли. 1H ЯМР (500MГц, CDCI 3): 1,4-1,9 (cm, 6H), 2,1-2,4 (cm, 6H), 2,6-3,5 (cm, 10Н), 3,6-3,8 (m, 1H), 4,6-4,8 (bd, 1H), 6,3-7,5 (m, 6H), 7,8 (s, 1H); LCMS:m/z 578 (М+1)+. Приклад 20 3-ціано-N-[(2S)-2-[4-флуорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]-N-метил5,6,7,8-тетрагідронафталін-1-карбоксамід 82518 30 3-ціано-N-(2S)-2-(4-флуорфеніл)4-оксобутил]N-метил-5,6,7,8-тетрагідронафталін-1-карбоксамід (див. Метод 19; 2,38г, 6,3ммоль) і дигідрохлорид 4ацетидин-3-ілморфоліну (див. WO 00/63168; 1,49г, 6,9ммоль) змішують з CH2CI 2 (120мл) і DIPEA (1,63г, 12,6ммоль). Суміш перемішують до розчинення всіх компонентів. Додають триацетоксиборгідрид натрію (1,87г, 8,8ммоль) і розчин перемішують при кімнатній температурі протягом ночі. Розчин видаляють і залишок розподіляють між етилацетатом і насиченим NaHCO3 (водн.). Фази розділяють і водний розчин екстрагують етилацетатом. Об'єднані органічні розчини сушать над MgSO4 і розчинник видаляють випарюванням. Залишок розбавляють невеликою кількістю ацетонітрилу і розчин витримують у морозильнику протягом ночі. Кристали збирають фільтруванням і з маточної рідини кристалізацією з ацетонітрилу одержують ще матеріал. Повний вихід - 1,43г (45%) зазначеної сполуки як білуватої твердої речовини. 1H ЯМР (500MГц, CD3OD): 1,44,2 (cm, 31H), 7,0-7,6 (cm, 6H); LCMS: m/z 505 (М+1)+. Матеріал є на 99,6% оптично чистим (енантіомерний надлишок), що підтверджується аналітичною хіральною ВЕРХ (Chiraipak AD, 250х4,6мм) з використанням суміші гептану, ізопропілового спирту, триетиламіну і мурашиної кислоти (70/30/0,1/0,05) як мобільної фази. Приклад 21 N-{(2S)-2-(4-флуорфеніл)-4-[3-(4гідроксипіперидин-1-ілацетидин-1-іл)бутил}-Nметил-3,5-біс(трифлуорметил)бензамід N-[(2S)-2-(4-флуорфеніл)-4-оксобутил]-Nметил-3,5-біс(трифлуорметил)бензамід (див. Метод 20; 0,40г, 0,91ммоль) розчиняють у CH2CI 2 (10мл) і до розчину додають діацетат 1-ацетидин3-ілпіперидин-4-олу (див. Метод 15, але діацетат використовують замість відповідного дигідрохлориду; 0,28г, 1,0ммоль) і DIPEA (0,76г, 5,8ммоль). Суміш перемішують декілька хвил. при кімнатній температурі і потім додають триацетоксиборгідрид натрію (0,43г, 2,0ммоль). Розчин перемішують при кімнатній температурі 31 протягом ночі і розчинник видаляють випарюванням. Залишок розподіляють між етилацетатом і насиченим NaHCO3 (водн.). Фази розділяють і водний розчин екстрагують двічі етилацетатом. Об'єднані органічні розчини промивають водою, сушать над Na2SO4 і розчинник видаляють випарюванням. Залишок очищають флеш-хроматографією, використовуючи суміш метанолу і CH2CI 2 як елюент. Продукт розчиняють у суміші води і ацетонітрилі і сушать виморожуванням. Вихід - 0,32г (60%) зазначеної сполуки як білої твердої речовини. 1 H ЯМР (400MГц, CDCI 3): 1,4-3,8 (cm, 24Н), 6,8-7,5 (cm, 6H), 7,9 (s, 1H); LCMS: m/z 576 (М+1)+. Приклад 22 3,5-диxлop-N-[(2S)-2-(4-флуopфeнiл-4-(3мopфoлiн-4-iлaцeтидин-1-iл)бvтил]-Nметилбензамід 3,5-дихлор-N-(2S)-2-(4-флуорфеніл)-4оксобутил]-N-метилбензамід (див. Метод 21; 146мг, 0,40ммоль) розчиняють у CH2CI 2 (8мл) і до розчину додають дигідрохлорид 4-ацетидин-3ілморфолін (див. WO 00/63168; 62мг, 0,44ммоль) і DIPEA (179мг, 1,39ммоль) з 5 краплями оцтової кислоти. Суміш перемішують 25 хвил. і потім додають триацетоксиборгідрид натрію (118мг, 0,55ммоль). Суміш перемішують при кімнатній температурі протягом ночі. Розчинник випарюють і залишок розподіляють між етилацетатом і насиченим NaHCO3 (водн.). Фази розділяють і водний розчин екстрагують етилацетатом. Об'єднані органічні розчини сушать над MgSO4 і розчинник видаляють випарюванням. Залишок хроматографують на силікагелі, використовуючи суміш метанолу і CH2CI 2 як елюент (градієнт від 0 до 20% метанолу). Вихід -124мг (63%) зазначеної сполуки у вигляді масла. 1 H ЯМР (500MГц, CDCI 3): 1,4-1,8 (cm, 2H), 2,2-3,8 (cm, 21 H), 6,7 (s, 1H), 6,87,2 (m, 5H), 7,3 (s, 1H); LCMS: m/z 494(М+1)+. Аналітична хіральна ВЕРХ (Chirobiotic V, 250 х 4,6мм) з використанням суміші метанолу, триетиламіну і оцтової кислоти (100/0,1/0,05) як мобільної фази показала оптичну чистоту матеріалу 95% (енантіомерний надлишок). Приклади 23-39 Наведені сполуки (див. табл.) синтезують, як це описано у Прикладах 18, 19, 20, 21 і 22, використовуючи належні амінові і альдегідні інтермедіати: ацетат 3-ціано-N-[(2S)-2-{3,4дихлорфеніл)-4-{3-морфолін-4-ілацетидин-1іл)бутил]-N-метил-1-нафтаміду (Приклад 23), ацетат 3-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл]бутил-N-метил-1 82518 32 нафтаміду (Приклад 24), діацетат 3-ціано-N-{(2S)2-(3,4-дихлорфеніл)-4-[3-(1,4-діокса-8азаспіро[4,5]дек-8-іл]ацетидин-1-ілбутил}-N-метил1-нафтаміду (Приклад 25), діацетат 3-ціано-N{(2S)-2-(3,4-дихлорфеніл)-4-[3-(4гідроксипіперидин-1-іл)ацетидин-1-іл]бутил}-Nметил-1-нафтаміду (Приклад 26), 3-ціано-N-[2-(4флуорфеніл)-4-(3-тіоморфолін-4-ілацетидин-1іл)бутил]-N-метил-1-нафтамід (Приклад 27), ацетат 3-ціано-N-[2-(4-ціанофеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-N-метил-1нафтамду(Приклад 28), ацетат 3-ціано-N-{(2S)-2(3,4-дихлорфеніл)-4-[3-(1,1-діоксидотіоморфолін-4іл)ацетидин-1-іл]бутил}-N-метил-1-нафтаміду (Приклад 29), 3-ціано-N-{(2S)-2-(4-флуорфеніл)-4[3-(4-гідроксипіперидин-1-ілацетидин-1-іл]бутил}N-метил-5,6,7,8-тетрагідронафталін-1-карбоксамід (Приклад 30), 3-ціано-N-етил-N-[(2S)-2-(4флуорфеніл)-4-(3-морфолін-4-ілацетидин-1іл)бутил]-5,6,7,8-тетрагідронафталін-1-карбоксамід (Приклад 31), 3-ціано-N-[(2S)-4-[3-(1,4-діокса-8азаспіро[4,5]дек-8-іл)ацетидин-1-іл]-2-(4флуорфеніл)бутил]-N-метил-5,6,7,8тетрагідронафталін-1-карбоксамід (Приклад 32), 3ціано-N-[(2S)-2-(4-флуорфеніл)-4-(3-морфолін-4ілацетидин-1-іл)бутил]-N-метил-1-нафтамід (Приклад 33), 3-ціано-N-{(2S)-2-(4-флуорфеніл)-4[3-(1,4-оксазепан-4-іл)ацетидин-1-іл]бутил}-Nметил-5,6,7,8-тетрагідронафталін-1-карбоксамід (Приклад 34), ацетат 3-флуор-N-[(2S)-2-(4флуорфеніл)-4-(3-морфолін-4-ілацетидин-1іл)бутил]-N-метил-5,6,7,8-тетрагідронафталін-1карбоксаміду (Приклад 35), 3,5-дибром-N-{(2S)-2(4-флуорфеніл)-4-[3-(4-гідроксипіперидин-1іл)ацетидин-1-іл]бутил}-N-метилбензамід (Приклад 36), дигідрохлорид 3-бром-N-[(2S)-2-(4флуорфеніл)-4-(3-морфолін-4-ілацетидин-1-іл)бутил]-5-йод-N-метилбензаміду (Приклад 37), дигідрохлорид 3-ціано-N-[2-(4-флуор-2метилфеніл)-4-(3-морфолін-4-ілацетидин-1іл)бутил]-N-метил-5,6,7,8-тетрагідронафталін-1карбоксаміду (Приклад 33), 6-ціано-N-[(2S)-2-(4флуорфеніл)-4-(3-морфолін-4-ілацетидин-1іл)бутил]-N-метиліндан-4-карбоксамід (Приклад 39). Синтез амінових і кислотних інтермедіатів, використаних у прикладах, описано у згаданих Методах (Мет.) або у документах: Приклад 23 (див. WO 00/63168 і WO 00/02859), Приклад 24 (див. WO 96/05193 і WO 00/02859), Приклад 25 (див. Мет. 13 і WO 00/02859), Приклад 26 (див. Мет. 15 і WO 00/02859), Приклад 27 (див. WO 96/05193 і Мет. 17), Приклад 28 (див. WO 96/05193 і Мет. 18), Приклад 29 (див. Мет. 14 і WO 00/02859), Приклад 30 (див. Мет. 15 і Мет. 19), Приклад 31 (див. WO 00/63168 і Мет. 22), Приклад 32 (див. Мет. 13 і Мет. 19), Приклад 33 (див. WO 00/63168 і Мет. 23), Приклад 34 (див. WO 96/05193 і Мет. 19), Приклад 35 (див. WO 00/63168 і Мет. 28), Приклад 36 (див. Мет. 15 і Мет. 24), Приклад 37 (див. WO 00/63168 і Мет. 25), Приклад 38 (див. WO 00/63168 і Мет. 26) і Приклад 39 (див. WO 00/63168 і Мет. 27). 33 82518 34 35 82518 36 37 Приклад 40 Діацетат 3-ціано-N-((2S)-2-(3,4-дихлорфеніл)4-[3-(1-оксидотіоморфолін-4-іл)ацетидин-1іл]бутил]-N-метил-1-нафтаміду Ацетат 3-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4(3-тіоморфолін-4-ілацетидин-1-іл)бутил]-N-метил1-нафтаміду (див. Приклад, 24; 127мг, 0,20ммоль) розчиняють в оцтовій кислоті (10мл) і до розчину додають гідрогенпероксид (0,04мл, 30%-й водн. розчин, 0,35ммоль). Суміш перемішують при кімнатній температурі 3 дні і потім розбавляють водою. Розчин видаляють ліофілізацією суміші, отримуючи залишок, який очищають зворотнофазовою хроматографією, використовуючи суміш ацетонітрилу і 0,1M водн. ацетату амонію. Вихід 52мг (35%) зазначеної сполуки як білої твердої речовини. 1H ЯМР (400MГц, DMSO-d6): 1,2-2,2 (m, 3H), 1,9 (s, 3H), 2,3-3,6 (m, 20Н), 4,4 (сm, 1H), 6,47,6 (m, 2Н), 7,4 (dd, 1H), 7,6-8,2 (5Н), 8,6 (d, 1H); LCMS:m/z 583(M+1)+. Приклад 41 Ацетат 3-ціано-N-(2-(4-ціанофеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-ілбутил}-Nметил-1-нафтаміду Ацетат 3-ціано-N-[2-(4-ціанофеніл)4-(3 82518 38 тіоморфолін-4-ілацетидин-1-іл)бутил]-N-метил-1нафтаміду (див. Приклад, 28; 60мг, 0,10ммоль) розчиняють у суміші ацетонітрилу (3мл) і CH2CI 2 (1мл) і до розчину додають каталітичну кількість FeCI 3 з охолодженням. Суміш перемішують 5 хвил. і потім додають перйодну кислоту (26мг, 0,11ммоль) і перемішування продовжують протягом ночі при 0°C. Додають ще каталітичну кількість FeCI 3 і перйодну кислоту (26мг, 0,11ммоль). Реакційну суміш перемішують при 0°C 2 год. і потім гасять доданням Na2S2O3. Суміш екстрагують тричі CH2CI2 і органіку промивають двічі водою і сушать над Na2SO4. Розчин видаляють випарюванням і продукт очищають зворотно-фазовою хроматографією, використовуючи суміш ацетонітрилу і 0,1M водн. ацетату амонію. Вихід - 25мг (41%) зазначеної сполука як блідожовтої твердої речовини. 1H ЯМР: (400MГц, CDCI 3): 1,4-2,0 (cm, 3Н), 2,0 (s, 3H), 2,14,3 (cm, 20Н), 6,4-8,0 (cm, 9H), 8,2 (s, 1H); LCMS: m/z 540 (М+1)+. Приклади 42-47 Наведені сполуки (див. табл.) синтезують, як це описано у Прикладах 40, 41, використовуючи належні тіоморфолінові інтермедіати: (див. табл.): ацетат 3,5-дихлор-N-{(2S)-2-(3,4-дихлорфеніл)-4[3-(1-оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил}N-метилбензаміду (Приклад 42), ацетат N-(2S)-2(3,4-дихлорфеніл)-4-(3-оксидотіоморфолін-4ілацетидин-1-іл)бутил]-N-метил-3,5біс(трифлуорметил)бензаміду (Приклад 43), ацетат 3-ціано-N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил}-Nметил-5,6,7,8-тетрагідронафталін-1-карбоксаміду (Приклад 44), ацетат 3-ціано-N-{2-(4-флуорфеніл)4-[3-(1-оксидотіоморфолін-4-іл)ацетидин-1іл]бутил}-N-метил-1-нафтаміду (Приклад 45), ацетат 3-ціано-N-{2-(4-флуорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил}-Nметил-5,6,7,8-тетрагідронафталін-1-карбоксаміду (Приклад 46) і ацетат N-{2-(4-флуорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил}-Nметил-3,5-біс(трифлуорметил)бензаміду (Приклад 47). 39 Приклад 48 Діацетат 3-ціано-N-{(2S)-2-(3,4-дихлорфеніл)4-[3-(4-оксопіперидин-1-іл)ацетидин-1-іл)бутил}-Nметил-1-нафтамід Діацетат 3-ціано-N-{(2S)-2-(3,4-дихлорфеніл)4-[3-(1,4-діокса-8-азаспіро[4,53дек-8-іл)-ацетидин1-іл)бутил]-N-метил-1-нафтаміду (див. Приклад 25; 35мг, 0,058ммоль) розчиняють декількох краплях ацетону-води (1:1) і до розчину додають ртолуолсульфонат піридиніуму (43мг, 0,17ммоль). Суміш піддають мікрохвильовому одновузловому 82518 40 підігріванню протягом 10 хвил. і розчинник видаляють випарюванням. Залишок розчиняють у CH2O2 і розчин промивають водним NaHCO3 і сушать над MgSO4. Видалення розчинника випарюванням дає масло, яке очищають зворотно-фазовою хроматографією, використовуючи суміш ацетонітрилу і 0,1М водн. ацетату амонію. Вихід - 35мг (89%) зазначеної сполуки як білої твердої речовини. 1 H ЯМР (400MГц, CD3OD): 1,4-2,2 (cm, 3H), 1,9 (s, 6H), 2,34,0 (cm, 20Н), 6,4-7,8 (cm, 7H), 8,0-8,2 (cm, 1H), 8,6 (d, 1H); LCMS: m/z 563 (М+1)+. Приклад 49 Наведену нижче сполуку (див. табл.) синтезують, як у Прикладі 48, використовуючи відповідну кетальну похідну (див. Приклад 15): N{2-(4-флуорфеніл)-4-[3-(4-оксопіперидин-1іл)ацетидин-1-іл]бутил}-N-метил-3,5біс(трифлуорметил) бензамід. 41 Приклад 50 3-ціано-N-{(2S)-(3,4-дихлорфеніл)-4-[3-(4флуорпіперидин-1-іл)ацетидин-1-іл)бутил]-Nметил}-1-нафтамід Діетиламіносульфуртрифлуорид (7мг, 0,044ммоль) розчиняють у сухому CH2CI 2 і охолоджують з перемішуванням під аргоном до 65°С. Додають 3-ціано-N-{(2S)-2-(3,4дихлорфеніл)-4-[3-(4-оксопіперидин-1-іл)ацетидин Приклад 52 3-ціано-N-{(2S)-2-(3,4-дихлорфеніл)-4-[3-(4метилпіперазин-1-іл)ацетидин-1-іл]бутил)-Nметил-1-нафтамід 1-[(3S)-4-[(3-ціано-1-нафтоїл)(метил)аміно]-3(3,4-дихлорфеніл)бутил]ацетидин-3-іл метансульфонат (Метод 16; 87мг, 0,16ммоль) і 1метилпіперазин (1мл, 9,0ммоль) розчиняють у CH2CI 2 (1,5мл) і суміш піддають мікрохвильовому одновузловому нагріванню протягом 5 хвил. Розчин видаляють випарюванням і продукт очищають зворотно-фазовою хроматографією, 82518 42 1-іл]бутил}-N-метил-1-нафтамід (Приклад 26; 40мг, 0,071ммоль), розчинений у сухому CH2CI 2 (0,5мл). Зовнішнє охолодження видаляють і розчин перемішують 1 год. Реакційну суміш гасять внесенням краплями у насичений водний розчин NaHCO3 (6мл). Органічний розчин промивають водою і сушать над MgSO4. Розчинник видаляють випарюванням і отримують 5мг (12%) зазначеної сполуки у вигляді масла. 1 H ЯМР (500MГц, CD3OD): 1,8-2,6 (cm, 7H), 2,6-3,3 (cm, 7H), 3,4-4,4 (cm, 9H), 5,0-5,3 (cm, 1Н), 7,0-8,4 (cm, 7H), 8,4-8,6 (m, 1H), 8,9-9,0 (d, 1H); LCMS: m/z 567 (54+1)+. Приклад 51 Наведену нижче сполуку (див. табл.) синтезують, як у Прикладі 50, використовуючи відповідну спиртову похідну (див. Приклад 14): 3ціано-N-[2-(4-флуорфеніл)-4-[3-(4флуорпіперидин-1-іл)ацетидин-1-іл]бутил)-Nметил-5,6,7,8-тетрагідронафталін-1-карбоксамід. використовуючи суміш ацетонітрилу і 0,1M водн. ацетату амонію. Вихід - 5мг (5%) зазначеної сполуки як білої твердої речовини. 1H ЯМР: (500MГц, CD3OD): 1,2-4,0 (cm, 29Н), 6,5-8,0 (cm, 8H), 8,4 (d, 1H); LCMS: m/z 564 (М+1)+. Приклади 53, 54 Наведені нижче сполуки (див. табл.) синтезують, як у Прикладі 52, використовуючи відповідні амінові і мезилатні інтермедіати: ацетат N-[(2S)-4-[3-(4-ацетилпіперазин-1-іл)ацетидин-1іл]-2-(3,4-дихлорфеніл)бутил]-3-ціано-N-метил-1нафтаміду (Приклад 53) і ацетат 3-ціано-N-[(2S)-4[3-(4-ціанопіперидин-1-іл)ацетидин-1-іл]-2-{3,4дихлорфеніл)бутил]-N-метил-1-нафтаміду (Приклад 54). Синтез тіоморфолінових інтермедіатів, використаних у прикладах, описано у згаданих Методах (Мет.) або у документах: Приклад 53 (див. WO 96/05193 і Мет. 16) і Приклад 54 (див. Synth Commun; 1990; 1757-1767 і Мет. 16). 43 Приготування вихідних матеріалів Вихідні матеріали для наведених вище прикладів є комерційно доступними або можуть бути легко приготовлені стандартними методами з відомих матеріалів, наприклад, наведені нижче реакції ілюструють (без обмеження винаходу) приготування деяких вихідних матеріалів. Метод 1 Дигідрохлорид [(2S)-2-(3,4-дихлорфеніл-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-метиламіну (a) 4-[1-(дифенілметил)ацетидин-3-іл] тіоморфолін Суміш 1-(дифенілметил)ацетидин-3-ілметансульфонату (див. J. Org. Chem.; 56; 1991; 6729; 10г, 31,5ммоль), тіоморфоліну (3,9г, 38ммоль) і DIPEA (4,9г, 38ммоль) витримують під зворотним холодильником протягом ночі. Леткі компоненти видаляють випарюванням і залишок розподіляють між CH2CI 2 і водним NaHCO3. Органічний шар промивають двічі водним NaHCO3 і потім екстрагують водним розчином лимонної кислоти (3x70мл, 1M). Водний шар охолоджують і коригують рН водним NaHCO3 і водним 2М NaOH. Суміш екстрагують сумішшю СН2СІ 2-ЕtOАсетанолом і органічний розчин сушать над MgSO4 і розчинник видаляють випарюванням. Вихід - 9,3г (91%) 4-[1-(дифеніл метил)ацетидин-3іл]тіоморфоліну як блідожовтої твердої речовини. 1 H ЯМР (400MГц, CDCI 3): 2,5 (m, 4Н), 2,7 (m, 4H), 2,8 (t, 2Н), 3,0 (qn, 1H), 3,4 (m, 2Н), 4,4 (s, 1H), 7,17,4 (m, 10H); LCMS: m/z 325 (М+1)+. (b) 4-ацетидин-3-ілтіоморфоліндигідрохлорид 4-[1-(дифенілметил)ацетидин-3-іл]тіоморфолін (1,0г, 3,1ммоль) розчиняють у CH2CI 2 під нітрогеном і перемішують при 0°C, додаючи 1хлоретилхлорформат (1,3г, 9,2ммоль). Суміш перемішують 90 хвил. і потім додають метанол 82518 44 (1мл). Розчин витримують під зворотним холодильником 20 хвил. і розчинник видаляють випарюванням. До залишку додають ацетон (10мл) і потім ізопропанол (10мл) і суміш витримують під зворотним холодильником 30 хвил., після чого витримують при кімнатній температурі протягом ночі. Суміш охолоджують і осад збирають фільтруванням. Вихід - 250мг (51%) 4-ацетидин-3-ілтіоморфоліндигідрохлориду як блідокоричневої твердої речовини. 1H ЯМР (400MГц, DMSO-d6): 2,4-3,8 (cm, 8H), 4,0 (b, 2H), 4,3 (m, 1H), 4,5 (b, 2H), 9,2 (b, 1H), 10,4 (b, 1H). (c) трет-бутил [(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]метилкарбамат. Трет-бутил [(2S)-2-(3,4-дихлорфеніл)-4оксобутил]метилкарбамат (див. WO 95/05377; 610мг, 1,8ммоль) розчиняють у 1,2-дихлоретані (20мл) і до розчину додають 4-ацетидин-3ілтіоморфолінгідрохлорид (430мг, 1,9ммоль) і потім триацетоксиборгідрид натрію (480мг, 2,2ммоль). Суміш перемішують при кімнатній температурі 5 год. і потім додають триетиламін (0,73мл, 5,2ммоль). Реакційну суміш перемішують 2 год. і розподіляють між CH2CI 2 і водним NaHCO3. Органічний шар промивають водою і об'єднані органічні розчини сушать над MgSO4. Розчинник видаляють випарюванням, отримуючи масло, яке хроматографують на зворотно-фазовій колонці, використовуючи суміш ацетонітрилу і 0,1M водн. ацетату амонію. Відповідні фракції екстрагують етером. Органічний розчин сушать над MgSO4 і розчинник видаляють випарюванням. Вихід 266мг (31%) трет-бутил [(2S)-2-(3,4-дихлорфеніл)4-(3-тіоморфолін-4-ілацетидин-1іл)бутил]метилкарбамату у вигляді масла. 1H ЯМР (400MГц, CDCI 3): 1,4 (s, 9H), 1,5-3,5 (cm, 23Н), 7,0 (dd, 1H), 7,3 (d, 1H), 7,4 (d, 1H); LCMS: m/z 488 (М+1)+. (d) Дигідрохлорид [(2S)-2-(3,4-дихлорфеніл)-4(3-тіоморфолін-4-ілацетидин-1-іл)бутил]метиламіну Трет-бутил [(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]метилкарбамат (260мг, 0,53ммоль) розчиняють в етері (15мл) і перемішують, додаючи краплями HCI (15мл 4М розчину у діоксані). Суміш перемішують при кімнатній температурі 1 год. і розчинник видаляють випарюванням. Вихід - 270мг (100%) 45 дигідрохлориду [(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]метиламіну як білої твердої речовини. 1H ЯМР (300MГц, CD3OD): 1,9-2,2 (b, 2H), 2,7 (s, 3H), 3..Q-4,8 (cm, 19Н), 7,4 (d, 1H), 7,6 (m, 1H); LCMS:m/z 388 (М4-І)+. Метод 2 Діацетат {2S)-2-(3,4-дихлорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1-іл]бутил} метиламіну Гідрохлорид [(2S)-2-(3,4-дихлорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]-метил-аміну (див. Метод 1; 270мг, 0,54ммоль) розчиняють в оцтовій кислоті і до розчину додають гідрогенпероксид (0,05мл 35%-го водного розчину, 0,54ммоль). Суміш перемішують при кімнатній температурі 2,5 год. і розчинник видаляють випарюванням. Залишок розчиняють в етанолі (50мл) і до розчину додають смолу MP-Carbonat (0,86г 3,18ммоль/г полімерно зв'язаної смоли). Суміш перемішують 30 хвил. і фільтрують і розчинник видаляють випарюванням. Продукт очищають зворотно-фазовою хроматографією, використовуючи суміш ацетонітрилу і 0,1M водн. ацетату амонію. Вихід - 140мг (49%) діацетату {(2S)-2-(3,4-дихлорфеніл)-4-[3-(1оксидотіоморфолін-4-іл)ацетидин-1іл]бутил}метиламіну. 1 H ЯМР (400MГц, CDCI 3): 1,61,8 (m, 2H), 1,9 (s, 6H), 2,3-2,4 (m, 1H), 2,4-2,5 (m, 7Н), 2,7-3,0 (m, 10Н), 3,1 (m, 1Н), 3,6 (m, 2Н), 7,0 (dd, 1H), 7,2 (d, 1H), 7,3 (d, 1H), 8,2 (s, 2H); LCMS: m/z404 (M+1)+. Метод З Гідрохлорид2-(4-флуорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]метиламіну (a) трет-бутил [2-(4-флуорфеніл)пент-4-ен-1іл]метилкарбамат [2-(4-флуорфеніл)пент-4-ен-1-іл]метиламін (див. Метод 17b; 11,2г, 190ммоль) розчиняють у ТГФ (350мл) і до розчину додають триетиламін (8,7мл, 100ммоль). Суміш охолоджують зовнішньої льодяною ванною і додають ди-третбутилдикарбонат (15г, 218ммоль). Ванну видаляють і реакційну суміш залишають досягти кімнатної температури і потім перемішують протягом ночі. Додають етер і суміш промивають водою. Органічний шар сушать (MgSO4) і 82518 46 розчинник видаляють випарюванням. Вихід - 16,5г (29%) трет-бутил [2-(4-флуорфеніл)пент-4-ен-1іл]метилкарбамату як жовтої твердої речовини. 1H ЯМР (400MГц, CDCI 3): 1,4 (s, 9Н), 2,2-2,4 (m, 2H), 2,5-2,7 (cm, 3Н), 2,8-3,8 (cm, 3H), 4,8-5,0 (cm, 2H), 5,5-5,7 (m,1H), 6,9 (t, 2H), 7,1 (b, 2H). (b) 1-[(трет-бутоксикарбоніл)(метил)аміно]1,2,3-тридеокси-2-(4-флуорфеніл)пентитол. Трет-бутил [2-(4-флуорфеніл)пент-4-ен-1іл]метилкарбамат (17,0г, 57,9ммоль) розчиняють у суміші ацетону, t-бутанолу і води (190мл, 2:1:1). Додають OsO4 (3мл, 2,5% розчин у t-бутанолі) при кімнатній температурі і після перемішування протягом 10 хвил. додають NMO (27,1г, 231ммоль). Суміш перемішують протягом ночі і реакційну суміш гасять доданням водного розчину 20% бісульфіту натрію. Суміш перемішують 15 хвил. і розбавляють водою. Розчин екстрагують CH2O2 і органічний екстракт промивають розсолом, сушать і концентрують на роторному випарювачі. Вихід - 19,4г (100%) сирого 1-[(третбутоксикарбоніл)(метил)аміно]-1,2,3-тридеокси-2(4-флуорфеніл)пентитолу у вигляді масла. 1 H ЯМР (400MГц, CDCI 3) 1,3 (s, 9H), 1,4-1,8 (cm, 2H), 2,03,6 (cm, 11H), 6,9 (t, 2H), 7,1 (b, 2H). (c) трет-бутил [2-(4-флуорфеніл)-4оксобутил]метилкарбамат 1-[(трет-бутоксикарбоніл)(метил)аміно]-1,2,3тридеокси-2-(4-флуорфеніл)пентитол (19,4г, 59,2ммоль) розчиняють у суміші ТГФ і вод (3:1) і до розчину додають NaIO4 (17,7г, 82,9ммоль). Після перемішування протягом 6 год. реакційну суміш розбавляють водою і екстрагують етилацетатом. Органічний екстракт промивають розсолом, сушать і концентрують на роторному випарювачі. Вихід - трет-бутил [2-(4-флуорфеніл)4-оксобутил]метилкарбамат у вигляді жовтого масла. 13C ЯМР (100MГц, CDCI 3): 28,4 (s), 35,1 (d), 38 (m), 47,3 (d), 54,6 (d), 79,8 (s), 115,7 (d), 129,4 (d), 137,2 (s), 155,8 (m), 160,7 (s), 163,2 (s), 200,6 (d). (d) трет-бутил [2-(4-флуорфеніл)-4-(3тіоморфолін-4-ілацетидин-1-іл)бутил]метилкарбамат Трет-бутил [2-(4-флуорфеніл)-4оксобутил]метилкарбамат (0,50г, 1,7ммоль) і дигідрохлорид 4-ацетидин-3-ілтіоморфоліну (0,45г, 2,0ммоль) розчиняють у метанолі (30мл). Додають метанольний розчин (15мл) ціаноборгідриду натрію (0,71г, 11,2ммоль) і хлориду цинку (0,77г, 5,6ммоль) і суміш перемішують 1 год. при кімнатній температурі. Розчинник видаляють випарюванням і залишок розподіляють між насиченим водним розчином NaHCO3 і етилацетатом. Органічний розчин відділяють і розчинник випарюють. Продукт очищають зворотно-фазовою хроматографією, використовуючи суміш ацетонітрилу і 0,1M водн. ацетату амонію. Вихід - 350мг (41%) трет-бутил [2(4-флуорфеніл)-4-(3-тіоморфолін-4-ілацетидин-1іл)бутил]метилкарбамату у вигляді блідо-жовтого масла. 1H ЯМР (500MГц, CDCI 3): 1,3 (s, 9Н), 1,6-1,7 (m, 2H), 2,0 (s, 1H), 2,3-2,7 (m, 12Н), 2,8-3,6 (m, 6Н), 3,6-3,7 (m, 2Н), 6,9-7,1 (m, 4Н), 10,2-10,4 (b, 1H);(e) LCMS: гідрохлорид +. 2-(4-флуорфеніл)-4-(3m/z 438 (М+1) тіоморфолін-4-ілацетидин-1-іл)бутил]метиламіну 47 Трет-бутил [2-(4-флуорфеніл)-4-(3тіоморфолін-4-ілацетидин-1іл)бутил]метилкарбамат (0,27г, 0,62ммоль) розчиняють у суміші HCI і діоксану (4М HCI у діоксані). Розчин перемішують протягом ночі при кімнатній температурі і потім леткі компоненти видаляють випарюванням. Вихід - 0,26г (100%) гідрохлориду 2-(4-флуорфеніл)-4-(3-тіоморфолін4-ілацетидин-1-іл)бутил]-метиламіну як твердої речовини. 1H ЯМР (400MГц, CD3OD): 1,8-2,1 (2Н), 2,7 (s, 3H), 2,9-4,6 (m, 18Н), 7,2 (t, 2H), 7,4 (m, 2Н); LCMS: m/z 338 (M-M)+. Метод 4 Дигідрохлорид [(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]метиламіну (a) трет-бутил [(2S)-2-(4-флуорфеніл)пент-4ен-1-іл]метилкарбамат [(2S)-2-(4флуорфеніл)пент-4-ен-1-іл]метиламін (див. Bioorg. Med. Chem. Lett; 2001; 265-270; 1,19г, 6,16ммоль) розчиняють у ТГФ (50мл) і до розчину додають триетиламін (0,69г, 6,7ммоль). Суміш охолоджують зовнішньою льодяною ванною і додають трет-бутилдикарбонат (1,6г, 7,4ммоль). Ванну видаляють і реакційну суміш залишають досягти кімнатної температури і потім перемішують 5 год. Додають етер і суміш промивають двічі водою. Органічний шар сушать (MgSO4) і розчинник видаляють випарюванням. Вихід - 2г (100%) трет-бутил [(2S)-2-(4флуорфеніл)пент-4-ен-1-іл]метилкарбамату як твердої речовини. 1H ЯМР (400MГц, CDCI 3): 1,4 (s, 9H), 2,3-2,4 (m, 2H), 2,8-3,6 (cm, 6H), 4,9-5,0 (cm, 2H), 5,6-5,7 (m, 1Н), 7,0 (m, 2Н), 7,1 (b, 2H). (b) трет-бутил [(2S)-2-(4-флуорфеніл)-4оксобутил]метилкарбамат. Трет-бутил [(2S)-2-(4-флуорфеніл)пент-4-ен-1іл]метилкарбамат (1,8г, 6,1ммоль) розчиняють у суміші ацетону (32мл), трет-бутанолу (16мл) і води (3мл). Розчин перемішують при кімнатній температурі, додаючи OsO4 (0,64мл 2,5% у третбутанолі, 0,06ммоль) і 4-метилморфолін N-оксид (3,2г, 27ммоль). Суміш перемішують при кімнатній температурі 4 год. Додають насичений водний розчин бісульфіту натрію (60мл) і суміш перемішують 20 хвил., після чого розбавляють водою (100мл). Розчин екстрагують двічі CH2CI 2 і об'єднані органічні розчини промивають розсолом. Розчинник видаляють випарюванням і залишок (2,4г) розчиняють у суміші ТГФ (28мл) і води (12мл) і додають перйодат натрію (1,44г, 6,7ммоль). Розчин перемішують при кімнатній температурі 4,5 год. і розбавляють водою і розсолом. Суміш екстрагують двічі CH2CI 2 і 82518 48 об'єднані органічні розчини сушать над MgSO4. Розчин видаляють випарюванням і отримують 1,58г (87%) трет-бутил [(2S)-2-(4-флуорфеніл)-4оксобутил]метилкарбамату. 1 H ЯМР (500MГц, CDCI 3): 1,4 (s, 9H), 2,6-2,8 (m, 5Н), 3,2-3,6 (cm, 3H), 7,0 (m, 2Н), 7,1 (b, 2H), 9,7 (s, 1H). (c) трет-бутил [(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]-метилкарбамат Трет-бутил [(2S)-2-(4-флуорфеніл)-4оксобутил]метилкарбамат (1,57г, 5,3ммоль) і 4ацетидин-3-ілморфолін (0,83г, 5,8ммоль) розчиняють у CH2CI 2 (60мл) разом з DIPEA (1,4г, 10,6ммоль). Суміш перемішують 20 хвил. і додають триацетоксиборгідрид натрію (1,6г, 7,4ммоль). Суміш перемішують при кімнатній температурі 6 год. і розчинник видаляють випарюванням. Залишок розподіляють між водним розчином NaHCO3 і етилацетатом. Водну фазу екстрагують етилацетатом і органічний розчин сушать над MgSO4 і потім видаляють випарюванням. Продукт хроматографують на силікагелі, використовуючи суміш метанолу і CH2CI 2 (5%-20%-й метанол) і отримують 440мг (20%) трет-бутил [(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-ілацетидин-1іл)бутил]метилкарбамату у вигляді масла. 1H ЯМР (400MГц, CDCI 3): 1,3 (s, 9H), 1,4-1,6 (m, 2H), 2,1-2,3 (b, 5H), 2,5-3,8 (cm, 16Н), 6,9 (t, 2H), 7,0-7,1 (b, 2H); LCMS: m/z 422 (M+1)+. [(2S)-2-(4-флуорфеніл)-4-(3(d) дигідрохлорид морфолін-4-ілацетидин-1-іл)бутил]-метиламін Трет-бутил [(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]-метилкарбамат (0,44г, 1,04ммоль) розчиняють у насиченому розчині етилацетату у HCI. Суміш перемішують при кімнатній температурі 1 год. і потім видаляють випарюванням розчинник. Вихід 450мг дигідрохлориду [(2S)-2-(4-флуорфеніл)-4-(3морфолін-4-ілацетидин-1-іл)бутил]метиламіну у вигляді піни. 1H ЯМР (500MГц, CD3OD): 2,0 (m, 1H), 2,2 (m, 1H), 2,7 (S1 3H), 3,0-5,0 (cm; 18Н), 7,2 (t, 2H), 7,5 (t, 2H); LCMS: m/z 322 (М+1)+. Метод 5 Дигідрохлорид 1-{1-[3-(4-флуорфеніл)-4(метиламіно)бутил]ацетидин-3-іл]піперидин-4-олу (a) трет-бутил {2-(4-флуорфеніл)-4-[3-(4гідроксипіперидин-1-іл)ацетидин-1-іл]бутил}метилкарбамат Цю сполуку синтезують згідно з Методом 3d, але використовуючи дигідрохлорид 1-ацетидин-3ілпіперидин-4-олу (див. Мет. 15) замість дигідрохлориду 4-ацетидин-3-ілтіоморфоліну (вихід 69%). 1H ЯМР (400MГц, CDCI 3): 1,4 (s, 9H),1,4-3,8 (cm, 25Н), 7,0 (t, 2H), 7,0-7,2 (b, 2H), 49 LCMS: m/z 436 (M-1-I)+. (b) дигідрохлорид 1-{1-[3-(4-флуорфеніл)-4(метиламіно)бутил]ацетидин-3-іл}-піперидин-4-олу Цю сполуку синтезують згідно з Методом 3е, але використовуючи трет-бутил {2-(4флуорфеніл)-4-[3-{4-гідроксипіперидин-1іл)ацетидин-1-іл]бутил}-метилкарбамат замість трет-бутил [2-(4-флуорфеніл)-4-(3-тіоморфолін-4ілацетидин-1-іл)бутил]-метил-карбамату (вихід 98%). 1H ЯМР (400MГц, CD3OD): 1,8-2,2 (b, 6H), 2,7 (s, 3H), 3,0-4,8 (m, 15Н), 7,0-7,2 (m, 2Н), 7,3-7,4 (m, 2Н). LCMS: m/z 336 (М+1)+. Метод 6 Трифлат [4-[3-(1,4-діокса-8-азаспіро[4,5]дек-8іл)ацетидин-1-іл]-2-(4-флуоррфеніл)бутиліметиламіну (а) трет-бутил[4-[3-(1,4-діокса-8азаспіро[4,5]дек-8-іл)ацетидин-1-іл]-2-(4флуорфеніл)-бутил]метилкарбамат Цю сполуку синтезують згідно з Методом 3d, але використовуючи гідрохлорид 8-ацетидин-3-іл1,4-діокса-8-азаспіро[4,5]декану (див. Мет. 13) замість дигідрохлориду 4-ацетидин-3ілтіоморфоліну (вихід 70%). 1H ЯМР (400MГц, CDCI 3): 1,4 (s, 9H), 1,4-3,6 (cm, 25Н), 3,9-4,0 (m, 2H), 6,9-7,0 (t, 2H), 7,1-7,2 (b, 2H), LCMS: m/z 478 (M+1)+.трифлат [4-[3-(1,4-діокса-8-азаспіро[4,5]декb) 8-іл)ацетидин-1-іл]-2-(4-флуорфеніл)бутил]метиламіну Цю сполуку синтезують згідно з Методом 3е, але використовуючи трет-бутил {2-(4флуорфеніл)-4-[3-(4-гідроксипіперидин-1іл)ацетидин-1іл]бутил}метилкарбамат]трифлуороцтову кислоту замість трет-бутил [2-(4-флуорфеніл)-4-(3тіоморфолін-4-ілацетидин-1іл)бутил]метилкарбамату і HCI (вихід 100%). LCMS: m/z 378 (М+1)+. Метод 7 Дигідрохлорид {(2S)-2-(3,4-дихлорфеніл)-4-[3(4-флуорпіперидин-1-іл)ацетидин-1іл)бутил}метиламін 82518 50 (а) трет-бутил {(2S)-2-(3,4-дихлорфеніл)-4-[3(4-флуорпіперидин-1-іл)ацетидин-1іл]бутил}метилкарбамат Цю сполуку синтезують згідно з Методом 3d, але використовуючи дигідрохлорид 1-ацетидин-3іл-4-флуорпіперидину (див. WO 97/27185) і третбутил [(2S)-2-(3,4-дихлорфеніл)-4оксобутил]метилкарбамат (див. WO 95/05377) замість дигідрохлориду 4-ацетидин-3ілтіоморфоліну і трет-бутил [2-(4-флуорфеніл)-4оксобутил]метил-карбамату (вихід 13%). 1H ЯМР (500MГц, CDCI 3): 1,3 (s, 9H), 1,5-3,6 (cm, 23Н), 4,64,8 (bd, 1H), 6,9-7,1 (dd, 1H), 7,2 (m, 1H), 7,4 (d, 1H), LCMS: m/z489 (M+1)+. (b) дигідрохлорид {(2S)-2-(3,4-дихлорфеніл)-4[3-(4-флуорпіперидин-1-іл)ацетидин-1-іл]бутил} метиламіну Цю сполуку синтезують згідно з Методом 3е, але використовуючи трет-бутил {(2S)-2-(3,4дихлорфеніл)-4-[3-(4-флуорпіперидин-1іл)ацетидин-1-іл]бутил}метил-карбамат замість трет-бутил [2-(4-флуорфеніл)-4-(3-тіоморфолін-4ілацетидин-1-іл)бутил]-метилкарбамату (вихід 100%). 1H ЯМР (500MГц, CD3OD): 1,9-2,4 (m, 6H), 2,7 (s, 3H), 3,1-5,1 (cm, 15Н), 7,4 (d, 1H), 7,7 (m, 2Н), LCMS: m/z 389 (М+1)+. Метод 8 Дигідрохлорид 1-{1-[(3S)-3-(3,4-дихлорфеніл)4-(метиламіно)бутил]ацетидин-3-іл} піперидин-4олу (a) трет-бутил {(2S)-2-(3,4-дихлорфеніл)-4-[3(4-гідроксипіперидин-1-іл)ацетидин-1-іл]бутил} метилкарбамат Цю сполуку синтезують згідно з Методом 3d, але використовуючи дигідрохлорид 1-ацетидин-3ілпіперидин-4-олу (див. Мет. 15) і трет-бутил [(2S)2-(3,4-дихлорфеніл)-4-оксобутил]метилкарбамату (див. WO 95/05377) замість дигідрохлориду 4ацетидин-3-ілтіоморфоліну і трет-бутил [2-(4флуорфеніл)-4-оксобутил]метилкарбамату (вихід 35%). 1H ЯМР (500MГц, CDCI 3): 1,3 (m, 2H), 1,4 (s, 51 9H), 1,5-3,8 (cm, 23Н), 7,0 (dd, 1H), 7,2-7,4 (m, 2Н), LCMS: m/z 487 (М+1)+. (b) дигідрохлорид 1-{1-[(3S)-3-(3,4дихлорфеніл)-4-(метиламіно)бутил]ацетидин-3іл)піперидин-4-олу Цю сполуку синтезують згідно з Методом 3е, але використовуючи трет-бутил {(2S)-2-(3,4дихлорфеніл)-4-[3-(4-гідроксипіперидин-1іл)ацетидин-1-іл]бутил}метилкарбамат замість трет-бутил [2-(4-флуорфеніл)-4-(3-тіоморфолін-4ілацетидин-1-іл)бутил]метилкарбамату (вихід 100%). 1H ЯМР (500MГц, CD3OD): 1,8-2,2 (m, 6H), 2,7 (s, 3H), 3,2-4,8 (cm, 17Н), 7,4 (dd, 1H), 7,6-7,7 (m, 2H), LCMS: m/z 387 (М+1)+. Метод 9 5-ціано-1-бензотіофен-7-карбонова кислота (a) етил 5-ціано-1-бензотіофен-7-карбоксилат Перхлорат N-[2-ціано-3-(диметиламіно)проп-2ен-1-іліден]-N-метилметанамініуму (див. Collect. Czech. Chem. Commun.; 32; 5; 1967; 1704; 5,84г, 23,2ммоль) і етил 2-тієнілацетат (3,95г, 23,2ммоль) змішують з хіноліном (117мл; 0°C). Додають етоксид натрію (1,97г, 27,9ммоль) і суміш перемішують при 0°C 30 хвил. і потім при кімнатній температурі ще 15 хвил. Реакційну суміш підігрівають до 75°С під нітрогеном протягом 5 год. і потім охолоджують до 0°C. Додають гідрохлорну кислоту (200мл 2М водного розчину) і суміш екстрагують тричі хлороформом. Органічний розчин промивають розсолом і сушать над Na2SO4. Розчин видаляють випарюванням і залишок флеш-хроматографують на силікагелі (гексан-етилацетат, 8:1). Вихід - 2,3г (43%) етил 5ціано-1-бензотіофен-7-карбоксилату як блідожовтої твердої речовини. 1H ЯМР (300MГц, CDCI 3): 1,5 (t, 3H), 4,5 (qt, 2H), 7,5 (d, 1H), 7,7 (d, 1Н),(b) 5-ціано-1-бензотіофен-7-карбонова кислота 8,3 (m, 2Н). Етил 5-ціано-1-бензотіофен-7-карбоксилат (5,6г, 24,3ммоль) розчиняють у ТГФ (96мл) і до розчину додають водний розчин NaOH (1,07г NaOH у 14мл води, 26,7ммоль) при 0°C. Суміш перемішують при кімнатній температурі протягом ночі і більшу частину розчину видаляють випарюванням. Залишок розчиняють у водному розчині NaOH (0,1M). Розчин промивають тричі хлороформом, підкислюють 2М HCI і екстрагують етилацетатом. Органічний розчин відділяють і розчинник випарюють. Залишок флешхроматографують на силікагелі (CH2CI 2-MeOHNH4OH, 8:2:0,5). Вихід - 4,3г (85%) 5-ціано-1бензотіофен-7-карбонової кислоти, як коричневої твердої речовини. 1H ЯМР (500MГц, DMSO-d6): 7,7 (d, 1H), 8,1 (d, 2Н), 8,3 (d, 1H), 8,7 (s, 1Н), 14 (b, 1H);Метод 10 202 (M-1)+. LCMS: m/z 7-хлор-2,3-дигідро-1,4-бензодіоксин-5карбонова кислота 82518 52 (a) 5-хлор-2,3-дигідроксибензальдегід 5-хлор-2-гідрокси-3-метоксибензальдегід (див. J. Ors. Chem. 56: 1991; 5453: 20,0г, 107ммоль) суспендують у гідробромній кислоті (100мл 47% у воді). Суміш витримують під зворотним холодильником 6 год. і потім охолоджують до кімнатної температури, після чого розбавляють водою (300мл). Осад збирають фільтруванням і промивають водою. Після сушіння повітрям твердий матеріал очищають просочуванням у CH2CI 2 (4 х 150мл). Вихід - 6,0г (32%) 5-хлор-2,3дигідроксибензальдегіду як твердої речовини. 1H ЯМР (300MГц, CDCI 3): 5,7 (s, 1Н), 7,1 (d, 1H), 7,2 (d, 1H), 9,8 (s, 1H), 11,0 (s, 1H). (b) 7-хлор-2,3-дигідро-1,4-бензодіоксин-5карбальдегід 5-хлор-2,3-дигідроксибензальдегід (6,0г, 34,7ммоль) розчиняють у ДМФ (100мл) і до розчину додають 1,2-диброметан (8,0г, 42,5ммоль) і карбонат калію (10,0г, 70ммоль). Суміш перемішують при 100°C протягом 1 год., охолоджують до кімнатної температури і потім розбавляють водою (200мл). Після екстрагування двічі етилацетатом (200мл) об'єднані органічні розчини промивають розсолом і сушать над Na2SO4. Розчин видаляють випарюванням і твердий залишок обробляють метанолом. Після фільтрування і сушіння отримують 6,5г (94%) 7хлор-2,3-дигідро-1,4-бензодіоксин-5карбальдегідом. 1H ЯМР (300MГц, CDCI 3): 4,3-4,4 (m, 4H), 7,1 (d, 1H), 7,3 (d, 1H), 10,3 (s, 1H). (c) 7-хлор-2,3-дигідро-1,4-бензодіоксин-5карбонова кислота 7-хлор-2,3-дигідро-1,4-бензодіоксин-5карбальдегід (6,25г, 31,4ммоль) розчиняють в ацетоні (150мл) і розчин охолоджують до 5°С. Додають краплями розчин CrO3 у сульфуровій кислоті (4М у 4М H2SO4, 12,5мл, 50ммоль) протягом 2 хвил. і суміш витримують під зворотним холодильником 30 хвил. Додають воду (150мл) і більшу частину ацетону видаляють випарюванням. Суміш екстрагують етером (150мл) і органічний розчин екстрагують розчином NaOH (0,5М, 150мл). Водний розчин підкислюють 2М гідрохлорною кислотою і екстрагують етером (150мл). Органічний розчин промивають розсолом і сушать над Na2SO4. Розчин видаляють випарюванням і залишок обробляють CH2CI 2. Після нітрування і сушіння отримують 5,2г (77%) 7хлор-2,3-дигідро-1,4-бензодіоксин-5-карбонової кислоти. 1H ЯМР (400MГц, ацетон-d6): 4,3-4,4 (m, 4H), 7,1 (d, 1R), 7,3 (d, 1H), 11-12 (b, 1H). Метод 11 3-ціано-1-нафтоїлхлорид 53 3-ціано-1-нафтоїнову кислоту (див. Bioorg. Med. Chem. Lett. 2001, 2769; 1,1г, 5,6ммоль) суспендують у CH2CI 2 (10мл) і з перемішуванням додають оксалілхлорид. Додають краплю ДМФ і суміш перемішують при кімнатній температурі протягом ночі під нітрогеном. Розчин видаляють випарюванням і отримують 1,2г (100%) 3-ціано-1нафтоілхлориду як блідожовтої твердої речовини. 1 H ЯМР (300MГц, CDCI 3): 7,7-7,8 (m, 1H), 7,8-7,9 (m, 1H), 8,0-8,1 (m, 1Н), 8,5 (s, 1Н), 8,7 (s, 1H)1 8,8 (d, 1H). Метод 12 1-ацетидин-3-ілпіролідин-3-ол-дигідрохлорид (a) 1-[1-(дифеніл метил)ацетидин-3іл]піролідин-3-ол 1-(дифенілметил)ацетидин-3-іл метансульфонат (див. J. Org. Chem.; 56; 1991; 6729; 310мг, 0,98ммоль) розчиняють в ацетонітрилі (3,5мл). Додають піролідин-3-ол (104мг, 1,2ммоль) і триетиламін (124мг, 1,2ммоль) і суміш піддають мікрохвильовому одновузловому нагріванню протягом 10 хвил. Розчинник видаляють випарюванням і залишок розчиняють в етилацетаті. Розчин промивають водою, сушать над MgSO4 і розчинник випарюють. Вихід - 280мг (93%) 1-[1-(дифенілметил)ацетидин-3-іл]піролідин3-олу у вигляді масла. 1H ЯМР (300MГц, CDCI 3): 1,6-1,8 (m, 1H), 2,1-2,3 (m, 2Н), 2,4-2,6 (m, 2Н), 2,62,8 (m, 1Н), 2,9-3,0 (m, 2Н), 3,1-3,2 (m, 1Н), 3,3-3,4 (m, 2Н), 4,3 (m, 1Н), 4,4 (s, 1H), 7,1-7,5 (m, 10Н); LCMS: m/z 309 (М+1)+. (b) 1-ацетидин-3-ілпіролідин-3-ол 1-[1-(дифенілметил)ацетидин-3-іл]піролідин-3ол (310мг, 0,98ммоль) розчиняють в етанолі (20мл). Додають суміш гідроксиду паладію на карбоні і паладій на активованому вугіллі і потім краплями додають концентр. HCI (0,1мл). Суміш перемішують під гідрогеном (5 ат) при кімнатній температурі протягом ночі і каталізатор відфільтровують на Celite®. Розчинник видаляють випарюванням і залишок перетирають з CH2CI 2. Вихід - 154мг (79%) дигідрохлориду 1-ацетидин-3ілпіролідин-3-олу як твердої речовини. 13C ЯМР (75MГц, D2O): 48,8 (s), 65,1 (s), 67,7 (s), 70,9 (s), 76,2 (s), 85,7 (s); LCMS: m/z 143 (М+1)+. Метод 13 Гідрохлорид 8-ацетидин-3-іл-1,4-діокса-8азаспіро[4,5]декану 82518 54 (a) 8-[1-(дифенілметил)ацетидин-3-іл]-1,4діокса-8-азаспіро[4,5]декан Цю сполуку синтезують згідно з Методом 12а, але використовуючи 1,4-діокса-8азаспіро[4,5]декан як вихідний матеріал замість піролідин-3-олу (вихід 72%). 1H ЯМР (400MГц, CDCI 3): 1,6-1,8 (m, 4H), 2,3-2,3 (m, 4H), 2,9 (t, 2H), 3,0 (qn, 1H), 3,4 (t, 2H), 3,9 (s, 4H), 4,4 (s, 1Н), 7,17,5 (m, 10Н); LCMS: m/z 365 (М+1)+. (b) гідрохлорид 8-ацетидин-3-іл-1,4-діокса-8азаспіро[4,5]декану 8-[1-(дифенілметил)ацетидин-3-іл]-1,4-діокса8-азаспіро[4,5]декан (0,5г, 1,4ммоль) розчиняють у сухому CH2CI 2 під нітрогеном і до розчину додають 1-хлоретилхлорформат (0,45мл, 4,1ммоль) при 0°C. Суміш перемішують 1,5 год. і додають метанол. Розчин гріють під зворотним холодильником 20 хвил. і розчинник видаляють випарюванням. Залишок перетирають з ацетоном і осад рекристалізують з ізопропілового спирту. Вихід - 235мг (73%) гідрохлориду 8-ацетидин-3-іл1,4-діокса-8-азаспіро[4,5]декану як твердої речовини. LCMS: m/z 199 (M+1)+. Метод 14 Дигідрохлорид тіоморфолін 1,1-діоксидк (a) 1,1-діоксид 4-[1-(дифенілметил)ацетидин-3іл]тіоморфоліну Цю сполуку синтезують згідно з Методом 12а, але використовуючи 1,1-діоксид тіомо-рфоліну (див. J. Chem. Soc. 1949, 3433) замість піролідин3-олу (вихід 19%). 1H ЯМР (400MГц, CDCI 3): 2,7-2,8 (m, 4H), 2,8-2,9 (m, 2Н), 3,0-3,1 (m, 4Н), 3,2 (qn, 1H), 3,4 (m, 2Н), 4,4 (s, 1Н), 7,1-7,4 (m, 10Н); LCMS: m/z 357 (М+1)+. (b) 1,1-діоксиддигідрохлорид тіоморфоліну Цю сполуку синтезують згідно з Методом 12b, але використовуючи 1,1-діоксид 4-[1(дифенілметил)ацетидин-3-іл]тіоморфоліну замість 1-[1-(дифенілметил)ацетидин-3-іл]піролідин-3-олу (вихід 89%). 1H ЯМР (400MГц, D2O): 3,2-3,4 (b, 4H), 3,4-3,5 (m, 4H), 4,2 (m, 1Н), 4,2-4,4 (4Н). Метод 15 Дигідрохлорид 1-ацетидин-3-ілпіперидин-4-олу 55 (a) 1-[1-(дифенілметил)ацетидин-3іл]піперидин-4-ол Цю сполуку синтезують згідно з Методом 12а, але використовуючи піперидин-4-ол замість піролідин-3-олу (вихід 73%). 1H ЯМР (400MГц, CDCI 3): 1,5-1,6 (m, 2H), 1,8 (m, 2Н}; 2,0 (m, 2Н), 2,5 (m, 2Н), 2,8-3,0 (m, 3H), 3,4 (m, 2H), 3,5-3,7 (m, 1Н), 4,4 (s, 1H), 7,1-7,5 (m, 10Н); LCMS: m/z 323 (М+1)+. (b) дигідрохлорид 1-ацетидин-3-ілпіперидин-4олу Цю сполуку синтезують згідно з Методом 12b, але використовуючи 1-[1-(дифеніл метил)ацетидин-3-іл]піперидин-4-ол замість 1-[1(дифенілметил)ацетидин-3-іл]піролідин-3-олу (вихід 89%). 1H ЯМР (400MГц, DMSO-d6): 1,6-5,0 (cm, 13Н), 9,0-9,4 (b, 1Н), 9,8-10,2 (b, 1H), 12,0-12,8 (b, 1H). Метод 16 1-[(3S)-4-[(3-ціано-1-нафтоїл)(метил)аміно]-3(3,4-дихлорфеніл)бутил]цетидин-3-ілметансульфонат (а) 3-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4-(3гідроксиацетидин-1-іл)бутил]-N-метил-1-нафтамід 3-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4оксобутил]-N-метил-1-нафтамід (див. WO 00/02859; 1,0г, 2,3ммоль) розчиняють у CH2CI 2 (10мл) і до розчину додають ацетидин-3олгідрохлорид (0,24г, 2,2ммоль) і триетиламін (0,30мл, 2,2ммоль). Після перемішування протягом 40 хвил. додають триацетоксиборгідрид натрію (0,65г, 3,1ммоль) і розчин перемішують при кімнатній температурі 3 год. Розчинник видаляють випарюванням і залишок розподіляють між насиченим водним розчином NaHCO3 і етилацетатом. Розчинник видаляють випарюванням і залишок розчиняють у гідрохлорній кислоті (1M). Розчин промивають CH2CI 2, підлужують водним NaOH (2M) і екстрагують CH2CI 2. Розчинник видаляють випарюванням і отримують 0,85г (80%) 3-ціано-N(2S)-2-(3,4-дихлорфеніл)-4-(3-гідроксиацетидин-1іл)бутил]-N-метил-1-нафтаміду як білої твердої речовини. 1H ЯМР (400MГц, DMSO-d6): 0,8-4,4 (cm, 16Н), 6,4-8,2 (cm, 8H), 8,6 (d, 1H); LCMS: m/z 482 (M+1)+. 1-[(3S)-4-[(3-ціано-1-нафтоїл)(метил)аміно](b) 3-(3,4-дихлорфеніл)бутил]ацетидин-3ілметансульфонат 3-ціано-N-[(2S)-2-(3,4-дихлорфеніл)-4-(3 82518 56 гідроксиацетидин-1-іл)бутил]-N-метил-1-нафтамід (0,20г, 0,41ммоль) розчиняють у CH2CI 2 і до розчину додають триетиламін (0,17мл, 0,41ммоль). Суміш охолоджують до 0°C і потім обережно додають метансульфоніл-хлорид (0,03мл, 0,41ммоль). Суміш перемішують з охолодженням 30 хвил. і потім при кімнатній температурі ще 1 год. Реакційну суміш розбавляють CH2CI 2 і промивають гідро-хлорною кислотою (1M), насиченим NaHCO3 і розсолом. Органічний розчин сушать над MgSO4 і розчинник видаляють випарюванням. Вихід - 0,21г (92%) 1[(3S)-4-[(3-ціано-1-нафтоїл)(метил)аміно]-3-(3,4дихлорфеніл)бутил]ацетидин-3ілметансульфонату як твердої речовини. LCMS: m/z 560 (М+1)+. Метод 17 3-ціано-N-[2-(4-флуорфеніл)-4-оксобутил]-Nметил-1-нафтамід (a) 2-(4-флуорфеніл)-N-метилпент-4-енамід 2-{4-флуорфеніл)пент-4-енойну кислоту (Bioorg. Med. Chem. Lett. 2000, 1893; 4,20г, 21,6ммоль) розчиняють у CH2CI 2 (75мл) і до розчину додають TBTU (7,29г, 22,7ммоль). Суміш перемішують при кімнатній температурі 15 хвил. і додають метиламін (11,9мл 2М розчину у ТГФ, 23,8ммоль) і DIPEA (11,2г, 86,5ммоль). Реакційну суміш перемішують при кімнатній температурі 3 год., розбавляють CH2CI 2 (50мл) і промивають декілька разів водою. Розчинник видаляють випарюванням і залишок флеш-хроматографують на силікагелі (гептан-етилацетат, 1:1). Вихід - 3,5г (78%) 2-(4-флуорфеніл)-N-метилпент-4-енамід у вигляді масла, яке швидко кристалізується. 1H ЯМР (400MГц, CDCI 3): 2,5 (qn, 1H), 2,7 (d, 3H), 2,9 (qn, 1H), 3,4 (t, 1H), 4,9-5,1 (m, 2H), 5,6-5,8 (m, 1Н), 6,0-6,2 (b, 1H), 7,0 (m, 2Н), 7,3 (m, 2Н). (b) [2-(4-флуорфеніл)пент-4-ен-1-іл]метиламін Алюмогідрид літію (0,11г, 2,9ммоль) суспендують в етері (15мл) під нітрогеном з перемішуванням. Обережно додають розчин 2-(4флуорфеніл)-N-метилпент-4-енаміду (0,20г у 5мл етеру, 0,97ммоль) і суміш перемішують при кімнатній температурі протягом ночі. Краплями додають воду (0,11мл) і потім розчин NaOH (0,11мл 15%-й водний розчин) і знову воду (0,33мл). Суміш перемішують 10 хвил. і фільтрують. Фільтрувальний брикет промивають етером і об'єднані розчини промивають декілька разів водою. Органічний розчин сушать над MgSO4 і розчинник видаляють випарюванням. Вихід 0,16г (86%) [2-(4-флуорфеніл)пент-4-ен-1іл]метиламіну у вигляді масла. 1 H ЯМР (400MГц, CDCI 3): 2,4-2,6 (m, 5H), 2,7-2,9 (m, 3H), 4,9-5,0 (m, 2H), 5,6-5,8 (m, 1Н), 7,0 (m, 2H), 7,1 (m, 2H); LCMS: m/z 1943-ціано-N-[2-(4-флуорфеніл)пент-4-ен-1-іл](c) (М+1)+. 57 1N-метил-1-нафтамід [2-(4-флуорфеніл)пент-4-ен-1-іл]метиламін (1,0г, 5,2ммоль) розчиняють у CH2CI 2 і перемішують при 0°C, додаючи DIPEA (1,5г, 11,4ммоль) і 3-ціано-1-нафтоїлхлорид (Метод 11; 1,1г, 5,17ммоль). Суміш короткочасно перемішують з охолодженням і потім перемішують при кімнатній температурі 2 год. Суміш промивають двічі водою, потім водним розчином KHSO4 і розсолом. Розчинник видаляють випарюванням і залишок флеш-хроматографують на силікагелі (метанол-СН2СІ 2, 5:95). Вихід - 1,55г (80%) 3-ціано-N-[2-(4-флуорфеніл)пент-4-ен-1-іл]N-метил-1-нафтаміду у вигляді масла. 1H ЯМР (400MГц, CDCI 3): 2,1-4,9 (cm, 8H), 5,0-5,1 (m, 2H), 5,6-5,8 (m, 1Н), 6,4-8,0 (cm, 9H), 8,2 (s, 1Н). (d) 3-ціано-N-[2-(4-флуорфеніл)-4-оксобутил]N-метил-1-нафтамід 3-ціано-N-{2-(4-флуорфеніл)пент-4-ен-1-іл]-Nметил-1-нафтамід (1,5г, 4,03ммоль) розчиняють у суміші ацетону (30мл), трет-бутанолу (15мл) і води (7,5мл) і перемішують при кімнатній температурі, додаючи OsO4 (0,40мл 2,5% у трет-бутанолі, 0,04ммоль). Додають 4-метилморфолі-N-оксид (2,08г, 17,8ммоль) і суміш перемішують при кімнатній температурі протягом ночі. Додають насичений водний розчин бісульфіт натрію (15мл) і суміш перемішують 5 хвил., після чого концентрують. Залишок розбавляють водою (100мл) і екстрагують тричі CH2CI 2. Об'єднані органічні розчини промивають розсолом і розчинник видаляють випарюванням. Залишок розчиняють у суміші ТГФ (21мл) і води (7мл) і додають перйодат натрію (0,95г, 4,43ммоль). Розчин перемішують при кімнатній температурі протягом ночі і потім розбавляють водою (150мл) і розсолом (75мл). Суміш екстрагують тричі етилацетатом і об'єднані органічні розчини промивають водою і розсолом. Розчинник видаляють випарюванням і залишок флешхроматографують на силікагелі (етилацетатгептан, 7:3). Вихід - 1,43г (95%) 3-ціано-N-[2-(4флуорфеніл)-4-оксобутил]-N-метил-1-нафтаміду як безбарвного масла. 1 H ЯМР (400MГц, CDCI 3): 2,4-4,4 (cm, 8H), 6,8-8,0 (cm, 9H), 8,2 (8, 1Н), 9,8 (s, 1Н).Метод 18 3-ціано-N-[2-(4-ціанофеніл)-4-оксобутил-Nметил-1-нафтамід (a) {2-(4-бромфеніл)-4[(триізопропілсиліл)окси]бутил}метиламін 3-(4-бромфеніл)-4-(метиламіно)бутан-1-ол (див. Chem. Pharm. Bull. 46, 1993, 242; 1,77г, 6,86ммоль) розчиняють у CH2CI 2 (100мл) при 0°C під аргоном. Додають імідазол (1,22г, 17,9ммоль), 82518 58 суміш перемішують 10 хвил. і потім додають триізопропілхлорсилан (3,16г, 16,4ммоль, з охолодженням). Суміш перемішують при кімнатній температурі протягом 48 год. і промивають двічі водою (100мл) і розсолом. Розчинник видаляють випарюванням і залишок флеш-хроматографують на силікагелі (CH2CI 2 - метанол - NH4OH, 15:1:0,1). Вихід 2,17г (75%) {2-(4-бромфеніл)-4[(триізопропілсиліл)окси]бутил}метиламіну у вигляді масла. 1 H ЯМР (300MГц, CDCI 3): 0,9-1,1 (m, 21Н), 1,6-1,9 (m, 2H), 2,4 (s, 3H), 2,7-2,8 (m, 2H), 3,0-3,1 (m, 1Н), 3,4-3,6 (m, 2Н), 7,1 (d, 2H), 7,4 (d, 2H). (b) трет-бутил {2-(4-бромфеніл)-4[(триізопропілсиліл)окси]бутил}метилкарбамат {2-(4-бромфеніл)-4[(триізопропілсиліл)окси]бутил}метиламін (0,95г, 2,3ммоль) і 4-диметиламінопіридин (0,34г, 2,8ммоль) розчиняють у сухому CH2CI 2 (10мл) під нітрогеном. Додають Вос-ангідрид (1,1г, 5,1ммоль) при 0°C і суміш перемішують при кімнатній температурі протягом 48 год. і промивають двічі розсолом. Розчин сушать над Na2SO4 і розчинник видаляють випарюванням. Залишок флешхроматографують на силікагелі (гек-сан-етер, від 40:1 до 8:1). Вихід - 1,66 г (73%) трет-бутил {2-(4бромфеніл)-4-[(триізопропілсиліл)окси]бутил}метилкарбамату у вигляді масла. 1H ЯМР (300MГц, CDCI3): 0,9-1,1 (m, 21Н), 1,4 (S, 9Н), 1,7-1,9 (m, 2Н), 2,7 (m, 3H), 3,2-3,6 (m, 5H), 7,0-7,1 (m, 2Н), 7,3-7,4 (m, 2Н). (c) трет-бутил {2-(4-ціанофеніл)-4[(триізопропілсиліл)окси]бутил}метилкарбамат Трет-бутил {2-(4-бромфеніл)-4[(триізопропілсиліл)окси]бутил}метилкарбамат (1,16г, 2,25ммоль), трис(дибензіліденацетон)дипаладій (0) (0,62г, 0,68ммоль) і три-о-толілфосфін (1,03г, 3,38ммоль) змішують з ацетонітрилом (3мл) і ДМФ (3мл) під аргоном. Додають ціанід цинку (0,16г, 1,35ммоль) і суміш перемішують при 81°С 24 год. і потім концентрують. Додають етилацетат і суспензію фільтрують через мікрофільтр. Розчинник видаляють випарюванням і залишок очищають флеш-хроматографією (гексан-етер, 10:1). Вихід 0,43г (41%) трет-бутил {2-(4-ціанофеніл)-4[(триізопропілсиліл)окси]бутил}-метилкарбамату як твердої речовини. 1H ЯМР (300MГц, CDCI 3): 0,91,1 (m, 21 H), 1,4 (s, 9H), 1,7-1,9 (m, 2H), 2,7 (m, 3H), 3,2-3,6 (m, 5H), 7,3-7,4 (m, 2H), 7,5-7,6 (m, 2H); MS: m/z 361 (М+1)+. (d) 4-{3-гідрокси-1[(метиламіно)метил]пропілібензонітрил Трет-бутил {2-(4-ціанофеніл)-4[(триізопропілсиліл)окси]бутил}метилкарбамат (0,37г) розчиняють у ТГФ (8мл) при 0°C. Додають гідрохлорну кислоту (8мл 6М розчину) і суміш перемішують протягом ночі при кімнатній температурі. Леткі компоненти видаляють випарюванням і потім видаляють азеотропічно після додання метанолу (5x50мл). Залишок розчиняють у воді і розчин підлужують до рН 8-9 доданням Na2CO3 (s), після чого екстрагують тричі етилацетатом (100мл). Органічний розчин сушать над Na2SO4 і розчинник випарюють. Продукт 59 очищають флеш-хроматографією (CH2CI 2-MeOHNH4OH, 9:1:0,1). Вихід - 0,10г, 60%) 4-{3-гідрокси-1[(метиламіно)метил]пропіл}бензонітрилу як твердої речовини. 1H ЯМР (300MГц, CDCI 3): 1,92,0 (m, 2H), 2,5 (s, 3H), 2,8-2,9 (m, 3H)1 3,4-3,7 (m, 3H), 3,7 (m, 1Н), 7,3 (d, 2H), 7,6 (d, 2H); LCMS: m/z 205 (М+1)+. (e) 3-ціано-N-[2-(4-ціанофеніл)-4гідроксибутил]-N-метил-1-нафтамід (f) 4-{3-гідрокси-1[(метиламіно)метил]пропіл}бензонітрил (0,55г, 2,69ммоль) і DIPEA (0,77г, 5,9ммоль) розчиняють у CH2CI 2 (5мл). Порціями з перемішуванням і охолодженням (зовнішня льодяна ванна) додають 3-ціано-1-нафтоїлхлорид (див. Метод 11; 0,58г, 2,69ммоль). Суміш перемішують 2 год. з охолодженням і розбавляють CH2CI 2 (10мл). Розчин промивають двічі водою, двічі насиченим водним KHSO4 і розсолом. Розчинник видаляють випарюванням і залишок флеш-хроматографують на силікагелі (CH2CI 2-MeOH, 9:1). Вихід -0,70г (67%) 3-ціано-N-[2-(4-ціанофеніл)-4-гідроксибутил]N-метил-1-нафтаміду як білої твердої речовини. 1H ЯМР (400MГц, CDCI 3): 1,4-2,5 (cm, 2H), 2,6 (s, 3H), 3,1-4,6 (cm, 6H), 6,4-7,8 (cm, 8H), 7,9 (d, 1H), 8,2 (s, 1H); LCMS: m/z 384 (М+1)+. (g) 3-ціано-N-[2-(4-ціанофеніл)-4-оксобутил]-Nметил-1-нафтамід 3-ціано-N-[2-(4-ціанофеніл)-4-гідроксибутил]-Nметил-1-нафтамід (0,70г, 1,8ммоль) розчиняють у CH2CI 2 (15мл) і до розчину порціями додають перйодинан Дес-Мартина (0,85г, 2,0ммоль). Суміш перемішують при кімнатній температурі протягом ночі і потім додають тіосульфат (1,9г, 12ммоль), розчинений у насиченому розчині NaHCO3 (30мл). Суміш перемішують протягом 2 год., органічний розчин промивають розсолом і сушать над Na2SO4. Розчинник видаляють випарюванням і залишок очищають флеш-хроматографією (етилацетат-гептан, 4:1). Вихід - 0,50г, (43%) 3ціано-N-[2-(4-ціанофеніл)-4-оксобутил]-N-метил-1нафтаміду як білої твердої речовини. 1B ЯМР (400MГц, CDCI 3): 2,7 (s, 3H), 2,9-4,4 (cm, 5H), 6,47,8 (cm, 8H), 7,9 (d, 1H), 8,2 (s, 1H), 9,8 (s, 1H); LCMS: m/z 382(М+1)+. Метод 19 3-ціано-N-[(2S)-2-(4-флуорфеніл-4-оксобутил]N-метил-5,6,7,8-тетрагідронафталін-1-карбоксамід (f) 3-ціано-N-[(2S)-2-(4-флуорфеніл)пент-4-ен1-іл]-N-метил-5,6,7,8-тетрагідронафталін-1карбоксамід [(2S)-2-(4-флуорфеніл)пент-4-ен-1іл]метиламін (див. Bioorg. Med. Chem. Lett; 2001; 265-270; 300мг, 1,55ммоль) розчиняють у CH2CI 2 (30мл) і до розчину додають DIPEA (440мг, 3,40ммоль) з 3-ціано-5,6,7,8-тетрагідронафталін-1 82518 60 карбонілхлоридом (див. WO 00/34243; 341мг, 1,55ммоль). Суміш перемішують 2 год. при кімнатній температурі, розбавляють CH2CI 2 (20мл) і промивають водою, водним розчином KHSO4 і розсолом. Розчин сушать над Na2SO4 і розчинник випарюють. Залишок хроматографують на силікагелі, використовуючи суміш гептану і етилацетату as елюент (7:3), і отримують 460мг (78%) 3-ціано-N-[(2S)-2-(4-флуорфеніл)пент-4-ен1-іл]-N-метил-5,6,7,8-тетрагідронафталін-1карбоксаміду у вигляді масла. 1E ЯМР (400MГц, CDCI 3): 0,8-4,2 (cm, 16Н), 4,8-5,1 (m, 2H), 5,6-5,8 (m, 1H), 6,7-7,4 (cm, 6H); LCMS: m/z 377 (М+1)+. (b) 3-ціано-N-[(2S)-2-(4-флуорфеніл)-4оксобутил]-N-метил-5,6,7,8-тетрагідронафталін-1карбоксамід 3-ціано-N-[(2S)-2-(4-флуорфеніл)пент-4-ен-1іл]-N-метил-5,6,7,8-тетрагідронафталін-1карбоксамід (460мг, 1,22ммоль) розчиняють у суміші ацетону (8мл), t-бутилового спирту (4mL) і води (2мл) під нітрогеном. Додають OsO4 (2,5% у tбутиловому спирті, 0,165мл, 0,01ммоль) разом з 4метилморфолін-4-оксидом (630мг, 5,4ммоль). Розчин перемішують при кімнатній температурі 5 год. і додають водний розчин NaHSO3 (39%, 12мл). Суміш перемішують 15 хвил., розбавляють водою (50мл) і екстрагують тричі CH2CI 2. Органічний розчин сушать над Na2SO4 і розчинник випарюють. Залишок (570мг) розчиняють у суміші ТГФ (7мл) і води (3мл) і до розчину додають перйодат натрію (287мг, 1,34ммоль). Суміш перемішують при кімнатній температур протягом ночі, розбавляють водою (50мл) і розсолом (30мл) і потім екстрагують двічі CH2CI 2. Органічний розчин сушать над Na2SO4 і розчинник випарюють. Вихід 415мг (89%) 3-ціано-N-[(2S)-2-(4-флуорфеніл)-4oкcoбyтил]-N-мeтил-5,6,7,8-тeтpaгiдpoнaфтaлiн-1кapбoкcaмiдy у вигляді масла. 1H ЯМР (400MГц, CDCI 3): 1,4-4,2 (cm, 16Н), 6,6-7,4 (cm, 6H), 9,7 (s, 1H); LCMS: m/z 379 (М+1)+. Метод 20 N-[(2S)-2-(4-флуорфеніл)-4-оксобутил-Nметил-3.5-біс(трифлуорметил)бензамід (a) N-[(2S}-2-(4-флуорфеніл)пент-4-ен-1-іл]-Nметил-3,5-біс(трифлуорметил)бензамід [(2S)-2-(4-флуорфеніл)пент-4-ен-1іл]метиламін (Bioorg. Med. Chem. Lett; - 2001; 265270; 300мг, 1,55ммоль) розчиняють у ДМФ (3мл) і до розчину додають 3,5біс(трифлуорметил)бензойну кислоту (440мг, 1,71ммоль), TBTU (548мг: 1,71ммоль) і DIPEA (803мг, 6,21ммоль). Суміш перемішують 2 год. при кімнатній температурі, розбавляють водним розчином NaHCO3 (насичен., 25мл) і екстрагують тричі етилацетатом. Об'єднані органічні розчини промивають тричі водою і сушать над Na2SO4.
ДивитисяДодаткова інформація
Назва патенту англійськоюAzetidine compounds, process for the preparation thereof (variants), pharmaceutical composition based thereon
Автори англійськоюJohansson Anders, Persson Joachim
Назва патенту російськоюСоединения азетидина, способ их получения (варианты), фармацевтическая композиция на их основе
Автори російськоюЙоханссон Андерс, Перссон Йоахим
МПК / Мітки
МПК: C07D 413/04, A61P 11/00, C07D 413/14, C07D 401/04, C07D 403/04, C07D 403/14, C07D 417/12, A61K 31/54, A61K 31/541, A61P 25/00, C07D 417/14, A61P 25/28, A61P 9/00
Мітки: азетидину, спосіб, сполуки, композиція, одержання, основі, фармацевтична, варіанти
Код посилання
<a href="https://ua.patents.su/36-82518-spoluki-azetidinu-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Сполуки азетидину, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі</a>
Попередній патент: Нові похідні 8-аза-біцикло[3.2.1]октану та їх застосування як інгібіторів ресорбції моноамінових медіаторів
Наступний патент: Заміщені дигідрохіназоліни, які мають антивірусні властивості
Випадковий патент: Трьохканальний гідравлічний розподілювач з відкритим центром












