Моногідрат похідного азаадамантану
Номер патенту: 110802
Опубліковано: 25.02.2016
Автори: Чжан Джефф Дж. З., Напір Джеймс Дж., Брекмейєр Пол Дж, Чень Шуан
Формула / Реферат
1. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату, де (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декан представлений формулою (І)
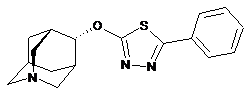 (I)
(I)
і де дигідроцитрат представлений формулою (II)
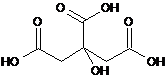 (II).
(II).
2. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату за п. 1, де моногідрат має чистоту, що характеризується вмістом щонайменше 90 % моногідратної форми і не більше ніж 10 % немоногідратної форми.
3. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату за п. 1, де моногідрат має чистоту, що характеризується вмістом щонайменше 95 % моногідратної форми і не більше ніж 5 % немоногідратної форми.
4. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату за п. 1, де моногідрат має чистоту, що характеризується вмістом щонайменше 97 % моногідратної форми і не більше ніж 3 % немоногідратної форми.
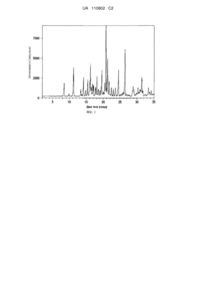
5. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату за п. 1, що характеризується щонайменше одним характеристичним піком на порошковій рентгенограмі при значеннях в градусах два-тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 і 26,9±0,20.
6. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату за п. 1, що має параметри елементарної комірки, в якій a становить приблизно 6,52Å, b становить приблизно 20,99Å, с становить приблизно 16,83Å, α становить приблизно 90,0°, β становить приблизно 93,75°, γ становить приблизно 90,0°, об'єм становить приблизно 2297,52Å3, і Z становить приблизно 4.
7. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату за п. 1, де моногідрат виявляє негігроскопічні властивості, що визначаються за допомогою методу динамічної гравіметрії сорбції вологи, маючи втрату маси менше ніж приблизно 0,2 % в інтервалі відносної вологості від 0 % до 90 %.
8. Спосіб лікування або попередження станів, розладів або порушень, що модулюються α7-нікотиновими ацетилхоліновими рецепторами, α4β2-нікотиновими ацетилхоліновими рецепторами або обома α7- і α4β2-нікотиновими ацетилхоліновими рецепторами, де стан, розлад або порушення вибирають з групи, що складається з розладу пам'яті, когнітивного розладу, нейродегенерації і порушення розвитку центральної нервової системи, що включає введення терапевтично придатної кількості кристалічного моногідрату за п. 1.
9. Спосіб за п. 8, де стан або розлад вибирають з групи, що складається з синдрому порушення уваги, синдрому дефіциту уваги з гіперактивністю (ADHD), хвороби Альцгеймера (AD), помірних когнітивних порушень, шизофренії, вікового порушення пам'яті (ААМІ), сенільної деменції, деменції при СНІДі, хвороби Піка, деменції, пов'язаної з тільцями Леві, деменції, пов'язаної з синдромом Дауна, бічного аміотрофічного склерозу, хвороби Хантінгтона, припинення куріння, абстинентного синдрому припинення прийому нікотину, шизоафективного розладу, біполярних і маніакальних розладів, дефіцитарної функції ЦНС, пов'язаної з травматичним пошкодженням мозку, гострого болю, післяопераційного болю, хронічного болю, запального болю і невропатичного болю.
10. Спосіб за п. 8, де стан або розлад являє собою когнітивне порушення, пов'язане з синдромом дефіциту уваги з гіперактивністю, шизофренією, хворобою Альцгеймера, помірними когнітивними порушеннями, віковим порушенням пам'яті і когнітивними порушеннями при шизофренії.
11. Спосіб за п. 8, що додатково включає введення сполуки, що включає кристалічний моногідрат за п. 1, в комбінації з атиповими нейролептиками.
12. Спосіб за п. 8, де стан або розлад вибирають з групи, що складається з безпліддя, недостатності кровообігу, необхідності в рості нових кровоносних судин, пов'язаної із загоєнням рани, необхідності в рості нових кровоносних судин, пов'язаної з васкуляризацією шкірних трансплантатів, ішемії, запалення, артриту і споріднених захворювань, загоєння рани і ускладнень, пов'язаних з діабетом.
13. Спосіб отримання кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату, в якому здійснюють стадії:
(a) розчинення (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло-[3.3.1.13,7]декану дигідроцитрату щонайменше в одному розчиннику при температурі в інтервалі від приблизно 65 °C до приблизно 85 °C;
(b) доведення температури розчину до температури в інтервалі від приблизно 55 °C до приблизно 75 °C;
(c) додавання до розчину щонайменше одного додаткового розчинника і перемішування;
(d) доведення температури розчинів до температури в інтервалі від приблизно 30 °C до приблизно 50 °C;
(e) додавання до розчину щонайменше одного додаткового розчинника;
(f) витримування суспензії при температурі в інтервалі від приблизно 30 °C до приблизно 50 °C;
(g) доведення температури суспензії до температури в інтервалі від приблизно -5 °C до приблизно 15 °C;
(h) перемішування суспензії протягом щонайменше однієї години; і
(і) виділення кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату.
14. Спосіб за п. 13, де використовують розчинник на стадії (а), який містить комбінацію води і щонайменше одного іншого органічного розчинника, де комбінація має критичну активність води, яка більше ніж або дорівнює 0,15.
15. Спосіб за п. 14, де щонайменше один інший розчинник вибирають з групи, що складається з метанолу, етанолу, 2-пропанолу, бутанолу, ацетонітрилу, ацетону, формаміду, диметилформаміду, толуолу, бензолу, анізолу, етилацетату, ізопропілацетату, тетрагідрофурану, 1,4-діоксану, метилтретбутилового ефіру, дихлорметану, хлороформу, гексанів, н-гептану, 2-бутанону, диметилсульфоксиду, нітрометану, 1-метил-2-піролідону, триетиламіну, трибутиламіну, трифтортолуолу і їх сумішей.
16. Спосіб за п. 13, де використовують розчинник стадії (а), який включає суміш 2-пропанолу і води.
17. Спосіб за п. 16, де суміш щонайменше одного іншого розчинника і води включає відношення 2-пропанолу до води в інтервалі від приблизно 20:1 до приблизно 1:10.
18. Спосіб за п. 16, де суміш щонайменше одного іншого розчинника і води включає відношення 2-пропанолу до води в інтервалі від приблизно 1:1 до приблизно 7:1.
19. Спосіб за п. 13, де температуру стадії (а) змінюють в інтервалі від приблизно 70 °C до приблизно 80 °C.
20. Спосіб за п. 13, де температуру стадії (а) змінюють в інтервалі від приблизно 74 °C до приблизно 76 °C.
21. Спосіб за п. 13, де стадія (b) включає доведення температури розчину в інтервалі від приблизно 60 °C до приблизно 70 °C.
22. Спосіб за п. 13, де на стадії (b) здійснюють коректування температури розчину в інтервалі від приблизно 64 °C до приблизно 66 °C.
23. Спосіб за п. 13, де використовують розчинник на стадії (с), що включає органічний розчинник, воду і їх комбінації.
24. Спосіб за п. 13, де розчинник стадії (с) вибирають з групи, що складається з метанолу, етанолу, 2-пропанолу, бутанолу, ацетонітрилу, ацетону, формаміду, диметилформаміду, толуолу, бензолу, анізолу, етилацетату, ізопропілацетату, тетрагідрофурану, 1,4-діоксану, метилтретбутилового ефіру, дихлорметану, хлороформу, гексанів, н-гептану, 2-бутанону, диметилсульфоксиду, нітрометану, 1-метил-2-піролідону, триетиламіну, трибутиламіну, трифтортолуолу, води і їх сумішей.
25. Спосіб за п. 13, де використовують розчинник на стадії (с), що включає 2-пропанол.
26. Спосіб за п. 25, де кількість 2-пропанолу, що використовують на стадії (с), включає від приблизно 2 об'ємів до приблизно 10 об'ємів відносно кількості розчинника, що використовують на стадії (а).
27. Спосіб за п. 25, де кількість 2-пропанолу, що використовують на стадії (с), включає від приблизно 5 об'ємів до приблизно 7 об'ємів відносно кількості розчинника, що використовують на стадії (а).
28. Спосіб за п. 13, де на стадії (d) здійснюють коректування температури в інтервалі від приблизно 35 °C до приблизно 45 °C.
29. Спосіб за п. 13, де на стадії (d) здійснюють коректування температури в інтервалі від приблизно 39 °C до приблизно 41 °C.
30. Спосіб за п. 13, де використовують розчинник на стадії (e), який включає органічний розчинник, воду і їх комбінації.
31. Спосіб за п. 13, де розчинник стадії (e) вибирають з групи, що складається з метанолу, етанолу, 2-пропанолу, бутанолу, ацетонітрилу, ацетону, формаміду, диметилформаміду, толуолу, бензолу, анізолу, етилацетату, ізопропілацетату, тетрагідрофурану, 1,4-діоксану, метилтретбутилового ефіру, дихлорметану, хлороформу, гексанів, н-гептану, 2-бутанону, диметилсульфоксиду, нітрометану, 1-метил-2-піролідону, триетиламіну, трибутиламіну, трифтортолуолу, води і їх сумішей.
32. Спосіб за п. 13, де використовують розчинник стадії (e), що включає 2-пропанол.
33. Спосіб за п. 32, де кількість 2-пропанолу, що використовують на стадії (e), включає від приблизно 1 об'єму до приблизно 10 об'ємів відносно кількості розчинника, що використовують на стадіях (а) і (с).
34. Спосіб за п. 32, де кількість 2-пропанолу, що використовують на стадії (e), включає від приблизно 4 об'ємів до приблизно 6 об'ємів відносно кількості розчинника, що використовують на стадіях (а) і (с).
35. Спосіб за п. 13, де на стаді (f) здійснюють доведення температури в інтервалі від приблизно 35 °C до приблизно 45 °C.
36. Спосіб за п. 13, де на стадії (f) здійснюють доведення температури в інтервалі від приблизно 39 °C до приблизно 41 °C.
37. Спосіб за п. 13, де на стадії (g) здійснюють доведення температури суспензії до температури в інтервалі від приблизно 0 °C до приблизно 10 °C.
38. Спосіб за п. 13, де на стадії (g) здійснюють доведення температури суспензії до температури в інтервалі від приблизно 4 °C до приблизно 6 °C.
39. Спосіб за п. 13, де на стадії (і) здійснюють виділення кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]-декану дигідроцитрату за допомогою фільтрації.
40. Спосіб отримання кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7] декану дигідроцитрату, в якому здійснюють стадії:
(a) розчинення (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло-[3.3.1.13,7]декану дигідроцитрату в приблизно 4 об'ємах 2-пропанолу і в приблизно 1 об'ємі води при температурі приблизно 75 °C;
(b) доведення температури розчину до температури приблизно 65 °C;
(c) додавання до розчину приблизно 6 об'ємів 2-пропанолу і перемішування;
(d) доведення температури до приблизно 40 °C;
(е) додавання до розчину приблизно 5 об'ємів 2-пропанолу;
(f) витримування суспензії при температурі приблизно 40 °C;
(g) доведення температури суспензії до температури приблизно 5 °C;
(h) перемішування суспензії; і
(і) виділення кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату.
41. Спосіб отримання кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату, в якому здійснюють стадії:
(a) контактування безводного (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату з розчинником в реакційній посудині;
(b) герметизації реакційної посудини і захисту суспензії від впливу світла за умов навколишнього середовища; і
(c) виділення кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату.
42. Спосіб за п. 41, де використовують розчинник на стадії (а), що включає воду.
43. Спосіб за п. 42, де використовують кількість безводного (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату, що включає від приблизно 10 мг до приблизно 500 мг, і де кількість води включає від приблизно 0,1 мл до приблизно 2,0 мл.
44. Спосіб за п. 42, де використовують кількість безводного (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату, що включає від приблизно 50 мг до приблизно 150 мг, і де кількість води включає від приблизно 0,8 мл до приблизно 1,2 мл.
45. Спосіб за п. 41, де використовують розчинник на стадії (а), що включає суміш органічного розчинника і води, де суміш має критичну активність води, яка більше ніж або дорівнює 0,15.
46. Спосіб за п. 45, де використовують органічний розчинник, що включає метанол, етанол, 2-пропанол, бутанол, ацетонітрил, ацетон, формамід, диметилформамід, толуол, бензол, анізол, етилацетат, ізопропілацетат, тетрагідрофуран, 1,4-діоксан, метилтретбутиловий ефір, дихлорметан, хлороформ, гексани, н-гептан, 2-бутанон, диметилсульфоксид, нітрометан, 1-метил-2-піролідон, триетиламін, трибутиламін, трифтортолуол і їх суміші.
47. Фармацевтична композиція, що містить кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату як активний інгредієнт і фармацевтично прийнятний носій, розріджувач або допоміжну речовину.
48. Фармацевтична композиція за п. 47, де кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату присутній в кількості в інтервалі від приблизно 0,1 % до приблизно 99,9 % за масою від загальної маси композиції.
49. Фармацевтична композиція за п. 47, де кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.13,7]декану дигідроцитрату характеризується щонайменше одним характеристичним піком на порошковій рентгенограмі при значеннях в градусах два-тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 і 26,9±0,20.
Текст
Реферат: Винахід стосується кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату, композицій, що містять цю сполуку, і способу отримання цієї сполуки. UA 110802 C2 (12) UA 110802 C2 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОПИС Перехресне посилання на споріднені заявки Ця заявка вимагає пріоритет попередньої заявки на патент США № 61/385674, поданої 23 вересня 2010 року, зміст якої наводиться в описі даного винаходу шляхом посилання на неї. Заява про дослідження і розробки, що фінансуються з державного бюджету Не фінансувалися. РІВЕНЬ ТЕХНІКИ Галузь техніки, до якої належить винахід Винахід належить до похідних азаадамантану і, більш конкретно, до кристалічних моногідратних форм похідних азаадамантану, композицій, що включають ці сполуки, до способів попередження або лікування станів і розладів з використанням таких сполук і композицій і до способів отримання цих сполук. Опис спорідненої технології Нікотинові ацетилхолінові рецептори (nAChRs) широко поширені в центральній (ЦНС) і периферичній (ПНС) нервовій системі. Такі рецептори відіграють важливу роль в регулюванні функції ЦНС, зокрема, шляхом модуляції вивільнення широкого ряду нейротрансмітерів, включаючи, але цим не обмежуючись, ацетилхолін, норепінефрин, допамін, серотонін і гаммааміномасляну кислоту (GABA). Отже, нікотинові рецептори опосередковують дуже широкий ряд фізіологічних ефектів, і їх цілеспрямовано застосовують для терапевтичного лікування нарівні з іншими станами, розладів, пов'язаних з когнітивною функцією, запам'ятовуванням і пам'яттю, нейродегенеративних розладів, болю, запалення, психозу, сенсорних розладів, розладів настрою і емоційних розладів. У ЦНС і на периферії існує велика кількість підтипів nAChR. Кожний підтип по-різному впливає на регулювання загальної фізіологічної функції. Звичайно nAChRs являють собою іонні канали, які утворені з пентамерного ансамблю білкових субодиниць. Щонайменше в нервовій тканині були ідентифіковані 12 білкових субодиниць - α2-α10 і β2-β42. Ці субодиниці забезпечують велику різноманітність гомомерних і гетеромерних комбінацій, які дають різні підтипи рецепторів. Наприклад, домінуючий рецептор, який є відповідальним за високоафінне зв'язування нікотину в тканині головного мозку, має композицію (α4) 2(β2)3 (підтип α4β2), в той час як інша основна популяція рецепторів складається з гомомерних (α7) 5 (підтип α7) рецепторів. Деякі сполуки, такі як нікотин рослинних алкалоїдів, взаємодіють з усіма підтипами nAChR, що пояснює сильні фізіологічні ефекти цієї сполуки. Незважаючи на те, що було показано, що нікотин має багато позитивних властивостей, проте не всі ефекти, опосередковані нікотином, є бажаними. Наприклад, нікотин надає побічну дію на шлунково-кишковий тракт і серцевосудинну систему, яка виявляється при терапевтичних дозах, і добре відома його здатність спричиняти звикання до нього і його висока токсичність. Ліганди, які селективно взаємодіють тільки з конкретними підтипами nAChR, дають можливість досягати позитивних терапевтичних ефектів при забезпеченні більшої міри безпеки. Було показано, що α7 і α4β2 nAChRs відіграють важливу роль в поліпшенні пізнавальної функції, включаючи аспекти запам'ятовування, пам'яті і уваги (Levin E. D., J. Neurobiol. 53: 633640, 2002). Наприклад, α7 nAChRs пов'язують з такими станами і розладами, як синдром порушення уваги, синдром дефіциту уваги з гіперактивністю (ADHD), шизофренія, хвороба Альцгеймера (AD), помірні когнітивні порушення, сенільна деменція, деменція, пов'язана з тільцями Леві, деменція, пов'язана з синдромом Дауна, деменція, пов'язана зі СНІДом, і хвороба Піка, а також запалення. Підтип α4β2 рецептора залучений до процесів, пов'язаних з увагою, пізнавальною здатністю, епілепсією і контролем болю (Paterson and Norberg, Progress in Neurobiology 61 75-111, 2000), а також з припиненням куріння або абстинентним синдромом припинення прийому нікотину. Активність обох підтипів α7 і α4β2 nAChRs може бути модифікована або контролюється шляхом введення лігандів, селективних відносно даного підтипу nAChR. Ліганди можуть виявляти властивості антагоніста, агоніста або часткового агоніста. Відомі також сполуки, які діють як алостеричні модулятори. Незважаючи на те, що відомі сполуки, які виявляють неселективну активність відносно ряду підтипів нікотинового рецептора, включаючи α4β2 і α7 nAChRs, проте бажано створити сполуки, які б селективно взаємодіяли з α7-вмісними нейронними nAChRs, α4β2 nAChRs або з обома, і з α7, і з α4β2 nAChRs, в порівнянні з іншими підтипами. У зв'язку з цією необхідністю, що виникла в рамках відомого рівня техніки, автори винаходу проводили пошук інших сполук і розробили нові похідні азаадамантану, розкриті в одночасно заявлених патентних документах. А саме заявка на патент США № 2008/0167336 (яка далі в 1 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 описі винаходу називається "публікацією '336") належала до похідних азаадамантану і сольових форм сполук. У публікації '336 указано, що розкриті в ній конкретні сполуки можуть існувати у вигляді солей сполуки винаходу. Солі такої сполуки включають, але цим не обмежуючись, негідратований L-бітартрат, гідратований L-бітартрат, негідратований дигідрофосфат, гідратований дигідрофосфат, негідратований бісукцинат, гідратований бісукцинат, четверний гідрат гідрохлориду, півторагідрат гідрохлориду, дигідроцитрат і моногідроцитрат. Ці сполуки вважають важливими внаслідок їх селективної взаємодії з α7-вмісними нейрональними nAChRs, α4β2 nAChRs, або з обома, і з α7, і з α4β2 nAChRs, в порівнянні з іншими сполуками відомого рівня техніки. КОРОТКИЙ ОПИС КРЕСЛЕНЬ На фіг. 1 наведена порошкова рентгенограма кристалічного моногідрату солі (4s)-4-(53,7 феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату. На фіг. 2 наведена термограма кристалічного моногідрату солі (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату. На фіг. 3 наведена ізотерма сорбції вологи для кристалічного моногідрату солі (4s)-4-(53,7 феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, отримана за допомогою ваг для дослідження динамічної сорбції вологи, що використовуються для визначення гігроскопічності сполуки. На фіг. 4(a) наведена порошкова рентгенограма для складу, що містить практично чистий 3,7 кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату (Сполука А). На фіг. 4(b) наведена порошкова рентгенограма для твердого (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату (Сполука А), виділеного з суспензії, що має активність води 0,20. На фіг. 4(с) наведена порошкова рентгенограма для твердого (4s)-4-(5-феніл-1,3,4-тіадіазол3,7 2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату (Сполука А), виділеного з суспензії, що має активність води 0,15. На фіг. 4(d) наведена порошкова рентгенограма для твердого (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату (Сполука А), виділеного з суспензії, що має активність води 0,10. На фіг. 4(е) наведена порошкова рентгенограма для твердого (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату (Сполука А), виділеного з суспензії, що має активність води 0,05. На фіг. 4(f) наведена порошкова рентгенограма для складу, що містить практично чистий 3,7 кристалічний безводний (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрат (Сполука А). СУТЬ ВИНАХОДУ Для виявлення вихідних сполук, що представляють інтерес, був проведений ретельний скринінг солей сполук публікації '336. У процесі випробування композицій солей негідратована 3,7 дигідроцитратна сіль (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану була виявлена як сполука, що являє особливий інтерес внаслідок сприятливих властивостей в твердому стані, фармацевтичних властивостей і властивостей, що дозволяють здійснити його промислове виробництво. У зв'язку з цими сприятливими характеристиками дигідроцитрат (4s)3,7 4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]-декану був вибраний для додаткового аналізу, що включає скринінг поліморфів і аналіз поліморфів. Відповідно, даний винахід належить до кристалічної моногідратної солі (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло-[3.3.1.1 ]декану дигідроцитрату і способів і процесів, що стосується її. Один варіант здійснення винаходу належить до кристалічної солі (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану, що має формулу (I) де сіль містить дигідроцитрат, що має формулу (II) 2 UA 110802 C2 . 5 10 15 20 25 30 35 40 45 50 55 У додатковому варіанті здійснення кристалічна моногідратна сіль (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату має чистоту, яка характеризується вмістом щонайменше 90 % моногідратної форми і не більше ніж 10 % немоногідратної форми. У ще одному додатковому варіанті здійснення кристалічна 3,7 моногідратна сіль (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату має чистоту, яка характеризується вмістом щонайменше 95 % моногідратної форми і не більше ніж 5 % немоногідратної форми. У ще одному додатковому варіанті здійснення кристалічна моногідратна сіль (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату має чистоту, яка характеризується вмістом щонайменше 97 % моногідратної форми і не більше ніж 3 % немоногідратної форми. У додатковому варіанті здійснення кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-23,7 ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату характеризується щонайменше одним характеристичним піком на порошковій рентгенограмі при значеннях в градусах два-тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 і 26,9±0,20. У ще одному варіанті здійснення кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-23,7 ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату за пунктом 1 має параметри елементарної комірки, де а становить приблизно 6,52Å, b становить приблизно 20,99Å, с становить приблизно 16,83Å, α становить приблизно 90,0º, β становить приблизно 93,75º, γ 3 становить приблизно 90,0º, об'єм становить приблизно 2297,52Å , і Z становить приблизно 4. У іншому варіанті здійснення кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-23,7 ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату характеризується негігроскопічними властивостями, що визначаються за допомогою методу гравіметрії сорбції вологи в динамічному режимі, при цьому втрати маси складають менше ніж приблизно 0,2 % при відносній вологості від 0 % до 90 %. Інший варіант здійснення винаходу належить до фармацевтичних композицій, що включають сполуку винаходу. Такі композиції можуть бути введені у відповідності зі способами винаходу звичайно як частини терапевтичної схеми для лікування або запобігання станам і розладам, пов'язаним з nAChR активністю і, більш конкретно, з α7 nAChR активністю, α4β2 nAChR активністю, або і з α7 nAChR активністю, і з α4β2 nAChR активністю. Ще один варіант здійснення винаходу належить до способу модулювання як α7, так і α4β2 nAChR активності. Спосіб застосовують для лікування, запобігання, або і для лікування, і для запобігання станам і розладам, пов'язаним як з α7, так і з α4β2 nAChR активністю, зокрема у ссавців. Інший варіант здійснення належить до способу селективного модулювання nAChR активності, наприклад α7 nAChR активності. Спосіб застосовують для лікування, запобігання або як для лікування, так і для запобігання станам і розладам, пов'язаним з α7 nAChR активністю у ссавців. Спосіб також передбачає і селективне модулювання α4β2 nAChR активності. Такі способи, нарівні з іншими системними і нейроімуномодулюючими методами, застосовують при станах і розладах, що належать до синдрому порушення уваги, синдрому дефіциту уваги з гіперактивністю (ADHD), хвороби Альцгеймера (AD), шизофренії, помірного когнітивного порушення, вікового порушення пам'яті (AAMI), сенільної деменції, деменції при СНІДі, хвороби Піка, деменції, пов'язаної з тільцями Леві, деменції, пов'язаної з синдромом Дауна, шизофренії, припинення куріння, абстинентного синдрому відміни прийому нікотину, бічного аміотрофічного склерозу, хвороби Хантінгтона, дефіцитарної функції ЦНС, пов'язаної з травматичним пошкодженням мозку, гострого болю, післяопераційного болю, хронічного болю, запального болю, невропатичного болю, безпліддя, недостатності кровообігу, необхідності в рості нових кровоносних судин, пов'язаної із загоєнням рани, більш конкретно кровообігу навколо оклюзії посудини, необхідності в рості нових кровоносних судин, пов'язаної з васкуляризацією шкірних трансплантатів, ішемії, запалення, сепсису, загоєння рани, і інших ускладненнях, пов'язаних з діабетом. Додатковий варіант здійснення винаходу належить до способу отримання кристалічної моногідратної солі даного винаходу з використанням негідратованої дигідроцитратної солі як 3 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 вихідного матеріалу. А саме спосіб отримання кристалічної моногідратної солі (4s)-4-(5-феніл3,7 1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, де спосіб включає 3,7 стадії: (a) розчинення (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану щонайменше в одному розчиннику при температурі в інтервалі від приблизно 65ºС до приблизно 85 °C; (b) доведення температури розчину до температури в інтервалі від приблизно 55ºС до приблизно 75ºС протягом періоду часу щонайменше тридцять хвилин; (с) додавання щонайменше одного додаткового розчинника до розчину і перемішування протягом періоду часу щонайменше тридцять хвилин; (d) доведення температури розчинів до температури в інтервалі від приблизно 30ºС до приблизно 50ºС протягом періоду часу більше ніж дві години; (е) додавання щонайменше одного додаткового розчинника до розчину протягом періоду часу не менше ніж три години; (f) витримування суспензії при температурі в інтервалі від приблизно 30ºС до приблизно 50ºС протягом періоду часу щонайменше одна година; (g) доведення температури суспензії до температури в інтервалі від приблизно -5ºС до приблизно 15ºС; (h) перемішування суспензії щонайменше протягом однієї години; і (i) виділення кристалічної 3,7 моногідратної солі (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату. Розчинник стадії (a) може містити органічний розчинник, воду і їх комбінації. У додатковому варіанті здійснення розчинник стадії (a) вибирають з групи, що складається з метанолу, етанолу, 2-пропанолу, бутанолу, ацетонітрилу, ацетону, формаміду, диметилформаміду, толуолу, бензолу, анізолу, етилацетату, ізопропілацетату, тетрагідрофурану, 1,4-діоксану, метилтретбутилового ефіру, дихлорметану, хлороформу, гексанів, н-гептану, 2-бутанону, диметилсульфоксиду, нітрометану, 1-метил-2-піролідону, триетиламіну, трибутиламіну, трифтортолуолу, води і їх сумішей. У переважному варіанті здійснення розчинник стадії (a) включає суміш 2-пропанолу і води. Суміш 2-пропанолу і води може містити відношення 2пропанолу до води в інтервалі від приблизно 1:10 до приблизно 10:1. У більш переважному варіанті здійснення суміш 2-пропанолу і води може містити відношення 2-пропанолу до води в інтервалі від приблизно 3:1 до приблизно 5:1. Крім того, температура стадії (a) може знаходитися в інтервалі від приблизно 70ºС до приблизно 80ºС і, в більш переважному варіанті здійснення температура стадії (a) може знаходитися в інтервалі від приблизно 74ºС до приблизно 76ºС. Стадія (b) може включати доведення температури розчину до температури від приблизно 60ºС до приблизно 70ºС протягом періоду часу щонайменше тридцять хвилин. При переважній ітерації стадія (b) може включати доведення температури розчину до температури від приблизно 64ºС до приблизно 66ºС протягом періоду часу щонайменше тридцять хвилин. Розчинник стадії (с) може містити органічний розчинник, воду і їх комбінації. У переважному варіанті здійснення розчинник стадії (с) може бути вибраний з групи, що складається з метанолу, етанолу, 2-пропанолу, бутанолу, ацетонітрилу, ацетону, формаміду, диметилформаміду, толуолу, бензолу, анізолу, етилацетату, ізопропілацетату, тетрагідрофурану, 1,4-діоксану, метилтретбутилового ефіру, дихлорметану, хлороформу, гексанів, н-гептану, 2-бутанону, диметилсульфоксиду, нітрометану, 1-метил-2-піролідону, триетиламіну, трибутиламіну, трифтортолуолу, води і їх сумішей. У більш переважному варіанті здійснення розчинник стадії (с) може містити 2-пропанол. Крім того, кількість 2-пропанолу, що використовується на стадії (с), може містити від приблизно 2 об'ємів до приблизно 10 об'ємів відносно кількості розчинника, що вводиться на стадії (a). У переважному варіанті здійснення кількість 2-пропанолу, що використовується на стадії (с), може містити від приблизно 5 об'ємів до приблизно 7 об'ємів в порівнянні з кількістю розчинника, що використовується на стадії (a). Стадія (d) може включати доведення температури в інтервалі від приблизно 35ºС до приблизно 45ºС протягом періоду часу більше ніж дві години. При переважній ітерації способу стадія (d) може включати доведення температури в інтервалі від приблизно 39ºС до приблизно 41ºС протягом періоду часу в інтервалі від приблизно 30 хвилин до приблизно восьми годин. Однак для фахівця в даній галузі є очевидним, що час може бути збільшений без відхилення від обсягу винаходу. Розчинник стадії (е) може містити органічний розчинник, воду і їх комбінації. У переважному варіанті здійснення розчинник стадії (е) може бути вибраний з групи, що складається з метанолу, етанолу, 2-пропанолу, бутанолу, ацетонітрилу, ацетону, формаміду, диметилформаміду, толуолу, бензолу, анізолу, етилацетату, ізопропілацетату, тетрагідрофурану, 1,4-діоксану, метилтретбутилового ефіру, дихлорметану, хлороформу, гексанів, н-гептану, 2-бутанону, диметилсульфоксиду, нітрометану, 1-метил-2-піролідону, триетиламіну, трибутиламіну, трифтортолуолу, води і їх сумішей. У більш переважному варіанті здійснення розчинник стадії (е) може містити 2-пропанол. Крім того, кількість 2-пропанолу, що 4 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовується на стадії (е), може містити від приблизно 1 об'єму до приблизно 10 об'ємів відносно кількості розчинника, що вводиться на стадії (a). У переважному варіанті здійснення кількість 2-пропанолу, що використовується на стадії (е), може містити від приблизно 4 об'ємів до приблизно 6 об'ємів в порівнянні з кількістю розчинника, що використовується на стадії (a). Стадія (f) може включати доведення температури реакції в інтервалі від приблизно 35ºС до приблизно 45ºС протягом періоду часу щонайменше одна година. У переважному варіанті здійснення стадія (f) може включати доведення температури в інтервалі від приблизно 39ºС до приблизно 41ºС протягом періоду часу щонайменше одна година. Стадія (g) може включати доведення температури суспензії до температури в інтервалі від приблизно 0ºС до приблизно 10ºС. У більш переважному варіанті здійснення стадія (g) може включати доведення температури суспензії до температури в інтервалі від приблизно 4ºС до приблизно 6ºС. Крім того, стадія (i) може включати виділення кристалічної моногідратної солі (4s)-4-(53,7 феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату за допомогою фільтрації. У іншому варіанті здійснення даний винахід включає спосіб отримання кристалічної 3,7 моногідратної солі (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, де спосіб включає стадії: (a) розчинення (4s)-4-(5-феніл-1,3,4-тіадіазол-23,7 ілокси)-1-азатрицикло[3.3.1.1 ]декану в приблизно 4 об'ємах 2-пропанолу і в приблизно 1 об'ємі води при температурі приблизно 75ºС; (b) доведення температури розчину до температури в інтервалі від приблизно 65ºС протягом періоду часу щонайменше тридцять хвилин; (с) додавання приблизно 6 об'ємів 2-пропанолу до розчину і перемішування протягом періоду часу щонайменше тридцять хвилин; (d) доведення температури до приблизно 40ºС протягом періоду часу більше ніж дві години; (е) додавання до розчину приблизно 5 об'ємів 2-пропанолу протягом періоду часу не менше ніж три години; (f) витримування суспензії при температурі приблизно 40ºС протягом періоду часу щонайменше одна година; (g) доведення температури суспензії до температури приблизно 5ºС; (h) перемішування суспензії протягом щонайменше однієї години; і (i) виділення кристалічної моногідратної солі (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану. У альтернативному варіанті здійснення даний винахід також включає спосіб отримання кристалічної моногідратної солі (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату, де спосіб включає стадії: (a) контактування 3,7 безводного (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату з розчинником в реакційній посудині; (b) герметизації реакційної посудини і захисту суспензії від впливу світла за умов навколишнього середовища; і (с) виділення кристалічної моногідратної солі (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло3,7 [3.3.1.1 ]декану. Згідно з цим способом, розчинник стадії (a) може містити воду. Крім того, кількість 3,7 безводного (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло-[3.3.1.1 ]декану дигідроцитрату може складати приблизно від 100 мг до приблизно 300 мг, а кількість води може складати приблизно від 0,1 мл до приблизно 2,0 мл. У додатковому переважному варіанті здійснення кількість безводного (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату складає приблизно від 150 мг до приблизно 250 мг, і при цьому кількість води складає від приблизно 0,8 мл до приблизно 1,2 мл. Для фахівця в цій галузі є також очевидним, що розчинник стадії (a) може містити суміш органічного розчинника і води. Крім того, органічний розчинник може містити метанол, етанол, 2-пропанол, бутанол, бутанол ацетонітрил, ацетон, формамід, диметилформамід, толуол, бензол, анізол, етилацетат, ізопропілацетат, тетрагідрофуран, 1,4-діоксан, метилтретбутиловий ефір, дихлорметан, хлороформ, гексани, н-гептан, 2-бутанон, диметилсульфоксид, нітрометан, 1метил-2-піролідон, триетиламін, трибутиламін, трифтортолуол і їх суміші. У ще одному альтернативному варіанті здійснення даний винахід включає фармацевтичну композицію, що містить кристалічну моногідратну сіль (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату як активний інгредієнт і фармацевтично прийнятний носій, розріджувач або допоміжну речовину. У переважному варіанті здійснення фармацевтичної композиції кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату присутній в кількості в інтервалі від приблизно 0,1 % до приблизно 99,9 % за масою від сумарної маси композиції. У цьому варіанті здійснення фармацевтична композиція, що включає кристалічний моногідрат (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрат, характеризується щонайменше одним характеристичним піком на порошковій рентгенограмі при значеннях в 5 UA 110802 C2 5 10 15 20 25 30 35 40 45 градусах два-тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 і 26,9±0,20. ДОКЛАДНИЙ ОПИС ВИНАХОДУ 3,7 Відомо, що (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]-декан існує в різноманітних сольових формах, про які повідомляється в документі "публікація '336", що знаходиться в процесі одночасного розгляду. Одна з сольових форм - дигідроцитратна сіль, була виявлена як найбільш перспективна сполука, внаслідок декількох виявлених переваг, що стосуються цієї сполуки. А саме негідратований дигідроцитрат має переважні властивості в твердому стані, що включають високу кристалічність, прийнятну температуру плавлення, негігроскопічність і відсутність схильності до виявлення комплексних поліморфізмів. Крім того, дигідроцитратна негідратована сіль виявляла переважні фармацевтичні властивості, що включають стабільність в твердому стані при 40ºС і 75 % відносній вологості протягом 12 тижнів, стабільність при впливі джерела випромінювання УФ-видимого світла, що визначається у відповідності зі стандартом ICH Type I, і стабільність при впливі парів пероксиду при 40ºС протягом 8 днів. Негідратований дигідроцитрат також характеризується розчинністю 28 мг/мл у воді. Крім того, негідратований дигідроцитрат також має переважні властивості, що дозволяють здійснити його промислове виробництво, внаслідок яких може бути отримана сполука з прийнятною чистотою і виходом, а розмір частинок може контролюватися шляхом помелу. Внаслідок цих переважних характеристик (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрат був вибраний для додаткового аналізу, що включає скринінг поліморфів і аналіз поліморфів. Було зазначено, що (4s)-4-(5-феніл-1,3,4-тіадіазол-23,7 ілокси)-1-азатрицикло[3.3.1.1 ]-декану дигідроцитрат, коли його отримують у відповідності зі способами публікації '336, виділяється в негідратованій формі. У зв'язку з цим автори даного винаходу провели для негідратованого дигідроцитрату скринінг поліморфів і термодинамічний аналіз з метою виявлення можливості отримання інших форм сполуки. А саме дигідроцитрат суспендували в різних розчинниках з метою виявлення можливості отримання інших кристалічних форм. Новий моногідрат даного винаходу має більш переважні властивості в порівнянні із сполуками, розкритими в публікації '336. А саме моногідрат даного винаходу являє собою термодинамічно стабільну форму солі за умов більш високої активності води, більш високої відносної вологості або більш високої активності води і більш високої відносної вологості, внаслідок чого моногідрат має більш високу хімічну і фізичну стабільність при впливі навколишнього середовища з більш високою вологістю і більш високою активністю води в порівнянні з негідратованою формою. Такі типи умов можуть часто мати місце в певних типах фармацевтичних композицій, таких як розчини, суспензії або будь-які парентеральні лікарські форми. Форма моногідрату дигідроцитрату даного винаходу також має переваги з точки зору технології отримання лікарських препаратів. Для отримання фармацевтично активних інгредієнтів широко застосовується метод вологої грануляції. У процесі вологої грануляції використання моногідратної форми дозволяє запобігати будь-якому перетворенню безводної форми в моногідрат, що в результаті приводить до підвищення стабільності. Відповідно, моногідрат дигідроцитрату забезпечує властивості фізичної і хімічної стабільності, які раніше були недосяжні. Моногідратні дигідроцитратні сполуки даного винаходу звичайно включають одну молекулу 3,7 (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану, що має хімічну формулу (I), і одну молекулу солі лимонної кислоти (тобто дигідроцитрату), що має хімічну формулу (II). Незважаючи на те, що даний винахід направлений головним чином на (4s)-діастереомер сполуки азаадамантану, проте сполуки за даним винаходом можуть існувати і в формах, представлених формулами (Ia) і (Ib): , 50 55 Азаадамантанова частина ізомеру (Ia) і ізомеру (Ib) не є хіральною, однак С-4 вуглець, до якого приєднаний L1, вважається псевдоасиметричним. Сполуки, представлені формулами (Ia) і (Ib), є діастереомерами. Конфігурацію структур формули (Ia) відносять до конфігурації 4r відповідно до публікації Synthesis, 1992, 1080, Becker D. P.; Flynn D. L. і визначень в монографії Stereochemistry of Organic Compounds, E. L. Eliel, S. H. Wilen; John Wiley and Sons, Inc. 1994. Крім того, застосовуючи аналогічні підходи, конфігурацію структур формули (Ib) відносять до конфігурації 4s. 6 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 Ізомери (Ia) і (Ib) можуть бути синтезовані роздільно, використовуючи індивідуальні стереоізомери, відповідно до описаних у винаході схем і прикладів. Як варіант ізомери (Ia) і (Ib) можуть бути синтезовані разом, коли в синтезі використовують суміші стереізомерів, після чого з суміші обох ізомерів можуть бути виділені індивідуальні ізомери за допомогою хроматографічних методів. Суміші ізомерів можуть бути також розділені за допомогою фракційної кристалізації солей амінів, що містяться в сполуках формули (I), які отримують шляхом взаємодії з енантіомерно чистими карбоновими кислотами. Даний винахід належить до кристалічного твердого моногідрату (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, який може бути ідентифікований характеристичними піками на його порошковій рентгенограмі, показаній на фіг. 1. Будь-який фахівець в галузі аналітичної хімії може легко ідентифікувати твердий моногідрат 3,7 (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, як мінімум, за одним характеристичним піком на його порошковій рентгенограмі. Положення кута два-тета характеристичних піків на порошковій рентгенограмі (4s)-4-(5-феніл-1,3,4-тіадіазол-23,7 ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату становлять 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20, і 26,9±0,20. Таким чином, кристалічний моногідрат (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату даного винаходу характеризується щонайменше одним характеристичним піком на порошковій рентгенограмі при значеннях в градусах два-тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 і 26,9±0,20. Крім того, даний винахід додатково передбачає, що кристалічний моногідрат (4s)-4-(5-феніл3,7 1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату характеризується щонайменше двома, щонайменше трьома, щонайменше чотирма, щонайменше п'ятьма, щонайменше шістьма, щонайменше сімома, щонайменше вісьмома, щонайменше дев'ятьма, щонайменше десятьма, щонайменше одинадцятьма, щонайменше дванадцятьма або щонайменше тринадцятьма характеристичними піками на порошковій рентгенограмі при значеннях в градусах два-тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 і 26,9±0,20. Крім того, даний винахід додатково передбачає, що кристалічний моногідрат (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату характеризується наступними чотирнадцятьма характеристичними піками на порошковій рентгенограмі при значеннях в градусах два-тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 і 26,9±0,20. Крім того, на фіг. 2 наведений термогравіметричний аналіз (TGA) моногідрату (4s)-4-(53,7 феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]-декану дигідроцитрату. Термогравіметричний аналіз показує, що із зростанням температури відбувається дегідратація 3,7 моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату. А саме моногідратна сіль характеризується втратою маси від приблизно 2,5 % до приблизно 3,5 %, з початком втрати маси при температурі від приблизно 60ºС до приблизно 70ºС. У переважному варіанті здійснення моногідратна сіль характеризується втратою маси 3,7 (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату приблизно на 2,9 %, з початком втрати маси при температурі приблизно 65ºС. Були також визначені кристалографічні параметри елементарної комірки моногідрату (4s)-43,7 (5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]-декану дигідроцитрату, які складали наступні значення: а дорівнює 6,519Å, b дорівнює 20,982Å, с дорівнює 16,833Å, α становить приблизно 90,0°, β становить приблизно 93,75° і γ становить приблизно 90,0° з об'ємом комірки 3 приблизно 2297,52Å , де a, b і с - кожний являє собою довжину вектора кристалічної решітки, а α, β і γ - всі являють собою кути елементарної комірки. Сіль кристалізується в моноклінній сингонії P21/n. Крім того, кристалічну моногідратну сіль (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату звичайно вважають негігроскопічною, при цьому зміна її маси, що вимірюється за допомогою ваг для дослідження динаміки сорбції вологи, складає від 0,05 % до 0,4 % при відносній вологості в інтервалі від 0 % до 90 %. У переважному варіанті здійснення зміна маси при відносній вологості від 0 % до 90 % становить приблизно 0,2 %. Ізотерма сорбції вологи моногідратом (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло-[3.3.1.1 ]декану дигідроцитрату показана на фіг. 3. А саме на фіг. 3 наведена ізотерма сорбції вологи для моногідратної солі при відносній вологості в інтервалі від 10 % до 90 %. 7 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, кристалічний моногідрат даного винаходу є термодинамічно стабільною формою солі в умовах високої активності води, високої відносної вологості або високої активності води і високої відносної вологості. А саме зазвичай вважають, що кристалічна моногідратна сіль (4s)3,7 4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату має критичне значення для активності води в інтервалі від 0,05 до 0,20. У переважному варіанті здійснення моногідрат дигідроцитратної солі має критичне значення для активності води від 0,10 до 0,15. У зв'язку з цим, коли кристалічний моногідрат даного винаходу зазнає впливу відносної вологості з рівнями менше ніж 0,15, або інших розчинників при активності води 0,15, сіль може перетворюватися з моногідратної форми в безводну форму. Якщо кристалічний моногідрат зазнає впливу відносної вологості з рівнем 0,15 або вище, або розчинників з активністю води більше ніж 0,15, кристалічна моногідратна сіль даного винаходу буде залишатися термодинамічно стабільною і не буде перетворюватися в безводну форму сполуки. Відповідно, при відносній вологості або активності води 0,10 або менше, тверді речовини даного винаходу перетворюються в негідратовану форму солі, в той час як при відносній вологості або активності води 0,15 і вище, тверді речовини перетворюються в моногідратну форму солі. Тому кристалічна моногідратна форма солі даної композиції може бути об'єднана з розчинниками або іншими фармацевтичними носіями, що мають активність води більше ніж 0,15, також як і з середовищами, що мають відносну вологість більше ніж 0,15, і при цьому кристалічний моногідрат не буде перетворюватися в безводну форму сполуки, що забезпечує термодинамічну стабільність. Термін середовище з "високою вологістю" або'високою активністю води", що використовується в описі винаходу, включає всі середовища з відносною вологістю або активністю води 0,15 або вище. Потрібно зазначити, що всі дані по активності води отримували за умов навколишнього середовища. Відносно активності води і всіх інших параметрів, що обговорюються в описі винаходу, під умовами навколишнього середовища звичайно мають на увазі температуру приблизно 20 °C і тиск приблизно одна атмосфера. На фіг. 4 проілюстрована стабільність даної сполуки в середовищах з різною активністю води і відносною вологістю більше ніж 0,15. А саме на фіг. 4 показана порошкова рентгенограма різних суспензій з різною активністю води. Зокрема на фіг. 4 показаний зсув від моногідратної солі до безводної солі при активності води в інтервалі від 0,10 до 0,15. Методика отримання результатів, наведених на фіг. 4, пояснюється більш детально в прикладі 6. Термін "практично чиста", що використовується в описі винаходу, коли мова йде про кристалічну моногідратну сіль (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату, належить до солі, чистота якої складає більше ніж 3,7 90 %. Інші форми (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату містять не більше ніж приблизно 10 % будь-яких інших сполук і, зокрема, містять не більше ніж приблизно 10 % будь-яких інших форм, таких як аморфні форми, безводні форми, сольватовані форми, несольватовані форми, десольватовані форми і енантіомер. Більш переважно, щоб термін "практично чиста" сіль належав до солі, яка має чистоту більше 95 %, коли кристалічна моногідратна сіль (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату містить не більше ніж приблизно 5 % будь-якої іншої сполуки і, зокрема, містить не більше ніж приблизно 5 % будь-якої іншої форми 3,7 моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, такої як аморфні форми, безводні форми, сольватовані форми, несольватовані форми, десольватовані форми і енантіомер. Ще більш переважно, щоб термін "практично чиста" сіль належав до солі, яка має чистоту більше 97 %, коли кристалічна моногідратна сіль (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату містить не більш ніж приблизно 3 % будь-якої іншої сполуки і, зокрема, містить не більше ніж приблизно 3 % будь-якої іншої форми моногідрату 3,7 (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, такої як аморфні форми, безводні форми, сольватовані форми, несольватовані форми, десольватовані форми і енантіомер. Як загальний протокол, в опис винаходу включені різні методи хімічного і фізичного аналізу. Рентгеноструктурний аналіз зразків в формі порошків (PXRD) проводили таким чином. Зразки для рентгеноструктурного аналізу готували шляхом розподілу зразка у вигляді тонкого шару на проботримачі і обережного розрівнювання зразка за допомогою предметного скла. Наприклад, зразок міг бути подрібнений в тонкий порошок за допомогою ступки і товкачика, або, у разі обмеженої кількості зразків, за допомогою предметного скла. Зразки піддавали дослідженню в одній із трьох конфігурацій: з круговим тримачем для об'ємних зразків, з кварцовою пластиною з нульовим фоном або з тримачем для дослідження при високій температурі (аналогічним кварцовій пластині з нульовим фоном). 8 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рентгенограми реєстрували за допомогою дифрактометра Inel G3000, обладнаного германієвим монохроматором для падаючого променя для отримання Cu-Kα1 випромінювання. Рентгенівський випромінювач працював при напрузі 40 кіловольт і струмі 30 міліампер. Inel G3000 обладнаний позиційно-чутливим детектором, який відстежує одночасно всі дифракційні дані. Детектор калібрували шляхом реєстрації ослабленого прямого променя протягом 7 секунд із інтервалами в 1 градус в діапазоні 90 градусів два-тета. Калібрування перевіряли відносно положення лінії кремнію в стандартному зразку (NIST 640c). Зразки вміщували на алюмінієвий проботримач і розрівнювали за допомогою предметного скла. Як варіант, рентгенівська порошкова дифрактометрія може бути здійснена за допомогою дифрактометра Rigaku Miniflex (30 кіловольт і 15 міліампер; джерело рентгенівського випромінювання: Cu; діапазон: 2,00-40,00º два-тета; швидкість сканування: 1-5 градус/хвилина) або дифрактометра Scintag X1 або X2 (рентгенівська трубка на 2 кіловольти з нормальним діапазоном фокусування з твердотільним германієвим детектором, що охолоджується або рідким азотом, або термоелектричним повітроохолоджувачем Пельтьє; 45 кіловольт і 40 міліампер; джерело рентгенівського випромінювання: Cu; діапазон: 2,00-40,00º два-тета; швидкість сканування: 1-5 градус/хвилина). Положення характеристичних піків на порошковій рентгенограмі наводиться за допомогою кутових положень (два-тета) при допустимому відхиленні ± 0,20º. Відхилення ± 0,10º передбачається використовувати при порівнянні двох порошкових рентгенограм. На практиці, якщо пік рентгенограми для одного зразка належить до діапазону кутових положень (два-тета), які являють собою виміряне положення піка ± 0,20º, і пік рентгенограми для іншого зразка належить до діапазону кутових положень (два-тета), які являють собою виміряне положення піка ± 0,20º, і якщо ці діапазони положення піка перекриваються, то тоді вважають, що ці два піки мають одне і те ж кутове положення (два-тета). Наприклад, якщо визначено, що пік рентгенограми одного зразка має положення піка 5,20º, для цілей порівняння допустиме відхилення дозволяє віднести положення піка в діапазоні 5,00º-5,40º. Якщо визначено, що пік для порівняння на іншій рентгенограмі має положення піка 5,35º і допустиме відхилення дозволяє віднести положення піка в діапазоні 5,15º-5,55º, то тоді вважають, що ці два піки, що порівнюються, мають одне і те ж кутове положення (два-тета), оскільки має місце перекриття між двома діапазонами положень піка. Дані рентгеноструктурного аналізу монокристалів реєстрували на дифрактометрі Bruker Apex II (Bruker AXS, Madison, WI), обладнаному майданним детектором Apex II CCD. Дифрактометр експлуатувався з трубкою з молібденовим анодом (2,0 кіловольти з тонким фокусуванням) при 50 кіловольт і 40 міліампер. Падаючий промінь кремнієвого монохроматора забезпечував Mo-Kα1 монохроматичне випромінювання. Дані реєстрували в потоці холодного газоподібного азоту при 100K, використовуючи низькотемпературний пристрій Kryoflex (Bruker AXS). Діаметр променя для реєстрації даних становив 5 мм, і детектор розташовувався на відстані 6 см. Юстирування гоніометра перевірялося за допомогою сферичного кристала 2диметилсульфураніліден-1,3-індандіону (YLID). Прилад працював під керуванням комп'ютера з використанням програмного забезпечення BIS і Apex 2 (Version 2008.5-0, Bruker AXS). Дані реєстрували при -100ºС. Термогравіметричний аналіз (TGA) зразків проводили таким чином. Дані TGA реєстрували за допомогою термоваг (Q-500, TA Instruments, New Castle, DE), забезпечених аналізатором даних (Universal Analysis 2000, version 5.4А, TA Instruments). Під час проведення експериментів пічку продували азотом при витраті 60 мл/хв., а камеру ваг продували при витраті азоту 40 мл/хв. Температуру пічки термогравіметричної установки калібрували з використанням точок Кюрі для алюмелю і нікелю. Звичайно експериментальні параметри включали зразок з масою 220 мг, який вміщували на відкриту алюмінієву чашку ваг; швидкість нагріву 10ºС на хвилину; і нагрівання зразка від 25ºС до 200ºС. Для оцінки гігроскопічності кристалічної моногідратної сполуки застосовували ваги для дослідження динаміки сорбції вологи (DMSB). Гігроскопічність оцінювали з використанням ваг для дослідження динаміки сорбції вологи (фірми IGAsorp, Hiden Isochema), обладнаної аналізатором даних. Ваги калібрували з використанням еталонних гирок масою 20, 50 і 100 мг. Зонд для вимірювання відносної вологості калібрували з використанням еталонних розчинів солей хлориду літію, карбонату калію і хлориду натрію. Під час проведення експерименту витрати газоподібного азоту при різній відносній вологості становили 250 мл/хв. Для безводних матеріалів зразок спочатку сушили за допомогою сухого азоту при 50ºС протягом двох годин. Потім встановлювали температуру 25ºС і змінювали відносну вологість від 0 % до 90 % і зворотно до 0 % з 10 % інтервалами. Для гідратованих зразків встановлювали температуру 25ºС і змінювали відносну вологість від 30 % до 90 %, зворотно до 10 %, і потім до 90 % з 9 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 інтервалами в 10 %. Для кожної описаної тут стадії приводили систему в рівновагу протягом однієї години. Критична активність води для моногідратної солі може бути визначена шляхом змішування в різних співвідношеннях органічних розчинників і води. Результати визначення активності води для цих сумішей розчинників залежать від температури. Визначення критичної активності води звичайно включає наступні стадії: (1) приготування суміші розчинників з різними значеннями активності води; (2) насичення сумішей органічний розчинник/вода моногідратною сіллю; (3) необов'язкової фільтрації насиченого розчину; (4) додавання 1:1 суміші твердих (наприклад, 25 мг/фаза) безводної і гідратованої фаз до насичених сумішей органічний розчинник/вода; (5) приведення до рівноваги при температурі, що досліджується (3-5 днів); і (6) аналізу твердих речовин, що залишаються, за допомогою відповідного методу, який відомий фахівцеві в цій галузі (наприклад, PXRD), для ідентифікації стабільних фаз. Способи отримання сполук винаходу Даний винахід також включає способи отримання сполуки моногідрату (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату. У способах отримання моногідратної форми дигідроцитратної солі як вихідний матеріал може бути використаний (4s)3,7 4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декан. Як варіант може бути використано дигідроцитратну негідратовану сполуку. Як більш детально описано в публікації '336, що знаходиться одночасно на розгляді патентного відомства, відомі різні способи 3,7 отримання сполуки (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану в формі вільної основи і в формі негідратованого дигідроцитрату, і зміст цієї публікації наводиться в описі даного винаходу шляхом посилання на неї. Для будь-якого фахівця в цій галузі є очевидним, що в обсягу даного винаходу також входять альтернативні способи отримання форм вільної основи і негідратованого дигідроцитрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)3,7 1-азатрицикло[3.3.1.1 ]декану, які відповідають традиційним способам. Як згадувалося вище, в одному варіанті здійснення, винахід включає спосіб отримання 3,7 моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату з вихідного матеріалу, що включає (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декан. Спосіб включає стадії: суспендування твердого (4s)-4-(5-феніл3,7 1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату в розчиннику; герметизації суспензії протягом часу, достатнього для утворення кристалів; і збору і виділення кристалів із суспензії. Звичайно спосіб здійснюють за умов навколишнього середовища (при кімнатній температурі); однак будь-який фахівець в цій галузі може підібрати температуру, яка необхідна для досягнення необхідних або альтернативних результатів. Звичайно розчинники даного винаходу являють собою комбінацію води і щонайменше одного іншого розчинника. Комбінація води і щонайменше одного іншого розчинника звичайно має критичну активність води більше ніж 0,10. Придатні розчинники, які можуть бути об'єднані з водою в цьому способі, включають, але цим не обмежуючись, аліфатичний спирт (термін "аліфатичний спирт", що використовується в описі винаходу, належить до нижчого алкілового спирту, при цьому термін "нижчий алкіловий" належить до C1-C6алкілу. Приклади аліфатичних спиртів включають, але цим не обмежуючись, метанол, етанол, 2-пропанол (IPA, так званий ізопропанол), бутанол і інші подібні). Приклади інших придатних розчинників включають ацетонітрил (ACN), ацетон, формамід, диметилформамід (DMF), толуол, бензол, анізол, етилацетат, ізопропілацетат (IPAc), тетрагідрофуран (THF), 1,4-діоксан, метилтретбутиловий ефір (MTBE), дихлорметан, хлороформ, гексани, н-гептан, 2-бутанон (MEK), диметилсульфоксид (DMSO), нітрометан, 1метил-2-піролідон (NMP), триетиламін, трибутиламін, трифтортолуол, етилацетат, суміші формамід/етанол (1:1), суміші формамід/IPA (1:1), суміші формамід/ACN (1:1), суміші формамід/MEK (1:1), суміші формамід/етилацетат (1:1), суміші формамід/THF (1:1), суміші DMSO/нітрометан (1:1), суміші DMSO/IPA (1:1), суміші DMSO/ACN (1:1), суміші DMSO/MEK (1:1), суміші DMSO/толуол (1:1), суміші DMSO/етилацетат (1:1), суміші DMSO/THF (1:1), суміші DMSO/дихлорметан (1:1), суміші формамід/етанол (1:3), суміші формамід/ACN (1:3), суміші формамід/MEK (1:3), суміші формамід/етилацетат (1:3), суміші формамід/THF (1:3), суміші DMSO/нітрометан (1:3), суміші DMSO/етанол (1:3), суміші DMSO/ACN (1:3), суміші DMSO/MEK (1:3), суміші DMSO/толуол (1:3), суміші DMSO/етилацетат (1:3), суміші DMSO/THF (1:3), суміші DMSO/дихлорметан (1:3) і їх комбінації. У додатковому варіанті здійснення розчинник включає комбінацію води з метанолом, етанолом, 2-пропанолом і бутанолом. У додатковому варіанті здійснення винаходу включає в себе спосіб отримання кристалічної 3,7 моногідратної солі (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, що включає стадії: (a) розчинення (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану в комбінації води і щонайменше одного розчинника при 10 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 температурі в інтервалі від приблизно 65ºС до приблизно 85ºС; (b) доведення температури розчину до температури в інтервалі від приблизно 55ºС до приблизно 75ºС протягом періоду часу від приблизно тридцяти хвилин до приблизно восьми годин; (с) додавання до розчину щонайменше одного додаткового розчинника і перемішування протягом періоду часу від приблизно тридцяти хвилин до приблизно восьми годин; (d) доведення температури розчинів до температури в інтервалі від приблизно 30ºС до приблизно 50ºС протягом періоду часу від приблизно тридцяти хвилин до приблизно восьми годин; (е) додавання до розчину щонайменше одного додаткового розчинника протягом періоду часу від приблизно тридцяти хвилин до приблизно восьми годин; (f) витримування суспензії при температурі в інтервалі від приблизно 30ºС до приблизно 50ºС протягом періоду часу від приблизно тридцяти хвилин до приблизно восьми годин; (g) стадії доведення температури суспензії до температури в інтервалі від приблизно -5ºС до приблизно 15ºС; (h) перемішування суспензії протягом періоду часу в інтервалі від приблизно тридцяти хвилин до приблизно восьми годин; і (i) виділення кристалічної моногідратної солі (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату. На стадії (a) способу для будь-якого фахівця в цій галузі є очевидним, що використовуваний 3,7 в способі (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декан може являти собою неочищений твердий (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декан, чистий (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декан або практично чистий (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декан. Крім того, на стадії (a) способу, для будь-якого фахівця в цій галузі є очевидним, що для розчинення (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану можуть застосовуватися різні розчинники і комбінації твердих речовин. Розчинювальний компонент звичайно включає комбінацію води щонайменше з одним іншим розчинником. Комбінація води і щонайменше одного іншого розчинника звичайно має критичну активність води більше ніж 0,10. Придатні розчинники, які можуть бути об'єднані з водою в цьому способі, включають, але цим не обмежуючись, аліфатичний спирт (такий як, але цим не обмежуючись, метанол, етанол, 2-пропанол (IPA), бутанол), ацетонітрил (ACN), ацетон, формамід, диметилформамід (DMF), толуол, бензол, анізол, етилацетат, ізопропілацетат (IPAc), тетрагідрофуран (THF), 1,4-діоксан, метилтретбутиловий ефір (MTBE), дихлорметан, хлороформ, гексани, н-гептан, 2-бутанон (MEK), диметилсульфоксид (DMSO), нітрометан, 1метил-2-піролідон (NMP), триетиламін, трибутиламін, трифтортолуол, етилацетат, суміші формамід/етанол (1:1), суміші формамід/IPA (1:1), суміші формамід/ACN (1:1), суміші формамід/MEK (1:1), суміші формамід/етилацетат (1:1), суміші формамід/THF (1:1), суміші DMSO/нітрометан (1:1), суміші DMSO/IPA (1:1), суміші DMSO/ACN (1:1), суміші DMSO/MEK (1:1), суміші DMSO/толуол (1:1), суміші DMSO/етилацетат (1:1), суміші DMSO/THF (1:1), суміші DMSO/дихлорметан (1:1), суміші формамід/етанол (1:3), суміші формамід/ACN (1:3), суміші формамід/MEK (1:3), суміші формамід/етилацетат (1:3), суміші формамід/THF (1:3), суміші DMSO/нітрометан (1:3), суміші DMSO/етанол (1:3), суміші DMSO/ACN (1:3), суміші DMSO/MEK (1:3), суміші DMSO/толуол (1:3), суміші DMSO/етилацетат (1:3), суміші DMSO/THF (1:3), суміші DMSO/дихлорметан (1:3) і їх комбінації. У іншому варіанті здійснення розчинник включає комбінацію води з метанолом, етанолом, 2-пропанолом і бутанолом. У додатковому переважному варіанті здійснення розчинник включає суміш 2-пропанолу і води. Суміш щонайменше одного іншого розчинника і води звичайно включає співвідношення від приблизно 20:1 до приблизно 1:10, відповідно. У переважному варіанті здійснення суміш щонайменше одного іншого розчинника і води включає співвідношення від приблизно 1:1 до приблизно 7:1, відповідно. У більш переважному варіанті здійснення суміш 2-пропанолу і води включає співвідношення приблизно 4:1. Крім того, в іншому варіанті здійснення, стадію (a) способу проводять при температурі в інтервалі від приблизно 70ºС до приблизно 80ºС. У переважному варіанті здійснення стадію (a) способу проводять при температурі в інтервалі від приблизно 74ºС до приблизно 76ºС. Стадія (b) способу, описана раніше, включає охолоджування розчину. У переважному варіанті здійснення стадії (b) способу температуру розчину знижують до температури в інтервалі від приблизно 60ºС до приблизно 70ºС протягом періоду часу від приблизно тридцяти хвилин до приблизно восьми годин. Однак для будь-якого фахівця в цій галузі є очевидним, що період часу може бути змінений до менше ніж приблизно 30 хвилин або більше ніж приблизно восьми годин без відхилення від обсягу винаходу. У більш переважному варіанті здійснення стадії (b) способу температуру розчину знижують до температури в інтервалі від приблизно 64ºС до приблизно 66ºС. 11 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 На стадії (с) способу для будь-якого фахівця в цій галузі також є очевидним, що в розчин можуть бути введені різні розчинники (а саме один або більше ніж один). Придатні приклади розчинників, які можуть бути введені на стадії (с), вже були описані вище для стадії (a), і їх перелік наводиться в цьому випадку шляхом посилання. У переважному варіанті здійснення розчинник містить аліфатичний спирт (такий як, але цим не обмежуючись, метанол, етанол, 2пропанол, бутанол), воду і їх суміші. У додатковому переважному варіанті здійснення розчинник містить 2-пропанол. Кількість розчинника, що додається на стадії (с) способу, звичайно може змінюватися від приблизно 1 об'єму до приблизно 10 об'ємів відносно кількості розчинника, введеної на стадії (a). У переважному варіанті здійснення кількість розчинника, що додається на стадії (с) способу, звичайно може змінюватися від приблизно 2 об'ємів до приблизно 8 об'ємів відносно кількості розчинника, введеного на стадії (a). У найбільш переважному варіанті здійснення кількість розчинника, що додається на стадії (с) способу, звичайно може змінюватися від приблизно 5 об'ємів до приблизно 7 об'ємів відносно кількості розчинника, введеного на стадії (a). Стадія (d) способу включає другу фазу охолоджування розчину після змішування з додатковим розчинником, описаним на стадії (с). У переважному варіанті здійснення стадії (d) температуру розчину знижують до температури в інтервалі від приблизно 35ºС до приблизно 45ºС протягом періоду часу від приблизно тридцяти хвилин до приблизно восьми годин. Для будь-якого фахівця в цій галузі є очевидним, що період часу може бути змінений до менше ніж приблизно 30 хвилин або більше ніж приблизно восьми годин без відхилення від обсягу винаходу. У більш переважному варіанті здійснення стадії (d) температуру розчину знижують до температури в інтервалі від приблизно 39ºС до приблизно 41ºС. Стадія (е) способу включає додавання до розчину щонайменше одного розчинника протягом періоду часу в інтервалі від приблизно 30 хвилин до приблизно восьми годин. Як вже було зазначено вище, для будь-якого фахівця в цій галузі є очевидним, що період часу може бути змінений до менше ніж приблизно 30 хвилин або більше ніж приблизно восьми годин без відхилення від обсягу винаходу. Придатні приклади розчинників, які можуть бути введені на стадії (е), вже були описані вище для стадії (a), і їх перелік наводиться в цьому випадку шляхом посилання. У переважному варіанті здійснення розчинник включає аліфатичний спирт (такий як, але цим не обмежуючись, метанол, етанол, 2-пропанол, бутанол), воду і їх суміші. У додатковому переважному варіанті здійснення розчинник включає 2-пропанол. Кількість розчинника, що додається на стадії (е) способу, звичайно може змінюватися від приблизно 1 об'єму до приблизно 10 об'ємів відносно кількості розчинника, введеного на стадії (a). У переважному варіанті здійснення кількість розчинника, що додається на стадії (е) способу, звичайно може змінюватися від приблизно 2 об'ємів до приблизно 8 об'ємів відносно кількості розчинника, введеного на стадії (a). У найбільш переважному варіанті здійснення кількість розчинника, що додається на стадії (е) способу, звичайно може змінюватися від приблизно 4 об'ємів до приблизно 6 об'ємів відносно кількості розчинника, введеного на стадії (a). Стадія (f) способу призначена для підтримки температури суспензії після додавання розчинника на стадії (е). Для будь-якого фахівця в цій галузі є очевидним, що температура, що підтримується на стадії (f), повинна співпадати з температурою, що застосовується на стадії (d). Стадія (g) способу включає охолоджування суспензії до температури в інтервалі від приблизно -5ºС до приблизно 15ºС протягом періоду часу від приблизно тридцяти хвилин до приблизно восьми годин. Однак для будь-якого фахівця в цій галузі є очевидним, що період часу може бути змінений до менше ніж приблизно 30 хвилин або більше ніж приблизно восьми годин без відхилення від обсягу винаходу. У переважному варіанті здійснення стадії (g) температуру розчину знижують до температури в інтервалі від приблизно 0ºС до приблизно 10ºС. У більш переважному варіанті здійснення стадії (d) температуру розчину знижують до температури в інтервалі від приблизно 4ºС до приблизно 6ºС. Стадія (h) способу включає перемішування охолодженої суспензії протягом періоду часу в інтервалі від приблизно тридцяти хвилин до приблизно восьми годин. Для будь-якого фахівця в цій галузі є очевидним, що період часу перемішування може бути змінений в залежності від реакційних умов без відхилення від обсягу винаходу. Для будь-якого фахівця в цій галузі є очевидним, що для перемішування можуть бути використані будь-які відомі в техніці пристрої, що включають як ручні, так і автоматизовані форми перемішування суспензії. І нарешті, стадія (i) способу призначена для виділення (наприклад, шляхом витягання) кристалічної моногідратної солі (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло3,7 [3.3.1.1 ]декану дигідроцитрату з розчину суспензії. У переважному варіанті здійснення спосіб виділення (витягання) включає додаткові стадії сушіння і фільтрації. Для фахівця в цій галузі є очевидним, що спосіб сушіння і фільтрації кристалів може бути здійснений будь-яким відомим в 12 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 техніці методом. Звичайно спосіб виділення включає період часу сушіння в інтервалі від приблизно одної години до приблизно двадцяти чотирьох годин при температурі в інтервалі від приблизно 40ºС до приблизно 70ºС. У додатковому варіанті здійснення даний винахід включає спосіб отримання кристалічної 3,7 моногідратної солі (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, використовуючи безводну форму сполуки як вихідний матеріал. Цей спосіб включає стадії: (a) контактування в реакційній посудині твердого безводного (4s)-4-(5-феніл3,7 1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату з розчинником, що містить комбінацію води і щонайменше одного іншого розчинника, де комбінація має активність води більше ніж 0,1; (b) герметизації реакційної посудини і захисту суспензії від дії світла за умов навколишнього середовища; і (с) виділення кристалічної моногідратної солі (4s)-4-(53,7 феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану. Способи отримання 3,7 негідратованого (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату розкриті в заявці на патент США №2008/0167336, що знаходиться на даний момент в процесі розгляду, зміст якої наводиться в описі даного винаходу шляхом посилання на неї. Розчинник, що використовується на стадії (a) способу, звичайно визначають як будь-який органічний розчинник, воду або їх суміш, здатні розчиняти безводну сіль (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату. Придатні приклади розчинників, які можуть бути використані в способі, що заявляється, містять, але цим не обмежуючись, аліфатичний спирт (такий як, але цим не обмежуючись, метанол, етанол, 2пропанол, бутанол і інші подібні спирти), ацетонітрил, ацетон, формамід, диметилформамід, толуол, бензол, анізол, етилацетат, ізопропілацетат,тетрагідрофуран, 1,4-діоксан, метилтретбутиловий ефір, дихлорметан, хлороформ, гексани, н-гептан, 2-бутанон, диметилсульфоксид, нітрометан, 1-метил-2-піролідон, триетиламін, трибутиламін, трифтортолуол, воду і їх суміші. У переважному варіанті здійснення розчинник містить воду. У ще одному переважному варіанті здійснення розчинник містить суміш органічного розчинника і води, при цьому органічний розчинник може містити будь-який з раніше згаданих розчинників. Для будь-якого фахівця в цій галузі є очевидним, що кількість безводної твердої речовини, що використовується в описаному вище способі, буде залежати від точних параметрів, що визначаються фахівцем. Відповідно, кількість безводної твердої речовини, що змішується з розчинником, буде змінюватися в залежності від конкретного вибраного розчинника. Звичайно кількість безводної твердої речовини може знаходитися в інтервалі від приблизно 1 мг до приблизно 1000 мг безводної твердої речовини на 1 мл розчинника. У переважному варіанті здійснення кількість безводної твердої речовини може знаходитися в інтервалі від приблизно 10 мг до приблизно 500 мг безводної твердої речовини на 1 мл розчинника. У більш переважному варіанті здійснення кількість безводної твердої речовини становить приблизно 90 мг на 1 мл розчинника. Крім того, в даному способі використовують 5 об'ємів розчинника для розчинення безводної твердої речовини при високій температурі в інтервалі від приблизно 40ºС до приблизно 70ºС. Розчин потім охолоджують до температури навколишнього середовища, і в розчин вносять затравку кристалів. Потім додають 6 об'ємів антирозчинника (що сумарно дає 11 об'ємів розчинника), суспензію, що утворюється в процесі кристалізації, знов охолоджують, і кристали збирають. Для будь-якого фахівця в цій галузі є очевидним, що антирозчинник може містити будь-який розчинник, який здатний знижувати розчинність речовини, що кристалізується, і, отже, пришвидшує утворення кристалів. Крім того, для фахівця в цій галузі є очевидним, що в даному винаході може застосовуватися будь-яка реакційна посудина, яка здатна вміщувати реакційну суміш і, при цьому, не надає негативного впливу на протікання реакції. Крім того, реакційна посудина може бути герметизована з метою захисту реакційної суміші від впливу світла за умов навколишнього середовища за допомогою будь-яких відомих в техніці засобів, включаючи спеціальну плівку для закупорювання лабораторного посуду парафільм. Крім того, для фахівця в цій галузі є очевидним, що реакцію проводять протягом періоду часу, достатнього для перетворення безводної форми сполуки в кристалічну моногідратну форму сполуки. Як вже зазначалося вище, умови навколишнього середовища звичайно визначають як температуру приблизно 20ºС і тиск приблизно одна атмосфера. І нарешті, для будь-якого фахівця в цій галузі є очевидним, що моногідратні кристали (4s)-43,7 (5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату можуть бути виділені будь-яким відомим в техніці методом. Конкретні приклади методів виділення включають методи фільтрації і сушіння. Метод фільтрації і тривалість, і температура сушіння можуть бути змінені відповідно до відомих методів. Фармацевтичні композиції винаходу 13 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід також пропонує фармацевтичні композиції, що включають терапевтично ефективну 3,7 кількість моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату в комбінації з фармацевтично прийнятним носієм. Композиції включають сполуки винаходу, приготовані разом з одним або більше нетоксичними фармацевтично прийнятними носіями. Для будь-якого фахівця в цій галузі є очевидним, що терапевтично ефективна кількість моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату може змінюватися в залежності від передбачуваного способу застосування фармацевтичного продукту. Однак, в переважних варіантах здійснення, концентрація моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату змінюється від приблизно 0,1 % до приблизно 99 % від маси композиції. Термін "фармацевтично прийнятний носій", що використовується в описі винаходу, означає нетоксичний, інертний твердий, напівтвердий або рідкий наповнювач, розріджувач, інкапсулюючий матеріал або допоміжну речовину будь-якого типу. Декількома прикладами матеріалів, які можуть служити як фармацевтично прийнятні носії, є цукри, такі як лактоза, глюкоза і сахароза; крохмалі, такі як кукурудзяний крохмаль і картопляний крохмаль; целюлоза і її похідні, такі як натрійкарбоксиметилцелюлоза, етилцелюлоза і ацетат целюлози; порошкоподібна трагакантова камедь; солод; желатин; тальк; масло какао і воски для супозиторіїв; олії, такі як арахісова олія, бавовняна олія, сафлорова олія, сезамова олія, оливкова олія, кукурудзяна олія і соєва олія; гліколі, такі як пропіленгліколь; ефіри, такі як етилолеат і етиллаурат; агар; буферні речовини, такі як гідроксид магнію і гідроксид алюмінію; альгінова кислота; апірогенна вода; ізотонічний розчин; розчин Рінгера; етиловий спирт і фосфатні буферні розчини, а також інші нетоксичні сумісні ковзні речовини, такі як лаурилсульфат натрію і стеарат магнію, а також забарвлюючі речовини, засоби, що полегшують витягання з прес-форми, речовини для утворення покриттів, підсолоджувачі, речовини, що коригують смак і запах, і ароматизатори, консерванти і антиоксиданти можуть також бути присутніми в композиції на розсуд фахівця-фармацевта. Фармацевтичні композиції цього винаходу можуть бути введені людям і іншим ссавцям перорально, ректально, парентерально, інтрацистернально, інтравагінально, інтраперитонеально, місцево (у вигляді порошків, мазей або крапель), букально або у вигляді перорального або назального спрею. Термін "парентерально", що використовується в описі винаходу, належить до способу введення, що включає внутрішньовенну, внутрішньом'язову, інтраперитонеальну, інтрастернальну, підшкірну, внутрішньосуглобову ін'єкцію і інфузію. Фармацевтичні композиції для парентеральної ін'єкції включають фармацевтично прийнятні стерильні водні або неводні розчини, дисперсії, суспензії або емульсії і стерильні порошки для відновлення в стерильних ін'єктованих розчинах або дисперсіях. Приклади придатних водних і неводних носіїв, розріджувачів, розчинників або середовищ включають воду, етанол, поліоли (пропіленгліколь, поліетиленгліколь, гліцерин і інші подібні поліоли і відповідні їх суміші), рослинні олії (такі як оливкова олія) і ін'єктовані органічні ефіри, такі як етилолеат, або придатні їх суміші. Відповідна текучість композиції може забезпечуватися, наприклад, шляхом використання покриття, такого як лецитин, шляхом підтримки необхідного розміру частинок у разі дисперсій або шляхом використання поверхнево-активних речовин. Ці композиції можуть також містити допоміжні речовини, такі як консерванти, зволожуючі засоби, емульгатори і диспергатори. Запобігання діяльності мікроорганізмів може здійснюватися за допомогою різних антибактеріальних і протигрибкових препаратів, наприклад парабенів, хлорбутанолу, фенолу, сорбінової кислоти і інших подібних речовин. Крім того, може бути бажаним включення ізотонічних речовин, наприклад цукрів, хлориду натрію і інших подібних сполук. Пролонгована абсорбція ін'єктованої фармацевтичної форми може бути забезпечена шляхом використання речовин, що сповільнюють абсорбцію, наприклад моностеарату алюмінію і желатину. У ряді випадків, для того, щоб пролонгувати дію лікарського засобу, часто потрібно сповільнити абсорбцію лікарського засобу при підшкірній або внутрішньом'язовій ін'єкції. Це може бути здійснене шляхом використання рідкої суспензії кристалічного або аморфного матеріалу з поганою розчинністю у воді. Швидкість абсорбції лікарського засобу може залежати від швидкості його розчинення, яка, в свою чергу, може залежати від розміру кристалів і кристалічної форми. Як варіант, форма лікарського засобу, що вводиться парентерально, може бути ведена шляхом розчинення або суспендування лікарського засобу в масляному середовищі. Суспензії, крім активних сполук, можуть містити суспендуючі речовини, наприклад етоксиловані ізостеарилові спирти, ефіри поліоксіетилену з сорбітом і сорбітаном, 14 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 мікрокристалічну целюлозу, метагідроксид алюмінію, бентоніт, агар-агар, трагакантову камедь і їх суміші. При бажанні, і для більш ефективного поширення, сполуки винаходу можуть бути введені в системи з уповільненим вивільненням або з цілеспрямованою доставкою лікарського засобу, такі як полімерні матриці, ліпосоми і мікросфери. Вони можуть бути піддані стерилізації, наприклад, шляхом фільтрації через затримуючий бактерії фільтр або шляхом введення стерилізуючих речовин в формі стерильних твердих композицій, які можуть бути розчинені в стерильній воді або деякому іншому стерильному ін'єктованому середовищі безпосередньо перед застосуванням. Ін'єктовані форми уповільненого всмоктування (з депо-ефектом) готують шляхом формування мікроінкапсульованих матриць лікарського засобу в біорозкладаних полімерах, таких як полілактид-полігліколід. Змінюючи співвідношення лікарського засобу до полімеру і природу полімеру, що конкретно використовується, можна контролювати швидкість вивільнення лікарського засобу. Приклади інших біорозкладаних полімерів включають поліортоефіри і поліангідриди. Ін'єктовані форми уповільненого всмоктування також готують шляхом включення лікарського засобу в ліпосоми або мікроемульсії, які сумісні з тканинами організму. Ін'єктовані лікарські форми можуть бути піддані стерилізації, наприклад, шляхом фільтрації через затримуючий бактерії фільтр або шляхом введення стерилізуючих речовин в формі стерильних твердих композицій, які можуть бути розчинені або дисперговані в стерильній воді або деякому іншому стерильному ін'єктованому середовищі безпосередньо перед застосуванням. Ін'єктовані препарати, наприклад стерильні ін'єктовані водні або масляні суспензії, можуть бути приготовані відомим способом, використовуючи придатні диспергатори або зволожуючі речовини і суспендуючі засоби. Стерильний ін'єктований препарат також може являти собою стерильний ін'єктований розчин, суспензію або емульсію в нетоксичному, парентерально прийнятному розріджувачі або розчиннику, такий як розчин в 1,3-бутандіолі. До прийнятних середовищ і розчинників, які можуть бути використані, належить вода, розчин Рінгера і ізотонічний розчин хлориду натрію. Крім того, як розчинник або суспендуюче середовище звичайно застосовують стерильні нелеткі масла. Для цієї мети може бути використане будь-яке неподразнююче нелетке масло, включаючи синтетичні моно- або дигліцериди. Крім того, при приготуванні ін'єктованих препаратів використовують жирні кислоти, такі як олеїнова кислота. Тверді лікарські форми для перорального введення включають капсули, таблетки, пілюлі, порошки і гранули. У таких твердих лікарських формах одну або більше сполук винаходу змішують щонайменше з одним фармацевтично прийнятним носієм, таким як цитрат натрію або дикальцію фосфат, і/або a) наповнювачами або сухими розріджувачами, такими як крохмаль, лактоза, сахароза, глюкоза, маніт і саліцилова кислота; b) зв'язуючими, такими як карбоксиметилцелюлоза, альгінати, желатин, полівінілпіролідон, сахароза і гуміарабік; c) зволожувачами, такими як гліцерин; d) розпушувачами, такими як агар-агар, карбонат кальцію, картопляний або маніоковий крохмаль, альгінова кислота, деякі силікати і карбонат натрію; e) уповільнювачами розчинення, такими як парафін; f) прискорювачами абсорбції, такими як четвертинні амонієві сполуки; g) змочувальними засобами, такими як цетиловий спирт і гліцеролмоностеарат; h) абсорбентами, такими як каолінова і бентонітова глина; і i) ковзними речовинами, такими як тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію і їх суміші. У разі капсул, таблеток і пілюль лікарська форма може також включати буферні речовини. Тверді композиції аналогічного типу можуть також бути використані як наповнювачі в м'яких і твердих желатинових капсулах, використовуючи лактозу або молочний цукор, а також високомолекулярні поліетиленгліколі. Тверді лікарські форми таблеток, драже, капсул, пілюль і гранул можуть бути приготовані з нанесенням покриттів і оболонок, таких як ентеросолюбільні покриття і інші покриття, добре відомі в фармацевтиці. Вони можуть необов'язково включати опалесціюючі компоненти і можуть також являти собою композицію, з якої вивільняється активний інгредієнт (активні інгредієнти) тільки або переважно в певній частині кишечнику в уповільненому режимі. Приклади матеріалів, що застосовуються для уповільненого вивільнення активного засобу, можуть містити полімерні речовини і воски. Переважно, щоб композиції для ректального або вагінального введення являли собою супозиторії, які можуть бути приготовані шляхом змішування сполук цього винаходу з придатними неподразнюючими носіями, такими як масло какао, поліетиленгліколь або супозиторний віск, які є твердими при температурі навколишнього середовища і рідкими при 15 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 температурі тіла і тому розплавляються в прямій кишці або вагінальній порожнині і вивільняють активну сполуку. Рідкі лікарські форми для перорального введення включають фармацевтично прийнятні емульсії, мікроемульсії, розчини, суспензії, сиропи і еліксири. Крім активних сполук, рідкі лікарські форми можуть вміщувати інертні розріджувачі, що зазвичай використовуються в техніці, такі як, наприклад, вода або інші розчинники, солюбілізуючі засоби і емульгатори, такі як етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, диметилформамід, олії (зокрема, бавовняну, арахісову, кукурудзяну, з пророщеного насіння пшениці, оливкову, касторову і сезамову олії), гліцерин, тетрагідрофураніловий спирт, поліетиленгліколі і ефіри жирних кислот з сорбітаном і їх суміші. Крім інертних розріджувачів, пероральні композиції можуть також вміщувати допоміжні речовини, такі як зволожуючі засоби, емульгатори і суспендуючі речовини, підсолоджувачі, речовини, що коригують смак і запах, і ароматизатори. Лікарські форми для місцевого або трансдермального введення сполуки цього винаходу включають мазі, пасти, креми, лосьйони, гелі, порошки, розчини, спреї, лікарські форми для інгаляції або пластири. Необхідну сполуку винаходу змішують в стерильних умовах з фармацевтично прийнятним носієм і, за необхідності, з будь-якими консервантами або буферами. Передбачається, що офтальмічні препарати, вушні краплі, очні мазі, порошки і розчини також входять в обсяг цього винаходу. Мазі, пасти, креми і гелі можуть включати, крім активної сполуки цього винаходу, тваринні і рослинні жири, олії, віск, парафіни, крохмаль, трагакантову камедь, похідні целюлози, поліетиленгліколі, силікони, бентоніти, кремнієву кислоту, тальк і оксид цинку або їх суміші. Порошки і спреї можуть включати, крім сполуки цього винаходу, лактозу, тальк, кремнієву кислоту, гідроксид алюмінію, силікати кальцію і порошок поліаміду або суміші цих речовин. Спреї можуть додатково включати традиційні пропеленти, такі як хлорфторвуглеводні. Сполуки винаходу також можуть бути введені в формі ліпосом. Відомо, що ліпосоми звичайно отримують з фосфоліпідів або інших ліпідних речовин. Ліпосоми утворюються моноабо багатошаровими гідратованими рідкими кристалами, які дисперговані у водному середовищі. Може бути використаний будь-який нетоксичний фізіологічно прийнятний ліпід, що перетворюється в ході метаболізму, здатний утворювати ліпосоми. Дані композиції в ліпосомній формі можуть включати, крім сполук винаходу, стабілізатори, консерванти і інші подібні речовини. Переважними ліпідами є природні і синтетичні фосфоліпіди і фосфатидилхоліни (лецитини), що застосовуються окремо або разом. Методи формування ліпосом відомі в техніці. Дивіться, наприклад, публікацію Prescott Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N.Y., (1976), р 33 et seq. Лікарські форми для місцевого введення сполуки цього винаходу включають порошки, спреї, мазі і лікарські форми для інгаляції. Активну сполуку змішують в стерильних умовах з фармацевтично прийнятним носієм і будь-якими необхідними консервантами, буферами або пропелентами. Передбачається, що офтальмічні препарати, очні мазі, порошки і розчини також входять в обсяг цього винаходу. Водні рідкі композиції винаходу також є особливо зручними. Термін "фармацевтично прийнятні проліки" або "проліки", що використовується в описі винаходу, означає ті проліки сполук винаходу, які на основі обґрунтованого медичного висновку придатні для використання при контакті з тканинами людей і нижчих тварин без виявлення надмірної токсичності, подразнення, алергічної реакції і інших побічних ефектів, при задоволенні прийнятного співвідношення користь/ризик, і ефективні при їх передбачуваному використанні. Проліки винаходу можуть швидко трансформуватися in vivo в вихідну сполуку 3,7 моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло-[3.3.1.1 ]декану дигідроцитрату, наприклад, в результаті гідролізу в крові. Докладне обговорення проліків наводиться в публікації Higuchi T. and Stella V. Pro-drugs as Novel Delivery Systems, V. 14 °F the A.C.S. Symposium Series, і в публікації Edward В. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press (1987). Винахід також охоплює фармацевтично прийнятні сполуки, які при введенні пацієнту, якщо це йому необхідно, можуть перетворюватися в результаті in vivo біотрансформації в сполуку формули (I). Визначення біологічної активності Для визначення ефективності моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату як ліганду для α7 nAChRs сполуки винаходу 3 оцінювали за допомогою аналізу зв'язування з [ H]-метилдикаконітином (MLA) або аналізу 3 зв'язування з [ H]-DPPB. Для визначення ефективності типових сполук цього винаходу як 16 UA 110802 C2 3 5 10 15 20 25 30 35 40 45 50 55 лігандів для α4β2 nAChRs сполуки винаходу оцінювали за допомогою аналізу зв'язування з [ H]цитизином, який проводили, як описано нижче. 3 Зв'язування з [ H]-цитизином Зв'язування з підтипом α4β2 nAChR визначали відповідно до умов методик, описаних в 3 публікації Pabreza L.A., Dhawan S., Kellar K.J., [ H]-Cytisine Binding to Nicotinic Cholinergic Receptors in Brain, Mol. Pharm. 39: 9-12, 1991, які були модифіковані. Збагачені мембранами фракції мозку щура з видаленим мозочком (ABS Inc., Wilmington, DE) повільно розморожували при 4ºС, промивали і ресуспендували в 30 об'ємах BSS-Tris буфера (120 мM NaCl/5 мM KCl/2 мM CaCl2/2 мM MgCl2/50 мM Tris-Cl, pH 7,4, 4ºC). Зразки, що містять 100-200 мкг білка і 0,75 нM 3 [ H]-цитизину (30 Ci/ммоль; Perkin Elmer NEN Life Science Products, Boston, MA), інкубували в кінцевому об'ємі 500 мкл протягом 75 хвилин при 4ºС. Сім концентрацій кожної сполуки з логарифмічним розведенням піддавали випробуванням в двох паралельних експериментах. Неспецифічне зв'язування визначали в присутності 10 мкМ (-)-нікотину. Зв'язану радіоактивність виділяли шляхом вакуумної фільтрації на заздалегідь зволожених скловолокнистих фільтруючих планшетах (Millipore, Bedford, MA), використовуючи 96-ямкову фільтрувальну установку (Packard Instruments, Meriden, CT), і потім швидко споліскували за допомогою 2 мл дуже холодного BSS буфера (120 мM NaCl/5 мM KCl/2 мM CaCl2/2 мM MgCl2). У кожну ямку додавали сцинтиляційний коктейль Packard MicroScint-20® (40 мкл) і вимірювали радіоактивність за допомогою приладу Packard TopCount®. Значення IC50 визначали, використовуючи нелінійну регресію в програмі Microsoft Excel®. Значення K i обчислювали із значень IC50, використовуючи рівняння Ченга-Прусоффа, де Ki=IC50/(1+[ліганд]/KD). 3 Зв'язування з [ H]-метиллікаконітином (MLA) Зв'язування з підтипом α7 nAChR визначали відповідно до умов, які були аналогічні умовам, 3 що використовуються для аналізу зв'язування з [ H]-цитизином. Збагачені мембранами фракції мозку щура з видаленим мозочком (ABS Inc., Wilmington, DE) повільно розморожували при 4ºС, промивали і ресуспендували в 30 об'ємах BSS-Tris буфера (120 мM NaCl/5 мM KCl/2 мM CaCl2/2 3 мM MgCl2/50 мM Tris-Cl, pH 7,4, 22ºC). Зразки, що містять 100-200 мкг білка, 5 нM [ H]-MLA (25 Ci/ммоль; Perkin Elmer/NEN Life Science Products, Boston, MA) і 0,1 % альбуміну бичачої сироватки (BSA, Millipore, Bedford, MA), інкубували в кінцевому об'ємі 500 мкл протягом 60 хвилин при 22ºС. Сім концентрацій кожної сполуки з логарифмічним розведенням піддавали випробуванням в двох паралельних експериментах. Неспецифічне зв'язування визначали в присутності 10 мкМ MLA. Зв'язану радіоактивність виділяли шляхом вакуумної фільтрації на заздалегідь зволожених за допомогою 2 % BSA, використовуючи 96-ямкову фільтрувальну установку (Packard Instruments, Meriden, CT), і потім швидко споліскували за допомогою 2 мл дуже холодного BSS буфера. У кожну ямку додавали сцинтиляційний коктейль Packard MicroScint-20® (40 мкл) і вимірювали радіоактивність за допомогою приладу Packard TopCount®. Значення IC50 визначали, використовуючи нелінійну регресію в програмі Microsoft Excel®. Значення Ki обчислювали із значень IC50, використовуючи рівняння Ченга-Прусоффа, де Ki=IC50/(1+[ліганд]/KD). 3 Зв'язування з [ H]-DPPB 3 3 Зв'язування [ H]-DPPB, [ H]-(S, S)-2,2-диметил-5-(6-фенілпіридазин-3-іл)-5-аза-2азоніабіцикло[2.2.1]гептану йодиду з підтипом α7 nAChR визначали, використовуючи збагачені мембранами фракції мозку щура з видаленим мозочком або кортикального шару людини (ABS Inc., Wilmington, DE). Таблетовані фракції біологічного матеріалу розморожували при 4ºС, промивали і ресуспендували на пристрої Polytron, встановленому на режим роботи 7, за допомогою 30 об'ємів BSS-Tris буфера (120 мM NaCl, 5 мM KCl, 2 мM CaCl2, 2 мM MgCl2 і 50 мM Tris-Cl, pH 7,4, 4ºC). Сім концентрацій випробуваних сполук з логарифмічним розведенням, що 3 містять 100-200 мкг білка і 0,5 нM [ H]-DPPB (62,8 Ci/ммоль; R46V, Abbott Labs), інкубували в кінцевому об'ємі 500 мкл протягом 75 хвилин при 4ºС в двох паралельних експериментах. Неспецифічне зв'язування визначали в присутності 10 мкМ метиллікаконітину. Зв'язану радіоактивність збирали на планшетах Millipore MultiScreen® з фільтром FB, заздалегідь просоченим за допомогою 0,3 % PEI, використовуючи харвестер клітин Packard, промивали за допомогою 2,5 мл дуже холодного буфера, і радіоактивність вимірювали за допомогою лічильника бета-частинок Packard TopCount Microplate. Значення IC 50 визначали, використовуючи нелінійну регресію в програмі Microsoft Excel® або програмі Assay Explorer. Значення Ki обчислювали із значень IC50, використовуючи рівняння Ченга-Прусоффа, де 3 Ki=IC50/(1+[ліганд]/KD). [ H]-DPPB отримували відповідно до методик, описаних нижче. 3 Отримання [метил- H]2,2-диметил-5-(6-фенілпіридазин-3-іл)-5-аза-2азоніабіцикло[2.2.1]гептану йодиду 17 UA 110802 C2 3 5 10 15 20 25 30 35 40 45 50 55 60 [Метил- H]2,2-диметил-5-(6-фенілпіридазин-3-іл)-5-аза-2-азоніабіцикло[2.2.1]гептану йодид, 3 що використовується вище в аналізі зв'язування з [ H]-DPPB, отримували згідно з наступними методиками. Стадія 1: отримання трет-бутил-(S, S)-5-(6-фенілпіридазин-3-іл)-2,5діазабіцикло[2.2.1]гептан-2-карбоксилату До суспензії трет-бутил-(S, S)-2,5-діазабіцикло[2.2.1]гептан-2-карбоксилату (3,43 г, 17,3 ммоль, Aldrich Chemical Company) і 3-хлор-6-фенілпіридазину (3,30 г, 17,3 ммоль, Aldrich Chemical Company) в толуолі (50 мл) додавали триетиламін (20 мл), і суміш нагрівали в атмосфері азоту при 100ºС протягом 7 днів. Суміш темного кольору охолоджували до кімнатної температури, і отриманий осад відфільтровували, промивали толуолом (15 мл) і сушили під вакуумом з отриманням даної сполуки у вигляді жовтувато-білої твердої речовини (3,00 г). Фільтрат концентрували, і залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи етилацетатом, з отриманням додаткового продукту (0,41 г, сумарний вихід + 3,41 г, 56 %): MS (DCI/NH3) m/z 353 (M+Н) . Стадія 2: отримання (S, S)-2-метил-5-(6-фенілпіридазин-3-іл)-2,5-діазабіцикло[2.2.1]гептану Продукт, отриманий на стадії 1 (3,41 г, 9,7 ммоль), розчиняли в мурашиній кислоті (20 мл) і обробляли формаліном (37 % за масою, 1,0 г, 12,3 ммоль). Суміш нагрівали при 100ºС протягом 1 години, і коричневий розчин охолоджували до кімнатної температури і концентрували під вакуумом. Залишок очищали за допомогою колонкової хроматографії на силікагелі, елююючи за допомогою CH2Cl2-CH3OH-NH4OH (95:5:1) з отриманням даної сполуки у вигляді жовтувато-білої + твердої речовини (2,50 г, 96 %): MS (DCI NH3) m/z 267 (M+Н) . 3 Стадія 3: отримання [ H]-(S, S)-2,2-диметил-5-(6-фенілпіридазин-3-іл)-5-аза-23 азоніабіцикло[2.2.1]гептану йодиду ([ Н]-РРРВ) 3 [ H]-метилйодид в толуолі (250 мCi в 0,1 мл, 85 Ci/ммоль, American Radiolabeled Chemicals, Inc.) об'єднували з розчином продукту, отриманого на стадії 2, в дихлорметані (0,788 мг, 2,96 мкмоль в 0,45 мл). Флакон закривали кришкою, і суміш реагувала протягом ночі при кімнатній температурі. Додавали метанол, і розчинники випаровували з отриманням 42 мCi. Продукт розчиняли в метанолі для очищення за допомогою ВЕРХ. Стадія 4: очищення за допомогою високоефективної рідинної хроматографії (ВЕРХ) 3 Близько 7 мCi [ H]-DPPB випаровували досуха, і залишок розчиняли повністю в приблизно 4,5 мл суміші ацетонітрил:вода:TFA (15:85:0,1). В колонку Phenomenex Luna С 18(2) (5 мікрон, 3 250×4,6 мм ID) вводили приблизно 0,9 мл, використовуючи ВЕРХ систему Agilent. [ H]-DPPB елюювали градієнтною рухомою фазою від 10 % В до 20 % В через 20 хвилин, де рухома фаза А=0,1 % трифтороцтової кислоти у воді, і рухома фаза В=0,1 % трифтороцтової кислоти в ацетонітрилі, при витраті приблизно 1 мл/хв. Детектування піка і хроматограми отримували за 3 допомогою УФ-детектора Agilent із змінною довжиною хвилі при 275 нм. Фракції, що містять [ H]DPPB, збирали приблизно на 14 хвилині, використовуючи колектор фракцій Agilent. Фракції об'єднували, і розчинники випаровували під вакуумом. Залишок розчиняли в абсолютному етанолі (2 мл) з отриманням 0,7 мCi. Стадія 5: визначення чистоти і специфічної активності 3 [ H]-DPPB піддавали аналізу з використанням ВЕРХ системи Agilent 1100 series, що складається з насоса для чотирикомпонентних сумішей, автоматичного дозатора і матричного фотодіодного УФ-детектора. До ВЕРХ системи був під'єднаний детектор радіоактивності Packard Radiomatic А 500. Для детектування радіоактивності використовували проточну кювету на 500 мкл і відношення 3:1 сцинтиляційного коктейлю Ultima-Flo M до рухомої фази ВЕРХ. Аналіз проводили з використанням колонки Phenomenex Luna С 18(2) (5 мікрон, 250×4,6 мм внутрішній діаметр). Рухома фаза складалася з градієнта, який здійснювали, починаючи з 10 % В і збільшуючи до 20 % В через 20 хвилин, потім збільшуючи до 90 % В через 1 хвилину, і підтримуючи 90 % В протягом 9 хвилин, де рухома фаза А=0,1 % трифтороцтової кислоти у воді, і рухома фаза В=0,1 % трифтороцтової кислоти в ацетонітрилі. Витрата становила приблизно 1 мл/хв., і УФ-детектування здійснювалося при довжині хвилі 275 нм. Переважні сполуки винаходу мали значення Ki від приблизно 0,1 наномоля до приблизно 10 3 мікромолів при проведенні випробувань за допомогою [ H]-MLA аналізу, при цьому багато які мали значення Ki менше ніж 1 мікромоль. Інші переважні сполуки демонстрували значення 3 зв'язування сполук винаходу з [ H]-цитизином в інтервалі від приблизно 0,1 наномоля до щонайменше 10 мікромолів. Деякі переважні сполуки виявляли більшу активність по відношенню до α7 рецепторів, ніж до α4β2 рецепторів. Для визначення таких переважних сполук звичайно розглядали значення Ki, виміряне за допомогою аналізу з MLA, з урахуванням значення Ki, виміряного за допомогою аналізу зв'язування з [3H]-цитизином, так що в формулі 3 D=Ki[ H]-цитизин/KiMLA D складає величину, більшу ніж приблизно 50. Як варіант, значення Ki, 18 UA 110802 C2 3 5 10 15 20 25 виміряне за допомогою аналізу [ H]-DPPB, може бути використано замість KiMLA, так що в 3 3 формулі D' = Ki[ H]-цитизин/Ki[ H]-DPPB D' складає величину, більшу ніж приблизно 50. Сполуки винаходу є лігандами для α7 nAChRs і/або лігандами для α4β2, які модулюють функцію α7 nAChRs і/або α4β2 шляхом зміни активності рецептора або активності сигнальної системи. Сполуки можуть бути зворотними агоністами, які інгібують базальну активність рецептора, або антагоністами, які повністю блокують дію агоністів, що активують рецептор. Сполуки можуть також бути частковими агоністами, які частково блокують або частково активують α7 nAChR рецептор, або агоністами, які активують рецептор. Зв'язування з α7 нікотиновим рецептором також запускає ключові процеси сигнальної системи, що включають різні кінази і фосфатази і білок-білкові взаємодії, які є важливими при впливі на пам'ять, цитопротекцію, транскрипцію гена і модифікацію хвороби. Способи винаходу Сполуки і композиції винаходу застосовують для модулювання впливів nAChRs і, більш конкретно, α7 nAChRs. Зокрема, сполуки і композиції винаходу можуть бути використані для лікування або запобігання розладам, що модулюються за допомогою α7 nAChRs. Звичайно стани при таких розладах можуть бути поліпшені шляхом селективного модулювання α7 nAChRs у ссавця, переважно шляхом введення сполуки або композиції винаходу або в чистому вигляді, або в комбінації з іншим активним засобом, наприклад, як частина схеми лікування. Крім того, винахід належить до способу лікування або запобігання станам, розладам або порушенням, що модулюються α7 нікотиновим ацетилхоліновим рецептором, α4β2 нікотиновим ацетилхоліновим рецептором або обома - і α7, і α4β2 нікотиновим ацетилхоліновим рецептором, де стан, розлад або порушення вибирають з групи, що складається з розладу пам'яті, когнітивного розладу, нейродегенерації або порушення розвитку центральної нервової системи, або їх комбінації, що включає введення терапевтично придатної кількості кристалічної 3,7 солі (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану, що має формулу (I) де сіль включає дигідроцитрат, що має формулу (II) 30 35 40 45 50 Винахід також пропонує спосіб лікування або запобігання стану або розладу, що модулюється α7 нікотиновим ацетилхоліновим рецептором, що включає стадію введення 3,7 сполуки моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, де стан або розлад вибирають з розладу пам'яті, когнітивного розладу, нейродегенерації або порушення розвитку центральної нервової системи. Винахід також пропонує спосіб лікування або запобігання стану або розладу, що модулюється α7 нікотиновим ацетилхоліновим рецептором, що включає стадію введення 3,7 сполуки моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, де стан або розлад вибирають з синдрому порушення уваги, синдрому дефіциту уваги з гіперактивністю (ADHD), хвороби Альцгеймера (AD), помірних когнітивних порушень, шизофренії, сенільної деменції, деменції при СНІДі, хвороби Піка, деменції, пов'язаної з тільцями Леві, деменції, пов'язаної з синдромом Дауна, бічного аміотрофічного склерозу, хвороби Хантінгтона, дефіцитарної функції ЦНС, пов'язаної з травматичним пошкодженням мозку, гострого болю, післяопераційного болю, хронічного болю і запального болю. Винахід також пропонує спосіб лікування або запобігання стану або розладу, що модулюється α7 нікотиновим ацетилхоліновим рецептором, що включає стадію введення 3,7 сполуки моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, де стан або розлад являє собою шизофренію. Винахід також пропонує спосіб лікування або запобігання стану або розладу, що модулюється α7 нікотиновим ацетилхоліновим рецептором, що включає стадію введення 19 UA 110802 C2 3,7 5 10 15 20 25 30 35 40 45 50 55 60 сполуки моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату в комбінації з атиповим нейролептиком. Винахід також пропонує спосіб лікування або запобігання стану або розладу, що модулюється α7 нікотиновим ацетилхоліновим рецептором, що включає стадію введення 3,7 сполуки моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, де стан або розлад являє собою безпліддя, недостатність кровообігу, необхідність у рості нових кровоносних судин, пов'язану із загоєнням рани, більш конкретно, кровообіг навколо оклюзії посудини, необхідність у рості нових кровоносних судин, пов'язану з васкуляризацією шкірних трансплантатів, ішемію, запалення, зокрема запалення, пов'язані з ревматоїдним артритом, загоєння рани і інші ускладнення, пов'язані з діабетом. Винахід також пропонує спосіб лікування або запобігання стану або розладу, що модулюється α7 нікотиновим ацетилхоліновим рецептором, що включає стадію введення 3,7 сполуки моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, де стан або розлад вибирають з групи розладів, при яких залучені як α7, так і α4β2 нікотинові рецептори. Вони включають синдром порушення уваги, синдром дефіциту уваги з гіперактивністю (ADHD), хворобу Альцгеймера (AD), помірні когнітивні порушення, шизофренію, сенільну деменцію, деменцію при СНІДі, хворобу Піка, деменцію, пов'язану з тільцями Леві, деменцію, пов'язану з синдромом Дауна, бічний аміотрофічний склероз, хворобу Хантінгтона, запалення, артрити різного типу, припинення куріння, абстинентний синдром відміни прийому нікотину, травматичне пошкодження мозку, гострий біль, післяопераційний біль, остеоартритичний біль, хронічний біль при невропатичних і запальних станах. Сполуки для способу винаходу, що включають, але цим не обмежуючись, сполуки, вказані в прикладах або ж конкретно названі, можуть модулювати і часто мають афінність до nAChRs і, більш конкретно, до α7 nAChRs. Як α7 nAChRs ліганди, сполуки винаходу можуть застосовуватися для лікування або запобігання ряду α7 nAChR-опосередкованих захворювань або станів. Конкретні сполуки винаходу виявляють, крім афінності до α7 nAChRs, і афінність до α4β2 nAChRs. Наприклад, було показано, що α7 nAChRs грає важливу роль в посиленні когнітивної функції, включаючи аспекти навчання, пам'яті і уваги (Levin E. D., J. Neurobiol. 53: 633-640, 2002). А саме, α7 ліганди застосовують для лікування станів і розладів, що належать до пам'яті і/або когнітивної діяльності, що включають, наприклад, синдром порушення уваги, синдром дефіциту уваги з гіперактивністю (ADHD), хворобу Альцгеймера (AD), помірні когнітивні порушення, сенільну деменцію, деменцію при СНІДі, хворобу Піка, деменцію, пов'язану з тільцями Леві, і деменцію, пов'язану з синдромом Дауна, а також когнітивні порушення, пов'язані з шизофренією. Крім того, було показано, що α7-вмісні nAChRs залучені до цитопротекторної дії нікотину як in vitro (Jonnala R. B. and Buccafusco J. J., J. Neurosci. Res. 66: 565-572, 2001), так і in vivo (Shimohama S. et al., Brain Res. 779: 359-363, 1998). Більш конкретно, нейродегенерація лежить в основі ряду прогресуючих розладів ЦНС, що включають, але цим не обмежуючись, хворобу Альцгеймера, хворобу Паркінсона, бічний аміотрофічний склероз, хворобу Хантінгтона, деменцію з тільцями Леві, а також дефіцитарну функцію ЦНС внаслідок травматичного пошкодження мозку. Наприклад, знижена функція α7 nAChRs під дією β-амілоїдних пептидів, пов'язана з хворобою Альцгеймера, вважається ключовим фактором розвитку когнітивних порушень при цьому захворюванні (Liu Q. S., Kawai Н., Berg D. K., PNAS 98: 4734-4739, 2001). Селективні відносно α7 ліганди можуть впливати на нейропротективні шляхи, приводячи до пониженого фосфорилування тау-білка, фосфорилування якого необхідне для утворення нейрофібрилярних клубків при різних, пов'язаних з тау-білком паталогіях, таких як хвороба Альцгеймера, і інші різні деменції (Bitner et al., Soc. Neuroscience, 2006 abst 325.6). Було показано, що активація α7 nAChRs блокує цю нейротоксичність (Kihara Т. et al., J. Biol. Chem. 276: 13541-13546, 2001). А саме селективні ліганди, які підвищують активність α7, можуть протидіяти порушенням при хворобі Альцгеймера і інших нейродегенеративних захворюваннях. α7 nAChRs також пов'язані з аспектами порушення розвитку центральної нервової системи, наприклад нейрогенезу головного мозку. (Falk L. et al., Developmental Brain Research 142: 151160, 2003; Tsuneki Н. et al., J. Physiol. (London) 547: 169-179, 2003; Adams C. E. et al., Developmental Brain Research 139: 175-187, 2002). А саме α7 nAChRs можуть застосовуватися для запобігання або лікування станів або розладів, пов'язаних з порушеннями розвитку центральної нервової системи, наприклад шизофренією (Sawa А. Mol. Med. 9:3-9, 2003). Було показано, що ряд сполук з високою афінністю відносно α4β2 неврональних нікотинових рецепторів (NNRs) поліпшують уважність і когнітивну діяльність в передклінічних моделях, які належать до синдрому дефіциту уваги з гіперактивністю (ADHD), захворювання, що 20 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 характеризується основними симптомами гіперактивності, неуважності і імпульсивності. Наприклад, ABT-418, повний агоніст відносно α4β2 NNRs, є ефективним в цілому ряді передклінічних моделей когнітивної діяльності. При контрольованому клінічному випробуванні на 32 дорослих пацієнтах було показано, що ABT-418, що вводиться трансдермально, є ефективним при лікуванні ADHD в більшості випадків і, зокрема, порушень уваги/когнітивної діяльності (Wilens T. E.; Biederman J.; Spencer T. J.; Bostic J.; Prince J.; Monuteaux M. C.; Soriano J.; Fince С.; Abrams А.; Rater M.; Polisner D. The American Journal of Psychiatry (1999) 156(12), 1931-1937.). Крім того, ABT-418 показав ознаки активності при пілотному випробуванні у разі хвороби Альцгеймера. На моделях гризунів і приматів було показано, що ABT-089 - селективний частковий агоніст α4β2, поліпшує стан при порушеннях уваги, здатності до навчання і пам'яті. ABT-089 і інший агоніст α4β2, іспроніклін, продемонстрували активність при пілотних клінічних випробуваннях. Крім когнітивної здатності, сполуки, які взаємодіють з α4β2 nAChRs, такі як ABT594 і інші, є також ефективними на передклінічних і клінічних моделях болю. А саме ліганди, які модулюють активність як відносно α7, так і α4β2, можуть мати більш широкий спектр терапевтичної ефективності при хворобливих станах, таких як стани, що включають когнітивні порушення і порушення уваги, біль, нейродегенеративні захворювання і інші порушення. Шизофренія являє собою комплексне захворювання, яке характеризується порушеннями сприйняття, когнітивної здатності і емоцій. Існують вагомі докази, підтверджуючі участь α7 nAChRs в цьому захворюванні, включаючи виміряний дефіцит цих рецепторів у померлих пацієнтів (Sawa А. Mol. Med. 9: 3-9, 2003; Leonard S., Eur. J., Pharmacol. 393: 237-242, 2000). Порушення обробки сенсорної інформації (пропускання сигналів) є однією з відмінних ознак шизофренії. Ці порушення можуть бути нормалізовані за допомогою нікотинових лігандів, які впливають на α7 nAChR (Adler L. E. et al., Schizophrenia Bull. 24: 189-202, 1998; Stevens K. E. et al., Psychopharmacology 136: 320-327, 1998). Більш пізні дослідження показали, що стимулювання α4β2 нікотинового рецептора також позитивно впливає на дію нікотину в моделі порушення пропущення сенсорних сигналів на мишах лінії DBA/2 (Radek et al., Psychopharmacology (Berl). 2006 187: 47-55). Таким чином, ліганди α7 і α7/α4β2 демонструють можливість їх застосування при лікуванні шизофренії. Ангіогенез - процес росту нових кровоносних судин, є важливим для здійснення корисних системних функцій організму, таких як загоєння ран, васкуляризація шкірних трансплантатів і посилення кровообігу, наприклад підвищеного кровообігу навколо оклюзії судини. Було показано, що неселективні агоністи nAChR, такі як нікотин, стимулюють ангіогенез (Heeschen С. et al., Nature Medicine 7: 833-839, 2001). Було показано, що підвищений ангіогенез характеризується активацією α7 nAChR (Heeschen С. et al., J. Clin. Invest. 110: 527-536, 2002). Наприклад, поліпшення станів, що належать до запалення, ішемії, серцевої ішемії і загоєння рани, наприклад, у хворих діабетом, було пов'язане з активністю α7 nAChR (Jacobi J. et al., Am. J. Pathol. 161: 97-104, 2002). Тому ліганди nAChR, які є селективними відносно α7 підтипу, пропонують поліпшену можливість стимулювання ангіогенезу при менших побічних ефектах. Популяція α7 або α4β2 nAChRs в спинному мозку модулює нейротрансмісійну передачу, яку пов'язують із знеболюючою дією нікотинових сполук (Cordero-Erausquin M. and Changeux J.-P. PNAS 98: 2803-2807, 2001). Ліганди α7 nAChR або/і α7/α4β2 пропонують терапевтичну можливість лікування больових станів, що включають гострий біль, післяопераційний біль, а також станів хронічного болю, що включають запальний біль і невропатичний біль. Більше того, α7 nAChRs експресують на поверхні первинних макрофагів, які беруть участь в запальній реакції, і активація α7 рецептора інгібує вивільнення фактора некрозу пухлин і інших цитокінів, які запускають запальну реакцію (Wang Н. et al Nature 421: 384-388, 2003). Тому, селективні α7 ліганди надають можливість лікування станів, що включають в себе запалення, включаючи запалення, пов'язані з різними формами артриту. Реакція акросом сперми ссавця являє собою процес екзоцитозу, що відіграє важливу роль в заплідненні яйцеклітини сперматозоїдом. Було показано, що активація α7 nAChR на клітинах сперми є необхідною для реакції акросом (Son J. H. and Meizel S. Biol. Reproduct. 68: 1348-1353 2003). Відповідно, селективні відносно α7 засоби можуть застосовуватися для лікування порушень фертильності. Сполуки даного винаходу особливо придатні для лікування і профілактики стану або розладу, що має відношення до пам'яті, когнітивної здатності, нейродегенерації і шизофренії. Когнітивний розлад, пов'язаний з шизофренією, часто обмежує здатність пацієнтів усвідомлено діяти, є симптомом, який не піддається адекватному лікуванню звичайними доступними засобами, наприклад лікуванню атиповим нейролептиком (Rowley M. et al., J. Med. Chem., 44: 477-501, 2001). Таке когнітивне порушення пов'язують з дисфункцією нікотинової холінергічної системи, зокрема зі зниженою активністю α7 рецепторів (Friedman J. I. et al., Biol 21 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 Psychiatry, 51: 349-357, 2002). Отже, активатори α7 рецепторів можуть забезпечити відповідну терапію для поліпшення когнітивної функції у хворих шизофренією, яких лікують за допомогою атипових нейролептиків. Відповідно, комбінація α7 nAChR ліганду і атипового нейролептика дозволяє отримати поліпшений терапевтичний метод лікування. Конкретні приклади придатних атипових нейролептиків включають, але цим не обмежуючись, клозапін, рисперидон, оланзапін, кветіапін, зипрасидон, зотепін, ілоперидон і інші подібні нейролептики. Реальні рівні доз активних інгредієнтів в фармацевтичних композиціях цього винаходу можуть бути змінені для того, щоб отримати кількість активної сполуки (активних сполук), яка була б ефективною для досягнення необхідного терапевтичного ефекту у конкретного пацієнта, для конкретних композицій і при конкретному способі введення. Вибираний рівень дози буде залежати від активності конкретної сполуки, способу введення, тяжкості захворювання, що піддається лікуванню, і загального стану і анамнезу пацієнта, що піддається лікуванню. Однак фахівець в даній галузі може почати введення з доз сполук, що знаходяться нижче рівня, необхідного для досягнення бажаного терапевтичного ефекту, і поступово збільшувати дози аж до досягнення бажаного ефекту. При застосуванні вказаного вище лікування або іншого лікування терапевтично ефективна кількість однієї із сполук даного винаходу може використовуватися в формі фармацевтично прийнятної солі, складного ефіру, аміду або проліків. Як варіант, сполука може бути введена у вигляді фармацевтичної композиції, що містить сполуку, що представляє інтерес, в поєднанні з одним або декількома фармацевтично прийнятними носіями. Термін "терапевтично ефективна кількість" сполуки даного винаходу означає кількість сполуки, достатню для лікування розладів, при розумному співвідношенні користь/ризик, яке застосовується для будь-якого медичного лікування. Однак потрібно мати на увазі, що сумарна добова доза сполук і композицій даного винаходу буде визначатися лікуючим лікарем на основі обґрунтованого медичного висновку. Конкретний рівень терапевтично ефективної дози для будь-якого конкретного пацієнта буде залежати від різних факторів, що включають розлад, що піддається лікуванню, і тяжкість такого розладу; активність конкретної сполуки, що використовується; конкретну композицію, що використовується; вік, вагу тіла, загальний стан здоров'я, стать і режим харчування пацієнта; час введення, спосіб введення і швидкість виведення з організму конкретної сполуки, що використовується; тривалість лікування; лікарські засоби, що використовуються в поєднанні або одночасно з конкретною сполукою, що використовується; і інші подібні фактори, добре відомі в медицині. Наприклад, в медицині добре відомо, що можна починати дозування сполуки при рівнях, які нижче, ніж потрібні для досягнення необхідного терапевтичного ефекту, і потім поступово підвищувати дозу доти, поки не буде досягнутий необхідний ефект. Сумарна добова доза сполук даного винаходу для введення людині або нижчій тварині знаходиться в інтервалі від приблизно 0,10 мкг/кг маси тіла до приблизно 10 мг/кг маси тіла. Більш переважно, щоб дози знаходилися в інтервалі від приблизно 0,10 мкг/кг маси тіла до приблизно 1 мг/кг маси тіла. При бажанні, ефективна добова доза для введення може бути розділена на декілька кратних доз. Отже, композиції разової дози можуть містити такі кількості або їх частини, які складають добову дозу. Далі наводяться приклади даного винаходу, але тільки як ілюстрації, а не як обмеження. Приклад 1 Форма вільної основи (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану Для отримання монокристала (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану в формі вільної основи (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декан у формі вільної основи (13 мг) розчиняли в 1,0 мл 2-пропанолу. Розчинник повільно випаровували. Протягом часу утворювалися монокристали (4s)-4-(5-феніл3,7 1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану в формі вільної основи. Приклад 2 3,7 (4s)-4-(5-Феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло-[3.3.1.1 ]декану дигідроцитрат Для того, щоб отримати кристалічну моногідратну форму, необхідно спочатку приготувати безводну сольову форму сполуки. А саме цей приклад належить до способу отримання безводної дигідроцитратної солі. Форму вільної основи (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)3,7 1-азатрицикло-[3.3.1.1 ]декану (63 мг, 0,2 ммоль) розчиняли в 1,0 мл метанолу. Розчиняли лимонну кислоту (41 мг, 0,21 ммоль) в 0,5 мл метанолу. Розчин лимонної кислоти додавали до 3,7 розчину вільної основи (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]-декану при перемішуванні. Після додавання посудину видаляли з пристрою для перемішування, і розчинник повільно випаровували. Протягом часу кристалізувався (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]-декану дигідроцитрат. 22 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для отримання монокристала (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрат (20 мг) розчиняли в 0,8 мл суміші вода/2-пропанол (1:6 за об'єм) при 50ºС. У розчин додавали затравку твердого (4s)-4-(5-феніл-1,3,4-тіадіазол-23,7 ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату і охолоджували до температури навколишнього середовища в герметизованій посудині. Протягом часу утворювалися монокристали. Приклад 3 3,7 Моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату Моногідратна сіль може бути отримана відповідно до наступної методики. Спочатку, 3,7 негідратований (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло-[3.3.1.1 ]декану дигідроцитрат розчиняють в 4 об'ємах 2-пропанолу і 1 об'ємі води при температурі 75ºС. Температуру отриманого розчину доводять до 65ºС протягом періоду часу не менше ніж 30 хвилин. Як тільки температура отриманого розчину досягає 65ºС, до розчину додають 6 об'ємів 2-пропанолу і перемішують протягом періоду часу не менше ніж 30 хвилин. Після перемішування відбувається спонтанне утворення активних центрів кристалізації, і температуру суспензії, що утворилася, повільно знижують до 40ºС протягом періоду часу, більшого ніж 2 години. Після того, як температура суспензії досягає 40ºС, до суспензії додають 5 об'ємів 2пропанолу протягом періоду часу не менше ніж 3 години. Після додавання 2-пропанолу до суспензії отриману суспензію витримують при температурі 40ºС протягом періоду часу щонайменше 1 година. Потім температуру суспензії повільно доводять до 5ºС і перемішують при 5ºС протягом щонайменше 1 години. Після завершення цих стадій моногідратні тверді речовини збирають за допомогою фільтрації. Приклад 4 Утворення моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату Автори винаходу отримували кристали моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)3,7 1-азатрицикло[3.3.1.1 ]декану дигідроцитрату відповідно до наступної методики. Спочатку, 200 мг твердого негідратованого (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло3,7 [3.3.1.1 ]декану дигідроцитрату суспендували в приблизно 1,0 мл води. Потім суспензію герметизували за допомогою плівки парафілм і зберігали в лабораторній шафі, захищеній від дії світла, за умов навколишнього середовища протягом часу, достатнього для кристалізації. Після утворення кристалів автори винаходу піддавали монокристали рентгеноструктурному аналізу, і було підтверджено, що кристалічний продукт являв собою моногідрат (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату. Приклад 5 3,7 Моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату Автори винаходу отримували кристали моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)3,7 1-азатрицикло[3.3.1.1 ]декану дигідроцитрату відповідно до наступної методики. 3,7 Негідратований твердий (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрат суспендували в суміші органічного розчинника (наприклад, метанолу, етанолу, ацетонітрилу і інших розчинників) і води. Після приведення суспензії до рівноваги з навколишніми умовами негідратовану сполуку перетворювали в моногідратну сполуку. Потім, автори винаходу виділяли моногідратну сполуку за допомогою фільтрації і підтверджували моногідратну структуру за допомогою рентгеноструктурного аналізу. Приклад 6 Визначення критичної активності води для утворення гідрату (4s)-4-(5-феніл-1,3,4-тіадіазол3,7 2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату Автори винаходу визначали критичну активність води для моногідрату (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату при температурі навколишнього середовища. Зокрема автори винаходу отримували суспензії кристалічного продукту в сумішах метанолу і води, при активності води 0,20, 0,15, 0,10 і 0,05, знімаючи порошкові рентгенограми для кожної суспензії, відповідно. Автори винаходу також знімали порошкову рентгенограму для практично чистої кристалічної моногідратної солі і для практично чистої кристалічної безводної солі, і об'єднали всі дані порошкових ренгенограм в одну діаграму, що перекривається. Автори винаходу об'єднали дані в одну діаграму для визначення значення активності води (або інтервалу значень), при якому безводна форма перетворюється в моногідратну форму. 23 UA 110802 C2 5 10 15 20 25 30 На фіг. 4(a)-4(f) наведені порошкові рентгенограми для шести різних складів. На фіг. 4(a) показана порошкова рентгенограма для складу, що являє собою практично чистий кристалічний 3,7 моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату. На фіг. 4(b) наведена порошкова рентгенограма для твердого (4s)-4-(5-феніл3,7 1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, виділеного з суспензії, що має активність води 0,20. На фіг. 4(с) показана порошкова рентгенограма для твердого (4s)3,7 4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, виділеного з суспензії, що має активність води 0,15. На фіг. 4(d) наведена порошкова рентгенограма для 3,7 твердого (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло-[3.3.1.1 ]декану дигідроцитрату, виділеного з суспензії, що має активність води 0,10. На фіг. 4(е) показана порошкова рентгенограма для твердого (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату, виділеного з суспензії, що має активність води 0,05. На фіг. 4(f) наведена порошкова рентгенограма для складу, що являє собою практично чистий кристалічний безводний (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрат. Порівняння фіг. 4(с) і 4(d) виявляє зсув в рентгенограмі моногідрату до рентгенограми негідратованої сполуки. Рентгенограми, показані на фіг. 4(с) і 4(d), представляють тверді речовини, виділені з суспензій, що мають активність води 0,15 і 0,10, відповідно. Тому, для будь-якого фахівця в цій галузі є очевидним, що, коли активність води розчинника, що використовується для кристалізації (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілокси)-1-азатрицикло3,7 [3.3.1.1 ]декану дигідроцитрату, становить 0,15 або більше, (4s)-4-(5-феніл-1,3,4-тіадіазол-23,7 ілокси)-1-азатрицикло-[3.3.1.1 ]декану дигідроцитрат буде існувати у вигляді моногідратної солі. Однак, якщо розчинник включає активність води 0,10 або менше, (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілокси)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрат буде існувати в негідратованій формі. Потрібно мати на увазі, що наведений вище докладний опис і супроводжуючі його приклади є тільки ілюстрацією, і їх не треба вважати обмежуючими обсяг винаходу, який визначається виключно прикладеними пунктами формули винаходу і їх еквівалентами. Для фахівців в цій галузі є очевидним, що в розкритих варіантах здійснень можуть бути зроблені різні зміни і модифікації. Такі зміни і модифікації належать до хімічних структур, замісників, похідних, проміжних сполук, синтезів, складів і/або способів застосування винаходу і можуть бути зроблені без відхилення від суті і обсягу домагань. ФОРМУЛА ВИНАХОДУ 35 1. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату, де (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декан представлений формулою (І) S O N N 40 (I) і де дигідроцитрат представлений формулою (II) O HO 45 50 N O OH OH O OH (II). 2. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату за п. 1, де моногідрат має чистоту, що характеризується вмістом щонайменше 90 % моногідратної форми і не більше ніж 10 % немоногідратної форми. 3. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату за п. 1, де моногідрат має чистоту, що характеризується вмістом щонайменше 95 % моногідратної форми і не більше ніж 5 % немоногідратної форми. 4. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату за п. 1, де моногідрат має чистоту, що 24 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 характеризується вмістом щонайменше 97 % моногідратної форми і не більше ніж 3 % немоногідратної форми. 5. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату за п. 1, що характеризується щонайменше одним характеристичним піком на порошковій рентгенограмі при значеннях в градусах два-тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 і 26,9±0,20. 6. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату за п. 1, що має параметри елементарної комірки, в якій a становить приблизно 6,52Å, b становить приблизно 20,99Å, с становить приблизно 16,83Å, α становить приблизно 90,0°, β становить приблизно 93,75°, γ становить приблизно 3 90,0°, об'єм становить приблизно 2297,52Å , і Z становить приблизно 4. 7. Кристалічний моногідрат (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату за п. 1, де моногідрат виявляє негігроскопічні властивості, що визначаються за допомогою методу динамічної гравіметрії сорбції вологи, маючи втрату маси менше ніж приблизно 0,2 % в інтервалі відносної вологості від 0 % до 90 %. 8. Спосіб лікування або попередження станів, розладів або порушень, що модулюються α7нікотиновими ацетилхоліновими рецепторами, α4β2-нікотиновими ацетилхоліновими рецепторами або обома α7- і α4β2-нікотиновими ацетилхоліновими рецепторами, де стан, розлад або порушення вибирають з групи, що складається з розладу пам'яті, когнітивного розладу, нейродегенерації і порушення розвитку центральної нервової системи, що включає введення терапевтично придатної кількості кристалічного моногідрату за п. 1. 9. Спосіб за п. 8, де стан або розлад вибирають з групи, що складається з синдрому порушення уваги, синдрому дефіциту уваги з гіперактивністю (ADHD), хвороби Альцгеймера (AD), помірних когнітивних порушень, шизофренії, вікового порушення пам'яті (ААМІ), сенільної деменції, деменції при СНІДі, хвороби Піка, деменції, пов'язаної з тільцями Леві, деменції, пов'язаної з синдромом Дауна, бічного аміотрофічного склерозу, хвороби Хантінгтона, припинення куріння, абстинентного синдрому припинення прийому нікотину, шизоафективного розладу, біполярних і маніакальних розладів, дефіцитарної функції ЦНС, пов'язаної з травматичним пошкодженням мозку, гострого болю, післяопераційного болю, хронічного болю, запального болю і невропатичного болю. 10. Спосіб за п. 8, де стан або розлад являє собою когнітивне порушення, пов'язане з синдромом дефіциту уваги з гіперактивністю, шизофренією, хворобою Альцгеймера, помірними когнітивними порушеннями, віковим порушенням пам'яті і когнітивними порушеннями при шизофренії. 11. Спосіб за п. 8, що додатково включає введення сполуки, що включає кристалічний моногідрат за п. 1, в комбінації з атиповими нейролептиками. 12. Спосіб за п. 8, де стан або розлад вибирають з групи, що складається з безпліддя, недостатності кровообігу, необхідності в рості нових кровоносних судин, пов'язаної із загоєнням рани, необхідності в рості нових кровоносних судин, пов'язаної з васкуляризацією шкірних трансплантатів, ішемії, запалення, артриту і споріднених захворювань, загоєння рани і ускладнень, пов'язаних з діабетом. 13. Спосіб отримання кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату, в якому здійснюють стадії: 3,7 (a) розчинення (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло-[3.3.1.1 ]декану дигідроцитрату щонайменше в одному розчиннику при температурі в інтервалі від приблизно 65 °C до приблизно 85 °C; (b) доведення температури розчину до температури в інтервалі від приблизно 55 °C до приблизно 75 °C; (c) додавання до розчину щонайменше одного додаткового розчинника і перемішування; (d) доведення температури розчинів до температури в інтервалі від приблизно 30 °C до приблизно 50 °C; (e) додавання до розчину щонайменше одного додаткового розчинника; (f) витримування суспензії при температурі в інтервалі від приблизно 30 °C до приблизно 50 °C; (g) доведення температури суспензії до температури в інтервалі від приблизно -5 °C до приблизно 15 °C; (h) перемішування суспензії протягом щонайменше однієї години; і (і) виділення кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату. 25 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 14. Спосіб за п. 13, де використовують розчинник на стадії (а), який містить комбінацію води і щонайменше одного іншого органічного розчинника, де комбінація має критичну активність води, яка більше ніж або дорівнює 0,15. 15. Спосіб за п. 14, де щонайменше один інший розчинник вибирають з групи, що складається з метанолу, етанолу, 2-пропанолу, бутанолу, ацетонітрилу, ацетону, формаміду, диметилформаміду, толуолу, бензолу, анізолу, етилацетату, ізопропілацетату, тетрагідрофурану, 1,4-діоксану, метилтретбутилового ефіру, дихлорметану, хлороформу, гексанів, н-гептану, 2-бутанону, диметилсульфоксиду, нітрометану, 1-метил-2-піролідону, триетиламіну, трибутиламіну, трифтортолуолу і їх сумішей. 16. Спосіб за п. 13, де використовують розчинник стадії (а), який включає суміш 2-пропанолу і води. 17. Спосіб за п. 16, де суміш щонайменше одного іншого розчинника і води включає відношення 2-пропанолу до води в інтервалі від приблизно 20:1 до приблизно 1:10. 18. Спосіб за п. 16, де суміш щонайменше одного іншого розчинника і води включає відношення 2-пропанолу до води в інтервалі від приблизно 1:1 до приблизно 7:1. 19. Спосіб за п. 13, де температуру стадії (а) змінюють в інтервалі від приблизно 70 °C до приблизно 80 °C. 20. Спосіб за п. 13, де температуру стадії (а) змінюють в інтервалі від приблизно 74 °C до приблизно 76 °C. 21. Спосіб за п. 13, де стадія (b) включає доведення температури розчину в інтервалі від приблизно 60 °C до приблизно 70 °C. 22. Спосіб за п. 13, де на стадії (b) здійснюють коректування температури розчину в інтервалі від приблизно 64 °C до приблизно 66 °C. 23. Спосіб за п. 13, де використовують розчинник на стадії (с), що включає органічний розчинник, воду і їх комбінації. 24. Спосіб за п. 13, де розчинник стадії (с) вибирають з групи, що складається з метанолу, етанолу, 2-пропанолу, бутанолу, ацетонітрилу, ацетону, формаміду, диметилформаміду, толуолу, бензолу, анізолу, етилацетату, ізопропілацетату, тетрагідрофурану, 1,4-діоксану, метилтретбутилового ефіру, дихлорметану, хлороформу, гексанів, н-гептану, 2-бутанону, диметилсульфоксиду, нітрометану, 1-метил-2-піролідону, триетиламіну, трибутиламіну, трифтортолуолу, води і їх сумішей. 25. Спосіб за п. 13, де використовують розчинник на стадії (с), що включає 2-пропанол. 26. Спосіб за п. 25, де кількість 2-пропанолу, що використовують на стадії (с), включає від приблизно 2 об'ємів до приблизно 10 об'ємів відносно кількості розчинника, що використовують на стадії (а). 27. Спосіб за п. 25, де кількість 2-пропанолу, що використовують на стадії (с), включає від приблизно 5 об'ємів до приблизно 7 об'ємів відносно кількості розчинника, що використовують на стадії (а). 28. Спосіб за п. 13, де на стадії (d) здійснюють коректування температури в інтервалі від приблизно 35 °C до приблизно 45 °C. 29. Спосіб за п. 13, де на стадії (d) здійснюють коректування температури в інтервалі від приблизно 39 °C до приблизно 41 °C. 30. Спосіб за п. 13, де використовують розчинник на стадії (e), який включає органічний розчинник, воду і їх комбінації. 31. Спосіб за п. 13, де розчинник стадії (e) вибирають з групи, що складається з метанолу, етанолу, 2-пропанолу, бутанолу, ацетонітрилу, ацетону, формаміду, диметилформаміду, толуолу, бензолу, анізолу, етилацетату, ізопропілацетату, тетрагідрофурану, 1,4-діоксану, метилтретбутилового ефіру, дихлорметану, хлороформу, гексанів, н-гептану, 2-бутанону, диметилсульфоксиду, нітрометану, 1-метил-2-піролідону, триетиламіну, трибутиламіну, трифтортолуолу, води і їх сумішей. 32. Спосіб за п. 13, де використовують розчинник стадії (e), що включає 2-пропанол. 33. Спосіб за п. 32, де кількість 2-пропанолу, що використовують на стадії (e), включає від приблизно 1 об'єму до приблизно 10 об'ємів відносно кількості розчинника, що використовують на стадіях (а) і (с). 34. Спосіб за п. 32, де кількість 2-пропанолу, що використовують на стадії (e), включає від приблизно 4 об'ємів до приблизно 6 об'ємів відносно кількості розчинника, що використовують на стадіях (а) і (с). 35. Спосіб за п. 13, де на стаді (f) здійснюють доведення температури в інтервалі від приблизно 35 °C до приблизно 45 °C. 26 UA 110802 C2 5 10 15 20 25 30 35 40 45 50 55 36. Спосіб за п. 13, де на стадії (f) здійснюють доведення температури в інтервалі від приблизно 39 °C до приблизно 41 °C. 37. Спосіб за п. 13, де на стадії (g) здійснюють доведення температури суспензії до температури в інтервалі від приблизно 0 °C до приблизно 10 °C. 38. Спосіб за п. 13, де на стадії (g) здійснюють доведення температури суспензії до температури в інтервалі від приблизно 4 °C до приблизно 6 °C. 39. Спосіб за п. 13, де на стадії (і) здійснюють виділення кристалічного моногідрату (4s)-4-(53,7 феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату за допомогою фільтрації. 40. Спосіб отримання кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату, в якому здійснюють стадії: 3,7 (a) розчинення (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-1-азатрицикло-[3.3.1.1 ]декану дигідроцитрату в приблизно 4 об'ємах 2-пропанолу і в приблизно 1 об'ємі води при температурі приблизно 75 °C; (b) доведення температури розчину до температури приблизно 65 °C; (c) додавання до розчину приблизно 6 об'ємів 2-пропанолу і перемішування; (d) доведення температури до приблизно 40 °C; (е) додавання до розчину приблизно 5 об'ємів 2-пропанолу; (f) витримування суспензії при температурі приблизно 40 °C; (g) доведення температури суспензії до температури приблизно 5 °C; (h) перемішування суспензії; і (і) виділення кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату. 41. Спосіб отримання кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату, в якому здійснюють стадії: (a) контактування безводного (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату з розчинником в реакційній посудині; (b) герметизації реакційної посудини і захисту суспензії від впливу світла за умов навколишнього середовища; і (c) виділення кристалічного моногідрату (4s)-4-(5-феніл-1,3,4-тіадіазол-2-ілоксі)-13,7 азатрицикло[3.3.1.1 ]декану дигідроцитрату. 42. Спосіб за п. 41, де використовують розчинник на стадії (а), що включає воду. 43. Спосіб за п. 42, де використовують кількість безводного (4s)-4-(5-феніл-1,3,4-тіадіазол-23,7 ілоксі)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, що включає від приблизно 10 мг до приблизно 500 мг, і де кількість води включає від приблизно 0,1 мл до приблизно 2,0 мл. 44. Спосіб за п. 42, де використовують кількість безводного (4s)-4-(5-феніл-1,3,4-тіадіазол-23,7 ілоксі)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату, що включає від приблизно 50 мг до приблизно 150 мг, і де кількість води включає від приблизно 0,8 мл до приблизно 1,2 мл. 45. Спосіб за п. 41, де використовують розчинник на стадії (а), що включає суміш органічного розчинника і води, де суміш має критичну активність води, яка більше ніж або дорівнює 0,15. 46. Спосіб за п. 45, де використовують органічний розчинник, що включає метанол, етанол, 2пропанол, бутанол, ацетонітрил, ацетон, формамід, диметилформамід, толуол, бензол, анізол, етилацетат, ізопропілацетат, тетрагідрофуран, 1,4-діоксан, метилтретбутиловий ефір, дихлорметан, хлороформ, гексани, н-гептан, 2-бутанон, диметилсульфоксид, нітрометан, 1метил-2-піролідон, триетиламін, трибутиламін, трифтортолуол і їх суміші. 47. Фармацевтична композиція, що містить кристалічний моногідрат (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату як активний інгредієнт і фармацевтично прийнятний носій, розріджувач або допоміжну речовину. 48. Фармацевтична композиція за п. 47, де кристалічний моногідрат (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату присутній в кількості в інтервалі від приблизно 0,1 % до приблизно 99,9 % за масою від загальної маси композиції. 49. Фармацевтична композиція за п. 47, де кристалічний моногідрат (4s)-4-(5-феніл-1,3,43,7 тіадіазол-2-ілоксі)-1-азатрицикло[3.3.1.1 ]декану дигідроцитрату характеризується щонайменше одним характеристичним піком на порошковій рентгенограмі при значеннях в градусах два-тета 8,4±0,20, 11,3±0,20, 14,2±0,20, 15,5±0,20, 16,4±0,20, 16,6±0,20, 17,2±0,20, 19,7±0,20, 20,7±0,20, 21,0±0,20, 21,2±0,20, 21,6±0,20, 24,8±0,20 і 26,9±0,20. 27 UA 110802 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMonohydrate of an azaadamantane derivative
Автори англійськоюChen, Shuang, Napier, James J., Zhang, Geoff G. Z., Brackemeyer, Paul J.
Автори російськоюЧень Шуан, Напир Джэймс Дж., Чжан Джефф Дж. З., Брэкмейер Пол Дж.
МПК / Мітки
МПК: A61K 31/439, A61P 25/28, A61P 25/00, C07D 471/08
Мітки: похідного, моногідрат, азаадамантану
Код посилання
<a href="https://ua.patents.su/32-110802-monogidrat-pokhidnogo-azaadamantanu.html" target="_blank" rel="follow" title="База патентів України">Моногідрат похідного азаадамантану</a>
Попередній патент: Збірна конструкція, виконана щонайменше із двох стінових елементів
Наступний патент: Спосіб застосування ґрунтовки, що містить самоемульгований поліефірний мікрогель
Випадковий патент: Спосіб формування структури крони кущових рослин