Спосіб одержання гетерологічного поліпептиду
Формула / Реферат
(57) 1. Способ получения гетерологичного полипептида в дрожжевой клетке, которая трансформируется рекомбинантным экспрес-сионным вектором, способным реплицироваться в дрожжах и несущим ДНК-конструкцию, кодирующую полипептид, отличающийся тем, что полилелтид имеет следующую структуру:
сигнальный пептид-лидерный пептид-Х1-Х2-Х3-Х4-гетерологичный протеин, где X1 является пептидной связью или представляет собой одну или более аминокислот, которые могут быть одинаковыми или различными, X2 представляет собой основную аминокислоту, выбранную из Lys и Arg, X3 представляет собой основную аминокислоту, выбранную из Lys и Arg, X4 является пептидной связью или представляет собой одну или более аминокислот, которые могут быть одинаковыми или различными, при условии, что X1 и/или X4 представляют одну или более аминокислот и, что, по крайней мере, одна из аминокислот, представленных X1 и/или X4, является отрицательно заряженной аминокислотой, выбранной из группы, состоящей из Glu или Asp.
2. Способ по п.1, отличающийся тем, что X1представляет собой Glu или Asp.
3. Способ по п.1, отличающийся тем, что X1 представляет собой последовательность двух аминокислот, имеющих структуру ВА, где А является Glu или Asp, а В является Glu, Asp, Val, Gly или Leu.
4. Способ по п.1, отличающийся тем, что X1представляет собой последовательность трех аминокислот, имеющих структуру СВА, где А является Glu или Asp. В является Glu, Asp, Val, Gly или Leu, а С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys.
5. Способ по п.1, отличающийся тем, что X1 представляет собой последовательность четырех аминокислот, имеющих структуру DCBA, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, a D имеет те же значения, что и С.
6. Способ по п.1, отличающийся тем, что X1представляет собой последовательность пяти аминокислот, имеющих структуру EDCBA, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, D является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, a E имеет те же значения,что и D.
7. Способ по п.1, отличающийся тем, что X1представляет собой последовательность шести аминокислот, имеющих структуру FEDCBA, где А является Glu или Asp, В является Glu, Asp, Val,Gly или Leu, С является Glu, Asp, Pro, Gly, Val,Leu, Arg или Lys, D является Glu, Asp, Pro, Gly,Val, Leu, Arg или Lys, E является Glu, Asp, Pro, Gly,Val, Leu, Arg или Lys, a F имеет те же значения,что и Е.
8. Способ по п.1, отличающийся тем, что X4 представляет собой Glu или Asp.
9. Способ по п.1, отличающийся тем, что X4 представляет собой последовательность двух аминокислот, имеющих структуру АВ, где А является Glu или Asp, а В является Glu, Asp, Val, Gly или Leu.
10. Способ по п.1, отличающийся тем, что X4 представляет собой последовательность трех аминокислот, имеющих структуру ABC, где А является Glu или Asp, В является Glu, Asp, Val, Glyили Leu, а С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys.
11. Способ по п.1, отличающийся тем, что X4 представляет собой последовательность четырех аминокислот, имеющих структуру ABCD, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, a D имеет те же значения, что и С.
12. Способ по п.1, отличающийся тем, что X4 представляет собой последовательность п’яти аминокислот, имеющих структуру ABCDE, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, D является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, a E имеет те же значения, что и D.
13. Способ по п.1, отличающийся тем, что X1 представляет собой последовательность шести аминокислот, имеющих структуру ABCDEF, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, D является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, E является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, a F имеет те же значения, что и Е.
14. Способ по п.1, отличающийся тем, что, когдаX1 и/или X4 представляют собой более одной аминокислоты, аминокислота, которая непосредственно примыкает к X2, представляет собой Glu или Asp, аминокислота, которая непосредственно примыкает к X3, представляет собой Glu или Asp, или обе являются Glu или Asp.
15. Способ по п.1, отличающийся тем, что, когда X1 и/или X4 представляют собой более одной аминокислоты, то указанная аминокислота является Glu или Asp.
16. Способ по п.1, отличающийся тем, что обе X1 и X4 представляют собой одну или более аминокислот.
17. Способ по п.1, отличающийся тем, что, когда X4 представляет собой одну или более аминокислот, между X4 и N-терминальным концом гетерологичного полипептида предусмотрен дополнительный процессинговый сайт.
18. Способ по п.1, отличающийся тем, что сигнальный пептид является сигнальным пептидома-фактора, сигнальным пептидом амилазы мышиной слюны, сигнальным пептидом карбоксипепти-дазы, или сигнальным пептидом BAR1.
19. Способ по п.1, отличающийся тем, что лидерный пептид является природным лидернымпептидом, таким как лидерный пептид a-фактора.
20. Способ по п.1, отличающийся тем, что лидерный пептид является синтетическим лидерным пептидом, выбранным из группы, состоящей из
Ala-Pro-Val-Thr-Gly-Asp-Glu-Ser-Ser-Val-Glu-lle-
Pro-Glu-Glu-Ser-Leu-lle-Gly-Phe-Leu-Asp-Leu-Ala-Gly-
Glu-Glu-lle-Ala-Glu-Asn-Thr-Thr-Leu-Ala
Ala-Pro-Val-Thr-Gly-Asp-Glu-Ser-Ser-Val-Glu-lle-
Pro-Glu-Glu-Ser-Leu-lle-lle-Ala-Glu-Asn-Thr-Thr-Leu-Ala-
Ala-Pro-Val-Thr-Gly-Asp-Glu-Ser-Ser-Val-Glu-lle
Pro-lle-Ala-Glu-Asn-Thr-Thr-Leu-Ala
Ala-Pro-Val-Thr-Gly-Asp-Glu-Ser-Ser-Val-Glu-lle-
Pro-Glu-Glu-Ser-Leu-lle-lle-Ala-Glu-Asn-Thr-Thr-
Leu-Ala-Asn-Val-Ala-Met-Ala and
Gln-Pro-Val-Thr-Gly-Asp-Glu-Ser-Ser-Val-Glu-lle-
Pro-Glu-Glu-Ser-Leu-lle-lle-Ala-Glu-Asn-Thr-Thr-
Leu-Ala-Asn-Val-Ala-Met-Ala
21. Способ по п.1, отличающийся тем, что гетерологичный полипептид выбран из группы, состоящей из апротинина, инсулина и предшественников инсулина, гормонов роста человека или бычьих, интерлейкина, активатора тканевого плазминогена, глюкагона, фактора VII, фактора VIII, фактора XIII, фактора роста, выделенного из тромбоцитов, ферментов и функциональных аналогов любого из этих полипептидов.
22. Способ по п.21, отличающийся тем, что гетерологичный полипептид является апротининомили его функциональным аналогом.
23. Способ по п.21, отличающийся тем, что X1 является Glu-Arg-Leu-Glu или Lys-Glu-Leu-Glu.
24. Способ по п.22, отличающийся тем, что X4 является Glu-Leu или Glu-Leu-Asp-Leu.
25. Способ по п.21, отличающийся тем, что гетерологичный полипептид является инсулином или предшественником инсулина или его функциональным аналогом.
26. Способ по п.25, отличающийся тем, что X1 является Glu-Arg-Leu-Glu или Lys-Glu-Leu-Glu.
27. Способ по п.25, отличающийся тем, что X4 является Glu.
28. Способ по любому из пп.25-27, отличающийся тем, что гетерологичный поли-пептид являетсяпредшественником инсулина В (1-29)-AlaAlaLys-A(1-29), и где X1 является Lys-Glu-Leu-Glu.
29. Способ по любому из пп.25-27, отличающийся тем, что гетерологичный поли-пептид являетсяпредшественником инсулина В (1-29)-SerAspAs-pAlaLys-A (1-29), и где X1 является Lys-Glu-Leu-Glu.
Текст
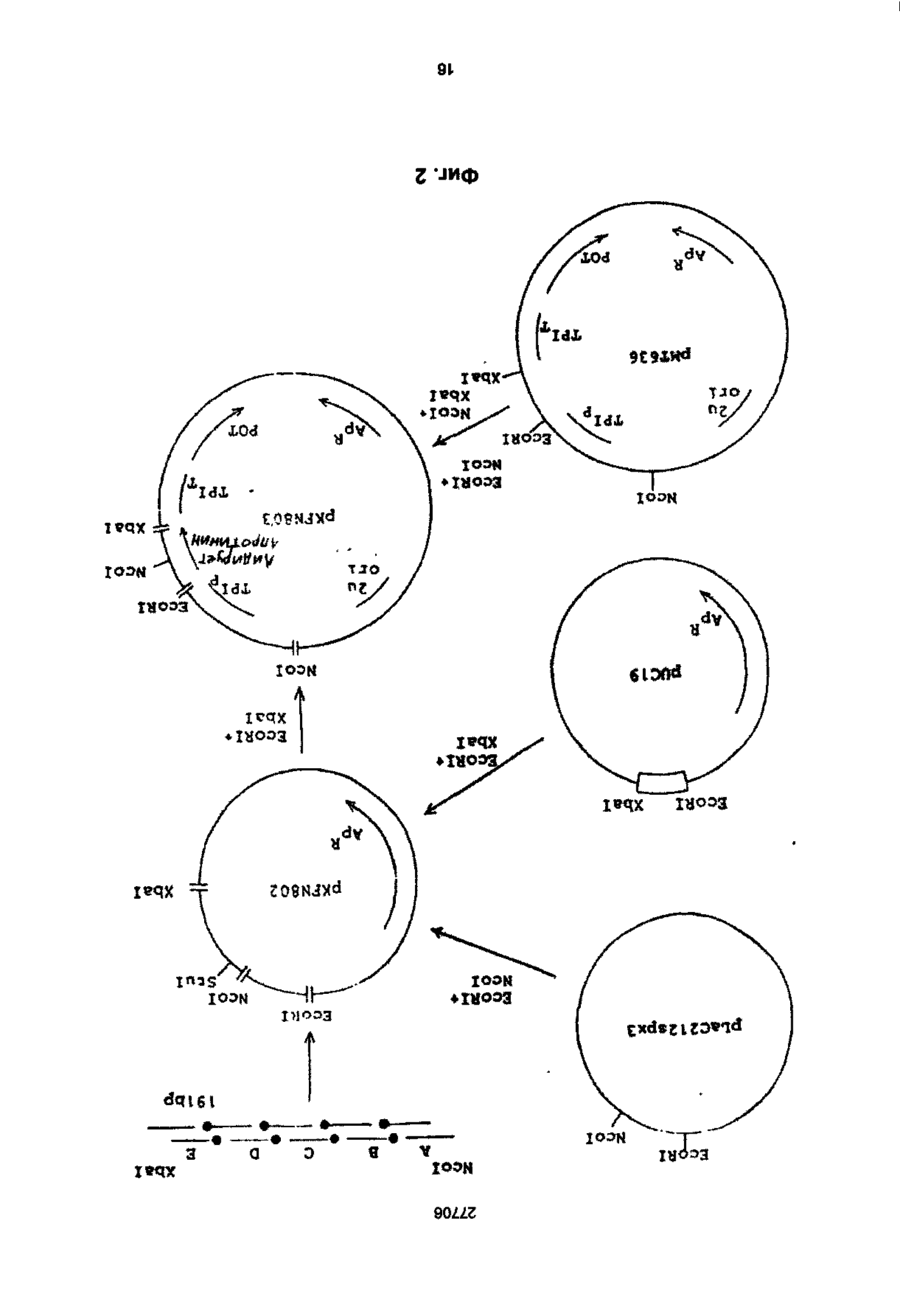
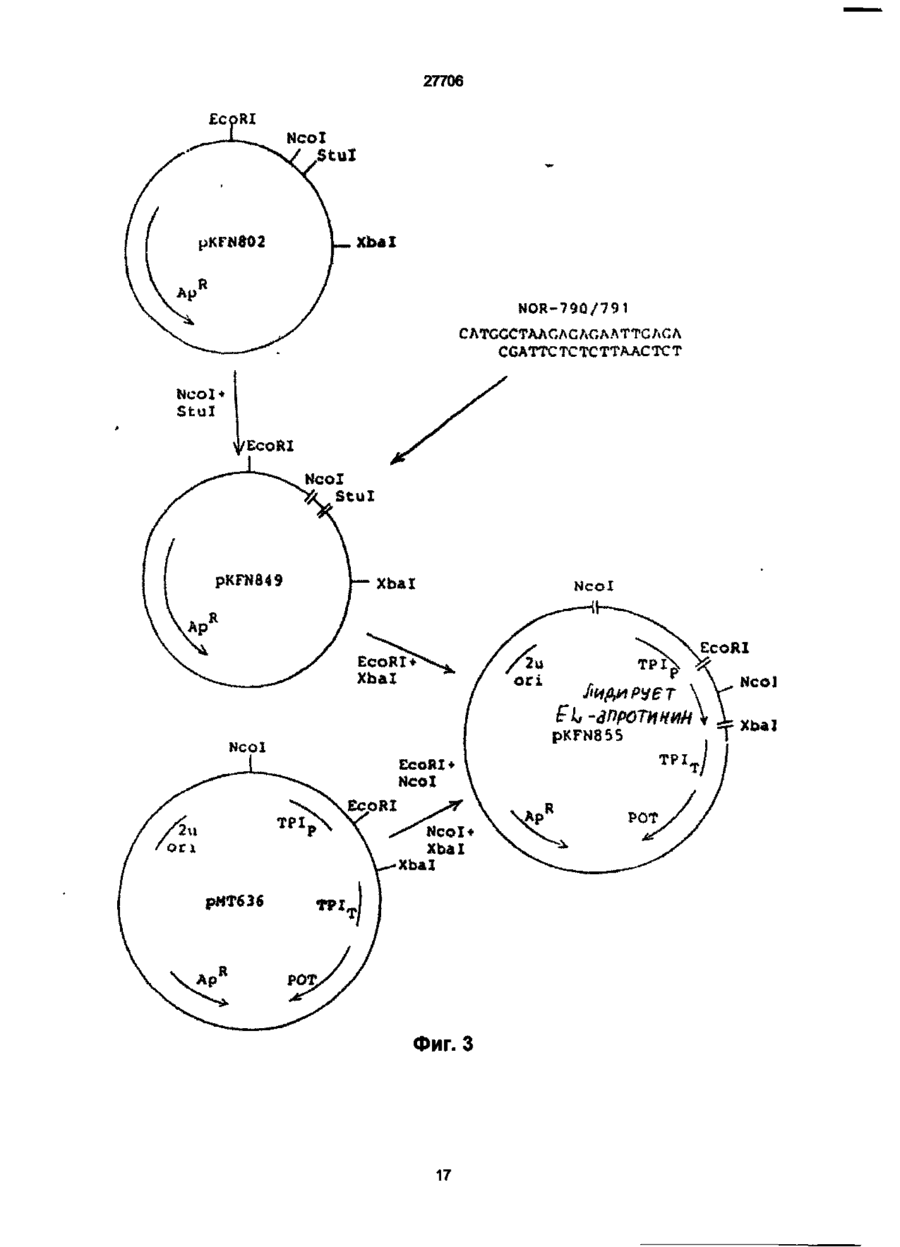
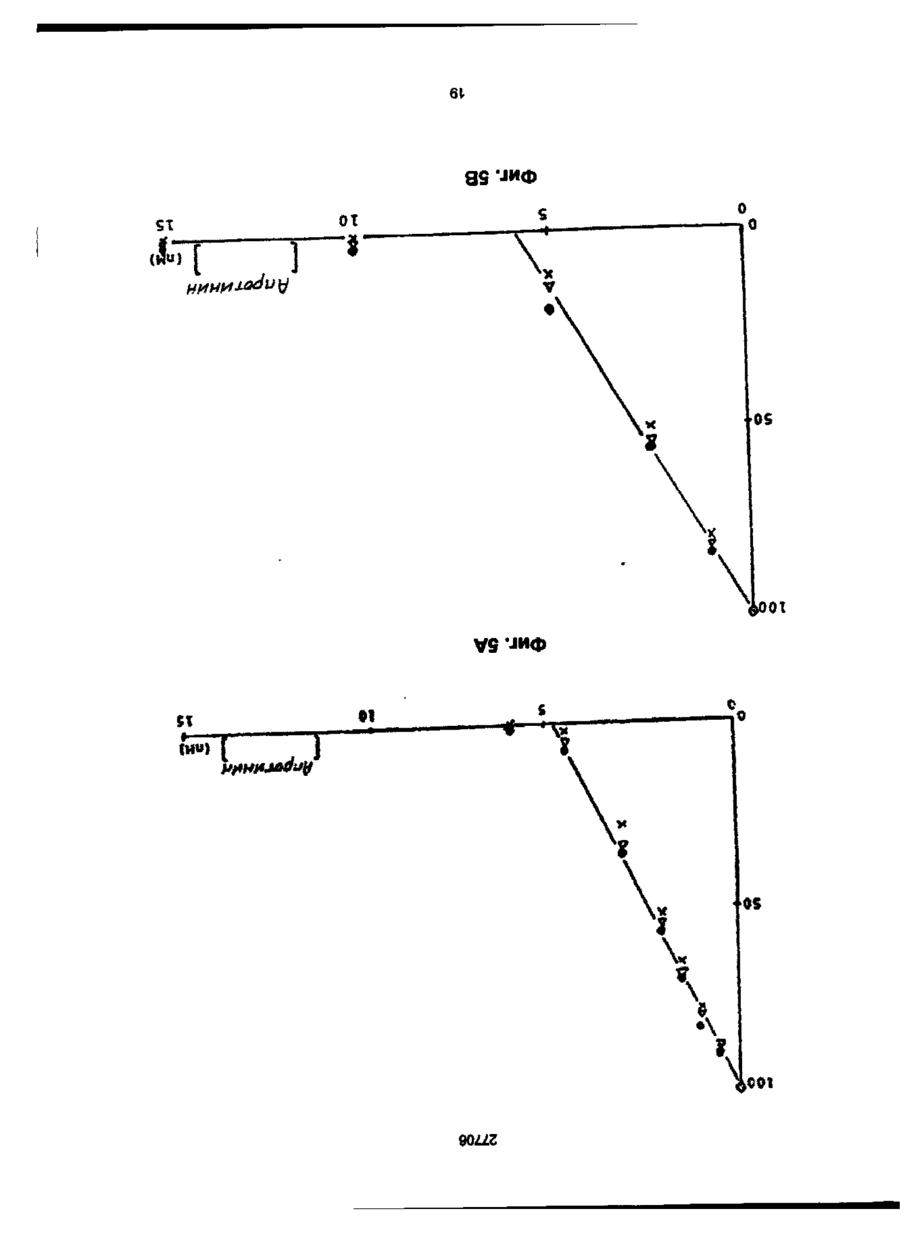
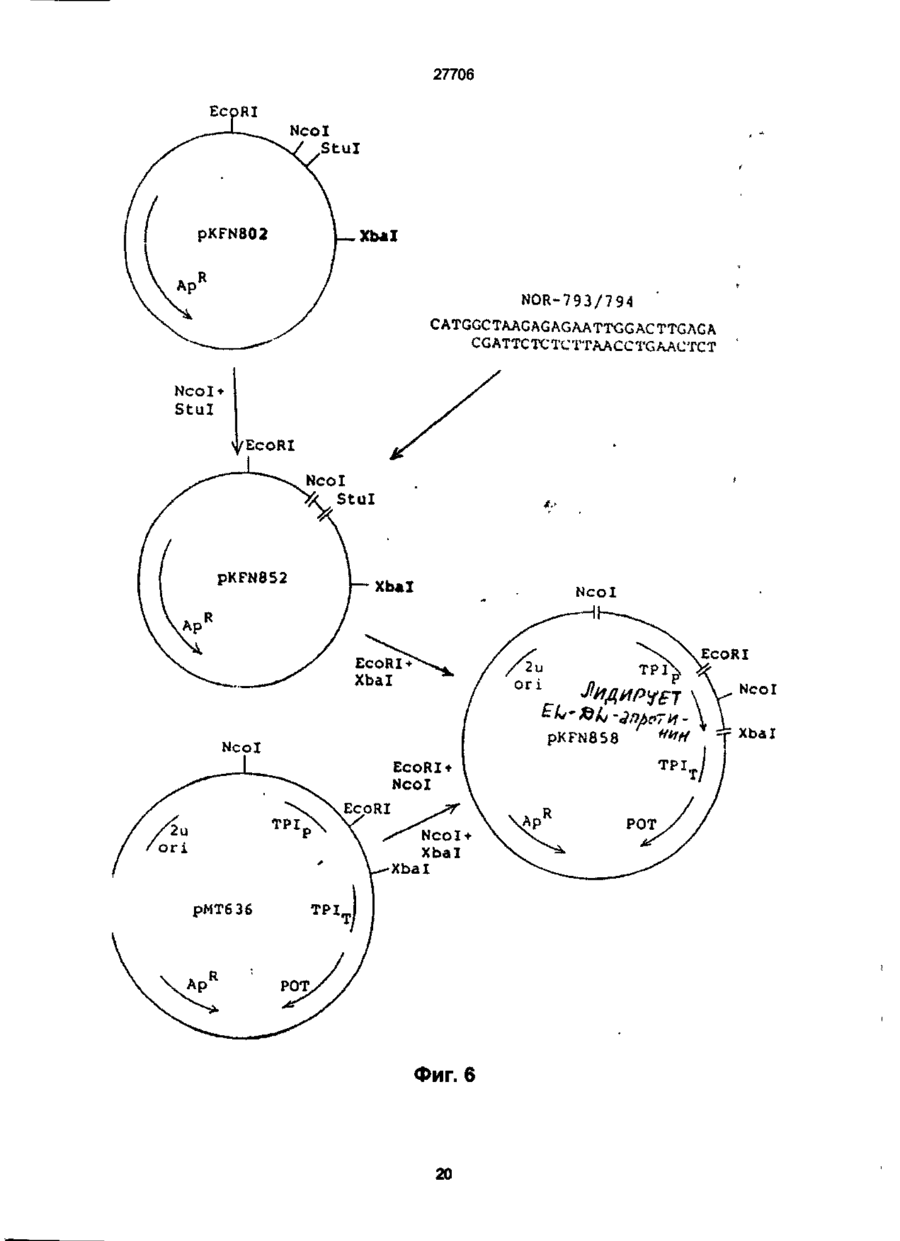
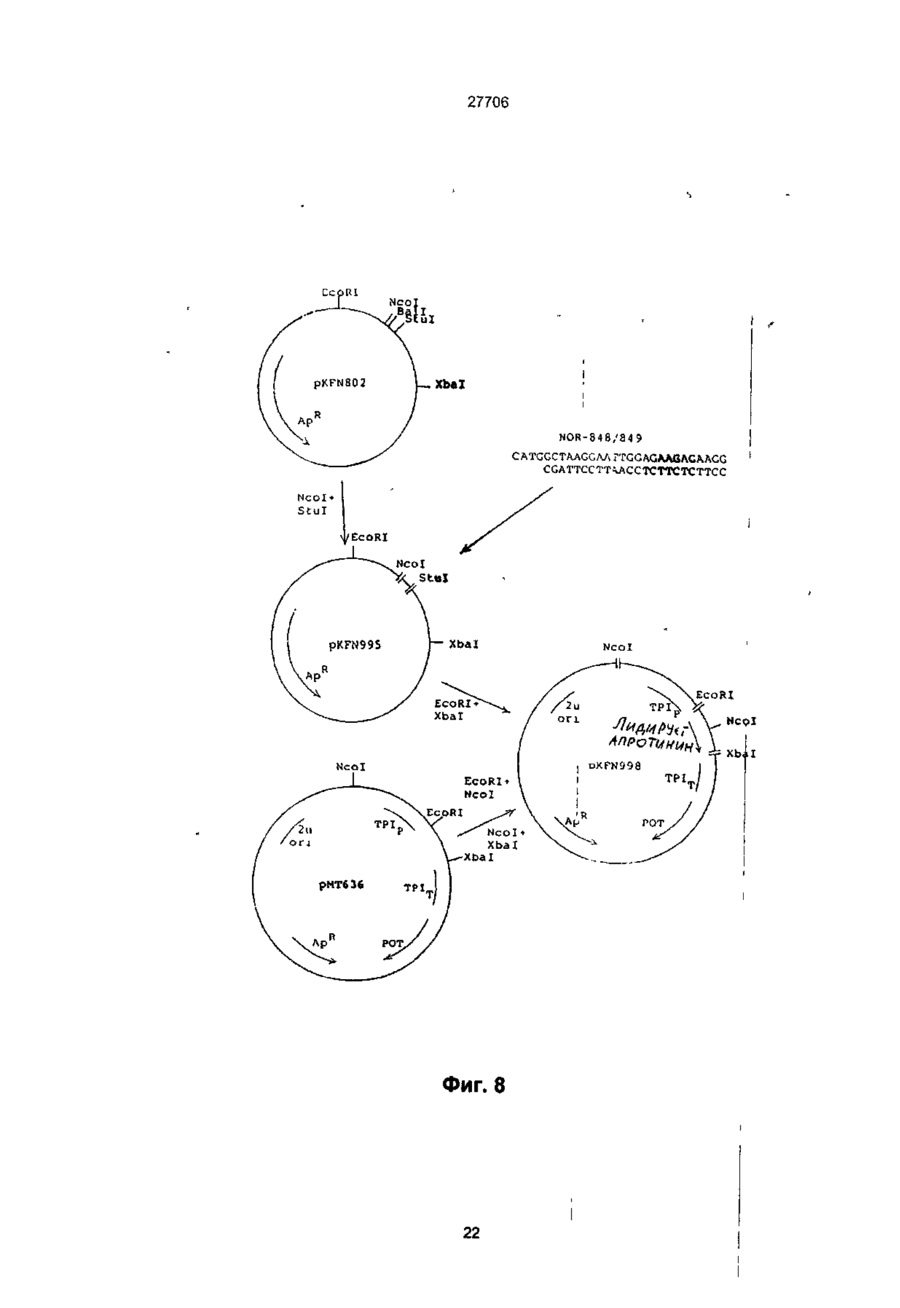
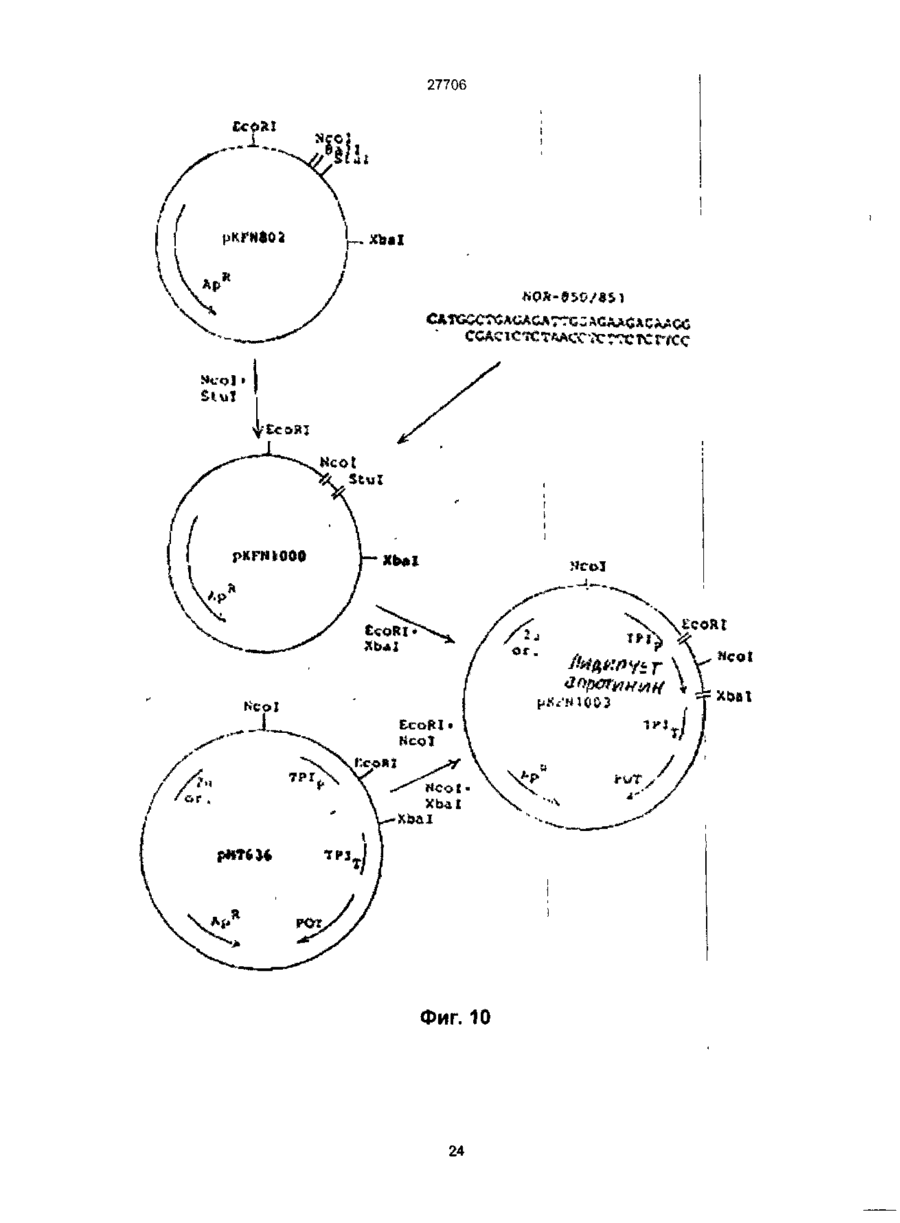
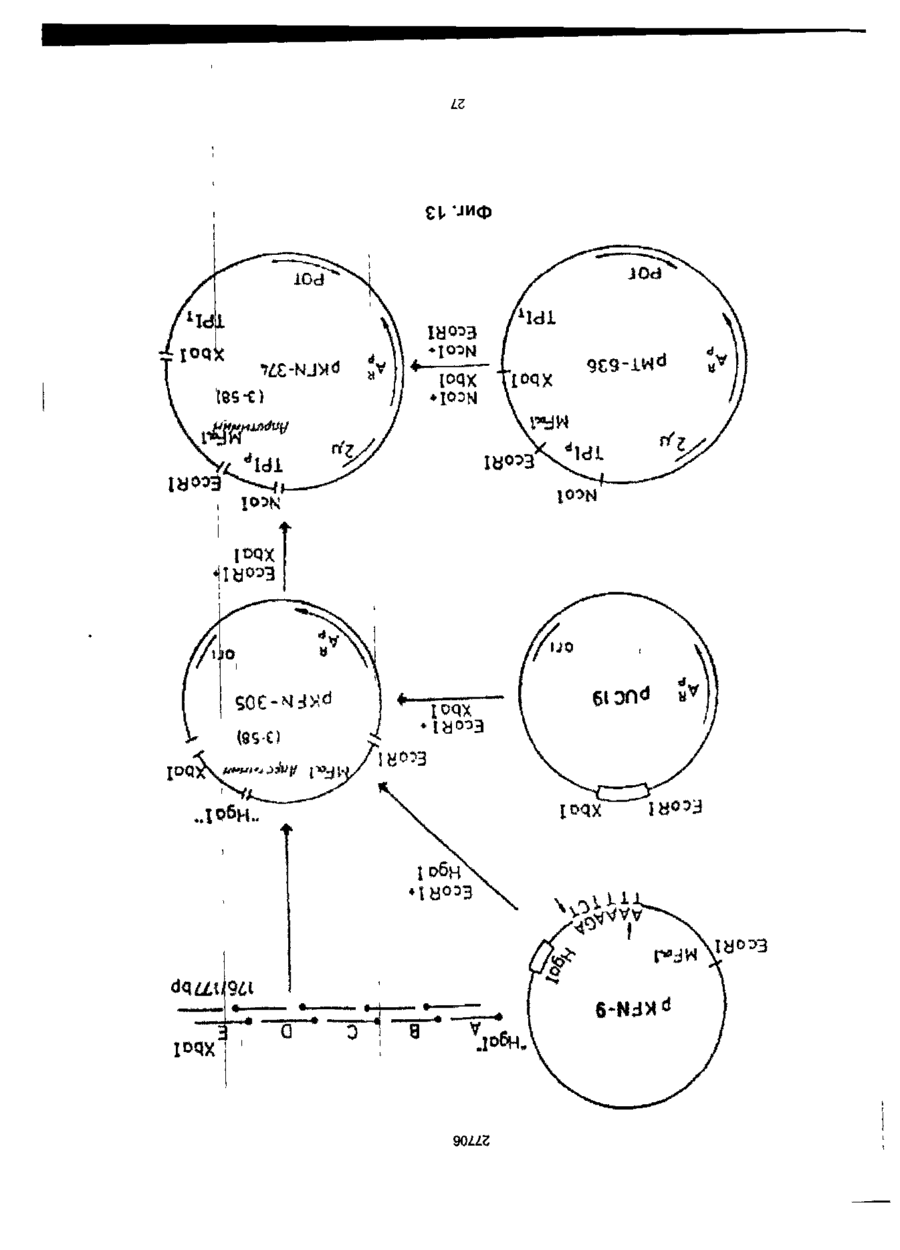
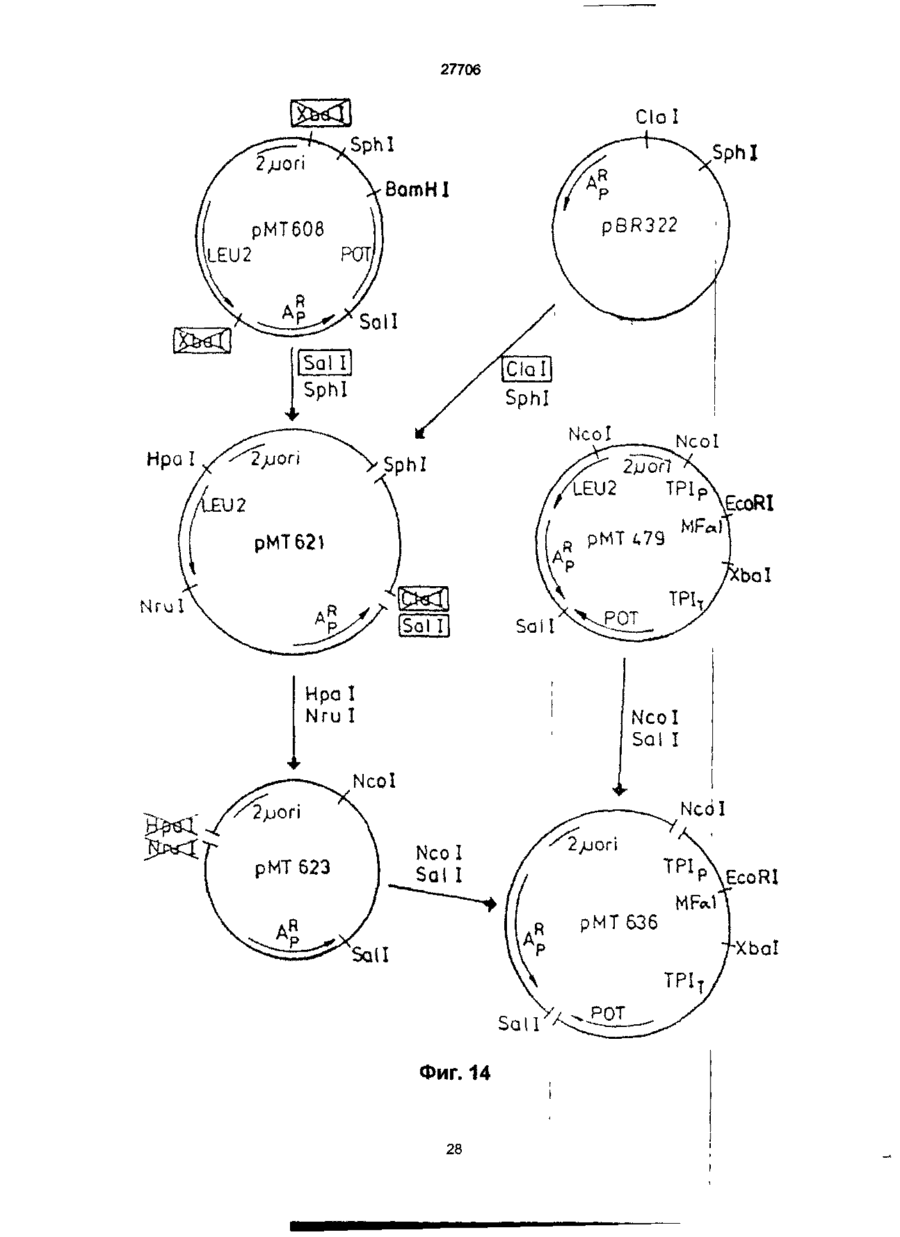
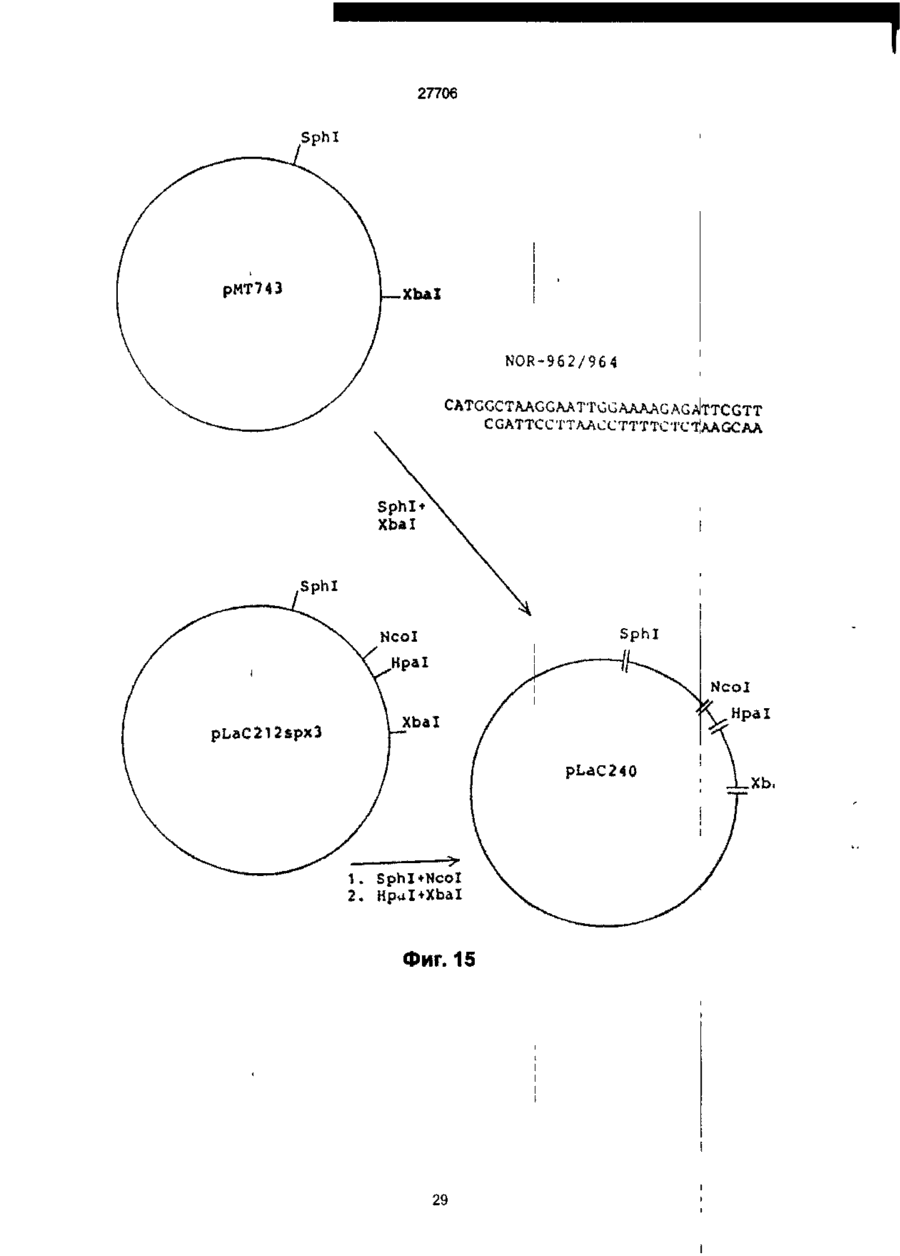
1. Способ получения гетерологичного полипептида в дрожжевой клетке, которая трансформируется рекомбинантным экспрес-сионным вектором, способным реплицироваться в дрожжах и несущим ДНК-конструкцию, кодирующую полипептид, отличающийся тем, что лолилелтид имеет следующую структуру. сигнальный пептид-лидерный пептид-Х1-Х2-Х3-Х4гетерологичный протеин, где X 1 является пептидной связью или представляет собой одну или более аминокислот, которые могут быть одинаковыми или различными, X 2 представляет собой основную аминокислоту, выбранную из Lys и Arg, X 3 представляет собой основную аминокислоту, выбранную из Lys и Arg, X4 является пептидной связью или представляет собой одну или более аминокислот, которые могут быть одинаковыми или различными, при условии, что X1 и/или X4 представляют одну или более аминокислот и, что, по крайней мере, одна из аминокислот, представленных X 1 и/или X 4 , является отрицательно заряженной аминокис-лотой, выбранной из группы, состоящей из Glu или Asp. 2. Способ по п.1, отличающийся тем, что X 1 представляет собой Glu или Asp. 3. Способ по п.1, отличающийся тем, что X 1 представляет собой последовательность двух аминокислот, имеющих структуру ВА, где А является Glu или Asp, а В является Glu, Asp, Val, Gly или Leu 4. Способ по п.1, отличающийся тем, что X 1 представляет собой последовательность трех аминокислот, имеющих структуру СВА, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, а С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys. 5. Способ по п.1, отличающийся тем, что X 1 представляет собой последовательность четырех аминокислот, имеющих структуру DCBA, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, a D имеет те же значения, что и С. 6. Способ по п 1 , отличающийся тем, что X1 представляет собой последовательность пяти аминокислот, имеющих структуру EDCBA, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, D является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, a E имеет те же значения, что и D. 7. Способ по п.1, отличающийся тем, что X 1 представляет собой последовательность шести аминокислот, имеющих структуру FEDCBA, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, D является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, E является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, a F имеет те же значения, что и Е. 8. Способ по п.1, отличающийся тем, что X4 представляет собой Glu или Asp. 9. Способ по п.1, отличающийся тем, что X 4 представляет собой последовательность двух аминокислот, имеющих структуру АВ, где А является Glu или Asp, а В является Glu, Asp, Val, Gly или Leu. 10. Способ по п.1, отличающийся тем, что X4 представляет собой последовательность трех аминокислот, имеющих структуру ABC, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, а С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys. 11. Способ по п.1, отличающийся тем, что X4 представляет собой последовательность четырех аминокислот, имеющих структуру ABCD, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, a D имеет те же значения, что и С. 12. Способ по п.1, отличающийся тем, что X4 представляет собой последовательность пяти аминокислот, имеющих структуру ABCDE, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, D является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, a E имеет те же значения, О СО о < 27706 что и D. 13. Способ по п.1, отличающийся тем, что X 1 представляет собой последовательность шести аминокислот, имеющих структуру ABCDEF, где А является Glu или Asp, В является Glu, Asp, Val, Gly или Leu, С является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, D является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, E является Glu, Asp, Pro, Gly, Val, Leu, Arg или Lys, a F имеет те же значения, что и Е. 14. Способ по п.1, отличающийся тем, что, когда X1 и/или X 4 представляют собой более одной аминокислоты, аминокислота, которая непосредственно примыкает к X2, представляет собой Glu или Asp, аминокислота, которая непосредственно примыкает к X3, представляет собой Glu или Asp, или обе являются Glu или Asp. 15. Способ по п.1, отличающийся тем, что, когда X1 и/или X4 представляют собой более одной аминокислоты, то указанная аминокислота является Glu или Asp. 16. Способ по п.1, отличающийся тем, что обе X1 и X4 представляют собой одну или более аминокислот. 17. Способ по п.1, отличающийся тем, что, когда X4 представляет собой одну или более аминокислот, между X4 и N-терминальным концом гетерологичного полипептида предусмотрен дополнительный процессинговый сайт. 18. Способ по п.1, отличающийся тем, что сигнальный пептид является сигнальным пептидом а-фактора, сигнальным пептидом амилазы мышиной слюны, сигнальным пептидом карбоксипептидазы, или сигнальным пептидом BAR1. 19. Способ по п.1, отличающийся тем, что лидерный пептид является природным лидерным пептидом, таким как лидерный пептид а-фактора. 20. Способ по п.1, отличающийся тем, что лидерный пептид является синтетическим лидерным пептидом, выбранным изгруппы, состоящей из Ala-Pro-Val-Thr-Gly-Asp-Glu-Ser-Ser-Val-Glu-llePro-Glu-Glu-Ser-Leu-lle-Gly-Phe-Leu-Asp-Leu-AlaGly-Glu-Glu-lle-Ala-Glu-Asn-Thr-Thr-Leu-Ala Ala-Pro-Val-Thr-Gly-Asp-Glu-Ser-Ser-Val-Glu-lle Pro-Glu-Glu-Ser-Leu-lle-lle-Ala-Glu-Asn-Thr-ThrLeu-Ala Ala-Pro-Val-Thr-Gly-Asp-Glu-Ser-Ser-Val-Glu-lle Pro-lle-Ala-Glu-Asn-Thr-Thr-Leu-Ala Ala-Pro-Val-Thr-Gly-Asp-Glu-Ser-Ser-Val-Glu-llePro-Glu-Glu-Ser-Leu-lle-lle-Ala-Glu-Asn-Thr-ThrLeu-Ala-Asn-Val-Ala-Met-Ala and Gln-Pro-Val-Thr-Gly-Asp-Glu-Ser-Ser-Val-Glu-llePro-Glu-Glu-Ser-Leu-lle-lle-Ala-Glu-Asn-Thr-ThrLeu-Ala-Asn-Val-Ala-Met-Ala 21. Способ по п.1, отличающийся тем, что гетерологичный полипептид выбран из группы, состоящей из апротинина, инсулина и предшественников инсулина, гормонов роста человека или бычьих, интерлейкина, активатора тканевого плазминогена, глюкагона, фактора VII, фактора VIII, фактора XIII, фактора роста, выделенного из тромбоцитов, ферментов и функциональных аналогов любого из этих полипептидов. 22. Способ по п.21, отличающийся тем, что гетерологичный полипептид является апро-тинином или его функциональным аналогом. 23. Способ по п.21, отличающийся тем, что X1 является Glu-Arg-Leu-Glu или Lys-Glu-Leu-Glu. 24 Способ по п.22, отличающийся тем, что X4 является Glu-Leu или Glu-Leu-Asp-Leu. 25. Способ по п.21, отличающийся тем, что гетерологичный полипептид является инсулином или предшественником инсулина или его функциональным аналогом. 26. Способ по п.25, отличающийся тем, что X1 является Glu-Arg-Leu-Glu или Lys-Glu-Leu-Glu. 27. Способ по п.25, отличающийся тем, что X4 является Glu. 28. Способ по любому из пп.25-27, отличающийся тем, что гетерологичный поли-пептид является предшественником инсулина В (1-29)-AlaAlaLys-A (1-29), и где X1 является Lys-Glu-Leu-Glu. 29. Способ по любому из пп.25-27, отличающийся тем, что гетерологичный поли-пептид является предшественником инсулина В (1-29)-SerAspAs-p AlaLys-A (1-29), и где X1 является Lys-Glu-Leu-Glu. Настоящее изобретение относиться к полипептидам, экпресссированным и процессированным в дрожжах, к векторной ДНК, включающей ДНК последовательность, копирующую такие полипептиды, к векторам несущим такие ДНК фрагменты и к дрожжевым клеткам, трансформируемым векторами, а также к способу продуцирования гетерологических протеинов в дрожжах. Дрожжевые организмы продуцируют ряд протеинов, синтезируемых внутриклеточно, но функционирующих вне клетки. Такие внеклеточные протеины относятся к секретируемым /выделяемым/ протеинам. Эти секретируемые протеины первоначально экспрессируются внутри клетки на предшественнике или пре-протеиновой структуре, содержащей пред-последовательность, определяющей эффективное направление экспрессируемого продукта через мембрану эндо плазматического редикулума /ЭР/. Предпоследовательность, обычно называемая сигнальным пептидом, как правило отщепляется от желаемого продукта в процессе транслокации. Вступив на секреторный путь, протеин транспортируется к аппарату Гольджи. Из аппарата Гольджи протеин может далее следовать различными путями, попадая либо в клеточную вакуоль, либо клеточную мембрану или выйти за пределы клетки, выделившись во внешнюю среду. / Prefer S.R., Rothman J. Ann. Rev.Bioch. 56/1987/. 829-852/. Были предложены некоторые подходы для объяснения экспрессии и секреции в дрожжах протеинов, гетерологических дрожжам. Европейская опубликованная патентная заявка № 008632 А содержит описание способа согласно которому происходит экспрессирование протеинов, гетерологических дрожжам, их процессирование и сек 27706 ретирование путем трансформирования организма дрожжей с экспрессией оболочки, несущей ДНК, кодирующую желаемый протеин и сигнальный пептид, подготовка культуры трансформируемого организма, выращивание культуры и выделение протеина из среды клеточной культуры. Сигнальный пептид может быть как сигнальным пептидом самих желаемых протеинов, гетерологическим сигнальным пептидом или гибридом нативного и гетерологического сигнального пептида. Проблема, которая может неожиданно возникнуть в связи с использованием сигнальных пептидов гетерологических дрожжам, возможно состоит в том, что гетерологический сигнальный пептид не гарантирует эффективной транслокации и/или расщепления после сигнального пептида. MF I/ (а-фактор S.serevisiae синтезируют в пред-проформе из 165 аминокислот, включающих 19 аминокислот длинного сигнального- или предпептида, за которым следует 64 аминокислоты длинного "лидирующего" или пропептида, окруженных тремя И-связанными гликозилированными сайтами, за которым следует /лизарг/асп/глу, ала/ 2-з (а-фактор Ы Kurjah I. Herskowitz.l. Cell 30/1982/, 933-943. Участок сигнал - лидер предпро - MF ! широко использовался для осуществления синтеза и секреции гетерологических протеинов в S.cerevisiae. Использование сигнальных и лидирующих пептидов гомологических дрожжам известно из спецификации патента США № 4, 546, 082. Европейской опубликованной патентной заявке № 0116201А, 0123294А, 0123544А, 0163529А и 0123289А и ДК патентные описания № 2484/84 и 3614/83. В ЕП 0123289А описано использование предшественника а-фактор S.cerevisiae, в то время как в ДК 2484/84 описано использование сигнального пептида инвертазы, а ДК 3615/83 описывает использование сигнального пептида РН05 Saccharomyces cerevisiae для секреции чужеродных протеинов. В спецификации патента США № 4, 564, 082, ЕП 0016201 А, 0123294А, 0123544А и 0163529А описаны способы согласно которым (а-фактор сигнал-лидера из Saccharomyces cerevisiae/ MF I или MF 2/ используется в процессе секреции экспрессированого гетерологического протеина в дрожжах. При включении ДНК последовательности, кодирующей S.cerevisiae MF I сигнал/лидер последовательность у 5 конца гена желаемого протеина было продемонстрировано процессирование и секреция желаемого протеина. В ЕП 206, 783 раскрывается система секреции полипептидов из S.cerevisiae, в которой а-фактор лидирующей последовательности усечен таким образом, чтобы устранить четыре а-факторных пептида, присутствующих в нативной лидирующей последовательности таким образом, чтобы оставить лидирующий пептид слитым с гетерологическим полипептидом через а-фактор процессингового сайта лизаргглуалаглуала. Эта конструкция приводит к эффективному процессированию небольших пептидов /содержащих менее 50 аминокислот/. Для секреции и процессирования больших полипептидов нативный а-фактор усекают так, чтобы оставить один или два а-факторных пептида между лидирующим пептидом и полипептидом. Ряд секретируемых протеинов направляется к протеолитической процессирующей системе, которая может расщеплять пептидную связь у карбоксильного конца двух последовательных основных аминокислот. Эта ферментативная активность присущая S.cerevisiae закодирована КЕХ2 геном /Yulins Д, А и др. Cell 37/1984/1075/. Процессинг продукта геном КЕХ2 необходим для секреции скрещивающего фактора a I / MF I или (афактор/, активным и S.cerevisiae, но не включен в секрецию скрещивающего фактора а, активным S.cerevisiae. Секреция и корректный процессинг полипептида, предназначенного к выделению, достигается в некоторых случаях при культивировании дрожжей нового организма, который трансформируют вектором, сконструированным так, как это сказано в ссылках, приведенных ниже. Во многих случаях, однако, уровень секреции очень низок или секреция вообще не имеет места, или протеолитический процессинг не верен или не известен. Настоящие изобретатели полагают, что это может быть связано в такой-то степени с недостаточной доступностью процессингового сайта, расположенного между С-терминальным концом лидирующего пептида и N-терминальным концом гетерологического протеина, так, что он оказывается бесполезным, или по крайней мере, менее-восприимчивым к протеолитическому расщеплению. Неожиданно было обнаружено, что при осуществлении некоторых модификаций вблизи процессингового сайта в С-терминальном конце лидирующего пептида и/или N-терминального конца гетерологического полипептида, слитого с лидирующим пептидом, возможно получить более высокий выход правильно процессированного протеина, чем в случае с немодифицированными конструкциями, лидирующий пептид - гетерологический полипептид. Итак, настоящее изобретение относится в полипептиду, включающему слияние сигнального пептида, лидирующего пептида и гетерологического протеина или полипептида, полипептида, который модифицирован в его аминокислотной последовательности, примыкающей к процессинговому сайту дрожжевой клетки, расположенному между С-терминальным концом лидирующего пептида и N-терминальным концом гетерологического протеина, таким образом, чтобы обеспечить представление процессингового сайта, в результате которого становиться возможным протеологическое расщепление, к полипептиду, имеющему следующее строение: Сигнальный пептид-лидирующий пептид - X1Хг-Х3-Х4 - гетерологический протеин, в котором X1 - это пептидная связь или X представляет одну или более аминокислот, которые могут быть одинаковыми или различными, X и X3 одинаковы или отличаются друг от друга и представляют основную аминокислоту, выбранную из группы, состоящей из лизина и аргинина, X и X3 вместе определяет процессинговый сайт дрожжевой клетки, и X4 - это пептидная связь или X4 представляет одну или более аминокислот, которые могут быть одинаковы или различны, при условии, что X1 и X4 27706 представляют одну или более аминокислот, и, что, по крайней мере, одна из аминокислот, представленных X1 и/или X4 - это отрицательно заряженная аминокислота, выбранная из группы, состоящей из глутаминовой и аспарагиновой кислот. В настоящем контексте термин "сигнальный пептид" означает предпоследовательность преимущественно гидрофобную по природе и присутствующую в виде N-термальной последовательности на форме предшественника внеклеточного протеина, экспрессированного в дрожжах. Функция сигнального пептида состоит в том, чтобы обеспечить вход секретируемого гетерологического протеина в эндоплазматический ретикулум В течении этого процесса сигнальный пептид обычно отщепляется. Сигнальный пептид может быть гетерологическим или гомологическим по отношению к дрожжевому организму, продуцирующему протеин, но, как объяснялось выше, более эффективно отщепление сигнального пептида происходит в том случае, когда он гомологичен к дрожжевому организму о котором идет речь Под выражением "лидирующий пептид" подразумевается преимущественно гидрофиль-ный пептид, функция которого состоит в том, чтобы обеспечить направление секретируемого гетерологического протеина от эндоплазматического ретикулума к аппарату Гольджи и далее в секреторную везикулу для секреции в среду /т.е. в том, чтобы обеспечить прохождение экспрессированного протеина или полипептида через стенку или, по крайней мере, через клеточную мембрану в околоплазменное пространственное пространство клетки/ Выражение "гетерологический протеин или полипептид" выбрано для обозначения протеина или полипептида, который не продуцируються в природе организмом дрожжевой клетки - хозяина. Термин "протеин" и "полипептид" в последующем описании по существу взаимозаменяемы. Модификация полипептида в процессинговом сайте /сайт-место отделения лидирующего пептида от гетерологического протеина при протеолитическом отщеплении под действием протеолитических ферментов дрожжей/, представлена X1 и/или X4 и может быть осуществлена как за счёт удлинения, замещения или утраты одной или более аминокислот в С-терминальном конце лидирующего пептида, так и/или в N-терминальном конце гетерологического протеина В данном изобретении было обнаружено, что более эффективное и корректное процессирование гетерологического протеина может быть достигнуто в том случае, когда, по крайней мере, одна из аминокислот участвующих в удлинении последовательности полипептида или которой замещают одну или более из нативных аминокислот последовательности - это отрицательно заряженная аминокислота, например, одна из указанных выше. Аналогичный эффект наблюдается, когда отрицательно заряженную аминокислоту располагают в близости процессинговым сайтом за счет того, что одну или более аминокислот убирают от С-терминального кольца лидирующего пептида или от N-терминального конца последовательности протеина до тех пор, пока отрицательно заря женная аминокислота не окажется примыкающей к процессинговому сайту. Не желая ограничиться какой-либо частной теорией, предположили, что этот эффект может быть объяснен возросшей гидрофильностью, вызванной отрицательно заряженными аминокислотами, примыкающими к процессинговому сайту, что приводит к увеличению экспонирования третичной структуры полипептида в процессинговом сайте в водном внутриклеточном окружении и вследствие этого становится более восприимчивой к протеолитическому отщеплению под действием процессингового фермента. Преимущественное влияние отрицательно заряженных аминокислот в отличие от положительно заряженных или нейтральных аминокислот может быть отнесено за счет того, что отрицательно заряженная сторона цепочек этих аминокислот увеличивает гидрофильность третичной структуры в процессинговом сайте, никоим образом не увеличивая потенциал ингибирования процессингового фермента. Возможно также, что отрицательно заряженные аминокислоты содействуют созданию и поддержанию третичной структуры в процессинговом сайте /например, оборотных, петлевых или "шпилечных" структур/ тем или иным способом, например, таким как взаимодействие с другими аминокислотными остатками в полипептиде. Далее, может иметь место также непосредственное взаимодействие отрицательно заряженных аминокислот и процессингового фермента. Таким образом, полагают, что отрицательно заряженные аминокислоты позиционно примыкающие к двум основным аминокислотам процессингового сайта могут направлять процессинговый фермент таким образом, чтобы осуществить корректное и эффективное расщепление при взаимодействиях заряда протеинов и/или протеина и растворителя С другой стороны, настоящее изобретение относится к векторной ДНК, включающей ДНК последовательность, кодирующую полипептид, определенный выше. Кроме того, данное изобретение относится к рекомбинантному вектору экспрессии, способному реплицироваться в дрожжах и несущему векторную ДНК, кодирующую вышеупомянутый полипептид, а также к дрожжевому штампу, способному экспрессировать гетерологический протеин или полипептид и трансформируемому этим вектором. Помимо всего, данное изобретение относиться к способу получения /продуцирования/ гетерологического протеина или полипептида в дрожжах, включающих культивацию трасформированного дрожжевого штамма в подходящей среде для достижения экспрессии и секреции гетерологического протеина или полипептида, с последующим выделением протеина или полипептида из среды. Согласно объяснению, данному выше, в тех случаях когда X1 представляет единственную аминокислоту, то ею является глутаминовая или аспарагиновая кислота. X1 и/или X 4 соответственно представляют 1-6 аминокислот. Если X1 представляет последовательность двух аминокислот, то она может иметь структуру ВА, в которой А - это глу или асл, а В - это глу, асп, вал, гли или лей, например, лейглу. 27706 Если X1 представляет последовательность трех аминокислот, то она может иметь структуру СВА, в которой А и В определены выше, а С - это асп, глу, про, вал, лей или лиз, например, асплейглу. Если X 1 представляет последовательность, состоящую из более чем двух аминокислот, то одна из дополнительных аминокислот может соответственно быть про или гли, поскольку известно, что эти аминокислоты представляют и/или образуют часть витков, "шпилечных" или петлевых структур, возможно облегчающих доступ процессингового сайта к протеолитическому ферменту. Если X1 представляет последовательность четырех аминокислот, то она может иметь структуру ДСВА, в которой А, В и С определены выше, а Д имеет те же значения, что и С, например, X1 это Глу, Apr, Лей Глу или ЛейАспЛейГлу или ЛизГлуЛейГлу. Если X 1 представляет последовательность пяти аминокислот, то она может иметь структуру ЕДСВА, в которой А, В, С и Д определены выше, а Е имеет те же значения, что и С, например, X1 это ЛейГлуАргЛейГлу. Если X представляет последовательность шести аминокислот, то она может иметь структуру ФЕСДВА, в которой А. В, С, Д и Е определены выше, а Ф имеет те же значения, что и С, например, X 1 - это ВалЛейГлуАргЛейГлу. Нужно иметь ввиду, что возможны и другие последовательности аминокислот, определяющих X1, в рамках данного изобретения, при условии, что по крайней мере, одна из аминокислот в последовательности - это отрицательно заряженная аминокислота, как это объяснялось выше. Соответствующие значения X4 могут быть теми же, что и значения, приведенные выше для X1, хотя порядок аминокислот в последовательности будет, как правило, обратным / т.е. вместо ABC СВА и т.д./. В тех вариантах полипептида настоящего изобретения, в которых гетерологический протеин инициирован или более положительно заряженными аминокислотами или гидрофобными аминокислотами, X 4 преимущественно представляет одну или более аминокислот, а не пептидную связь, так как полагают, что в этом случае достигается большая доступность процессингового сайта для протеолитических ферментов. В тех случаях, когда X4 представляет Nтерминальное удлинение из 1-6 аминокислот, он может соответственно обеспечить дополнительный процессинговый сайт между аминокислотой или кислотами, представленными X4 и Nтерминальным концом гетерологического протеина. Это, в частности, важно тогда, когда протеин должен использоваться для целей, в которых необходимо присутствие протеина, не имеющего Nтерминального удлинения / удлиняющего сегмента /. Дополнительные N-терминальные аминокислоты могут быть удалены при протеолитическом отщеплении в присутствии соответствующего протеолитического фермента, например, припсин подобной протеазы, или путем химической обработки, например, бромистым цианом. Возможно также осуществление отщепления у дополнительного процессингового сайта организма дрожжевой клетки хозяина за счет выбора процессингового сайта специфичного для другого протеолитического фермента дрожжей. В некоторых случаях, однако, возможно лучше сформировать N-терминальный удлиненный сегмент для решения специфической задачи. Так, удлинение может служить маркером, определяющимпротеин, может способствовать очистке протеина или может служить средством позволяющим осуществлять контроль за содействием in vivo фармацевтического препарата, например, пролонгировать полупериод осуществления лекарства в организме или направлять лекарственное вещество в конкретное место в теле. В предпочтительном варианте полипептида настоящего изобретения X1 и/или X4 представляют аминокислотную последователь-ность из 1-4 аминокислот. В таком варианте аминокислота, непосредственно примыкающая к X2, это предпочтительно глутаминовая или аспарагиновая кислота, аминокислота непосредственно примыкающая к X 3 - это предпочтительно глу или асп, или обе вместе, так как, в этом случае, обеспечивается предпочтительное представление процессингового сайта, обусловленное гидрофильной природой этих аминокислот, как уже детально объяснялось выше. Аминокислотная последовательность, представленная X 1 и X4 может соответственно включать более одной Глу или Асп. В другом, представляющем интерес, варианте полипептида настоящего изобретения X1 и X 4 обе представляют одну или более аминокислот, другими словами, полипептид модифицирован как у С-терминального конца лидирующего пептида, так и у N-терминального конца гетерологического протеина. В этом варианте X1 и X4 могут быть симметрично идентичны, это значит, что аминокислота или кислоты, представленные X1 и X4 одинаковы и удлиняются в направлении от X 2 и X3, соответственно. Последовательность сигнального пептида полипептида настоящего изобретения может быть любым сигнальным пептидом, который обеспечивает эффективное направление экспрессированного полипептида в секреторный канал /путь/ клетки. Сигнальный пептид может представлять сигнальный пептид естественного происхождения или не быть его частью, или он может быть синтетическим пептидом. Обнаружено, что соответствующие сигнальные пептиды представляют афактор сигнального пептида, например, сигнальный пептидамилазы слюны мыши, модифицированный сигнальный пептид карбоксипептидазы или сигнальный пептид дрожжей ВАРІ. Сигнальная последовательность амилазы слюны мыши описана в работе О. Hagenbl спіеи др. Nature 289, 1981, 643-646. Сигнальная последовательность карбоксипептидазы описана в работе LF.Valls и др. Cell 48, 1987, стр. 887-897. Сигнальный пептид ВАРІ раскрыт в WO 87/02670. Лидирующим пептидом полипептида настоящего изобретения может быть любой лидирующий пептид, функцией которого является направление экспрессированного полипептида в эндоплазматический ретикулум и далее ао секреторному пути. Возможные лидирующие последовательности, которые подходят для этой цели, это природные 27706 лидирующие пептиды, выделяемые из дрожжей или других организмов, например, лидер афактора или его функционального аналога. Лидирующий пептид может быть также синтетическим лидирующим пептидом, например, один из синтеA. B. C. D. E. тических лидирующих пептидов раскрыт в Международной Патентной Заявке, Публикация № WO 89/02463. Ниже приведены аминокислотные последовательности. Ala-Pro-Val-Thr-Gly-Asp-Glu-Ser-Ser-Val-Glu-lle-Pro-G)u-Glu-Ser-Leu-Iie-Gly-Phe-Leu-AspLeu-Aia-Gly-Glu-Glu-lle-Ala-Glu-Asn-Thr-Thr-Leu-Ala Aia-Pro-Va)-Thr-Giy-Asp-Glu-Ser-Ser-Val-Glu-lle-Pro-Glu-Glu-Ser-Leu-))e-)le-A!a-Glu-Asn-ThrThr-Leu-Ala Ala-Pro-Val-Thr-G!y-Asp-G)u-Ser-Ser-Vai-Gtu-He-Pro-lle-Ala-Glu-Asn-Thr-Thr-Leu-Ala Ala-Pro-Val-Thr-GIy-Asp-Glu-Ser-Ser-Val-Glu-lle-Pro-Glu-Glu-Ser-Leu-lie-lle-Ala-Glu-Asn-ThrThr-Leu-Ala-Asn-Val-Ala-Met-Alaand Gin-Pro-Val-Thr-Gly-Asp-Glu-Ser-Ser-Val-G!u-He-Pr o-Glu-Glu-Ser-Leu-iie-lie-Al a-Glu-AsnThr-Thr-Leu-Ala-Asn-Val-Ala-Met-Ala и производные на их основе Гетерологический протеин, продуцированный по методу настоящего изобретения, может быть любви протеином, преимущественно продуцируемым в дрожжах. Примерами таких протеинов являются апротинин или любые другие ингибиторы протеазы, инсулин /включая предшественники инсулина/, гормоны человека или бычьи, интерлейкин, глюкагон, плазминогенный активатор ткани, фактор УП, фактор Y1II, фактор YII1, фактор роста из тромбоцитов, ферменты и т.д. или их функциональные аналоги. В настоящем контексте термин "функциональный аналог" означает полипептид с такой же функцией, как у нативного протеина /под функцией следует понимать природу действия, а не уровень биологической активности нативного протеина/. Такой полипептид может иметь такой же аминокислотный состав, что и у нативного протеина, а может быть получен из нативного протеина путем добавления одной или более аминокислот как к одному концу, так и к обоим к С-терминальному и N-терминальному концам нативного протеина, замещением одной или более аминокислоты в одном или ряде различных мест /сайтов/ в нативной аминокислотной последовательности, путем делеции /вычитания, утраты/ одной или более аминокислоты с одного или обоих концов нативного протеина или из одного или различных сайтов в аминокислотной последовательности, или путем включения в один или более сайтов в нативной аминокислотной последовательности одной или аминокислот. Также модификации хорошо известны для различных протеинов, которые были упомянуты выше. В соответствии с настоящим изобретением было установлено, что модификации у Стерминального конца лидирующего пептида или у N-терминального конца гетерологического протеина согласно вышеприведенным описаниям позволяют получить с высокими выходами корректно процессированный апротинин /или его функциональный аналог, в соответствии с вышеприведенным определением/. Апротинин - это протеин, ингибирующий протеазу, свойства которого дают возможность использовать его при лечении ряда заболеваний /например, при лечении панкреатитов, синдрома септического шока: гиперфибринолитического кровотечения и инфарктов миокарда/. Введение апротинина в больших дозах резко снижает потери крови при операциях на сердце или других крупных операциях Апротинин также полезен в качестве добавки, вводимой в культурную среду, поскольку он ингибирует протеазы клеток-хозяев, которые в свою очередь могут вызывать нежелательное отщепление экспрессированных протеинов. При использовании в качестве лидирующего пептида при синтезе в дрожжах корректно лроцессированного протинина имелись трудности, связанные с получением высокого выхода продукта, известных природных лидирующих последовательностей, например, (а-факторного лидера. Нативный апротинин зарождается у N-терминала основной аминокислотой - аргинином /арг/, и, в связи с этим, предшествующий процессинговый сайт может быть менее доступен /подвержен/ для протеолитического расщепления /как объяснено выше/, когда один из известных лидирующих пептидов /например, (а-факторный лидер/ используют без того, чтобы модифицировать согласно настоящему изобретению, что приводит к низким выходам корректно процессированного апротинина. Согласно настоящему изобретению, особенно хорошие результаты при продуцировании апротинина достигаются тогда, когда X 1 представляет Глулей или Глулейасплей /см. нижеследующие примеры/, хотя можно ожидать приличных выходов апротинина и при других значениях X1 и X4, при условии, что, по крайней мере, одна аминокислота, а наиболее предпочтительный вариант, когда ближайшая к процессинговому сайту аминокислота является отрицательно заряженной аминокислотой, как объяснено выше. Также в настоящем изобретении установлено, что модификации у С-терминального конца лидирующего пептида или у N-терминального конца гетерологического протеина в соответствии с вышеприведенным описанием позволяет получать с высоким выходом корректно процессированный предшественник инсулина /или функциональный аналог на его основе/ В этом варианте осуществления изобретения, если X1 представляет Глу-арг-лей-глу или лиз-глу-лейглу, то X4 представляет пептидную связь альтернативно, когда X4 представляет т у , то X 1 обычно представляет пептидную связь. В частности, полезные результаты были получены согласно настоящему изобретению при экспрессии предшественника аналога инсулина В/1-29/ алаала-лизА/1-29/, когда X1 представляет лизглулейглу, или. 27706 когда X 4 представляет предшественник инсулина, в котором первая аминокислотафенилаланин /фен/ замешана на глутаминовую кислоту /глу/ /см. следующие далее примеры/. Вполне приличные выходы предшественника аналога инсулина В/1-29/ сераспаспалализ-А/129/ были получены, когда X представлял лизглу-лей-глу. Кроме того, ожидают, что высокие выходы предшественника инсулина могут быть получены и при других значениях X 1 и X4 при условии, что, по крайней мере, одна аминокислота, а наиболее предпочтителен вариант, когда ближайшая к процессинговому сайту аминокислота является отрицательно заряженной аминокислотой. Векторная кислота настоящего изобретения, кодирующая полипептид настоящего изобретения, может быть получена синтетическим путем с использованием традиционных методов синтеза, например, фосфоамицитного метода, описанного в работе S.b.Beaucage и m Careters Tetrahedron Lett 22, 1981, стр. 1859-1869 или согласно методу, описанному Matthes и др., EMBO Journal 3, 1984, стр.801-805. Согласно фосфоамицитному способу, синтезируют олигонуклеотиды, например, в автоматическом ДНК синтезаторе, очищают, удваивают и лигируют, получая синтетическую векторную ДНК. Векторная ДНК настоящего изобретения может быть также геномного или кДНК происхождения, например, получена при создании банка /библиотеки/ геномных или кольцевых ДНК и скрининга последовательностей ДНК, кодирующих весь или часть полипептида данного изобретения, путем гибридизации с использованием проб синтетического олигонуклеотида в соответствии со стандартной техникой /см. Т. Maniatis и др., Moleculas cloning, A Leboratory Manual, Cold Spring Наг, 1982/. В этом случае последовательность геномной или кДНК, кодирующая сигнальный лидирующий пептид может быть соединена с последовательностью геномной или кДНК, кодирующей гетерологический протеин, после чего ДНК-последовательность может быть модифицирована у сайта, соответствующего аминокислотной последовательности Х1-Х2~Х -X4 полипептида, например, сайт направленного мутагенеза, используемого синтетические олигонуклеотиды, кодирующие нужную аминокислотную последовательность при гомологической рекомбитнации в соответствии с хорошо известными способами. И, наконец, векторная ДНК может представлять смесь синтетической и геномной, смесь синтетической и кДНК или смесь геномной и кДНК, полученной при ренатурации фрагментов синтетической, геномной или кДНК, фрагментов, соответствующих различным частям полной векторной ДНК в соответствии со стандартными методами. Следовательно, можно представить, что ДНК последовательность, кодирующая гетерологический протеин может быть геномного происхождения, в то время как последовательность, кодирующая лидирующий пептид, может быть получена синтетическим путем. Предпочтительными векторными ДНК, кодирующими протеин, являются ДНК, представлен ные на фиг. 4, 7, 9,11 и 12, или соответствующие из модификации, кодирующие апротинин или его функциональные аналоги. Примерами подходящих модификаций ДНК служат нуклеотидные замены, которые не дают возможности возникнуть другой аминокислотной последовательности протеина, но которые могут соответствовать использованию кодона организма дрожжей, в которой проведена вставка векторной ДНК или нуклеотидных замен, которые могут привести к возникновению отличной аминокислотной последовательности и, следовательно, возможно, к отличной структуре протеина, однако, без ослабления антипротеазных свойств нативного протеина. Другими примерами возможных модификаций являются вставка одного или более нуклеотидов в последовательность, дополнение одного или более нуклеотидов у одного и другого конца последовательности и делеция одного или более нуклеотидов у концов последовательности или внутри последовательности. Примерами конкретных аналогов апротинина являются те, что приведены в Европейской патентной заявке, публикация № 339942. Предпочтительные векторные ДНК, кодирующие предшественников инсулина, приведены на фигурах 16 и 17. здесь же даны соответствующие им модификации. Рекомбинантный вектор экспрессии, несущий ДНК последовательность, кодирующую полипептид настоящего изобретения, может представлять любой вектор, который способен реплицироваться в организмах дрожжей. В векторе ДНК последовательность, кодирующая полипептид настоящего изобретения, должна быть связана с подходящим промотором /стимулятором/ последовательности. Стимулятор может быть любой последовательностью ДНК, проявляющей транскрипционную активность в дрожжах и может быть выделен из генов, кодирующих протеины, как гомологических, так и гетерологических дрожжам. Предпочтительно выделение стимулятора из гена, кодирующего протеин, гомологический дрожжам. Примерами соответствующих стимуляторов служат Ml, TPI, АДН или РСК стимуляторы Saccharomyces cerevisiae. ДНК последовательность настоящего изобретения, кодирующая полипептид настоящего изобретения, должна быть также оперативно связана с соответствующим терминатором, например, TPI терминатором /см. Т. Alber Kawasaki, J. Moll. Appl. Genet I, 1982, стр. 419-434/. Рекомбинантный вектор экспрессии данного изобретения кроме того включает ДНК последовательность, дающую возможность вектору реплицировать в дрожжах. Примеры таких последовательностей - это дрожжевая плазмида 2, репликация генов PEP 1-3 и источник репликации. Вектор может также включать селективный маркер, например, TPI ген, Schizosaccaromyces pombe, как это описано P.R.Russel Gene 40, 1985, стр. 125-150. Процедуры, используемые для лигирования / сшивания / ДНК последовательностей, кодирующих полипептид данного изобретения, стимулятора и терминатора, соответственно, и для того, чтобы осуществить их вставки в подходящие 27706 дрожжевые векторы, содержащие информацию, необходимую для репликации дрожжей, хорошо известны специалистам в данной области /см., например, Mamaris и др./ Следует понять, что вектор может быть сконструирован либо путем получения вначале векторной ДНК, содержащей полную ДНК последовательность, кодирующую полипептид настоящего изобретения и последующей вставкой этого фрагмента в соответствующий экспрессионный вектор, либо путем последовательной вставки ДНК фрагментов, содержащих генетическую информацию для индивидуальных элементов /таких как сигнальный, лидирующий или гетерологический протеин/ с последующим их лигированием. Дрожжевой организм, использованный в процессе данного изобретение, может быть любым подходящим дрожжевым организмом, который, при культивировании, продуцирует большие количества гетерологического протеина или полипептида. Примерами подходящих дрожжевых организмов могут служить штаммы дрожжей вида Saccaromyces cerevisia, Saccharomyces Kluyveri, Schizosaccharomyces pombe или Saccharomyces uvarum. Трансформация дрожжевых клеток может быть осуществлена, например, при формировании протопласта /см. Пример 1 ниже/, с последующей трансформацией per se. Среда, используемая для культивации клеток это любая традиционная среда, подходящая для выращивания организма. Секретированный гетерологический протеин, значительная часть которого может присутствовать в среде в корректно процессированной форме, может быть выделен из среды стандартными методами, включая центрифугирование и фильтрацию для отделения дрожжевых клеток от среды, осаждение протеинообразных компонентов из супернатантного слоя или фильтрата добавлением соли, например, сульфата аммония, последущую очистку с использованием различных хроматографических методов, например, ионно-обменной хроматографии, афинной хроматографии и тому подобных методов. Кроме вышеперечисленного, данное изобретение относится также к новому аналогу апротинина общей формулы Х4-апротинин /1-58/, в которой X4 представляет N-терминальное удлинение одной или более аминокислотами, по крайней мере, одна из которых - это отрицательно заряженная аминокислота, выбранная из группы, состоящей из глутаминовой /ту/ и аспарагиновой /асп/ кислот. X 4 может представлять последовательность из 1-6 аминокислот, в частности, 1-4 аминокислот, и может иметь значения, приведенные выше. Особенно предпочтительные значения X 4 - это глу-лей и глу-лей-асп-лей. Краткое описание рисунков. Далее изобретение раскрывается в следующих примерах и прилагаемых рисунках: Фиг.1. Представлена ДНК и аминокислотная последовательность апротинина /1-58/. Зигзагообразные линии, изображенные на ДНКпоследовательности, означают сайты, у которых осуществлялось сшивание /лигирование/ дуплексов, образованных из синтетических олигонуклеотидов. Фиг.2. Представлена схема конструирования плазмида pKFN-802 и pKFN-803. Фиг.З. Представлена схема конструирования плазмида pKFN-849 и pKFN-856. Фиг.4. Представлена ДНК последовательность фрагмента bp EcoRI - xbal из pKFN-849 и pKFN-856. Стрелка отмечает сайт, у которого происходит протеолитическое отщепление во время секреции. Фиг.5А и 5В. Представлены зависимости ингибирования трипсина и плазмина, соответственно, апротинином, " - бычий апротинин из поджелудочной железы, X - глулей-протенин, Д глулейасплей-апротинин. Фиг.6. Представлено конструирование плазмид pKFN-852 и pKFN-858. Фиг.7. Представлена ДНК последовательность фрагмента 412 ЬрЕсо Rl-Xbal из pKFN-852 и pKFN-858. Стрелка отмечает сайт, у которого происходит протеолитическое отщепление во время секреции. Фиг 8. Представлено конструирование плазмид pKFN-995 и pKFN-998. Фиг.9. Представлена ДНК последовательность фрагмента 412 bp ЕсоР! - X al из pKFN-995 и pKFN-998. Стрелка отмечает сайт протеолитического отщепления во время секреции. Фиг. 10. Представлено конструирование плазмид pKFN-1000 и pKFN-1003. Фиг.11. Представлена ДНК последовательность фрагмента 412 ЬрЕсо RI - X bal из pKFN1000 и pKFN-ЮОЗ. Стрелка отмечает сайт, у которого происходит протеолитическое отщепление во время секреции. Фиг. 12. Представлена ДНК последовательность гена синтетического апротинина /3-53/. Зигзагообразные линии внутри последовательности указывают сайты, у которых лигируются пять дуплексов, сформированных IO синтезированными олигонуклеотидами. Фиг. 13. Представлено конструирование плазмид pKFN-305 и pKFN-374/375. Фиг. 14. Представлено конструирование плазмиды рМТ-363. Фиг. 15. Представлено конструирование плазмиды piaC-240. Фиг. 16 Представлена ДНК последовательность гена модифицированного предшественника лидер-инсулина из pLaC-240. Фиг. 17. Представлена ДНК последовательность фрагмента 508 р EcoPI-X al из pKFN-458, кодирующая MF 1-сигнал-лидер /I - 85/ и предшественник аналога инсулина В/1-29, Іглу+27 Глу IАлаАлаЛ из- А/1 -21 /. Примеры. Пример 1. Продуцирование Глу-лей-апротинин /1-53/ из дрожжевого штамма KFN-837/ а/ Конструирование плазмиды pKFN-802. Лигированием /сшиванием/ 10 олигонуклеотидов сконструировали синтетический ген, кодирующий апротинин /1-58/ Олигонуклеотиды синтезировали в автоматическом ДНК синтезаторе на стеклянной пористой подложке с применением фосфоамидитной химии /Beaucage S.L. Caruthers, MH.Tetrahedrem 27706 Letters 22/1981/1859-1869/. Были синтезированы следующие Ю олигонуклеотидов. NOR-760: CATGGCCAAAAGAAGGCCTGATTTCTGTTTGGAACCTCCATACACTGGTCC NCR-754:TTACATGGACCAGTGTATGGAGGTTCCAAACAGAAATCAGGCCTTCTTTTGGC NCR-354:ATGTAAAGCTAGAATCATCAGATACTTCTACAAGG NCR-355:CTTGGCGTTGTAGAAGTATCTGATGATTCTAGCT NCR-356:CCAAGGCTGGTTTGTGTCAAACTTTCGTTTACGGTGGCT NCR-357:TCTGCAGCCACCGTAAACGAAAGTTTGACACAAACCAGC NCR-358: GCAGAGCTAAGAGAAACAACTTCAAGT NCR-359: AGCAGACTTGAAGTTGTTTCTCTTAG NCR-360.CTGCTGAAGACTGCATGAGAACTTGTGGTGGTGCCTAAT NCR-361: CTAGATTAGGCACCACCACAAGTTCTCATGCAGTCTTC 5 дуплексов были сформированы из 10 вышеприведенных олигонуклеотидов в соответствии с рис.1. 20 пикомолей каждого дуплекса А-Е были сформированы из соответствующих пар 5 1 фосфорилированных олигонуклеотидов при нагревании в течение 5 минут при 90°С, с последующим охлаждением до комнатной температуры в течение 75 минут, 5 дуплексов смешали и обработали Ї4 ДНК лигазой. Синтезированный ген изолировали после электрофореза сшитой смеси на геле 2% агарозы /окрашенная полоса 191 Ьр/. Полученный синтезированный ген представлен на рис.1. Синтезированный ген сшили с фрагментом 209 bp EcoPI - Ncel из р LaC212 spx3 и с 2,7 кв EcoPi - Xbal фрагментом плазмиды рИ с19 /Yahish, Perren C.Virira, I., Messing I., Ycne 33/1985/ 103-119/. Плазмид рфС212 S рхЗ описан в примере 3 международной патентной заявки, публикации№ WO/89/02483. Фрагмент 209 bp EcoPI - N ol из р LaC212 Spx3 кодирует синтетический лидирующий пептид дрожжей. Сшитая смесь была использована для трансформации компонента E.coli штамма г", т \ выбранного по устойчивости к ампициллину. Определение первичной структуры /секвенирование/ фрагмента 32p.xoai-EcoPi /Maxam Gillert W., Methods Enzymel 65/1980/, 499-560/, показало, что плазмиды из полученных колоний содержали коректную ДНК последовательность для апротинина /1-58/. Один плазмид pKFN-802 был отобран для дальнейшего использования. Конструирование плазмида pKFN-802 приведено на рис.2. б/ Конструирование плазмидов pKFN-849, pKFN-855 и дрожжевого штамма pKFN-837. 3,0 к NCOI - stul фрагмента pKFN-802 сшили синтезированным фрагментом ПОР-790/791, использовав Ї 4 ДНК лигазу: Сшитую смесь гидролизировали с помощью рестрикционного фермента stul для того, чтобы снизить фон pKFN-802, и полученную смесь использовали для трансформации компонента штамма / г*", m + , / E.coli выбранного по устойчивости к ампициллину. Согласно /Sanger.F., Micklen, Coubson A.R., Proc. Natl.Acad.Sci USA 74/1977/ 5463-5467/ ,была определена первичная структура ДНК плазмида pKFN-849 из одной из полученных колоний для того, чтобы осуществить корректную вставку ДНК последовательности для Глу-лей-апротинина /1-58/ в синтезированный лидерный ген дрожжей. Конструирование плазмида pKFN-849 проиллюстрировано на рис.3. pKFN-849 был разрезан EcoPi и X al и фрагментов 406 b р был сшит с 9,5 к b N col - Xbal фрагментом из рМТбЗб и 1,4 Kb Ncol - EcoPI фрагментом из рМТбЗб, в результате получили плазмиду у pKFN-855, см. рис.3. Плазмид рМТбЗб описан в международной патентной заявке № РСТ/ДК88/00138. рМТбЗб - это E.coii - S.cerevisiae челночный вектор, содержащий Schizosacharomycer pomb TPI ген/РОТ/ Russel P.R., Gene 40/1985/125-130, стимулятор и терминатор S.cerevisiae триосефосфатизомеразы, TPIp и ТРТ /Alber Т. Kawasaki G.Mol. Appl. Gen 1/1982/, 419-434/. Плазмид pKFN-855 содержит следующую последовательность: TPp-LaC212 S px 3 сигнал-лидерглулейапротинин /1-58/-ТРІТ, в которой LaC212 s hx З сигнал -лидер - это синтетический дрожжевой лидер, описанный в международной патентной заявке, публикации № WO 89/02463. последовательность ДНК фрагмента 406 р р EcoPI - X al из pKFN-849 и pKFN-855 приведены на рис. 4. Штамм МТ663 S.cerevisiae /E2-7B ХЕП-36 а/, pep 4-3/ pep 4-3/ вырастили на УР9аІ_ / 1 % Bacto дрожжевой экстракт 2% Bacto пептон, 2% галактоза, 1% лактоза/, оптическая плотность при 600 hm равна 0,6, 100 мл культуры собрали путем центрифугирования, промыли 10 мл воды, рецентрифугировали и ресуспендировали в 10 мл раствора, содержащего 1,2 М сорбитол, 25 мМ Паг ЭДТА рН=8,0 и 6,7 мг/мл дитиотрейтола. Суспензию инкубировали при 30 в течении 15 минут, центрифугировали и клетки ресуспендировали в 10 мл раствора, содержащего 1,2 М сорбитола, ЮмМ Na2 ЭДТА, 0,1 М цитрата натрия, рН=5,8 и 2 мг Novozym /P/ 234. Суспензию инкубировали при 30°С в течении 30 минут, клетки собрали путем центрифугирования, промыли в 10 мл 1,2 М сорбитола и 10 мл CAS /1,2 М сорбитол, ЮмМ СаСЬ. 10 мМ, 10 мМ ТрисНСІ /Трис=трис/ гидроксиметил/ аминометан/, рН=7,5/ и ресуспендировали в 2 мл CaS . Для трансформации 0,1 мл ресуспендированных в CaS клеток смешали с примерно 1 мг плазмида pKFN-855 и оставили при комнатной температуре на 15 минут, 1 мл /20% полиэтиленгликоль 4000, 20 мМ СаСЬ, 10 мМ Трис HCI, рН=7,5/ добавили и смесь оставили при комнатной температуре ещё на 30 минут. Смесь центрифугировали и образовавшиеся катышки ресуспендировали в 0,1 мл SOS /1,2 М сорбитол, 33% об. УРО 6 7 мМ CaCI2, 14 мг/мл лейкина/ и инкубировали в течении 2 часов при 30°С. Суспензию затем центрифугиро 27706 Однако, как видно из таблицы 1. колонка 3, подобное явление характерно и для нативного апротинина. При сравнении специфической активности глу-лей-апротинина /1-58/ и специфической активности нативного апротинина, проведенным с использованием упомянутого выше метода Kassel, было установлено, что в пределах ошибки эксперимента, они совпадают. Кривые ингибирующего титрования трипсина и плазмина глулей-апротинином /1-58/ неотличимы от кривых титрования апротинином из поджелудочной железы быка /Апротинин Nova/. После инкубирования фермента с апротинином или его аналогами в течении 30 минут, добавили 0,6 мМ 2251 /Kabivitrum/, измерил активность по скорости образования нитроанилина. Активность, как функция концентрации апротинина представлена на рис.5А и 5В. Отмечено полное ингибирование обоих ферментов всеми тремя ингибиторами. Пример 2. Продуцирование Глу-лей-асп-лейапротинина /1-58/ из штамма дрожжей KFN-840. Синтетический ген, кодирующий глу-лей-асплей-апротинин /1-58/ был сконструирован так. как это описано в примере 1. Синтезированный фрагмент NOP-793/794 был использован вместо NOP-790/791: вали и катышки ресуспендировали в 0,5 мл 1,2 М сорбитола. Затем при 52 С добавили 6 мл top агара /SC среда Sherman's/ Methods in Yeast Jenetics, cold Spring Harbor Laboratory /1981//, содеражащего 1,2 M сорбитола +2,5% агара/ и суспензию вылили на пластинки, заполненые тем же затвердевшим агаром с сорбитолсодержащей средой. Трансформированные колонии были отобраны после выдержки в течении 3 дней при 30°С, реизолированы и использованы для выращивания суспензионных культур. Один такой трансформант pKFN-837 был выбран для последующего охарактеризований. Дрожжевой штамм pKFN-837 вырастили на УР среде / 1 % дрожжевой экстракт, 2% пептон/Difco Laboratories/ и 6% глюкоза/, 200 мл культуры штамма встряхивали при 30°С при 250 об/мин в течение 3 дней до оптической плотности при 600 hm равной 20 /Сухая биомасса дрожжей, 18,8 г/литр/. После центрифугирования супернатантный слой проанализировали методом ионно-обменной хроматографии ГР С /жидкостная экспресси хроматография белков/. Дрожжевой супернатант профильтровали через Millex GV фильтр с размером пор 0,22 мм и 1 мл перенесли в иннообменную колонку Mouos /0,5х 5 см/, уравноввешенную 20 мМ Bicine, pH=8,7. После промывки равновесным буфером колонку проэлюировали раствором с линейным градиентом концентрации NaCI /0-1 М/ в равновесном буфере. Ингибирующая активность элюированных фракций была определена по отношению к трипсину спектрофотометрическим методом /Kassel, Methods Enzymol 19, 1970 /844-852/ и MAKRELDLR CATGGCTAAGAGAGAATTGGACTTGAGA CGATTCTCTCTTAACCTCAAGTCT Плазмид pKFN-849. согласно процедуре, описанной в примере 1. был получен плазмид pKFN-858, содержащей следующую конструкцию: TPIp-La С 212 S рхЗ сигнал-лидер-глулейасплейапротинин /1-58/ -TPI/ Конструирование плазмидов pKFN-852 pKFN-858 проиллюстрировано на рис.6. ДНК последовательность фрагмента 412 bp E coPI Xfal из pKFN-852 и из pKFN-858 приведена на рис.7. Плазмид pKFN-858 был трансформирован в дрожжевой штамм МТ663 согласно методике, описанной выше, результатом является дрожжевой штамм KFN-840. 200 мл культуры KFN-840 в среде YPD встряхивали при 300С в течение 3 дней со скоростью 250 об/мин до оптической плотности при 600 hm, равной 18 /сухая биомасса 16,7 мг/литр/. После FPLC ионной хроматографии супернатанта получили глу-лей-асп-лей-апротинин /1-58/ с выходом 90 мг/литр. Данные аминокислотного анализа, приведенного в таблице 1. подтверждают ожидаемый аминокислотный состав. Кривые ингибирующего титрования трипсина и плазмина глу-лей-асп-лей-апротинином /1-58/ неотличимы от кривой титрования апротинином из поджелудочной железы быка. /Апротинин NOVO/ см. рис.5А и 5В. Пример 3. Продуцирование апротинина /1-58/ из штамма дрожжей KFN-1006. Плазмид pKFN-995 сконструирован из pKFN802 путем сшивания 3,0 к b N col-stul фрагмента i% интегрированием поглощения при 280 hm Е 2 8 0 /апротинин/ =8,3. Выход составил 120 мг/ литр глу-лей-апротинина /1-58/. Для проведения аминокислотного анализа и определения первичной структуры N-терминала провели концентрирование и последующую очистку градиента элюата /глу-лей-апротинин /1-58// методом ВЭЖХ на колонке с реверсивной фазой. /Vidac C4, 4,6 х 250 мм/. Элюитрование проводили в градиенте CH3CN в 0,1% TFA. собрание фракции сконцентрировали примерно до 100 мл методом вакуумного центрифугирования, и далее были отобраны образцы для определения первичной структуры П-терминала и аминокислотного анализа. Секвенирование N-терминала позволило установить следующую последовательность Nконца: глу-лей-арг-про-асп-фен-Х-лей-глу-пропро-тир-тре-гли-про-Х-лиз-ала-арг-илей-арг-тирфен-тир-асп-М-ала-лиз-ала подтверждающую корректность N-терминального конца. Половина цистеиновых остатков не определяется этим методом, что и отмечено X, обозначающим остатки № 7 и 16. Данные аминокислотного анализа приведены в Таблице 1.Из этих данных очевидно, что продукт имеет ожтдаемый аминокислотный состав, т.е. больше глу и лей. Слегка заниженное содержание илей может в большинстве случаев отнесено за счет неполного гидролиза илей /18/илей/19/ /это хорошо известно специалистам/. Также следует отметить слегка завышенное содержание, по сравнению с ожидаемым, аргинина. 10 27706 с синтезированным фрагментом NOR-848/849 глуарглейглу /Лиз-Apr/ апротинин /1-58/ - ТРІт. Конструирование плазмидов pKFN-ЮОЗ проиллюстрировано на рис.10. ДНК последовательность 412 b p EcoRI - Xbal фрагмента из pKFN1000 и pKFN-ЮОЗ приведено на рис.11. Плазмид pKFN-ЮОЗ был трансформирован в дрожжевой штамм МТ663, как описано выше, в результате получили дрожжевой штамм KFN1008. Выращивание трансформированного штамма KFN-1008 в УР - среде и анализ на апротинин /1-58/ супернатанта проведен в соответствии с проведенным выше описанием. Выход апротинина /1-58/ составил 120 мг/л. Аминокислотный анализ подтвердил ожидаемый аминокислотный состав. Кроме того, подтверждение полной первичной структуры было получено путем газофазного секвенирования редуцированного пиридилэтилированного полипептида Далее, специфическая ингибирующая активность рекомбинантного апротинина /1-58/ в отношении трипсина совпадает с активностью апротинина, выделенного из поджелудочной железы быка. Пример 5. Продуцирование апротинина /1-58/ из дрожжевого штамма KFN-783. Плазмид pKFN-802 /см пример 1/ разрезали С помощью EcoRI и X al, и фрагмент 400 b p сшили с фрагментом 9,5 к b Ncol - X b al из рМТбЗб и фрагментом 1,4 к Ncol-EcoPI из рМТбЗб, в результате получили плазмид pKFN803, см. рис.2 pKFN-803 содержит следующую конструкцию: TPIp-LaC212s рхЗ сигнал-лидерапротинин /1-58/- TPIT. Плазмид pKFN-803 трансформировали в дрожжевой штамм МТ663 согласно описанию, приведенному выше. Выращивание трансформированного штамма KFN-783 в YPD в среде и EPLC ионная хроматография супернатанта были проведены согласно описанию, приведенному выше. Апротинин /1-58/ количественно охарактеризовали путем сравнения с хроматограммой стандартного раствора аутентичного апротинина, выделенного из бычьей поджелудочной железы. Выход апротинина /1-58/ был ниже 1 мг/литр. MAKELEKRR CATGGCTAAGGAATTGGAGAAGAAGG CGATTCCTTAACCTCTGCTCTTCC Сшитая смесь была гидролизирована с помощью рестрикционного фермента Bait с целью снижения pKFN-802. Дрожжевой экспрессионный плазмид pKFN998 сконструирован в основном как описано в примере 1 и показано на рис.8: TPIP-L a C212 S рхЗ сигнал-лидер /1-47/ лиз-глу-лей-глу-/лиз-арг/протинин /1-58/ - ТРІт. ДНК последовательность фрагмента 412 b p EcoRI - Xb al- из pKFN-995 и из pKFN-998 приведена на рис.9. Плазмид pKFN-998 был трансформирован в дрожжевой штамм МТ663 в соответствии с описанием примера 1, в результате получили штамм KFN-1006. Культивирование штамма KFN-1006 в YPD - среде и анализ супернатанта на апротинин был проведен в соответствии с приведенным выше описанием Выход апротинина /1-58/ составил 30 мг/литр. Аминокислотный анализ очищенного материала подтвердил ожидаемый аминокислотный состав. Пример 4. Продуцирование апротинина /1-58/ из дрожжевого штамма KFN-1008. PUC - полученный плазмид pKFN-ЮОО был сконструирован в соответствии с описанием примера 1 путем сшивания 3,0 к ПсоІ1 фрагмента pKFN-802 и синтетического фрагмента ПОР-850/851: МАЕ RLEKRR CATGGCTGAGAGATTGGAGAAGAGAAGG CGACTCTCTAACCTCTTCTCTTCC Следуя процедуре, описанный в примерах 1 и 3, был получен дрожжевой экспрессионный плазмид pKFN-ЮОЗ, содержащий следующую конструкцию ТР1Р-АС212 хЗ сигнал-лидер /1-47/ Таблица 1 Аминокислотный состав Аминокислота Аспарагиновая кислота /асп/ Треонин /тре/ Серии /сер/ Глутаминовая кислота /глу/ Пролин /про/ Глицин /гли/ Алании /ала/ Цистеин /цис/ Валин /вал/ Метионин /мет/ Изолейцин /илей/ Лейцин апротинин теория 5 апротинин найдено 5,00 К-837 найдено 4,95 К-840 найдено 5,93 Ml 3 1 3 2,86 0,94 3,04 2,84 0,92 3,97 /+1/ 2,85 0,93 3,99/+1/ 4 6 6 6 1 1 2 2 4,18 5,95 5,85 5,20 1,00 0,83 1,39 1,97 3,90 5,91 5,92 5,21 1,00 0,65 1,58 3,00 Ml 3,86 5,94 5,94 5,22 1,01 0,67 1,58 4,001+2-1 11 27706 Продолжение таблицы 1. К-837 К-840 апротинин найдено найдено найдено 3,74 3,84 3,71 Тирозин /тир/ 3,94 3,92 Фенилаланин /фен/ 3,98 3,92 3,99 3,99 Лизин /лиз/ 6,35 6,39 6,34 Аргинин /арг/ 57,87 56,33 59,88 Сумма сшивания /лигирования/. Пример 6, Следующие 10 нуклеотидов были синтезиропродуцирование апротинина /3-58/. ваны в соответствии с описанием, приведенном Синтетический ген для апротинина /3-58/ был сконструирован из ряда нуклеотидов путем их в примере 1: Аминокислота I: II: III: IV: V: VI: VII: VIII: IX: X: апротинин теория 4 4 4 6 58 AAACAGATTTCTGTTTGGAACCTCCATACACTGGTCC 37-merTTACATGGACCAGTGTATGGAGGTTCCAAACAGAAACT 38-mer ATGTAAAGCTAGAATCATCAGATACTTCTACAACG 35-mer CTTGGCGTTGTAGAAGTATCTGATGATTCTAGCT 34-mer CCAAGGCTGGTTTGTGTCAAACTTTCGTTTACGGTGGCT. 39-mer CTCTGCAGCCACCGTAAACGAAAGTTTGACACAAACCAGC 40-mer GCAGAGCTAAGAGAAACAACTTCAAGT 27-mer AGCAGACTTGAAGTTGTTTCTCTTAG 26-mer CTGCTGAAGACTGCATGAGAACTTGTGGTGGTGCCTAAT 39-mer CTAGATTAGGCACCACCACAAGTTCTCATGCAGTCTTC 38-mer Пять дуплексов А-Е были сформированы из 10 вышеприведенных олигонуклеотидов, см. рис.12. 20 пикомолей каждого из дуплексов А=Е было сформировано из соответствующих пар 51фосфорилированных олигонуклеотидов 1-Х при нагревании в течении 5 минут при 90°С с последующим охлаждением до комнатной температуры в течении 75 минут. Пять дуплексов смешали и обработали Т4 лигазой. После электрофореза сшитой смеси на геле 2% агарозы выделили синтезированный ген /окрашенная полоса 176 b p/. Полученный синтетический ген представлен на рис.12. Синтетический ген 176 b р сшили с 330 b p EcoRi - Hoal фрагментом из плазмида pKFN-9, кодирующего последовательностьскрещивающий фактор І-сигнал-лидер /1-85/ S.cerevisiae / Mar Kussen. I и др., Protein Engineering 1/1987/, 215-223/ и с 2,7 к EcoRI-X al фрагментом из р С19// Lanish - Perron С , Viera I., Messing I Gene 33/1985/ 103-119/. Конструкция pKFN-9, у которой Hga I сайт находиться сразу после последовательности MF ( I лидер описана в ЕП 214826. Сшитую смесь использовали для трансформирования компетента штамма /г", m+/ E.coli, отобранного по устойчивости к ампициллину. Секвенирование 32р-хьаі-ЕсоРі фрагмента /Махат A, Lilbert W., Methods Enzymoi 65, 1980 /499-560/ показало, что плазмиды из выращенных колоний содержали корректную ДНК последовательность для кодирования апротинина /3-58/. Плазмид pKFN-305 отобрали для дальнейшего использования. Конструкция плазмида рМТбЗб проиллюстрирована на рис. 13. pKFN-305 разрезали EcoPl и X bal, и 0,5 к b фрагмент сшили с 9,5 к b Ncol-Xbal фрагментом из рМТбЗб и 1,4 к b Ncol-EcoPI фрагментом из рМТбЗб в результате получили плазмид pKFN734, см. рис.13. Плазмид рМТбЗб сконструировали из рМТ608 после делеции LEU-2 гена и из рМТ479, см. рис.14. рМТ608 описан в ЕП 195691. рМТ479 описан в ЕП 163529. рМТ479 содержит Schizosaccaharomyces pombe TPI ген /рот/, промотор /стимулятор/ и терминатор S.cerevisiae триозефосфат изомеразы, ТР!Р и TPI T /Albert Т., Kawasaki G. Jmol ApplGen I /1982/, 419-4434/. Плазмид pKFN-734 содержит следующую последовательности: TPIp-MF і сигнал лидер /1-85/апротинин /3-58/- ТРІ, в которой MF I - это скрещивающий фактор ( I S.cerevisiae кодирующий последовательность /Kurjam G., Herskowits J.Cell 30 /1982/, 933-943/, сигнал-лидер /1-85/ означает, что последовательность содержит первые 85 аминокислотных остатка MF I сигнал-лидер последовательности, и апротинин /3-58/ - это синтетическая последовательность, кодирующая производные апротинина, в котором отсутствуют два первых аминокислотных остатка. Штамм МТ663 /Е2-7В ХЕІІ-36 a/ a Atpi Дірі pep 4-3 /pep 4-3/ S.cerevisiae вырастили на YPGal / 1 % Basto дрожжевой екстракт, 2% Basto пептон, 2% галактоза, 1 % лактат/ до оптической плотности 0,6 при длине волны 600 hm. 12 27706 вали в линейном градиенте /0-1 М/ в равновесном буфере. Ингибирующую активность элюированных фракций в отношении трипсина определяли спектрофотометрическим методом, и интегрированием поглощения при 280 hm Е ^ , Путем центрифугирования отобрали 100 мл выращенной культуры, промыли 10 мл воды, рецентрифугировали и ресуспендировали в 10 мл раствора, содержащего 1,2 М сорбитола, 25 мМ Na2 ЭДТА рН=8,0 и 6,7 мг/мл дитиотрейтола. Суспензию инкубировали при 30°С в течение 15 минут, центрифугировали и клетки ресуспендировали в 10 мл раствора, содержащего 1,2 М сорбитола, 10 мМ Ыаг ЭДТА, 0,1 М цитрата натрия, рН=5,8 и 2 мг Novozym® 234. Суспензию инкубировали при 30°С в течение 30 минут клетки собрали путем центрифугирования, промыли в 10 мл 1,2 М сорбитола и 10 мл СА /1,2 М сорбитол, 10 мл СаСІг, 10 мМ трис НСІ /Тристи/гидроксиметил/аминометан, рН=7,5/ и ресуспендировали в 2 мл CAS. Для трансформации 0,1 мл клеток, ресуспендированных в С AS, смешали с примерно 1 мг плазмида pKFN-374 и оставили при комнатной температуре на 15 минут. 1 мл /20% полиэтиленгликоль 4000, 10 мМ CaCI, 10 мМ трис HCI, рН=7,5/добавили, и смесь оставили ещё на 30 минут при комнатной температуре. Смесь центрифугировали, и катышки ресуспендировали в 0,1 мл SOS /1,2 М сорбитол, 33% об/об YPD 6,7 мМ СаСІг 14 г/мл лейкина/ и инкубировали при 30°С в течение 2 часов. Суспензию вновь центрифугировали, и катышки ресуспендировали в 0,5 мл 1,2 М сорбитола. Затем 6 мл top агара /SC среда Sherman и др./, содержали 1,2 М сорбитола плюс 2,5% при 520С добавили, и суспензию вылили на пластины, содержащие тот же затвердевший агар с сорбитолсодержащей средой. После выдержки в течение 3 дней при 30 С колонки трансформированных клеток были отобраны, реизолированы и использованы для выращивания суспензионных культур. Один такой трансформант KFN-322 был отобран для дальнейшего охарактеризована. Дрожжевой штамм KFN-322 вырастили на YPD среде / 1 % дрожжевой экстракт, 2% пептон/, полученный из Difco Laboratories и 2% глюкоза/, 10 мл культуры штамма встряхивали при 300С до достижения оптической плотности 32 при длине волны 600 hm. После центрифугирования супернатант проанализировали методом F PC ионно-обменной хроматографии. Дрожжевой супернатант профильтровали через фильтр МШех® с размером пор 0,22 м, и 1 мл внесли в колонкую, заполненную катионнообменной смолой /0,5 х 5 см/, уравновешенную 20мМ Becine рН=8.7. После промывания равновесным буферным раствором содержимое колонки проэлюироNOR-542: NOR-543: NOR-6 9: NOR-73: NOR-315: NOR-316: NOR-70: NOR-71: NOR-78: NOR-72: /апротинин/=8,3. Выход апротинина /3-58/ составил примерно 3 мг/литр. Пример 7. Продуцирование инсулина предшественника В/1-29/-ала-ала-лиз-А/1-21/ из дрожжевого штамма L aCI667. 589 b p Sph I + Ncol и 172 b p Hpai-X al фрагменты были выделены из р L aC212 S рхЗ /описание дано в WO 89/02463/. Эти фрагменты были соединены с синтетическим адаптером NOP - 962 NOP - 964 И С 10 к b X al - Sph I фрагментом из ррМТ743/ описано в WO 89/02463, в результате получили плазмид р LAC 240/, см. рис.15. ДНК последовательность гена из р LaC 240 для модифицирования предшественника лидеринсулина представлена на рис.16. Трансформация дрожжевого штамма МТ 633 плазмидом р LaC240 привело к образованию штамма р LaC 1667 /МТ663/ pLa С 240, секретирующего предшественник инсулина, продуктивность которого составляет 165%, производительности штамма LACI414 /МТ663/ р L a C212 s рхЗ/, содержащего ген для немодифицированного предшественника лидер-инсулина, описано в WO 89/02463. Пример 8. Продуцирование предшественника аналога инсулина В/1-29,1 глу +27 глу/-алаалализ-А/1-21/ из дрожжевого штамма KFN-470. Синтетический ген, кодирующий предшественник аналога инсулина В/1-29, 1 глу + 27 глу/алаалализ - А/1-21/ сконструировали путем сшивания 10 олигонуклеотидов. В /1-29/ 1 глу + 27 глу/ означает полипептид, содержащий первые 29 аминокислотных остатков В-цепи человеческого инсулина, в котором глу - остатки были замещены на ВІР he и В27Т hr остатки. А/1-21/ это А - цепь человеческого инсулина. Трипептидалаала-лиз - связывает В29 лиз остаток с остатком AI глу. Были синтезированы следующие 10 олигонуклеотидов: AAAGAGAAGTTAACCAACACTTGTGCGGTTCCCAC AACCAAGTGGGAACCGCACAAGTGTTGGTTAACTTC TTGGTTGAAGCTTTGTACTTGGTTTGCGGTGAAAGAGGTTTCT GTAGAAGAAACCTCTTTCACCGCAAACCAAGTACAAAGCTTC TCTACGAACCTAAGGCTGCTAAGGGTATTGCT ATTGTTCGACAATACCCTTAGCAGCCTTACGTfC GAACAATGCTGTACCTCCATCTGCTCCTTGTACCAAT TTTTCCAATTGGTACAAGGAGCAGATGGAGGTACAGC TGGAAAACTACTGCAACTAGACGCAGCCCGCAGGCT CTAGAGCCTGCGGGCTGCGTCTAGTTGCAGTAG 5 дуплексов было сформировано из приведенных выше 10 олигонуклеотидов и эти дуплек сы были сшиты таким же путем, как это было сделано в примере 1. 13 27706 Синтетический 178 р ген был сшит с 330 р EcoPI - Н al фрагментом из pKFN-9, кодирующим последовательность скрещивающего фактора альфа 1-сигнал-лидер /1-85/ S.cerevisiae Marrussen и др., Protein Engineering 1/1987/, 215223/ и с 2,7 к EcoPI-X а! фрагментом плазмида з С 19 / Yanish - Perron С , Vieira, messing Y, Gene 33/1985,103-119/. Сшивание смеси было использовано для трансформирования компетента штамма /г-, т + / Е/соП, отобранного по устойчивости к ампицилину. Секвенирование 32 Р-Х al-EcoPl фрагмента /Maxam A Gillert W. Methods of Enzymd 65 /1980/, 499-560/ показало, что плазмиды из полученных колоний содержали корректную ДНК последовательность для кодирования предшественника аналога инсулина. Плазмид pKFN-456 был выбран для дальнейшего использования. Согласно процедуре примера 1 был получен дрожжевой экспрессионный плазмид, содержащий следующий полигенный зкспрессирующий кластер: ТР!Р - MF ! - сигнал-лидер /1 -85/ - В /1-29,1 глу + 27 глу/ алаалализ-А-/1-21/ - ТРІт. ДНК последовательность 508 р EcoPl-X al фрагмента из pKFN-456 приведена на рис.17. Предшественники В/1 -29/-алаалализ-А/1 -21 / В/1-29/ 27 глу / алаалализ-А/1-21/ В/1-29,1 глу + 27/-алаалализ-А/1-21/ Плазмид pKFN-458 был трансформирован в дрожжевой штамм МТ-633 в соответствии с описанием, приведенным выше, в результате получили дрожжевой штамм KFN-470. выращивание трансформированного штамма провели на УР среде в соответствии с вышеприведенной методикой. Содержание предшественника аналога инсулина в супернатанте было определено методом ВЭЖХ в соответствии с описанием, приведенным в работе L.Snel и др., Chromatographia 24/1987/, 329-332. В таблице 2 сравнивается уровни экспресии предшественников аналога инсулина В/1-29/ 1 глу + 27 глу/-алаалализ-Ф/1-21/, В/1-29/ 27 глу/алаалализ-А/1-21/ и предшественника инсулина В/1-29/-алаалализ-А /1-21/. Все три предшественника были экспрессированы в одном и том же штамма хозяине МТ-633, трансформированном S. pomle TPI геном, содержащим плазмиды с полигенным экспрессирующим кластером. TPIp MF I сигнал-лидер /1-85/предшественник-ТРІт, уровни экспрессии предшественников инсулина и аналогов инсулина в дрожжевых трансформантах. Уровень экспресии 100% 148% 479% Уровни экспрессии представлены как процентное отношение к уровню экспрессии пред шественника инсулина В/1-29/-алаалализ-А/121/, который принят за 100% 14 27706 1 S 10 MetAiaLysArgArgProAspPheCysLeuGluProProTyrThrGly Ncol StuI CAfGGCCAAAAGAAGGCCTGATTTCTGTTTGGAACCTCCATACACTGGT CGGTTTTCTTCCGGACTAAAGACAAACCTTGGAGGTATGTGACCA 15 20 25 ProCysLysAlaArgllelleArgTyrPheTyrAsnAlaLysAlaGly CCJATGTAAAGCTAGAATCATCAGATACTTCTACAACCJCCAAGGCTGGT GGTACATTfTCGATCTfAGTAGTCTATGAAGATGTTGCGGTTqCGACCA 30 35 40 LeuCysGlnThrPheValTyrGlyGlyCysArgAlaLysArgAsnAsn TTGTGTCAAACTTTCGTTTACGGTCGClbCAGAGCTAAGAGAAACAAC AACACAGTTTGAAAGCAAATCCCACCGACGTCTCpATTCTCTTTGTTG 45 50 55 58 PheLysSerAlaGluAspCysHetArgThrCysGlyGlyAlaStop , XbaX TTCAAGIPTGCTGAAGACTGCATGAGAACTTGTGGTGGTGCCTAAT AAGTTCAGACG^JCTTCTCACGTACTCTTGAACACCACCACGGATTAGATC Фиг. 1 15 1НОЭЗ 90ZZ2 27706 EcoRX Ncol Sttlt NOR-79Q/791 CATGGCTAACAGAGAATTCACA CGATTCTCTCTTAACТСТ Ncol vEcoRI \V FL -апротннин V x Фиг. 3 17 Ncoi 27706 10 20 ЗО 40 50 60 •J і І І І І GAATTCCATTCAAGAATAGTTCAAACAAGAAGATTACAAACTATCAATTTCATACAGAAT 70 120 І ATAA^CGACCAAAAGAATGAAGGCTGTTTTCTTGGTTTTGTCCTTGATCCGATTCTGCTG ; 80 ! 90 : 100 110 ; : METLysAlaValPheLeuValLeuSerLeuIleGlyPheCysTrp 130 140 150 160 * * І І ПО 180 * * GGCCCAACCAGTCACTGGCGATGAATCATCTGTTGAGATTCCGGAACAGTCTCTGATCAT AlaGlnProValThrGlyAspGluSerSerValGluIleProGluGluSerLeuIlelle 190 200 210 220 230 240 CCCTGAAAACACCACTTTGGCTAACGTCGCCATCGCTAAGAGAGAATTGAGACCTGATTT AlaGluAsnThrThrteuAlaAsnValAlaMETAlabysArgGluLouArgProAspPhc f 250 і і 260 270 280 290 ; І t І і * > < ! I * / 180 , | » l | GGCCCAACCAGTCACTGCCGATGAATCATCTGTTGAGATTCCGCAAGAGTCTCTCfATCAT AlaClnProValThrGlyAspGluSerSerValGluIl^ProGluGluSerLieoIlelle 190 200 210 220 230 240 CGCTGAAAACACCACTTTCGCTAACGTCGCCATGGCTAAGGAATTCGAGAACACAAGGCC AlaGluAsnThrThrLeuAlaAsnValAlaMETAlaLysGluLeuGluLysArgArgPro t 250 260 27 0 280 290 300 TGATTTCTGTTTCGAACCTCCATACACTGGTCCATGTAAAGCTAGAATCATCAGATACTT AspPheCysLeuGluProProTyrThrGlyProCysLysAlaArgrielleArgTyrPhe 310 320 330 340 350 360 CTACAACGCCAAGGCTGGTTTGTGTCAAACTTTCGTTTACGGTGGCTGCAGAGC^AAGAG TyrAsnAlaLysAlaGlyLeuCysGlnThrPheValTyrGlyGlyCysArgAl aLysArg 370 380 390 40Ь 410 і і \ \ AAACAACTTCAAGTCTGCTGAAGACTGCATGAGAACTTGTGGTGGTGCCTAATCifAGA AsnAsnPheLysSerAlaGluAspCysHETArgThrCysGlyGlyAla Фиг. 9 23 27706 Фиг. 10 24 27706 30 20 10 40 50 GAATTCCATTCAACAATAGTTCAAACAAGAAGATTACAAACTATCAATTTLATACACAAT 70 80 , 90 • 100 I 110 і I 120 » ATAAACGArcr\AAAGAATCAAGGCTGTTTTCTTGGTTTT
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of obtaining heterologous polypeptide
Автори англійськоюBJORN SOREN, NORRIS KJELD, NORRIS FANNY
Назва патенту російськоюСпособ получения гетерологического полипептида
Автори російськоюБьорн Сорен, Норрис Келд, Норрис Фанни
МПК / Мітки
МПК: C12P 21/02, C12N 1/19, C12N 15/62, C12N 15/09, C07K 14/62, C07K 19/00, C07K 14/81, C07K 14/00
Мітки: спосіб, гетерологічного, поліпептиду, одержання
Код посилання
<a href="https://ua.patents.su/32-27706-sposib-oderzhannya-geterologichnogo-polipeptidu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання гетерологічного поліпептиду</a>
Попередній патент: Сінозбиральна машина
Наступний патент: Фармацевтична композиція для лікування патологічних станів, пов’язаних з активністю лейкотриєнів
Випадковий патент: Струминний апарат