Спосіб лікування та/або профілактики нейродегенеративних розладів
Формула / Реферат
1. Спосіб лікування та/або профілактики нейродегенеративного розладу або захворювання, причому зазначений спосіб включає введення композиції, що містить екстракти: Conium maculatum, який одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, Ambra grisea, який одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, petroleum rectificatum, який одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї й Anamirta cocculus, який одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, і при цьому зазначені екстракти вводять у дозуванні щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день.
2. Спосіб за п. 1, який відрізняється тим, що зазначену композицію, яка містить зазначені сирі екстракти, вводять у концентрації щонайменше приблизно 1 мл/кг, щонайменше приблизно 2 мл/кг маси тіла суб'єкта, якого лікують, на день.
3. Спосіб за п. 1 або 2, який відрізняється тим, що зазначений нейродегенеративний розлад або захворювання асоційоване з порушенням когнітивних функцій.
4. Спосіб за п. 3, який відрізняється тим, що зазначене порушення когнітивних функцій запобігають або полегшують.
5. Спосіб за будь-яким із пп. 1-4, який відрізняється тим, що зазначене нейродегенеративне захворювання або розлад являє собою хворобу Альцгеймера.
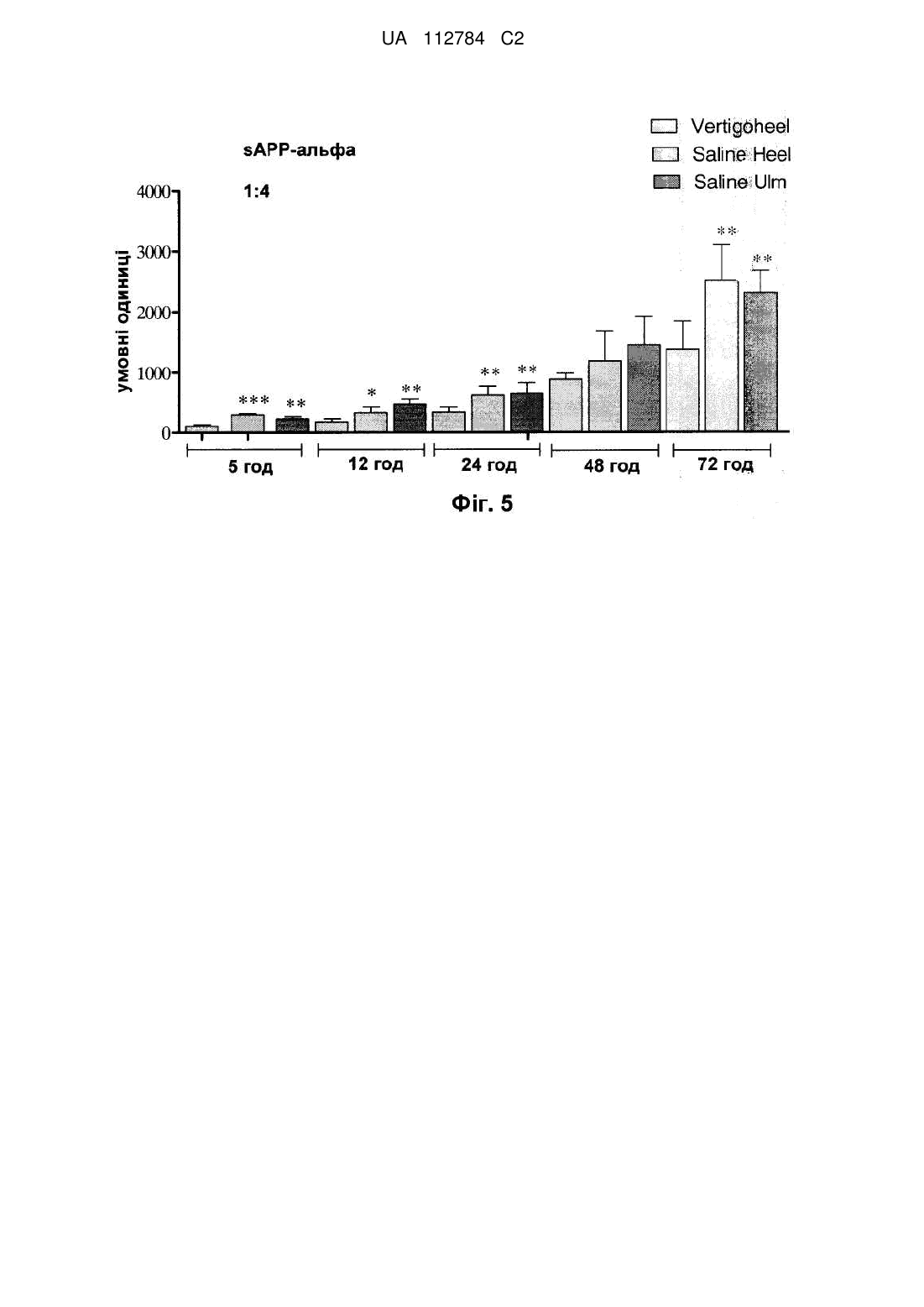
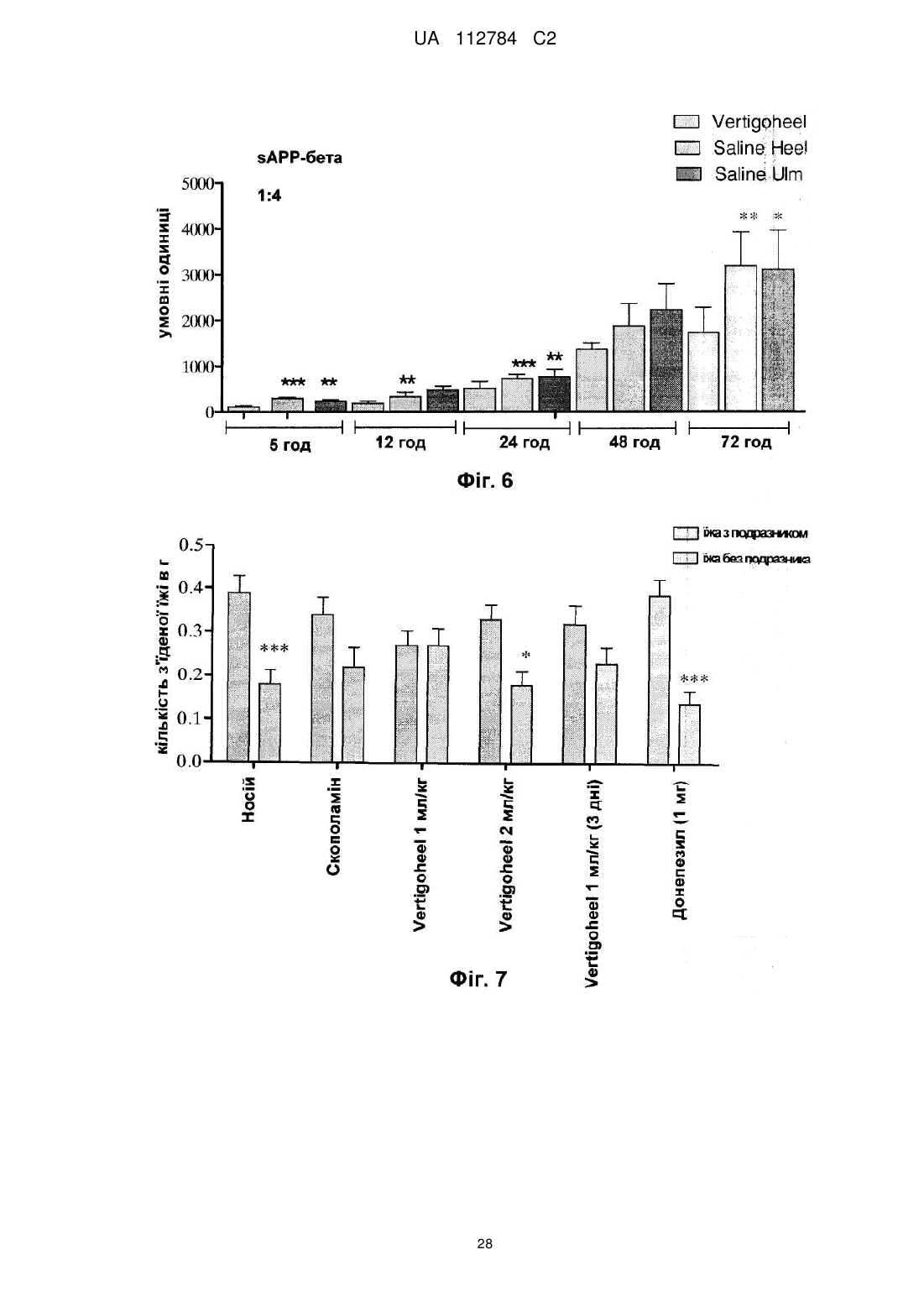
6. Спосіб за п. 5, який відрізняється тим, що процесинг білка-попередника бета-амілоїду, який супроводжує хворобу Альцгеймера, знижується.
7. Спосіб за будь-яким із пп. 1-4, який відрізняється тим, що зазначене нейродегенеративне захворювання або розлад являє собою амнезію, дефіцит навченості та пам'яті, бічний аміотрофічний склероз, обмежену передстаречу атрофію головного мозку, кортикобазальну дегенерацію, дегенерацію нервової системи, викликану алкоголем, неспецифічне дегенеративне захворювання нервової системи, дегенеративний синдром, діабетичну поліневропатію, епілепсію, атаксію Фрідрейха, лобово-скроневу деменцію та паркінсонізм 17 хромосоми, хворобу Хантингтона, помірні когнітивні порушення, хворобу Піка, некласифіковані дегенеративні захворювання або розлади нервової системи, прогресуючу ізольовану афазію, прогресуючий над'ядерний параліч, некласифіковану сенільну дегенерацію головного мозку, спинально-церебелярну атаксію/дегенерацію, розумову відсталість, ушкодження спинного мозку, безпам'ятність та хворобу Паркінсона.
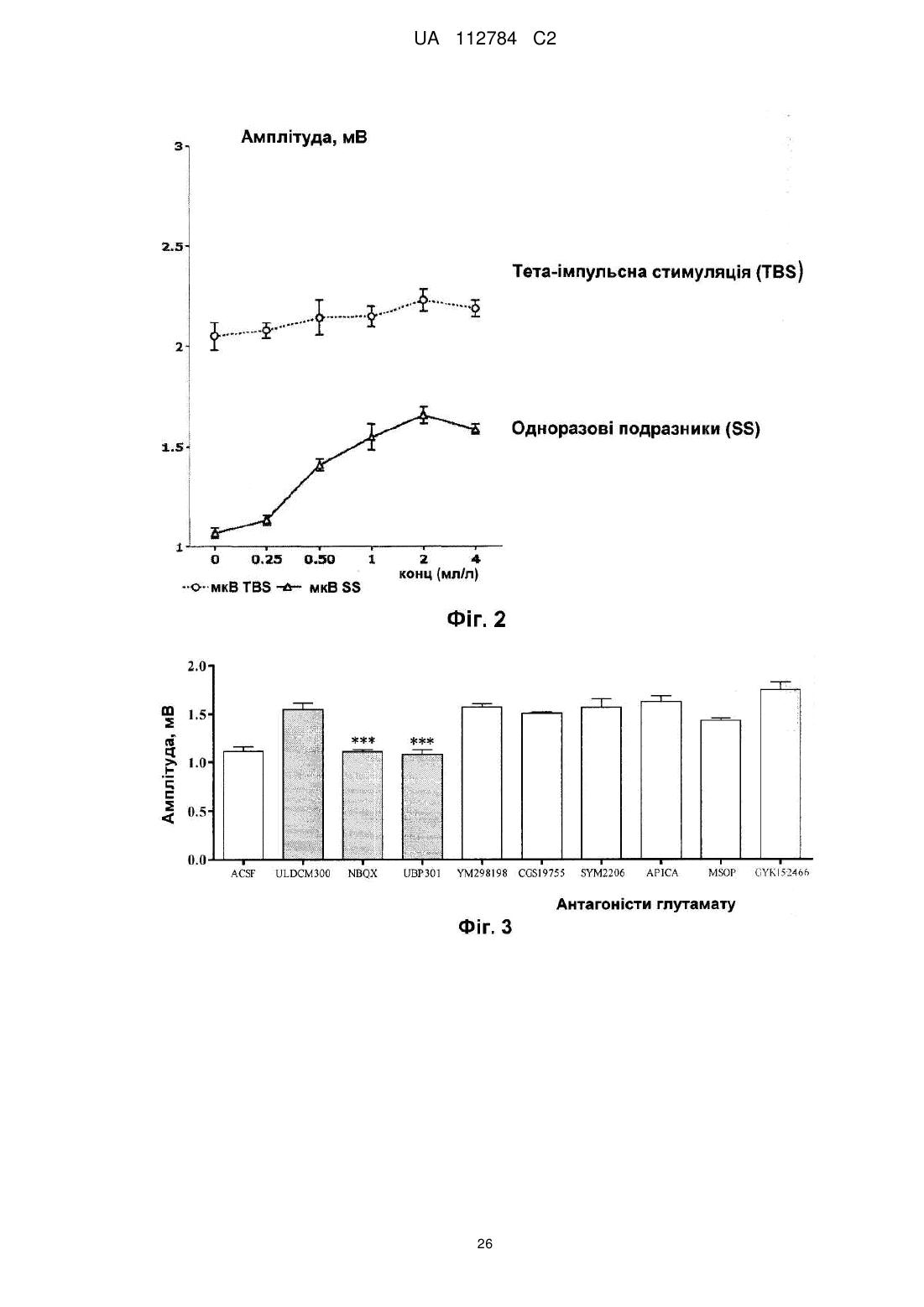
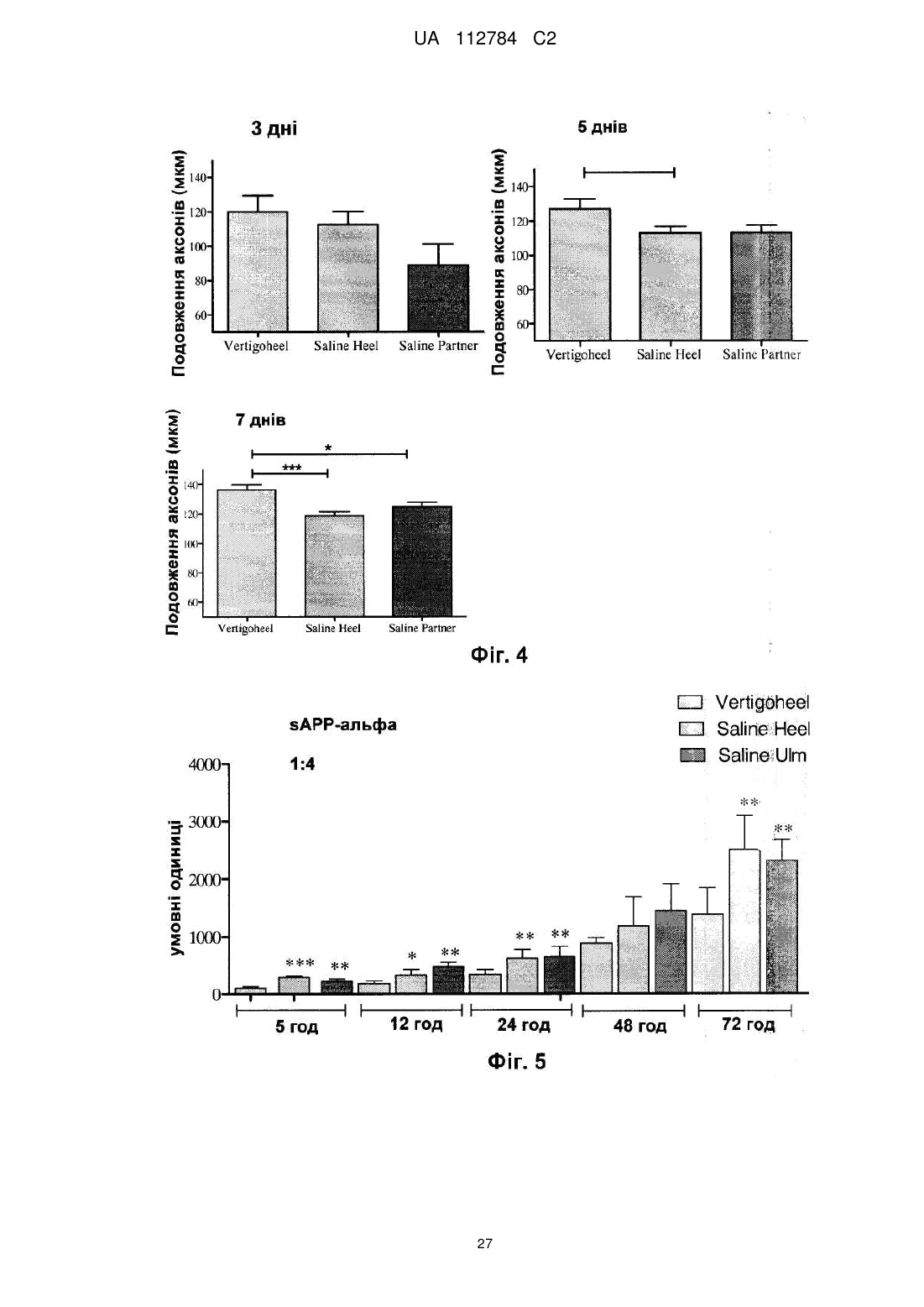
8. Спосіб за будь-яким із пп. 1-7, який відрізняється тим, що за рахунок уведення композиції підсилюється ріст нейронів.
9. Спосіб за будь-яким із пп. 1-8, який відрізняється тим, що зазначена композиція містить щонайменше один додатковий фармацевтично активний інгредієнт, вибраний з групи, яка складається з: донепезилу, ривастигміну, галантаміну, такрину, мемантину, каптоприлу, етанерцепту, Gingko biloba, вітаміну В12, ресвератролу, женьшеню, екстракту зеленого чаю, вітаміну Е, леводопи, праміпексолу дигідрохлориду моногідрату і разагіліну.
10. Спосіб для поліпшення навченості та пам'яті, причому зазначений спосіб включає введення композиції, що містить екстракти: Conium maculatum, який одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, Ambra grisea, який одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, petroleum rectificatum, який одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї й Anamirta cоссulus, який одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, і відрізняється тим, що зазначений спосіб включає введення зазначених екстрактів у дозуванні, яке рівне щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день.
11. Спосіб за п. 10, який відрізняється тим, що природне забування знижують для поліпшення навченості та пам'яті.
12. Спосіб за будь-яким із пп. 1-11, який відрізняється тим, що зазначена композиція додатково містить фармацевтично прийнятний носій та/або розріджувач.
13. Застосування композиції для поліпшення навченості та пам'яті, яке відрізняється тим, що зазначена композиція містить екстракти: Сonium maculatum, який одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, Ambra grisea, який одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, petroleum rectificatum, який одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї й Anamirta cocculus, який одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, при цьому застосування включає введення зазначених екстрактів у дозуванні, яке рівне щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день.
14. Застосування за п. 13, яке відрізняється тим, що зазначений лікарський засіб додатково містить фармацевтично прийнятний носій та/або розріджувач.
15. Застосування композиції для лікування та/або профілактики нейродегенеративного розладу або захворювання, яке відрізняється тим, що зазначена композиція включає: екстракти Conium maculatum, який одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, Ambra grisea, який одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, petroleum rectificatum, який одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї, й Anamirta cocculus, який одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, при цьому застосування включає введення зазначених екстрактів у дозуванні, яке рівне щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день.
Текст
Реферат: Винахід належить до лікування та/або профілактики нейродегенеративного розладу або захворювання, а також способу для поліпшення навченості та пам′яті, що передбачають введення композиції, яка містить екстракти Anamirta cocculus (Анамірта кокулюсоподібна), Conium; maculatum (боліголов плямистий), Ambra grisea (сіра амбра) і Petroleum rectificatum (петролеум ректифікатум), де зазначені екстракти вводять у дозуванні щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день. UA 112784 C2 (12) UA 112784 C2 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід відноситься до фармацевтично корисних композицій рослинного походження. Зокрема, він відноситься до композиції для застосування в лікуванні та/або профілактиці нейродегенеративного розладу або захворювання, причому зазначена композиція містить екстракти Anamirta cocculus (Анамірта кокулюсоподібна), Conium maculatum (боліголов плямистий), Ambra grisea (сіра амбра) і Petroleum rectificatum (петролеум ректифікатум), і при цьому композиція містить зазначені екстракти в дозуванні щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день. Даний винахід також відноситься до зазначеної композиції для застосування у поліпшенні навченості та пам'яті. Крім того, запропонований лікарський засіб, який містить зазначену композицію, а також спосіб лікування та/або профілактики нейродегенеративного розладу або захворювання у суб'єкта, що страждає ним, причому зазначений спосіб включає введення зазначеному суб'єкту композиції в терапевтично ефективній кількості. Нейродегенеративні захворювання та розлади в цей час перебувають у центрі уваги різних наукових і медичних досліджень. Через невідому етіологію такі складні та багатофакторні захворювання ЦНС з труднощами піддаються лікуванню. Вони являють собою захворювання, що розвиваються, які частіше виникають у людей похилого віку. Внаслідок демографічного розвитку нашого суспільства вбік старіння населення існує виражена медична потреба в лікуванні таких захворювань. Відповідно, у цей час вживають різні зусилля для більш ефективної профілактики або лікування такого захворювання. Однак на сьогоднішній день терапевтичні можливості обмежені симптоматичним лікуванням. Лікарські засоби лише знижують симптоми, однак схвалені для застосування при нейродегенеративних захворюваннях лікарські засоби, які модифікують перебіг захворювання, відсутні. Нейродегенеративним захворюванням, що має особливе значення в розвинених країнах зі старіючим населенням, є хвороба Альцгеймера. Хвороба Альцгеймера в цей час є найпоширенішою причиною деменції. Вона являє собою невиліковне прогресуюче дегенеративне термінальне захворювання, яке було вперше описане Алоісом Альцгеймером (Alois Alzheimer) на початку 20-го століття. Вона є четвертою з поширеності причиною смерті після серцево-судинних захворювань, раку й інсульту. Хвороба Альцгеймера в більшості випадків діагностується у віці старше 65 років. Однак деменція може проявлятися значно раніше. З епідеміологічної точки зору дана хвороба також має важливе значення, тому що в 2006 році від хвороби Альцгеймера страждало близько 26 мільйонів пацієнтів у світі, та існує прогноз, що до 2050 року від зазначеного захворювання буде страждати 1 з кожних 85 людей у світі. Етіологія хвороби Альцгеймера до цього часу невідома, однак досягнутий великий прогрес у розумінні клітинних і молекулярних механізмів зазначеного багатофакторного захворювання. Вважають, що хвороба Альцгеймера викликається декількома подіями, що призводять до конвергентних і складних патофізіологічних явищ (Bolognesi 2009, Curr Pharm Des 15(6): 601613, Leon 2011, Curr Med Chem 18(4): 552-576. Galimberti 2011, CNS Neurol Disord Drug Targets 10(2): 163-174, Niedermeyer 2011, Am J Electroneurodiagnostic Technol 51(2): 82-91). Перебіг хвороби Альцгеймера індивідуальний та відрізняється у всіх пацієнтів. Проте, є деякі загальні симптоми, найбільш ранні з яких найчастіше невірно приписуються впливу інших факторів, наприклад, віку або стресових умов. Хвороба Альцгеймера характеризується трьома відмітними ознаками: дифузійною загибеллю нейронів, в основному в холінергічній системі, внутрішньоклітинними відкладаннями білка, які називаються нейрофібрилярними клубками, і позаклітинним накопиченням амілоїдних бляшок. Передбачається, що зазначені фактори є причиною хвороби Альцгеймера, на них засновані інші теорії, що пояснюють патогенез хвороби Альцгеймера, наприклад, холінергічна гіпотеза (Bartus 1982, Science. 1982 Jul 30;217(4558):40814), гіпотеза амілоїдного каскаду (Hardy 1992, Trends Neurosci. 1992 Jun;15(6):200-1) і гіпотеза гіперфосфорилування (Grundke-Iqbal 1986, J Alzheimers Dis. 2006;9(3 Suppl):219-42). На ранніх стадіях розповсюдженим симптомом захворювання є погіршення пам'яті, зокрема, про більш пізні події (короткострокової пам'яті). Дане захворювання можна підтвердити за допомогою МРТ або ПЕТ-сканування головного мозку й аналізу поведінки, а також тестів когнітивних здатностей. Симптоми більш пізніх стадій захворювання включають сплутаність свідомості, дратівливість, агресивність, перепади настрою, порушену мову, втрату довгострокової пам'яті та загальний аутизм пацієнта в міру посилення порушення сприйняття. На кінцевій стадії відбувається порушення важливих функцій організму у зв'язку з дегенерацією нейронів, і це порушення в остаточному підсумку призводить до смерті. У хвороби Альцгеймера поганий прогноз, і більшість пацієнтів проживають не більше десяти років після первинної постановки діагнозу. Ведення хвороби є великою проблемою, оскільки пацієнтам необхідні та потрібні особливі види допомоги. 1 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 Причини і фактори, які впливають на захворювання, до цього часу мало вивчені. Дане захворювання первинно ідентифікували за гістопатологічними результатами, тобто присутністю так званих бляшкових структур головного мозку. Існує вагомий науковий доказ порушення процесингу білка-попередника амілоїду бета (АРР) у пацієнтів із хворобою Альцгеймера, і це порушення призводить до продукції таких різновидів молекул, як білок амілоїду бета (Aß) або його олігомери, наприклад, дифундуючі ліганди амілоїду (ADDL), що впливають на зв'язок між нейронами (Palop 2010, Neuromolecular Med. 2010 Mar; 12(1):48-55., Zhang 2011, APP processing in Alzheimer's disease. Mol Brain 4:3, Duyckaerts 2009, Acta Neuropathol. 2009 Jul;118(1):5-36). У цей час вживаються значні зусилля з розробки ліків від хвороби Альцгеймера, а також інших нейродегенеративних розладів. Наприклад, в 2008 році виконано близько 500 клінічних досліджень ліків від хвороби Альцгеймера. На жаль, проблеми токсичності та неефективності ліків обмежують розробку нових терапевтичних засобів, і в цей час доступне тільки симптоматичне лікування, а лікарські засоби, які модифікують хід захворювання, відсутні. Крім вищезгаданої хвороби Альцгеймера, існують й інші важкі нейродегенеративні захворювання, які також включають порушення зв'язку між нейронами. Таке порушення зв'язку між нейронами необов'язково призводить до когнітивних порушень, але може впливати і на інші функції організму, які регульовані нервовою системою. Приклади таких захворювань включають бічний аміотрофічний склероз (Sica 2011, Arq Neuropsiquiatr. 2011 Aug;69(4):699-706), обмежену передстаречу атрофію головного мозку, кортикобазальну дегенерацію, дегенерацію нервової системи, викликану алкоголем, невизначене дегенеративне захворювання нервової системи, дегенеративний синдром, діабетичну поліневропатію, епілепсію, атаксію Фрідрейха, лобовоскроневу деменцію та паркінсонізм 17 хромосоми, хворобу Хантингтона (Vonsattel 2011, Handb Clin Neurol. 2011;100:83-100), помірні когнітивні порушення, хворобу Піка, некласифіковані дегенеративні захворювання або розлади нервової системи, прогресуючу ізольовану афазію, прогресуючий над'ядерний параліч, некласифіковану сенільну дегенерацію головного мозку, спинально-церебелярну атаксію/дегенерацію, розумову відсталість, ушкодження спинного мозку, безпам'ятність та хворобу Паркінсона (Coskun Biochim Biophys Acta. 2011 Aug 16, Gruber 2011, Postepy Hig Med Dosw (Online). 2011 Aug 19;65:542-51). Повідомлялося, що фітофармацевтичні засоби є ефективними ліками при багатьох захворюваннях. Фітофармацевтичні засоби, наприклад, протягом тривалого часу використовуються як гомеопатичні лікарські засоби. Гомеопатичні лікарські засоби є сильно розведеними препаратами природних інгредієнтів, найчастіше сполук рослинного походження або їх складних сумішей. Фітофармацевтичні засоби на основі Gingko biloba згадувалися як потенційні лікарські засоби для лікування деменції. Однак їх фармацевтична ефективність до цього часу перебуває під питанням. Аналогічним чином, повідомлялося, що лікарські засоби рослинного походження, наприклад, ресвератрол, женьшень й екстракт зеленого чаю є лікарськими засобами для лікування нейродегенеративних розладів. Повідомлялося, що більш складні фітофармацевтичні засоби, наприклад, Vertigoheel®, поліпшують мікроциркуляцію в цілому і, таким чином, можуть бути корисні для поліпшення деяких симптомів, що супроводжують нейродегенеративні захворювання, у гомеопатичному дозуванні (див., наприклад, Issing 2005, J Alter Compl Med 11(1):155-160; Klopp 2005, Microvascular Rev 69:10-16; Weiser 1998, Arch Otolaryngol Head Nech Surg 124: 879-885; Schneider 2005, Arzneim.-Forsch/Drug Res 55(1):23-29); Heinle 2010, Clinical hemorheology and microcirculation 46, 23-25; Wolscher 2001, Biologische Medizin, 30, 184-190; Seeger-Schellerhof 2009, J Integrative Medicine 1:231; Zenner s. Biological Ther. X:281-288, 1992). Проте, все ще існує потреба в додаткових композиціях для ефективного лікування та/або профілактики нейродегенеративних захворювань або розладів. Технічне завдання, що лежить в основі даного винаходу, може розглядатися як забезпечення засобів і способів для задоволення зазначених вище потреб. Дане технічне завдання вирішується за допомогою варіантів реалізації, охарактеризованих у формулі винаходу та нижче в даному документі. Відповідно, даний винахід відноситься до композиції для застосування в лікуванні та/або профілактиці нейродегенеративного розладу або захворювання, причому зазначена композиція містить екстракти Conium maculatum, які одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, Ambra grisea (сірої амбри), які одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, Petroleum rectificatum (Петролеум ректифікатум), які одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї, і Anamirta cocculus, які одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, і при цьому 2 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 композиція містить зазначені екстракти у концентрації щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день. Термін "композиція" у даному документі відноситься до суміші екстрактів із, зокрема, таких біологічних джерел, як рослини, які додатково визначені в інших розділах даного документа. У переважному варіанті зазначена композиція може додатково містити інші інгредієнти або розріджувачі. У переважному варіанті такі додаткові інгредієнти можуть бути стабілізаторами, зволожувачами, фармацевтичними носіями, додатковими фармацевтично активними агентами, регуляторами вивільнення та т.п. Переважні розріджувачі включають воду, спирти, фізіологічні розчини NaСl, буфери, наприклад, фізіологічні розчини з фосфатним буфером, сироп, масло, воду, емульсії, різні типи зволожувачів і т.п. У переважному варіанті даного винаходу запропонована композиція, яка додатково містить щонайменше один фармацевтично прийнятний носій та/або розріджувач. Носій(ї) повинен бути "прийнятним" у сенсі сумісності з іншими інгредієнтами складу та фізіологічно нешкідливим для реципієнта. Фармацевтичний носій, який використовують, може включати тверду речовину, напіврідку речовину (наприклад, гель) або рідину. Прикладами твердих носіїв є лактоза, каолін, сахароза, тальк, желатин, агар, пектин, гуміарабік, стеарат магнію, стеаринова кислота та т.п. Аналогічно, носій або розріджувач може включати матеріал, що забезпечує вповільнене вивільнення, добре відомий у техніці, наприклад, гліцерилмоностеарат або гліцерилдистеарат, окремо або разом із воском. Зазначені придатні носії включають вищезгадані й інші носії, добре відомі в техніці, див., наприклад, Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pennsylvania. Фармацевтично прийнятний розріджувач вибирають таким чином, щоб він не впливав на біологічну активність комбінації. Прикладами таких розріджувачів є дистильована вода, фізіологічний розчин, розчин Рінгера, розчин декстрози і розчин Хенка. Крім того, фармацевтична композиція або склад може також включати інші носії, ад'юванти або нетоксичні, не терапевтичні, не імуногенні стабілізатори і т.п. Композицію слід адаптувати для застосування в лікуванні та/або профілактиці нейродегенеративного захворювання або розладу. Відповідно, слід розуміти, що залежно від бажаного способу введення композицію слід готувати у формі для системного або місцевого застосування. У переважному випадку композицію, описану в даному документі, складають для системного перорального застосування. Однак, залежно від природи і способу дії, композицію можна вводити іншими шляхами, у тому числі внутрішньом'язово, внутрішньочеревинно, підшкірно, перорально або внутрішньовенно. У переважному випадку композиція може бути приготовлена у формі для болюсного введення або для безперервного застосування, як докладно викладено у даному описі. У переважному варіанті композицію за даним винаходом готують у формі лікарського засобу, як докладно викладено у даному описі. Термін "лікування" у даному документі відноситься до будь-якого поліпшення нейродегенеративного захворювання або розладу, яке відбувається в суб'єкта, що одержує лікування, у порівнянні з суб'єктом, що не одержує лікування. Таке поліпшення може являти собою запобігання погіршення або прогресування зазначеного захворювання або розладу. Крім того, таке поліпшення може також бути полегшенням або лікуванням нейродегенеративного захворювання або розладу, або супровідних його симптомів. Слід розуміти, що лікування може не бути успішним у 100 % суб'єктів, яких лікують. У той самий час даний термін вимагає, щоб лікування було успішним у статистично значимої частини суб'єктів (наприклад, когорти у груповому дослідженні). Статистичну значимість частини може легко визначити фахівець, використовуючи різні добре відомі інструменти статистичної оцінки, наприклад, визначення довірчих інтервалів, визначення - значення, t-критерій Стьюдента, критерій Манна-Уітні, однофакторний дисперсійний аналіз апостеріорних тестів, двофакторний дисперсійний аналіз, критерій Уілкоксона тощо. Подробиці містяться у Dowdy and Wearden, Statistics for Research, John Wiley & Sons, New York 1983. Переважні довірчі інтервали становлять щонайменше 90 %, щонайменше 95 %, щонайменше 97 %, щонайменше 98 % або щонайменше 99 %. Значення p переважно становлять 0,05, 0,01, 0,005 або 0,0001. Термін "профілактика" у даному документі відноситься до запобігання виникнення нейродегенеративного захворювання або розладу, описаного у даному документі, або супровідних його синдромів. Слід розуміти, що профілактика відноситься до запобігання прояву нейродегенеративного захворювання або розладу протягом певного часового вікна в майбутньому. Зазначене часове вікно переважно повинно починатися після введення сполуки згідно з винаходом і тривати протягом щонайменше 1 місяця, щонайменше 6 місяців, щонайменше 9 місяців, щонайменше 1 року, щонайменше 2 років, щонайменше 5 років, щонайменше 10 років або навіть протягом фізіологічного життя суб'єкта, що залишилося. Слід розуміти, що профілактика може не бути успішною в 100 % суб'єктів, які підлягають 3 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 профілактичному лікуванню. У той самий час даний термін вимагає, щоб профілактика була успішною в статистично значимої частини суб'єктів (наприклад, когорти у груповому дослідженні). Статистичну значимість частини може легко визначити фахівець, використовуючи різні добре відомі інструменти статистичної оцінки, також докладно обговорювані в даному документі. Термін "нейродегенеративне захворювання або розлад" у даному документі відноситься до будь-якого захворювання або розладу, викликаного порушенням росту нейронів, загибеллю нейронів у результаті апоптозу, інтоксикації або некрозу, або порушенням функції нейронів через дефекти дендритів або аксонів. У переважному варіанті зазначений нейродегенеративний розлад або захворювання асоційоване з когнітивними порушеннями. У більш переважному варіанті зазначені когнітивні порушення запобігають або полегшують за допомогою композиції згідно з даним винаходом. У переважному варіанті ріст нейронів підсилюється в результаті введення композиції. Відповідно, переважні нейродегенеративні захворювання або розлади відповідно до даного винаходу, являють собою хворобу Альцгеймера, амнезію, дефіцит навченості та пам'яті, бічний аміотрофічний склероз, обмежену передстаречу атрофію головного мозку, кортикобазальну дегенерацію, дегенерацію нервової системи, викликану алкоголем, неспецифічне дегенеративне захворювання нервової системи, дегенеративний синдром, діабетичну поліневропатію, епілепсію, атаксію Фрідрейха, лобово-скроневу деменцію та паркінсонізм 17 хромосоми, хворобу Хантингтона, помірні когнітивні порушення, хворобу Піка, некласифіковані дегенеративні захворювання або розлади нервової системи, прогресуючу ізольовану афазію, прогресуючий над'ядерний параліч, некласифіковану сенільну дегенерацію головного мозку, спинально-церебелярну атаксію/дегенерацію, розумову відсталість, ушкодження спинного мозку, безпам'ятність та хворобу Паркінсона. Симптоми, що супроводжують вищевказані захворювання та розлади, добре відомі фахівцям і докладніше описані в стандартних підручниках з медицини, наприклад, Stedman або Pschyrembl. У конкретному переважному варіанті реалізації композиції згідно з винаходом зазначена композиція призначена для застосування в лікуванні та/або профілактиці хвороби Альцгеймера як нейродегенеративного захворювання або розладу. Хвороба Альцгеймера, як відомо, супроводжується неправильним процесингом білка-попередника бета-амілоїду (APP). У переважному варіанті процесинг білка-попередника бета-амілоїду (APP), що супроводжує хворобу Альцгеймера, знижується при введенні композиції згідно з даним винаходом. Рослини, що згадуються у зв'язку з даним винаходом, тобто Conium maculatum і Anamirta cocculus, добре відомі фахівцю області й охарактеризовані з ботанічної точки зору. Відповідно, зазначені рослини, які використовуються як вихідний матеріал для одержання композиції відповідно до даного винаходу, можна ідентифікувати, культивувати і/або зібрати без зайвих утруднень. Зокрема, дані рослини, переважно, одержують шляхом вирощування сіянців, що розвиваються, у теплиці при стандартній вологості, температурі й освітленості, культивування зазначених рослин протягом певного періоду часу, достатнього для забезпечення наробітку вторинних метаболітів рослин, і збору рослин або їх частин, необхідних для процесу екстракції, описаного в даному документі. Conium maculatum (боліголов плямистий) для застосування у виготовленні композиції відповідно до винаходу являє собою спиртовий екстракт, який одержують у відповідності зі способом 2а Німецької гомеопатичної фармакопеї. Здійснення способу 2а відповідно до Німецької гомеопатичної фармакопеї добре відоме в техніці. У переважному варіанті екстракт Conium macculatum для застосування в композиції згідно з даним винаходом одержують у такий спосіб: матричну настойку одержують зі свіжої трави Conium maculatum, що містить менше 70 % віджатого соку та більше 60 % вологи (втрата під час сушіння) і не містить ефірного масла або смоли. Придатний сирий рослинний матеріал потім подрібнюють при 105 °C протягом 2 годин в ексикаторі. Подрібнений рослинний матеріал змішують з кількістю етанолу (90 % об/об), що становить не менше половини маси рослинного матеріалу. Точну кількість етанолу, що додається, необхідно розраховувати згідно з наступною формулою: маса сирого рослинного матеріалу (кг), помножена на відсоток втрати при сушінні (який можна визначити шляхом аналізу втрат у процесі сушіння зразка рослинного матеріалу), розділена на 100. Потім суміш зберігають у закритих контейнерах при кімнатній температурі (не більше 20 °C) протягом щонайменше 10 днів із періодичним перемішуванням шляхом розкручування. Потім суміш віджимають та фільтрують отриману рідину. Фільтрат доводять етанолом (50 % об/об). Кількість етанолу для згаданого доведення розраховують у такий спосіб: масу фільтрату (кг) множать на [процентну частку сухого залишку або процентний вміст фільтрату, отриманий при аналізі, мінус процентна частка сухого залишку або вміст, отриманий при аналізі, необхідний відповідно до 4 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 монографії] і ділять на процентну частку сухого залишку або вміст, отриманий при аналізі, необхідний відповідно до монографії. Відрегульовану суміш залишають при кімнатній температурі (не більше 20 °C) не менше ніж на 5 днів і можливо знову фільтрують з одержанням матричної настойки. D-розведення матричної настойки можна одержати шляхом застосування наступної схеми розведення: 2 частини матричної настойки змішують з 8 частинами етанолу (50 % об/об), одержуючи розведення D1. 1 частину розведення D1 змішують з 9 частинами етанолу (50 % об/об) для одержання розведення D2. У переважному варіанті екстракт Conium macculatum для застосування в композиції згідно з винаходом характеризують за аналітичними параметрами, наведеними у відповідній монографії. Екстракт Conium macculatum переважно представлений у вигляді матричної настойки або розведення D2. Вищезгаданий екстракт Conium macculatum включають до складу композиції згідно з винаходом переважно у вигляді розведення D3 і в кількості 10 % (мас/мас). Anamirta cocculus для застосування у виготовленні композиції відповідно до винаходу являє собою спиртовий екстракт, який одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї. Здійснення способу відповідно до Німецької гомеопатичної фармакопеї добре відоме в техніці. У переважному варіанті екстракт Anamirta cocculus для застосування відповідно до композиції згідно з даним винаходом одержують у такий спосіб: сирий рослинний матеріал подрібнюють та додають 10 частин етанолу (90 % об/об) на 1 частину висушеного рослинного матеріалу. Потім суміш зберігають у закритих контейнерах при кімнатній температурі (не більше 20 °C) протягом достатнього часу. Залишки відокремлюють від етанолу та пресують. Дві рідини, які отримані таким чином, поєднують у вигляді мацерату. Для перколяції суміш одержують, як описано вище, та зберігають у закритих контейнерах при кімнатній температурі (не більше 20 °C) протягом достатнього часу. Суміш переносять у перколятор, і дозволяють перколяту повільно стікати при кімнатній температурі таким чином, що рослинний матеріал завжди покритий етанолом, який залишився. Залишок можна спресувати, а віджату рідину об'єднати з перколятом. Перколят і мацерат поєднують та доводять етанолом (90 % об/об). Кількість етанолу відповідної концентрації для доведення розраховують згідно з наступною формулою: масу перколяту або мацерату (кг) множать на [процентну частку сухого залишку або процентний вміст перколяту або мацерату, отриманий при аналізі, мінус процентна частка сухого залишку або вміст, отриманий при аналізі, необхідний відповідно до монографії] і ділять на процентну частку сухого залишку або вміст, отриманий при аналізі, необхідний відповідно до монографії. Отримана відрегульована суміш перколяту і мацерату є материнською тинктурою, яка також відповідає розведенню D1. Розведення D2 можна одержати шляхом змішування 1 частини матричної настойки/розведення D1 з 9 частинами етанолу відповідної концентрації. У переважному варіанті екстракт Anamirta cocculus для застосування в композиції згідно з винаходом характеризують аналітичними параметрами, наведеними у відповідній монографії. Екстракт Anamirta cocculus переважно представлений у вигляді матричної настойки або розведення D3. Вищезгаданий екстракт Anamirta cocculus включають до складу композиції згідно з винаходом переважно у вигляді розведення D4 у кількості 70 % (мас/мас). Petroleum rectificatum (петролеум ректифікатум), який одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї, являє собою очищену фракцію нафтопродуктів, отриману з сирої нафти шляхом послідовної дистиляції, яку називають ректифікацією. Одержання petroleum rectificatum добре відоме в техніці й описане у вищезгаданій монографії "Petroleum rectificatum". Послідовні Dрозведення можна одержати у такий спосіб: розведення D1 одержують шляхом змішування 1 частини petroleum rectificatum з 9 частинами (90 % об/об) етанолу. Одну частину розведення D1 потім змішують з 9 частинами етанолу (50 % об/об) для одержання розведення D2. Наступні розведення, наприклад, розведення D3–D7, можна одержати, як описано для розведення D2, у кожному випадку використовуючи попереднє розведення як вихідний матеріал. У переважному варіанті petroleum rectificatum для застосування в композиції згідно з даним винаходом характеризують аналітичними параметрами, наведеними у відповідній монографії. Petroleum rectificatum переважно використовують у розведенні D8. Petroleum rectificatum включають до складу композиції згідно з винаходом у кількості приблизно 10 % (мас/мас). Ambra grisea (Сіра амбра), яку одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, являє собою речовину, що знаходиться в кишечнику кашалота. Одержання сірої амбри добре відоме в техніці й описане у вищезгаданій монографії "Ambra grisea". Зокрема, 10 частин подрібненого матеріалу амбри змішують з 100 частинами безводного етанолу і нагрівають суміш до кипіння протягом 1 години зі зворотним холодильником. Після охолодження суміші її фільтрують, одержуючи матричну настойку, яка 5 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 також відповідає розведенню D1. Послідовні розведення D2–D4 можна одержати шляхом змішування 1 частини матричної настойки або попереднього розведення з 9 частинами етанолу (90 % об/об). З розведення D5 і далі 1 частину попереднього розведення змішують з 9 частинами етанолу (50 % об/об). У переважному варіанті сіру амбру для застосування в композиції згідно з даним винаходом характеризують аналітичними параметрами, наведеними у відповідній монографії. Сіру амбру переважно використовують у розведенні D6. Сіру амбру включають до складу композиції згідно з винаходом переважно в кількості приблизно 10 % (мас/мас). Переважно композицію для застосування відповідно до даного винаходу одержують шляхом змішування вищезгаданих інгредієнтів у такий спосіб: для 100 г рідкої композиції змішують 10 г сірої амбри в розведенні D6 з 70 г Anamirta cocculus у розведенні D4, 10 г Conium maculatum у розведенні D3, і 10 г petroleum rectificatum у розведенні D8. Таку композицію можна застосовувати для лікування та/або профілактики нейродегенеративного захворювання згідно з даним винаходом. У більш переважному варіанті зазначену композицію Vertigoheel® застосовують у надвисоких дозах, тобто дозах, щонайменше приблизно в 60-130 разів, переважно щонайменше в 64 рази або щонайменше в 127 разів перевищуючих рекомендоване дозування сучасних гомеопатичних варіантів їх застосування. Композицію варто готувати і/або застосовувати або вводити, забезпечуючи дозування екстрактів щонайменше приблизно 1 мл/кг маси тіла суб'єкта на добу, переважно, дозування щонайменше від 1 мл/кг маси тіла на добу до приблизно 2 мл/кг маси тіла на добу. У переважному варіанті вищезгадане дозування може бути доставлене шляхом однократного введення (болюсного) або досягатися за рахунок більше ніж одного етапів уведення на добу. Більше того, передбачається також, що зазначене дозування переважно забезпечують за допомогою пристроїв для безперервного вивільнення, які забезпечують безперервне введення дозування протягом доби. Правильне складання композиції з метою забезпечення зазначеного щодобового дозування добре відоме в техніці. Наприклад, композиції, що забезпечують низьке дозування, які містять інгредієнти композиції згідно з даним винаходом і, переважно, комерційно доступну композицію Vertigoheel®, можна вводити неодноразово та, таким чином, одержувати необхідне дозування. Як альтернатива, можна представити композицію, збагачену окремими інгредієнтами. Така композиція у переважному випадку забезпечує дозування за рахунок однократного болюсного введення. У переважному варіанті композицію, що забезпечує високе дозування за рахунок однократного болюса, можна одержати шляхом збільшення кількостей, зазначених вище для композиції з низькою дозою для багаторазового введення, щонайменше приблизно в 60-130 разів, переважно щонайменше в 64 рази або щонайменше в 127 разів. Як обговорювалося раніше, композиція згідно з даним винаходом також може включати додаткові інгредієнти, наприклад, фармацевтично активні інгредієнти. Такі додаткові інгредієнти можуть міститися в самій композиції, тобто бути компонентом суміші, або можуть бути представлені для комбінованого застосування у вигляді фізично окремого елемента так, що композиція для лікування та/або запобігання нейродегенеративного захворювання або розладу фактично утворюється в процесі об'єднаного введення в організмі суб'єкта. Переважні додаткові інгредієнти являють собою сполуки або композиції, які в цей час застосовуються в терапії або профілактиці вищезгаданих нейродегенеративних захворювань або розладів. Зокрема, наступні класи фармацевтичних інгредієнтів: інгібітори ацетилхолінестерази, антагоністи NMDA, інгібітори ангіотензин-перетворюючого ферменту (АПФ), ФНО-альфа, попередники дофаміну, агоністи дофаміну, інгібітори МАО або хімічні сполуки рослинного походження, що мають нейропротективну активність. У переважному варіанті композиції згідно з даним винаходом містять щонайменше один фармацевтично активний інгредієнт, вибраний з групи, яка складається з: донепезилу, ривастигміну, галантаміну, такрину, мемантину, каптоприлу, етанерцепту, Gingko biloba, вітаміну В12, ресвератролу, женьшеню, екстракту зеленого чаю, вітаміну Е, леводопи, праміпексолу дигідрохлориду моногідрату і разагіліну. У дослідженнях, які лежать в основі даного винаходу, було виявлено, що композицію, яка містить вищевказані інгредієнти, можна застосовувати у певному дозуванні для ефективного та поліпшеного лікування вищевказаних нейродегенеративних захворювань. Зокрема, дана композиція, очевидно, добре підходить для лікування хвороби Альцгеймера. Хоча застосування композицій, які містять інгредієнти відповідно до даного винаходу, вже відомі в техніці в рамках їх застосування в низьких дозах у гомеопатії (наприклад, Vertigoheel®), зненацька було виявлено, що на відміну від концепції розведень, яка використовується в гомеопатичних підходах, значне збільшення кількості інгредієнтів, що вводяться суб'єкту, призводить до ефективного лікування та/або профілактики нейродегенеративних захворювань. Зокрема, ефективне дозування відповідно до даного винаходу приблизно в 64–127 разів перевищувало 6 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 дозування, яке використовували в гомеопатії, тобто було надвисоким дозуванням. Крім того, встановлено, що в таких високих дозах дана композиція ефективно та прямо стимулює ріст нейронів і, таким чином, відновлює функції нейронів при нейродегенеративних захворюваннях або розладах. Крім того, даний позитивний ефект також можна використовувати в зовні здорових суб'єктів для поліпшення навченості та пам'яті. Таким чином, даний винахід додатково відноситься до композиції для застосування у поліпшенні навченості та пам'яті, причому зазначена композиція є композицією, що містить екстракти Conium maculatum (боліголов плямистий), який одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, Ambra grisea (сіра амбра), який одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, petroleum rectificatum (петролеум ректифікатум), який одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї, й "Anamirta cocculus", який одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, і композиція містить зазначені екстракти у дозуванні, яке рівне щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день. Термін "навченість та пам'ять" у даному документі відноситься до здатності суб'єкта аналізувати і розуміти певний контекст (навченість) або зберігати і запам'ятовувати певну інформацію (пам'ять). Навченість, як вона розуміється в даному документі, можна поліпшити за рахунок здатності суб'єкта більш ефективно аналізувати і розуміти певний контекст або розуміти й аналізувати контекст швидше. Пам'ять можна поліпшити за рахунок здатності суб'єкта зберігати і пам'ятати інформацію або шляхом запобігання природного забування. У переважному випадку з метою поліпшення навченості та пам'яті згідно з даним винаходом при введенні композиції знижується природне забування. У переважному варіанті зазначені навченість та пам'ять також поліпшуються згідно з винаходом у суб'єкта, що є зовні здоровішим, щонайменше, у відношенні нейродегенеративних захворювань або розладів. Даний винахід, крім того, відноситься до лікарського засобу, який містить композицію, що містить екстракти Conium maculatum, які одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, Ambra grisea, які одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, petroleum rectificatum, які одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї, й Anamirta cocculus, які одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, і при цьому композиція містить зазначені екстракти у дозуванні, яке рівне щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день. Термін "лікарський засіб" у даному документі відноситься до фармацевтичної композиції, яка містить вищевказані інгредієнти у терапевтично ефективній дозі, зазначеній в даному документі, та, переважно, щонайменше один фармацевтично прийнятний носій та/або розріджувач. Лікарський засіб може бути виготовлений у формі для різних шляхів уведення, як докладно викладено в даному описі. Терапевтично ефективна доза відноситься до кількостей інгредієнтів, які використовують для виготовлення лікарського засобу, що запобігає, полегшує або лікує захворювання або розлад, який згадується в даному документі, або щонайменше симптоми, які супроводжують зазначені захворювання або розлади. Терапевтичну ефективність та токсичність сполуки можна визначити з використанням стандартних фармацевтичних процедур на культурах клітин або експериментальних тварин, наприклад, ED50 (дози, терапевтично ефективної для 50 % особин популяції) і LD50 (дози, смертельної для 50 % особин популяції). Співвідношення доз, які виявляють терапевтичну і токсичну дію, являє собою терапевтичний індекс і може виражатися у вигляді відношення LD50/ED50. Схему приймання може визначити лікар із урахуванням інших клінічних факторів. Як відомо в області медицини, дозування для кожного пацієнта залежать від багатьох факторів, включаючи розміри пацієнта, площу поверхні тіла, вік, конкретну сполуку, яку вводять, стать, час і шлях введення, загальний стан здоров'я й інші препарати, що одночасно вводяться. Прогрес можна відслідковувати шляхом періодичних оцінок. Конкретні дозування, зазначені в даному описі, розраховані для суб'єкта середніх років і середньої маси (приблизно 70 кг). Конкретні лікарські засоби на основі композиції згідно з винаходом одержують способом, добре відомим у фармацевтиці, вони містять активні інгредієнти, зазначені вище в даному описі, змішані або іншим способом об'єднані з щонайменше одним фармацевтично прийнятним носієм або розріджувачем. Для виготовлення зазначених конкретних лікарських засобів активні інгредієнти зазвичай змішують та, можливо, поєднують з носієм або розріджувачем. Отримані склади слід адаптувати до способу введення. Процедури приготування лікарського засобу, 7 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 зазначені в даному документі, можуть включати в міру необхідності змішування, гранулювання, пресування або розчинення інгредієнтів для утворення бажаної композиції. Слід прийняти до уваги, що форма та характер фармацевтично прийнятного носія або розріджувача визначається кількістю активного інгредієнта, з яким його поєднують, шляхом уведення, а також іншими добре відомими факторами. Рекомендації з дозування слід указати в інструкціях для медпрацівників або користувачів із метою планування коректування дози залежно від передбачуваного реципієнта. Нарешті, варто розуміти, що приготування композиції відповідно до винаходу, яку використовують як лікарський засіб відбувається, переважно, у стандартних умовах GMP і т.п. для забезпечення якості, фармацевтичної безпеки й ефективності лікарського засобу. Таким чином, даний винахід відноситься до способу виготовлення лікарського засобу, переважно для застосування в лікуванні та/або профілактиці нейродегенеративного розладу або захворювання, який включає етапи: (a) одержання композиції, що містить екстракти Conium maculatum (боліголов плямистий), які одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, Ambra grisea (сіра амбра), які одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, Petroleum rectificatum (петролеум ректифікатум), які одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї, й Anamirta cocculus (Анамірта кокулюсоподібна), які одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, при цьому композиція містить зазначені екстракти у дозуванні, яке рівне щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день; і (b) складання зазначеної композиції у формі лікарського засобу фармацевтично прийнятним способом. Способи виготовлення вищезгаданих екстрактів Conium maculatum, Ambra grisea, petroleum rectificatum або Anamirta cocculus згідно з відповідними монографіями докладно викладені в даному документі. Крім того, описані способи приготування композиції як лікарського засобу з метою забезпечення передбаченого вище дозування. Нарешті, даний винахід відноситься до способу лікування та/або профілактики нейродегенеративного розладу або захворювання в страждаючого ним суб'єкта, причому зазначений спосіб включає введення зазначеному суб'єкту терапевтично ефективної кількості композиції, що містить екстракти Conium maculatum, які одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, з Ambra grisea, які одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, petroleum rectificatum, які одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї, й "Anamirta cocculus", які одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, і композиція містить зазначені екстракти у дозуванні щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день. Способи введення вищезгаданої композиції докладно описані в даному документі. Крім того, фахівець у техніці знає, як забезпечити терапевтично ефективну кількість у придатній формі для даного способу. Докладна інформація з даної теми міститься в даному описі. Всі цитовані тут джерела включені в даний документ за допомогою посилань відносно конкретного змісту розкриття, що згадується, а також у всій їхній повноті. Фігури Фігура 1: Дані показують дозо- і часозалежний вплив Vertigoheel® на частоту електричної активності головного мозку пацюків, визначений шляхом вимірювання ЕЕГ Фігура 2: Запис активності нейронів після однократного стимулу (SS) і тета-імпульсної стимуляції (TBS) після обробки Vertigoheel®. Фігура 3: Активність нейронів під дією Vertigoheel® (1 мл) у присутності декількох антагоністів глутамату. Фігура 4: Кількісний аналіз росту нейронів PHN після інкубування з Vertigoheel® (розведення 1:3, однократна обробка). ** P < 0,01, *** P < 0,001 у порівнянні з фізіологічним розчином Saline Heel. Фігура 5: Рівні sAPP-α після обробки Vertigoheel® у клітинній лінії нейробластоми SHSY-5Y. * P < 0,05, **P < 0,01, *** P < 0,001 у порівнянні з фізіологічним розчином Saline Heel. Фігура 6: Рівні sAPP-β після обробки Vertigoheel® у клітинній лінії нейробластоми SHSY-5Y. * P < 0,05, **P < 0,01, *** P < 0,001 у порівнянні з фізіологічним розчином Saline Heel. Фігура 7: Вплив Vertigoheel® на нюхову пам'ять вимірювали в тесті соціальної передачі харчових переваг, * Р < 0,05, *** р < 0,001 у порівнянні з відповідною їжею-подразником. 8UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фігура 8: Формування контекстного страху - вплив Vertigoheel® на пам'ять про подразник. Фігура 9: Вплив Vertigoheel® на довгострокову пам'ять вимірювали за допомогою тесту пасивного уникнення, * Р < 0,05 у порівнянні з відповідною контрольною групою. Фігура 10: Вплив Vertigoheel® на природнє забування (час на дослідження нового об'єкта) у завданні розпізнавання нового об'єкта * Р < 0,05 у порівнянні з 24-год. групою. Фігура 11: Вплив Vertigoheel® на природнє забування (кількість контактів із новим об'єктом) у завданні розпізнавання нового об'єкта * Р < 0,05 у порівнянні з 24-год. групою. Фігура 12: Вплив Vertigoheel® на короткочасну пам'ять у мишей з недостатністю пізнавальних функцій за допомогою тесту T-лабіринту, * p < 0,001 у порівнянні з групою з дефектом пізнавальних функцій. Приклади Приклад 1: Дослідження телеЕЕГ - вплив Vertigoheel® на криву ЕЕГ у пацюків Завдання полягало у вивченні характеристик Vertigoheel® з використанням електрофармакограмм на основі електроенцефалографії (ЕЕГ) у пацюків, що вільно пересуваються, і порівняння картини ЕЕГ з ЕЕГ під дією ряду лікарських засобів, що впливають на центральну нервову систему, вже протестованих у цій системі. Певні потенціали поля містять інформацію про більші локальні мережі електрично активних нейронів, відбиваючи взаємодію лікарських засобів із їхніми мішенями при погодженій передачі нервових імпульсів. Дана методика дає уявлення про профіль фармакологічної часо- і дозозалежної дії різних препаратів як окремо, так і при порівнянні один із одним. В обох серіях експериментів використовували перехресне дослідження з щонайменше 1тижневим періодом вимивання між уведеннями. Vertigoheel®, який складається з 4 природних інгредієнтів і фізіологічного розчину NaСl, використовували як контрольне лікування. Протестували три дозування обох препаратів: Vertigoheel® уводили по 0,5, 1,0 і 2,0 мл/кг внутрішньочеревинно. Застосовувані дозування були надвисокими дозуваннями, щонайменше приблизно в 32, 64 або 127 разів перевищуючи дозування, які застосовували в гомеопатичних варіантах застосування композиції Vertigoheel® для людей. Після 45-хвилинного періоду до введення дози для запису вихідного рівня спостерігали вплив препаратів безупинно протягом 245 хвилин, розділених на 15-хвилинні періоди, починаючи через 5 хвилин після внутрішньочеревинного введення. Зміни електричної потужності (мкВ2) виражали у відсотках від абсолютних значень спектральної потужності, зареєстрованих протягом 45 хвилин перед уведенням дози у межах кожного діапазону частот. Дані усереднювали на підставі записів для тварин у конкретний день експерименту. Дані виражали як середні значення по 10-11 тваринам для кожної з 2 послідовних серій експериментів. Двадцяти двом дорослим пацюкам Fisher (у віці 6-8 місяців, що втримувалися щонайменше протягом 2 місяців при зверненому циклі день-ніч: 12/12 год., починаючи з 6:00; придбаним в Charles River Laboratories) імплантували 4 біполярних концентричних сталевих електроди з використанням стереотаксичної хірургічної процедури. Усі чотири електроди поміщали на 3 мм латеральніше в межах лівої півкулі. Дорсовентральні координати становили 4,0, 6,0, 4,2 і 8,0 мм, а антеріальні координати становили 3,7, 9,7, 5,7 і 12,2 мм для фронтальної кори, смугастого тіла, гіпокампу і ретикулярної формації, відповідно (за даними атласу Paxinos). Заздалегідь сконструйовану базову плату, що несе 4 біполярних напівмікроелектрода з нержавіючої сталі (неврологічні електроди "SNF 100"; Rhodes Medical Instruments, Inc, Саммерленд, штат Каліфорнія, США) і 5-контактний роз'єм, фіксували на черепі зубним цементом, взаємодіючим із 3 сталевими гвинтами, розташованими на деякій відстані в кості. Віддалений записуючий елемент електрода був активним електродом, а проксимальні кругові елементи 4 електродів були з'єднані один із одним, утворюючи загальний електрод порівняння. Ретикулярну формацію вибрали, оскільки вона містить джерело дофамінергічної передачі (вентральну область покришки). З ним з'єднані нігростріальний (до смугастого тіла), мезолімбічний (до гіпокампу) та мезокортикальний (до лобової кори) шляхи. Роз'єм для передавача фіксували на базовій платі (маса 5,2 г [з акумулятором]; розмір 26 × 12 × 6 мм). Під час запису пацюки могли вільно пересуватися, не одержуючи їжі (жування генерувало б занадто багато артефактів). Експерименти почали в 6:30 у темряві під час активної фази тварин. Тваринам дозволили відновитися після процедури протягом 2 тижнів. Після цього включали передавач для адаптації та проведення контрольних експериментів із фізіологічним розчином. Принципи лабораторного догляду за тваринами дотримували у всіх випробуваннях, і місцеві органи, відповідальні за догляд за тваринами, дозволили дане дослідження відповідно до керівних принципів охорони здоров'я Німеччини. Сигнали ЕЕГ записували від лобової кори, гіпокампу, смугастого тіла та ретикулярної формації в кімнаті, яка повністю екранована мідним екраном. Сигнали передавали за 9 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 допомогою бездротового зв'язку радіотелеметричною системою (Rhema Labortechnik, Хофхайм, Німеччина), з використанням 40 МГц як несуча частота, підсилювали й обробляли, як описано вище, одержуючи спектри потужності з дозволом 0,25 Гц, згідно Dimpfel і Suter. Коротенько, після автоматичного артефакту, сигнали відторгнення реєстрували з інтервалом в 4 секунди і трансформували, використовуючи методику швидкого перетворення Фур'є. Частота реєстрації становила 512 Гц. Чотири значення усереднювали, одержуючи остаточну частоту реєстрації 128 Гц, що значно вище частоти Найквіста. Отримані спектри електричної потужності ділили на 6 спеціально заданих частотних діапазонів: дельта, 0,80-4,50 Гц; тета, 4,75-6,75 Гц; альфа1, 7,00-9,50 Гц; альфа2, 9,75-12,50 Гц; бета1, 12,75-18,50 Гц; і бета 2, 18,75-35,00 Гц. В усіх більш ранніх дослідженнях було виявлено, що зазначені частотні діапазони мінялися незалежно один від одного. Спектри усереднювали за 3-хвилинними інтервалами і відображали в режимі онлайн. В офф-лайн процедурі спектри усереднювали, одержуючи 30-хвилинні або більш тривалі періоди для подальшого аналізу і надавання даних. У межах цих більш тривалих періодів усереднювали короткострокові коливання змін, підкреслюючи фармакологічні ефекти. Цей тип змін польового потенціалу в присутності лікарських засобів порівнювали з вихідним рівнем і називали електрофармакограммою. Тваринну модель "теле-стерео-ЕЕГ", яка складається з безперервного запису внутрішньомозкових польових потенціалів, використовували в комбінації зі системою відеоспостереження для виявлення змін рухомості (GJB Datentechnik Gmbh, Лангевізен, Німеччина). Дана система розпізнавала пересування та стереотипну поведінку, відслідковуючи відмінність у контрастності чорного передавача на голові тварини у порівнянні з навколишнім середовищем. Валідацію системи виконували у попередньому дослідженні з використанням різних дозувань кофеїну. Значення розраховували у відсотках від вихідного рівня. Зазначені значення логарифмічно перетворювали для досягнення нормального багатомірного розподілу і виконання передумов для статистичного аналізу. Розрахунок складався з визначення статистичної значимості для кожної смуги частот у межах кожної області мозку окремо для полегшення інтерпретації стосовно взаємодії з рецепторами нейромедіатора. У ході аналізу завжди порівнювали кожний період із аналогічним періодом змін після введення фізіологічного розчину. Статистичні показники розраховували відповідно до тесту Уілкоксона (Манна-Уітні) та дискримінантним аналізом. При цій математичній процедурі препарати з аналогічними клінічними показаннями групували разом у просторі, що відповідає результатам перших 3 дискримінантних функцій, які проеціюються у простір x-y-z. По-перше, 3-мірний простір свідчив про схожість або несхожість дії лікарських засобів. По-друге, близькі кольори вказували на аналогічний механізм дії. Результати наступних 3 дискримінантних функцій кодували згідно адитивної колірної суміші червоного (четверта функція), зеленого (п'ята функція) та синього (шоста функція), яку використовували для реєстрації додаткових невеликих відмінностей між дією лікарських речовин (відомий спосіб формування телевізійних зображень). Положення та колір еталонних сполук із відомими клінічними показаннями перераховані на фігурі разом із дозуванням і часом запису. Близьке сусідство та близькі кольори вказували на подібність дії. Згідно зі зазначеною системою, контрольні сполуки можна групувати за змінами активності, специфічними стосовно показань, і в кластери з відомим клінічним застосуванням. Результати Вплив фізіологічного розчину: через 4 години після введення фізіологічного розчину, що слідує за 45-хвилинною реєстрацією вихідного рівня, не виявляли істотних змін спектральної потужності в межах 4 областей мозку. Вплив Vertigoheel® (надвисоке дозування): на першому етапі визначили вплив Vertigoheel® на електричну потужність. Vertigoheel® демонстрував дозо- і часозалежну дію на ККД нейронної мережі в 4 оцінюваних областях головного мозку. Протягом першої години найбільш виражений вплив на зміну спектральної частоти вимірювали після обробки Vertigoheel® у дозуванні 1 і 2 мл/кг. У присутності 1 мл Vertigoheel® альфа2- і дельта-частоти значно знижувалися в лобовій корі, гіпокампі та смугастому тілі протягом першої години вимірювання. У гіпокампі значно послаблялися бета1-хвилі, а в лобовій корі - бета1- і тета-хвилі. У ході експерименту вплив 1 мг Vertigoheel® зник. Уведення максимальної дози 2,0 мл/кг призвело до сильних змін смуг спектральної частоти, в основному в гіпокампі, лобовій корі та ретикулярній формації. Дельта-, тета-, альфа- і бета-хвилі значно знизилися. У смугастому тілі спостерігали менш виражений вплив на ККД нейронної мережі. Мінімальна доза Vertigoheel®, 0,5 мг/кг, не демонструвала значних змін. Дані показують дозо- і часозалежну дію Vertigoheel® на частоту електричної активності (Фіг. 1). 10 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дискримінантний аналіз електрофармакограмм: дані Vertigoheel® проектували в 3-мірні координати відповідно до змін частоти на ЕЕГ. Еталонні ліки, які вводяться внутрішньочеревинно, аналізували протягом першої напівгодини після введення. Препарат Vertigoheel®, який вводили внутрішньочеревинно, аналізували протягом 5-65 хвилин після введення. Vertigoheel® представляли у вигляді 1 дозування – 1 мл/кг. Положення Vertigoheel® було близьким до лікарських засобів, які поліпшують пізнавальні здатності, й анальгетиків, наприклад, метанікотину та трамадолу; і до ліків проти хвороби Паркінсона, наприклад, разагіліну та селегіліну. Це вказує на дію даного лікарського засобу, аналогічну дії вищезгаданих медикаментів. Такий підхід забезпечив докази того, що Vertigoheel® у надвисокому дозуванні безпосередньо впливав на ЦНС. Можна показати, що Vertigoheel® демонстрував часо- і дозозалежну дію та головним чином впливав на лобову кору і гіпокамп, одну з ключових областей мозку для обробки і зберігання інформації, що поступає (= навченості). Подальше порівняння Vertigoheel® з іншими фармакологічними лікарськими засобами виявило подібність даного медикаменту з лікарськими засобами, які поліпшують пізнавальні здатності, й анальгетиками, наприклад, метанікотином і трамадолом; і з ліками проти хвороби Паркінсона, наприклад, разагіліном і селегіліном. Це було першим науковим свідченням того, що Vertigoheel® впливає на важливі області головного мозку, які беруть участь у когнітивних функціях. Приклад 2: Одержання зрізів гіпокампу: дія Vertigoheel® на активність нейронів у гіпокампі У першому експерименті (ТелеЕЕГ) продемонстрували, що Vertigoheel® впливав на активність нейронів і на електричні частоти у гіпокампі, за допомогою вимірів електроенцефалограми. Для одержання додаткових знань про можливу безпосередню мішень Vertigoheel® одержували нейрофізіологічні записи зі зрізів гіпокампу in vitro. Вплив Vertigoheel® на локальну синаптичну схему й активацію нейронів, а також на різні типи рецепторів глутамату в даній області, значимій для пізнавальних здатностей, досліджували за допомогою зазначеної системи ex vivo. Зрізи гіпокампу одержували з 47 дорослих самців пацюків Sprague-Dawlay (Charles River Wiga, Зульцбах, Німеччина). Пацюків утримували при зверненому циклі день/ніч протягом 2 тижнів до експериментів для запису активності зрізів in vitro під час активної фази їх циркадного ритму. Тварин знекровлювали під ефірним наркозом, цілком видаляли головний мозок і виділяли формацію гіпокампу під стереомікроскопом. Використовували чотири-п'ять зрізів від кожної тварини. Середню частину гіпокампу встановлювали на столику вібраційного мікротома (Rhema Labortechnik, Хофхайм, Німеччина) за допомогою ціанакрилатного клею, занурювали в охолоджений фізіологічний розчин із бікарбонатним буфером (штучну цереброспінальну рідину (ШЦСР): NaCl: 124 мМ, KCl: 5 мМ, NaH2PO4: 1,25 мМ; CaCl2: 2 мМ, MgSO4: 2 мМ, NaHCO3: 26 мМ, глюкоза: 10 мМ, і нарізали зрізами товщиною 400 мкм. Осмолярність ШЦСР становила 260270 мОсмоль/л (осмолярність плазми становить 288+/-5). Перед використанням усі зрізи попередньо інкубували у ШЦСР, яка насичена карбогеном (pH 7,4) у передкамері протягом щонайменше 1 год. У ході експерименту зрізи тримали й обробляли у спеціальній зрошуваній камері (List Electronics, Дармштадт, Німеччина) при 35 °C. Використовували чотири зрізи від одного пацюка на день в одному з варіантів умов тестування (контроль або різні концентрації тестованого препарату). Препарат зрошували штучною спинномозковою рідиною (ШЦСР) зі швидкістю 180230 мл/год. Електричну стимуляцію (імпульси постійного струму 200 мкА з шириною імпульсу 200 мкс) колатералей Шеффера в області CA2 і запис позаклітинних польових потенціалів від шару пірамідних клітин СА1 виконували відповідно до звичайних електрофізіологічних способів, використовуючи комп'ютерну систему "Labteam" і програмний пакет "Neurotool" (Medisyst Gmbh, Лінден, Німеччина). Вимірювання проводили з 10-хвилинними інтервалами для усунення потенціювання. Чотири стимуляції – через кожні 20 сек – усереднювали для кожної часової точки. Після одержання стабільних відповідей на одиночні подразники (SS) індукували довгострокове потенціювання шляхом стимуляції тета-імпульсами. Середню амплітуду трьох сигналів, які реєструються через кожні 20 секунд, усереднювали, одержуючи середні значення абсолютної напруги (у мікровольтах) (стандартна помилка середнього значення для кожного варіанта умов експерименту (однократного стимулу або тета-імпульсної стимуляції). Для блокування рецепторів глутамату використовували 8 антагоністів: CGS 19755 (BN0142, 1A/33087), динатрієву сіль NBQX (BN0608, 06088BN/02), GYKI 52466 (BN0380, BN0380, 1A/35052), гідрохлорид YM 298198 (BN0553, 0553BN/01), SYM 2206 (0961, 7A/34998), UBP 301 (BN0532, 0532BN/01), (RS)-APICA (BN0092, 0092BN/01), MSOP (BN0349 0349BN/01), придбані в BIO TREND Chemikalien. Їх тестували у пілотних експериментах із метою виявлення 11 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 концентрації, яка по суті не міняє амплітуду популяційного спайка у присутності одиночних подразників і тета-імпульсної стимуляції. Результати Вплив Vertigoheel® на активність нейронів: після однократного застосування електричного стимулу до колатералей Шеффера відповіді пірамідних клітин збільшувалися залежно від концентрації Vertigoheel®. Амплітуда популяційного спайка збільшувалася приблизно на 50 % із максимумом при 2 мг/л Vertigoheel® (амплітуда збільшувалася від 1,07 до 1,73 мВ). Зростання статистично значимо відрізнялося від контрольного значення без лікарського засобу (p < 0,01). Після електричної тета-імпульсної стимуляції присутність Vertigoheel® призводило лише до незначного збільшення амплітуди популяційного спайка (від 2,06 мВ до 2,24 мВ). Антагонізм Vertigoheel® за рахунок стимуляції глутаматергічними антагоністами: для дослідження конкретних мішеней Vertigoheel® до середовища, що зрошує зріз гіпокампу, додавали декілька антагоністів рецепторів глутамату. Відповідні дози визначали шляхом експериментальних досліджень. Ефективні концентрації Vertigoheel® були взяті з першої серії експериментів (1 мл/л для Vertigoheel®, Фіг.3). Функціональні перешкоди з боку сигналу, опосередкованого NMDA-рецептором: для перевірки можливих перешкод Vertigoheel® з боку змін сигналу, активованого NMDAрецептором, глутаматергічну передачу нервових імпульсів модулювали CGS 19755, дуже потужним і селективним антагоністом NMDA-рецепторів. У присутності 250 нМ CGS 19755 вимірювали лише дуже незначне зниження амплітуди сигналу. Концентрація 250 нМ не збільшувала амплітуду в присутності Vertigoheel® після однократної стимуляції. Таким чином, після обробки Vertigoheel® перешкод з боку передачі сигналу, опосередкованого NMDAрецептором, не спостерігали. Функціональні перешкоди з боку сигналу, опосередкованого AMPA-рецептором: для перевірки можливих перешкод Vertigoheel® з боку змін сигналу, активованого AMPAрецептором, глутаматергічну передачу нервових імпульсів модулювали NBQX, дуже потужним і селективним конкурентним антагоністом AMPA-рецепторів. У присутності 50 нМ NBQX окремо від інших препаратів вимірювані їх зміни амплітуди сигналу були відсутні. У той самий час концентрація 50 нМ значимо блокувала підвищену амплітуду популяційного спайка у присутності Vertigoheel® після однократних подразнень. Таким чином, можна було спостерігати чіткі перешкоди для дії Vertigoheel® з боку передачі сигналу, опосередкованого AMPAрецептором. Функціональні перешкоди за рахунок неконкурентної модуляції АМРА-рецептора GYKI 52466 і SYM 2206: для перевірки можливих перешкод Vertigoheel® з боку змін сигналу, активованого неконкурентним AMPA-рецептором глутамату, глутаматергічну передачу нервових імпульсів модулювали GYKI 52466, дуже потужним і селективним неконкурентним антагоністом AMPAрецепторів. У присутності 500 нМ GYKI 52466 окремо від інших препаратів вимірювали лише дуже незначне зниження амплітуди сигналу. GYKI 52466 (500 нМ) не збільшував амплітуду в присутності Vertigoheel® після однократної стимуляції. Таким чином, антагонізму з передачею сигналу, опосередкованого неконкурентним AMPA-рецептором, не спостерігали. Аналогічні ефекти одержували у присутності SYM 2206, ще одного неконкурентного антагоніста AMPAрецептора. Функціональні перешкоди за рахунок модуляції рецептора каїнату UBP 301: для перевірки можливих перешкод Vertigoheel® з боку каїнатних рецепторів глутаматергічну передачу нервових імпульсів модулювали UBP 301, дуже потужним і селективним конкурентним антагоністом каїнатного рецептора. У присутності 50 нМ UBP 301 окремо від інших препаратів вимірювана зміна амплітуди сигналу була відсутня. Концентрація 50 нМ повністю пригнічувала значиме підвищення амплітуди популяційного спайка у присутності Vertigoheel® після однократних подразнень. Таким чином, дані вказують на чіткі перешкоди Vertigoheel® з боку каїнатних рецепторів. Функціональні перешкоди за рахунок модуляції метаботропного рецептора Glu 1 за допомогою YM 298198: для перевірки можливих перешкод Vertigoheel® з боку метаботропного рецептора глутамату 1 класу, глутаматергічну передачу нервових імпульсів модулювали YM 298198, дуже потужним і селективним антагоністом метаботропного рецептора глутамату 1 класу. При зрошенні 50 нМ YM 298198 окремо від інших препаратів вимірювали лише дуже незначне зниження амплітуди сигналу після обробки TBS. Значення амплітуди після одиночних подразнень не змінювалися у присутності Vertigoheel® у комбінації з антагоністом. Однак під час TBS спостерігалося невелике підвищення амплітуди у присутності Vertigoheel® у комбінації з антагоністом. Таким чином, дія Vertigoheel® не опосередковане метаботропним рецептором глутамату 1. 12 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 Функціональні перешкоди за рахунок модуляції метаботропного рецептора Glu 2 за допомогою (RS)-APICA: антагоніст метаботропного рецептора глутамату 2 класу (RS)-APICA у концентрації 100 нМ окремо від інших сполук не інгібував амплітуду сигналу Vertigoheel®. Вплив Vertigoheel® після одиночної імпульсної стимуляції не змінювався. Функціональні перешкоди за рахунок модуляції метаботропного рецептора Glu 3 за допомогою MSOP: антагоніст метаботропного рецептора глутамату 3 класу MSOP у концентрації 50 нМ окремо від інших сполук не інгібував амплітуду сигналу Vertigoheel® після однократного імпульсу або TBS. Вплив Vertigoheel® після одиночної імпульсної стимуляції не змінювався за рахунок зазначеної сполуки. Таким чином, Vertigoheel® демонстрував дуже специфічний профіль мішені. Підвищена активність нейронів після інкубування з Vertigoheel® може пригнічуватися конкурентним AMPA й антагоністом рецептора каїнату. Передбачається, що вплив Vertigoheel® частково опосередкований зазначеними рецепторами нейронів, які беруть участь у процесах запам'ятовування та навчання в гіпокампі. Приклад 3: Вплив Vertigoheel® на функціонування нейронів Метою дослідження було вивчення існування потенційного впливу різних доз Vertigoheel® на функціонування нейронів in vitro. Досліджували три різні функції: цілісність та життєздатність нейронів (аналіз МТТ і ЛДГ), морфологію нейронів (ріст первинних нейронів гіпокампу) і вплив на процесинг і метаболізм АРР (середньомасштабний твердофазний ІФА). Досліджували вплив Vertigoheel® на цілісність та життєздатність нейронів, оскільки токсичне ушкодження клітин може викликати загибель окремих клітин, і втрата достатньої кількості клітин може призводити до недостатності та дисфункції тканини або органа та, в остаточному підсумку, до загибелі організму. Даний ефект досліджували у первинних нейронах гіпокампу миші та лінії клітин нейробластоми людини за допомогою аналізу ЛДГ і МТТ. Зміна морфології нейронів і синаптсів має важливе значення для функціонування нейронів і може забезпечити розуміння того, чи діє Vertigoheel® як церебральний активатор і чи підтримує він передачу нервових імпульсів. Вплив на процесинг АРР й інші аспекти метаболізму, пов'язані з ХА, має важливе значення у зв'язку з деменцією. Секретази діють на білок-попередник амілоїду (APP), розщеплюючи його на три фрагменти. Послідовне розщеплення β-секретазою (BACE) і γ-секретазою продукує βамілоїд, пептидний фрагмент, який утворює агрегати, що називають "бляшками", у головному мозку пацієнтів із хворобою Альцгеймера. α-секретази діють на APP, не утворюючи β-амілоїду, оскільки α-секретази розпізнають послідовність білка-мішені, розташовану ближче до поверхні клітини, ніж BACE. У наступному дослідженні вивчили вплив Vertigoheel® на процесинг і метаболізм APP. Для первинної культури клітин використовували мишей C57BL/6J в ембріональний день 18. Вагітних мишей умертвляли відповідно до загальних керівних принципів для експериментів на тваринах шляхом зсуву шийних хребців. Ембріони E18 витягали з матки і умертвляли шляхом декапітації. Цілий мозок витягали з черепа та переносили в чашку для культивування, що містить крижаний 1x HBSS із феноловим червоним. Наступні етапи проводили на льоді. Півкулі розділяли, видаляли м'які мозкові оболонки і висікали гіпокамп із тканини головного мозку, що залишилася, за допомогою одного атравматичного пінцета та стереомікроскопа Zeiss Stemi 2000-C. Виділені гіпокампи збирали в стерильну 15-мл пробірку, що містить 1x HBSS із феноловим червоним. Для дисоціації гіпокампи промивали 1x HBSS без фенолового червоного. 1x HBSS видаляли до об'єму 2 мл і додавали 0,2 мл 2,5 % трипсину. Потім гіпокампи інкубували і промивали. 1x HBSS видаляли, додавали ДНКазу I (65 од/мл), гіпокампи механічно дисоціювали за допомогою піпетки. Додавали середовище DMEM, доповнену 10 % FCS, 2 мм L-глутаміну, 100 МО пеніциліну й 0,1 мг/мл стрептоміцину. Кількість клітин визначали за допомогою камери Нейбауера для підрахунку клітин. Суспензію клітин коректували до бажаної щільності 10*104 клітин на мл і висівали в 24-ямкові планшети для культивування клітин, що містять 13-мм круглі покривні стекла з полі-L-лізиновим покриттям. 2 Загальна концентрація клітин склала 2,5 * 104 клітин на см . Первинні нейрони гіпокампу використовували для дослідження цілісності та життєздатності нейронів і для дослідження росту нейронів після обробки Vertigoheel®. Лінія клітин SH-SY5Y являє собою тричі клоновану нейробластому. Дані клітини містять аномальну хромосому 1, що несе додаткову копію сегмента 1q, яка називається трисомією 1q. Відомо, що клітини SH-SY5Y є активними за дофамін-бета-гідроксилазою, ацетилхолінергічними, глутаматергічними й аденозинергічними. У даних клітин дуже сильно відрізняються фази росту. Клітини розмножуються шляхом мітозу та диференціюються шляхом росту нейритів у навколишнє середовище. Клітини, що діляться, можуть утворювати кластери 13 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 клітин, які нагадують про їхню ракову природу, але обробка деякими речовинами, наприклад ретиноєвою кислотою та BDNF, може викликати ріст дендритів і диференціювання клітин. SHSY-5Y використовували для дослідження цілісності та життєздатності нейронів і для дослідження впливу на процесинг і метаболізм APP після обробки Vertigoheel®. Первинні нейрони гіпокампу підтримували при 37 °C у атмосфері 5 % CO2. Середовище міняли через 3-18 годин після посіву. Середовище DMEM видаляли і додавали 600 мкл нейробазального культурального середовища, доповненого 10 % B27, 2 мм L-глутаміну, 100 од. пеніциліну й 0,1 мг/мл стрептоміцину. Раз на тиждень нейробазальне культуральне середовище додавали по 200 мкл в ямки 24-ямкового планшета для культивування тканин і по 50 мкл в ямки 96-ямкового планшета для культивування тканин. Клітини SHSY-5Y підтримували при 37 °C в атмосфері 5 % CO2. Середовище міняли кожні 3 дні, клітини розділяли раз на тиждень. Вплив на цілісність та життєздатність нейронів вимірювали з використанням аналізу МТТ: аналіз МТТ являє собою колориметричний аналіз для вимірювання метаболічної активності ферментів, які відновлюють МТТ або близькі барвники (XTT, МТС, WST) до формазанових барвників, що дають пурпурне забарвлення. Основний варіант застосування дозволяє оцінити життєздатність (підрахунок клітин) і проліферацію клітин (аналіз клітинних культур). Його також можна використовувати для визначення цитотоксичності потенційних лікарських агентів і токсичних матеріалів, оскільки ці агенти повинні стимулювати або пригнічувати життєздатність та ріст клітин. Первинні нейрони гіпокампу миші та клітини SHSY-5Y інкубували з Vertigoheel®, Saline Heel і Saline Ulm (див. главу 2.1) протягом різного часу в 96-ямкових планшетах (Таблиця 1а/b) і обробляли МТТ (3-(4,5-диметилтіазол-2-іл-2,5-дифенілтетразолійбромідом) протягом 3 годин. Після додавання солянокислого ізопропанолу (0,04 н. HСl в ізопропанолі) в ямки планшети зчитували на Power Wave 200, Biotek Instruments, використовуючи робочу довжину хвилі 570 нм і довжину хвилі порівняння 630 нм. 10 мкм ротенону в ДМСО використовували як позитивний контроль, а неопрацьовані клітини – як негативний контроль. Аналіз ЛДГ: лактатдегідрогеназа (ЛДГ) являє собою розчинний цитозольний фермент, який вивільняється в культуральне середовище після порушення цілісності мембрани в результаті апоптозу або некрозу. Активність ЛДГ, отже, можна використовувати як індикатор цілісності клітинних мембран і як загальний засіб для оцінки цитотоксичності хімічних сполук або токсичних факторів навколишнього середовища. Первинні нейрони гіпокампу миші та клітини SHSY-5Y інкубували з Vertigoheel®, Saline Heel і Saline Ulm протягом різного часу в 96-ямкових планшетах (Таблиця 2а/b) і збирали надосадову рідину. Після додавання солі тетразолію планшети інкубували протягом 30 хвилин. Сіль тетразолію відновлювали до інтенсивно забарвленого формазану і вимірювали при 490 нм за допомогою Power Wave 200, Biotek Instruments (Фіг. 4). 10 мкм ротенону в ДМСО використовували як позитивний контроль, а неопрацьовані клітини – як негативний контроль. Зміна морфології нейронів і синаптсів: первинні нейрони гіпокампу миші в кількості 8 × 104 клітин/ямку інкубували з Vertigoheel®, Saline Heel (бідистильована вода та NaСl, придбані в Heel і приготовлені університетом Ульма) і Saline Ulm (0,9 % фізіологічний розчин, придбаний в Sigma Aldrich) з концентрацією 1:3 і 3:1 протягом 3-7 днів з метою досліджувати зміни довжини і розгалуження аксонів, і забезпечити розуміння проліферативного або інгібуючого впливу Vertigoheel®. Клітини PHN висіювали на покривні стекла в 24-ямкових планшетах, інкубували і фіксували. Клітини забарвлювали α MAP2 для виявлення дендритів і синаптсів. За допомогою флуоресцентної мікроскопії й аналізу Шолля виявляли зміни довжини аксонів і числа дендритів. Потім визначали вплив на процесинг АРР і інші аспекти метаболізму, пов'язані з ХА. Електрохемілюмінесцентний аналіз (sAPP): процесинг APP: α-секретаза та γ-секретаза утворюють p3, що не утворює бляшок, а γ-секретаза та β-секретаза утворюють Aβ, що утворює амілоїдні бляшки. Зазначені різні області білка APP. SHSY-5Y інкубували з Vertigoheel®, Saline Heel і Saline Ulm (Таблиця 3). Супернатант середовища збирали, інкубували з антитілами проти APP у форматі твердофазного ІФА та вимірювали за допомогою Sektor Imager 2400 (середньомасштабного) для виявлення змін у процесингу APP (sAPP). Для перевірки значимих відмінностей між групами застосовували непараметричні тести. Для порівняння двох груп виконували розрахунки t-критерію та непараметричного критерію суми рангів Уілкоксона (Програмне забезпечення: Sigma stat 3.5) для всіх експериментів. Відмінності з p < 0,05 вважали значимими. Результати 14 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 Аналіз життєздатності для PHN: аналізи MTT у PHN продемонстрували, що клітини переносили обробку Vertigoheel® у розведенні 1:3 і 3:1 до 5 днів. Ця обробка не впливала на життєздатність та проліферацію клітин у порівнянні з контрольними. Протестоване розведення Vertigoheel® і Saline використовували для подальших експериментів із вимірювання росту нейронів. Аналізи ЛДГ давали аналогічні результати для використовуваних розведень 1:3 і 3:1 для PHN. Аналіз життєздатності для SHSY-5Y: аналізи MTT і ЛДГ у SHSY-5Y продемонстрували, що клітини переносили обробку при розведенні 1:5, 1:4, 1:3 і 1:2 і часу інкубування 1 год., 3 год., 5 год., 12 год. і 24 год. Клітини показали гарну життєздатність після обробки. Для тривалих експериментів переносимим було розведення 3:1 (див. доповідь CK3031, університет Ульма). Таким чином, для експериментів із росту нейронів у PHN тривалістю від 3 до 5 днів використовували розведення 3:1. Дослідження продуктів процесингу APP у SHSY-5Y виконували з використанням більш високих коефіцієнтів розведення 1:3 і 1:4. (див. також Фіг. 46). Морфологія нейронів і синаптсів: обробка первинних нейронів гіпокампу Vertigoheel® протягом 5-7 днів продемонструвала значне збільшення довжини аксонів у порівнянні з клітинами, обробленими контрольною сполукою. Після 3 днів інкубування клітини, оброблені Vertigoheel®, продемонстрували подовження аксонів у середньому на 6 мкм, через 5 днів - у середньому на 12 мкм, а після 7 днів - у середньому на 14 мкм, але тільки зміни через 5 і 7 днів були статистично значимими. Процесинг APP: твердофазний ІФА APP для клітин SHSY-5Y продемонстрував значне зниження sAPPα і sAPPβ після інкубування протягом 5 год., 12 год., 24 год. і 72 год. при коефіцієнті розведення 1:4 (графіки 6 і 7). Тривале інкубування з коефіцієнтом розведення 3:1 продемонструвало лише тенденцію до зниження рівнів sAPP, однак зазначений ефект зростав при збільшенні часу інкубування й особливо при щоденній обробці (дані не показані). sAPP-β і sAPP-α є продуктами розщеплення APP секретазами. Фізіологічно sAPP-α має нейротрофні і нейропротективні властивості, та поліпшує LTP і просторову пам'ять. Роль sAPPβ вивчена недостатньо. У той самий час припускають, що високі рівні білка β-амілоїду (Aβ) у головному мозку призводять до первинного токсичного інсульту, що через численні механізми продукує когнітивну недостатність при хворобі Альцгеймера (ХА). Широко поширена думка, що накопичення Aß, невеликого пептиду з високою схильністю до утворення агрегатів (бляшок), займає центральне місце у патогенезі ХА. Оскільки кількість обох продуктів можна знизити за допомогою Vertigoheel®, передбачається, що Vertigoheel® сприятливо впливає на продукцію зазначених нейротоксичних різновидів і, отже, може запобігати утворенню бляшок у головному мозку. Приклад 4: Вплив Vertigoheel® на скополамін-індуковане формування контекстного страху і дефект соціальної передачі харчових переваг у мишей C57BL/6 Метою даного дослідження було вивчення здатності Vertigoheel® полегшити скополамініндуковану когнітивну недостатність у самців мишей C57BL/6 у тестах формування контекстного страху (CFC) і соціальної передачі харчових переваг (STFP). Обидві моделі широко використовуються у фармакологічній промисловості для дослідження пам'яті та навчання у тварин після медикаментозного лікування. STFP оцінював продуктивність нюхової пам'яті, у той час як CFC визначав вплив Vertigoheel® на контекстну пам'ять та пам'ять про страх. Усі експерименти на тваринах проводили відповідно до керівництва Національного інституту охорони здоров'я США (NIH) з використання лабораторних тварин і догляду за ними, і були схвалені Державним губернським керуванням Південної Фінляндії, номер ліцензії 605/01/2006. В експерименті використовували в цілому 90 самців C57BL/6 (Charles River, Німеччина) у віці 12 тижнів. Тварин утримували при стандартній температурі (22±1 °C) і в середовищі з контрольованим освітленням (світло включали з 7:00 до 20:00) при вільному доступі до їжі та води. Тварин розподіляли за групами наступним чином: Фаза 1, тест CFC: 15 мишей обробляли носієм (10 мл/кг, в/ч) протягом 3 днів і носієм для скополаміну (10 мл/кг, в/ч) 30 хв до навчання при CFC 15 мишей обробляли носієм (10 мл/кг, в/ч) протягом 3 днів і скополаміном (1 мг/кг, 10 мл/кг, в/ч) 30 хв до навчання при CFC 15 мишей обробляли VERTIGOHEEL® (1 мл/кг, 10 мл/кг, в/ч) і скополаміном (1 мг/кг, 10 мл/кг, в/ч) 30 хв до навчання при CFC 15 мишей обробляли VERTIGOHEEL® (2 мл/кг, 10 мл/кг, в/ч) і скополаміном (1 мг/кг, 10 мл/кг, в/ч) 30 хв до навчання при CFC 15 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 15 мишей обробляли VERTIGOHEEL® (1 мл/кг, 10 мл/кг, в/ч) протягом 3 днів і скополаміном (1 мг/кг, 10 мл/кг, в/ч) 30 хв до навчання при CFC 15 мишей обробляли донепезилом (1 мг/кг, 10 мл/кг, в/ч) і скополаміном (1 мг/кг, 10 мл/кг, в/ч) 30 хв до навчання при CFC Фаза 2, тест STFP: 15 мишей обробляли носієм (10 мл/кг, в/ч) протягом 3 днів і носієм для скополаміну (10 мл/кг, в/ч) 30 хв до фази взаємодії при STFP 15 мишей обробляли носієм (10 мл/кг, в/ч) протягом 3 днів і скополаміном (1 мг/кг, 10 мл/кг, в/ч) 30 хв до фази взаємодії при STFP 15 мишей обробляли Vertigoheel® (1 мл/кг, 10 мл/кг, в/ч) і скополаміном (1 мг/кг, 10 мл/кг, в/ч) 30 хв до фази взаємодії при STFP 15 мишей обробляли Vertigoheel® (2 мл/кг, 10 мл/кг, в/ч) і скополаміном (1 мг/кг, 10 мл/кг, в/ч) 30 хв до фази взаємодії при STFP 15 мишей обробляли Vertigoheel® (1 мл/кг, 10 мл/кг, в/ч) протягом 3 днів і скополаміном (1 мг/кг, 10 мл/кг, в/ч) 30 хв до фази взаємодії при STFP 15 мишей обробляли донепезилом (1 мг/кг, 10 мл/кг, в/ч) і скополаміном (1 мг/кг, 10 мл/кг, в/ч) 30 хв до фази взаємодії при STFP Введення скополаміну: у тварин викликали амнезію шляхом внутрішньочеревинного (в/ч) введення (-) скополаміну-HBr (1 мг/кг, в/ч) за 30 хв до тесту CFC і тесту STFP. Здатність сполуки Vertigoheel® купірувати скополамін-індуковану амнезію визначали шляхом її однократного (-30 хв) або 3-денного введення до навчання в рамках тесту CFC. Носій (стерильний фізіологічний розчин) вводили в/ч в об'ємному дозуванні 10 мл/кг. Донепезил (1 мг/кг) вводили в/ч. Для досягнення кінцевого об'ємного дозування 10 мл/кг Vertigoheel® додатково розбавляли стерильним фізіологічним розчином у співвідношенні 1:4 для групи, яка одержувала 2 мл/кг, і 1:9 для групи, яка одержувала 1 мл/кг. Таким чином, доза Vertigoheel® становила 1 і 2 мл/кг, а об'ємне дозування – 10 мл/кг. Тест контекстного формування страху: тест контекстного формування страху (CFC) модифікували у порівнянні з описаним у Comery et al. (2005). Навчання та тестування проводили протягом двох днів підряд, використовуючи систему Coulbourn FreezeFrame (Coulbourn, Уайтхолл, штат Пенсильванія, США). Тест CFC є одним із когнітивних тестів, які найбільше часто використовують на гризунах, а саме на генетично модифікованих мишах із хворобою Альцгеймера. Тест заснований на природній поведінці гризунів, тобто очікується, що тварина буде залишатися повністю нерухомою ("завмирання"), зіштовхнувшись зі ситуацією, що викликає страх, або подразником. Широко досліджена участь областей мозку, які відповідають за різні аспекти тестування CFC. Виявлено, що мигдалина бере участь в регуляції пам'яті про страх (пам'яті про подразник, а також пам'яті про контекст), тоді як гіпокамп регулює пам'ять про контекст, у якому відбулася подія, що викликала страх (пам'ять про контекст) (LeDoux, 1994). Клінічно тест CFC має відношення до поведінки людини не тільки за рахунок його когнітивних аспектів, але і у тому відношенні, що формування страху може бути досягнуте в людей, а ушкодження мигдалини запобігає формуванню страху (LeDoux, 2000). Його також використовували як модель посттравматичного стресового розладу (Layton and Krikorian, 2002). Показано, що різні фармакологічні агенти, наприклад, естроген, донепезил і росиглітазон, поліпшують поведінку при CFC у гризунів (Gemma et al., 2004; Dong et al., 2005; Dong et al., 2006). День 1 Навчання полягало в тому, що мишу поміщали у камеру, включали яскраве освітлення та дозволяли оглядітися протягом 2 хв. Потім подавали слуховий подразник (1700 Гц, 80 дБ, умовний подразник (УП)) протягом 15 с. Протягом останніх 2 із УП подавали 2-с електробольове подразнення на стопи (1,5 мА; безумовний подразник (БП)). Дану процедуру повторювали, і через 30 с мишу видаляли з камери. День 2 Приблизно через 20 годин після навчання мишу повертали в ту саму камеру, в якій відбувалося навчання (пам'ять про контекст), і реєстрували завмирання за допомогою комп'ютеризованої системи камер спостереження. Для кількісної оцінки завмирання застосовували автоматизовану систему FreezeFrame, яка оцифровує відеосигнал із частотою 4 Гц і покадрово порівнює рух миші. Наприкінці 5-хв контекстного тесту мишу повертали в її клітку. Через годину реєстрували завмирання в новому оточенні (зміненому контексті), та у відповідь на подразник (пам'ять про подразник). Нове оточення являло собою модульну тестову камеру з іншими умовами освітлення, забарвленням і текстурами на стінах і іншим матеріалом підлоги. Мишу поміщали у нове оточення та використовували дискретизацію за часом для оцінки 16 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 завмирання протягом 3 хв. Потім подавали слуховий подразник (1700 Гц, 80 дБ, УП) протягом 3 хв і знову оцінювали завмирання. Бальні оцінки завмирання для кожного суб'єкта виражали у відсотках для кожної частини тесту (пам'яті про контекст, зміненого контексту, пам'яті про подразник). Соціальна передача харчових переваг у мишей: тест соціальної передачі харчових переваг виконували через 4 тижні після завершення тесту CFC (період вимивання). Парадигма соціальної передачі харчових переваг (STFP) включала двох соціально знайомих мишей, одна з яких відігравала роль спостерігача, а інша – демонстратора. Демонстратор передавав нюхову інформацію про незалежно отриманий досвід нової їжі спостерігачеві під час соціальної взаємодії після одержання зазначеного досвіду. Через 24 год. після соціальної взаємодії спостерігача тестували на збереження переданої інформації про запах: мишам-спостерігачам надавали вибір між запахом їжі, яку їв демонстратор, і деякими іншими новими запахами. Нормальні, здорові миші-спостерігачі віддавали перевагу запаху їжі, яку їв демонстратор. Це явище опирається на природню поведінку гризунів: поїдання нової їжі, запах якої є присутнім у подиху здоровішого члена групи, є безпечним. Пам'ять у зазначеному завданні чутлива до ушкоджень областей мозку, що мають вирішальне значення для формування пам'яті у гризунів. Конкретно, ураження гіпокампу до навчання призводять до порушень поведінки (Bunsey and Eichenbaum, 1995); крім того, показано, що холінергічні базальні відділи переднього мозку мають важливе значення для успішного виконання завдання (Berger-Sweeney et al., 2000). Пам'ять гіпокампу, що має вирішальне значення для успішної поведінки у тесті STFP, можна порівняти з вербальною пам'яттю людини. Це пам'ять саме того типу, яка порушується, наприклад, уже на ранній стадії хвороби Альцгеймера. Показано, що, наприклад, естроген і вальпроєва кислота ефективно регулюють поведінку при STFP у гризунів (Sgobio et al., 2010; Clipperton et al., 2007). Протокол модифікували у порівнянні зі способом, описаним Wrenn (2004). Мишей утримували за групами у співвідношенні не більше чотирьох мишей-спостерігачів на одного демонстратора. До експерименту тварин годували групами з необмеженим доступом до підніжного корму і води. Наприкінці фази групової годівлі підніжний корм видаляли з клітки і заміняли двома чашками порошкового корму, які поміщали у клітки, де втримувалися миші, так що миші звикали їсти порошковий корм із чашок. Зазначена фаза привчання займала 4 дня. День 0 Після фази привчання мишу-демонстратора видаляли з клітки і розміщали окремо без доступу до їжі. Мишей-демонстраторів не включали у жодну з експериментальних груп у даному експерименті. День 1 Клітки мишей-спостерігачів заміняли на чисті та видаляли з кліток усю їжу. Це відбувалося за 4 год. до запланованої взаємодії з мишею-демонстратором. Після 24-год. періоду позбавлення їжі кожну мишу-демонстратора поміщали у порожню клітку з чашкою порошкового корму, ароматизованого корицею (1 % мас/мас) або какао (2 % мас/мас). Усіх мишей і групи ділили порівну на тих, що одержували їжу, ароматизовану корицею та какао. Кожній миші-демонстратору давали 1 год. 30 хв на поїдання ароматизованої їжі. Безпосередньо після цього їх поміщали назад у вихідні клітки з мишами-спостерігачами і дозволяли взаємодіяти зі спостерігачами – сусідами по клітці протягом 30 хв. Потім демонстраторів видаляли, а мишей-спостерігачів залишали у спокої на 24 год. День 2 Через 24 год. після етапу взаємодії кожну мишу-спостерігача поміщали у свою окрему тестову клітку та дозволяли харчуватися протягом 1 год. 30 хв. Тестові клітки містили по одній чашці кожного ароматизованого корму (тобто ароматизованого корицею та какао). Один із запахів, какао або кориця, був "їжею з подразником" (представленою демонстратором за 24 години до цього), а інший був "їжею без подразника" (новий запах, не знайомий раніше). Розташування нової їжі в клітці (у передній або задній частині клітки) було врівноважене серед мишей. Через 1 год. 30 хв мишей-спостерігачів повертали в їхні домашні клітки і до вільної годівлі підніжним кормом. Для аналізу даних усі чашки з ароматизованою їжею зважували до та після їжі як для мишей-демонстраторів, так і спостерігачів. Дані виражали у вигляді 1) відсотків від загального споживання, що доводилися на їжу з подразником, і 2) кількість (г) з'їденої їжі з подразником у порівнянні з неорієнтирною. Всі сполуки (носій, скополамін, донепезил; в/ч, 10 мл/кг) вводили за 30 хв до фази взаємодії між мишею-демонстратором і спостерігачем у день 1. Vertigoheel® однократно вводили у той 17 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 самий час, що і скополамін, або Vertigoheel® (1 мл/кг, в/ч) вводили за 3 дня до Дня 1 тесту STFP, як і в тесті CFC. Усі значення представлені як середнє ± стандартне відхилення (СВ) або стандартна помилка середнього (SEM); відмінності вважали статистично значимими на рівні P < 0,05. Статистичний аналіз проводили зі застосуванням статистичного програмного забезпечення StatsDirect. Для тесту CFC відмінності між середніми значеннями аналізували за допомогою однофакторного дисперсійного аналізу з наступним апостеріорним тестом Даннетта (порівняння з контрольною (= носій з обробкою скополаміном) групою) і двовибіркового t-критерію для незалежних вибірок (носій + носій у порівнянні зі скополаміном + носій). Для тесту STFP кількість з'їденої їжі з подразником у порівнянні з їжею без подразника аналізували з використанням двостороннього t-критерію в кожній експериментальній групі. Результати Соціальна передача харчових переваг у мишей: тест контекстного формування страху проводили у віці 12 тижнів. Вплив обробки Vertigoheel® на завмирання в тесті CFC представлено на Фігурі 1. Миші, оброблені скополаміном, проводили значно менше часу в завмерлому стані для пам'яті про контекст у порівнянні з мишами, обробленими носієм, що вказувало на порушення когнітивних функцій, викликане обробкою скополаміном (двовибірковий t-критерій для незалежних вибірок, * p 0,05); див. також Фіг. 7. Контекстне формування страху: тест контекстного формування страху проводили у віці 12 тижнів. Миші, оброблені скополаміном, проводили значно менше часу в завмерлому стані при згадуванні контексту в порівнянні з мишами, обробленими носієм, що вказувало на порушення когнітивних функцій, викликане обробкою скополаміном (двовибірковий t-критерій для незалежних вибірок, * p 0,05), що вказує на поліпшення пам'яті після Vertigoheel® (див. також Фіг. 8). Таким чином, обробка скополаміном викликала погіршення як у контекстній пам'яті в тесті формування контекстного страху, так і в тесті соціальної передачі харчових переваг. У тесті CFC істотний вплив обробки Vertigoheel® на дефекти пам'яті, викликані скополаміном, був відсутній, хоча існувала незначуща тенденція до посилення контекстної пам'яті в мишей, що одержували 1 мл/кг Vertigoheel® протягом 3 днів і до посилення пам'яті про подразник у мишей, які одержували однократну дозу 1 мл/кг Vertigoheel®. Таким чином, можливо, що лікування однократною дозою Vertigoheel® впливало на функції мигдалини, тоді як більш тривале, 3денне лікування, виявляло могутніший вплив на функції гіпокампу. Крім того, існувала незначуща тенденція до посилення контекстної пам'яті при лікуванні еталонною сполукою, донепезилом. Зазначене часткове купірування скополамін-індукованої амнезії знаходилося в межах нормального діапазону, яке зазвичай спостерігається при лікуванні донепезилом. У тесті STFP скополамін-індукований дефект пам'яті про орієнтирну їжу купірували як у мишей, які одержували однократну дозу 2 мл/кг Vertigoheel®, так і у мишей, які одержували 1 мг/кг донепезилу. Оскільки вважається, що приблизно 70 % частка з'їденої їжі з подразником від загального споживання вказує на гарну перевагу стосовно орієнтирної їжі, то обробка скополаміном досить часто не призводила до значимого зниження частки з'їденої їжі з подразником від загального споживання. Це пояснюється головним чином тим, що вже 50 % частка з'їденої їжі з подразником є рівнем можливості. Ці дані свідчать, що Vertigoheel® поліпшує нюхову пам'ять. Приклад 5: Вплив Vertigoheel® на пасивне уникнення при дефекті, який викликаний скополаміном, у пацюків Wistar. 18 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 Метою дослідження було вивчення можливості полегшення когнітивного дефіциту, викликаного введенням скополаміну, за допомогою лікування Vertigoheel®. Дефіцит навченості та пам'яті аналізували за допомогою тесту пасивного уникнення (PA). Цей тест, зокрема, досліджує довгочасну пам'ять. Всі експерименти на тваринах проводили відповідно до керівництва Національного інституту охорони здоров'я США (NIH) з використання лабораторних тварин і догляду за ними, і були схвалені Державним губернським керуванням Південної Фінляндії, номер ліцензії 605/01/2006. В експерименті використовували в цілому 90 дорослих самців пацюків Wistar (Charles River, Німеччина) масою 225-350 г. Тварин утримували при стандартній температурі (22±1 °C) і в середовищі з контрольованим освітленням (світло включали з 7:00 до 20:00) при вільному доступі до їжі та води. Фаза 2, тест PA: 15 пацюків обробляли носієм (2 мл/кг, в/ч) протягом 3 днів і носієм для скополаміну (2 мл/кг, в/ч) 30 хв до PA 15 пацюків обробляли носієм (2 мл/кг, в/ч) протягом 3 днів і скополаміном (1 мг/кг, 2 мл/кг, в/ч) 30 хв до PA 15 пацюків однократно обробляли VERTIGOHEEL® (2 мл/кг, в/ч) у день тестування разом із обробкою скополаміном (1 мг/кг, 2 мл/кг, в/ч) 30 хв до PA 15 пацюків обробляли VERTIGOHEEL® (1 мл/кг, в/ч) протягом 3 днів і скополаміном (1 мг/кг, 2 мл/кг, в/ч) 30 хв до PA 15 пацюків обробляли VERTIGOHEEL® (2 мл/кг, в/ч) протягом 3 днів і скополаміном (1 мг/кг, 2 мл/кг, в/ч) 30 хв до PA 15 пацюків обробляли донепезилом (1 мг/кг, 2 мл/кг, в/ч) і скополаміном (1 мг/кг, 2 мл/кг, в/ч) 30 хв до PA Введення скополаміну: у тварин викликали амнезію шляхом внутрішньочеревинного (в/ч) введення скополаміну (1 мг/кг, 2 мл/кг, в/ч) за 30 хвилин до навчання в Т-подібному лабіринті або тесті пасивного уникнення (PA). Доставка лікарських засобів: усі препарати (носій, скополамін, донепезил; в/ч, 2 мл/кг) вводили за 30 хв до тесту PA. Vertigoheel® (1 або 2 мл/кг) вводили або однократно у той самий час, що і скополамін, або Vertigoheel® (1 або 2 мл/кг, в/ч) вводили за 3 дні до тесту PA. Пасивне уникнення: поведінку пасивного уникнення тестували в системі Gemini Avoidance (San Diego Instruments, США). Даний поведінковий тест складався з однократного навчального випробування з наступним тестовим випробуванням 24 год. потому. При навчальному випробуванні кожного пацюка поміщали у початкову камеру на 15 с для адаптації, після чого початкову камеру освітлювали і відкривали гільйотину двері в темну камеру. Коли пацюк переходив на темну сторону, гільйотину двері закривали, і тварина одержувала 0,4-мА електробольове подразнення стоп протягом 3 с. Час переходу в темну камеру записували. Тестове випробування виконували через 24 год.; воно було ідентично навчальному випробуванню за винятком того, що якщо пацюк входив у темну камеру, гільйотину двері закривали, але електробольове подразнення не подавали. Максимальна тривалість тесту становила 600 с у кожний день тестування. Значення затримки виходу в усі дні, а також відмінність затримки виходу між випробуваннями при придбанні й утриманні в пам'яті використовували в статистичних аналізах. Усі значення представлені як середнє ± стандартна помилка середнього (SEM); відмінності вважали статистично значимими на рівні p 0,1). Крім того, групи, які одержували лікарський засіб, не відрізнялися від групи, яка одержувала скополамін у день 1, що вказувало на нормальну поведінку пацюків. У випробуванні втримання в 2 день тестування пацюки, які одержували скополамін, продемонстрували зниження затримки у порівнянні з пацюками, обробленими носієм, що вказувало на погіршення втримання даних у пам'яті в даному завданні (двовибірковий t-критерій для незалежних вибірок, р < 0,0001). У той самий час 19 UA 112784 C2 5 10 15 20 для груп, які одержували лікарський засіб, дисперсійний аналіз був неефективний. У дозі 2 мл/кг Vertigoheel® міг купірувати скополамін-індуковане порушення пам'яті (двовибірковий t-критерій для незалежних вибірок між групами, які одержували скополамін і 2 мл/кг Vertigoheel®, p < 0,05, Фіг. 9). Отримані результати показують, що гостре лікування Vertigoheel® (в/ч) у дозі 2,0 мл/кг трохи полегшувало порушення пам'яті, індуковане скополаміном, при тестуванні дорослих пацюків Wistar у тесті пасивного уникнення. Можна припустити, що Vertigoheel® впливав на області гіпокампу, оскільки для втримання в тесті PA необхідне функціонування гіпокампу. Приклад 6: Вплив Vertigoheel® у тесті розпізнавання нового об'єкта Вплив Vertigoheel® на когнітивну діяльність пацюків оцінювали за допомогою тесту розпізнавання нового об'єкта. Розпізнавання вимірювали за здатністю пацюків розрізняти знайомий та новий об'єкти після 24-год. затримки втримання для індукування природного забування у здорових тварин. Внутрішньочеревинне введення Vertigoheel® (0,1, 1 і 2 мл/кг) виконували за 40 хв перед випробуванням із набуття пам'яті. Одержання лікарського засобу: Vertigoheel® поставлявся Heel у вигляді готового робочого розчину. Усі склади при необхідності одержували у свіжому вигляді за допомогою Neurofit SAS щодня. Vertigoheel® тестували в дозах 0,1, 1 і 2 мл/кг, що вводяться в/ч. Для одержання доз 0,1, 1 і 2 мл/кг у пацюків при використанні об'ємного дозування 2 мл/кг робочий розчин додатково розбавляли у 20 і 2 рази для одержання 0,1 і 2 мл/кг, відповідно. Розведення проводили 0,9 % NaСl (фізіологічним розчином). Обробку виконували за 40 хв до випробування з набуття пам'яті. Донепезил розчиняли у фізіологічному розчині was і вводили п/о в об'ємі 2 мл/кг. Еталонну сполуку вводили за 30 хв до випробування з набуття пам'яті. Розклад обробки 25 № групи 1 2 3 4 5 6 30 35 40 45 Опис Утримання через 30 хв/фізіологічний розчин Утримання через 24 год./фізіологічний розчин Утримання через 24 год./VERTIGOHEEL® (0,1 мл/кг) Утримання через 24 год./VERTIGOHEEL® (1 мл/кг) Утримання через 24 год./VERTIGOHEEL® (2 мл/кг) Утримання через 24 год./донепезил (0,3 мг/кг) n шлях введення Схема Час до випробування з набуття пам'яті (хв) 12 в/ч гостре 40 12 в/ч гостре 40 12 в/ч гостре 40 12 в/ч гостре 40 12 в/ч гостре 40 12 в/ч гостре 30 Тестовані тварини: у дослідженні використовували 72 самців пацюків Wistar. Їх придбали в (Жанвьє; Ля Жені Сен Іль – Франція). Їх групами утримували у клітках (12–14 тварин на клітку), які містять підстилку (Mixal, Safe, Епіне-сюр-Орж, Франція), і в кімнаті з контрольованою температурою (21-22 °C), при відносній вологості 26-41 % і зверненому циклі світло-темрява (12 год./12 год.; освітлення включено: 17:30 – 05:30; освітлення виключено: 05:30 – 17:30). Доступ до їжі (A04; Safe, Епіне-сюр-Орж, Франція) та води надавали без обмежень. Апарат: апарат складався з відкритої клітки з акрилового скла (100 см 100 см зі стінками 45 см), в якій тварини могли вільно переміщатися. Одним із об'єктів була металева куля, а іншим – чорний ящик. Зазначені об'єкти мали аналогічний об'єм. Наближення тварини до об'єктів записували за допомогою системи відеоспостереження (Viewpoint, Франція). Експериментальна процедура: пацюків випадковим чином призначали в одну з різних експериментальних груп. Кожну тварину ідентифікували за назвою групи, номером клітки, серією (днем) експерименту і кількістю (1-10) міток, нанесених незмивними чорнилами на хвіст. За день до тестування пацюкам дозволяли обстежити відкрите поле протягом 15-хв ознайомлювальної сесії. Наступного дня на периферію уявлюваного центрального квадрата (30 см 30 см) відкритого поля поміщали об'єкт А, який називають "знайомим об'єктом". Пацюків уводили в зазначену експериментальну ситуацію (випробування з набуття пам'яті) на 10 хвилин. Тварин, які не проявляли рухомої активності (повна нерухомість) або не обстежили об'єкт, виключали. Після 24-год. затримки для індукції природного забування (Roncarati et al., 20 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 60 2009) поряд із об'єктом А, який залишався на тому самому місці, що і при випробуванні набуття пам'яті, поміщали об'єкт B ("новий об'єкт"). Кожну тварину вводили в зазначену ситуацію на 10 хв. Час на обстеження кожного з 2 об'єктів під час випробування втримання (tA і tB, відповідно), реєстрували роздільно. Обстеженням вважався напрямок носа на об'єкти з відстані ≤ 2 см. Тварин, які не проявляли рухомої активності (повністю нерухомих) або не обстежили об'єкти довше ніж протягом загального часу 5 с (час на об'єкт А + час на об'єкт B), виключали. В одній групі пацюків (група № 1, див. Таблицю), випробування з втримання проводили через 30 хв після набуття пам'яті замість 24 год. Діяльність зазначених пацюків уважали оптимальним рівнем розпізнавання, оскільки спонтанне забування ще не відбулося. Розрахунок: пам'ять про розпізнавання оцінювали за допомогою індексу розпізнавання (RI), відповідного до частки (%) часу, витраченого у випробуванні втримання на дослідження об'єкта B, стосовно загального часу, витраченого на дослідження знайомого об'єкта А та нового об'єкта B (Bohme et al., 2004). RI розраховували наступним чином: RI=tB/(tA+tB) x 100, де t - час. Індекс розпізнавання також виражали у вигляді частки від кількості візитів (контактів) до нового об'єкта, з поправкою на загальну кількість візитів до обох об'єктів, і розраховували наступним чином: RI=nB/(nA+nB) x 100, де n - кількість контактів. Однофакторний дисперсійний аналіз (ANOVA) з наступною оцінкою мінімального захищеного значимого відмінності Фішера застосовували для порівняння пар групових середніх. p 0,05 вважали значимим. Результати 24-год. затримка між випробуваннями з набуття й утримання пам'яті призводила до значного погіршення розпізнавання нового об'єкта пацюками. Дане зниження становило 27 і 32 % для індексу розпізнавання, що розраховується за часом (Фіг. 10) за візитами (Фіг. 11), відповідно. Зазначене природнє забування купірували обробкою донепезилом. Донепезил асоційований зі збільшенням індексу розпізнавання, що розраховується за часом і за візитами, на 11 і 18 %, відповідно. Вплив донепезилу було значимим для індексу розпізнавання, що розраховується за візитами. Vertigoheel® викликав залежне від дози підвищення розпізнавання нового об'єкта. Фактично, індекс розпізнавання, що розраховується за часом, зростав на 5, 9 і 16 % при дозах 0,1, 1 і 2 мл/кг Vertigoheel®, відповідно (Фіг. 10). Даний ефект був значимим для дози 2 мл/кг (Фіг. 11). Крім того, індекс розпізнавання, що розраховується за візитами, зростав на 3, 17 і 18 % при дозах 0,1, 1 і 2 мл/кг Vertigoheel®, відповідно. Даний ефект був значимим для доз 1 і 2 мл/кг. Дане дослідження проводили з метою оцінки когнітивного ефекту Vertigoheel® у тесті розпізнавання нового об'єкта у пацюків. При використанні протоколу з 24-год. затримкою втримання для стимулювання природного забування, в/ч введення Vertigoheel® викликало дозозалежне збільшення розпізнавання нового об'єкта, що вказує на властивість даної сполуки поліпшувати пам'ять. Даний ефект був значимим для доз 1 і 2 мл/кг. Завдання розпізнавання об'єкта є способом вимірювання специфічних форм епізодичної пам'яті у пацюків і мишей. Вона заснована на спонтанній поведінці гризунів і може вважатися тестом утримання в пам'яті, повністю вільним від компонентів довгочасної пам'яті. Крім того, вона не заснована на звичайних позитивних або негативних підкріплювальних стимулах, наприклад, їжі або електробольовому подразненні, які ускладнюють інтерпретацію впливу лікарських засобів на пам'ять. Розпізнавання об'єкта переважно застосовують як доклінічний тест для дослідження поліпшення пам'яті за рахунок інгібіторів ацетилхолінестерази (АХЕ), наприклад, донепезилу, які застосовують для лікування ХА. Показано, що інгібітори АХЕ стимулюють процеси з набуття пам'яті, а не консолідації або відновлення інформації про об'єкт. У даному дослідженні Vertigoheel® викликав явне поліпшення набуття інформації про об'єкт зі ступенем, порівнянним із впливом донепезилу. Приклад 7: Вплив Vertigoheel® на тест чергування у Т-подібному лабіринті у мишей Дану роботу виконували з метою оцінки здатності Vertigoheel® купірувати дефект пам'яті, викликаний скополаміном у мишей, яку вимірюють за збільшенням чергування в тесті з Тподібним лабіринтом. Спонтанне чергування Т-подібного лабіринту є поведінковим тестом для вимірювання дослідницької поведінки у тварин, особливо моделей розладів ЦНС у гризунів. Спонтанне чергування є вродженим прагненням гризунів чергувати вільний вибір у Т-лабіринті в серії почергових пробігів. Ця послідовна процедура ґрунтується на короткочасній пам'яті та чутлива до різних фармакологічних маніпуляцій з процесами пам'яті. Зазначений тест заснований на бажанні гризунів досліджувати нове оточення (наприклад, вони воліють відвідувати нову гілку лабіринту, а не знайому гілку). У зазначеному завданні беруть участь різні частини головного мозку, у тому числі гіпокамп, септа, базальні структури переднього мозку і префронтальна кора. Спочатку тварин поміщали у початкову гілку лабіринту. Перше 21 UA 112784 C2 5 10 15 випробування було примусовим випробуванням із наступними 14 випробуваннями вільного вибору, в яких тварини могли вибирати ліву або праву гілку. При повторних випробуваннях тварини повинні демонструвати менше прагнення йти у раніше відвідану гілку. Зазначений тест застосовують для кількісної оцінки когнітивних дефектів у мишей і оцінки впливу медикаментів на пізнавальну здатність. Vertigoheel® поставлявся Heel у вигляді готового робочого розчину. Vertigoheel® тестували в дозах 1 і 2 мл/кг, що вводяться в/ч. Для одержання доз 1 і 2 мл/кг у мишей при використанні об'ємного дозування 10 мл/кг робочий розчин додатково розбавляли в 10 і 5 раз, відповідно. Розведення проводили 0,9 % NaСl (фізіологічним розчином). Донепезил розчиняли у фізіологічному розчині та вводили в/ч в об'ємі 10 мл/кг. Всі розчини, за винятком розчину донепезилу, одержував і кодував лаборант, що не був лаборантом, який проводив тест Т-подібного лабіринту. Скополамін (-(-)скополаміну гідрохлорид) придбали в Sigma (Франція), розчиняли у фізіологічному розчині та вводили в/ч в об'ємному дозуванні 10 мл/кг. Донепезил одержали в подарунок від Galantos Pharma GmbH (Німеччина). Назви груп Спонтанне чергування (%) Фізіологічний розчин/носій (в/ч) Скополамін 1 мг/кг/носій (в/ч) Скополамін 1 мг/кг/Vertigoheel® (1 мл/кг; в/ч, гостре введення) Скополамін 1 мг/кг/Vertigoheel® (2 мл/кг; в/ч, гостре введення) Скополамін 1 мг/кг/Vertigoheel® (1 мл/кг; в/ч, раз на день, протягом 3 днів) Скополамін 1 мг/кг/Vertigoheel® (1 мл/кг; в/ч, два рази на день, протягом 3 днів) Скополамін 1 мг/кг/донепезил (0,3 мг/кг; в/ч) 20 25 30 35 40 Середнє s.e.m. 66,4 2,8 32,9 1,6 Відновлення (%) n 10 10 100 0 57,2 2,6 10 72 57,8 2,7 10 74 58,5 2,3 10 77 57,. 57,1 3,2 2,4 10 10 72 72 Тестовані тварини: у дослідженні використовували 5-тижневих самців мишей CD-1 (Жанвьє; Ля Жені Сен Іль – Франція). Їх групами (10 мишей на клітку) утримували в кімнаті з контрольованою температурою (21-22 °C), при зверненому циклі світло-темрява (12 год./12 год.; освітлення включено: 17:30 – 05:30; освітлення виключено: 05:30-17:30); і необмеженому доступі до їжі та води. Розклад обробки: при гострому лікуванні Vertigoheel® або носій (фізіологічний розчин) в/ч вводили за 40 хв перед випробуванням у Т-подібному лабіринті. При субхронічному лікуванні Vertigoheel® або носій (фізіологічний розчин) в/ч вводили протягом 3 днів один або два рази на день. Останню обробку виконували за 40 хв до випробування у Т-подібному лабіринті. Донепезил (0,3 мг/кг) в/ч вводили за 20 хв до випробування у Т-подібному лабіринті; скополамін (1 мг/кг) або його носій (фізіологічний розчин) в/ч вводили за 20 хв до випробування у Тподібному лабіринті. Експериментальна процедура: мишей випадковим чином призначали в одну з різних експериментальних груп. Кожну тварину ідентифікували за назвою групи, номером клітки, серією (днем) експерименту і кількістю (1-10) міток, нанесених незмивними чорнилами на хвіст. Апарат Т-подібний лабіринт був зроблений з сірого плексигласу і містив головний коридор (55 см довжини 10 см ширини 20 см висоти) і дві гілки (30 см довжини 10 см ширини 20 см висоти), розташовані під кутом 90 градусів стосовно основного коридору. Початкова камера (15 см довжини 10 см ширини) відділялася від основного коридору зсувними дверима. Крім того, зсувні двері використовували для закривання конкретних гілок під час завдання примусового чергування. Протокол експерименту складався з однієї сесії, яка починалася з 1 "примусового" випробування з наступними 14 випробуваннями "вільного вибору". Під час першого випробування "вільного вибору" тварину втримували протягом 5 с у початковій гілці, а потім випускали, блокуючи ліву або праву цільову гілку за допомогою горизонтальних дверей. Потім тварина долала лабіринт, в остаточному підсумку проходячи у відкриту цільову гілку, і 22 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 поверталася у вихідне положення. Відразу після повернення тварини у вихідне положення відкривали ліву або праву цільові двері та дозволяли тварині вільно вибирати між лівою та правою цільовими гілками (випробування "вільного вибору"). Тварину вважали такою, що ввійшла в одну з гілок, коли вона входила в дану гілку 4 лапами. Сесію завершували і тварину випускали з лабіринту після виконання 14 випробувань вільного вибору або після закінчення 10 хв, залежно від того, яка з цих подій відбулася раніше. Після кожної тварини апарат чистили спиртом (70°). З лабіринту видаляли сечу та фекалії. Під час випробувань по можливості мінімізували маніпуляції з тваринами і видимість оператора. Частку чергування за 14 випробуваннями вільного доступу визначали для кожної миші та використовували як показник функціонування короткочасної пам'яті. Зазначену частку виражали як кількість входів в іншу гілку Т-подібного лабіринту в послідовних випробуваннях (тобто лівуправу-ліву-праву тощо). До отриманих даних застосовували дисперсійний аналіз (ANOVA). Для попарного порівняння застосовували мінімальну захищену значиму відмінність Фішера. Р ≤ 0,05 вважали значимим. Купірування викликаного скополаміном дефекту пам'яті розраховували шляхом прийняття відповідної відповіді при введенні фізіологічного розчину/носія за 100 %, а відповіді в групі, яка одержувала скополамін/носій, - за 0 % купірування. Результати Концентрація 1 мг/кг скополаміну була асоційована зі значимим зниженням спонтанного чергування (приблизно на 34 %) у порівнянні з мишами, які одержували ін'єкції фізіологічного розчину. Дезорганізацію чергування, викликану скополаміном, купірували шляхом обробки 0,3 мг/кг донепезилу, яка підвищувала чергування на 24 %. Ступінь відновлення поведінки мишей, яка асоційована з лікуванням із застосуванням донепезилу, склала 72 %. Лікування зі застосуванням Vertigoheel® викликало підвищення чергування в мишей, оброблених скополаміном. Дане підвищення склало 24 і 25 % для гострих доз 1 і 2 мл/кг, відповідно. Відновлення пізнавальної діяльності склало 72 і 74 % для доз 1 і 2 мл/кг, відповідно. Дане підвищення склало 26 і 24 % для субхронічного лікування в дозі 1 мл/кг один або два рази на день, відповідно. Відновлення пізнавальної діяльності склало 77 і 72 % для субхронічного лікування в дозі 1 мл/кг один або два рази на день, відповідно. Статистично значимі відмінності між ефектами, які викликані різною обробкою Vertigoheel®, були відсутні. Зміни, які викликані Vertigoheel®, статистично не відрізнялися від змін у групі, яка одержувала скополамін/донепезил (див. також Фіг. 12). У даному дослідженні ми намагалися оцінити посилення пізнавальних здатностей, яке викликане препаратом Vertigoheel®. Дослідження проводили на мишах, які оброблені скополаміном, шляхом вимірювання зростання спонтанного чергування у Т-подібному лабіринті. Як і в результатах, описаних у літературі, донепезил призводив до значного збільшення спонтанного чергування у мишей, які оброблені скополаміном, що вказує на поліпшення пам'яті в аналізі Т-подібного лабіринту. Vertigoheel® викликав значне збільшення спонтанного чергування в мишей, які оброблені скополаміном, що вказує на поліпшення пам'яті мишей, які оброблені скополаміном, в аналізі Тподібного лабіринту за допомогою Vertigoheel®. Крім того, вплив Vertigoheel® був порівнянним із впливом 0,3 мг/кг донепезилу. Відзначено, що однократної 1-год. попередньої обробки Vertigoheel® досить для того, щоб зробити ефект, порівнянний з ефектом субхронічного лікування. Таким чином, дуже імовірно, що Vertigoheel® містить швидкодіючий(і) початок(и), відповідальні за поліпшення пізнавальних функцій у мишей у парадигмі Т-подібного лабіринту. Крім того, даний ефект, очевидно, є оптимальним уже після однократної обробки Vertigoheel®. У той самий час, поки невідомо, чи досяжна більш висока ефективність у діапазоні більш низьких доз. Потрібні додаткові експерименти для вирішення зазначеного питання. Зазначені дані підтверджують роль надвисоких дозувань Vertigoheel® як церебральноактивного препарату, пов'язану з підвищеною ефективністю обробки нейронів і продуктивністю пам'яті. Ці дані забезпечують механістичний доказ посилення пізнавальної активності під дією Vertigoheel®. Таким чином, Vertigoheel® є потенційним препаратом, який застосовують в якості додаткової фармакологічної терапії при деменції. ФОРМУЛА ВИНАХОДУ 60 1. Спосіб лікування та/або профілактики нейродегенеративного розладу або захворювання, причому зазначений спосіб включає введення композиції, що містить екстракти: Conium 23 UA 112784 C2 5 10 15 20 25 30 35 40 45 50 55 maculatum, який одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, Ambra grisea, який одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, petroleum rectificatum, який одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї й Anamirta cocculus, який одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, і при цьому зазначені екстракти вводять у дозуванні щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день. 2. Спосіб за п. 1, який відрізняється тим, що зазначену композицію, яка містить зазначені сирі екстракти, вводять у концентрації щонайменше приблизно 1 мл/кг, щонайменше приблизно 2 мл/кг маси тіла суб'єкта, якого лікують, на день. 3. Спосіб за п. 1 або 2, який відрізняється тим, що зазначений нейродегенеративний розлад або захворювання асоційоване з порушенням когнітивних функцій. 4. Спосіб за п. 3, який відрізняється тим, що зазначене порушення когнітивних функцій запобігають або полегшують. 5. Спосіб за будь-яким із пп. 1-4, який відрізняється тим, що зазначене нейродегенеративне захворювання або розлад являє собою хворобу Альцгеймера. 6. Спосіб за п. 5, який відрізняється тим, що процесинг білка-попередника бета-амілоїду, який супроводжує хворобу Альцгеймера, знижується. 7. Спосіб за будь-яким із пп. 1-4, який відрізняється тим, що зазначене нейродегенеративне захворювання або розлад являє собою амнезію, дефіцит навченості та пам'яті, бічний аміотрофічний склероз, обмежену передстаречу атрофію головного мозку, кортикобазальну дегенерацію, дегенерацію нервової системи, викликану алкоголем, неспецифічне дегенеративне захворювання нервової системи, дегенеративний синдром, діабетичну поліневропатію, епілепсію, атаксію Фрідрейха, лобово-скроневу деменцію та паркінсонізм 17 хромосоми, хворобу Хантінгтона, помірні когнітивні порушення, хворобу Піка, некласифіковані дегенеративні захворювання або розлади нервової системи, прогресуючу ізольовану афазію, прогресуючий над'ядерний параліч, некласифіковану сенільну дегенерацію головного мозку, спинально-церебелярну атаксію/дегенерацію, розумову відсталість, ушкодження спинного мозку, безпам'ятність та хворобу Паркінсона. 8. Спосіб за будь-яким із пп. 1-7, який відрізняється тим, що за рахунок уведення композиції підсилюється ріст нейронів. 9. Спосіб за будь-яким із пп. 1-8, який відрізняється тим, що зазначена композиція містить щонайменше один додатковий фармацевтично активний інгредієнт, вибраний з групи, яка складається з: донепезилу, ривастигміну, галантаміну, такрину, мемантину, каптоприлу, етанерцепту, Gingko biloba, вітаміну В12, ресвератролу, женьшеню, екстракту зеленого чаю, вітаміну Е, леводопи, праміпексолу дигідрохлориду моногідрату і разагіліну. 10. Спосіб для поліпшення навченості та пам'яті, причому зазначений спосіб включає введення композиції, що містить екстракти: Conium maculatum, який одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, Ambra grisea, який одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, petroleum rectificatum, який одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї й Anamirta cоссulus, який одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, і відрізняється тим, що зазначений спосіб включає введення зазначених екстрактів у дозуванні, яке рівне щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день. 11. Спосіб за п. 10, який відрізняється тим, що природне забування знижують для поліпшення навченості та пам'яті. 12. Спосіб за будь-яким із пп. 1-11, який відрізняється тим, що зазначена композиція додатково містить фармацевтично прийнятний носій та/або розріджувач. 13. Застосування композиції для поліпшення навченості та пам'яті, яке відрізняється тим, що зазначена композиція містить екстракти: Сonium maculatum, який одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, Ambra grisea, який одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, petroleum rectificatum, який одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї й Anamirta cocculus, який одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, при цьому застосування 24 UA 112784 C2 5 10 15 включає введення зазначених екстрактів у дозуванні, яке рівне щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день. 14. Застосування за п. 13, яке відрізняється тим, що зазначений лікарський засіб додатково містить фармацевтично прийнятний носій та/або розріджувач. 15. Застосування композиції для лікування та/або профілактики нейродегенеративного розладу або захворювання, яке відрізняється тим, що зазначена композиція включає: екстракти Conium maculatum, який одержують у відповідності зі способом 2а відповідно до Німецької гомеопатичної фармакопеї, Ambra grisea, який одержують відповідно до інформації в монографії "Ambra grisea" Німецької гомеопатичної фармакопеї, petroleum rectificatum, який одержують у відповідності зі способом 5а та додатковою інформацією в монографії "Petroleum rectificatum" Німецької гомеопатичної фармакопеї, й Anamirta cocculus, який одержують у відповідності зі способом 4а та додатковою інформацією в монографії "Anamirta cocculus" Німецької гомеопатичної фармакопеї, при цьому застосування включає введення зазначених екстрактів у дозуванні, яке рівне щонайменше приблизно 1 мл/кг маси тіла суб'єкта, якого лікують, на день. 25 UA 112784 C2 26 UA 112784 C2 27 UA 112784 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition for treating or preventing neurodegenerative disorders
Автори англійськоюSeilheimer, Bernd, Roska, Kerstin
Автори російськоюЗайльхаймер Бэрнд, Рёска Кэрстин
МПК / Мітки
МПК: A61K 36/59, A61K 36/23
Мітки: розладів, профілактики, лікування, спосіб, нейродегенеративних
Код посилання
<a href="https://ua.patents.su/34-112784-sposib-likuvannya-ta-abo-profilaktiki-nejjrodegenerativnikh-rozladiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування та/або профілактики нейродегенеративних розладів</a>
Попередній патент: Спосіб одержання целюлаз з використанням міцеліального гриба, придатного для біореактора, що має низький об’ємний коефіціент перенесення кисню kla
Наступний патент: Фільтруюча суміш для комплексного очищення води та пристрій для комплексного очищення води, який її включає
Випадковий патент: Спосіб роботи плазмового електрогенератора