Анти-cd79b антитіла, і імунокон’югати та способи їх застосування
Номер патенту: 106586
Опубліковано: 25.09.2014
Автори: Чень Івонне, Полсон Ендрю, Денніс Марк, Чжен Бін, Елкінс Крісті, Дорнан Девід, Джунутула Джагатх Редді
Формула / Реферат
1. Сконструйоване aнти-CD79b антитіло з цистеїновими замінами, що містить один або декілька вільних амінокислотних залишків цистеїну і послідовність, вибрану з:
Послідовність біля мутації Cys
Номер в послідовності
Номер за Кабат
Номер за
Еu
Номер послідовності
VTVSSCSTKGP
А118С
А114С
А118С
255
GLSSPCTKSFN
V209C
V205C
284
2. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 1, яке містить одну або декілька вільних амінокислот цистеїнів і послідовність SEQ ID NO:255.
3. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 1, яке містить одну або декілька вільних амінокислот цистеїнів і послідовність SEQ ID NO:284.
4. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 1, де один або декілька вільних амінокислотних залишків цистеїну розташовані у важкому ланцюзі.
5. Сконструйоване анти-CD79b антитіло з цистеїновими замінами за п. 4, де антитіло містить одну або декілька послідовностей, вибраних з:
Послідовність біля мутації Cys
Номер в послідовності
Номер за Кабат
Номер за Еu
Номер послідовності
EVQLCESGGG
V5C
V5C
251
LRLSCCASGYT
А23С
А23С
252
MNSLRCEDTAV
А88С
А84С
253
TLVTVCSASTK
S116C
S112C
254
VSSASCKGPSV
Т120С
Т116С
Т120С
256
WYVDGCEVHNA
V282C
V278C
V282C
257
KGFYPCDIAVE
S375C
S371C
S375C
258
PPVLDCDGSFF
S400C
S396C
S400C
259
6. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 1, де один або декілька вільних амінокислотних залишків цистеїну розташовані в легкому ланцюзі.
7. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 6, де антитіло містить одну або декілька послідовностей, вибраних з:
Послідовність біля мутації Cys
Номер в послідовності
Номер за Кабат
Номер за Еu
Номер послідовності
SLSASCGDRVT
V15C
V15C
278
EIKRTCAAPSV
V114C
V110C
279
TVAAPCVFIFP
S118C
S114C
280
FIFPPCDEQLK
S125C
S121C
281
DEQLKCGTASV
S131C
S127C
282
VTEQDCKDSTY
S172C
S168C
283
8. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 1, де антитіло отримане способом, який передбачає заміну одного або декількох амінокислотних залишків батьківського антитіла проти CD79b на цистеїн, і де батьківське антитіло містить послідовність важкого ланцюга, вибрану з: SEQ ID NО:308, 304, 306 і 310
і/або послідовність легкого ланцюга, вибрану з: SEQ ID NO:307, 303, 305 і 309.
9. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за будь-яким з пп. 1-8, де антитіло ковалентно приєднане до ауристатинового лікарського засобу, в результаті чого утворюється кон'югат "антитіло-лікарський засіб".
10. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 9, яке містить сконструйоване анти-СD79b антитіло з цистеїновими замінами (Аb) і групу ауристатинового лікарського засобу (D), де вказане сконструйоване анти-СD79b антитіло з цистеїновими замінами приєднане до D за допомогою лінкерної молекули (L) через одну або декілька вільних амінокислот цистеїну, де сполука має формулу І:
Ab-(L-D)p, I
де р дорівнює 1, 3, 4 або, переважно, 2.
11. Сконструйоване анти-СD79B антитіло з цистеїновими замінами за п. 10, де L являє собою:
-Аа-Ww-Yy-,
де:
А являє собою подовжувальний компонент, ковалентно зв'язаний з тіолом цистеїну сконструйованого антитіла (Аb);
а дорівнює 0 або 1;
кожний W незалежно являє собою амінокислотну одиницю;
w дорівнює цілому числу від 0 до 12;
Y означає спейсерний компонент, ковалентно зв'язаний з молекулою лікарського засобу; і
у дорівнює 0, 1 або 2.
12. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 10, де кон'югат "антитіло-лікарський засіб" має формулу:
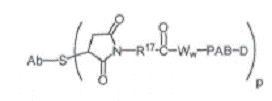 ,
,
де РАВ являє собою пара-амінобензилкарбамоїл, a R17 являє собою двовалентний радикал, вибраний з (СН2)r, С3-С8-карбоциклілу, -О-(СН2)r, арилену, (СН2)r-арилену, -арилен-(СН2)r-, (СН2)r-(С3-С8-карбоциклілу), (С3-С8-карбоцикліл)-(СН2)r, С3-С8-гетероциклілу, (СН2)r-(С3-С8-гетероциклілу), -(С3-С8-гетероцикліл)-(CH2)r--(CH2)rC(O)NRb(CH2)r, -(CH2CH2O)r, -(СН2СН2О)r-СН2--(CH2)C(O)NRb(CH2CH2O)r-, -(CH2)rC(O)NRb(CH2CH2O)r-CH2-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-CH2- i -(CH2CH2O)rC(O)NRb(CH2)r-, де Rb являє собою Н, С1-С6-алкіл, феніл або бензил, а r незалежно дорівнює цілому числу від 1 до 10.
13. Сконструйоване aнти-CD79b антитіло з цистеїновими замінами за п. 11, де Ww являє собою валін-цитрулін.
14. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 10, яке має формулу:
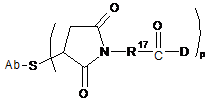 ,
,
де R17 являє собою двовалентний радикал, вибраний з (СН2)r, С3-С8-карбоциклілу, -О-(СН2)r, арилену, (СН2)r-арилену, -арилен-(СН2)r-, (СН2)r-(С3-С8-карбоциклілу), (С3-С8-карбоцикліл)-(СН2)r, С3-С8-гетероциклілу, (СН2)r-(С3-С8-гетероциклілу), -(С3-С8-гетероцикліл)-(CH2)r-, -(CH2)rC(O)NRb(CH2)r, -(CH2CH2O)r, -(СН2СН2О)r-СН2-, -(CH2)C(O)NRb(CH2CH2O)r-, -(CH2)rC(O)NRb(CH2CH2O)r-CH2-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-CH2- i -(CH2CH2O)rC(O)NRb(CH2)r-.
15. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 14, де R17 являє собою (СН2)5 або (СН2)2.
16. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 10, яке має формулу:
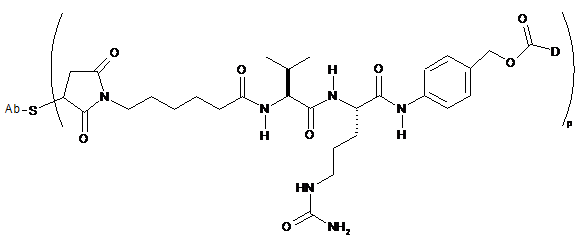 .
.
17. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 10, де L являє собою SMCC, SPP, SPDB або ВМРЕО.
18. Сконструйоване анти-СD79b антитіло з цистеїновими замінами за п. 10, де D являє собою або ММАЕ, що переважно має структуру:
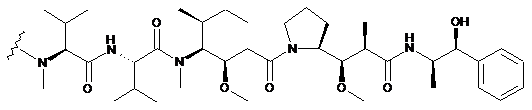 ,
,
де хвиляста лінія позначає сайт зв'язування з лінкером L; або MMAF, що переважно має структуру:
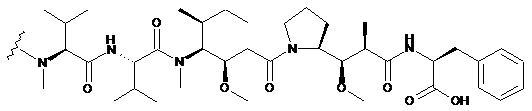 ,
,
де хвиляста лінія позначає сайт зв'язування з лінкером L.
19. Сполука-кон'югат "антитіло-лікарський засіб", вибрана із структур:
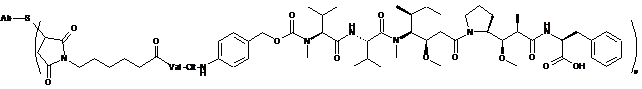
Ab-MC-vc-PAB-MMAF,
де Val являє собою валін; Cit являє собою цитрулін; р дорівнює 1, 2, 3 або 4;
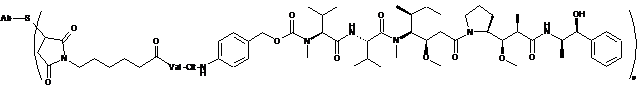
Ab-MC-vc-PAB-MMAE,
де Val являє собою валін; Cit являє собою цитрулін; р дорівнює 1, 2, 3 або 4;
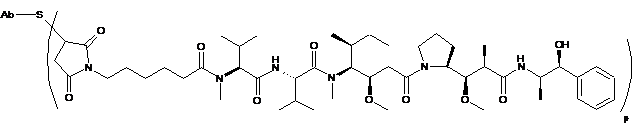
Ab-MC-MMAE,
де Val являє собою валін; Cit являє собою цитрулін; р дорівнює 1, 2, 3 або 4; або
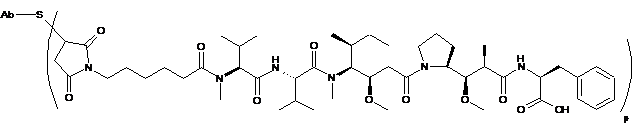
Ab-MC-MMAF,
де Val являє собою валін; Cit являє собою цитрулін; р дорівнює 1, 2, 3 або 4, де антитіло являє собою антитіло за будь-яким з пп. 1-8.
20. Сконструйоване aнти-CD79b антитіло з цистеїновими замінами за п. 19, яке має структуру:
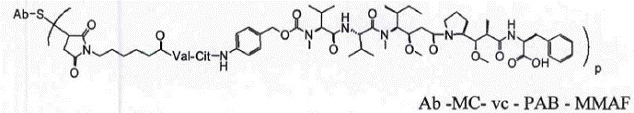 ,
,
де Val являє собою валін; Cit являє собою цитрулін; р дорівнює 1, 2, 3 або 4;
де антитіло являє собою антитіло за будь-яким з пп. 1-8.
21. Сконструйоване aнти-CD79b антитіло з цистеїновими замінами за п. 20, де антитіло являє собою антитіло за п. 2.
22. Сконструйоване aнти-CD79b антитіло з цистеїновими замінами за п. 20, де антитіло являє собою антитіло за п. 3.
23. Сконструйоване aнти-CD79b антитіло з цистеїновими замінами за п. 19, яке має структуру:
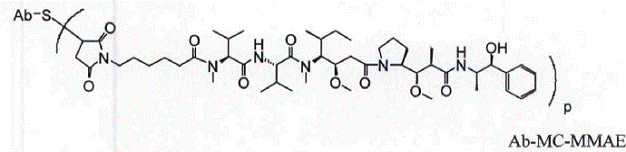 ,
,
де Val являє собою валін; Cit являє собою цитрулін; р дорівнює 1, 2, 3 або 4, де антитіло являє собою антитіло за будь-яким з пп. 1-8.
24. Сконструйоване aнти-CD79b антитіло з цистеїновими замінами за п. 23, де антитіло являє собою антитіло за п. 2.
25. Сконструйоване aнти-CD79b антитіло з цистеїновими замінами за п. 23, де антитіло являє собою антитіло за п. 3.
26. Сконструйоване aнти-CD79b антитіло з цистеїновими замінами за будь-яким з пп. 1-8 або сполука-кон'югат "антитіло-лікарський засіб" за пп. 9-19, де батьківське антитіло проти CD79b вибране з моноклонального антитіла, біспецифічного антитіла, химерного антитіла, людського антитіла, гуманізованого антитіла і фрагмента антитіла, переважно фрагмента Fab.
27. Кон'югат "антитіло-лікарський засіб" за п. 19, де антитіло одержане способом, який передбачає заміну одного або декількох амінокислотних залишків батьківського анти-CD79b антитіла цистеїном, де батьківське антитіло містить:
і) SEQ ID NО:307 і/або SEQ ID NО:308;
іі) SEQ ID NО:303 і/або SEQ ID NО:304;
ііі) SEQ ID NО:305 і/або SEQ ID NО:306; або
iv) SEQ ID NО:309 і/або SEQ ID NО:310.
28. Фармацевтична композиція, яка містить сконструйоване анти-СD79b антитіло з цистеїновими замінами за будь-яким з пп. 1-8 або кон'югат "антитіло-лікарський засіб" за будь-яким з пп. 9-27 і фармацевтично прийнятний розріджувач, носій або ексципієнт, і, необовязково, також терапевтично ефективну кількість хіміотерапевтичного засобу.
29. Спосіб визначення присутності білка CD79b в зразку, який імовірно містить вказаний білок, де вказаний спосіб передбачає контактування вказаного зразка із сконструйованим анти-CD79b антитілом з цистеїновими замінами за п. 1 і визначення зв'язування вказаного антитіла із вказаним білком CD79b у вказаному зразку, де зв'язування антитіла із вказаним білком є показником присутності вказаного білка у вказаному зразку.
30. Спосіб за п. 29, де вказане антитіло ковалентно зв'язане з міткою, вибраною з флуоресцентного барвника, радіоізотопу, біотину або ліганду, який утворює комплекс з металом; або де вказаний зразок містить клітину, імовірно експресуючу вказаний білок CD79b, або де вказана клітина є злоякісною клітиною гемопоетичної пухлини.
31. Спосіб детекції ракових клітин, який передбачає:
(a) обробку клітин сполукою-кон'югатом "антитіло-лікарський засіб" за п. 9; і
(b) визначення рівня зв'язування сполуки-кон'югата "антитіло-лікарський засіб" з клітинами;
де, переважно, клітини є клітинами гемопоетичної пухлини.
32. Спосіб інгібування клітинної проліферації, який передбачає обробку пухлинних клітин ссавця в середовищі для культивування клітин сполукою-кон'югатом "антитіло-лікарський засіб" за п. 9, і тим самим інгібуючи проліферацію пухлинних клітин, де пухлинні клітини ссавців переважно являють собою клітини гемопоетичної пухлини.
33. Антитіло за будь-яким з пп. 1-8, кон'югат "антитіло-лікарський засіб" за будь-яким з пп. 9-27 або фармацевтична композиція за п. 28 для застосування в способі лікування раку, де, переважно, рак вибраний з групи, яка складається з лімфоми, мієломи та лейкозу.
34. Антитіло, кон'югат "антитіло-лікарський засіб" або фармацевтична композиція для застосування за п. 33, де спосіб передбачає введення хіміотерапевтичного засобу пацієнту в поєднанні із сполукою-кон'югатом "антитіло-лікарський засіб".
35. Спосіб одержання сполуки-кон'югата "антитіло-лікарський засіб", що містить сконструйоване анти-CD79b антитіло з цистеїновими замінами (Аb) за п. 1 і молекулу ауристатинового лікарського засобу (D), де вказане сконструйоване анти-CD79b антитіло з цистеїновими замінами приєднане до D лінкерною молекулою (L) за допомогою однієї або декількох сконструйованих амінокислот цистеїну, де вказана сполука має формулу І:
Ab-(L-D)p, I
де р дорівнює 1, 2, 3 або 4, і де спосіб передбачає стадії:
(a) взаємодії сконструйованої цистеїнової групи сконструйованого антитіла з цистеїновими замінами з лінкерним реагентом з формуванням проміжної сполуки "антитіло-лінкер" Ab-L; і
(b) взаємодії Ab-L з активованою групою лікарського засобу D; з утворенням, таким чином, кон'югата "антитіло-лікарський засіб";
або передбачає стадії:
(c) взаємодії нуклеофільної групи молекули лікарського засобу з лінкерним реагентом з утворенням проміжної сполуки "лікарський засіб-лінкер" D-L; і
(d) взаємодії D-L із сконструйованою цистеїновою групою сконструйованого антитіла з цистеїновими замінами; з утворенням, таким чином, кон'югата "антитіло-лікарський засіб";
де спосіб, необов’язково, передбачає стадію експресування сконструйованого на основі цистеїну антитіла в клітинах яєчника китайського хом'ячка (СНО).
36. Спосіб за п. 35, який додатково передбачає стадію обробки експресованого сконструйованого антитіла з цистеїновими замінами відновником, де відновник, переважно, вибраний з ТСЕР і DTT.
37. Спосіб за п. 36, який додатково передбачає стадію обробки експресованого сконструйованого антитіла з цистеїновими замінами окислювачем, де вказаний окислювач, переважно, вибраний з сульфату міді, дегідроаскорбінової кислоти і повітря.
Текст
Реферат: Даний винахід стосується сконструйованого aнти-CD79b антитіла з цистеїновими замінами, що містить один або декілька вільних амінокислотних залишків цистеїну і послідовність, вибрану з: Послідовність біля мутації Номер за Номер в послідовності Cys Кабат VTVSSCSTKGP А118С А114С GLSSPCTKSFN V209C V205C Номер за Номер послідовності Еu А118С 255 284 UA 106586 C2 (12) UA 106586 C2 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресне посилання на споріднені заявки По даній заявці, що не є тимчасовою, поданій згідно зі статтею 37, § 1.53(b) Зводу Федеральних Правил (CFR), вимагається пріоритет тимчасової заявки на патент США № 61/025137, поданої 31 січня 2008 р., попередньої заявки на патент США рег. № 61/032790, поданої 29 лютого 2008 р., і тимчасової заявки на патент США рег. № 61/054709, поданої 20 травня 2008 р., згідно зі статтею 35, § 119(е) Кодексу законів США, причому опис кожної з цих заявок повністю включений в дану заявку за допомогою посилання. Галузь, до якої належить винахід Даний винахід стосується композицій, які можуть бути використані для лікування гемопоетичної пухлини у ссавців, і способів застосування таких композицій. Попередній рівень техніки У США злоякісні пухлини (рак), після хвороб серця, є другим лідируючим захворюванням, яке приводить до летального кінця (Boring et al., CA Cancel J. Clin. 43:7 (1993)). Рак характеризується збільшенням числа патологічних або пухлинних клітин, що походять від нормальної тканини, яка проліферує з утворенням пухлинної маси і інвазією суміжних тканин такими неопластичними пухлинними клітинами, з утворенням злоякісних клітин, які, зрештою, розповсюджуються через систему кровообігу або лімфатичну систему в регіональні лімфовузли і в периферичні області за механізмом, званим метастазуванням. При раку клітини проліферують в умовах, при яких нормальні клітини рости не можуть. Саме ракове захворювання виявляється в різних формах широкого ряду, що характеризуються різною мірою інвазивності і агресивності. Ракові захворювання, в яких беруть участь клітини, що утворюються в процесі гемопоезу, тобто в процесі, завдяки якому утворюються клітинні елементи крові, такі як лімфоцити, лейкоцити, тромбоцити, еритроцити і природні клітини-кілери, називаються раком гемопоетичної системи. Лімфоцити, які можуть бути виявлені в крові і в лімфатичній тканині і відіграють вирішальну роль в імунній відповіді, поділяються на два основних класи: Влімфоцити (В-клітини) і Т-лімфоцити (Т-клітини), які опосередковують гуморальну і клітинноопосередковану імунну відповідь, відповідно. В-клітини дозрівають в кістковому мозку і залишають кістковий мозок, експресуючи на своїй поверхні антигензв'язувальне антитіло. Після першого контакту "ненавчених" В-клітин з антигеном, відносно якого мембранозв'язане антитіло є специфічним, клітини починають швидко ділитися, а їх потомство диференціюється в В-клітини пам'яті і ефекторні клітини, звані "плазматичними клітинами". В-клітини пам'яті мають більш тривалий час життя і продовжують експресувати мембранозв'язане антитіло, яке має таку ж специфічність, як і вихідні батьківські клітини. Плазматичні клітини не продукують мембранозв'язане антитіло, а замість цього вони продукують антитіло у формі, яка може секретуватися. Секретованими антитілами є основні ефекторні молекули гуморальної імунної відповіді. Т-клітини дозрівають в тимусі і створюють умови для проліферації і диференціювання незрілих Т-клітин. У процесі свого дозрівання Т-клітини піддаються реаранжируванню генів, яке приводить до продукування Т-клітинного рецептора, і піддаються позитивному і негативному відбору, який полегшує визначення фенотипу клітинної поверхні зрілих Т-клітин. Характерними маркерами клітинної поверхні зрілих Т-клітин є комплекси CD3:Т-клітинний рецептор і один з корецепторів, CD4 або CD8. У спробах виявлення ефективних клітинних мішеней для протиракової терапії були проведені дослідження з ідентифікації трансмембранних або інших мембранозв'язаних поліпептидів, які специфічно експресуються на поверхні ракових клітин одного або декількох конкретних типів в порівнянні з однією або декількома нормальними нераковими клітинами. У більшості випадків такі мембранозв'язані поліпептиди у великій кількості експресуються на поверхні ракових клітин, але не на поверхні неракових клітин. Ідентифікація таких асоційованих з пухлиною поліпептидів-антигенів клітинної поверхні дає можливість специфічно руйнувати ракові клітини-мішені шляхом терапії з використанням антитіл. У зв'язку з цим слід зазначити, що терапія на основі антитіл виявилася дуже ефективною для лікування деяких ракових пухлин. Так, наприклад, герцептин (HERCEPTIN®) і ритуксан (RITUXAN®) (обидва цих антитіла постачаються компанією Genentech Inc., South San Francisco, California) являють собою антитіла, які з успіхом застосовувалися для лікування раку молочної залози і неходжкінської лімфоми, відповідно. Більш конкретно, HERCEPTIN® являє собою гуманізоване моноклональне антитіло, яке було одержане методами рекомбінантних ДНК і яке селективно зв'язується з позаклітинним доменом протоонкогена рецептора людського епідермального фактора росту 2 (HER2). Надекспресія білка HER2 спостерігалася у 25-30 % випадків захворювань первинним раком молочної залози. RITUXAN® являє собою генетично сконструйоване химерне 1 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 моноклональне антитіло "миша/людина", направлене проти антигену CD20, що знаходиться на поверхні нормальних і злоякісних В-лімфоцитів. Обидва ці антитіла рекомбінантно продукуються в клітинах СНО. У інших спробах виявлення ефективних клітинних мішеней для протиракової терапії були проведені дослідження з ідентифікації (1) поліпептидів, які не є мембранозв'язаними і які, на відміну від неракових нормальних клітин одного або декількох конкретних типів, специфічно продукуються однією або декількома раковими клітинами конкретних типів, (2) поліпептидів, продукованих раковими клітинами на рівні експресії, що значно перевищує рівень експресії поліпептидів однією або декількома нормальними нераковими клітинами, або (3) поліпептидів, експресія яких, зокрема, обмежується тканинами одного типу (або дуже обмеженого числа тканин інших типів), ураженими і не ураженими раком (наприклад, нормальною тканиною передміхурової залози і пухлинною тканиною передміхурової залози). Такі поліпептиди можуть бути постійно локалізовані всередині клітин, або вони можуть секретуватися раковими клітинами. Крім того, такі поліпептиди можуть експресуватися не самими раковими клітинами, а клітинами, які продукують і/або секретують поліпептиди, що здійснюють потенціюючу дію на ракові клітини або дію, стимулюючу ріст ракових клітин. У більшості випадків такими секретованими поліпептидами є білки, які забезпечують раковим клітинам, але не нормальним клітинам, переважний ріст, і такими поліпептидами є, наприклад, ангіогенні фактори, фактори клітинної адгезії, фактори росту і т. п. При цьому передбачається, що ідентифікація антагоністів вказаних поліпептидів, які не є мембранозв'язаними, дозволить виявляти ефективні терапевтичні засоби для лікування вказаних ракових захворювань. Крім того, ідентифікація характеру експресії таких поліпептидів може бути використана для діагностики конкретних ракових пухлин у ссавців. Незважаючи на згадані вище успіхи в протираковій терапії ссавців, необхідність в одержанні додаткових терапевтичних засобів, здатних детектувати присутність пухлини у ссавців і ефективно інгібувати ріст пухлинних клітин, відповідно, залишається особливо актуальною. Відповідно до цього, метою даного винаходу є ідентифікація поліпептидів, мембранозв'язаних, секретованих або внутрішньоклітинні поліпептидів, експресія яких, зокрема, обмежується тканинами тільки одного типу (або дуже обмеженого числа тканин інших типів), гемопоетичними тканинами, ураженими і не ураженими раком; і застосування таких поліпептидів і нуклеїнових кислот, що кодують вказані поліпептиди, для одержання композицій згідно з винаходом, які можуть бути використані з метою терапії і/або діагностики гемопоетичного раку у ссавців. CD79 являє собою сигнальний компонент В-клітинного рецептора, який складається з ковалентно зв'язаного гетеродимеру, що містить CD79a (Igα, mb-1) і CD79b (Igβ, B29). Кожний з CD79a і CD79b містить позаклітинний домен імуноглобуліну (Ig), трансмембранний домен, внутрішньоклітинний сигнальний домен і домен активації імунорецептора, що має тирозиновий мотив (ITAM). CD79 експресується на В-клітинах і в клітинах неходжкінської лімфоми (НХЛ) (Cabezudo et al., Haematologica, 84:413-418 (1999); D'Arena et al., Am. J. Hematol., 64:275-281 (2000); Olejniczak et al., Immunol. Invest., 35:93-114 (2006)). Всі CD79a і CD79b і sIg необхідні для поверхневої експресії CD79 (Matsuuchi et al., Curr. Opin. Immunol., 13(3):270-7)). Середній рівень поверхневої експресії CD79b на НХЛ аналогічний його експресії на нормальних В-клітинах, але в більш широких межах (Matsuuchi et al., Curr. Opin. Immunol., 13(3):270-7 (2001)). Що стосується експресії CD79b, то можна сказати, що він більш ефективний в продукуванні терапевтичних антитіл проти антигену CD79b і має мінімальну антигенність або взагалі не має антигенності при його введенні пацієнтам, зокрема, при тривалому лікуванні. Даний винахід задовольняє всі ці і інші вимоги. Даний винахід стосується анти-CD79b антитіл, які не мають недоліків, властивих сучасним терапевтичним композиціям, а також мають інші переваги, які будуть очевидні з нижченаведеного докладного опису. Використання кон'югатів "антитіло-лікарський засіб" (АDC), тобто імунокон'югатів, з метою локальної доставки цитотоксичних або цитостатичних агентів, наприклад, лікарських засобів, для знищення або пригнічення росту пухлинних клітин при лікуванні раку (Lambert J. (2005) Curr. Opinion in Pharmacology 5:543-549; Wu et al., (2005) Nature Biotechnology 23(9):1137-1146; Payne G. (2003) Cancer Cell 3:207-212; Syrigos & Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz & Springer (1997) Adv. Drg. Del. Rev. 26:151-172; патент США № 4975278), дозволяє здійснювати направлену доставку лікарського засобу в пухлини і забезпечувати їх акумуляцію всередині клітин, тоді як системне введення цих некон'югованих лікарських засобів може приводити до продукування рівнів токсичності, які є неприйнятними для нормальних клітин і недостатніми для знищення пухлинних клітин (Baldwin et al., 1986, Lancet pp. (Mar. 15, 1986):603-05; Thorpe, 1985, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: А Review" in Monoclonal Antobodies 84:Biological And Clinical Applications, A. Pinchera et al. (eds.), pp. 475-506). 2 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 В спробах підвищити терапевтичний індекс, тобто максимально підвищити ефективність і максимально знизити токсичність ADC, всі зусилля були направлені на підвищення селективності поліклональних антитіл (Rowland et al. (1986), Cancer Immunol. Immunother. 21:183-87) і моноклональних антитіл (mAb), а також на поліпшення таких властивостей, як зв'язування з лікарським засобом і вивільнення лікарських засобів (Lambert J. (2005) Curr. Opinion in Pharmacology 5:543-549). Лікарськими засобами, використовуваними в кон'югатах "антитіло-лікарський засіб", є бактеріальні білкові токсини, такі як дифтерійний токсин, рослинні білкові токсини, такі як рицин, і невеликі молекули, такі як ауристатини, гельданаміцин (Mandler et al., (2000) J. of the Nat.Cancer Inst. 92 (19):1573-1581; Mandler et al. (2000), Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al. (2002), Bioconjugate Chem. 13:786-791), майтанзиноїди (ЕР 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623), каліхеаміцин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (1993) Cancer Res. 53:3336-3342), дауноміцин, доксорубіцин, метотрексат і віндезин (Rowland et al. (1986) див. вище). Ці лікарські засоби можуть впливати на цитотоксичні і цитостатичні механізми, включаючи зв'язування з тубуліном, зв'язування з ДНК або інгібування топоізомерази. Деякі цитотоксичні лікарські засоби, при їх кон'югуванні з великими антитілами або лігандами білків-рецепторів, мають тенденцію до втрати або зменшення активності. Лікарські засоби, а саме ауристатинові пептиди, ауристатин Е (АЕ) і монометилауристатин (ММАЕ), тобто синтетичні аналоги доластатину (WO 02/088172), були кон'юговані: (i) з химерними моноклональними антитілами cBR96 (специфічними до антигену Lewis Y на карциномах); (ii) з сАС10, яке є специфічним до CD30, присутнього на гематологічних злоякісних пухлинах (Klussman et al. (2004) Bioconjugate Chemistry 15(4):765-773; Doronina et al. (2003) Nature Biotechnology 21(7):778-784; Francisco et al. (2003) Blood 102(4):1458-1465; публікація заявки на патент США 2004/0018194); (iii) з анти-CD20 антитілами, такими як ритуксан® (WO 04/032828), використовуваний для лікування CD20-експресуючих ракових пухлин і імунних розладів; (iv) з анти-EphB2R антитілом 2Н9, використовуваним для лікування раку прямої і ободової кишки (Mao et al. (2004) Cancer Research 64(3):781-788); (v) з антитілом проти Еселектину (Bhaskar et al. (2003) Cancer Res. 63:6387-6397); (vi) з трастузумабом (HERCEPTIN®, заявка США 2005/0238649), і (vii) анти-CD30 антитілами (WO 03/043583). Варіанти ауристатину Е описані в патентах США 5767237 і 6124431. Монометилауристатин Е, кон'югований з моноклональними антитілами, описаний в роботі Senter et al., Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, опублікованій 28 березня, 2004. Ауристатинові аналоги ММАЕ і MMAF були кон'юговані з різними антитілами (заявка США 2005/0238649). Стандартний метод приєднання, тобто ковалентного зв'язування молекули лікарського засобу з антитілом, по суті дозволяє одержати гетерогенну суміш молекул, в яких лікарські засоби приєднані в різних ділянках молекули антитіла. Так, наприклад, цитотоксичні лікарські засоби звичайно кон'югують з антитілами за допомогою великої кількості лізинових залишків антитіла з одержанням гетерогенної суміші кон'югата "антитіло-лікарський засіб". Залежно від умов реакції гетерогенна суміш звичайно містить певне число антитіл, до яких приєднані від 0 і приблизно до 8 або більше молекул зв'язаних лікарських засобів. Крім того, в кожній підгрупі кон'югатів, з відношенням молекул лікарського засобу до молекул антитіла, яке дорівнює конкретному цілому числу, може бути присутньою гетерогенна суміш, в якій молекула лікарського засобу приєднана в різних ділянках антитіла. Аналітичні і препаративні методи можуть бути непридатними для розділення і характеризації молекул-кон'югатів "антитілолікарський засіб" в гетерогенній суміші, одержаній в результаті реакції кон'югування. Антитіла являють собою великі, складні і відмінні за своєю структурою біомолекули, які, в більшості випадків, мають множину реакційноздатних функціональних груп. Здатність цих груп реагувати з лінкерними реагентами і проміжними сполуками "лікарський засіб-лінкер" залежить від таких факторів, як рН, концентрація, концентрація солі і присутність співрозчинників. Крім того, спосіб багатостадійного кон'югування може виявитися таким, що невідтворюваним, що зумовлено складностями регуляції умов реакції і характеризації реагентів і проміжних сполук. На відміну від більшості амінів, які є протонованими і менш нуклеофільними при рН~7, тіоли цистеїнів є реакційноздатними при нейтральному рН. Оскільки вільні тіолові (RSH, сульфгідрильні) групи є відносно реакційноздатними, то білки, що містять цистеїнові залишки, часто мають окислену форму і являють собою зв'язані з дисульфідом олігомери, або вони містять внутрішні місточкові дисульфідні групи. Позаклітинні білки звичайно не містять вільних тіолових груп (Garman, 1997, Non-Radioactive Labelling: А Practical Approach, Academic Press, London, page 55). Тіолові групи цистеїну антитіла звичайно є більш реакційноздатними, тобто більш нуклеофільними відносно електрофільних реагентів кон'югування, ніж аміногрупи або 3 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 гідроксильні групи антитіла. Цистеїнові залишки були введені в білки методами генної інженерії з утворенням ковалентних зв'язків з лігандами або з утворенням нових внутрішньомолекулярних дисульфідних зв'язків (Better et al. (1994) J. Biol. Chem. 13:9644-9650; Bernhard et al. (1994) Bioconjugate Chem. 5:126-132; Greenwood et al. (1994) Therapeutic Immunology 1:247-255; Tu et al. (1999) Proc. Natl. Acad. Sci USA 96:4862-4867; Kanno et al. (2000) J. of Biotechnology, 76:207-214; Chmura et al. (2001) Proc. Nat. Acad. Sci. USA 98(15):8480-8484; патент США 6248564). Однак конструювання тіолових груп цистеїну шляхом заміни різних амінокислотних залишків білка цистеїновими залишками може бути пов'язане з певними проблемами, особливо, якщо присутні незв'язані (вільні Cys) залишки або залишки, які є відносно доступними для реакції або окислення. У концентрованих розчинах білка, незалежно від того, чи присутні вони в периплазмі Е. coli, супернатантах культури або є частково або повністю очищеними білками, незв'язані залишки Cys на поверхні білка можуть зв'язуватися і окислюватися з утворенням міжмолекулярних дисульфідів, а отже і димерів або мультимерів білка. Утворення дисульфідних димерів робить новий залишок Cys нездатним утворювати кон'югати з лікарським засобом, лігандом або іншою міткою. Крім того, якщо білок в результаті окислення утворює внутрішньомолекулярний дисульфідний зв'язок між новим сконструйованим Cys і вже наявним залишком Cys, то обидві тіолові групи Cys стають недоступними для функціонування в активному центрі і до взаємодії. Крім того, такий білок може ставати неактивним або неспецифічним в результаті неправильного укладання або втрати третинної структури (Zhang et al. (2002) Anal. Biochem. 311:1-9). Сконструйовані на основі цистеїну антитіла були одержані у вигляді FAB-фрагментів антитіл (тіо-Fab) і експресовані як повнорозмірні моноклональні антитіла IgG (тіо-Mab) (Junutula, J.R. et al. (2008) J. Immunol Methods 332:41-52; заявка США 2007/0092940, зміст яких вводиться в даний опис за допомогою посилання). Антитіла тіо-Fab і тіо-Mab були кон'юговані за допомогою лінкерів в положеннях нововведених тіолів цистеїну з використанням реагуючих з тіолом лінкерних реагентів і реагентів "лікарський засіб-лінкер" з одержанням кон'югатів "антитілолікарський засіб" (тіо-ADC). Всі роботи, що цитуються тут, включаючи патентні заявки і публікації, повністю включені в даний опис за допомогою посилання. Опис суті винаходу Даний винахід стосується анти-CD79b антитіл або їх функціональних фрагментів, а також способу їх застосування для лікування гемопоетичних пухлин. У одному зі своїх аспектів даний винахід стосується антитіла, яке зв'язується, переважно специфічно, з будь-яким з вищеописаних або нижчеописаних поліпептидів. Таким антитілом є, але необов'язково, моноклональне антитіло, фрагмент антитіла, включаючи Fab-, Fab'-, F(ab')2- і Fv-фрагмент, діантитіло, однодоменне антитіло, химерне антитіло, гуманізоване антитіло, одноланцюжкове антитіло або антитіло, яке конкурентно інгібує зв'язування антитіла проти поліпептиду CD79b з його відповідним антигенним епітопом. Антитіла згідно з винаходом можуть бути, але необов'язково, кон'юговані із ріст-інгібуючим агентом або з цитотоксичним засобом, таким як токсин, включаючи, наприклад, ауристатин, майтанзиноїд, похідне доластатину або каліхеаміцин, антибіотик, радіоактивний ізотоп, нуклеолітичний фермент або т. п. Антитіла згідно з винаходом можуть бути, але необов'язково, продуковані в клітинах СНО або в бактеріальних клітинах, а переважно індукують загибель клітин, з якими вони зв'язуються. Антитіла згідно з винаходом, використовувані в цілях детекції, можуть бути детектовано помічені, приєднані до твердого носія або т. п. У одному зі своїх аспектів даний винахід стосується гуманізованого анти-CD79b антитіла, де афінність одновалентного антитіла (наприклад, афінність антитіла, використовуваного як Fabфрагмент проти CD79b) або афінність двовалентної форми антитіла проти CD79b (наприклад, афінність антитіла, використовуваного як IgG-фрагмент проти CD79b) по суті аналогічна, нижче або вище афінності одновалентного або афінності двовалентного, відповідно, мишачого антитіла (наприклад, афінності мишачого антитіла, використовуваного як Fab-фрагмент або IgG-фрагмент проти CD79b), або химерного антитіла (наприклад, афінності химерного антитіла, використовуваного як Fab-фрагмент або IgG-фрагмент проти CD79b), що містить послідовність варіабельного домену легкого і важкого ланцюга або складається або по суті складається з вказаної послідовності, представленої на фігурах 7A, B (SEQ ID NO: 10) і на фігурах 8A, B (SEQ ID NO: 14). У іншому своєму аспекті даний винахід стосується гуманізованого анти-CD79b антитіла, де афінність вказаного антитіла в його двовалентній формі відносно CD79b (наприклад, афінність антитіла типу IgG проти CD79b) становить 0,4 нM, 0,2 нM або 0,5 нM. У одному зі своїх аспектів даний винахід стосується антитіла, яке зв'язується з CD79b, де 4 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 вказане антитіло містить щонайменше одну, дві, три, чотири, п'ять або шість HVR, вибраних з групи, яка складається з: (i) HVR-L1, що містить послідовність A1-A15, де A1-A15 являє собою KASQSVDYDGDSFLN (SEQ ID NO: 131); (ii) HVR-L2, що містить послідовність B1-B7, де B1-B7 являє собою AASNLES (SEQ ID NO: 132); (iii) HVR-L3, що містить послідовність C1-C9, де C1-C9 являє собою QQSNEDPLT (SEQ ID NO: 133); (iv) HVR-H1, що містить послідовність D1-D10, де D1-D10 являє собою GYTFSSYWIE (SEQ ID NO: 134); (v) HVR-H2, що містить послідовність E1-E18, де E1-E18 являє собою GEILPGGGDTNYNEIFKG (SEQ ID NO: 135); і (vi) HVR-H3, що містить послідовність F1-F10, де F1-F10 являє собою TRRVPVYFDY (SEQ ID NO: 136). У одному зі своїх аспектів даний винахід стосується антитіла, яке зв'язується з CD79b, де вказане антитіло містить щонайменше один варіант HVR, де вказаний варіант HVR містить модифікацію щонайменше одного залишку послідовності, представленої в SEQ ID NO: 131, 132, 133, 134, 135 або 136. У одному зі своїх аспектів даний винахід стосується антитіла, що включає варіабельний домен важкого ланцюга, який містить послідовність HVR1-HC, HVR2-HC і/або HVR3-HC, представлену на фігурі 15 (SEQ ID NO: 164-166). У одному зі своїх аспектів даний винахід стосується антитіла, що включає варіабельний домен легкого ланцюга, який містить послідовність HVR1-LC, HVR2-LC і/або HVR3-LC, представлену на фігурі 15 (SEQ ID NO: 156-158). У одному зі своїх аспектів даний винахід стосується антитіла, що включає варіабельний домен важкого ланцюга, який містить послідовність HVR1-HC, HVR2-HC і/або HVR3-HC, представлену на фігурі 16 (SEQ ID NO: 183-185). У одному зі своїх аспектів даний винахід стосується антитіла, що включає варіабельний домен легкого ланцюга, який містить послідовність HVR1-LC, HVR2-LC і/або HVR3-LC, представлену на фігурі 16 (SEQ ID NO: 175-177). У одному зі своїх аспектів даний винахід стосується антитіла, що включає варіабельний домен важкого ланцюга, який містить послідовність HVR1-HC, HVR2-HC і/або HVR3-HC, представлену на фігурі 17 (SEQ ID NO: 202-204). У одному зі своїх аспектів даний винахід стосується антитіла, що включає варіабельний домен легкого ланцюга, який містить послідовність HVR1-LC, HVR2-LC і/або HVR3-LC, представлену на фігурі 17 (SEQ ID NO: 194-196). У одному зі своїх аспектів даний винахід стосується антитіла, що включає варіабельний домен важкого ланцюга, який містить послідовність HVR1-HC, HVR2-HC і/або HVR3-HC, представлену на фігурі 18 (SEQ ID NO: 221-223). У одному зі своїх аспектів даний винахід стосується антитіла, що включає варіабельний домен легкого ланцюга, який містить послідовність HVR1-LC, HVR2-LC і/або HVR3-LC, представлену на фігурі 18 (SEQ ID NO: 213-215). У одному зі своїх аспектів даний винахід стосується анти-СD79b антитіла, що містить варіабельний домен важкого ланцюга, вибраний з SEQ ID NO: 170, 189, 208 або 227. У іншому своєму аспекті даний винахід стосується анти-CD79b антитіла, що містить варіабельний домен легкого ланцюга, вибраний з SEQ ID NO: 169, 188, 207 або 226. У одному зі своїх аспектів даний винахід стосується сконструйованого на основі цистеїну анти-CD79b антитіла, що містить одну або декілька вільних цистеїнових амінокислот і послідовність, вибрану з SEQ ID NO: 251-298. Сконструйоване на основі цистеїну анти-CD79b антитіло може зв'язуватися з поліпептидом CD79b. Сконструйоване на основі цистеїну антиCD79b антитіло може бути одержане способом, який включає заміну одного або декількох амінокислотних залишків батьківського анти-CD79b антитіла цистеїном. У одному зі своїх аспектів даний винахід стосується сконструйованого на основі цистеїну анти-CD79b антитіла, що містить одну або декілька вільних амінокислот цистеїнів, де вказане сконструйоване на основі цистеїну анти-CD79b антитіло зв'язується з поліпептидом CD79b, і де вказане антитіло було одержане способом, який включає заміну одного або декількох амінокислотних залишків батьківського анти-CD79b антитіла цистеїном, де вказане батьківське антитіло містить щонайменше одну послідовність HVR, вибрану з: (a) HVR-L1, що містить послідовність A1-A15, де A1-A15 являє собою KASQSVDYDGDSFLN (SEQ ID NO: 131) або KASQSVDYEGDSFLN (SEQ ID NO: 137); 5 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 (b) HVR-L2, що містить послідовність B1-B7, де B1-B7 являє собою AASNLES (SEQ ID NO: 132); (с) HVR-L3, що містить послідовність C1-C9, де C1-C9 являє собою QQSNEDPLT (SEQ ID NO: 133); (d) HVR-H1, що містить послідовність D1-D10, де D1-D10 являє собою GYTFSSYWIE (SEQ ID NO: 134); (е) HVR-H2, що містить послідовність E1-E18, де E1-E18 являє собою GEILPGGGDTNYNEIFKG (SEQ ID NO: 135); і (f) HVR-H3, що містить послідовність F1-F10, де F1-F10 являє собою TRRVPVYFDY (SEQ ID NO: 136) або TRRVPIRLDY (SEQ ID NO: 138). Сконструйованим на основі цистеїну анти-CD79b антитілом може бути моноклональне антитіло, фрагмент антитіла, химерне антитіло, гуманізоване антитіло, одноланцюжкове антитіло або антитіло, яке конкурентно інгібує зв'язування антитіла проти поліпептиду CD79b з його відповідним антигенним епітопом. Антитіла згідно з винаходом можуть бути, але необов'язково, кон'юговані з ріст-інгібуючим агентом або з цитотоксичним засобом, таким як токсин, включаючи, наприклад, ауристатин або майтанзиноїд. Антитіла згідно з винаходом можуть бути, але необов'язково, продуковані в клітинах СНО або в бактеріальних клітинах, а переважно ці антитіла інгібують ріст або проліферацію клітин, з якими вони зв'язуються, або індукують загибель цих клітин. Антитіла згідно з винаходом, використовувані в діагностичних цілях, можуть бути детектовано помічені, приєднані до твердого носія або т. п. У одному зі своїх аспектів даний винахід стосується способів одержання антитіла згідно з винаходом. Так, наприклад, даний винахід стосується способу одержання анти-CD79b антитіла (яке, як визначено в даній заявці, включає повнорозмірне антитіло і його фрагменти), де вказаний спосіб включає експресію у придатній клітині-хазяїні рекомбінантного вектора згідно з винаходом, що кодує вказане антитіло (або його фрагмент), і виділення вказаного антитіла. У одному зі своїх аспектів даний винахід стосується фармацевтичної композиції, що включає антитіло згідно з винаходом або кон'югат "антитіло-лікарський засіб" згідно з винаходом і фармацевтично прийнятним розріджувач, носій або ексципієнт. У одному зі своїх аспектів даний винахід стосується промислового виробу, який включає контейнер, і композиції, що міститься в цьому контейнері, де вказана композиція включає одне або декілька анти-CD79b антитіл згідно з винаходом. У одному зі своїх аспектів даний винахід стосується набору, який включає перший контейнер, що містить композицію, яка містить одне або декілька анти-CD79b антитіл згідно з винаходом, і другий контейнер, що містить буфер. У одному зі своїх аспектів даний винахід стосується застосування анти-CD79b антитіла згідно з винаходом з метою одержання лікарського засобу для терапевтичного і/або профілактичного лікування захворювання, такого як рак, пухлина і/або клітиннопроліферативний розлад. У одному зі своїх аспектів даний винахід стосується застосування промислового виробу згідно з винаходом з метою одержання лікарського засобу для терапевтичного і/або профілактичного лікування захворювання, такого як рак, пухлина і/або клітиннопроліферативний розлад. У одному зі своїх аспектів даний винахід стосується застосування набору згідно з винаходом з метою одержання лікарського засобу для терапевтичного і/або профілактичного лікування захворювання, такого як рак, пухлина і/або клітинно-проліферативний розлад. У одному зі своїх аспектів даний винахід стосується способу інгібування росту клітин, експресуючих CD79b, де вказаний спосіб включає контактування вказаної клітини з антитілом згідно з винаходом і тим самим інгібування росту вказаної клітини. У одному з варіантів винаходу вказане антитіло кон'юговане з цитотоксичним засобом. У одному з варіантів винаходу вказане антитіло кон'юговане з ріст-інгібуючим агентом. У одному зі своїх аспектів даний винахід стосується способу терапевтичного лікування ссавця, що має ракову пухлину, яка містить клітини, експресуючі CD79b, де вказаний спосіб включає введення вказаному ссавцю терапевтично ефективної кількості антитіла згідно з винаходом і тим самим ефективне лікування вказаного ссавця. У одному з варіантів винаходу вказане антитіло кон'юговане з цитотоксичним засобом. У одному з варіантів винаходу вказане антитіло кон'юговане з ріст-інгібуючим агентом. У одному зі своїх аспектів даний винахід стосується способу лікування або попередження клітинно-проліферативного розладу, асоційованого з підвищеним рівнем експресії CD79b, де вказаний спосіб включає введення індивідууму, потребуючому такого лікування, ефективної кількості антитіла згідно з винаходом і тим самим ефективне лікування або попередження 6 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 вказаного клітинно-проліферативного розладу. У одному з варіантів винаходу вказаним проліферативним розладом є рак. У одному з варіантів винаходу вказане антитіло кон'юговане з цитотоксичним засобом. У одному з варіантів винаходу вказане антитіло кон'юговане з рістінгібуючим агентом. У одному зі своїх аспектів даний винахід стосується способу інгібування росту клітин, який, щонайменше частково, залежить від ріст-потенціюючої дії CD79b, де вказаний спосіб включає контактування вказаної клітини з ефективною кількістю антитіла згідно з винаходом і тим самим інгібування росту вказаних клітин. У одному з варіантів винаходу вказане антитіло кон'юговане з цитотоксичним засобом. У одному з варіантів винаходу вказане антитіло кон'юговане з рістінгібуючим агентом. У одному зі своїх аспектів даний винахід стосується способу терапевтичного лікування пухлини у ссавця, ріст якої, щонайменше частково, залежить від ріст-потенціюючої дії CD79b, де вказаний спосіб включає контактування вказаної клітини з ефективною кількістю антитіла згідно з винаходом і тим самим ефективне лікування вказаної пухлини. У одному з варіантів винаходу вказане антитіло кон'юговане з цитотоксичним засобом. У одному з варіантів винаходу вказане антитіло кон'юговане з ріст-інгібуючим агентом. У одному зі своїх аспектів даний винахід стосується способу лікування раку, який включає введення пацієнту фармацевтичної композиції, що містить описаний тут імунокон'югат і прийнятний розріджувач, носій або ексципієнт. У одному зі своїх аспектів даний винахід стосується способу інгібування проліферації Вклітин, який включає обробку клітин імунокон'югатом, що містить антитіло згідно з винаходом, в умовах, що сприяють зв'язуванню імунокон'югата з CD79b. У одному зі своїх аспектів даний винахід стосується способу детекції присутності CD79b в зразку, який, як передбачається, містить CD79b, де вказаний спосіб включає обробку вказаного зразка антитілом згідно з винаходом і визначення рівня зв'язування вказаного антитіла з CD79b у вказаному зразку, де зв'язування вказаного антитіла з CD79b у вказаному зразку є показником присутності вказаного білка в даному зразку. У одному зі своїх аспектів даний винахід стосується способу діагностики клітиннопроліферативного розладу, асоційованого із збільшенням числа клітин, таких як В-клітини, експресуючі CD79b, де вказаний спосіб включає контактування тестованих клітин в біологічному зразку з будь-яким з вищезгаданих антитіл; визначення рівня антитіла, зв'язаного з тестованими клітинами в зразку, за допомогою детекції зв'язування вказаного антитіла з CD79b; і порівняння рівнів антитіла, зв'язаного з клітинами в контрольному зразку, де рівень зв'язаного антитіла нормалізують по числу CD79b-експресуючих клітин в тестованих і контрольних зразках, і де більш високий рівень зв'язаного антитіла в тестованому зразку, в порівнянні з контрольним зразком, вказує на наявність клітинно-проліферативного розладу, асоційованого з клітинами, експресуючими CD79b. У одному зі своїх аспектів даний винахід стосується способу детекції розчинного CD79b в крові або сироватці, де вказаний спосіб включає контактування вказаної тестованої проби крові або сироватки, взятої у ссавця, у якого підозрюється В-клітинно-проліферативний розлад, з анти-CD79b антитілом згідно з винаходом, і детекцію збільшення рівня розчинного CD79b в тестованій пробі крові в порівнянні з його рівнем в контрольній пробі крові або сироватки, взятій у здорового ссавця. У одному зі своїх аспектів даний винахід стосується способу зв'язування антитіла згідно з винаходом з клітиною, експресуючою CD79b, де вказаний спосіб включає контактування вказаної клітини з вказаним антитілом згідно з винаходом. У одному з варіантів винаходу вказане антитіло кон'юговане з цитотоксичним агентом. У одному з варіантів винаходу вказане антитіло кон'юговане з ріст-інгібуючим агентом. Короткий опис графічного матеріалу На фігурі 1 представлена нуклеотидна послідовність (SEQ ID NO: 1) кДНК PRO36249, де SEQ ID NO: 1 являє собою клон, позначений "DNA225786" (також званий тут "CD79b"). Нуклеотидна послідовність кодує CD79b зі старт- і стоп-кодонами, які виділені жирним шрифтом і підкреслені. На фігурі 2 представлена амінокислотна послідовність (SEQ ID NO: 2), що походить від кодуючої послідовності SEQ ID NO: 1, представленої на фігурі 1. На фігурі 3 представлена нуклеотидна послідовність (SEQ ID NO: 3) легкого ланцюга химерного мишачого анти-CD79b антитіла (chMA79b) IgG1 (MA79b являє собою мишаче моноклональне анти-CD79b антитіло). Нуклеотидна послідовність кодує легкий ланцюг chMA79b зі старт- і стоп-кодонами, які виділені жирним шрифтом і підкреслені. На фігурі 4 представлена амінокислотна послідовність (SEQ ID NO: 4), яка не містить 7 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 перших 18 амінокислот сигнальної послідовності і походить від кодуючої послідовності SEQ ID NO: 3, представленої на фігурі 3. Варіабельні області не підкреслені. На фігурі 5 представлена нуклеотидна послідовність (SEQ ID NO: 5) важкого ланцюга химерного мишачого антитіла (chMA79b) IgG1 (MA79b являє собою мишаче моноклональне анти-CD79b антитіло). Нуклеотидна послідовність кодує важкий ланцюг chMA79b зі старт- і стоп-кодонами, які виділені жирним шрифтом і підкреслені. На фігурі 6 представлена амінокислотна послідовність (SEQ ID NO: 6), яка не містить перших 18 амінокислот сигнальної послідовності і останнього лізину (K) перед стоп-кодоном і походить від кодуючої послідовності SEQ ID NO: 5, представленої на фігурі 5. Варіабельні області не підкреслені. На фігурах 7A, B показано вирівнювання послідовностей варіабельних легких ланцюгів: консенсусної послідовності людського легкого ланцюга каппа I (позначеної "huKI"; SEQ ID NO: 9) з VL-FR1, VL-FR2, VL-FR3, VL-FR4 (SEQ ID NO: 139-142, відповідно), мишачого анти-CD79b антитіла (позначеного "MA79b"; SEQ ID NO: 10), MA79b-зв'язаного "гуманізованого" антитіла (позначеного "huMA79b-гібрид"; SEQ ID NO: 11), MA79b-зв'язаного варіанта 17 "гуманізованого" антитіла (позначеного "huMA79b.v17"; SEQ ID NO: 169), MA79b-зв'язаного варіанта 18 "гуманізованого" антитіла (позначеного "huMA79b.v18"; SEQ ID NO: 188), MA79b-зв'язаного варіанта 28 "гуманізованого" антитіла (позначеного "huMA79b.v28"; SEQ ID NO: 207) і MA79bзв'язаного варіанта 32 "гуманізованого" антитіла (позначеного "huMA79b.v32"; SEQ ID NO: 226). Положення пронумеровані по Кебату, а гіперваріабельні області (HVR) від MA79b, приєднані до консенсусної каркасної області варіабельної області легкого ланцюга каппа I, вказані в рамках. На фігурах 8A, B проілюстровано вирівнювання послідовностей варіабельних областей важких ланцюгів: консенсусної послідовності людського важкого ланцюга підгрупи III (позначеної "humIII"; SEQ ID NO: 13) з VH-FR1, VH-FR2, VH-FR3 і VH-FR4 (SEQ ID NO: 143-146), мишачого анти-CD79b антитіла (позначеного "MA79b"; SEQ ID NO: 14), MA79b-зв'язаного "гуманізованого" антитіла (позначеного "huMA79b-гібрид"; SEQ ID NO: 15) (що містить 71A, 73T і 78A), MA79bзв'язаного варіанта 17 "гуманізованого" антитіла (позначеного "huMA79b.v17"; SEQ ID NO: 170) (що містить 71A, 73T і 78A), MA79b-зв'язаного варіанта 18 "гуманізованого" антитіла (позначеного "huMA79b.v18"; SEQ ID NO: 189) (що містить 71A, 73T і 78A), MA79b-зв'язаного варіанта 28 "гуманізованого" антитіла (позначеного "huMA79b.v28"; SEQ ID NO: 208) (що містить 71A, 73T і 78A) і MA79b-зв'язаного варіанта 32 "гуманізованого" антитіла (позначеного "huMA79b.v32"; SEQ ID NO: 227) (що містить 71A, 73T і 78A). Положення пронумеровані по Кебату, а гіперваріабельні області (HVR) від MA79b, приєднані до консенсусної каркасної області варіабельної області важкого ланцюга підгрупи III, вказані в рамках. На фігурі 9 представлені різні послідовності HVR вибраних варіантів MA79b-зв'язаного "гуманізованого" антитіла (SEQ ID NO: 17-21), де кожний варіант має одну амінокислотну заміну в одній HVR MA79b-зв'язаного "гуманізованого" антитіла (HVR-L1 (SEQ ID NO: 131); HVR-L2 (SEQ ID NO: 132); HVR-L3 (SEQ ID NO: 133)). Послідовності варіабельної області легкого ланцюга і варіабельної області важкого ланцюга, що знаходяться за межами вказаної однієї амінокислотної заміни, ідентичні huMA79b-гібриду і на фігурі не показані. Яких-небудь змін в HVR-H1 (SEQ ID NO: 134), HVR-H2 (SEQ ID NO: 135) або HVR-H3 (SEQ ID NO: 136) MA79bзв'язаного "гуманізованого" антитіла не спостерігалося. На фігурі 10 представлені різні послідовності HVR вибраних варіантів MA79b-зв'язаного "гуманізованого" антитіла (SEQ ID NO: 22-106), включаючи huMA79b L2-2 (також позначене тут "L2") і huMA79b H3-10 (також позначене тут "H3"), де кожний варіант має множину амінокислотних замін в одній області HVR MA79b-зв'язаного "гуманізованого" антитіла (HVR-L2 (SEQ ID NO: 132); HVR-L3 (SEQ ID NO: 133); HVR-H1 (SEQ ID NO: 134); частина HVR-H3 (SEQ ID NO: 136) показана на фігурі 10 як SEQ ID NO: 107). Послідовності варіабельної області легкого ланцюга і варіабельної області важкого ланцюга, що знаходяться за межами вказаних амінокислотних замін, ідентичні послідовності huMA79b-гібриду і на фігурі не показані. Якихнебудь змін в HVR-L1 (SEQ ID NO: 131) або HVR-H2 (SEQ ID NO: 135) MA79b-зв'язаного "гуманізованого" антитіла не спостерігалося. На фігурі 11 проілюстрований Biacore-аналіз вибраних анти-CD79b антитіл, включаючи мишаче анти-CD79b антитіло (позначене "MA79b"), MA79b-зв'язане "гуманізоване" антитіло (позначене "huMA79b-гібрид") і варіанти MA79b-зв'язаного "гуманізованого" антитіла, включаючи huMA79b L2-2 (52R, 53K, 55G, 56R; SEQ ID NO: 22), huMA79b H3-10 (98I, 99R, 100L; SEQ ID NO: 94), huMA79b H1-6 (28P, 30T, 31R, 35N; SEQ ID NO: 57) і huMA79b L2/H3 (мутації L2-2 і H3-10, описані нижче) проти вказаних антигенів, включаючи позаклітинний домен людського CD79b (huCD79becd), позаклітинний домен людського CD79b, приєднаний до Fc (huCD79becd-Fc) і пептид з 16 амінокислот, що містить епітоп для MA79b і chMA79b (SEQ ID NO: 8 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 16). На фігурі 12 проілюстрований Biacore-аналіз вибраних анти-CD79b антитіл, включаючи MA79b-зв'язане "гуманізоване" антитіло (позначене "huMA79b-гібрид") і варіанти MA79bзв'язаного "гуманізованого" антитіла (позначені як 1-34 в першому стовпці або як "вся каркасна область" в першому стовпці) проти позаклітинного домену людського CD79b (антигену huCD79b-ecd). Варіанти MA79b-зв'язаного "гуманізованого" антитіла включають варіанти "всіх каркасних областей", в яких присутні потенційно важливі мишачі каркасні залишки, і варіанти (позначені 1-34) з комбінаціями мутацій в каркасній області в присутності або за відсутності мутацій HVR варіабельної області важкого ланцюга і варіабельної області легкого ланцюга. Варіант 17 MA79b-зв'язаного "гуманізованого" антитіла (позначений тут "huMA79b.v17") вказаний в першому стовпці як 17, варіант 18 MA79b-зв'язаного "гуманізованого" антитіла (позначений тут "huMA79b.v18") вказаний в першому стовпці як 18, варіант 28 MA79b-зв'язаного "гуманізованого" антитіла (позначений тут "huMA79b.v28") вказаний в першому стовпці як 28, а варіант 32 MA79b-зв'язаного "гуманізованого" антитіла (позначений тут "huMA79b.v32") вказаний в першому стовпці як 32. Укладання, характерне для двовалентного зв'язування, представлене як Kd конкретного варіанта MA79b-зв'язаного "гуманізованого" антитіла (позначена "Kdvariant")/Kd химерного антитіла MA79b (chMA79b) (позначеного "Kdchimera"); величини під стовпцем, озаглавленим "укладання, характерне для двовалентного зв'язування", представляють Kdvariant/Kdchimera. Недетектоване зв'язування позначене на фігурі як "NDB". На фігурах 13A, B (консенсусні каркасні варіабельні області важкого ланцюга (VH)) і на фігурі 14 (консенсусні каркасні варіабельні області легкого ланцюга (VL)) вказані репрезентативні консенсусні каркасні акцепторні послідовності людського антитіла, використовувані для здійснення даного винаходу, разом з послідовностями-ідентифікаторами, такими як: (фігури 13A, B) консенсусна каркасна область людської VH підгрупи I без CDR по Кебату (SEQ ID NO: 108), консенсусна каркасна область людської VH підгрупи I без подовжених гіперваріабельних областей (SEQ ID NO: 109-111), консенсусна каркасна область людської VH підгрупи II без CDR по Кебату (SEQ ID NO: 112), консенсусна каркасна область людської VH підгрупи II без подовжених гіперваріабельних областей (SEQ ID NO: 113-115), консенсусна каркасна область людської VH підгрупи III без CDR по Кебату (SEQ ID NO: 116), консенсусна каркасна область людської VH підгрупи III без подовжених гіперваріабельних областей (SEQ ID NO: 117-119), акцепторна каркасна область людської VH без CDR по Кебату (SEQ ID NO: 120), акцепторна каркасна область людської VH без подовжених гіперваріабельних областей (SEQ ID NO: 121-122), акцепторна каркасна область людської VH2 без CDR по Кебату (SEQ ID NO: 123) і акцепторна каркасна область людської VH2 без подовжених гіперваріабельних областей (SEQ ID NO: 124-26) і (фігура 14) консенсусна каркасна область людської VL каппа підгрупи I (SEQ ID NO: 127), консенсусна каркасна область людської VL каппа підгрупи II (SEQ ID NO: 128), консенсусна людська каркасна область каппа підгрупи III (SEQ ID NO: 129) і консенсусна людська каркасна область каппа підгрупи IV (SEQ ID NO: 130). На фігурах 15A (легкий ланцюг) і 15B (важкий ланцюг) представлені амінокислотні послідовності антитіла згідно з винаходом (huMA79b.v17). На фігурах 15A (легкий ланцюг) і 15B (важкий ланцюг) показані амінокислотні послідовності каркасної області (FR), гіперваріабельної області (HVR), першого константного домену (CL або CH1) і Fc-області (Fc) одного з варіантів антитіла згідно з винаходом (huMA79b.v17) (SEQ ID NO: 152-159 (фігура 15A) і SEQ ID NO: 160168 (фігура 15B)). Також представлені повнорозмірні амінокислотні послідовності (варіабельні і константні області) легкого і важкого ланцюгів huMA79b.v17 (SEQ ID NO: 303 (фігура 15A) і 304 (фігура 15B)), відповідно, з підкресленими константними доменами. Представлені амінокислотні послідовності варіабельних доменів (SEQ ID NO: 169 (фігура 15A для легкого ланцюга) і SEQ ID NO: 170 (фігура 15B для важкого ланцюга)). На фігурах 16A (легкий ланцюг) і 16B (важкий ланцюг) представлені амінокислотні послідовності антитіла згідно з винаходом (huMA79b.v18). На фігурах 16A (легкий ланцюг) і 16B (важкий ланцюг) показані амінокислотні послідовності каркасної області (FR), гіперваріабельної області (HVR), першого константного домену (CL або CH1) і Fc-області (Fc) одного з варіантів антитіла згідно з винаходом (huMA79b.v18) (SEQ ID NO: 171-178 (фігура 16A) і SEQ ID NO: 179187 (фігура 16B)). Також представлені повнорозмірні амінокислотні послідовності (варіабельні і константні області) легкого і важкого ланцюгів huMA79b.v18 (SEQ ID NO: 305 (фігура 16A) і 306 (фігура 16B)), відповідно, з підкресленими константними доменами. Представлені амінокислотні послідовності варіабельних доменів (SEQ ID NO: 188 (фігура 16A для легкого ланцюга) і SEQ ID NO: 189 (фігура 16B для важкого ланцюга)). На фігурах 17A (легкий ланцюг) і 17B (важкий ланцюг) представлені амінокислотні послідовності антитіла згідно з винаходом (huMA79b.v28). На фігурах 17A (легкий ланцюг) і 17B 9 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 (важкий ланцюг) показані амінокислотні послідовності каркасної області (FR), гіперваріабельної області (HVR), першого константного домену (CL або CH1) і Fc-області (Fc) одного з варіантів антитіла згідно з винаходом (huMA79b.v28) (SEQ ID NO: 190-197 (фігура 17A) і SEQ ID NO: 198206 (фігура 17B)). Також представлені повнорозмірні амінокислотні послідовності (варіабельні і константні області) легкого і важкого ланцюгів huMA79b.v28 (SEQ ID NO: 307 (фігура 17A) і 308 (фігура 17B)), відповідно, з підкресленими константними доменами. Представлені амінокислотні послідовності варіабельних доменів (SEQ ID NO: 207 (фігури 7A, В для легкого ланцюга) і SEQ ID NO: 208 (фігури 8А, B для важкого ланцюга)). На фігурах 18A (легкий ланцюг) і 18B (важкий ланцюг) представлені амінокислотні послідовності антитіла згідно з винаходом (huMA79b.v32). На фігурах 18A (легкий ланцюг) і 18B (важкий ланцюг) показані амінокислотні послідовності каркасної області (FR), гіперваріабельної області (HVR), першого константного домену (CL або CH1) і Fc-області (Fc) одного з варіантів антитіла згідно з винаходом (huMA79b.v32) (SEQ ID NO: 209-216 (фігура 18A) і SEQ ID NO: 217225 (фігура 18В)). Також представлені повнорозмірні амінокислотні послідовності (варіабельні і константні області) легкого і важкого ланцюгів huMA79b.v32 (SEQ ID NO: 309 (фігура 18A) і 310 (фігура 18B)), відповідно, з підкресленими константними доменами. Представлені амінокислотні послідовності варіабельних доменів (SEQ ID NO: 226 (фігура 18А для легкого ланцюга) і SEQ ID NO: 227 (фігура 18B для важкого ланцюга)). На фігурі 19 проілюстроване вирівнювання амінокислотних послідовностей CD79b людини (SEQ ID NO: 2), собакоподібних мавп (cyno) (SEQ ID NO: 7) і мишей (SEQ ID NO: 8). Амінокислотні послідовності CD79b людини і собакоподібних мавп ідентичні на 85 %. Також показані сигнальна послідовність, тестований пептид (епітоп з 11 амінокислот для MA79b, chMA79b і антитіла проти CD79b собакоподібних мавп, описані в прикладі 1; ARSEDRYRNPK (SEQ ID NO: 12)), трансмембранний (TM) домен і домен мотиву активації імунорецептора на основі тирозину (ITAM). Область, показана в рамці, являє собою область CD79b, яка відсутня в сплайсованому варіанті CD79b (як описано в прикладі 1). На фігурі 20 представлений графік інгібування росту пухлини in vivo в BJAB-люциферазній моделі ксенотрансплантата, де з вказаного графіка видно, що введення анти-CD79b антитіл ((a) chMA79b-SMCC-DM1, завантаження лікарського засобу становить приблизно 2,9 (таблиця 9) і (b) huMA79b L2/H3-SMCC-DM1, завантаження лікарського засобу становить приблизно 2,4 (таблиця 9)) мишам SCID, що мають людську В-клітинну пухлину, приводить до значного інгібування росту пухлини. Контроль включає Herceptin® (трастузумаб)-SMCC-DM1 (анти-HER2SMCC-DM1). На фігурі 21A представлений графік інгібування росту пухлини in vivo у моделі ксенотрансплантата Granta-519 (людської лімфоми клітин кори головного мозку), де з вказаного графіка видно, що введення анти-CD79b антитіл ((a) chMA79b-SMCC-DM1, завантаження лікарського засобу становить приблизно 3,6 (таблиця 10), (b) huMA79b.v17-SMCC-DM1, завантаження лікарського засобу становить приблизно 3,4 (таблиця 10), (с) huMA79b.v28SMCC-DM1, завантаження лікарського засобу становить приблизно 3,3 або 3,4 (таблиця 10), (d) huMA79b.v18-SMCC-DM1, завантаження лікарського засобу становить приблизно 3,4 (таблиця 10) і (е) huMA79b.v32-SMCC-DM1, завантаження лікарського засобу становить приблизно 2,9 (таблиця 10)) мишам SCID, що мають людську В-клітинну пухлину, приводить до значного інгібування росту пухлини. Контроль включає Herceptin® (трастузумаб)-SMCC-DM1 (анти-HER2SMCC-DM1). На фігурі 21В представлений графік зміни процента по масі у досліджуваних мишей з ксенотрансплантатом Granta-519 (фігура 21A і таблиця 10), що вказує на відсутність яких-небудь значущих змін маси протягом перших 7 днів проведення досліджень. "Нu" означає гуманізоване антитіло, а "ch" означає химерне антитіло. На фігурі 22 представлені кон'югати "сконструйоване на основі цистеїну анти-CD79b антитіло-лікарський засіб" (ADC), де молекула лікарського засобу приєднана до сконструйованої цистеїнової групи: в легкому ланцюзі (LC-ADC); у важкому ланцюзі (HC-ADC); і в Fc-області (Fc-ADC). На фігурі 23 проілюстровані стадії: (i) відновлення аддуктів цистеїнових дисульфідів і міжланцюгових і внутрішньоланцюгових дисульфідів в анти-CD79b антитілі, сконструйованому на основі цистеїну (ThioMab), відновником TCEP (гідрохлоридом трис-(2-карбоксіетил)фосфіну); (ii) часткового окислення, тобто повторного окислення з утворенням міжланцюгових і внутрішньоланцюгових дисульфідів під дією dhAA (дегідроаскорбінової кислоти); і (iii) кон'югування повторно окисленого антитіла з проміжною сполукою "лікарський засіб-лінкер" з утворенням кон'югата "цистеїновое анти-CD79b антитіло-лікарський засіб" (ADC). На фігурі 24 показані (А) послідовність легкого ланцюга (SEQ ID NO: 229) і (В) послідовність важкого ланцюга (SEQ ID NO: 228) гуманізованого анти-CD79b антитіла, сконструйованого на 10 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 основі цистеїну (тіо-huMA79b.v17-HC-A118C), де аланін, присутній в положенні 118 відповідно до Європейської системи нумерації (положення аланіну 118 відповідно до послідовної системи нумерації; положення по Кебату - 114), у важкому ланцюзі був замінений на цистеїн. Молекула лікарського засобу може бути приєднана до введеної цистеїнової групи у важкому ланцюзі. На кожній фігурі модифікована амінокислота показана жирним шрифтом з подвійним підкресленням. Константні області підкреслені однією рискою. Варіабельні області не підкреслені. Fc-область показана курсивом. "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурі 25 показані (А) послідовність легкого ланцюга (SEQ ID NO: 231) і (В) послідовність важкого ланцюга (SEQ ID NO: 230) гуманізованого анти-CD79b антитіла, сконструйованого на основі цистеїну (тіо-huMA79b.v18-HC-A118C), де аланін, присутній в положенні 118 відповідно до Європейської системи нумерації (положення аланіну 118 відповідно до послідовної системи нумерації; положення по Кебату - 114), у важкому ланцюзі був замінений на цистеїн. Молекула лікарського засобу може бути приєднана до введеної цистеїнової групи у важкому ланцюзі. На кожній фігурі модифікована амінокислота показана жирним шрифтом з подвійним підкресленням. Константні області підкреслені однією рискою. Варіабельні області не підкреслені. Fc-область показана курсивом. "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурі 26 показані (А) послідовність легкого ланцюга (SEQ ID NO: 233) і (В) послідовність важкого ланцюга (SEQ ID NO: 232) гуманізованого анти-CD79b антитіла, сконструйованого на основі цистеїну (тіо-huMA79b.v28-HC-A118C), де аланін, присутній в положенні 118 відповідно до Європейської системи нумерації (положення аланіну 118 відповідно до послідовної системи нумерації; положення по Кебату - 114), у важкому ланцюзі був замінений на цистеїн. Молекула лікарського засобу може бути приєднана до введеної цистеїнової групи у важкому ланцюзі. На кожній фігурі модифікована амінокислота показана жирним шрифтом з подвійним підкресленням. Константні області підкреслені однією рискою. Варіабельні області не підкреслені. Fc-область показана курсивом. "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурі 27 показані (А) послідовність легкого ланцюга (SEQ ID NO: 235) і (В) послідовність важкого ланцюга (SEQ ID NO: 234) анти-CD79b антитіла, сконструйованого на основі цистеїну (тіо-huMA79b-LC-V205C), де валін в положенні 205 по Кебату (положення валіну 209 відповідно до послідовної системи нумерації) легкого ланцюга був замінений на цистеїн. Молекула лікарського засобу може бути приєднана до введеної цистеїнової групи в легкому ланцюзі. На кожній фігурі модифікована амінокислота показана жирним шрифтом з подвійним підкресленням. Константні області підкреслені однією рискою. Варіабельні області не підкреслені. Fc-область показана курсивом. "Тіо" означає сконструйоване на основі цистеїну антитіло. На фігурі 28 показані (А) послідовність легкого ланцюга (SEQ ID NO: 237) і (В) послідовність важкого ланцюга (SEQ ID NO: 236) анти-CD79b антитіла, сконструйованого на основі цистеїну (тіо-huMA79b-НC-А118C), де аланін, присутній в положенні 118 відповідно до Європейської системи нумерації (положення аланіну 118 відповідно до послідовної системи нумерації; положення по Кебату - 114), у важкому ланцюзі був замінений на цистеїн. Молекула лікарського засобу може бути приєднана до введеної цистеїнової групи у важкому ланцюзі. На кожній фігурі модифікована амінокислота показана жирним шрифтом з подвійним підкресленням. Константні області підкреслені однією рискою. Варіабельні області не підкреслені. Fc-область показана курсивом. "Тіо" означає сконструйоване на основі цистеїну антитіло. На фігурах 29A, B представлені FACS-графіки, які вказують на те, що зв'язування кон'югатів "анти-CD79b антитіло thioMAb-лікарський засіб" (TDC) згідно з винаходом з CD79b, експресованим на поверхні клітин BJAB, що містять люциферазу, аналогічне зв'язуванню кон'югованих (А) варіантів LC(V205C) тіо-MAb і (В) варіантів HC(A118C) тіо-MAb антитіла chMA79b з MMAF. Детекцію проводили за допомогою мас-спектрометрії (МС) з використанням ФЕ-кон'югованого антитіла проти людського IgG. "Тіо" означає сконструйоване на основі цистеїну антитіло. На фігурах 30A-D представлені FACS-графіки, які вказують на те, що зв'язування кон'югатів "анти-CD79b антитіло thioMAb-лікарський засіб" (TDC) згідно з винаходом з CD79b, експресованим на поверхні клітин BJAB, що містять люциферазу, аналогічне зв'язуванню (А) "оголених" (некон'югованих) варіантів НС(А118С) тіо-MAb huMA79b.v18 і кон'югованих варіантів HC(A118C) тіо-MAb антитіла huMA79b.v18 з різними вказаними кон'югатами лікарських засобів ((В) MMAF, (С) MMAE і (D) DM1)). Детекцію проводили за допомогою мас-спектрометрії (МС) з використанням ФЕ-кон'югованого антитіла проти людського IgG. "Тіо" означає сконструйоване 11 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурах 31A-D представлені FACS-графіки, які вказують на те, що зв'язування кон'югатів "анти-CD79b антитіло thioMAb-лікарський засіб" (TDC) згідно з винаходом з CD79b, експресованим на поверхні клітин BJAB, що містять люциферазу, аналогічне зв'язуванню (А) "оголених" (некон'югованих) варіантів НС(А118С) тіо-MAb huMA79b.v28 і кон'югованих варіантів HC(A118C) тіо-MAb антитіла huMA79b.v28 з різними вказаними кон'югатами лікарських засобів ((В) MMAЕ, (С) DM1 і (D) MMAF)). Детекцію проводили за допомогою мас-спектрометрії (МС) з використанням ФЕ-кон'югованого антитіла проти людського IgG. "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурах 32A-D представлені FACS-графіки, які вказують на те, що зв'язування кон'югатів "антитіло проти CD79b собакоподібних мавп тіо-MAb-лікарський засіб" (TDC) згідно з винаходом з CD79b, експресованим на поверхні BJAB-клітин, експресуючих CD79b собакоподібних мавп, аналогічне зв'язуванню (А) "оголених" (некон'югованих) варіантів НС(А118С) тіо-Mab проти CD79b собакоподібних мавп (ch10D10) і кон'югованих варіантів HC(A118C) тіо-MAb проти CD79b собакоподібних мавп (ch10D10) з різними вказаними кон'югатами лікарських засобів ((В) MMAE, (С) DM1 і (D) MMAF)). Детекцію проводили за допомогою мас-спектрометрії (МС) з використанням ФЕ-кон'югованого антитіла проти людського IgG. "Тіо" означає сконструйоване на основі цистеїну антитіло. На фігурі 33A представлений графік інгібування росту пухлини in vivo у моделей ксенотрансплантата Granta-519 (людської лімфоми клітин кори головного мозку), на якому видно, що введення анти-CD79b TDC, які відрізняються в положеннях введеного цистеїну (LC (V205C) або HC (A118C)) і/або різними дозами лікарського засобу, мишам SCID, що мають людські В-клітинні пухлини, приводить до значного інгібування росту пухлини. Моделі ксенотрансплантата, оброблені тіо-chMA79b-HC(A118C)-MC-MMAF із завантаженням лікарського засобу приблизно 1,9 (таблиця 11) або тіо-chMA79b-LC(V205C)-MC-MMAF із завантаженням лікарського засобу приблизно 1,8 (таблиця 11), виявляли значне інгібування росту пухлини під час дослідження. Як контроль використовували hu-анти-HER2-MC-MMAF, тіоhu-анти-HER2-HC(A118C)-MC-MMAF і chMA79b-MC-MMAF. На фігурі 33B представлений графік зміни процента по масі у досліджуваних мишей з ксенотрансплантатом Granta-519 (фігура 33A і таблиця 11), що вказує на відсутність яких-небудь значущих змін маси протягом перших 14 днів проведення досліджень. "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурі 34A представлений графік інгібування росту пухлини in vivo у моделі ксенотрансплантата клітин BJAB, що містять люциферазу (лімфоми Беркітта), де показано, що введення анти-CD79b TDC, кон'югованих з різними молекулами "лінкер-лікарський засіб" (MCvcPAB-MMAE, BMPEO-DM1 або MC-MMAF), мишам SCID, що мають людські В-клітинні пухлини, приводило до значного інгібування росту пухлини. Моделі ксенотрансплантата, оброблені тіо-huMA79b.v28-HC(A118C)-MCvcPAB-MMAE, із завантаженням лікарського засобу приблизно 1,87 (таблиця 12), тіо-huMA79b.v28-HC(A118C)-BMPEO-DM1, із завантаженням лікарського засобу приблизно 1,85 (таблиця 12), або тіо-huMA79b.v28-HC(A118C)-MC-MMAF, із завантаженням лікарського засобу приблизно 1,95 (таблиця 12), виявляли значне інгібування росту пухлини під час дослідження. Як контроль використовували контрольне анти-HER2 антитіло (тіо-hu-анти-HER2-HC(A118C)-BMPEO-DM1, тіо-hu-анти-HER2-HC(A118C)-MC-MMAF, тіо-hu-анти-HER2-HC(A118C)-MCvcPAB-MMAE), контрольне антитіло huMA79b.v28 (huMA79b.v28-SMCC-DM1 і тіо-huMA79b.v28-HC(A118C)) і контрольне анти-CD22 антитіло (тіоhu-анти-CD22(10F4v3)-HC(A118C)-MC-MMAF). На фігурі 34B представлений графік зміни процента маси досліджуваних мишей з ксенотрансплантатом BJAB-люциферази (фігура 34А і таблиця 12), що вказує на відсутність яких-небудь значущих змін маси протягом перших 7 днів проведення досліджень. "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурі 35A представлений графік інгібування росту пухлини in vivo у моделі ксенотрансплантата WSU-DLCL2 (дифузної великоклітинної лімфоми), де показано, що введення анти-CD79b TDC, кон'югованих з різними молекулами "лінкер-лікарський засіб" (MCvcPAB-MMAE, BMPEO-DM1 або MC-MMAF), мишам SCID, що мають людські В-клітинні пухлини, приводило до значного інгібування росту пухлини. Моделі ксенотрансплантата, оброблені тіо-huMA79b.v28-HC(A118C)-MCvcPAB-MMAE, із завантаженням лікарського засобу приблизно 1,87 (таблиця 13), тіо-huMA79b.v28-HC(A118C)-BMPEO-DM1, із завантаженням лікарського засобу приблизно 1,85 (таблиця 13), або тіо-huMA79b.v28-HC(A118C)-MC-MMAF, із завантаженням лікарського засобу приблизно 1,95 (таблиця 13), виявляли значне інгібування росту пухлини під час дослідження. Як контроль використовували контрольне анти-HER2 12 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіло (тіо-hu-анти-HER2-HC(A118C)-BMPEO-DM1, тіо-hu-анти-HER2-HC(A118C)-MC-MMAF, тіо-hu-анти-HER2-HC(A118C)-MCvcPAB-MMAE), контрольне антитіло huMA79b.v28 (huMA79b.v28-SMCC-DM1 і тіо-huMA79b.v28-HC(A118C)) і контрольне анти-CD22 антитіло (тіоhu-анти-CD22(10F4v3)-HC(A118C)-MC-MMAF). На фігурі 35B представлений графік зміни процента маси досліджуваних мишей з ксенотрансплантатом WSU-DLCL2 (фігура 35А і таблиця 13), що вказує на відсутність яких-небудь значущих змін маси протягом перших 7 днів проведення досліджень. "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурі 36 представлений графік інгібування росту пухлини in vivo у моделі ксенотрансплантата DOHH2 (фолікулярної лімфоми), де показано, що введення анти-CD79b TDC, кон'югованих з різними молекулами "лінкер-лікарський засіб" (BMPEO-DM1, MC-MMAF або MCvcPAB-MMAE), мишам SCID, що мають людські В-клітинні пухлини, приводило до значного інгібування росту пухлини. Моделі ксенотрансплантата, оброблені тіо-huMA79b.v28-BMPEODM1, із завантаженням лікарського засобу приблизно 1,85 (таблиця 14), тіо-huMA79b.v28-MCMMAF, із завантаженням лікарського засобу приблизно 1,95 (таблиця 14), або тіо-МА796HC(A118C)-MCvcPAB-MMAE, із завантаженням лікарського засобу приблизно 1,87 (таблиця 14), виявляли значне інгібування росту пухлини під час дослідження. Як контроль використовували контрольне анти-HER2 антитіло (тіо-hu-анти-HER2-HC(A118C)-BMPEO-DM1, тіо-hu-анти-HER2HC(A118C)-MC-MMAF, тіо-hu-анти-HER2-HC(A118C)-MCvcPAB-MMAE), контрольне антитіло huMA79b.v28 (huMA79b.v28-SMCC-DM1 і тіо-huMA79b.v28-HC(A118C)) і контрольне анти-CD22 антитіло (тіо-hu-анти-CD22(10F4v3)-HC(A118C)-MC-MMAF). "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурі 37 представлений графік інгібування росту пухлини in vivo у моделі ксенотрансплантата клітин BJAB, що містять люциферазу (лімфоми Беркітта), де показано, що введення анти-CD79b TDC, кон'югованих з різними молекулами "лінкер-лікарський засіб" (MCvcPAB-MMAE, BMPEO-DM1 або MC-MMAF) і/або в різних дозах, мишам SCID, що мають людські В-клітинні пухлини, приводило до значного інгібування росту пухлини. Моделі ксенотрансплантата, оброблені тіо-huMA79b.v28-HC(A118C)-BMPEO-DM1, із завантаженням лікарського засобу приблизно 1,85 (таблиця 15), тіо-huMA79b.v28-HC(A118C)-MCvcPAB-MMAE, із завантаженням лікарського засобу приблизно 1,9 (таблиця 15), або тіо-huMA79b.v28HC(A118C)-MC-MMAF, із завантаженням лікарського засобу приблизно 1,9 (таблиця 15), виявляли значне інгібування росту пухлини під час дослідження. Як контроль використовували носій (тільки буфер), контрольне анти-HER2 антитіло (тіо-hu-анти-HER2-HC(A118C)-BMPEODM1, тіо-hu-анти-HER2-HC(A118C)-MC-MMAF, тіо-hu-анти-HER2-HC(A118C)-MCvcPAB-MMAE), контрольне антитіло huMA79b.v28 (тіо-huMA79b.v28-HC(A118C)) і контрольне анти-CD22 антитіло (тіо-hu-анти-CD22(10F4v3)-HC(A118C)-MC-MMAF). "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурі 38A представлений графік інгібування росту пухлини in vivo у моделі ксенотрансплантата Granta-519 (людської лімфоми клітин кори головного мозку), де показано, що введення анти-CD79b TDC, кон'югованих з різними молекулами "лінкер-лікарський засіб" (BMPEO-DM1 або MC-MMAF) і/або в різних дозах, мишам SCID, що мають людські В-клітинні пухлини, приводило до значного інгібування росту пухлини. Моделі ксенотрансплантата, оброблені тіо-huMA79b.v28-HC(A118C)-BMPEO-DM1, із завантаженням лікарського засобу приблизно 1,85 (таблиця 16), або тіо-huMA79b.v28-HC(A118C)-MC-MMAF, із завантаженням лікарського засобу приблизно 1,95 (таблиця 16), виявляли значне інгібування росту пухлини під час дослідження. Як контроль використовували контрольне анти-HER2 антитіло (тіо-hu-антиHER2-HC(A118C)-BMPEO-DM1, тіо-hu-анти-HER2-HC(A118C)-MC-MMAF). На фігурі 38B представлений графік зміни процента маси досліджуваних мишей з ксенотрансплантатом Granta-519 (фігура 38А і таблиця 16), що вказує на відсутність яких-небудь значущих змін маси протягом перших 14 днів проведення досліджень. "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурі 39 представлений графік інгібування росту пухлини in vivo у моделі ксенотрансплантата WSU-DLCL2 (дифузної великоклітинної лімфоми), де показано, що введення анти-CD79b TDC, кон'югованих з різними молекулами "лінкер-лікарський засіб" (BMPEO-DM1, MC-MMAF або MCvcPAB-MMAE) і/або в різних дозах, мишам SCID, що мають людські В-клітинні пухлини, приводило до значного інгібування росту пухлини. Моделі ксенотрансплантата, оброблені тіо-huMA79b.v28-HC(A118C)-BMPEO-DM1, із завантаженням лікарського засобу приблизно 1,85 (таблиця 17), тіо-huMA79b.v28-HC(A118C)-MC-MMAF, із завантаженням лікарського засобу приблизно 1,9 (таблиця 17), або тіо-huMA79b.v28HC(A118C)-MCvcPAB-MMAE, із завантаженням лікарського засобу приблизно 1,9 (таблиця 17), 13 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 виявляли значне інгібування росту пухлини під час дослідження. Як контроль використовували носій (тільки буфер) і контрольне анти-HER2 антитіло (тіо-hu-анти-HER2-HC(A118C)-BMPEODM1, тіо-hu-анти-HER2-HC(A118C)-MC-MMAF, тіо-hu-анти-HER2-HC(A118C)-MCvcPAB-MMAE). "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурі 40 представлений графік інгібування росту пухлини in vivo у моделі ксенотрансплантата Granta-519 (людської лімфоми клітин кори головного мозку), де показано, що введення анти-CD79b TDC, кон'югованих з різними молекулами "лінкер-лікарський засіб" (BMPEO-DM1 або MCvcPAB-MMAE) і/або в різних дозах, мишам SCID, що мають людські Вклітинні пухлини, приводило до значного інгібування росту пухлини. Моделі ксенотрансплантата, оброблені тіо-huMA79b.v28-HC(A118C)-BMPEO-DM1, із завантаженням лікарського засобу приблизно 1,85 (таблиця 18), або тіо-huMA79b.v28-HC(A118C)-MCvcPABMMAE, із завантаженням лікарського засобу приблизно 1,87 (таблиця 18), виявляли значне інгібування росту пухлини під час дослідження. Як контроль використовували контрольне антиHER2 антитіло (тіо-hu-анти-HER2-HC(A118C)-BMPEO-DM1, тіо-hu-анти-HER2-HC(A118C)MCvcPAB-MMAЕ). "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурі 41 представлений графік, побудований за результатами аналізу на проліферацію пухлинних клітин in vitrо (А) BJAB, (В) Granta-519 або (С) WSU-DLCL2, оброблених різними концентраціями 0,001-10000 нг TDC на мл, включаючи: (1) контрольне антитіло тіо-hu-анти-gDHC(A118C)-MCvcPAB-MMAE, із завантаженням 2,0 MMAE/Ab, (2) контрольне антитіло тіо-huанти-gD-HC(A118C)-MC-MMAF, із завантаженням 2,1 MMAF/Ab, (3) контрольне антитіло тіо-huанти-gD-HC(A118C)-BMPEO-DM1, із завантаженням 2,1 DM1/Ab, (4) тіо-huMA79b.v18HC(A118C)-MC-MMAF, із завантаженням 1,91 MMAF/Ab, (5) тіо-huMA79b.v18-HC(A118C)BMPEO-DM1, із завантаженням 1,8 DM1/Ab, і (6) тіо-huMA79b.v28-HC(A118C)-MCvcPAB-MMAE, із завантаженням 2,0 MMAE/Ab. "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. "gD" означає глікопротеїн D. На фігурі 42 представлена нуклеотидна послідовність кДНК (SEQ ID NO: 238) PRO283627, де SEQ ID NO: 235 являє собою клон, позначений "DNA548455" (також називаний тут "cyno CD79b"). Нуклеотидна послідовність кодує CD79b собакоподібних мавп зі старт- і стопкодонами, які вказані жирним шрифтом і підкреслені. На фігурі 43 представлена амінокислотна послідовність (SEQ ID NO: 239), що походить від кодуючої послідовності SEQ ID NO: 235, представленої на фігурі 42. На фігурі 44 представлена нуклеотидна послідовність (SEQ ID NO: 240) легкого ланцюга антитіла проти CD79b собакоподібних мавп (ch10D10). Нуклеотидна послідовність кодує легкий ланцюг антитіла проти CD79b собакоподібних мавп (ch10D10) зі старт- і стоп-кодонами, які вказані жирним шрифтом і підкреслені. На фігурі 45 представлена амінокислотна послідовність (SEQ ID NO: 241), яка не містить перших 18 амінокислот сигнальної послідовності і походить від кодуючої послідовності SEQ ID NO: 240, представленої на фігурі 44. Варіабельні області (SEQ ID NO: 302) не підкреслені. На фігурі 46 представлена нуклеотидна послідовність (SEQ ID NO: 242) важкого ланцюга антитіла проти CD79b собакоподібних мавп (ch10D10). Нуклеотидна послідовність кодує важкий ланцюг антитіла проти CD79b собакоподібних мавп (ch10D10) зі старт- і стоп-кодонами, які вказані жирним шрифтом і підкреслені. На фігурі 47 представлена амінокислотна послідовність (SEQ ID NO: 243), яка не містить перших 18 амінокислот сигнальної послідовності і останнього лізину (K) перед стоп-кодоном і походить від кодуючої послідовності SEQ ID NO: 242, представленої на фігурі 46. Варіабельні області (SEQ ID NO: 301) не підкреслені. На фігурі 48 показані (А) послідовність легкого ланцюга (SEQ ID NO: 245) і (В) послідовність важкого ланцюга (SEQ ID NO: 244) антитіла проти CD79b собакоподібних мавп, сконструйованого на основі цистеїну (тіо-анти-cynoCD79b-HC-A118C), де аланін, присутній в положенні 118 відповідно до Європейської системи нумерації (положення аланіну 118 відповідно до послідовної системи нумерації; положення по Кебату - 114), у важкому ланцюзі був замінений на цистеїн. Амінокислота D в положенні 6 відповідно до Європейської системи нумерації (на фігурі заштрихована) у важкому ланцюзі може альтернативно являти собою Е. Молекула лікарського засобу може бути приєднана до введеної цистеїнової групи у важкому ланцюзі. На кожній фігурі модифікована амінокислота показана жирним шрифтом з подвійним підкресленням. Константні області підкреслені однією рискою. Варіабельні області не підкреслені. Fc-область показана курсивом. "Тіо" означає сконструйоване на основі цистеїну антитіло. На фігурі 49 показані (А) послідовність легкого ланцюга (SEQ ID NO: 300) і (В) послідовність 14 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 важкого ланцюга (SEQ ID NO: 299) антитіла проти CD79b собакоподібних мавп, сконструйованого на основі цистеїну (тіо-анти-cynoCD79b-LC-V205C), де валін в положенні 205 по Кебату (положення валіну 209 надане відповідно до послідовної системи нумерації) в легкому ланцюзі був замінений на цистеїн. Амінокислота D в положенні 6 відповідно до Європейської системи нумерації (на фігурі заштрихована) у важкому ланцюзі може альтернативно являти собою Е. Молекула лікарського засобу може бути приєднана до введеної цистеїнової групи важкого ланцюга. На кожній фігурі модифікована амінокислота показана жирним шрифтом з подвійним підкресленням. Константні області підкреслені однією рискою. Варіабельні області не підкреслені. Fc-область показана курсивом. "Тіо" означає сконструйоване на основі цистеїну антитіло. На фігурі 50 представлений графік інгібування росту пухлини in vivo у моделі ксенотрансплантата BJAB-cynoCD79b (клітини BJAB, експресуючі cynoCD79b) (лімфоми Беркітта), де показано, що введення анти-CD79b TDC, кон'югованих з різними молекулами "лінкер-лікарський засіб" (BMPEO-DM1, MC-MMAF або MCvcPAB-MMAE), мишам SCID, що мають людські В-клітинні пухлини, приводило до значного інгібування росту пухлини. Моделі ксенотрансплантата, оброблені тіо-huMA79b.v28-HC(A118C)-BMPEO-DM1, із завантаженням лікарського засобу приблизно 1,85 (таблиця 19), тіо-huMA79b.v28-HC(A118C)-MC-MMAF, із завантаженням лікарського засобу приблизно 1,9 (таблиця 19), або тіо-huMA79b.v28HC(A118C)-MCvcPAB-MMAE, із завантаженням лікарського засобу приблизно 1,9 (таблиця 19), тіо-анти-cyno-CD79b(ch10D10)-HC(A118C)-BMPEO-DM1, із завантаженням лікарського засобу приблизно 1,8 (таблиця 19), тіо-анти-cyno-CD79b(ch10D10)-HC(A118C)-MC-MMAF, із завантаженням лікарського засобу приблизно 1,9 (таблиця 19), або тіо-анти-cynoCD79b(ch10D10)-HC(A118C)-MCvcPAB-MMAE, із завантаженням лікарського засобу приблизно 1,86 (таблиця 19), виявляли значне інгібування росту пухлини під час дослідження. Як контроль використовували контрольне анти-HER2 антитіло (тіо-hu-анти-HER2-HC(A118C)-BMPEO-DM1, тіо-hu-анти-HER2-HC(A118C)-MCvcPAB-MMAE, тіо-hu-анти-HER2-HC(A118C)-MC-MMAF). "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло. На фігурі 51 представлений графік інгібування росту пухлини in vivo у моделі ксенотрансплантата BJAB-cynoCD79b (клітини BJAB, експресуючі cynoCD79b) (лімфоми Беркітта), де показано, що введення анти-CD79b TDC, кон'югованих з різними молекулами "ВМРЕО-DM1-лінкер-лікарський засіб", в різних дозах мишам SCID, що мають людські В-клітинні пухлини, приводило до значного інгібування росту пухлини. Моделі ксенотрансплантата, оброблені тіо-huMA79b.v28-HC(A118C)-BMPEO-DM1, із завантаженням лікарського засобу приблизно 1,85 (таблиця 20), або тіо-анти-cyno(ch10D10)-HC(A118C)-BMPEO-DM1, із завантаженням лікарського засобу приблизно 1,8 (таблиця 20), виявляли значне інгібування росту пухлини під час дослідження. Як контроль використовували контрольне анти-HER2 антитіло (тіо-hu-анти-HER2-HC(A118C)-BMPEO-DM1), контрольне антитіло huMA79b.v28 (тіоhuMA79b.v28-HC(A118C)) і контрольне антитіло anti-cynoCD79b(ch10D10) (тіо-антиcynoCD79b(ch10D10)-HC(A118C)). "Тіо" означає сконструйоване на основі цистеїну антитіло, а "hu" означає гуманізоване антитіло.) Докладний опис переважних варіантів здійснення винаходу Даний винахід стосується способів, композицій, наборів і промислових виробів, застосовуваних для ідентифікації композицій, використовуваних для лікування гемопоетичної пухлини у ссавців, і способів застосування таких композицій згідно з винаходом у вказаних цілях. Докладний опис вказаних способів, композицій, наборів і промислових виробів наводиться нижче. I. Загальні методи Даний винахід може бути здійснений, якщо це не обумовлено особливо, стандартними методами, використовуваними в молекулярній біології (включаючи рекомбінантні методи), в мікробіології, біології клітини, біохімії і імунології і відомими фахівцям. Такі методи детально описані в літературі, наприклад, в керівництві "Molecular Cloning: А Laboratory Manual", second edition (Sambrook et al., 1989); "Oligonucleotide Synthesis" (M. J. Gait, ed., 1984); "Animal Cell Culture" (R. I. Freshney, ed., 1987); "Methods in Enzymology" (Academic Press, Inc.); "Current Protocols in Molecular Biology" (F. M. Ausubel et al., eds., 1987, і в сучасних періодичних виданнях); "PCR: The Polymerase Chain Reaction", (Mullis et al., ed., 1994); "А Practical Guide to Molecular Cloning" (Perbal Bernard V., 1988); "Phage Display: А Laboratory Manual" (Barbas et al., 2001). II. Визначення Для кращого розуміння даного винаходу, нижче наводяться визначення термінів, 15 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовуваних в даному описі, при цьому, якщо це не обумовлено особливо, мається на увазі, що терміни, використовувані в однині, можуть означати і іменники у множині, і навпаки. Якщо при визначенні будь-якого терміна в цьому описі виникають протиріччя з визначенням, що наводиться в будь-якому документі, який вводиться в даний опис за допомогою посилання, то вони можуть бути врегульовані відповідно до опису, представленого нижче. Використовуваний тут термін "маркер В-клітинної поверхні" або "антиген В-клітинній поверхні" означає антиген, експресований на поверхні В-клітини, на яку може бути направлений антагоніст, що зв'язується з цією клітиною, включаючи, але не обмежуючись ними, антитіла проти антигену В-клітинної поверхні або розчинної форми антигену В-клітинній поверхні, що мають здатність інгібувати зв'язування ліганду з природним В-клітинним антигеном. Прикладами маркерів В-клітинної поверхні є маркери поверхні лейкоцитів, такі як CD10, CD19, CD20, CD21, CD22, CD23, CD24, CD37, CD40, CD53, CD72, CD73, CD74, CDw75, CDw76, CD77, CDw78, CD79a, CD79b, CD80, CD81, CD82, CD83, CDw84, CD85 і CD86 (опис див. в публікації The Leukocyte Antigen Facts Book, 2nd Edition, 1997, ed. Barclay et al., Academic Press, Harcourt Brace & Co., New York). Іншими маркерами В-клітинної поверхні є RP105, FcRH2, В-клітинний CR2, CCR6, P2 × 5, HLA-DOB, CXCR5, FCER2, BR3, BAFF, BLyS, Btig, NAG14, SLGC16270, FcRH1, IRTA2, ATWD578, FcRH3, IRTA1, FcRH6, BCMA і 239287. Маркер В-клітинної поверхні, що представляє особливий інтерес, експресується переважно на В-клітинах, на відміну від інших не-В-клітинних тканин ссавця, і може експресуватися як на В-клітинах-попередниках, так і на зрілих В-клітинах. Використовуваний тут термін "CD79b" означає будь-який природний CD79b, що походить від будь-яких хребетних, включаючи ссавців, таких як примати (наприклад, людина, собакоподібні мавпи (cyno)) і гризуни (наприклад, миші і щури), якщо це не обумовлено особливо. Людський CD79b також позначається тут "PRO36249" (SEQ ID NO: 2) і кодується нуклеотидною послідовністю (SEQ ID NO: 1), також позначуваною тут "DNA225786". CD79b собакоподібних мавп також позначається тут "cyno-CD79b" або "PRO283627" (SEQ ID NO: 239) і кодується нуклеотидною послідовністю (SEQ ID NO: 238), також позначуваною тут "DNA548455". Термін "CD79b" охоплює "повнорозмірний" непроцесований CD79b, а також будь-яку форму CD79b, яка утворюється в результаті процесингу в клітині. Цей термін також охоплює природні варіанти CD79b, наприклад, сплайсовані варіанти, алельні варіанти і ізоформи. Описані тут поліпептиди CD79b можуть бути виділені з різних джерел, наприклад, з людських тканин або з інших джерел, або вони можуть бути одержані рекомбінантними методами або методами синтезу. "Нативна послідовність поліпептиду CD79b" включає поліпептид, що має таку ж амінокислотну послідовність, як і відповідний природний поліпептид CD79b. Такі поліпептиди CD79b з нативною послідовністю можуть бути виділені з природного джерела, або вони можуть бути одержані рекомбінантними методами або методами синтезу. Термін "поліпептид CD79b з нативною послідовністю", зокрема, охоплює природні усічені або секретовані форми специфічного поліпептиду CD79b (наприклад, послідовність позаклітинного домену), природні варіанти (наприклад, альтернативно сплайсовані форми) і природні алельні варіанти поліпептиду. У деяких варіантах винаходу описані тут поліпептиди CD79b з нативною послідовністю являють собою зрілі поліпептиди або повнорозмірні поліпептиди з нативною послідовністю, що містять повнорозмірні амінокислотні послідовності, представлені в описі графічного матеріалу. У описі графічного матеріалу, старт- і стоп-кодони (якщо вони вказані) показані жирним шрифтом і підкреслені. Залишки нуклеїнової кислоти, позначені "N" в описі графічного матеріалу, являють собою будь-які залишки нуклеїнової кислоти. Хоч поліпептиди CD79b, вказані в описі графічного матеріалу, починаються з метіонінових залишків, позначених в даному описі як положення амінокислоти 1, однак, можливо, що як початковий амінокислотний залишок для поліпептидів CD79b можуть бути використані і інші метіонінові залишки, розташовані вище або нижче від положення амінокислоти 1, як показано в описі графічного матеріалу. Використовувані тут терміни "MA79b" або "мишаче анти-CD79b антитіло" або "мишаче антитіло проти CD79b", зокрема, означають мишаче моноклональне анти-CD79b антитіло, яке містить варіабельний домен легкого ланцюга SEQ ID NO: 10 (фігури 7A, B) і варіабельний домен важкого ланцюга SEQ ID NO: 14 (фігури 8A, B). Мишаче моноклональне анти-CD79b антитіло може бути закуплене у комерційних фірм, таких як Biomeda (антитіло проти людського CD79b; Foster City, CA), BDbioscience (антитіло проти людського CD79b; San Diego, CA) або Ancell (антитіло проти людського CD79b; Bayport, MN), або воно може бути виділене з гібридомного клону 3A2-2E7, депонованого в Американській колекції типових культур (ATCC) під депозитарним номером HB11413, наданим ATCC 20 липня 1993 р. Використовуваний тут термін "chMA79b" або "химерне антитіло MA79b", зокрема, означає 16 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 химерне антитіло проти людського CD79b (описане раніше в заявці на патент США № 11/462336, поданій 3 серпня 2006 р.), де вказане химерне анти-CD79b антитіло містить легкий ланцюг SEQ ID NO: 4 (фігура 4). Легкий ланцюг SEQ ID NO: 4 також містить варіабельний домен SEQ ID NO: 10 (фігури 7A, B) і константний домен легкого ланцюга людського IgG1. Химерне анти-CD79b антитіло також містить важкий ланцюг SEQ ID NO: 6 (фігура 6). Важкий ланцюг SEQ ID NO: 6 також містить варіабельний домен SEQ ID NO: 14 (фігури 8A, B) і константний домен важкого ланцюга людського IgG1. Використовуваний тут термін "анти-cynoCD79b" або "антитіло проти CD79b собакоподібних мавп" означає антитіла, які зв'язуються з CD79b собакоподібних мавп (SEQ ID NO: 239 фігури 43) (як було описано раніше в заявці на патент США № 11/462336, поданій 3 серпня 2006 р.). Використовуваний тут термін "анти-cynoCD79b (ch10D10)" або "ch10D10" означає химерне антитіло проти CD79b собакоподібних мавп (описане раніше в заявці на патент США № 11/462336, поданій 3 серпня 2006 р.), яке зв'язується з CD79b собакоподібних мавп (SEQ ID NO: 239 фігури 43). Анти-cynoCD79b(ch10D10) або ch10D10 являє собою химерне антитіло проти CD79b собакоподібних мавп, яке містить легкий ланцюг SEQ ID NO: 241 (фігура 45). АнтиcynoCD79b(ch10D10) або ch10D10 також містить важкий ланцюг SEQ ID NO: 243 (фігура 47). Використовуваний тут термін "MA79b-гібрид" або "MA79b-зв'язане гуманізоване антитіло", або "huMA79b-гібрид", зокрема, означає гібрид, одержаний шляхом приєднання гіперваріабельних областей, що походять від мишачого анти-CD79b антитіла (MA79b), до акцепторної послідовності людської консенсусної VL каппа I (huKI) і людської консенсусної VH підгрупи III (huIII) із замінами R71A, N73T і L78A (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992)) (див. приклад 1A і фігури 7 (SEQ ID NO: 11) і 8 (SEQ ID NO: 15)). Використовуваний тут термін "модифікація" амінокислотного залишку/положення означає заміну в первинній амінокислотній послідовності в порівнянні з вихідною амінокислотною послідовністю, де вказана заміна відбувається внаслідок модифікації послідовності, що включає вказані амінокислотні залишки/положення. Так, наприклад, типовими модифікаціями є заміна залишку (або залишку у вказаному положенні) іншим амінокислотним залишком (наприклад, консервативна або неконсервативна заміна), інсерція однієї або декількох (звичайно менше ніж 5 або 3) амінокислот, суміжних з вказаним залишком/положенням, і делеція вказаного залишку/положення. Термін "амінокислотна заміна" або її варіант означає заміну наявного амінокислотного залишку є в попередньо визначеній (вихідній) амінокислотній послідовності іншим амінокислотним залишком. Взагалі кажучи і переважно, модифікація приводить до зміни щонайменше однієї фізико-біохімічної активності поліпептидного варіанта в порівнянні з активністю поліпептиду, що містить вихідну амінокислотну послідовність (або "послідовність дикого типу"). Так, наприклад, у випадку антитіл, зміненою фізико-біохімічною активністю може бути афінність зв'язування з молекулою-мішенню, здатність зв'язуватися з молекулою-мішенню і/або вплив на зв'язування з молекулою-мішенню. Використовуваний тут термін "антитіло" застосовується в найбільш широкому значенні, зокрема, охоплює окремі моноклональні анти-CD79b антитіла (включаючи агоністи, антагоністи, нейтралізуючі антитіла, повнорозмірні моноклональні антитіла або інтактні моноклональні антитіла), композиції анти-CD79b антитіл, що мають поліепітопну специфічність, поліклональні антитіла, полівалентні антитіла, мультиспецифічні антитіла (наприклад, біспецифічні антитіла, при умові, що вони мають потрібну біологічну активність), утворені щонайменше з двох інтактних антитіл, одноланцюжкові анти-CD79b антитіла і фрагменти анти-CD79b антитіл (див. нижче), включаючи Fab-, Fab'-, F(ab')2- і Fv-фрагменти, діантитіла, однодоменні антитіла (sdAb), при умові, що вони мають потрібну біологічну або імунологічну активність. Використовувані тут терміни "імуноглобулін (Ig)" і "антитіло" є синонімами. Антитіло може бути людським, гуманізованим і/або афінно зрілим. Термін "анти-CD79b антитіло" або "антитіло, яке зв'язується з CD79b" означає антитіло, яке здатне зв'язуватися з CD79b з афінністю, достатньою для використання даного антитіла як діагностичного і/або терапевтичного засобу, націленого на CD79b. Переважно рівень зв'язування анти-CD79b антитіла з неспорідненим білком, тобто білком, що не є CD79b, складає менше ніж приблизно 10 % від зв'язування антитіла з CD79b, як було визначено за допомогою, наприклад, радіоімуноаналізу (РІА). У деяких варіантах винаходу, антитіло, що зв'язується з CD79b, має константу дисоціації (Kd), що складає ≤1 мкM, ≤100 нM, ≤10 нM, ≤1 нM або ≤0,1 нM. У деяких варіантах винаходу анти-CD79b антитіло зв'язується з епітопом CD79b, який є консервативним у CD79b різних видів. "Виділене" антитіло являє собою антитіло, яке було ідентифіковане і виділене і/або очищене від компонентів його природного оточення. Контамінуючими компонентами його природного оточення є матеріали, що негативно впливають на терапевтичну ефективність антитіла, і 17 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 такими компонентами можуть бути ферменти, гормони і інші білкові або небілкові розчинені речовини. У переважних варіантах винаходу, вказане антитіло може бути очищене: (1) на більше ніж 95 % по масі антитіла, як може бути визначено методом Лаурі, а більш переважно не більше ніж на 99 % по масі антитіла, (2) до міри, достатньої для одержання щонайменше 15 залишків у N-кінцевій або внутрішній частини амінокислотної послідовності, що може бути визначено з використанням секвенатора, забезпеченого центрифужною посудиною, або (3) до гомогенності, що може бути підтверджено за допомогою електрофорезу в ДСН-ПААГ у відновних або невідновних умовах з фарбуванням кумасі синім або, переважно, сріблом. Термін "виділене антитіло" включає антитіло in situ в рекомбінантних клітинах, якщо відсутній щонайменше один природний компонент цього антитіла. Однак звичайно виділене антитіло може бути одержане щонайменше в одній стадії очищення. Основна 4-ланцюжкова молекула антитіла являє собою гетеротетрамерний глікопротеїн, що складається з двох ідентичних легких (L) ланцюгів і двох ідентичних важких (Н) ланцюгів (антитіло IgM складається з 5 основних гетеротетрамерних молекул разом з додатковим поліпептидом, називаним J-ланцюгом, а тому воно містить 10 антигензв'язувальних сайтів, а секретовані антитіла IgА можуть полімеризуваться з утворенням полівалентних конструкцій, що містять 2-5 основних 4-ланцюжкових молекул разом з J-ланцюгом). У випадку IgG 4-ланцюжкова молекула в основному має розмір приблизно 150000 Дальтон. Кожний L-ланцюг зв'язаний з Нланцюгом одним ковалентним дисульфідним зв'язком, а два Н-ланцюги зв'язані один з одним одним або декількома дисульфідними зв'язками залежно від ізотипу Н-ланцюга. Кожний Н- і Lланцюг також має рівномірно розташовані внутрішньоланцюгові дисульфідні містки. Кожний Нланцюг має біля свого N-кінця варіабельний домен (VH), за яким ідуть три константних домени (CH) для кожного з α- і γ-ланцюгів, і чотири СН-домени для ізотипів μ і ε. Кожний L-ланцюг має біля свого N-кінця варіабельний домен (VL), за яким іде константний домен (CL) біля його іншого кінця. VL розташований на одній лінії з VH, а CL розташований на одній лінії з першим константним доменом важкого ланцюга (CH1). Очевидно, що конкретні амінокислотні залишки утворюють приганичну область між варіабельними доменами легкого ланцюга і важкого ланцюга. Спарювання VH і VL приводить до утворення одного антигензв'язувального сайта. Структура і властивості антитіл різних класів описані, наприклад, в публікації Basic and Clinical Immunology, 8th edition, Daniel Р. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, CT, 1994, page 71 and Chapter 6. L-ланцюг, що походить від антитіла хребетних будь-якого виду, може належати до одного з двох чітко розрізнюваних типів, званих каппа і лямбда, виходячи з амінокислотних послідовностей їх константних доменів. Імуноглобуліни, залежно від амінокислотної послідовності константного домену їх важких ланцюгів (CH), можуть бути віднесені до різних класів або ізотипів. Існує п'ять класів імуноглобулінів: IgA, IgD, IgE, IgG і IgM, що мають важкі ланцюги, позначувані α, δ, ε, γ і μ, відповідно. Класи γ і α також підрозділені на підкласи, виходячи з відносно невеликих відмінностей в послідовностях і функціях CH, наприклад, у людини експресуються імуноглобуліни наступних підкласів: IgG1, IgG2, IgG3, IgG4, IgA1 і IgA2. Терміни "варіабельна область" або "варіабельний домен" антитіла означають амінокінцеві домени важкого або легкого ланцюга антитіла. Варіабельний домен важкого ланцюга може називатися "VH". Варіабельний домен легкого ланцюга може називатися "VL". Ці домени в основному є найбільш варіабельними частинами антитіла і містять антигензв'язувальні сайти. Термін "варіабельний" стосується деяких сегментів варіабельних доменів, які мають значні відмінності в послідовностях різних антитіл. Домен V опосередковує зв'язування з антигеном і визначає специфічність конкретного антитіла до конкретного антигену. Однак варіабельність нерівномірно розподіляється по всіх варіабельних доменах, що складаються з 110 амінокислот. Але звичайно області V складаються з відносно інваріантних сегментів, називаних каркасними областями (FR), що складаються з 15-30 амінокислот, відділених більш короткими областями з гіперваріабельністю, називаними "гіперваріабельними областями", кожна з яких має довжину в 9-12 амінокислот. Кожний варіабельний домен нативного важкого і легкого ланцюгів містить чотири FR, що мають, головним чином, β-складчасту конфігурацію і з'єднані трьома гіперваріабельними областями, які утворюють петлі, що з'єднують, а в деяких випадках створюють частину β-складчастої структури. Гіперваріабельні області в кожному ланцюзі утримуються в безпосередній близькості одна від одної за допомогою FR і, разом з гіперваріабельними областями іншого ланцюга, беруть участь в утворенні антигензв'язувального сайта антитіл (див. Kabat et al. Sequences of Proteins of Immunological Interest, Sth. Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Константні домени не беруть безпосередньої участі в зв'язуванні антитіла з антигеном, але мають різні ефекторні функції, такі як участь антитіла в антитілозалежній клітинній 18 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 цитотоксичності (ADCC). "Інтактне" антитіло являє собою антитіло, що містить антигензв'язувальний сайт, а також CL і щонайменше константні домени важкого ланцюга, CH 1, CH2 і CH3. Константні домени можуть являти собою константні домени нативної послідовності (наприклад, константні домени людської нативної послідовності) або варіанти їх амінокислотних послідовностей. Інтактне антитіло переважно має одну або декілька ефекторних функцій. Використовуваний тут термін "оголене антитіло" означає антитіло, яке не є кон'югованим з цитотоксичною молекулою або радіоактивною міткою. "Фрагменти антитіл" містять частину інтактного антитіла, а переважно антигензв'язувальну або варіабельну область інтактного антитіла. Прикладами фрагментів антитіл є Fab-, Fab'-, F(ab')2- і Fv-фрагменти; діантитіла; лінійні антитіла (див. патент США № 5641870, приклад 2; Zapata et al., Protein Eng. 8(10):1057-1062 [1995]); молекули одноланцюжкових антитіл; і мультиспецифічні антитіла, утворені з фрагментів антитіл. У одному з варіантів винаходу фрагмент антитіла містить антигензв'язувальний сайт інтактного антитіла, а тому він зберігає свою здатність зв'язуватися з антигеном. В результаті гідролізу антитіл папаїном утворюються два ідентичних антигензв'язувальних фрагменти, званих "Fab"-фрагментами, і один "Fc"-фрагмент, що залишився, назва якого вказує на його здатність легко кристалізуватися. Fab-фрагмент складається з повнорозмірного Lланцюга разом з доменом варіабельної області Н-ланцюга (VH) і першого константного домену одного важкого ланцюга (CH1). Кожний Fab-фрагмент є одновалентним відносно зв'язування з антигеном, тобто він має один антигензв'язувальний сайт. В результаті обробки антитіла пепсином утворюється один великий F(ab')2-фрагмент, який приблизно відповідає двом зв'язаним дисульфідним зв'язком Fab-фрагментам, що мають двовалентну антигензв'язувальну активність і здатність перехресно зв'язуватися з антигеном. Fab'-фрагменти відрізняються від Fab-фрагментів присутністю декількох додаткових залишків біля карбоксикінця домену CH1, включаючи один або декілька цистеїнів, що походять від шарнірної області антитіла. Fab'-SH, використовуваний в даній заявці, являє собою Fab', в якому цистеїновий(і) залишок(ки) константних доменів має(ють) вільну тіолову групу. F(ab') 2-фрагменти антитіла спочатку були одержані у вигляді пар Fab'-фрагментів, які мають розташовані між ними шарнірні цистеїни. Фахівцям також відомі інші методи хімічного зв'язування фрагментів антитіл. Fc-фрагмент містить карбоксикінцеві частини обох Н-ланцюгів, зв'язаних за допомогою дисульфідних зв'язків. Ефекторні функції антитіл визначають по послідовностях Fc-області, які являють собою також частини, розпізнавані Fc-рецепторами (FcR), що знаходяться на клітинах деяких типів. "Fv" являє собою мінімальний фрагмент антитіла, що містить повнорозмірний антигенрозпізнавальний сайт і антигензв'язувальний сайт. Цей фрагмент складається з димеру одного варіабельного домену важкого ланцюга і одного варіабельного домену легкого ланцюга, жорстко зв'язаних один з одним нековалентним зв'язком. У одноланцюжковому Fv (scFv) один варіабельний домен важкого ланцюга і один варіабельний домен легкого ланцюга можуть бути ковалентно зв'язані гнучким пептидним лінкером, в результаті чого легкий і важкий ланцюги можуть асоціюватися один з одним з утворенням "димерної" структури, аналогічної структурі дволанцюжкових Fv. Після укладання цих двох доменів утворюється шість гіперваріабельних петель (3 петлі, кожна з яких походить від Н- і L-ланцюга), які забезпечують амінокислотні залишки для зв'язування з антигеном і надають антитілу специфічність зв'язування з антигеном. Однак навіть один варіабельний домен (або половина Fv, що містить тільки три CDR, специфічних до антигену) має здатність розпізнавати антиген і зв'язуватися з ним, хоч і з меншою афінністю, ніж весь сайт зв'язування. "Одноланцюжкові Fv-фрагменти", також позначувані "sFv" або "scFv", являють собою фрагменти антитіла, які включають домени VH і VL антитіла, з'єднані в одному поліпептидному ланцюзі. Переважно поліпептид scFv також містить між доменами VH і VL поліпептидний лінкер, який забезпечує утворення scFv зі структурою, необхідною для зв'язування з антигеном. Опис scFv можна знайти в роботі Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Borrebaeck 1995, див. нижче. Термін "діантитіла" означає фрагменти антитіл з двома антигензв'язувальними сайтами, де вказані фрагменти включають варіабельний домен важкого ланцюга (VH), з'єднаний з варіабельним доменом легкого ланцюга (VL) в одному і тому ж поліпептидному ланцюзі (VHVL). Невеликі фрагменти антитіл одержують шляхом конструювання scFv-фрагментів (див. попередній абзац) з використанням коротких лінкерів (приблизно 5-10 залишків) між доменами VH і VL так, щоб досягалося міжланцюгове, але не внутрішньоланцюгове, спарювання доменів 19 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 V, з утворенням двовалентного фрагмента, тобто фрагмента, що має два антигензв'язувальних сайти. Діантитіла можуть бути двовалентними або біспецифічними. Біспецифічними діантитілами є гетеродимери двох "перехресно зв'язаних" scFv-фрагментів, в яких домени VH і VL двох антитіл присутні на різних поліпептидних ланцюгах. Діантитіла більш детально описані, наприклад, в EP 404097; WO 93/11161; Hudson et al., Nat. Med. 9:129-134 (2003); і Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993). Триантитіла і тетраантитіла також описані в публікації Hudson et al., Nat. Med. 9:129-134 (2003). Використовуваний тут термін "моноклональне антитіло" означає антитіло, одержане від популяції в основному гомогенних антитіл, тобто окремих антитіл, які входять в цю популяцію і є ідентичними за винятком можливих природних мутацій, що можуть бути присутніми в невеликих кількостях. Моноклональні антитіла є у високій мірі специфічними і направлені проти однієї антигенної детермінанти. Крім того, на відміну від препаратів поліклональних антитіл, які включають різні антитіла, направлені проти різних детермінант (епітопів), кожне моноклональне антитіло направлене проти однієї детермінанти на антигені. Крім своєї специфічності, моноклональні антитіла мають ту перевагу, що вони можуть бути синтезовані так, щоб вони не містили домішок інших антитіл. Термін "моноклональний" не означає, що дане антитіло повинно бути продуковане яким-небудь конкретним методом. Так, наприклад, моноклональні антитіла згідно з винаходом можуть бути одержані за допомогою гібридомної технології, уперше описаної Kohler et al. (1975) Nature 256:495, або вони можуть бути одержані методами рекомбінантних ДНК в клітинах бактерій, еукаріотичних організмів або рослин (див., наприклад, патент США № 4816567). "Моноклональні антитіла" можуть бути також виділені з фагових бібліотек антитіл методами, описаними, наприклад, Clackson et al., Nature, 352:624-628 (1991) і Marks et al., J. Mol. Biol., 222:581-597 (1991). Використовувані тут моноклональні антитіла включають, зокрема, "химерні" антитіла, в яких частина важкого і/або легкого ланцюга ідентична або гомологічна відповідним послідовностям антитіл, які походять від конкретного виду або належать до конкретного класу або підкласу антитіл, а інший(і) ланцюг(и) ідентичний(і) або гомологічний(і) відповідним послідовностям антитіл, які походять від іншого виду або належать до іншого класу або підкласу антитіл, а також включають фрагменти таких антитіл, при умові, що вони мають потрібну біологічну активність (див. патент США № 4816567 і публікацію Morrison et al. Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). Химерними антитілами, що представляють інтерес, згідно з винаходом є "приматизовані" антитіла, які містять антигензв'язувальні послідовності варіабельних доменів, що походять від послідовностей константної області приматів, які не є людиною (наприклад, мавп, людиноподібних мавп і т. п.), і людини. "Гуманізовані форми" нелюдських антитіл (наприклад, антитіл гризунів) являють собою химерні антитіла, які містять мінімальну послідовність, що походить від нелюдського антитіла. Здебільшого, гуманізовані антитіла являють собою людські імуноглобуліни (антитіло-реципієнт), в яких залишки, що походять від гіперваріабельної області антитіла-реципієнта, замінені залишками, що походять від гіперваріабельної області нелюдського антитіла (донорного антитіла), такого як мишаче антитіло, щуряче антитіло, кроляче антитіло або антитіло приматів, які не є людиною, де вказані антитіла мають потрібну специфічність, афінність і зв'язувальну здатність. У деяких випадках залишки каркасної області (FR) людського імуноглобуліну замінені відповідними залишками нелюдського антитіла. Крім того, гуманізовані антитіла можуть містити залишки, які не виявляються в антитілі-реципієнті або в антитілі-донорі. Ці модифікації вводять для поліпшення властивостей антитіла. У загальних рисах, гуманізоване антитіло може містити в основному всі або щонайменше один, а звичайно два варіабельних домени, в яких всі або майже всі гіперваріабельні петлі відповідають гіперваріабельним петлям нелюдського імуноглобуліну, і всі або майже всі FR являють собою FR з послідовністю людського імуноглобуліну. Гуманізоване антитіло також містить, але необов'язково, щонайменше частину константної області імуноглобуліну (Fc), звичайно області людського імуноглобуліну. Більш докладний опис див. у Jones et al. Nature, 321:522-525 (1986); Riechmann et al. Nature 332:323329 (1998) і Presta Curr. Op. Struct. Biol., 2:593-596 (1992). Див. також нижченаведені оглядові статті і цитовані там роботи: Vaswani and Hamilton, Ann. Allergy, Asthma and Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994). Використовуваний тут термін "тіо" стосується антитіла, сконструйованого на основі цистеїну, а використовуваний тут термін "hu" стосується гуманізованого антитіла. "Людське антитіло" являє собою антитіло, що має амінокислотну послідовність, яка відповідає амінокислотній послідовності антитіла, продукованого у людини і/або одержаного будь-яким з методів продукування людських антитіл, описаних в даній заявці. Це визначення 20 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 людського антитіла, зокрема, виключає гуманізоване антитіло, що містить антигензв'язувальні залишки нелюдського антитіла. Людські антитіла можуть бути одержані різними методами, відомими фахівцям, включаючи використання бібліотек фагового представлення. Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991). Для одержання людських моноклональних антитіл можуть бути також застосовані методи, описані в публікації Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, р. 77 (1985); Boerner et al., J. Immunol., 147(1):86-95 (1991). Див. також van Dijk & van de Winkel, Curr. Opin. Pharmacol., 5:36874 (2001). Людські антитіла можуть бути одержані шляхом введення антигену трансгенній тварині, яка була модифікована з метою продукування таких антитіл у відповідь на антигенну стимуляцію, але у якої були блоковані ендогенні локуси, наприклад, у імунізованої миші з ксенотрансплантатом (див., наприклад, патенти США №№ 6075181 і 6150584, що стосуються технології XENOMOUSE™). Див. також, наприклад, публікацію Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006), що стосується людських антитіл, одержаних із застосуванням технології людських В-клітинних гібридом. Використовувані тут терміни "гіперваріабельна область", "HVR" або "HV" означають області варіабельного домену антитіла, які є в даній послідовності гіперваріабельними і/або утворюють петлі певної структури. У загальних рисах, вказані антитіла містять шість гіперваріабельних областей; три області в VH (Н1, Н2, Н3) і три області в VL (L1, L2, L3). У даній заявці використовується ряд гіперваріабельних областей, які входять в обсяг даного винаходу. Гіперваріабельні області (області, що визначають комплементарність (CDR)) по Кебату мають високу міру варіабельності послідовності і знаходять широке застосування (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Замість визначення гіперваріабельних областей по Кебату, Чотія запропонував визначати гіперваріабельні області по локалізації структурних петель (Chothia & Lesk, J. Mol.Biol. 196:901-917 (1987)). Кінець петлі CDR-H1 по Чотія, при нумерації відповідно до нумерації Кебата, варіюється між положеннями H32 і H34 залежно від довжини петлі (це відбувається тому, що згідно зі схемою нумерації по Кебату інсерції знаходяться в положеннях H35A і H35B; при цьому, якщо не присутній ні 35A, ні 35B, то петля закінчується в положенні 32; якщо присутній тільки 35A, то петля закінчується в положенні 33; а якщо присутні 35A і 35B, то петля закінчується в положенні 34). Визначення гіперваріабельних областей AbМ являє собою компроміс між "CDR" по Кебату і "структурними петлями" по Чотія, і такі визначення використовуються в комп'ютерній програмі по моделюванню антитіл Oxford Molecular's AbМ. "Контактні" гіперваріабельні області визначають, виходячи з аналізу наявних складних кристалічних структур. Залишки кожної з цих гіперваріабельних областей наводяться нижче. Петля По Кебату AbМ По Чотія Контактні області L1 L24-L34 L24-L34 L26-L32 L30-L36 L2 L50-L56 L50-L56 L50-L52 L46-L55 L3 L89-L97 L89-L97 L91-L96 L89-L96 Н1 Н31-Н35В Н26-Н35В Н26-Н32 Н30-Н35В (Нумерація по Кебату) Н1 Н31-Н35 Н26-Н35 Н26-Н32 Н30-Н35 (Нумерація по Чотія) Н2 Н50-Н65 Н50-Н58 Н53-Н55 Н47-Н58 Н3 Н95-Н102 Н95-Н102 Н96-Н101 Н93-Н101 Термін "гіперваріабельні області" може включати "подовжені гіперваріабельні області", а саме: 24-36 або 24-34 (L1), 46-56 або 50-56 (L2) і 89-97 (L3) в VL; і 26-35В (Н1), 50-65, 47-65 або 49-65 (Н2) і 93-102, 94-102 або 95-102 (Н3) в VH. Залишки варіабельних доменів для кожного з вказаних визначень пронумеровані по Кебату і ін., див. вище. "Каркасними" або "FR" залишками є залишки варіабельних доменів, за винятком залишків гіперваріабельних областей, визначених вище. Використовуваний тут термін "залишок варіабельного домену, пронумерований по Кебату" або "положення амінокислоти, пронумероване по Кебату" і їх варіанти означає систему, використовувану для нумерації варіабельних доменів важкого ланцюга або варіабельних доменів легкого ланцюга антитіл, описаної в довіднику по антитілах Кебата (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Відповідно до цієї системи нумерації фактична первинна амінокислотна послідовність може містити менше число або додаткове число амінокислот, відповідне укороченій або подовженій FR- або CDR-області варіабельного домену. Так, наприклад, варіабельний домен важкого ланцюга може включати інсерцію однієї амінокислоти (залишку 52а відповідно до нумерації Кебата) після залишку 52 Н2, і залишки (наприклад, 21 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 залишки 82а, 82b і 82с і т. п., відповідно до нумерації Кебата), вбудовані після залишку 82 FR важкого ланцюга. Нумерація залишків даного антитіла по Кебату може бути здійснена після вирівнювання його послідовності в областях гомології зі "стандартною" послідовністю, пронумерованою по Кебату. Система нумерації по Кебату звичайно застосовується до залишків у варіабельному домені (приблизно залишків 1-107 легкого ланцюга і залишків 1-113 важкого ланцюга) (наприклад, Kabat et al., Sequences of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Європейська система нумерації "EU" або "Eu-індекс" звичайно застосовується до залишків константної області важкого ланцюга імуноглобуліну (наприклад, EU-індекс описаний у Kabat et al., див. вище). Термін "EU-індекс по Кебату" означає нумерацію залишків людського антитіла IgG1 відповідно до Європейської системи нумерації. Якщо це не вказане в даному описі, то вказівка на число залишків у варіабельному домені антитіл означає залишки, пронумеровані відповідно до системи нумерації Кебата. Якщо це не вказане в даному описі, то вказівка на число залишків в константному домені антитіл означає залишки, пронумеровані відповідно до Європейської системи нумерації (див., наприклад, попередню заявку на патент США № 60/640323; на фігурах надана Європейська нумерація). "Афінно зрілим" антитілом є антитіло, що має одну або декілька модифікацій в одній або декількох HVR, де вказані модифікації приводять до підвищення афінності антитіла до антигену, в порівнянні з батьківським антитілом, яке не має таку(их) модифікацію(ій). Переважні афінно зрілі антитіла мають наномолярні або навіть пікомолярні афінності до антигену-мішені. Афінно зрілі антитіла одержують методами, відомими фахівцям. У публікації Marks et al. Bio/Technology 10:779-783 (1992) описане дозрівання афінності за допомогою перестановки доменів VH і VL. Неспецифічний мутагенез HVR і/або каркасних залишків описаний в публікаціях Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); і Hawkins et al, J. Mol. Biol. 226:889-896 (1992). "Блокуюче" антитіло або "антитіло-антагоніст" являє собою антитіло, яке інгібує або знижує біологічну активність антигену, з яким воно зв'язується. Переважні блокуючі антитіла або антитіла-антагоністи в основному або повністю інгібують біологічну активність антигену. Використовуваний тут термін "антитіло-агоніст" означає антитіло, яке імітує щонайменше одну з функціональних активностей поліпептиду, що представляє інтерес. "Видоспецифічне антитіло", наприклад, антитіло ссавця проти людського IgE, являє собою антитіло, яке має більш високу афінність зв'язування з антигеном, що походить від ссавця першого виду, в порівнянні з гомологом антигену, що походить від ссавця другого виду. Звичайно видоспецифічне антитіло "специфічно зв'язується" з людським антигеном (тобто має -7 величину афінності зв'язування (Kd) не більше ніж приблизно 1×10 M, переважно не більше -8 -9 ніж приблизно 1×10 М, а найбільш переважно не більше ніж приблизно 1×10 M), тоді як афінність зв'язування з гомологом антигену, що походить від ссавця другого виду, що не є людиною, щонайменше приблизно в 50 разів або щонайменше приблизно в 500 разів, або щонайменше приблизно в 1000 разів нижче афінності зв'язування з людським антигеном. Видоспецифічне антитіло може являти собою будь-яке з антитіл різних типів, визначених вище, але переважно таким антитілом є гуманізоване або людське антитіло. Термін "афінність зв'язування" по суті означає силу сумарних нековалентних взаємодій одного сайта зв'язування молекули (наприклад, антитіла) з його партнером по зв'язуванню (наприклад, з антигеном). Якщо це не обумовлено особливо, то використовуваний тут термін "афінність зв'язування" означає природну афінність зв'язування, при якій відбувається взаємодія 1:1 між членами пар зв'язування (наприклад, антитіла з антигеном). Афінність зв'язування молекули Х з її партнером Y, в загальних рисах, може називатися константою дисоціації (Kd). Афінність може бути визначена стандартними методами, відомими фахівцям, включаючи описані тут методи. Низькоафінні антитіла звичайно зв'язуються з антигеном з меншою швидкістю і мають тенденцію легко дисоціюватися, тоді як високоафінні антитіла звичайно зв'язуються з антигеном з більшою швидкістю і мають тенденцію залишатися зв'язаними протягом більш тривалого періоду часу. Фахівцям в даній галузі відомі різні методи вимірювання афінності зв'язування, і для здійснення даного винаходу може бути застосований будь-який з цих методів. Конкретні репрезентативні варіанти здійснення винаходу описані нижче. Використовуване тут визначення "або вище", якщо воно застосовується відносно афінності зв'язування, означає більш високий рівень зв'язування молекули з її партнером по зв'язуванню. Використовуване тут визначення "або вище", якщо воно застосовується в даній заявці, означає більш сильне зв'язування, що визначається меншим числовим значенням Kd. Так, наприклад, 22 UA 106586 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіло, яке має афінність зв'язування з антигеном "0,6 нM або вище", означає антитіло, яке має афінність зв'язування з антигеном
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-cd79b antibodies and immunoconjugates and methods of use
Автори англійськоюChen, Yvonne, Dennis, Mark, Dornan, David, Elkins, Kristi, Junutula, Jagath, Reddy, Polson, Andrew, Zheng, Bing
Автори російськоюДеннис Марк
МПК / Мітки
МПК: C12N 15/13, A61K 47/48, C07K 16/28, A61P 35/00, A61K 39/395
Мітки: антитіла, застосування, імунокон'югати, анти-cd79b, способи
Код посилання
<a href="https://ua.patents.su/342-106586-anti-cd79b-antitila-i-imunokonyugati-ta-sposobi-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Анти-cd79b антитіла, і імунокон’югати та способи їх застосування</a>
Попередній патент: Спосіб одержання синтетичного газу
Наступний патент: Химерний цирковірус свиней pcv2gen-1rep та його застосування
Випадковий патент: Кормороздавач












