Протимікробна композиція
Номер патенту: 102709
Опубліковано: 12.08.2013
Автори: Дресбек Девід С., Бьюрак Ерік С., Лорд Деніелль Берер, Лі Данпін
Формула / Реферат
1. Фармацевтична композиція, що містить
(a) похідне хінолонкарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір, причому зазначене похідне хінолонкарбонової кислоти відповідає наступній сполуці (А)
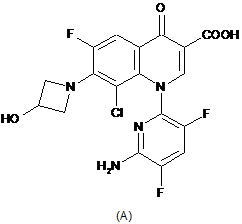
i
(b) циклодекстрин, де зазначений циклодекстрин вибраний з бета-циклодекстрину і сульфоалкілефірного похідного циклодекстрину формули 1
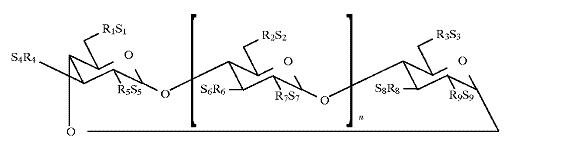
Формула 1,
де n дорівнює 4, 5 або 6;
кожен з R1, R2, R3, R4, R5, R6, R7, R8 і R9 у формулі 1 незалежно являє собою О- або О-(С2-6алкілен)-SО3- групу, і щонайменше один з R1 і R2 незалежно являє собою зазначену О-(С2-6алкілен)-SО3- групу; і
кожен з S1, S2, S3, S4, S5, S6, S7, S8 і S9 незалежно являє собою фармацевтично прийнятний катіон, при цьому зазначена композиція характеризується відсутністю вихідного циклодекстрину згідно з даними тонкошарової хроматографії.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що зазначений циклодекстрин являє собою бета-циклодекстрин і зазначений бета-циклодекстрин являє собою гідроксіалкіл-бета-циклодекстрин.
3. Фармацевтична композиція за п. 2, яка відрізняється тим, що зазначений гідроксіалкіл-бета-циклодекстрин являє собою гідроксипропіл-бета-циклодекстрин.
4. Фармацевтична композиція за п. 1, яка відрізняється тим, що зазначений циклодекстрин являє собою бета-циклодекстрин формули (3)
![]() ,
,
де R являє собою гідроксипропіл, причому зазначений бета-циклодекстриновий ефір має розчинність у воді, яка дорівнює більш ніж 1,8 г в 1000 мл води.
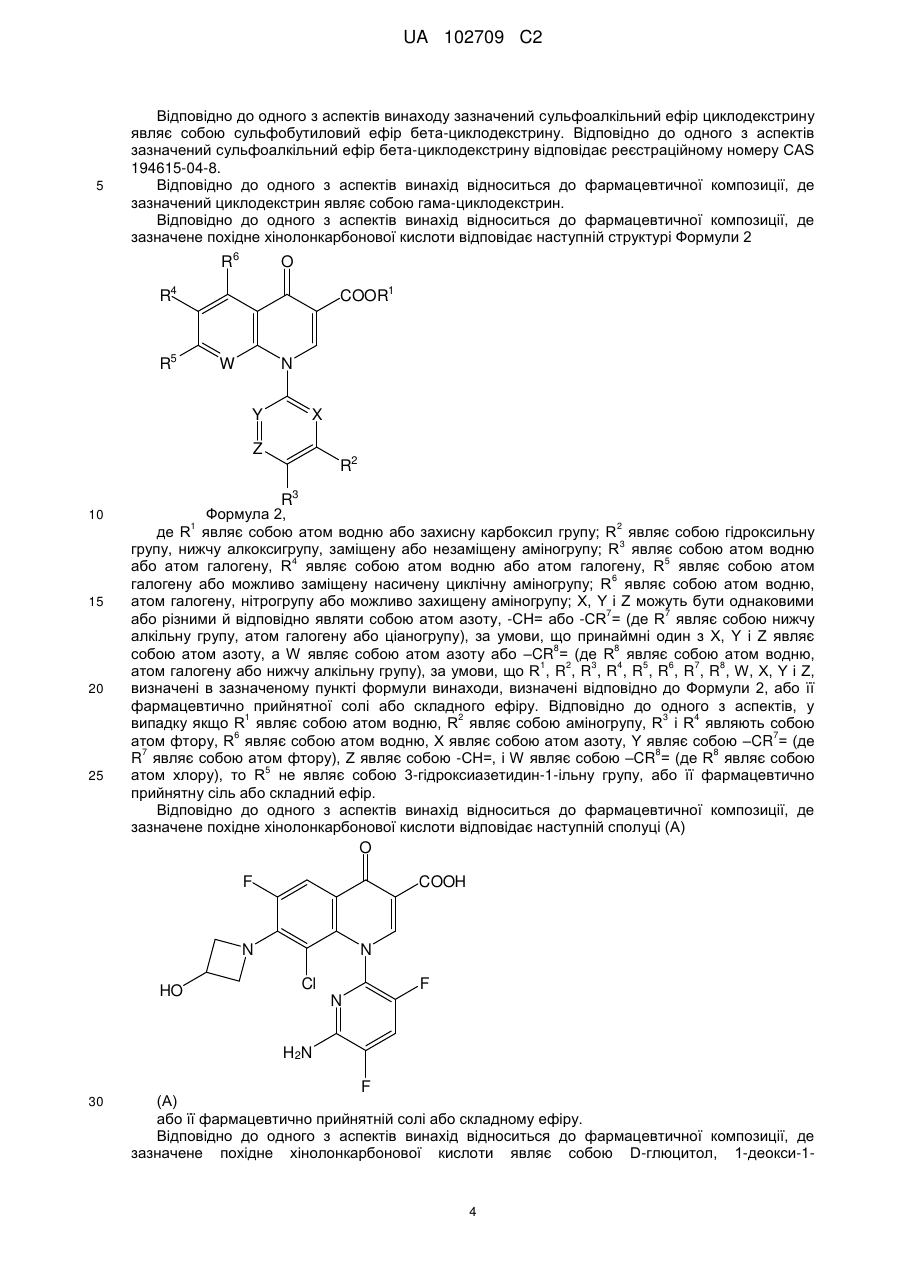
5. Фармацевтична композиція за п. 3, яка відрізняється тим, що зазначений гідроксипропіл-бета-циклодекстрин відповідає реєстраційному номеру CAS 128446-35-5.
6. Фармацевтична композиція за п. 1, яка відрізняється тим, що циклодекстрин являє собою сульфоалкілефірне похідне циклодекстрину формули 1 і щонайменше один з R4, R6 і R8 незалежно являє собою зазначену О-(С2-6алкілен)-SО3- групу, а кожен з R5, R7 і R9 являє собою О-.
7. Фармацевтична композиція за п. 1, яка відрізняється тим, що зазначений циклодекстрин являє собою сульфоалкільний ефір циклодекстрину і зазначений сульфоалкільний ефір циклодекстрину являє собою сульфобутиловий ефір бета-циклодекстрину.
8. Фармацевтична композиція за п. 6, яка відрізняється тим, що зазначений сульфоалкіловий ефір бета-циклодекстрину каптизол.
9. Фармацевтична композиція за п. 1, яка відрізняється тим, що зазначене похідне хінолонкарбонової кислоти являє собою D-глюцитол, 1-дезокси-1-(метиламіно)-, 1-(6-аміно-3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідроксі-1-азетидиніл)-4-оксо-3-хінолінкарбоксилат (сіль).
10. Фармацевтична композиція за п. 1, яка відрізняється тим, що зазначене похідне хінолонкарбонової кислоти являє собою D-глюцитол, 1-деокси-1-(метиламіно)-, 1-(6-аміно-3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1-азетидиніл)-4-оксо-3-хінолінкарбоксилату тригідрат (сіль).
11. Фармацевтична композиція за п. 1, яка додатково містить хелатоутворюючий агент.
12. Фармацевтична композиція за п. 11, яка відрізняється тим, що зазначений хелатоутворюючий агент являє собою динатрій ЕДТА.
13. Фармацевтична композиція за п. 1, яка додатково містить полігідроксіамінну сполуку.
14. Фармацевтична композиція за п. 13, яка відрізняється тим, що зазначена полігідроксіамінна сполука являє собою меглумін.
15. Фармацевтична композиція за п. 1, яка відрізняється тим, що зазначене похідне хінолонкарбонової кислоти має помітно покращену розчинність у порівнянні з похідним хінолонкарбонової кислоти у воді, та/або композиція має покращену стабільність, та/або композиція забезпечує помітне покращення переносимості у венах.
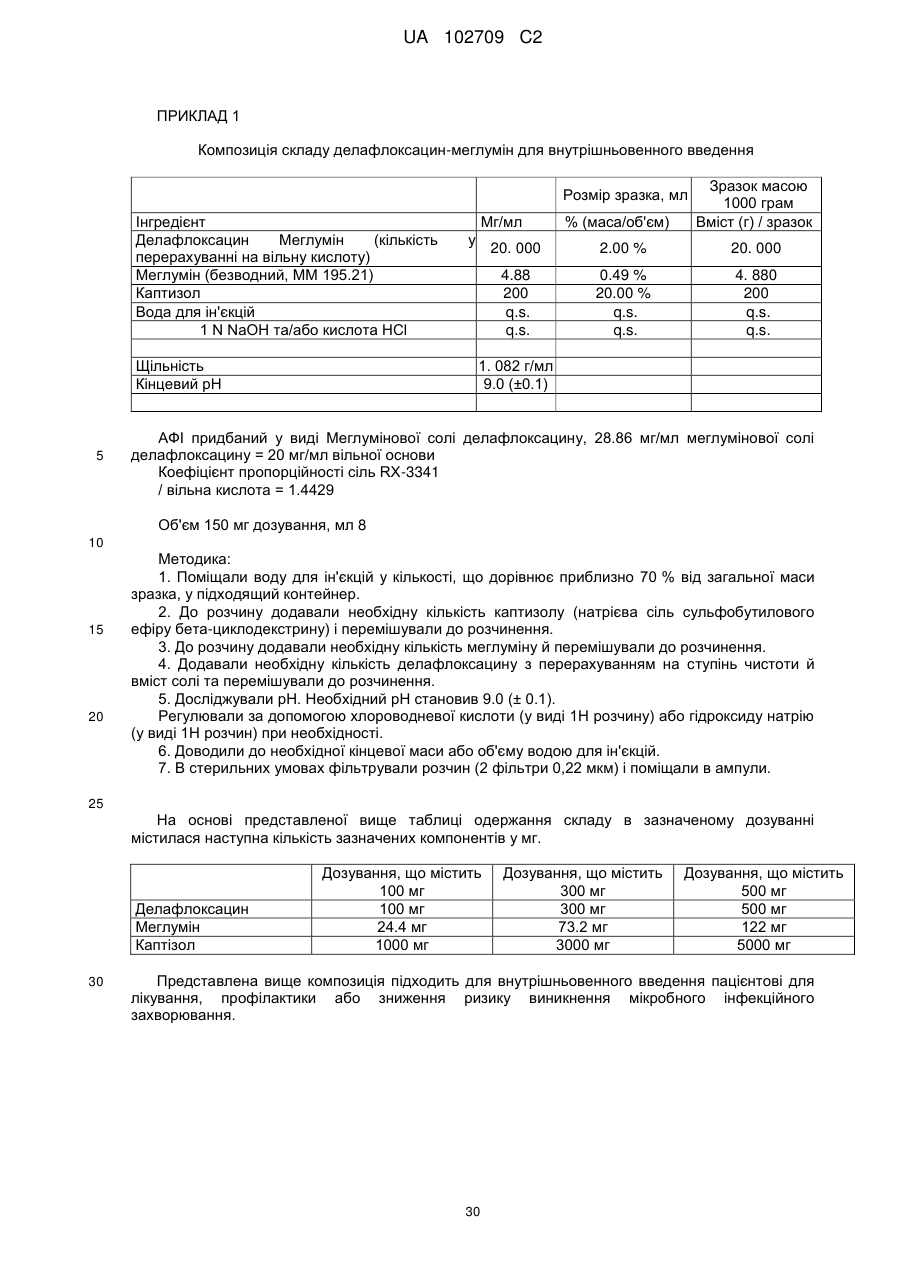
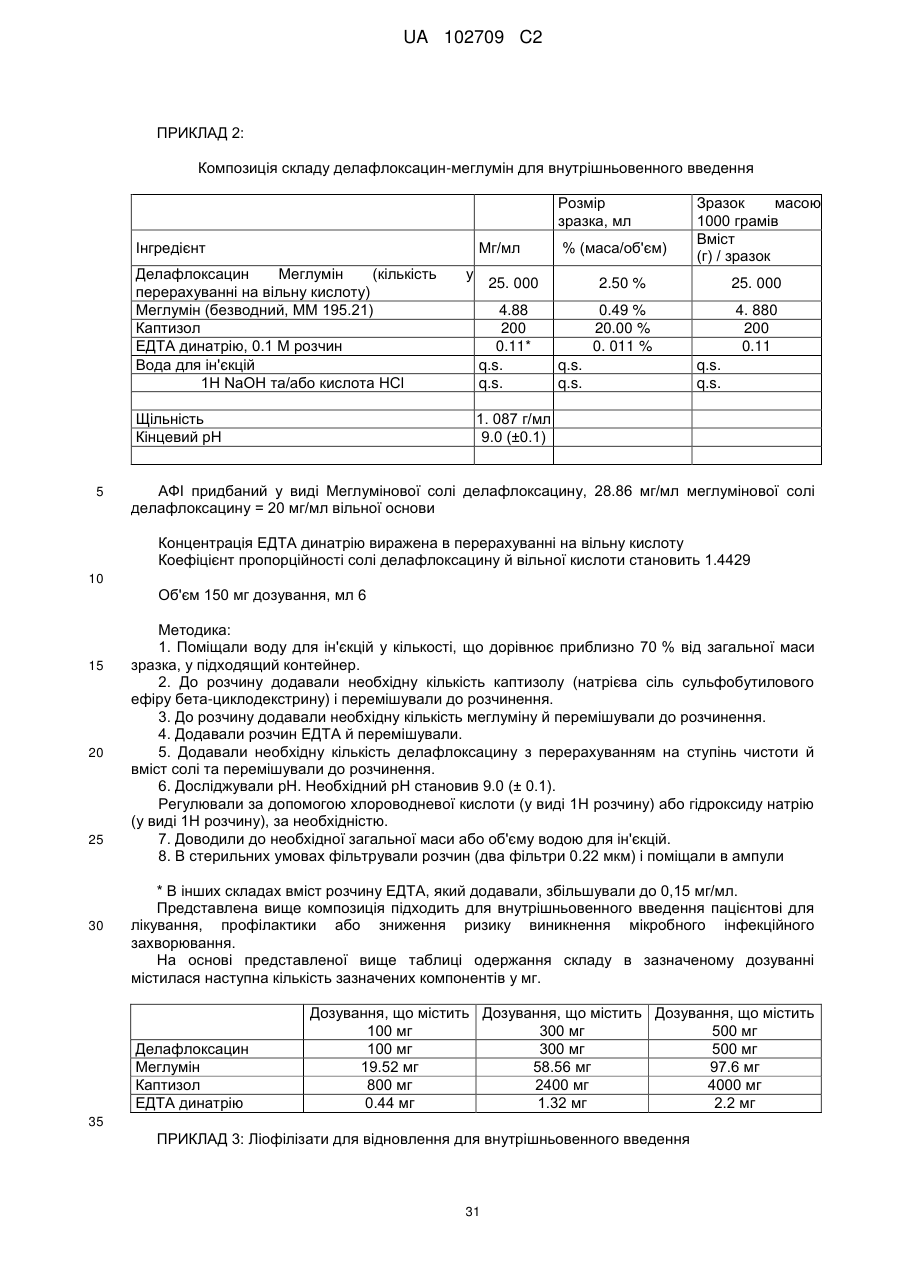
16. Фармацевтична композиція, що містить
(a) від приблизно 100 мг до приблизно 500 мг делафлоксацину,
(b) від приблизно 15 мг до приблизно 125 мг меглуміну,
(c) від приблизно 500 мг до приблизно 5000 мг сульфобутилового ефіру бета-циклодекстрину каптизол, і
(d) від 0 мг до приблизно 4 мг динатрію ЕДТА.
17. Фармацевтична композиція за п. 16, яка знаходиться у формі ліофілу.
18. Застосування композиції за п. 1 для лікування, профілактики або зниження ризику виникнення бактеріальної інфекції.
Текст
Реферат: Винахід стосується протимікробних композицій похідних хінолонкарбонової кислоти. Зазначені композиції мають покращену розчинність, стабільність й переносимість. Зазначені композиції підходять для внутрішньовенного введення для лікування, профілактики або зниження ризику виникнення інфекційного захворювання. UA 102709 C2 (12) UA 102709 C2 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Даний винахід відноситься до фармацевтичних композицій, які містять протимікробну сполуку, що являє собою похідне хінолокарбонової кислоти, і циклодекстрин. Зазначені композиції мають покращену розчинність, стабільність й переносимість організмом. Зазначені композиції підходять для внутрішньовенного введення для лікування, профілактики або зниження ризику виникнення інфекційних захворювань. Рівень техніки Застосування підходящої системи фармацевтичних носіїв, як правило, є необхідною вимогою для безпечної й ефективної доставки фармацевтично активного лікарського засобу. Фармацевтична композиція як ціле, тобто фармацевтично активний лікарський засіб, приготований у фармацевтичному носії, може впливати на біодоступність, а також на фармакокінетику й фармакодинаміку активного лікарського засобу. Таким чином, важливо ретельно розробити й одержати фармацевтичну композицію для забезпечення доставки цільового фармацевтично активного лікарського засобу безпечним і ефективним чином. Доставка протимікробних агентів для лікування або профілактики мікробних інфекційних захворювань може являти собою непросту задачу. Для забезпечення терапевтичної ефективності, як правило, необхідно, щоб протимікробний агент вводили пацієнтові із забезпеченням досягнення концентрації в системі кровообігу або органах-мішенях, яка перевищує мінімальну інгібуючу концентрацію (МІК), протягом достатнього часу для придушення конкретного мікробного організму або організмів, проти яких направлена терапія. Отже, протимікробний агент, що має ефективні протимікробні характеристики in vitro, може бути неефективним, або навіть шкідливим, якщо зазначений агент не приготований належним чином для введення in vivo. Задача розробки підходящих протимікробних композицій додатково ускладнюється у випадку розробки рідких складів для парентерального введення, такого як внутрішньовенне введення. Внутрішньовенна доставка активного лікарського засобу є важливим способом введення лікарського засобу, який не може бути введений перорально або іншими способами, наприклад, у випадках, якщо пацієнт знаходиться в несвідомому стані або серйозно хворий, або не може з інших причин приймати лікарський засіб перорально. Багато лікарських засобів, на відміну від протимікробних агентів, що являють собою піридинкарбонові кислоти згідно із даним винаходом, не підходять для пероральної доставки внаслідок низької пероральної біодоступності або низкої пероральної переносимості. Розробка підходящих композицій для внутрішньовенного введення найчастіше пов'язана з рядом утруднень, включаючи знаходження балансу взаємного впливу розчинності активного лікарського засобу, хімічної й фізичної стабільності композиції та переносимості композиції при інфузії. На додаток до розчинності, стабільності й переносимості до уваги приймають простоту виробництва композиції, зручність зберігання композиції та простоту відновлення композиції, наприклад, для композицій, які знаходяться у формі сухих порошків або ліофільних продуктів, які потрыбно перед введенням відновлювати. Розчинність фармацевтично активного лікарського засобу є важливою, якщо не головною, вимогою для продукту, призначеного для внутрішньовенного введення, тому що не маючи достатньої розчинності, фармацевтично активний лікарський засіб може не підходити для внутрішньовенного введення. Крім того, обмеження за об'ємом складу для внутрішньовенного введення, підходить для безпечного й зручного введення, додатково ускладнюють розробку складу на практиці. У випадку, якщо фармацевтичний лікарський препарат на практиці не може бути солюбілізований, розробка складу для внутрішньовенного введення на основі зазначеного лікарського препарату може навіть виявитися неможливою. Стабільність фармацевтичної композиції є іншою важливою вимогою. Фармацевтична композиція повинна мати достатню хімічну й фізичну стабільність, щоб таким чином, забезпечувати підтримку активності фармацевтично активного лікарського засобу вище необхідного рівня й цілісності всього складу для забезпечення безпечного введення. Важливо, щоб утворення потенційно шкідливих продуктів розкладання, а також побічних продуктів було мінімальним. Переносимість фармацевтичної композиції є іншою важливою вимогою, тому що склад для внутрішньовенного введення не повинен викликати в пацієнта запалення або ушкодження кровоносних судин і навколишніх тканин. Крім того, композиція не повинна викликати при введенні надмірної чуттєвості у венах або зайвого дискомфорту або, альтернативно, повинна знижувати високу чуттєвість у венах або дискомфорт. Фармацевтична композиція повинна мати достатню ефективність. Фармацевтична композиція також повинна мати достатню хімічну й фізичну стабільність для забезпечення 1 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 можливості введення пацієнтові. Фармацевтична композиція також повинна підтримувати активність лікарського засобу протягом необхідного періоду часу. Активність лікарського засобу у фармацевтичній композиції можна підтримувати, наприклад, за допомогою підтримки концентрації або рівня лікарського засобу в композиції постійними, або приблизно постійними протягом часу. Таким чином, даний винахід направлений на задоволення вищевказаних й інших потреб. Короткий опис креслень На Фігурі 1 представлена порошкова рентгенівська дифрактограма кристалічного DГлюцитол, 1-деокси-1-(метиламіно)-, 1-(6-аміно-3,5-дифторпіридин-2-іл)-8-хлор-6-фтор-1,4дигідро-7-(3-гідроксиазетидин-1-іл)-4-оксо-3-хінолінкарбоксилату (соль). На Фігурі 2 представлена порошкова рентенівська дифрактограма кристалічного DГлюцитол, 1-деокси-1-(метиламіно)-, 1-(6-аміно-3,5-дифторпіридин-2-іл)-8-хлор-6-фтор-1,4дигідро-7-(3-гідроксиазетидин-1-іл)-4-оксо-3-хінолінкарбоксилат тригідрату (соль). Короткий опис винаходу Даний винахід відноситься до протимікробних композицій і, більш конкретно, до композицій похідних хінолокарбонової кислоти. Даний винахід відноситься до фармацевтичної композиції, що містить похідне хінолокарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір, і циклодекстрин, обраний з групи, що складається з альфа-циклодекстрину, бета-циклодекстрину, гама-циклодекстрину та їхніх сумішей. Зазначені композиції мають покращену розчинність активного лікарського засобу, покращену хімічну й фізичну стабільність, тобто покращену стабільність активного лікарського засобу та композиції в цілому, і покращену переносимість при внутрішньовенному введенні або ін'єкції. Зазначені композиції підходять для внутрішньовенного введення або ін'єкції для лікування, профілактики або зниження ризику виникнення інфекційного захворювання. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка перед змішуванням містить (а) похідне хінолокарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір, і (b) циклодекстрин. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка перед змішуванням містить (а) похідне хінолокарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір, (b) циклодекстрин і (с) хелатоутворюючий агент. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) похідне хінолокарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір і (b) циклодекстрин. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) похідне хінолокарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір, (b) циклодекстрин і (с) хелатоутворюючий агент. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить комплекс включення, причому зазначений комплекс включення містить (а) похідне хінолокарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір і (b) циклодекстрин. Відповідно до одного з аспектів даний винахід відноситься до фармацевтичної композиції, яка містить (а) комплекс включення, причому зазначений комплекс включення додатково містить (i) похідне хінолокарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір і (ii) циклодекстрин; і (b) хелатоутворюючий агент. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (тобто знаходиться у формі) водний розчин. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (тобто знаходиться у формі) суху суміш. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначена суха суміш являє собою ліофільний продукт. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначена суха суміш одержана шляхом ліофілізації. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, у якій зазначена суха суміш або ліофіл відновлені. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначена фармацевтична композиція розведена. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин обраний із групи, що складається з альфа-циклодекстринів, бетациклодекстринів, гама-циклодекстринів і їх сумішей. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин обраний із групи, що складається з бета-циклодекстринів, гама-циклодекстринів та їхніх сумішей. Відповідно до 2 UA 102709 C2 5 10 15 20 25 30 35 40 45 одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою бета-циклодекстрин. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою бета-циклодекстрин, обраний з групи, що складається з простого ефіру бета-циклодекстрину, складного ефіру бета-циклодекстрину або їхніх сумішей. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою гідроксиалкіл-бета-циклодекстрин. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений гідроксиалкіл-бета-циклодекстрин являє собою гідроксипропіл-бета-циклодекстрин. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою бета-циклодекстрин, який відповідає наступній формулі (3) (бета-циклодекстрин)-OR (3), де залишки R являють собою водень або гідроксиалкільні групи, а частина залишків R може являти собою алкільні групи, причому зазначений простий ефір бета-циклодекстрину має розчинність у воді, яка є більш ніж 1,8 г в 100 мл води. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де R обраний з групи, що складається з гідроксиетилу, гідроксипропілу, дигідроксипропілу, метилу або етилу. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначена група R являє собою гідроксипропіл. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений гідроксипропіл-бета-циклодекстрин характеризується молекулярним заміщенням на ангідроглюкозну ланку, яке дорівнює від приблизно 0,86 до приблизно 1,14. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений гідроксипропіл-бета-циклодекстрин характеризується молекулярним заміщенням на ангідроглюкозну ланку, що дорівнює від приблизно 0,59 до приблизно 0,73. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений гідроксипропіл-бета-циклодекстрин відповідає реєстраційному номеру CAS 128446-35-5. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою просте сульфоалкілефірне похідне циклодекстрину, що має Формулу 1 Формула 1 де n дорівнює 4, 5 або 6; кожен з R1, R2, R3, R4, R5, R6, R7, R8 і R9 у Формулі 1 незалежно являє собою О або О-(С2-6 алкілен)-SO3 групу, і щонайменше один з R 1 і R2 незалежно являє собою зазначену О-(С2-6 алкілен)-SO3 групу; і кожен з S1, S2, S3, S4, S5, S6, S7, S8 і S9 незалежно являє собою фармацевтично прийнятний катіон, причому зазначена композиція не містить первинного циклодекстрину, що визначено за допомогою тонкошарової хроматографії. Відповідно до одного з аспектів кожен з R 1, R2 і R3 незалежно являє собою зазначену О-(С2-6 алкілен)-SO3 групу. Відповідно до одного з аспектів щонайменше один з R1, R2 і R3 незалежно являє собою О-(СН2)m-SO3 групу, де m дорівнює 2, 3, 4, 5 або 6. Відповідно до одного з аспектів кожен з R 1, R2 і R3 незалежно являє собою О-(СН2)mSO3 групу, де m дорівнює 3 або 4. Відповідно до одного з аспектів R 4, R6 і R8 незалежно являють собою зазначену О-(С2-6 алкілен)-SO3 групу; і кожен з R5, R7 і R9 являє собою О. Відповідно до одного з аспектів R4, R6 і R8 незалежно являють собою зазначену О-(С2-6 алкілен)SO3 групу; і кожен з R5, R7 і R9 являє собою О. Відповідно до одного з аспектів кожен з R 4, R6 і R8 незалежно являє собою зазначену О-(С2-6 алкілен)-SO3 групу; і кожен з R5, R7 і R9 являє собою О. Відповідно до одного з аспектів кожен з S1, S2, S3, S4, S5, S6, S7, S8 і S9 незалежно + + + + +2 +2 являє собою H , Li , Na , K , Ca , Mg , або амоній. 3 UA 102709 C2 5 Відповідно до одного з аспектів винаходу зазначений сульфоалкільний ефір циклодекстрину являє собою сульфобутиловий ефір бета-циклодекстрину. Відповідно до одного з аспектів зазначений сульфоалкільний ефір бета-циклодекстрину відповідає реєстраційному номеру CAS 194615-04-8. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою гама-циклодекстрин. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначене похідне хінолонкарбонової кислоти відповідає наступній структурі Формули 2 R6 O R4 R5 COOR1 W N Y X Z R2 R3 10 15 20 25 Формула 2, 1 2 де R являє собою атом водню або захисну карбоксил групу; R являє собою гідроксильну 3 групу, нижчу алкоксигрупу, заміщену або незаміщену аміногрупу; R являє собою атом водню 4 5 або атом галогену, R являє собою атом водню або атом галогену, R являє собою атом 6 галогену або можливо заміщену насичену циклічну аміногрупу; R являє собою атом водню, атом галогену, нітрогрупу або можливо захищену аміногрупу; X, Y і Z можуть бути однаковими 7 7 або різними й відповідно являти собою атом азоту, -СН= або -СR = (де R являє собою нижчу алкільну групу, атом галогену або ціаногрупу), за умови, що принаймні один з Х, Y і Z являє 8 8 собою атом азоту, а W являє собою атом азоту або –CR = (де R являє собою атом водню, 1 2 3 4 5 6 7 8 атом галогену або нижчу алкільну групу), за умови, що R , R , R , R , R , R , R , R , W, X, Y і Z, визначені в зазначеному пункті формули винаходи, визначені відповідно до Формули 2, або її фармацевтично прийнятної солі або складного ефіру. Відповідно до одного з аспектів, у 1 2 3 4 випадку якщо R являє собою атом водню, R являє собою аміногрупу, R і R являють собою 6 7 атом фтору, R являє собою атом водню, Х являє собою атом азоту, Y являє собою –CR = (де 7 8 8 R являє собою атом фтору), Z являє собою -СН=, і W являє собою –CR = (де R являє собою 5 атом хлору), то R не являє собою 3-гідроксиазетидин-1-ільну групу, або її фармацевтично прийнятну сіль або складний ефір. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначене похідне хінолонкарбонової кислоти відповідає наступній сполуці (А) O F COOH N HO N Cl F N H2N F 30 (А) або її фармацевтично прийнятній солі або складному ефіру. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначене похідне хінолонкарбонової кислоти являє собою D-глюцитол, 1-деокси-1 4 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 (метиламіно)-,1-(6-аміно-3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1азетидиніл)-4-оксо-3-хінолінкарбоксилат (сіль). Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначене похідне хінолонкарбонової кислоти являє собою кристалічний D-глюцитол, 1-деокси1-(метиламіно), 1-(6-аміно-3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1азетидиніл)-4-оксо-3-хінолінкарбоксилат (сіль), який характеризується вимірюванням при приблизно 25 °C із застосуванням випромінювання Cu-Ka, порошковою дифрактограмою, представленою на Фігурі 1. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначене похідне хінолонкарбонової кислоти являє собою тригідрат D-глюцитол, 1-деокси-1(метиламіно)-,1-(6-аміно-3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1азетидиніл)-4-оксо-3-хінолінкарбоксилату тригідрат (сіль). Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначене похідне хінолонкарбонової кислоти являє собою кристалічний тригідрат D-глюцитол, 1-деокси-1-(метиламіно)-,1-(6-аміно-3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3гідроксиазетидиніл)-4-оксо-3-хінолінкарбоксилату тригідрат (сіль), який характеризується при вимірюванні приблизно 25 °C із застосуванням випромінювання Cu-Ka, порошковою дифрактограмою, представленою на Фігурі 2. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначений хелатоутворюючий агент являє собою ЕДТА або її сіль. Відповідно до одного з аспектів зазначений хелатоутворюючий агент являє собою сіль ЕДТА, обрану з групи, яка складається з натрієвої солі, калієвої солі, кальцієвої солі, магнієвої солі та їхніх сумішей. Відповідно до одного з аспектів зазначений хелатоутворюючий агент являє собою динатрій ЕДТА. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка додатково містить полігідроксиамінну сполуку. Відповідно до одного з аспектів зазначена полігідроксиамінна сполука являє собою меглумін. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначене похідне хінолонкарбонової кислоти має помітно підвищену розчинність в порівнянні з похідним хінолонкарбонової кислоти у воді. Відповідно до одного з аспектів похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 1 мг/мл при 25 °C. Відповідно до одного з аспектів зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 2 мг/мл при 25 °C. Відповідно до одного з аспектів зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 3 мг/мл при 25 °C. Відповідно до одного з аспектів зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 5 мг/мл при 25 °C. Відповідно до одного з аспектів зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 10 мг/мл при 25 °C. Відповідно до одного з аспектів зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 15 мг/мл при 25 °C. Відповідно до одного з аспектів зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 20 мг/мл при 25 °C. Відповідно до одного з аспектів зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 25 мг/мл при 25 °C. Відповідно до одного з аспектів зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 30 мг/мл при 25 °C. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка має покращену стабільність. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка має покращену стабільність, що визначено щонайменше за одним з наступних параметрів: (а) композиція підтримує значення рН в межах приблизно 10 % від відповідгого вихідного значення рН, або (b) композиція зберігає щонайменше приблизно 90 %, або щонайменше приблизно 95 % вихідної кількості похідного хінолонкарбонової кислоти, або (с) композиція не утворює осаду таким чином, що на одиничний контейнер припадає 6000 або менше часток композиції розміром 10 мікронів або більше і 600 або менше часток розміром 25 мікронів або більше, що визначено за допомогою стандартноно випробування шляхом підрахунку кількості часток за затуханням світла, описаного в Розділі 788 Фармакопеї США "Вміст твердих часток в ін'єкційних препаратах" (Particulate Matter in Injections). 5 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до одного з аспектів винаходу будь-які параметри (а), (b) або (с) визначають через щонайменше 30, 60, 90, 180 днів або один рік витримки композиції при кімнатній температурі. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначена композиція забезпечує помітне збільшення переносимості у венах. Відповідно до одного з аспектів переносимість у венах визначають в моделі інфузії у хвіст пацюка. Відповідно до одного з аспектів зазначену композицію можна інфузувати в моделі інфузії у хвіст пацюка протягом щонайменше однієї години зі швидкістю, що дорівнює 10 мл/кг/год. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції за п. 65, де зазначену композицію можна інфузувати протягом щонайменше двох, трьох, чотирьох або п'яти днів підряд у моделі інфузії у хвіст пацюка протягом щонайменше однієї години зі швидкістю, що дорівнює 10 мл/кг/год. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, де зазначене похідне хінолонкарбонової кислоти має помітно підвищену розчинність у порівнянні з похідним хінолонкарбонової кислоти у воді, та/або композиція має покращену стабільність та/або композиція забезпечує помітне збільшення переносимості у венах. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) від приблизно 0,01 % до приблизно 50 % за масою делафлоксацину відносно загальної маси композиції; (b) від приблизно 0,1 % до приблизно 50 % за масою меглуміну відносно загальної маси композиції; (с) від приблизно 1 % до приблизно 50 % за масою сульфобутилового ефіру бетациклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8, відносно загальної маси композиції. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) від приблизно 0,01 % до приблизно 50 % за масою делафлоксацину відносно загальної маси композиції; (b) від приблизно 0,1 % до приблизно 50 % за масою меглуміну відносно загальної маси композиції; (с) від приблизно 1 % до приблизно 50 % за масою сульфобутилового ефіру бетациклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8 відносно загальної маси композиції; і (d) від приблизно 0,001 % до приблизно 0,10 % за масою динатрій ЕДТА відносно загальної маси композиції. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) від приблизно 100 мг до приблизно 500 мг делафлоксацину; (b) від приблизно 15 мг до приблизно 125 мг меглуміну, і (с) від приблизно 1000 мг до приблизно 5000 мг сульфобутилового ефіру бетациклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) від приблизно 100 мг до приблизно 500 мг делафлоксацину; (b) від приблизно 15 мг до приблизно 125 мг меглуміну, і (с) від приблизно 500 мг до приблизно 5000 мг сульфобутилового ефіру бетациклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8, і (d) від 0 мг до приблизно 4 мг динатрій ЕДТА. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) від приблизно 100 мг до приблизно 500 мг делафлоксацину; (b) від приблизно 15 мг до приблизно 125 мг меглуміну, і (с) від приблизно 500 мг до приблизно 5000 мг сульфобутилового ефіру бетациклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8, і (d) від приблизно 0,40 мг до приблизно 4 мг динатрій ЕДТА. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) приблизно 100 мг делафлоксацину, (b) приблизно 24,4 мг меглуміну, і 6 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 (с) приблизно 1000 мг сульфобутилового ефіру бета-циклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) приблизно 300 мг делафлоксацину, (b) приблизно 73,2 мг меглуміну, і (с) приблизно 3000 мг сульфобутилового ефіру бета-циклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) приблизно 500 мг делафлоксацину, (b) приблизно 122 мг меглуміну, і (с) приблизно 5000 мг сульфобутилового ефіру бета-циклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) приблизно 100 мг делафлоксацину, (b) приблизно 19,52 мг меглуміну, (с) приблизно 800 мг сульфобутилового ефіру бета-циклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8, і (d) приблизно 0,44 мг динатрій ЕДТА. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) приблизно 300 мг делафлоксацину, (b) приблизно 58,56 мг меглуміну, (с) приблизно 2400 мг сульфобутилового ефіру бета-циклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8, і (d) приблизно 1,32 мг динатрій ЕДТА. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка містить (а) приблизно 500 мг делафлоксацину, (b) приблизно 97,6 мг меглуміну, (с) приблизно 4000 мг сульфобутилового ефіру бета-циклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8, і (d) приблизно 2,2 мг динатрій ЕДТА. Відповідно до одного з аспектів винахід відноситься до водної фармацевтичної композиції, яка містить (а) приблизно 20 мг/мл делафлоксацину, (b) приблизно 4,88 мг/мл меглуміну, (с) приблизно 200 мг/мл сульфобутилового ефіру бета-циклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8, і (d) воду. Відповідно до одного з аспектів винахід відноситься до водної фармацевтичної композиції, яка містить (а) приблизно 25 мг/мл делафлоксацину, (b) приблизно 4,88 мг/мл меглуміну, (с) приблизно 200 мг/мл сульфобутилового ефіру бета-циклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8, (d) приблизно 0,11 мг/мл динатрій ЕДТА, і (е) воду. Відповідно до одного з аспектів винахід відноситься до будь-яких фармацевтичних композицій, описаних вище, що мають рН, що дорівнює приблизно 9±0,1 одиниць рН. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, яка додатково містить маніт. Відповідно до одного з аспектів винахід відноситься до фармацевтичної композиції, у виді стандартної дозованої форми. Відповідно до одного з аспектів винахід відноситься до способу лікування, профілактики або зниження ризику виникнення бактеріальної інфекції, що включає введення пацієнтові, який цього потребує, композиції, запропонованої в даному винаході. 7 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до одного з аспектів винахід відноситься до способу лікування, профілактики або зниження ризику виникнення бактеріальної інфекції у пацієнта, який цього потребує, при зниженні надмірної чуттєвості у венах під час введення, що включає введення пацієнту, який цього потребує, композиції, запропонованої в даному винаході, наприклад, із застосуванням пакету для внутрішньовенного вливання. Як носій, композиція може містити сольовий розчин або декстрозу. В одному з аспектів винахід відноситься до набору, що містить фармацевтичну композицію за будь-яким із пп. 1-90 і контейнер. Контейнер може являти собою пляшку, ампулу, шприц або пакет для крапельного вливання, або композиція може додатково містити контейнер, наприклад, пляшку, ампулу, шприц або пакет для крапельного вливання. Детальний опис винаходу У даному винаході несподівано було виявлено, що комбінація конкретних циклодекстринових сполук із протимікробними сполуками, що являють собою похідні хінолонкарбонової кислоти, забезпечують необхідний баланс розчинності, стабільності й переносимості продукту. Кінцевий склад на основі лікарського засобу є результатом складного взаємного впливу розчинності, стабільності й переносимості. Даний винахід відноситься до фармацевтичної композиції, що містить похідне хінолонкарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір і циклодекстрин, обраний з групи, що складається з бета-циклодекстрину, гама-циклодекстрину та їхных сумішей. Зазначені композиції підходять для внутрішньовенного введення або ін'єкції для лікування, профілактики або зниження ризику виникнення інфекційного захворювання. Зазначені композиції мають підвищену стабільність, підвищену розчинність хінолонкарбонової кислоти, і підвищену переносимість пацієнтом при введенні внутрівенно або у виді ін'єкції. Підвищена стабільність є важливою тому що фармацевтична композиція повинна мати достатній строк придатності для зберігання зручним чином протягом підходящого періоду часу. Підвищена розчинність є важливою тому що деякі хінолонкарбонові кислоти не мають достатньої розчинності у воді, що дозволяє приготувати склад з необхідною концентрацією. У даному винаході запропоновані композиції, що мають підвищену розчинність в порівнянні з розчинністю, якої вдалося б досягти без застосування даного винаходу. Підвищена переносимість пацієнтом є важливою тому що у винаході запропоновані композиції, які є безпечними й добре переносимими. Ефективність фармацевтичної композиції є недостатньою характеристикою, оскільки важливо, щоб ефективність була досягнута при відповідному рівні безпеки й переносимості. Таким чином, композиції згідно із даним винаходом забезпечують переваги в порівнянні з композиціями, відомими в даній галузі техніки. В одному з варіантів реалізації винахід відноситься до фармацевтичної композиції, яка до змішування містить (а) похідне хінолонкарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір і (b) циклодекстрин. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, яка містить похідне хінолонкарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір і (b) циклодекстрин. В одному з варіантів реалізації композиція містить похідне хінолонкарбонової кислоти і циклодекстрин. В іншому варіанті реалізації композиція містить фармацевтично прийнятну сіль похідного хінолонкарбонової кислоти і циклодекстрин. В іншому варіанті реалізації композиція містить фармацевтично прийнятний складний ефір похідного хінолонкарбонової кислоти і циклодекстрин. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, яка містить комплекс включення, причому зазначений комплекс включення містить (а) похідне хінолонкарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір і (b) циклодекстрин. В одному з варіантів реалізації композиція містить похідне хінолонкарбонової кислоти або його фармацевтично прийнятну сіль або складний ефір в циклодекстрині. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, яка містить (тобто знаходиться у формі) водного розчину. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, яка містить (тобто знаходиться у формі) сухої суміші. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначена суміш являє собою ліофіл. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначена суха суміш одержана за допомогою ліофілізації. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначена суха суміш або ліофіл відновлені. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначена фармацевтична композиція додатково розбавлена. 8 UA 102709 C2 5 10 15 20 25 30 35 40 45 В одному з варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин обраний з групи, що складається з альфа-циклодекстринів, бетациклодекстринів, гама-циклодекстринів або їхніх сумішей. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин обраний із групи, що складається з бета-циклодекстринів, гама-циклодекстринів та їхніх сумішей. В одному з варіантів реалізації вільні гідроксили циклодекстрину повністю або частково піддані перетворенню. В іншому варіанті реалізації вільні гідроксили циклодекстрину повністю піддані перетворенню. В іншому варіанті реалізації вільні гідроксили циклодекстрину частково піддані перетворенню. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою бетациклодекстрин, обраний з групи, що складається з простого ефіру бета-циклодекстрину, складного ефіру бета-циклодекстрину та їхніх сумішей. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою гідроксиалкіл-бета-циклодекстрин. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений гідроксиалкіл-бета-циклодекстрин являє собою гідроксипропіл-бета-циклодекстрин. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою бета-циклодекстрин, який відповідає наступній формулі (3): (бета-циклодекстрин)-OR (3) де залишки R являють собою гідроксиалкільні групи, а частина залишків R може являти собою алкільні групи, причому зазначений простий ефір бета-циклодекстрину має розчинність у воді, яка дорівнює більше ніж 1,8 г в 100 мл води. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою бета-циклодекстрин, що відповідає наступній формулі: (бета-циклодекстрин)-OR, у якій всі або частина залишків R незалежно можуть являти собою гідроксиалкільні групи або алкільні групи. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою бета-циклодекстрин, що відповідає наступній формулі (3): (бета-циклодекстрин)-OR, у якій всі або частина залишків R незалежно можливо являють собою гідроксиалкільні групи або алкільні групи. В одному з варіантів реалізації бета-циклодекстрин має розчинність у воді, яка дорівнює більше ніж 1,8 г в 100 мл. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де R обраний із групи, яка складається з гідроксиетилу, гідроксипропілу, дигідроксипропілу, метилу або етилу. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначена група R являє собою гідроксипропіл. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений гідроксипропіл-бета-циклодекстрин характеризуєтьмя молекулярним заміщенням на ангідроглюкозну ланку, що дорівнює від приблизно 0,86 до приблизно 1,14. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений гідроксипропіл-бета-циклодекстрин характеризуєтьмя молекулярним заміщенням на ангідроглюкозну ланку, який дорівнює від приблизно 0,59 до приблизно 0,73. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений гідроксипропіл-бета-циклодекстрин відповідає реєстраційному номеру CAS 128446-35-5. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою сульфоалкілефірне похідне циклодекстрину, що має формулу 1 Формула 1 9 UA 102709 C2 5 10 15 20 25 де n дорівнює 4, 5 або 6; кожен з R1, R2, R3, R4, R5, R6, R7, R8 і R9 у Формулі 1 незалежно являє собою О або О-(С2-6 алкілен)-SO3 групу, і щонайменше один з R1 і R2 незалежно являє собою зазначену О-(С2-6 алкілен)-SO3 групу; і кожен з S1, S2, S3, S4, S5, S6, S7, S8 і S9 незалежно являє собою фармацевтично прийнятний катіон, причому зазначена композиція не містить вихідного циклодекстрину, що визначено за допомогою тонкошарової хроматографії. В інших варіантах реалізації кожен з R1, R2 і R3 незалежно являє собою зазначену О-(С2-6 алкілен)-SO3 групу. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де щонайменше один з R1, R2 і R3 незалежно являє собою О-(СН2)m-SO3 групу, де m дорівнює 2, 3, 4, 5 або 6. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де кожен з R1, R2 і R3 незалежно являє собою О-(СН2)m-SO3 групу, де m дорівнює 3 або 4. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де щонайменше один з R4, R6 і R8 незалежно являє собою зазначену О-(С2-6 алкілен)-SO3 групу; і кожен з R5, R7 і R9 являє собою О . В інших варіантах реалізації даний винахід відноситься до композиції, де щонайменше один з R4, R6 і R8 незалежно являє собою зазначену О-(С2-6 алкілен)-SO3 групу; і кожен з R5, R7 і R9 являє собою О. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де кожен з R 4, R6 і R8 незалежно являє собою О-(С2-6 алкілен)-SO3 групу; і кожен з R5, R7 і R9 являє собою О. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений сульфоалкільний ефір циклодекстрину являє собою сульфобутиловий ефір бета-циклодекстрину. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений сульфоалкільний ефір бета-циклодекстрину відповідає реєстраційному номеру CAS 194615-048. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, де зазначений циклодекстрин являє собою гама-циклодекстрин. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти відповідає наступній структурі Формули 2: R6 O R4 R5 COOR1 W N Y X Z R2 R3 30 35 40 45 Формула 2 1 2 де R являє собою атом водню або захисну карбоксил групу; R являє собою гідроксильну 3 групу, нижчу алкоксигрупу, заміщену або незаміщену аміногрупу; R являє собою атом водню 4 5 або атом галогену, R являє собою атом водню або атом галогену, R являє собою атом 6 галогену або можливо заміщену насичену циклічну аміногрупу; R являє собою атом водню, атом галогену, нітрогрупу або можливо захищену аміногрупу; X, Y і Z можуть бути однаковими 7 7 або різними й відповідно являти собою атом азоту, -СН= або -СR = (де R являє собою нижчу алкільну групу, атом галогену або ціаногрупу), за умови, що щонайменше один з Х, Y і Z являє 8 8 собою атом азоту, а W являє собою атом азоту або –CR = (де R являє собою атом водню, 1 2 3 4 5 6 7 8 атом галогену або нижчу алкільну групу), за умови, що R , R , R , R , R , R , R , R , W, X, Y і Z, визначені в зазначеному абзаці, визначені відносно до Формули 2, і відрізняються від визначень, даних для циклодекстринів, або його фармацевтично прийнятної солі або складного ефіру. 1 2 Відповідно до одного з варіантів реалізації, у випадку якщо R являє собою атом водню, R 3 4 6 являє собою аміногрупу, R і R являють собою атом фтору, R являє собою атом водню, Х 7 7 являє собою атом азоту, Y являє собою –CR = (де R являє собою атом фтору), Z являє собою 8 8 5 -СН=, і W являє собою –CR = (де R являє собою атом хлору), то R не являє собою 3гідроксиазетидин-1-ільну групу. 10 UA 102709 C2 Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти відповідає наступній сполуці (А), O F COOH N HO N Cl F N H2N F 5 10 15 20 25 30 35 40 45 (А) або її фармацевтично прийнятній солі або складному ефіру. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти являє собою D-глюцитол, 1-деокси-1-(метиламіно), 1-(6-аміно-3,5-дифтор-2-піридиніл)8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1-азетидиніл)-4-оксо-3-хінолінкарбоксилат (сіль). Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти являє собою кристалічний D-глюцитол, 1-деокси-1(метиламіно)-, 1-(6-аміно-3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1азетидиніл)-4-оксо-3-хінолінкарбоксилат (сіль). Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти являє собою кристалічний D-глюцитол, 1-деокси-1-(метиламіно)-, 1-(6-аміно-3,5-дифтор-2-піридиніл)8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1-азетидиніл)-4-оксо-3-хінолінкарбоксилат (сіль), що характеризується вимірюванням при приблизно 25 °C із застосуванням Cu-Ka випромінювання, порошковою дифрактограмою, представленою на Фігурі 1. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти являє собою тригідрат D-глюцитол, 1-деокси-1(метиламіно)-, 1-(6-аміно-3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1азетидиніл)-4-оксо-3-хінолінкарбоксилату тригідрат (сіль). Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти являє собою кристалічний тригідрат D-глюцитол, 1-деокси-1-(метиламіно)-, 1-(6-аміно3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1-азетидиніл)-4-оксо-3хінолінкарбоксилату тригідрат (сіль). Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти являє собою кристалічний тригідрат D-глюцитол, 1-деокси-1-(метиламіно)-, 1-(6-аміно-3,5-дифтор-2піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1-азетидиніл)-4-оксо-3-хінолінкарбоксилату тригідрат (сіль), який характеризується вимірюванням при приблизно 25 °C із застосуванням Cu-Ka випромінювання порошковою дифрактограмою, представленою на Фігурі 2. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти має помітно покращену розчинність. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти має помітно покращену розчинність в порівнянні з розчинністю індивідуального похідного хінолонкарбонової кислоти у воді. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 1 мг/мл при 25 °C. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 2 мг/мл при 25 °C. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 3 мг/мл при 25 °C. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 5 мг/мл при 25 °C. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 10 мг/мл при 25 °C. Відповідно до інших варіантів реалізації даний винахід 11 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 60 відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 15 мг/мл при 25 °C. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 20 мг/мл при 25 °C. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 25 мг/мл при 25 °C. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти має розчинність, яка дорівнює щонайменше приблизно 30 мг/мл при 25 °C. Згідно інших варіантів реалізації даний винахід відноситься до композиції, що має підвищену стабільність. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, що має підвищену стабільність, визначену щонайменше за одним із наступних параметрів: (а) композиція підтримує значення рН в межах приблизно 10 % від вихідного значення рН, або (b) композиція зберігає щонайменше приблизно 90 % або 95 % від вихідної кількості похідного хінолонкарбонової кислоти, або (с) композиція не утворює осаду таким чином, що на одиничний контейнер припадає 6000 або менше часток композиції розміром 10 мікрон або більше і 600 або менше часток розміром 25 мікрон або більше, що визначено шляхом стандартного випробування шляхом підрахунку кількості часток за затуханням світла, описаного в Розділі 788 Фармакопеї США "Вміст часток твердої речовини" (USP в Particulate Matter in Injections). Фармацевтичні композиції згідно із даним винаходом мають достатню хімічну й фізичну стабільність для забезпечення можливості введення пацієнтові та підтримання ефективності фармацевтично активного лікарського засобу протягом підходящого періоду часу. Відповідно до одного з варіантів реалізації активність активного інгредієнта у виді похідного хінолонкарбонової кислоти в фармацевтичній композиції підтримують за допомогою збереження фармацевтично активного лікарського засобу в розчині в результаті обмеження хімічного розкладання фармацевтично активного лікарського засобу або інших компонентів фармацевтичної композиції або в результаті обмеження фізичного розкладання композиції. Відповідно до одного з варіантів реалізації композиція зберігає розчинність лікарського засобу, ефективність лікарського засобу або захищає лікарський засіб або інші компоненти композиції від хімічного або фізичного розкладання. Відповідно до іншого варіанта реалізації композиція зберігає активність вихідного складу або активність, по суті аналогічну активності вихідного складу. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де будьякі параметри (а), (b) або (с) визначають через щонайменше 30 днів витримки композиції при кімнатній температурі. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де будь-які параметри (а), (b) або (с) визначають через щонайменше 60 днів витримки композиції при кімнатній температурі. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де будь-які параметри (а), (b) або (с) визначають через щонайменше 90 днів витримки композиції при кімнатній температурі. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де будь-які параметри (а), (b) або (с) визначають через щонайменше 180 днів витримки композиції при кімнатній температурі. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де будь-які параметри (а), (b) або (с) визначають через щонайменше 1 рік витримки композиції при кімнатній температурі. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначена композиція забезпечує помітне збільшення переносимості у венах. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначену переносимість у венах визначають в моделі інфузії у хвіст пацюка. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначену композицію можна інфузувати у моделі інфузії у хвіст пацюка протягом щонайменше однієї години зі швидкістю, що дорівнює 10 мл/кг/год. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначену композицію можна інфузувати протягом щонайменше двох днів підряд у моделі інфузії у хвіст пацюка протягом щонайменше однієї години зі швидкістю, що дорівнює 10 мл/кг/год. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначену композицію можна інфузувати протягом щонайменше трьох днів підряд у моделі інфузії у хвіст пацюка протягом, щонайменше, однієї години зі швидкістю, що дорівнює 10 мл/кг/год. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначену композицію можна інфузувати послідовно протягом щонайменше чотирьох днів у моделі інфузії у хвіст пацюка протягом щонайменше однієї години зі швидкістю, що дорівнює 10 мл/кг/год. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де 12 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 60 зазначену композицію можна інфузувати протягом щонайменше п'яти днів підряд у моделі інфузії у хвіст пацюка протягом щонайменше однієї години зі швидкістю, що дорівнює 10 мл/кг/год. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, де зазначене похідне хінолонкарбонової кислоти має помітно підвищену розчинність у порівнянні з похідним хінолонкарбонової кислоти у воді, та/або композиція має покращену стабільність, та/або композиція забезпечує помітне збільшення переносимості у венах. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, що містить (а) від приблизно 100 мг до приблизно 500 мг делафлоксацин меглуміну й (b) від приблизно 1000 мг до приблизно 5000 мг сульфобутилового ефіру бетациклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, що містить (а) приблизно 300 мг делафлоксацин меглуміну, і (b) приблизно 3000 мг сульфобутилового ефіру бета-циклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8. Відповідно до інших варіантів реалізації даний винахід відноситься до фармацевтичної композиції, яка перед змішуванням містить (а) приблизно 300 мг делафлоксацин меглуміну, і (b) приблизно 3000 мг сульфобутилового ефіру бета-циклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8. Відповідно до інших варіантів реалізації даний винахід відноситься до водної фармацевтичної композиції, яка містить (а) приблизно 300 мг делафлоксацин меглуміну, (b) приблизно 3000 мг сульфобутилового ефіру бета-циклодекстрину, що відповідає реєстраційному номеру CAS 194615-04-8, і (с) воду, причому зазначена композиція має об'єм при 25 °C, який дорівнює приблизно 15 мл, і рН, що дорівнює приблизно 9. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, яка знаходиться у формі ліофілу. Відповідно до інших варіантів реалізації даний винахід відноситься до композиції, яка додатково містить маніт. Відповідно до інших варіантів реалізації даний винахід відноситься до способу лікування, профілактики або зниження ризику виникнення бактеріальної інфекції, який включає введення пацієнтові, який цього потребує, композиції, описаної в даній заявці. Відповідно до інших варіантів реалізації даний винахід відноситься до способу лікування, профілактики або зниження ризику виникнення бактеріальної інфекції у пацієнта, який цього потребує, при зниженні дискомфорту при інфузії, який включає введення пацієнтові, який цього потребує, композиції, описаної в даній заявці. 1. Визначення Термін "пацієнт", що використовується у даній заявці, означає людину або тварину (у випадку тварини, як правило, ссавець). Пацієнт, як правило, являє собою суб'єкта, який має потребу в композиціях або способах, описаних у даній заявці. "Який має потребу" може означати, що пацієнт має інфекційне захворювання або у пацієнта діагностоване зазначене захворювання, наприклад, мікробне інфекційне захворювання, або що у пацієнта є ризик виникнення інфекційного захворювання внаслідок травми, медичних або хірургічних процедур або мікробного зараження, або пацієнт може знаходитися в стані, який може піддати людину мікробному зараженню. Зазначені інфекційні захворювання можуть виникати в результаті, наприклад, шкірної інфекції, внутрілікарняної пневмонії, пост-вірусної пневмонії, черевної інфекції, інфекції сечовивідних шляхів, бактеріємії, септицемії, ендокардиту, інфекції атріовентривукулярного каналу, інфекції судинного доступу, менінгіту, інфекційного захворювання, викликаного хірургічними або інвазивними медичними процедурами, інфекції черевної порожнини, кісткової інфекції, інфекції в суглобах, резистентної до метициліну інфекції Staphylococcus aureus, резистентної до ванкоміцину інфекції Enterococci, резистентної до лінезоліду інфекції організму, туберкульозу, резистентної до хінолону інфекції, викликаної грампозитивними мікроорганізмами, резистентної до ципрофлоксацину й метициліну (MRSA) інфекції, бронхіту, ускладненої інфекції шкіри й підшкірної клітковини (cSSSI), неускладненої інфекції шкіри й підшкірної клітковини (uSSSI), загальної інфекції дихальних шляхів і мультирезистентної (MDR) інфекції, викликаної грам-негативними мікроорганізмами. Термін "профілактика", що використовується у даній заявці, означає, наприклад, повне або практично повне запобігання виникненню інфекційного захворювання, наприклад, у випадку якщо пацієнт схильний до інфекції або існує ризик зараження інфекційним захворюванням. Термін "зниження ризику", що використовується у даній заявці, означає наприклад, зниження можливості або ймовірності виникнення інфекційного захворювання, наприклад, у випадку якщо пацієнт схильний до інфекції або існує ризик зараження інфекційним захворюванням. 13 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "лікування", що використовується у даній заявці, означає наприклад, лікування, інгібування, припинення поширення, зниження симптомів або ефектів, уповільнення або викликання регресії інфекційного захворювання у пацієнта, що страждає від інфекційного захворювання. Варто розуміти, що терміни "профілактика", "зниження ризику" і "лікування" не обмежують даний винахід, при цьому можливе взаємне перекривання зазначених термінів. Використовуваний у даній заявці термін "ефективна кількість" означає кількість фармацевтично активної сполуки, тобто активного лікарського засобу, наприклад, протимікробного агента, що являє собою похідне хінолонкарбонової кислоти, або його фармацевтично прийнятної солі або складного ефіру, що вводиться пацієнтові, достатнє для прояву біологічної активності, наприклад, протиінфекційної активності, наприклад, протимікробної активності. Термін "ефективна для профілактики кількість" означає кількість фармацевтично активної сполуки, тобто активного лікарського засобу, наприклад, протимікробного агента, який являє собою похідне хінолонкарбонової кислоти, що вводиться пацієнтові, й достатнє для профілактики або зниження ризику виникнення мікробного інфекційного захворювання. Використовуваний у даній заявці термін "фармацевтично прийнятний" відноситься до тих сполук, речовин, композицій, носіїв та/або дозованих форм, які з точки зору зваженого медичного судження підходять для застосування у контакті з тканинами людей і тварин без прояву надлишкової токсичності, подразнення, алергійної реакції або інших проблем або ускладнень, та відповідають розумному співвідношенню користь/ризик. Використовуваний у даній заявці термін "фармацевтично прийнятна сіль" відноситься до похідних пропонованих сполук, де вихідна сполука модифікована шляхом одержання кислих або основних солей зазначеної сполуки. Приклади фармацевтично прийнятних солей включають, але не обмежуються ними, мінеральні або органічні кислі солі основних залишків, таких як аміни, лужні або органічні солі кислотних залишків, таких як карбонові кислоти тощо. Фармацевтично прийнятні солі включають підходящі нетоксичні солі або солі четвертинного амонію вихідних сполук, одержаних, наприклад, з нетоксичних неорганічних або органічних кислот. Наприклад, зазначені підходящі нетоксичні солі включають, але не обмежуються тільки ними, солі, одержані з неорганічних або органічних кислот, обраних з 2-ацетоксибензойної, 2гідроксиетансульфокислоти, оцтової, аскорбінової, бензосульфокислоти, бензойної, бікарбонової, вугільної, лимонної, етилендіамінтетраоцтової, етандисульфокислоти, етансульфокислоти, фумарової, глюкогептонової, глюконової, глутамінової, гліколієвої, глікольліарсанілової, гексилрезорцинової, гідрабамової, бромоводневої, хлороводневої, йодоводневої, гідроксималеїнової, гідроксинафтойної, ізетіонової, молочної, лактобіонової, лаурилсульфокислоти, малеїнової, малевої, мигдальної, метансульфокислоти, напсилової, азотної, оксалілової, памової, пантотенової, фенілоцтової, фосфорної, полігалактуронової, пропіонової, саліцилової, стеаринової, надоцтової, сукцинової, сульфамінової, сульфанілінової, сарної, дубильної, толуолсульфокислоти й розповсюджені амінокислоти, наприклад, гліцин, аланін, фенілаланін, аргінін тощо. Фармацевтично прийнятні солі згідно із даним винаходом можуть бути синтезовані з вихідної сполуки, яка містить основну або кислотну групу за допомогою підходящих хімічних способів. Як правило, зазначені солі можуть бути одержані в результаті взаємодії вільних основних або кислотних форм зазначених сполук зі стехіометричною кількістю відповідної основи або кислоти у воді або органічному розчиннику, або їхніх сумішах. Відповідно до одного з варіантів реалізації неводне середовище, наприклад, діетиловий ефір, етилацетат, етанол, ізопропанол або ацетонітрил є застосованим для одержання солей представлених сполук. th Перелік підходящих солей наведений в Remmington's Pharmaceutical sciences, 18 ed. (Mack Publishing Company, 1990). Наприклад, солі можуть включати, але не обмежуються ними, хлорводневі й ацетатні солі аліфатичних аміновмісних, гідроксиламіновмісних та іміновмісних сполук згідно із даним винаходом. Додатково, сполуки згідно із даним винаходом, наприклад, солі сполук, можуть існувати в гідратованій або негідратованій (безводній) формі або у виді сольватів з молекулами інших розчинників. Необмежуючи приклади гідратів включають моногідрати, дигідрати тощо. Необмежуючи приклади сольватів включають етанольні сольвати, ацетонові сольвати тощо. Використовуваний у даній заявці термін "фармацевтично прийнятні складні ефіри" відноситься до похідних пропонованих сполук, де вихідна сполука модифікована у виді спиртового складного ефіру карбонової кислоти або кислотного складного ефіру спирту. Сполуки згідно із даним винаходом також можуть бути одержані у виді складних ефірів, наприклад, фармацевтично прийнятних складних ефірів. Наприклад, карбоксильна 14 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 функціональна група сполуки може бути перетворена у відповідний складний ефір, наприклад, метиловий ефір або інший ефір. Також спиртова група сполуки може бути перетворена у відповідний складний ефір, наприклад, ацетат, пропіонат або інший складний ефір. Використовуваний у даній заявці термін "стандартне дозування" означає одиничну дозу фармацевтичної композиції, що призначена для введення повністю. Стандартне дозування являє собою зручну форму для введення попередньо заданої кількості активного лікарського засобу. В даному описі форми однини також включають форми множини, якщо з контексту явним чином не випливає інше. Якщо не зазначене інше, всі технічні й наукові терміни, використовувані в заявці, мають значення, загальноприйняті фахівцями в галузі техніки, до якої належить даний винахід. У випадку протиріч варто керуватися значеннями, наведеними в даному описі. Всі процентні вмісти й співвідношення, використовувані в даній заявці, якщо не зазначене зворотне, розраховуються за масою. В описі, у випадку якщо композиції описані, як такі, що мають, або включають, або містять конкретні компоненти, передбачається, що композиції також по суті складаються із зазначених компонентів. Аналогічно, якщо способи або процеси описані як такі, що мають, або включають, або містять конкретні стадії процесу, процеси також складаються по суті або складаються із зазначених стадій процесу. Також варто розуміти, що черговість стадій або черговість проведення конкретних дій не є суттєвими за умови, що винахід залишається здійсненним. Крім того, дві або більше стадії або дії можна проводити одночасно. 2. Композиції згідно із даним винаходом Композиції згідно із даним винаходом містять всі або деякі наступні компоненти. Композиції можуть бути визначені до або після змішування компонентів. Підходящі компоненти описані, наприклад, в Eds. R.C. Rowe, et al., Handbook of Pharmaceutical Excipients, Fifth Edition, Pharmaceutical Press (2006); Remington's Pharmaceutical th Sciences, 18 ed. (Mack Publishing Company, 1990); і Remington: the Science and Practice of th Pharmacy, 20 edition, Baltimore, MD: Lippincott Williams & Wilkins, 2000, вміст яких включений в дану заявку по всій повноті за допомогою посилання. Навіть незважаючи на те, що багато із зазначених компонентів-носіїв за своєю функцією можуть бути віднесені до певної категорії, зазначена функціональна категорія не призначена для обмеження функції або області дії компонента, і фахівцеві в даній галузі техніки стане зрозуміло, що компонент може належати до більше ніж однієї функціональної категорії, і що вміст конкретного компонента й присутність інших компонентів може впливати на функціональні властивості компонента. а. Похідне хінолонкарбонової кислоти Композиції згідно із даним винаходом містять похідне хінолонкарбонової кислоти (також відоме, зокрема, як похідне піридон-карбонової кислоти або похідне піридон карбонової кислоти) або його фармацевтично прийнятну сіль або складний ефір, як протимікробну сполуку, тобто як активний фармацевтичний інгредієнт, або АФІ, композицій згідно із даним винаходом. У винаході також запропоновані способи синтезу будь-яких сполук згідно із даним винаходом. У винаході також запропоновані фармацевтичні композиції, що містять ефективну кількість однієї або більше сполук згідно із даним винаходом й фармацевтично прийнятний носій. У даному винаході також запропоновані способи одержання зазначених сполук, носіїв і фармацевтичних композицій. Похідні хінолонкарбонової кислоти, що підходять для цілей даного винаходу, описані, включаючи опис синтезу, складів і застосування, у патенті США №6156903, виданому Язакі зі співавторами (Yazaki et al.), 5 грудня 2000 року й списках замічених помилок від 13 листопада 2001 року й 11 грудня 2001 року; патенті США №6133284, виданому Язакі зі співавторами (Yazaki et al.), 17 жовтня 2000 року, патенті США №5998436, виданому Язакі зі співавторами (Yazaki et al.), 7 грудня 1999 року й списках замічених помилок від 23 січня 2001 року, 30 жовтня 2001 року й 17 грудня 2002 року, заявці РСТ WO2006/110815 Abbott Laboratories, опублікованій 19 жовтня 2006 року, заявці РСТ WO2006/042034 Abbott Laboratories, опублікованій 20 квітня 2006 року, заявці РСТ WO2006/015194 Abbott laboratories, опублікованій 9 лютого 2006 року, заявці РСТ WO01/34595 Wakunaga Pharmaceutical Co., Ltd, опублікованій 27 березня 1997 року, вміст яких включено в даний опис у повному об'ємі за допомогою посилання. Похідні хінолонкарбонової кислоти, що підходять для застосуваня в способах, композиціях і застосуваннях згідно із даним винаходом, включають сполуки, що відповідають Формулі 2 15 UA 102709 C2 R6 O R4 R5 COOR1 W N Y X Z R2 R3 5 10 15 20 25 30 35 40 Формула 2, 1 2 де у Формулі 2 R являє собою атом водню або захисну карбоксил групу; R являє собою 3 гідроксильну групу, нижчу алкоксигрупу, заміщену або незаміщену аміногрупу; R являє собою 4 5 атом водню або атом галогену, R являє собою атом водню або атом галогену, R являє собою 6 атом галогену або можливо заміщену насичену циклічну аміногрупу; R являє собою атом водню, атом галогену, нітрогрупу або можливо захищену аміногрупу; X, Y і Z можуть бути 7 7 однаковими або різними й відповідно являти собою атом азоту, -СН= або -СR = (де R являє собою нижчу алкільну групу, атом галогену або ціаногрупу), за умови, що принаймні один з Х, Y 8 8 і Z являє собою атом азоту, а W являє собою атом азоту або –CR = (де R являє собою атом водню, атом галогену або нижчу алкільну групу). 1 2 Відповідно до одного з варіантів реалізації, у випадку якщо R являє собою атом водню, R 3 4 6 являє собою аміногрупу, R і R являють собою атом фтору, R являє собою атом водню, Х 7 7 являє собою атом азоту, Y являє собою –CR = (де R являє собою атом фтору), Z являє собою 8 8 5 -СН=, і W являє собою –CR = (де R являє собою атом хлору), то R не являє собою 3гідроксиазетидин-1-ільну групу, або її фармацевтично прийнятну сіль, складний ефір або проліку. 1 1 У випадку якщо R являє собою захисну карбоксил групу, R може являти собою карбоксилатний складноефірний залишок, який відносно легко відщеплюється, наприклад, in vivo, з утворенням відповідної вільної карбоксильної групи. Типові захисні карбоксил групи включають групи, які можуть розкладатися в результаті гідролізу, каталітичного відновлення й інших способів обробки в м'яких умовах, такі як нижчі алкільні групи, такі як метильна група, етилова група, н-пропілова група, ізо-пропілова група, н-бутилова група, ізо-бутилова група, трет-бутилова група, пентилова група, гексилова група й гептилова група, нижчі алкенільні групи, такі як вінільна група, алільна група, 1-пропенільна група, бутенільна група, пентенільна група, гексенільна група й гептенільна група; аралкільні групи, такі як бензилова група; і арильні групи, такі як фенільна група й нафтильна група; і групи, які можуть легко розкладатися в організмі, такі як нижчі алканоілоксиалкільні групи, такі як ацетоксиметильна група й півалоілоксиметильна група; нижчі алкоксикарбонілоксиалкільні групи, такі як метоксикарбонілоксиметильна група й 1-етоксикарбонілоксиетильна група; нижча алкоксиметильна група, така як метоксиметильна група; лактонові групи, такі як фталідил; нижчі діалкіламіноалкільні групи, такі як 1-диметиламіноетильна група; і (5-метил-2-оксо-1,3-діоксол-4іл)метильна група. 1 Відповідно до одного з варіантів реалізації R у Формулі 2 являє собою Н. 2 Відповідно до одного з варіантів реалізації R у Формулі 2 являє собою –NH2. 3 Відповідно до одного з варіантів реалізації R у Формулі 2 являє собою галоген. 3 Відповідно до іншого варіанта реалізації R у Формулі 2 являє собою фтор. 4 Відповідно до одного з варіантів реалізації R у Формулі 2 являє собою галоген. 4 Відповідно до іншого варіанта реалізації R у Формулі 2 являє собою фтор. 5 Відповідно до одного з варіантів реалізації R у Формулі 2 являє собою заміщену циклічну аміногрупу. N 5 Відповідно до одного з варіантів реалізації R у Формулі 2 являє собою HO 16 . UA 102709 C2 6 5 10 15 Відповідно до одного з варіантів реалізації R у Формулі 2 являє собою водень. Відповідно до одного з варіантів реалізації Х у Формулі 2 являє собою атом азоту. 7 Відповідно до одного з варіантів реалізації Y у Формулі 2 являє собою =CR . 7 Відповідно до одного з варіантів реалізації R у Формулі 2 являє собою галоген. 7 Відповідно до іншого варіанта реалізації R у Формулі 2 являє собою фтор. Відповідно до одного з варіантів реалізації Z у Формулі 2 являє собою =СН-. 8 Відповідно до одного з варіантів реалізації W у Формулі 2 являє собою =CR -. 8 Відповідно до одного з варіантів реалізації R у Формулі 2 являє собою галоген. 8 Відповідно до іншого варіанта реалізації R у Формулі 2 являє собою хлор. 1 2 3 4 5 6 7 8 9 1 2 3 Слід зазначити, що замісники R , R , R , R , R , R , R , R , R , A, J , J , J , W, X, Y, Z, e, f, і g визначені в даній заявці для зручності відносно хімічної структури похідних хінолонкарбонової кислоти, наприклад, для Формули 2. Відповідно до інших варіантів реалізації даний винахід відноситься до способу, композиції 8 8 або застосування сполуки Формули 2, де W являє собою –CR =, де R являє собою атом водню, атом галогену або нижчу алкільну групу. Відповідно до інших варіантів реалізації даний винахід відноситься до способу, композиції 5 або застосування похідного хінолонкарбонової кислоти Формули 2, де R являє собою групу, представлену наступними формулами (а) або (b): (а) J1 J2 (CH2)e J3 N 20 (b) J1 J2 (CH2)f A N (CH2)g J3 9 25 30 J1 (CH2)e 35 9 де А являє собою атом кисню, атом сірки або NR (де R являє собою атом водню або нижчу алкільну групу), е являє собою число від 3 до 5, f являє собою число від 1 до 3, g являє собою 1 2 3 число від 0 до 2, J , J і J , які можуть бути однаковими або різними, являють собою атом водню, гідроксильну групу, нижчу алкільну групу, нижчу аміноалкільну групу, аміногрупу, нижчу алкіламіногрупу, нижчу алкоксигрупу або атом галогену. Відповідно до інших варіантів реалізації даний винахід відноситься до способу, композиції або застосування похідного хінолонкарбонової кислоти Формули 2, де R5 являє собою групу, представлену формулою (а). (а) J2 J3 N Відповідно до інших варіантів реалізації даний винахід відноситься до способу, композиції або застосування похідного хінолонкарбонової кислоти структури Похідного 1 Хінолонкарбонової Кислоти, де е у формулі (а) дорівнює 3 або 4. (а) 17 UA 102709 C2 J1 J2 (CH2)e 5 10 N Відповідно до інших варіантів реалізації даний винахід відноситься до способу, композиції або застосування похідного хінолонкарбонової кислоти структури Похідного 1 1 2 Хінолонкарбонової Кислоти, де R являє собою атом водню, R являє собою аміногрупу, нижчу 3 4 алкіламіногрупу або нижчу діалкіламіногрупу, R являє собою атом галогену, R являє собою 6 атом галогену, R являє собою атом водню, Х являє собою атом азоту, Y і Z являють собою 7 7 СН= або –CR = (де R являє собою нижчу алкільну групу або атом галогену), а W являє собою – 8 8 CR = (де R являє собою атом галогену або нижчу алкільну групу). Відповідно до інших варіантів реалізації даний винахід відноситься до способу, композиції 2 або застосування Похідного 1 Хінолонкарбонової Кислоти Формули 1, де R являє собою 3 4 аміногрупу, R являє собою атом фтору, R являє собою атом фтору, Y являє собою –CF=, Z 8 8 являє собою -СН=, W являє собою –CR = (де R являє собою атом хлору, атом брому або метильну групу), а е у формулі (а) дорівнює 3. (а) J1 J2 (CH2)e 15 J3 J3 N Слід зазначити, що змінні, використовувані для опису похідних хінолонкарбонової кислоти, відрізняються від змінних, використовуваних для визначення циклодекстринів. Відповідно до інших варіантів реалізації даний винахід відноситься до способу, композиції або застосування, де зазначена хінолонкарбонова кислота відповідає сполуці (А): O F COOH N HO N Cl F N H2N 20 25 30 F (А), або її фармацевтично прийнятній солі, складному ефіру або проліку. Представлене вище похідне хінолонкарбонової кислоти, сполука (А), також відоме як USAN, делафлоксацин, із широко відомими кодовими найменуваннями RX-3341, АВТ-492 і WQ3034, а також, зокрема, як сполука з хімічною назвою 1-(6-аміно-3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3гідрокси-1-азетидиніл)-4-оксо-3-хінолінкарбонова кислота або 1-(6-аміно-3,5-дифтор-2піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідроксиазетидин-1-іл)-4-оксо-3-хінолінкарбонова кислота. Зазначена кислотна форма сполуки у виді карбонової кислоти відповідає реєстраційному номеру CAS 189279-58-1. Крім того, в WO2006/042034, вказаному вище, описана 1-деокси-1-(метиламіно)-D-глюцитолова сіль зазначеної сполуки, також відома як Dглюцитол, 1-деокси-1-(метиламіно)-,1-(6-аміно-3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4 18 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 60 дигідро-7-(3-гідрокси-1-азетидиніл)-4-оксо-3-хінолінкарбоксилат (сіль) і тригідрат 1-деокси-1(метиламіно)-D-глюцитолової солі зазначеної сполуки, також відомий як D-глюцитол, 1-деокси1-(метиламіно)-,1-(6-аміно-3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1азетидиніл)-4-оксо-3-хінолінкарбоксилату тригідрат (сіль). 1-Деокси-1-(метиламіно)-Dглюцитолова сіль і тригідрат 1-деокси-1-(метиламіно)-D-глюцитолової солі відповідають реєстраційним номерам CAS 352485-37-8 і 83105-02-0, відповідно. 1-Деокси-1-(метиламіно)-Dглюцитол відповідає реєстраційному номеру CAS 6284-40-8. 1-Деокси-1-(метиламіно)-Dглюцитол також відомий за назвою меглумін. D-глюцитол, 1-деокси-1-(метиламіно)-, 1-(6-аміно3,5-дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1-азетидиніл)-4-оксо-3хінолінкарбоксилат, що являє собою меглумінову сіль делафлоксацину також відома як делафлоксацин меглумін. Тригідрат D-глюцитол, 1-деокси-1-(метиламіно)-,1-(6-аміно-3,5дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1-азетидиніл)-4-оксо-3хінолінкарбоксилату, що являє собою тригідрат меглумінової солі делафлоксацину також відомий як делафлоксацин меглумін тригідрат. В WO2006/042034 також описана кристалічна форма 1-деокси-1-(метиламіно)-D-глюцитолової солі, що характеризується при вимірюванні при 25 °C і Cu-Ka випромінюванні, порошковою дифрактограмою, представленою на Фігурі 1 (див., WO 2006/042034) і кристалічна форма тригідрату 1-деокси-1-(метиламіно)-D-глюцитолу, що характеризується при вимірюванні при 25 °C і Cu-Ka випромінюванні, порошковою дифрактограмою, представленою на Фігурі 2 (див, WO2006/042034, вміст якої включено в даний опис у повному об'ємі за допомогою посилання). Зазначені 1-деокси-1-(метиламіно)-Dглюцитолові солі підходять для застосування згідно даному винаходу. Також, див. роботу А.Р. Хейта зі співавторами (A.R. Haight et al.), "Synthesis of Quinolone ABT-492: Crystallizations for Optimal Processing", Organic Process Research & Development (2006), 10(4), 751-756, вміст якої включено в даний опис у повному об'ємі за допомогою посилання. Додатково інші фармацевтично прийнятні солі представленої сполуки, делафлоксацину, включають калієву сіль і трис-сіль. Трис являє собою загальноприйняте скорочення для трис(гідроксиметил)амінометану, що відомий за назвою по IUPAC 2-аміно-2-гідроксиметилпропан-1,3-діол. Протимікробний агент, що являє собою хінолонкарбонову кислоту, становить від приблизно 0,01 % до приблизно 50 % від маси композиції. Відповідно до інших варіантів реалізації протимікробний агент, що являє собою хінолонкарбонову кислоту, становить від приблизно 0,25 % до приблизно 20 % від маси композиції. Відповідно до інших варіантів реалізації протимікробний агент, що являє собою хінолонкарбонову кислоту, становить від приблизно 0,5 % до приблизно 10 % від маси композиції. Відповідно до інших варіантів реалізації протимікробний агент, що являє собою хінолонкарбонову кислоту, становить від приблизно 1 % до приблизно 5 % від маси композиції. Процентний вміст за масою протимікробного агента, що являє собою хінолонкарбонову кислоту, визначають на основі активної маси вихідної сполуки. Інакше кажучи, відповідні наближення й обчислення, добре відомі фахівцеві в даній галузі техніки, можуть бути легко проведені для визначення активної маси. Як необмежуючий приклад, якщо застосовують вихідну вільну карбонову кислоту делафлоксацину, тобто 1-(6-аміно-3,5дифтор-2-піридиніл)-8-хлор-6-фтор-1,4-дигідро-7-(3-гідрокси-1-азетидиніл)-4-оксо-3хінолінкарбонову кислоту, її масу варто скорегувати, у випадку якщо необхідно застосовувати сіль, таку як натрієва сіль, так як молекулярна маса сполуки збільшиться на приблизно 21,9, хоча кількість активної сполуки, що доставляється, залишиться такою ж. Дозування фармацевтично активного інгредієнта й спосіб введення фармацевтичної композиції залежать від пацієнта або суб'єкта, якому виконують введення, і цільового мікроорганізму, наприклад, цільового бактеріального організму. Відповідно до додаткового опису, представленого далі, часто є переважним здрібнювання фармацевтично активного інгредієнта в невеликі й однорідні за розміром частки, як правило, мікронного діапазону, тобто мікронізація. Здрібнювання можна проводити із застосуванням стандартних методик, добре відомих фахівцям у даній галузі техніки. Відповідно до одного з варіантів реалізації підходящі діапазони розмірів часток фармацевтично активного інгредієнта, як правило, становлять від приблизно 0,01 мікронів до приблизно 100 мікронів. Відповідно до іншого варіанта реалізації застосовувані діапазони розмірів часток фармацевтично активного інгредієнта становлять від приблизно 0,1 мікрона до приблизно 20 мікронів. Відповідно до іншого варіанта реалізації підходящі діапазони розмірів часток фармацевтично активного інгредієнта становлять від приблизно 0,5 мікронів до приблизно 5 мікронів. b. Циклодекстрини Композиції згідно із даним винаходом містять циклодекстрин (іноді скорочено називаний "ЦД"). Циклодекстрини являють собою циклічні олігосахариди, що складаються з п'яти або 19 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 60 більше альфа-D-глюкопіранозидних фрагментів, тобто фрагментів цукру. Циклодекстрини одержують з крохмалю за допомогою ферментативного перетворення. Циклодекстрини, що містять шість фрагментів цукру, називають альфа-циклодекстринами (також αциклодекстринами). Циклодекстрини, що містять сім фрагментів цукру називають бетациклодекстринами (також β-циклодекстринами). Циклодекстрини, що містять вісім фрагментів цукру називають гама-циклодекстринами (також γ-циклодекстринами). Циклодекстрини додатково описані в Handbook of Pharmaceutical Excipients, Third Edition, за редакцією А.Х. Кібе (Edited by A.H.Kibbe), стор. 165-168, American Pharmaceutical Association and Pharmaceutical Press (2000), вміст якої включено в даний опис у повному об'ємі за допомогою посилання. Повідомлялося, що циклодекстрини, які являють собою циклічні олігосахариди, підходять для застосування у фармацевтичних складах. Також, у публікаціях в галузі розробки фармацевтичних продуктів повідомлялося про різні склади й технології, що відносяться до розчинності й стабільності лікарських засобів, а також до переносимості складів для внутрішньовенного введення. Див., наприклад, патент США №6407079 В1, виданий на ім'я Мюлера зі співавторами (Muller et al.), виданий 18 червня 2002 року, патент США №5874418, виданий Стелла зі співавторами (Stella et al.), опублікований 23 лютого 1999 року; патент США №5376645, виданий Стелла зі співавторами (Stella et al.), опублікований 27 грудня 1994 року; патент США №5134127, виданий Стелла зі співавторами (Stella et al.), 28 липня 1992 року й патент США №5084276, виданий Юнкерові зі співавторами (Yunker et al.), 28 січня 1992 року, вміст кожного з яких включено в даний опис у повному об'ємі за допомогою посилання. Проте, незважаючи на те, що циклодекстрини досліджували як наповнювачі для фармацевтичних композицій для внутрішньовенного введення, не всі циклодекстрини автоматично підходять для застосування із забезпеченням бажаних характеристик і переваг складів. На основі літературних даних не можна апріорі вибрати циклодекстрин для застосування з конкретним лікарським продуктом з одержання бажаного кінцевого результату. Кінцевий склад лікарського продукту є результатом складного взаємного впливу розчинності, стабільності й переносимості. Циклодекстрин становить від приблизно 0,01 % до приблизно 50 % від маси композиції. Відповідно до інших варіантів реалізації протимікробний агент, що являє собою хінолонкарбонову кислоту, становить від приблизно 0,25 % до приблизно 20 % від маси композиції. Відповідно до одного з варіантів реалізації композиції згідно із даним винаходом містять циклодекстрин, обраний з групи, що складається з альфа-циклодекстрину, бетациклодекстрину, гама-циклодекстрину та їхніх сумішей. Відповідно до одного з варіантів реалізації композиції згідно із даним винаходом містять циклодекстрин, обраний з групи, що складається з бета-циклодекстрину, гама-циклодекстрину та їхніх сумішей. Бета-циклодекстрини, що підходять для застосування згідно із даним винаходом, включають прості ефіри бета-циклодекстрину, складні ефіри бета-циклодекстрину та їхні суміші. Бетациклодекстрини додатково описані в патенті США №6407079, виданому Мюлеру зі співавторами (Muller et al.), опублікованому 18 червня 2002 року, вміст якого включено в даний опис у повному об'ємі за допомогою посилання. У зазначеному патенті "079" зазначені бетациклодекстрини описані як такі, що відповідають наступній формулі (3): (бета-циклодекстрин)-OR (3) в якій залишки R являють собою водень або гідроксиалкільні групи, а частина залишків R може можливо являти собою алкільні групи, причому простий ефір бета-циклодекстрину має розчинність у воді, яка дорівнює більше ніж 1,8 г в 100 мл води. Відповідно до одного з варіантів реалізації залишки R являють собою гідроксиалкільні групи, а частина залишків R може можливо являти собою алкільні групи. Відповідно до іншого варіанта реалізації простий ефір бета-циклодекстрину має розчинність у воді, яка дорівнює більше 1,8 г в 100 мл води. Відповідно до іншого варіанта реалізації залишки R являють собою гідроксиалкільни групи, а частина залишків R може являти собою алкільні групи, причому простий ефір бетациклодекстрину має розчинність у воді, яка дорівнює більше ніж 1,8 г в 100 мл води. Відповідно до одного з варіантів реалізації застосовують частково етерифікований бетациклодекстрин формули 3, в якому деякі залишки R являють собою гідроксиетильні, гідроксипропільні або дигідроксипропільні групи. Можливо, частина залишків R може, наприклад, являти собою метильну або етильну групу. Відповідно до одного з варіантів реалізації застосування частково метильованих простих ефірів бета-циклодекстрину, що містять від 7 до 14 метильних груп у молекулі бета-циклодекстрину, як відомо з German Offenlegungsschrift 3118218, не потрапляє у рамки даного винаходу. Відповідно до одного з 20 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантів реалізації неповні ефіри бета-циклодекстрину, які містять тільки алкільні групи (метил, етил) можуть бути підходящими відповідно до винаходу, якщо вони мають низький ступінь заміщення (визначений нижче), що дорівнює від 0,05 до 0,2. Бета-циклодекстрин являє собою сполуку з кільцевою структурою, що складається з 7 ангідроглюкозних ланок; також бета-циклодекстрин називають циклогептаамілозою. Кожне з 7 глюкозних кілець містить три гідроксильні групи в положеннях 2, 3 і 6, які можуть бути етерифікованими. У частково етерифікованих похідних бета-циклодекстрину, застосовуваних згідно із даним винаходом, тільки частина зазначених гідроксильних груп етерифікована гідроксиалкільними групами й, можливо, додатково алкільними групами. При етерифікації гідроксиалкільними групами, яку можна проводити за допомогою взаємодії з відповідними алкіленоксидами, ступінь заміщення визначають як молярне заміщення (MS), що розраховується в молях на ангідроглюкозну ланку, - для порівняння патент США №3459731, колонка 4. У гідроксиалкільних простих ефірах бета-циклодекстрину, застосовуваних згідно із даним винаходом, молярне заміщення становить від 0,05 до 10. Відповідно до іншого варіанта реалізації молярне заміщення становить від 0,2 до 2. Відповідно до іншого варіанта реалізації молярне заміщення становить від приблизно 0,25 до приблизно 1. Етерифікація алкільними групами може бути визначена безпосередньо як ступінь заміщення (СЗ) глюкозного фрагмента, що – як визначено вище – становить 3 для повного заміщення. Частково етерифіковані бета-циклодекстрини, які містять крім гідроксиалкільних груп також алкільні групи, особливо метильні або етильні групи, до ступеня заміщення, що дорівнює від 0,05 до 2,0, застосовують у рамках даного винаходу. Відповідно до одного з варіантів реалізації ступінь заміщення алкільними групами становить від приблизно 0,2 до приблизно 1,5. Відповідно до одного з варіантів реалізації ступінь заміщення становить від приблизно 0,5 до приблизно 1,2. Відповідно до одного з варіантів реалізації молярне співвідношення лікарського засобу до простого ефіру бета-циклодекстрину становить приблизно від 1:6 до 4:1, зокрема приблизно від 1:2 до 1:1. Відповідно до одного з варіантів реалізації комплексоутворюючий агент застосовують у молярному надлишку. Підходящі комплексоутворюючі агенти, являють собою гідроксиетиловий, гідроксипропіловий і дигідрокиспропіловий ефіри, їх відповідні змішані ефіри, а також змішані ефіри з метиловими або етиловими групами, такі як метилгідроксиетиловий, метилгідроксипропіловий, етилгідроксиетиловий і етилгідроксипропіловий ефір бетациклодекстрину. Одержання гідроксиалкілових ефірів бета-циклодекстрину можна проводити із застосуванням способу, описаного в патенті США №3459731. Підходящі способи одержання простих ефірів бета-циклодестрину можна додатково знайти в роботі Шейтлі зі співавторами (Szejtli et al.), Starke 32, 165 (1980) і роботі П. Крофта й Р.А. Барша (P. Croft and R. A. Bartsch), Tetrahedron 39, 1417 (1983). Змішані прості ефіри бета-циклодекстрину можуть бути одержані в результаті взаємодії бета-циклодекстрину в основному рідкому реакційному середовищі, що містить гідроксид лужного металу, воду й, можливо, щонайменше один органічний розчинник (наприклад, диметоксиетан або ізопропанол) із щонайменше двома різними гідроксиалкілуючими й, можливо, алкілуючими етерифікуючими агентами (наприклад, етиленоксидом, пропіленокидом, метил- або етилхлоридом). Бета-циклодекстрини, що підходять для застосування згідно із даним винаходом, включають гідроксипропіл-бета-циклодекстрини. Приклади гідроксипропіл-бета-циклодекстринів, застосованих згідно із даним винаходом, включають Cavitron® W7 HP7 Pharma, реєстраційний номер CAS 128446-35-5, що являє собою гідроксипропіл-бета-циклодекстрин, що містить сім глюкозних ланок і має молекулярне заміщення ангідроглюкозну ланку, що дорівнює 0,86-1,14, і Cavitron® W7 HP5 Pharma, що являє собою гідроксипропіл-бета-циклодекстрин, що містить сім глюкозних ланок і має молекулярне заміщення на ангідроглюкозну ланку, що дорівнює 0,59-0,73. Сульфоалкілефірні похідні циклодекстрину Прості сульфоалкільні ефіри циклодекстрину, які підходять для застосування згідно із даним винаходом, включають сульфоалкілефірні похідні циклодекстрину, додатково описані в патенті США №5874418, виданому Стелла зі співавторами (Stella et al.), 23 лютого 1999 року; у патенті США №5376645, виданому Стелла зі співавторами (Stella et al.), 27 грудня 1994 року, спільно зі списком замічених помилок від 19 травня 2008 року; і в патенті США №5134127, виданому Стелла зі співавторами (Stella et al.), 28 липня 1992 року, вміст яких включено в даний опис у повному об'ємі за допомогою посилання. У зазначених патентах описані сульфоалкільні ефіри циклодекстрину, представлені далі. 21 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 У даному винаході також запропоновані похідні циклодекстрину, які підходять для фармацевтичного застосування. Зазначені похідні підходять для застосування як агенти, що утворюють клатрати з лікарськими засобами з одержанням клатратних комплексів, які підходять для застосування в парентеральних й інших фармацевтичних складах. Також запропоновані способи одержання й виділення похідних циклодекстрину. Сульфоалкілефірні похідні циклодекстрину згідно із даним винаходом є функціоналізованими (С2-6 алкілен)-SO3 групами, і таким чином, являють собою заряджені фрагменти. Той факт, що зазначені сполуки забезпечують дуже низький рівень токсичності, є дивним з погляду на існувавшу в даній галузі техніки до теперішнього часу точку зору про те, що похідні циклодекстрину повинні зберігати електронейтральність, щоб не проявляти токсичності (див. Pitha, "Amorphous Water-Soluble", Third International Symposium on Recent Advances in Drug Delivery Systems, Salt Lake City, Utah, Feb. 23-27, 1987). Висока розчинність у воді похідних циклодекстрину згідно із даним винаходом й відповідна знижена нефротоксичність також є дивними з урахуванням опису патенту США №4727064, в якому повідомляють, що для підтримання високого рівня розчинності похідних циклодекстрину варто застосовувати суміш похідних. Вважають, що розчинність у воді, яку мають сульфоалкільні похідні циклодекстрину згідно із даним винаходом, досягається за рахунок сольватації фрагментів сульфокислоти. Таким чином, гетерогенна суміш похідних циклодекстрину згідно із даним винаходом не є необхідною вимогою для виникнення спостережуваної покращеної сольватації. Хоча суміш сульфоалкілефірних похідних можна застосовувати відповідно до даного винаходу, зазначена суміш не є необхідною вимогою для покращеної розчинності. Відповідно до одного з варіантів реалізації сульфоалкілефірні похідні циклодекстрину згідно із даним винаходом мають структури, представлені формулою (1), наведеною безпосередньо нижче: Формула 1 де: n дорівнює 4, 5 або 6; кожен з R1, R2, R3, R4, R5, R6, R7, R8 і R9 незалежно являє собою О- або О-(С2-6 алкілен)-SO3 групу, де щонайменше один з R1 і R2 незалежно являє собою О-(С2-6 алкілен)-SO3 групу, наприклад, О-(СН2)m-SO3 групу, де m дорівнює від 2 до 6, наприклад, від 2 до 4 (наприклад, ОСН2СН2СН2SO3 або OCH2CH2CH2CH2SO3 ); і кожен з S1, S2, S3, S4, S5, S6, S7, S8 і S9 незалежно являє собою фармацевтично прийнятний + + + + катіон, що включає, наприклад, Н , лужні метали (наприклад, Li , Na , K ), лужно-земельні 2+ 2+ метали (наприклад, Са , Mg ), амонійні іони й катіони амінів, такі як катіони С1-6 алкіламінів, піперидину, піразину, С1-6 алканоламінів і С4-8 циклоалканоламінів. Відповідно до іншого варіанта реалізації (2): R1 являє собою О-(С2-6 алкілен)-SO3 групу, наприклад, О-(СН2)m-SO3 групу (наприклад, ОСН2СН2СН2SO3 або OCH2CH2CH2CH2SO3 ); групи від R2 до R9 являють собою О; і групи від S1 до S9 визначені для формули 1 вище. Відповідно до іншого варіанта реалізації (3): Кожен з R1, R2 і R3 незалежно являє собою О-(С2-6 алкілен)-SO3 групу, наприклад, О-(СН2)mSO3 групу (наприклад, ОСН2СН2СН2SO3 або OCH2CH2CH2CH2SO3 ); групи від R4 до R9 являють собою О; і групи від S1 до S9 визначені для формули 1 вище. Відповідно до іншого варіанта реалізації (4): Групи від R1 до R3 визначені відповідно до варіантів реалізації (2) або (3), представлених вище; щонайменше один з R4, R6 і R8 являє собою О-(С2-6 алкілен)-SO3 групу, наприклад, О(СН2)m-SO3 групу (наприклад, ОСН2СН2СН2SO3 або OCH2CH2CH2CH2SO3 ); 22 UA 102709 C2 5 10 15 20 25 30 35 40 45 50 55 60 R5, R7 і R9 являють собою О, і групи від S1 до S9 визначені для формули 1 вище. Відповідно до іншого варіанта реалізації (6): кожен з R1, R2, R3, R4, R6 і R8 незалежно являє собою О-(С2-6 алкілен)-SO3 групу, наприклад, О-(СН2)m-SO3 групу (наприклад, ОСН2СН2СН2SO3 або OCH2CH2CH2CH2SO3 ); R5, R7 і R9 являють собою О, і групи від S1 до S9 визначені для формули 1 вище. Терміни "алкілен" і "алкіл" у зазначеному тексті (наприклад, в О-(С2-6 алкілен)-SO3 групі або в алкіламінах) включають лінійні або розгалужені, насичені або ненасичені (тобто, що містять один подвійний зв'язок) бівалентні алкіленові групи й одновалентні алкільні групи, відповідно. Термін "алканол" у зазначеному тексі, аналогічно, включає лінійні й розгалужені насичені й ненасичені алкільні компоненти алканольних груп, у яких гідроксильні групи можуть розташовуватися в будь-якому положенні алкільного фрагмента. Термін "циклоалканол" включає незаміщені або заміщені (наприклад, метилом або етилом) циклічні спирти. Відповідно до одного з варіантів реалізації в даному винаході запропоновані композиції, що містять суміш похідних циклодекстрину, що мають структуру, представлену у формулі (1), де композиція в цілому містить у середньому від щонайменше 1 до 3n+6 груп алкілсульфокислоти на молекулу циклодекстрину. У даному винаході також запропоновані композиції, що містять по суті тільки один тип похідного циклодекстрину. Відповідно до одного з варіантів реалізації похідні циклодекстрину згідно із даним винаходом заміщені за, щонайменше, за одною з первинних гідроксильних груп (тобто щонайменше одна з груп R1 до R3 є замісником) або заміщені по обох первинних гідроксильних групах і гідроксильній групі в положенні 3 (тобто щонайменше одна з груп від R1 до R3 і щонайменше одна із груп R4, R6 і R8 є замісниками). Відповідно до іншого варіанта реалізації вважають, що заміщення по гідроксильній групі в положенні 2, у випадку якщо заміщення теоретично можливе, не є значимим для продуктів згідно із даним винаходом. Похідні циклодекстрину згідно із даним винаходом одержують (відповідно до обговорення, запропонованого далі) у виді очищених композицій, наприклад, у виді композицій, що містять принаймні 95 мас. % похідного(их) циклодекстрину із заміщенням, проведеним за, щонайменше, одною первинною гідроксильною групою молекули циклодекстрину (тобто R 1, R2 або R3 1 формули (1)), визначеним за допомогою Н ЯМР із частотою 300 Мгц. Відповідно до одного з варіантів реалізації можна одержати очищені композиції, що містять принаймні 98 мас. % похідного(их) циклодекстрину. Відповідно до одного з варіантів реалізації це суперечить вмісту патента США №3426011, у якому повідомляють про одержання винятково продуктів взаємодії циклодекстрину з сульфоновим реагентом. Продукти взаємодії згідно патенту «’011" містять значні кількості вихідного незаміщеного циклодекстрину. Відповідно до одного з варіантів реалізації композицій згідно із даним винаходом непрореагований циклодекстрин по суті видаляли, причому домішки, що залишалися (тобто ≤5 мас. % композиції) були незначними для характеристик композиції, яка містить похідне циклодекстрину. Слід зазначити, що змінні, застосовувані для опису циклодекстринів, є відмінними від змінних, застосовуваних для визначення похідних хінолонкарбонової кислоти. Було виявлено, що алкілсульфонові похідні циклодекстрину з більш високим ступенем заміщення згідно із даним винаходом забезпечують, на додаток до значно покращених характеристик розчинності й низької токсичності, переважну властивість, що полягає в зменшеному руйнуванні мембран. У дослідженнях гемолізу червоних кров'яних тілець похідні циклодекстрину з більш високим ступенем заміщення викликали зневажливо низьке руйнування мембран. Монозаміщені похідні циклодекстрину викликали руйнування кількості мембран, що приблизно відповідало руйнуванню, викликаному гідроксипропільним похідним. Відповідно до одного з варіантів реалізації покращені характеристики досягають у випадку композицій згідно із даним винаходом, які містять
ДивитисяДодаткова інформація
Назва патенту англійськоюAntimicrobial composition
Автори англійськоюLi, Danping, Burak, Eric, S., Dresbacr, David, S., Lord, Danielle, Beurer
Назва патенту російськоюПротивомикробная композиция
Автори російськоюЛи Данпин, Бьюрак Эрик С., Дресбек Дэвид С., Лорд Дэниэлль Берер
МПК / Мітки
МПК: A01N 43/44, A01P 1/00, A01N 43/42, A61K 8/49, A61K 47/40, A61K 31/47
Мітки: протимікробна, композиція
Код посилання
<a href="https://ua.patents.su/37-102709-protimikrobna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Протимікробна композиція</a>
Попередній патент: Кулеструминний пристрій для буріння свердловин
Наступний патент: Спосіб переробки хвостів флотації поліметалічних руд
Випадковий патент: Спосіб оцінки стану системи мати-плацента-плід у вагітних з наявністю урогенітальних інфекцій