Частинка антагоніста crth2 (варіанти)
Формула / Реферат
1. Частинки {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)-піримідин-5-іл}оцтової кислоти формули І:
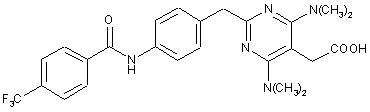 (I)
(I)
у кристалічній формі І;
де частинки мають середній розмір частинок, що змінюється від близько 0,1 до близько 150 мкм, від близько 0,5 до близько 100 мкм, від близько 1 до близько 50 мкм, від близько 1 до близько 25 мкм, від близько 1 до близько 20 мкм, від близько 1 до близько 10 мкм, від близько 2 до близько 10 мкм або від близько 2 до близько 7,5 мкм; і/або
частинки мають коефіцієнт однорідності, який змінюється від близько 1 до близько 20, від близько 1 до близько 10, від близько 2 до близько 5 або від близько 3 до близько 4; і/або
частинки мають насипну масу після ущільнення, яка змінюється від близько 0,1 до близько 1,0 г/мл, від близько 0,15 до близько 0,8 г/мл, від близько 0,2 до близько 0,6 г/мл, від близько 0,25 до близько 0,5 г/мл або від близько 0,3 до близько 0,4 г/мл; і/або
частинки містять не менше близько 95 %, не менше близько 97 %, не менше близько 98 %, не менше близько 99 % або не менше близько 99,5 % по масі кислоти формули І; і/або
частинки мають залишковий вміст органічного розчинника не більше близько 5 %, не більше близько 2 %, не більше близько 1 %, не більше близько 0,9 %, не більше близько 0,8 %, не більше близько 0,7 %, не більше близько 0,6 %, не більше близько 0,5 %, не більше близько 0,4 %, не більше близько 0,3 %, не більше близько 0,2 %, не більше близько 0,1 %, не більше близько 0,05 % або не більше близько 0,01 % по масі; і/або
частинки мають залишковий вміст метанолу не більше близько 100000 ч/млн., не більше близько 10000 ч/млн., не більше близько 5000 ч/млн., не більше близько 4000 ч/млн., не більше близько 3000 ч/млн., не більше близько 2000 ч/млн., не більше близько 1000 ч/млн., не більше близько 500 ч/млн. або не більше близько 100 ч/млн; і/або
частинки містять не менше близько 90 %, не менше близько 95 %, не менше близько 98 %, не менше близько 99 % або не менше ніж 99,5 % по масі частинок у кристалічній формі І.
2. Частинки за п. 1, де частинки мають дифрактограму рентгенівського випромінювання на порошку, по суті як показано на фіг. 1.
3. Частинки за п. 1, де частинки мають дифрактограму рентгенівського випромінювання на порошку з одним або більше піками, вираженими в подвійному куті зближення приблизно 9,8°, 13,1°, 22,0° і 26,4°.
4. Частинки за пп. 1, де частинки мають дифрактограму рентгенівського випромінювання на порошку з піком, вираженим у подвійному куті зближення приблизно 22,0°±0,1°.
5. Частинки за п. 1, де частинки мають термограму диференціальної скануючої калориметрії, як показано на фіг. 2.
6. Частинки за п. 1, де частинки мають термограму диференціальної скануючої калориметрії з ендотермою при піковій температурі близько 224 °С і температурі початку розкладання близько 220 °С.
7. Частинки за п. 1, де кристалічні характеристики частинок є голчастими.
8. Частинки за п. 1, які мають розчинність у воді близько 3 мкг/мл при кімнатній температурі.
9. Частинки {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)-піримідин-5-іл}оцтової кислоти формули І:
 (I)
(I)
у кристалічній формі II.
10. Частинки за п. 9, де частинки мають дифрактограму рентгенівського випромінювання на порошку, по суті як показано на фіг. 6.
11. Частинки за п. 9, де частинки мають дифрактограму рентгенівського випромінювання на порошку з піком, вираженим у подвійному куті зближення приблизно 31,7°.
12. Частинки за п. 9, де частинки містять не менше близько 90 %, не менше близько 95 %, не менше близько 98 %, не менше близько 99 % або не менше близько 99,5 % по масі частинок у кристалічній формі II.
13. Частинки {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)-піримідин-5-іл}оцтової кислоти формули І:
 (I)
(I)
в аморфній формі.
14. Частинки за п. 13, де частинки містять не менше близько 90 %, не менше близько 95 %, не менше близько 98 %, не менше близько 99 % або не менше близько 99,5 % по масі частинок в аморфній формі.
15. Частинки за будь-яким з пп. 9-14, де частинки містять не менше близько 95 %, не менше близько 97 %, не менше близько 98 %, не менше близько 99 % або не менше близько 99,5 % по масі кислоти формули І; і/або
частинки мають середній розмір частинок, який змінюється від близько 0,1 до близько 150 мкм, від близько 0,5 до близько 100 мкм, від близько 1 до близько 50 мкм, від близько 1 до близько 25 мкм, від близько 1 до близько 20 мкм, від близько 1 до близько 10 мкм, від близько 2 до близько 10 мкм або від близько 2 до близько 7,5 мкм; і, або
частинки мають коефіцієнт однорідності від близько 1 до близько 100, від близько 1 до близько 50, від близько 1 до близько 20 або від близько 5 до близько 20; і/або
частинки мають коефіцієнт однорідності, який змінюється від близько 1 до близько 20, від близько 1 до близько 10, від близько 2 до близько 5 або від близько 3 до близько 4; і/або
частинки мають залишковий вміст органічного розчинника не більше близько 5 %, не більше близько 2 %, не більше близько 1 %, не більше близько 0,9 %, не більше близько 0,8 %, не більше близько 0,7 %, не більше близько 0,6 %, не більше близько 0,5 %, не більше близько 0,4 %, не більше близько 0,3 %, не більше близько 0,2 %, не більше близько 0,1 %, не більше близько 0,05 % або не більше близько 0,01 % по масі.
16. Фармацевтична композиція, яка містить частинки за п. 1 і фармацевтично прийнятний носій.
17. Фармацевтична композиція за п. 16, де композиція приготована для перорального, назального, бронхіального або місцевого введення.
18. Фармацевтична композиція за п. 16 або 17, де композиція приготована у вигляді лікарської форми для введення разової дози.
19. Спосіб для лікування, профілактики або полегшення одного або більше симптомів захворювання, опосередкованого CRTH2, який включає введення частинок за будь-яким з пп. 1-18.
20. Спосіб лікування, профілактики або полегшення одного або більше симптомів захворювання, пов'язаного з еозинофілами, який включає введення пацієнтові терапевтично ефективної кількості частинок за будь-яким з пп. 1-18.
21. Спосіб лікування, профілактики або полегшення одного або більше симптомів захворювання, пов'язаного з базофілами, який включає введення терапевтично ефективної кількості солі за будь-яким з пп. 1-18.
22. Спосіб лікування, профілактики або полегшення одного або більше симптомів запального захворювання, який включає введення пацієнтові терапевтично ефективної кількості солі за будь-яким з пп. 1-18.
23. Спосіб за будь-яким з пп. 19-21, де захворювання вибирають із групи, яка складається з астми, алергічної астми, астми, індукованої фізичними навантаженнями, алергічного риніту, цілорічного алергічного риніту, сезонного алергічного риніту, атопічного дерматиту, контактної гіперчутливості, контактного дерматиту, кон'юнктивіту, алергічного кон'юнктивіту, еозинофільного бронхіту, харчової алергії, еозинофільного гастроентериту, запального захворювання кишечнику, виразкового коліту, хвороби Крона, мастоцитозу, гіпep-IgE-синдрому, системного червоного вовчака, псоріазу, акне, розсіяного склерозу, відторгнення трансплантата, реперфузійного ушкодження, хронічного обструктивного захворювання легенів, синдрому Чарга-Стросса, синуситу, базофільної лейкемії, хронічної кропивниці, базофільного лейкоцитозу, псоріазу, екземи, ХОХЛ (хронічної обструктивної хвороби легенів), артриту, ревматоїдного артриту, псоріатичного артриту й остеоартриту.
24. Спосіб за п. 23, де захворюванням є астма, астма, індукована фізичними навантаженнями, алергічний риніт, атопічний дерматит, хронічна обструктивна хвороба легенів або алергічний кон'юнктивіт.
25. Спосіб за п. 23, де захворюванням є синдром Чарга-Стросса або синусит.
26. Спосіб одержання частинок за п. 1, в якому здійснюють контактування {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти з розчинником.
27. Спосіб одержання частинок за будь-яким з пп. 1-15, який включає стадії (а) одержання розчину {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)-піримідин-5-іл}оцтової кислоти в розчиннику при першій температурі; і (b) створення частинок при другій температурі.
28. Спосіб за п. 27, де частинки одержують випарюванням розчинника з розчину при другій температурі.
29. Спосіб за п. 27, де частинки одержують охолодженням розчину до другої температури.
30. Спосіб за п. 27, де частинки одержують додаванням антирозчинника до розчину при другій температурі.
31. Спосіб за п. 27, де частинки одержують додаванням розчину до антирозчинника при другій температурі.
32. Спосіб за п. 30, де антирозчинник вибирають із групи, яка складається з вуглеводню, хлорованого вуглеводню, спирту, простого ефіру, кетону, складного ефіру, карбонату, нітрилу, нітросполуки, гетероциклу, карбонсульфіду, води і їх сумішей, за умови, що кислота формули І має більш високу розчинність у розчиннику, ніж в антирозчиннику.
33. Спосіб за п. 31, де антирозчинник вибирають із групи, яка складається з вуглеводню, хлорованого вуглеводню, спирту, простого ефіру, кетону, складного ефіру, карбонату, нітрилу, нітросполуки, гетероциклу, карбонсульфіду, води і їх сумішей, за умови, що кислота формули І має більш високу розчинність у розчиннику, ніж в антирозчиннику.
34. Спосіб за п. 32, де розчинник і антирозчинник є щонайменше частково змішуваними.
35. Спосіб за п. 33, де розчинник і антирозчинник є щонайменше частково змішуваними.
36. Спосіб одержання частинок за п. 1, який включає стадії (а) одержання густої суспензії {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в розчиннику при першій температурі; і (b) одержання частинок шляхом впливу на суспензію другої температури.
37. Спосіб одержання частинок за п. 1, який включає стадії (а) одержання розчину {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в розчиннику при першій температурі; (b) утворення густої суспензії шляхом охолодження розчину до другої температури; і (с) одержання частинок шляхом обробки густої суспензії одним або більше циклами нагрівання й охолодження.
38. Спосіб за п. 37, де цикл нагрівання й охолодження проводять у діапазоні температур від близько -50 до близько 120 °С, від близько -50 до близько 100 °С, від близько -20 до близько 80 °С, від близько 0 до близько 80 °С, від близько 10 до близько 80 °С, від близько 20 до близько 80 °С, від близько 20 до близько 60 °С або від близько 20 до близько 50 °С.
39. Спосіб за будь-яким з пп. 27-38, де перша температура становить від близько 20 до близько 200 °С, від близько 20 до близько 150 °С або від близько 20 до близько 100 °С.
40. Спосіб за будь-яким з пп. 27-38, де друга температура становить від -100 до 100 °С, від близько -50 до близько 50 °С, від близько -10 до близько 30 °С, від 20 до близько 200 °С, від близько 20 до близько 150 °С або від близько 20 до близько 100 °С.
41. Спосіб за будь-яким з пп. 26-38, який додатково включає стадію виділення частинок.
42. Спосіб за будь-яким з пп. 26-38, де розчинник вибирають із групи, яка складається з вуглеводню, хлорованого вуглеводню, спирту, простого ефіру, кетону, складного ефіру, карбонату, аміду, нітрилу, сульфоксиду, сульфону, нітросполуки, гетероциклу, карбонової кислоти, гексаметилфосфораміду, карбонсульфіду, води і їх сумішей.
43. Спосіб за п. 42, де розчинник вибирають із групи, яка складається з ацетонітрилу, хлороформу, дихлорметану, ДМФА, 1,4-діоксану, метанолу, 2-метоксіетанолу, МІВК, толуолу, гексану(ів), ацетону, 1-бутанолу, МТВЕ, ДМСО, етанолу, етилацетату, етилформіату, гептану, ізобутилацетату, 1-пропанолу, ІРА, МЕК, ТГФ, води або їх сумішей.
Текст
Реферат: У даному описі надані частинки {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в аморфній або кристалічній формах, способи їх одержання, фармацевтичні композиції, які їх містять, і їх застосування для лікування, профілактики або полегшення одного або більше симптомів розладу або захворювання, опосередкованих CRTH2. UA 99138 C2 (12) UA 99138 C2 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 У даному винаході розглядають частинки {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в аморфній і кристалічній формах, способи одержання і їх фармацевтичні композиції. Також надані способи їх застосування для лікування, профілактики або полегшення одного або більше симптомів розладу або захворювання, опосередкованих CRTH2. CRTH2 являє собою хемоатрактантний рецептор, зв'язаний з G-білками, експресованими на Th2-клітинах, еозинофілах і базофілах (Nagata et al., J. Immunol. 1999, 162, 1278-1286; Hirai et al., J. Exp. Med. 2001, 193, 255-261). Простагландин D2 (PGD2), основний медіатор запалення, продукований тучними клітинами, є природним лігандом CRTH2. Останнім часом було показано, що активація CRTH2 PGD2 викликає міграцію й активацію Th2-клітин і еозинофілів, передбачаючи, що CRTH2 може відігравати прозапальну роль в алергічних захворюваннях (Hirai et al., J. Exp. Med. 2001, 193, 255-261; Gervais et al., J. Allergy Clin. Immunol. 2001, 108, 982988). Також було показано, що у пацієнтів з атопічним дерматитом існує підвищення циркулюючих Т-клітин, експресуючих CRTH2, яке корелює з тяжкістю захворювання (Cosmi et al., Eur. J. Immunol. 2000, 30, 2972-2979; Iwazaki et al., J. Investigative Dermatology 2002, 119, 609616). Роль PGD2 у розвитку й підтриманні алергічного запалення додатково була продемонстрована в моделі астми на мишах, показуючи, що надлишкова продукція PGD2 PGD2синтазою in vivo посилює запалення дихальних шляхів (Fujitani et al., J. Immunol. 2002, 168, 443449). Отже, антагоністи CRTH2 є потенційно застосовними для лікування розладів або захворювань, опосередкованих CRTH2, таких як алергічний риніт, алергічна астма, бронхоконстрикція, атопічний дерматит або системні запальні захворювання. Надано частинки {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти, яка має формулу I: , в аморфній формі або кристалічній формі I або II. Сполука формули I була ідентифікована як антагоніст CRTH2 (WO 2004/0022218). В одному варіанті здійснення винаходу частинки {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти мають форму I, яка має дифрактограму рентгенівського випромінювання на порошку, по суті як показано на фіг. 1, або термограму диференціальної скануючої калориметрії, по суті як показано на фіг. 2. В іншому варіанті здійснення винаходу частинки {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти мають форму II, яка має дифрактограму рентгенівського випромінювання на порошку, по суті як показано на фіг. 6. У ще одному варіанті здійснення винаходу частинки {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти є аморфними. Також надана фармацевтична композиція, яка містить частинки {4,6-біс(диметиламіно)-2-(4(4-(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в аморфній формі, кристалічній формі I або II або їх суміші і один або більше фармацевтично прийнятних носіїв або допоміжних речовин. Додатково наданий спосіб для лікування, профілактики або полегшення одного або більше симптомів розладу або захворювання, опосередкованих CRTH2, який включає введення частинок {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)-бензамідо)бензил)піримідин-5іл}оцтової кислоти в аморфній формі, кристалічній формі I або II або їх суміші. Крім того, наданий спосіб для одержання частинок {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в аморфній формі або кристалічній формі I або II. На фіг. 1 зображена дифрактограма рентгенівського випромінювання на порошку частинок {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)-бензил)піримідин-5-іл}оцтової кислоти в кристалічній формі I. На фіг. 2 зображена термограма диференціальної скануючої калориметрії (DSC) частинок кислоти формули I у формі I. На фіг. 3 зображена термогравіметрична (TG) термограма частинок кислоти формули I у формі I. 1 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фіг. 4 зображені фотографії скануючої електронної мікроскопії (SEM) частинок кислоти формули I у формі I при збільшенні 2500 (А), 5000 (В) і 10000 (С). На фіг. 5 зображений графік розподілу за розміром частинок кислоти формули I у формі I. На фіг. 6 зображена XRP дифрактограма частинок кислоти формули I у формі II. На фіг. 7 зображені SEM фотографії частинок кислоти формули I у формі II при збільшенні 370 (А), 2000 (В), 5500 (С) і 10000 (D). На фіг. 8 зображена XRP дифрактограма частинок кислоти формули I, одержаних за допомогою фази встановлення рівноваги між частинками у формі I і формі II. На фіг. 9 зображена XRP дифрактограма кислоти формули I в аморфній формі. На фіг. 10 зображена крива доза-відповідь для {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти формули I в аналізі конкурентного зв'язування радіоліганду з використанням клітин, трансфекованих CRTH2. На фіг. 11 зображена крива доза-відповідь для {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти формули I (▲), разом із селективним антагоністом DP1 BWA 868C ( ), в аналізі конкурентного зв'язування радіоліганду з використанням клітин, трансфекованих DP1. Для полегшення розуміння опису, представленого нижче, ряд термінів визначено нижче. Як використовується в даному описі, форми однини можуть стосуватися форм множини, якщо особливим чином не зазначено інакше. Звичайно номенклатура, використовувана в даному описі й лабораторних методиках в органічній хімії, медичній хімії й фармакології, описана в даному описі, є такою, добре відомою й звичайно використовуваною в галузі техніки. Якщо не зазначено інакше, всі технічні й наукові терміни, використовувані в даному описі, звичайно мають такі ж значення, які як правило розуміє звичайний фахівець в галузі техніки, до якої належить цей опис. У випадку, коли існує множина визначень для терміна, превалюють визначення, представлені в даному розділі, якщо не зазначено інакше. Термін "антирозчинник" стосується рідини, яку додають до розчинника для зменшення розчинності сполуки в такому розчиннику, приводячи до осадження сполуки. Термін "пацієнт" стосується тварини, включаючи, але не обмежуючись перерахованими, примата (наприклад, людини), корову, вівцю, козу, коня, собаку, кішку, кролика, щура або мишу. Звичайно терміни "суб'єкт" і "пацієнт" використовуються в даному описі взаємозамінно стосовно, наприклад, суб'єкта ссавця, особливо пацієнта людини. Терміни "лікувати", "лікування" і "процес лікування" призначені для включення полегшення або усунення розладу або захворювання або одного або більше симптомів, асоційованих з розладом або захворюванням; або полегшення або усунення причин(и) розладу або захворювання як такого. Терміни "запобігати", "запобігання" і "профілактика" стосуються способу уповільнення або запобігання розвитку захворювання й/або його супутніх симптомів, охороняючи пацієнта від розвитку захворювання, або зменшення ризику розвитку захворювання у пацієнта. Термін "терапевтично ефективна кількість" стосується кількості сполуки, якої при введенні достатньо для профілактики розвитку або до деякої міри полегшення одного або більше симптомів стану або розладу, що піддається лікуванню. Термін "терапевтично ефективна кількість" також стосується кількості сполуки, яка підсилює біологічну або медичну відповідь тканини, системи, тварини або людини, яку шукає дослідник, ветеринар, лікар або клініцист. Терміни "фармацевтично прийнятний носій", "фармацевтично прийнятна допоміжна речовина", "фізіологічно прийнятний носій" або "фізіологічно прийнятна допоміжна речовина" стосуються фармацевтично прийнятного матеріалу, композиції або носія, такого як рідкий або твердий наповнювач, розріджувач, розчинник або інкапсулюючий матеріал. Кожний компонент повинен бути "фармацевтично прийнятним" у розумінні сумісності з іншими інгредієнтами фармацевтичної композиції. Він також повинен бути придатним для використання в контакті із тканинами або органами людей і тварин без надмірної токсичності, подразнення, алергічної відповіді, імуногенності або інших проблем або ускладнень, відповідаючи прийнятному співвідношенню користь/ризик. Термін "природного походження" або "нативний" при використанні у зв'язку з біологічними матеріалами, такими як молекули нуклеїнової кислоти, поліпептиди, клітини-носії й подібні, стосується матеріалів, які виявляються в природі й не створені людиною. Подібним чином, термін "неприродного походження" або "ненативний" стосується матеріалу, який не виявляється в природі або який був структурно модифікований або синтезований людиною. Термін "CRTH2" стосується білка рецептора CRTH2 або його варіанта, який здатний опосередковувати клітинну відповідь на PGD2 in vitro або in vivo. Варіанти CRTH2 включають білки, по суті гомологічні нативному CRTH2, тобто білки, які мають одну або більше природних 2 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 або неприродних делецій, вставок або замін амінокислот (наприклад, похідні, гомологи й фрагменти CRTH2) у порівнянні з послідовністю амінокислот природного CRTH2. Послідовність амінокислот варіанта CRTH2 є на щонайменше близько 80% ідентичною, щонайменше близько 90% ідентичною або щонайменше близько 95% ідентичною нативному CRTH2. Термін "інший рецептор PGD2" стосується білка простаноїдного рецептора, відмінного від CRTH2, або його варіанта, який здатний опосередковувати клітинну відповідь на PGD2 in vivo або in vitro. "Інший рецептор PGD2" може бути селективним для PGD2, наприклад, DP або будьякого одного або більше інших простаноїдів. Варіанти "іншого рецептора PGD 2" включають білки, по суті гомологічні відповідним нативним простаноїдним рецепторам, відмінним від CRTH2, тобто білки, які мають одну або більше природних або неприродних делецій, вставок або замін амінокислот (наприклад, похідні, гомологи й фрагменти нативного простаноїдного рецептора, відмінного від CRTH2). Послідовність амінокислот нативного варіанта "іншого рецептора PGD2" є на щонайменше близько 80% ідентичною, щонайменше близько 90% ідентичною або щонайменше близько 95% ідентичною відповідному "іншому рецептору PGD 2". Термін "антагоніст CRTH2" стосується сполуки, яка, наприклад, частково або повністю, блокує, знижує, запобігає, інгібує або пригнічує активність CRTH2 і/або активність одного або більше інших рецепторів PGD2. Термін "антагоніст CRTH2" також стосується сполуки, яка зв'язується з, уповільнює активацію, інактивує або десенсибілізує CRTH2 або один або більше інших рецепторів PGD2. Антагоніст CRTH2 може діяти, втручаючись у взаємодію PGD 2 з CRTH2 або одним або більше іншими рецепторами PGD2. Терміни "розлад або захворювання, опосередковане CRTH2" і "стан, розлад або захворювання, опосередковане CRTH2" стосуються стану, розладу або захворювання, які характеризуються невідповідною, наприклад, меншою ніж або більшою ніж нормальна, активністю CRTH2. Невідповідна функціональна активність CRTH2 може виникати в результаті експресії CRTH2 у клітинах, які звичайно не експресують CRTH2, збільшеної експресії CRTH2 або ступеня внутрішньоклітинної активації, що приводить до, наприклад, запальних або імунопов'язаних розладів або захворювань; або зниженої експресії CRTH2. Стан, розлад або захворювання, опосередковані CRTH2, можуть бути повністю або частково опосередковані невідповідною активністю CRTH2. Зокрема, стан, розлад або захворювання, опосередковані CRTH2, є такими, при яких модуляція CRTH2 або одного або більше рецепторів PGD2 приводить в деякій мірі до фонового стану або розладу, наприклад, антагоніст або агоніст CRTH2 приводить до деякого поліпшення у щонайменше деяких пацієнтів, які піддаються лікуванню. Термін "насипна маса після ущільнення" стосується насипної щільності в тісно наповненому стані за допомогою відведення рідини, такого як скидання з контейнера, наповненого зразком, попередньо визначеної висоти повторно для одержання невеликого тиску на дно контейнера. Насипна маса після ущільнення може бути визначена з використанням, наприклад, Powder Tester PT-D (Hosokawa Micron Corporation, Osaka, Japan). Термін "коефіцієнт однорідності" стосується параметра, який показує ступінь однорідності розподілу частинок за розміром і його визначають як значення, одержане діленням розміру частинок 60 процентиля на розмір частинок 10 процентиля, які одержують із кривої розподілу частинок. Коли розподіл частинок за розміром стає більше однорідним, коефіцієнт однорідності наближається до 1. Частинки У даному описі надані частинки {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в аморфній формі або кристалічній формі I або II. Частинки кислоти формули I можуть бути охарактеризовані з використанням ряду способів, відомих фахівцеві в галузі техніки, включаючи монокристалічну рентгенівську дифракцію, дифракцію рентгенівського випромінювання на порошку (XRPD), мікроскопію (наприклад, скануючу електронну мікроскопію (SEM)), термічний аналіз (наприклад, диференціальну скануючу калориметрію (DSC), термічний гравіметричний аналіз (TGA) і мікроскопію з нагрівальним столиком) і спектроскопію (наприклад, інфрачервону, Рамана, ядерний магнітний резонанс твердої фази). Розмір частинок і розподіл за розміром можуть бути визначені звичайними методами, такими як методика розсіювання лазерного випромінювання. Чистота частинок кислоти формули I може бути визначена стандартними аналітичними методами, такими як тонкошарова хроматографія (ТШХ), гель-електрофорез, газова хроматографія, високоефективна рідинна хроматографія (ВЕРХ) і мас-спектрометрія (МС). В одному варіанті здійснення винаходу частинки {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти знаходяться у кристалічній формі I. В одному варіанті здійснення винаходу частинки форми I мають дифрактограму 3 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 рентгенівського випромінювання на порошку, по суті як показано на фіг. 1. В іншому варіанті здійснення винаходу частинки форми I мають характерні піки XRP дифракції при подвійному куті зближення приблизно 9,8, 13,1, 22,0 і 26,4°. У ще одному варіанті здійснення винаходу частинки форми I мають характерний пік XRP дифракції при подвійному куті зближення приблизно 9,8, 13,1, 22,0 і 26,4°. У ще одному варіанті здійснення винаходу частинки форми I мають характерний пік XRP дифракції при подвійному куті зближення приблизно 22,0°. У ще одному варіанті здійснення винаходу частинки форми I мають термограму диференціальної скануючої калориметрії, по суті як показано на фіг. 2. У ще одному варіанті здійснення винаходу частинки форми I мають DSC термограму з ендотермою при піковій температурі близько 224°С і температурі початку розкладання близько 220°С. У ще одному варіанті здійснення винаходу форма кристала частинок форми I є по суті голчастою (фіг. 4). У ще одному варіанті здійснення винаходу частинки форми I мають розчинність у воді близько 3 мкг/мл при кімнатній температурі. В одному варіанті здійснення винаходу частинки форми I можуть мати середній розмір частинок, який варіюється від близько 0,1 до близько 150 мкм, від близько 0,5 до близько 100 мкм, від близько 1 до близько 50 мкм, від близько 1 до близько 25 мкм, від близько 1 до близько 20 мкм, від близько 1 до близько 10 мкм, від близько 2 до близько 10 мкм або від близько 2 до близько 7,5 мкм В іншому варіанті здійснення винаходу частинки форми I можуть мати однорідний розподіл частинок за розміром, що оцінюють за коефіцієнтом однорідності, що варіюється від близько 1 до близько 20, від близько 1 до близько 10, від близько 2 до близько 5 або від близько 3 до близько 4. У ще одному варіанті здійснення винаходу тверді частинки форми I можуть мати насипну масу після ущільнення, яка варіюється від близько 0,1 до близько 1,0, від близько 0,15 до близько 0,8, від близько 0,2 до близько 0,6, від близько 0,25 до близько 0,5 або від близько 0,3 до близько 0,4 г/мл. Частинки з такими властивостями частинок можуть бути одержані безпосередньо способом одержання, описаним у даному описі. Альтернативно, частинки таких розмірів можуть також бути одержані з використанням будь-якого звичайного способу одержання частинок, такого як здрібнювання, мікронізація або гранулювання. Частинки форми I, представлені в даному описі, придатні для безпосереднього одержання кислоти формули I як терапевтичних продуктів, таким чином, спрощуючи процес виробництва й усуваючи ризики, асоційовані зі звичайними способами одержання частинок, такі як небажана конверсія речовини, яка кристалізується в різних формах. У певних варіантах здійснення винаходу частинки кислоти формули I у формі I можуть містити не менше близько 95%, не менше близько 97%, не менше близько 98%, не менше близько 99% або не менше близько 99,5% по масі кислоти формули I. Частинки також можуть містити не менше близько 90%, не менше близько 95%, не менше близько 98%, не менше близько 99% або не менше близько 99,5% по масі твердих частинок у формі I. У певних варіантах здійснення винаходу частинки кислоти формули I у формі I можуть мати залишковий вміст органічного розчинника не більше близько 5%, не більше близько 2%, не більше близько 1%, не більше близько 0,9%, не більше близько 0,8%, не більше близько 0,7%, не більше близько 0,6%, не більше близько 0,5, не більше близько 0,4%, не більше близько 0,3%, не більше близько 0,2%, не більше близько 0,1%, не більше близько 0,05% або не більше близько 0,01% по масі. У певних варіантах здійснення винаходу частинки кислоти формули I у формі I можуть мати залишковий вміст метанолу не більше близько 100000 ч/млн., не більше близько 10000 ч/млн., не більше близько 5000 ч/млн., не більше близько 4000 ч/млн., не більше близько 3000 ч/млн., не більше близько 2000 ч/млн., не більше близько 1000 ч/млн., не більше близько 500 ч/млн. або не більше близько 100 ч/млн. В іншому варіанті здійснення винаходу частинки {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти знаходяться у кристалічній формі II. Частинки форми II мають дифрактограму рентгенівського випромінювання на порошку, по суті як показано на фіг. 6. Частинки форми I мають характерний пік XRP дифракції при подвійному куті зближення приблизно 31,7°. В одному варіанті здійснення винаходу частинки форми II можуть мати середній розмір частинок, який варіюється від близько 0,1 до близько 150 мкм, від близько 0,5 до близько 100 мкм, від близько 1 до близько 50 мкм, від близько 1 до близько 25 мкм, від близько 1 до близько 20 мкм, від близько 1 до близько 10 мкм, від близько 1 до близько 5 мкм або від близько 2 до близько 5 мкм В іншому варіанті здійснення винаходу частинки форми II можуть мати однорідний розподіл частинок за розміром, що оцінюють за коефіцієнтом однорідності, який варіюється від близько 1 до близько 20, від близько 1 до близько 10, від близько 2 до близько 5 4 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 або від близько 3 до близько 4. У ще одному варіанті здійснення винаходу частинки форми II можуть мати насипну масу при ущільненні, яка варіюється від близько 0,1 до близько 1,0, від близько 0,15 до близько 0,8, від близько 0,2 до близько 0,6, від близько 0,25 до близько 0,5 або від близько 0,3 до близько 0,4 г/мл. Частинки із зазначеними властивостями частинок можуть бути одержані безпосередньо способом одержання, описаним у даному описі. Альтернативно, частинки таких розмірів також можуть бути одержані з використанням будь-яких звичайних способів, таких як здрібнювання, мікронізація або гранулювання. У певних варіантах здійснення винаходу частинки кислоти формули I у формі II можуть містити не менше близько 95%, не менше близько 97%, не менше близько 98%, не менше близько 99% або не менше близько 99,5% по масі кислоти формули I. Частинки також можуть містити не менше близько 90%, не менше близько 95%, не менше близько 98%, не менше близько 99% або не менше близько 99,5% по масі частинок у формі II. У певних варіантах здійснення винаходу частинки кислоти формули I у формі II можуть мати залишковий вміст органічного розчинника не більше близько 5%, не більше близько 2%, не більше близько 1%, не більше близько 0,9%, не більше близько 0,8%, не більше близько 0,7%, не більше близько 0,6%, не більше близько 0,5%, не більше близько 0,4%, не більше близько 0,3%, не більше близько 0,2%, не більше близько 0,1%, не більше близько 0,05% або не більше близько 0,01% по масі. У ще одному варіанті здійснення винаходу частинки {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти є аморфними. Аморфні частинки мають дифрактограму рентгенівського випромінювання на порошку, по суті як показано на фіг. 9, яка не має характерних піків XRP дифракції для частинок форми I і/або форми II. В одному варіанті здійснення винаходу аморфні частинки можуть містити не менше близько 95%, не менше близько 97%, не менше близько 98%, не менше близько 99% або не менше близько 99,5% по масі кислоти формули I. В іншому варіанті здійснення винаходу частинки можуть також містити не менше близько 90%, не менше близько 95%, не менше близько 98%, не менше близько 99% або не менше близько 99,5% по масі аморфних твердих частинок. У певних варіантах здійснення винаходу аморфні частинки кислоти формули I можуть мати залишковий вміст органічного розчинника не більше близько 5%, не більше близько 2%, не більше близько 1%, не більше близько 0,9%, не більше близько 0,8%, не більше близько 0,7%, не більше близько 0,6%, не більше близько 0,5%, не більше близько 0,4 %, не більше близько 0,3%, не більше близько 0,2%, не більше близько 0,1%, не більше близько 0,05% або не більше близько 0,01% по масі. Необхідно розуміти, що числові значення піків дифрактограм рентгенівського випромінювання на порошку можуть трохи варіюватися від одного приладу до іншого або від одного зразка до іншого, і тому зазначені значення повинні розглядатися не як абсолютні, а з доступною варіабельністю, такою як 0,1°, яка рекомендована у Фармакопеї Сполучених Штатів (сторінки: 387-389, 2007). Спосіб одержання Також надані способи для одержання частинок кислоти формули I в аморфній формі або кристалічній формі I або II. Способи включають стадію контактування кислоти формули I з розчинником, у якому частинки кислоти формули I в аморфній формі або кристалічній формі I або II можуть бути утворені з розчину або перетворені з однієї твердої форми в іншу. Спосіб може додатково включати стадію виділення, на якій частинки можуть бути виділені звичайним способом, таким як фільтрація й центрифугування, з наступним промиванням розчинником і потім сушінням (наприклад, сушіння у вакуумній печі, сушіння на повітрі або сушіння десикантом). Придатні розчинники для використання в одержанні твердих частинок в аморфній формі або кристалічній формі I або II включають, але не обмежуються перерахованими, вуглеводні, включаючи петролейний ефір, пентан, гексан(и), гептан, октан, ізооктан, циклопентан, циклогексан, метилциклогексан, бензол, толуол, ксилол, тетралін і кумен; хлоровані вуглеводні, включаючи дихлорметан (ДХМ), 1,2-дихлоретан, 1,1-дихлоретен, 1,2-дихлоретен, хлороформ, трихлоретан, трихлоретен, тетрахлорид вуглецю, хлорбензол і трифторметилбензол; спирти, включаючи метанол, етанол, ізопропанол (IPA), 1-пропанол, 1-бутанол, 2-бутанол, третбутанол, 3-метил-1-бутанол, 1-пентанол, 2-метоксіетанол, 2-етоксіетанол і етиленгліколь; прості ефіри, включаючи діетиловий ефір, діізопропіловий ефір, метил-трет-бутиловий ефір (MTBE), дифеніловий ефір, 1, 2-диметоксіетан, бі(2-метоксіетиловий)ефір, 1,1-диметоксиметан, 2,2диметоксипропан і анізол; кетони, включаючи ацетон, бутанон, метилетилкетон (MEK), 5 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 метилізопропілкетон, метилбутилкетон і метилізобутилкетон (MIBK); складні ефіри, включаючи метилацетат, етилформіат, етилацетат, пропілацетат, ізопропілацетат, ізобутилацетат і бутилацетат; карбонати, включаючи етиленкарбонат і пропіленкарбонат; аміди, включаючи формамід, N,N-диметилформамід (ДМФА) і N,N-диметилацетамід; нітрили, включаючи ацетонітрил (ACN); сульфоксиди, такі як диметилсульфоксид (ДМСО); сульфони, такі як сульфолан; нітросполуки, такі як нітрометан і нітробензол; гетероцикли, такі як Nметилпіролідон, 2-метилтетрагідрофуран, тетрагідрофуран (ТГФ), діоксан і піридин; карбонові кислоти, такі як оцтова кислота, трихлороцтова кислота й трифтороцтова кислота; фосфораміди, такі як гексаметилфосфорамід; сульфід вуглецю; вода; і їх суміші. Тверді частинки кислоти формули I у кристалічній формі I можуть бути одержані з розчину або густої суспензії кислоти формули I у розчиннику з використанням звичайних методів, включаючи, але не обмежуючись перерахованими, охолодження, заморожування, випарювання розчинника або додавання антирозчинника. В одному варіанті здійснення винаходу спосіб для одержання частинок форми I включає стадії (а) одержання розчину кислоти формули I у розчиннику при першій температурі; і (b) створення частинок форми I при другій температурі. Для прискорення утворення частинок форми I спосіб також може включати стадію висівання шляхом затравлювання розчину кристалами форми I перед або під час стадії (b). Спосіб може додатково включати стадію виділення, як описано в даному описі. Розчин може бути одержаний з будь-яких форм кислоти формули I, включаючи, але не обмежуючись перерахованими, масла, напівтверді речовини, тверді речовини (такі як аморфна форма або форма I або II) або їх суміші. Розчин за стадією (а) може бути одержаний як насичений або майже насичений розчин при першій температурі. Насичений або майже насичений розчин може бути одержаний розчиненням достатньої кількості кислоти формули I у розчиннику при температурі, яка вище, ніж перша температура, так, що, коли розчину дозволяють охолонути до першої температури, одержують насичений або майже насичений розчин. Достатня кількість кислоти формули I може бути оцінена на основі розчинності частинок форми I у розчиннику при першій температурі, яка може бути визначена з використанням способу, відомого фахівцеві в галузі техніки. Перша температура може варіюватися від кімнатної до температури близько температури кипіння розчинника, наприклад, від близько 20 до близько 200°С, від близько 20 до близько 150°С або від близько 20 до близько 100°С. Друга температура може варіюватися від -100 до 100°С, від близько -50 до близько 50°С, від близько -10 до близько 30°С, від близько 20 до близько 200°С, від близько 20 до близько 150°С або від близько 20 до близько 100°С. Перша температура може бути вище або нижче, або такою ж, як друга температура. Для максимального збільшення виходу й ефективності способу другу температуру звичайно встановлюють нижче, ніж перша температура. В одному варіанті здійснення винаходу частинки форми I утворюються шляхом випарювання розчинника з розчину при другій температурі. Випарювання розчинника може бути полегшене застосуванням до розчину тепла й/або вакууму. В одному варіанті здійснення винаходу розчинником є ацетонітрил, дихлорметан, ДМФА, 1,4-діоксан, метанол, 2метоксіетанол, MIBK, ацетон, 1-бутанол, MTBE, ДМСО, етанол, етилацетат, ізобутилацетат, ізопропілацетат, 1-пропанол, IPA, MEK, ТГФ або їх суміш. В іншому варіанті здійснення винаходу частинки форми I утворюються шляхом охолодження розчину до другої температури. У такому випадку другу температуру встановлюють нижче, ніж перша температура. В одному варіанті здійснення винаходу розчинником є ДМФА, 1,4-діоксан, метанол, 2-метоксіетанол, 1-бутанол, 1-пропанол, IPA, MEK, ТГФ або їх суміш. У ще одному варіанті здійснення винаходу частинки форми I утворюються шляхом додавання антирозчинника до розчинника при другій температурі. Придатні антирозчинники включають, але не обмежуються перерахованими, вуглеводні, включаючи петролейний ефір, пентан, гексан(и), гептан, октан, ізооктан, циклопентан, циклогексан, метилциклогексан, бензол, толуол, ксилол, тетралін і кумен; хлоровані вуглеводні, включаючи дихлорметан (ДХМ), 1,2-дихлоретан, 1,1-дихлоретен, 1,2-дихлоретен, хлороформ, трихлоретан, трихлоретен, тетрахлорид вуглецю, хлорбензол і трифторметилбензол; спирти, включаючи ізопропанол (IPA), 1-пропанол, 1-бутанол, 2-бутанол, трет-бутанол, 3-метил-1бутанол, 1-пентанол, 2-етоксіетанол і етиленгліколь; прості ефіри, включаючи діетиловий ефір, діізопропіловий ефір, метил-трет-бутиловий ефір (MTBE), дифеніловий ефір, 1,2-диметоксіетан, бі(2-метоксіетил)ефір, 1,1-диметоксиметан, 2,2-диметоксипропан і анізол; кетони, включаючи бутанон, метилізопропілкетон, метилбутилкетон і метилізобутилкетон (MIBK); складні ефіри, включаючи метилацетат, етилформіат, етилацетат, пропілацетат, ізопропілацетат, 6 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 ізобутилацетат і бутилацетат; карбонати, включаючи етиленкарбонат і пропіленкарбонат; нітросполуки, включаючи нітрометан і нітробензол; гетероцикли; сульфід вуглецю; вода і їх суміші. Коли як пару розчинник/антирозчинник використовують два розчинники, кислота формули I має більш високу розчинність у розчиннику, ніж в антирозчиннику. Необов'язково, розчинник і антирозчинник у парі розчинник/антирозчинник є щонайменше частково змішуваними. В одному варіанті здійснення винаходу розчинником є ТГФ, метоксіетанол, ДМСО, ДМФА або їх суміш; і антирозчинником є гексан(и), MTBE, толуол, вода або їх суміш. В іншому варіанті здійснення винаходу парою розчинника/антирозчинника є ТГФ/гексан, ТГФ/вода, ДМФА/MTBE або ДМФА/вода. У ще одному варіанті здійснення винаходу частинки форми I одержують шляхом додавання розчинника до антирозчинника при другій температурі. В одному варіанті здійснення винаходу розчинником є ТГФ, метоксіетанол, ДМСО, ДМФА або їх суміш; і антирозчинником є гексан(и), MTBE, толуол, ізопропілацетат, вода або їх суміш. В іншому варіанті здійснення винаходу парою розчинник/антирозчинник є ТГФ/гексан, ТГФ/вода, 2-метоксіетанол/гексан, ДМСО/вода або ДМФА/вода. В іншому варіанті здійснення винаходу спосіб для одержання частинок форми I включає стадії (а) одержання густої суспензії кислоти формули I у розчиннику при першій температурі; і (b) одержання частинок форми I шляхом впливу на густу суспензію другої температури. Густа суспензія може бути одержана з будь-яких форм кислоти формули I, включаючи, але не обмежуючись перерахованими, масла, напівтверді речовини, тверді речовини (такі як аморфна форма або форма I або II) або їх суміші. Спосіб може додатково включати стадію висівання й/або стадію виділення, як описано в даному описі. Перша й друга температури й розчинник є такими, як визначено в даному описі. В одному варіанті здійснення винаходу розчинником є ацетонітрил, хлороформ, дихлорметан, ДМФА, 1,4діоксан, метанол, 2-метоксіетанол, MIBK, толуол, гексан(и), ацетон, 1-бутанол, MTBE, ДМСО, етанол, етилацетат, етилформіат, гептан, ізобутилацетат, ізопропілацетат, 1-пропанол, IPA, MEK, ТГФ або їх суміш. У ще одному варіанті здійснення винаходу спосіб для одержання частинок форми I включає стадії (а) одержання розчину кислоти формули I у розчиннику при першій температурі; (b) утворення густої суспензії шляхом охолодження розчину до другої температури; і (с) створення твердих частинок форми I шляхом впливу на густу суспензію одного або більше циклів нагрівання й охолодження. Спосіб може додатково включати стадію висівання й/або стадію виділення, як описано в даному описі. Перша й друга температури й розчинник є такими, як визначено в даному описі. В одному варіанті здійснення винаходу розчинником є ацетонітрил, 1,4-діоксан, 2-метоксіетанол, MIBK, ацетон, 1-бутанол, етанол, 1-пропанол, IPA, MEK, ТГФ, вода/ТГФ (3:7, об./об.) або їх суміш. Цикли нагрівання й охолодженні можуть проводитися в діапазоні температур від близько -50 до близько 120°С, від близько -50 до близько 100°С, від близько -20 до близько 80°С, від близько 0 до близько 80°С, від близько 10 до близько 80°С, від близько 20 до близько 80°С, від близько 20 до близько 60°С або від близько 20 до близько 50°С. Частинки кислоти формули I у кристалічній формі II можуть бути одержані з розчину або густої суспензії кислоти формули I у розчиннику з використанням звичайних методів, включаючи, але не обмежуючись перерахованими, охолодження, заморожування, випарювання розчинника або додавання антирозчинника. В одному варіанті здійснення винаходу спосіб для одержання частинок форми II включає стадії (а) одержання розчину кислоти формули I у розчиннику при першій температурі; і (b) одержання частинок форми II при другій температурі. Для прискорення утворення частинок форми II спосіб також може включати стадію висівання шляхом затравлювання розчину кристалами форми II перед або під час стадії (b). Спосіб може додатково включати стадію виділення, як описано в даному описі. Розчин може бути одержаний з будь-яких форм кислоти формули I, включаючи, але не обмежуючись перерахованими, масла, напівтверді речовини, тверді речовини (такі як аморфна форма або форма I або II) або їх суміші. Розчин за стадією (а) може бути одержаний як насичений або майже насичений розчин при першій температурі. Насичений або майже насичений розчин може бути одержаний шляхом розчинення достатньої кількості кислоти формули I у розчиннику при температурі, яка вище, ніж перша температура, так, що, коли розчину дозволяють охолонути до першої температури, одержують насичений або майже насичений розчин. Достатня кількість кислоти формули I може бути оцінена на основі 7 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчинності частинок форми II у розчиннику при першій температурі, яка може бути визначена з використанням методу, відомого фахівцеві в галузі техніки. В одному варіанті здійснення винаходу частинки форми II утворюються шляхом випарювання розчинника з розчину при другій температурі. Випарювання розчинника може бути полегшено застосуванням до розчину нагрівання й/або вакууму. В одному варіанті здійснення винаходу розчинником є ДМФА, 1,4-діоксан, метанол, 2-метоксіетанол, 1-бутанол, 1-пропанол, IPA, MEK, ТГФ або їх суміш. В іншому варіанті здійснення винаходу частинки форми II утворюються шляхом охолодження розчину до другої температури. У ще одному варіанті здійснення винаходу частинки форми II утворюються шляхом додавання антирозчинника до розчинника при другій температурі. В одному варіанті здійснення винаходу розчинником є ТГФ, метоксіетанол, ДМСО, ДМФА або їх суміш; і антирозчинником є гексан(и), MTBE, толуол, вода або їх суміш. У ще одному варіанті здійснення винаходу частинки форми II утворюються шляхом додавання розчину до антирозчинника при другій температурі. В одному варіанті здійснення винаходу розчинником є ТГФ, метоксіетанол, ДМСО, ДМФА і їх суміші; і антирозчинником є гексан(и), MTBE, толуол, вода і їх суміші. В іншому варіанті здійснення винаходу парою розчинник/антирозчинник є ДМФА/MTBE. В іншому варіанті здійснення винаходу спосіб для одержання частинок форми II включає стадії (а) одержання густої суспензії кислоти формули I у розчиннику при першій температурі; і (b) створення твердих частинок форми II шляхом впливу на суспензію другої температури. Густа суспензія може бути одержана з будь-яких форм кислоти формули I, включаючи, але не обмежуючись перерахованими, масла, напівтверді речовини, тверді речовини (такі як аморфна форма або форма I або II) або їх суміші. Спосіб може додатково включати стадію висівання й/або стадію виділення, як описано в даному описі. Перша й друга температури й розчинник є такими, як описано в даному описі. В одному варіанті здійснення винаходу розчинником є ацетонітрил, хлороформ, дихлорметан, ДМФА, 1,4діоксан, метанол, 2-метоксіетанол, MIBK, толуол, гексан(и), ацетон, 1-бутанол, MTBE, ДМСО, етанол, етилацетат, етилформіат, гептан, ізобутилацетат, ізопропілацетат, 1-пропанол, IPA, MEK, ТГФ, вода або їх суміш. Аморфні частинки кислоти формули I можуть бути одержані з розчину або густої суспензії кислоти формули I у розчиннику з використанням звичайних методів, включаючи, але не обмежуючись перерахованими, охолодження, заморожування, випарювання розчинника або додавання антирозчинника. В одному варіанті здійснення винаходу спосіб для одержання аморфних частинок кислоти формули I включає стадії (а) одержання розчину кислоти формули I у розчиннику при першій температурі; і (b) створення аморфних частинок при другій температурі. Спосіб може також включати стадію виділення, як описано в даному описі. Розчин може бути одержаний з будь-яких форм кислоти формули I, включаючи, але не обмежуючись перерахованими, масла, напівтверді речовини, тверді речовини (такі як аморфна форма або форма I або II) або їх суміші. Розчин за стадією (а) може бути одержаний у вигляді насиченого або майже насиченого розчину при першій температурі. Насичений або майже насичений розчин може бути одержаний шляхом розчинення достатньої кількості кислоти формули I у розчиннику при температурі, яка вище, ніж перша температура, так, що, коли розчину дозволяють охолонути до першої температури, одержують насичений або майже насичений розчин. Достатня кількість кислоти формули I може бути оцінена на основі розчинності аморфних частинок у розчиннику при першій температурі, яка може бути визначена з використанням методу, відомого фахівцеві в галузі техніки. В одному варіанті здійснення винаходу аморфні частинки утворюються при випарюванні розчинника з розчину при другій температурі. Випарювання розчинника може бути полегшене шляхом застосування до розчину нагрівання й/або вакууму. В одному варіанті здійснення винаходу розчинником є етилформіат, ізобутилацетат, MTBE або їх суміш. В іншому варіанті здійснення винаходу аморфні частинки утворюються шляхом охолодження розчину до другої температури. В одному варіанті здійснення винаходу розчинником є MEK. У ще одному варіанті здійснення винаходу аморфні частинки утворюються шляхом додавання антирозчинника до розчину при другій температурі. В одному варіанті здійснення винаходу розчинником є ТГФ, метоксіетанол, ДМСО, ДМФА або їх суміш; і антирозчинником є гексан(и), MTBE, толуол, вода або їх суміш. В іншому варіанті здійснення винаходу парою розчинник/антирозчинник є ТГФ/гексан або ДМСО/вода. 8 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 У ще одному варіанті здійснення винаходу аморфні частинки утворюються шляхом додавання розчину до антирозчинника при другій температурі. В одному варіанті здійснення винаходу розчинником є ТГФ, метоксіетанол, ДМСО, ДМФА або їх суміш; і антирозчинником є гексан(и), MTBE, толуол, вода або їх суміш. В іншому варіанті здійснення винаходу парою розчинник/антирозчинник є ТГФ/гексан або ДМСО/вода. У ще одному варіанті здійснення винаходу спосіб для одержання аморфних частинок кислоти формули I включає стадії (а) одержання густої суспензії кислоти формули I у розчиннику при першій температурі; і (b) створення аморфних частинок за допомогою конверсії фаз при другій температурі. Густа суспензія може бути одержана з будь-яких форм кислоти формули I, включаючи, але не обмежуючись перерахованими, масла, напівтверді речовини, тверді речовини (такі як аморфна форма або форма I або II) або їх суміші. Перша й друга температури й розчинник є такими, як визначено в даному описі. В одному варіанті здійснення винаходу розчинником є хлороформ, гексан(и), MTBE, етилформіат, гептан, IPA, вода або їх суміш. Інші способи одержання частинок також можуть застосовуватися для одержання частинок кислоти формули I в аморфній формі або кристалічній формі I або II, включаючи розпилювальне сушіння, вальцьове сушіння, ліофілізацію й кристалізацію з розплаву. Фармацевтичні композиції Також надана фармацевтична композиція, яка включає як активний фармацевтичний інгредієнт частинки {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)піримідин5-іл}оцтової кислоти в аморфній формі або кристалічній формі I або II або її прийнятний гідрат або сольват у комбінації з одним або більше фармацевтично прийнятними носіями або допоміжними речовинами. Вибір допоміжної речовини, більшою мірою, залежить від факторів, таких як визначений шлях введення, ефект допоміжної речовини на розчинність і стабільність активного інгредієнта й природа лікарської форми. Фармацевтичні композиції, представлені в даному описі, можуть бути забезпечені в лікарських формах, які містять разову дозу, або лікарських формах, які містять кілька доз. Лікарські форми, які містять разову дозу, як використовується в даному описі, стосуються фізично окремих одиниць, придатних для введення пацієнтам людям і тваринам і упакованих окремо, як відомо в галузі техніки. Кожна разова доза містить попередньо визначену кількість активного інгредієнта(ів), достатню для забезпечення бажаного терапевтичного ефекту, у сполученні з необхідними фармацевтичними носіями або допоміжними речовинами. Приклади лікарських форм, які містять разові дози, включають ампули, шприци й окремо упаковані таблетки й капсули. Лікарські форми, які містять разову дозу, можуть вводитися окремо або разом. Лікарські форми, які містять кілька доз, являють собою множину однакових лікарських форм, які містять разову дозу, упакованих в окремий контейнер для ведення в окремих лікарських формах, які містять разову дозу. Приклади лікарських форм, які містять кілька доз, включають флакони, бутилі таблеток або капсул або бутилі пінт або галонів. Частинки кислоти формули I, представлені в даному описі, можуть бути введені окремо або в комбінації з однією або більше сполуками, представленими в даному описі, одним або більше іншими активними інгредієнтами. Фармацевтичні композиції, представлені в даному описі, можуть бути рецептовані в різних лікарських формах для перорального, парентерального й місцевого введення. Фармацевтичні композиції також можуть бути рецептовані у вигляді лікарської форми з модифікованим вивільненням, включаючи лікарські форми з відстроченим, тривалим, пролонгованим, безперервним, пульсовим, контрольованим, прискореним і швидким, націленим, програмованим вивільненням, і лікарських форм, утримуваних у шлунку. Такі лікарські форми можуть бути одержані відповідно до звичайних методів і методик, відомих фахівцеві в галузі техніки (див. Remington: The Science and Practice of Pharmacy, вище; ModifiedRelease Drug Deliver Technology, Rathbone et al., Eds., Drugs and the Pharmaceutical Science, Marcel Dekker, Inc.: New York, NY, 2002; Vol. 126). Фармацевтичні композиції, представлені в даному описі, можуть вводитися один раз або кілька разів з інтервалами часу. Розуміють, що точне дозування й тривалість лікування можуть варіюватися залежно від віку, маси тіла й стану пацієнта, що піддається лікуванню, і можуть бути визначені емпірично з використанням відомих протоколів дослідження або шляхом екстраполяції досліджень in vivo або in vitro або діагностичних даних. Також розуміють, що для будь-якого певного пацієнта специфічні схеми введення повинні із часом коригуватися відповідно до потреб індивіда й професійної думки особи, яка вводить або спостерігає за введенням композицій. А. Пероральне введення 9 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтичні композиції, представлені в даному описі, можуть бути представлені у твердих, напівтвердих або рідких лікарських формах для перорального введення. Як використовується в даному описі, пероральне введення також включає букальне, лінгвальне й сублінгвальне введення. Придатні пероральні лікарські форми включають, але не обмежуються перерахованими, таблетки, капсули, пігулки, коржі, пастилки, фарм. пастилки, крохмальні капсули, кульки, лікувальну жувальну гумку, гранули, нерозфасований порошок, шипучі або нешипучі порошки або гранули, розчини, емульсії, суспензії, брикети, спреї, еліксири й сиропи. На доповнення до активного інгредієнта(ів) фармацевтичні композиції можуть містити один або більше фармацевтично прийнятних носіїв або допоміжних речовин, включаючи, але не обмежуючись перерахованими, в'язкі речовини, наповнювачі, розріджувачі, дезінтегруючі речовини, зволожувальні речовини, мастильні засоби, гліданти, барвники, інгібітори міграції барвника, підсолоджувачі й ароматизатори. В'язкі речовини або гранулятори надають таблетці зчіплюваність для забезпечення того, щоб таблетка залишалася інтактною після пресування. Придатні в'язкі речовини або гранулятори включають, але не обмежуються перерахованими, крохмаль, картопляний крохмаль і пептизований крохмаль (наприклад, STARCH 1500); желатин; цукри, такі як сахароза, глюкоза, декстроза, патока й лактоза; натуральні й синтетичні камеді, такі як акація, альгінова кислота, альгінати, екстракт ірландського моху, панварова камедь, гхатті-камедь, слиз плівки isabgol, карбоксиметилцелюлоза, метилцелюлоза, полівінілпіролідон (PVP), вігум, арабогалактан модрини, порошкоподібний трагакант і гуарова камедь; целюлози, такі як етилцелюлоза, ацетат целюлози, карбоксиметилцелюлоза кальцію, карбоксиметилцелюлоза натрію, метилцелюлоза, гідроксіетилцелюлоза (HEC), гідроксипропілцелюлоза (HPC), гідроксипропілметилцелюлоза (HPMC); мікрокристалічні целюлози, такі як AVICEL-PH-101, AVICEL-PH-103, AVICEL-RC-581, AVICEL-PH-105 (FMC Corp., Marcus Hook, PA); і їх суміші. Придатні наповнювачі включають, але не обмежуються перерахованими, тальк, карбонат кальцію, мікрокристалічну целюлозу, порошкоподібну целюлозу, декстрани, каолін, маніт, кремнієву кислоту, сорбіт, крохмаль, пептизований крохмаль і їх суміші. В'язка речовина або наповнювач можуть бути присутніми у фармацевтичній композиції, представленій в даному описі, у кількості від близько 50 до близько 99% по масі. Придатні розріджувачі включають, але не обмежуються перерахованими, фосфат дикальцію, сульфат кальцію, лактозу, сорбіт, сахарозу, інозитол, целюлозу, каолін, маніт, хлорид натрію, сухий крохмаль і порошкоподібний цукор. Певні розріджувачі, такі як маніт, лактоза, сорбіт, сахароза й інозитол, коли присутні в достатній кількості, можуть надавати властивості деяким пресованим таблеткам, які сприяють розкладанню в порожнині рота при жуванні. Такі пресовані таблетки можуть використовуватися як жувальні таблетки. Придатні дезінтегруючі речовини включають, але не обмежуються перерахованими, агар; бентоніт; целюлози, такі як метилцелюлоза й карбоксиметилцелюлоза; деревні вироби; натуральну губку; катіонообмінні смоли; альгінову кислоту; камеді, такі як гуарова камедь і вігум HV; цитрусові вижимки; зшиті целюлози, такі як кроскармелоза; зшиті полімери, такі як кросповідон; зшиті крохмалі; карбонат кальцію; мікрокристалічну целюлозу, таку як гліколят крохмалю натрію; полакрилін калію; крохмалі, такі як кукурудзяний крохмаль, картопляний крохмаль, крохмаль тапіоки й пептизований крохмаль; глини; альгіни і їх суміші. Кількість дезинтегруючої речовини у фармацевтичній композиції, представленій в даному описі, варіюється від типу композиції й легко очевидна звичайному фахівцеві в галузі техніки. Фармацевтичні композиції, представлені в даному описі, можуть містити від близько 0,5 до близько 15% або від близько 1 до близько 5% по масі дезинтегруючої речовини. Придатні мастильні речовини включають, але не обмежуються перерахованими, стеарат кальцію; стеарат магнію; мінеральне масло; легке мінеральне масло; гліцерин; сорбіт; маніт; гліколі, такі як бегенат гліцерину й поліетиленгліколь (PEG); стеаринову кислоту; лаурилсульфат натрію; тальк; гідрогенізовані рослинні олії, включаючи арахісову олію, бавовняну олію, соняшникову олію, кунжутну олію, маслинову олію, кукурудзяну олію й соєву олію; стеарат цинку; етилолеат; етиллаурат; агар; крохмаль; лікоподій; діоксид кремнію або силікагелі, такі як AEROSIL® 200 (W.R. Grace Co., Baltimor, MD) і CAB-O-SIL® (Cabot Co. Of Boston, MA); і їх суміші. Фармацевтичні композиції, представлені в даному описі, можуть містити від близько 0,1 до близько 5% по масі мастильної речовини. Придатні гліданти включають колоїдний діоксид кремнію, CAB-O-SIL® (Cabot Co. Of Boston, MA) і тальк без азбесту. Барвники включають будь-які схвалені сертифіковані водорозчинні барвники FD&C і водонерозчинні барвники FD&C, суспендовані на гідраті алюмінію й барвні лаки і їх суміші. Барвний лак являє собою комбінацію абсорбції водорозчинної фарби на водному оксиді важкого металу, даючи нерозчинну форму фарби. Ароматизатори включають 10 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 природні ароматизатори, екстраговані з рослин, таких як фрукти, і синтетичні суміші сполук, які дають відчуття приємного смаку, такі як м'ята перцева й метилсаліцилат. Підсолоджувачі включають сахарозу, лактозу, маніт, сиропи, гліцерин і штучні підсолоджувачі, такі як сахарин і аспартам. Придатні емульгатори включають желатин, акацію, трагакант, бентоніт і поверхневоактивні речовини, такі як моноолеат поліоксіетиленсорбіту (TWEEN®-20), моноолеат 80 поліоксіетиленсорбіту (TWEEN®-80) і олеат триетаноламіну. Суспендувальні й диспергувальні агенти включають карбоксиметилцелюлозу натрію, пектин, трагакант, вігум, акацію, карбоксиметилцелюлозу натрію, гідроксипропілметилцелюлозу й полівінілпіролідон. Консерванти включають гліцерин, метил і пропілпарабен, бензойну кислоту, бензоат натрію й спирт. Зволожувальні речовини включають моностеарат пропіленгліколю, моноолеат сорбіту, монолаурат діетилгліколю й лауриловий ефір поліоксіетилену. Розчинники включають гліцерин, сорбіт, етиловий спирт і сироп. Приклади неводних рідин, використовуваних в емульсіях, включають мінеральне масло й бавовняну олію. Органічні кислоти включають лимонну й виннокам’яну кислоту. Джерела діоксиду вуглецю включають бікарбонат натрію й карбонат натрію. Необхідно розуміти, що множина носіїв і допоміжних речовин може мати декілька функцій, навіть в одній і тій же композиції. Фармацевтичні композиції, представлені в даному описі, можуть бути надані у вигляді пресованих таблеток, порошків таблеток, жувальних пастилок, таблеток, що швидко розчиняються, багаторазово пресованих таблеток або таблеток, покритих кишковорозчинною оболонкою, таблеток, покритих оболонкою із цукру або плівки. Таблетки, покриті кишковорозчинною оболонкою, являють собою пресовані таблетки, покриті оболонкою з речовин, які стійкі до дії шлункової кислоти, але розчиняються або розкладаються в кишечнику, у такий спосіб захищаючи активні інгредієнти від кислого оточення шлунка. Кишковорозчинні оболонки включають, але не обмежуються перерахованими, жирні кислоти, жири, фенілсаліцилат, воски, шелак, амонійований шелак і ацетатфталат целюлози. Таблетки, покриті оболонкою із цукру, являють собою пресовані таблетки, оточені цукровою оболонкою,яка може бути корисною в приховуванні неприйнятного смаку або запаху й у захисті таблеток від окислювання. Таблетки, покриті плівкою, являють собою пресовані таблетки, які покриті тонким шаром або плівкою водорозчинного матеріалу. Плівкові оболонки включають, але не обмежуються перерахованими, гідроксіетилцелюлозу, карбоксиметилцелюлозу натрію, поліетиленгліколь 4000 і ацетатфталат целюлози. Плівкові оболонки дають такі ж загальні характеристики, як і цукрові оболонки. Багаторазово пресовані таблетки являють собою пресовані таблетки, одержані за допомогою більше ніж одного циклу пресування, включаючи шаруваті таблетки й таблетки, покриті відбитками або покриті оболонкою сухим способом. Лікарські форми таблеток можуть бути одержані з активного інгредієнта в порошкоподібній, кристалічній або гранулярній формах, окремо або в комбінації з одним або більше носіями або допоміжними речовинами, описаними у даному описі, включаючи в'язкі речовини, дезінтегруючі речовини, полімери з контрольованим вивільненням, мастильні речовини, розріджувачі й/або барвники. Ароматизуючі й підсолоджувальні речовини є особливо застосовними у формуванні жувальних таблеток і пастилок. Фармацевтичні композиції, представлені в даному описі, можуть бути представлені у вигляді м'яких або твердих капсул, які можуть бути вироблені з желатину, метилцелюлози, крохмалю або альгінату кальцію. Тверда желатинова капсула, також відома як сухонаповнена капсула (DFC), складається із двох відділів, одного, насадженого на інший, у такий спосіб повністю покриваючи активний інгредієнт. М'яка еластична капсула (SEC) являє собою м'яку глобулярну шкарлупу, таку як желатинова капсула, яка пластифікована додаванням гліцерину, сорбіту або подібного поліолу. М'які желатинові капсули можуть містити консервант для запобігання росту мікроорганізмів. Придатні консерванти є такими, як описано в даному описі, включаючи метил- і пропілпарабени й сорбінову кислоту. Рідкі, напівтверді й тверді лікарські форми, забезпечувані в даному описі, можуть бути інкапсульовані в капсулу. Придатні рідкі й напівтверді лікарські форми включають розчини й суспензії в пропіленкарбонаті, рослинних оліях або тригліцеридах. Капсули, які містять такі розчини, можуть бути одержані як описано в патенті США №№ 4328245, 4409239 і 4410545. Капсули також можуть бути покриті оболонкою, як відомо фахівцеві в галузі техніки, з метою модифікації або тривалого розчинення активного інгредієнта. Фармацевтичні композиції, представлені в даному описі, можуть бути забезпечені в рідкій і напівтвердої лікарських формах, включаючи емульсії, розчини, суспензії, еліксири й сиропи. Емульсія являє собою двофазну систему, у якій одна рідина диспергована у формі дрібних глобул по всій іншій рідині, яка може бути маслом-у-воді або водою-в-маслі. Емульсії можуть включати фармацевтично прийнятні неводні рідини або розчинники, емульгувальний засіб і 11 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 консервант. Суспензії можуть включати фармацевтично прийнятний суспендувальний засіб і консервант. Водно-спиртові розчини можуть включати фармацевтично прийнятні ацеталі, такі як ди(нижчий алкіл)ацеталь нижчого алкілальдегіду (термін "нижчий" означає алкіл, що має від 1 до 6 атомів вуглецю), наприклад, діетилацеталь ацетальдегіду; і змішуваний з водою розчинник, який має одну або більше гідроксильних груп, такий як пропіленгліколь і етанол. Еліксири є прозорими, солодкими й водно-спиртовими розчинами. Сиропи являють собою концентровані водні розчини цукру, наприклад, сахарози, і також можуть містити консервант. Для рідкої лікарської форми, наприклад, розчин у поліетиленгліколі може бути розведений достатньою кількістю фармацевтично прийнятного рідкого носія, наприклад, води, в мірі, зручній для введення. Інші застосовні рідкі й напівтверді лікарські форми включають, але не обмежуються перерахованими, такі, що містять активний інгредієнт(и), представлений у даному описі, і діалкілований моно- або поліалкіленгліколь, включаючи 1,2-диметоксиметан, диглім, триглім, тетраглім, диметиловий ефір поліетиленгліколю-350, диметиловий ефір поліетиленгліколю-550, диметиловий ефір поліетиленгліколю-750, де 350, 550 і 750 стосуються приблизної середньої молекулярної маси поліетиленгліколю. Такі композиції можуть додатково включати один або більше антиоксидантів, таких як бутильований гідрокситолуол (ВНТ), бутильований гідроксіанізол (ВНА), пропілгалат, вітамін Е, гідрохінон, гідроксикумарини, етаноламін, лецитин, цефалін, аскорбіновакислота, яблучна кислота, сорбіт, фосфорна кислота, бісульфіт, метабісульфіт натрію, тіодипропіонова кислота і її складні ефіри й дитіокарбамати. Фармацевтичні композиції, представлені в даному описі для перорального введення, можуть також бути представлені у формі ліпосом, міцел, мікросфер або наносистем. Міцелярні лікарські форми можуть бути одержані, як описано в патенті США № 6350458. Фармацевтичні композиції, представлені в даному описі, можуть бути забезпечені у вигляді нешипучих або шипучих гранул і порошків для відновлення в рідкі лікарські форми. Фармацевтично прийнятні носії й допоміжні речовини, використовувані в нешипучих гранулах або порошках, можуть включати розріджувачі, підсолоджувачі й зволожувальні засоби. Фармацевтично прийнятні носії й допоміжні речовини, використовувані в шипучих гранулах або порошках, можуть включати органічні кислоти й джерело діоксиду вуглецю. Барвники й ароматизатори можуть бути використані у всіх вищевказаних лікарських формах. Фармацевтичні композиції, представлені в даному описі, можуть бути рецептовані у вигляді лікарських форм негайного або модифікованого вивільнення, включаючи форми відстроченого, безперервного, пульсового, контрольованого, цільового й програмованого вивільнення. Фармацевтичні композиції, представлені в даному описі, можуть бути спільно рецептовані з іншими активними інгредієнтами, які не впливають на бажану терапевтичну дію, або з речовинами, які доповнюють бажану дію, такими як антациди, інгібітори протонової помпи й антагоністи рецептора H2. В. Парентеральне введення Фармацевтичні композиції, представлені в даному описі, можуть вводитися парентерально ін'єкцією, інфузією або імплантацією, місцевим або системним введенням. Парентеральне введення, як використовується в даному описі, включає внутрішньовенне, внутрішньоартеріальне, внутрішньоочеревинне, інтратекальне, внутрішньошлуночкове, інтрауретральне, інтрастернальне, інтракраніальне, внутрішньом'язове, інтрасиновіальне й підшкірне введення. Фармацевтичні композиції, представлені в даному описі, можуть бути рецептовані в будьяких лікарських формах, які придатні для парентерального введення, включаючи розчини, суспензії, емульсії, міцели, ліпосоми, мікросфери, наносистеми й тверді форми, придатні для розчинів або суспензій у рідині перед ін'єкцією. Такі лікарські форми можуть бути одержані відповідно до звичайних способів, відомих фахівцеві в галузі техніки фармацевтичних наук (див. Remington: The Science and Practice of Pharmacy, вище). Фармацевтичні композиції, призначені для парентерального введення, можуть включати один або більше фармацевтично прийнятних носіїв і допоміжних речовин, включаючи, але не обмежуючись перерахованими, водні носії, носії, змішувані з водою, неводні носії, антимікробні засоби або консерванти проти росту мікроорганізмів, стабілізатори, підсилювачі розчинності, ізотонічні засоби, буферні засоби, антиоксиданти, місцеві анестетики, суспендувальні й диспергувальні засоби, зволожувальні або емульгувальні засоби, комплексоутворювальні засоби, комплексоутворювальні або хелатуючі засоби, кріопротектори, ліопротектори, загусники, засоби, що регулюють рн, і інертні гази. Придатні водні носії включають, але не обмежуються перерахованими, воду, сольовий розчин, фізіологічний розчин або фосфатний буферний розчин (PBS), ін'єкційний розчин 12 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 хлориду натрію, ін'єкційний розчин Рінгера, ізотонічний розчин декстрози для ін'єкцій, стерильну воду для ін'єкцій, декстрозу й лактатний розчин Рінгера для ін'єкцій. Неводні носії включають, але не обмежуються перерахованими, нелеткі олії рослинного походження, касторову олію, кукурудзяну олію, бавовняну олію, маслинову олію, арахісову олію, олію м'яти перцевої, сафлорову олію, кунжутну олію, соєву олію, гідрогенізовані рослинні олії, гідрогенізовану соєву олію й середньоланцюжкові тригліцериди кокосової олії й олії пальмового насіння. Змішувані з водою носії включають, але не обмежуються перерахованими, етанол, 1,3-бутандіол, рідкий поліетиленгліколь (наприклад, поліетиленгліколь 300 і поліетиленгліколь 400), пропіленгліколь, гліцерин, N-метил-2-піролідон, диметилацетамід і диметилсульфоксид. Придатні антимікробні засоби або консерванти включають, але не обмежуються перерахованими, феноли, крезоли, ртутні препарати, бензиловий спирт, хлорбутанол, метил- і пропіл-п-гідроксибензати, тимеросал, хлорид бензалконію, хлорид бензетонію, метил- і пропілпарабени й сорбінову кислоту. Придатні ізотонічні засоби включають, але не обмежуються перерахованими, хлорид натрію, гліцерин і декстрозу. Придатні буферні засоби включають, але не обмежуються перерахованими, фосфат і цитрат. Придатні антиоксиданти являють собою ті, які описані в даному описі, включаючи бісульфіт і метабісульфіт натрію. Придатні місцеві анестетики включають, але не обмежуються перерахованими, гідрохлорид прокаїну. Придатні суспендувальні й диспергувальні засоби являють собою такі, як описано в даному описі, включаючи карбоксиметилцелюлозу натрію, гідроксипропілметилцелюлозу й полівінілпіролідон. Придатні емульгувальні засоби включають описані в даному описі, включаючи монолаурат поліоксіетиленсорбіту, моноолеат поліоксіетиленсорбіту 80 і олеат триетаноламіну. Придатні комплексоутворювальні або хелатуючі засоби включають, але не обмежуються перерахованими, ЕДТА. Придатні засоби, що регулюють рн, включають, але не обмежуються перерахованими, гідроксид натрію, соляну кислоту, лимонну кислоту й молочну кислоту. Придатні комплексоутворювальні засоби включають, але не обмежуються перерахованими, циклодекстрини, включаючи альфа-циклодекстрин, бета-циклодекстрин, гідроксипропіл-бета-циклодекстрин, сульфобутиловий ефір бета-циклодекстрину і сульфобутиловий ефір 7-бета-циклодекстрину (CAPTISOL®, CyDex, Lenexa, KS). Фармацевтичні композиції, представлені в даному описі, можуть бути рецептовані для разового введення або введення декількох доз. Лікарські композиції, які містять разові дози, упаковані в ампули, флакони або шприци. Парентеральні композиції, які містять кілька доз, повинні містити антимікробний засіб у бактеріостатичних або фунгістатичних концентраціях. Всі парентеральні композиції мають бути стерильними, як відомо й використовується в галузі техніки. В одному варіанті здійснення винаходу фармацевтичні композиції надані у вигляді готових до застосування стерильних розчинів. В іншому варіанті здійснення винаходу фармацевтичні композиції надані у вигляді стерильних сухих розчинних продуктів, включаючи ліофілізовані порошки й гіподермальні таблетки, для відновлення носієм перед використанням. У ще одному варіанті здійснення винаходу надані фармацевтичні композиції у вигляді стерильних суспензій, готових до вживання. У ще одному варіанті здійснення винаходу фармацевтичні композиції надані у вигляді стерильних сухих нерозчинних продуктів для відновлення носієм перед застосуванням. У ще одному варіанті здійснення винаходу фармацевтичні композиції надані у вигляді готових до використання стерильних емульсій. Фармацевтичні композиції, забезпечувані в даному описі, можуть бути рецептовані у вигляді лікарських форм негайного або модифікованого вивільнення, включаючи форми відстроченого, безперервного, пульсового, контрольованого, цільового й програмованого вивільнення. Фармацевтичні композиції можуть бути рецептовані у вигляді суспензії, твердої речовини, напівтвердої речовини або тиксотропної рідини для введення у вигляді імплантованого депо. В одному варіанті здійснення винаходу фармацевтична композиція, забезпечена в даному описі, диспергована у твердій внутрішній матриці, яка оточена зовнішньою полімерною мембраною, яка є нерозчинною в рідинах тіла, але дозволяє активному інгредієнту у фармацевтичних композиціях дифундувати через них. Придатні внутрішні матриці включають поліметилметакрилат, полібутилметакрилат, пластифікований або непластифікований полівінілхлорид, пластифікований нейлон, пластифікований поліетилентерфталат, натуральний каучук, поліізопрен, поліізобутилен, полібутадієн, поліетилен, співполімери етилену-вінілацетату, силіконові каучуки, полідиметилсилоксани, співполімери карбонату кремнію, гідрофільні полімери, такі як гідрогелі складних ефірів акрилової й метакрилової кислоти, колаген, зшитий полівініловий спирт і зшитий частково гідролізований полівінілацетат. Придатні зовнішні полімерні мембрани включають поліетилен, поліпропілен, співполімери 13 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 етилену/пропілен, співполімери етилену/етилакрилату, співполімери етилену/вінілацетату, силіконові каучуки, полідиметилсилоксани, неопренові каучуки, хлорований поліетилен, полівінілхлорид, співполімери вінілхлориду з вінілацетатом, хлорид вінілідену, етилен і пропілен, іономер терфталату поліетилену, бутилкаучук, епіхлоргідринові каучуки, співполімер етилену/вінілового спирту, терполімер етилену/вінілацетату/вінілового спирту й співполімер етилену/вінілоксіетанолу. С. Місцеве введення Фармацевтичні композиції, представлені в даному описі, можуть вводитися місцево на шкіру, отвори або слизові оболонки. Місцеве введення, як використовується в даному описі, включає (інтра)дермальне, кон’юнктивальне, інтракорнеальне, внутрішньоочне, очне, вушне, черезшкірне, назальне, вагінальне, уретральне, респіраторне й ректальне введення. Фармацевтичні композиції, представлені в даному описі, можуть бути рецептовані в будьяких лікарських формах, які придатні для місцевого введення для локального або системного ефекту, включаючи емульсії, розчини, суспензії, креми, гелі, гідрогелі, мазі, присипки, пов'язки, еліксири, лосьйони, суспензії, настойки, пасти, піни, плівки, аерозолі, зрошення, спреї, супозиторії, бинти, шкірні пластири. Місцеві композиції фармацевтичних композицій, представлених у даному описі, також можуть включати ліпосоми, міцели, мікросфери, наносистеми і їх суміші. Фармацевтично прийнятні носії й допоміжні речовини, придатні для застосування в місцевих композиціях, представлених у даному описі, включають, але не обмежуються перерахованими, водні носії, змішувані з водою носії, неводні носії, антимікробні засоби або консерванти проти росту мікроорганізмів, стабілізатори, підсилювачі розчинності, ізотонічні засоби, буферні засоби, антиоксиданти, місцеві анестетики, суспендувальні й диспергувальні засоби, воложувальні або емульгувальні засоби, комплексоутворювальні засоби, комплексони або хелатуючі засоби, підсилювачі пенетрації, кріопротектанти, ліопротектанти, згущувальні засоби й інертні гази. Фармацевтичні композиції також можуть вводитися місцево за допомогою електропорації, іонофорезу, фонофорезу, сонофорезу й мікроголкових або безголкових ін'єкцій, таких як TM TM POWDERJECT (Chiron Corp., Emeryville, CA) і BIOJECT (Bioject Medical Technologist Inc., Tualatin, OR). Фармацевтичні композиції, представлені в даному описі, можуть бути представлені у формі мазей, кремів і гелів. Придатні мазеві носії включають масляні або вуглеводневі основи, включаючи такі як жир, бензоїнований жир, маслинова олія, бавовняна олія й інші олії, білий вазелін; емульговані або абсорбуючі основи, такі як гідрофільний вазелін, сульфат гідроксистеарину й безводний ланолін; основи, що видаляються водою, такі як гідрофільна мазь; водорозчинні мазеві основи, включаючи поліетиленгліколі різної молекулярної маси; основи емульсій або емульсії вода-в-маслі (W/O), або емульсії масло-у-воді (O/W), включаючи цетиловий спирт, гліцерилмоностеарат, ланолін і стеаринову кислоту (див. Remington: The Science and Practice of Pharmacy, вище). Такі носії є пом'якшувальними речовинами, але звичайно вимагають додавання антиоксидантів і консервантів. Придатні кремові основи можуть бути маслом-у-воді або водою-у-маслі. Кремові носії можуть бути змиваними водою й містити масляну фазу, емульгатор і водну фазу. Масляна фаза також називається "внутрішньою" фазою, яка звичайно включає вазелін і жирний спирт, такий як цетиловий або стеариловий спирт. Водна фаза звичайно, хоча не обов'язково, перевищує масляну фазу в об'ємі й звичайно містить зволожувач. Емульгатор у композиції крему може бути неіонною, аніонною, катіонною або амфотерною поверхнево-активною речовиною. Гелі є напівтвердими системами типу суспензії. Монофазні гелі містять органічні макромолекули, розподілені по суті гомогенно по всьому рідкому носію. Придатні гелеутворювальні засоби включають зшиті полімери акрилової кислоти, такі як карбомери, карбоксиполіалкілени, Carbopol®; гідрофільні полімери, такі як поліетиленоксиди, співполімери поліоксіетилену-поліоксипропілену й полівініловий спирт; полімери целюлози, такі як гідроксипропілцелюлоза, гідроксіетилцелюлоза, гідроксипропілметилцелюлоза, фталат гідроксипропілметилцелюлози й метилцелюлоза; камеді, такі як трагакант і ксантанова камедь; альгінат натрію й желатин. З метою одержання однорідного гелю, можуть бути додані диспергувальні засоби, такі як спирт або гліцерин, або гелеутворювальні засоби можуть бути дисперговані розтиранням, механічним змішуванням і/або перемішуванням. Фармацевтичні композиції, представлені в даному описі, можуть вводитися ректально, уретрально, вагінально або перивагінально у формах супозиторіїв, песарієв, бужів, компресів або припарок, паст, порошків, пов'язок, кремів, пластирів, контрацептивів, мазей, розчинів, емульсій, суспензій, тампонів, гелів, пін, спреїв або спринцювань. Такі лікарські форми можуть 14 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 бути одержані з використанням звичайних способів, як описано в Remington: The Science and Practice of Pharmacy, вище. Ректальні, уретральні й вагінальні супозиторії є твердими тілами для вставляння в отвори тіла, які є твердими при звичайній температурі, але тануть або розм'якшуються при температурі тіла з вивільненням активного інгредієнта(ів) усередині отворів. Фармацевтично прийнятні носії, використовувані в ректальних й вагінальних супозиторіях, включають носії, такі як речовини, що підвищують твердість, які дають температуру плавлення близько температури тіла, при рецептуванні з фармацевтичними композиціями, представленими в даному описі; і антиоксиданти, як описано в даному описі, включаючи бісульфіт і метабісульфіт натрію. Придатні носії включають, але не обмежуються перерахованими, масло какао (какао-масло), гліцерин-желатин, карбовакс (поліоксіетиленгліколь), спермацет, парафін, білий і жовтий віск і відповідні суміші моно-, ди- і тригліцеридів жирних кислот, гідрогелі, такі як полівініловий спирт, гідроксіетилметакрилат, поліакрилова кислота; желатин із гліцерином. Можуть бути використані комбінації різних носіїв. Ректальні й вагінальні супозиторії можуть бути одержані методом пресування або лиття. Звичайна маса ректального й вагінального супозиторія становить від близько 2 до 3 г. Фармацевтичні композиції, представлені в даному описі, можуть вводитися офтальмологічно у формах розчинів, суспензій, мазей, емульсій, гелеутворювальних розчинів, порошків для розчинів, гелів, очних вставок і імплантатів. Фармацевтичні композиції, представлені в даному описі, можуть вводитися інтраназально або шляхом інгаляції в респіраторний тракт. Фармацевтичні композиції можуть бути представлені у формі аерозолю або розчину для введення з використанням контейнера під тиском, насоса, спрея, пульверизатора, такого як пульверизатор з використанням електрогідродинаміки для одержання наддрібного розпилення, або небулайзера, окремо або в комбінації з придатним пропелентом, таким як 1,1,1,2-тетрафторетан або 1,1,1,2,3,3,3гептафторпропан. Фармацевтичні композиції можуть також бути представлені у вигляді сухого порошку для вдихання, окремо або в комбінації з інертним носієм, таким як лактоза або фосфоліпіди; і назальних крапель. Для інтраназального застосування порошок може включати біоадгезивний засіб, включаючи хітозан або циклодекстрин. Розчини або суспензії для використання в контейнері під тиском, насосі, спреї, пульверизаторі або небулайзері можуть бути рецептовані й містити етанол, водний етанол або придатний альтернативний агент для диспергування, розчинення або продовження вивільнення активного інгредієнта, представленого в даному описі, пропеленту у вигляді розчинника і/або поверхнево-активної речовини, такої як триолеат сорбіту, олеїнова кислота або олігомолочна кислота. Фармацевтичні композиції, представлені в даному описі, можуть бути мікронізовані до розміру, придатного для доставки шляхом інгаляції, наприклад, 50 мікрометрів або менше або 10 мікрометрів або менше. Частинки таких розмірів можуть бути одержані з використанням подрібнювального методу, відомого фахівцеві в галузі техніки, такого як здрібнювання спіральним струменем, здрібнювання в млині із псевдозрідженим шаром, обробка надкритичною рідиною до одержання наночастинок, гомогенізація при високому тиску або розпилювальне сушіння. Капсули, блістери й картриджі для використання в інгаляторі або інсуфляторі можуть бути рецептовані як такі, що містять порошкову суміш фармацевтичні композиції, представлені у даному описі; придатну порошкову основу, таку як лактоза або крохмаль; і модифікатор характеристик, такий як l-лейцин, маніт або стеарат магнію. Лактоза може бути безводною або у формі моногідрату. Інші придатні допоміжні речовини включають декстран, глюкозу, мальтозу, сорбіт, ксиліт, фруктозу, сахарозу й трегалозу. Фармацевтичні композиції, представлені в даному описі для інгаляційного/інтраназального введення, можуть додатково включати придатний ароматизатор, такий як ментол і левоментол, або підсолоджувачі, такі як сахарин або сахарин натрію. Фармацевтична композиція, представлена в даному описі для місцевого введення, може бути рецептована для негайного вивільнення або модифікованого вивільнення, включаючи відстрочене, безперервне, пульсове, контрольоване, цільове й програмоване вивільнення. D. Модифіковане вивільнення Фармацевтичні композиції, представлені в даному описі, можуть бути рецептовані у вигляді лікарських форм модифікованого вивільнення. Як використовується в даному описі, термін "модифіковане вивільнення" стосується лікарської форми, у якій швидкість або місце вивільнення активного інгредієнта(ів) відрізняється від таких лікарської форми негайного вивільнення при введенні таким же шляхом. Лікарські форми модифікованого вивільнення 15 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 включають лікарські форми відстроченого, тривалого, пролонгованого, безперервного, ударного або пульсового, контрольованого, прискореного й швидкого, націленого, програмованого вивільнення, і лікарські форми, утримувані в шлунку. Фармацевтичні композиції в лікарських формах модифікованого вивільнення можуть бути одержані з використанням множини пристроїв і методів модифікованого вивільнення, відомих фахівцеві в галузі техніки, включаючи, але не обмежуючись перерахованими, пристрої з контрольованим вивільненням на основі матриці, пристрої з осмотичним контрольованим вивільненням, пристрої з контрольованим вивільненням з множини частинок, іонообмінні смоли, кишкові оболонки, багатошарові оболонки, мікросфери, ліпосоми і їх комбінації. Швидкість вивільнення активного інгредієнта(ів) також може бути модифікована, варіюючи розміри частинок і поліморфізм активного інгредієнта(ів). Приклади модифікованого вивільнення включають, але не обмежуються перерахованими, описані в патентах США №№: 3845770, 3916899, 3536809, 3598123, 4008719, 5674533, 5059595, 5591767, 5120548, 5073543, 5639476, 5354556, 5639480, 5733566, 5739108, 5891474, 5922356, 5972891, 5980945, 5993855, 6045830, 6087324, 6113943, 6197350, 6248363, 6264970, 6267981, 6376461, 6419961, 6589548, 6613358 і 6699500. 1. Пристрої контрольованого вивільнення на основі матриці Фармацевтичні композиції, представлені в даному описі, у лікарській формі модифікованого вивільнення, можуть бути одержані з використанням пристрою з контрольованим вивільненням на основі матриці, відомого фахівцеві в галузі техніки (див. Takada et al. In "Encyclopedia of Controlled Drug Delivery", Vol. 2, Mathiowitz ed., Wiley, 1999). В одному варіанті здійснення винаходу фармацевтичні композиції, представлені в даному описі, у лікарській формі модифікованого вивільнення рецептують з використанням пристрою матриці, що розкладається, яка являє собою полімери, які набухають у воді, які розкладаються або розчинні полімери, включаючи синтетичні полімери й природні полімери й похідні, такі як полісахариди й білки. Матеріали, застосовні в одержанні матриці, що розкладається, включають, але не обмежуються перерахованими, хітин, хітозан, декстран і полулан; агарову камедь, гуміарабік, камедь карайя, камедь плодово-ріжкового дерева, трагакант, карагенаны, гхатті-камедь, гуарову камедь, ксантанову камедь і склероглюкан; крохмалі, такі як декстрин і мальтодекстрин; гідрофільні колоїди, такі як пектин; фосфатиди, такі як лецитин; альгінати; альгінат пропіленгліколю; желатин; колаген; і целюлози, як етилцелюлоза (ЕС), метилетилцелюлоза (МЕС), карбоксиметилцелюлоза (СМС), СМЕС, гідроксіетилцелюлоза (НІС), гідроксипропілцелюлоза (НРС), ацетат целюлози (СА), пропіонат целюлози (СР), бутират целюлози (СВ), бутират ацетату целюлози (САВ), САР, САТ, гідроксипропілметилцелюлоза (НРМС), НРМСР, НРМСАS, тримелітат ацетату гідроксипропілметилцелюлози (НРМСАТ) і етилгідроксіетилцелюлоза (ЕНЕС); полівінілпіролідон; полівініловий спирт; полівінілацетат; складні ефіри гліцерину й жирних кислот; поліакриламід; поліакрилова кислота; співполімери етакрилової кислоти або метакрилової кислоти (EURAGIT®, Rohm America, Inc., Piscataway, NJ); полі(2-гідроксіетилметакрилат); полілактиди; співполімери L-глютамової кислоти й етил Lглютамату; співполімери, що розкладаються, молочної кислоти-гліколевої кислоти; полі-D-(-)-3гідроксимасляна кислота; і інші похідні акрилової кислоти, такі як гомополімери й співполімери бутилметакрилату, метилметакрилат, етилметакрилат, етилакрилат, (2диметиламіноетил)метакрилат і хлорид (триметиламіноетил)метакрилату. В іншому варіанті здійснення винаходу фармацевтичні композиції рецептують з матрицею, що не розкладається. Активний інгредієнт(и) розчиняється або диспергується в інертній матриці й вивільняється при введенні переважно за допомогою дифузії з інертної матриці. Матеріали, придатні для використання у вигляді матриці, що не розкладається, включають, але не обмежуються перерахованими, нерозчинні пластики, такі як поліетилен, поліпропілен, поліізопрен, поліізобутилен, полібутадієн, поліметилметакрилат, полібутилметакрилат, хлорований поліетилен, полівінілхлорид, співполімери метилакрилату-метилметакрилату, співполімери етилену-вінілацетату, співполімери етилену/пропілену, співполімери етилену/етилакрилату, співполімери вінілхлориду з вінілацетатом, хлорид вінілідену, етилен і пропілен, іономер терфталату поліетилену, бутиловий каучук, епіхлоргідриновий каучук, співполімер етилену/вінілового спирту, терполімер етилену/вінілацетату/вінілового спирту й співполімер етилену/вінілоксіетанолу, полівінілхлорид, пластифікований нейлон, пластифікований поліетилентерфталат, природний каучук, силіконові каучуки, полідиметилсилоксани, співполімери карбонату кремнію й гідрофільні полімери, такі як етилцелюлоза, ацетат целюлози, кросповідон і зшитий частково гідролізований полівінілацетат; і жирні сполуки, такі як карнаубський віск, мікрокристалічний віск і тригліцериди. 16 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 У системі матриці з контрольованим вивільненням, бажана кінетика вивільнення може бути контрольованою, наприклад, за допомогою типу використовуваного полімеру, в'язкості полімеру, розміру частинок полімеру й/або активного інгредієнта(ів), співвідношення активного інгредієнта(ів) і полімеру й інших допоміжних речовин у композиції. Фармацевтичні композиції, представлені в даному описі, у лікарській формі модифікованого вивільнення можуть бути одержані методами, відомими фахівцеві в галузі техніки, включаючи безпосереднє пресування, сухе або вологе гранулювання з наступним пресуванням, гранулювання з розплаву з наступним пресуванням. 2. Осмотичні пристрої з контрольованим вивільненням Фармацевтичні композиції, представлені в даному описі, у лікарській формі з модифікованим вивільненням можуть бути одержані з використанням осмотичного пристрою з контрольованим вивільненням, включаючи однокамерну систему, двокамерну систему, асиметричну мембранну методику (АМТ) і екструдуючу базову систему (ECS). Загалом, такі пристрої мають щонайменше два компоненти: (а) ядро, яке містить активний інгредієнт(и); і (b) напівпроникну мембрану з щонайменше одним отвором для доставки, у якій інкапсульоване ядро. Напівпроникна мембрана контролює приплив води до ядра з водного оточення так, щоб викликати вивільнення лікарського засобу видавлюванням через отвір(ори) для доставки. На доповнення до активного інгредієнта(ів) ядро осмотичного пристрою необов'язково включає осмотичний засіб, який створює рушійну силу для перенесення води з оточуючого середовища в ядро пристрою. Одним класом осмотичних засобів є гідрофільні полімери, що набухають у воді, які також називаються "осмополімери" і "гідрогелі", включаючи, але не обмежуючись перерахованими, гідрофільні полімери вінілу й акрилу, полісахариди, такі як альгінат кальцію, поліетиленоксид (РЕО), поліетиленгліколь (PEG), поліпропіленгліколь (PPG), полі(2-гідроксіетилметакрилат), полі(акрилова)кислота, полі(метакрилова)кислота, полівінілпіролідон (PVP), зшитий PVP, полівініловий спирт (PVA), співполімери PVA/PVP, співполімери PVA/PVP з гідрофобними мономерами, такими як метилметакрилат і вінілацетат, гідрофільні поліуретани, що містять великі блоки РЕО, кроскармелоза натрію, карагенан, гідроксіетилцелюлоза (НІС), гідроксипропілцелюлоза (НРС), гідроксипропілметилцелюлоза (НРМС), карбоксиметилцелюлоза (СМС) і карбоксіетилцелюлоза (СЕС), альгінат натрію, полікарбофіл, желатин, ксантанова камедь і гліколят крохмалю натрію. Іншим класом осмотичних засобів є осмогени, які здатні усмоктувати воду для впливу на градієнт осмотичного тиску через бар'єр оточуючих оболонок. Придатні осмогени включають, але не обмежуються перерахованими, неорганічні солі, такі як сульфат магнію, хлорид магнію, хлорид кальцію, хлорид натрію, хлорид літію, сульфат калію, фосфати калію, карбонат натрію, сульфіт натрію, сульфат натрію, хлорид калію й сульфат натрію; цукри, такі як декстроза, фруктоза, глюкоза, інозитол, лактоза, мальтоза, маніт, рафіноза, сорбіт, сахароза, трегалоза й ксиліт; органічні кислоти, такі як аскорбінова кислота, бензойна кислота, фумарова кислота, лимонна кислота, малеїнова кислота, себацинова кислота, сорбінова кислота, адипінова кислота, едетова кислота, глютамова кислота, п-толуолсульфонова кислота, бурштинова кислота й виннокам’яна кислота; сечовина і їх суміші. Осмотичні засоби з різними швидкостями розчинення можуть використовуватися для впливу на те, як швидко активний інгредієнт(и) початково виділяється з лікарської форми. Наприклад, аморфні цукри, такі як Mannogeme EZ (SPI Pharma, Lewes, DE), можуть використовуватися для забезпечення більш швидкої доставки протягом перших декількох годин для відповідного одержання бажаного терапевтичного ефекту й поступово й безупинно вивільняти іншу кількість для підтримання бажаного рівня терапевтичного або профілактичного ефекту протягом тривалого періоду часу. У такому випадку активний інгредієнт(и) вивільняється з такою швидкістю, щоб заміщати метаболізовану й екскретовану кількість активного інгредієнта. Ядро також може включати широку множину інших допоміжних речовин і носіїв, як описано в даному описі, для посилення введення лікарської форми або для забезпечення стабільності або обробки. Матеріали, застосовні в одержанні напівпроникної мембрани, включають різні ступені похідних акрилу, вінілу, ефірів, поліамідів, поліефірів і целюлози, які є проникними для води й нерозчинними у воді при фізіологічно важливих рн або здатні ставати нерозчинними у воді при хімічних змінах, таких як зшивання. Приклади придатних полімерів, застосовуваних в одержанні оболонки, включать пластифіковані, непластифіковані й посилений ацетат целюлози (СА), діацетат целюлози, триацетат целюлози, пропіонат СА, нітрат целюлози, бутират ацетату целюлози (САВ), етилкарбамат СА, САР, метилкарбамат СА, сукцинат СА, триметилат ацетату целюлози (САТ), диметиламіноацетат СА, етилкарбонат СА, хлорацетат СА, етилоксалат СА, метилсульфонат СА, бутилсульфонат СА, п-толуолсульфонат СА, ацетат агару, триацетат 17 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 амілози, ацетат бета-глюкану, триацетат бета-глюкану, диметилацетат ацетальдегіду, триацетат смоли плодово-ріжкового дерева, гідроксильований етиленвінілацетат, ЕС, PEG, PPG, співполімери PEG/PPG, PVP, HEC, HPC, CMC, CMEC, HPMC, HPMCP, HPMCAS, HPMCAT, полі(акрилові)кислоти й складні ефіри й полі(метакрилові)кислоти й складні ефіри і їх співполімери, крохмаль, декстран, декстрин, хітозан, колаген, желатин, поліалкени, поліефіри, полісульфони, поліефірсульфони, полістироли, полівінілгалоїди, полівінілові складні й прості ефіри, натуральні воски й синтетичні воски. Напівпроникними мембранами також можуть бути гідрофобні мікропористі мембрани, де пори є по суті наповненими газом і не зволожені водним середовищем, але проникні для парів води, як описано в патенті США № 5798119. Така гідрофобна, але проникна для водних парів мембрана звичайно складається з гідрофобних полімерів, таких як поліалкени, поліетилен, поліпропілен, політетрафторетилен, похідні поліакрилової кислоти, поліефіри, полісульфони, поліефірсульфони, полістироли, полівінілгалоїди, фторид полівінілідену, полівінілові складні й прості ефіри, натуральні воски й синтетичні воски. Впускний отвір(ори) на напівпроникній мембрані може бути утворений після покривання оболонкою шляхом механічного або лазерного свердління. Впускний отвір(ори) також може бути утворений на місці шляхом руйнування пробки з водорозчинного матеріалу або шляхом розриву тонкої частини мембрани над заглибинами в ядрі. Крім того, впускні отвори можуть бути утворені під час процесу покривання оболонкою, як у випадку асиметричних мембранних оболонок типу, описаного в патентах США №№ 5612059 і 5698220. Загальна кількість активного інгредієнта(ів), що вивільняється, і швидкість вивільнення можуть по суті модулюватися за допомогою товщини й пористості напівпроникної мембрани, складу ядра й кількості, розміру й розташування впускних отворів. Фармацевтичні композиції в осмотичних лікарських формах з контрольованим вивільненням можуть також включати додаткові звичайні допоміжні речовини, як описано в даному описі, для забезпечення показників або обробки композиції. Осмотичні лікарські форми з контрольованим вивільненням можуть бути одержані відповідно до звичайних методів і методик, відомих фахівцеві в галузі техніки (див. Remington: The Science and Practice of Pharmacy, вище; Santus і Baker, J. Controlled Release 1995, 35, 1-21; Verma et al., Drug Development and Industrial Pharmacy 2000, 26, 695-708; Verma et al., J. Controlled Release 2002, 79, 7-27). У певних варіантах здійснення винаходу фармацевтичні композиції, представлені в даному описі, рецептовані у вигляді АМТ лікарських форм із контрольованим вивільненням, які включають асиметричну осмотичну мембрану, яка покриває ядро, яке містить активний інгредієнт(и) і інші фармацевтично прийнятні допоміжні речовини. Див. патенти США № 5612059 і WO 2002/17918. АМТ лікарські форми з контрольованим вивільненням можуть бути одержані відповідно до звичайних методів і методик, відомих фахівцеві в галузі техніки, включаючи пряме пресування, сухе гранулювання, вологе гранулювання й метод нанесення покриття зануренням. У певному варіанті здійснення винаходу фармацевтичні композиції, представлені в даному описі, рецептовані у вигляді ESC лікарських форм із контрольованим вивільненням, які включають осмотичну мембрану, яка покриває ядро, яке містить активний інгредієнт(и), гідроксилетилцелюлозу й інші фармацевтично прийнятні допоміжні речовини. 3. Пристрої з контрольованим вивільненням множини частинок Фармацевтичні композиції, представлені в даному описі, у лікарській формі з модифікованим вивільненням можуть бути представлені в пристроях по контрольованому вивільненню множини частинок, які включають множину частинок, гранул або кульок, що варіюються від близько 10 мкм до близько 3 мм, від близько 50 мкм до близько 2,5 мм або від близько 100 мкм до 1 мм у діаметрі. Така множина частинок може бути одержана способами, відомими фахівцеві в галузі техніки, включаючи вологе й сухе гранулювання, екструзію/сферонізацію, ролерне ущільнення, заморожування розплаву й покривання оболонкою висіяних ядер шляхом розпилення. Див., наприклад, Multiparticulate Oral Drug Delivery; Marcel Dekker: 1994; і Pharmaceutical Pelletization Technology; Marcel Dekker: 1989. Інші допоміжні речовини, як описано в даному описі, можуть бути змішані з фармацевтичними композиціями для поліпшення обробки й утворення множини частинок. Одержані частинки можуть самі по собі складати пристрій з множиною частинок або можуть бути покриті оболонкою з різних плівкоутворювальних матеріалів, таких як кишковорозчинні полімери, полімери, що набухають у воді й розчинні у воді. Множина частинок може бути додатково представлена у вигляді капсули або таблетки. 4. Спрямоване введення 18 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтичні композиції, представлені в даному описі, також можуть бути рецептовані для націлювання на певні тканини, рецептори або інші ділянки тіла пацієнта, що піддається лікування, включаючи системи введення, основані на ліпосомах, вивільнених еритроцитах і антитілах. Приклади включають, але не обмежуються перерахованими, патенти США №№ 6316652, 6274552, 6271359, 6253872, 6139865, 6131570, 6120751, 6071495, 6060082, 6048736, 6039975, 6004534, 5985307, 5972366, 5900252, 5840674, 5759542 і 5709874. Способи застосування В одному варіанті здійснення винаходу представлений спосіб лікування, профілактики або полегшення одного або більше симптомів розладу або захворювання, асоційованого з CRTH2 і/або одним або більше іншими рецепторами PGD2, шляхом введення пацієнтові, що має або передбачувано має такий стан або захворювання, терапевтично ефективної кількості частинок {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в аморфній формі або кристалічної формі I або II. В інших варіантах здійснення винаходу представлений спосіб лікування, профілактики або полегшення одного або більше симптомів захворювання або розладу, що відповідає за модуляцію CRTH2 і/або одного або більше інших рецепторів PGD 2, який включає введення пацієнтові, що має або передбачувано має такий стан або захворювання, терапевтично ефективної кількості частинок {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в аморфній формі або кристалічній формі I або II. У ще одному варіанті здійснення винаходу наданий спосіб лікування, профілактики або полегшення одного або більше симптомів захворювання або розладу, опосередкованого CRTH2 і/або одним або більше іншими рецепторами PGD2, який включає введення пацієнтові, що має або передбачувано має такий стан або захворювання, терапевтично ефективної кількості частинок {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в аморфній формі або кристалічній формі I або II. У ще одному варіанті здійснення винаходу наданий спосіб для лікування, профілактики або полегшення одного або більше симптомів захворювання, пов'язаного з еозинофілами, який включає введення пацієнтові, що має або передбачувано має такий стан або захворювання, терапевтично ефективної кількості частинок {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)-бензил)піримідин-5-іл}оцтової кислоти в аморфній формі або кристалічній формі I або II. У ще одному варіанті здійснення винаходу наданий спосіб для лікування, профілактики або полегшення одного або більше симптомів захворювання, пов'язаного з базофілами, який включає введення пацієнтові, що має або передбачувано має такий стан або захворювання, терапевтично ефективної кількості частинок {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)-бензил)піримідин-5-іл}оцтової кислоти в аморфній формі або кристалічній формі I або II. У ще одному варіанті здійснення винаходу наданий спосіб для лікування, профілактики або полегшення одного або більше симптомів запального захворювання, який включає введення пацієнтові, що має або передбачувано має такий стан або захворювання, терапевтично ефективної кількості частинок {4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в аморфній формі або кристалічній формі I або II. Розлади й захворювання, виліковні частинками, представленими в даному описі, включають, але не обмежуються (1) запальні або алергічні захворювання, включаючи системну анафілаксію й розлади гіперчутливості, атопічний дерматит, кропивницю, алергії на ліки, алергії на укуси комах, харчову алергію (включаючи глютенову хворобу й подібні) і мастоцитоз; (2) запальні захворювання кишечнику, включаючи хворобу Крона, виразковий коліт, ілеїт і ентерит; (3) васкуліти й синдром Бехчета; (4) псоріаз і запальні дерматози, включаючи дерматит, екзему, атопічний дерматит, алергічний контактний дерматит, кропивницю, вірусні шкірні патології, включаючи виникаючі в результаті папіломавірусу людини, ВІЛ або RLV інфекцію, бактеріальні, грибні й інші паразитарні шкірні патології й шкірний червоний вовчак; (5) астму й респіраторні алергічні захворювання, включаючи алергічну астму, астму, викликану фізичними навантаженнями, алергічний риніт, середній отит, алергічний кон’юнктивіт, гіперчутливі захворювання легенів і хронічні обструктивні хвороби легенів; (6) аутоімунні захворювання, включаючи артрит (включаючи ревматоїдний і псоріатичний), системний червоний вовчак, діабет I типу, міастенію гравіс, розсіяний склероз, хворобу Грейвса й гломерулонефрит; (7) відторгнення трансплантата (включаючи відторгнення алотрансплантата й хворобу "трансплантат-проти-хазяїна"), наприклад, відторгнення шкірного трансплантата, відторгнення 19 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 трансплантата солідних органів, відторгнення трансплантата кісткового мозку; (8) лихоманку; (9) серцево-судинні захворювання, включаючи гостру серцеву недостатність, гіпотензію, гіпертензію, стенокардію, інфаркт міокарда, кардіоміопатію, застійну серцеву недостатність, атеросклероз, ішемічну хворобу серця, рестеноз і судинний стеноз; (10) захворювання судин головного мозку, включаючи травматичне ушкодження головного мозку, інсульт, ішемічнореперфузійне ушкодження й аневризму; (11) рак молочної залози, шкіри, передміхурової залози, шийки матки, матки, яєчників, яєчок, сечового міхура, легенів, печінки, гортані, порожнини рота, товстої кишки й шлунково-кишкового тракту (наприклад, стравоходу, шлунка, підшлункової залози), головного мозку, щитовидної залози, крові й лімфатичної системи; (12) фіброз, захворювання сполучної тканини й саркоїдоз, (13) статеві й репродуктивні стани, включаючи еректильну дисфункцію; (14) захворювання шлунково-кишкового тракту, включаючи гастрит, виразки, нудоту, панкреатит і блювання; (15) неврологічні розлади, включаючи хворобу Альцгеймера; (16) розлади сну, включаючи безсоння, сонливість, синдром апное уві сні й синдром Піквіка; (17) біль; (18) захворювання нирок; (19) захворювання очей, включаючи глаукому; і (20) інфекційні захворювання, включаючи ВІЛ. У певних варіантах здійснення винаходу захворювання вибирають із групи, яка складається з астми, алергічної астми, астми, індукованої фізичним навантаженням, алергічного риніту, цілорічного алергічного риніту, сезонного алергічного риніту, атопічного дерматиту, контактної гіперчутливості, контактного дерматиту, кон’юнктивіту, алергічного кон’юнктивіту, еозинофільного бронхіту, харчової алергії, еозинофільного гастроентериту, запального захворювання кишечнику, виразкового коліту, хвороби Крона, мастоцитозу, гіпер-IgE-синдрому, системного червоного вовчака, псоріазу, акне, розсіяного склерозу, відторгнення трансплантата, реперфузійного ушкодження, хронічного обструктивного захворювання легенів, синдрому Чарга-Стросса, синуситу, базофільного лейкозу, хронічної кропивниці, базофільного лейкоцитозу, псоріазу, екземи, ХОХЛ (хронічної обструктивної хвороби легенів), артриту, ревматоїдного артриту, псоріатичного артриту й остеоартриту. У певних варіантах здійснення винаходу захворюванням є астма, астма, індукована фізичним навантаженням, алергічний риніт, атопічний дерматит, хронічні обструктивні хвороби легенів або алергічний кон’юнктивіт. У певних варіантах здійснення винаходу захворюванням є синдром Чарга-Стросса або синусит. Залежно від захворювання, яке піддається лікуванню, і стану пацієнта тверді частинки або композиції, представлені в даному описі, можуть вводитися пероральним, парентеральним (наприклад, внутрішньом'язовим, інтраперитонеальним, внутрішньовенним шляхом, ICV, ін'єкцією або інфузією у цистерну, підшкірною ін'єкцією або імплантатом), інгаляційним, назальним, вагінальним, ректальним, сублінгвальним або місцевим (наприклад, трансдермальним або місцевим) шляхами введення й можуть бути рецептовані окремо або разом у придатних лікарських формах з фармацевтично прийнятними добавками й носіями, придатними для кожного шляху введення. Також надане введення твердих частинок, представлених у даному описі, у композиціях депо, у яких активний інгредієнт вивільняється протягом попередньо визначеного періоду часу. У лікуванні, профілактиці або полегшенні одного або більше симптомів астми, алергічного риніту, екземи, псоріазу, атопічного дерматиту, лихоманки, сепсису, системного червоного вовчака, діабету, ревматоїдного артриту, розсіяного склерозу, атеросклерозу, відторгнення трансплантата, запальних захворювань кишечнику, раку або інших станів, захворювань або розладів, асоційованих з CRTH2 і/або одним або більше рецепторами PGD 2, відповідний рівень дозування звичайно становить від близько 0,001 до 100 мг на кг маси тіла пацієнта на добу (мг/кг на добу), від близько 0,01 до близько 75 мг/кг на добу, від близько 0,1 до близько 50 мг/кг на добу, від близько 0,5 до близько 25 мг/кг на добу або від близько 1 до близько 20 мг/кг на добу, які можна вводити в разовій або декількох дозах. У цьому діапазоні дозування може становити від 0,005 до 0,05, від 0,05 до 0,5 або від 0,5 до 5,0, від 1 до 15, від 1 до 20 або від 1 до 50 мг/кг на добу. У певних варіантах здійснення винаходу рівень дозування становить від близько 0,001 до 100 мг/кг на добу. У певних варіантах здійснення винаходу рівень дозування становить від близько 0,01 до близько 75 мг/кг на добу. У певних варіантах здійснення винаходу рівень дозування становить від близько 0,1 до близько 50 мг/кг на добу. У певних варіантах здійснення винаходу рівень дозування становить від близько 0,5 до близько 25 мг/кг на добу. У певних варіантах здійснення винаходу рівень дозування становить від близько 1 до близько 20 мг/кг на добу. Для перорального введення фармацевтична композиція може бути представлена у формі таблеток, які містять від 1,0 до 1000 мг активного інгредієнта, особливо близько 1, близько 5, 20 UA 99138 C2 5 10 15 20 25 30 35 40 45 50 55 60 близько 10, близько 15, близько 20, близько 25, близько 50, близько 75, близько 100, близько 150, близько 200, близько 250, близько 300, близько 400, близько 500, близько 600, близько 750, близько 800, близько 900 і близько 1000 мг активного інгредієнта для симптоматичної корекції дози для пацієнта, що піддається лікування. Композиції можна вводити за схемою від 1 до 4 разів на добу, включаючи один, два, три рази або чотири рази на добу. Однак, зрозуміло, що специфічний рівень дозування й частота введення для будь-якого певного пацієнта можуть варіюватися й будуть залежати від множини факторів, включаючи активність специфічних використовуваних сполук, метаболічну стабільність і тривалість дії такої сполуки, вік, масу тіла, загальний стан здоров'я, стать, харчування, тип і час введення, швидкість екскреції, комбінації лікарських засобів, тяжкість певного стану й організм, що піддається лікуванню. Також у даному описі надані способи модуляції CRTH2 і/або одного або більше інших рецепторів PGD2, які включають контактування рецептора(ів) із частинками в одній або більше твердих формах, як представлено в даному описі. В одному варіанті здійснення винаходу рецептор(и) експресуються клітиною. Частинки, представлені в даному описі, також можуть бути скомбіновані або використані в комбінації з іншими засобами, застосовними в лікуванні, профілактиці або полегшенні одного або більше симптомів захворювання або стану, для яких частинки, представлені в даному описі, є застосовними, включаючи астму, алергічний риніт, екзему, псоріаз, атопічний дерматит, лихоманку, сепсис, системний червоний вовчак, діабет, ревматоїдний артрит, розсіяний склероз, атеросклероз, відторгнення трансплантата, запальні захворювання кишечнику, рак і патологічні стани, визначені вище. Такі інші засоби, або лікарські засоби, можуть вводитися шляхом і в кількості, звичайно використовуваних для них, одночасно або послідовно із частинками, представленими в даному описі. Коли частинки, представлені в даному описі, використовуються одночасно з одним або більше лікарськими засобами, може використовуватися фармацевтична композиція, яка містить такі інші лікарські засоби на доповнення до частинок, представлених у даному описі, але не обов'язково. Відповідно, фармацевтичні композиції, представлені в даному описі, включають такі, які також містять один або більше інших активних інгредієнтів або терапевтичних засобів на доповнення до частинок, представлених у даному описі. Масове співвідношення частинок, представлених у даному описі, до другого активного інгредієнта може варіюватися й буде залежати від ефективної дози кожного інгредієнта. Звичайно використовується ефективна доза кожного. Отже, наприклад, коли частинки, представлені в даному описі, комбінують із НПВС, масове співвідношення твердих частинок до НПВС може варіюватися від близько 1000:1 до близько 1:1000 або від близько 200:1 до близько 1:200. Комбінації частинок, представлених у даному описі, і інших активних інгредієнтів звичайно знаходяться у рамках вищевказаного діапазону, але в кожному випадку повинна використовуватися ефективна доза кожного активного інгредієнта ПРИКЛАДИ Частинки кислоти формули I у наступних прикладах характеризували дифрактометрією рентгенівського випромінювання на порошку (XRPD), диференціальною скануючою калориметрією (DSC), термогравіметрією (TGA) і скануючою електронною мікроскопією (SEM). Дифрактограму рентгенівського випромінювання на порошку записували за допомогою дифрактометра рентгенівського випромінювання на порошку Rigaku MiniFlex (Rigaku Americas, The Woodlands, TX). Випромінюванням було CuKa (40 кВ, 40 мА). Дані одержували при кімнатній температурі від 3 до 45 градусів, подвійному куті зближення 0,02 градуса на крок і 0,6 секунд на крок. Зразки одержували на скляних тримачах зразків у вигляді тонкого шару порошкоподібного матеріалу без розчинника. Диференціальну скануючу калориметрію проводили з використанням Mettler 850, TA 2920. Зразки поміщали в герметичні алюмінієві лотки для аналізів з порожнім алюмінієвим лотком як контролем. Швидкість нагрівання 10º/хв. використовували в діапазоні температур від 30ºС до 280ºС. Термогравіметричний аналіз також проводили на Mettler 850, TA 2920. Зразки поміщали в керамічний або алюмінієвий лоток для зразків. Швидкість нагрівання 20º/хв. використовували в діапазоні температур від 20ºС до 600ºС. Приклад 1 Визначення розчинності {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти Насичені розчини {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти формули I у розчинниках, перерахованих у таблиці 1, 21 UA 99138 C2 5 10 15 20 одержували з кислоти переважно у формі I при 25 і 50ºС. Концентрацію кожного насиченого розчину визначали з використанням ВЕРХ, і результати підсумовані в таблиці 1. Приклад 2 Одержання {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)-бензил)піримідин-5іл}оцтової кислоти форми I Густу суспензію {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)-бензил)піримідин5-іл}оцтової кислоти в метанолі перемішували протягом ночі при кімнатній температурі. Потім частинки фільтрували, промивали гексаном і сушили. Дифрактограма рентгенівського випромінювання на порошку частинок проілюстрована на фіг. 1. Частинки мали характерні піки XRP дифракції, виражені в подвійних кутах зближення при приблизно 9,8, 13,1, 22,0 і 26,4º, передбачаючи, що частинки є кристалічними. Як показано на фіг. 4, частинки являють собою довгі голчасті кристали розміром від близько 1 до близько 5 мкм. Диференціальна скануюча калориметрична термограма частинок проілюстрована на фіг. 2. Частинки мають ендотерму з піковою температурою 223,8ºС і температурою початку розкладання 220,2ºС. Термограма термогравіметричного аналізу частинок у формі I показана на фіг. 3. Частинки є дуже стабільними й не проявляють суттєвої втрати маси до розкладання близько 200ºС. Середній розмір частинок і розподіл за розміром частинок у формі I вимірювали з використанням Microtrac S3000 (Microtrac Inc., Montgomeryville, PA). Результати показані на фіг. 5 і підсумовані в таблиці 2. Частинки у формі I мають середній розмір частинок (MV) 6,495 мкм і коефіцієнт однорідності 3,24. Розчинник Ацетонітрил Хлороформ Дихлорметан ДМФА 1,4-діоксан Метанол 2-метоксіетанол MIBK Толуол Гексан Ацетон н-бутанол MTBE ДМСО Етанол Етилацетат Етилформіат Гептан Ізобутилацетат Ізопропілацетат 1-пропанол Ізопропанол Вода МЕК ТГФ ТАБЛИЦЯ 1 РОЗЧИННІСТЬ Розчинність (мг/мл) 25ºС 50ºС 0,24 0,94 0,17 0,35 0,07 >50 >50 3,37 9,83 2,23 3,04 5,35 8,55 0,54 1,80 0,00 0,03 0,00 0,00 2,62 3,34 0,79 2,11 0,09 0,41 >50 >50 1,09 2,25 0,53 1,27 0,39 1,51 0,00 0,00 0,20 0,83 0,27 0,78 0,79 2,41 0,77 1,96 0,00 0,02 1,98 4,26 11,32 32,72 25 22 UA 99138 C2 ТАБЛИЦЯ 2 РОЗПОДІЛ ЧАСТИНОК ЗА РОЗМІРОМ Процентиль Розмір частинок (мкм) 10 1,807 20 2,393 30 3,004 40 3,713 50 4,627 60 5,852 70 7,498 80 9,825 90 13,70 95 17,57 5 10 15 20 25 30 35 Приклад 3 Одержання {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)-бензил)піримідин-5іл}оцтової кислоти у формі II Розчин {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)-піримідин-5іл}оцтової кислоти (50 мг) у ДМФА (0,5 мл) одержували з кислоти переважно у формі I. Потім розчин додавали до 8 мл МТВЕ при кімнатній температурі. Після перемішування при кімнатній температурі протягом додаткових 15 хвилин суміш ставала густою суспензією. Потім частинки фільтрували, промивали гексаном і сушили. Дифрактограма рентгенівського випромінювання на порошку частинок проілюстрована на фіг. 6. Частинки мали характерні піки XRP дифракції, виражені в подвійному куті зближення приблизно 31,7º, передбачаючи, що частинки знаходяться у кристалічній формі (форма II), яка відрізняється від форми I. Кристалічні характеристики частинок форми II показані на фіг. 7. Приклад 4 Зрівноважування фаз На основі розчинності {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в різних розчинниках, як визначено в прикладі 1, частинки кислоти переважно у формі I піддавали впливу розчинників, перерахованих у таблиці 3, при 25 або 50ºС протягом достатнього періоду часу. Частинки фільтрували й сушили й потім аналізували з використанням XRPD. Результати підсумовані в таблиці 3. Приклад 5 Зрівноважування фаз між формою I і формою II Частинки форми II одержували у вигляді густої суспензії, як описано в прикладі 2. Коротко, розчин {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)-бензамідо)бензил)піримідин-5-іл}оцтової кислоти (50 мг) у ДМФА (0,5 мг) додавали до 8 мл МТВЕ для одержання густої суспензії частинок форми II. Частинки форми I (20 мг) потім додавали до суспензії і одержану суспензію перемішували протягом ночі при кімнатній температурі. Потім частинки фільтрували, промивали гексаном і сушили. Частинки аналізували з використанням XRPD. Дифрактограма XRP показана на фіг. 8, вказуючи, що частинки після зрівноважування фаз мали форму I. Приклад 6 Утворення частинок за допомогою випарювання розчинника На основі розчинності {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти в різних розчинниках, як визначено в прикладі 1, кислоту переважно у формі I розчиняли в системі розчинників, перерахованих у таблиці 4. Розчиннику дозволяли випаровуватися з розчину при 25 або 50ºС. Одержані частинки одержували фільтрацією й аналізували з використанням XRPD. Результати підсумовані в таблиці 4. 23 UA 99138 C2 ТАБЛИЦЯ 3 КРИСТАЛІЧНА ФОРМА ПІСЛЯ ЗРІВНОВАЖУВАННЯ ФАЗ Речовина, що кристалізується в різних формах Розчинник 25ºС 50ºС Ацетонітрил Форма I Форма I Хлороформ Форма I Форма I Дихлорметан Форма I a ДМФА NA 1,4-діоксан Форма I Форма I Метанол Форма I Форма I 2-метоксіетанол Форма I Форма I MIBK Форма I Форма I Толуол Форма I Форма I Гексан Форма I Форма I Ацетон Форма I Форма I н-бутанол Форма I Форма I МТВЕ Форма I Форма I ДМСО NA Етанол Форма I Форма I Етилацетат Форма I Форма I Етилформіат Форма I Форма I Гептан Форма I Форма I Ізобутилацетат Форма I Форма I Ізопропілацетат Форма I Форма I 1-пропанол Форма I Форма I Ізопропанол Форма I Форма I Вода Форма I Форма I МЕК Форма I Форма I ТГФ Форма I Форма I a NA: не доступно. Зразок не дає якої-небудь або достатньої кількості твердої речовини. 5 10 15 20 Приклад 7 Утворення частинок за допомогою додавання антирозчинника Насичені розчини кислоти формули I у розчинниках, перерахованих у таблиці 5, одержували з кислоти переважно у формі I. Потім до насичених розчинів додавали антирозчинник для одержання осадження. ТГФ, 2-метоксіетанол, ДМСО й ДМФА використовували як розчинники для розчинення частинок форми I, тоді як гексан, МТВЕ, толуол і воду використовували як антирозчинники. Одержані частинки збирали фільтруванням і аналізували з використанням XRPD. Результати підсумовані в таблиці 5. Приклад 8 Утворення частинок при додаванні зворотного антирозчинника Насичені або майже насичені розчини кислоти формули I у розчинниках, перерахованих у таблиці 6, одержували з кислоти, переважно у формі I. Потім розчинники, кожний, додавали до більшої кількості змішуваного антирозчинника. ТГФ, 2-метоксіетанол, ДМСО й ДМФА використовували як розчинники для розчинення твердих частинок, тоді як гексан, MTBE, толуол і воду використовували як антирозчинники. Одержані частинки збирали фільтрацією й аналізували з використанням XRPD. Результати підсумовані в таблиці 6. Приклад 9 Утворення частинок за допомогою холодного гасіння Насичені розчини кислоти формули I у розчинниках, перерахованих у таблиці 7, одержували з кислоти переважно у формі I при близько 30-50ºС. Розчини гасили холодом на бані ацетон/лід. Одержані частинки збирали фільтрацією й аналізували з використанням XRPD. Результати підсумовані в таблиці 7. 25 24 UA 99138 C2 ТАБЛИЦЯ 4 КРИСТАЛІЧНА ФОРМА ПРИ ВИПАРЮВАННІ РОЗЧИННИКА Речовина, що кристалізується в різних формах Розчинник 25ºС 50ºС Ацетонітрил Форма I Форма I a Хлороформ NA NA Дихлорметан NA ДМФА Форма I Форма I 1,4-діоксан Форма I Форма I Метанол Форма I Форма I 2-метоксіетанол Форма I Форма I MIBK Форма I Форма I Толуол NA NA Гексан NA NA Ацетон Форма I Форма I н-бутанол NA Форма I МТВЕ NA Форма I ДМСО Форма I Форма I Етанол Форма I Форма I Етилацетат Форма I Форма I Етилформіат Аморфна NA Гептан NA NA Ізобутилацетат Форма I Форма I Ізопропілацетат Форма I Форма I 1-пропанол Форма I Форма I Ізопропанол Форма I Форма I Вода NA NA МЕК Форма I Форма I ТГФ Форма I Форма I а NA: не доступно. Зразок абсолютно не давав або не давав достатньої кількості твердої речовини. ТАБЛИЦЯ 5 КРИСТАЛІЧНА ФОРМА ПІСЛЯ ДОДАВАННЯ АНТИРОЗЧИННИКА Речовина, що кристалізується в Розчинник Антирозчинник різних формах ТГФ Гексан Форма I a ТГФ МТВЕ NA ТГФ Толуол NA ТГФ Вода Форма I 2-метоксіетанол Гексан NA 2-метоксіетанол МТВЕ NA 2-метоксіетанол Толуол NA 2-метоксіетанол Вода NA ДМСО Гексан NA ДМСО МТВЕ NA ДМСО Толуол NA ДМСО Вода Переважно аморфний ДМФА Гексан NA ДМФА МТВЕ Невелика кількість (?) ДМФА Толуол NA ДМФА Вода Форма I а NA: не доступно. Зразок абсолютно не давав або не давав достатньої кількості твердої речовини. 5 Приклад 10 Частинки при кристалізації із циклами нагрівання й охолодження 25 UA 99138 C2 5 Насичені розчини кислоти формули I у розчинниках, перерахованих у таблиці 8, одержували з кислоти, переважно у формі I, при близько 30-50ºС. Розчини повільно прохолоджували з використанням програмованої циркулюючої бані до одержання густої суспензії. Потім одержану густу суспензію спочатку нагрівали до 50ºС протягом 2 годин, з наступним охолодженням до 25ºС протягом 2 годин. Такий процес нагрівання й охолодження повторювали протягом ночі. Одержані частинки потім збирали фільтрацією й аналізували з використанням XRPD. Результати підсумовані в таблиці 8. ТАБЛИЦЯ 6 КРИСТАЛІЧНА ФОРМА ПРИ ЗВОРОТНОМУ ДОДАВАННІ АНТИРОЗЧИННИКА Речовина, що кристалізується в Розчинник Антирозчинник різних формах ТГФ (1 мл) Гексан (4 мл) Форма I a ТГФ (0,5 мл) МТВЕ (8 мл) NA ТГФ (0,5 мл) Толуол (8 мл) NA ТГФ (0,5 мл) Вода (4 мл) Форма I 2-метоксіетанол (0,5 мл) Гексан (8 мл) Форма I 2-метоксіетанол (0,5 мл) МТВЕ (8 мл) NA 2-метоксіетанол (0,5 мл) Толуол (8 мл) NA 2-метоксіетанол (0,5 мл) Вода (8 мл) NA ДМСО (0,5 мл) Гексан (8 мл) NA ДМСО (0,5 мл) МТВЕ (8 мл) Невелика кількість (?) ДМСО (0,5 мл) Толуол (8 мл) NA ДМСО (1 мл) Вода (4 мл) Форма I ДМФА (0,5 мл) Гексан (8 мл) NA ДМФА (0,5 мл) МТВЕ (8 мл) Форма II ДМФА (0,5 мл) Толуол (8 мл) NA ДМФА (1 мл) Вода (4 мл) Форма I а NA: не доступно. Зразок абсолютно не давав або не давав достатньої кількості твердої речовини. ТАБЛИЦЯ 7 КРИСТАЛІЧНА ФОРМА ШВИДКОГО ОХОЛОДЖЕННЯ Речовина, що кристалізується в Розчинник різних формах a ДМФА NA 1,4-діоксан NA 2-метоксіетанол NA Ацетонітрил Форма I Метанол Форма I н-бутанол NA 1-пропанол Форма I Ізопропанол NA МЕК Форма I ТГФ NA а NA: не доступно. Зразок абсолютно не давав або не давав достатньої кількості твердої речовини. 10 26 UA 99138 C2 ТАБЛИЦЯ 8 КРИСТАЛІЧНА ФОРМА ДЛЯ ВИПАРЮВАННЯ Речовина, що кристалізується в різних Розчинник формах Ацетонітрил Форма I 1,4-діоксан Форма I 2-метоксіетанол Форма I MIBK Форма I Ацетон Форма I н-бутанол Форма I Етанол Форма I 1-пропанол Форма I Ізопропанол Форма I Вода/ТГФ (3:7, об./об.) Форма I МЕК Форма I ТГФ Форма I 5 10 15 20 25 30 35 40 Приклад 11 Аналіз конкурентного зв'язування радіоліганду Здатність зв'язування й селективність амінних солей 4,6-біс(диметиламіно)-2-(4-(4(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтової кислоти, представленої в даному описі, оцінювали з використанням аналізу конкурентного зв'язування радіоліганду зі стабільно трансфекованими клітинними лініями, експресуючими CRTH2 або DP1. Простагландин D2 і 13,14-дигідро-15-кето PGD2 одержували від Cayman Chemical (Ann Arbor, 3 MI). Мічений радіоактивною міткою PGD 2 (5,6,8,9,12,14,15- Н(N)) зі специфічною активністю 160 Кі/ммоль одержували від PerkinElmer (Boston, MA). Середовище для культур клітин RPMI 1640, буфер HEPES, фосфатний буферний розчин (PBS), L-глутамін і розчин пеніцилінустрептоміцину одержували від Mediatech (Herndon, VA). Ембріональну сироватку телят (FCS) одержували від Cambrex (Walkersville, MD). Пуроміцин одержували від Invitrogen (San Diego, CA). Полі(етиленімін) (PEI) одержували від Acros Organics (Morris Plains, NJ). Очищені моноклональні щурячі антилюдські антитіла до CRTH2 (BM16), Rat IgG2a, κ (клон R35-95) і козячі антищурячі Ig-FITC одержували від Becton Dickinson Biosciences (San Diego, CA). BSA (фракція V) і азид натрію одержували від Sigma Chemical Company (St. Louis). Стабільні клітинні лінії CRTH2 і DP1 створювали відповідно до методики, описаної Sugimoto et al. (J. Pharm. Exp. Therap. 2003, 305, 347-352). Такі клітинні лінії тримали в культуральному середовищі RPMI 1640, яке містить буфер HEPES (25 мм), FCS (10%), L-глутамін (2 мм), пеніцилін (10 МО/мл), стрептоміцин (100 мкг/мл) і пуроміцин (1 мкг/мл). Поверхневу експресію CRTH2 на трансфекованих клітинних лініях відслідковували періодично протягом культивування й перед кожним аналізом конкурентного зв'язування радіоліганду. Клітини, експресуючі CRTH2, і нетрансфековані клітини інкубували на льоду або з очищеними анти-CRTH2 антитілами (клон ВМ16), або з ізотиповими контрольними антитілами (Rat IgG2a,κ) протягом 15 хв. Потім клітини промивали в 2 мл буфера FACS (PBS, що містить 1% BSA (фракція V) і 0,1% азид натрію. Клітини надалі інкубували на льоду з FITCкон’югованими антищурячими антитілами (козячі антищурячі Ig-FITC). Після промивання холодним буфером FACS клітини аналізували з використанням аналізатора FACScan II і програмного забезпечення CellQuest, обидва від Becton Dickinson (Mountain View, CA). Функціональність клітин, трансфекованих рецепторами, також оцінювали безпосереднім вимірюванням мобілізації кальцію у відповідь на PGD2, як описано (Sugimoto et al., J.Pharm.Exp.Therap. 2003, 305, 347-352; Sugimoto et al., Eur.J.Pharmacol. 2005, 524, 30-37). Аналізи зв'язування радіоліганду проводили відповідно до методів Sugimoto et al. (J.Pharm.Exp.Therap. 2003, 305, 347-352; Eur.J.Pharmacol. 2005, 524, 30-37). Тестовані сполуки розчиняли в ДМСО в концентрації 100 мМ у вигляді основного розчину. Серійні розведення від 10 мкМ одержували в зв’язувальному буфері перед аналізом. Трансфековані клітини ресупендували в зв’язувальному буфері (50 мМ Tris-HCl, 40 мМ MgCl2 і 0,1% альбуміну бичачої 6 сироватки, при рН 7,4) у концентрації 4 10 /мл при кімнатній температурі. Потім транфековані клітини висівали в U-донні поліпропіленові 96-ямкові планшети (Fisher) шляхом додавання 50 3 мкл суспензії клітин, з подальшим додаванням 10 мкл H-PGD2, 10 мкл розчину тестованої сполуки в ряді розведень концентрації або контролю, 30 мкл зв’язувального буфера для 3 доведення остаточного об'єму до 100 мкл. Остаточна концентрація H-PGD2 у кожній ямці 27 UA 99138 C2 5 10 15 20 становила 1 нМ. Після інкубації протягом 1 години при кімнатній температурі з акуратним струшуванням, суспензію клітин переносили у фільтрувальні планшети (Millipore, MA), які попередньо зволожували 0,5% буфером PEI. Осади клітин промивали три рази зв’язувальним TM буфером, і планшетам дозволяли висохнути на повітрі. Сцинтилятор (50 мкл; Microscint 20, Perkin Elmer, Boston, MA) додавали до кожної ямки, і радіоактивність підраховували на TopCount (Packard Bioscience, Meriden, CT). Аналіз даних проводили з використанням графічної TM програми Prizm (GraphPad Software Inc., San Diego, CA). Як показано на фіг. 10 і 11, {4,6біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)піримідин-5-іл}оцтова кислота формули I мала високу спорідненість і селективно зв'язувалася з CRTH2. Приклади, зазначені вище, представлені для того, щоб дати звичайному фахівцеві в галузі техніки повний опис і роз'яснення, як створювати й застосовувати варіанти здійснення винаходу, і не призначені для обмеження рамок опису. Модифікації вищеописаних варіантів здійснення опису, які очевидні фахівцеві в галузі техніки, знаходяться у рамках наступної формули винаходу. Всі публікації, патенти й патентні заявки, зазначені в цій специфікації, включені в даний опис у вигляді посилань, начебто кожна така публікація, патент або патентна заявка були специфічно й окремо представлені для включення в даний опис у вигляді посилання. ФОРМУЛА ВИНАХОДУ 1. Частинки {4,6-біс(диметиламіно)-2-(4-(4-(трифторметил)бензамідо)бензил)-піримідин5-іл}оцтової кислоти формули І: N O N H F3C 25 30 35 40 45 50 N(CH 3)2 N COOH N(CH 3)2 (I) у кристалічній формі І; де частинки мають середній розмір частинок, що змінюється від близько 0,1 до близько 150 мкм, від близько 0,5 до близько 100 мкм, від близько 1 до близько 50 мкм, від близько 1 до близько 25 мкм, від близько 1 до близько 20 мкм, від близько 1 до близько 10 мкм, від близько 2 до близько 10 мкм або від близько 2 до близько 7,5 мкм; і/або частинки мають коефіцієнт однорідності, який змінюється від близько 1 до близько 20, від близько 1 до близько 10, від близько 2 до близько 5 або від близько 3 до близько 4; і/або частинки мають насипну масу після ущільнення, яка змінюється від близько 0,1 до близько 1,0 г/мл, від близько 0,15 до близько 0,8 г/мл, від близько 0,2 до близько 0,6 г/мл, від близько 0,25 до близько 0,5 г/мл або від близько 0,3 до близько 0,4 г/мл; і/або частинки містять не менше близько 95 %, не менше близько 97 %, не менше близько 98 %, не менше близько 99 % або не менше близько 99,5 % по масі кислоти формули І; і/або частинки мають залишковий вміст органічного розчинника не більше близько 5 %, не більше близько 2 %, не більше близько 1 %, не більше близько 0,9 %, не більше близько 0,8 %, не більше близько 0,7 %, не більше близько 0,6 %, не більше близько 0,5 %, не більше близько 0,4 %, не більше близько 0,3 %, не більше близько 0,2 %, не більше близько 0,1 %, не більше близько 0,05 % або не більше близько 0,01 % по масі; і/або частинки мають залишковий вміст метанолу не більше близько 100000 ч/млн., не більше близько 10000 ч/млн., не більше близько 5000 ч/млн., не більше близько 4000 ч/млн., не більше близько 3000 ч/млн., не більше близько 2000 ч/млн., не більше близько 1000 ч/млн., не більше близько 500 ч/млн. або не більше близько 100 ч/млн; і/або частинки містять не менше близько 90 %, не менше близько 95 %, не менше близько 98 %, не менше близько 99 % або не менше ніж 99,5 % по масі частинок у кристалічній формі І. 2. Частинки за п. 1, де частинки мають дифрактограму рентгенівського випромінювання на порошку, по суті як показано на фіг. 1. 3. Частинки за п. 1, де частинки мають дифрактограму рентгенівського випромінювання на порошку з одним або більше піками, вираженими в подвійному куті зближення приблизно 9,8°, 13,1°, 22,0° і 26,4°. 4. Частинки за пп. 1, де частинки мають дифрактограму рентгенівського випромінювання на порошку з піком, вираженим у подвійному куті зближення приблизно 22,0°±0,1°. 5. Частинки за п. 1, де частинки мають термограму диференціальної скануючої калориметрії, як показано на фіг. 2. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюParticulates of a crth2 antagonist
Автори англійськоюLy, Tai, Wei, Li, Hui-yin
Назва патенту російськоюЧастичка антагониста crth2 (варианты)
Автори російськоюЛай Тай Вей, Ли Хой-инь
МПК / Мітки
МПК: A61K 31/33, C07D 239/48, A61P 29/00, A61P 11/06
Мітки: антагоніста, частинка, варіанти, crth2
Код посилання
<a href="https://ua.patents.su/38-99138-chastinka-antagonista-crth2-varianti.html" target="_blank" rel="follow" title="База патентів України">Частинка антагоніста crth2 (варіанти)</a>
Попередній патент: Термостабільна композиція для тварин, що містить суміш ферментів
Наступний патент: Спосіб інгібування реакції на етилен у рослин, циклопропенамінні сполуки та їх композиції
Випадковий патент: Пристрій для демонстрації перетворення теплової енергії в механічну












