Спосіб очищення fс-злитого білка
Формула / Реферат
1. Спосіб очищення Fc-злитого білка, що має ізоелектричну точку (рІ) 6,9-9,5, що передбачає наступні стадії:
a) піддавання рідини, що містить зазначений Fc-злитий білок, Білок А- або Білок G-афінній хроматографії;
b) піддавання елюату зі стадії (а) катіонообмінній хроматографії;
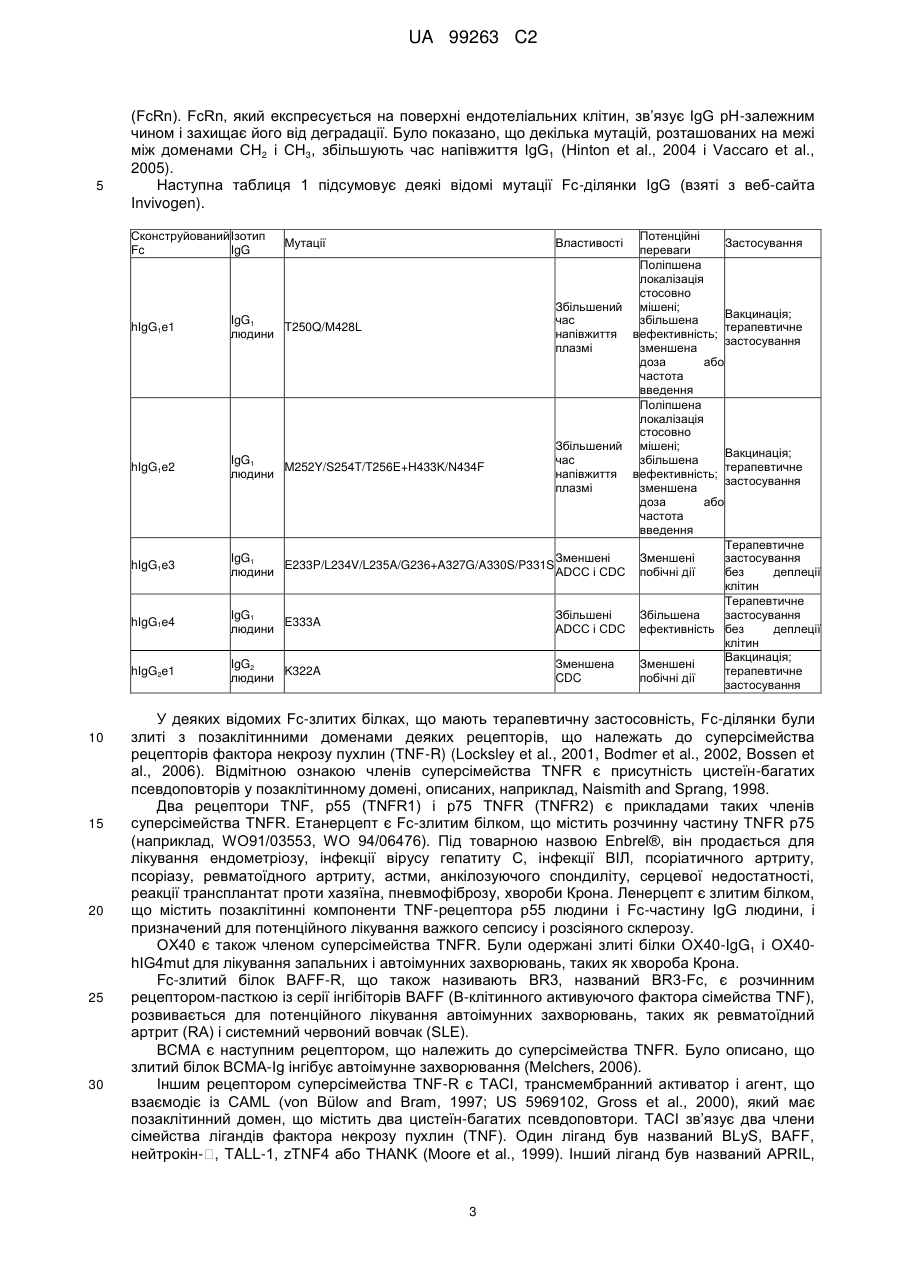
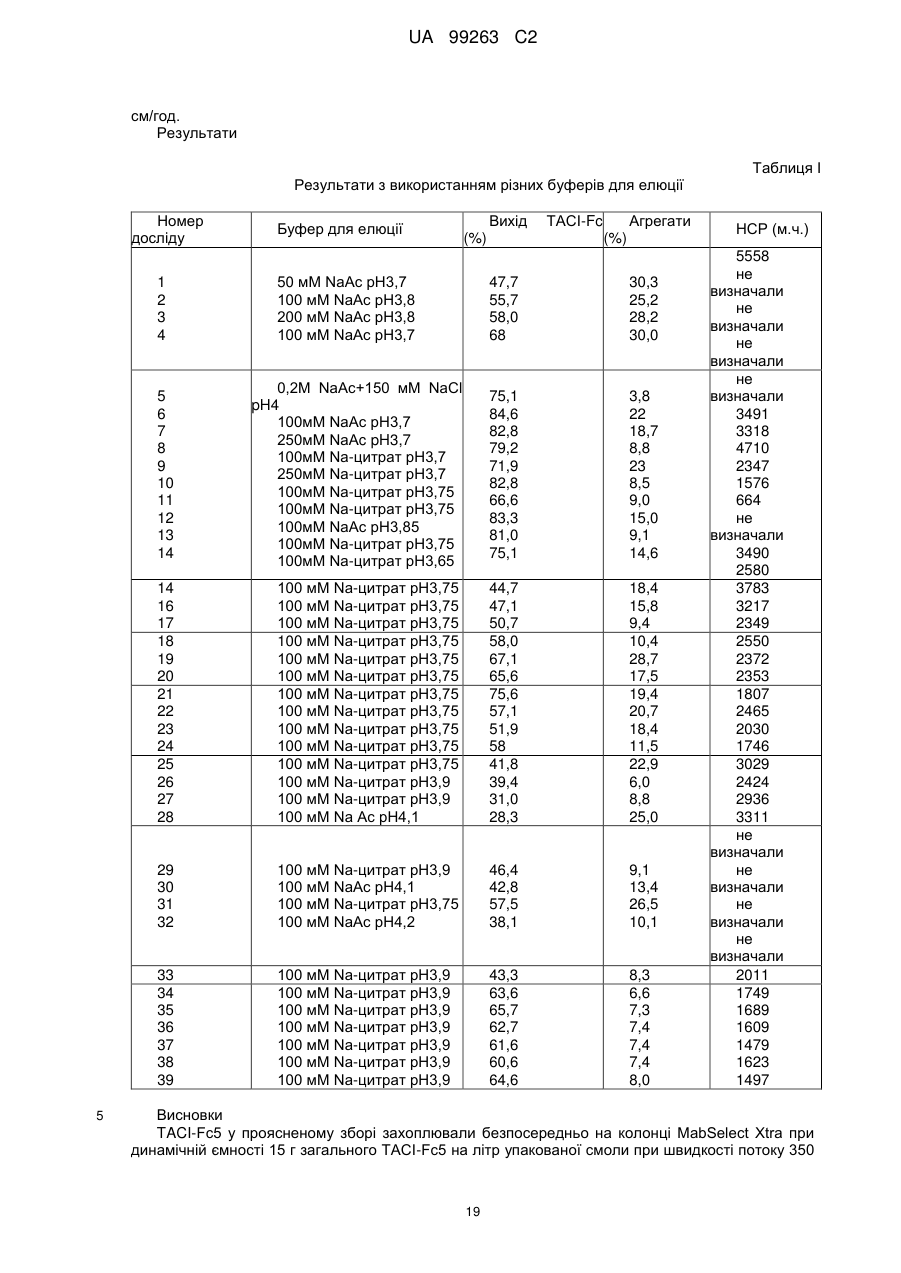
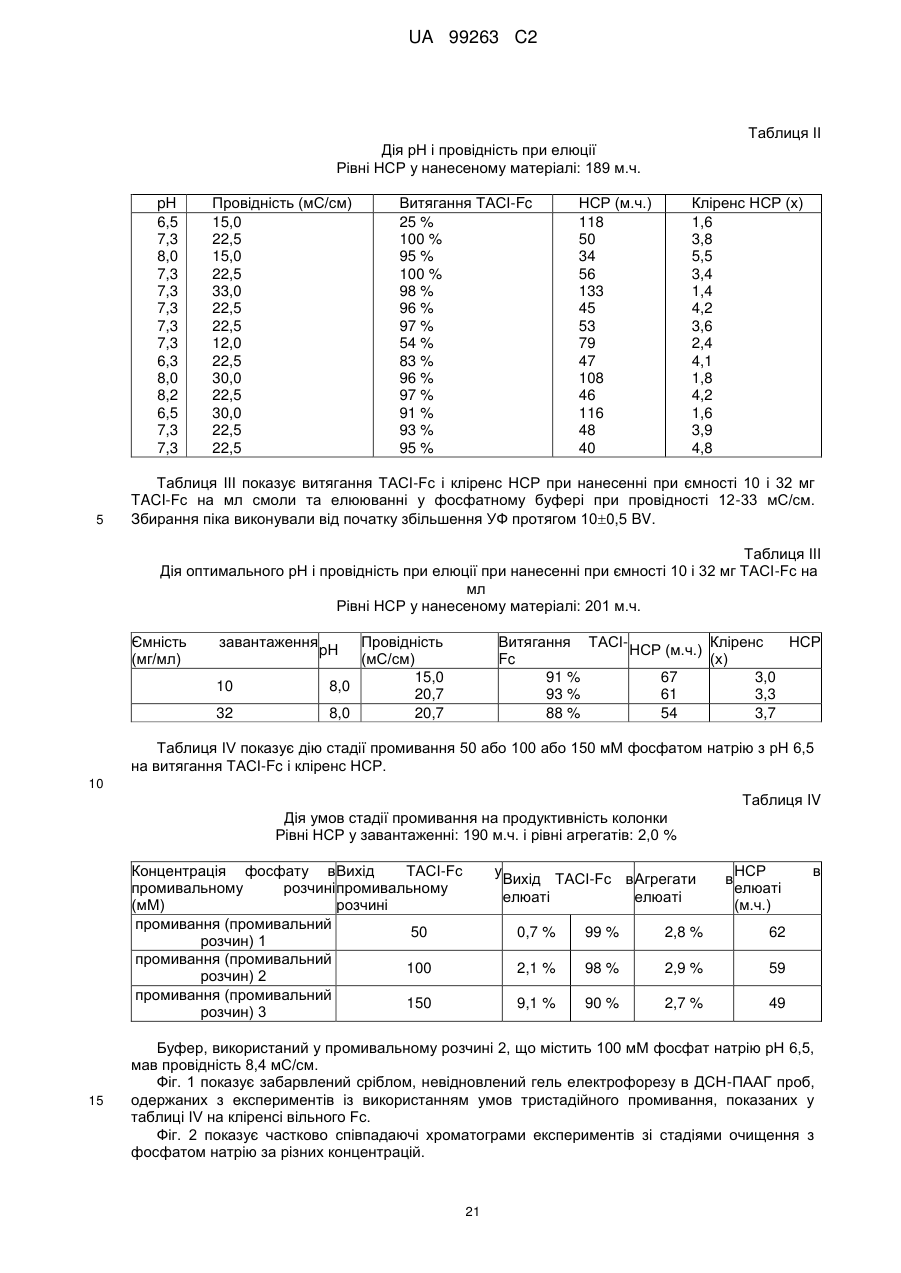
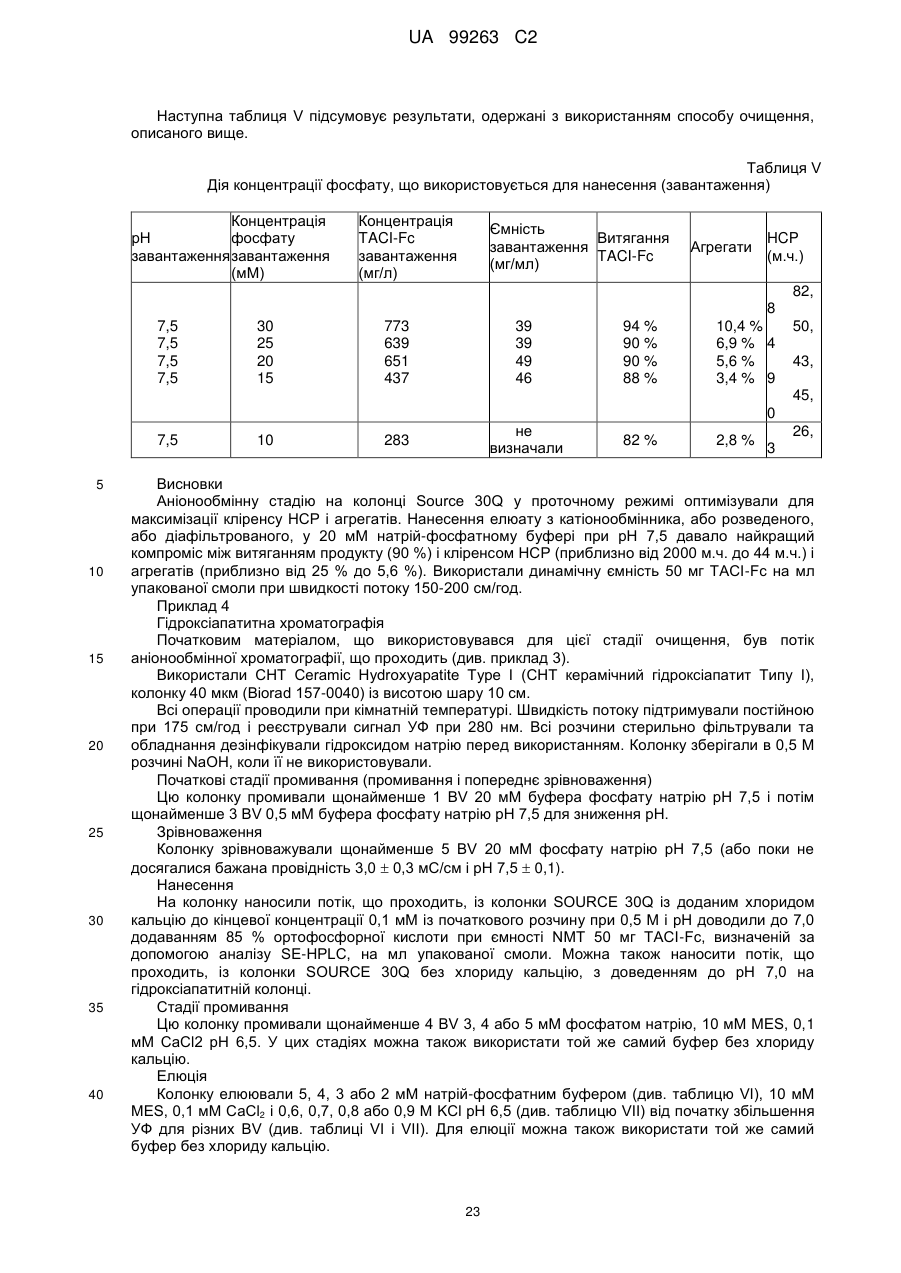
с) піддавання елюату зі стадії (b) аніонообмінній хроматографії; і
d) піддавання фракції стадії (с), що проходить, гідроксіапатитній хроматографії і збирання елюату для одержання очищеного Fc-злитого білка.
2. Спосіб за п. 1, де елюцію в стадії (а) проводять при рН у діапазоні від 2,8 до 4,5.
3. Спосіб за будь-яким із попередніх пунктів, де стадія (b) додатково передбачає:
b.l) промивання катіонообмінної смоли після нанесення буфером, що має рН у діапазоні від 6,0 до 7,0 і провідність у діапазоні від 6 до 10 мС/см; і
b.2) елюцію колонки при рН у діапазоні від 7,3 до 8,2 і провідності у діапазоні від 15 до 22 мС/см.
4. Спосіб за будь-яким із попередніх пунктів, де в стадії (с) зрівноваження і нанесення проводять у буфері, що має провідність 3-4,6 мС/см і рН на одну одиницю нижче, ніж величина рІ Fc-злитого білка.
5. Спосіб за будь-яким із попередніх пунктів, де елюцію в стадії (d) проводять у присутності фосфату натрію в діапазоні концентрацій від 3 до 10 мМ.
6. Спосіб за будь-яким із попередніх пунктів, де елюцію в стадії (d) проводять у присутності хлориду калію в діапазоні від 0,4 до 1 М.
7. Спосіб за будь-яким із попередніх пунктів, де елюцію в стадії (d) проводять при рН у діапазоні від 6 до 7.
8. Спосіб за будь-яким із попередніх пунктів, де стадію (а) проводять на смолі, що містить зшиту агарозу, модифіковану рекомбінантним Білком А або Білком G.
9. Спосіб за будь-яким із попередніх пунктів, де стадію (b) проводять на сильній катіонообмінній смолі.
10. Спосіб за п. 9, де зазначена смола містить зшитий метакрилат, модифікований SО3--групами.
11. Спосіб за будь-яким із попередніх пунктів, де стадію (с) проводять на сильній аніонообмінній смолі.
12. Спосіб за п. 11, де зазначена смола містить полістирол/дивінілбензол, модифікований N+(СН3)3.
13. Спосіб за будь-яким із попередніх пунктів, де стадію (d) проводять на керамічній гідроксіапатитній смолі.
14. Спосіб за п. 13, де керамічна гідроксіапатитна смола містить частинки з розміром 40 мкм.
15. Спосіб за будь-яким із попередніх пунктів, що додатково передбачає щонайменше одну стадію ультрафільтрації.
16. Спосіб за п. 15, де стадію ультрафільтрації проводять між стадіями (b) і (с) і/або після стадії (d).
17. Спосіб за будь-яким із попередніх пунктів, що додатково передбачає приготування Fc-злитого білка у вигляді фармацевтичної композиції.
18. Спосіб за будь-яким із попередніх пунктів, де Fc-злитий білок має рІ 8-9.
19. Спосіб за будь-яким із попередніх пунктів, де Fc-злитий білок має рІ 8,3-8,6.
20. Спосіб за будь-яким із попередніх пунктів, де Fc-злитий білок містить лігандзв'язувальну частину члена суперсімейства рецепторів фактора некрозу пухлини (TNFR).
21. Спосіб за п. 20, де лігандзв'язувальна частина вибрана з позаклітинного домену TNFR1, TNFR2 або їхнього TNF-зв'язувального фрагмента.
22. Спосіб за п. 20, де лігандзв'язувальна частина вибрана з позаклітинного домену BAFF-R, ВСМА, ТАСІ або їхнього фрагмента, що зв'язує щонайменше один із Blys або APRIL.
23. Спосіб за п. 22, де Fc-злитий білок містить поліпептид, вибраний із:
a) амінокислот 34-66 SEQ ID NO: 2;
b) амінокислот 71-104 SEQ ID NO: 2;
c) амінокислот 34-104 SEQ ID NO: 2;
d) амінокислот 30-110 SEQ ID NO: 2;
e) SEQ ID NO: 3;
f) SEQ ID NO: 4;
g) поліпептиду, що кодується полінуклеотидом, який гібридизується з комплементом SEQ ID NO: 5 або 6, або 7 за умов високої суворості; і
h) мутеїну будь-якого із (с), (d), (e) або (f), що має щонайменше 80 % або 85 %, або 90 %, або 95 % ідентичність послідовності з поліпептидом (с), (d), (e) або (f);
де поліпептид зв'язується щонайменше з одним із Blys або APRIL.
24. Спосіб за будь-яким із попередніх пунктів, де Fc-злитий білок містить константну ділянку важкого ланцюга імуноглобуліну.
25. Спосіб за п. 24, де константна ділянка є константною ділянкою імуноглобуліну людини.
26. Спосіб за п. 24 або 25, де імуноглобуліном є IgG1.
27. Спосіб за будь-яким із пп. 23-25, де ця константна ділянка містить шарнірну ділянку, СН2- і СН3-домени.
28. Композиція очищеного Fc-злитого білка, одержана за допомогою способу за будь-яким із попередніх пунктів, де Fc-злитий білок містить поліпептид, вибраний із:
a) амінокислот 34-66 SEQ ID NO: 2;
b) амінокислот 71-104 SEQ ID NO: 2;
c) амінокислот 34-104 SEQ ID NO: 2;
d) амінокислот 30-110 SEQ ID NO: 2;
e) SEQ ID NO: 3;
f) SEQ ID NO: 4;
g) поліпептиду, що кодується полінуклеотидом, який гібридизується з комплементом SEQ ID NO: 5 або 6, або 7 за умов високої суворості; і
h) мутеїну будь-якого із (с), (d), (e) або (f), що має щонайменше 80 % або 85 %, або 90 %, або 95 % ідентичність послідовності з поліпептидом (с), (d), (e) або (f);
де цей поліпептид зв'язується щонайменше з одним із Blys або APRIL; і
де зазначена композиція містить менше 1 % або менше 0,5 % агрегатів білка; і
де зазначена композиція містить менше 1 % або менше 0,5 %, або менше 0,1 % вільного Fc-білка.
Текст
Реферат: Винахід належить до способу очищення Fc-злитого білка, який має ізоелектричну точку (рІ) 6,99,5, що передбачає піддавання рідини, що містить зазначений Fc-злитий білок, білок А- або білок G-афінній хроматографії, з наступною катіонообмінною хроматографією, аніонообмінною хроматографією та гідроксіапатитною хроматографією та збирання елюату для одержання очищеного Fc-злитого білка. UA 99263 C2 (12) UA 99263 C2 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується галузі очищення білків. Конкретніше, він стосується очищення Fcзлитих білків за допомогою Білок А- або Білок G-афінної хроматографії, катіонообмінної хроматографії, аніонообмінної хроматографії і гідроксіапатитної хроматографії. Білки стали комерційно важливими як лікарські засоби, які звичайно називають “біологічними засобами”. Одним із найважливіших завдань є розвиток економічних і ефективних способів для очищення білків у комерційному масштабі. Хоча є багато способів доступних тепер для великомасштабного одержання білків, неочищені продукти, такі як супернатанти культур клітин, містять не тільки бажаний продукт, але також домішки (забруднення), які важко відділити від бажаного продукту. Хоча супернатанти культур клітин, що експресують рекомбінантні білкові продукти, можуть бути менш забрудненими, якщо ці клітини вирощуються в безсироваткому середовищі, білки клітини-хазяїна (НСР) все ще вимагають елімінації під час процесу очищення. Крім того, органи охорони здоров’я вимагають високих стандартів чистоти для білків, призначених для введення людині. Багато способів очищення містять стадії, що вимагають застосування низького або високого рН, високих концентрацій солей або інших надзвичайних умов, які можуть ставити під загрозу біологічну активність цього білка. Відомий ряд хроматографічних систем, які є широко застосовними для очищення білків. Системи іонообмінної хроматографії використовуються для розділення білків передусім на основі відмінностей у заряді. В іонообмінній хроматографії заряджені ділянки на поверхні розчиненої речовини атрагуються протилежними зарядами, приєднаними до хроматографічного матриксу, за умови, що іонна сила буфера, який оточує, є низькою. Елюція звичайно досягається збільшенням іонної сили (тобто провідності) цього буфера для конкуренції з розчиненою речовиною за заряджені сайти іонообмінного матриксу. Зміна рН і, отже, зміна заряду розчиненої речовини є іншою шляхом досягнення елюції цієї розчиненої речовини. Зміна продуктивності або рН може бути поступовою (градієнтна елюція) або ступінчастою (ступінчаста елюція). Аніонообмінники можуть класифікуватися як слабкі або сильні. Зарядженою групою на слабкому аніонообміннику є слабка основа, яка стає депротонованою і, отже, втрачає свій заряд при високому рН. ДЕАЕ-сефароза є прикладом слабкого аніонообмінника, де аміногрупа може бути позитивно зарядженою нижче рН ~ 9 і поступово втрачає свій заряд при вищих величинах рН. Діетиламіноетил (ДЕАЕ) або діетил(2-гідроксипропіл)аміноетил (QAE) мають, наприклад, хлорид як протиіон. З іншого боку, сильний аніонообмінник містить сильну основу, яка залишається позитивно зарядженою протягом діапазону рН, що звичайно використовується для іонообмінної хроматографії (рН 1-14). Q-сефароза (Q означає четвертинний амоній) є прикладом сильного аніонообмінника. Катіонообмінники можуть бути також класифіковані як слабкі або сильні. Сильний катіонообмінник містить сильну кислоту (наприклад, сульфопропільну групу), яка залишається зарядженою від рН 1 до 14; тоді як слабкий катіонообмінник містить слабку кислоту (наприклад, карбоксиметильну групу), яка поступово втрачає свій заряд, коли рН зменшується нижче за 4 або 5. Карбоксиметил (СМ) і сульфопропіл (SP) мають, наприклад, натрій у ролі протиіона. Інша хроматографічна смола основана на нерозчинному гідроксильованому кальційфосфатному матриксі, що називають гідроксіапатитом. Гідроксіапатитна хроматографія є способом очищення білків, який використовує нерозчинний гідроксильований фосфат кальцію (Ca5(PO4)3OH)2, який утворює як матрикс, так і ліганд. Функціональні групи складаються з пар позитивно заряджених іонів кальцію (С-сайтів) і кластерів негативно заряджених груп (Р-сайтів). Взаємодії між гідроксіапатитом і білками є комплексними і різноманітними. В одному способі взаємодії, позитивно заряджені аміногрупи на білках зв’язуються з негативно зарядженими Рсайтами, а карбоксильні групи білка взаємодіють за допомогою координаційного комплексоутворення із С-сайтами (Shepard et al., 2000). Кристалічний гідроксіапатит був першим типом гідроксіапатиту, використаним у хроматографії. Хроматографія на керамічному гідроксіапатиті (СНА) є подальшим розвитком гідроксіапатитної хроматографії. Керамічний гідроксіапатит має високий термін служби (високу міцність), хорошу здатність зв’язування білка і може бути використаний при вищих швидкостях потоку і тиску, ніж кристалічний гідроксіапатит (Vola et al., 1993). Гідроксіапатит використали в хроматографічному розділенні білків, нуклеїнових кислот, а також антитіл. У гідроксіапатитній хроматографії колонку врівноважують звичайним чином і наносять пробу у фосфатному буфері низької концентрації і потім адсорбовані білки елююють у градієнті концентрацій фосфатного буфера (Giovannini et al., 2000). Ще один спосіб очищення білків оснований на афінності білка, що становить інтерес, стосовно іншого білка, який іммобілізований на хроматографічній смолі. Прикладами таких 1 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 іммобілізованих лігандів є білки бактеріальних клітинних стінок Білок А і Білок G, що мають специфічність щодо Fc-частини деяких імуноглобулінів. Хоча як Білок А, так і Білок G мають сильну афінність щодо IgG-антитіл, вони мають також афінності стосовно інших класів і ізотипів імуноглобулінів, що варіюються. Білок А є білком у 43000 Дальтон, який продукується бактеріями Staphylococcus aureus і містить чотири сайти зв’язування з Fc-ділянками IgG. Білок G продукується стрептококами групи G і має два сайти зв’язування для Fc-ділянки IgG. Обидва білки були широко охарактеризовані стосовно їхньої афінності з різними типами імуноглобулінів. Білок L є наступним бактеріальним білком, що походить із Peptostreptococcus, що зв’язується з імуноглобулінами та їхніми фрагментами, що містять легкі ланцюги Ig (Akerstrom and Bjork, 1989). Білок А-, Білок G- і Білок-L-афінна хроматографія широко використовується для виділення та очищення імуноглобулінів. Оскільки сайти зв’язування для Білка А і білка G знаходяться в Fc-ділянці імуноглобуліну, Білок А- і Білок G-афінна хроматографія дозволяє також очищення так званих Fc-злитих білків. Fc-злиті білки є химерними білками, що складаються з ефекторної ділянки білка, такої як зв’язувальна ділянка рецептора, злитого з Fc-ділянкою імуноглобуліну, який часто є імуноглобуліном G (IgG). Fc-злиті білки використовуються широко як терапевтичні засоби, оскільки вони надають переваги, що надаються Fc-ділянкою, такі як: - Можливість очищення з використанням Білок А- або Білок G-афінної хроматографії з афінностями, що варіюють відповідно до ізотипу IgG. IgG 1, IgG2 і IgG4 людини зв’язуються сильно з Білком А, і всі IgG людини, у тому числі IgG 3, зв’язуються сильно з Білком G; - Збільшений час напівжиття в системі кровообігу, оскільки Fc-ділянка зв’язується з рецептором порятунку FcRn, який захищає від лізосомної деградації; - Залежно від медичного застосування Fc-злитого білка, можуть бути бажаними ефекторні функції Fc. Такі ефекторні функції включають у себе антитілозалежну клітинну цитотоксичність (ADCC) через взаємодії з Fc-рецепторами (FcR) і комплементзалежну цитотоксичність (CDC) за допомогою зв’язування з компонентом комплементу 1q (С1q). Ізоформи IgG виявляють різні рівні ефекторних функцій. IgG1 і IgG3 людини мають сильні ефекти ADCC і CDC, у той час як IgG2 людини виявляє слабкі ефекти ADCC і CDC. IgG4 людини виявляє слабкі ефекти ADCC і не виявляє ефекти CDC. Час напівжиття в сироватці та ефекторні функції можуть бути модульовані конструюванням Fc-ділянки для збільшення або зменшення її зв’язування з FcRn, FcR і C1q, відповідно, залежно від терапевтичного застосування, передбачуваного для Fc-злитого білка. У ADCC, Fc-ділянка антитіла зв’язується з Fc-рецепторами (FcR) на поверхні імунних ефекторних клітин, таких як природні клітини-кілери і макрофаги, призводячи до фагоцитозу або лізису цих клітин-мішеней. У CDC, ці антитіла вбивають клітини-мішені запуском каскаду комплементу на поверхні клітин. Ізоформи IgG виявляють різні рівні ефекторних функцій, що збільшуються в послідовності IgG4 < IgG2 < IgG1 < IgG3. IgG1 людини виявляє високі ADCC і CDC і є найбільш застосовним для терапевтичного застосування проти патогенів і ракових клітин. За деяких обставин, наприклад, коли виснаження клітини-мішені є небажаним, може бути потрібним анулювання або зменшення ефекторних функцій. Навпаки, у випадку антитіл, призначених для застосування в онкології, збільшення ефекторних функцій може поліпшувати їх терапевтичну активність (Carter et al., 2006). Модифікація ефекторних функцій може досягатися конструюванням Fc-ділянки або для поліпшення, або для зменшення зв’язування антитіл із FcR або факторами комплементу. Зв’язування IgG з активуючими (FcRI, FcRIIa, FcRIIIa і FcRIIIb) та інгібуючими (FcRIIb) FcR або першим компонентом комплементу (C1q) залежить від залишків, локалізованих у шарнірній ділянці і СН2-домені. Дві ділянки СН2-домену є вирішальними для FcR і зв’язування С1q комплементу і мають унікальні послідовності в IgG 2 і IgG4. Наприклад, заміна залишків IgG2 у положеннях 233-236 в IgG1 людини сильно зменшувала ADCC і CDC (Armour et al., 1999 і Shields et al., 2001). Численні мутації були зроблені в СН2-домені IgG та їхню дію на ADCC і CDC випробовували in vitro (Shields et al., 2001, Idusogie et al., 2001 і 2000, Steurer et al., 1995). Зокрема, повідомлялося, що мутація аланіну в Е333 збільшувала як ADCC, так і CDC (Idusogie et al., 2001 і 2000). Збільшення часу напівжиття терапевтичного антитіла є іншим шляхом для поліпшення його ефективності, що робить можливими вищі рівні в кровотоці, менш часте введення і зменшені дози. Це може бути досягнуто підсиленням зв’язування Fc-ділянки з FcR новонародженого 2 UA 99263 C2 5 (FcRn). FcRn, який експресується на поверхні ендотеліальних клітин, зв’язує IgG рН-залежним чином і захищає його від деградації. Було показано, що декілька мутацій, розташованих на межі між доменами СН2 і СН3, збільшують час напівжиття IgG1 (Hinton et al., 2004 і Vaccaro et al., 2005). Наступна таблиця 1 підсумовує деякі відомі мутації Fc-ділянки IgG (взяті з веб-сайта Invivogen). Сконструйований Ізотип Fc IgG Мутації Властивості hIgG1e1 30 IgG1 Зменшені E233P/L234V/L235A/G236+A327G/A330S/P331S людини ADCC і CDC IgG1 E333A людини Збільшені ADCC і CDC hIgG2e1 25 Збільшений час напівжиття плазмі hIgG1e4 20 IgG1 M252Y/S254T/T256E+H433K/N434F людини hIgG1e3 15 Збільшений час напівжиття плазмі hIgG1e2 10 IgG1 T250Q/M428L людини IgG2 K322A людини Зменшена CDC Потенційні Застосування переваги Поліпшена локалізація стосовно мішені; Вакцинація; збільшена терапевтичне в ефективність; застосування зменшена доза або частота введення Поліпшена локалізація стосовно мішені; Вакцинація; збільшена терапевтичне в ефективність; застосування зменшена доза або частота введення Терапевтичне Зменшені застосування побічні дії без деплеції клітин Терапевтичне Збільшена застосування ефективність без деплеції клітин Вакцинація; Зменшені терапевтичне побічні дії застосування У деяких відомих Fc-злитих білках, що мають терапевтичну застосовність, Fc-ділянки були злиті з позаклітинними доменами деяких рецепторів, що належать до суперсімейства рецепторів фактора некрозу пухлин (TNF-R) (Locksley et al., 2001, Bodmer et al., 2002, Bossen et al., 2006). Відмітною ознакою членів суперсімейства TNFR є присутність цистеїн-багатих псевдоповторів у позаклітинному домені, описаних, наприклад, Naismith and Sprang, 1998. Два рецептори TNF, p55 (TNFR1) і p75 TNFR (TNFR2) є прикладами таких членів суперсімейства TNFR. Етанерцепт є Fc-злитим білком, що містить розчинну частину TNFR р75 (наприклад, WO91/03553, WO 94/06476). Під товарною назвою Enbrel®, він продається для лікування ендометріозу, інфекції вірусу гепатиту С, інфекції ВІЛ, псоріатичного артриту, псоріазу, ревматоїдного артриту, астми, анкілозуючого спондиліту, серцевої недостатності, реакції трансплантат проти хазяїна, пневмофіброзу, хвороби Крона. Ленерцепт є злитим білком, що містить позаклітинні компоненти TNF-рецептора р55 людини і Fc-частину IgG людини, і призначений для потенційного лікування важкого сепсису і розсіяного склерозу. OX40 є також членом суперсімейства TNFR. Були одержані злиті білки OX40-IgG1 і OX40hIG4mut для лікування запальних і автоімунних захворювань, таких як хвороба Крона. Fc-злитий білок BAFF-R, що також називають BR3, названий BR3-Fc, є розчинним рецептором-пасткою із серії інгібіторів BAFF (В-клітинного активуючого фактора сімейства TNF), розвивається для потенційного лікування автоімунних захворювань, таких як ревматоїдний артрит (RA) і системний червоний вовчак (SLE). BCMA є наступним рецептором, що належить до суперсімейства TNFR. Було описано, що злитий білок BCMA-Ig інгібує автоімунне захворювання (Melchers, 2006). Іншим рецептором суперсімейства TNF-R є TACI, трансмембранний активатор і агент, що взаємодіє із CAML (von Вülow and Bram, 1997; US 5969102, Gross et al., 2000), який має позаклітинний домен, що містить два цистеїн-багатих псевдоповтори. TACI зв’язує два члени сімейства лігандів фактора некрозу пухлин (TNF). Один ліганд був названий BLyS, BAFF, нейтрокін- TALL-1, zTNF4 або THANK (Moore et al., 1999). Інший ліганд був названий APRIL, , 3 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 ліганд 1 смерті TNRF або ZTNF2 (Hahne et al., J. Exp.Med. 188: 1185 (1998). Відомі також злиті білки, що містять розчинні форми рецептора TACI, злиті з Fc-ділянкою IgG, які були названі TACI-Fc (WO 00/40716, WO 02/094852). TACI-Fc інгібує зв’язування BLyS і APRIL з В-клітинами (Xia et al., 2000). Він розробляється для лікування автоімунних захворювань, у тому числі системного червоного вовчака (SLE), ревматоїдного артриту (RA) і гематологічних злоякісних захворювань, а також для лікування розсіяного склерозу (MS). Крім цього, TACI-Fc розробляється для лікування множинної мієломи (MM) (Novak et al., 2004; Moreau et al., 2004) і не-ходжкінської лімфоми (NHL), хронічного лімфоцитарного лейкозу (CLL) і макроглобулінемії Вальденстрема (WM). Внаслідок терапевтичної застосовності Fc-злитих білків, зокрема, Fc-злитих білків, що містять позаклітинні частини суперсімейства TNFR, існує потреба в значних кількостях високо очищеного білка, який є достатнім для введення людині. WO 02/094852 описує спосіб часткового очищення TACI-Fc, який включає в себе білок Ахроматографію з подальшою гель-проникаючою (гель-фільтраційною) хроматографією S200. WO 03/059935 описує спосіб очищення для p75 TNFR:Fc-злитого білка з використанням комбінації гідроксіапатитної хроматографії та афінної хроматографії на Білку А. Однак, у способі, описаному в WO 03/059935, Fc-злитий білок не зв’язується з гідроксіапатитом і, отже, міститься у фракції, що протікає через гідроксіапатитну колонку. Крім того, застосування іонообмінної хроматографії не згадується для очищення цього p75 TNFR:Fc-злитого білка. WO 2005/044856 описує спосіб видалення високомолекулярних агрегатів із препаратів антитіл за допомогою гідроксіапатитної колонки. Описаний також спосіб очищення з використанням Білка А, аніонообмінної хроматографії і гідроксіапатитної хроматографії. Однак, по-перше, цей спосіб був описаний виключно для антитіл і, по-друге, немає опису застосування стадії катіонообмінної хроматографії між стадією Білок А-афінної хроматографії і стадією аніонообмінної хроматографії. WO 94/06476 передбачає гіпотетичні протоколи очищення для рекомбінантних розчинних TNF-рецепторів на основі TNF- або лектин-афінної хроматографії, аніоно- або катіонообмінної хроматографії та обернено-фазової високоефективної рідинної хроматографії (ОФ-ВЕРХ). У цьому документі не згадується гідроксіапатитна хроматографія як відповідна стадія очищення для розчинних TNF-рецепторів. US 2002/0115175 описує очищення металопротеаз, таких як фермент TNF-альфаконвертаза (ТАСЕ). TACE має теоретичну ізоелектричну точку приблизно 5,4, як розраховано, наприклад, із використанням “EMBL WWW Gateway to Isoelectric Point Service”, доступного в Інтернеті. TACE є протеазою, яка відщеплює 8 амінокислот на N-кінці мембранозв’язаного (про-) TNF. Таким чином, цитокін TNF вивільняється з клітинної мембрани і за допомогою цього активується. Спосіб очищення TACE, описаний в US 2002/0115175, містить стадію з використанням аглютиніну із зародків пшениці-агарози. Fc-злиті білки ТАСЕ описані в цьому документі, але вони не були очищені. EP 1561756 описує, що хроматографія на основі Білка А або Білка G може бути недостатньою для відділення ДНК-домішок від білків і що для очищення білка можуть бути використані додаткові стадії, такі як аніоно- або катіонообмінна хроматографія, гідроксіапатитна хроматографія або їхні комбінації. Для цих хроматографічних стадій не пропонувалася яканебудь конкретна послідовність. Крім того, білки EP 1561756 є гематопоетичними факторами, цитокінами та антитілами. У ЕР 1561756 немає згадок про Fc-злиті білки. EP 1614693 описує спосіб очищення антитіл на основі Білок А-афінної хроматографії, аніонообмінної хроматографії і катіонообмінної хроматографії. У цьому документі, зазначається, що ці антитіла очищають за допомогою аніонообмінної і катіонообмінної хроматографії в цьому порядку або, альтернативно, за допомогою катіонообмінної хроматографії. Гідрофобна хроматографія може бути замінена хроматографією будь-якого іншого типу, у тому числі гідроксіапатитною хроматографією. В ЕР 1614693 не згадуються Fc-злиті білки. Feng et al., 2005, описують способи очищення антитіл, основані на початковій стадії захоплення на Білкові А із подальшими стадіями додаткового очищення, якими можуть бути хроматографія гідрофобної взаємодії, аніонообмінна хроматографія, катіонообмінна хроматографія або гідроксіапатитна хроматографія. Однак, Feng et al. описує тільки способи очищення антитіл, але не Fc-злитих білків. Крім того, крім початкової стадії первинної Білок Аафінної хроматографії не пропонується яка-небудь послідовність для систематичного видалення всіх небажаних забруднень, таких як білки клітин-хазяїнів (НСР), агрегати, ДНК, вірусні домішки і Білок, що просочується А. Таким чином, все ще є незадоволена потреба в ефективних способах очищення для Fcзлитих білків, що призводять до такої чистоти, яка є придатною для введення людині. 4 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід ґрунтується на розвитку способу очищення для Fc-злитого білка. Таким чином, у першому аспекті, цей винахід стосується способу очищення Fc-злитого білка, що включає в себе наступні стадії: a. піддавання рідини, що містить зазначений Fc-злитий білок Білок А- або Білок G-афінної хроматографії; b. піддавання елюату зі стадії (а) катіонообмінної хроматографії; с. піддавання елюату зі стадії (b) аніонообмінної хроматографії; і d. піддавання фракції, що проходить, стадії (с) гідроксіапатитної хроматографії і збирання елюату для одержання очищеного Fc-злитого білка. Цей спосіб використовують для очищення Fc-злитих білків, що мають ізоелектричну точку (рI) у діапазоні 7,0-9,5. Цей спосіб переважно використовують для очищення терапевтичних Fc-злитих білків, тобто Fc-злитих білків, призначених для введення людині. Переважніше, його використовують для Fcзлитого білка, що містить позаклітинну частину, зокрема, лігандзв’язувальну і необов’язково інгібуючу позаклітинну частину, члена суперсімейства рецепторів фактора некрозу пухлин (TNFR). Несподівано було показано, що стадія (b) була придатна для видалення так званого вільного Fc, тобто доменів важкого ланцюга імуноглобуліну, які не злиті з повною терапевтичною частиною молекули, такою як, наприклад, лігандзв’язувальна позаклітинна частина члена сімейства TNFR. У другому аспекті, цей винахід стосується очищеного Fc-злитого білка, переважно терапевтичного Fc-злитого білка, переважніше Fc-злитого білка, що містить позаклітинну частину, зокрема, лігандзв’язувальну позаклітинну частину, члена суперсімейства рецепторів фактора некрозу пухлин (TNFR), що містить менш ніж 1 % або 0,5 % або 0,2 % або 0,1 % вільного Fc-білка. Далі, було показано, що комбінація стадій (a), (с) і (d) значуще елімінувала агрегати Fcзлитого білка, які є терапевтично неактивними і небажаними для введення людині. Таким чином, у третьому аспекті, цей винахід стосується композиції очищеного Fc-злитого білка, переважно терапевтичного Fc-злитого білка, переважніше Fc-злитий білок, що містить позаклітинну частину, зокрема, лігандзв’язувальну позаклітинну частину, члена суперсімейства рецепторів фактора некрозу пухлин (TNFR), що містить менш ніж 1 % або менш ніж 0,5 % агрегатів Fc-злитого білка і/або менш ніж 0,5 % або менш ніж 0,2 % або менш ніж 0,1 % вільного Fc-білка. Наступний аспект даного винаходу стосується застосування катіонообмінної хроматографії для видалення вільного Fc у препараті Fc-злитого білка, переважно препараті терапевтичного Fc-злитого білка, переважніше Fc-злитий білок, що містить позаклітинну частину члена сімейства рецепторів фактора некрозу пухлин або її лігандзв’язувальний і необов’язково інгібуючий фрагмент. У додатковому аспекті даний винахід стосується застосування гідроксіапатитної хроматографії для видалення агрегатів у препараті Fc-злитого білка, переважно препараті терапевтичного Fc-злитого білка, переважніше Fc-злитий білок, що містить позаклітинну частину члена сімейства рецепторів фактора некрозу пухлин або її лігандзв’язувальний і необов’язково інгібуючий фрагмент. Фіг. 1 показує невідновлювальний забарвлений сріблом електрофорез в ДСН-ПААГ різних фракцій, що походять з катіонообмінної хроматографії, описаної в прикладі 2. Доріжка 1: маркери молекулярної маси, Доріжка 2: очищений ТАСI-Fc, Доріжка 3: нанесений препарат, Доріжка 4: промивання 2, Доріжка 5: елюат 2, Доріжка 6: промивання 3, Доріжка 7: елюат 3, Доріжка 8: промивання 1, Доріжка 9: елюат 1, Доріжка 10: очищений вільний Fc. Фіг. 2 показує хроматографічний профіль катіонообмінної хроматографії, описаної в прикладі 2. SEQ ID NO: 1 є цистеїновою послідовністю-фінгерпринтом (багатим цистеїном псевдоповтором), загальним для членів суперсімейства TNFR; SEQ ID NO: 2 є повнорозмірною послідовністю рецептора TACI людини (наприклад, описаною у WO 98/39361); SEQ ID NO: 3 є прикладом Fc-послідовності людини цього винаходу (наприклад, описаним у WO 02/094852); SEQ ID NO: 4 є переважним Fc-злитим білком цього винаходу, що містить послідовності, зроблені з позаклітинної частини TACI і Fc-частини людини (наприклад, описаним у WO 02/094852); SEQ ID NO: 5 є полінуклеотидом, що кодує поліпептид SEQ ID NO: 2 (наприклад, описаний у 5 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 WO 02/094852); SEQ ID NO: 6 є полінуклеотидом, що кодує поліпептид SEQ ID NO: 3 (наприклад, описаний у WO 02/094852); SEQ ID NO: 7 є полінуклеотидом, що кодує поліпептид SEQ ID NO: 4 (наприклад, описаний у WO 02/094852). Даний винахід ґрунтується на розвитку способу очищення для зразкового терапевтичного Fc-злитого білка, названого TACI-Fc, що призводить до високоочищеного препарату TACI-Fc, який придатний для введення людині. Таким чином, винахід стосується способу очищення Fc-злитого білка, що включає в себе наступні стадії: a. піддавання рідини, що містить зазначений Fc-злитий білок, Білок А- або Білок G-афінній хроматографії; b. піддавання елюату зі стадії (а) катіонообмінній хроматографії; с. піддавання елюату зі стадії (b) аніонообмінній хроматографії; і d. піддавання минущої фракції стадії (с) гідроксіапатитній хроматографії і збиранню елюату для одержання очищеного Fc-злитого білка. В одному варіанті здійснення, цей спосіб очищення не включає в себе стадії лектин-афінної хроматографії і, зокрема, він не включає в себе стадії з використанням аглютиніну із зародків пшениці-агарози. Спосіб цього винаходу застосовують для очищення Fc-злитого білка, що має pI в діапазоні 6,9-9,5. “Ізоелектрична точка” або “pI” білка є pH, при якому цей білок має повний загальний заряд, що дорівнює нулю, тобто рН, при якому цей білок має однакову кількість позитивних і негативних зарядів. Визначення pI для кожного конкретного білка може виконуватися відповідно до добре встановлених способів, таких як, наприклад, ізоелектричне фокусування. Таким чином, pI Fc-злитого білка, що підлягає очищенню відповідно до даного винаходу, може бути, наприклад, будь-яким із 6,9, 6,95, 7,0, 7,05, 7,1, 7,15, 7,2, 7,25, 7,3, 7,35, 7,4, 7,45, 7,5, 7,55, 7,6, 7,65, 7,7, 7,75, 7,8, 7,85, 7,9, 7,95, 8,0, 8,05, 8,1, 8,15, 8,2, 8,25, 8,3, 8,35, 8,4, 8,45, 8,5, 8,55, 8,6, 8,65, 8,7, 8,75, 8,8, 8,85, 8,9, 8,95, 9,0, 9,05, 9,1, 9,15, 9,2, 9,25, 9,3, 9,35, 9,4, 9,45, 9,5. Переважно, pI Fc-злитого білка, що підлягає очищенню відповідно до даного винаходу, дорівнює 8-9 або 8,0-9,0, переважніше 8,3-8,6. Спосіб цього винаходу призначений переважно для очищення терапевтичного Fc-злитого білка, тобто Fc-злитий білок призначений для лікування або попередження захворювання тварини або переважно для лікування людини. Переважніше, спосіб цього винаходу призначений для очищення Fc-злитого білка, що містить позаклітинний домен члена суперсімейства рецепторів фактора некрозу пухлин (TNFR). Ця позаклітинна частина є переважно лігандзв’язувальним фрагментом позаклітинної частини або домену відповідного рецептора. Переважний Fc-злитий білок, який може бути очищений відповідно до даного винаходу, зв’язує ліганд та інгібує або блокує функцію ліганду, наприклад, активацію рецептора. Термін “Fc-злитий білок”, у даному контексті, означає білки, зокрема, терапевтичні білки, що містять виготовлену з імуноглобуліну частину молекули, яка буде називатися тут “Fc-частиною”, і частину молекули, виготовлену з другого, білка, що не є імуноглобуліном, яка буде називатися тут “терапевтичною частиною молекули”, незалежно від того, передбачається або не передбачається лікування захворювання. Термін “вільний Fc”, у даному контексті, включає в себе будь-яку частину Fc-злитого білка, що підлягає очищенню відповідно до даного винаходу, яка виготовлена з імуноглобулінової частини Fc-злитого білка і не містить істотної частини терапевтичної частини Fc-злитого білка. Таким чином, вільний Fc може містити димери шарнірної ділянки IgG, домени CH2 і CH3, які не сполучені або не пов’язані з істотними частинами терапевтичної частини молекули, і відповідає, наприклад, Fc-частині, яка генерується розщепленням папаїном. Мономери, зроблені з Fcчастини молекули, можуть також міститися в цій фракції вільного Fc. Зрозуміло, що вільний Fc може все ще містити ряд амінокислотних залишків із терапевтичної частини молекули, таких як, наприклад, одну - десять (наприклад, 2, 3, 4, 5, 6, 7, 8 або 9) амінокислот, що належать до терапевтичної частини молекули, злитої з Fc-частиною молекули. Fc-частина може бути зроблена з імуноглобуліну (Ig) людини або тварини, який є переважно IgG. Цей IgG може бути IgG1, IgG2, IgG3 або IgG4. Переважно також, ця Fc-частина молекули зроблена з важкого ланцюга імуноглобуліну, переважно IgG. Переважніше, Fc-частина молекули містить частину, таку як, наприклад, домен, константної ділянки важкого ланцюга імуноглобуліну. Така константна ділянка Ig переважно містить щонайменше один константний домен Ig, вибраний із будь-якої з шарнірної ділянки, домену СН2, СН3 або будь-якої їхньої комбінації. Переважно, Fc-частина молекули містить щонайменше домен СН2 і СН3. Крім того, 6 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 переважно, Fc-частина молекули містить шарнірну ділянку IgG, домен СН2 і СН3. Fc-злитий білок цього винаходу може бути мономером або димером. Fc-злитий білок може бути також “псевдодимером”, що містить димерну Fc-частину (наприклад, димер із двох пов’язаних дисульфідним містком конструкцій шарнір-CH2-CH3, з яких тільки одна зв’язана з терапевтичною частиною молекули). Fc-злитий білок може бути гетеродимером, що містить дві різні терапевтичні частини молекули, або гомодимером, що містить дві копії єдиної терапевтичної частини молекули. Відповідно до даного винаходу, Fc-частина молекули може бути також модифікована для модуляції ефекторних функцій. Наприклад, можуть бути введені наступні мутації Fc, згідно з положеннями EU-індексів (Kabat et al., 1991), якщо ця Fc-частина молекули зроблена з IgG1: T250Q/M428L M252Y/S254T/T256E + H433K/N434F E233P/L234V/L235A/G236 + A327G/A330S/P331S E333A; K322A. Додатковими Fc-мутаціями можуть бути, наприклад, заміни в положеннях EU-індексів, вибраних із 330, 331, 234 або 235, або їхні комбінації. Амінокислотна заміна в EU-індексположенні 297, розташованому в домені СН2, також може бути введена у Fc-частину в контексті даного винаходу, з елімінацією потенційного сайта приєднання N-зв’язаного вуглеводу. Залишок цистеїну в EU-індекс-положенні 220 може бути також замінений залишком серину, що виключає залишок цистеїну, який звичайно утворює дисульфідні зв’язки з константною ділянкою легкого ланцюга імуноглобуліну. Згідно з даним винаходом, переважно, Fc-частина містить SEQ ID NO: 3 або складається з SEQ ID NO: 3 або кодується полінуклеотидом, що містить SEQ ID NO: 6. Терапевтичною частиною молекули цього винаходу може бути, наприклад, EPO, TPO, гормон росту, інтерферон-альфа, інтерферон-бета, інтерферон-гама, PDGF-бета, VEGF, IL-1альфа, IL-1-бета, IL-2, IL-4, IL-5, IL-8, IL-10, IL-12, IL-18, IL-18-зв’язувальний білок, TGF-бета, TNF-альфа або TNF-бета або їхні похідні. Терапевтична частина молекули цього винаходу може бути також зроблена з рецептора, наприклад, трансмембранного рецептора, може бути переважно зроблена з позаклітинного домену рецептора і, зокрема, лігандзв’язувального і необов’язково інгібуючого фрагмента позаклітинної частини або домену конкретного рецептора. Прикладами рецепторів, що становлять інтерес, є CD2, CD3, CD4, CD8, CD11a, CD14, CD18, CD20, CD22, CD23, CD25, CD33, CD40, CD44, CD52, CD80, CD86, CD147, CD164, IL-2-рецептор, IL-4-рецептор, IL-6рецептор, IL-12-рецептор, субодиниці IL-18-рецептора (IL-18R-альфа, IL-18R-бета), EGFрецептор, VEGF-рецептор, інтегрин альфа 4/бета 7, інтегрин VLA4, інтегрини B2, TRAILрецептори 1, 2, 3 і 4, RANK, ліганд RANK, адгезійна молекула епітеліальних клітин (EpCAM), молекула 3 міжклітинної адгезії (ICAM-3), CTLA4 (який є цитотоксичним Т-лімфоцитасоційованим антигеном), Fc-гама-1-рецептор, HLA-DR 10 бета, антигенний HLA-DR, Lселектин. Високо переважним є те, що терапевтична частина молекули цього винаходу зроблена з рецептора, що належить до суперсімейства TNFR. Ця терапевтична частина молекули може бути, наприклад, позаклітинним доменом TNFR1 (p55), TNFR2 (p75), OX40, остеопротегерином, CD27, CD30, CD40, RANK, DR3, Fas-лігандом, TRAIL-R1, TRAIL-R2, TRAIL-R3, TAIL-R4, NGFR, AITR, BAFFR, BCMA, TACI або може бути зроблена з них. Згідно з даним винаходом, ця терапевтична частина молекули, зроблена з члена суперсімейства TNFR, переважно містить весь позаклітинний домен цього члена TNFR або частину позаклітинного домену цього члена TNFR і переважніше містить лігандзв’язувальний і необов’язково інгібуючий фрагмент такого члена TNFR. Наступна таблиця 5 містить список членів суперсімейства TNFR, з яких може бути зроблена терапевтична частина молекули відповідно до даного винаходу, та їхніх відповідних лігандів. “Лігандзв’язувальний фрагмент” члена цього сімейства TNFR може бути легко визначений кваліфікованим у даній галузі фахівцем, наприклад, у простому аналізі in vitro, вимірюванням зв’язування між білковим фрагментом цього рецептора і відповідним лігандом. Таким аналізом може бути, наприклад, простий сендвіч-аналіз in vitro типу RIA або ELISA, в якому один із цих білків, наприклад, фрагмент рецептора, іммобілізують із носієм (наприклад, планшетом ELISA) та інкубують, після придатного блокування сайтів зв’язування білка на цьому носії, із другим білком, наприклад, лігандом. Після інкубування, зв’язування ліганду детектують, наприклад, із використанням радіоактивного мічення, у сцинтиляційному лічильнику. Зв’язування ліганду може бути також визначене з міченим антитілом або першим ліганд-специфічним антитілом і другим, міченим антитілом, спрямованим проти константної частини першого антитіла. Таким 7 UA 99263 C2 5 чином, зв’язування ліганду може бути легко визначене, залежно від мітки, що використовується, наприклад, у кольоровій реакції. Блокування або інгібування функції зв’язування ліганду може бути протестоване у придатних аналізах на основі клітин. Переважно, спосіб даного винаходу призначений для очищення Fc-злитого білка, що містить терапевтичну частину молекули, зроблену з члена суперсімейства TNFR, вибраного з членів суперсімейства TNFR, наведених у списку в таблиці 5. Таблиця 5 Суперсімейство TNFR (згідно з Locksley et al., 2001 і Bossen et al., 2006) Член суперсімейства TNFR NGFR EDAR XEDAR CD40 Fas Ox40 AITR GITR CD30 CD40 HveA 4-1BB TNFR2 LT-бетаR DR3 CD27 TNFR1 LTBR RANK TACI BCMA BAFF-R TRAILR1 TRAILR2 TRAILR3 TRAILR4 Fn14 OPG DR4 DR5 DcR1 DcR2 DcR3 10 15 20 Ліганд NGF EDA-A1 EDA-A2 CD40L FasL OX40L AITRL GITRL CD30L CD40L LIGHT, LT-альфа 4-1BBL TNF-альфа, LT-альфа, LT-альфа-бета LIGHT, LT-альфа, LT-альфа-бета TL1A CD27L TNF-альфа, LT-альфа, LT-альфа-бета LT-бета RANKL BlyS, APRIL BlyS, APRIL BAFF (= BlyS) TRAIL TRAIL TRAIL TRAIL TWEAK RANKL, TRAIL TRAIL TRAIL TRAIL TRAIL FasL, LIGHT, TL1A У переважному варіанті здійснення, Fc-злитий білок містить терапевтичну частину, вибрану з позаклітинного домену TNFR1, TNFR2 або їхнього TNF-зв’язувального і необов’язково інгібуючого фрагмента. У наступному переважному варіанті здійснення, Fc-злитий білок містить терапевтичну частину, вибрану з позаклітинного домену BAFF-R, BCMA або TACI або їхнього фрагмента, що зв’язує щонайменше один із Blys або APRIL. Один аналіз для тестування здатності зв’язування з Blys або APRIL описаний, наприклад, у Hymowitz et al., 2006. TACI є переважно TACI людини. SEQ ID NO: 2 відповідає амінокислотній послідовності повнорозмірного рецептора TACI людини (також вхід SwissProt О14836). Переважніше, ця терапевтична частина молекули містить розчинну частину TACI, переважно зроблену з позаклітинного домену TACI. Переважно, зроблена з TACI терапевтична частина молекули містить щонайменше амінокислоти 33-67 SEQ ID NO:2 і/або амінокислоти 70-104 SEQ ID NO:2. В одному переважному варіанті здійснення, позаклітинний домен TACI, включений у цю 8 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 терапевтичну частину згідно з даним винаходом, містить амінокислоти (або складається з них) 1-166 SEQ ID NO: 2, або амінокислоти 30-166 SEQ ID NO: 2, або амінокислоти 30-119 SEQ ID NO: 2, або амінокислоти 30-110 SEQ ID NO: 2. Всі з цих терапевтичних частин молекул є переважними для одержання Fc-злитого білка для очищення за способом цього винаходу, і комбінуються з Fc-частинами, описаними детально вище, і, зокрема, з Fc-частиною молекули, що містить SEQ ID NO: 3 або що складається з SEQ ID NO: 3. Один високо переважний Fcзлитий білок, що підлягає очищенню з використанням даного винаходу, містить SEQ ID NO: 4 або складається з SEQ ID NO: 4 або кодується полінуклеотидом SEQ ID NO: 7. Таким чином, надзвичайно переважно, щоб Fc-злитий білок містив поліпептид, вибраний із a. амінокислот 34-66 SEQ ID NO: 2; b. амінокислот 71-104 SEQ ID NO: 2; з. амінокислот 34-104 SEQ ID NO: 2; d. амінокислот 30-110 SEQ ID NO: 2; е. SEQ ID NO: 3; f. SEQ ID NO: 4; g. поліпептиду, що кодується полінуклеотидом, що гібридизується з комплементом SEQ ID NO: 5 або 6 або 7 за умов високої суворості; і h. мутеїну будь-якого із (с), (d), (е) або (f), що має щонайменше 80 % або 85 % або 90 % або 95 % ідентичність послідовності з поліпептидом (с), (d), (е) або (f); причому цей поліпептид зв’язується щонайменше з одним із Blys або APRIL. У наступному переважному варіанті здійснення, Fc-злитого білка містить константну ділянку важкого ланцюга імуноглобуліну, переважніше константну ділянку імуноглобуліну людини. В одному варіанті здійснення цього винаходу, цим імуноглобуліном є IgG 1. Переважно також, ця константна ділянка містить шарнірну ділянку, домени СН2 і СН3. У наступному варіанті здійснення, ця терапевтична частина молекули містить багатий цистеїном псевдоповтор SEQ ID NO:1. Відповідно до даного винаходу, рідину, що містить Fc-злитий білок, спочатку піддають Білок А- або Білок G-афінній хроматографії. Ця рідина може бути переважно матеріалом культури клітин, наприклад, солюбілізованими клітинами, переважніше супернатантом культури клітин. Термін “супернатант культури клітин” стосується в даному контексті, середовища, в якому культивуються клітини і в яке секретуються білки, за умови, що вони містять придатні клітинні сигнали, так звані сигнальні пептиди. Переважно клітини, які експресують Fc-злиті білки, культивують в умовах безсироваткового культивування. Так, переважно, супернатант культури клітин позбавлений компонентів сироватки тварин. Найпереважніше, середовище культури клітин є середовищем із певним хімічним складом. Білок А, що використовується для афінної хроматографії, може бути, наприклад, рекомбінантним. Він може бути також модифікований для поліпшення його властивостей (наприклад, як у смолі, що називають MabSelect SuRe, комерційно доступній із GE Healthcare). У переважному варіанті здійснення, стадію (а) проводять на смолі, що містить зшиту агарозу, модифіковану рекомбінантним Білком А. Колонка, комерційно доступна під назвою Mabselect Xtra (з GE Healthcare), є прикладом афінної смоли, яка особливо придатна для стадії (а) цього способу. Білок А- або Білок G-афінна хроматографія використовується переважно як стадія захоплення і, отже, служить для очищення Fc-злитого білка, зокрема, елімінації білків клітинихазяїна та агрегатів Fc-злитого білка, і для концентрування препарату Fc-злитого білка. Термін “агрегати”, у даному контексті, стосується агрегатів білка. Він включає в себе мультимери (такі як димери, тетрамери або агрегати вищого порядку) Fc-злитого білка, що підлягає очищенню, і можуть призводити, наприклад, до високомолекулярних агрегатів. Афінна хроматографія має додаткову перевагу зменшення рівня агрегатів у 2-4 рази. Із використанням Білок А- або G-афінної хроматографії рівні білків клітини-хазяїна можуть бути зменшені в 100-300 разів. У переважному варіанті здійснення цього винаходу, елюцію в стадії (а) проводять при рН у діапазоні 2,8-4,5, переважно 3,0-4,2, переважніше при 3,5, 3,55, 3,6, 3,65, 3,7, 3,75, 3,8, 3,85, 3,9, 3,95, 4,0, 4,05, 4,1 або 4,15. Елюція в стадії (a) може також проводитися градієнтом pH переважно градієнтом pH від 4,5 до 2,8. У наступному переважному варіанті здійснення, елюцію в стадії (а) проводять у буфері, вибраному з ацетату натрію або цитрату натрію. Придатні концентрації буфера вибрані, наприклад, із 50 мМ або 100 мМ або 150 мМ або 200 мМ або 250 мМ. Згідно з даним винаходом, елюат з Білок А- або Білок G-хроматографії піддають катіонообмінній хроматографії. Катіонообмінна хроматографія може проводитися на будь-якій 9 UA 99263 C2 придатній катіонообмінній смолі, такій як, наприклад, слабкі або сильні катіонообмінники, як пояснюється вище в розділі Рівень техніки цього винаходу. Переважно, стадію (b) проводять на сильній катіонообмінній смолі. Переважніше, катіонообмінний матеріал містить зшитий метакрилат, модифікований 5 10 15 20 25 30 35 40 45 50 55 SO 3 SO 3 -групами. Колонка, комерційно доступна під товарною назвою Fractogel EMD (з Merck), є прикладом катіонообмінної смоли, яка особливо придатна для стадії (b) цього способу. Переважно, елюат Білок А-колонки наносять безпосередньо на катіонообмінну колонку. Переважно, нанесення проводять при рН щонайменше на одну одиницю нижчому, ніж рI підлягаючого очищенню Fc-злитого білка. Переважно, після нанесення цю колонку промивають буфером, що має провідність 6-10 мС/см, наприклад, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8 або 9,9 мС/см. Переважніше, провідність знаходиться в діапазонах від 7,6 до 9,2, тобто 8,4 0,8 мС/см. Цю стадію промивання переважно проводять при рН у діапазоні від 5,5 до 7,5, переважно від 6,0 до 7,0. У додатковому переважному варіанті здійснення, цю катіонообмінну колонку елююють при рН у діапазоні від 7,0 до 8,5, переважно 7,25 або 7,3 або 7,35 або 7,4 або 7,45 або 7,5 або 7,55 або 7,6 або 7,65 або 7,7 або 7,7 або 7,75 або 7,8 або 7,85 або 7,9 або 7,95 або 8,0 або 8,05 або 8,1 або 8,15 або 8,2 або 8,25 або 8,3 або 8,35 або 8,4 або 8,45 або 8,5. Елюція може переважно проводитися при провідності в діапазоні від 15 до 22 мС/см. Наприклад, провідність може бути вибрана з 16, 17, 18, 19, 20, 21 або 22 мС/см. Переважним буфером для елюції є фосфатний буфер. У високо переважному варіанті здійснення, стадія (b) включає в себе наступні додаткові стадії: b.1. промивання катіонообмінної смоли буфером, що має рН у діапазоні від 6,0 до 7,0 і провідність у діапазоні від 6 до 10 мС/см; і b.2. елюцію цієї колонки при рН у діапазоні від 7,0 до 8,5 і провідність у діапазоні від 15 до 22 мС/см. Переважним буфером для стадії (b.1) є 75-125 мМ фосфат натрію. У рамках даного винаходу було несподівано виявлено, що стадія (b) ефективно елімінує вільний Fc. Таким чином, згідно з даним винаходом, катіонообмінна хроматографія може бути переважно використана для елімінації або зменшення вільного Fc у 5-15 разів. Переважно, стадія (b) способу даного винаходу зменшує також концентрацію білків клітинихазяїна з препарату Fc-злитого білка, наприклад, в 1-2 рази, значно сприяючи кліренсу білка клітини-хазяїна (HCP). Потім, згідно з даним винаходом, елюат зі стадії катіонообмінної хроматографії піддають аніонообмінній хроматографії. Аніонообмінна хроматографія може проводитися на будь-якій придатній аніонообмінній смолі, такій як, наприклад, слабкі або сильні аніонообмінники, як пояснюється вище в розділі Рівень техніки цього винаходу. Переважно, стадію (с) проводять на сильній аніонообмінній смолі. Переважніше, аніонообмінна смола містить + полістирол/дивінілбензол, модифікований N (CH3)3. Колонка, комерційно доступна під назвою Source 30Q (із GE Healthcare) є прикладом аніонообмінної смоли, яка особливо придатна для стадії (с) даного способу. Переважно, елюат стадії (b) розводять або діалізують у придатний буфер для нанесення перед нанесенням його на аніонообмінну колонку. Аніонообмінну колонку переважно також врівноважують буфером для нанесення. Переважний рН для буфера нанесення є щонайменше на одну одиницю нижчим, ніж рI. Придатні величини рН знаходяться в діапазоні від 6,0 до 8,5, переважно від 7,0 до 8,0, наприклад, 7,0, 7,05, 7,1, 7,15, 7,2, 7,25, 7,3, 7,35, 7,4, 7,45, 7,5, 7,55, 7,6, 7,65, 7,7, 7,75, 7,8, 7,85, 7,9, 7,95 або 8,0. Переважна провідність для буфера для нанесення знаходиться в діапазоні 3,0-4,6 мС/см. Придатним буфером для зрівноваження/нанесення може бути, наприклад, фосфат натрію при концентрації в діапазоні від 5 до 35, переважно від 20 до 30 мМ. Наприклад, концентрація буфера може бути 10, 15, 20, 25, 30 мМ. У рамках даного винаходу, протікальну рідину (яку також називають рідиною, що проскакує) аніонообмінної хроматографії, що містить Fc-злитий білок, який становить інтерес, збирають. Стадія (с) цього способу даного винаходу додатково зменшує агрегати в 3-5 разів і білки клітини-хазяїна в 30-70 разів. Згідно з даним винаходом, рідину аніонообмінної хроматографії, що проходить стадії (с), 10 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовують потім для додаткового очищення гідроксіапатитною хроматографією. Будь-яка гідроксіапатитна смола може бути використана для проведення стадії (d) способу за цим винаходом. У переважному варіанті здійснення, стадію (d) проводять на керамічній гідроксіапатитній колонці, такій як гідроксіапатитна смола типу I або типу II. Гідроксіапатитна смола може мати частинки будь-якого розміру, наприклад, 20, 40 або 80 мкм. У високо переважному варіанті здійснення, ця керамічна гідроксіапатитна смола містить частинки, що мають розмір 40 мкм. Гідроксіапатитною смолою, яка особливо придатна для стадії (d) цього способу, є колонка, комерційно доступна під назвою Керамічний гідроксіапатит Типу I СНТ, 40 мкм. У переважному варіанті здійснення, рідину, що проходить, зі стадії (с) безпосередньо наносять на гідроксіапатитну смолу, тобто без попереднього розведення або діалізу в придатний буфер для нанесення. Нанесення переважно проводять при pH 6,5-7,5, наприклад, 6,6, 6,7, 6,8, 6,9, 7,1, 7,2, 7,3 або 7,4, і переважно 7,0. У наступному переважному варіанті здійснення, елюцію в стадії (d) проводять у присутності фосфату натрію в діапазоні від 2 до 10 мМ, переважно в діапазоні від 1,75 до 5,25 мМ, наприклад, при 2, 2,25, 2,5, 2,75, 3, 3,25, 3,5, 3,75, 4, 4,25, 4,5, 4,75, 5 мМ. Ще в одному переважному варіанті здійснення, елюцію в стадії (d) проводять при рН у діапазоні від 6,0 до 7,0, наприклад, при 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9. В іншому переважному варіанті здійснення, елюцію в стадії (d) проводять у присутності хлориду натрію в діапазоні від 0,4 до 1 M, переважно при 0,45, 0,5, 0,55, 0,6, 0,65, 0,7, 0,75, 0,8, 0,85, 0,9, 0,95 M, найпереважніше при 0,6 M. Згідно з даним винаходом, збирають елюат стадії (d), що містить остаточно очищений препарат Fc-злитого білка. Придатними матеріалами матриксу, тобто матеріалами-носіями для хроматографічних смол, що використовуються в стадіях (а) - (с), які можуть бути використані у зв’язку з даним винаходом, може бути, наприклад, агароза (сефароза, супероза), декстран (сефадекс), поліпропілен, метакрилат-целюлоза, полістирол/дивінілбензол, або т. ін. Ці матеріали смол можуть бути присутніми в різних зшитих формах, залежно від конкретного застосування. Об’єм смоли, довжина і діаметр колонки, що використовується, а також динамічна ємність і швидкість потоку залежать від декількох параметрів, таких як об’єм рідини, що обробляється, концентрація білка в рідині, що піддається способу цього винаходу, і т.д. Визначення цих параметрів для кожної стадії знаходиться в межах середньої кваліфікації фахівця у даній галузі. У переважному варіанті здійснення даного способу очищення, виконують одну або декілька стадій ультрафільтрації. Ультрафільтрація є застосовною для видалення малих органічних молекул і солей в елюатах, що походять із попередніх хроматографічних стадій, для зрівноваження Fc-злитого білка у загальному буфері або для концентрування Fc-злитого білка до бажаної концентрації. Така ультрафільтрація може, наприклад, виконуватися на ультрафільтраційних мембранах, із порами, що дозволяють видалення компонентів, які мають молекулярну масу нижчу за 5, 10, 15, 20, 25, 30 або більшу за кДа. Переважно, ультрафільтрацію проводять між стадіями (b) і (с), і/або після стадії (d). Переважніше, проводять дві стадії ультрафільтрації, одну між стадіями (b) і (с) і одну після стадії (d). Якщо білок, очищений відповідно до цього способу даного винаходу, призначений для введення людям, корисно включити одну або декілька стадій видалення вірусів у цьому способі. Переважно, стадію фільтрації для видалення вірусів проводять після стадії (d). Переважніше, цією стадією фільтрації для видалення вірусу є стадія нанофільтрації, де цей фільтр має номінальний розмір пір 20 нм. Спосіб за даним винаходом і, зокрема, стадії (a), (с), (d) у комбінації з нанофільтрацією ефективно елімінує вірусне навантаження до об’єднаної LRV (logвеличини зменшення) до приблизно 15-25. Для полегшення зберігання або транспортування, наприклад, цей матеріал може бути замороженим і розморожуватися до і/або після будь-якої стадії очищення цього винаходу. Згідно з даним винаходом, рекомбінантний Fc-злитий білок може продукуватися в еукаріотичній системі експресії, такій як клітини дріжджів, комахи або ссавця, що призводить до глікозильованих Fc-злитих білків. Згідно з даним винаходом, найпереважніше експресувати Fc-злитий білок у клітинах ссавців, таких як клітинні лінії тварин, або в клітинних лініях людини. Клітини яєчника Китайського хом’ячка (СНО) або клітинна лінія мієломи миші NS0 є прикладами клітинних ліній, які є особливо придатними для експресії Fc-злитого білка, що підлягає очищенню. Цей Fc-злитий білок може також переважно продукуватися в клітинних лініях людини, таких як, наприклад, клітинна лінія фібросаркоми НТ1080 людини, клітинна лінія ретинобластоми людини PERC6 або 11 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітинна лінія ембріональної нирки людини 293 або перманентна клітинна лінія амніоцитів, як описано, наприклад, в ЕР 1230354. Якщо Fc-злитий білок, що підлягає очищенню, експресується клітинами ссавців, що секретують його, початковим матеріалом способу очищення цього винаходу є супернатант культури клітин, що також називають збором клітин або неочищеним збором. Якщо клітини культивують у середовищі, що містить сироватку тварини, супернатант цієї культури клітин також містить сироваткові білки як забруднення. Переважно, клітини, що експресують і секретують Fc-злитий білок, культивують у безсироваткових умовах. Fc-злитий білок може також продукуватися в середовищі з певним хімічним складом. У цьому випадку, вихідним матеріалом способу очищення є супернатант безсироваткової культури клітин, який містить в основному білки клітин-хазяїнів як забруднення. Якщо до середовища культури клітин додають фактори росту, такі як інсулін, ці білки будуть також елімінуватися під час процесу очищення. Для створення розчинних, секретованих Fc-злитих білків, які вивільняються в супернатант культури клітин, використовують або природний сигнальний пептид терапевтичної частини Fcзлитого білка, або переважно гетерологічний сигнальний пептид, тобто сигнальний пептид, зроблений з іншого секретованого білка, що є ефективним у цій конкретній системі експресії, такій як, наприклад, сигнальний пептид бичачого або людського гормону росту, або сигнальний пептид імуноглобуліну. Як згадувалося вище, переважним Fc-злитим білком для очищення згідно з даним винаходом, є Fc-злитий білок, що має терапевтичну частину молекули, зроблену з TACI людини (SEQ ID NO: 2), і, зокрема, із його позаклітинного домену (амінокислоти 1-165 SEQ ID NO: 2). Переважний фрагмент містить амінокислоти 30-110 SEQ ID NO: 2. У подальшому описі, терапевтичні частини, зроблені з позаклітинного домену TACI, будуть називатися “розчинним TACI” або “sTACI”. Переважна Fc-частина молекули містить SEQ ID NO: 3, що призводить до Fcзлитого білка SEQ ID NO: 4, який у подальшому описі називають “TACI-Fc”. Термін TACI-Fc, у даному контексті, включає в себе також мутеїни TACI-Fc. Термін “мутеїни”, у даному контексті, стосується аналогів sTACI або TACI-Fc, в яких один або декілька з амінокислотних залишків sTACI або TACI-Fc замінені іншими амінокислотними залишками або делетовані, або один або декілька амінокислотних залишків додані до первинної послідовності sTACI або TACI-Fc без істотної зміни активності одержаних продуктів у порівнянні з первинними sTACI або TACI-Fc. Ці мутеїни одержують відомими способами синтезу і/або сайтспрямованого мутагенезу, або будь-яким іншим способом, придатним для цього. Мутеїни відповідно до даного винаходу включають у себе білки, що кодуються нуклеїновою кислотою, такою як ДНК або РНК, яка гібридизується з комплементом ДНК або РНК, який кодує sTACI або TACI-Fc відповідно до будь-якого з SEQ ID NO: 2 або 4 за суворих умов. Одним прикладом ДНК-послідовності, що кодує TACI-Fc, є SEQ ID NO: 7. Термін “суворі умови” стосується гібридизації і подальших умов промивання, які фахівці зі звичайною кваліфікацією в даній галузі звичайно називають “суворими”. Див. Ausubel et al., Current Protocols in Molecular Biology, supra, Interscience, N. Y., зз6.3 and 6.4 (1987, 1992). Без обмеження, приклади суворих умов включають у себе умови промивання, на 12-20 C нижче розрахованої Tm досліджуваного гібриду, наприклад, у 2xSSC і 0,5 % ДСН протягом 5 хвилин, 2xSSC і 0,1 % ДСН протягом 15 хвилин; 0,1xSSC і 0,5 % ДСН при 37 °С протягом 30-60 хвилин і потім 0,1xSSC і 0,5 % ДСН при 68 °С протягом 30-60 хвилин. Фахівці зі звичайною кваліфікацією в даній галузі розуміють, що умови суворості залежать також від довжини ДНК-послідовностей, олігонуклеотидних зондів (наприклад, 10-40 основ) або змішаних олігонуклеотидних зондів. Якщо використовуються змішані зонди, переважно використовувати хлорид тетраметиламонію (TMAC) замість SSC. Див. Ausubel, supra. В іншому варіанті здійснення, будь-який такий мутеїн має щонайменше 50 % щонайменше 60 %, щонайменше 70 %, щонайменше 75 % щонайменше 80 % щонайменше 85 % щонайменше 90 % або щонайменше 95 % ідентичність або гомологію з вихідним білком. Ідентичність відображає спорідненість між двома або більше поліпептидними послідовностями або двома або більше полінуклеотидними послідовностями, що визначається порівнянням цих послідовностей. Звичайно, ідентичністю називають точну відповідність нуклеотиду нуклеотидові або амінокислоти амінокислоті двох полінуклеотидів або двох поліпептидних послідовностей, відповідно, протягом довжини послідовностей, що порівнюються. Для послідовностей, де немає точної відповідності, може бути визначена “% ідентичність”. Звичайно, ці дві послідовності, що порівнюються, зіставляють для одержання максимальної кореляції між цими послідовностями. Це може включати в себе інсертування “гепів” у будь-яку 12 UA 99263 C2 5 10 15 20 25 30 35 одну з послідовностей або в обидві послідовності для збільшення ступеня зіставлення. % ідентичність може бути визначена протягом всієї довжини кожної з послідовностей (так зване глобальне зіставлення), що порівнюються, яке є особливо зручним для послідовностей однієї і тієї ж довжини, або протягом коротких певних довжин (так зване локальне зіставлення), яке є особливо зручним для послідовностей нерівної довжини. Способи для порівняння ідентичності і гомології двох або декількох послідовностей добре відомі в даній галузі. Так, наприклад, програми, доступні в пакеті Wisconsin Sequence Analysis Package, version 9.1 (Devereux J et al., 1984), наприклад, програми BESTFIT і GAP, можуть бути використані для визначення % ідентичності між двома полінуклеотидами, і % ідентичності і % гомології між двома поліпептидними послідовностями. BESTFIT використовує алгоритм “локальної гомології” Smith і Waterman (1981) і знаходить найкращу єдину ділянку схожості між двома послідовностями. Інші програми для визначення ідентичності і/або схожості між послідовностями також відомі в даній галузі, наприклад, родина програм BLAST (Altschul SF et al, 1990, Altschul SF et al, 1997, доступне через домашню сторінку NCBI в www.ncbi.nlm.nih.gov), і FASTA (Pearson WR, 1990). Будь-який такий мутеїн переважно має послідовність амінокислот, досить “дублікатну” стосовно послідовності sTACI або TACI-Fc, щоб мати по суті однакову лігандзв’язувальну активність з активністю білка SEQ ID NO: 2 або 4. Наприклад, однією активністю TACI є його здатність зв’язування з Blys або APRIL (Hymowitz et al., 2006). Можна вважати, що, поки цей мутеїн має істотну зв’язувальну APRIL або Blys активність, він має по суті однакову активність стосовно TACI. Таким чином, кваліфікований у даній галузі фахівець може легко визначити, чи має будь-який конкретний мутеїн по суті ту ж саму активність, що і білок SEQ ID NO: 2 або 4, за допомогою рутинного експериментування. Переважні зміни для мутеїнів згідно з цим винаходом є змінами, які відомі як “консервативні” заміни. Консервативні амінокислотні заміни sTACI або TACI-Fc можуть включати в себе синонімічні амінокислоти в групі, які мають досить схожі фізико-хімічні властивості, щоб заміна між членами цієї групи зберігала біологічну функцію цієї молекули (Grantham, 1974). Зрозуміло, що інсерції і делеції амінокислот можуть бути також зроблені у вищеописаних послідовностях без зміни їх функції, зокрема, якщо ці інсерції або делеції включають у себе тільки невелику кількість амінокислот, наприклад, менше тридцяти, менше двадцяти або переважно менше десяти, і не видаляють або не замінюють амінокислоти, які є вирішальними для функціональної конформації, наприклад, залишки цистеїну. Білки і мутеїни, продуковані такими делеціями і/або інсерціями, входять у сферу дії даного винаходу. Переважно, цими консервативними групами амінокислот є групи, визначені в таблиці 2. Переважніше, групами синонімічних амінокислот є групи, визначені в таблиці 3; і найпереважніше групами синонімічних амінокислот є групи, визначені в таблиці 4. Таблиця 2 Переважні групи синонімічних амінокислот Амінокислота Ser Arg Leu Pro Thr Ala Val Gly Ile Phe Tyr Cys His Gln Asn Lys Asp Glu Met Trp Синонімічна група Ser, Thr, Gly, Asn Arg, Gln, Lys, Glu, His Ile, Phe, Tyr, Met, Val, Leu Gly, Ala, Thr, Pro Pro, Ser, Ala, Gly, His, Gln, Thr Gly, Thr, Pro, Ala Met, Tyr, Phe, Ile, Leu, Val Ala, Thr, Pro, Ser, Gly Met, Tyr, Phe, Val, Leu, Ile Trp, Met, Tyr, Ile, Val, Leu, PheTrp, Met, Phe, Ile, Val, Leu, Tyr Ser, Thr, Cys Glu, Lys, Gln, Thr, Arg, His Glu, Lys, Asn, His, Thr, Arg, Gln Gln, Asp, Ser, Asn Glu, Gln, His, Arg, Lys Glu, Asn, Asp Asp, Lys, Asn, Gln, His, Arg, Glu Phe, Ile, Val, Leu, Met Trp 13 UA 99263 C2 Таблиця 3 Переважніші групи синонімічних амінокислот Амінокислота Ser Arg Leu Pro Thr Ala Val Gly Ile Phe Tyr Cys His Gln Asn Lys Asp Glu Met Trp Синонімічна група Ser His, Lys, Arg Leu, Ile, Phe, Met Ala, Pro Thr Pro, Ala Val, Met, Ile Gly Ile, Met, Phe, Val, Leu Met, Tyr, Ile, Leu, Phe Phe, Tyr Cys, Ser His, Gln, Arg Glu, Gln, His Asp, Asn Lys, Arg Asp, Asn Glu, Gln Met, Phe, Ile, Val, Leu Trp Таблиця 4 Найбільш переважні групи синонімічних амінокислот Амінокислота Ser Arg Leu Pro Thr Ala Val Gly Ile Phe Tyr Cys His Gln Asn Lys Asp Glu Met Trp 5 10 Синонімічна група Ser Arg Leu, Ile, Met Pro Thr Ala Val Gly Ile, Met, Leu Phe Tyr Cys, Ser His Gln Asn Lys Asp Glu Met, Ile, Leu Met Функціональна похідна може бути одержана із Fc-злитого білка, очищеного відповідно до даного винаходу. “Функціональні похідні”, у даному контексті, включають у себе похідні Fcзлитого білка, що підлягають очищенню відповідно до даного винаходу, які можуть бути одержані з функціональних груп, які зустрічаються у вигляді бічних ланцюгів на цих залишках, або N- або С-кінцевих груп, способами, відомими в даній галузі, і включені в цей винахід, поки вони залишаються фармацевтично прийнятними, тобто вони не руйнують активність цього білка, яка є по суті однаковою з активністю немодифікованого Fc-злитого білка, визначеного вище, і не надають токсичні властивості утримуючим його композиціям. Функціональні похідні Fc-злитого білка можуть бути, наприклад, кон’юговані з полімерами 14 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 для поліпшення властивостей цього білка, таких як стабільність, час напівжиття, біодоступність, переносимість організмом людини або імуногенність. Для досягнення цієї мети TACI-Fc може бути зв’язаний, наприклад, із поліетиленгліколем (ПЕГ). ПЕГілювання може проводитися відомими способами, описаними, наприклад, у WO 92/13095. Функціональні похідні можуть також включати в себе, наприклад, аліфатичні ефіри карбоксильних груп, аміди карбоксильних груп, утворені реакцією з аміаком або з первинними або вторинними амінами, N-ацилпохідні вільних аміногруп амінокислотних залишків, утворені з ацильними частинами молекул (наприклад, алканоїльною або карбоциклічною ароїльною групами) або О-ацилпохідні вільних гідроксильних груп (наприклад, гідроксильних груп серильних або треонільних залишків), утвореними з ацильними частинами молекул. У третьому аспекті, цей винахід стосується білка, очищеного способом очищення відповідно до даного винаходу. Далі такий білок називається також “очищеним Fc-злитим білком”. Такий очищений Fc-злитий білок є переважно високоочищеним Fc-злитим білком. Високоочищений Fc-злитий білок визначають, наприклад, за присутністю єдиної смуги в забарвленому сріблом, невідновленому гелі електрофорезу в ДСН-ПААГ після нанесення білка в кількості 2 мкг на доріжку. Очищений Fc-злитий білок може бути також визначений за елюцією у вигляді єдиного піка у ВЕРХ. Препарат Fc-злитого білка, одержаний процесом очищення згідно з винаходом, може містити менше 20 % забруднень, переважно менше за 10 %, 5 %, 3 %, 2 % або 1 % забруднень, або він може бути очищений до гомогенності, тобто бути таким, що не містить яких-небудь детектованих білкових забруднюючих домішок згідно з визначенням, наприклад, електрофорезом у ДСН-ПААГ із забарвлюванням сріблом або ВЕРХ, як пояснено вище. Очищені Fc-злиті білки можуть бути призначені для терапевтичного застосування, зокрема, для введення пацієнтам-людям. Якщо очищений Fc-злитий білок вводять пацієнтам, його вводять переважно системно і переважно підшкірно або внутрішньом’язово, або місцево, тобто локально. Може бути зручним також ректальне або внутрішньооболонкове введення, залежно від конкретного медичного застосування очищеного Fc-злитого білка. Для цієї мети, у переважному варіанті здійснення даного винаходу, очищений Fc-злитий білок може бути приготований у вигляді фармацевтичної композиції, тобто разом із фармацевтично прийнятним носієм, ексципієнтами або т.ін. Визначення “фармацевтично прийнятний” включає в себе будь-який носій, який не перешкоджає ефективності біологічної активності активного інгредієнта і який не є токсичним стосовно хазяїна, якому його вводять. Наприклад, для парентерального введення цей активний білок (активні білки) можуть бути приготовані в уніфікованій (стандартній) формі для ін’єкції в таких носіях, як сольовий розчин, розчин декстрози, сироватковий альбумін і розчин Рінгера. Активні інгредієнти фармацевтичної композиції згідно з цим винаходом можуть вводитися індивідууму різними способами. Способи введення включають у себе інтрадермальний, трансдермальний (наприклад, у препаратах повільного вивільнення), внутрішньом’язовий, внутрішньчеревинний, внутрішньовенний, підшкірний, пероральний, внутрішньочерепний, епідуральний, місцевий, ректальний та інтраназальний способи введення. Може бути використаний будь-який інший терапевтично ефективний спосіб введення, наприклад, абсорбція через епітеліальні та ендотеліальні тканини або за допомогою генної терапії, де пацієнту вводять (наприклад, за допомогою вектора) ДНК-молекулу, яка кодує активний агент, що викликає експресію і секрецію цього активного агента in vivo. Крім того, білок (білки) цього винаходу можуть вводитися разом з іншими компонентами біологічно активних агентів, такими як фармацевтично прийнятні поверхнево-активні речовини, ексципієнти, носії, розріджувачі і наповнювачі. Для парентерального (наприклад, внутрішньовенного, підшкірного, внутрішньом’язового) введення, активний білок (активні білки) можуть бути приготовані у вигляді розчину, суспензії, емульсії або ліофілізованого порошку в асоціації з фармацевтично прийнятним парентеральним носієм (наприклад, водою, сольовим розчином, розчином декстрози) і добавками, які підтримують ізотонічність (наприклад, маннит) або хімічну стабільність (наприклад, консерванти і буфери). Цей препарат стерилізують способами, що звичайно використовуються. Терапевтично ефективні кількості активного білка (активних білків) будуть залежати від багатьох змінних, у тому числі від типу Fc-злитого білка, афінності Fc-злитого білка стосовно його ліганду, способу введення, клінічного стану пацієнта. “Терапевтично ефективна кількість” є такою кількістю, що при введенні цей Fc-злитий білок призводить до інгібування його ліганду терапевтичної частини цього Fc-злитого білка, як пояснювалося вище, і відповідно до таблиці 5 вище. Доза, що вводиться, у вигляді єдиної дози або у вигляді множинних доз, індивідууму, буде 15 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіюватися залежно від різних факторів, що включають у себе фармацевтичні властивості Fcзлитого білка, спосіб введення, стан і характеристики пацієнта (стать, вік, маса тіла, стан здоров’я, розмір), ступінь симптомів, одночасні способи лікування, частоту введення доз і бажаний ефект. Коректування встановлених діапазонів доз і маніпулювання ними знаходиться цілком у рамках кваліфікації фахівців у даній галузі, так само як і способи in vitro і in vivo визначення інгібування його ліганду терапевтичної частини Fc-злитого білка в індивідуумові. Очищений Fc-злитий білок може бути використаний у кількості 0,001-100 мг/кг або 0,01-10 мг/кг маси тіла або 0,1-5 мг/кг маси тіла або 1-3 мг/кг маси тіла або 2 мг/кг маси тіла. У наступних переважних варіантах здійснення, очищений білок Fc-злитий білок вводять один раз на день або кожний другий день або три рази на тиждень або один раз на тиждень. Добові дози звичайно вводять у розділених дозах або у вигляді форми затриманого вивільнення, ефективної для одержання бажаних результатів. Друге або подальше введення можуть виконуватися у вигляді дози, яка є такою ж самою, меншою або більшою, ніж початкова або попередня доза, введена цьому індивідууму. Друге або подальше введення може виконуватися під час або до прояву цього захворювання. Даний винахід стосується також композиції очищеного Fc-злитого білка, що містить позаклітинну частину члена суперсімейства рецепторів фактора некрозу пухлин (TNFR), одержаної за способом відповідно до цього винаходу, описаного детально вище, причому зазначена композиція містить менше 2 % або менше 1,5 % або менше 1 % або менше 0,7 % або менше 0,6 % або переважно менше 0,5 % агрегатів білка. Композиція цього винаходу переважно містить повністю інтактний Fc-злитий білок, який позбавлений не більш, ніж 1 або 2 амінокислот на його N- або С-кінці. Даний винахід стосується також композиції очищеного Fc-злитого білка, що містить позаклітинну частину члена суперсімейства рецепторів фактора некрозу пухлин (TNFR), одержаної за способом відповідно до цього винаходу, описаним детально вище, причому зазначена композиція містить менше 1 % або менше 0,8 % або менше 0,5 % або менше 0,1 % вільного Fc, визначеного вище. Такий Fc-злитий білок може бути, наприклад, одержаний з OX40, члена суперсімейства TNFR. Такі білки з OX40-функцією, наприклад, OX40-IgG1 і OX40-hIgG4mut, можуть бути переважно використані для лікування і/або попередження запальних і автоімунних захворювань, таких як хвороба Крона. Fc-злитий білок, що містить терапевтичну частину молекули, вибраний переважно з позаклітинного домену TNFR1, TNFR2 або їх TNF-зв’язувального фрагмента. У переважному варіанті здійснення, таким Fc-злитим білком є Етанерцепт, Fc-злитий білок, що містить розчинну частину TNFR р75 (наприклад, WO91/03553, WO 94/06476). Етанерцепт, очищений відповідно до даного винаходу, може бути використаний, наприклад, для лікування і/або попередження ендометріозу, інфекції вірусу гепатиту С, ВІЛ-інфекції, псоріатичного артриту, псоріазу, ревматоїдного артриту, астми, анкілозуючого спондиліту, серцевої недостатності, реакції трансплантат проти хазяїна, пневмофіброзу, хвороби Крона. Ленерцепт є злитим білком, що містить позаклітинні компоненти TNF-рецептора р55 людини і Fc-частину IgG людини, і призначений для потенційного лікування важкого сепсису і розсіяного склерозу. У наступному переважному варіанті здійснення, Fc-злитий білок містить терапевтичну частину, вибрану з позаклітинного домену BAFF-R, BCMA або TACI або їхнього фрагмента, зв’язуючого щонайменше один з Blys або APRIL. Fc-злитий білок, зроблений із BAFF-R, очищений відповідно до даного винаходу, може бути переважно використаний для лікування і/або попередження автоімунних захворювань, таких як ревматоїдний артрит (RA) і системний червоний вовчак (SLE). BCMA-Ig-злитий білок, очищений відповідно до даного винаходу, може бути переважно використаний для лікування і/або попередження автоімунних захворювань. Fc-злитий білок, зроблений із TACI (TACI-Fc), переважно містить поліпептид, вибраний із: a. амінокислот 34-66 SEQ ID NO: 2; b. амінокислот 71-104 SEQ ID NO: 2; с. амінокислот 34-104 SEQ ID NO: 2; d. амінокислот 30-110 SEQ ID NO: 2; е. SEQ ID NO: 3; f. SEQ ID NO: 4; g. поліпептиду, що кодується полінуклеотидом, що гібридизується з комплементом SEQ ID NO: 5 або 6 або 7, за умов гібридизації високої суворості; і h. мутеїну будь-якого із (с), (d), (е) або (f), що має щонайменше 80 % або 85 % або 90 % або 95 % ідентичність послідовності з поліпептидом (с), (d), (е) або (f); 16 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 причому цей поліпептид зв’язується щонайменше з одним із Blys або APRIL. Очищений TACI-Fc може бути переважно використаний для приготування лікарського засобу для лікування і/або попередження ряду захворювань або порушень. Такі захворювання або порушення переважно вибрані з автоімунних порушень, таких як системний червоний вовчак (SLE), ревматоїдний артрит (RA), а також розсіяного склерозу (MS). Очищений TACI-Fc може бути також використаний для лікування раку, наприклад, гематологічних злоякісних захворювань, таких як множинна мієлома (MM) і не-ходжкінська лімфома (NHL), хронічний лімфоцитарний лейкоз (CLL) і макроглобулінемія Вальденстрема (WM). Після повного опису цього винаходу, кваліфікованим у даній галузі фахівцям буде зрозуміло, що він може виконуватися в широкому діапазоні еквівалентних параметрів, концентрацій і умов без відхилення від ідеї та обсягу цього винаходу і без надмірного експериментування. Хоча цей винахід був описаний у зв’язку з його конкретними варіантами здійснення, буде зрозуміло, що він може бути підданий додатковим модифікаціям. Ця заявка призначена для включення будь-яких варіацій, застосувань або адаптації цього винаходу відповідно, загалом, до принципів цього винаходу і з включенням таких відхилень від даного опису, які знаходяться в межах відомої або звичайної практики в галузі, якої стосується цей винахід, і які можуть бути застосовані до основних ознак, описаних тут вище, як випливає з обсягу доданої формули винаходу. Всі цитовані тут посилання, у тому числі журнальні статті або анотації, опубліковані або неопубліковані заявки на патент США або іноземні заявки, видані США, або іноземні патенти або інші посилання, включені тут як посилання в повному вигляді, у тому числі з усіма результатами, таблицями, фігурами і текстом, представленими в цих посиланнях, що цитуються. Крім того, весь вміст цих посилань у цитованих тут документах включений тут у повному вигляді. Посилання на відомі стадії способу, загальноприйняті стадії способів, відомі способи або загальноприйняті способи ні в якій мірі не є визнанням того, що будь-який аспект, будь-який опис або будь-який варіант здійснення цього винаходу описаний, пояснений або висловлений як припущення у відомому рівні техніки. Попередній опис конкретних варіантів здійснення буде настільки повно виявляти основний характер цього винаходу, що інші дослідники можуть, за допомогою використання знань, що даються кваліфікацією в даній галузі (у тому числі наведеним змістом цитованих посилань), легко модифікують і/або адаптують для різного застосування такі конкретні варіанти здійснення, без надмірного експериментування, без відхилення від загальної концепції даного винаходу. Таким чином, передбачається, що така адаптація і модифікації знаходяться в діапазоні еквівалентів цих описаних варіантів здійснення, на основі тверджень і керівних описів, представлених у них. Повинно бути зрозумілим, що фразеологія або термінологія, яка застосовується тут, служить меті опису, а не обмеження, так що ця термінологія або фразеологія даного опису повинна інтерпретуватися кваліфікованим у даній галузі фахівцем у світлі пояснень і керівництва, представлених тут, у комбінації зі знаннями фахівця зі звичайною кваліфікацією в даній галузі. ПРИКЛАДИ ОЧИЩЕННЯ РЕКОМБІНАНТНОГО TACI-Fc ЛЮДИНИ З БЕЗСИРОВАТКОВОГО СУПЕРНАТАНТУ КЛІТИН СНО Перелік скорочень BV: об’єм шару CHO: яєчник китайського хомячка DSP: процес нижче за потоком EDTA: етилендіамінтетраоцтова кислота ELISA: твердофазний імуносорбентний аналіз HAC: гідроксіапатитна хроматографія HCP: білок клітини-хазяїна ВЕРХ: високоефективна рідинна хроматографія id: внутрішній діаметр K: калій кД: кілоДальтон) MES: 2-морфоліноетансульфонова кислота Na: натрій NaAc: ацетат натрію н.в.: не визначали 17 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 60 PA-SE-HPLC: Білок А – гель-проникаюча – високоефективна рідинна хроматографія м.ч.: мільйонні частки RO: зворотний осмос К.т.: кімнатна температура ДСН-ПААГ: додецилсульфат натрію поліакриламідний гель-електрофорез SE-HPLC: гель-проникаюча високоефективна рідинна хроматографія Т°С: температура TMAC: хлорид тетраметиламонію УФ: ультрафіолет WFI: вода для ін’єкцій WRO водний зворотний осмос Приклад 1 Стадія захоплення: Афінне очищення на Білкові А Початковим матеріалом був прояснений збір клону клітин СНО, що експресують TACI-Fc і що культивуються за безсироваткових умов і зберігаються в замороженому вигляді до використання. Стадію захоплення на колонці MabSelect Xtra™ (GE Healthcare 17-5269-03) проводили відповідно до наступного протоколу, на колонці, що має висоту шару 17 см. Всі операції виконували при кімнатній температурі, за винятком розчину для нанесення, який зберігали при температурі нижчій за 15 °С. Реєстрували сигнал УФ при 280 нм. Дезінфікування Колонку дезінфікували щонайменше 3 колонковими об’ємами (3 BV) 0,1 М оцтова кислота + 20 % етанол у зворотному потоці при 250 см/год. Цей потік зупиняли і витримували протягом 1 години. Стадія промивання Колонку промивали щонайменше 2 колонковими об’ємами (2 BV) RO води у зворотному потоці при 250 см/год. Зрівноваження Колонку зрівноважували щонайменше 5 колонковими об’ємами (5 BV) 25 мМ фосфат натрію + 150 мМ NaCl pH 7,0 (поки параметри провідності і рН знаходяться у зазначеному діапазоні: pH 7,0 ± 0,1, провідність 18 ± 2 мС/см) у спрямованому вниз потоці при 450 см/год. Нанесення На колонку наносили прояснений збір, що зберігається при температурі нижчій 15 °С, до ємності 15 мг загального TACI-Fc, визначеної аналізом Biacore, на мл упакованої смоли при швидкості потоку 350 см/год. Стадія промивання Цю колонку промивали щонайменше 2 колонковими об’ємами (2 BV) буфера для зрівноваження при 350 см/год, потім щонайменше 4 колонковими об’ємами (4 BV) буфера для зрівноваження (поки сигнал УФ не повертався до лінії фону) при 450 см/год. Елюція Цей матеріал елюювали різними буферами для елюції, як показано в таблиці І, при швидкості потоку 350 см/год. Фракцію елюату збирали від початку збільшення сигналу УФ до 6,0±0,5 BV елюції. Елюат інкубували протягом 1 години при кімнатній температурі при рН нижчому за 4,1 (доведеному додаванням розчину лимонної кислоти, якщо необхідно) і потім рН доводили до 5,0±0,1 додаванням 32% розчину NaOH. Регенерація Колонку регенерували щонайменше 3 колонковими об’ємами (3 BV) 50 мМ NaOH + 1 M NaCl у зворотному потоці при 450 см/год, зупиняли потік на 15 хвилин і потім знову запускали цей потік при 450 см/год щонайменше протягом протікання 3 колонкових об’ємів (поки сигнал УФ не повертався до лінії фону). З цієї стадії колонка працювала в режимі зворотного потоку. Стадія промивання Колонку промивали щонайменше 2 BV RO-води при 450 см/год. Дезінфікування Колонку дезінфікували щонайменше 3 BV буфера для дезинфекції при 250 см/год, потік зупиняли і колонку інкубували протягом 60 хвилин. Кінцеві стадії промивання Колонку промивали щонайменше 1 BV RO-води при 250 см/год, потім щонайменше 3 BV буфера для зрівноваження при 250 см/год і нарешті щонайменше 2 BV RO-води при 250 см/год. Нарешті, колонку зберігали після промивання щонайменше 3 BV 20 % етанолу при 250 18 UA 99263 C2 см/год. Результати Таблиця I Результати з використанням різних буферів для елюції Номер досліду 1 2 3 4 Буфер для елюції Вихід (%) 50 мМ NaAc pH3,7 100 мМ NaAc pH3,8 200 мМ NaAc pH3,8 100 мМ NaAc pH3,7 TACI-Fc Агрегати (%) 47,7 55,7 58,0 68 30,3 25,2 28,2 30,0 5 6 7 8 9 10 11 12 13 14 75,1 84,6 82,8 79,2 71,9 82,8 66,6 83,3 81,0 75,1 3,8 22 18,7 8,8 23 8,5 9,0 15,0 9,1 14,6 14 16 17 18 19 20 21 22 23 24 25 26 27 28 100 мМ Na-цитрат pH3,75 100 мМ Na-цитрат pH3,75 100 мМ Na-цитрат pH3,75 100 мМ Na-цитрат pH3,75 100 мМ Na-цитрат pH3,75 100 мМ Na-цитрат pH3,75 100 мМ Na-цитрат pH3,75 100 мМ Na-цитрат pH3,75 100 мМ Na-цитрат pH3,75 100 мМ Na-цитрат pH3,75 100 мМ Na-цитрат pH3,75 100 мМ Na-цитрат pH3,9 100 мМ Na-цитрат pH3,9 100 мМ Na Ac pH4,1 44,7 47,1 50,7 58,0 67,1 65,6 75,6 57,1 51,9 58 41,8 39,4 31,0 28,3 18,4 15,8 9,4 10,4 28,7 17,5 19,4 20,7 18,4 11,5 22,9 6,0 8,8 25,0 29 30 31 32 100 мМ Na-цитрат pH3,9 100 мМ NaAc pH4,1 100 мМ Na-цитрат pH3,75 100 мМ NaAc pH4,2 46,4 42,8 57,5 38,1 9,1 13,4 26,5 10,1 33 34 35 36 37 38 39 5 0,2M NaAc+150 мМ NaCl pH4 100мМ NaAc pH3,7 250мМ NaAc pH3,7 100мМ Na-цитрат pH3,7 250мМ Na-цитрат pH3,7 100мМ Na-цитрат pH3,75 100мМ Na-цитрат pH3,75 100мМ NaAc pH3,85 100мМ Na-цитрат pH3,75 100мМ Na-цитрат pH3,65 100 мМ Na-цитрат pH3,9 100 мМ Na-цитрат pH3,9 100 мМ Na-цитрат pH3,9 100 мМ Na-цитрат pH3,9 100 мМ Na-цитрат pH3,9 100 мМ Na-цитрат pH3,9 100 мМ Na-цитрат pH3,9 43,3 63,6 65,7 62,7 61,6 60,6 64,6 8,3 6,6 7,3 7,4 7,4 7,4 8,0 HCP (м.ч.) 5558 не визначали не визначали не визначали не визначали 3491 3318 4710 2347 1576 664 не визначали 3490 2580 3783 3217 2349 2550 2372 2353 1807 2465 2030 1746 3029 2424 2936 3311 не визначали не визначали не визначали не визначали 2011 1749 1689 1609 1479 1623 1497 Висновки TACI-Fc5 у проясненому зборі захоплювали безпосередньо на колонці MabSelect Xtra при динамічній ємності 15 г загального TACI-Fc5 на літр упакованої смоли при швидкості потоку 350 19 UA 99263 C2 5 10 см/год. Умови елюції, зокрема, pH, оптимізували для максимізації витягання продукту, при забезпеченні значного зменшення рівнів агрегатів. Був вибраний буфер для елюції 0,1 М цитрат натрію pH 3,9, що дає приблизно 5-10 % рівні агрегатів, у порівнянні з приблизно 25-40 % у проясненому зборі, без спостереження каламутності. Рівні HCP звичайно дорівнювали 15002000 м.ч. Рівні HCP вимірювали за допомогою ELISA із використанням поліклональних антитіл. Цю суміш антитіл генерували проти білків клітин-хазяїнів, одержаних із проясненого і концентрованого супернатанту культури клітин нетрансфікованих клітин СНО. Приклад 2 Катіонообмінна хроматографія Елюат зі стадії захоплення на Білку А, діалізований у придатний буфер для нанесення, використали як вихідний матеріал для катіонообмінної хроматографії. У цій стадії використали колонку Fractogel EMD SO3- (Merck 1.16882.0010), що має висоту SO 15 20 25 30 35 40 3 із висотою шару 15 см. В шару 10 см. Може бути використана також колонка Fractogel останньому випадку динамічна ємність і швидкість потоку можуть вимагати адаптації, яка знаходиться цілком у межах звичайних знань фахівця у даній галузі. Всі операції виконували при кімнатній температурі і швидкість потоку підтримували постійною при 150 см/год. При всіх часових точках реєстрували сигнал УФ при 280 нм. Стадія промивання Колонку промивали щонайменше 1 BV WRO (водним зворотним осмосом). Дезінфікування Потім колонку дезінфікували щонайменше 3 BV 0,5M NaOH + 1,5 М NaCl у режимі потоку вгору. Промивання Колонку промивали щонайменше 4 BV WRO у режимі потоку вниз. Зрівноваження Колонку зрівноважували щонайменше 4 BV 100 мМ цитратом натрію pH 5,0 (або поки не досягалися бажана провідність 121 мС/см і рН 5,00,1). Нанесення На колонку наносили матеріал після захоплення при рН 5,0 (pH при 5,00,1, провідність при 121 мС/см) і при ємності не більше 50 мг TACI-Fc, як визначено аналізом SE-HPLC, на мл упакованої смоли. Стадія промивання Потім колонку промивали щонайменше 5 BV 100 мМ фосфатом натрію pH 6,5. Елюція Колонку елюювали різними буферами і за різних умов, наведених у таблицях II-IV нижче. Регенерація і дезінфікування Колонку регенерували і дезінфікували 4 BV 0,5 M NaOH + 1,5 M NaCl у режимі потоку вгору. Потім потік зупиняли і витримували протягом 30 хвилин. Промивання Колонку промивали щонайменше 4 BV WRO. Зберігання Колонку зберігали щонайменше в 3 BV 20 % етанолу. Результати 20 UA 99263 C2 Таблиця II Дія рН і провідність при елюції Рівні HCP у нанесеному матеріалі: 189 м.ч. pH 6,5 7,3 8,0 7,3 7,3 7,3 7,3 7,3 6,3 8,0 8,2 6,5 7,3 7,3 5 Провідність (мС/см) 15,0 22,5 15,0 22,5 33,0 22,5 22,5 12,0 22,5 30,0 22,5 30,0 22,5 22,5 Витягання TACI-Fc 25 % 100 % 95 % 100 % 98 % 96 % 97 % 54 % 83 % 96 % 97 % 91 % 93 % 95 % НСР (м.ч.) 118 50 34 56 133 45 53 79 47 108 46 116 48 40 Кліренс НСР (х) 1,6 3,8 5,5 3,4 1,4 4,2 3,6 2,4 4,1 1,8 4,2 1,6 3,9 4,8 Таблиця III показує витягання TACI-Fc і кліренс HCP при нанесенні при ємності 10 і 32 мг TACI-Fc на мл смоли та елююванні у фосфатному буфері при провідності 12-33 мС/см. Збирання піка виконували від початку збільшення УФ протягом 100,5 BV. Таблиця III Дія оптимального рН і провідність при елюції при нанесенні при ємності 10 і 32 мг TACI-Fc на мл Рівні НСР у нанесеному матеріалі: 201 м.ч. Ємність (мг/мл) завантаження 10 32 Провідність (мС/см) 15,0 8,0 20,7 8,0 20,7 Витягання TACIКліренс НСР HCP (м.ч.) Fc (х) 91 % 67 3,0 93 % 61 3,3 88 % 54 3,7 pH Таблиця IV показує дію стадії промивання 50 або 100 або 150 мМ фосфатом натрію з рН 6,5 на витягання TACI-Fc і кліренс НСР. 10 Таблиця IV Дія умов стадії промивання на продуктивність колонки Рівні HCP у завантаженні: 190 м.ч. і рівні агрегатів: 2,0 % Концентрація фосфату в Вихід TACI-Fc промивальному розчині промивальному (мМ) розчині промивання (промивальний 50 розчин) 1 промивання (промивальний 100 розчин) 2 промивання (промивальний 150 розчин) 3 15 у Вихід TACI-Fc в Агрегати елюаті елюаті в НСР елюаті (м.ч.) 0,7 % 99 % 2,8 % 62 2,1 % 98 % 2,9 % 59 9,1 % 90 % 2,7 % в 49 Буфер, використаний у промивальному розчині 2, що містить 100 мМ фосфат натрію рН 6,5, мав провідність 8,4 мС/см. Фіг. 1 показує забарвлений сріблом, невідновлений гель електрофорезу в ДСН-ПААГ проб, одержаних з експериментів із використанням умов тристадійного промивання, показаних у таблиці IV на кліренсі вільного Fc. Фіг. 2 показує частково співпадаючі хроматограми експериментів зі стадіями очищення з фосфатом натрію за різних концентрацій. 21 UA 99263 C2 5 10 15 20 25 30 35 40 45 50 55 Стадію промивання оптимізували при рН 6,5 з концентраціями фосфату натрію, що збільшуються (50-150 мМ). Як можна бачити на фігурі 1, концентрація промивального буфера 150 мМ (промивання 3, доріжка 6) призводила до втрат TACI-Fc. Концентрація промивального буфера 50 мМ (промивання 1, доріжка 8) призводила до піка чистого TACI-Fc, однак цей елюат містив сліди вільного Fc. Стадія промивання зі 100 мМ фосфатом натрію pH 6,5 призводила до 98 % витягання в основному піку елюції і тільки 2 % втратам у цьому промиванні (фіг. 2). Кліренс HCP збільшувався в 3,2 рази. Аналіз фракцій промивання та елюату за допомогою електрофорезу в ДСН-ПААГ показав, що стадія промивання містила вільний Fc з деякою кількістю інтактного TACI-Fc при концентраціях буфера 100 мМ або вищих (фіг. 1, доріжки 4 і 6). Концентрація 100 мМ або більше є необхідною для повного видалення вільного Fc з фракцій елюату (фіг. 1, доріжки 5 і 7). Висновки Катіонообмінну стадію вводили як другу стадію очищення після стадії захоплення. Елюат стадії захоплення був при низькому рН (5,0) і низькій провідності і міг бути безпосередньо SO 3 із завантажувальною нанесений на катіонообмінник. Була вибрана смола Fractogel EMD місткістю 50 мг/мл. Продукт не біологічно активної деградації, вільний Fc, міг бути ефективно видалений на стадії промивання 0,1 М фосфатом натрію рН 6,5. Умови елюції були оптимізовані для найкращого кліренсу HCP і високого витягання TACI-Fc (179 мМ фосфат натрію рН 8,0, провідність 20,7 мС/см). Альтернативно, елюція може проводитися в 10 BV 20 мМ фосфату натрію і 180 мМ NaCl рН 8,0 від початку збільшення оптичної щільності при 280 нм. Приклад 3 Аніонообмінна хроматографія Вихідним матеріалом, що використовується для цієї стадії очищення, був елюат з So 3 (див. приклад 2), розведений або діалізований у катіонообмінної стадії на Fractogel придатний буфер для нанесення. Цю стадію аніонообмінної хроматографії проводили на колонці SOURCE 30Q (GE Healthcare 17-1275-01) із висотою шару 10 см. У цій стадії може бути також використана колонка SOURCE 30Q із висотою шару 15 см. В останньому випадку, динамічна ємність і швидкість потоку можуть вимагати адаптації, яка знаходиться цілком у межах звичайних знань фахівця в даній галузі. Всі операції виконували при кімнатній температурі і реєстрували сигнал УФ при 280 нм. Ці стадії проводили при швидкості потоку або 150, або 200 см/год. Промивання Спочатку цю колонку промивали щонайменше 1 BV RO води при швидкості потоку 150 см/год. Дезінфікування Потім колонку дезінфікували щонайменше 3 BV 0,5 M NaOH + 1,5 M NaCl. Стадія промивання Колонку промивали щонайменше 3 BV, переважно, 4-10 BV 0,5 M фосфату Na pH 7,5 при швидкості потоку 200 см/год. Зрівноваження Колонку зрівноважували щонайменше 5 BV 10, 15, 20, 25 або 30 мМ фосфату натрію pH 7,5. Необов’язково, ця колонка може бути заздалегідь зрівноважена 3 BV 0,5 M фосфату натрію pH 7,5. Нанесення, промивання і збирання забруднювачів TACI-Fc у потокові, що проходить На колонку наносили матеріал, одержаний після катіонообміну, розведений для одержання концентрації фосфату 10-30 мМ, рН 7,5 при ємності не більше 50 мг TACI-Fc, згідно з визначенням за допомогою аналізу SE-HPLC, на мл упакованої смоли, збираючи потік, що проходить, від початку збільшення УФ до кінця цієї стадії промивання, яку проводять у 4±0,5 BV буфери для зрівноваження. Регенерація/дезінфікування Цю колонку регенерували і дезінфікували щонайменше 3 BV 0,5 M NaOH + 1,5 M NaCl у режимі зворотного потоку (поки сигнал УФ не повертається до лінії фону) при швидкості потоку 150 см/год. У кінці цієї регенерації насос зупиняли на 30 хвилин. Стадія промивання Колонку промивали щонайменше 3 BV RO води при швидкості потоку 200 см/год. Зберігання Колонку зберігали щонайменше у 3 BV 20 % етанолу (об./об.). Результати 22 UA 99263 C2 Наступна таблиця V підсумовує результати, одержані з використанням способу очищення, описаного вище. Таблиця V Дія концентрації фосфату, що використовується для нанесення (завантаження) Концентрація рН фосфату завантаження завантаження (мМ) Концентрація TACI-Fc завантаження (мг/л) Ємність Витягання завантаження TACI-Fc (мг/мл) Агрегати HCP (м.ч.) 82, 8 7,5 7,5 7,5 7,5 30 25 20 15 773 639 651 437 39 39 49 46 94 % 90 % 90 % 88 % 10,4 % 6,9 % 4 5,6 % 3,4 % 9 50, 43, 45, 0 7,5 5 10 15 20 25 30 35 40 10 не визначали 283 82 % 2,8 % 26, 3 Висновки Аніонообмінну стадію на колонці Source 30Q у проточному режимі оптимізували для максимізації кліренсу HCP і агрегатів. Нанесення елюату з катіонообмінника, або розведеного, або діафільтрованого, у 20 мМ натрій-фосфатному буфері при рН 7,5 давало найкращий компроміс між витяганням продукту (90 %) і кліренсом HCP (приблизно від 2000 м.ч. до 44 м.ч.) і агрегатів (приблизно від 25 % до 5,6 %). Використали динамічну ємність 50 мг TACI-Fc на мл упакованої смоли при швидкості потоку 150-200 см/год. Приклад 4 Гідроксіапатитна хроматографія Початковим матеріалом, що використовувався для цієї стадії очищення, був потік аніонообмінної хроматографії, що проходить (див. приклад 3). Використали CHT Ceramic Hydroxyapatite Type I (СНТ керамічний гідроксіапатит Типу I), колонку 40 мкм (Biorad 157-0040) із висотою шару 10 см. Всі операції проводили при кімнатній температурі. Швидкість потоку підтримували постійною при 175 см/год і реєстрували сигнал УФ при 280 нм. Всі розчини стерильно фільтрували та обладнання дезінфікували гідроксидом натрію перед використанням. Колонку зберігали в 0,5 M розчині NaOH, коли її не використовували. Початкові стадії промивання (промивання і попереднє зрівноваження) Цю колонку промивали щонайменше 1 BV 20 мМ буфера фосфату натрію pH 7,5 і потім щонайменше 3 BV 0,5 мМ буфера фосфату натрію рН 7,5 для зниження рН. Зрівноваження Колонку зрівноважували щонайменше 5 BV 20 мМ фосфату натрію pH 7,5 (або поки не досягалися бажана провідність 3,0 0,3 мС/см і рН 7,5 0,1). Нанесення На колонку наносили потік, що проходить, із колонки SOURCE 30Q із доданим хлоридом кальцію до кінцевої концентрації 0,1 мМ із початкового розчину при 0,5 М і рН доводили до 7,0 додаванням 85 % ортофосфорної кислоти при ємності NMT 50 мг TACI-Fc, визначеній за допомогою аналізу SE-HPLC, на мл упакованої смоли. Можна також наносити потік, що проходить, із колонки SOURCE 30Q без хлориду кальцію, з доведенням до рН 7,0 на гідроксіапатитній колонці. Стадії промивання Цю колонку промивали щонайменше 4 BV 3, 4 або 5 мМ фосфатом натрію, 10 мМ MES, 0,1 мМ CaCl2 pH 6,5. У цих стадіях можна також використати той же самий буфер без хлориду кальцію. Елюція Колонку елюювали 5, 4, 3 або 2 мМ натрій-фосфатним буфером (див. таблицю VI), 10 мМ MES, 0,1 мМ CaCl2 і 0,6, 0,7, 0,8 або 0,9 M KCl pH 6,5 (див. таблицю VII) від початку збільшення УФ для різних BV (див. таблиці VI і VII). Для елюції можна також використати той же самий буфер без хлориду кальцію. 23 UA 99263 C2 5 10 Промивання Колонку промивали: - щонайменше 1 BV 20 мМ натрій-фосфатного буфера pH 7,5; - щонайменше 3 BV 0,5 M натрій-фосфатного буфера pH 7,5; і - щонайменше 1 BV 20 мМ натрій-фосфатного буфера pH 7,5. Зберігання Цю колонку зберігали щонайменше в 3 BV 0,5 M NaOH. Результати Таблиця VI показує дію концентрації фосфату (від 2 до 5 мМ) у буфері для елюції на кліренс агрегатів і витягання продукту. Фракції піка елюції об’єднували та аналізували за допомогою SEHPLC на концентрацію TACI-Fc і рівні агрегатів. Таблиця VI Дія концентрації фосфату в буфері елюціїї Концентрація фосфату (мМ) 5 4 3 2 15 BV елюції 12 13 14 15 16 17 18 12 13 14 15 16 17 18 12 13 14 15 16 17 18 12 13 14 15 16 17 18 Вихід TACI-Fc 73 % 74 % 68 % 77 % 77 % 70 % 76 % 68 % 67 % 66 % 67 % 66 % 66 % 66 % 70 % 76 % 73 % 71 % 69 % 69 % 70 % 65 % 66 % 66 % 68 % 66 % 71 % 65 % Агрегати 0,49 % 0,52 % 0,65 % 0,67 % 0,70 % 0,73 % 0,85 % 0,34 % 0,29 % 0,36 % 0,39 % 0,38 % 0,32 % 0,40 % 0,46 % 0,42 % 0,51 % 0,52 % 0,55 % 0,50 % 0,53 % 0,19 % 0,00 % 0,18 % 0,14 % 0,17 % 0,19 % 0,16 % Таблиця VII показує дію концентрації KCl у буфері для елюції на кліренс агрегатів і витягання продукту. Досліджували дві концентрації фосфату натрію: 2 і 3 мМ. Фракції піка елюції об’єднували і аналізували за допомогою SE-HPLC на концентрацію TACI-Fc і рівні агрегатів. 24 UA 99263 C2 Таблиця VII Дія концентрації хлориду калію в буфері для елюції Концентрація (мМ) фосфату Концентрація (М) 3 3 20 25 30 0,6 2 15 0,8 2 10 0,7 3 5 0,6 0,9 KCl BV елюції 10 11 12 13 14 10 11 12 13 14 10 11 12 13 14 10 11 12 13 14 10 11 12 13 14 Вихід TACI Агрегат и Fc 102 % 109 % 106 % 105 % 103 % 96 % 97 % 98 % 96 % 96 % 106 % 110 % 112 % 101 % 110 % 71 % 79 % 80 % 80 % 81 % 64 % 72 % 73 % 70 % 66 % 0,48 % 0,46 % 0,43 % 0,42 % 0,43 % 0,42 % 0,40 % 0,41 % 0,40 % 0,43 % 0,58 % 0,55 % 0,57 % 0,59 % 0,57 % 0,29 % 0,28 % 0,29 % 0,29 % 0,26 % 0,27 % 0,25 % 0,29 % 0,33 % 0,24 % Висновки: Гідроксіапатитна хроматографія забезпечує надійний ефективний спосіб зменшення рівнів агрегатів TACI-Fc. Із використанням як вихідний матеріал очищеного аніонообмінною хроматографією матеріалу (див. приклад 3) із рівнями агрегатів приблизно 5-8 %, гідроксіапатитна хроматографія може зменшувати ці рівні до менше 0,8 % із витяганням TACIFc 85-90 %. ЗАГАЛЬНИЙ РЕЗУЛЬТАТ Був розроблений чотиристадійний спосіб очищення для TACI-Fc, що призводить до високо очищеного TACI-Fc, із загальним зменшенням агрегатів до менше 1 % (0,2-0,8 % у п’яти експериментах), загальним зменшенням НСР до приблизно 5-10 м.ч. і загальним зменшенням рівнів вільного Fc до менше 0,5 % (0,2 і 0,1 % у двох експериментах). ПОСИЛАННЯ 1. Akerstrom and Bjork, J Biol Chem. 1989 Nov 25;264(33): 19740-6 2. Altschul S F et al., J Mol Biol, 215, 403-410, 1990 3. Altschul S F et al., Nucleic Acids Res., 25:389-3402, 1997 4. Armour KL. et al., 1999. Recombinant human IgG molecules lacking Fcgamma receptor I binding and monocyte triggering activities. Eur J Immunol. 29(8):2613-24 5. Black et al., US 2002/0115175 6. Bodmer et al., TIBS 27(1), 19-24 7. Boschetti, Е., Jungbauer, Sep. Sci. & Tech. 2 No. 15, Acad. Press (2000) 53 8. Boschetti et al., Genetic EnGlneering Vol. 20, No. 13, July, 2000 9. Bossen et al., JBC 281 (2), 13964-13971 10. Bram and von Bulow, US 5,969,102 (1999) 11. Bram et al., WO 98/39361 12. Carter PJ., 2006. Potent antibody therapeutics by design. Nature Reviews Immunology. Advance online publication 13. Devereux J et al, Nucleic Acids Res, 12, 387-395, 1984 14. Feng et al., Bioprocessing 2005, 1-7 25 UA 99263 C2 5 10 15 20 25 30 35 40 45 15. Giovannini, Biotechnology and Bioengineering 73:522-529 (2000) 16. Grantham et al., Science, Vol. 185, pp. 862-864 (1974) 17. Gross et al., Nature 404(27), 995-999 18. Gross et al., WO 00/40716 19. Hinton PR. et al., 2004. Engineered human IgG antibodies with longer serum half-lives in primates. J Biol Chem. 279(8):6213-6 20. Hymowitz et al., JBC 280(8), 7218-7227 21. Idusogie EE. et al., 2000. Mapping of the C1q binding site on rituxan, а chimeric antibody with а human IgGI Fc. J Immunol. 164(8):4178-84 22. Idusogie EE. et al., 2001. Engineered antibodies with increased activity to recruit complement. J Immunol. 166(4):2571-5 23. Ishihara, EP 1614693 24. Kabat, E. A., Wu, T. T., Perry, H. M., Gottesman, K. S., and Foeller, С. (1991), Sequences of Proteins of Immunological Interest, 5th Ed., National Institutes of Health, Bethesda, MD 25. Kochanek et al., EP 1 230 354 26. Locksley et al., Cell 104, 487-501, 2001 27. Melchers, Ann. Rheum. Dis 2003, 62, 25-27 28. Moore et al., Science 285: 260-3 29. Moreau et al., Blood 103(8), 3148-3157 30. Naismith and Sprang, TIBS 23, 74-79, 1998 31. Novak et al., Blood 103(2), 689-694 32. Rixon et al., WO 02/094852 33. Pearson, Methods Enzymol. 1990;183:63-98 34. Porath, J. Carlsson, I. Olsson, and G. Belfrage, Nature (London) 258, 598-599 (1975) 35. Porath and B. Olin, Biochemistry 22, 1621-1630 (1983) 36. Puren et al., Proc Natl Acad Sci USA. 1999 Mar 2;96(5):2256-61 37. Shepard, J. of Chromatography 891:93-98 (2000) 38. Shields RL. et al., 2001. High resolution mapping of the binding site on human IgG1 for Fc gamma Rl, Fc gamma RII, Fc gamma RIII, and FcRn and design of IgGI variants with improved binding to the Fc gamma R. J Biol Chem. 276(9):6591-604. 39. Smith et al., WO 91/03553 40. Smith et al., WO 94/06476 41. Stanker, J. Immunological Methods 76:157-169 (1985) (10 mM to 30 mM sodium phosphate elusion gradient) 42. Steurer W. et al., 1995. Ex vivo coating of islet cell allografts with murine CTLA4/Fc promotes graft tolerance. J Immunol. 155(3): 1165-74 43. Sun et al., WO 2005/044856 44. Takeda et al., EP 1 561 756 45. Tarditi, J. Chromatography 599:13-20 (1992) 46. Vaccaro C. et al., 2005. Engineering the Fc region of immunoglobulin G to modulate in vivo antibody levels. Nat Biotechnol. 23(10): 1283-8 47. Vigers et al., Nature. 1997 Mar 13; 386(6621 ):190-4 48. Vedantham et al., WO 03/59935 49. Vola et al., BioTechniques 14:650-655 (1993) 50. von Bulow and Bram, Science 228: 138 (1997) 51. Xia et al., J. Exp. Med. 2000, 137-143. 26 UA 99263 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 60 1. Спосіб очищення Fc-злитого білка, що має ізоелектричну точку (рІ) 6,9-9,5, що передбачає наступні стадії: a) піддавання рідини, що містить зазначений Fc-злитий білок, Білок А- або Білок G-афінній хроматографії; b) піддавання елюату зі стадії (а) катіонообмінній хроматографії; с) піддавання елюату зі стадії (b) аніонообмінній хроматографії; і d) піддавання фракції стадії (с), що проходить, гідроксіапатитній хроматографії і збирання елюату для одержання очищеного Fc-злитого білка. 2. Спосіб за п. 1, де елюцію в стадії (а) проводять при рН у діапазоні від 2,8 до 4,5. 3. Спосіб за будь-яким із попередніх пунктів, де стадія (b) додатково передбачає: b.l) промивання катіонообмінної смоли після нанесення буфером, що має рН у діапазоні від 6,0 до 7,0 і провідність у діапазоні від 6 до 10 мС/см; і b.2) елюцію колонки при рН у діапазоні від 7,3 до 8,2 і провідності у діапазоні від 15 до 22 мС/см. 4. Спосіб за будь-яким із попередніх пунктів, де в стадії (с) зрівноваження і нанесення проводять у буфері, що має провідність 3-4,6 мС/см і рН на одну одиницю нижче, ніж величина рІ Fcзлитого білка. 5. Спосіб за будь-яким із попередніх пунктів, де елюцію в стадії (d) проводять у присутності фосфату натрію в діапазоні концентрацій від 3 до 10 мМ. 6. Спосіб за будь-яким із попередніх пунктів, де елюцію в стадії (d) проводять у присутності хлориду калію в діапазоні від 0,4 до 1 М. 7. Спосіб за будь-яким із попередніх пунктів, де елюцію в стадії (d) проводять при рН у діапазоні від 6 до 7. 8. Спосіб за будь-яким із попередніх пунктів, де стадію (а) проводять на смолі, що містить зшиту агарозу, модифіковану рекомбінантним Білком А або Білком G. 9. Спосіб за будь-яким із попередніх пунктів, де стадію (b) проводять на сильній катіонообмінній смолі. 10. Спосіб за п. 9, де зазначена смола містить зшитий метакрилат, модифікований SО3 групами. 11. Спосіб за будь-яким із попередніх пунктів, де стадію (с) проводять на сильній аніонообмінній смолі. 12. Спосіб за п. 11, де зазначена смола містить полістирол/дивінілбензол, модифікований + N (СН3)3. 13. Спосіб за будь-яким із попередніх пунктів, де стадію (d) проводять на керамічній гідроксіапатитній смолі. 14. Спосіб за п. 13, де керамічна гідроксіапатитна смола містить частинки з розміром 40 мкм. 15. Спосіб за будь-яким із попередніх пунктів, що додатково передбачає щонайменше одну стадію ультрафільтрації. 16. Спосіб за п. 15, де стадію ультрафільтрації проводять між стадіями (b) і (с) і/або після стадії (d). 17. Спосіб за будь-яким із попередніх пунктів, що додатково передбачає приготування Fcзлитого білка у вигляді фармацевтичної композиції. 18. Спосіб за будь-яким із попередніх пунктів, де Fc-злитий білок має рІ 8-9. 19. Спосіб за будь-яким із попередніх пунктів, де Fc-злитий білок має рІ 8,3-8,6. 20. Спосіб за будь-яким із попередніх пунктів, де Fc-злитий білок містить лігандзв'язувальну частину члена суперсімейства рецепторів фактора некрозу пухлини (TNFR). 21. Спосіб за п. 20, де лігандзв'язувальна частина вибрана з позаклітинного домену TNFR1, TNFR2 або їхнього TNF-зв'язувального фрагмента. 22. Спосіб за п. 20, де лігандзв'язувальна частина вибрана з позаклітинного домену BAFF-R, ВСМА, ТАСІ або їхнього фрагмента, що зв'язує щонайменше один із Blys або APRIL. 23. Спосіб за п. 22, де Fc-злитий білок містить поліпептид, вибраний із: a) амінокислот 34-66 SEQ ID NO: 2; b) амінокислот 71-104 SEQ ID NO: 2; c) амінокислот 34-104 SEQ ID NO: 2; d) амінокислот 30-110 SEQ ID NO: 2; e) SEQ ID NO: 3; f) SEQ ID NO: 4; g) поліпептиду, що кодується полінуклеотидом, який гібридизується з комплементом SEQ ID NO: 5 або 6, або 7 за умов високої суворості; і 27 UA 99263 C2 5 10 15 20 25 h) мутеїну будь-якого із (с), (d), (e) або (f), що має щонайменше 80 % або 85 %, або 90 %, або 95 % ідентичність послідовності з поліпептидом (с), (d), (e) або (f); де поліпептид зв'язується щонайменше з одним із Blys або APRIL. 24. Спосіб за будь-яким із попередніх пунктів, де Fc-злитий білок містить константну ділянку важкого ланцюга імуноглобуліну. 25. Спосіб за п. 24, де константна ділянка є константною ділянкою імуноглобуліну людини. 26. Спосіб за п. 24 або 25, де імуноглобуліном є IgG1. 27. Спосіб за будь-яким із пп. 23-25, де ця константна ділянка містить шарнірну ділянку, СН 2- і СН3-домени. 28. Композиція очищеного Fc-злитого білка, одержана за допомогою способу за будь-яким із попередніх пунктів, де Fc-злитий білок містить поліпептид, вибраний із: a) амінокислот 34-66 SEQ ID NO: 2; b) амінокислот 71-104 SEQ ID NO: 2; c) амінокислот 34-104 SEQ ID NO: 2; d) амінокислот 30-110 SEQ ID NO: 2; e) SEQ ID NO: 3; f) SEQ ID NO: 4; g) поліпептиду, що кодується полінуклеотидом, який гібридизується з комплементом SEQ ID NO: 5 або 6, або 7 за умов високої суворості; і h) мутеїну будь-якого із (с), (d), (e) або (f), що має щонайменше 80 % або 85 %, або 90 %, або 95 % ідентичність послідовності з поліпептидом (с), (d), (e) або (f); де цей поліпептид зв'язується щонайменше з одним із Blys або APRIL; і де зазначена композиція містить менше 1 % або менше 0,5 % агрегатів білка; і де зазначена композиція містить менше 1 % або менше 0,5 %, або менше 0,1 % вільного Fcбілка. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the purification of fc-fusion protein
Автори англійськоюEon-Duval, Alex, Lamproye, Alain
Назва патенту російськоюСпособ очистки fc-слитого белка
Автори російськоюЭон-Дюваль Алекс, Лампруа Ален
МПК / Мітки
МПК: C07K 1/36, A61K 38/02
Мітки: спосіб, білка, fс-злитого, очищення
Код посилання
<a href="https://ua.patents.su/38-99263-sposib-ochishhennya-fs-zlitogo-bilka.html" target="_blank" rel="follow" title="База патентів України">Спосіб очищення fс-злитого білка</a>
Попередній патент: Спосіб зменшення концентрації вільних fc-частин в рідині, що містить fc-вмісний білок
Наступний патент: Пристрій для випускання двофазної суміші
Випадковий патент: Компактний електродуговий вібратор рідкого металу