Спосіб прогнозування порушень центральних механізмів регуляції гонадотропоцитів гіпофізу при гіперурикемії
Номер патенту: 20885
Опубліковано: 07.10.1997
Автори: Баринов Едуард Федорович, Баринова Марія Едуардовна, Гринь Вячеслав Костянтинович, Синяченко Олег Володимирович, Бондаренко Надія Миколаївна, Ніколенко Ольга Гнатівна
Формула / Реферат
Способ прогнозирования нарушений центральных механизмов регуляции гонадотропоцитов гипофиза при гиперурикемии, включающий проведение фармакологической пробы экзогенным люлиберин (ЛГ-РГ) и оценку уровня лютеинизирующего гормона (ЛГ) в крови до- и после ее введения, отличающийся тем, что предварительно вводят дезоксикортикостерона ацетат (ДОКА), в количестве 15-20 мг/кг массы, а результат фармакологической пробы оценивают по повышению уровня ЛГ, который регистрируют на 5 и 30 мин после введения ЛГ-РГ, при этом, если прирост уровня ЛГ по отношению к 5-й мин составит меньше 41 %, то прогнозируют нарушение центральных механизмов регуляции гонадотропоцитов гипофиза при гиперурикемии.
Текст
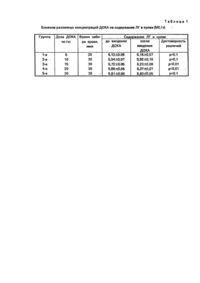
Заявляемый способ прогнозирования нарушений центральных механизмов регуляции гонадотропоцитов гипофиза при гиперурикемии относится к области экспериментальной медицины и биологии, в частности, к нагрузочным тестам определения функционального состояния гипоталамо-гипофизарной системы, и может быть использован при моделировании гиперурикемии для отбора животных в хронический эксперимент или выявления животных, предрасположенных к гиперурикемии и выбраковки животных. Известен способ определения функционального состояния центральной нервной системы (ЦНС) [Авт.св. СССР № 1426542, кл. А 61 В 10/00, G 01 N 33/48, 1988] путем проведения фармакологической пробы и исследования в эритроцитах крови основных ионов до- и после проведения фармакологической пробы. Выполняют способ путем введения внутривенно Новодрина в количестве 1,0 мл, а через 5 мин исследуют в эритроцитах концентрацию ионов Na+, K+ и Са2+. В случае уменьшения содержания К+ и Са2+ и увеличения Nа+ определяют возбуждение нервной системы. Недостатком известного способа является то, что оценивают функциональные процессы возбуждения или торможения, охватывающие всю центральную нервную систему, без селективного анализа гипоталамогипофизарной системы. Так, по нашим данным, вероятность прогнозирования нарушений центральных механизмов регуляции гипофиза по описанному выше способу не превышает 20%. Наиболее близким по технической сути заявляемому способу является способ диагностики гипоталамогипофизарной системы [Бутрова С.А. Функциональные тесты, применяемые для диагностики гипоталамогипофизарных заболеваний (лекция) // Проблемы эндокринологии. - 1990, -Т.36, № 6. - С.48-51], включающий проведение фармакологической пробы с введением экзогенного люлиберина (ЛГ-РГ) и последующую оценку изменения содержания в крови лютеинизирующего гормона (Л Г) но сравнению с исходным уровнем. Способ-прототип включает следующие приемы: 1) у больного из вены забирают 10 мл крови для радиоиммунологического определения в плазме исходного уровня половых гормонов (лютеинизирующего гормона-ЛГ и фолликулостимулирующе го гормона ΦCГ); 2) внутривенно одномоментно вводят 100 мкг ЛГ-РГ и через каждые 30 мин в течение 2-х часов исследуют содержание в периферической крови лютеинизирующего гормона (Л Г); 3) если к 30-й минуте содержание ЛГ не превышает исходный уровень в 5 раз, и/или к 60-й мин ФСГ не превышает исходный уровень в 3 раза, то диагностируют наличие гипофизарной патологии, обусловливающей нарушение секреции гонадотропинов. Недостатком известного способа является то, что исследуют только гипофизарное звено центральных механизмов, при этом отсутствует возможность оценки влияния гипоталамуса, гиппокампа и подкорковых структур, способных активизировать резервные механизмы регуляции функции гона* дотропоцитов. Описанный подход базируется на предположении о неизменности оптимального уровня и соотношения внутриклеточных вторичных мессенджеров (прежде всего цАМФ), реализующих механизм нейросекреции, в т.ч. ЛГ. Это справедливо при отсутствии каких-либо системных метаболических нарушений, способных изменить а головном мозге содержание биологически активных ве ществ, вторичных мессенджеров или медиаторов. В противном случае наличие патохимических процессов в мозге сопровождается активацией компенсаторно-приспособительных механизмов, которые, как раз и определяют прогноз течения патологического процесса. Проведение в этом случае фармакологического теста с ЛГ-РГ позволяет оценить только гипофизарное звено регуляции содержания в крови половых гормонов, а достоверность прогноза нарушений центральных механизмов регуляции гонадотропоцитов гипофиза при гиперурикемии достигает лишь 50%. В основу изобретения поставлена задача прогноза нарушений центральных механизмов регуляции гонадотропоцитов гипофиза при гиперурикемии путем предварительного введения дезоксикортикостерона ацетата (ДОКА) в количестве 15-20 мг/кг массы, и проведения фармакологической пробы экзогенным люлиберином (ЛГ-РГ) с последующей оценкой уровня лютеинизирующего гормона (Л0 в крови до- и после ее проведения, а результат фармакологической пробы оценивают по повышению уровня Л Г, который регистрируют на 5 и 30 мин после введения ЛГ-РГ, при этом, если прирост уровня ЛГ по отношению к 5-й мин составит меньше 41%, то прогнозируют нарушение центральных механизмов регуляции гонадотропоцитов гипофиза при гиперурикемии. Это позволит активировать резервные механизмы регуляции функции гонадотропоцитов со стороны гипоталамуса, гиппокампа и подкорковых структур мозга и, следовательно, объективно проанализировать действительно центральные механизмы регуляции, а не только его гипофизарное звено, благодаря такому подходу повышается точность прогноза, сокращается время исследования и уменьшаются материальные затраты. Кроме того, прирост ЛГ в крови, будет отражать мощность компенсаторно-приспособительных метаболических процессов в гипофизе, которые являются основой формирования механизмов выздоровления (саногенеза) или прогрессирования патологического процесса. Вследствие активации компенсаторно-приспособительных механизмов в структурах головного мозга удастся стандартизировать условия проведения фармакологической пробы, а значит - добиться сопоставимости результатов исследования у разных животных. Суть изобретения заключается в том, что предварительно вводят дезоксикортико-стерона ацетат (ДОКА) в количестве 15-20 мг/кг массы, а результат фармакологической пробы оценивают по повышению уровня лютеинизирующего гормона (ЛГ), который регистрируют на 5 и 30 мин после введения экзогенного люлиберина (ЛГ-РГ). при этом, если прирост уровня Л Г по отношению к 5-й мин составит меньше 41%, то прогнозируют нарушение центральных механизмов регуляции гонадотропоцитов гипофиза при гиперурикемии. Разработка заявляемого способа стала возможной благодаря впервые установленному авторами следующему научному .факту. Было замечено, что без специального отбора животных по различным биохимическим и физиологическим показателям воспроизводимость гиперурикемии составляла 37,7% через 30 дней моделирования патологического процесса. Такое явление увеличивало стоимость и снижало эффективность работы, поскольку ограничивало количество животных, которые могли быть использованы для исследований. Это побудило провести различные биохимические, морфологические и физиологические исследования, направленные на выявление тех показателей гомеостаза, которые являются наиболее информативными в плане прогнозирования воспроизведения гиперурикемии. В результате такого анализа установлено, что в случае успешного моделирования гиперурикемии, статистически достоверно возрастает внутриклеточное содержание аденозина и цАМФ в стр уктурах головного мозга (гипоталамусе, гиппокампе и подкорковых структурах). Это происходило вследствие высокой активности фермента 51-нуклеотидазы (51НК), синтезирующего аденозин. Более того, введение этим животным Диоксикортикостерона ацетата (ДОКА) приводило к избирательному повышению активности фермента 51ТК, тогда как активность фермента аденозиндезаминазы (АД-3А), разрушающего аденозин, не изменялась. Поскольку аденозин превращается в цАМФ, а последний является посредником между сигналом с рецептора гонадотропоцита и внутриклеточным ответом (в рассматриваемом случае - экзоцито-зом гранул гормона), то по приросту в крови содержания ЛГ в ответ на введение ЛГ-РГ можно в хроническом эксперименте судить о метаболизме аденозина и соответственно уровне цАМФ. Если у животных, модель гиперурикемии воспроизводилась не в полном объеме (не возникала уратная кардиомиопатия или нефропатия), или - не воспроизводилась совсем, то в нейронах гипоталамуса, гиппокампа имело место снижение внутриклеточного уровня аденозина и цАМФ. Э то было следствием высокой активности фермента АДЗА, разрушающего аденозин. Причем введение этим животным ДОКА сопровождалось преимущественным повышением активности именно АДЗА и являлось, по сути, отражением активации компенсаторно-приспособительных механизмов, направленных на нормализацию уровня аденозина при моделировании гиперурикемии. Следовательно, более высокая активность АД3А по сравнению с 51-НК и возможность ее существенного прироста при необходимости, является причиной низкой воспроизводимости гиперурикемии у этих животных. Таким образом, в структура х головного мозга при моделировании гиперурикемии у разных животных формируется противоположная динамика содержания аденозин-цАМФ, вследствие активации ферментов синтеза или превращения аденозина. Такая непредсказуемость уровня цАМФ в нейронах конкретного животного в момент проведения фармакологической пробы с ЛГ-РГ, делает невозможным достоверный прогноз на основании исследования концентрации ЛГ в циркулирующей крови. Выход из положения видится в том, что пробу с Л Г-РГ проводят на фоне введения ДОКА, т.е. предварительной стимуляции компенсаторноприспособительных механизмов, определяющих содержание аденозина в различных структурах мозга. При этом можно рассчитывать, что, во-первых, введение ДОКА за 5-6 ч до фармакологической пробы с ЛГ-РГ позволит активировать резервные механизмы регуляции функции гонадотропоцитов со стороны гипоталамуса, гиппокампа и подкорковых структур мозга и, следовательно, проанализировать объективно действительно центральные механизмы регуляции, а не только его гипофизарное звено. Во-вторых, уровень аденозин-цАМФ, а значит прирост ЛГ в крови, будет отражать мощность компенсаторно-приспособительных метаболических процессов в гипофизе, которые являются основой формирования механизмов выздоровления (саногенеза) или прогрессирования патологического процесса. В-третьих, вследствие активации компенсаторно-приспособительных механизмов в структурах головного мозга удастся стандартизировать условия проведения фармакологической пробы, а значит - добиться сопоставимости результатов исследования у разных животных. Прирост ЛГ в. циркулирующей крови в ответ на введение экзогенного ЛГ-РГ был выбран как наиболее информативный показатель. Прогностическая значимость указанного показателя подтверждена статистически с помощью интегративного пакета прикладных программ Statistical Grafics Corparatlon на ПЭВМ IBM PC/AT. Это можно объяснить тем, что одним из ведущи х звеньев в реакциях организма при моделировании гиперурикемии является активация ферментов пуринового обмена, в том числе изменяющих уровень аденозина. Действительно, при гиперурикемии изменяется активность ферментов, превращающих аденозин. Последний определяет внутриклеточное содержание цАМФ и, как следствие, устанавливается должный уровень секреции в кровь ЛГ. Использованный нами метод определения ЛГ - общепризнан, является чувствительным и информативным. Предлагаемый показатель прироста ЛГ в циркулирующей крови в ответ на введение ЛГ-РГ сам по себе не несет информации о воспроизводимости гиперурикемии. Прогностическое значение может иметь изучение прироста Л Г при введении ЛГ-РГ на фоне искусственной стимуляции ферментов, принимающих участие в синтезе и распаде аденозина. Достижение технического результата данного изобретения основано на предварительном (за 5-6 ч до начала проведения фармакологического теста с ЛГ-РГ) введении ДОКА (15 мг/кг массы). Наши исследования показали, что если дальнейший отбор животных проводить по уровню прироста ЛГ на фоне предварительного введения ДОКА, то прогноз воспроизведения гиперурикемии повышается до 84,6%. Реализацию способа осуществляют следующим образом. Берут из вивария животных, содержащихся в одинаковых условиях, одинаковых по полу и возрасту и адаптируют к среде лаборатории. В течение 7 дней у животных моделируют гиперурикемию (нарушения пуринового обмена) путем скармливания животным аутолизата дрожжей (источник пуринов) с молибдатом аммония (стимулятор ксантиноксидазы) и инозином (предшественником мочевой кислоты). В день исследования животному под легкой анестезией в яремную вену вводят катетер для получения микродоз крови. В полученном образце отделяют плазму и в ней радиоиммунным методом (набор фирмы "International Cis", Франция) определяют содержание ЛГ. Вводят 1520 мг/кг массы ДОКА и через 5-6 часов проводят фармакологическую пробу с экзогенным ЛГ-РГ (140 нг/кг массы). Затем через 5 и 30 минут забирают кровь для радиоиммунного исследования ЛГ. В случае, если прирост уровня ЛГ к 30-й мин составляет менее 41 % по отношению к таковому на 5-й мин, то прогнозируют нарушение центральных механизмов регуляции гонадотропоцитов гипофиза и такое животное не включают в длительный хронический эксперимент. Таким образом, совокупность существенных признаков способа позволяет активизировать резервные механизмы регуляции функции гонадотропоцитов гипофиза, за счет чего повышается точность прогноза, сокращается время исследования и уменьшаются материальные затраты на проведение экспериментов. Приводим конкретные примеры реализации заявляемого способа отбора животных в хронический эксперимент. Πример 1. Поиск оптимальной дозы ДОКА проведен на 5 группах равноценных животных (по весу, полу, условиям содержания). Гиперурикемию моделировали путем скармливания гидролизата дрожжей с добавлением молйбдата аммония и рибокси- "* на. На 7-й день у животных каждой группы до- и после внутримышечного введения изучаемой дозы ДОКА забирали образец крови (0,2 мл) и путем центрифугирования отделяли плазму, в которой радиоиммунным методом определяли содержание ЛГ. Полученные данные приведены в табл.1. Таким образом, только при введении ДОКА в дозе 15 и 20 мг/кг имело место достоверное повышение уровня Л Г в циркулирующей крови, что является отражением регулирующего влияния на гонадотропоциты гипофиза со стороны гипоталамуса, лим-бической системы и други х подкорковых структур. Πример 2. Определение оптимального · срока забора крови для проведения содержания Л Г проведен на 7 группах равноценных животных (по весу, полу, условиям содержания). Гиперурикемию моделировали путем скармливания гидролизата дрожжей с добавлением молибдата аммония и рибоксина. На 7-й день животным каждой группы внутримышечно вводили ДОКА в дозе 15 мг/кг, через 6 часов проводили инфузию ЛГ-РГ, а затем через определенное время забирали образец крови (0,2 мл) и путем центрифугирования отделяли плазму, в которой радиоиммунным методом определяли содержание ЛГ. Полученные данные приведены в табл.2. Таким образом, первый пик повышения в крови содержания Л Г регистрировался на 5-й минуте, а' максимальный прирост концентрации ЛГ приходился на 30 минуту наблюдения, что послужило основанием для выбора этих сроков в качестве основополагающих при исследовании ответной реакции гонадотропоцитов на ЛГ-РГ. Πример 3. Моделировали гиперурикемию у крысы с шифром К04, массой 168 г путем скармливания гидролизата дрожжей с добавлением молибдата аммония и рибоксина. На 7-й день исследования животному под эфирным наркозом вводили в наружную яремную вену катетер, получали образец крови (0,2 мл) и путем центрифугирования отделяли плазму, в которой радиоиммунным методом определяли содержание ЛГ. Уровень ЛГ в циркулирующей крови достигал 6,0 МЕ/л. Вн утримышечно вводили ДОКА (15 мг/кг массы) и через 6 часов через катетер проводили инфузию ЛГ-РГ (140 нг/кг массы). Через 5 мин повторно определяли содержание ЛГ. Имело место повышение содержания ЛГ до 6,2 МЕ/л. Через 30 мин уровень ЛГ в циркулирующей крови возрос до 8 МЕ/л, т.е. прирост ЛГ к 30-й минуте в ответ на введение ЛГ-РГ не превышал 41% по сравнению с соответствующими данными на 5-й мин, следовательно, это животное подлежало включению в хронический эксперимент. Через 30 дней при морфологическом исследовании крысы К04 выявлены уратная кардиомиопатия и нефропатия. Πример 4. Гиперурикемию моделировали в течение 7 дней у крысы с шифром К 005, массой 175 г путем скармливания гидролизата дрожжей с добавлением молибдата аммония и рибоксина. В день исследования животному под эфирным наркозом вводили в наружную яремную вену катетер и получали образец крови (0,2 мл). Отделяли плазму и в ней радиоиммунным методом определяли содержание ЛГ. Уровень ЛГ в циркулирующей крови достигал 6,4 МЕ/л. Вн утримышечно инъецировали стандартную дозу ДОКА (15 мг/кг массы) и через 6 часов вводили ЛГ-РГ (140 нг/кг массы). В течение 5 мин повторно определяли содержание ЛГ, которое составило 5,5 МЕ/л. Через 30 мин уровень ЛГ в циркулирующей крови повысился до 9,6 МЕ/л, т.е. прирост ЛГ к 30-й минуте в ответ на введение ЛГ-РГ превышал 41%, поэтому данное животное не подлежало включению в хронический эксперимент. Через 30 дней при морфологическом исследовании у крысы К005 не выявлены признаки уратной кардиомиопатии или нефропатии. Преимущество заявляемого способа состоит в том, что он универсален, технически прост, экономичен, информативен, сокращает время и материальные затраты на проведение экспериментов, повышает достоверность результатов опыта. Перечисленные преимущества определяют перспективность применения метода в экспериментальной биологии и медицине для прогнозирования нарушений центральных механизмов регуляции гипофиза при моделировании гиперурикемии, выявления групп с низкой воспроизводимостью данной патологии и выбраковки животных. Кроме этого способ может быть положен в основу метода прогнозирования течения подагры у больных. Лабораторные испытания заявляемого способа проведены на 54 крысах. Данные примеры подтверждают достоверность прогноза нарушения центральных механизмов регуляции гипофиза при гиперурикемии в случае предварительного введения ДОКА и последующей оценки реакции гонадотропоцитов на экзогенный ЛГ-РГ. Таким образом, совокупность признаков формулы изобретения дает возможность получения технического результата. Достоинством технического решения заявляемого способа является высокая вероятность прогноза 84,6%, что позволяет отбирать животных в хронический эксперимент.
ДивитисяДодаткова інформація
Автори англійськоюBarinov Eduard Fedorovych, Hryn Viacheslav Kostiantynovych, Syniachenko Oleh Volodymyrovych, Barynova Maria Eduardivna
Автори російськоюБаринов Эдуард Федорович, Гринь Вячеслав Константинович, Синяченко Олег Владимирович, Баринова Мария Эдуардовна
МПК / Мітки
МПК: G01N 33/74
Мітки: гонадотропоцитів, гіперурикемії, гіпофізу, центральних, регуляції, спосіб, прогнозування, механізмів, порушень
Код посилання
<a href="https://ua.patents.su/4-20885-sposib-prognozuvannya-porushen-centralnikh-mekhanizmiv-regulyaci-gonadotropocitiv-gipofizu-pri-giperurikemi.html" target="_blank" rel="follow" title="База патентів України">Спосіб прогнозування порушень центральних механізмів регуляції гонадотропоцитів гіпофізу при гіперурикемії</a>
Попередній патент: Транспортер для коренеплодів
Наступний патент: Пристрій для вимірювання швидкості поширення ультразвуку у біологічних тканинах
Випадковий патент: Фільтр струмів вищих гармонік та нульової послідовності трифазної мережі