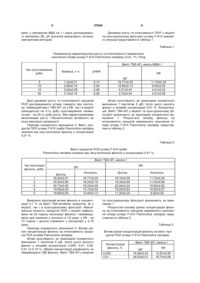
Спосіб мікотестування забруднення навколишнього середовища фенолом
Номер патенту: 57945
Опубліковано: 25.03.2011
Автори: Перцевой Михайло Сергійович, Федотов Олег Валерійович
Формула / Реферат
Спосіб мікотестування забруднення навколишнього середовища фенолом, що включає визначення вмісту продуктів перекисного окислення ліпідів в міцеліальних культурах Flammulina velutipes (Curt.: Fr.) Sing. при штучному культивуванні на живильних середовищах, який відрізняється тим, що культивування проводять на живильних середовищах, які містять фенол у концентрації 0,005-0,15 %, а ступінь токсичного навантаження фенолом на природні системи визначають за рівнем інтенсивності процесів перекисного окислення ліпідів дослідної культури у порівнянні з контролем.
Текст
Спосіб мікотестування забруднення навколишнього середовища фенолом, що включає визначення вмісту продуктів перекисного окислення 3 міцетів, змивають конідії з поверхні культури, замочують спори в розчинах біхромату калію наступних концентрацій - 0,5 ррт, 0,5 ррт, 50 ррт та підраховують кількість пророслих конідій. На основі отриманих даних інгібування проростання конідій встановлюють чутливість до токсиканту. Недоліками цього способу є патогенність міксоміцетів по відношенню до людини, яка проявляється у здатності викликати алергічні реакції, а також необхідність постійного культивування грибів у лабораторних умовах. Відомі біосорбенти для очистки поверхні природних і штучних водойм, стічних вод і рідких відходів виробництв від забруднення нафтою і нафтопродуктами з одночасною утилізацією забруднення мікроорганізмами. Біосорбенти включають біомасу штамів певних мікроміцетів чи їх консорціум [3]. Запропоновані способи не містять дані щодо реакцій окремих видів мікроміцетів на забруднення нафтою і нафтопродуктами. Відомий спосіб біотестування забруднення навколишнього середовища полютантами з використанням грибів [8]. Спосіб полягає в тому, що шляхом здійснення експрес-оцінки ступеня токсичного навантаження на природні системи, аналіз впливу замочування спор в розчинах біхромату калію на їх проростання, згідно з корисною моделлю, що заявляється, отримують з плодових тіл зморшкових грибів стерильні відбитки аскоспор, визначають вплив розчинів біхромату калію при концентраціях - 1,3; 1,5; 1,7; 1,9; 2,1; 2,3; 2,5 та 3 мг/л на проростання аскоспор та формування ростових трубок, а ступінь токсичного навантаження на природні системи визначають за відсотком зниження чисельності пророслих спор. Недоліком цього способу є необхідність зберігання аскоспор з певними характеристиками проростання чи постійного культивування зморшкових грибів для отримання аскоспор. Найбільш близьким за технічною сутністю і досягненням результату є спосіб визначення стресового стану базидіоміцетів та екологічного стану місця їх зростання за вмістом продуктів перекисного окиснення ліпідів [9]. З метою індикації стану базидіоміцетів та діагностики екологічного стану довкілля, спосіб містить визначення вмісту продуктів перекисного окислення ліпідів у міцелії дикоростучих плодових тілах базидіоміцетів з різних за екологічними умовами місць зростання та міцеліальних культурах цих грибів при штучному культивуванні в оптимальних умовах і за дії температурних стресорів. Недоліками цього способу є необхідність збору дикорослих плодових тіл певних базидіоміцетів на визначених територіях чи культивування їх у лабораторних умовах. В основу корисної моделі поставлена задача створення способу мікотестування забруднення навколишнього середовища фенолом, який відрізняється від прототипу визначенням вмісту продуктів перекисного окислення ліпідів (ПОЛ) у міцеліальних культурах їстівного лікарського базидіоміцету Flammulina velutipes (Curt.: Fr.) Sing., який не є патогенним, не викликає алергічні реак 57945 4 ції, а також не потребує збору плодових тіл макроміцету на визначених територіях. Використання цього способу дозволяє проведення швидкого і якісного тестування навколишнього середовища, окремо оцінювати рівень забруднення фенолом повітря, ґрунтових вод та розчинів різного походження. Поставлена задача вирішується тим, що спосіб мікотестування забруднення навколишнього середовища фенолом включає визначення вмісту продуктів перекисного окислення ліпідів в міцеліальних культурах Flammulina velutipes (Curt.: Fr.) Sing, при штучному культивуванні на живильних середовищах, згідно корисної моделі культивування проводять на живильних середовищах, які містять фенол у концентрації 0,005-0,15 % (дослід), а ступінь токсичного навантаження фенолом на природні системи визначають за рівнем інтенсивності процесів перекисного окислення ліпідів дослідної культури у порівнянні з контролем. Спосіб заснований на тому, що оцінку ступеня токсичного навантаження на природні системи проводять використовуючи в якості тестіндикаторів міцеліальні культури їстівного лікарського базидіоміцету Flammulina velutipes. Визначають вплив фенолу на інтенсивність протікання процесів перекисного окиснення ліпідів. Спосіб визначення токсичності повітря, води чи водної витяжки або розчину речовин ґрунтується на встановленні різниці між вмістом продуктів ПОЛ у культурі, яку культивували в середовищі що аналізується (дослід) та в стандартних умовах без впливу фенолу (контроль). Приклад конкретного виконання 1. Вивчення інтенсивності процесів ПОЛ штаму F-610 Flammulina velutipes в динаміці росту. Для вивчення динаміки росту і процесів ПОЛ штаму F-610 Flammulina velutipes, культуру вирощують поверхнево в колбах Erlenmeyer об'ємом 250 мл, які містять 50 мл глюкозо-пептонного середовища з початковим рН 6,0-6,5 при температурі 27,5°С протягом 20 діб. Ріст штаму оцінюють за накопиченням біомаси (абсолютно сухий міцелій) ваговим методом [4, 5]. Для оцінки активності процесів ПОЛ використовують тест з тіобарбітуровою кислотою - ТБК-тест. Метод заснований на визначенні кількості забарвленого продукту, який має максимум поглинання в червоному видимому спектрі при 532 нм. Забарвлений продукт утворюється в результаті взаємодії двох молекул ТБК з однією молекулою малонового діальдегіду (МДА) - одного із вторинних продуктів ПОЛ. Встановлено, що реакцію з ТБК дає не тільки МДА, а й багато інших карбонільних сполук, які утворюються під час ПОЛ. Тому разом їх називають ТБК-активні продукти (ТБК-АП) [6]. Вміст продуктів ПОЛ у міцелії та культуральному фільтраті (КФ) визначають на 5, 10, 15 і 20-ту добу культивування. Для отримання гомогенату (МГ), міцелій відділяють від КФ і розтирають в ступці. Суміш центрифугують при 3000 об/ хв. протягом 10 хвилин. Визначають вміст продуктів ПОЛ у мікологічному матеріалі в присутності 20 % трихлороцтової кислоти. Спектри поглинання ТБК-АП реєструють на спектрофотометрі, наприклад на СФ-26, при 532 нм та перераховують на 5 57945 вміст у наномолях МДА на 1 г маси досліджуваного матеріалу [6]. рН розчинів визначають потенціометричним методом. 6 Динаміка росту та інтенсивності ПОЛ у міцелії та культуральному фільтраті штаму F-610 зимового опенька представлені в таблиці 1. Таблиця 1 Порівняльна характеристика росту та інтенсивності перекисного окислення ліпідів штаму F-610 Flammulina velutipes (Curt.: Fr.) Sing. Вміст ТБК-АП, нмоль МДА/ г Час культивування, доба Біомаса, г/ л рНКФ 5 10 15 20 1,24±0,21 2,98±0,16 3,63±0,09 3,15±0,16 6,10 5,94 6,28 6,28 Дані динаміки росту та інтенсивності процесів ПОЛ досліджуваного штаму говорять про наступне. Найвищий вміст ТБК-АП, як у КФ, так і в міцелії приходиться на 5-ту добу культивування; мінімальний - на 20-ту добу росту. Між зареєстрованими величинами росту і біосинтетичної активності не існує вірогідної залежності. Приклад конкретного виконання 2. Вміст продуктів ПОЛ штаму F-610 гриба Flammulina velutipes залежно від часу експозиції фенолу у концентрації 0,01 %. КФ МГ 16,77±0,05 14,85±0,13 4,51±0,04 3,74±0,04 11,70±0,20 9,55±0,05 4,01±0,04 2,27±0,09 Штам культивують за прикладом конкретного виконання 1 протягом 5 діб, після цього вносять фенол у кінцевій концентрації 0,01 %. Концентрація. Вміст ТБК-АП у міцелії та культуральному фільтраті визначають за прикладом конкретного виконання 1. Результати впливу фенолу на інтенсивність процесів перекисного окислення ліпідів штаму F-610 Flammulina velutipes представлені в таблиці 2. Таблиця 2 Вміст продуктів ПОЛ штаму F-610 гриба Flammulina velutipes залежно від часу експозиції фенолу у концентрації 0,01 %. Вміст ТБК-АП, нмоль/ г Час експозиції фенолу, доба 1 2 3 4 5 КФ МГ Дослід 26,83±0,01 25,00±0,88 22,75±0,02 19,05±0,29 18,60±0,05 Контроль Дослід Контроль 16,77±0,05 16,20±0,10 16,20±0,05 15,15±0,03 14,85±0,13 16,75±0,09 18,30±0,68 22,94±0,04 19,25±0,92 11,35±0,34 11,70±0,20 11,00±0,68 10,65±0,92 10,50±0,27 9,55±0,05 Виявлено вірогідний вплив фенолу в концентрації 0,1 % на вміст ТБК-активних продуктів, як у міцелії, так і в культуральному фільтраті. Максимальна кількість продуктів ПОЛ у міцелії зафіксована на 24 годину експозиції фенолу і перевищувала цей показник у контролі в 1,6 рази; у КФ - на 72 годину і зросла порівняно з контролем у 2,16 рази. Приклад конкретного виконання 3. Вплив різних концентрацій фенолу на інтенсивність процесів ПОЛ штамів Flammulina velutipes. Штам культивують за прикладом конкретного виконання 1 протягом 5 діб, після цього вносять фенол у кінцевій концентрації 0,005; 0,01; 0,05; 0,01 та 0,15 %. Обрані концентрації дорівнюють чи перевищують ГДК фенолу. Вміст ТБК-АП у міцелію та культуральному фільтраті визначають за прикладом 1. Результати впливу різних концентрацій фенолу на інтенсивність процесів перекисного окислення ліпідів штаму F-610 Flammulina velutipes представлені в таблиці 3. Таблиця 3 Вплив різних концентрацій фенолу на вміст продуктів ПОЛ штаму F-610 Flammulina velutipes. Концентрація фенолу, % 0,005 0,01 Вміст ТБК-АП, нмоль/ г МГ 19,36±0,52 26,83±0,01 КФ 12,67±0,95 16,75±0,09 7 57945 Продовження таблиці 3 0,05 од 0,15 Контроль (0) 167,50±9,05 62,03±0,82 32,93±0,07 16,77±0,05 23,30±0,45 27,68±0,45 34,51±0,21 11,70±0,20 Вивчення впливу концентрацій фенолу в інтервалі від 0,005 до 0,15 на інтенсивність процесів ПОЛ досліджуваного штаму показало наступне. Максимальна кількість ТБК-активних продуктів у міцелії була зафіксована при концентрації фенолу 0,05 % і перевищила контрольну у 9,99 рази; у КФ - при концентрації 0,15 % та у 2,95 рази, відповідно. Таким чином, результати дослідження впливу фенолу на інтенсивність процесів перекисного окислення ліпідів штаму F-610 їстівного лікарського гриба Flammulina velutipes дозволяють зробити наступні висновки. Фенол впливає та веде до інтенсифікації процесів ПОЛ, як у міцелії, так і в культуральному фільтраті Flammulina velutipes. Максимальне нагромадження продуктів ПОЛ в міцелії зафіксовано на 24 годину експозиції фенолу в концентрації 0,01 %, а в КФ - на 72 годину досліду. Максимальна кількість ТБК-активних продуктів у міцелії спостерігається при концентрації фенолу 0,05 %, а в культуральному фільтраті - 0,15 %. Отже, міцеліальні культури Flammulina velutipes мають достовірний відгук на дію фенолу, що вказує на можливість використання їх для мікологічного тестування забруднення навколишнього середовища цією речовиною. Джерела інформації, які використані при укладанні заявки: 1. Биологический контроль окружающей среды. Биоиндикация и биотестирование: учеб. пособие для студентов вузов / О.П. Мелехова и др. М.: Академия, 2007. - 287 с. 2. Биомодификатор для определения фенола и его производных / Цивилева О.М., Никитина В.Е., Кучменко Т.А., Силина Ю.Е. // Патент 2346051 Россия МПК 7 C12Q 1/00, Ин-т биохимии и физиол. растений и микрооганизмов РАН № 20071106772/13; заявл. 26.02.07; опубл. 10.02.09 // Бюл. № 4. 3. Биосорбент для очистки водоемов от нефтепродуктов на основе бактерий и дрожжевых грибов / Хабибуллина Ф.М., Арчегова И.Б., Ибатуллина И.З. и др. // Патент 2318736 Россия МПК 7 Комп’ютерна верстка Г. Паяльніков 8 C02F 3/34, Ин-т биологии КНЦ УрО РАН № 2006104082/13, заявл. 10.02.06; опубл. 10.03.08. // Бюл. № 4. 4. Бисько Н.А., Бухало А.С., Вассер С.П. Высшие съедобные базидиомицеты в поверхностной и глубинной культуре / Под общ. ред. И.А. Дудки К.: Наук, думка, 1983. - 312 с. 5. Дудка И.А. Методы экспериментальной микологии / И.А. Дудка, С.П. Вассер, И.А. Элланская. - К.: Наук, думка, 1982. - 550 с. 6. Капич А.Н. Содержание в грибах продуктов перекисного окисления липидов, реагирующих с тиобарбитуровой кислотой / А.Н. Капич, Т.С Гвоздкова // Микол, и фитопатол. 1998. - Т. 32, вып. 4. - с. 30-36. 7. Крайнюкова A.M., Васьковець Л.А., Соколова С.А. та ін. Методика визначення гострої токсичності води на водоростях Scenedesmus quadricauda (Turp) Breb: КНД 211.1.4.058-97: Затв. Мінекобезпеки України 21.05.97. - Київ, 1997. - 24 с. 8. Спосіб біотестування забруднення навколишнього середовища полютантами з використанням грибів / Сухомлин М.М., Куткова О.В. // Патент 41752 Україна МПК (2009) А01Н 15/00, A01G 7/00, Київський національний університет ім. Тараса Шевченка, № u200814059; заявл. 05.12.08; опубл. 10.06.09. // Бюл. № 11. 9. Спосіб визначення стресового стану базидіоміцетів та екологічного стану місця їх зростання за вмістом продуктів перекисного окиснення ліпідів / Федотов О.В. Патент 12384 Україна МПК A01G 7/00, С30В 28/00, С04В 35/00, А01Н 3/00, Донецький національний університет, № u200504732; заявл. 20.05.05; опубл. 15.02.06. // Бюл. № 2. (прототип). 10. Терехова В.А. Биоиндикационное значение микромицетов в экологической оценке водных и наземных экосистем. Автореф. дис. ... д-ра. биол. наук: 03.00.16 / Моск. гос. ун-т им. М.В. Ломоносова. - М., 2004. - 48 с. 11. Терехова В.А. Микотестирование химических воздействий / В.А. Терехова // Материалы 2го Съезда микологов России. Современная микология в России - М.: Национальная академия микологии, 2008. - Т 2. - с. 106-108. 12. Терехова В.А. Микромицеты в экологической оценке водных и наземных экосистем / В.А. Терехова. - М.: Наука, 2007. - 216 с. Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for mycotesting environmental phenolic pollution
Автори англійськоюFedotov Oleh Valeriiovych, Pertsevoi Mykhailo Serhiiovych
Назва патенту російськоюСпособ микотестирования загрязнения окружающей среды фенолом
Автори російськоюФедотов Олег Валериевич, Перцевой Михаил Сергеевич
МПК / Мітки
МПК: A01G 7/00, A01H 15/00
Мітки: спосіб, забруднення, мікотестування, фенолом, навколишнього, середовища
Код посилання
<a href="https://ua.patents.su/4-57945-sposib-mikotestuvannya-zabrudnennya-navkolishnogo-seredovishha-fenolom.html" target="_blank" rel="follow" title="База патентів України">Спосіб мікотестування забруднення навколишнього середовища фенолом</a>
Попередній патент: Спосіб вилучення ванадію (iv)
Наступний патент: Спосіб розшліхтування бавовняних текстильних матеріалів
Випадковий патент: Спосіб лікування синдрому відміни кодтерпінової залежності у неповнолітніх