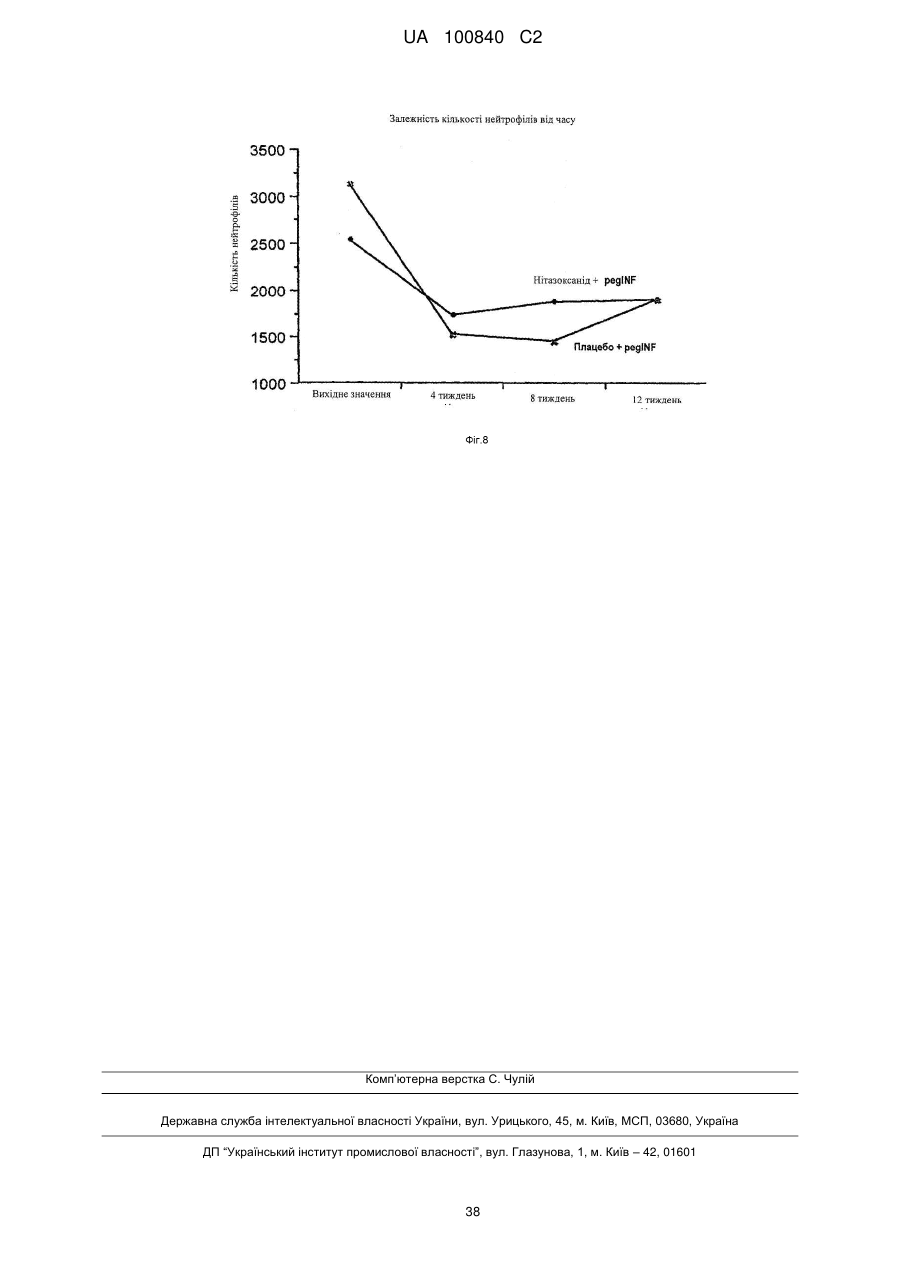
Композиція для лікування вірусного гепатиту
Формула / Реферат
1. Композиція для лікування гепатиту С, яка включає сполуку, вибрану з нітазоксаніду, тизоксаніду або їхніх сумішей.
2. Композиція за п. 1, яка додатково містить фармацевтично прийнятний носій.
3. Композиція за п. 2, яка містить суміш сполук, вибраних із нітазоксаніду і тизоксаніду.
4. Композиція за п. 2, яка додатково містить один або декілька додаткових біологічно активних засобів, вибраних з групи, яка складається з інтерферону, протидіабетичного засобу, рибавірину та 2-метилцитидину.
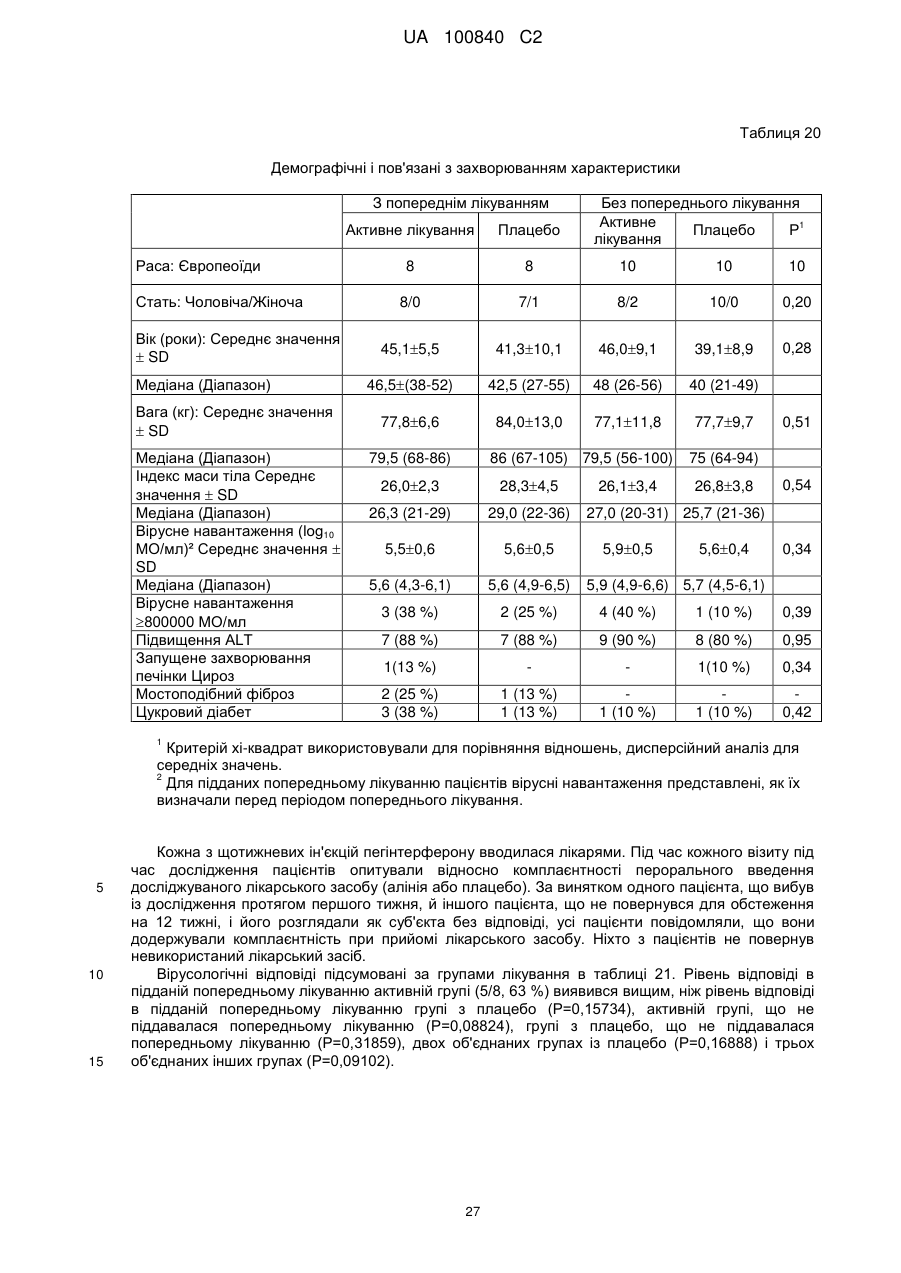
5. Композиція за п. 1, яку вводять пацієнту протягом періоду часу між приблизно 3 добами і приблизно 24 тижнями, з наступним введенням сполуки та інтерферону пацієнту протягом періоду між приблизно 1 тижнем і приблизно 48 тижнями.
6. Композиція за п. 1, яка включає введення сполуки пацієнту протягом періоду приблизно між 3 добами і приблизно 2 роками.
7. Композиція за п. 1, яка додатково включає один або декілька додаткових активних засобів, вибраних з інтерферону, протидіабетичного засобу, рибавірину та 2-метилцитидину.
8. Композиція за н. 7, де один або декілька додаткових активних засобів містять інтерферон.
9. Композиція за п. 8, де інтерферон складений окремо від сполуки.
10. Композиція за п. 8, де інтерферон являє собою α-2а-інтерферон, α-2b-інтерферон або кон’югат поліетиленгліколю та α -2а-інтерферону або а-2b-інтерферону.
11. Композиція за п. 8, де інтерферон вводять пацієнту протягом періоду приблизно від 1 тижня до приблизно 48 тижнів.
12. Композиція за п. 11, де інтерферон вводять пацієнту протягом періоду приблизно від 1 тижня до приблизно 4-12 тижнів.
13. Композиція за п. 8, де інтерферон вводять пацієнту від 1 до 3 разів щотижня.
14. Композиція за п. 8, де введення інтерферону починають після лікування пацієнта сполукою протягом попередньо визначеного періоду часу.
15. Композиція за п. 14, де попередньо визначений період часу складає приблизно від 3 діб і приблизно до 6 місяців.
16. Композиція за п. 15, де попередньо визначений період часу складає приблизно від 1 тижня і приблизно до 4 тижнів.
17. Композиція за п. 1, де сполуку вводять пацієнту від одного до трьох разів на добу протягом попередньо визначеного періоду лікування.
18. Композиція за п. 7, де один або декілька додаткових активних засобів включають у протидіабетичний засіб.
19. Композиція за п. 18, де протидіабетичний засіб складений окремо від вказаної сполуки.
20. Композиція за п. 2, де композиція містить вказану сполуку та один або декілька додаткових активних засобів, вибраних з групи, яка складається з інтерферону, протидіабетичного засобу, рибавірину та 2-метилцитидину.
21. Композиція за п. 20, яка додатково містить протидіабетичний засіб.
22. Композиція за п. 20, яка додатково містить інтерферон.
23. Композиція за п. 20, яка додатково містить інтерферон і протидіабетичний засіб.
24. Композиція за п. 1, де спосіб лікування гепатиту С включає (а) попереднє лікування пацієнта за допомогою введення пацієнту протягом попередньо визначеного періоду часу композиції, і (b) після попередньо визначеного періоду часу, введення пацієнту кількості другої композиції, що містить активний засіб, вибраний з групи, яка складається з інтерферону, протидіабетичного засобу, рибавірину та 2-метилцитидину.
25. Композиція за п. 24, де попередньо визначений період часу складає від приблизно 3 діб і до приблизно 3 місяців.
26. Композиція за п. 25, де попередньо визначений період часу складає від приблизно 1 тижня і до приблизно 4 тижнів.
27. Композиція за п. 24, де активний засіб являє собою інтерферон, вибраний з α-2а-інтерферону, α-2b-інтерферону і кон'югату поліетиленгліколю і α-2а-інтерферону або α-2b-інтерферону.
28. Композиція за п. 27, де друга композиція додатково містить сполуку, вибрану з нітазоксаніду, тизоксаніду або їхніх сумішей.
29. Композиція за п. 1, яка додатково включає інтерферон.
30. Композиція за п. 29, де кількість інтерферону, необхідна для досягнення стійкої відповіді в пацієнта, знижена в порівнянні з кількістю інтерферону, необхідною для досягнення стійкої відповіді в пацієнта без введення нітазоксаніду, тизоксаніду або їхніх сумішей.
31. Композиція за п. 29, де кількість інтерферону, необхідна для досягнення стійкої відповіді в пацієнта, знижена в порівнянні з кількістю інтерферону, необхідною для досягнення стійкої відповіді в пацієнта при введенні сполучення рибавірину та інтерферону.
32. Композиція за п. 29, яка забезпечує підвищення імовірності зниження кількості РНК HCV у сироватці пацієнта після лікування в порівнянні зі способом лікування гепатиту С сполученням рибавірину та інтерферону.
33. Композиція за п. 29, яка викликає менше побічних ефектів у порівнянні з лікуванням гепатиту С сполученням рибавірину та інтерферону.
34. Композиція для лікування гепатиту С, яка містить (а) одну або декілька сполук, вибраних із нітазоксаніду або тизоксаніду; (b) інтерферон; і (с) протидіабетичний засіб.
35. Композиція за п. 29 або 34, де інтерферон вибраний з α-2а-інтерферону, α-2b-інтерферону і кон'югату поліетиленгліколю і α-2а-інтерферону або α-2b-інтерферону.
36. Композиція за п. 1, де спосіб лікування гепатиту С включає (а) попереднє лікування пацієнта введенням пацієнту добової дози від 100 мг до 2000 мг нітаксозаніду протягом попередньо визначеного періоду часу від 3 днів до 4 тижнів, і (b) після попередньо визначеного періоду часу, лікування пацієнта протягом від 1 до 48 тижнів інтерфероном, необов'язково у сполученні з нітазоксанідом та/або рибавірином.
37. Композиція за п. 35, де інтерферон вибраний з α-2а-інтерферону, α-2b-інтерферону і кон'югату поліетиленгліколю і α-2а-інтерферону або α-2b-інтерферону.
38. Композиція за п. 35, де введення рибавірину повністю виключене.
39. Композиція за п. 35, де попередньо визначений період часу складає від 1 тижня і приблизно до 4 тижнів.
Текст
Реферат: Винахід належить до галузі медицини і стосується композицій для лікування вірусного гепатиту, зокрема гепатиту С, що включають нітазоксанід або тизоксанід, або їхні суміші. UA 100840 C2 (12) UA 100840 C2 UA 100840 C2 5 10 15 20 25 30 35 40 45 50 55 60 Права уряду Уряд США має певні права на цей винахід відповідно до контракту № NO1-AI-30046, що надав NIAID. Перехресне посилання на споріднені заявки За цією заявкою вимагається пріоритет, відповідно до 35 USC. § 119, за попередньою патентною заявкою США № 60/757036, поданою 9 січня 2006, опис якої наведений тут як посилання. Галузь техніки Даний опис стосується способів лікування вірусного гепатиту, сполук, придатних для лікування вірусного гепатиту, і фармацевтичних композицій, що містять такі сполуки. Рівень техніки Гепатит стосується безлічі станів, в які утягнуте запалення печінки. Вірусний гепатит, якого існує кілька типів (наприклад, гепатит A, B, C, D і E), являє собою запалення печінки унаслідок вірусної інфекції. Кожен тип вірусного гепатиту може мати різні симптоми, і його можна охарактеризувати за різними способами лікування і профілактики. Наприклад, розроблені вакцини для гепатиту A і B, але не для гепатиту C або E. Основна мета лікування хронічного гепатиту C складається у видаленні детектованої вірусної РНК із крові. Пацієнти, у яких відсутня детектована РНК вірусу гепатиту C у крові через 24 тижні після закінчення лікування, як правило, мають сприятливий прогноз, і їх можна розглядати як вилікуваних від вірусу. Такий стан відомий як стійка вірусологічна відповідь. Для пацієнтів, що не досягли стійкої вірусологічної відповіді, можуть існувати скромніші переваги лікування, такі як сповільнення прогресування рубцювання печінки (фіброзу). Лікування вірусного гепатиту C (HCV), як правило, включає в себе введення інтерферону, який вводять шляхом ін'єкції, (або пегільованого інтерферону, який вводять шляхом ін'єкції), рибавірину або їхнього сполучення. Альфа-інтерферон являє собою глікопротеїн, що зустрічається в природі і секретується клітинами у відповідь на вірусні інфекції. Він виявляє свої ефекти за допомогою зв'язування з мембранним рецептором. Зв'язування рецептора запускає каскад внутрішньоклітинних сигнальних подій, що зрештою призводять до посилення експресії певних генів. Це призведе до посилення та індукції певних видів клітинної активності, включаючи посилення знищення клітин-мішеней лімфоцитами та інгібування реплікації вірусу в інфікованих клітинах. Рибавірин являє собою синтетичний нуклеозид, що має активність проти широкого спектра вірусів. Альфа-інтерферон, із рибавірином або без нього, пов'язаний із багатьма побічними ефектами. Грипоподібні симптоми, депресія, висип, інші аномальні реакції і патологічні показники формули крові є звичайними прикладами таких побічних ефектів. Рибавірин пов'язаний зі значним ризиком порушення розвитку плоду. Таким чином, жінкам, із підозрою на вагітність, не слід починати лікування доти, поки не будуть одержані негативні дані тесту на вагітність. Жінкам-пацієнтам радять уникати вагітності під час лікування. Пацієнтам із використанням альфа-інтерферону і рибавірину радять здавати аналізи крові приблизно один раз на місяць, і трохи частіше на початку лікування. Деякі групи пацієнтів не можуть приймати рибавірин, наприклад, пацієнти з анемією, захворюванням серця або захворюванням нирок. У таких випадках призначають тільки, як правило, пегільований альфа-інтерферон. Деяким пацієнтам з гепатитом C (наприклад, пацієнтам, що також мають запущене захворювання печінки) не рекомендують приймати інтерферон або пегільований альфа-інтерферон унаслідок ризику серйозних побічних ефектів. Для таких пацієнтів до цього моменту не відомо доступного способу лікування, що є ефективним і безпечним для лікування гепатиту C. Таким чином, існує потреба в даній галузі в розробці ефективного способу лікування гепатиту C. При ідеальному способі лікування повинна досягатися стійка вірусологічна відповідь у широкого кола пацієнтів. При такому лікуванні варто застосовувати легко доступні активні засоби, і воно повинно викликати мінімальну кількість побічних ефектів. При застосуванні сумісного введення альфа-інтерферону в ідеальному способі лікування повинні вимагатися знижені кількості альфа-інтерферону (тобто знижена частота введення, знижена кількість на введення, або і те, й інше) при порівнянні з традиційними способами лікування. Суть винаходу Даний винахід спрямований на вирішення однієї або декількох із вищезгаданих проблем відомих способів лікування вірусного гепатиту C. В одному з варіантів здійснення, таким чином, у даному документі описаний спосіб лікування пацієнта, що страждає на гепатит C. Спосіб включає в себе введення пацієнту терапевтично ефективної кількості сполуки, вибраної з нітазоксаніду, тизоксаніду, похідних нітазоксаніду і похідних тизоксаніду. 1 UA 100840 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому варіанті здійснення в даному документі описаний спосіб лікування пацієнта, що страждає на вірусний гепатит. Спосіб містить у собі введення пацієнту терапевтично ефективної кількості першої сполуки, що має структуру формули I: R1-NHCO-R2. У формулі I, R1 і R2 незалежно вибрані з компонентів, що забезпечують поліпшену стабільність групи NHCO у біологічних рідинах і тканинах. В іншому аспекті варіанта здійснення перша сполука не є ні нітазоксанідом, ні тизоксанідом. В іншому варіанті здійснення в даному документі описане удосконалення способу лікування пацієнта, що страждає на гепатит C, що включає введення пацієнту терапевтично ефективної кількості нітазоксаніду, тизоксаніду або їхніх сумішей. В іншому варіанті здійснення в даному документі описаний спосіб лікування пацієнта, що страждає на гепатит C. Спосіб містить у собі попереднє лікування пацієнта шляхом уведення пацієнту протягом попередньо визначеного періоду часу першої композиції, що містить терапевтично ефективну кількість сполуки, вибраної з нітазоксаніду, тизоксаніду, похідних нітазоксаніду і похідних тизоксаніду, або їхніх сумішей. Спосіб додатково включає введення пацієнту, після наперед визначеного періоду часу, терапевтично ефективної кількості другої композиції, що містить активний засіб. В іншому варіанті здійснення в даному документі описана композиція, що містить: (a) одну або декілька сполук, вибраних з нітазоксаніду, тизоксаніду, похідних нітазоксаніду і похідних тизоксаніду; (b) інтерферон; і (c) протидіабетичний засіб. В іншому варіанті здійснення в даному документі описані композиції, ефективні в способах лікування, описаних у даному документі. Короткий опис креслень Фіг. 1a і 1b являють собою графіки, на яких показана синергічна активність нітазоксаніду з альфа-2b-інтерфероном або 2-C-метилцитидином стосовно реплікації HCV у лінії клітин, що містить реплікон HCV. Фіг. 2a і 2b являють собою графіки, на яких показана синергічна активність при обробці лінії клітин, що містять реплікон HCV, спочатку нітазоксанідом, а потім нітазоксанідом плюс альфа2b-інтерферон. Фіг. 3 являє собою блок-схему проведення досліджень пацієнтів, на якій показаний відбір учасників для експерименту, описаного в прикладі 5. Фіг. 4, описана в прикладі 5, являє собою графік, на якому показані середні кількісні значення рівнів РНК HCV у сироватці з плином часу для груп з різним лікуванням. Фіг. 5, описана в прикладі 5, являє собою графік, на якому показані кількісні значення рівнів РНК HCV у сироватці з плином часу для різних пацієнтів. Фіг. 6 являє собою блок-схему проведення досліджень пацієнтів, на якій показаний відбір учасників для експерименту, описаного в прикладі 6. Фіг. 7, описана в прикладі 6, являє собою графік, на якому показана кількість тромбоцитів стосовно часу введення пацієнтам пегільованого альфа-2b-інтерферону плюс або алінію® або плацебо. Фіг. 8, описана в прикладі 6, являє собою графік, на якому показана кількість нейтрофілів стосовно часу введення пацієнтам пегільованого альфа-2b-інтерферону плюс або алінію® або плацебо. Детальний опис винаходу Визначення і номенклатура Перед детальним описом даного винаходу слід зазначити, що, якщо не зазначено інакше, даний винахід не обмежений конкретними дозуваннями, композиціями або способами застосування, що можуть варіювати. Також варто розуміти, що використовувана в даному документі термінологія призначена тільки для цілей опису конкретних варіантів здійснення і не призначена служити як обмеження. Слід зазначити, що, як використовують у даному описі та наведеній формулі винаходу, форми однини стосуються також і множини, якщо тільки з контексту чітко не випливає поіншому. Таким чином, наприклад, "лікарська форма" стосується не тільки індивідуальної лікарської форми, але також сполучення двох або більше різних лікарських форм, "активний засіб" стосується як сполучення активних засобів, так й індивідуального активного засобу і т.ін. Як використовують в описі і наведеній формулі винаходу, терміни "наприклад", "такий як", "включаючи" і т.ін. означають наведення прикладів, в яких додатково пояснюють більш загальний предмет розгляду. Якщо не зазначено інакше, то ці приклади представлені тільки для сприяння в розумінні винаходу, і не призначені служити як обмеження будь-яким чином. Якщо не визначено інакше, усі технічні і наукові терміни, використовувані в даному документі, мають значення, що звичайно розуміється рядовим фахівцем у даній галузі, який має 2 UA 100840 C2 5 10 15 20 25 30 35 40 45 50 55 60 відношення до винаходу. Хоча будь-які способи і речовини, подібні або еквівалентні до способів і речовин, описаних у даному документі, можна використовувати для практичного застосування або тестування даного винаходу, переважні способи і речовини описані нижче. Особливо важлива для опису даного винаходу специфічна термінологія визначена нижче. При посиланні на сполуку за винаходом, і якщо не зазначено інакше, термін "сполука" призначений охоплювати не тільки певний молекулярний об'єкт, але також його фармацевтично прийнятні, фармакологічно активні аналоги, включаючи як необмежуючі приклади, солі, поліморфні модифікації, складні ефіри, аміди, проліки, аддукти, кон'югати, активні метаболіти і т.ін., де такі модифікації молекулярного об'єкта є доцільними. Термін "лікування", як застосовують тут, стосується зменшення тяжкості і/або частоти симптомів, зникнення симптомів і/або причини, що лежить в основі, профілактики виникнення симптомів і/або причини, що лежить в їхній основі, (наприклад, профілактична терапія), виправлення або усунення ушкодження, або зменшення інтенсивності інфекції. Терміни "ефективна кількість" і "терапевтично ефективна кількість" сполуки за винаходом означають нетоксичну, але достатню кількість лікарського засобу або речовини для забезпечення необхідного ефекту. "Фармацевтично прийнятний" означає речовину, яка не є біологічною або іншим чином небажаною, тобто речовину можна ввести у фармацевтичну композицію, що вводиться пацієнту, без викликання будь-яких небажаних біологічних ефектів або шкідливої взаємодії з будь-якими іншими компонентами композиції, у якій вона міститься. Якщо термін "фармацевтично прийнятний" використовують стосовно фармацевтичного носія або ексципієнта, то мають на увазі, що носій або ексципієнт відповідає необхідним стандартам токсикологічного і виробничого тестування, або що його включають у керівництво з неактивних інгредієнтів, яке видають Управлінням з контролю за продуктами і лікарськими засобами США. "Пацієнт" або "суб'єкт" означає будь-яку тварину, що має потребу в лікуванні. Пацієнти можуть бути ссавцями, і, як правило, як застосовують тут, пацієнт є людиною. Даний опис включає сполуки формули I: R1-NHCO-R2, а також їхнє застосування для лікування гепатиту, зокрема, гепатиту C, і фармацевтичні композиції, що їх містять. В одному з варіантів здійснення формули I R1 і R2 незалежно вибрані з компонентів, що стабілізують (тобто забезпечують поліпшення стабільності) групу NHCO. "Стабілізувати" означає те, що група NHCO стає менш схильною до взаємодії в біологічній рідині і тканині в порівнянні з незаміщеною групою NHCO (наприклад, NH2COH, R1-NHCOH, NH2CO-R2 і т.ін.), тобто в порівнянні з аналогічною сполукою, що містить водень на або місці R1 або R2. Такі взаємодії включають розщеплення групи NHCO (наприклад, розщеплення зв'язку азот-вуглець), приєднання до групи NHCO, реакції заміщення, реакції гідрогенізації, реакції гідратації, реакції окиснення, реакції відновлення і т.ін. В одному з варіантів здійснення сполуки формули I не включають нітазоксанід і тизоксанід. В іншому варіанті здійснення сполуки формули I включають нітазоксанід і тизоксанід. В іншому варіанті здійснення кожен із R1 і R2 являє собою заміщену або незаміщену циклічну групу. Такі групи можуть бути гетероциклічними групами або карбоциклічною групою, такою як арильна або циклоалкільна група. В одному з прикладів R1 являє собою гетероциклічне кільце, і R2 являє собою арил, необов'язково, заміщений одним-трьома замісниками. Інший приклад групи сполук формули I включає сполуки, де R1 і R2 обидва являють собою бензол, кожен, необов'язково, заміщений одним-трьома замісниками. В іншому варіанті здійснення R1 вибраний з тіазолу і тіадіазолу, заміщеного одним-трьома замісниками, і R2 являє собою бензол, заміщений одним-трьома замісниками. Приклади замісників для R1 і R2 включають OH, алкокси, гало, алкіл, фторалкіл, складний ефір, тіоалкіл і функціональні групи. Конкретні приклади включають фтор, бром, OAc, CH 3, CF3, NO2, CH2CO2Et, SCH3, OCH3 і т.ін. Приклади гетероциклічних груп для R1 і R2 включають ароматичні гетероциклічні групи, або насичені, або ненасичені неароматичні гетероциклічні групи (аліциклічні гетероциклічні групи). Такі групи містять, крім атомів вуглецю, принаймні, один гетероатом (переважно, від 1 до 4 гетероатомів, переважніше, від 1 до 2 гетероатомів), і можуть містити від 1 до 3 різних видів гетероатомів (переважно, від 1 до 2 видів гетероатомів). Як застосовують тут, термін "гетероатом" включає атоми кисню, атоми сірки та атоми азоту. Приклади "ароматичної гетероциклічної групи" включають ароматичну моноциклічну гетероциклічну групу, таку як 5- або 6-членну ароматичну моноциклічну гетероциклічну групу (наприклад, фурил, тієніл, піроліл, оксазоліл, ізооксазоліл, тіазоліл, тіадіaзоліл, ізотіазоліл, імідазоліл, піразоліл, 1,2,3-оксадіaзоліл, 1,2,4-оксадіaзоліл, 1,3,4-оксадіaзоліл, фуразаніл, 1,2,3тіадіaзоліл, 1,2,4-тіадіaзоліл, 1,3,4-тіадіaзоліл, 1,2,3-триaзоліл, 1,2,4-триaзоліл, тетразоліл, 3 UA 100840 C2 5 10 15 20 25 30 35 40 45 50 55 60 піридил, піридазиніл, піримідиніл, піразиніл, триазиніл і т.ін.); ароматичну конденсовану гетероциклічну групу, таку як 8-12-членну ароматичну конденсовану гетероциклічну групу (наприклад, бензофураніл, ізобензофураніл, бензотієніл, індоліл, ізоіндоліл, 1H-індaзоліл, бензіндaзоліл, бензоксазоліл, 1,2-бензоізооксазоліл, бензотіазоліл, бензопіраніл, 1,2бензоізотіазоліл, 1H-бензотриaзоліл, хіноліл, ізохіноліл, циннолініл, хіназолініл, хіноксалініл, фталазиніл, нафтилідиніл, пуриніл, птеридиніл, карбазоліл, альфа-карболініл, бета-карболініл, гамма-карболініл, акридиніл, феноксазиніл, фенотіазиніл, феназиніл, феноксатиніл, тіантреніл, фенантридиніл, фенантролініл, індолізиніл, піроло[1,2-b]піридазиніл, піразоло[1,5-a]піридил, імідазоло[1,2-a]піридил, імідазоло[1,5-a]піридил, імідазоло[1,2-b]піридазиніл, імідазоло[1,2a]піримідиніл, 1,2,4-триазоло[4,3-a]піридил, 1,2,4-триазоло[4,3-b]піридазиніл); переважно, гетероциклічну групу, що складається з вищезгаданої 5- або 6-членної ароматичної моноциклічної гетероциклічної групи, конденсованої з бензольним кільцем, або гетероциклічну групу, що складається з вищезгаданої 5- або 6-членної ароматичної моноциклічної гетероциклічної групи, конденсованої з такою самою або іншою вищезгаданою 5- або 6-членною ароматичною моноциклічною гетероциклічною групою. Приклади "неароматичної гетероциклічної групи" включають 3-8-членну (переважно, 5- або 6-членну) насичену або ненасичену (переважно, насичену) неароматичну гетероциклічну групу (аліфатичну гетероциклічну групу) таку як, оксирaніл, азетидиніл, оксетaніл, тієтаніл, піролідиніл, тетрагідрофурил, тіолaніл, піперидиніл, тетрагідропіраніл, морфолініл, тіоморфолініл, піперазиніл. В одному з варіантів здійснення сполук, що мають структуру формули I, R1 є гетероциклом. В іншому варіанті здійснення R1 є гетероциклом, що містить 2 або 3 гетероатоми. В іншому варіанті здійснення R1 є заміщеним гетероциклом і містить 2 або 3 гетероатоми. В іншому варіанті здійснення R1 є гетероциклом, заміщеним 1, 2, або 3 групами, вибраними з гідроксиду, галогену (тобто йоду, хлору, брому або фтору), алкокси (наприклад, OCH3), фторалкілу (наприклад, CF3), складного ефіру (наприклад, CH2CO2Et), тіоалкілу (наприклад, SCH3), OAc і алкілу (наприклад, CH3). Наприклад, R1 являє собою тіазол або заміщений тіазол. В одному з варіантів здійснення сполук, що мають структуру формули I, R2 являє собою арил. В іншому варіанті здійснення R2 являє собою заміщений арил. В іншому варіанті здійснення R2 являє собою арил, що містить 2, 3 або 4 замісники. В іншому варіанті здійснення R2 являє собою арил і містить замісники в орто- і метаположеннях (стосовно місця приєднання арильної групи до карбонільної групи формули I). В іншому варіанті здійснення R2 являє собою арил, що містить 2 або більше замісників, вибраних із гідроксиду, галогену (тобто йоду, хлору, брому або фтору), алкокси (наприклад, OCH3), фторалкілу (наприклад, CF 3), складного ефіру (наприклад, CH2CO2Et), тіоалкілу (наприклад, SCH3), OAc і алкілу (наприклад, CH3). В одному з варіантів здійснення сполук, що мають структуру формули I, реакційна здатність групи NHCO у сполуці зменшена стосовно реакцій розщеплення в порівнянні з реакційною здатністю аналогічної сполуки, що містить водень на місці або R1 або R2. В іншому варіанті здійснення R1 і R2 незалежно вибрані з заміщених циклічних груп, незаміщених циклічних груп, заміщених гетероциклічних груп і незаміщених гетероциклічних груп, де R1 або R2, або як R1, так і R2 необов'язково є ароматичними. В іншому варіанті здійснення R1 і R2 вибрані з арилу, заміщеного арилу, гетероарилу, заміщеного гетероарилу, аліциклу, заміщеного аліциклу, гетероциклу і заміщеного гетероциклу. В іншому варіанті здійснення кожен із R1 і R2 заміщений одним-трьома замісниками, незалежно вибраними з OH, NO2, алкокси (такого як метокси), гало (такого як F і Br), алкілу (такого як метил), фторалкілу (такого як фторметил), складного ефіру (такого як OAc і CH 2CO2Et) і тіоалкілу (такого як тіометил). В іншому варіанті здійснення, принаймні, один із R1 і R2 є гетероциклом. В іншому варіанті здійснення, принаймні, один з R1 і R2 містить від 1 до 3 гетероатомів. В іншому варіанті здійснення, принаймні, один з R1 і R2 містить гетероциклічну групу, вибрану з ароматичних моноциклічних гетероциклів, ароматичних конденсованих гетероциклів і неароматичних гетероциклів. В іншому варіанті здійснення, принаймні, один з R1 і R2 містить гетероциклічну групу, вибрану з фурилу, тієнілу, піролілу, оксазолілу, ізооксазолілу, тіазолілу, тіадіазолілу, ізотіазолілу, імідазолілу, піразолілу, 1,2,3-оксадіaзолілу, 1,2,4-оксадіaзолілу, 1,3,4-оксадіaзолілу, фуразанілу, 1,2,3-тіадіaзолілу, 1,2,4-тіадіaзолілу, 1,3,4-тіадіaзолілу, 1,2,3-триaзолілу, 1,2,4триaзолілу, тетразолілу, піридилу, піридазинілу, піримідинілу, піразинілу, триазинілу, бензофуранілу, ізобензофуранілу, бензотієнілу, індолілу, ізоіндолілу, 1H-індaзолілу, бензіндaзолілу, бензоксазолілу, 1,2-бензоізооксазолілу, бензотіазолілу, бензопіранілу, 1,2бензоїзотіазолілу, 1H-бензотриaзолілу, хінолілу, ізохінолілу, циннолінілу, хіназолінілу, хіноксалінілу, фталазинілу, нафтилідинілу, пуринілу, птеридинілу, карбaзолілу, альфакарболінілу, бета-карболінілу, гамма-карболінілу, акридинілу, феноксазинілу, фенотіазинілу, 4 UA 100840 C2 5 10 15 20 25 30 35 феназинілу, феноксатинілу, тіантренілу, фенантридинілу, фенантролінілу, індолізинілу, піроло[1,2-b]піридазинілу, піразоло[1,5-a]піридилу, імідазоло[1,2-a]піридилу, імідазоло[1,5a]піридилу, імідазоло[1,2-b]піридазинілу, імідазоло[1,2-a]піримідинілу, 1,2,4-триазоло[4,3a]піридилу, 1,2,4-триазоло[4,3-b]піридазинілу, оксирaнілу, азетидинілу, оксетaнілу, тієтанілу, піролідинілу, тетрагідрофурилу, тіолaнілу, піперидинілу, тетрагідропіранілу, морфолінілу, тіоморфолінілу і піперазинілу, кожен з яких може, необов'язково бути заміщений 1-3 замісниками. В іншому варіанті здійснення R1 являє собою гетероциклічну групу, необов'язково, заміщену 1-3 замісниками, і R2 являє собою арил, необов'язково, заміщений 1-3 замісниками. В іншому варіанті здійснення R1 являє собою тіазол або тіадіазол, необов'язково, заміщений 1-3 замісниками. В іншому варіанті здійснення R2 являє собою феніл, необов'язково, заміщений 1-3 замісниками. В іншому варіанті здійснення R1 і R2 обоє являють собою арил, де кожен, необов'язково, заміщений 1-3 замісниками. Приклади сполук, що мають структурну формулу I, включають нітазоксанід, тизоксанід, RM4803, RM-4819, RM-4832 і RM-4850, де нітазоксанід, тизоксанід, RM-4819, RM-4832 і RM-4850 є особливо переважними. Структури цих сполук представлені в наступному списку: Як описано нижче, композиції за даним описом містять, як активний засіб, сполуки, що мають структурну формулу I у фармацевтично прийнятній формі. За необхідності, композиції можуть додатково містити один або декілька додаткових активних засобів (також детально описаних нижче). Там, де це доцільно, кожен з активних засобів можна вводити у формі сполуки самої по собі і/або у формі солі, поліморфної модифікації, складного ефіру, аміду, проліків, похідної або т.ін., за умови, що сіль, поліморфна модифікація, складний ефір, амід, проліки або похідна є фармакологічно придатними. Там, де це доцільно, солі, складні ефіри, аміди, проліки та інші похідні активних засобів можна одержувати з використанням загальноприйнятих способів, відомих фахівцям у даній галузі синтетичної органічної хімії та описаних, наприклад, у J. March, Advanced Organic Chemistry: Reactions, Mechanisms and Structure, 4th Ed. (New York: Wiley-Interscience, 1992). Для будь-якого активного засобу, що може існувати в енантіомерних формах, активний засіб можна вводити в дані композиції або у вигляді рацемату, або у формі, збагаченій енантіомером. Сполуки, що мають структурну формулу I, можна одержувати відповідно до способів, описаних у літературі. Наприклад, одержання сполук 1a і 1b описано в патенті США № 3950351 і WO 95/28393, відповідно. У синтетичних способах одержання аналогів і похідних 1a і 1b, а також інших сполук, що мають структури, які стосуються формули I, застосовують відомі способи, які є очевидними для фахівця. Фармацевтичні композиції відповідно до цього опису містять сполуку, що має структурну формулу I, як описано в даному документі. Такі фармацевтичні композиції можуть також містити: (1) одну або декілька додаткових сполук, що мають структурну формулу (I); (2) один або декілька фармацевтично прийнятних носіїв, як описано в даному документі; і (3) один або 5 UA 100840 C2 5 10 15 20 25 30 35 40 45 50 55 60 декілька додаткових компонентів, як описано в даному документі. Композиції можуть містити від 0,05 % до 95 % за масою активного(их) засобу(ів), із фармацевтично прийнятним(ими) носієм(ями) і будь-якими додатковими компонентами, що утворюють від 5 % до 99,95 % за масою, яка залишається. Один або декілька додаткових активних засобів можна включати в описані в даному документі фармацевтичні композиції і способи лікування. В одному з варіантів здійснення додатковий активний засіб є ефективним для лікування гепатиту. Наприклад, композиції можуть включати один або декілька додаткових терапевтичних засобів, придатних для лікування гепатиту C, таких як рибавірин і імуностимулюючі засоби, такі як інтерферони, включаючи -2bінтерферон, похідну -2b-інтерферону, таку як кон'югована з поліетиленгліколем форма -2bінтерферону, -2a-інтерферон або інтерферон альфакон-1. Конкретні приклади також включають омега-IFN (BioMedicines Inc., Emeryville, CA); BILN-2061 (Boehringer Ingelheim Pharma KG, Ingelheim, Німеччина); саметрел (Endo Pharmaceuticals Holdings Inc., Chadds Ford, PA); роферон-A, пегасис, пегасис і рибавірин, і целцепт (F. Hoffmann-La Roche LTD, Basel, Швейцарія); велферон (GlaxoSmithKline plc, Uxbridge, UK), альбуферон- (Human Genome Sciences Inc., Rockville, MD); левовірин (ICN Pharmaceuticals, Costa Mesa, CA); IDN-6556 (Idun Pharmaceuticals Inc., San Diego, CA); IP-501 (Indevus Pharmaceuticals Inc., Lexington, MA); актімун (InterMune Inc., Brisbane, CA); інферген-A (InterMune Pharmaceuticals Inc., Brisbane, CA); ISIS 14803 (ISIS Pharmaceuticals Inc, Carlsbad, CA/Elan Phamaceuticals Inc., New York, NY); JTK-003 (Japan Tobacco Inc., Tokyo, Японія); цеплен, пегасис і цеплен (Maxim Pharmaceuticals Inc., San Diego, CA); цивацир (Biopharmaceuticals Inc., Boca Raton, FL); інтрон-A і задаксин (RegeneRx Biopharmiceuticals Inc., Bethesda, MD/SciClone Pharmaceuticals Inc, San Mateo, CA); левовірин, вірамідин (Ribapharm Inc., Costa Mesa, CA); гептазим (Ribozyme Pharmaceuticals Inc., Boulder, CO); інтрон-A, пегінтрон, ребетрон, рибавірин, пегінтрон/рибавірин (Schering-Plough Corporation, Kenilworth, NJ); задазим (SciClone Pharmaceuticals Inc., San Mateo, CA); ребіф (Serono, Geneva, Швейцарія); IFN- і EMZ701 (Transition Therapeutics Inc., Ontario, Канада); T67 (Tularik Inc., South San Francisco, CA); VX-497 (Vertex Pharmaceuticals Inc., Cambridge, MA); VX-950/LY-570310 (Vertex Pharmaceuticals Inc., Cambridge, MA/EH Lilly and Co. Inc., Indianapolis, IN); омніферон (Viragen Inc., Plantation, FL); і XTL-002 (Biopharmaceuticals Ltd., Rehovot, Ізраїль). На додаток до засобів проти гепатиту або замість них, фармацевтичні композиції і способи, описані в даному документі, можуть містити один або декілька додаткових активних засобів, якщо це доцільно. Додаткові активні засоби включають засоби, ефективні при лікуванні розладів ендокринної системи, таких як діабет і гіперінсулінемія. Приклади протидіабетичних засобів включають інсулін, прамлінтид, екзенатид, сульфонілсечовини (наприклад, хлорпропамід, гліпізид, глібурид, глімепірид), меглітиніди (наприклад, репаглінід, натеглінід), бігуаніди (наприклад, метформін), тіазолідиндіони (наприклад, розиглітазон, троглітазон, піоглітазон) та інгібітори -глюкозидази (наприклад, акарбоза, меглітол). Такі активні засоби можна вводити або перед уведенням сполук, описаних у даному документі, або одночасно з ними з метою регуляції рівнів інсуліну в плазмі. При одночасному введенні такі додаткові активні засоби можна вводити як частину тієї самої композиції зі сполуками, описаними в даному документі, або їх можна вводити у вигляді окремої композиції. Подібним чином, інші активні засоби, такі як засоби, ефективні при лікуванні захворювань печінки, можна також застосовувати зі сполуками, описаними в даному документі. Фармацевтичні композиції, що містять сполуки за описом, що придатні для описаних тут застосувань, можуть також містити фармацевтично прийнятний носій. Як буде прийнято до уваги фахівцем у даній галузі, вибір придатних фармацевтичних носіїв може залежати, наприклад, від способу введення композиції. Фармацевтично прийнятні носії можуть бути твердими речовинами або рідинами, або їхніми сумішами. Фармацевтично прийнятні носії є речовинами, такими як зв'язуючі речовини, лубриканти (мастильні речовини), дезінтегрувальні речовини, наповнювачі, поверхнево-активні речовини, емульгатори, барвники і т.ін. Зв'язуючі речовини використовують для додавання зв'язуючих якостей і, таким чином, забезпечення того, що композиція залишиться інтактною (наприклад, у вигляді імплантату або таблетки). Придатні зв'язуючі речовини включають як необмежуючі приклади полімерні матриці, гідрогелі, крохмаль (включаючи кукурудзяний крохмаль і пептизований крохмаль), желатин, цукри (включаючи сахарозу, глюкозу, декстрозу і лактозу), поліетиленгліколь, воски, і природні і синтетичні камеді, наприклад, камедь альгінату натрію, полівінілпіролідон, полімери целюлози (включаючи гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, метилцелюлозу, мікрокристалічну целюлозу, етилцелюлозу, гідроксіетилцелюлозу і т.ін.), і вігум. Лубриканти використовують для полегшення виробництва, сприяючи плинності порошку і запобігаючи злипанню частинок (тобто руйнуванню частинок) при 6 UA 100840 C2 5 10 15 20 25 30 35 40 45 50 55 60 зменшенні тиску. Придатні лубриканти являють собою стеарат магнію, стеарат кальцію і стеаринову кислоту. Дезінтегрувальні речовини використовують для полегшення дезінтеграції композиції, і вони, як правило, являють собою види крохмалю, глини, целюлози, альгіну, або камеді поперечнозшиті полімери. Наповнювачі включають, наприклад, речовини, такі як діоксид кремнію, діоксид титану, оксид алюмінію, тальк, каолін, порошкову целюлозу і мікрокристалічну целюлозу, а також розчинні речовини, такі як маніт, сечовину, сахарозу, лактозу, декстрозу, хлорид натрію і сорбіт. Поверхнево-активні речовини являють собою зволожуючі речовини, і вони можуть включати іонні речовини, такі як солі жирних кислот, і неіонні речовини, такі як види плюроніка™ (такі як F-127, L-122, L-101, L-92, L-81 і L-61). Наприклад, фармацевтично прийнятний носій для композицій, описаних у даному документі, може містити один або декілька біосумісних полімерів. "Біосумісний" стосується речовини, що не викликає побічної реакції при попаданні в біологічне оточення, таке як при імплантації або ін'єкції in vivo. Більше того, в одному з варіантів здійснення при введенні in vivo біосумісні речовини не викликають імунну відповідь. Якщо не зазначено інакше, біосумісні речовини включають речовини, що є здатними до біологічного розпаду (є здатними до біологічної деградації), здатними до біологічного розкладання (біорозкладними) і здатними до біологічного розсмоктування. Полімерні носії, такі як біосумісні полімери можуть являти собою гомополімери або співполімери кожної з мономерних ланок, описаних у даному документі. Більше того, співполімери не обмежені будь-якою конкретною структурою, і можуть складатися з невпорядкованих співполімерів, співполімерів з регулярним чергуванням мономерних одиниць, блок-співполімерів (включаючи мультиблочні), зіркоподібних, гребінчастих, щеплених, і розгалужених співполімерів, а також їхніх сполучень. Суміші з більше ніж одного полімеру, здатного до біологічної деградації, також входять до обсягу даного опису. Буде прийнято до уваги, що поперечнозшиті і поперечнозшивані полімери також можна використовувати за умови, що таке поперечне зшивання не чинить несприятливу дію на здатність речовини утворювати описані в даному документі композиції (наприклад, здатність речовини до біологічної деградації). Наприклад, оборотні поперечні зшивання (там, де поперечні зшивання містять нековалентні і/або слабко ковалентні міжмолекулярні зв'язки) можуть бути присутніми перед уведенням композицій, або такі зв'язки можуть утворюватися in vivo. Придатні полімери, здатні до біологічної деградації, можуть включати поліортоефіри, полілактони, такі як полі--капролактон і полі--капролактон, полілактиди, полімолочну кислоту, полігліколіди, полігліколеву кислоту, поліетилентерефталат, полімасляну кислоту, полівалеріанову кислоту, полімерні ангідриди, полівініловий спирт, поліетиленвінілацетат, полімери -гідроксикарбонової кислоти та її похідних, альбумін, колаген, желатин, гіалуронову кислоту, крохмаль, целюлозу і похідні целюлози (наприклад, метилцелюлозу, гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, карбоксиметилцелюлозу, ацетатфталат целюлози, ацетат-сукцинат целюлози, фталат гідроксипропілметилцелюлози), казеїн, декстрани, полісахариди, фібриноген, мультиблочні співполімери полімерних простих і складних ефірів, поліефіри, такі як поліетиленгліколь і полібутилентерефталат, тирозин-похідні полікарбонатів, полігідроксилові кислоти, полігідроксибутират, полідіоксанон, поліалкілкарбонат, полігідроксивалеріанову кислоту, полідіоксанон, деградовані полімерні складні ефіри, поліяблучну кислоту, політартронову кислоту, поліакриламіди, поліфосфазени, поліамінокислоти, блок-співполімери поліалкіленоксиду і полімерного складного ефіру, полігідроксимасляну кислоту, полі-бета-бутиролактон, полі-гамма-бутиролактон, полі-гаммавалеролактон, полі-d-деканолактон, політриметиленкарбонат, полі-1,4-діоксан-2-он або полі1,5-діоксепан-2-он або їхні сполучення (тобто співполімери, що входять до складу мономерних ланок, суміші і т.ін.). Приклади полімерів, здатних до біологічної деградації, включають синтетичні полімери, такі як полімери молочної кислоти і гліколевої кислоти, поліангідриди, поліортоефіри, поліуритани, полімасляну кислоту, полівалеріанову кислоту і полілактид-спів-капролактон, і природні полімери, такі як альгінат та інші полісахариди, включаючи декстран і целюлозу, колаген, їхні хімічні похідні (заміщення, приєднання хімічних груп, наприклад, алкілування, алкенування, гідроксилювання, окиснення та інші модифікації, що одержують загальноприйнятими способами фахівцями в даній галузі), альбумін та інші гідрофільні білки, зеїн та інші проламіни і гідрофобні білки, співполімери та їхні суміші. Як правило, ці речовини руйнуються під дією ферментативного гідролізу або під дією води in vivo, шляхом поверхневого або об'ємного руйнування. Компоненти композиції можна розподіляти гомогенно у фармацевтично прийнятному носії, або можуть існувати локальні ділянки з градієнтами концентрації. "Гомогенний розподіл" 7 UA 100840 C2 5 10 15 20 25 30 35 40 45 50 55 60 стосується випадків молекулярної гомогенності, а також об'ємної або макроскопічної гомогенності. Наприклад, активний засіб можна гомогенно розподілити на молекулярному рівні (як розчинена речовина гомогенно розподілена в розчиннику) або на макроскопічному рівні (як дискретні частки активного засобу гомогенно розподілені в носії). Компоненти композиції можна приєднувати (ковалентно або іншим способом, включаючи фізичну сорбцію, іонне приєднання і т.ін.) до фармацевтично прийнятного носія. Для композицій, що вводяться у вигляді водних лікарських форм або інших лікарських форм на основі розчинників (наприклад, для парентерального введення), можна використовувати безліч рідких носіїв. Водні розчини можуть включати солі, буфери і т.ін. Неводні рідкі носії включають, наприклад, жирні олії, такі як маслинова олія і кукурудзяна олія, синтетичні складні ефіри жирних кислот, такі як етилолеат або тригліцериди, низькомолекулярні спирти, такі як пропіленгліколь, синтетичні гідрофільні полімери, такі як поліетиленгліколь, ліпосоми і т.ін. На додаток до одного або декількох фармацевтично прийнятних носіїв, фармацевтичні композиції, що містять одну або кілька сполук, описаних у даному документі і придатних для описаних тут застосувань, можуть також містити один або декілька додаткових компонентів. Додаткові компоненти включають, наприклад, солі, буфери, підсилювачі проникності, підсилювачі усмоктування, гелеутворюючі речовини, такі як полімери, речовини, що сприяють візуалізації, диспергуючі засоби, стабілізатори, ексципієнти і пластифікатори. Буфери являють собою сполуки або розчини, які використовують для допомоги в підтримці концентрації аналіту в межах необхідного діапазону. Наприклад, фармацевтично прийнятні pHбуфери використовують для підтримки кислотності або основності розчину у фармацевтично прийнятному діапазоні. Буфери для використання в композиціях, описаних у даному документі, можуть являти собою будь-який відомий або відкритий у майбутньому буфер. Підсилювачі проникності включають сполуки, що забезпечують або підсилюють проникнення композицій через межі, такі як мембрани. Приклади підсилювачів проникності можна знайти у відповідній літературі (наприклад, Percutaneous Penetration Enhancers, Smith and Maibach, eds., CRC Press, New York NY, 2005), і вони включають похідні циклогексанону, циклічні монотерпени, піролідони, діоксолани, 1-додецилазациклогептан-2-он (азон), диметилсульфоксид (DMSO) і лімонен. Гелеутворювальні речовини можуть бути полімерами або неполімерами, і, як правило, здатні утворювати гелеподібну сітку. В одному з варіантів здійснення гелеутворювальні речовини здатні утворювати гелі in vivo, у той час як в інших варіантах здійснення утворення гелю відбувається ex vivo. Приклади гелеутворювальних речовин включають колаген, хітозан, пектини, гіалуронову кислоту і т.ін. Диспергуючі засоби являють собою поверхнево-активні речовини (наприклад, як описано в даному документі) у сполученні з розчинником, таким як вода. Пластифікатори являють собою сполуки, використовувані для пластифікації (тобто додавання гнучкості) пластмасі та іншим речовинам. Приклади включають пропіленгліколь, ацетилтрибутилцитрат, ацетилтриетилцитрат, п-трет-бутилфенілсаліцилат, бутилстеарат, бутилфталілбутилгліколят, дибутилсебацинат, ди-(2-етилгексил)фталат, діетилфталат, діізобутилaдипітат, діізооктилфталат, дифеніл-2-етилгексилфосфат, епоксидована соєва олія, етилфталілетилгліколят, гліцеринмоноолеат, моноізопропілцитрат, моно-, диі тристеарилцитрат, триацетин (гліцеринтриацетат), триетилцитрат і 3-(2-ксеноліл)-1,2епоксипропан. Ексципієнти являють собою неактивні інгредієнти, які можна використовувати в описаних у даному документі композиціях виходячи з декількох причин. Широкий діапазон ексципієнтів описаний у літературі (наприклад, Rowe et al., Handbook of Pharmaceutical Excipients, McGraw Hill, 2006). Речовини, що сприяють візуалізації, являють собою сполуки, що допомагають візуалізувати композицію для доставки лікарського засобу або будь-які її компоненти за допомогою способу візуалізації, такого як флюороскопія, магнітно-резонансна томографія (MRI), видиме світло, ультразвук або радіографія. Будь-які речовини, що сприяють візуалізації, які відомі в даній галузі, можна використовувати в композиціях, описаних у даному документі. В одному з аспектів композиції за даним описом включають один або декілька консервантів або бактеріостатичних засобів, що є присутніми в ефективній кількості для запобігання композиції і/або інгібування росту бактерій у композиції. Приклади включають трибромфенат вісмуту, метилгідроксибензоат, бацитрацин, етилгідроксибензоат, пропілгідроксибензоат, еритроміцин, 5-фторурацил, метотрексат, доксорубіцин, мітоксантрон, рифаміцин, хлоркрезол, хлориди бензалконію, складні ефіри параоксибензойної кислоти, хлорбутанол, бензиловий спирт, фенілетиловий спирт, дегідрооцтову кислоту, сорбінову кислоту і т.ін. 8 UA 100840 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стабілізатори включають сполуки, такі як антиоксиданти, і їх використовують для інгібування або уповільнення реакцій розпаду, що включають, наприклад, реакції окиснення. Приклади стабілізаторів включають бутильований гідрокситолуол (BHT), бутильований гідроксіанізол (BHA), аскорбінову кислоту, етилендіамінтетраоцтову кислоту (EDTA), сполуки-похідні токоферолу, такі як альфа-токоферол, сульфіти, трет-бутилгідрохінон, лимонна кислота, оцтова кислота і пектин. Композиції, описані в даному документі, або їхні попередники можуть додатково містити пороутворювальні засоби, що забезпечують значнішу ділянку поверхні, наприклад, імплантату або таблетки. Приклади пороутворювальних засобів включають неорганічні солі, сахарозу, поверхнево-активні речовини, низькомолекулярні полімери, швидко деградуючі полімери, термооборотні полімерні преципітати, пухирці газу і кавітаційні пухирці. Кількість активного засобу (а також інших активних інгредієнтів у випадку їхньої наявності) у композиціях, описаних у даному документі, залежить від ряду факторів і буде варіювати від суб'єкта до суб'єкта. Такі фактори очевидні рядовому фахівцю в даній галузі, і можуть включати конкретний розлад або стан, що підлягає лікуванню, спосіб уведення, тяжкість симптомів, вік, маса і загальний стан пацієнта, і рішення лікуючого лікаря. В одному з варіантів здійснення композиція містить сполуку формули I як активний засіб і фармацевтично прийнятний носій. Носій можна застосовувати в будь-якій придатній кількості стосовно активного засобу, і відношення маси носія до активного засобу може варіювати від приблизно 0,1:1 до приблизно 100000:1, залежно від способу застосування. В одному з прикладів цього варіанта здійснення композиція складається тільки з активного засобу і фармацевтично прийнятного носія. В іншому прикладі композиція містить активний засіб, носій, і один або декілька додаткових компонентів, таких як компоненти, описані в даному документі. В іншому прикладі композиція містить активний засіб, другий активний засіб, один або декілька носіїв, і один або декілька додаткових компонентів. Сполуки, що мають структурну формулу I, як описано в даному документі, придатні як лікарські засоби і як активні засоби у фармацевтичних композиціях. В одному з варіантів здійснення такі сполуки і композиції придатні для лікування вірусного гепатиту. Зокрема, сполуки і композиції придатні для лікування пацієнтів, що страждають від вірусу гепатиту B (HBV) і вірусу гепатиту C (HCV). В іншому варіанті здійснення сполуки, описані в даному документі, придатні в удосконаленому способі лікування гепатиту C інтерфероном, де удосконалення включає введення ефективної кількості нітазоксаніду, тизоксаніду або їхніх сумішей суб'єкту, що їх потребує. За допомогою цього удосконалення збільшується відсоткова частка суб'єктів, у яких виявляють зниження кількості РНК HCV у сироватці в порівнянні зі способом лікування гепатиту C інтерфероном або поєднанням рибавірину та інтерферону. Крім того, кількість інтерферону, необхідного для досягнення стійкої вірусологічної відповіді в пацієнта, можна знижувати в порівнянні з кількістю інтерферону, необхідного для досягнення стійкої вірусологічної відповіді в пацієнта без уведення нітазоксаніду, тизоксаніду або їхніх сумішей. Більше того, кількість інтерферону, необхідного для досягнення стійкої вірусологічної відповіді в пацієнта, можна знижувати в порівнянні з кількістю інтерферону, необхідного для досягнення стійкої вірусологічної відповіді в пацієнта, при лікуванні сполученням рибавірину та інтерферону. В одному з варіантів здійснення запропонований спосіб лікування, де пацієнта, що страждає на гепатит C, піддають попередньому лікуванню з використанням нітазоксаніду і/або тизоксаніду перед лікуванням інтерфероном (таким як будь-який з інтерферонів, описаних у даному документі). Конкретні приклади цього та іншого варіантів здійснення детальніше описані нижче в даному документі. Нітазоксанід, тизоксанід та їхні суміші, зокрема, ефективні при лікуванні гепатиту C. За допомогою лікування пацієнтів з гепатитом C нітазоксанідом, тизоксанідом або їхньою сумішшю, можливе зниження кількості інтерферону, необхідного для ефективного лікування, хоча таке зниження не є необхідним. Також можливо цілком уникнути використання рибавірину, хоча це також не є необхідним. Ці переваги можна одержувати при одночасному збільшенні відсоткової частки суб'єктів, які позитивно реагують у термінах зниження кількості РНК HCV у сироватці. Таким чином, у даному документі описаний спосіб лікування гепатиту C, що включає в себе введення суб'єкту, що потребує цього, ефективної кількості нітазоксаніду, тизоксаніду або їхньої суміші. Подібним чином, даний винахід стосується будь-якого з вищезгаданих варіантів здійснення, в яких будь-яка сполука формули I або поєднання таких сполук застосовують замість нітазоксаніду і тизоксаніду. Уведення композицій, описаних у даному документі, можна здійснювати з використанням будь-якого придатного способу введення і лікарської форми. Таким чином, уведення може 9 UA 100840 C2 5 10 15 20 25 30 35 40 45 50 55 являти собою, наприклад, пероральне, очне, букальне, ректальне, місцеве, парентеральне, трансдермальне, трансмукозальне, під'язичне, за допомогою інгаляції (з використанням або твердих або рідких композицій), або за допомогою імплантації резервуара з лікарською формою. Буде прийнято до уваги, що більшість придатних способів у будь-якому конкретному випадку буде залежати від природи і тяжкості стану, що підлягає лікуванню, і від природи конкретної застосовуваної форми сполуки формули I. Термін "парентеральний", як застосовують тут, стосується, наприклад, підшкірної, внутрішньовенної, інтрадермальної і внутрішньом'язової ін'єкції. Термін "трансмукозальний", як застосовують тут, стосується, наприклад, ректального, вагінального, букального, під'язикового введення і введення в статевий член. Термін "інгаляція", як застосовують тут, стосується інгаляції через ніс або рот, і включає ті випадки, де усмоктування композиції відбувається в легенях, а також, наприклад, у слизових оболонках ротової, носової порожнини і глотки. Уведення за допомогою імплантації стосується імплантатів, введених у будь-яке місце або розташованих у будь-якому місці усередині організму, включаючи усередині порожнин тіла (наприклад, внутрішньочеревинні імплантати, внутрішньоочні імплантати, імплантати в суглоби і т.ін.), усередині органів і підшкірно. Залежно від наміченого способу уведення фармацевтична композиція може бути твердою, напівтвердою, або рідкою, такою як, наприклад, таблетка, капсула, каплет, аерозоль, рідина, суспензія, емульсія, крем, гель, супозиторій, гранули, пігулки, намисто, плівка, порошок, або губка т.ін. В одному з варіантів здійснення композиція містить стандартну лікарську форму, придатну для однократного введення точного дозування. В іншому варіанті здійснення композиція містить резервуар, такий як в імплантаті, здатний до контрольованої доставки композиції з часом. Придатні фармацевтичні композиції і лікарські форми можна одержувати з використанням загальноприйнятих способів, відомих фахівцям у галузі фармацевтичних композицій і описаних у відповідних текстах і літературі, наприклад, у Remington: The Science and Practice of Pharmacy (Easton, PA: Mack Publishing Co., 1995). Опис деяких, але не всіх, придатних лікарських форм представлено нижче. Композиції, придатні для перорального введення, можна представити у вигляді дискретних компонентів, таких як капсули, крохмальні капсули, пастилки або таблетки, де кожен компонент містить попередньо визначену кількість сполуки формули I; у вигляді порошку або гранул; у вигляді розчину або суспензії у водній або неводній рідині; або у вигляді емульсії "олія у воді" або "вода в олії". Такі композиції можна одержувати будь-яким придатним способом фармацевтичної справи, що включає стадію утворення сполучення активної сполуки і придатного носія (який може містити один або кілька допоміжних інгредієнтів). Таблетки можна виготовляти з використанням загальноприйнятих способів виготовлення таблеток і обладнання для них. На додаток до реверсину, таблетки, як правило, містять неактивні, фармацевтично прийнятні речовини носія, як описано в даному документі. Придатні капсули можуть бути або твердими або м'якими, і, як правило, виготовлені з речовини желатину, крохмалю або целюлози, де желатинові капсули є переважними. Дві частини твердих желатинових капсул переважно герметично з'єднують, наприклад, желатиновими смужками або т.ін. Див., наприклад, Remington: The Science and Practice of Pharmacy, цитований вище, у якому описані речовини і способи одержання інкапсульованих лікарських речовин. Пероральні лікарські форми, або таблетки, капсули, каплети, або частинки, можна, за необхідності, складати таким чином, щоб забезпечити поступове, уповільнене вивільнення активного засобу протягом тривалого періоду часу. Наприклад, як візьмуть до уваги рядові фахівці в даній галузі, лікарські форми можна складати, диспергуючи активний засіб усередині матриці поступово гідролізованої речовини, такої як гідрофільний полімер, або покриваючи тверду лікарську форму, що містить лікарський засіб, такою речовиною. Одним із прикладів переважної лікарської форми є алінія® (див. вкладиш в упакування для алінії® і/або патенти США № 5387598, 5578621, 5968961, 5856348, 5859138, 5886013, 5965590, 6020353 і 6117894). Слід зазначити, що, якщо не зазначено інакше, у даному описі (включаючи приклади і формулу винаходу) будь-які посилання, зроблені на алінію®, наведені тільки як приклади, і не призначені для обмеження. Таким чином, такі посилання призначені для застосування в однаковій мірі до інших композицій, що містять нітазоксанід, тизоксанід і/або сполуки, що мають структурну формулу I. Композиції, придатні для букального (наприклад, під'язикового) уведення включають таблетки для розсмоктування, що містять сполуку формули I, на ароматизованій основі, як правило, із сахарози і або камеді трагаканту; і пастилки, що містять сполуку на інертній основі, такій як желатин і гліцерин, або сахароза і камедь. 10 UA 100840 C2 5 10 15 20 25 30 35 40 45 50 55 Препарати, відповідно до цього опису придатні для парентерального введення, включають стерильні водні і неводні розчини, суспензії та емульсії. Такі препарати, переважно, є ізотонічними крові передбачуваного реципієнта. Водні розчини, що вводять шляхом ін'єкції, можуть містити активний засіб у водорозчинній формі, або можуть містити суспензію або емульсію активного засобу. У даному документі описані приклади неводних розчинників або носіїв. Парентеральні композиції можуть також містити ад'юванти, такі як солюбілізатори, консерванти, зволожуючі засоби, емульгатори, диспергенти і стабілізатори, і водні суспензії можуть містити речовини, що підвищують в'язкість суспензії, такі як натрійкарбоксиметилцелюлоза, сорбіт і декстран. Композиції, що вводять шляхом ін'єкцій, можна одержувати стерильними за допомогою, наприклад, внесення стерилізуючого засобу, фільтрації через фільтр, який не пропускає бактерії, опромінення або теплової обробки. Їх також можна виготовляти з використанням стерильного середовища для ін'єкцій. Будь-який активний засіб, що є присутнім у композиціях, може також являти собою висушену, наприклад, ліофілізовану, форму, яку можна регідратувати придатним носієм безпосередньо перед уведенням за допомогою ін'єкції. Парентеральні препарати, переважно, уводять внутрішньовенно, хоча введення можна також здійснювати за допомогою підшкірної, внутрішньом'язової або інтрадермальної ін'єкції. В одному з варіантів здійснення такі препарати одержують змішуванням сполуки з водою або гліциновим буфером, і роблячи одержаний розчин стерильним та ізотонічним крові. Композиції, описані в даному документі, можна також уводити через шкіру з використанням загальноприйнятих трансдермальних систем доставки лікарського засобу, де активний засіб міститься усередині шаруватої структури, яка служить як пристрій для доставляння лікарського засобу, який фіксують на шкірі. У такій структурі композиція з активним засобом міститься в шарі, або "резервуарі", що лежить під верхнім покриваючим шаром. Шарувата структура може містити один резервуар, або вона може містити кілька резервуарів. В одному з варіантів здійснення резервуар містить полімерну матрицю з фармацевтично прийнятної контактної адгезивної речовини, яка служить для фіксації системи на шкірі протягом доставляння лікарського засобу. Альтернативно, резервуар, що містить активний засіб, і контактна речовина для адгезії на шкірі присутні у вигляді окремих і різних шарів, де адгезивна речовина лежить під резервуаром, який, у цьому випадку, може являти собою полімерну матрицю, як описано вище, або він може являти собою рідкий резервуар або резервуар на основі гідрогелю, або може приймати іншу форму. Трансдермальні системи доставки лікарського засобу можуть, крім того, містити підсилювач проникності шкіри. Композиції для трансдермального введення можна також доставляти іонтофорезом (див., наприклад, Pharmaceutical Research 3(6), 318, (1986)), і придатні композиції, як правило, приймають форму, необов'язково, забуференого водного розчину сполуки формули I. Придатні композиції містять, наприклад, цитратний буфер або буфер на основі біс/трис (pН 6), або систему етанол/вода, і містять від 0,1 до 0,2 М активного інгредієнта. Композиції, описані в даному документі, можна також уводити місцево з використанням загальноприйнятих лікарських форм для місцевого введення, де активний засіб міститься в носії. Лікарські форми, придатні для місцевого застосування, включають, наприклад, креми, пасти, желе, гелі, мазі, рідини, аерозолі, олії, лосьйони, пінки, суспензії та емульсії. Носії, які можна використовувати, включають вазелін, ланолін, поліетиленгліколі, спирти та їхні сполучення по два або більше. На додаток до раніше описаних композицій, сполуки можна також складати у вигляді препаратів-депо для контрольованого вивільнення активного засобу, переважно, уповільненого вивільнення протягом тривалого періоду часу. Ці лікарські форми для уповільненого вивільнення можна вводити за допомогою імплантації (наприклад, підшкірної, внутрішньочеревинної, внутрішньом'язево або за допомогою внутрішньом'язової ін'єкції). Композиції, придатні для ректального введення, переважно одержувати у вигляді супозиторіїв, що містять стандартне дозування. Їх можна одержувати змішуванням сполуки формули I з одним або декількома загальноприйнятими твердими носіями, наприклад, олією какао, і потім додати форму одержаної суміші. Хоча композиції, описані в даному документі, як правило, уводять перорально, парентерально, трансдермально або за допомогою імплантованого депо, також підходять й інші способи введення. Наприклад, уведення може бути ректальним або вагінальним, переважно з використанням супозиторію, що містить, на додаток до активного засобу, ексципієнти, такі як віск для супозиторіїв. Композиції для назального або під'язикового введення можна також одержувати з загальноприйнятими ексципієнтами, добре відомими в даній галузі. 11 UA 100840 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтичні композиції за винаходом можна також складати для інгаляції, наприклад, у вигляді розчину в сольовому розчині, у вигляді сухого порошку або у вигляді аерозолю. Буде прийнято до уваги, що композиції, описані в даному документі, можна одержувати та упаковувати у вигляді форм для однократного дозування, як наприклад, для перорального введення (наприклад, таблеток). Композиції можна також одержувати та упаковувати у вигляді композицій для багаторазового дозування, або у вигляді дозувань, придатних для довгострокового введення, як наприклад, для місцевого введення (наприклад, кремів), уведення через оболонки (наприклад, пластирів) або імплантації. Сполуки, описані в даному документі, можна вводити протягом періоду часу будь-якої тривалості, придатного для наміченого застосування. Уведення сполук, описаних у даному документі, як правило, здійснюють протягом періоду приблизно від 3 діб до приблизно 104 тижнів, але можна здійснювати протягом періоду тривалішого, ніж 104 тижні, і можна навіть здійснювати невизначено довго. Наприклад, лікування гепатиту C із використанням сполук, описаних у даному документі, як правило, включає введення сполук протягом періоду 12, 24 або 48 тижнів. Для сполук, описаних у даному документі, і фармацевтичних композицій, що містять такі сполуки, можна використовувати будь-яке придатне дозування і режим. В одному з варіантів здійснення сполуку, що має структурну формулу I, вводять у сполученні з додатковим активним засобом, таким як, наприклад, інтерферон, такий як кожен з інтерферонів, описаних у даному документі. Сполуку, що має структурну формулу I, і додатковий активний засіб (наприклад, інтерферон) можна вводити у вигляді частини однієї і тієї ж композиції, або їх можна вводити в окремих композиціях (включаючи окремі композиції, що відрізняються за лікарською формою, профілями вивільнення і т.ін.). В одному з варіантів здійснення пацієнта, що страждає на гепатит C, спочатку піддають попередньому лікуванню нітазоксанідом, тизоксанідом або будь-якою сполукою, описаною у даному документі, що має структурну формулу I. Тривалість попереднього періоду лікування може знаходитися в діапазоні приблизно від 3 діб і приблизно до 6 місяців, наприклад, у діапазоні приблизно від 1 тижня і приблизно до 12 тижнів, і як додатковий приклад, у діапазоні приблизно від 1 тижня і приблизно до 4 тижнів. За періодом попереднього лікування потім йде період лікування, де підданого попередньому лікуванню пацієнта лікують або тільки інтерфероном або інтерфероном у сполученні з нітазоксанідом, тизоксанідом або будь-якою сполукою, що має структурну формулу I. У ході періоду лікування можна використовувати будьякий з інтерферонів, описаних у даному документі. Тривалість періоду лікування є будь-якою тривалістю, що потрібно для одержання необхідної відповіді, і, як правило, складає приблизно від 1 доби і приблизно до 12 місяців або більше. Наприклад, період лікування може включати щотижневі ін'єкції інтерферону, і може включати лікування протягом одного тижня, лікування протягом 2-4 тижнів, лікування протягом 4-12 тижнів або більше (таке як 6 місяців, 1 рік, 2 роки або невизначено довгий час). Приклади режимів, що придатні для введення сполук, описаних у даному документі, включають наступне: 24 тижня введення нітазоксаніду з наступними 12 тижнями введення композиції, що містить нітазоксанід і -2b-інтерферон пегільований -2b-інтерферон; 2-4 тижні введення нітазоксаніду з наступними 12 тижнями введення композиції, що містить нітазоксанід і пегільований -2b-інтерферон; уведення композиції, що містить нітазоксанід + пегільований 2b-інтерферон, протягом 12, 24 або 48 тижнів; і 12, 24 або 48 тижнів уведення нітазоксаніду, тизоксаніду або їхнього сполучення. Буде прийнято до уваги, що такі режими представлені тільки як приклади, тому що придатні тривалості, дозування і порядки введення будуть варіювати. Відповідні режими, як правило, визначає лікар. Буде прийнято до уваги, що дозування можуть варіювати, і, як правило, їх підбирають таким чином, щоб забезпечити терапевтично ефективну кількість активного засобу для пацієнта. В одному з прикладів, дозування може знаходитися в діапазоні приблизно від 100 мг до приблизно 2000 мг, або в діапазоні приблизно від 250 мг до приблизно 1000 мг, або, переважно, приблизно 500 мг. В іншому конкретному прикладі відповідне дозування підбирають для досягнення і підтримки рівня активного засобу в крові (наприклад, нітазоксаніду) у пацієнта, що знаходиться приблизно між 0,1 мкг/мл і приблизно 10 мкг/мл, переважно, приблизно 1 мкг/мл. Способи одержання композицій, описаних у даному документі, стануть очевидними для рядового фахівця. В одному з варіантів здійснення композиції за описом можна одержувати за допомогою однорідного і безпосереднього змішування активної сполуки з рідким або дрібно подрібненим твердим носієм, або і з тим, і з іншим, і потім, за необхідності, надаванням форми одержаній суміші. Наприклад, таблетки можна одержувати пресуванням або формуванням покритого або непокритого порошку, або покритих або непокритих гранул, що містять активну 12 UA 100840 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполуку, необов'язково, з одним або декількома допоміжними інгредієнтами. Пресовані таблетки можна одержувати пресуванням у придатному пристрої сполуки в сипучій формі, такій як порошок або гранули, необов'язково, змішаної зі зв'язуючою речовиною, лубрикантом, інертним розріджувачем і/або поверхнево-активним(ими)/диспергуючим(ими) засобом(ами). Формовані таблетки можна одержувати формуванням у придатному пристрої порошкоподібної сполуки, зволоженої інертною рідкою зв'язуючою речовиною. Даний опис також стосується наборів для здійснення такого лікування, як описано в даному документі. Набори містять: (і) ефективну кількість сполуки формули I; (ii) один або декілька фармацевтично прийнятних носіїв і/або допоміжних речовин; і (iii) інструкції для застосування (наприклад, при лікуванні гепатиту). Як застосовують тут, фраза "інструкції для застосування" буде означати будь-які санкціоновані FDA етикетки, інструкції або вкладиші в упаковки, що стосуються введення сполуки формули I з метою лікування вірусного гепатиту. Наприклад, інструкції для застосування можуть включати як необмежуючі приклади вказівки для конкретного захворювання, виявлення специфічних симптомів конкретного захворювання, яке можна полегшувати заявленими сполуками, і рекомендовані кількості дозувань для суб'єктів, що страждають на захворювання. Набір за даним винаходом додатково містить стандартне дозування сполуки в кількості, ефективній для лікування вірусного гепатиту. Слід розуміти, що хоча винахід описаний у зв'язку з переважними конкретними варіантами його здійснення, вищевикладений опис, а також далі наступні приклади призначені для ілюстрації і не обмежують обсяг винаходу. Інші аспекти, переваги і модифікації в межах обсягу винаходу стануть очевидними для фахівців у даній галузі, яких стосується винахід. Усі патенти, патентні заявки і публікації, згадані в даному документі, наведені тут як посилання в повному обсязі. Однак якщо патент, патентна заявка або публікація, що містять явно виражені визначення, наведені як посилання, то ці явно виражені визначення слід розуміти в застосуванні до цитованого патенту, патентної заявки або публікації, в яких вони представлені, і не стосовно іншого тексту цієї заявки, зокрема, формули винаходу цієї заявки. Приклади Приклад 1 Активність стосовно реплікації HCV Противірусну активність нітазоксаніду, тизоксаніду, -інтерферону, рибавірину і 2-Cметилцитидину аналізували на п'ятьох різних лініях клітин, що містять реплікон HCV: (1) AVA5, субгеномна конструкція генотипу 1b (Blight et al., 2000, Science 290:1972-1974); (2) H/FL-Neo, повнорозмірна конструкція генотипу 1a (Blight et al., 2003, Journal of Virology 77:3181-3190); (3) JWT, субгеномна конструкція генотипу 1b (Pfeiffer and Kirkegaard, 2005, Journal of Virology, 79:2346-2355); (4) 4-3-10, субгеномна конструкція генотипу 1b, розроблена способом, що включає послідовне пасирування клітин JWT у 100 мкм протягом одного місяця з наступним пасируванням у 400 мкм рибавірину протягом двох тижнів (Pfeiffer and Kirkegaard, 2005, Journal of Virology, 79:2346-2355); і (5) RP7, субгеномна конструкція генотипу 1b (Elazar et al., 2003, Journal of Virology 77:6055-6061). Противірусну активність кожної тестованої сполуки визначали, як описано раніше (Okuse et al., 2005, Antiviral Research 65:23-34). У короткому викладі, реплікон-вмісні лінії клітин пасирували у вигляді субконфлюєнтних культур у 96-ямкових планшетах. Сполуки додавали щодня протягом трьох діб у свіжому середовищі. Через двадцять чотири години після додавання останньої дози сполуки, противірусну активність визначали аналізом на основі блотинг-гібридизації внутрішньоклітинної РНК HCV, і цитотоксичність аналізували по включенню барвника нейтрального червоного. EC50, EC90, CC50 та індекс селективності обчислювали для кожної сполуки, тестованої в реплікон-вмісній лінії клітин. EC50 = концентрація лікарського засобу, що викликає зниження на 50 % внутрішньоклітинної РНК HCV стосовно середніх значень рівнів у неопрацьованих культурах. EC 90 = концентрація лікарського засобу, що викликає зниження на 90 % внутрішньоклітинної РНК HCV щодо середніх значень рівнів у неопрацьованих культурах. CC50 = концентрація лікарського засобу, що викликає зниження на 50 % включення барвника нейтрального червоного щодо середніх значень рівнів у неопрацьованих культурах. Індекс селективності = CC50, розділений на EC50. Величини EC50, EC90 і CC50 ( стандартні відхилення [S.D.]) обчислювали лінійним регресійним аналізом із використанням даних, об'єднаних із усіх оброблених культур. Значення медіан EC 50 і EC90 обчислювали для кожної сполуки на основі результатів, визначених для п'яти різних репліконвмісних ліній клітин. Нітазоксанід і тизоксанід одержували від Romark Laboratories, L.C. (Tampa, FL USA). Рекомбінантний -2b-інтерферон одержували від PBL Biomedical Laboratories (Piscataway, NJ 13 UA 100840 C2 5 10 15 USA). Рибавірин одержували від Sigma-Aldrich (St. Louis, MO USA). 2-C-метилцитидин (Pierra, et al. 2005, Nucleosides Nucleotides Nucleic Acids, 24:767-770) одержували від Moraveck Biochemicals, Inc. (La Brea, CA USA). -2b-інтерферон розчиняли і/або розводили в стерильному фосфатно-буферному сольовому розчині (PBS)/1 % BSA, відповідно до інструкцій виробника. Рибавірин, нітазоксанід, тизоксанід і 2-C-метилцитидин розчиняли в 100 % DMSO ступеню чистоти для культури тканин (Sigma). Маткові розчини зберігали при -70C для -2bінтерферону, -20C для нітазоксаніду, тизоксаніду, рибавірину і 2-C-метилцитидину в кількостях, достатніх для одиночного експерименту і використовували тільки один раз. Добові аліквоти тестованих сполук одержували з маткових розчинів в індивідуальних пробірках і зберігали при відповідних температурах. У кожну добу обробки добові аліквоти тестованих сполук суспендували в культуральному середовищі при кімнатній температурі і безпосередньо додавали в культури клітин, таким чином, піддаючи кожну аліквоту тестованої сполуки однаковій, обмеженій кількості циклів розморожування-відтавання. Нітазоксанід і тизоксанід вибірково знижували внутрішньоклітинну реплікацію HCV у кожній із п'яти ліній клітин, що містять реплікон, що походить з генотипу 1 HCV (таблиця 1). Медіани EC50 складали 0,13 мкМ і 0,15 мкМ для нітазоксаніду і тизоксаніду, відповідно, у порівнянні з 0,86 МО/мл для -2b-інтерферону, 69 мкМ для рибавірину і 2,1 мкМ для 2-C-метилцитидину. Таблиця 1 Відносна активність тестованих сполук стосовно реплікації HCV Лікарський засіб Лінія клітин 1 ЕС50 (мкМ) ЕС50 (мкМ) СС50 (мкМ) S.I. Нітазоксанід AVA5 0,130,02 1,00,2 393,9 300 H/FL-Neo JWT 4-3-10 RP7 Медіана 0,330,05 0,110,01 0,100,03 0,160,01 0,13 1,10,1 1,00,2 0,870,16 1,20,1 1,0 491,5 391,0 340,4 380,8 149 354 340 238 Тизоксанід AVA5 0,120,01 0,770,10 252,8 208 H/FL-Neo JWT 4-3-10 RP7 Медіана 0,250,03 0,160,02 0,110,05 0,150,01 0,15 1,00,1 0,760,03 0,550,08 0,940,10 0,77 4,20,2 242,9 211,1 251,0 17 150 191 167 1,50,2 8,20,8 >10000 >6667 2,10,2 0,770,03 0,860,06 0,410,01 0,86 9,40,9 2,60,2 5,70,4 3,60,2 5,7 >10000 >10000 >10000 >10000 >4762 >12987 >11627 >24390 700,5 22034 844,7 1,2 232,2 621,7 897,5 3,9 694,4 69 12213 122 774,9 1,2 2-C-метилцитидин AVA5 2,10,2 8,10,7 >300 >143 H/FL-Neo 1,80,2 8,10,8 >1000 >556 -2b-інтерферон (МО/мол) AVA5 H/FL-Neo JWT 4-3-10 RP7 Медіана Рибавірин AVA5 H/FL-Neo JWT 4-3-10 RP7 Медіана 20 14 UA 100840 C2 JWT 4-3-10 SRP7 Медіана 2,20,1 2,10,1 2,00,1 2,1 8,20,7 8,00,9 9,00,6 8,1 >300 >300 >300 >136 >143 >150 S.I. – (індекс селективності) = CC50/EC50. 5 10 Приклад 2 Синергічна активність нітазоксаніду і тизоксаніду з іншими лікарськими засобами проти HCV Активність сумісного лікування нітазоксанідом плюс -2b-інтерферон, тизоксанідом плюс 2b-інтерферон, нітазоксанідом плюс 2-C-метилцитидин і тизоксанідом плюс 2-C-метилцитидин проти реплікації HCV оцінювали в реплікон-вмісній лінії клітин AVA5 із використанням способів, описаних раніше (Okuse et al., 2005, Antiviral Research 65:23-34). Аналізи взаємодії між сполуками, використовуваними в сумісному лікуванні, здійснювали з використанням програмного забезпечення Calcusyn™ (Biosoft, Cambridge, UK). Сполучення нітазоксаніду або з -2b-інтерфероном або із 2-C-метилцитидином, і тизоксаніду або з -2b-інтерфероном або з 2-C-метилцитидином мали синергічні взаємодії стосовно реплікації HCV (таблиця 2, фіг. 1a і 1b). На фіг. 1a і 1b представлені аналізи взаємодій між сполуками при сумісному лікуванні. 15 Таблиця 2 Відносна активність сумісного лікування проти реплікації HCV у культурах клітин AVA5 Лікування Нітазоксазид Тизоксанід IFN-2b 2-C-метилцитидин (2CMeC) 2CMeC+IFN-2b, 1:1 NTZ+IFN-2b, 1:10 NTZ+2CMeC, 1:10 TIZ+IFN-2b, 1:10 TIZ+2CMeC, 1:10 1 ЕС50 (мкМ) 0,210,03 0,150,02 2 1,90,2 ЕС90 (мкМ) 0,930,11 0,810,92 2 8,90,9 СС50 (мкМ) 381,8 151,2 2 >10000 S.I. 181 100 >5263 1,60,2 8,30,7 >300 >188 0,670,007 0,060,008 0,070,005 0,070,01 0,060,004 2,30,3 0,250,03 0,280,02 0,220,03 0,190,02 >300 331,3 351,5 171,3 181,1 >448 550 500 245 300 1 SI=CC50/EC50. Значення для IFN-2b виражені в МО/мл. 2 20 25 На фіг. 1a представлені графіки CI-Fa (індекс сполучення - частка ушкоджених (вірусом)) (Belen'kii and Schinazi, 1994, Antiviral Research 25:11-18). Для цих графіків індекс сполучення [CI] більше 1,0 вказує на антагонізм, і CI менше 1,0 вказує на синергізм. Оцінки синергічності, адитивності (підсумовування), або антагонізму на різних рівнях інгібування вірусу (наприклад, від 5 % або Fa=0,05, до 99 % або Fa=0,99) представлені нанесеними на графік лініями і точками. На фіг. 1b показані консервативні ізоболограми. Для цих графіків величини EC 50, EC75 і EC90 (50 %, 75 % і 90 % ефективних противірусних концентрацій) для сумісного лікування представлені у вигляді окремих точок. Три лінії, що відходять від осей, позначають очікувані (наприклад, адитивні) величини EC50, EC75 і EC90 для сполучень лікарських засобів, що обчислюють виходячи з монотерапії. Величини EC50, EC75 і EC90 для сполучень, що нанесені на графік ліворуч (наприклад, менше ніж) від відповідних ліній, вказують на синергічність, і величини, нанесені на графік праворуч (наприклад, більше ніж) від відповідних ліній, вказують на антагонізм. 15 UA 100840 C2 5 10 15 20 25 Приклад 3 Посилення активності альфа-інтерферону + нітазоксанід після попереднього лікування нітазоксанідом Для оцінки ефекту попереднього лікування нітазоксанідом перед сумісним лікуванням, культури обробляли протягом або 3 або 6 діб нітазоксанідом, -2b-інтерфероном або 2-Cметилцитидином, або сполученнями нітазоксаніду і або -2b-інтерферону або 2-Cметилцитидину. Альтернативно, культури обробляли нітазоксанідом протягом 3 діб з наступними додатковими 3 добами обробки сполученням нітазоксаніду і або -2b-інтерферону або 2-C-метилцитидину. Противірусну активність і цитотоксичність визначали через 24 години після закінчення кожного з відповідних видів лікування, як описано раніше. Попереднє лікування нітазоксанідом поліпшувало ефективність сумісного лікування нітазоксанідом плюс -2b-інтерферон приблизно в 3 рази (таблиця 3 і фіг. 2a і 2b). Попереднє лікування, однак, не впливало на ефективність сумісного лікування 2-C-метилцитидином (таблиця 4). На фіг. 2a і 2b представлені аналізи ефекту в культурах, попередньо оброблених нітазоксанідом перед обробкою нітазоксанідом плюс -2b-інтерферон. Аналізи здійснювали з використанням програмного забезпечення Calcusyn™ (Biosoft, Cambridge, UK). Представлено два типи оцінок. На фіг. 2a представлені графіки CI-Fa (індекс сполучення-частка ушкоджених (вірусом)) (Belen'kii and Schinazi, 1994). Для цих графіків індекс сполучення [CI] більше 1,0 вказує на антагонізм, і CI менше 1,0 вказує на синергізм. Оцінки синергічності, адитивності (підсумовування), або антагонізму на різних рівнях інгібування вірусу (наприклад, від 5 % або Fa=0,05, до 99 % або Fa=0,99) представлені нанесеними на графік лініями і точками. Пунктирні лінії вказують на стандартні відхилення 1,96 (не показані на фіг. 1a для ясності). На фіг. 2b показані консервативні ізоболограми. Для цих графіків величини EC 50, EC75 і EC90 (50 %, 75 % і 90 % ефективних противірусних концентрацій) для сумісного лікування представлені у вигляді окремих точок. Три лінії, що відходять від осей, позначають очікувані (наприклад, адитивні) величини EC50, EC75 і EC90 для сполучень лікарських засобів, що обчислені виходячи з монотерапії. Величини EC50, EC75 і EC90 для сполучень, що нанесені на графік ліворуч (наприклад, менше ніж) від відповідних ліній, вказують на синергічність, і величини, нанесені на графік праворуч (наприклад, більше ніж) від відповідних ліній, вказують на антагонізм. 30 Таблиця 3 Ефект попереднього лікування за допомогою NTZ на ефективність сумісного лікування NTZ+IFN Лікування IFN IFN NTZ NTZ NTZ+IFN, 1:10 NTZ+IFN, 1:10 NTZ, потім NTZ+IFN 3 6 3 6 3 6 6 NTZ (мкМ) Тривалість (доба) ЕС50 (мкМ) ЕС90 (мкМ) 0,220,03 0,200,02 0,080,010 0,090,010 0,030,004 1,00,1 0,920,10 0,270,03 0,240,04 0,090,011 16 IFN-2b (МО/мл) ЕС50 (мкМ) 1,90,3 1,70,2 ЕС90 (мкМ) 8,30,9 7,80,8 0,820,07 0,750,09 0,310,04 2,70,3 2,40,2 0,960,12 UA 100840 C2 Таблиця 4 Ефект попереднього лікування за допомогою NTZ на ефективність сумісного лікування NTZ+2CMeC Лікування 2CMeC 2CMeC NTZ NTZ NTZ+2CMeC, 1:10 NTZ+2CMeC, 1:10 NTZ, потім NTZ+2СMeC 5 10 15 20 25 30 35 40 Тривалість (доба) 3 6 3 6 3 6 NTZ (мкМ) ЕС50 (мкМ) ЕС90 (мкМ) IFN-2b (МО/мл) ЕС50 (мкМ) ЕС90 (мкМ) 1,70,2 6,20,5 1,30,2 5,80,9 0,220,03 0,200,02 0,050,006 0,050,007 1,00,1 0,920,10 0,160,02 0,170,03 0,570,07 0,540,06 1,80,2 1,90,2 0,060,005 0,150,02 0,580,08 1,70,3 Приклад 4 Підсилення активності альфа-інтерферону після попереднього лікування нітазоксанідом або тизоксанідом Для оцінки ефекту альфа-інтерферону після попереднього лікування нітазоксанідом або тизоксанідом, батьківську реплікон-вмісну лінію клітин, (RP-7) послідовно пасирували в зростаючих концентраціях нітазоксаніду або тизоксаніду. Активність альфа-2b-інтерферону стосовно HCV визначали з використанням батьківської лінії клітин і з використанням ліній клітин, одержаних після пасирування з нітазоксанідом або тизоксанідом. Активність стосовно HCV визначали способами, описаними вище. Батьківську реплікон-вмісну лінію клітин, одержували електропорацією РНК, транскрибованої in vitro з лінеаризованою по ScaІ плазміди Bart79I, у клітини Huh-7 (Elazar et al., 2003). Bart79I кодує високо ефективний біцистронний субгеномний реплікон другого покоління генотипу 1b, що містить одиночну адаптивну мутацію (S11791) у гені NS5A, і ген неоміцинфосфотрансферази в першому цистроні. Електропоровані клітини висівали разом із вихідними живильними клітинами Huh-7 і вирощували в середовищі DMEM (4,5 г/л глюкози, Lглутамін і піруват натрію - Mediatech 10-013-CV), 10 % ембріональна бичача сироватка, 1 % пеніцилін-стрептоміцин, 1 % L-глутамін (кінцева концентрація 2 мм), 1 нежиттєво важливі амінокислоти MEM (100) (Invitrogen) і 1 мг/мл G418. Через 3 тижні з'являлися стійкі до G418 колонії. Одну з одержаних колоній виділяли, розмножували, пасирували в 700 мкг/мл G418 і позначили як RP-7. Клітини RP-7 вирощували в умовах, що сприяють стійкості, як описано далі. Клітини вирощували у вищеописаному середовищі, що містить 700 мкг/мл G418 (Invitrogen), 1 % DMSO ступеня чистоти для культури тканин (Sigma) і початкову низьку концентрацію нітазоксаніду або тизоксаніду, що потім постійно підвищували щотижня, роблячи перерву у внесенні лікарського засобу на 2 доби між кожним підвищенням дози. З 1 по 5 добу для кожної дози лікарського засобу середовище щодня змінювали для забезпечення джерелом свіжого лікарського засобу. На 6 і 7 добу не робили зміну середовища (перерва у внесенні лікарського засобу). Початкова концентрація нітазоксаніду або тизоксаніду складала 0,02 мкм, з наступними 0,05 мкм, 0,1 мкм, 0,5 мкм, 1 мкм, і з подальшими підвищеннями щотижня на 1 мкм. Кінцеву концентрацію 11 мкм використовували для клітин, пасированих з нітазоксанідом, у той час як для клітин, пасированих з тизоксанідом, використовували кінцеву концентрацію 8 мкм. Одержані клітини потім пасирували при цій кінцевій концентрації протягом, принаймні, 2 місяців перед використанням для тестування активності альфа-2b-інтерферону стосовно HCV. Результати представлені в таблиці 5. Послідовне пасирування батьківської лінії клітин зі зростаючими концентраціями нітазоксаніду або тизоксаніду не викликало стійкості до альфа-2bінтерферону. Лінії клітин, пасировані з нітазоксанідом або тизоксанідом, фактично були в 2,5-7,6 разів більш чуттєвими до альфа-2b-інтерферону, ніж батьківська реплікон-вмісна лінія клітин, яку не пасирували з нітазоксанідом або тизоксанідом. 17 UA 100840 C2 Таблиця 5 Активність -2b-інтерферону щодо реплікації HCV в клітинах RP7 перед послідовним пасируванням із зростаючими концентраціями нітазоксаніду і тизоксаніду, і після нього Лінія клітин Батьківська лінія клітин (RP-7) Клітини RP7, пасировані з нітазоксанідом Клітини RP7, пасировані з тизоксанідом 5 10 15 20 25 ЕС50 (мкМ) 0,410,01 ЕС90 (мкМ) 3,60,2 СС50 (мкМ) >10000 SI >24390 0,110,02 0,470,04 >10000 >90909 0,160,01 0,420,04 >10000 >62500 Приклад 5 Лікування хронічного гепатиту C зі сполученням нітазоксаніду і тизоксаніду П'ятдесят (50) пацієнтів зареєстрували для участі подвійним сліпим способом у дослідженні алінії® (фармацевтичної композиції, що містить 99 % нітазоксаніду і 1 % тизоксаніду як активні засоби), що вводиться перорально у вигляді таблеток 500 мг два рази на добу протягом 24 тижнів у порівнянні з плацебо, для лікування пацієнтів із хронічним гепатитом C генотипу 4,50 пацієнтів зареєстрували в трьох місцях для дослідження в Єгипті: 32 у Каїрі, 12 в Олександрії і 6 у Танте. Три пацієнти вибули з дослідження безпосередньо після реєстрації і не поверталися для будь-якого наступного лікарського спостереження після лікування. Один з пацієнтів не повернувся для наступного лікарського спостереження після 12 тижня. Усі з 46 пацієнтів, що залишилися, закінчили дослідження. Див. фіг. 3 для блок-схеми проведення досліджень пацієнтів. Один з пацієнтів виявився сумісно інфікованим вірусом гепатиту B. Пацієнт виявився HBeAg-негативним, і було зроблене виключення, щоб дозволити зареєструвати цього пацієнта. Протоколом передбачалося використання популяції з призначеним лікуванням (усі пацієнти пройшли рандомізацію) для первинного аналізу ефективності. Трьох пацієнтів, що вибули до одержання якого-небудь лікування, виключили з аналізу ефективності. Пацієнта, що вибув після 12 тижня, включили в аналіз ефективності й аналізували на основі останнього перенесеного вперед спостереження. Демографічні та пов'язані з захворюванням характеристики 47 пацієнтів, включених в аналіз ефективності, підсумовані за групами лікування в таблиці 6. При кожному відвідуванні для дослідження пацієнтів опитували щодо комплаєнтності лікування. За одним виключенням, усі пацієнти, що закінчили дослідження, повідомляли, що вони додержувались проведеного лікування. Один із пацієнтів закінчив дослідження, але повідомив про окремі випадки некомплаєнтності при проведенні лікування внаслідок абдомінального болю. Таблиця 6 Демографічні і зв'язані із захворюванням характеристики Раса:Європеоїди Стать: Чоловіча/Жіноча Вік (роки): Середнє значення SD Медіана (Діапазон) Вага (кг): Середнє значення SD Медіана (Діапазон) Індекс маси тіла: Середнє значення SD Всі суб'єкти Активне лікування 47 23 39/8 19/4 47,39,3 49,78,4 48(27-67) 51 (35-67) 86,218,8 84,816,7 84 (64-143) 84 (64-130) 29,45,5 29,05,1 18 Плацебо 24 20/4 45,09,6 46 (27-64) 87,521,0 82 (65-143) 29,86,0 1 Р 1,0 1,0 0,08 0,62 0,62 UA 100840 C2 Медіана (Діапазон) Вірусне навантаження (log10 МО/мл): Середнє значення SD Медіана (Діапазон) Вірусне навантаження >800000 МО/мл Підвищення ALT Некрозапальниий показник: Середнє значення SD Медіана (Діапазон) Захворювання печінки: Відсутність фіброзу Розвиток портального фіброзу Мостоподібний фіброз Цироз (компенсований) Цироз (декомпенсований) Попереднє лікування пегінтерфероном/рибавірином Цукровий діабет Контрольований Неконтрольований 28,2 (21-47) 27,3 (22-47) 28,3 (21-46) 5,20,7 5,30,7 0,43 5,20,8 5,3 (3,5-6,5) 5,4 (4,0-6,3) 5,3 (3,5-6,5) 10 6 4 0,49 31 13 18 0,23 0,51 6,03,2 6,33,3 5,72,7 5 (2-17) 8 18 14 3 4 5 (3-17) 4 8 7 1 3 5,5 (2-11) 4 10 7 2 1 5 3 2 0,67 7 3 4 1 3 2 0,70 1,0 0,95 1 Точний критерій Фішера або критерій хі-квадрат використали для порівняння відношень, критерій Ст'юдента для порівняння середніх. 5 Вірусологічні відповіді підсумовані за групами лікування в таблиці 7. Частка суб'єктів з вірусологічними відповідями в групі з активним лікуванням виявилася значно вищою, ніж у групі з лікуванням плацебо (P=0,0039). Вірусологічні відповіді (недетектований рівень РНК HCV у сироватці) спостерігали на 4 тиждень (n=3), 8 тиждень (n=3) і 20 тиждень (n=1). Кожна з цих відповідей зберігалась протягом періоду лікування. Таблиця 7 Вірусологічні відповіді за групами лікування Активне лікування 7/23 (30,4 %) Суб'єкти з відповідями/загальна кількість (%); 1 Плацебо P 0/24 (0 %) 0,0039 1 Точний двобічний критерій Фішера 10 15 Демографічні характеристики, вихідні лабораторні дані, дані біопсій печінки та історії хвороби оцінювали для виявлення незалежних прогностичних параметрів вірусологічної відповіді в групі з активним лікуванням. Прогностичні параметри відповіді перераховані в таблиці 8. Найбільш важливим прогностичним параметром відповіді виявилося знижене вихідне вірусне навантаження. Усі суб'єкти з відповіддю мали вихідні вірусні навантаження 384615 МО/мл. Вихідні лабораторні величини (кількості тромбоцитів, протромбіновий час і альфафетопротеїн) також дозволяли припустити, що суб'єкти з відповіддю мали менш важке захворювання печінки. 19 UA 100840 C2 Таблиця 8 Незалежні прогностичні параметри відповіді Прогностичні параметри відповіді Знижене вихідне вірусне навантаження Індикатори менш тяжкого захворювання печінки - Підвищені кількості тромбоцитів - Знижений протромбіновий час - Знижена кількість альфа-фетопротеїну 5 10 15 P 0,0086 0,0385 0,0579 0,0696 Подальший аналіз пацієнтів з ускладнюючими факторами, пов'язаними з захворюванням, такими як високі вірусні навантаження, цироз, неконтрольований цукровий діабет або сумісна інфекція гепатитом B, показав дуже низькі рівні відповідей у цих підгруп пацієнтів (див. таблицю 9). П'ятнадцять (15) з 16 суб'єктів з невдалим лікуванням алінією® мали високе вірусне навантаження, запущене захворювання печінки, неконтрольований цукровий діабет або сумісну інфекцію вірусом гепатиту B. Суб'єктів з відповіддю, яких лікували алінією®, можна, таким чином, описати як пацієнтів із низькими вірусними навантаженнями (800000 МО/мл), запущене захворювання печінки, неконтрольований цукровий діабет або сумісну інфекцію вірусом гепатиту B. Таблиця 14 Вірусологічна відповідь за групами лікування і центрами дослідження Активне лікування Плацебо Каїр 7/14 (50 %) 0/15 (0 %) Олександрія 0/6 (0 %) 0/6 (0 %) Танта 0/3 (0 %) 0/3 (0 %) Р=0,0453. Критерій Кочрена-Мантеля-Хензеля. Сумарне зведення рівнів відповіді для групи з активним лікуванням за пов'язаним із захворюванням ускладненням і центрами дослідження наведене в таблиці 15. 30 22 UA 100840 C2 Таблиця 15 Рівні відповіді для групи з активним лікуванням за пов'язаними із захворюванням ускладнюючими факторами, і центрами дослідження Ускладнюючі фактори Високе вірусне навантаження Цироз Мостоподібний фіброз Неконтрольований цукровий діабет Сумісна інфекція вірусом гепатиту B Високе вірусне навантаження і цироз Високе вірусне навантаження + мостоподібний фіброз Високе вірусне навантаження, діабет, мостоподібний фіброз Пацієнти без ускладнюючих факторів Усього 5 Каїр 0/1 0/2 3/4 0/1 Центр дослідження Олександрія 0/2 0/2 0/1 0/1 Танта 0/1 0/1 0/1 0/1 4/5 7/14 0/6 0/3 Були відсутні значні розбіжності в протоколі, що могли б підтвердити ефективність аналізу підгруп. Аналіз підгрупи пацієнтів з низькими вірусними навантаженнями і відсутністю цирозу, неконтрольованого діабету або сумісної інфекції вірусом гепатиту B представлений у таблиці 16. Таблиця 16 Вірусологічні відповіді за групами лікування, підгрупами пацієнтів із низькими вірусними навантаженнями і відсутністю цирозу, неконтрольованого діабету або сумісної інфекції гепатитом B Активне лікування 7/10 (70 %) Суб'єкти з відповідями/загальна кількість (%) Плацебо 0/15 (0 %) Р 0,0002 Точний двобічний критерій Фішера. 10 15 20 25 30 Таблетки алінія®, що вводяться по 500 мг два рази на добу з їжею протягом 24 тижнів, викликали вірусологічні відповіді (недетектований рівень РНК HCV у сироватці) у 7 з 23 пацієнтів (30,4 %) у порівнянні з нулем з 25 пацієнтів (0 %) із групи з плацебо (P=0,0039). Вірусологічні відповіді виникали між 4 і 20 тижнями лікування (3 на 4 тиждень, 3 на 8 тиждень, 1 на 20 тиждень) і зберігалися до закінчення лікування за відсутності вірусологічних рецидивів. Вірусологічна відповідь зберігалася в 5 з 23 пацієнтів у групі лікування алінією®, принаймні, 24 тижні після закінчення лікування (P=0,0219). Обидва пацієнти, в яких відбувся рецидив після закінчення відвідування під час лікування, мали запущене захворювання печінки (мостоподібний фіброз). Один пацієнт вибув з дослідження після 8 тижнів лікування, й інший пацієнт повідомляв про окремі випадки некомплаєнтності при проходженні дослідницького лікування. Низьке вірусне навантаження виявилося найбільш значимим незалежним прогностичним параметром вірусологічної відповіді (P=0,0086). Ніхто з пацієнтів з цирозом, неконтрольованим цукровим діабетом або сумісною інфекцією вірусом гепатиту B не давав відповіді на лікування. Якщо пацієнтів з високими вірусними навантаженнями, цирозом, неконтрольованим діабетом або сумісною інфекцією гепатитом B виключити з аналізу ефективності, то рівні вірусологічної відповіді складуть 7/10 (70 %) для групи з активним лікуванням і 0/15 для групи з плацебо (P=0,0002). Двоє з трьох суб'єктів, що не реагували на лікування алінією®, включені в цей аналіз, мали запущене захворювання печінки з мостоподібним фіброзом. Ці результати вказують на те, що 24 тижні монотерапії алінією® ефективні для досягнення стійкої вірусологічної відповіді в пацієнтів із хронічним гепатитом C генотипу 4, якщо пацієнти 23 UA 100840 C2 5 мають низькі вірусні навантаження і не мають інших ускладнюючих факторів, таких як цироз, неконтрольований діабет або сумісна інфекція гепатитом B. У пацієнтів, що приймають алінію, провели виміри безпеки в порівнянні з пацієнтами, що одержують таблетки плацебо. Ступінь впливу підсумований у таблиці 17. Троє пацієнтів (2 рандомізованих у групі лікування алінією, 1 рандомізований у групі з плацебо) вибули з дослідження перед поверненням для будь-яких наступних лікарських спостережень. Ці пацієнти не повідомляли про проведення якого-небудь лікування або спостереження яких-небудь побічних ефектів, і їх виключили з аналізів безпеки. Таблиця 17 Ступінь впливу Лікування/вплив Алінія 500 мг два рази на добу 24 тижні Алінія 500 мг два рази на добу 12 тижнів Плацебо два рази на добу 24 тижні Кількість пацієнтів 22 1 24 10 15 20 Шістнадцять пацієнтів (11 із групи лікування алінією®, 5 із групи з плацебо) повідомляли усього про 33 побічні ефекти. Мало місце два серйозних побічних ефекти. Один пацієнт із групи з плацебо зазнав важкий гематемезис, і пацієнт у групі лікування алінією® зазнав мелену середньої тяжкості. Обидві події вимагали госпіталізації, але вирішилися без переривання лікування. Побічні ефекти, що залишилися, були від легкої до середньої тяжкості і короткочасними за своєю природою, ні для одного з них не потрібні були модифікація або переривання лікування. Побічні ефекти представлені за системами організму, загальноприйнятими термінами, тяжкості та етіології в таблиці 18 для групи з активним лікуванням і в таблиці 19 для групи з лікуванням плацебо. Частки пацієнтів, що повідомляли про кожен із побічних ефектів, порівнювали за групами лікування. Були відсутні значні відмінності за частотою або природою побічних ефектів, повідомлених у двох групах лікування. Таблиця 18 Побічні ефекти: пацієнти, що приймали алінію (N=23) Побічний ефект 1 (порушена система) Жовтяниця (DIG) Анорексія (DIG) Запор (DIG) Діарея (DIG) Здуття кишечнику (DIG) Розлад GI (DIG) Мелена (DIG) Нудота (DIG) Астенія (DIG) Абдомінальний біль (BODY) Розлад сечовипускання (UG) Носова кровотеча (RES) Пацієнти, що повідомляли про Тяжкість і взаємозв'язок із прийомом лікарського засобу² побічні ефекти Середньої Легка Тяжка тяжкості кількість % N U P PR N U P PR N U P PR 2 8,7 2 1 4,3 1 1 4,3 1 1 4,3 1 1 4,3 1 1 1 1 4 4,3 4,3 4,3 17,4 1 4 1 1 1 4,3 1 2 4,3 1 1 1 4,3 1 24 UA 100840 C2 Прискорене серцебиття (CV) Міалгія (MS) Сонливість (NER) Зміна кольору шкіри (SKIN) 1 4,3 1 1 1 4,3 4,3 1 1 1 4,3 1 1 DIG - Травна; BODY – Організм як ціла або неспецифічна система; UG – сечостатева; RES – дихальна; CV – серцево-судинна; MS – кістково-м'язова; NER – нервова; SKIN – шкіра. 2 Зв'язок із застосуванням лікарського засобу: N – не пов'язаний, U – ймовірно не пов'язаний; Р – можливо пов'язаний; PR – ймовірно пов'язаний. Таблиця 19 Побічні ефекти: пацієнти, що приймали плацебо (N=24) Побічний ефект 1 (порушена система) Пацієнти, що повідомляли про побічні ефекти Тяжкість і взаємозв'язок з прийомом лікарського засобу² Легка Середньої тяжкості U P PR кількість Жовтяниця (DIG) гематемезис (DIG) Блювота (DIG) Астенія (BODY) Абдомінальний біль (BODY) Головний біль (BODY) Лихоманка (BODY) Порушення сечовипускання (UG) Кровохаркання (RES) Цукровий діабет (MAN) % 1 1 1 2 4,2 4,2 4,2 8,3 N U 1 1 2 P PR N 2 8,3 2 1 1 4,2 4,2 1 1 1 4,2 1 1 4,2 1 1 4,2 1 Тяжка N 1 U P PR 1 DIG - Травна; BODY – Організм як ціле або неспецифічна система; UG – сечостатева; RES – дихальна; MAN - метаболічна або пов'язана з харчуванням. 2 Зв'язок із застосуванням лікарського засобу: N – не пов'язаний, U – ймовірно не пов'язаний; Р – можливо пов'язаний; PR – ймовірно пов'язаний. 5 10 15 Зміни в лабораторних параметрах безпеки з часом аналізували за групами лікування з використанням повторного аналізу вимірів варіацій для безперервних даних і точних критеріїв Фішера для категорійних даних. Не було виявлено значних змін у лабораторних параметрах безпеки. У ході цього дослідження не було виявлено ніяких проблем безпеки. Таблетки алінії®, що вводяться по 500 мг два рази на добу з їжею пацієнтам із хронічним гепатитом C, виявилися безпечними і такими, що добре переносяться. Побічні ефекти, що повідомлялися пацієнтами, яких лікували таблетками алінії®, виявилися подібними до ефектів, що повідомлялися пацієнтами, яких лікували плацебо. У даному дослідженні таблетки алінії®, що вводяться по 500 мг двічі на добу з їжею протягом 24 тижнів, викликали вірусологічні відповіді (недетектовані рівні РНК HCV у сироватці) у 7 з 23 пацієнтів (30,4 %) у порівнянні з нулем з 25 пацієнтів (0 %) із групи з плацебо (P=0,0039). Вірусологічні відповіді виникали між 4 і 20 тижнями лікування (3 на 4 тиждень, 3 на 8 тиждень, 1 на 20 тиждень) і зберігалися до закінчення лікування без вірусологічних рецидивів. Вірусологічна відповідь зберігалася в 5 пацієнтів, принаймні, 24 тижня після закінчення лікування. 25 UA 100840 C2 5 10 15 20 25 30 35 40 Низьке вірусне навантаження виявилося найбільш значимим незалежним прогностичним параметром вірусологічної відповіді (P=0,0086). Ніхто з пацієнтів із цирозом, неконтрольованим цукровим діабетом або сумісною інфекцією вірусом гепатиту B не реагував на лікування. Якщо виключити пацієнтів з високими вірусними навантаженнями, цирозом, неконтрольованим діабетом або сумісною інфекцією гепатитом B з аналізу ефективності, то рівні вірусологічної відповіді складуть 7/10 (70 %) для групи з активним лікуванням і 0/15 для групи з плацебо (P=0,0002). Два з трьох суб'єктів, що не реагували на лікування алінією®, включені в цей аналіз, мали запущене захворювання печінки з мостоподібним фіброзом. Ці результати вказують на те, що 24 тижні монотерапії алінією® ефективні для досягнення стійкої вірусологічної відповіді в пацієнтів із хронічним гепатитом C генотипу 4, якщо пацієнти мають низькі вірусні навантаження і не мають інші фактори, що ускладнюють, такі як цироз, неконтрольований діабет або сумісна інфекція гепатитом B. У ході цього дослідження не було виявлено ніяких проблем безпеки. Побічні ефекти, про які повідомляли пацієнти в групі лікування алінією, виявилися подібними до ефектів, про які повідомляли пацієнти в групі з плацебо. У ході 24-тижневого курсу лікування в групі лікування алінією у порівнянні з групою з плацебо були відсутні значні зміни в клінічних лабораторних показниках. Приклад 6 Лікування вірусного гепатиту алінією і пегільованим альфа-2В-інтерфероном Тридцять шість (36) пацієнтів зареєстрували для клінічного дослідження для оцінки ефективності і безпеки сумісного лікування алінією® плюс пегільований альфа-2b-інтерферон (-2b-PegIFN) у порівнянні з плацебо плюс -2b-PegIFN при лікуванні хронічного гепатиту C. Пацієнтів підбирали, як описано далі: після закінчення фази 24-тижневого лікування в дослідженні RM01-3027 (див. приклад 4), рандомізованому плацебо-контрольованому дослідженні алінії® подвійним сліпим способом, вісімнадцяти (18) суб'єктам без відповіді запропонували можливість брати участь у цьому клінічному дослідженні. Двоє пацієнтів відхилили реєстрацію внаслідок запущеної стадії захворювання і небажання піддаватися лікуванню пегільованим інтерфероном. Шістнадцять (16) пацієнтів зареєстрували для дослідження. Ці пацієнти продовжували сліпе дослідження перорального лікування поряд з 12 щотижневими ін'єкціями -2b-PegIFN. Двадцять (20) пацієнтів, яких не піддавали лікуванню, у той же самий час вибрали для дослідження для початку сліпого дослідження лікування плюс 2b-PegIFN (перша ін'єкція PegIFN і перша доза сліпого перорального лікування на ту ж саму добу). Див. на фіг. 6 блок-схему проведення досліджень пацієнтів. Один з пацієнтів зареєстрований із генотипом 2 HCV (випадковим чином внесений в активну групу з попереднім лікуванням). Один з пацієнтів вибув з дослідження безпосередньо після одержання першої дози PegIFN і не повертався для якого-небудь лікарського спостереження після лікування. Один з пацієнтів не повернувся для наступного лікарського спостереження після 8 тижня. Усі з тих 34 пацієнтів, що залишилися, закінчили дослідження. Популяцію з призначеним лікуванням (усі пацієнти пройшли рандомізацію) використовували для первинного аналізу ефективності, при цьому суб'єктів, що вибули з дослідження, розглядали як випадки несприятливого результату. Демографічні дані і пов'язані з захворюванням характеристики підсумовані за групами лікування в таблиці 20. 26 UA 100840 C2 Таблиця 20 Демографічні і пов'язані з захворюванням характеристики З попереднім лікуванням Без попереднього лікування Активне 1 Плацебо Р лікування Активне лікування Раса: Європеоїди Стать: Чоловіча/Жіноча Вік (роки): Середнє значення SD Медіана (Діапазон) Вага (кг): Середнє значення SD Медіана (Діапазон) Індекс маси тіла Середнє значення SD Медіана (Діапазон) Вірусне навантаження (log10 МО/мл)² Середнє значення SD Медіана (Діапазон) Вірусне навантаження 800000 МО/мл Підвищення ALT Запущене захворювання печінки Цироз Мостоподібний фіброз Цукровий діабет Плацебо 8 8 10 10 10 8/0 7/1 8/2 10/0 0,20 45,15,5 41,310,1 46,09,1 39,18,9 0,28 46,5(38-52) 42,5 (27-55) 48 (26-56) 40 (21-49) 77,86,6 84,013,0 77,111,8 77,79,7 79,5 (68-86) 86 (67-105) 79,5 (56-100) 26,13,4 0,51 75 (64-94) 26,83,8 0,54 26,02,3 28,34,5 26,3 (21-29) 29,0 (22-36) 5,50,6 5,60,5 5,6 (4,3-6,1) 5,6 (4,9-6,5) 3 (38 %) 2 (25 %) 4 (40 %) 1 (10 %) 0,39 7 (88 %) 7 (88 %) 9 (90 %) 8 (80 %) 0,95 1(13 %) 1(10 %) 0,34 2 (25 %) 3 (38 %) 1 (13 %) 1 (13 %) 1 (10 %) 1 (10 %) 0,42 27,0 (20-31) 25,7 (21-36) 5,90,5 5,60,4 0,34 5,9 (4,9-6,6) 5,7 (4,5-6,1) 1 Критерій хі-квадрат використовували для порівняння відношень, дисперсійний аналіз для середніх значень. 2 Для підданих попередньому лікуванню пацієнтів вірусні навантаження представлені, як їх визначали перед періодом попереднього лікування. 5 10 15 Кожна з щотижневих ін'єкцій пегінтерферону вводилася лікарями. Під час кожного візиту під час дослідження пацієнтів опитували відносно комплаєнтності перорального введення досліджуваного лікарського засобу (алінія або плацебо). За винятком одного пацієнта, що вибув із дослідження протягом першого тижня, й іншого пацієнта, що не повернувся для обстеження на 12 тижні, і його розглядали як суб'єкта без відповіді, усі пацієнти повідомляли, що вони додержували комплаєнтність при прийомі лікарського засобу. Ніхто з пацієнтів не повернув невикористаний лікарський засіб. Вірусологічні відповіді підсумовані за групами лікування в таблиці 21. Рівень відповіді в підданій попередньому лікуванню активній групі (5/8, 63 %) виявився вищим, ніж рівень відповіді в підданій попередньому лікуванню групі з плацебо (P=0,15734), активній групі, що не піддавалася попередньому лікуванню (P=0,08824), групі з плацебо, що не піддавалася попередньому лікуванню (P=0,31859), двох об'єднаних групах із плацебо (P=0,16888) і трьох об'єднаних інших групах (P=0,09102). 27 UA 100840 C2 Таблиця 21 Вірусологічні відповіді за групами лікування З попереднім лікуванням Активне Плацебо лікування Суб'єкти з відповідями/загальна кількість (%) 5/8 (63 %) 2/8 (25 %) Без попереднього лікування Активне Плацебо лікування 2/10 (20 %) 4/10 (40 %) Р=0,26, критерій хі-квадрат. 5 10 15 За допомогою аналізів логістичної регресії виявили, що знижена концентрація глюкози в крові натще є значимим незалежним прогностичним параметром вірусологічної відповіді (P=0,0101) для всієї дослідженої популяції пацієнтів (n=36). Взаємозв'язок між концентрацією глюкози в крові натще і вірусологічною відповіддю виявився найбільш значимим (P=0,0011) у підданої попередньому лікуванню активної групи, у якій знаходилися три пацієнти з неконтрольованим цукровим діабетом. Виходячи з взаємозв'язків, що спостерігаються, між вірусологічною відповіддю і концентрацією глюкози в крові натще, повторювали аналіз ефективності для підгрупи пацієнтів, в яку не ввійшли пацієнти з неконтрольованим цукровим діабетом. Результати цього аналізу представлені в таблиці 5. У цій підгрупі недіабетичних пацієнтів рівень відповіді в підданій попередньому лікуванню активній групі (5/5, 100 %) виявився вищим, ніж рівень відповіді в підданій попередньому лікуванню групі з плацебо (P=0,02652), активній групі, що не піддавалася попередньому лікуванню (P=0,01049), групі з плацебо, що не піддавалася попередньому лікуванню (P=0,06294), двох об'єднаних групах із плацебо (P=0,02270) і трьох об'єднаних інших групах (P=0,00903). Демографічні і пов'язані з захворюванням характеристики підгрупи недіабетичних пацієнтів, проаналізовані в таблиці 22, порівнювали за групами лікування, і значні відмінності між групами були відсутні. 20 Таблиця 22 Вірусологічні відповіді за групами лікування, в які не ввійшли пацієнти з неконтрольованим цукровим діабетом З попереднім лікуванням Активне лікування Суб'єкти з відповідями/загальна кількість (%) Плацебо 5/5 (100 %) 2/7 (29 %) Без попереднього лікування Активне Плацебо лікування 2/9 (22 %) 4/9 (44 %) Р=0,01, критерій хі-квадрат. 25 Кожний із суб'єктів з вірусологічною відповіддю в підданій попередньому лікуванню групі алінія® + pegIFN мав ускладнюючі пов'язані з захворюванням фактори, що, як правило, можуть знижувати імовірність успішного лікування pegIFN-рибавірином. Рівні відповіді для підгруп пацієнтів з високими вірусними навантаженнями, запущеним захворюванням печінки і неконтрольованим діабетом представлені за групами лікування в таблиці 23. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition for the treatment of viral hepatitis
Автори англійськоюRossignol Jean-Francois
Назва патенту російськоюКомпозиция для лечения вирусного гепатита
Автори російськоюРоссинель Жан-Франсуа
МПК / Мітки
МПК: A61P 31/12, A61K 31/16, A61K 31/426, A61K 39/42, A61K 31/166
Мітки: композиція, вірусного, гепатиту, лікування
Код посилання
<a href="https://ua.patents.su/40-100840-kompoziciya-dlya-likuvannya-virusnogo-gepatitu.html" target="_blank" rel="follow" title="База патентів України">Композиція для лікування вірусного гепатиту</a>
Попередній патент: Замок бурової свердловини з інтегрованою мішалкою (варіанти)
Наступний патент: Стійкі композиції вітаміну с
Випадковий патент: Спосіб інтраопераційного кишкового лаважу та пристрій для його здійснення