Антитіла проти рецептора ii типу трансформуючого фактора росту бета (tgfbrii)
Формула / Реферат
1. Антитіло або його фрагмент, що зв'язує людський TGFβRII, що специфічно зв'язується з позаклітинним доменом людського рецептора II типу TGFβ (TGFβRII) і містить:
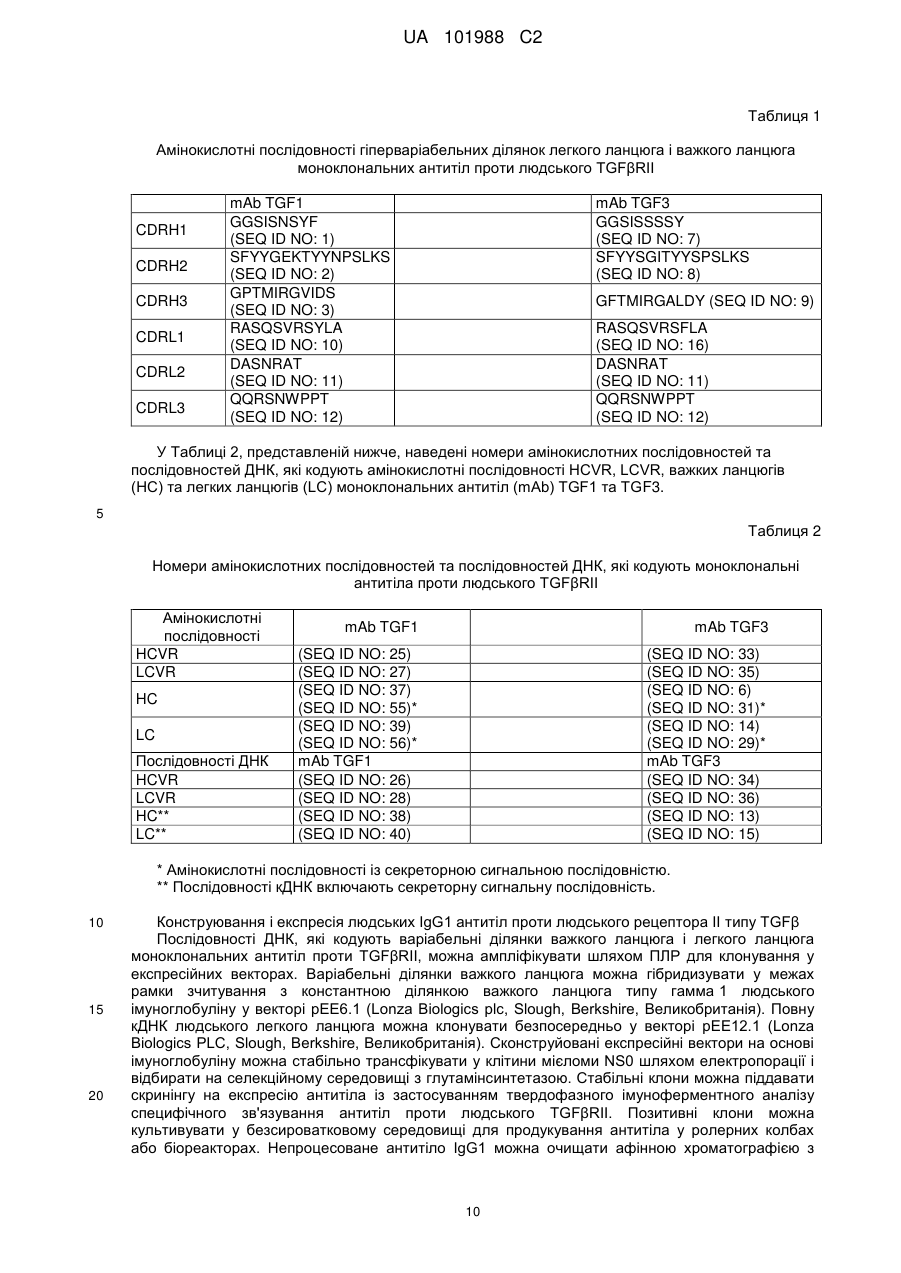
CDRH1, яка має послідовність GGSISNSYF (SEQ ID NO: 1);
CDRH2, яка має послідовність SFYYGEKTYYNPSLKS (SEQ ID NO: 2);
CDRH3, яка має послідовність GPTMIRGVIDS (SEQ ID NO: 3);
CDRL1, яка має послідовність RASQSVRSYLA (SEQ ID NO: 10);
CDRL2, яка має послідовність DASNRAT (SEQ ID NO: 11); та
CDRL3, яка має послідовність QQRSNWPPT (SEQ ID NO: 12).
2. Антитіло за п. 1, яке містить:
амінокислотну послідовність HCVR:
QLQVQESGPGLVKPSETLSLTCTVSGGSISNSYFSWGWIRQPPGKGLEWIGSFYYGEKTYYNPSLKSRATISIDTSKSQFSLKLSSVTAADTAVYYCPRGPTMIRGVIDSWGQGTLVTVSS (SEQ ID NO: 25); та
амінокислотну послідовність LCVR:
EIVLTQSPATLSLSPGERATLSCRASQSVRSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPTFGQGTKVEIK (SEQ ID NO: 27).
3. Антитіло за п. 1 або п. 2, яке містить важкий ланцюг (SEQ ID NO: 37) та легкий ланцюг (SEQ ID NO: 4).
4. Антитіло за п. 1 або п. 2, яке містить два важкі ланцюги (SEQ ID NO: 37) і два легкі ланцюги (SEQ ID NO: 4).
5. Антитіло за п. 1-4, яке блокує зв'язування людського TGFβ1, TGFβ2 або TGFβ3 з людським TGFβRII зі значенням ІС50, меншим ніж 1,0 нМ при визначенні за допомогою ELISA.
6. Антитіло за п. 1-4, причому значення KD менше ніж 100 пМ при кімнатній температурі (20-25 °С).
7. Антитіло за п. 1-4, яке пригнічує TGFβ-індуковане фосфорилування Smad2 зі значенням ІС50, меншим ніж 30 нМ.
8. Фармацевтична композиція, яка містить антитіло або фрагмент за будь-яким із пп. 1-7 і фармацевтично прийнятні носій, розріджувач або наповнювач.
9. Продукт, який містить антитіло або фрагмент за будь-яким із пп. 1-7 та додатковий протираковий агент для комбінованого лікування у комбінації для одночасного, роздільного або послідовного застосування у терапії.
Текст
Реферат: Винахід стосується антитіла або його фрагмента, що зв'язує людський TGFβRII, що специфічно зв'язується з позаклітинним доменом людського рецептора II типу TGFβ (TGFβRII) і містить: CDRH1, яка має послідовність GGSISNSYF (SEQ ID NO: 1); CDRH2, яка має послідовність SFYYGEKTYYNPSLKS (SEQ ID NO: 2); CDRH3, яка має послідовність GPTMIRGVIDS (SEQ ID NO: 3); CDRL1, яка має послідовність RASQSVRSYLA (SEQ ID NO: 10); CDRL2, яка має послідовність DASNRAT (SEQ ID NO: 11); та CDRL3, яка має послідовність QQRSNWPPT (SEQ ID NO: 12). UA 101988 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ця заявка претендує на пріоритет за заявками на патент США № 61/198,697, поданою 7 листопада 2008 р. та № 61/170,369, поданою 17 квітня 2009 р. Цей винахід належить до галузі медицини, зокрема, до антитіл, які зв'язують людський рецептор II типу трансформуючого фактора росту бета (TGFβRII), фармацевтичних композицій, які містять антитіла, та способів застосування згаданих антитіл, наприклад, для лікування раку, фіброзу та фіброзних захворювань. TGFβ являють собою плейотропні цитокіни, які регулюють ріст та диференціацію клітин, рухливість, продукування позаклітинного матриксу та імунні функції. TGFβ у ссавців мають три ізоформи, TGFβ-1, TGFβ-2 та TGFβ-3, кожна з яких має чітко визначені функції in vivo. Усі три ізоформи TGFβ використовують одну й ту саму рецепторну систему передавання сигналів. Зв'язування TGFβ з TGFβRII являє собою вирішальний крок у ініціюванні активації шляху передавання сигналів TGFβ, який призводить до фосфорилування Smad2 та транслокації активованого комплексу Smad2/Smad4 до ядра для модулювання експресії генів. Людські моноклональні антитіла (mAbs), які зв'язують людський TGFβRII з високою 10 9 спорідненістю (KD 8,0610- M та 1,9110- M), для лікування хвороби нирок та тканинного фіброзу описані у JP 2004/121001A. Ця заявка також розкриває, що mAbs супресують TGFβіндукований ріст кератиноцитів (середнє значення IC50 становить 2,17-3,89 мкг/мл, 3,174,95 мкг/мл та 3,21-5,07 мкг/мл). Повідомлялося про ефективне застосування повністю людського моноклонального антитіла проти TGFβRII для зниження відкладення позаклітинного матриксу у разі анти-Thy-1 нефриту у пацюків. (Kasuga H., et al., Kidney Int'l, Vol. 60 (2001) 17451755). До цього часу не описані високоспецифічні високоафінні антитіла проти TGFβRII, які б специфічно зв'язували позаклітинний домен людського TGFβRII з дуже високою спорідненістю, блокували зв'язування людського TGFβ1, TGFβ2 та TGFβ3 з людським TGFβRII, інгібували ангіогенез, пригнічували ріст пухлинних клітин, інгібували міграцію та інвазію ракових клітин, зменшували відкладення колагену та пригнічували функцію печінки, пригнічували індуковану лігандами регуляцію Т-клітин або пригнічували ріст пухлин у комбінації із цитотоксичними агентами, у яких, унаслідок цього, є потреба. Цей винахід пропонує нові ізольовані моноклональні антитіла проти TGFβRII, які задовольняють цим потребам. Рецептор II типу TGF-бета є ссавцевим, за варіантом, якому віддається перевага, – людським. Антитіла за цим винаходом є здатними до однієї або декількох таких активностей: 1) демонстрування високоафінного зв'язування з позаклітинним доменом людського TGFβRII; 2) блокування зв'язування лігандів TGFβRII (TGFβ1, TGFβ2 та TGFβ3) з TGFβRII, із пригніченням, в результаті цього, TGFβ-індукованого фосфорилування Smad2; 3) інтерналізації TGFβRII, яка може діяти як механізм негативної модуляції передавання сигналів незалежно від взаємодії ліганду та рецептора; 4) пригнічення ліганд-індукованих шляхів передавання сигналу TGFβRII; 5) пригнічення TGFβRII-опосередкованих клітинних активностей; 6) пригнічення росту пухлин in vitro та in vivo; а крім того, за варіантом, якому віддається більша перевага, є також здатними до однієї або декількох з таких активностей: 7) пригнічення ангіогенезу шляхом зниження TGFβ-індукованої секреції фактора росту ендотелію судин A (VEGF-A); 8) пригнічення міграції та інвазії ракових клітин, 9) зменшення відкладення колагену та пригнічення функції печінки; 10) пригнічення індукованої лігандами регуляції Т-клітин з одержанням Treg-клітин, які мають імуносупресорну активність; або 11) пригнічення росту пухлин у комбінації з цитотоксичними агентами. Високоафінне моноклональне антитіло, яке специфічно зв'язується з TGFβRII і нейтралізує TGFβRII-опосередковану активність, було б особливо прийнятним як терапевтичний біологічний агент для лікування захворювань, які опосередковуються передаванням сигналу TGFβ. За першим аспектом цього винаходу запропоновані ізольовані антитіла, які специфічно зв'язують позаклітинний домен людського TGFβRII із значенням K D, меншим за 100 пМ при кімнатній температурі (20-25C). За одним з аспектів антитіла за цим винаходом блокують зв'язування людського TGFβ1, TGFβ2 або TGFβ3 з людським TGFβRII зі значенням IC 50, меншим ніж 1,0 нМ, при визначенні за допомогою ELISA (твердофазний імуноферментний аналіз). За іншим аспектом антитіла за цим винаходом пригнічують TGFβ-індуковане фосфорилування Smad2 зі значенням IC50, меншим ніж 30 нМ. За ще одним аспектом антитіла за цим винаходом являють собою антитіло, яке специфічно зв'язується з TGFβRII і містить: і) CDRH1, яка має послідовність GGSISNSYF (SEQ ID NO: 1), CDRH2, яка має послідовність SFYYGEKTYYNPSLKS (SEQ ID NO: 2), CDRH3, яка має послідовність GPTMIRGVIDS (SEQ ID NO: 3), CDRL1, яка має послідовність RASQSVRSYLA (SEQ ID NO: 10), CDRL2, яка має 1 UA 101988 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовність DASNRAT (SEQ ID NO: 11), та CDRL3, яка має послідовність QQRSNWPPT (SEQ ID NO: 12); або іі) CDRH1, яка має послідовність GGSISSSSY (SEQ ID NO: 7), CDRH2, яка має послідовність SFYYSGITYYSPSLKS (SEQ ID NO: 8), CDRH3, яка має послідовність GFTMIRGALDY (SEQ ID NO: 9), CDRL1, яка має послідовність RASQSVRSFLA (SEQ ID NO: 16), CDRL2, яка має послідовність DASNRAT (SEQ ID NO: 11), та CDRL3, яка має послідовність QQRSNWPPT (SEQ ID NO: 12). За іншим аспектом антитіла за цим винаходом містять: i) амінокислотну послідовність HCVR: QLQVQESGPGLVKPSETLSLTCTVSGGSISNSYFSWGWIRQPPGKGLEWIGSFYYGEKTYYNPS LKSRATISIDTSKSQFSLKLSSVTAADTAVYYCPRGPTMIRGVIDSWGQGTLVTVSS (SEQ ID NO: 25) та амінокислотну послідовність LCVR: EIVLTQSPATLSLSPGERATLSCRASQSVRSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGS GSGTDFTLTISSLEPEDFAVYYCQQRSNWPPTFGQGTKVEIK (SEQ ID NO: 27); або ii) амінокислотну послідовність HCVR: QLQLQESGPGLVKPSETLSLTCTVSGGSISSSSYSWGWIRQPPGKGLEWIGSFYYSGITYYSPSL KSRIIISEDTSKNQFSLKLSSVTAADTAVYYCASGFTMIRGALDYWGQGTLVTVSS (SEQ ID NO: 33), та амінокислотну послідовність LCVR: EIVLTQSPATLSLSPGERATLSCRASQSVRSFLAWYQQKPGQAPRLLIYDASNRATGIPARFSGS GSGTDFTLTISSLEPEDFAVYYCQQRSNWPPTFGQGTKVEIK (SEQ ID NO: 35). За іншим аспектом антитіла за цим винаходом містять амінокислотну послідовність HCVR: QLQVQESGPGLVKPSETLSLTCTVSGGSISNSYFSWGWIRQPPGKGLEWIGSFYYGEKTYYNPS LKSRATISIDTSKSQFSLKLSSVTAADTAVYYCPRGPTMIRGVIDSWGQGTLVTVSS (SEQ ID NO: 25) та амінокислотну послідовність LCVR: EIVLTQSPATLSLSPGERATLSCRASQSVRSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGS GSGTDFTLTISSLEPEDFAVYYCQQRSNWPPTFGQGTKVEIK (SEQ ID NO: 27). За іншим аспектом антитіла за цим винаходом містять: i) важкий ланцюг SEQ ID NO: 37 та легкий ланцюг SEQ ID NO: 4; або ii) важкий ланцюг SEQ ID NO: 6 та легкий ланцюг SEQ ID NO: 14. За іншим аспектом антитіла за цим винаходом містять два важкі ланцюги SEQ ID NO: 37 та два легкі ланцюги SEQ ID NO: 4. За іншим аспектом цей винахід охоплює людський TGFβRII-зв'язувальний фрагмент. Передбачається, що будь-яке з антитіл за цим винаходом можна вводити в організм суб'єкта, який цього потребує. Відповідно, за одним з аспектів цей винахід пропонує фармацевтичну композицію, яка містить антитіло або фрагмент за цим винаходом і фармацевтично прийнятні носій, розріджувач або наповнювач. За аспектом цього винаходу, якому віддається перевага, антитіло або його функціональний фрагмент конкурує за зв'язування з позаклітинним доменом TGFβRII у конкурентному ELISA з конкурентним антитілом, причому згадане конкурентне антитіло зв'язує TGFβRII зі значенням KD, меншим ніж 100 пМ, при кімнатній температурі (20-25C). За іншим аспектом цього винаходу, якому віддається перевага, антитіло за цим винаходом блокує зв'язування людського TGFβ1, TGFβ2 або TGFβ3 з людським TGFβRII зі значенням IC 50, меншим ніж 1,0 нМ, при визначенні за допомогою ELISA. Передбачається також, що моноклональні антитіла за цим винаходом можна застосовувати для лікування фіброзу або фіброзних захворювань легень, печінки та нирок. За одним з аспектів запропонований спосіб лікування фіброзу або фіброзних захворювань легень, печінки та нирок, який включає введення в організм суб'єкта, який потребує такого лікування, ефективної кількості моноклонального антитіла за цим винаходом. За одним з аспектів цей винахід пропонує антитіла за цим винаходом для застосування як лікарський засіб. За одним з аспектів цей винахід пропонує антитіла за цим винаходом для застосування при лікуванні раку. За іншим аспектом цей винахід пропонує антитіла для застосування при лікуванні раку молочної залози, раку легень або раку підшлункової залози. Антитіла за цим винаходом можна застосовувати при лікування раку разом із протираковим агентом. За іншим аспектом цей винахід пропонує продукт, який містить антитіло або фрагмент, та додатковий протираковий агент для лікування у комбінації для одночасного, роздільного або послідовного застосування у терапії. За аспектом, якому віддається перевага, цей винахід пропонує ізольоване антитіло, яке 2 UA 101988 C2 5 10 15 20 25 30 35 40 45 50 55 60 специфічно зв'язує позаклітинний домен hTGFβRII та яке містить CDRH1, яка має послідовність GGSISX1SX2 × 3 (SEQ ID NO: 17), де X1 – N або S, X2 – Y або S, та X3 – F або Y; CDRH2, яка має послідовність SFYYX1 × 2 × 3TYYX4PSLKS (SEQ ID NO: 18), де X1 – G або S, X2 – E або G, X3 – K або I, X4 – N або S; CDRH3, яка має послідовність GX 1TMIRGX2 × 3DX4 (SEQ ID NO: 42), де X1 – P або F, X2 – V або A, X3 – I або L, X4 – S або Y; CDRL1, яка має послідовність RASQSVRSX 1LA (SEQ ID NO: 20), де X1 – Y або F; CDRL2, яка має послідовність DASNRAT (SEQ ID NO: 11); та CDRL3, яка має послідовність QQRSNWPPT (SEQ ID NO:12). За іншим аспектом цей винахід пропонує спосіб лікування раку у пацієнта, який включає введення в організм згаданого пацієнта ефективної кількості антитіл за цим винаходом. Таким раком може бути рак молочної залози, рак легень або рак підшлункової залози. Згадані антитіла можна вводити в організм пацієнта з ефективною кількістю іншого протиракового агента, одночасно, роздільно або послідовно. Таким протираковим агентом може бути циклофосфамід. За іншим аспектом цей винахід пропонує ізольоване антитіло, яке специфічно зв'язується з позаклітинним доменом людського рецептора II типу TGFβ (TGFβRII) і містить: CDRH1, яка має послідовність GGSISNSYF (SEQ ID NO: 1), CDRH2, яка має послідовність SFYYGEKTYYNPSLKS (SEQ ID NO: 2), CDRH3, яка має послідовність GPTMIRGVIDS (SEQ ID NO: 3), CDRL1, яка має послідовність RASQSVRSYLA (SEQ ID NO: 10), CDRL2, яка має послідовність DASNRAT (SEQ ID NO: 11), та CDRL3, яка має послідовність QQRSNWPPT (SEQ ID NO: 12); або CDRH1, яка має послідовність GGSISSSSY (SEQ ID NO: 7), CDRH2, яка має послідовність SFYYSGITYYSPSLKS (SEQ ID NO: 8), CDRH3, яка має послідовність GFTMIRGALDY (SEQ ID NO: 9), CDRL1, яка має послідовність RASQSVRSFLA (SEQ ID NO: 16), CDRL2, яка має послідовність DASNRAT (SEQ ID NO: 11), та CDRL3, яка має послідовність QQRSNWPPT (SEQ ID NO: 12), або TGFβRII-зв'язувальний фрагмент згаданого антитіла. За іншим аспектом цей винахід охоплює антитіло за цим винаходом, яке містить амінокислотну послідовність HCVR: QLQVQESGPGLVKPSETLSLTCTVSGGSISNSYFSWGWIRQPPGKGLEWIGSFYYGEKTYYNPS LKSRATISIDTSKSQFSLKLSSVTAADTAVYYCPRGPTMIRGVIDSWGQGTLVTVSS (SEQ ID NO: 25) та амінокислотну послідовність LCVR: EIVLTQSPATLSLSPGERATLSCRASQSVRSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGS GSGTDFTLTISSLEPEDFAVYYCQQRSNWPPTFGQGTKVEIK (SEQ ID NO: 27); або амінокислотну послідовність HCVR: QLQLQESGPGLVKPSETLSLTCTVSGGSISSSSYSWGWIRQPPGKGLEWIGSFYYSGITYYSPSL KSRIIISEDTSKNQFSLKLSSVTAADTAVYYCASGFTMIRGALDYWGQGTLVTVSS (SEQ ID NO: 33), та амінокислотну послідовність LCVR: EIVLTQSPATLSLSPGERATLSCRASQSVRSFLAWYQQKPGQAPRLLIYDASNRATGIPARFSGS GSGTDFTLTISSLEPEDFAVYYCQQRSNWPPTFGQGTKVEIK (SEQ ID NO: 35), або TGFβRIIзв'язувальний фрагмент згаданого антитіла. За іншим аспектом цей винахід охоплює антитіло за цим винаходом, яке містить важкий ланцюг (SEQ ID NO: 37) та легкий ланцюг (SEQ ID NO: 39); або важний ланцюг (SEQ ID NO: 6) та легкий ланцюг (SEQ ID NO: 14). "Ізольованим антитілом" є антитіло, яке (1) було частково, значною мірою або повністю очищене від суміші компонентів; (2) було ідентифіковане та відокремлене та/або виділене з компонента його природного середовища; (3) є моноклональним; (4) є вільним від інших білків від того самого виду; (5) експресується клітиною від іншого виду; або (6) не зустрічається у природі. Забруднювальними компонентами його природного середовища є матеріали, які можуть перешкоджати діагностичному або терапевтичному застосуванню згаданого антитіла, і до них можуть належати ферменти, гормони та інші білкові або небілкові розчинені речовини. Прикладами ізольованих антитіл є антитіло, очищене афінним шляхом, антитіло, продуковане гібридомою або іншою лінією клітин in vitro та людське антитіло від трансгенної миші. Термін "антитіло", який вживають у цьому описі, означає імуноглобулінові молекули, які складаються з 4 поліпептидних ланцюгів, двох важких (H) ланцюгів і двох легких (L) ланцюгів, з'єднаних між собою дисульфідними зв'язками. Кожен важкий ланцюг складається з варіабельної ділянки важкого ланцюга (яка у цьому описі скорочено позначається як HCVR або VH) і константної ділянки важкого ланцюга. Константна ділянка важкого ланцюга містить три домени, CH1, CH2 та CH3. Кожен легкий ланцюг складається з варіабельної ділянки легкого ланцюга (яка у цьому описі скорочено позначається як LCVR або VL) і константної ділянки легкого ланцюга. Легкі ланцюги антитіл (імуноглобулінів) будь-якого виду хребетних можуть бути віднесені до одного з двох типів, які чітко різняться між собою, а саме каппа (K) і лямбда (λ), на основі амінокислотних послідовностей цих константних доменів. Варіабельні ділянки легких ланцюгів типу каппа позначають у цьому описі як VK. Позначення VL, яке вживають у 3 UA 101988 C2 5 10 15 20 25 30 35 40 45 50 55 60 цьому описі, охоплює як варіабельні ділянки легких ланцюгів типу каппа (VK), так і легких ланцюгів типу лямбда. Константна ділянка легкого ланцюга містить один домен CL. Ділянки VH і VL включають в себе гіперваріабельні ділянки, які називають ділянками, що обумовлюють комплементарність (CDR), між якими розташовані більш консервативні ділянки, які називають каркасними ділянками (FR). Кожна VH та VL складається з трьох CDR та чотирьох FR, розміщених від амінокінця до карбоксильного кінця у такому порядку: FR1-CDR1-FR2-CDR2FR3-CDR3-FR4. "CDRH1" означає першу CDR ділянку важкого ланцюга антитіла, "CDRH2" означає другу CDR ділянку важкого ланцюга антитіла і "CDRH3" означає третю CDR ділянку важкого ланцюга антитіла. "CDRL1" означає першу CDR ділянку легкого ланцюга антитіла, "CDRL2" означає другу CDR ділянку легкого ланцюга антитіла, і "CDRL3" означає третю CDR ділянку легкого ланцюга антитіла. Словосполучення "антигензв'язувальний фрагмент" означає частину або фрагмент інтактного антитіла, що містить його антигензв'язувальну або варіабельну ділянку. Прикладами фрагментів антитіла є частини антитіла, менші за непроцесоване антитіло, наприклад, Fabфрагмент, F(ab")2 або одноланцюговий варіабельний фрагмент (scFv). Аналогічно, цей винахід охоплює діатіла, лінійні антитіла, одноланцюгові антитіла, гібридні білки, рекомбінантні білки та мультивалентні або мультиспецифічні антитіла, одержані або частково одержані з антигензв'язувального фрагмента за цим винаходом. Термін "рецептор II типу трансформуючого фактора росту бета" або "TGFβRII", який вживають у цьому описі, означає поверхневоклітинний рецептор, який зв'язує ліганд, у тому числі, але без обмеження, TGFβ1, TGFβ2 та TGFβ3, і, як результат, ініціює шлях трансдукції сигналу у клітині. Людський TGFβRII являє собою трансмембранний білок, який кодується послідовністю ДНК послідовності SEQ ID NO: 40. Антитіла за цим винаходом зв'язують людський TGFβRII, конкретніше, позаклітинний домен людського TGFβRII, і блокують зв'язування людського TGFβ1, TGFβ2 та TGFβ3 з людським TGFβRII. До антитіл за цим винаходом також належать антитіла, зв'язувальні характеристики яких були поліпшені шляхом прямого мутування, методами "визрівання афінності", засобами фагового дисплею або переставлянням ланцюгів методами, відомими у цій галузі. Антитіла за цим винаходом містять будь-яку комбінацію важких і легких ланцюгів (які мають повну довжину або їх частину) антитіл за цим винаходом, які позначають як TGF1 та TGF3. Антитіла за цим винаходом можна застосовувати як матрицю або вихідне антитіло для одержання додаткових антитіл за цим винаходом із застосуванням різноманітних методів, у тому числі, пересадження CDR, гуманізації шляхом "маскування" антигенних детермінант (veneering), зміни поверхневої локалізації і кількості антигенних детермінант (resurfacing) та переставляння ланцюгів (наприклад, як описано у патенті США № 5,565,332). Людські антитіла за цим винаходом можуть містити амінокислотні залишки, які не кодуються послідовністю людських імуноглобулінових генів у зародковій лінії (наприклад, мутації, введені шляхом неспецифічного або сайтспецифічного мутагенезу in vitro або соматичною мутацією in vivo), наприклад, у CDR. Людське антитіло може мати щонайменше одне положення із заміною на амінокислотний залишок, наприклад, амінокислотний залишок, який посилює активність, яка не кодується послідовністю людських імуноглобулінових генів у зародковій лінії, з одержанням, таким чином, інших амінокислотних послідовностей варіабельної ділянки, одержаних з послідовностей, які пропонуються у цьому описі. За одним із варіантів підходу, CDR вихідного антитіла пересаджують на людський каркас, який має високу ідентичність послідовності з каркасом вихідного антитіла. Ідентичність послідовності нового каркасу буде, загалом, становити щонайменше 80 %, щонайменше 85 % або щонайменше 90 % з відповідним каркасом вихідного антитіла. Результатом цього пересадження може бути зниження зв'язувальної спорідненості у порівнянні з вихідним антитілом. У такому разі, каркас можна піддати зворотній мутації до вихідного каркасу у певних положеннях, виходячи зі специфічних критеріїв, опублікованих Queen (Queen, et al., Proc. Natl. Acad. Sci. USA 88, 2869 (1991)). До інших методів, які можуть застосовуватись, належать, наприклад, Jones et al., Nature, 321:522 (1986); Riechmann et al., Nature, 332:323-327 (1988); та Verhoeyen et al., Science, 239:1534 (1988). До 20 альтернативних природних амінокислот можуть бути введені до конкретного сайту, який замінюється. In vitro селекційний процес, який визначається у цьому описі, можна у подальшому відповідним чином застосовувати для скринінгу цих додаткових амінокислотних послідовностей варіабельної ділянки на Fab-фрагменти, які мають заявлену перехресну реактивність in vitro. Подібним чином ідентифікують інші Fab-фрагменти, прийнятні для 4 UA 101988 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержання гуманізованого антитіла за цим винаходом. За варіантом, якому віддається перевага, амінокислотна заміна у межах каркасів обмежується одним, двома або трьома положеннями у межах однієї або кожної з каркасних послідовностей, розкритих у цьому описі. За варіантом, якому віддається перевага, амінокислотна заміна у межах CDR обмежується одним-трьома положеннями у межах однієї або кожної з CDR; за варіантом, якому віддається більша перевага, заміну здійснюють у одному або двох амінокислотних положеннях у межах однієї або кожної CDR. За іншим варіантом здійснення цього винаходу, якому віддається перевага, амінокислотну заміну здійснюють у одному або двох амінокислотних положеннях CDR варіабельної ділянки важкого ланцюга. Прийнятна методика комбінування замін у CDR і каркасі для одержання альтернативних антитіл за цим винаходом із застосуванням антитіла, опис якого наведений у цій заявці, як вихідного антитіла, наведена у Wu et al., J. Mol. Biol., 294:151-162. Термін "KD" означає константу дисоціації конкретної взаємодії антитіло-антиген. Її обчислюють за формулою: k off/kon=KD. Термін "kon" означає константу асоціації або константу -1 -1 швидкості прямої або комплексотвірної реакції, яка вимірюється у одиницях: M с . Термін "koff" означає константу дисоціації або константу швидкості реакції дисоціації антитіла з комплексу антитіло/антиген, яка вимірюється у одиницях: 1/с. Зв'язувальна спорідненість антитіла за цим винаходом часто більше корелює з меншим значенням k off, аніж із більшим значенням k on, однак, не зв'язуючи себе теорією, включають варіанти здійснення як з поліпшеним значенням koff, так і з поліпшеним значенням k on. За аспектом, якому віддається більша перевага, антитіла за цим винаходом є високоефективними антитілами або їх фрагментами, які, як правило, демонструють низькі значення k off. За певними аспектами антитіла за цим винаходом мають значення K D у межах від приблизно 1 пМ до приблизно 200 пМ, від приблизно 5 пМ до приблизно 100 пМ або від приблизно 10 пМ до приблизно 80 пМ. Терміни "блокує зв'язування" та "пригнічує зв'язування", які вживають у цьому описі взаємозамінно, означають блокування/пригнічення зв'язування цитокіну з його рецептором, результатом чого є повне або часткове пригнічення біологічної функції шляху передавання сигналу цитокін/рецептор. Блокування/пригнічення зв'язування TGFβ з TGFβRII оцінюється шляхом визначення повного або часткового пригнічення одного або декількох in vitro або in vivo індикаторів активності TGFβ, наприклад, зв'язування рецептора, пригнічувальної дії на ріст клітин, хемотаксису, апоптозу, фосфорилування внутрішньоклітинного білка або трансдукції сигналів. Здатність блокування зв'язування TGFβ з TGFβRII можна визначати за допомогою ELISA, як описано у цій заявці. Здатність пригнічення активності TGFβ можна оцінювати шляхом визначення пригнічення фосфорилування Smad2 у клітині, наприклад, у людських клітинах лінії MDA-MB-231, як описано у цій заявці. Антитіла за цим винаходом блокують зв'язування людського TGFβ1, TGFβ2 або TGFβ3 з людським TGFβRII з IC50, що становить від приблизно 0,05 нМ до приблизно 1,0 нМ, від приблизно 0,08 нМ до приблизно 0,75 нМ або від приблизно 0,10 нМ до приблизно 0,60 нМ. Антитіла за цим винаходом пригнічують TGFβ-індуковане фосфорилування Smad2 із значенням IC50, яке є меншим або дорівнює значенню, яке становить від приблизно 2,0 нМ до приблизно 30 нМ, від приблизно 3,0 нМ до приблизно 15,0 нМ або від приблизно 4,0 нМ до приблизно 7,5 нМ у in vitro аналізі блокування, наприклад, у in vitro аналізі блокування клітин лінії MDA-MB-231, як описано у цій заявці. Антитіла можуть мати характер глікозилування, який відрізняється або є зміненим порівняно з тим, що спостерігається у нативних видів. Як відомо у цій галузі, характер глікозилування може залежати від послідовності антитіла (наприклад, присутності або відсутності конкретних амінокислотних залишків глікозилування) або клітини-хазяїна чи мікроорганізму, у якому продукується білок. Передбачається, що антитіла за цим винаходом охоплюють антитіла, розкриті у цьому описі, а також їх глікозиловані варіанти. Цей винахід також охоплює експресійні вектори, які містять будь-який з полінуклеотидів, опис якого наведений у цій заявці. До прикладів векторів належать плазміди, фагеміди, косміди, віруси та фагові нуклеїнові кислоти або інші нуклеїновокислотні молекули, які є здатними до реплікації у прокаріотному або еукаріотному хазяїні, такому як клітина, наприклад, клітина ссавця. Згаданий вектор може бути експресійним вектором, де полінуклеотид, який кодує антитіло, є функціонально зв'язаним із контрольними елементами експресії. Типові експресійні вектори містять термінатори транскрипції і трансляції, ініціювальні послідовності та промотори, прийнятні для регулювання експресії нуклеїновокислотних молекул за цим винаходом. Ці вектори можуть також містити полігенні експресійні кластери, які містять незалежну термінаторну послідовність, послідовності, які надають можливість реплікації згаданого вектора як у еукаріотах, так і у прокаріотах, тобто "човникові" вектори та селекційні маркери як для 5 UA 101988 C2 5 10 15 20 25 30 35 40 45 50 55 60 прокаріотних, так і для еукаріотних систем. Такі вектори, як правило, містять маркер для забезпечення фенотипової ознаки для селекції трансформованих хазяїв, таких як надання стійкості до антибіотиків, таких як ампіцилін або неоміцин. До прийнятних промоторів належать конститутивні промотори та індуцибельні промотори. До репрезентативних промоторів належать промотори, які були одержані з людського цитомегаловірусу, промотор металотіонеїну, ранній промотор SV-40, пізній промотор SV-40, промотор вірусу раку молочних залоз мишей, промотор вірусу саркоми Рауса та промотор поліедрину. Цей винахід також охоплює рекомбінантні клітини, які містять нуклеїновокислотну молекулу або експресійний вектор за цим винаходом. "Рекомбінантна клітина" означає нелюдський багатоклітинний організм або "клітину-хазяїна", що означає клітини або популяцію клітин, до яких вводять нуклеїновокислотну молекулу або вектор за цим винаходом. Клітиною-хазяїном за цим винаходом може бути еукаріотна клітина або лінія клітин, наприклад, клітина або лінія клітин рослини, тварини, хребетного, ссавця, гризуна, миші, примату або людини. За одним з аспектів хазяїн за цим винаходом може бути прокаріотним або еукаріотним. До прийнятних прокаріотних хазяїв належать, наприклад, Escherichia coli, такі як E. coli SG-936, E. coli HB 101, E. coli W3110, E. coli X1776, E. coli X2282, E. coli DHI та E. coli MRC1, Pseudomonas, Bacillus, такі як Bacillus subtilis, та Streptomyces. До прийнятних еукаріотних клітин належать клітини дріжджів та інших грибів, клітини комах, клітини рослин, клітини людей та клітини тварин, у тому числі клітини ссавців, такі як лінії гібридом, клітини COS, клітини NS0 та клітини CHO. Цей винахід охоплює способи продукування антитіла шляхом культивування рекомбінантної клітини, яка експресує одну або декілька нуклеїновокислотних послідовностей, які кодують антитіло за цим винаходом, і виділення згаданого антитіла з культурального середовища. Експресоване таким чином антитіло, як правило, очищають або ізолюють після експресії. Антитіла можна ізолювати або очищати різними способами, відомими фахівцям у цій галузі. Стандартними методами очищення є хроматографічні методи, електрофоретичні, імунологічні методи, осадження, діаліз, фільтрація, концентрація та хроматофокусування. Як добре відомо у цій галузі, різноманітні природні білки зв'язують антитіла, наприклад, бактеріальні білки A, G та L, і ці білки можуть знайти застосування за цим винаходом для очищення. Очищення часто можна здійснити за допомогою конкретного гібридизаційного партнера. Наприклад, білки можна очищати із застосуванням глутатіонової смоли, якщо застосовується гібридизація з білком GST, +2 Ni афінної хроматографії, якщо застосовується мітка His-Tag або іммобілізованого анти-Flag антитіла, якщо застосовується мітка His-Tag. Згадане антитіло може бути очищене шляхом його відділення від культурального середовища. Антитіла, які містять більше одного ланцюга, можна одержати шляхом експресії кожного ланцюга разом у одному хазяїні; або шляхом експресії окремих ланцюгів, які складають перед або після виділення з культурального середовища. Антитіла можна піддавати скринінгу із застосуванням різних методів, у тому числі, але без обмеження, in vitro аналізів, in vitro клітинних аналізів, in vivo аналізів та селекційних технологій. Властивості антитіл, які можна піддавати скринінгу, охоплюють, але без обмеження ними, біологічну активність, стабільність, розчинність та зв'язувальну спорідненість з мішенню. Численні властивості можна відбирати одночасно або індивідуально. Білки можуть бути очищеними або неочищеними, у залежності від вимог аналізу. За одним з aспектів скринінг являє собою якісний або кількісний аналіз зв'язування антитіл із білком або небілковою молекулою, про яку відомо або яку вважають такою, яка зв'язує антитіло. У процедурах скринінгу можна застосовувати автоматизовані або високопродуктивні технології скринінгу. У процесі скринінгу можна застосовувати гібридний білок або мічений білок. Аналізи зв'язування можна здійснювати із застосуванням різних методів, відомих у цій галузі, у тому числі, але без обмеження, ELISA. Вислів "конкурує за зв'язування", який вживають у цьому описі, означає ситуацію, при якій антитіло зменшує зв'язування або передавання сигналу на щонайменше приблизно 20 %, 30 %, 50 %, 70 % або 90 %, при визначенні способом, доступним у цій галузі, наприклад, конкурентним ELISA або способом визначення Kd за допомогою BIAcore, але не означає, що антитіло повністю ліквідує зв'язування. Одним із приладів для визначення зв'язувальних взаємодій, добре відомим у цій галузі, є TM прилад BIAcore ™ 2000, який виготовляє Pharmacia Biosensor (Uppsala, Швеція). Цей винахід охоплює фармацевтичну композицію, яка містить антитіло за цим винаходом, опис якого наведено у цій заявці, та фармацевтично прийнятний носій, розріджувач або наповнювач. Згадана фармацевтична композиція факультативно може містити інші терапевтичні інгредієнти. Вислів "фармацевтично прийнятний носій", який вживають у цьому описі, означає розчинники, диспергатори, покриття, антибактеріальні та протигрибкові агенти, 6 UA 101988 C2 5 10 15 20 25 30 35 40 45 50 55 60 агенти для регулювання ізотонічності та агенти для уповільнення абсорбції тощо, які є фізіологічно сумісними. Приклади фармацевтично прийнятних носіїв охоплюють воду, фізіологічний розчин, забуферений фосфатом фізіологічний розчин, декстрозу, гліцерин, етанол тощо, а також їх комбінації. Фармацевтично прийнятні носії можуть також містити незначні кількості допоміжних речовин, таких як зволожувальні агенти або емульгатори, консерванти або буфери, які подовжують строк зберігання або ефективність антитіла, а також агентів регулювання ізотонічності, таких як цукри, поліспирти, такі як маніт та сорбіт, і хлориду натрію. Фармацевтичні композиції за цим винаходом можна виготовляти у різноманітних формах, в тому числі, наприклад, рідкій, напівтвердій та твердій дозованих формах, таких як рідкі розчини (наприклад, розчини для ін'єкцій та вливань), дисперсії або суспензії, порошки, ліпосоми та супозиторії. За варіантом, якому віддається перевага, композиції мають форму розчинів для ін'єкцій або вливань. Способом введення, якому віддається перевага, є парентеральний (наприклад, внутрішньовенний, підшкірний, внутрішньоочеревинний, внутрішньом'язовий). Способами введення, яким віддається особлива перевага, є внутрішньовенне вливання або ін'єкція, внутрішньом'язова ін'єкція або підшкірна ін'єкція. Згадані композиції розробляються відповідно до традиційних способів, які наведені, наприклад, у Remington, The Science and Practice of th Pharmacy, 19 Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA 1995, де наведений стислий опис способів одержання лікарських форм, які, взагалі, відомі практикам. Ефективні дози композицій за цим винаходом для лікування захворювання або розладу, як описано у цій заявці, варіюють у залежності від багатьох різних факторів, у тому числі способів введення, сайту-мішені, фізіологічного стану суб'єкта, від того, чи є згаданий суб'єкт людиною або твариною, інших введених лікарських засобів і від того, чи є лікування профілактичним або терапевтичним. Терапевтичні дози можна титрувати із застосуванням звичайних способів, відомих фахівцям у цій галузі, для оптимізації безпечності та ефективності. Терміни "лікувати" та "лікування" означають терапевтичне лікування, метою якого є уповільнення (зменшення) небажаної фізіологічної зміни, пов'язаної із захворюванням або розладом. Сприятливі або бажані клінічні результати охоплюють, але без обмеження ними, полегшення симптомів, зменшення ступеня розвитку захворювання або розладу, стабілізацію захворювання або розладу (тобто, коли захворювання або розлад не погіршується), затримку або уповільнення розвитку захворювання або розладу та ремісію (часткову або повну, виявлювану або невиявлювану) захворювання або розладу. Термін "лікування" може також означати подовження строку виживаності, порівняно з очікуваним строком виживаності без проведення лікування. До пацієнтів, які потребують лікування, належать пацієнти, які вже мають захворювання або розлад, а також ті, що є схильними до появи захворювання або розладу. Фармацевтичні композиції за цим винаходом можуть містити "терапевтично ефективну кількість" антитіла проти TGFβRII за цим винаходом. Термін "терапевтично ефективна кількість" означає кількість, ефективну у дозах та протягом періодів часу, необхідних для досягнення бажаного терапевтичного результату. Терапевтично ефективна кількість антитіла може варіювати у відповідності до таких факторів, наприклад, як стан захворювання, вік, стать, маса індивідуума та здатність антитіла або частини антитіла до викликання необхідної реакції у індивідуума. Терапевтично ефективною кількістю також є кількість, у разі якої будь-які токсичні або шкідливі ефекти антитіла або частини антитіла переважуються терапевтично сприятливими ефектами. Схеми приймання лікарського засобу можна регулювати для забезпечення оптимальної бажаної реакції. Наприклад, можна вводити одну ударну дозу, декілька дрібніших доз можна вводити протягом певного періоду часу або доза може бути пропорційно зменшена або збільшена у залежності від вимог терапевтичної ситуації. Особливу перевагу надає виготовлення парентеральних композицій у дозованій одиничній формі для полегшення введення та однорідності дозування. Дозована одинична форма означає дозу, яка містить заздалегідь визначену кількість активної сполуки, розраховану на викликання бажаного терапевтичного ефекту, у поєднанні з необхідним фармацевтичним носієм. Технічні вимоги до дозованих одиничних форм за цим винаходом визначаються і безпосередньо залежать від (a) унікальних характеристик активної сполуки і конкретного терапевтично або профілактичного ефекту, який повинен бути досягнутим, та (b) обмежень, притаманних галузі виготовлення лікарського засобу, наприклад, активної сполуки для лікування чутливості індивідуумів. Наприклад, необмежувальний діапазон терапевтично ефективної кількості антитіла за цим винаходом становить 0,1-50 мг/кг. За іншим аспектом ефективна кількість антитіла становить 3 7 UA 101988 C2 5 10 15 20 25 30 35 40 45 50 55 60 35 мг/кг. За іншим аспектом ефективна кількість становить 10-25 мг/кг. За іншим аспектом ефективна кількість становить 5-20 мг/кг. За іншим аспектом ефективна кількість становить 315 мг/кг. За іншим аспектом ефективна кількість становить 2-10 мг/кг. За іншим аспектом ефективна кількість становить 5-10 мг/кг. За іншим аспектом ефективна кількість становить 110 мг/кг. Слід звернути увагу на те, що величину дози можна змінюватись у залежності від типу та тяжкості стану, призначеного для полегшення. Крім того, слід розуміти, що для будь-якого конкретного суб'єкта, конкретні схеми приймання лікарського засобу повинні регулюватись з плином часу відповідно до індивідуальних потреб та професійного розсуду персони, яка вводить або наглядає за введення згаданих композицій, і що наведені у цьому описі діапазони доз є лише прикладами і не призначені для обмеження обсягу або практичного застосування заявленої композиції. Антитіла за цим винаходом можна застосовувати для лікування раку. Раком вважають велику групу захворювань, які класифікуються за тканиною походження та ступенем розвитку пухлини. Рак можна також класифікувати як первинні пухлини та метастатичні пухлини, а також як резистентні або рецидивні пухлини. Резистентними пухлинами є пухлини, які не реагують або є стійкими до лікування лише хіміотерапевтичними агентами, лише антитілами, лише опроміненням або їх комбінаціями. Рецидивними пухлинами є пухлини, які видаються пригніченими лікуванням такими агентами, але рецидивують через п'ять років, подеколи через десять або більше років після припинення лікування. Рак, який можна лікувати, також охоплює неваскуляризовані пухлини або пухлини, які не є васкуляризованими значною мірою, а також васкуляризовані пухлини. Рак може являти собою несолідні (гемолімфатичні) пухлини або солідні пухлини. Антитіла проти TGFβRII за цим винаходом можна також застосовувати для лікування розладів, захворювань або станів, пов'язаних із TGFβRII, до яких належать хронічні та гострі розлади або захворювання, у тому числі, ті патологічні стани, які спричинюють схильність ссавця до згаданого розладу. До розладів, які підлягають лікуванню за цим винаходом належать фіброз, спричинений пошкодженням артерій, інфекційні захворювання, ревматоїдний артрит, діабет або діабетичний стан, злоякісна пухлина, захворювання, які характеризуються накопиченням позаклітинного матриксу, захворювання, які спричинюються передаванням сигналу TGFβRII, стани, які спричинюються супресією імунної системи, яка виникла внаслідок TGFβRII-опосередкованої активності, гострі імунодефіцити, які є наслідком тяжких пошкоджень, опіків та захворювань, таких як вірусні або бактеріальні інфекційні захворювання, та системних захворювань із мультиорганним ураженням, спричиненим TGFβRII-опосередкованою активністю. TGFβ відіграють значну роль у самооновленні, проліферації та диференціації гемопоетичних стовбурових клітин. Антитіла за цим винаходом можна застосовувати для збагачення та регенерації стовбурових клітин та полегшення застосування лікарських препаратів на основі стовбурових клітин після інфаркту міокарда, у разі неврологічних розладів та регенерації тканин різних типів. Антитіла за цим винаходом можна вводити окремо або у комбінації з протипухлинним агентом, окрім антитіл проти людського TGFβRII, у тому числі хіміотерапевтичними агентами, опроміненням, іншими антагоністами TGFβRII, антагоністами TGFβ, антиангіогенними засобами, антитілами проти інших мішеней та невеликими молекулами. Антитіла проти TGFβRII є особливо прийнятними для лікування пухлин, резистентних до анти-VEGF-A терапії. Введення таких антитіл з іншими антитілами та/або лікарськими засобами можна здійснювати одночасно або роздільно, тим самим або іншим шляхом, у той самий або інший час. Способи лікування, опис яких наведений у цій заявці, можна застосовувати для лікування будь-якого відповідного ссавця, у тому числі приматів, таких як мавпи та люди, коней, корів, кішок, собак, кролів та гризунів, таких як пацюки та миші. Наведені нижче приклади пропонуються лише для ілюстративних цілей і не призначені для будь-якого обмеження обсягу цього винаходу. ПРИКЛАДИ Матеріали та лінії клітин Людські TGFβ1, TGFβ2 та TGFβ3 можна одержати рекомбінантним шляхом і очистити, або їх можна закупити, наприклад, у компанії R&D Systems. Рекомбінантні гібридні білки TGFβRII і Fc (TGFβRII-Fc) та розчинні рекомбінантні білки TGFβRII і лужної фосфатази (TGFβRII-AP) можуть бути експресовані у стабільно трансфікованих клітинах та очищені від супернатантів клітинних культур за процедурами, відомими фахівцю у цій галузі (Tessler, J. Biol. Chem., 269:12456-12461 (1994)). Людські лінії ракових клітин BXPC-3, PANC-1, MDA-MB-231, мишачі лінії ракових клітин 8 UA 101988 C2 5 10 15 20 25 30 35 40 45 50 55 EMT6, 4T1, CT26, B16-F10 і лінії клітин мієломи P3-X63-Ag8.653 можна одержати з Американської колекції типових культур (American Type Tissue Culture Collection, Manassas, штат Вірджинія). Лінію клітин MDA-MB-231, трансфіковану люциферазою, можна одержати з наукового центру Sunnybrook Health Sciences Centre. Клітини можна зберігати у середовищі RPMI1640 або IMDM (середовище Дульбекко, модифіковане за способом Ісков) (Invitrogen/Life Technologies, Inc., Rockville, штат Меріленд), яке містить 10 % фетальної телячої сироватки (FCS, виробник Hyclone, Logan, штат Юта). Усі клітини можна зберігати при температурі 37C у зволоженій атмосфері з 5 % CO2. Одержання моноклональних антитіл проти TGFβRII Моноклональні антитіла (mAbs) проти TGFβRII можна одержати по суті за стандартною гібридомною технологією (Harlow & Lane, ed., Antibodies: A Laboratory Manual, Cold Spring Harbor, стор. 211-213 (1998)) із застосуванням мишей, трансгенних за людським імуноглобуліном (Medarex, San Jose, штат Каліфорнія), які продукують важкі ланцюги типу гамма і легкі ланцюги типу каппа людського імуноглобуліну, або пацюків лінії Lewis (Charles River Laboratories, Wilmington, штат Массачусетс). Стисло, мишей або пацюків імунізують підшкірним (s.c.) шляхом рекомбінантним людським або мишачим білком TGFβRII-Fc, емульгованим із повним ад'ювантом Фрейнда. Тварин тричі реімунізують внутрішньоочеревинно (i.p.) тим самим білком TGFβRII-Fc у неповному ад'юванті Фрейнда. Тварини відпочивають протягом місяця, після чого вони одержують останню внутрішньоочеревинну бустер-ін'єкцію (50 мікрограмів (мкг) білка TGFβRII-Fc у забуференому фосфатом фізіологічному розчині (PBS)). Спленоцити, відібрані у імунізованих мишей, гібридизують із клітинами плазмоцитоми лінії P3-X63-Ag8.653 із застосуванням поліетиленгліколю (PEG, молекулярна маса (MW): 1450 кДа). Після гібридизації, клітини ресуспендують у середовищі HAT (гіпоксантин, аміноптерин, тимідин), доповненому 10 % фетальної телячої сироватки (FBS), і розподіляють на 96-лункових планшетах із густиною 200 мкл на лунку для одержання клітин гібридом. На 10-12 день після гібридизації гібридоми піддають скринінгу на продукування антитіла та специфічну зв'язувальну активність культуральних супернатантів із білком TGFβRII у аналізі зв'язування і блокування на основі ELISA. Конкретніше, гібридоми, які продукують моноклональні антитіла проти TGFβRII, спочатку ідентифікують шляхом виявлення TGFβRIIзв'язаного антитіла із застосуванням козячого антилюдського легкого ланцюга типу каппа або антитіла проти мишачого IgG, кон'югованого з пероксидазою хрону (HRP), за наведеною нижче процедурою. Лунки 96-лункових титраційних мікропланшетів сенсибілізують людським TGFβRIIFc або мишачим TGFβRII-Fc (100 нг на лунку) при температурі 4C протягом ночі. ® Сенсибілізовані планшети блокують блокувальним буфером (0,05 % розчин TWEEN 20 у PBS, який містить 5 % сухого молока) при кімнатній температурі протягом 2 год. Супернатанти гібридом або очищені антитіла розбавляють у PBS з 2 % бичачого сироваткового альбуміну ® (BSA) і 0,05 % TWEEN 20 (буфер, який застосовується при проведенні ELISA), та інкубують у TGFβRII-сенсибілізованих 96-лункових титраційних мікропланшетах протягом 30 хв. Планшети промивають буфером, який застосовується при проведенні ELISA, та інкубують із козячим антилюдським легким ланцюгом типу каппа або кон'югатом антимишачого IgG-HRP протягом 30 хв. Субстрат TMB (3,3',5,5’-тетраметилбензидин) застосовують для проявлення забарвлення за інструкціями виробника. Оптичну густину при 450 нанометрах (нм) зчитують для кількісного визначення зв'язувальної активності антитіл. Для ідентифікування гібридом, які продукують нейтралізуючі моноклональні антитіла проти TGFβRII, аналіз блокування на основі ELISA проводять за наведеною нижче процедурою. Лунки 96-лункових планшетів сенсибілізують TGFβ1, TGFβ2 або TGFβ3 (200 нм на лунку), після чого лунки блокують блокувальним буфером. Супернатанти гібридом інкубують із буфером, що застосовується при проведенні ELISA, який містить TGFβRII-AP (лужна фосфатаза), у TGFβ-сенсибілізованих 96-лункових титраційних мікропланшетах протягом 1 год. Після промивання п-нітрофенілфосфатний (PNPP) субстрат для AP додають до лунок для проявлення забарвлення за інструкціями виробника. Оптичну густину при 405 нм зчитують для кількісного визначення зв'язування TGFβRII з TGFβ1, TGFβ2 та TGFβ3. Значення оптичної густини (OD) зчитують із застосуванням мікротитраційного планшетрідера (Molecular Devices Corp., Sunnyvale, штат Каліфорнія). Позитивні гібридоми тричі субклонують шляхом культивування методом послідовних розведень для одержання лінії клітин гібридом, які продукують моноклональне антитіло. У Таблиці 1 наведені амінокислотні послідовності гіперваріабельних ділянок легкого ланцюга і важкого ланцюга моноклональних антитіл TGF1 і TGF3. 9 UA 101988 C2 Таблиця 1 Амінокислотні послідовності гіперваріабельних ділянок легкого ланцюга і важкого ланцюга моноклональних антитіл проти людського TGFβRII CDRH1 CDRH2 CDRH3 CDRL1 CDRL2 CDRL3 mAb TGF1 GGSISNSYF (SEQ ID NO: 1) SFYYGEKTYYNPSLKS (SEQ ID NO: 2) GPTMIRGVIDS (SEQ ID NO: 3) RASQSVRSYLA (SEQ ID NO: 10) DASNRAT (SEQ ID NO: 11) QQRSNWPPT (SEQ ID NO: 12) mAb TGF3 GGSISSSSY (SEQ ID NO: 7) SFYYSGITYYSPSLKS (SEQ ID NO: 8) GFTMIRGALDY (SEQ ID NO: 9) RASQSVRSFLA (SEQ ID NO: 16) DASNRAT (SEQ ID NO: 11) QQRSNWPPT (SEQ ID NO: 12) У Таблиці 2, представленій нижче, наведені номери амінокислотних послідовностей та послідовностей ДНК, які кодують амінокислотні послідовності HCVR, LCVR, важких ланцюгів (HC) та легких ланцюгів (LC) моноклональних антитіл (mAb) TGF1 та TGF3. 5 Таблиця 2 Номери амінокислотних послідовностей та послідовностей ДНК, які кодують моноклональні антитіла проти людського TGFβRII Амінокислотні послідовності HCVR LCVR HC LC Послідовності ДНК HCVR LCVR HC** LC** mAb TGF1 mAb TGF3 (SEQ ID NO: 25) (SEQ ID NO: 27) (SEQ ID NO: 37) (SEQ ID NO: 55)* (SEQ ID NO: 39) (SEQ ID NO: 56)* mAb TGF1 (SEQ ID NO: 26) (SEQ ID NO: 28) (SEQ ID NO: 38) (SEQ ID NO: 40) (SEQ ID NO: 33) (SEQ ID NO: 35) (SEQ ID NO: 6) (SEQ ID NO: 31)* (SEQ ID NO: 14) (SEQ ID NO: 29)* mAb TGF3 (SEQ ID NO: 34) (SEQ ID NO: 36) (SEQ ID NO: 13) (SEQ ID NO: 15) * Амінокислотні послідовності із секреторною сигнальною послідовністю. ** Послідовності кДНК включають секреторну сигнальну послідовність. 10 15 20 Конструювання і експресія людських IgG1 антитіл проти людського рецептора II типу TGFβ Послідовності ДНК, які кодують варіабельні ділянки важкого ланцюга і легкого ланцюга моноклональних антитіл проти TGFβRII, можна ампліфікувати шляхом ПЛР для клонування у експресійних векторах. Варіабельні ділянки важкого ланцюга можна гібридизувати у межах рамки зчитування з константною ділянкою важкого ланцюга типу гамма 1 людського імуноглобуліну у векторі pEE6.1 (Lonza Biologics plc, Slough, Berkshire, Великобританія). Повну кДНК людського легкого ланцюга можна клонувати безпосередньо у векторі pEE12.1 (Lonza Biologics PLC, Slough, Berkshire, Великобританія). Сконструйовані експресійні вектори на основі імуноглобуліну можна стабільно трансфікувати у клітини мієломи NS0 шляхом електропорації і відбирати на селекційному середовищі з глутамінсинтетазою. Стабільні клони можна піддавати скринінгу на експресію антитіла із застосуванням твердофазного імуноферментного аналізу специфічного зв'язування антитіл проти людського TGFβRII. Позитивні клони можна культивувати у безсироватковому середовищі для продукування антитіла у ролерних колбах або біореакторах. Непроцесоване антитіло IgG1 можна очищати афінною хроматографією з 10 UA 101988 C2 5 10 15 20 25 білком (Poros A, виробник PerSeptive Biosystems Inc., Foster City, штат Каліфорнія), та елюювати у нейтральний забуферений фізіологічний розчин. кДНК, які кодують варіабельні ділянки важкого і легкого ланцюгів моноклональних антитіл TGF1 і TGF3 проти людського TGFβRII, можна клонувати і гібридизувати у межах рамки зчитування з константною ділянкою важкого ланцюга типу гамма 1 людського імуноглобуліну у векторі експресії GS (глутамінсинтетаза). Сконструйовані вектори для експресії імуноглобуліну можна стабільно трансфікувати у клітини CHO. Стабільні клони можна перевіряти на експресію антитіла, яке специфічно зв'язується з людським TGFβRII. Позитивні клони можна розмножувати шляхом культивування у безсироватковому середовищі для продукування антитіл у біореакторах. Непроцесоване антитіло IgG1 можна очищати афінною хроматографією з білком А і елюювати у нейтральний забуферений фізіологічний розчин. Моноклональні антитіла проти TGFβRII зв'язуються з TGFβRII і блокують зв'язування TGFβRII з його лігандами Зв'язувальну та блокувальну активність очищених моноклональних антитіл проти TGFβRII визначають із застосуванням ELISA, як описано у наведеному вище розділі "Одержання моноклональних антитіл проти TGFβRII". ED50 та IC50 згаданих антитіл аналізують із ® застосуванням програми GraphPad Prism software 3.03 (GraphPad Software Inc., San Diego, штат Каліфорнія). Кожне з моноклональних антитіл TGF1 і TGF3 проти людського TGFβRII окремо демонструє зв'язувальну активність з людським TGFβRII зі значеннями ED 50 0,0310,059 нМ у аналізі зв'язування на основі ELISA, у той час як у нормального людського IgG зв'язувальної активності по відношенню до згаданого рецептора не спостерігається. Кожне з очищених моноклональних антитіл TGF1 і TGF3 окремо ефективно блокує зв'язування людського TGFβ1, TGFβ2 або TGFβ3 з людським TGFβRII із значеннями IC 50, які становлять 0,10-0,54 нМ. У Таблиці 3 наведені узагальнені зв'язувальні та блокувальні характеристики антитіла проти людського TGFβRII. Таблиця 3 Зв'язувальні та блокувальні характеристики антитіл проти людського TGFβRII Клон TGF1 TGF3 30 Зв'язувальна активність Блокувальна активність Зв'язувальна спорідненість до відносно людського зв'язування людського людського TGFβRII (значення TGFβRII (ED50) за TGFβRII з людським TGFβ1, 2 KD) за даними аналізу Biacore даними ELISA або 3 (IC50) за даними ELISA 0,12 нМ: TGFβ1 0,059 нМ 0,011 нМ 0,54 нМ: TGFβ2 0,19 нМ: TGFβ3 0,031 нМ 0,019 нМ 0,10 нМ: TGFβ1 0,41 нМ: TGFβ2 0,13 нМ: TGFβ3 Зв'язувальна активність моноклонального антитіла MT1 проти мишачого TGFβRII з мишачим TGFβRII має значення ED50 0,054 нМ, а блокувальна активність моноклонального антитіла MT1 відносно зв'язування мишачого TGFβRII з мишачими TGFβ1, TGFβ2 або TGFβ3, має значення IC50 0,12-0,54 нМ. У Таблиці 4 наведені узагальнені зв'язувальні та блокувальні характеристики моноклонального антитіла MT1. 35 11 UA 101988 C2 Таблиця 4 Зв'язувальні та блокувальні характеристики моноклонального антитіла MT1 проти мишачого TGFβRII Блокувальна активність зв'язування Зв'язувальна активність з Зв'язувальна спорідненість до мишачого TGFβRII з мишачими мишачим TGFβRII (ED50) мишачого TGFβRII (значення TGFβ1, 2 або 3 (IC50) за даними за даними ELISA KD) за даними аналізу Biacore ELISA 0,12 нМ: TGFβ1 0,054 нМ 0,033 нМ 0,54 нМ: TGFβ2 0,19 нМ: TGFβ3 5 10 15 Зв'язувальна спорідненість моноклональних антитіл проти TGFβRII Зв'язувальну спорідненість моноклональних антитіл проти TGFβRII визначають за TM технологією поверхневого плазмонного резонансу із застосуванням BIAcore 2000 при кімнатній температурі (20-25C) (Pharmacia, Piscataway, штат Нью-Джерсі). Кінетичні аналізи моноклональних антитіл здійснюють шляхом іммобілізації гібридного білка рекомбінантного позаклітинного домену мишачого TGFβRII (послідовність SEQ ID NO: 41) або позаклітинного домену людського TGFβRII. ÿêèé êîäóєòüñÿ послідовністю (SEQ ID NO: 40), сполученою, відповідно, з мишачим або людським Fc чи константною ділянкою важкого ланцюга, на сенсорній поверхні з концентрацією від 5 нМ до 100 нМ. Моноклональні антитіла TGF1 і TGF3 проти людського TGFβRII демонструють високу спорідненість зі значеннями K D 11 пМ, 78 пМ, 19 пМ, відповідно. Моноклональне антитіло МТ1 проти мишачого TGFβRII демонструє високу спорідненість зі значенням KD 33 пМ. У Таблиці 5 наведені узагальнені кінетичні дані моноклональних антитіл Таблиця 5 Кінетичні дані моноклональних антитіл проти людського TGFβRII Mab TGF1 TGF3 20 25 30 35 40 Koff (1/c) -5 1,710 Kon (1/Mc) 6 1,510 1,410 6 -5 2,710 KD (M) -11 1,110 -11 1,910 Видоспецифічність моноклональних антитіл проти людського TGFβRII Специфічність моноклональних антитіл проти людського TGFβRII визначають шляхом визначення реактивності згаданих антитіл по відношенню до людського TGFβRII або мишачого TGFβRII із застосуванням ELISA. Моноклональне антитіло TGF1 проти людського TGFβRII не демонструє перехресної реактивності з мишачим TGFβRII, у той час як моноклональне антитіло TGF3 демонструє проміжну або мінімальну перехресну реактивність з мишачим TGFβRII. Однак моноклональне антитіло TGF3 не блокує зв'язування людського TGFβ1 з мишачим TGFβRII. Зв'язування моноклональних антитіл проти TGFβRII з нативним TGFβRII на клітинах, які експресують TGFβRII Зв'язувальна активність моноклонального антитіла TGF1 проти людського TGFβRII і міченого флуоросцеїнізотіоціанатом (FITC) козячого антилюдського IgG антитіла може бути визначена із застосуванням аналізу із забарвлюванням з лінією 293 клітин-трансфектантів людського TGFβRII та клітин людської карциноми. Конкретніше, аліквоти клітин-трансфектантів, клітин карциноми, клітин селезінки або клітин лімфовузлів збирають із субконфлюентних культур та інкубують з міченими флуоресцеїном або неміченими першими антитілами з необхідними молекулами у PBS (забуферений фосфатом фізіологічний розчин) з 1 % BSA (забарвлювальний буфер) протягом 1 год. на льоду. Суміщений ізотип IgG застосовують як негативний контроль. Клітини двічі промивають забарвлювальним буфером, після чого інкубують з FITC, фікоеритрином (PE) або міченим барвником Alxas Red видоспецифічним другим антитілом до першого антитіла (BioSource International, Camarillo, штат Каліфорнія) у буфері протягом 30 хв на льоду. Клітини промивають, як вказувалось вище, і аналізують за допомогою протокового цитометра. Мертві клітини і дебрис видаляють з аналізу на основі прямого і бічного розсіювання світла. Одиниці середньої інтенсивності флуоресценції (MFIU) 12 UA 101988 C2 5 10 15 20 25 30 35 40 45 50 55 60 обчислюють як середню інтенсивність флуоресценції на логарифмічній шкалі часу на відсоток позитивної популяції. Індекс середньої інтенсивності флуоресценції (MFIR) обчислюють для кількісного визначення відносних рівнів експресії TGFβRII у лініях клітин. MFIR являє собою середню інтенсивність флуоресценції (MFI) клітин, забарвлених TGFβRII-специфічним моноклональним антитілом, поділену на MFI клітин, забарвлених ізотиповим контрольним антитілом. Моноклональне антитіло проти людського TGFβRII TGF1 демонструє зв'язувальну реактивність з лінією 293 клітин-трансфектантів людського TGFβRII та лінією MDA-MB-231 людських клітин раку молочної залози з MFIR 46 та 209, відповідно, у той час як нормальний людський IgG зі згаданими клітинами не реагує. Наведені результати вказують на те, що моноклональне антитіло TGF1 має специфічну реактивність з нативним людським TGFβRII, експресованим на клітинній поверхні. Пригнічувальна активність моноклональних антитіл проти TGFβRII на активацію TGFβRII у прямому напрямку відносно рецепторів кінази Smad2 у відповідь на TGFβ1 Фосфорилування Smad2 (p-Smad2), індуковане TGFβ, являє собою типовий прямий шлях передавання сигналу TGFβ через TGFβRII, який опосередковує клітинні біологічні реакції, такі як проліферація, рухливість, виживаність та диференціювання, у клітин різних типів. Здатність моноклональних антитіл проти людського TGFβRII та антилюдського мишачого TGFβRII до пригнічення активації p-Smad2 може бути визначена шляхом застосування мишачої лінії клітин 4T1 раку молочної залози та людської лінії клітин MDA-MB-231 раку молочної залози за наведеною нижче процедурою. Стисло, клітини вирощують до 80 % злиття у середовищі, яке містить FCS. Після заміни згаданого культурального середовища на безсироваткове середовище, клітини обробляють антитілом або ізотиповим контролем у присутності 10 нг/мл TGFβ протягом 1 год. Після промивання за допомогою лізисного буфера одержують клітинні лізати, які піддають електрофорезу та електроперенесенню на нітроцелюлозну мембрану. Фосфорилований Smad2 та Smad2 виявляють за допомогою вестерн-блотингу із застосуванням моноклональних антитіл проти фосфо-Smad2 та Smad2 (Millipore Corporate) та системи електрохемілюмінесценції (ECL) з подальшою візуалізацією та кількісним визначенням шляхом денситометрії із застосуванням аналізатора зображень Fuji Image Analyzer. Моноклональні антитіла TGF1 і MT1 проти TGFβRII зменшують TGFβ-індуковане фосфорилування Smad2 у лініях клітин раку молочної залози (людська MDA-MB-231 і мишача 4T1) дозозалежним чином. Значення IC50 для моноклональних антитіл TGF1 і MT1 у аналізах пригнічення p-Smad2 становлять за визначенням 50,5 нМ, у той час як моноклональне антитіло TGF3 демонструє значення IC50, нижче ніж 250,5 нМ. Пригнічувальна активність моноклональних антитіл проти TGFβRII на in vitro міграцію та інвазію ракових клітин Пригнічувальна дія моноклональних антитіл проти TGFβRII на інвазивність ракових клітин може бути визначена із застосуванням in vitro випробувань міграції та інвазії. Стисло, клітини 3 карциноми вносять із густиною 510 клітин на лунку у верхні камери, вставлених у нижні, сенсибілізовані колагеном I і IV, камери 48-лункових планшетів із безсироватковим живильним середовищем. Клітини обробляють моноклональними антитілами TGF1 або MT1 у дозах 3 мкг/мл, 10 мкг/мл та 30 мкг/мл у присутності 10 нг/мл TGFβ при температурі 37C протягом 2448 год. При проведенні випробувань TGFβRII-Fc (25 мкг/мл) або ізотип IgG (25 мкг/мл) застосовують як позитивний і негативний контроль. Такі самі умови застосовують при проведені випробування інвазивності, за виключенням того, що застосовують верхні камери, сенсибілізовані матригелем. Після завершення інкубації мігровані клітини на протилежних боках верхніх камер фіксують 10 % забуференим нейтральним розчином формаліну і забарвлюють (2 мкг/мл) розчином Hoechst 33342 (у формі гідрохлориду тригідрату) з проведенням підрахунку при 20-кратному збільшенні із застосуванням цифрової камери Zeiss Digital Image Camera і програми Image-Pro Plus 5.1. Моноклональні антитіла TGF1 і MT1 проти TGFβRII суттєво пригнічували міграцію клітин лінії BXPC-3 раку підшлункової залози людини та інвазію клітин лінії 4T1 раку молочної залози мишей на 100 % (P
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibodies against human transforming growth factor beta receptor ii (tgfbrii)
Автори англійськоюWu, Yan
Назва патенту російськоюАнтитела против рецептора ii типа трансформирующего фактора роста бета (tgfbrii)
Автори російськоюВу Янь
МПК / Мітки
МПК: A61K 39/395, C07K 16/28, A61P 35/00
Мітки: росту, рецептора, фактора, трансформуючого, антитіла, типу, tgfbrii, бета
Код посилання
<a href="https://ua.patents.su/43-101988-antitila-proti-receptora-ii-tipu-transformuyuchogo-faktora-rostu-beta-tgfbrii.html" target="_blank" rel="follow" title="База патентів України">Антитіла проти рецептора ii типу трансформуючого фактора росту бета (tgfbrii)</a>
Попередній патент: Спосіб та система пакування сигарет
Наступний патент: Пристрій для видалення згустків осаду та спосіб видалення згустків осаду, отриманих при фільтрації під тиском у герметичному резервуарі
Випадковий патент: Спосіб лікування виразкової хвороби дванадцятипалої кишки