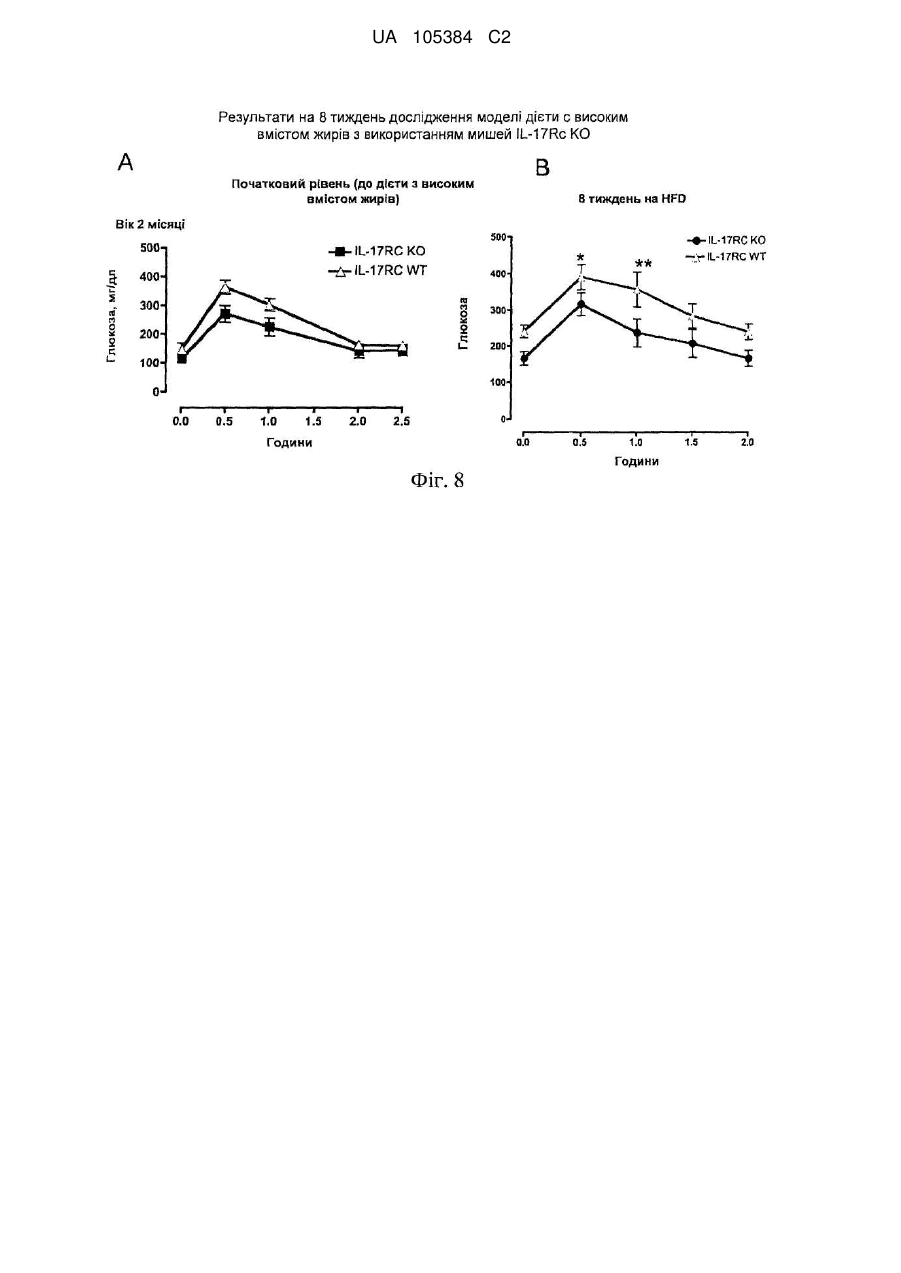
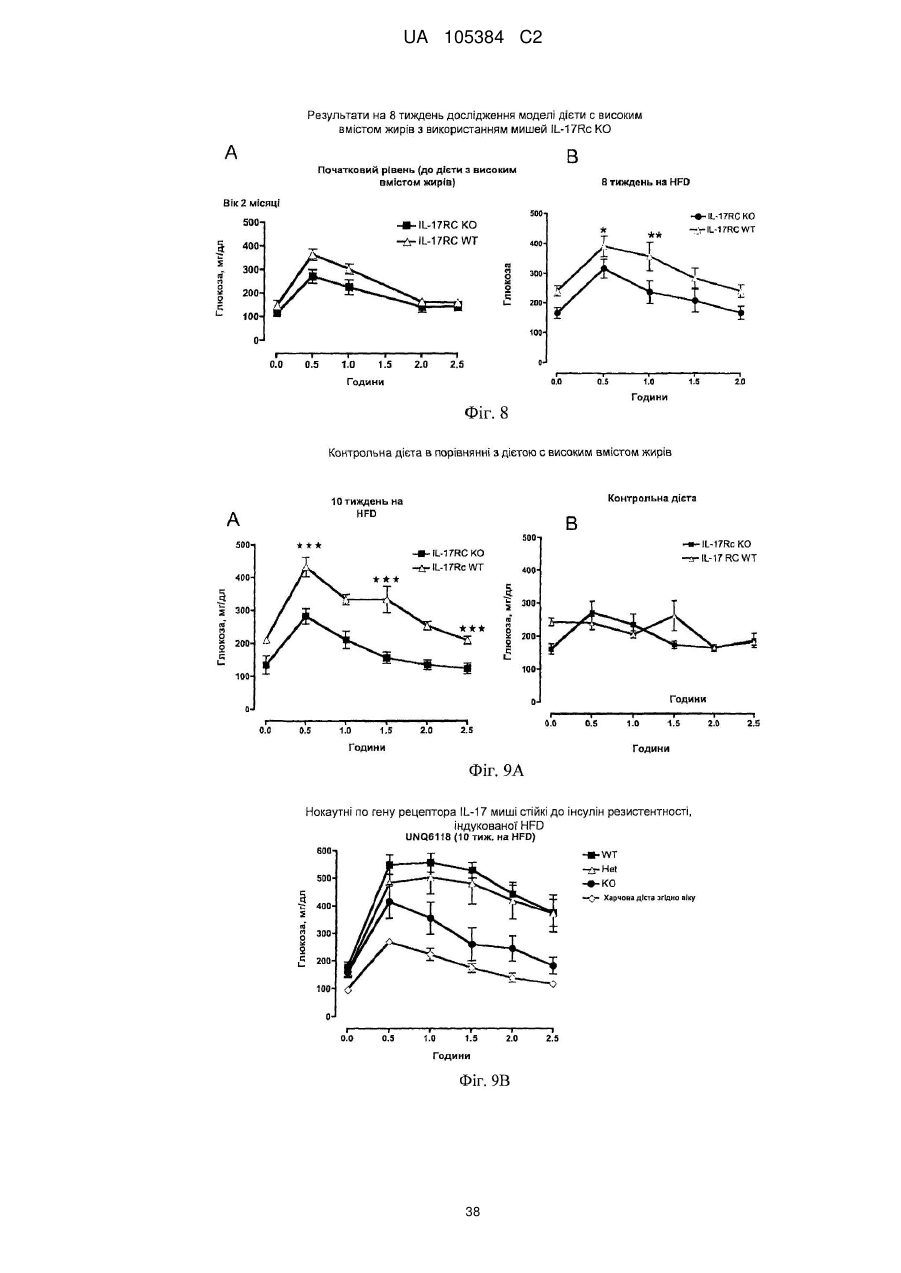
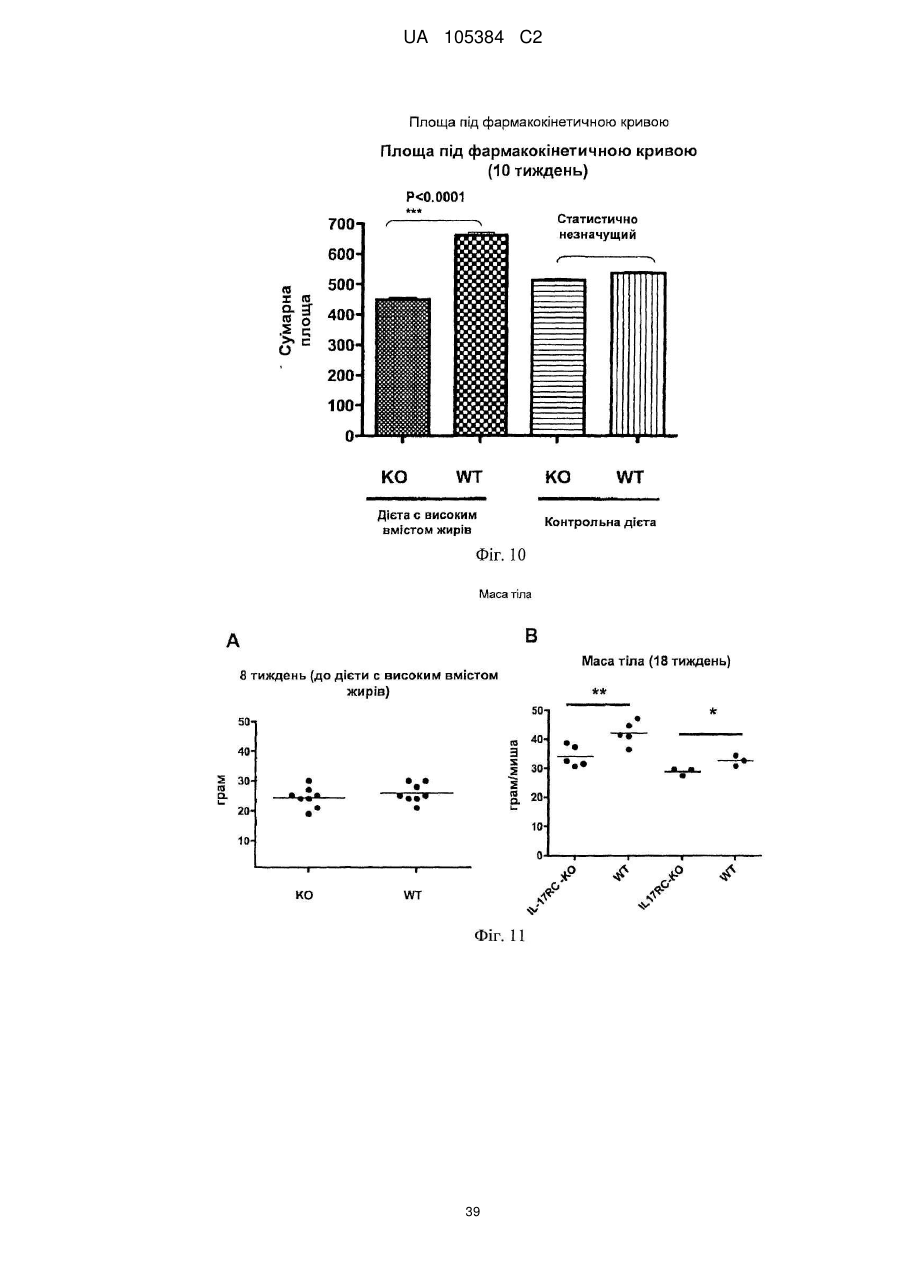
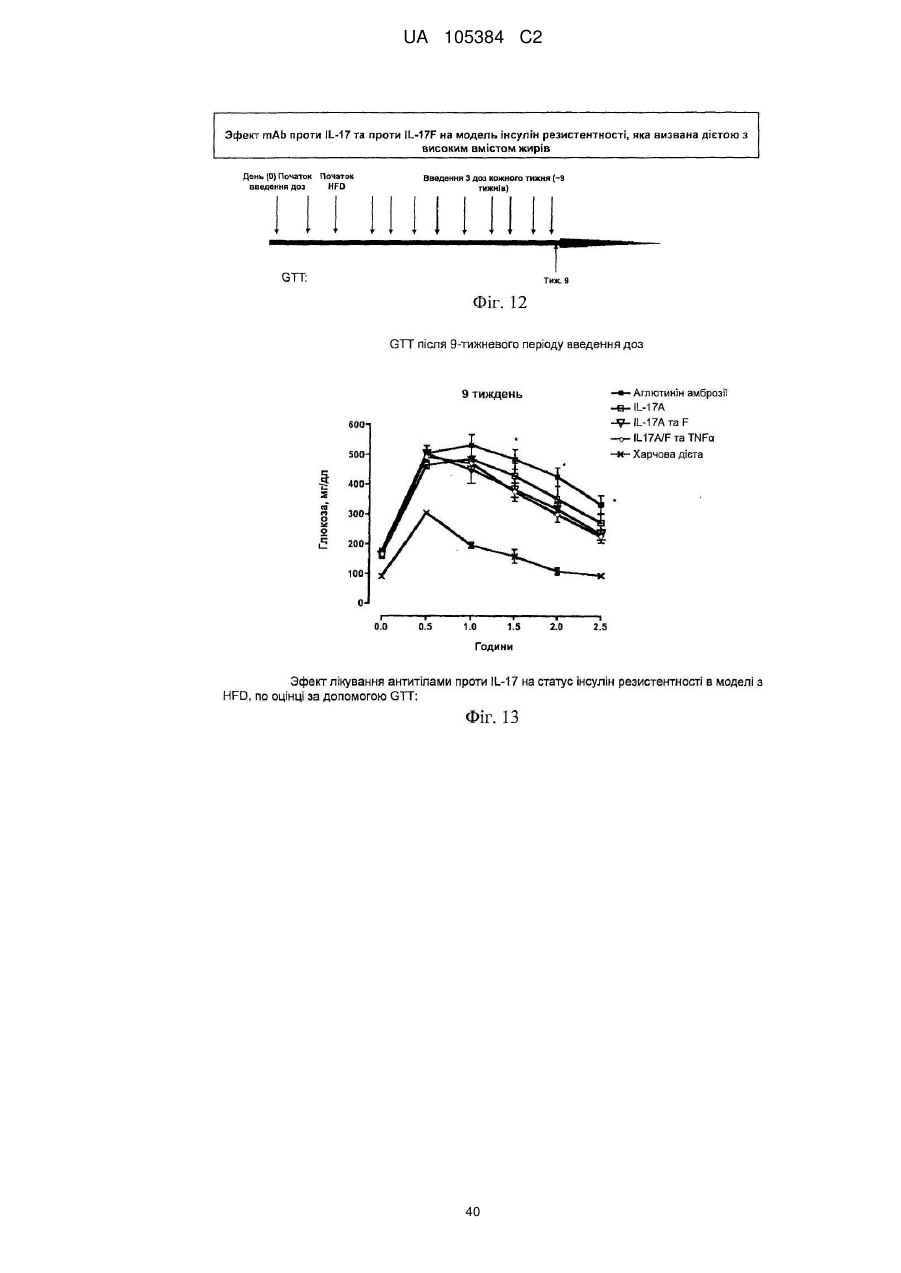
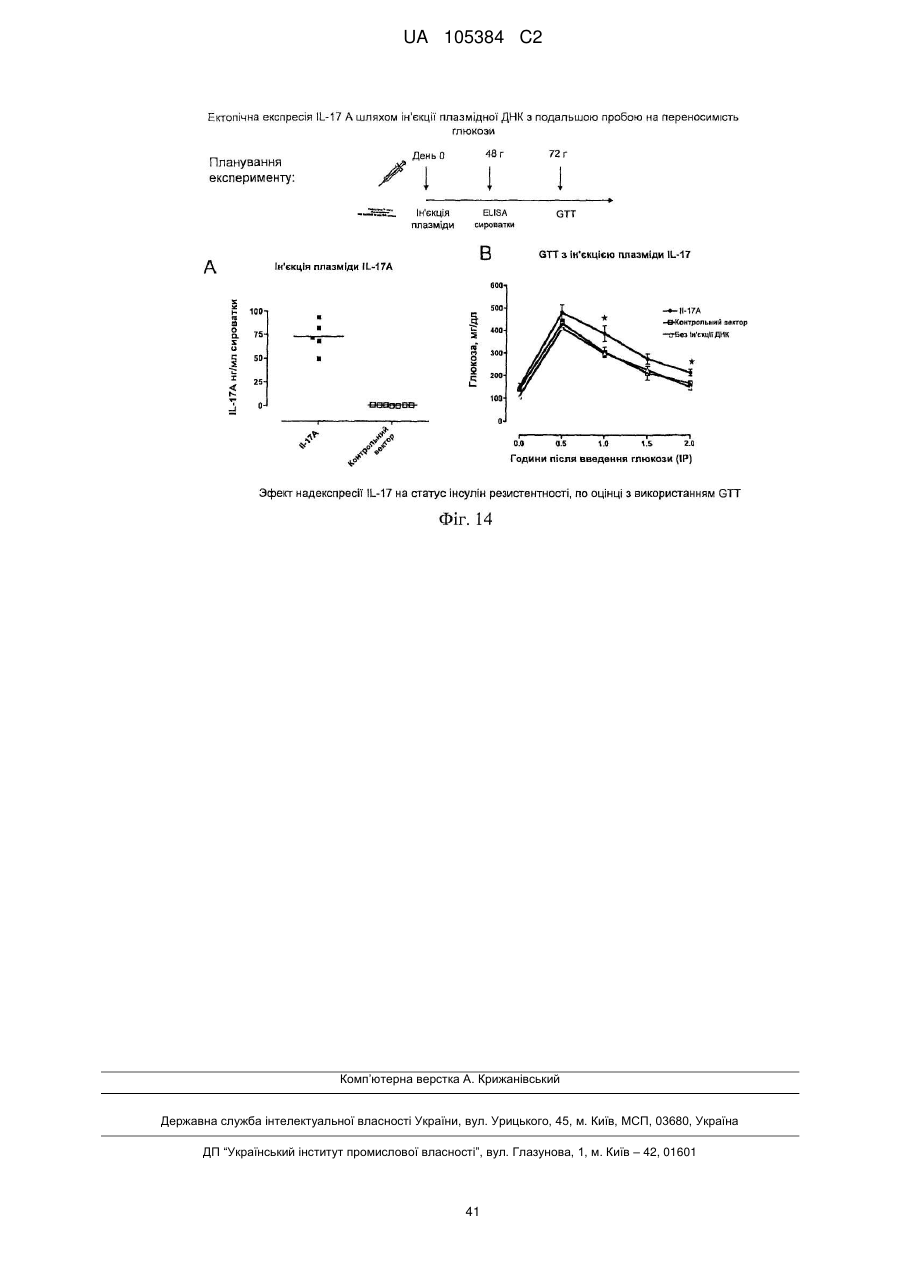
Лікування порушень, пов’язаних з інсулінорезистентністю
Номер патенту: 105384
Опубліковано: 12.05.2014
Автори: Оуян Веньцзюнь, Ху Янь (Хелен), Колумам Ганеш А.
Формула / Реферат
1. Спосіб лікування порушення, пов'язаного з інсулінорезистентністю, у ссавця, що включає введення ссавцеві, який має потребу у цьому, ефективної кількості антагоніста IL-17A і/або IL-17F, деантагоніст є антитілом або його антигензв'язувальним фрагментом.
2. Спосіб за п. 1, який відрізняється тим, що порушення вибирають з групи, що складається з інсуліннезалежного цукрового діабету (ІНЦД), ожиріння, гіперандрогенії яєчників і гіпертонії.
3. Спосіб за п. 2, який відрізняється тим, що порушення є ІНЦД або ожирінням.
4. Спосіб за п. 1, який відрізняється тим, що ссавець є людиною, і введення є системним.
5. Спосіб за п. 1, який відрізняється тим, що антитіло є антитілом, вибраним з групи, що складається з антитіл проти IL-17A, проти IL-17F, проти IL-17A/F, проти IL-17Rc і проти IL-17RA.
6. Спосіб за п. 5, який відрізняється тим, що антитіло є моноклональним антитілом.
7. Спосіб за п. 6, який відрізняється тим, що антитіло є химерним, гуманізованим антитілом або антитілом людини.
8. Спосіб за п. 7, який відрізняється тим, що антитіло є біспецифічним, мультиспецифічним або антитілом, що має перехресну реактивність.
9. Спосіб за п. 8, який відрізняється тим, що додатково включає введення ефективної кількості агента для лікування інсулінорезистентності.
10. Спосіб за п. 9, який відрізняється тим, що агент для лікування інсулінорезистентності є інсуліном, IGF-1 або сульфонілсечовиною.
11. Спосіб за п. 9, який відрізняється тим, що додатково включає ефективну кількість додаткового агента, прийнятного для лікування зазначеного порушення, пов'язаного з інсулінорезистентністю.
12. Спосіб за п. 11, який відрізняється тим, що додатковий агент є Dickkopf-5 (Dkk-5).
13. Застосування фармацевтичної композиції, що містить антагоніст IL-17A і/або IL-17F, де антагоніст є антитілом або його антигензв'язувальним фрагментом, з додаванням фармацевтично прийнятної допоміжної речовини, для лікування порушення, пов'язаного з інсулінорезистентністю.
14. Застосування за п. 13, яке відрізняється тим, що антитіло є антитілом, вибраним з групи, що складається з антитіл проти IL-17A, проти IL-17F, проти IL-17A/F, проти IL-17Rс і проти IL-17RA.
15. Застосування за п. 14, яке відрізняється тим, що антитіло є моноклональним антитілом.
16. Застосування за п. 15, яке відрізняється тим, що антитіло є химерним, гуманізованим антитілом або антитілом людини.
17. Застосування за п. 16, яке відрізняється тим, що антитіло є біспецифічним, мультиспецифічним або антитілом, що має перехресну реактивність.
18. Застосування антагоніста IL-17A і/або IL-17F для виготовлення лікарського препарату для лікування порушення, пов'язаного з інсулінорезистентністю, де антагоніст є антитілом або його антигензв'язувальним фрагментом.
19. Застосування за п. 18, яке відрізняється тим, що лікування включає введення ссавцеві, що потребує цього, ефективної кількості антагоніста IL-17A і/або IL-17F у лікарському препараті, де антагоніст є антитілом або його антигензв'язувальним фрагментом.
20. Застосування за п. 18, яке відрізняється тим, що під час введення при лікуванні, ссавцеві, що потребує цього, вводиться ефективна кількість антагоніста IL-17A і/або IL-17F у лікарському препараті.
21. Застосування за п. 18, яке відрізняється тим, що лікарський препарат знаходиться у формі, придатній для введення ефективної кількості антагоніста IL-17А і/або IL-17F у лікарському препараті ссавцеві, що потребує цього.
22. Застосування за будь-яким з пп. 19-21, яке відрізняється тим, що ссавець є людиною і введення є системним.
23. Застосування за будь-яким з пп. 18-22, яке відрізняється тим, що порушення вибране з групи, що складається з інсуліннезалежного цукрового діабету (ІНЦД), ожиріння, гіперандрогенії яєчників і гіпертонії.
24. Застосування за п. 23, яке відрізняється тим, що порушення являє собою ожиріння або ІНЦД.
25. Застосування за п. 18, яке відрізняється тим, що антитіло є антитілом, вибраним з групи, що складається з анти-IL-17A, анти-IL-17F, анти-IL-17A/F, анти-IL-17Rc і анти-IL-17RA антитіл.
26. Застосування за п. 25, яке відрізняється тим, що антитіло є моноклональним антитілом.
27. Застосування за п. 26, яке відрізняється тим, що антитіло є химерним, гуманізованим або людським антитілом.
28. Застосування за п. 27, яке відрізняється тим, що антитіло є біспецифічним, мультиспецифічним або антитілом, що має перехресну реактивність.
29. Застосування за п. 25, яке відрізняється тим, що лікарський препарат додатково містить агент для лікування інсулінорезистентності.
30. Застосування за п. 25, яке відрізняється тим, що лікарський препарат знаходиться у формі, придатній для введення окремо або разом з агентом для лікування інсулінорезистентності.
31. Застосування антагоніста IL-17A і/або IL-17F і агента для лікування інсулінорезистентності для виготовлення лікарського препарату для введення в комбінації або окремо для лікування порушення, пов'язаного з інсулінорезистентністю, де антагоніст є антитілом або його антигензв'язувальним фрагментом.
32. Застосування за будь-яким з пп. 29-31, яке відрізняється тим, що агент для лікування інсулінорезистентності є інсуліном, IGF-1 або сульфонілсечовиною.
33. Застосування за п. 32, яке відрізняється тим, що лікарський препарат додатково містить ще один агент, прийнятний для лікування зазначеного порушення, пов'язаного з інсулінорезистентністю.
34. Застосування за п. 32, яке відрізняється тим, що лікарський препарат знаходиться у формі, придатній для введення окремо або разом з додатковим агентом, прийнятним для лікування зазначеного порушення, пов'язаного з інсулінорезистентністю.
35. Застосування антагоніста IL-17A і/або IL-17F, агента для лікування інсулінорезистентності і додаткового агента, прийнятного для лікування зазначеного порушення, пов'язаного з інсулінорезистентністю, для виготовлення лікарського препарату, придатного для введення в комбінації або окремо, для лікування порушення, пов'язаного з інсулінорезистентністю.
36. Застосування за будь-яким з пп. 33-35, яке відрізняється тим, що додатковим агентом є Dickkopf-5 (DKK-5).
37. Застосування за будь-яким з пп. 29-36, яке відрізняється тим, що агент для лікування інсулінорезистентності є присутнім у лікарському препараті в ефективній кількості.
38. Застосування за будь-яким з пп. 33-36, яке відрізняється тим, що додатковий агент присутній у лікарському препараті в ефективній кількості.
39. Застосування набору для лікування порушення, пов'язаного з інсулінорезистентністю, що містить: (а) контейнер, який містить антагоніст IL-17A і/або IL-17F, де антагоніст є антитілом або його антигензв'язувальним фрагментом; і (б) етикетку або інструкцію із введення зазначеного антитіла для лікування зазначеного порушення.
Текст
Реферат: Винахід стосується лікування порушень, пов'язаних з інсулінорезистентністю, зокрема, введенням ефективної кількості антагоніста IL-17A і/або IL-17F, де антагоніст є антитілом або його антигензв’язувальним фрагментом. UA 105384 C2 (12) UA 105384 C2 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Винахід належить до лікування порушень, пов'язаних з інсулінорезистентністю. Зокрема, даний винахід стосується лікування порушень, пов'язаних з інсулінорезистентністю, введенням антагоністів IL-17, наприклад, IL-17A і/або IL-17F, таких як антитіла проти IL-17A і/або IL- 17F і/або IL- 17Rc або фрагменти антитіл. Рівень техніки Сімейство IL-17 Інтерлейкін-17A (IL-17A) є виробленою T-клітинами прозапальною молекулою, що стимулює епітеліальні, ендотеліальні клітини й фібробласти до утворення інших збуджуючих (запальних) цитокінів і хемокінів, включаючи IL-6, IL-8, Г-КСФ і MCP-1 (див. Yao, Z. et al., J. Immunol., 122(12):5483-5486 (1995); Yao, Z. et al., Immunity, 3(6):811-821 (1995); Fossiez, F., et al., J. Exp. Med., 183(6): 2593-2603 (1996); Kennedy, J., et al., J. Interferon Cytokine Res., 16(8):611-7 (1996); Cai, X. Y., et al., Immunol. Lett, 62(l):51-8 (1998); Jovanovic, D.V., et al., J. Immunol., 160(7):3513-21 (1998); Laan, M., et al., J. Immunol., 162(4):2347-52 (1999); Linden, A., et al., Eur Respir J, 15(5):973-7 (2000); і Aggarwal, S. and Gurney, A. L., J Leukoc Biol. 71(1): 1-8 (2002)). IL-17 також виявляє синергічну дію з іншими цитокінами, включаючи TNF-α и IL-1β, на подальшу індукцію експресії хемокінів (Chabaud, M., et al., J. Immunol. 161(1):409-14 (1998)). IL-17A володіє плейотропними біологічними активностями відносно різних типів клітин. IL-17A також здатний індукувати експресію на поверхні клітин ICAM-1, проліферацію T-клітин і ріст та диференціювання попередників клітин CD34+ людини в нейтрофіли. Також показана участь IL17A у метаболізмі кісток, і передбачається, що він відіграє важливу роль у патологічних станах, які характерізуються присутністю активованих T-клітин і продукцією TNF-α, таких як ревматоїдний артрит і розпушення кісткових імплантатів (Van Bezooijen et al., J. Bone Miner. Res., 14: 1513-1521 (1999)). Виявлено, що активовані T-клітини із синовіальної тканини, отриманої від пацієнтів з ревматоїдним артритом, секретують більш високу кількість IL-17A, чим клітини, отримані в здорових індивідуумів або пацієнтів з остеоартритом (Chabaud et al., Arthritis Rheum., 42: 963-970 (1999)). Було висловлене припущення, що цей прозапальний цитокін активно сприяє запаленню синовіальної сумки при ревматоїдному артриті. Крім його прозапальної ролі, IL-17A, очевидно, вносить вклад у патологію ревматоїдного артриту за допомогою ще одного механізму. Наприклад, було показано, що IL-17A індукує експресію мРНК фактора диференціювання остеокластів (ODF) в остеобластах (Kotake et al., J. Clin. Invest., 103: 1345-1352 (1999)). ODF стимулює диференціювання клітин-попередників в остеокласти, клітини, що беруть участь у резорбції кісткової тканини. Тому що рівень IL-17A у синовіальній рідині пацієнтів з ревматоїдним артритом істотно підвищений, вважають, що індуковане IL-17A утворення остеокластів відіграє критичну роль у резорбції кісткової тканини при ревматоїдному артриті. Уважається також, що IL-17A відіграє ключову роль при деяких інших аутоімунних порушеннях, таких як множинний склероз (Matusevicius et al., Mult. Scler., 5: 101-104 (1999); Kurasawa, K., et al., Arthritis Rheu 43(11):2455-63 (2000)) і псоріаз (Teunissen, M. B., et al., J Invest Dermatol 111(4): 645-9 (1998); Albanesi, C., et al., J Invest Dermatol 115(l):81-7 (2000); і Homey, B., et al., J. Immunol. 164(12:6621-32 (2000)). Крім того, було показано, що IL-17A через внутрішньоклітинну передачу сигналу стимулює 2+ надходження в клітину Ca і зниження концентрації цАМФнеорг. в макрофагах людини (Jovanovic et al., J. Immunol., 160:3513 (1998)). Фібробласти, оброблені IL-17A, індукують активацію NFkB (Yao et al., Immunity, 3:811 (1995), Jovanovic et al., вище), у той час, як оброблені їм макрофаги, активують NF-kB і мітоген-активовані протеїнкінази (Shalom-Barek et al., J. Biol. Chem., 273:27467 (1998)). Крім того, IL-17A також має подібність послідовності із цитокіноподібним фактором-7 ссавців, що бере участь у зростанні кісток і хрящів. Іншими білками, з якими поліпептиди IL-17A мають подібність послідовності, є ембріональний родинний фактор інтерлейкіну (EDIRF) і інтерлейкін-20. Відповідно до широкого діапазону ефектів IL-17A виявлено, що рецептори IL-17A на клітинній поверхні широко експресуються в багатьох тканинах і типах клітин (Yao et al., Cytokine, 2:794 (1997)). Хоча амінокислотна послідовність рецептора IL-17A людини (IL-R) (866 амінокислот) передбачає білок з одиночним трансмембранним доменом і довгим, який містить 525 амінокислот, внутрішньоклітинним доменом, послідовність рецептора є унікальною й не має подібності з якими-небудь іншими рецепторами із сімейства рецепторів цитокінів/ростових факторів. Цей факт, а також відсутність подібності самого IL-17A з іншими відомими білками, вказує на те, що IL-17A і його рецептор можуть бути частиною нового сімейства сигнальних білків і рецепторів. Показано, що активність IL-17A опосередкує через його зв'язування з унікальним рецептором на поверхні клітини (позначеним у цьому документі як IL-17R людини), при цьому попередні дослідження показали, що контакт T-клітин з розчинною формою 1 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 поліпептиду рецептора IL-17A інгібував проліферацію T-клітин і продукцію IL-2, індуковані фітогемаглютиніном, конканаваліном А та моноклональними антитілами проти TCR (Yao et al., J. Immunol., 155:5483-5486 (1995)). По суті, є істотний інтерес в ідентифікації й визначенні характеристик нових поліпептидів, що володіють гомологією з відомими рецепторами цитокінів, зокрема, рецепторами IL-17A. У цей час інтерлейкін 17A вважається прототипним членом нового сімейства цитокінів. Великомасштабне секвенування геномів людини й інших хребетних виявило наявність додаткових генів, що кодують білки, що мають явне споріднення з IL-17A, установивши, таким чином, нове сімейство цитокінів. Є, щонайменше, 6 членів сімейства IL-17 у людини й миші, включаючи IL-17A, IL-17B, IL-17C, IL-17D, IL-17E і IL-17F, а також нові рецептори IL-17RH1, IL17RH2, IL-17RH3 і IL-17RH4 (див. WO01/46420, опублікований 28 червня 2001 р.) Показано, що один такий член IL-17 (позначений як IL-17F) зв'язується з рецептором IL-17 людини (IL-17R) (Yao et al., Cytokine, 9(11):794-800 (1997)). Початкове визначення характеристик свідчить, що, подібно IL-17A, деякі із цих ново виявлених молекул мають здатність модулювати імунну функцію. Сильна збуджуюча дія, виявлена для деяких із цих факторів і асоціацій, що виявляються з серйозними захворюваннями людини вказують на те, що ці білки можуть відігравати істотну роль у запальних процесах і можуть надати можливість для терапевтичного втручання. Ген, що кодує IL-17F людини, розташований поруч із геном IL-17A (Hymowitz, S. G., et al., Embo J, 20(19):5332-41 (2001)). IL-17A і IL-17F мають приблизно 44 % ідентичності по амінокислотній послідовності, при цьому інші члени сімейства IL-17 мають більш обмежену ідентичність амінокислотних послідовностей в 15-27 %, що вказує на утворення IL-17A і IL-17F відособленої підгрупи в межах сімейства IL-17 (Starnes, T., et al., J Immunol. 167(8):4137-40 (2001); Aggarwal, S. and Gurney, A. L., J. Leukoc Biol, 71(1):1-8 (2002)). Певно, IL-17F має біологічну дію, схожу з такою IL-17A, і здатну стимулювати продукцію IL-6, IL-8 і Г-КСФ у великої розмаїтості клітин. Подібно IL-17A, він здатний індукувати вивільнення хрящового матриксу й інгібувати синтез нового хрящового матриксу (див. патент США 2002-0177188-A1, опублікований 28 листопада 2002 р.) Таким чином, як і IL-17A, IL-17F потенційно може брати участь у патології запальних порушень. Повідомлялося, що як IL-17A, так і IL-17F індукуються в T-клітинах під дією інтерлейкіну 23 (IL-23) (Aggarwal, S., et al., J. Biol. Chem., 278(3): 1910-4 (2003)). Зокрема, як IL17A, так і IL-17F були виявлені як діючі фактори при прогресуванні й патології різних запальних і аутоімунних захворювань у людини й у моделях захворювань людини в мишей. Дійсно, IL-17A і, у меншому ступені, IL-17F, були виявлені як ефекторні цитокіни, які запускають запальні відповіді й у такий спосіб беруть участь у ряді аутозапальних (аутоімунних) захворювань, включаючи множинний склероз (MS), ревматоїдний артрит (RA) і запальні захворювання кишечнику (IBD). Ця лінія була позначена як Th17, і кількість цих клітин чітко корелює із прогресуванням і ступенем важкості захворювання в моделях аутоімунних захворювань людини в мишей. Хоча участь IL-17A і IL-17F у запальних захворюваннях здається очевидним (див., наприклад, Kolls, J. K., A. Linden. Immunity 21: 467-476 (2004)), клітини-мішені цих цитокінів не були ідентифіковані, зокрема, через те, що не був ідентифікований рецептор IL-17F. IL-17A володіє афінністю до IL-17RA. Амінокислотна послідовність IL-17RA людини є в NCBI GenBank під номером доступу NP_055154.3. На цей момент, щонайменше, чотири додаткових рецептори в сімействі IL-17R були ідентифіковані на основі гомології послідовності у відношенні IL-17RA (IL-17Rhl, IL-17Rc, IL-17RD і IL-17RE), і серед них, як було показано, IL-17Rc фізично взаємодіє з IL-17RA, що вказує на те, що він може бути функціональним компонентом комплексу IL-17R (Toy, D. et al., J. Immunol. 177: 36-39 (2006)). Нещодавно було повідомлено, що IL-17Rc є рецептором як для IL-17A, так і для IL-17F (Presnell, et al., J. Immunol. 179(8):5462-73 (2007)). Запалення й ожиріння Важливим новим внеском у наше розуміння ожиріння є поява концепції про те, що запалення й діабет характеризуються станом хронічного слабкого запалення. Підставою для такої точки зору є те, що при ожирінні з'являються підвищені циркулюючі концентрації деяких маркерів запалення, як прозапальних цитокінів, так і білків гострої фази; такі маркери включають IL-6, систему TNFα, C-реактивний білок (CRP) і гаптоглобін. Однак, не ясна ступінь залучення у термінах області самого запалення, чи є воно системним або місцевим. Інсулінорезистентність, яка визначається як більш слабка, ніж очікувана, біологічна відповідь на дану дозу інсуліну, є звичайним корелятом ожиріння. Дійсно, вважають, що багато патологічних наслідків ожиріння включають інсулінорезистентність. Сюди відносяться гіпертонія, гіперліпідемія й, найбільше важливо, інсуліннезалежний цукровий діабет (ІНЦД). Більшість пацієнтів з ІНЦД страждають ожирінням, і найбільш важливим і раннім компонентом розвитку ІНЦД є інсулінорезистентність (Moller et al., New Eng. J. Med., 325: 938 (1991)). 2 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 Показано, що при інсулінорезистентності розвивається аномалія пост-рецепторних компонентів, на додаток до пригнічування функції рецепторів інсуліну під час початкових стадій цього захворювання (Olefsky et al., in Diabetes Mellitus, Rifkin and Porte, Jr., Eds. (Elsevier Science Publishing Co., Inc., New York, ed. 4, 1990), pp. 121-153). Суть винаходу Даний винахід заснований, щонайменше, частково, на тому факті, що члени сімейства IL-17, і, зокрема, IL-17A і IL-17F, відіграють роль в ожирінні, інсулінорезистентності й інших порушеннях, асоційованих з ожирінням, таких як гіперліпідемія й метаболічний синдром, і що антагоністи IL-17, особливо антагоністи IL-17A і IL-17F, можуть застосовуватися для лікування цих станів. В одному аспекті даний винахід стосується способу лікування у ссавця порушення, пов'язаного з інсулінорезистентністю, що включає введення ссавцеві, що потребує, ефективної кількості антагоніста IL-17A і/або IL-17F. В іншому аспекті даний винахід стосується фармацевтичної композиції, що містить антагоніст IL-17A і/або IL-17F з додаванням фармацевтично прийнятної допоміжної речовини, для лікування порушення, пов'язаного з інсулінорезистентністю. У додатковому аспекті даний винахід належить до застосування антагоніста IL-17A і/або IL17F для лікування порушення, пов'язаного з інсулінорезистентністю. В іншому аспекті даний винахід належить до набору для лікування порушення, пов'язаного з інсулінорезистентністю, зазначеному набору, що містить: (а) контейнер, що містить антагоніст IL-17A і/або IL-17F; і (б) етикетку або інструкцію із введення зазначеного антитіла для лікування зазначеного порушення. У всіх аспектах, в одному з варіантів втілення даного винаходу, порушення обрано із групи, що складається з інсуліннезалежного цукрового діабету (ІНЦД), ожиріння, гіперандрогенії яєчників і гіпертонії. В іншому варіанті втілення даного винаходу, порушення є ІНЦД або ожирінням. У додатковому варіанті втілення, ссавець є людиною і введення є системним. В іншому додатковому варіанті втілення, антагоніст IL-17A і/або IL-17F є антитілом або його фрагментом, таким як антитіло, яке обране із групи, що містить антитіла проти IL-17A, проти IL17F, проти IL-l7A/F, проти IL-17Rc і проти IL-17RA або його фрагмент. Переважно, антитіло є моноклональним антитілом, включаючи химерні, гуманізовані антитіла або антитіла людини, біспецифічні, мультиспецифічні антитіла або антитіла з перехресною реактивністю. В іншому варіанті втілення даного винаходу, спосіб включає введення ефективної кількості агента для лікування інсулінорезистентності, такого як інсулін, IGF-1 або сульфонілсечовина. У додатковому варіанті, спосіб включає введення ефективної кількості додаткового агента, здатного лікувати зазначене порушення, пов'язане з інсулінорезистентністю, такого як Dickkopf5 (Dkk-5) Короткий опис фігур На Фіг. 1 показана нуклеотидна послідовність (ПОСЛ. ID №: 1) кДНК нативної послідовності IL-17A людини. На Фіг. 2 показана амінокислотна послідовність (ПОСЛ. ID №: 2) нативної послідовності IL17A людини, що одержана з послідовності, що кодує, ПОСЛ. ID №: 1, показаної на ФІГ. 1. На Фіг. 3 показана нуклеотидна послідовність (ПОСЛ. ID №: 3) кДНК нативної послідовності IL-17F людини. На Фіг. 4 показана амінокислотна послідовність (ПОСЛ. ID №: 4) нативної послідовності IL17F людини, що одержана з послідовності, що кодує, ПОСЛ. ID №: 3, показаної на ФІГ. 3. На Фіг. 5 показана нуклеотидна послідовність (ПОСЛ. ID №: 5), що кодує нативну послідовність поліпептиду рецептора C IL-17 людини (IL-17Rc), що також відома як клон, позначений "DNA164625-2890". На Фіг. 6 показана амінокислотна послідовність (ПОСЛ. ID №: 6) нативної послідовності поліпептиду IL-17Rc людини (також відомого як рецептор IL-17RH2). Фіг. 7 Планування експерименту дослідження моделі дієти з високим вмістом жирів (HFD) з використанням мишей IL-17Rc KO. Фіг. 8 Результати на 8 тижні дослідження моделі дієти з високим вмістом жирів (HFD) з використанням мишей IL-17Rc KO. Фіг. 9A і 9B Рівні глюкози в мишей дикого типу й IL-17Rc KO у контрольній групі й групі, з дієтою з високим вмістом жирів. Миші IL-17Rc KO стійкі до інсулінорезистентності, індукованою дієтою з високим вмістом жирів (HFD). Фіг. 10 Площа під фармакокінетичною кривою на 10 тижні. 3 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 11 Результати по масі тіла. Фіг. 12 Ефект моноклональних антитіл (mAb) проти IL-17 і проти IL-17F на модель інсулінорезистентності при дієті з високим вмістом жирів. Фіг. 13 Проба на переносимість глюкози (GTT) у період після 9 тижнів введення доз. Фіг. 14 Ектопічна експресія IL-17 A шляхом ін'єкції плазмідної ДНК із наступною пробою на переносимість глюкози (GTT). Ефект надекспресії IL-17 на статус інсулінорезистентності, оцінений із застосуванням GTT. Детальний опис винаходу A. Визначення Термін "IL-17" в основному застосовується для позначення членів сімейства IL-17, включаючи IL-17A, IL-17, IL-17B, IL-17C, IL-17D, IL-17E, IL-17F і IL-17A/F. Переважними IL-17 у цьому документі є IL-17A, IL-17F і IL-17A/F. "Поліпептид з нативною послідовністю IL-17" включає поліпептид, що має таку саму амінокислотну послідовність, що й відповідний поліпептид IL-17, отриманий із природного джерела. Такі поліпептиди з нативною послідовністю IL-17 можуть бути виділені із природних джерел або можуть бути отримані рекомбінантним або синтетичними способами. Термін "поліпептид з нативною послідовністю IL-17" явним чином включає природного походження вкорочені або ті, що секретують форми специфічного поліпептиду IL-17 (наприклад, послідовність позаклітинного домена), варіантні форми природного походження (наприклад, форми, що утворюються в результаті альтернативного сплайсингу) і алельні варіанти природного походження поліпептиду. У різних втіленнях даного винаходу, поліпептиди з нативною послідовністю IL-17, описані в цьому документі, є зрілими або повнорозмірними поліпептидами з нативними послідовностями IL-17A, IL-17F і IL-17A/F людини, що містять повнорозмірні амінокислотні послідовності, які приведені на фігурах 2 і 4 (ПОСЛ. ID №№: 2 і 4). Стартові й стоп-кодони зазначені на фігурах жирним шрифтом і підкресленням. "Поліпептид з нативною послідовністю IL-17Rc" або "нативна послідовність IL-17Rc" позначає поліпептид, що має ту ж амінокислотну послідовність, що й відповідний поліпептид IL17Rc, отриманий із природного джерела. Такі поліпептиди з нативною послідовністю IL-17Rc можуть бути виділені із природних джерел або можуть бути отримані рекомбінантним або синтетичними способами. Термін "поліпептид з нативною послідовністю IL-17Rc" явним чином включає вкорочені або ті, що секретують форми природного походження специфічного поліпептиду IL-17Rc, природного походження варіантні форми (наприклад, форми, що утворяться в результаті альтернативного сплайсингу) і природного походження алельні варіанти поліпептиду. У різних втіленнях даного винаходу, поліпептид з нативною послідовністю IL-17Rc, описаний у цьому документі, є повнорозмірними IL-17Rc людини з нативною послідовністю, що містить повнорозмірну амінокислоту, яка приведена на Фігурі 6 (ПОСЛ. ID №: 6). "Ізольований", при використанні для опису різних поліпептидів, розкритих у цьому документі, означає поліпептид, що був ідентифікований і виділений і/або витягнутий з компонента його природного оточення. Забруднюючими компонентами його природного оточення є матеріали, які в типовому випадку перешкоджали б діагностичним або терапевтичним застосуванням поліпептиду, і які можуть включати ферменти, гормони й інші розчинені речовини білкової або небілкової природи. У кращому варіанті, поліпептид буде очищений (1) до ступеня, достатнього для визначення, щонайменше, 15 залишків N-кінцевої або внутрішньої амінокислотної послідовності із застосуванням секвенатору з обертовою склянкою, або (2) до гомогенності в ДСН-ПААГ в умовах, що не відновлюють або відновлюють з використанням фарбування кумасси блакитним або, переважно, срібним. Ізольований поліпептид включає поліпептид in situ у рекомбінантних клітинах, з моменту, коли, щонайменше, один компонент природного оточення поліпептиду IL-17 буде відсутній. Звичайно, однак, ізольований поліпептид буде готуватися за допомогою, щонайменше, одного етапу очищення. При використанні в цьому документі, "ожиріння" позначає стан, при якому ссавець має 2 індекс маси тіла (BMI), вирахований як маса (у кг) на ріст (у метрах), рівний, щонайменше, 25,9. Прийнято вважати, що індивідууми з нормальною масою мають BMI від 19,9 до менш ніж 25,9. Ожиріння, асоційоване з інсулінорезистентністю, явним чином підпадає під це визначення. "Інсулінорезистентність" або "порушення, пов'язане з інсулінорезистентністю", або "активність, пов'язана з інсулінорезистентністю" є захворюванням, станом або порушенням, що виникає в результаті порушення нормальної метаболічної відповіді периферичних тканин (нечутливості) на дію екзогенного інсуліну, тобто, цей стан, при якому присутність інсуліну приводить до більш слабкій, чим у нормі, біологічній відповіді. У клінічних термінах, інсулінорезистентність є, коли нормальний або підвищений рівні глюкози в крові зберігаються в 4 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 присутності нормального або підвищеного рівнів інсуліну. Вона являє собою, по суті, інгібування синтезу глікогену, при якому або базальний, або стимульований інсуліном синтез глікогену, або оба цих типа, зменшені до рівнів нижче норми. Інсулінорезистентність відіграє основну роль при діабеті 2 типу, як продемонстровано тим фактом, що гіперглікемія, що є присутня при діабеті 2 типу, іноді може бути звернена за допомогою дієти або зниження маси, що достатньо, мабуть, для відновлення чутливості периферичних тканин до інсуліну. Термін включає аномальну переносимість глюкози, а також багато порушень, таких як ожиріння, цукровий діабет, гіперандрогенія яєчників і гіпертонія, при яких інсулінорезистентність відіграє ключову роль. "Цукровий діабет" позначає стан хронічної гіперглікемії, тобто, надлишку цукру в крові, як наслідок відносної або повної недостатності дії інсуліну. Виділяють три основних типи цукрового діабету, I тип або інсулінзалежний цукровий діабет (ІЗЦД), II тип або інсуліннезалежний цукровий діабет (ІНЦД) і інсулінорезистентність типу A, хоча тип A зустрічається відносно рідко. Пацієнти з діабетом I типу або II типу можуть набути нечутливість до дії екзогенного інсуліну шляхом різних механізмів. Інсулінорезистентність типу A виникає в результаті або мутацій у гені рецептора інсуліну, або порушень у пост-рецепторних областях дії, критичних для метаболізму глюкози. Хворі діабетом суб'єкти можуть бути легко ідентифіковані лікарем, і для них характерна гіперглікемія, порушення толерантності до глюкози, глікозильований гемоглобін і, у деяких випадках, кетоацидоз, асоційований з ушкодженням або захворюванням. "Інсуліннезалежний цукровий діабет" або "ІНЦД" позначає діабет II типу. Пацієнти з ІНЦД мають аномально високу концентрацію глюкози в крові натще й уповільнене поглинання глюкози клітинами після споживання їжі або після діагностичного тесту, відомого як проба на переносимість глюкози. ІНЦД діагностують на підставі визнаних критеріїв (American Diabetes Association, Physician's Guide to Insulin-Dependent (Type I) Diabetes, 1988; American Diabetes Association, Physician's Guide to Non-Insulin-Dependent (Type II) Diabetes, 1988). Симптоми й ускладнення діабету, які будуть піддаватися лікуванню у якості порушення, при використанні в цьому документі, включають гіперглікемію, незадовільний глікемічний контроль, кетоацидоз, інсулінорезистентність, підвищені рівні гормону росту, підвищені рівні глікозильованого гемоглобіну й підвищений вміст кінцевих продуктів глікозування (AGE), ранкову гіперглікемію, незадовільний ліпідний профіль, захворювання судин (наприклад, атеросклероз), захворювання капілярів, порушення сітківки (наприклад, проліферативну діабетичну ретинопатію), порушення функції нирок, нейропатію, ускладнення при вагітності (наприклад, передчасні пологи й пороки розвитку) тощо. У визначенні лікування включені такі кінцеві крапки, як, наприклад, підвищення чутливості до інсуліну, зниження дозування інсуліну при збереженні глікемічного контролю, зниження рівня HbAlc, поліпшення глікемічного контролю, ослаблення судинних, ниркових, невральних, ретинальних і інших діабетичних ускладнень, запобігання або зниження ранкової гіперглікемії, поліпшений ліпідний профіль, зниження ускладнень при вагітності й зниження кетоацидозу. "Терапевтична композиція" або "композиція", при використанні в цьому документі, визначається як композиція, що містить Dkk-5 і фармацевтично прийнятний носій, такий як вода, неорганічні сполуки, білки й інші допоміжні речовини, відомі фахівцям у даній галузі. Термін "ссавець" для цілей лікування належить до будь-якої тварини, яка класифікується як ссавець, включаючи, у якості не обмежуючих прикладів, людину, гризунів, тварин, які використовують у спорті, що утримуються в зоопарках і будинках, і одомашнених або сільськогосподарських тварин, таких як собаки, кішки, велика рогата худоба, вівці, свині, коні й не людиноподібні примати, такі як мавпи. Кращими гризунами є миші або пацюки. Переважно, ссавцем є людина, також названа у цьому документі пацієнтом. При використанні в цьому документі, "лікування" позначає терапію й догляд за ссавцем з метою боротьби з кожним із захворювань або станів, до лікування яких належить даний винахід, включаючи, як необмежуючі приклади, інсулінорезистентність, цукровий діабет, гіперінсулінемію, гіпоінсулінемію або ожиріння, і включає введення лікарського засобу для профілактики виникнення симптомів або ускладнень, зм'якшення симптомів або ускладнень, або усунення цільових захворювань або станів. Для цілей даного винаходу, корисні або бажані клінічні результати "лікування" для зниження інсулінорезистентності включають, як необмежуючі приклади, зм'якшення симптомів, асоційованих з інсулінорезистентністю, зменшення ступеня важкості симптомів інсулінорезистентності, стабілізацію (тобто, відсутність погіршення) симптомів інсулінорезистентності (наприклад, зниження потреби в інсуліні), підвищення чутливості до інсуліну й/або секреції інсуліну для запобігання ушкодження клітин острівців, і затримку або вповільнення прогресування інсулінорезистентності, наприклад, прогресування діабету. Відносно ожиріння, "лікування" звичайно позначає зниження BMI ссавця до менш, ніж 5 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 приблизно 25,9 і підтримка цієї маси протягом як мінімум 6 місяців. Придатність лікування призводить у результаті до зниження споживання ссавцем їжі або калорій. Крім того, у цьому контексті лікування належить до профілактики виникнення ожиріння, якщо лікування проводиться до появи стану ожиріння. Лікування включає інгібування й/або повне придушення ліпогенезу в ссавців з ожирінням, тобто, надлишкового накопичування ліпідів у жирових клітинах, що є однією з головних характеристик ожиріння в людини й тварин, а також зниження загальної маси тіла. Ті, хто "має потребу в лікуванні", включають ссавців, у яких уже є порушення, а також тих, хто має схильність до цих порушень, у тому числі тих, у кого порушення варто запобігти. "Агент для лікування інсулінорезистентності" - це агент, відмінний від антагоніста IL-17, що застосовують для лікування інсулінорезистентності, такий як, наприклад, Dickkopf-5 (Dkk-5) (див., наприклад, публікацію заявки на патент США № 2005/0170440), і гіпоглікемічні агенти. Приклади таких лікарських агентів включають інсулін (один або кілька різних інсулінів); міметики інсуліну, такі як низькомолекулярний інсулін, наприклад, L-783,281; аналоги інсуліну (наприклад, інсулін HUMALOG® (Eli Lilly Co.)), інсулін LysB28, інсулін ProB29 або інсулін AspB21 або такі, які описані, наприклад, у патентах США №№ 5149777 і 5514646), або їх фізіологічно активні фрагменти; родинні інсуліну пептиди ( C-пептид, GLP-1, інсуліноподібний фактор росту-I (IGE-1) або комплекс IGF-1/IGFBP-3) або їхні аналоги або фрагменти; ергосет; прамлінтид; лептін; BAY27-9955; T-1095; антагоністи інгібітору тирозинкінази рецептора інсуліну; антагоністи функції TNF- α; агент вивільнення гормону росту; амілін або антитіла до аміліну; сенсибілізуючий до інсуліну агент, такий як сполуки сімейства глітазону, включаючи такі, описані в патенті США № 5753681, такі як троглітазон, піоглітазон, енглітазон і родинні сполуки; ліналоол окремо або з вітаміном Є (патент США № 6187333); підсилювачі секреції інсуліну, такі як натеглінід (AY-4166), кальцію (2S)-2-бензил-3-(цис-гексагідро-2-ізоіндолінилкарбонил)пропіоната дигідрат (мітиглінід, KAD-1229) і репаглінід; лікарські засоби на основі сульфонілсечовини, наприклад, ацетогексамід, хлорпропамід, толазамід, толбутамід, гліклопірамід та його аммонієва сіль, глібенкламід, глібомурид, гліклазид, 1-бутил-3-метанилілсечовина, карбутамід, гліпізид, гліквідон, глізоксепід, глібутіазол, глібузол, глігексамід, глімідин, гліпінамід, фенбутамід, толцикламід, глімепірид і т. п.; бігуаніди (такі як фенформін, метформін, буформін и т. п.); інгібітори α-глюкозидази (такі як акарбоза, воглібоза, міглітол, еміглітат и т. п.) і такі нетипові способи лікування, як трансплантація підшлункової залози або аутоімунні реагенти. "Агент для зниження маси" позначає молекулу, корисну для лікування або профілактики ожиріння. Такі молекули включають, наприклад, гормони (катехоламіни, глюкагон, АКТГ і гормон росту в сполученні з IGF-1); білок Ob; клофібрат; галогенат; цинхокаїн; хлорпромазін; лікарські засоби, що пригнічують апетит, які діють на норадренергічні нейротрансміттери, такі як мазіндол і похідні фенетіламіну, наприклад, фенілпропаноламін, діетилпропіон, фентермін, фендіметразін, бензфетамін, амфетамін, метамфетамін і фенметразин; лікарські засоби, що діють на серотонінові нейротрансміттери, такі як фенфторамін, триптофан, 5гідрокситриптофан, флуоксетин і сертралін; лікарські засоби центральної дії, такі як налоксон, нейропептид-Y, галанін, кортикотропін - вивільнюючий гормон і холецистокінін; холінергічні агоністи, такі як піридостигмін; сфінголіпід, такі як лізосфінголіпід або його похідні; термогенні лікарські засоби, такі як тіреоїдний гормон; ефедрін; бета-адренергічні агоністи; ліки, що впливають на шлунково-кишковий тракт, такі як інгібітори ферментів, наприклад, тетрагідроліпостатин, неперетравлювані продукти харчування, такі як поліефір сахарози, і інгібітори спорожнювання шлунка, такі як треохлоролимонна кислота або її похідні; бетаадренергічні агоністи, такі як ізопротеренол і йохімбін; амінофіллін для посилення ефектів йохімбіну, подібних бета-адренергічним, ліки, що блокують α2-адренергічну передачу, таке як клонідин окремо або в сполученні з пептидом, що вивільняє гормон росту; ліки, що перешкоджають поглинанню в кишечнику, такі як бігуанідини, наприклад, метформін і фенформін; об'ємні наповнювачі, такі як метилцелюлоза; лікарські засоби, що блокують метаболізм, такі як гідроксицитрат; прогестерон; агоністи холецистокініну; малі молекули, мімікруючи під кетокислоти; агоністи кортикотропін - вивільнюючого гормону; які одержують з спориньї, сполуки, що інгібує пролактин для зниження жирових запасів тіла (патент США № 4783469, виданий 8 листопада 1988 р.); бета-3-агоністи; бромокріптин; антагоністи опіоїдних пептидів; антагоністи нейропептиду Y; антагоністи рецепторів глюкокортикоїдів; агоністи гормону росту; їхньої комбінації й т.д. При використанні в цьому документі, "інсулін" належить до будь-якої субстанції, що має дію інсуліну, і представленої, наприклад, інсуліном тваринного походження, екстрагованим з підшлункової залози бика або свині, напівсинтетичним інсуліном людини, що синтезується ферментативно з інсуліну, екстрагованого з підшлункової залози свині, і інсуліном людини, 6 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 синтезованим із застосуванням методик генної інженерії, звичайно із застосуванням E. coli або дріжджів і т.д. Додатково, інсулін може включати комплекс інсуліну із цинком, що містить приблизно від 0,45 до 0,9 мас. % цинку, протамін-інсулін-цинк, одержуваний із цинку хлориду, комплекс протаміну сульфату й інсуліну й т.д. Інсулін може бути представлений у формі його фрагментів або похідних, наприклад, INS-1. Інсулін також може включати інсулінподібні субстанції, такі як L83281 і агоністи інсуліну. Тому що інсулін доступний у різноманітних видах, таких як супер-негайної дії, негайної дії, бімодальної дії, проміжної дії, тривалої дії й т.д., ці види можуть бути належним чином обрані відповідно до стану пацієнта. "Терапевтична композиція" при використанні в цьому документі, визначається як композиція, що містить антагоніст IL-17 (включаючи антагоністи IL-17A і IL-17F) і фармацевтично прийнятний носій, такий як вода, неорганічні сполуки, білки й інші допоміжні речовини, відомі фахівцям у даній галузі. Мається на увазі, що вираження "антагоніст", "антагоніст стосовно IL-17 (A і/або F)", "антагоніст IL-17 (A і/або F)" і їм подібні в рамках даного винаходу включають будь-яку молекулу, що перешкоджає функції IL-17, такого як IL-17A і/або IL-17F, або блокує, або нейтралізує відповідну активність IL-17 (такого як IL-17A і/або F) будь-яким способом, залежно від показань до лікування. Вона може запобігати взаємодії між IL-17 (включаючи IL-17 і IL-17F) і одним або декількома його рецепторами. Такі агенти здійснюють цю дію різними способами. Наприклад, клас антагоністів, які "нейтралізують" активність IL-17, буде зв'язуватися з IL-17 або з рецептором IL-17 з достатньою афінністю й специфічністю, створюючи перешкоду для дії IL17, як описано нижче. Антитіло, "яке зв'язується" з IL-17 або з рецептором IL-17 (наприклад, IL17Rc), - це антитіло, що здатне зв'язатися із цим антигеном з достатньої афінністю, таким чином, що антитіло є корисним у якості терапевтичного агента для цільового впливу на клітини, експресуючі IL-17 або рецептор IL-17. Термін "антагоніст IL-17" застосовується для позначення кожного з антагоністів IL-17A, IL-17F і IL-17A/F. До складу цієї групи антагоністів входять, наприклад, антитіла, вироблені проти IL-17 або його частин, реактивні у відношенні IL-17, або рецептора IL-17 або їхніх частин, у тому числі антитіла проти IL-17A і/або IL-17F і IL-17Rc. Термін також включає будь-який агент, що буде перешкоджати зверхпродукції IL-17A і/або IL-17F або робити антагоністичну дію відносно рецептора, щонайменше, одного IL-17 (наприклад, IL-17A і/або IL-17F), такого як IL-17Rc. Такі антагоністи можуть бути представлені у формі химерних гібридів, корисних для сполучення функції агента з білком-носієм для підвищення періоду напіввиведення із сироватки терапевтичного агента або для забезпечення міжвидової переносимості. Отже, приклади таких антагоністів включають біоорганічні молекули (наприклад, пептидоміметики), антитіла, білки, пептиди, глікопротеїни, глікопептиди, гліколіпіди, полісахариди, олігосахариди, нуклеїнові кислоти, фармакологічні агенти і їхні метаболіти, транскрипційні й трансляційні регуляторні послідовності тощо. У кращому варіанті, антагоніст представлений антитілом, що має необхідні властивості зв'язування з IL-17A і/або IL-17F і що запобігає його взаємодії з рецептором, переважно, з IL-17Rc. Термін "антитіло" використовується в самому широкому вмісті й певно включає, наприклад, одиничні моноклональні антитіла проти IL-17A/F або проти IL17A, або проти IL-17F (включаючи агоністи, антагоністи й нейтралізуючі антитіла), композиції відповідних антитіл з поліепітопною специфічністю, поліклональні антитіла, одноланцюгові антитіла й фрагменти антитіл (див. нижче), якщо вони проявляють необхідну біологічну або імунологічну активність. Основна одиниця 4-ланцюгового антитіла являє собою гетеротетрамірний глікопротеїн, що складається із двох ідентичних легких (L) ланцюгів і двох ідентичних важких (H) ланцюгів (антитіло IgM складається з 5 основних гетеротетрамірних одиниць і додаткового поліпептиду, який має назву J-ланцюга, і, таким чином, містить 10 антигензвя'зуючих сайтів, у той же час секретуючі антитіла IgA можуть полімерізовуватися з утворенням полівалентних комплексів, що складаються з 2-5 основних 4-ланцюгових одиниць і J-ланцюга). У випадку IgG, 4-ланцюгова одиниця звичайно має масу близько 150000 дальтон. Кожний L-ланцюг з'єднаний з H-ланцюгом одним ковалентним дисульфідним зв'язком, а два H-ланцюги з'єднані один з одним одною або декількома дисульфідними зв'язками, залежно від ізотипу H-ланцюга. Кожний H- і L-ланцюг також має рівномірно розташовані внутриланцюгові дисульфідні містки. У кожного H-ланцюга на N-кінці є варіабельність домен (VH), за яким ідуть три консервативних домена (CH) для кожного з α і γ ланцюгів і чотири CH домена у випадку μ і ε ізотипів. У кожного L-ланцюга на N-кінці є варіабельність домен (VL), за яким іде консервативний домен (CL) на іншому її кінці. VL розташований поруч із VH, а CL розташований поруч із першим консервативним доменом важкого ланцюга (CH1). Уважається, що окремі амінокислотні залишки утворюють поверхню взаємодії між варіабельними доменами легкого ланцюга й важкого ланцюга. Об'єднання в пару 7 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 VH і VL призводить до формування одиничного антигензвя'зуючого сайту. Структура й властивості різних класів антитіл представлені, наприклад, в Basic and Clinical Immunology, 8th edition, Daniel P. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, Conn., 1994, сторінка 71 і Розділ 6. L-ланцюг будь-якого виду хребетних тварин може бути віднесений до одного із двох типів, що чітко розрізняються, що називають каппа й лямбда, виходячи з амінокислотних послідовностей їх консервативних доменів. Залежно від амінокислотної послідовності консервативного домену їхніх важких ланцюгів (CH), імуноглобуліни можуть бути віднесені до різних класів або ізотипам. Виділяють п'ять класів імуноглобулінів: IgA, IgD, IgE, IgG, і IgM, які мають важкі ланцюги, позначені α, δ, ε, γ і μ, відповідно. Класи γ і α далі підрозділяються на підкласи на підставі щодо незначних розходжень у послідовності CH і функції, наприклад, у людини експресуються наступні підкласи: IgGl, IgG2, IgG3, IgG4, IgAl і IgA2. Термін "варіабельність" позначає той факт, що певні сегменти варіабельних доменів істотно різняться по послідовності між антитілами. V-домен опосередковує зв'язування антигену й визначає специфічність конкретного антитіла до його конкретного антигену. Однак варіабельність розподілена нерівномірно по всій довжині 110-амінокислотних варіабельних доменів. На противагу цьому, V-ділянки складаються з відносно інваріантних ділянок, що називають каркасними ділянками (FR) довжиною 15-30 амінокислот, розділених більше короткими ділянками з підвищеною варіабельністю, що називають "гіперваріабельними ділянками", які мають довжину 9-12 амінокислот кожний. Варіабельні домени нативних важких і легких ланцюгів складаються кожний із чотирьох FR, в основному тих, що має конфігурацію бета-листа, з'єднаних трьома гіперваріабельними ділянками, які утворюють петлі, що з'єднують і, у деяких випадках, що утворюють частину структури бета-листа. Гіперваріабельні ділянки в кожному ланцюзі тісно зближені один з одним за допомогою FR і, разом з гіперваріабельними ділянками іншого ланцюга, беруть участь у формуванні антигензвя'зуючого сайту антитіл (див. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Консервативні домени не залучені безпосередньо у зв'язування антитіла з антигеном, але виконують різні ефекторні функції, такі як участь антитіла в антитілозалежній клітково-опосредкованій цитотоксичності (АЗКЦ). Термін "гіперваріабельна ділянка", при використанні в цьому документі, належить до амінокислотних залишків антитіла, які відповідають за зв'язування антигену. Гіперваріабельна ділянка звичайно містить амінокислотні залишки з "ділянки, що визначає комплементарність" або "CDR" (наприклад, приблизно в районі залишків 24-34 (L1), 50-56 (L2) і 89-97 (L3) у складі VL, і приблизно в районі 1-35 (H1), 50-65 (H2) і 95-102 (H3) у складі VH; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)) і/або залишки з "гіперваріабельної петлі" (наприклад, залишки 26-32 (L1), 50-52 (L2) і 91-96 (L3) у складі VL, і 26-32 (H1), 53-55 (H2) і 96-101 (H3) у складі VH; Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). Термін "моноклональне антитіло", при використанні в цьому документі, означає антитіло, отримане з популяції в істотній мірі однорідних антитіл, тобто, індивідуальні антитіла, що становлять популяцію, є ідентичними, за винятком можливих мутацій природного походження, які можуть бути присутні у невеликих кількостях. Моноклональні антитіла високо специфічні, тому що виробляються проти одиничного антигенного сайту. Додатково, на відміну від препаратів поліклональних антитіл, які містять різні антитіла, вироблені проти різних детермінант (епітопів), кожне моноклональне антитіло вироблене проти одиничної детермінанти на антигені. На додаток до їхньої специфічності, моноклональні антитіла мають перевагу в тому, що вони можуть бути синтезовані без домішки інших антитіл. Таке моноклональне антитіло звичайно включає антитіло, що містить гіперваріабельну ділянку, що зв'язується з мішенню, при цьому антитіло було отримано способом, що включає відбір антитіл з безлічі антитіл. Наприклад, спосіб відбору може бути відбором унікального клону з безлічі клонів, таких як пул губридомних клонів, фагових клонів або клонів з рекомбінантною ДНК. При цьому варто розуміти, що відібране антитіло може далі змінюватися, наприклад, для поліпшення афінності до мішені, для гуманізування антитіла, для поліпшення його продукції в культурі клітин, для зниження його імуногенності in vivo, для створення мультиспецифічного антитіла й т.д., і що антитіло, що містить змінену послідовність гіперваріабельної ділянки, також є моноклональним антитілом по даному винаході. На додаток до їхньої специфічності, препарати моноклональних антитіл мають перевагу в тому, що вони звичайно не містять домішки інших імуноглобулінів. Визначення "моноклональний" указує на таку властивість антитіла, що воно було отримано з в істотної міри однорідної популяції антитіл, і не повинне витлумачуватися як вимога до одержання антитіла яким-небудь певним способом. Наприклад, моноклональні антитіла, які 8 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 будуть застосовуватися відповідно до даного винаходу, можуть бути отримані за допомогою різних способів, включаючи гібридомний метод (наприклад, Kohler et al., Nature, 256:495 (1975); Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., в: Monoclonal Antibodies and T-Cell Hybridomas 563-681, (Elsevier, N.Y., 1981), методи рекомбінантної ДНК (див., наприклад, патент США № 4816567), методики фагового дисплею (див., наприклад, Clackson et al., Nature, 352:624-628 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991); Sidhu et al., J. Mol. Biol. 338(2):299-310 (2004); Lee et al., J.Mol.Biol.340(5): 1073-1093 (2004); Fellouse, Proc. Nat. Acad. Sci. USA 101(34): 12467-12472 (2004); і Lee et al. J. Immunol. Methods 284(1-2): 119-132 (2004) і методики для одержання антитіл людини або антитіл, подібних до антитіл людини, із тварин, які містять частини або цілі імуноглобулінові локуси людини або гени, що кодують послідовності імуноглобулінів людини (див., наприклад, W098/24893, WO/9634096, WO/9633735 і WO/91 10741, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggemann et al., Year in Immuno., 7:33 (1993); патенти США №№ 5545806, 5569825, 5591669 (усі належать GenPharm); 5545807; WO 97/17852, патенти США №№ 5545807; 5545806; 5569825; 5625126; 5633425; і 5661016, і Marks et al., Bio/Technology, 10: 779-783 (1992); Lonberg et al., Nature, 368: 856-859 (1994); Morrison, Nature, 368: 812-813 (1994); Fishwild et al., Nature Biotechnology, 14: 845-851 (1996); Neuberger, Nature Biotechnology, 14: 826 (1996); і Lonberg and Huszar, Intern. Rev. Immunol., 13: 65-93 (1995). Моноклональні антитіла в цьому документі включають "химерні" антитіла, у яких частина важкого й/або легкого ланцюга ідентична або гомологічна відповідним послідовностям в антитілах, отриманих від конкретного виду або приналежних до конкретного класу або підкласу антитіл, при цьому інша частина ланцюга(їй) ідентична або гомологічна відповідним послідовностям в антитілах,отриманих від іншого виду або приналежних до іншого класу або підкласу антитіл, а також фрагменти таких антитіл, якщо вони володіють необхідною біологічною активністю (див. патент США № 4816567; і Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851 6855 (1984)). Химерні антитіла, розглянуті в цьому документі, включають "приматизовані" антитіла, які містять антигензвя'зуючі послідовності варіабельних доменів, отриманих із приматів, відмінних від людини (наприклад, мавп старого світу, людиноподібних мавп і т.д.), і послідовності консервативних ділянок людини. "Інтактним" антитілом є антитіло, що містить антигензвя'зуючий сайт, а також CL і, щонайменше, консервативні домени важкого ланцюга CH1, CH2 і CH3. Консервативні домени можуть бути консервативними доменами з нативною послідовністю (наприклад, консервативними доменами з нативною послідовністю людини) або їхніми варіантами амінокислотної послідовності. Переважно, інтактне антитіло володіє однією або декількома ефекторними функціями. "Фрагменти антитіла" містять частину інтактного антитіла, переважно антигензвя'зуючу або варіабельну ділянку інтактного антитіла. Приклади фрагментів антитіл включають фрагменти Fab, Fab', F(ab')2 і Fv; діатіла; лінійні антитіла (див. патент США № 5641870, Приклад 2; Zapata et al., Protein Eng. 8(10): 1057-1062 [1995]); молекули одноланцюгових антитіл; і мультиспецифічні антитіла, утворені із фрагментів антитіл. У кращому варіанті втілення, фрагмент є "функціональним", тобто якісно зберігає здатність відповідного інтактного антитіла зв'язуватися із цільовими поліпептидами IL-17A і IL-17F і, якщо інтактне антитіло також інгібує біологічну активність або функцію IL-17A/F, також якісно зберігає таке інгібуючу властивість. Якісне збереження означає, що зберігається така ж сама активність, але ступінь афінності зв'язування й/або активності може відрізнятися. Розщеплення антитіл папаїном призводить до утворення двох ідентичних антигензвя'зуючих фрагментів, що мають назву "Fab"-фрагменти, і залишкового "Fc"-фрагменту, чиє позначення показує його здатність легко кристалізуватися. Fab-Фрагмент складається із цілого L-ланцюга, з'єднаного з доменом варіабельної ділянки H-ланцюга (VH), і першого консервативного домена одного важкого ланцюга (CH1). Кожний Fab-фрагмент моновалентний стосовно зв'язування антигену, тобто він має одиничний антигензвя'зуючий сайт. Обробка антитіла пепсіном дає одиночний великий F(ab')2-фрагмент, що приблизно відповідає двом зшитим дисульфідним зв'язком Fab-фрагментам, що мають бівалентну антигензвя'зуючу активність, і зберігає здатність поперечної зшивки антигену. Fab'-фрагменти відрізняються від Fab-фрагментів наявністю декількох додаткових залишків на карбоксильному кінці домену CH1, у тому числі одного або декількох цистеїнів із шарнірної ділянки антитіла. Fab'-SH у цьому документі позначає Fab', у якому залишок (залишки) цистеїну консервативних доменів несуть вільну тіольну групу. Фрагменти антитіл F(ab')2 спочатку одержували як пари Fab'-фрагментів, які з'єднані між собою цистеїнами шарнірної області. Також відомі інші способи хімічної зшивки 9 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 фрагментів антитіл. Fc-Фрагмент містить карбокси-кінцеві частини обох H-ланцюгів, з'єднані разом дисульфідними зв'язками. Ефекторні функції антитіл визначаються послідовностями в ділянці Fc, і ця ділянка також є частиною, яка пізнається рецепторами Fc (FcR), виявленими на певних типах клітин. "Fv" - це мінімальний фрагмент антитіла, що містить повний сайт дізнавання й зв'язування антигену. Цей фрагмент складається з димеру варіабельних ділянок доменів одного важкого й одного легкого ланцюгів, що перебувають у міцній нековалентній взаємодії. У результаті фолдінгу цих двох доменів утворюються шість гіперваріабельних петель (по 3 петлі з H- і Lланцюга), які надають амінокислотні залишки для зв'язування антигену й забезпечують антитілу специфічність зв'язування антигену. Однак навіть одиничний варіабельний домен (або половина Fv, що містить тільки три CDR, специфічні до антигену) має здатність дізнаватися й зв'язувати антиген, хоча й з більше низькою афінністю, чим повний сайт зв'язування. "Одноланцюгові Fv", також скорочено позначувані "sFv" або "scFv", - це фрагменти антитіл, які містять домени VH і VL антитіл, з'єднані в один поліпептидний ланцюг. Переважно, поліпептид sFv додатково містить поліпептидний лінкер між доменами VH і VL, що дозволяє sFv утворювати необхідну для зв'язування антигену структуру. Огляд по sFv див. в Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Borrebaeck 1995, нижче. Термін "діатіла" позначає малі фрагменти антитіла, приготовлені шляхом конструювання sFv-фрагментів (див. попередній параграф) з короткими лінкерами (близько 5-10 залишків) між доменами VH і VL таким чином, що досягається міжланцюгове, але не внутриланцюгове, спарювання V-доменів, що дає в результаті бівалентний фрагмент, тобто фрагмент із двома антигензвя'зуючими сайтами. Біспецифічні діатіла є гетеродимерами двох "перехресних" sFvфрагментів, у яких домени VH і VL двох антитіл присутні на різних поліпептидних ланцюгах. Діатіла більш докладно описані, наприклад, в EP 404,097; WO 93/11161; і Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993). "Гуманізовані" форми антитіл, що належать не людині (наприклад, гризунам), - це химерні антитіла, які містять мінімальну послідовність, що має походження з антитілами, що не належать людині. У більшості випадків, гуманізовані антитіла є імуноглобулінами людини (реципієнтне антитіло), у яких залишки з гіперваріабельної ділянки реципієнта замінені на залишки з гіперваріабельної ділянки виду, відмінного від людини (донорне антитіло), такого як миша, пацюк, кролик або відмінні від людини примати, що мають необхідну специфічність, афінність і здатність антитіла. У деяких випадках, залишки каркасної ділянки (FR) імуноглобуліну людини замінюють відповідними залишками з виду, відмінного від людини. Додатково, гуманізовані антитіла можуть містити залишки, які не виявлені в реципієнтному антитілі або в донорному антитілі. Ці модифікації роблять для додаткового поліпшення робочих характеристик антитіла. У цілому, гуманізоване антитіло буде містити, в істотній мірі, усе з, щонайменше, одного, а в типовому випадку двох, варіабельних доменів, у яких всі або в істотній мірі всі гіперваріабельні петлі відповідають таким імуноглобулінам, що не належить людині, і всі або в істотній мері всі FR є такими з послідовністю імуноглобуліну людини. Гуманізоване антитіло необов'язково також буде містити, щонайменше, частину консервативної ділянки імуноглобуліну (Fc), у типовому випадку, такового імуноглобуліну людини. Для більш докладного опису див. Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323329 (1988); і Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). Термін "мультиспецифичне антитіло" використовується в самому широкому вмісті й, зокрема, включає антитіло, що містить варіабельний домен важкого ланцюга (VH) і варіабельний домен легкого ланцюга (VL), при цьому одиниця VHVL володіє поліепітопною специфічністю (тобто, здатна зв'язувати два різних епітопи на одній біологічній молекулі або кожний епітоп на іншій біологічній молекулі). Такі мультиспецифічні антитіла включають, як необмежуючі приклади, повнорозмірні антитіла, антитіла, що мають два або більше доменів VL і VH, фрагменти антитіл, такі як Fab, Fv, dsFv, scFv, діатіла, біспецифічні діатіла й триатіла, фрагменти антитіл, ковалентно або нековалентно зшиті. "Полиепітопна специфічність" означає здатність специфічно зв'язуватися із двома або більше різними епітопами на тієї ж самій або іншій(іх) мішені(ях). "Моноспецифічний" означає здатність зв'язуватися тільки з одним епітопом. Відповідно до одного з варіантів, мультиспецифічне антитіло у формі IgG1 зв'язується з кожним епітопом з афінністю від 5 мкм до 0,001 пм, від 3 мкм до 0,001 пм, від 1 мкм до 0,001 пм, від 0,5 мкм до 0,001 пм або від 0,1 мкм до 0,001 пм. "Антитіло з перехресною реактивністю" - це антитіло, що розпізнає ідентичні або схожі 10 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 епітопи на більш ніж одному антигені. Таким чином, антитіла з перехресною реактивністю у даному винаході розпізнають ідентичні або схожі епітопи, що є присутні як на IL-17A, так і на IL17F. В одному з варіантів, антитіло з перехресною реактивністю використовує той же або в істотній мірі той же паратоп для зв'язування як з IL-17A, так і з IL-17F. Переважно, антитіла з перехресною реактивністю в цьому документі також блокують функцію (активність) як IL-17A, так і IL-17F. Термін "паратоп" застосовується в цьому документі для позначення частини антитіла, що зв'язується із цільовим антигеном. "Видо-специфічне (залежне) антитіло", наприклад, антитіло ссавця проти IL-17A/F, це антитіло, що володіє більш сильною афінністю зв'язування до антигену з першого виду ссавців, чим до гомологу цього антигену із другого виду ссавців. Стандартно, видо-специфічне антитіло "специфічно зв'язується" з антигеном людини (тобто, має значення афінності зв'язування (Kd) -7 -8 не більш ніж приблизно 1 x 10 M, переважно, не більш ніж приблизно 1 x 10 M і найбільше -9 переважно, не більш ніж приблизно 1 x 10 M), але має афінність зв'язування з гомологом антигену із другого виду ссавця, відмінного від людини, що, щонайменше, приблизно в 50 разів, або, щонайменше, приблизно в 500 разів, або, щонайменше, приблизно в 1000 разів слабкіше, ніж його афінність зв'язування з антигеном людини. Видо-специфічне антитіло може належати до кожного з різних типів антитіл, зазначених вище, але переважно є гуманізованим антитілом або антитілом людини. Антитіло, "яке зв'язується" з розглянутим антигеном, - це антитіло, що зв'язується з антигеном з істотною афінністю таким чином, що це антитіло корисно в якості діагностичного й/або терапевтичного агенту при цільовому впливі на клітини або тканини, що експресують антиген, і не має істотної перехресної специфічності відносно інших білків. У таких варіантах втілення, ступінь зв'язування антитіла з "нецільовим" білком буде дорівнювати менш чим приблизно 10 % від зв'язування антитіла з його конкретним цільовим білком, відповідно до визначення методом флуоресцентно-активованого клітинного сортингу (FACS) або радіоімунопреципітацією (РІА). Стосовно зв'язування антитіла із цільовою молекулою, термін "специфічне зв'язування" або "специфічно зв'язується з" або є "специфічним до" конкретного поліпептиду або епітопу на конкретному цільовому поліпептиді означає зв'язування, що вимірно відрізняється від неспецифічної взаємодії. Специфічне зв'язування може бути виміряне, наприклад, шляхом визначення зв'язування молекули, у порівнянні зі зв'язуванням контрольної молекули, якою звичайно є молекула зі схожою структурою, що не має єднальну активність. Наприклад, специфічне зв'язування може бути визначене по конкуренції з контрольною молекулою, що схожа із цільовою, наприклад, при надлишку неміченої цільової молекули. У цьому випадку, на специфічне зв'язування вказує той факт, що зв'язування міченої цільової молекули із зондом конкурентно інгібує надлишком неміченої цільової молекули. Термін "специфічне зв'язування" або "специфічно зв'язується з" або є "специфічним до" конкретного поліпептиду або епітопу на конкретному цільовому поліпептиді, при використанні в цьому документі, може бути використаний у відношенні, наприклад, молекули, що має Kd відносно -4 -5 цільової молекули, щонайменше, приблизно 10 M, як варіант, щонайменше, приблизно 10 M, -6 -7 як варіант, щонайменше, приблизно 10 M, як варіант, щонайменше, приблизно 10 M, як -8 -9 варіант, щонайменше, приблизно 10 M, як варіант, щонайменше, приблизно 10 M, як варіант, -10 -11 щонайменше, приблизно 10 M, як варіант, щонайменше, приблизно 10 M, як варіант, -12 щонайменше, приблизно 10 M, або більше. В одному з варіантів, термін "специфічне зв'язування" позначає зв'язування, при якому молекула зв'язується з конкретним поліпептидом або епітопом на конкретному поліпептиді без істотного зв'язування з будь-яким іншим поліпептидом або епітопом на поліпептиді. У кращих варіантах втілення, афінність -10 специфічного зв'язування дорівнює, щонайменше, приблизно 10 М. "Ефекторні функції" антитіла позначають біологічні активності, властиві ділянці Fc (ділянці Fc з нативною послідовністю або ділянці Fc з варіантом амінокислотної послідовності) антитіла, і змінюються залежно від ізотипу антитіла. Приклади ефекту або функцій антитіла включають: зв'язування Clq і комплемент-залежну цитотоксичність; зв'язування рецептора Fc; антитілозалежна клітинно-опосередкована цитотоксичність (АЗКЦ); фагоцитоз; придушення активності рецепторів поверхні клітин (наприклад, рецептора B-клітин); і активацію B-клітин. "Антитілозалежна клітинно-опосередкована цитотоксичність " або "АЗКЦ" означає форму цитотоксичності, при якій секретуємі імуноглобуліни, пов'язані з рецепторами Fc (FcR), присутні на певних цитотоксичних клітинах (наприклад, натуральних кіллерних (NK) клітинах, нейтрофілах і макрофагах), надають цим цитотоксичним ефекторним клітинам здатність специфічно зв'язуватися з несучим антиген цільовими клітинами й надалі вбивати цільову клітину за допомогою цитотоксинів. Антитіла "озброюють" цитотоксичні клітини і є абсолютно 11 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 необхідними для такого знищення. Первинні клітини для опосередкування АЗКЦ, NK-клітини, експресують тільки FcγRIII, у той час як моноцити експресують FcγRI, FcγRII і FcγRIII. Експресія FcR на гематопоетичних клітинах резюмована в Таблиці 3 на сторінці 464 в Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Для оцінки активності в АЗКЦ досліджуваної молекули, може бути проведений аналіз АЗКЦ in vitro, такий як аналіз, описаний у патенті США № 5500362 або 5821337. Корисні для таких аналізів ефекторні клітини включають мононуклеарні клітини периферичної крові (МКПК) і натуральні кілерні (NK) клітини. Відповідно до іншого варіанта, або додатково, активність в АЗКЦ досліджуваної молекули може бути оцінена in vivo, наприклад, у тваринній моделі, так як описана в Clynes et al. Proc. Natl. Acad. Sci. U.S.A. 95:652-656 (1998). "Рецептор Fc" або "FcR" описує рецептор, що зв'язується з ділянкою Fc антитіла. Кращим FcR є FcR людини з нативною послідовністю. Більш того, кращим FcR є такий рецептор, що зв'язується з антитілом IgG (гамма-рецептор) і включає рецептори підкласів FcγRI, FcγRII і FcγRIII, у тому числі алельні варіанти й форми цих рецепторів, що виникли в результаті альтернативного сплайсингу. Рецептори FcγRII включають FcγRIIA ("рецептор, що активує") і FcγRIIB ("рецептор, що інгібує"), які мають схожі амінокислотні послідовності, що різняться в основному своїми цитоплазматичними доменами. Рецептор, що активує FcγRIIA містить імунорецепторний, що містить тирозин, активаторний мотив (ITAM) у своєму цитоплазматичному домені. Рецептор, що інгібує FcγRIIB містить імунорецепторний, що містить тирозин, інгібіторний мотив (ITIM) у своєму цитоплазматичному домені (див. огляд M. in Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). Огляд FcR даний в Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991); Capel et al., Immunomethods 4:25-34 (1994); і de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). Інші FcR, включаючи ті, які будуть ідентифіковані в майбутньому, теж включені в термін "FcR" у цьому документі. Термін також включає неонатальний рецептор, FcRn, що відповідає за перенос материнських IgG до плоду (Guyer et al., J. Immunol. 117:587 (1976) і Kim et al., J. Immunol. 24:249 (1994)). "Ефекторні клітини людини" є лейкоцитами, які експресують один або декілька FcR і виконують ефекторні функції. Переважно, клітини експресують, щонайменше, FcγRIII і виконують ефекторну функцію в АЗКЦ. Приклади лейкоцитів людини, які опосередковують АЗКЦ, включають мононуклеарні клітини периферичної крові (МКПК), натуральні кілерні (NK) клітини, моноцити, цитотоксичні T-клітини й нейтрофіли; при цьому кращими є МКПК і NKклітини. Ефекторні клітини можуть бути виділені із природного джерела, наприклад, із крові. "Комплемент-залежна цитотоксичність " або "CDC" позначає лізис цільової клітини в присутності комплементу. Активація класичного каскаду комплементу починається зв'язуванням першого компонента системи комплементу (Clq) з антитілами (відповідного підкласу), які зв'язані зі своїми відповідними антигенами. Для оцінки активації комплементу може бути проведений CDC-аналіз, наприклад, як описано в Gazzano-Santoro et al., Immunol. Methods 202:163 (1996). Терміни "нейтралізувати" і "нейтралізувати активність" застосовуються в цьому документі для позначення, наприклад, блокування, запобігання, зниження, протидії активності або перетворення IL-17 (наприклад, IL-17A і/або IL-17F) у неефективну молекулу за допомогою будь-якого механізму. Отже, антагоніст може запобігти акту зв'язування, необхідний для активації IL-17. Під "нейтралізуючим антитілом" розуміють молекулу антитіла, описану в цьому документі, що здатна блокувати або істотно знизити ефекторну функцію IL-17 (включаючи IL-17A і/або IL17F). Наприклад, антитіло, що нейтралізує, може інгібувати або зменшити здатність IL-17 (наприклад, IL-17A і/або IL-17F) взаємодіяти з рецептором IL-17, таким як IL-17Rc. Відповідно до іншого варіанта, що нейтралізує антитіло може інгібувати або зменшити здатність IL-17 блокувати сигнальний шлях рецептора IL-17. Нейтралізуюче антитіло також може імуноспецифічно зв'язуватися з IL-17 при імуноаналізі на активність IL-17. "Нейтралізуюче антитіло" по винаходу відрізняється тим, що воно зберігає свою функціональну активність у ситуації як in vitro, так і in vivo. B. Детальний опис винаходу 1. Терапевтичні застосування Інсулінорезистентність - це стан, при якому присутність інсуліну викликає знижену у порівнянні з нормою біологічну відповідь. У клінічних термінах, інсулінорезистентність є, коли нормальний або підвищений рівні глюкози в крові зберігаються в присутності нормального або підвищеного рівнів інсуліну. Вона являє собою, по суті, інгібування синтезу глікогену, при якому або базальний, або стимульований інсуліном синтез глікогену, або оба цих типа, зменшені до рівнів нижче норми. Інсулінорезистентність відіграє основну роль при діабеті 2 типу, як продемонстровано тим фактом, що гіперглікемія, що є присутня при діабеті 2 типу, іноді може 12 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 бути звернена за допомогою дієти або зниження маси, достатніх для відновлення чутливості периферичних тканин до інсуліну. Даний винахід належить до лікування інсулінорезистентності або діабету 2 типу шляхом введення антагоністів IL-17A і/або IL-17F. Як обговорювалося раніше, антагоніст IL-17A і/або IL17F може бути будь-якою молекулою, що перешкоджає функції IL-17A і/або IL-17F, або блокує або нейтралізує відповідну активність IL-17A і/або F будь-яким способом, залежно від показань до лікування. Він може запобігати взаємодії між IL-17A і/або IL-17F і одним або декількома його рецепторами, особливо IL-17Rc. Такі агенти здійснюють цю дію різними способами. Наприклад, клас антагоністів, які нейтралізують активність IL-17A і/або IL-17F, буде зв'язуватися з IL-17A і/або IL-17F, або з рецептором IL-17A і/або IL-17F, особливо з IL-17Rc, з істотною афінністю й специфічністю для впливу, що заважає, на IL-17A і/або IL-17F. 2. Введення й рецептури Антагоніст IL-17 може бути введений будь-яким придатним способом, включаючи парентеральний спосіб введення, такий як, як необмежуючі приклади, внутрішньовенний (IV), внутрім'язовий (IM), підшкірний (SC) і інтраперітонеальний (IP), а також трансдермальний, букальний, під'язичний, інтраректальний, інтраназальний і інгаляційний способи. IV, IM, SC і IP введення можуть здійснюватися у вигляді ударної дози або інфузії, а у випадку SC введення, може також застосовуватися імплантуючий пристрій для поступового вивільнення, включаючи, як необмежуючі приклади, насоси, рецептури з поступовим вивільненням і механічні пристрої. Переважно, введення є системним. Одним особливо кращим способом введення антагоніста IL-17 є підшкірна інфузія, зокрема, із застосуванням дозуючого инфузійного пристрою, такого як насос. Такий насос може бути багаторазового або одноразового використання й імплантуючим або який прикріплюють зовнішньо. Насоси для інфузії лікарських препаратів, успішно застосовувані для цієї мети, включають, наприклад, насоси, описані в патентах США №№ 5637095; 5569186; і 5527307. Композиції можуть вводитися з такого пристрою постійно або періодично. Терапевтичні рецептури антагоністів IL-17, придатні для зберігання, включають суміші антагоністів, що мають необхідний ступінь чистоти, з фармацевтично прийнятними носіями, допоміжними речовинами або стабілізаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), у формі ліофілізованих композицій або водяних розчинів. Прийнятні носії, допоміжні речовини або стабілізатори є нетоксичними для реципієнтів у використовуваних дозуваннях і концентраціях і включають буфери, такі як фосфатний, цитратний і інших органічних кислот; антиоксиданти, у тому числі аскорбінову кислоту й метіонін; консерванти (такі як октадецилдиметилбензил амонію хлорид; гексаметоніум хлорид; бензалконіум хлорид, бензетоніум хлорид; фенол, бутиловий або бензиловий спирт; алкілпарабени, такі як метилабо пропілпарабен; катехол; резорцинол; циклогексанол; 3-пентанол і m-крезол); низькомолекулярні (менш ніж близько 10 залишків) поліпептиди; білки, такі як сивороточний альбумін, желатин або імуноглобуліни; гідрофільні полімери, такі як полівінилпірролідон; амінокислоти, такі як гліцин, глутамін, аспарагін, гістідін, аргінін або лізин; моносахариди, дисахариди та інші вуглеводи, які включають глюкозу, маннозу або декстрини; хелатіруючі агенти, такі як ЕТА; цукри, такі як сахароза, маннітол, трегалоза або сорбітол; соліутворюючі противоіони, такі як натрій; комплекси с металами (наприклад, комплекси Zn з білками); і/або неіонні поверхнево-активні речовини, такі як TWEENT™, PLURONICS™ або поліетіленгліколь (ПЕГ). Найкращі рецептури ліофабозованих антитіл проти IL-17 описані в WO 97/04801. Ці композиції містять антагоніст IL-17, що включає від приблизно 0,1 до 90 % по масі активного антагоністу, переважно в розчинній формі, і в основному від приблизно 10 до 30 %. Активні інгредієнти також можуть міститься в мікрокапсулах, приготовлені, наприклад, за допомогою методики коацервації або шляхом полімеризації на границі фаз, наприклад, гідроксиметилцелюлозні або желатинові мікрокапсули й полі-(метилметацетатні) мікрокапсули, відповідно, у колоїдні системи доставки лікарського засобу (наприклад, ліпосоми, альбумінові мікросфери, мікроемульсії, наночастки й нанокапсули) або в макроемульсії. Такі способи описані в Remington's Pharmaceutical Sciences, вище. Антагоністи IL-17A і/або IL-17F, такі як антитіла проти IL-17, описані в цьому документі, також можуть бути приготовлені у вигляді імуноліпосом. Ліпосоми, що містять антитіло, готують способами, відомими в даній області, такими як описані в Epstein et al., Proc. Natl. Acad. Sci. USA, 82: 3688 (1985); Hwang et al., Proc. Natl Acad. Sci. USA, 77: 4030 (1980); патентах США №№ 4485045 і 4544545; і WО97/38731, опублікованому 23 жовтня 1997 р. Ліпосоми зі збільшеним часом циркуляції описані в патенті США № 5013556. Зокрема, корисні ліпосоми можуть бути отримані способом обернуто-фазового випарювання з ліпідною композицією, що містить фосфатиділхолін, холестерин і модифікований ПЕГ 13 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 фосфатиділетаноламін (PEG-PE). Ліпосоми продавлюють крізь фільтри із заданим розміром пор для одержання ліпосом з необхідним діаметром. Fab'-фрагменти антитіла у даному винаході можуть бути коню'говані з ліпосомами, як описано в Martin et al., J. Biol. Chem., 257: 286-288 (1982), шляхом реакції дисульфідного обміну. Можуть бути виготовлені рецептури пролонгованої дії. Придатні приклади препаратів пролонгованої дії включають напівпроникні матрикси міцних гідрофобних полімерів, що містять антитіло, і ці матрикси перебувають у вигляді оформлених часток, наприклад, плівок або мікрокапсул. Приклади матриксів пролонгованої дії включають поліефіри, гідрогелі (наприклад, полі(2-гідроксиетилметакрилат) або полівініловий спирт), полілактіди (патент США № 3773919), сополімери L-глутамінової кислоти й γ - етил-L-глутамату, недеградований етиленвінилацетат, деградовані сополімери молочної кислоти й гліколевої кислоти, такі як LUPRON DEPOT™ (ін'єкційні мікросфери, що складаються із сополімеру молочної кислоти й гліколевої кислоти й лейпроліду ацетат), і полі-D-(-)- 3-гідроксимасляна кислота. Кожний зі специфічних антагоністів може бути з'єднаний з білком-носієм для збільшення періоду напіввиведення із сироватки терапевтичного антагоніста. Наприклад, розчинні химери імуноглобулінів, такі як описані в цьому документі, можуть бути отримані для кожного специфічного антагоніста IL-17 або його антагоністичної частини, як описано в патенті США № 5116964. Химери імуноглобулінів легко можуть бути очищені із застосуванням хроматографії на сефарозі з Ig-єднальним білком A. Химери мають здатність утворювати імуноглобуліно-подібні димери з одночасним підвищенням авідності й періоду напіввиведення із сироватки. Рецептури, які будуть застосовуватися для введення in vivo, повинні бути стерильними. Це легко досягти шляхом фільтрації через стерильні мембранні фільтри. Рецептура, описана в цьому документі, також може містити більше одної активної сполуки, якщо це необхідно для конкретного показання до лікування, переважно, такі з комплементарними активностями, які не роблять один на одного небажаного впливу. Також, така активна сполука може вводитися ссавцеві, підданому лікуванню, окремо. Наприклад, у випадку таких показань може бути бажано додатково забезпечити агент для лікування інсулінорезистентності. Крім того, діабет 2 типу, при якому не відбувається відповіді на дотримання дієти й зниження ваги, може дати відповідь на терапію із застосуванням похідних сульфонілсечовини разом з антагоністом IL-17. Клас лікарських засобів на основі сульфонілсечовини включає ацетогексамід, хлорпропамід, толазамід, толбутамід, глібенкламід, глібомурід, гліклазид, гліпізид, гліквідон і глімідин. Інші агенти, застосовувані для цієї мети, включають аутоімунний реагент, сенсибілізуючі до інсуліну агенти, такі як сполуки глітазонового сімейства, у тому числі такі, описані в патенті США № 5753681, такі як троглітазон, піоглітазон, енглітазон і родинні сполуки, антагоністи інгібітору тирозинкінази інсулінового рецептора (патенти США №№ 5939269 і 5939269), комплекс IGF-1/IGFBP-3 (патент США № 6040292), антагоністи функції TNF-альфа (патент США № 6015558), агент вивільнення гормону росту (патент США № 5939387) і антитіла до амабону (патент США № 5942227). Інші сполуки, які можуть застосовуватися, включають інсулін (один або кілька різних інсулінів), міметики інсуліну, такі як низькомолекулярний інсулін, аналоги інсуліну, зазначені вище, або їх фізіологічно активні фрагменти, родинні інсуліну пептиди, як зазначено вище, або їхні аналоги, або фрагменти. Агенти додатково описані у визначеннях, наведених вище. Для лікування гіпоінсулінемії, наприклад, інсулін можуть вводити разом або окремо з антагоністом IL-17. Такі додаткові молекули належним чином присутні або вводяться в сполученні в кількостях, які є ефективними для наміченої мети, звичайно в менших кількостях, чим застосовуються при їхньому введенні окремо, без антагоніста IL-17. Якщо вони перебувають у суміші, вони можуть входити до складу суміші в кількостях, певних у відповідності, наприклад, з типом показання, суб'єктом, віком і масою тіла суб'єкта, клінічним станом на даний час, часом введення, лікарською формою, способом введення й т.п. Наприклад, у цьому документі супутній лікарський засіб застосовується переважно в співвідношенні приблизно від 0,0001 до 10000 масових часток на одну масову частку антагоніста IL-17. Застосування антагоніста IL-17 у сполученні з інсуліном дозволяє знизити дозу інсуліну, у порівнянні з дозою при введенні тільки одного інсуліну. Отже, знижується ризик ускладнень на кровоносні судини й індукції гіпоглікемії, які можуть являти собою проблему при введенні великої кількості інсуліну. Для введення інсуліну дорослому пацієнтові з діабетом (з масою тіла приблизно 50 кг), наприклад, щоденна доза звичайно становить приблизно від 10 до 100 Е (Одиниць), переважно від 10 до 80 Е, але може бути менше, відповідно до вказівок лікаря. Для введення підсилювачів секреції інсуліну тому ж типу пацієнта, наприклад, щоденна доза становить переважно приблизно від 0,1 до 1000 мг, більш переважно приблизно від 1 до 100 мг. 14 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для введення бігуанідів тому ж типу пацієнта, наприклад, щоденна доза становить переважно приблизно від 10 до 2500 мг, більш переважно приблизно від 100 до 1000 мг. Для введення інгібіторів α -глюкозидази тому ж типу пацієнта, наприклад, щоденна доза становить переважно приблизно від 0,1 до 400 мг, більш переважно приблизно від 0,6 до 300 мг. Введення ергосету, прамлінтиду, лептину, BAY-27-9955 або T-1095 таким пацієнтам може бути ефективним при дозуванні переважно приблизно від 0,1 до 2500 мг, більш переважно приблизно від 0,5 до 1000 мг. Всі перераховані вище дози можуть вводитися однократно або кілька разів у день. Антагоніст IL-17 також може вводитися разом із придатним не медикаментозним лікуванням інсулінорезистентності, таким як трансплантація підшлункової залози. Дозування антагоніста, що вводяться ссавцеві з інсулінорезистентністю або гіпоінсулінемією, будуть визначені лікарем з урахуванням супутніх обставин, включаючи стан ссавця, тип антагоніста, тип показання й обраний спосіб введення. Дозування переважно перебуває на досить низькому рівні, щоб не викликати збільшення маси тіла в як або істотного ступеню, і цей рівень може бути визначений лікарем. Глітазони, затверджені для лікування діабету 2 типу в людини (росиглітазон/Авандія й пяоглітазон/Актос), викликають деяке збільшення маси тіла, проте, їх застосовують, незважаючи на побічні ефекти, тому що доведено, що вони корисні завдяки своєму терапевтичному індексу. Діапазони дозувань, представлені в цьому документі, не мають наміру обмежити рамки застосування даного винаходу яким-небудь чином. "Терапевтично ефективна" кількість для цілей, зазначених у цьому документі, у відношенні гіпоінсулінемії й інсулінорезистентності, визначається вищевказаними факторами, але звичайно становить приблизно від 0,01 до 100 мг/кг маси тіла/день. Краща доза становить приблизно 0,1-50 мг/кг/день, більш переважно приблизно від 0,1 до 25 мг/кг/день. Ще більш переважно, при введенні антагоніста IL-17 щодня, внутрішньовенна або внутрім'язова доза для людини становить приблизно від 0,3 до 10 мг/кг маси тіла в день, більш переважно приблизно від 0,5 до 5 мг/кг. Для підшкірного введення доза, переважно, вища, ніж терапевтично еквівалентна доза, що вводиться внутрівенно або внутрімя'зово. Переважно, щоденна підшкірна доза для людини становить приблизно від 0,3 до 20 мг/кг, більш переважно приблизно від 0,5 до 5 мг/кг для обох показань. Даний винахід припускає різні режими дозування. Даний винахід включає безперервний графік введення доз, за яким антагоніст IL-17 вводиться регулярно (щодня, щотижня або щомісяця, залежно від дози й лікарської форми), без істотних перерв. Кращі безперервні режими дозування включають щоденну безперервну інфузію, коли антагоніст IL-17 вводять за допомогою інфузії щодня, і безперервні режими введення ударних доз, коли антагоніст IL-17 вводять, щонайменше, один раз у день шляхом ін'єкції ударної дози речовини або інгаляційним або інтраназальним способами. Даний винахід також включає переривчасті режими дозування. Точні параметри переривчастих режимів введення будуть варіювати відповідно до рецептури, способів доставки й клінічних потреб ссавця, що одержує лікування. Наприклад, якщо антагоніст IL-17 вводять шляхом інфузії, режими введення можуть містити перший період введення, за яким наступає другий період введення, у ході якого антагоніст IL-17 не вводиться, і цей період більше, дорівнює або менше, ніж перший період. При введенні шляхом ін'єкції ударної дози речовини, особливо ін'єкції ударної дози речовини у випадку рецептури з уповільненим вивільненням, режими дозування можуть також бути безперервними в тому розумінні, що антагоніст IL-17 вводять щодня, або можуть бути переривчастими, з першим і другим періодами, як описано вище. Безперервні й переривчасті режими введення будь-яким способом також включають режими дозування, при яких доза змінюється протягом першого періоду таким чином, що, наприклад, на початку першого періоду доза низька й зростає аж до кінця першого періоду, доза спочатку висока й знижується протягом першого періоду, доза споконвічно низька, зростає до пікового рівня, а потім знижується аж до кінця першого періоду, і будь-які комбінації цього. Ефекти від введення антагоніста IL-17 на інсулінорезистентність можуть бути обмірювані із застосуванням різних способів, відомих у даній галузі. Найбільш часте зм'якшення ефектів діабету буде призводити до поліпшеного глікемічного контролю (який вимірюють шляхом серійних аналізів рівня глюкози в крові), зниженню потреби в інсуліні для підтримки гарного глікемічного контролю, зниженню рівня глікозильованого гемоглобіну, зниженню рівня поліпшених кінцевих продуктів глікозилірування (AGE) у крові, зниженню ранкової гіперглікемії, зниженню кетоацидозу й поліпшенню ліпідного профілю. Як варіант, введення антагоністу IL-17 може призводити до стабілізації симптомів діабету, про що свідчать зниження рівнів глюкози в крові, зниження потреби в інсуліні, зниження вмісту глікозильованого гемоглобіну й AGE у крові, зм'якшення судинних, ниркових, нейрональних і ретинальних ускладнень, зм'якшення ускладнень вагітності й поліпшення ліпідного профілю. 15 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ефект зниження вмісту цукру в крові антагоністом IL-17 може бути оцінений шляхом визначення концентрації глюкози або Hb (гемоглобіну) A1c у плазмі венозної крові в суб'єкта до й після введення, з наступним порівнянням отриманої концентрації перед введенням і після введення. HbA1c позначає глікозильований гемоглобін, що поступово утвориться у відповідь на концентрацію глюкози в крові. Отже, як відомо, HbA1c важливий як показник контролю цукру в крові, що мало підданий впливу швидких змін вмісту цукру в крові в пацієнтів з діабетом. Докази лікування гіпоінсулінемії демонструють, наприклад, по збільшенню циркулюючих рівнів інсуліну в пацієнтів. Дозування для виправлення ушкоджень і регенерації м'язів становить звичайно приблизно від 0,01 до 100 мг/кг маси тіла, більш переважно від 1 до 10 мг/кг, залежно від стану пацієнта, того, який специфічний тип виправлення ушкодження м'язів необхідний і т.п. Режим дозування відповідає стандартному режиму, застосовуваному клініцистами в цій області. Доказ виправлення ушкоджень і регенерації м'язів продемонстровано за допомогою випробувань для визначення різних показників, добре відомих у даній галузі, який включає аналіз проліферації й диференціювання м'язових клітин і випробування з полімеразною ланцюговою реакцією (див., наприклад, Best et al., J. Orthop. Res., 19: 565-572 (2001), де приводиться аналіз змін вмісту мРНК продуктів генів у міобластах і фібробластах при лікуванні кістякового м'яза кролика із застосуванням кількісного методу зворотної транскрипції з наступною полімеразною ланцюговою реакцією). 3. Вироби й набори Даний винахід також спрямований на створення наборів для лікування інсулінорезистентності й гіпоінсулінемії й для виправлення ушкоджень і регенерації м'язів. Набори, відповідно до винаходу, містять один або кілька контейнерів антагоніста IL-17, переважно антитіла, у сполученні з набором інструкцій, звичайно письмових інструкцій, що відносяться до застосування й дозування антагоніста IL-17 для лікування інсулінорезистентності або гіпоінсулінемії, або будь-якого іншого цільового захворювання, асоційованого з інсулінорезистентністю. Інструкції, включені в набір, звичайно містять інформацію про дозування, режим дозування й спосіб введення з метою лікування цільового захворювання, такого як інсулінорезистентність або гіпоінсулінемічні порушення. Контейнери антагоніста IL-17 можуть бути разовими дозами, не розфасованими впакуваннями (наприклад, багатодозовими впакуваннями) або частковими дозами. Виріб включає контейнер і етикетку або листівку-вкладиш в упакуванні, на або разом з контейнером. Придатні контейнери включають, наприклад, флакони, ампули, шприци й т.д. Контейнери можуть бути зроблені з різних матеріалів, таких як скло або пластик. Контейнер містить композицію, що ефективна для лікування стану, і може мати вхідний отвір для стерильного доступу (наприклад, контейнер може бути пакетом з розчином для внутрішньовенного уливання або флаконом із пробкою, що може бути проткнута голкою для підшкірних ін'єкцій). Щонайменше, один активний агент у композиції є антагоністом IL-17 по даному винаході. Етикетка або листівка-вкладиш в упакуванні вказує, що композиція застосовується для лікування конкретного стану. Етикетка або листівка-вкладиш в упакуванні додатково буде містити інструкції із введення композиції антитіл пацієнтові. Також передбачаються вироби й набори, що містять комбіновані лікарські препарати, описані в цьому документі. Листівка-Вкладиш в упакуванні належить до інструкцій, терапевтичних виробів, що включається звичайно в комерційні впакування, що містить інформацію про показання, застосування, дозування, введення, протипоказаннях і/або застереженнях, що належить до застосування таких терапевтичних виробів. Крім того, виріб може додатково містити другий контейнер з фармацевтично прийнятним буферним розчином, таким як бактеріостатична вода для ін'єкцій (BWFI), фосфатно-сольовий буфер, розчин Рингеру й розчин декстрози. Воно може додатково містити інші матеріали, необхідні з комерційної або користувальницької точки зору, у тому числі інші буферні розчини, розріджувачі, фільтри, голки й шприци. 4. Готування антитіл Моноклональні антитіла Моноклональні антитіла можуть бути приготовлені із застосуванням гібридомного способу, уперше описаного в Kohler et al., Nature, 256:495 (1975), або можуть бути приготовлені способами із застосуванням рекомбінантних ДНК (патент США № 4816567). При гібридомному способі, мишу або іншу придатна тварину-хазяїна, таку як хом'як або макака, імунізують, як описано вище, щоб витягти лімфоцити, які продукують або здатні продукувати антитіла, які будуть специфічно зв'язуватися з білком, застосованим для імунізації. Відповідно до іншого 16 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіанта, лімфоцити можуть бути імунізовані in vitro. Після цього лімфоцити зливають із мієломними клітинами із застосуванням придатного агента, що викликає злиття клітин, такого як поліетиленгліколь, з утворенням гібридомної клітини (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Приготовлені в такий спосіб гібридомні клітини висівають і вирощують у придатному культуральному середовищі, що переважно містить одну або більше субстанцій, що інгібують ріст або виживання незлитих, вихідних мієломних клітин. Наприклад, якщо у вихідних мієломних клітинах відсутній фермент гіпоксантин-гуанін-фосфорибозилтрансфераза (HGPRT або HPRT), культуральне середовище для гібридом буде в типовому випадку містити гіпоксантин, аміноптерин і тімідин ( HAT-середовище) - субстанції, які запобігають росту дефектних по HGPRT клітин. Кращими мієломними клітинами є клітини, які ефективно зливаються, підтримують стабільну високу продукцію антитіла відібраними клітинами, які продукують антитіла, і чутливі до такого середовища як HAT-середовище. Крім цього, кращими лініями мієлоїдних клітин є лінії мієломи миші, такі як отримані з пухлин мишей MOPC-21 і MPC-11, доступні в Salk Institute Cell Distribution Center, Сан-Дієго, Каліфорнія, США, і клітини SP-2 або X63-Ag8-653, доступні в American Type Culture Collection, Роквілл, Меріленд, США. Також були описані клітинні лінії мієломи людини й гетеромієломи миші й людини для одержання моноклональних антитіл людини (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)). У культуральному середовищі, у якому вирощують гібридомні клітини, проводять кількісне визначення продукції моноклональних антитіл, вироблених проти антигену. Переважно, специфічність зв'язування моноклональних антитіл, які продукуються гібридомними клітинами, визначають шляхом імунопреципітації або аналізу зв'язування in vitro, такого як радіоімуноаналіз (РІА) або твердофазний імуноферментний аналіз (ELISA). Після ідентифікації гібридомних клітин, які продукують антитіла з необхідною специфічністю, афінністю й/або активністю, клони можуть бути піддані субклонуванню методами серійних розведень і вирощені стандартними способами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Придатні для цієї мети культуральні середовища включають, наприклад, середовище D-MEM або RPMI-1640. Крім того, гібридомні клітини можуть вирощуватися in vivo у вигляді асцитних пухлин у тварини. Моноклональні антитіла, які секретуються субклонами, відповідним чином виділяють із культурального середовища, асцитної рідини або сироватки із застосуванням стандартних способів очищення імуноглобулінів, таких як, наприклад, хроматографія на білок A-сефарозі, гідроксіапатитах, гель-електрофорез, діаліз або афінна хроматографія. ДНК, що кодує моноклональні антитіла, може бути легко виділена й секвенірована із застосуванням стандартних способів (наприклад, із застосуванням олігонуклеотидних зондів, здатних специфічно зв'язуватися з генами, що кодують важкі й легкі ланцюги моноклональних антитіл). Гібридомніклітини служать кращим джерелом такому ДНК. Після виділення ДНК може бути поміщена в експресійні вектори, якими потім трансфецирують клітини-хазяїна, такі як клітини E. coli, клітини COS мавпи, клітини яєчника китайського хом'ячка (CHO) або мієломні клітини, які в іншому випадку не продукують імуноглобулінові білки, для забезпечення синтезу моноклональних антитіл у рекомбінантних клітинах-хазяїна. Рекомбінантне одержання антитіл буде більш докладно описано далі. У додатковому варіанті втілення, антитіла або фрагменти антитіл можуть бути ізольовані з фагових бібліотек антитіл, отриманих із застосуванням способів, описаних в McCafferty et al., Nature, 348:552-554(1990). Clackson et al., Nature, 352:624-628 (1991) і Marks et al., J. Mol. Biol., 222:581-597 (1991) описують виділення антитіл миші й людини, відповідно, із застосуванням фагових бібліотек. Наступні публікації описують одержання високо афінних (у нм діапазоні) антитіл людини за допомогою комбінування варіабельних доменів легкого й важкого ланцюгів (Marks et al., Bio/Technology, 10:779-783 (1992)), а також комбінаторної інфекції й in vivo рекомбінації як стратегії для конструювання дуже великих фагових бібліотек (Waterhouse et al., Nuc. Acids. Res., 21:2265-2266 (1993)). Таким чином, ці способи є придатними альтернативами традиційним гібридомним способам одержання моноклональних антитіл для виділення моноклональних антитіл. ДНК також може бути модифікована, наприклад, шляхом заміни гомологічних послідовностей миші на послідовність, що кодує, консервативних доменів важкого й легкого ланцюга людини (патент США № 4816567; Morrison, et al., Proc. Natl. Acad. Sci. USA, 81:6851 (1984)), або ковалентним приєднанням до послідовності всієї або, що кодує імуноглобулін, 17 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 частини послідовності, що кодує неімуноглобуліновий поліпептид. У типовому випадку, такі неімуноглобулінові поліпептиди заміщають консервативні домени антитіла, або вони заміщають варіабельні домени одного антигензвя'зуючого сайту антитіла для створення химерного бівалентного антитіла, що містить один антигензвя'зуючий сайт зі специфічністю до одного антигену й інший антигензвя'зуючий сайт зі специфічністю до іншого антигену. Гуманізовані антитіла й антитіла людини Гуманізоване антитіло містить один або кілька амінокислотних залишків, впроваджених у нього із джерела, відмінного від клітин людини. Ці не приналежні людині амінокислотні залишки часто називають "імпортованими" залишками, які звичайно взяті з "імпортованого" варіабельного домена. Гуманізування в істотній мірі може бути проведене відповідно до способу Вінтера зі співавторами (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), шляхом заміни CDR або послідовностей CDR гризунів на відповідні послідовності антитіла людини. Відповідно, такі "гуманізовані" антитіла є химерними антитілами (патент США № 4816567), при цьому в істотній мірі менш чим інтактний варіабельний домен людини був замінений відповідною послідовністю з виду, відмінного від людини. Практично, гуманізовані антитіла в типовому випадку є антитілами людини, у яких залишки CDR і, можливо, деякі залишки FR заміщені залишками з аналогічних сайтів антитіл гризунів. Вибір варіабельних доменів людини, як у легкому, так і у важкому ланцюзі, що буде робитися при одержанні гуманізованих антитіл, дуже важливий для зниження антигенності. Відповідно до так званого методу "найбільш відповідного", проводять скринінг послідовності вентиляції домену антитіла гризуна проти повної бібліотеки відомих послідовностей варіабельних доменів людини. Послідовність людини, що найбільш близька до такого гризуна, потім приймають як каркасну ділянку (FR) людини для гуманізованого антитіла (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987)). При іншому способі застосовують особливу каркасну ділянку, що походить від консенсусної послідовності всіх антитіл людини з конкретною підгрупою легкого або важкого ланцюгів. Та сама каркасна ділянка може бути застосована для декількох різних гуманізованих антитіл (Carter et al., Proc. Natl. Acad Sci. USA, 89:4285 (1992); Presta et al., J. Immnol., 151:2623 (1993)). Також важливо, щоб антитіла були гуманізовані зі збереженням високої афінності до антигену й інших сприятливих біологічних властивостей. Для досягнення цієї мети, відповідно до кращого способу, гуманізовані антитіла готують шляхом аналізу вихідних послідовностей і різних умоглядних гуманізованих продуктів із застосуванням просторових моделей вихідної й гуманізованої послідовностей. Просторові моделі імуноглобулінів загальнодоступні й відомі для фахівця в даній області. Доступні комп'ютерні програми, які ілюструють і відображають імовірні просторові конформаційні структури обраних кандидатних імуноглобулінових послідовностей. Дослідження цих відображень дозволяє проводити аналіз можливої ролі залишків у функціонуванні кандидатної імуноглобулінової послідовності, тобто аналіз залишків, які впливають на здатність кандидатного імуноглобуліну зв'язуватися зі своїм антигеном. Таким чином, залишки FR можуть бути обрані й скомбіновані з реципієнтною і імпортованою послідовностей так, що будуть досягнуті необхідні характеристики антитіла, такі як підвищена афінність до цільового(их) антигену(ів). У цілому, залишки CDR прямо й найбільше істотно залучені у вплив на зв'язування антигену. Відповідно до іншого варіанта втілення, у цей час можливе одержання трансгенних тварин (наприклад, мишей), які здатні, після імунізації, продукувати повний набір антитіл людини під час відсутності продукції ендогенних імуноглобулінів. Наприклад, було описано, що гомозиготна делеція гену сполучної ділянки важкого ланцюга антитіл (J.sub.H) у химерних і з мутаціями в клітинах зародкової лінії мишей призводить до повного інгібуванню продукції ендогенних антитіл. Перенос набору імуноглобулінових генів із клітин зародкової лінії людини таким мишам з мутаціями в клітинах зародкової лінії призведе до продукції антитіл людини після введення антигену. Див., наприклад, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993); і Duchosal et al. Nature 355:258 (1992). Антитіла людини також можуть походити з бібліотек на основі фагового дисплею (Hoogenboom et al., J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991); Vaughan et al. Nature Biotech 14:309 (1996)). Одержання антитіл людини з бібліотек антитіл на основі фагового дисплея більш докладно описано далі. Фрагменти антитіл Різні способи були розроблені для одержання фрагментів антитіл. Традиційно ці фрагменти одержували протеолітичним розщепленням інтактних антитіл (див., наприклад, Morimoto et al., 18 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 Journal of Biochemical and Biophysical Methods 24:107-117 (1992) і Brennan et al., Science, 229:81 (1985)). Однак зараз ці фрагменти можуть бути отримані прямо з рекомбінантних клітин-хазяїв. Наприклад, фрагменти антитіл можуть бути виділені з фагових бібліотек антитіл, як обговорювалося вище. Відповідно до іншого варіанта, фрагменти Fab'-SH можуть бути прямо витягнуті з E. coli і хімічно з'єднані з утворенням фрагментів F(ab')2 (Carter et al., Bio/Technology 10:163-167 (1992)). В іншому варіанті, як описано в прикладі нижче, F(ab')2 утворюють із застосуванням білку з лейциновою застібкою GCN4, що сприяє складанню молекули F(ab')2. Відповідно до іншого способу, фрагменти F(ab')2 можуть бути виділені прямо з культури рекомбінантних клітин-хазяїв. Інші способи одержання фрагментів антитіл будуть очевидні для фахівця в даній області. В інших варіантах втілення, обране антитіло є одно ланцюговим фрагментом Fv (scFv). Див. WO 93/16185. Мультиспецифічні антитіла Мультиспецифічні антитіла мають специфічність зв'язування, щонайменше, із двома різними епітопами, при цьому епітопи звичайно належать різним антигенам. Хоча такі молекули в нормі будуть зв'язуватися тільки із двома різними епітопами (тобто бути біспецифічними антитілами, BsAb), антитіла з додатковими специфічностями, такі як триспецифічні антитіла, включені в це вираження при його використанні в цьому документі. Способи одержання біспецифічних антитіл відомі в даній області. Традиційне одержання повнорозмірних біспецифічних антитіл засновано на спільній експресії двох пар важких і легких ланцюгів імуноглобулінів, при цьому два ланцюги мають різні специфічності (Millstein et al., Nature, 305:537-539 (1983)). Завдяки випадковому комбінуванню важких і легких ланцюгів імуноглобулінів, такі гібридоми (квадроми) продукують потенційну суміш із 10 різних молекул антитіл, з яких тільки одна має правильну біспецифічну структуру. Очищення правильної молекули, що звичайно проводять за допомогою етапів афінної хроматографії, досить складні, а вихід продукту низький. Подібні способи описані в WO 93/08829 і в Traunecker et al., EMBO J., 10:3655-3659 (1991). Відповідно до іншого способу, вентиляції домени антитіл з необхідними специфічностями зв'язування (сайтами зв'язування антитіла з антигеном) зшивають із послідовностями консервативних доменів імуноглобуліну. Зшивку переважно проводять із консервативним доменом важкого ланцюга імуноглобуліну, що містить, щонайменше, частина шарнірної, CH2 і CH3 ділянок. Переважно, щоб перша консервативна ділянка важкого ланцюга (CH1), що містить сайт, необхідний для зв'язування легкого ланцюга, була присутня, щонайменше, на одній зі зшивок. ДНК, що кодують зшивки важких ланцюгів імуноглобулінів, і, якщо необхідно, легкий ланцюг імуноглобуліну, впроваджують в окремі експресійні вектора й спільно трансфекуюють ними придатний організм-хазяїна. Це забезпечує більшу гнучкість при коректуванні співвідношення відносно один одного трьох поліпептидних фрагментів у варіантах втілення, коли нерівні частки трьох поліпептидних ланцюгів, застосовуваних у конструкції, забезпечують оптимальний вихід. Можливо, однак, вставити послідовності, що кодують, для двох або всіх трьох поліпептидних ланцюгів в один експресійний вектор, коли експресія, щонайменше, двох поліпептидних ланцюгів у рівному співвідношенні призведе до високого виходу або коли співвідношення не грають істотної ролі. У кращому варіанті втілення цього способу, біспецифічні антитіла складаються з гібридного важкого ланцюга імуноглобуліну з першою специфічністю зв'язування на одному плечі, і гібридної пари важкого ланцюга й легкого ланцюга імуноглобуліну (який забезпечує другу специфічність зв'язування) на іншому плечі. Було виявлено, що ця асиметрична структура сприяє відділенню потрібної біспецифичної сполуки від небажаних комбінацій імуноглобулінових ланцюгів, тому що присутність легкого ланцюга імуноглобуліну тільки в одній половині біспецифичної молекули забезпечує легкий спосіб поділу. Цей спосіб описаний в WO 94/04690. Для більше докладного опису одержання біспецифічних антитіл див., наприклад, Suresh et al., Methods in Enzymology, 121:210 (1986). Відповідно до іншого способу, описаного в WO96/27011, область взаємодії між парою молекул антитіла може бути сконструйована таким чином, щоб максимізувати відсоток гетеродимерів, які витягають із культури рекомбінантних клітин. Краща область взаємодії містить, щонайменше, частину домену CH3 з консервативного домену антитіла. При цьому способі, одна або кілька малих бічних ланцюгів амінокислот на поверхні взаємодії першої молекули антитіла заміщені більшими бічними ланцюгами (наприклад, тирозином або триптофаном). "Порожнини, що компенсують," ідентичного або схожого з більшими бічними ланцюгами(ланцюгом) розміру створюють на поверхні взаємодії другої молекули антитіла шляхом заміщення більших бічних ланцюгів амінокислот на більше дрібні (наприклад, аланін або треонін). Це забезпечує механізм для збільшення виходу гетеродимеру стосовно небажаних кінцевих продуктів, таких як гомодимери. 19 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 Біспецифічні антитіла включають поперечно зшиті або "гетероконю'гування" антитіла. Наприклад, одне з антитіл у гетерокон'югаті може бути з'єднане з авідіном, інше з біотином. Такі антитіла були, наприклад, запропоновані для націлювання клітин імунної системи на небажані клітини (патент США № 4676980) і для лікування ВІЧ-інфекції (WO 91/00360, WO 92/200373). Гетероконю'гувані антитіла можуть бути отримані із застосуванням будь-якого стандартного способу поперечної зшивки. Придатні агенти для поперечної зшивки добре відомі в даній області й описані в патенті США № 4676980, разом з рядом способів поперечної зшивки. Способи одержання біспецифічних антитіл із фрагментів антитіл також були описані в літературі. Наприклад, біспецифічні антитіла можуть бути приготовлені із застосуванням хімічної зшивки. Brennan et al., Science 229: 81 (1985) описують спосіб, при якому інтактні антитіла протеолітично розщеплюють для одержання фрагментів F(ab')2. Ці фрагменти відновлюють у присутності дитіолового комплексоутворюючого агента арсеніту натрію для стабілізації сусідніх дитіолів і запобігання утворення міжмолекулярних дисульфідних зв'язків. Фрагменти, що утворилися, Fab' після цього перетворюють у тіонитробензойні (TNB) похідні. Одне з похідних Fab'-TNB після цього знову перетворюють в Fab'-тіол шляхом відновлення меркаптоетиламіном і змішують із еквімолярною кількістю іншого похідного Fab'-TNB для утворення біспецифічного антитіла. Отримані біспецифічні антитіла можуть застосовуватися як агенти для селективної іммобілізації ферментів. Фрагменти Fab'-SH також можуть бути прямо витягнуті з E. coli і хімічно з'єднані з утворенням біспецифічних антитіл. Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описують одержання молекули F(ab')2 повністю гуманізованого біспецифічного антитіла. Кожний фрагмент Fab' окремо секретувався клітинами E. coli і був підданий прямій хімічній зшивці in vitro з утворенням біспецифічного антитіла. Також були описані різні способи одержання й виділення фрагментів біспецифічних антитіл безпосередньо з культури рекомбінантних клітин. Наприклад, біспецифічні антитілаодержували із застосуванням лейцинових застібок. Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992). Пептиди з лейциновими застібками з білків Fos і Jun зшили з Fab'-частиною двох різних антитіл за допомогою злиття генів. Гомодимери антитіл відновили в шарнірній ділянці для утворення мономерів, а потім повторно окислювали для утворення гетеродимерів антитіл. Цей спосіб також може застосовуватися для одержання гомодимерів антитіл. Спосіб одержання "діател", описаний в Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993), забезпечив альтернативний спосіб готування фрагментів біспецифічного антитіла. Фрагменти містять варіабельність домен важкого ланцюга (VH), з'єднаний з варіабельним доменом легкого ланцюга (VL) лінкером, що занадто короткий для того, щоб було можливо утворення пари між двома доменами на одній і тім же ланцюзі. Відповідно, домени VH і VL одного фрагмента змушені утворювати пари з комплементарними доменами VL і VH іншого фрагмента, тим самим утворюючи два антигензвя'зуючих сайти. Повідомляли також про інший спосіб одержання фрагментів біспецифічного антитіла із застосуванням димерів одноланцюгових Fv (sFv). Див. Gruber et al., J. Immunol. 152:5368 (1994). Передбачаються антитіла з більш ніж двома валентностями. Наприклад, можуть бути приготовлені триспецифічні антитіла. Tuft et al. J. Immunol. 147: 60 (1991). Конструювання ефекторної функції Може бути бажано модифікувати антитіло за цим винаходом у відношенні ефекторної функції таким чином, щоб підсилити ефективність антитіла. Наприклад, в ділянку Fc може бути впроваджений цистеїновий залишок(залишки), що уможливить утворення міжланцюгового дисульфідного зв'язку в цій ділянці. Отримане в такий спосіб гомодимірне антитіло може мати поліпшену здатність до інтерналізації й/або посиленою активністю в комплементопосередкованої цитотоксичності й антитіло залежної клітинно-опосередкованої цитотоксичності (АЗКЦ). Див. Caron et al., J. Exp Med. 176:1191-1195 (1992) і Shopes, B. J. Immunol. 148:2918-2922 (1992). Гомодимерні антитіла з посиленою противопухлинною активністю також можуть бути отримані із застосуванням гетеробіфункційних поперечних зшивок, як описано в Wolff et al. Cancer Research 53:2560-2565 (1993). Відповідно до іншого варіанта, може бути сконструйоване антитіло, що містить дві області Fc і завдяки цьому може мати посилену активність у лізисі комплементу й АЗКЦ. Див. Stevenson et al Anti-Cancer Drug Design 3:219-230 (1989). Химери антитіла з епітопом зв'язування з рецептором реутилізації У деяких варіантах втілення даного винаходу, може бути бажано застосування фрагмента антитіла, а не інтактного антитіла. У цьому випадку, може бути бажано проведення модифікації фрагмента антитіла з метою збільшення його періоду напіввиведення із сироватки. Це може бути досягнуто, наприклад, шляхом впровадження епітопу зв'язування з рецептором 20 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 реутилізації у фрагмент антитіла (наприклад, шляхом мутації відповідної ділянки у фрагменті антитіла або впровадження епітопу в пептидну мітку, що потім зшивають із фрагментом антитіла на будь-якому кінці або в середині, наприклад, із застосуванням синтезу ДНК або пептидного синтезу). Епітоп зв'язування з рецептором реутилізації переважно містить ділянку, де будь-які один або кілька амінокислотних залишків з однієї або двох петель домену Fc перенесені в аналогічну позицію фрагмента антитіла. Навіть більш переважно, перенесені три або кілька залишків з однієї або двох петель домену Fc. Ще більш переважно, епітоп узятий з домену CH2 ділянки Fc (наприклад, з IgG) і перенесений в ділянку CH1, CH3 або V.sub.H, або більш ніж одну таку ділянку антитіла. Відповідно до іншого варіанта, епітоп узятий з домену CH2 ділянки Fc і перенесений в ділянку CL або в ділянку VL, або в обидві ділянки фрагмента антитіла. Інші ковалентні модифікації антитіл У межах обсягу даного винаходу знаходяться ковалентні модифікації антитіл.. Вони можуть бути здійснені шляхом хімічного синтезу або ферментативного або хімічного розщеплення антитіла, якщо це є застосовним. Інші типи ковалентних модифікацій антитіла вводять у молекулу шляхом реакції цільових амінокислотних залишків антитіла з органічним агентом для одержання похідних, що здатні реагувати з обраними бічними ланцюгами або N- або Cкінцевими залишками. Приклади ковалентних модифікацій описані в патенті США № 5534615, спеціально включеному в цей документ як посилання. Кращий тип ковалентної модифікації антитіла включає зшивку антитіла з одним з безлічі небілкових полімерів, наприклад, поліетиленгліколем, поліпропіленгліколем або поліоксиалкіленами, способом, викладеним у патентах США №№ 4640835; 4496689; 4301144; 4670417; 4791192 або 4179337. Одержання антитіл із синтетичних фагових бібліотек антитіл У кращому варіанті втілення, даний винахід спрямований на створення способу одержання й відбору нових антитіл із застосуванням унікального способу фагового дисплею. Спосіб включає одержання синтетичних фагових бібліотек антитіл на основі одиночної матриці каркасної ділянки, дизайн достатньої розмаїтості в межах варіабельних доменів, одержання дисплею поліпептидів, що мають різні варіабельні домени, вибір кандидатних антитіл з високої афінністю до цільового антигену й виділення обраних антитіл. Детальний опис методів фагового дисплею можна знайти, наприклад, в WO03/102157, опублікованому 11 грудня 2003 р., повне розкриття якого спеціально включено в цей документ як посилання. В одному з варіантів втілення даного винаходу, бібліотеки антитіл, застосовувані у винаході, можуть бути отримані шляхом мутацій у доступні для розчинника й/або високо варіабельність позиціях в, щонайменше, однієї CDR варіабельного домену антитіла. Деякі або всі CDR можуть бути піддані мутаціям із застосуванням способу, наведеного в цьому документі. У деяких варіантах, втілення може бути кращим одержання різних бібліотек антитіл шляхом мутування позицій в CDRH1, CDRH2 і CDRH3 з формуванням єдиної бібліотеки, або шляхом мутування позицій в CDRL3 і CDRH3 з формуванням єдиної бібліотеки, або шляхом мутування позицій в CDRL3 і CDRH1, CDRH2 і CDRH3 з формуванням єдиної бібліотеки. Наприклад, може бути отримана бібліотека варіабельних доменів антитіл, що мають мутації в доступні для розчинника й/або високо варіабельних позиціях CDRH1, CDRH2 і CDRH3. Може бути отримана ще одна бібліотека з мутаціями в CDRLl, CDRL2 і CDRL3. Ці бібліотеки також можуть застосовуватися спільно один з одним для одержання єднальних молекул з необхідною афінністю. Наприклад, після одного або декількох раундів відбору бібліотек важких ланцюгів на зв'язування із цільовим антигеном, бібліотека легких ланцюгів може бути переміщена в популяцію єднальних молекул на основі важких ланцюгів для подальших раундів відбору з метою збільшення афінності єднальних молекул. Переважно, бібліотеку створюють шляхом заміни вихідних амінокислот варіантними амінокислотами в ділянці CDRH3 варіабельного домену (регіону, ділянки) послідовності важкого ланцюга. Отримана в результаті бібліотека може містити безліч послідовностей антитіл, при цьому розмаїтість послідовностей спостерігається, в основному, в ділянці CDRH3 послідовності важкого ланцюга. В одному з варіантів втілення даного винаходу, бібліотека створюється в контексті послідовності гуманізованого антитіла 4D5, або послідовності амінокислот каркаса послідовності гуманізованого антитіла 4D5. Переважно, бібліотека створюється шляхом заміни, щонайменше, залишків 95-100a у важкому ланцюзі амінокислотами, кодуємого набором кодонів DVK, при цьому набір кодонів DVK застосовують для кодування набору варіантних амінокислот для кожної із цих позицій. Приклад набору олігонуклеотидів, корисного для здійснення цих замін, включає послідовність (DVK)7. У деяких варіантах втілення даного винаходу, бібліотеку 21 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 створюють шляхом заміни залишків 95-100a амінокислотами, що кодуються наборами кодонів як DVK, так і NNK. Приклад набору олігонуклеотидів, корисного для здійснення цих замін, включає послідовність (DVK)6(NNK). В іншому варіанті втілення даного винаходу, бібліотеку створюють шляхом заміни, щонайменше, залишків 95-100a амінокислотами, що кодуються наборами кодонів як DVK, так і NNK. Приклад набору олігонуклеотидів, корисного для здійснення цих замін, включає послідовність (DVK)5(NNK). Ще один приклад набору олігонуклеотидів, корисного для здійснення цих замін, включає послідовність (NNK)6. Інші приклади придатних олігонуклеотидних послідовностей можуть бути визначені фахівцем у даній галузі відповідно до критеріїв, описаних в цьому документі. В іншому варіанті втілення даного винаходу, різні конструкції CDRH3 застосовують для виділення високоафінних єднальних молекул і виділення єднальних молекул для різних епітопів. Діапазон довжин CDRH3, отриманих у цій бібліотеці, становить від 11 до 13 амінокислот, хоча можуть бути отримані й фрагменти з іншими довжинами. Розмаїтість H3 може бути розширена за допомогою наборів кодонів NNK, DVK і NVK, а також більше обмеженої розмаїтості на N- і/або C-кінці. Розмаїтість також може бути отримана в CDRH1 і CDRH2. При створенні розмаїтості в CDRH1 і H2 випливають стратегії прагнення до відтворення подібності з набором природних антитіл, як описано у випадку модифікації,що націлена на розмаїтість, що більш тісно відповідає природній розмаїтості, чим попередня конструкція. Для розмаїтості в CDRH3 може бути сконструйоване окремо безліч бібліотек з різними довжинами H3, які після цього поєднують для відбору єднальних молекул для цільового антигену. Безліч бібліотек можна поєднувати й сортувати із застосуванням способів відбору на твердій підложці й сортингу в розчині, як описано раніше й нижче в цьому документі. Можуть бути застосовані різні стратегії сортингу. Наприклад, один варіант втілення включає сортинг за допомогою мішені, іммобілізованої на твердій підложці, після чого треба сортинг по мітці, що може бути присутнім на химерному поліпептиді (наприклад, мітка анти-gD), за яким треба ще один сортинг за допомогою мішені, іммобілізованої на твердій підложці. Відповідно до іншого варіанта, бібліотеки можуть спочатку сортувати за допомогою мішені, іммобілізованої на твердій підложці, а елюірованні єднальні молекули потім сортують із застосуванням зв'язування розчинної фази з концентраціями, що знижуються, цільового антигену. Застосування комбінацій різних способів сортингу забезпечує мінімізацію відбору тільки відносно послідовностей з високим рівнем експресії й спрямовано на відбір ряду різних клонів з високої афінністю. Високо афінні єднальні молекули для цільового антигену можуть бути виділені з бібліотек. 4 5 Обмеження розмаїтості в ділянці H1/H2 знижує виродженість приблизно в 10 -10 разів, а дозвіл більшої розмаїтості в H3 забезпечує одержання єднальних молекул з більше високою афінністю. Застосування бібліотек з різними типами розмаїтості в CDRH3 (наприклад, із застосуванням DVK або NVT) забезпечує виділення єднальних молекул, які можуть зв'язуватися з різними епітопами на цільовому антигені. Для єднальних молекул, виділених з об'єднаних як описано вище бібліотек, було виявлено, що їх афінність може бути додатково поліпшена шляхом забезпечення обмеженої розмаїтості в легкому ланцюзі. Розмаїтість легкого ланцюга одержують у цьому варіанті в такий спосіб - в CDRL1: позиція амінокислоти 28 кодується RDT; позиція амінокислоти 29 кодується RKT; позиція амінокислоти 30 кодується RVW; позиція амінокислоти 31 кодується ANW; позиція амінокислоти 32 кодується THT; необов'язково, позиція амінокислоти 33 кодується CTG; в CDRL2: позиція амінокислоти 50 кодується KBG; позиція амінокислоти 53 кодується AVC; і, необов'язково, позиція амінокислоти 55 кодується GMA; в CDRL3: позиція амінокислоти 91 кодується TMT або SRT, або обома; позиція амінокислоти 92 кодується DMC; позиція амінокислоти 93 кодується RVT; позиція амінокислоти 94 кодується NHT; і позиція амінокислоти 96 кодується TWT або YKG, або обома. В іншому варіанті втілення даного винаходу, одержують бібліотеку або бібліотеки з розмаїтістю в ділянках CDRH1, CDRH2 і CDRH3. У цьому варіанті, розмаїтість в CDRH3 одержують із застосуванням розмаїтості довжин ділянок H3 і із застосуванням в основному наборів кодонів XYZ і NNK або NNS. Бібліотеки можуть бути сформовані із застосуванням одиничних олігонуклеотидів і об'єднані, або олігонуклеотиди можуть бути об'єднані для формування підтипів бібліотек. Бібліотеки в цьому варіанті можуть бути відсортовані стосовно мішені, іммобілізованої на твердій підложці. Клони, виділені з безлічі типів, можуть бути повалені скринінгу на специфічність і афінність за допомогою аналізу ELISA. Для визначення специфічності клони можуть бути піддані скринінгу у відношенні необхідного цільового антигену, а також інших, нецільових, антигенів. Після цього, ті єднальні молекули, які зв'язуються із цільовим антигеном, можуть бути піддані скринінгу на афінність із застосуванням аналізу ELISA 22 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 для конкурентного зв'язування в розчині або аналізу конкурентного зв'язування в плямах. Високоафінні єднальні молекули можуть бути виділені з бібліотеки, що використовує набори кодонів XYZ, приготовленої як описано вище. Ці єднальні молекули можуть бути легко отримані у вигляді антитіл або антигензвя'зуючих фрагментів з високим виходом у культурі клітин. У деяких варіантах втілення даного винаходу може бути бажано одержання бібліотек з більшою розмаїтістю довжин ділянці CDRH3. Наприклад, може бути бажано одержання бібліотек з ділянками CDRH3 у діапазоні від приблизно 7 до 19 амінокислот. Високо афінні єднальні молекули, виділені з бібліотек по цих втіленнях, легко одержують у культурі бактеріальних або еукаріотичних клітин з високим виходом. Можуть бути сконструйовані вектори, у яких можна легко проводити видалення послідовностей, таких як мітки gD, послідовність компонента білка вірусної оболонки, і/або вставку в послідовності консервативних ділянок для забезпечення продукції повнорозмірних антитіл або антигензвя'зуючих фрагментів з високим виходом. Бібліотека з мутаціями в CDRH3 може бути скомбінована з бібліотекою, що містить варіантні версії інших CDR, наприклад, CDRL1, CDRL2, CDRL3, CDRH1 і/або CDRH2. Таким чином, наприклад, в одному з варіантів, бібліотека CDRH3 скомбінована з бібліотекою CDRL3, створеною в контексті послідовності гуманізованого антитіла 4D5 з варіантними амінокислотами в позиціях 28, 29, 30,31 і/або 32 із застосуванням попередньо установлених наборів кодонів. В іншому варіанті, бібліотека з мутаціями в CDRH3 може бути скомбінована з бібліотекою, що містить варіантні CDRH1 і/або CDRH2 у варіабельних доменах важкого ланцюга. В одному з варіантів, бібліотека CDRH1 створена на основі послідовності гуманізованого антитіла 4D5 з варіантними амінокислотами в позиціях 28, 30, 31, 32 і 33. Бібліотека CDRH2 може бути створена на основі послідовності гуманізованого антитіла 4D5 з варіантними амінокислотами в позиціях 50, 52, 53, 54, 56 і 58 із застосуванням попередньо установлених наборів кодонів. Передбачається, що вищевикладений письмовий опис є достатнім для того, щоб фахівець у даній галузі міг практично використовувати даний винахід. Наступні Приклади наведені тільки з метою ілюстрації й не призначені для обмеження обсягу даного винаходу яким-небудь чином. Дійсно, різні модифікації винаходу, на додаток до тих, що показано й описані в цьому документі, будуть очевидні для фахівця в даній області з вищевикладеного опису й попадають в обсяг прикладеної формули винаходу. Доступні для придбання реагенти, зазначені в Прикладах, застосовували відповідно до інструкцій виробників, якщо не зазначено інакше. Джерелом клітин, ідентифікованих у наступних Прикладах і в описі винаходу по номерах доступу ATCC, є American Type Culture Collection, Манассас, Вірджинія. Якщо не зазначено інакше, у даному винаході застосовують стандартні способи технології рекомбінантних ДНК, такі як описані вище в цьому документі й у наступних наукових роботах: Sambrook et al., вище; Ausubel et al., Current Protocols in Molecular Biology (Green Publishing Associates and Wiley Interscience, N.Y., 1989); Innis et al., PCR Protocols: A Guide to Methods and Applications (Academic Press, Inc.: N.Y., 1990); Harlow et al., Antibodies: A Laboratory Manual (Cold Spring Harbor Press: Cold Spring Harbor, 1988); Gait, Oligonucleotide Synthesis (IRL Press: Oxford, 1984); Freshney, Animal Cell Culture, 1987; Coligan et al., Current Protocols in Immunology, 1991. Додаткові детальні характеристики винаходу наведені в наступних необмежуючих прикладах. Всі посилання, процитовані в розкритті винаходу, спеціально включені сюди у своїй повноті як посилання Приклад 1 Роль членів сімейства IL-17 у діабеті й інсулінорезистентності. Миші IL-17Rc KO і дослідження моделі дієти з високим вмістом жирів 8-тижневі самці IL-17Rc (UNQ6118.KO.lex) нокаутних і однопослідних дикого типу (WT) контрольних мишей одержували або нормальну харчову дієту, або 60 %-у дієту з високим вмістом жирів (HFD). Група 1: IL-17Rc нокаутні (KO) миші на дієті з високим вмістом жирів (5 тварин) Група 2: IL-17Rc дикі типи однопослідні контрольні тварини на дієті з високим вмістом жирів (5 тварин) Група 3: IL-17Rc KO миші на нормальній дієті (3 тварин) Група 4: IL-17Rc дикі типи однопослідні контрольні тварини на нормальній дієті (3 тварин). Планування експерименту представлене на Фігурі 7. Мишам проводили пробу на переносимість глюкози (GTT) для оцінки їхнього статусу інсулінорезистентності. GTT проводили із застосуванням наступного способу. 23 UA 105384 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вимір вмісту глюкози й інсуліну в крові: Зразки крові одержували взяттям крові з підшкірної вени й відразу ж аналізували на концентрацію глюкози із застосуванням глюкометру (глюкометру One Touch виробництва Lifescan, США). Вміст інсуліну в сироватці визначали із застосуванням методу ELISA. Проба на переносимість глюкози (GTT): після нічного голодування (14 годин), проводили випробування на тваринах ранком, в 9:00. Рівень глюкози в крові вимірювали в зразках, отриманих при взятті крові з підшкірної вени перед інтраперітонеальною ін'єкцією глюкози 1,5 мг/грам маси тіла кожної тварини, а також через 30, 60, 120 і 150 хвилин після введення глюкози. Значення обчислювали як вміст глюкози в мг/дл. GTT проводили для вихідного рівня (до переходу на дієту з високим вмістом жирів), а також на тижні 8, тижні 10, тижні 12 і тижні 14 після початку участі в групі з дієтою з високим вмістом жирів. Мишей, що одержували нормальну харчову дієту, використовували як контрольні групи. Решта умов були схожими для нокаутних і дикого типу (WT) однопослідних контрольних мишей. На додаток до GTT, щотижня вимірювали загальну масу тіла тварини, а також вміст у сироватці інсуліну й глюкози натще. Результати представлені на Фігурах 8-11. У той час як однопослідні контрольні миші з IL-17Rc дикого типу демонстрували істотне збільшення маси й розвиток фенотипу з інсулінорезистентністю, нокаутні по IL-17Rc миші були істотно більш худими й виводили глюкозу набагато краще, ніж їхнього дикого типу однопослідна контрольна група. Навіть після одержання дієти з високим вмістом жирів протягом більш ніж 12 тижнів, нокаутні миші не набирали масу тіла. Обидві групи продемонстрували схожі рівні вмісту циркулюючого інсуліну натще. Не спостерігалося істотного розходження між нокаутними й дикого типу мишами в групах, що одержували контрольну дієту. Крім описаного вище експерименту з IL-17 Rc KO мишами були виконані ДВІ додаткові лінії досліджень для з'ясування ролі прозапальних цитокінів IL-17A і IL-17F у діабеті й інсулінорезистентності. Приклад 2 Ефект моноклональних антитіл (mAb) проти IL-17 і проти IL-17F на мишей з моделлю інсулінорезистентності, викликаною дієтою з високим вмістом жирів. Метою даного дослідження було вивчення ефективності mAb проти IL-17 і проти IL-17F у превентивній і встановленій моделі інсулінорезистентності й порівняння з терапевтичним ефектом muTNFRII-Fc. Планування експерименту й групи: Група 1: Аглютинін амброзії, 6 мг/кг в 100 мкл розчину натрію хлориду IP 3 рази в тиждень протягом 10 тижнів (n=10). Група 2: MuTNFRII-IgG2a, 4 мг/кг в 100 мкл розчину натрію хлориду 3 рази в тиждень протягом 10 тижнів (n=10). Група 3: MuAnti-IL-17, 6 мг/кг в 100 мкл розчину натрію хлориду IP 3 рази в тиждень протягом 10 тижнів (n=10). Група 4: MuAnti-IL-17+MuAnti-IL-17F mAb, 6 мг/кг в 100 мкл розчину натрію хлориду IP 3 рази в тиждень протягом 10 тижнів (n=10). Група 5: MuTNFRII-Fc 4 мг/кг = MuAnti-IL-17 6 мг/кг+MuAnti-IL17FmAb 6 мг/кг протягом 18 тижнів і 24 тижнів (10 тварин). Всі групи одержували дієту з високим вмістом жирів. Для оцінки статусу інсулінорезистентності мишей проводили пробу на переносимість глюкози (GTT) кожні 2 тижня після початку HFD (дієти з високим вмістом жирів) і введення доз антитіл. Протокол проілюстрований на Фігурі 12. Ефект моноклональних антитіл проти IL-17A і проти IL-17F на переносимість глюкози через 9 тижнів введення доз показаний на Фігурі 13. Приклад 3 Ефект надекспресії IL-17 на статус інсулінорезистентності, оцінений із застосуванням GTT. Дослідження основане на гідродинамічній ін'єкції у хвостову вену (HTV) плазмідної ДНК для експресії нативних білків миші IL-17A і IL-17F у нормальних і мишей, які одержували дієту з високим вмістом жирів з метою експресії високого рівня прозапальних цитокінів миші IL-17A і IL17F у мишах для вивчення їхньої ролі в інсулінорезистентності. Група 1: без плазміди Група 2: тільки вектор pRK Група 3: pRK-IL-17A Група 4: pRK-IL-17F У межах кожної групи робили ін'єкції 5 підгрупам мишей для відбору крові в різних тимчасових крапках (0 год.…, 2 год.…, 6 год.…, 24 год.… і 72 год.… після ін'єкції ДНК) з метою 24 UA 105384 C2 5 10 15 20 виміру рівнів циркулюючих цитокінів у сироватці. Коли цей параметр був установлений, здійснювали надекспресію IL-17A і IL-17F у мишей з дієтою з високим вмістом жирів (HFD) для оцінки зміни статусу інсулінорезистентності. Експерименти по ін'єкції у хвостову вену: 1) Конструкцію ДНК (вектор pRK або pRK-IL-17A і pRK-IL-17F) розбавляли в розчині натрію хлориду (переважно, розчині Рингеру) до концентрації, що дасть кінцеву дозу 50 мкг/миша/ін'єкція. 2) Кожній миші робили внутрішньовенну ін'єкцію у хвостову вену приблизно 1,6 мл розчину, що містить ДНК у розчині натрію хлориду або розчині Рингеру. 3) Дози вводили у вигляді внутрішньовенної ін'єкції ударної дози (у хвостову вену) протягом періоду 4-5 секунд (максимум - 8 секунд) для максимального поглинання ДНК. Результати представлені на Фігурі 14. A) Восьмитижневим мишам c57BL/6 робили ін'єкції 50 мкг плазмідної ДНК (pRK-lL-17A) або тільки вектора pRK. Через 48 годин в обох групах збирали сироватку й вимірювали рівень IL-17 у сироватці за допомогою ELISA. B) Три групи мишей після нічного голодування піддали інтраперітонеальній GTT, і результати представлені у вигляді графіка залежності від часу, що пройшов після ін'єкції глюкози (*p>0,05). Хоча даний винахід був описаний з посиланнями на конкретні приклади втілення, при цьому розуміється, що даний винахід не обмежений такими втіленнями. Навпаки, мається на увазі, що даний винахід охоплює різні модифікації й еквіваленти, включені в суть і обсяг прикладеної формули винаходу. 25 UA 105384 C2 26 UA 105384 C2 27 UA 105384 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюTreatment of insulin-resistant disorders
Автори англійськоюKolumam, Ganesh, A., Hu, Yan, US); Ouyang, Wenjun
Автори російськоюКолумам Ганеш А., Ху Янь (Хелен), Оуян Веньцзюнь
МПК / Мітки
МПК: A61K 39/395, A61P 5/48, C07K 16/24, C07K 16/28
Мітки: лікування, порушень, пов'язаних, інсулінорезистентністю
Код посилання
<a href="https://ua.patents.su/43-105384-likuvannya-porushen-povyazanikh-z-insulinorezistentnistyu.html" target="_blank" rel="follow" title="База патентів України">Лікування порушень, пов’язаних з інсулінорезистентністю</a>
Попередній патент: Спосіб утилізаціїї полімінеральних розсолів прикарпаття
Наступний патент: Кристалічна форма сполуки трициклічного бензопірану і спосіб її отримання (варіанти)
Випадковий патент: Підкладка для звукоізоляції плаваючої плити