1′,3′-дизаміщені 4-феніл-3,4,5,6-тетрагідро-2н,1’н-[1,4′]біпіридиніл-2′-они
Номер патенту: 100126
Опубліковано: 26.11.2012
Автори: МакДональд Грегор Джеймс, Дюве Ґійом Альбер Як'юес, Трабанко-Суарез Андрес Авеліно, Сід-Нюнез Хосе Марія, Фінн Террі Патрік, Лют'єнс Роберт Йоганнес
Формула / Реферат
1. Сполука, що має формулу (І)
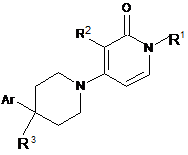 , (І)
, (І)
або її стереохімічно ізомерні форми, де
R1 - С1-6алкіл або С1-3алкіл, що заміщено вибраним з групи: С3-7циклоалкіл, феніл або феніл, що заміщено вибраним з групи: галоген, трифлуорметил або трифлуорметокси;
R2 - галоген, трифлуорметил, С1-3алкіл або циклопропіл;
R3 - гідроген, флуор, гідроксил, гідроксіС1-3алкіл, гідроксіС1-3алкілоксил, флуорС1-3алкіл, флуорС1-3алкілоксил або ціано; а
Аr - незаміщений феніл або феніл, що заміщено n радикалами R4, де n = 1, 2 або 3;
R4 вибрано з групи: гідроген, галоген, С1-3алкіл, гідроксіС1-3алкіл, полігалогенС1-3алкіл, ціано, гідроксил, аміно, карбоксил, С1-3алкілоксіС1-3алкіл, С1-3алкілокси, полігалогенС1-3алкілокси, С1-3алкілкарбоніл, моно- та ді(С1-3алкіл)аміно та морфолініл; або
два сусідні R4 разом утворюють бівалентний радикал формули
-N=CH-NH-, (a)
-CH=CH-NH- (b) або
-О-СН2-СН2-NН- (с); або
R3 та R4 в орто-позиції разом утворюють бівалентний радикал формули
-СН2-О- (d) або
-О-СН2- (e);
або її фармацевтично прийнятна сіль або сольват.
2. Сполука за п. 1, де
R1 - 1-бутил, 2-метил-1-пропіл, 3-метил-1-бутил, (циклопропіл)метил або 2-(циклопропіл)-1-етил;
R3 - гідроген, флуор або ціано; а
Аr - незаміщений феніл або феніл, що заміщено вибраним з групи: галоген, трифлуорметил, морфолініл або гідроксіС1-3алкіл;
або її фармацевтично прийнятна сіль або сольват.
3. Сполука за п. 1 де
R1 - 1-бутил, 3-метил-1-бутил, (циклопропіл)метил або 2-(циклопропіл)-1-етил;
R2 - хлор;
R3 - гідроген або флуор; а
Аr - незаміщений феніл або феніл, що заміщено вибраним з групи: гідроксіC1-3алкіл;
або її фармацевтично прийнятна сіль або сольват.
4. Сполука за п. 1, якою є:
3'-хлоро-1'-циклопропілметил-4-феніл-3,4,5,6-тетрагідро-2H,1'Н-[1,4']біпіридиніл-2'-он;
або її фармацевтично прийнятна сіль або сольват.
5. Сполука за п. 1, якою є:
1'-бутил-3'-хлоро-4-феніл-3,4,5,6-тетрагідро-2Н,1'Н-[1,4']біпіридиніл-2'-он;
або її фармацевтично прийнятна сіль або сольват.
6. Сполука за п. 1, якою є:
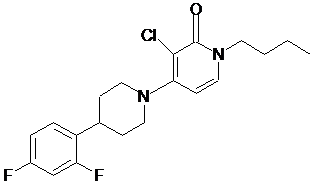 ;
;
або її фармацевтично прийнятна сіль або сольват.
7. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-6 та фармацевтично прийнятний носій або наповнювач.
8. Сполука за будь-яким з пп. 1-6 для застосування як медикаменту.
9. Застосування сполуки за будь-яким з пп. 1-6 або фармацевтичної композиції за п. 7 для вироблення медикаменту для лікування або попереджання стану у ссавця, у тому числі людини, лікування або попереджання якого піддається дії або полегшується нейромодуляторною дією позитивних алостеричних модуляторів mGluR2.
10. Спосіб лікування або попереджання розладу центральної нервової системи, що вибрано з групи: розлади з компонентом тривоги, психотичні розлади, розлади особистості, пов'язані з хімічними речовинами розлади, розлади харчування, розлади настрою, мігрень, епілепсія або судомні синдроми, дитячі розлади, когнітивні розлади, нейродегенерація, нейротоксичність та ішемія, який полягає у застосуванні до особи сполуки за будь-яким з пп. 1-6.
11. Спосіб за п. 10, згідно з яким розлад центральної нервової системи є розладом з компонентом тривоги, що вибрано з групи: агорафобія, генералізований розлад з компонентом тривоги (GAD), обсесивно-компульсивний розлад (OCD), розлад панічного типу, посттравматичний стресовий розлад (PTSD), соціальна фобія та інші фобії.
12. Спосіб за п. 10, згідно з яким розладом центральної нервової системи є психотичний розлад, що вибрано з групи: шизофренія, маячний розлад, шизоафективний розлад, шизоморфний розлад та індукований хімічною речовиною психотичний розлад.
13. Спосіб за п. 10, згідно з яким розлад центральної нервової системи є розладом особистості, що вибрано з групи: обсесивно-компульсивний розлад особистості та шизоїдний розлад, розлад особистості при шизофренії.
14. Спосіб за п. 10, згідно з яким розладом центральної нервової системи є пов'язаний з хімічною речовиною розлад, що вибрано з групи: зловживання алкоголем, залежність від алкоголю, синдром відвикання від алкоголю, делірій при відвиканні від алкоголю, індукований алкоголем психотичний розлад, залежність від амфетамінів, синдром відвикання від амфетамінів, залежність від кокаїну, синдром відвикання від кокаїну, залежність від нікотину, синдром відвикання від нікотину, залежність від опіоїдів та синдром відвикання від опіоїдів.
15. Спосіб за п. 10, згідно з яким розлад центральної нервової системи є розладом харчування, що вибрано з групи: нервова анорексія та нейрогенна булімія.
16. Спосіб за п. 10, згідно з яким розлад центральної нервової системи є розладом настрою, що вибрано з групи: біполярні розлади (І та II), циклотимічний розлад, депресія, психодепресивний розлад, глибокий депресивний розлад та індукований хімічною речовиною розлад настрою.
17. Спосіб за п. 10, згідно з яким розладом центральної нервової системи є мігрень.
18. Спосіб за п. 10, згідно з яким розладом центральної нервової системи є епілепсія або конвульсивний синдром, що вибрано з групи: генералізована неконвульсивна епілепсія, генералізована конвульсивна епілепсія, епілептичний стан при малій епілепсії, епілептичний стан при великій епілепсії, часткова епілепсія з порушенням або без порушення свідомості, дитячі спазми, часткова повторювана епілепсія та інші форми епілепсії.
19. Спосіб за п. 10, згідно з яким дитячим розладом є розлад з гіперактивністю та нестачею уваги.
20. Спосіб за п. 10, згідно з яким розладом центральної нервової системи є когнітивний розлад, що вибрано з групи: марення, індуковане хімічною речовиною стійке марення, деменція, деменція внаслідок ВІЛ-хвороби, деменція внаслідок хвороби Хантінгтона, деменція внаслідок хвороби Паркінсона, деменція типу Альцгеймера, індукована хімічною речовиною стійка деменція та помірне когнітивне порушення.
21. Спосіб за п. 10, згідно з яким розлад центральної нервової системи є вибраним з групи: тривога, шизофренія, мігрень, депресія та епілепсія.
22. Спосіб за пп. 10-21, в якому застосовують до особи сполуки за будь-яким з пп. 1-6 у комбінації з ортостеричним агоністом mGluR2.
Текст
Реферат: Цей винахід стосується нових сполук, зокрема нових піридинопохідних формули (I) O R2 N Ar R3 R1 N , (І) де усі радикали є визначеними у заявці та формулі винаходу. UA 100126 C2 (12) UA 100126 C2 Сполуки згідно з винаходом є позитивними алостеричними модуляторами метаботропних рецепторів підтипу 2 ("mGluR2"), котрі є корисними для лікування або запобігання неврологічним та психіатричним розладам, асоційованим з глутаматною дисфункцією, та хворобам, у котрих задіяні метаботропні рецептори підтипу mGluR2. Зокрема, такими хворобами є розлади центральної нервової системи, вибрані з групи: тривога, шизофренія, мігрень, депресія та епілепсія. Винахід також стосується фармацевтичних композицій та способів отримання таких сполук та композицій, а також застосування таких сполук для запобігання та лікування таких хвороб, у котрих задіяні mGluR2. O R2 N Ar R3 N R1 UA 100126 C2 5 10 15 20 25 30 35 40 45 50 55 Цей винахід стосується нових піридинон-похідних, котрі є позитивними алостеричними модуляторами метаботропного рецептору глутамату підтипу 2 ("mGluR2"), та котрі є корисними для лікування або запобігання неврологічних та психіатричних розладів, асоційованих з глутаматною дисфункцією, та хвороб, у котрих задіяні метаботропні рецептори підтипу mGluR2. Винахід також стосується фармацевтичних композицій, що містять такі сполуки, способів отримання таких сполук та композицій, та застосування таких сполук для запобігання або лікування неврологічних та психіатричних розладів та хвороб, у котрих задіяні mGluR2. Глутамат є головним нейротрансмітером амінокислот у центральній нервовій системі ссавців. Глутамат грає головну роль у ряді фізіологічних функцій, як-то навчання та пам'ять, але також сенсорне сприйняття, розвиток синаптичної пластичності, моторний контроль, дихання та регулювання серцево-судинної функції. Більш того, глутамат є у центрі кількох відмінних неврологічних та психіатричних хвороб, де є неузгодженість у глутаматергічній нейротрансмісії. Глутамат опосередковує синаптичну нейротрансмісію активацією іонотропних каналів рецепторів глутамату (іGluR) та рецепторів NМDА, АМРА та каїнатних рецепторів, котрі є відповідними за швидку передачу збудження. На додаток, глутамат активує метаботропні рецептори глутамату (mGluR), котрі грають більшу модуляторну роль, що сприяє точному регулюванню синаптичної ефективності. Глутамат активує mGluR через зв'язування з великим зовнішньоклітинним амінокінцевим доменом рецептору, тут названим ортостеричним сайтом зв'язування. Це зв'язування індукує конформаційну зміну у рецепторі, що призводить до активації G-білку та внутрішньоклітинних шляхів передачі сигналів. Підтип mGluR2 є негативно сполученим з аденілат-циклазою активацією Gαі-білку, та його активація призводить до інгібування вивільнення глутамату у синапсі. У центральній нервовйі системі (ЦНС), рецептори mGluR2 є поширеними головним чином у корі головного мозку, таламічних регіонах, допоміжній нюховій луковиці, гіпокампі, мигдалевидній залозі та хвостатій шкаралупі. Активування mGluR2 було показано у клінічних дослідженнях як ефективне для лікування розладів з компонентом тривоги. На додаток, активування mGluR2 у різних тваринних моделях було показаним як ефективне, таким чином представляючи можливий новий терапевтичний підхід для лікування вибраного з групи: шизофренія, епілепсія, схильність/залежність від ліків, хвороба Паркінсона, біль, розлади сну та хвороба Хантингтона. Досі більшість доступних фармакологічних засобів, що націлюють mGluR, є ортостеричними лігандами, котрі активують кілька членів родини, оскільки вони є структурними аналогами глутамату. Новим шляхом розробки селективних сполук, що діють на mGluR, є ідентифікація сполук, що діють через алостеричні механізми, модулюючи рецептор зв'язуванням з сайтом, відмінним від високо збереженого ортостеричного сайту зв'язування. Позитивні алостеричні модулятори mGluR виявлені останнім часом як нові фармакологічні сутності, що забезпечують цю привабливу альтернативу. Різні сполуки описані як позитивні алостеричні модулятори mGluR2. WО2004/092135 (NРS & Аstrа Zеnеса), WО2004/018386, WО2006/014918 та WО2006/015158 (Меrсk), WО2001/56990 (Еlі Lіllу) та WО2006/030032 (Аddех & Jаnssеn Рhаrmасеutіса) описують відповідно фенілсульфонамід, ацетофенон, інданон, піридилметилсульфонамід та піридинон-похідні як позитивні алостеричні модулятори mGluR2. Жодна з конкретно розкритих там сполук не є структурно спорідненою зі сполуками цього винаходу. Продемонстровано, що такі сполуки не активують рецептор самі по собі. Переважно вони роблять можливим створення максимальної реакції рецептору на концентрацію глутамату, котра сама індукує мінімальну реакцію. Мутаційний аналіз недвозначно продемонстрував, що зв'язування позитивних алостеричних модуляторів mGluR2 не відбувається на ортостеричному сайті, але замість цього на алостеричному сайті, розташованому у сьомому трансмембранному регіоні рецептору. Дані від тварин свідчать, що позитивні алостеричні модулятори mGluR2 виявляють дію у моделях тривоги та психозу, подібних отриманим з ортостеричними агоністами. Алостеричні модулятори mGluR2 були показані як активні у потенційованому острахом переляку, та у моделях тривоги, індукованої стресом від гіпертермії. Більш того, такі сполуки були показані як активні у скасуванні індукованої кетаміном або амфетаміном гіперлокомоції, та у скасуванні індукованого амфетаміном зруйнування преімпульсного інгібування моделей шизофренії під дією акустичного переляку. (J. Рhаrmасоl. Ехр. Тhеr. 2006, 318, 173-185; Рsусhорhаrmасоlоgу 2005, 179, 271-283). 1 UA 100126 C2 5 10 Сучасні дослідження тварин крім того виявляють, що селективний позитивний алостеричний модулятор метаботропного рецептору глутамату підтипу 2 біфеніл-інданон (ВІNА) блокує модель психозу з галюциногенними ліками, підтримуючи стратегію націлювання рецепторів mGluR2 на лікування глутаматергічної дисфункції при шизофренії. (Моl. Рhаrmасоl. 2007, 72, 477-484). Позитивні алостеричні модулятори роблять можливим потенціювання реакції глутамату, але вони, як також показано, потенціюють реакцію на ортостеричні агоністи mGluR2, як-то LY379268 або DСG-ІV. Ці дані дають свідоцтво ще одного нового терапевтичного підходу для лікування вищезгаданих неврологічних та психіатричних хвороб, охоплюючи mGluR2, із застосуванням комбінації позитивного алостеричного модулятору mGluR2 разом з ортостеричним агоністом mGluR2. Цей винахід стосується сполук, що мають модуляторну активність метаботропних рецепторів глутамату 2, вказані сполуки мають формулу (І) O R Ar 15 20 25 30 35 40 45 50 R3 R1 2 N N (І) та їх стереохімічно ізомерних форм, де R1 - С1-6алкіл; або С1-3алкіл, заміщений С3-7циклоалкілом, феніл, або феніл, заміщений галогеном, трифлуорметилом або трифлуорметоксилом; R2 - галоген, трифлуорметил, С1-3алкіл або циклопропіл; R3 - гідроген, флуор, гідроксил, гідроксиС1-3алкіл, гідроксиС1-3алкілоксил, флуорС1-3алкіл, флуорС1-3алкілоксил або ціано; та Аr - незаміщений феніл; або феніл, заміщений n радикалами R4, де n=1, 2 або 3; R4 є вибраним з групи: гідроген, галоген, С1-3алкіл, гідроксиС1-3алкіл, полігалогенС13алкіл, ціано, гідроксил, аміно, карбоксил, С1-3алкілоксиС1-3алкіл, С1-3алкілоксил, полігалогенС1-3алкілоксил, С1-3алкілкарбоніл, моно- та ді(С1-3алкіл)аміно, та морфолініл; або два сусідні R4-радикали разом утворюють двовалентний радикал формули -N=СН-NН- (а), -СН=СН-NН- (b), або -О-СН2-СН2-NН- (с); або R3 та R4-радикал в орто-позиції разом утворюють двовалентний радикал формули -СН2-О- (d), або -О-СН2- (е); та їх фармацевтично прийнятних солей та сольватів. В одному втіленні винахід стосується сполуки формули (І) або її стереохімічно ізомерної форми, де R1 - С1-6алкіл; або С1-3алкіл, заміщений С3-7циклоалкілом, феніл, або феніл, заміщений галогеном, трифлуорметилом або трифлуорметоксилом; R2 - галоген, трифлуорметил, С1-3алкіл або циклопропіл; R3 - гідроген, флуор, гідроксил, гідроксиС1-3алкіл, гідроксиС1-3алкілоксил, флуорС1-3алкіл, флуорС1-3алкілоксил або ціано; та Аr - незаміщений феніл, або феніл, заміщений n радикалами R4, де n=1, 2 або 3; R4 є вибраним з групи: гідроген, галоген; С1-3алкіл; гідроксиС1-3алкіл, полігалогенС13алкіл; ціано; гідроксил; аміно; карбоксил; С1-3алкілоксиС1-3алкіл; С1-3алкілоксил; полігалогенС1-3алкілокси; С1-3алкілкарбоніл; моно- та ді(С1-3алкіл)аміно, та морфолініл; або два сусідні R4-радикали разом утворюють двовалентний радикал формули -N=СН-NН- (а), -СН=СН-NН- (b), або -О-СН2-СН2-NН- (с); та їх фармацевтично прийнятних солей та сольватів. В одному втіленні винахід стосується сполуки формули (І) або її стереохімічно ізомерної форми, де R1-1-бутил, 2-метил-1-пропіл, 3-метил-1-бутил, (циклопропіл)метил або 2- (циклопропіл)-1етил; R2 - хлор, бром, циклопропіл або трифлуорметил; 2 UA 100126 C2 5 10 15 20 25 30 35 40 45 50 55 60 R3 - гідроген, флуор або ціано; та Аr - незаміщений феніл; або феніл, заміщений галогеном, трифлуорметилом, морфолінілом або гідроксиС1-3алкілом; або її фармацевтично прийнятної солі або сольвату. В одному втіленні винахід стосується сполуки формули (І) або її стереохімічно ізомерної форми, де R1 - 1-бутил, 3-метил-1-бутил, (циклопропіл)метил або 2-(циклопропіл)-1-етил; R2 - хлор; R3 - гідроген або флуор; та Аr - незаміщений феніл; або феніл, заміщений гідроксиС1-3 алкілом; або її фармацевтично прийнятної солі або сольвату. В одному втіленні винахід стосується сполуки 3'-Хлор-1'-циклопропілметил-4-феніл-3,4,5,6-тетрагідро-2Н, 1'Н-[1,4']біпіридиніл-2'-он (П1) або 1'-Бутил-3'-хлор-4-феніл-3,4,5,6-тетрагідро-2Н, 1'Н-[1,4']біпіридиніл-2'-он (П2). Позначення С1-3алкіл як групи або частини групи визначає насичений, нерозгалужений або розгалужений вуглеводневий радикал, що має від 1 до 3 атомів карбону, як-то метил, етил, 1пропіл та 1-метилетил; наприклад, гідроксиС1-3алкіл, наприклад, визначає гідроксиметил, 2гідроксіетил, 3-гідроксипропіл та 1-гідрокси-1-метилетил. Позначення С1-6алкіл як групи або частини групи визначає насичений, нерозгалужений або розгалужений вуглеводневий радикал, що має від 1 до 6 атомів карбону карбону, як-то метил, етил, 1-пропіл, 1-метилетил, 1-бутил, 2-метил-1-пропіл, 3-метил-1-бутил, 1-пентил, 1-гексил тощо. Позначення С3-7циклоалкіл визначає насичений, циклічний вуглеводневий радикал, що має від 3 до 7 атомів карбону, як-то циклопропіл, циклобутил, циклопентил, циклогексил та циклогептил. Позначення галогену як групи або частини групи є загальним для флуору, хлору, брому, йоду. Для терапевтичного застосування солі сполук формули (І) мають фармацевтично прийнятний протиіон. Однак, солі кислот та основ, котрі є фармацевтично неприйнятними, можуть також знайти застосування, наприклад, при отриманні або очистці фармацевтично прийнятної сполуки. Усі солі, фармацевтично прийнятні або ні, є охопленими цим винаходом. Фармацевтично прийнятні солі, як визначено, містять терапевтично активні нетоксичні кислотно-адитивні солі, які сполуки формули (І) здатні утворювати. Вказані солі можна отримувати обробкою основної форми сполуки формули (І) прийнятними кислотами, наприклад, неорганічними кислотами, наприклад, галогенідною кислотою, як-то хлоридна кислота, бромідна кислота, сульфатна кислота, нітратна кислота та фосфатна кислота; органічними кислотами, як-то оцтова кислота, гідроксіоцтова кислота, пропанова кислота, молочна кислота, піровиноградна кислота, щавлева кислота, малонова кислота, бурштинова кислота, малеїнова кислота, фумарова кислота, яблучна кислота, винна кислота, лимонна кислота, метансульфонова кислота, етансульфонова кислота, бензенсульфонова кислота, птолуєнсульфонова кислота, цикламінова кислота, саліцилова кислота, п-аміносаліцилова кислота та памова кислота. Навпаки, вказану сіль можна перетворити у вільну основу обробкою прийнятною основою. Сполуки формули (І), що містять кислотні протони, можна також перетворити в їх терапевтично активні нетоксичні солі основ обробкою прийнятними органічними та неорганічними основами. Прийнятні солі основ містять, наприклад, солі амонію, солі лужних та лужноземельних металів, як-то літій, натрій, калій, магній та кальцій, солі з органічними основами, як-то бензатин, N-метил-D-глюкамін, гібрамін, та солі з амінокислотами, як-то аргінін та лізин. Навпаки, вказану сіль можна перетворити у вільну кислоту обробкою прийнятною кислотою. Термін сольват охоплює форми з вмістом розчиннику, а також їх солі, котрі сполуки формули (І) здатні утворювати. Прикладами таких форм з вмістом розчиннику є, наприклад, гідрати, алкоголяти тощо. Термін "стереохімічно ізомерні форми" визначає усі можливі ізомерні форми, що сполуки формули (І) можуть мати. Якщо не згадане інше, хімічне позначення сполуки означає суміш усіх можливих стереохімічно ізомерних форм, вказані суміші містять усі діастереомери та енантіомери основної молекулярної структури. Винахід також стосується кожної з індивідуальних ізомерних форм сполук формули (І) та їх солей і сольватів, по суті вільних, тобто асоційованих із менше, ніж 10 %, переважно менше, ніж 5 %, зокрема менше, ніж 2 % та 3 UA 100126 C2 5 10 15 20 25 30 35 40 45 найкраще менше, ніж 1 % інших ізомерів. Таким чином, коли сполука формули (І) є, наприклад, вказана як (R), це означає, що сполука є по суті вільною від (S) ізомеру. Стереогенні центри можуть мати R- або S-конфігурацію; замісники на двовалентних циклічних (частково) насичених радикалах можуть мати цис- або транс-конфігурацію. За номенклатурою САS, коли два стереогенні центри відомої абсолютної конфігурації є наявними у сполуці, дескриптор R або S є визначеним (на основі правила Кана-ІнгольдаПрелога) стосовно найнижче-нумерованого хірального центра, опорного центра. Конфігурацію другого стереогенного центра визначають, застосовуючи відповідні дескриптори [R*,R*] або [R*,S*], де R* завжди вказано як опорний центр та [R*,R*] визначає центри з такою ж хіральністю та [R*,S*] визначає центри іншої хіральності. Наприклад, якщо найнижче-нумерований хіральний центр у сполуці має S-конфігурацію та другий центр є R, стереодескриптор вказує S[R*,S*]. Якщо застосовують "α" та "β": позиція заміснику найвищого пріоритету на асиметричному атомі карбону у кільцевій системі, що має найнижчий кільцевий номер, є довільно завжди у позиції "α" середньої площини, визначеної кільцевою системою. Позиція заміснику найвищого пріоритету на іншому асиметричному атомі карбону у кільцевій системі (атом гідрогену у сполуках формули (І)) відносна позиція заміснику найвищого пріоритету на опорному атомі є названою "α", якщо вона є з того ж боку середньої площини, визначеної кільцевою системою, або "β", якщо вона є з іншого боку середньої площини, визначеної кільцевою системою. У рамках цієї заявки, елемент, зокрема, при згадуванні відносно сполук формули (І), містить усі ізотопи та ізотопні суміші цього елементу, існуючі у природі або отримані синтетично, з природною поширеністю або у збагаченій ізотопами формі. Радіомічені сполуки формули (І) можуть містити радіоактивний ізотоп, вибраний з групи: 3Н, 11С, 18F, 122І, 123І, 125І, 131І, 75Вr, 76Вr, 77Вr та 82Вr. Переважно, радіоактивний ізотоп є вибраним з групи: 3Н, 11С та 18F. Отримання Сполуки згідно з винаходом можна загалом отримувати послідовністю етапів, кожний з котрих є відомим спеціалісту. Зокрема, сполуки можна отримувати нижченаведеними способами синтезу. Сполуки формули (І) можна синтезувати у формі рацемічної суміші енантіомерів, котру можна розділяти відомими способами розділення. Рацемічні сполуки формули (І) можна перетворити у відповідні діастереомерні солі реакцією з придатною хіральною кислотою. Вказані діастереомерні солі далі розділяють, наприклад, селективною або фракційною кристалізацією та енантіомери вивільняють звідти лугом. Альтернативний спосіб розділення енантіомерів сполук формули (І) охоплює рідинну хроматографію, застосовуючи хіральну стаціонарну фазу. Вказані чисті стереохімічно ізомерні форми можуть також бути похідними з відповідних чистих стереохімічно ізомерних форм прийнятних вихідних матеріалів, за умови, що реакція відбувається стереоспецифічно. А. Отримання кінцевих сполук Експериментальні способи 1 Сполуки формули (І), у випадку R2 як галогену, можна отримувати реакцією інтермедіату формули (ІІ) з N-галогенсукцинімідом, як-то N-хлорсукцинімід, N-бромсукцинімід або Nйодсукцинімід, згідно зі схемою реакцій (1). Цю реакцію проводять у придатному інертному апротонному розчиннику, як-то, наприклад, дихлорметан або 1,2-дихлоретан, перемішуючи реакційну суміш при придатній температурі, звичайно при кімнатній температурі, протягом потрібного часу для завершення реакції, звичайно 1 годину. У схемі реакцій (1), R2 - галоген, а усі інші змінні є визначеними як у формулі (І). Схема реакцій 1 O R1 N Ar R2 O R1 N N-галогенсукцинімід N Ar R3 R3 (II) N (I) R 2 = галоген 50 Експериментальні способи 2 4 UA 100126 C2 5 10 Альтернативно, сполуки формули (І) можна отримувати реакцією інтермедіату формули (ІІІ) з інтермедіатом формули (ІV), котрий може бути комерційно доступним або його можна синтезувати способами, добре відомими спеціалісту, згідно зі схемою реакцій (2). Цю реакцію проводять у придатному інертному розчиннику, як-то, наприклад, толуєн, у присутності придатної основи, як-то, наприклад, натрій трет-бутоксид, каталізатору на основі металу, конкретно паладієвого каталізатору, як-то паладій(ІІ) ацетат, та придатного ліганду, як-то, наприклад, [1,1'-бінафтален]-2,2'-діїлбіс[дифенілфосфін] (ВІNАР), гріючи протягом достатнього часу, що дозволяє завершення реакції, наприклад, при 100 ºС протягом 16 годин у герметично закритій тубі. У схемі реакцій (2), Zа є групою, придатною для опосередкованого паладієм сполучення з амінами, як-то, наприклад, галоген або трифлат. Усі інші змінні є визначеними як у формулі (І). Схема реакцій 2 Ar O R1 R2 N R3 NH O R1 R2 N (IV) Ar Za R3 (III) N (I) 15 20 25 30 35 40 Такі інтермедіати формули (ІІ) та формули (ІІІ) можна отримувати згідно зі схемами реакцій (3) - (11) (дивись нижче). Перетворення відмінних функціональних груп, наявних у кінцевих сполуках, в інші функціональні групи формули (І), можна проводити способами синтезу, добре відомими спеціалісту. Додатково, сполуки формули (І) може отримувати спеціаліст відомими способами наступними модифікаціями сполук формули (І): Алкілування сполуки формули (І), що містить у структурі один або більш гідроксизамісників, придатним засобом алкілування, як-то, наприклад, 2-флуоретил тозилат в умовах нагрівання, застосовуючи придатн основ, як-то, наприклад, натрій гідрид, у придатному інертному розчиннику, як-то, наприклад, 1,2-диметоксіетан або диметилформамід. Флуорування сполуки формули (І), що містить у структурі один або більш гідроксизамісників, із придатн флуорування агент, як-то, наприклад, (діетиламіно)сульфур трифлуорид. Цю реакцію можна проводити у придатному інертному розчиннику, як-то, наприклад, дихлорметан, при помірно нижчій температурі, як-то, наприклад, температур в межах від -78 ºС до 30 ºС протягом, наприклад, 0,5-12 годин. Реакція сполуки формули (І), що містить у структурі один або більш гідроксизамісників, із спиртовим похідним, застосовуючи придатну систему сполучення, як-то, наприклад, ді-третбутилазодикарбоксилат/трифенілфосфін в умовах нагрівання. В. Отримання інтермедіатів Експериментальні способи 3 Інтермедіати формули (ІІ) можна отримувати реакцією інтермедіату формули (V) з інтермедіатом формули (ІV) згідно зі схемою реакцій (3). Цю реакцію проводять у придатному інертному розчиннику, як-то, наприклад, толуєн, у присутності придатної основи, як-то, наприклад, натрій трет-бутоксид, каталізатору на основі металу, конкретно паладієвого каталізатору, як-то паладій(ІІ) ацетат, та придатного ліганду, як-то, наприклад, [1,1'бінафтален]-2,2'-діїлбіс[дифенілфосфін] (ВІNАР), гріючи протягом достатнього часу, що дозволяє завершення реакції, наприклад, при 100ºС протягом 16 годин у герметично закритій тубі. У схемі реакцій (3), усі змінні є визначеними як у формулі (І). 45 5 UA 100126 C2 Схема реакцій 3 Ar O R1 N R3 NH O R1 N (IV) N Ar Halo R3 (V) (II) галоген 5 10 Експериментальні способи 4 Інтермедіати формули (ІІІ-а) та (ІІІ-b) можна отримувати реакцією інтермедіату формули (VІ), де Y - Н або R2 (як визначено у формулі І), з придатним засобом галогенування, як-то, наприклад, фосфор оксибромід. Цю реакцію можна проводити у придатному інертному розчиннику, як-то, наприклад, ДМФ, при помірно підвищеній температурі, як-то, наприклад, 110 ºС, протягом достатнього часу, що дозволяє завершення реакції, , наприклад, протягом 1 години. У схемі реакцій (4), змінну R1 визначено як у формулі (І). Схема реакцій 4 O R1 Y N O Y засіб галогенування (III-a): Y = R2 (III-b): Y = H (VI) 20 R1 Halo HO 15 N Експериментальні способи 5 Інтермедіати формули (ІІІ-с) можна отримувати реакцією інтермедіату формули (VІ-а) з трифлат-ангідридом (трифлуорметансульфоновий ангідрид). Реакцію можна проводити у придатному інертному розчиннику, як-то, наприклад, дихлорметан, у присутності основи, як-то, наприклад, піридин при нижчій температурі, як-то, наприклад, -78 ºС. У схемі реакцій (5), усі змінні є визначеними як у формулі (І). Схема реакцій 5 O R 2 N R1 O OO O S S O CF3 CF3 O R2 O CF3 HO (VI-a) 25 30 N O S R1 O (III-c) Експериментальні способи 6 Інтермедіати формули (VІ) можна отримувати гідрогенолізом інтермедіатів формули (VІІ-а, VІІ-b або VІІ-с), у придатному інертному розчиннику, як-то, наприклад, етанол, у присутності каталізатору, як-то, наприклад, 10 % паладію на активованому вугіллі, протягом часу, що гарантує завершення реакції, звичайно при кімнатній температурі та 1 атмосфері водню протягом 2 годин. У схемі реакцій (6), змінну R1 визначено як у формулі (І). 6 UA 100126 C2 Схема реакцій 6 O Y O N R1 Y Реакція гідрування O (VI) Y = H, CF3, C1-3 алкіл чи циклопропіл (VII-a): Y = H, (VII-b): Y = CF3, (VII-c): Y = C1-3 алкіл чи циклопропіл 10 R1 HO (VII) 5 N Експериментальні способи 7 Альтернативно, інтермедіати формули (VІ), де Y = галоген, можна отримувати реакцією інтермедіату формули (VІІ-d) у суміші оцтової кислоти та бромідної кислоти, та гріючи суміш при температурі та протягом часу, потрібних для завершення реакції, звичайно при 130 ºС протягом 30 хвилин при мікрохвильовому опроміненні. У схемі реакцій (7), змінну R1 визначено як у формулі (І). Схема реакцій 7 O Y O N R1 кислотний гідроліз O Y N R1 HO (VI) Y = галоген (VII-d): Y = галоген 15 20 25 Експериментальні способи 8 Інтермедіати формули (VІІ-а) можна отримувати відомими способами реакцією комерційно доступного 4-бензилокси-1Н-піридин-2-ону з комерційно доступним засобом алкілування формули (VІІІ), у котрій Zb - придатна відщеплювана група, застосовуючи основу, як-то, наприклад, К2СО3, та, як варіант, йодид, як-то, наприклад, КІ, в інертному розчиннику, як-то, наприклад, ацетонітрил або ДМФ, при помірно високій температурі, як-то, наприклад, 80-120 ºС, протягом достатнього часу, що дозволяє завершення реакції, наприклад, 16 годин. У схемі реакцій (8), змінну R1 визначено як у формулі (І) та Zb - придатна відщеплювана група, як-то, наприклад, галоген. Схема реакцій 8 O Zb N H O R1 N (VIII) R1 O O (VII-a) 30 Експериментальні способи 9 Інтермедіати формули (VІІ-b) можна отримувати реакцією інтермедіату формули (VІІ-е), де Y - йод, з комерційно доступним метил 2,2-дифлуор-2-(флуорсульфоніл)ацетатом, у придатному інертному розчиннику, як-то, наприклад, ДМФ, у присутності придатної солі купруму, як-то купрум(І) йодид, гріючи протягом достатнього часу, що дозволяє завершення реакції, наприклад, при 100ºС протягом 5 годин. У схемі реакцій (9), змінну R1 визначено як у формулі (І). 35 7 UA 100126 C2 Схема реакцій 9 O O Y N R1 CF3 R1 N O O (VII-b) (VII-e), wherein Y = I 5 Експериментальні способи 10 Інтермедіати формули (VІІ-d) можна отримувати реакцією інтермедіату формули (VІІ-а) з комерційно доступним N-галогенсукцинімідом, як-то N-хлор-(NСS), N-бром- (NВS) або Nйодсукцинімід (NІS), у придатному інертному розчиннику, як-то, наприклад, ДМФ, дихлорметан або оцтова кислота, звичайно при кімнатній температурі протягом 1 до 24 годин. У схемі реакцій (10), змінну R1 визначено як у формулі (І). 10 Схема реакцій 10 O O галоген R1 NCS, NBS or NIS N O O (VII-a) 15 20 R1 N (VII-d) Експериментальні способи 11 Інтермедіати формули (VІІ-с) можна отримувати реакцією інтермедіату формули (VІІ-d) з похідним С1-3алкіл- або циклопропіл-боронової кислот, як-то циклопропіл-боронова кислот або метил-боронова кислот, у придатному інертному розчиннику, як-то, наприклад, 1,4-діоксан, у присутності придатного комплексного паладієвого каталізатору, як-то, наприклад, [1,1’біс(дифенілфосфіно)-фероцен]-дихлорпаладій(ІІ) - ДХМ-комплекс, та у присутності придатної основи, як-то натрій гідрогенкарбонат, гріючи протягом достатнього часу, що дозволяє завершення реакції, наприклад, при 175 ºС протягом 20 хвилин при мікрохвильовому опроміненні. У схемі реакцій (11), змінну R1 визначено як у формулі (І). Схема реакцій 11 O Halo HO N R1 B OH O B O OH Y або C1-3 алкіл циклопропіл R1 O O 25 N (VII-d) (VII-c): Y = C1-3 алкіл чи циклопропіл Експериментальні способи 12 Інтермедіати формули (ІV) можна отримувати зняттям захисту з піперидинового нітрогену в інтермедіаті формули (ІХ) де L - придатна захисна група для атома нітрогену похідного піперидину, як-то, наприклад, трет-бутоксикарбоніл, етоксикарбоніл, бензилоксикарбоніл, бензил та метил, відомими способами, згідно зі схемою реакцій (12). У схемі реакцій (12), усі змінні є визначеними як у формулі (І). 30 Схема реакцій (12) N L кислотний гідроліз чи основний гідроліз чи гідрування NH Ar Ar R3 R3 (IX) (IV) Експериментальні способи 13 8 UA 100126 C2 Інтермедіати формули (ІV-а) можна отримувати гідрогенуванням інтермедіату формули (Х) відомими способами, згідно зі схемою реакцій (13). У схемі реакцій (13), Аr визначено як у формулі (І). 5 Схема реакцій (13) NH NH гідрування Ar Ar (IV-a) (X) 10 15 Експериментальні способи 14 Інтермедіати формули (ІХ-а) можна отримувати гідрогенуванням інтермедіату формули (ХІ) де L - придатна захисна група для атома нітрогену похідного тетрагідропіридину, як-то, наприклад, трет-бутоксикарбоніл, етоксикарбоніл, бензилоксикарбоніл, бензил та метил, відомими способами, згідно зі схемою реакцій (14). У схемі реакцій (14), Аr визначено як у формулі (І). Схема реакцій (14) NH NH гідрування Ar Ar (IV-a) (X) 20 25 Експериментальні способи 15 Інтермедіати формули (Х) можна отримувати зняттям захисту з тетрагідропіридиного нітрогену в інтермедіаті формули (ХІ) де L - придатна захисна група для атома нітрогену похідного тетрагідропіридину, як-то, наприклад, трет-бутоксикарбоніл, етоксикарбоніл, бензилоксикарбоніл, бензил та метил, відомими способами, згідно зі схемою реакцій (15). У схемі реакцій (15), Аr визначено як у формулі (І). Схема реакцій (15) N L кислотний гідроліз чи основний гідроліз чи гідрування NH Ar Ar (X) (XI) 30 35 40 Експериментальні способи 16 Інтермедіати формули (ХІ) можна отримувати реакцією інтермедіату формули (ХІІ) з інтермедіатом формули (ХІІІ) згідно зі схемою реакцій (16). Реакцію можна проводити у придатному інертному розчиннику, як-то, наприклад, 1,4-діоксан, або суміші інертних розчинників, як-то, наприклад, 1,4-діоксан/ДМФ, у присутності придатної основи, як-то, наприклад, водний NаНСО3 або Nа2СО3, придатного каталізатору, як-то, наприклад, комплексний паладієвий каталізатор, як-то, наприклад, Рd(РРh3)4, в умовах нагрівання, як-то, наприклад, гріючи реакційну суміш при 150 ºС при мікрохвильовому опроміненні, протягом, наприклад, 10 хвилин. У схемі реакцій (16), усі змінні є визначеними як у формулі (І); Zс є групою, придатною для опосередкованого паладієм сполучення з бороновими кислотами або бороновими естерами, як-то, наприклад, галоген або трифлат; L - придатна захисна група для атома нітрогену похідного тетрагідропіридину, як-то, наприклад, трет-бутоксикарбоніл, етоксикарбоніл, бензилоксикарбоніл, бензил та метил, та R4 та R5 - гідроген або С1-4алкіл, або можуть разом утворювати, наприклад, двовалентний радикал формули -СН2СН2-, СН2СН2СН2-, або -С(СН3)2С(СН3)2-. 9 UA 100126 C2 Схема реакцій (16) Zc N R4O L Ar N (XII) B OR5 Ar (XI) (XIII) 5 10 15 Експериментальні способи 17 Інтермедіати формули (ІV) де R3 - флуор або С1-3алкіл, заміщений флуором, вказаний R3 представлено як -L1-F де L1 - С1-3алкіл або ковалентний зв'язок, та вказані інтермедіати формули (ІV-b), можна отримувати відомими способами реакцією інтермедіату формули (ІХ-b) де L - придатна захисна група для піперидинового нітрогену, як-то, наприклад, третбутоксикарбоніл, етоксикарбоніл, бензилоксикарбоніл, бензил та метил, з придатним засобом флуорування, як-то, наприклад, (діетиламіно)сульфур трифлуорид, даючи інтермедіат формули (ІХ-с) згідно зі схемою реакцій (17) етап (а). Реакцію можна проводити у придатному інертному розчиннику, як-то, наприклад, дихлорметан. Реакцію можна проводити при помірно нижчій температурі, як-то, наприклад, температурі в межах від -78 ºС до 30 ºС протягом, наприклад, 0,5-12 годин. Утворений інтермедіат формули (ІХ-с) можна тоді перетворювати згідно зі схемою реакцій (17) етап (b), в інтермедіаті формули (ІV-b) зняттям захисту з піперидинового нітрогену відомими способами, як-то, наприклад, описаними в експериментальних способах 15 тут вище. У схемі реакцій (17), Аr визначено як у формулі (І). Схема реакцій (17) L N Ar (a) 30 35 (b) NH Ar F L1 (IV-b) Експериментальні способи 18 Інтермедіати формули (ІV) де R3 - С1-3алкілоксил, заміщений флуором, вказаний С13алкілоксил представлено як Q, вказаний R3 представлено як -Q-F, та вказані інтермедіати формули (ІV-d), можна отримувати відомими способами реакцією гідроксил-заміщеного інтермедіату формули (ІХ-d) де L - придатна захисна група для піперидинового нітрогену, як-то, наприклад, трет-бутоксикарбоніл, етоксикарбоніл, бензилоксикарбоніл, бензил та метил, з придатним засобом флуорування, як-то (діетиламіно)сульфур трифлуорид, даючи інтермедіат формули (ІХ-е) згідно зі схемою реакцій (18) етап (а). Реакцію можна проводити у придатному інертному розчиннику, як-то, наприклад, дихлорметан, при помірно нижчій температурі, як-то, наприклад, температурі в межах від -78 ºС до 30 ºС протягом, наприклад, 0,5-12 годин. Інтермедіат формули (ІХ-е) можна тоді перетворювати згідно зі схемою реакцій (18) етап (b) в інтермедіат формули (ІV-d) зняттям захисту з піперидинового нітрогену відомими способами, якто, наприклад, описаними в експериментальних способах 17 вище. У схемі реакцій (18), Аr визначено як у формулі (І). Схема реакцій (18) L N Ar HO Q (IX-d) 40 L (IX-c) (IX-b) 20 N Ar F L1 HO L1 25 L (a) N Ar F Q L (b) NH Ar F Q (IX-e) (IV-d) Експериментальні способи 19 Інтермедіати формули (ІХ-b) де L1 - СН2, вказані інтермедіати формули (ІХ-f), можна отримувати реакцією інтермедіату формули (ХІV) де L - придатна захисна група для піперидинового нітрогену, як-то, наприклад, трет-бутоксикарбоніл, етоксикарбоніл, 10 UA 100126 C2 бензилоксикарбоніл, бензил та метил, з придатним відновником, як-то наприклад, літій алюмогідрид, згідно зі схемою реакцій (19). Реакцію можна проводити у придатному розчиннику, як-то, наприклад, тетрагідрофуран, при помірно нижчій температурі, як-то, наприклад, від -20 ºС. У схемі реакцій (19) Аr визначено як у формулі (І) 5 Схема реакцій (19) L N Ar O O N Ar L OH (IX-f) (XIV) 10 15 20 25 30 35 40 45 50 Вихідні матеріали формул (VІІІ), (ІХ-b), (ІХ-d), (ХІІ), (ХІІІ) та ХІV є комерційно доступними або їх можна отримувати звичайними способами, загалом відомими спеціалістам. Фармакологія Сполуки цього винаходу є позитивними алостеричними модуляторами метаботропних рецепторів глутамату, зокрема вони є позитивними алостеричними модуляторами mGluR2. Сполуки цього винаходу не виявляють зв'язування з сайтом розпізнавання глутамату, сайтом ортостеричного ліганду, але замість цього з алостеричним сайтом у сьомому трансмембранному регіоні рецептору. У присутності глутамату або агоністу mGluR2, сполуки цього винаходу посилюють реакцію mGluR2. Сполуки цього винаходу, як очікують, матимуть свою дію на mGluR2 за їх здатністю посилювати реакцію таких рецепторів на глутамат або агоністи mGluR2, посилюючи реакцію рецептору. Звідси, цей винахід стосується сполук згідно з цим винаходом для застосування як ліків, а також для застосування сполуки згідно з винаходом або фармацевтичної композиції згідно з винаходом для виробництва медикаменту для лікування або запобігання, зокрема лікування, стану у ссавця, охоплюючи людину, лікування або запобігання котрого модифікується або полегшується нейромодуляторною дією алостеричних модуляторів mGluR2, зокрема їх позитивних алостеричних модуляторів. Цей винахід також стосується сполуки згідно з винаходом або фармацевтичної композиції згідно з винаходомдля застосування у виробництві медикаменту для лікування або запобігання, зокрема лікування, стану у ссавця, охоплюючи людину, лікування або запобігання котрого модифікується або полегшується нейромодуляторною дією алостеричних модуляторів mGluR2, зокрема їх позитивних алостеричних модуляторів. Цей винахід також стосується сполуки згідно з винаходом або фармацевтичної композиції згідно з винаходом для лікування або запобігання, зокрема лікування, стану у ссавця, охоплюючи людину, лікування або запобігання котрого модифікується або полегшується нейромодуляторною дією алостеричних модуляторів mGluR2, зокрема їх позитивних алостеричних модуляторів. Також, цей винахід стосується застосування сполуки згідно з винаходом або фармацевтичної композиції згідно з винаходом для виробництва медикаменту для лікування, запобігання, полегшення, контролювання або зменшення ризику різних неврологічних та психіатричних розладів, асоційованих з глутаматною дисфункцією у ссавця, охоплюючи людину, лікування або запобігання котрого модифікується або полегшується нейромодуляторною дією позитивних алостеричних модуляторів mGluR2. Коли винахід стосується застосування сполуки або композиції згідно з винаходом для виробництва медикаменту для, наприклад, лікування ссавця, ясно, що таке застосування інтерпретується на практиці як спосіб, наприклад, лікування ссавця, що полягає у застосуванні до ссавця при потребі такого лікування ефективної кількості сполуки або композиції згідно з винаходом. Зокрема, неврологічні та психіатричні розлади, асоційовані з глутаматною дисфункцією, охоплюють один або більше з нижченаведених станів або хвороб: гострі неврологічні та психіатричні розлади, як-то, наприклад, мозковий дефіцит після серцевого шунтування та пересадження, інсульт, ішемія головного мозку, травма спинного хребта, травма голови, перинатальна гіпоксія, серцева зупинка, гіпоглікемічне неврональне пошкодження, деменція (у тому числі індукована СНІД деменція), хвороба Альцгеймера, хорея Хантингтона, бічний аміотрофний склероз, пошкодження очей, ретинопатія, когнітивні розлади, ідіопатична та 11 UA 100126 C2 5 10 15 20 25 30 35 40 45 50 55 індукована ліками хвороба Паркінсона, м'язові спазми та розлади, асоційовані з м'язовою спастичністю, охоплюючи тремор, епілепсія, конвульсії, мігрень (у тому числі головний біль при мігрені), нетримання сечі, звичка до речовини, синдром відвикання від речовини (у тому числі речовини, як-то, наприклад, опіати, нікотин, тютюнові продукти, алкоголь, бензодіазепіни, кокаїн, заспокійливі, снодійні, тощо), психоз, шизофренія, тривога (у тому числі генералізований розлад з компонентом тривоги, розлад панічного типу, та обсесивно-компульсивний розлад), розлади настрою (у тому числі депресія, манія, біполярні розлади), тригемінальна невралгія, втрати слуху, дзвін у вухах, дистрофія жовтої плями, блювота, набряк головного мозку, біль (у тому числі гострі та хронічні стани, суворий біль, непіддатливий біль, невропатичний біль, та посттравматичний біль), пізня дискінезія, розлади сну (у тому числі нарколепсія), розлад з гіперактивністю та нестачею уваги, та порушення поведінки. Зокрема, станом або хворобою є розлад центральної нервової системи, вибраний з групи: розлади з компонентом тривоги, психотичні розлади, розлади особистості, пов'язані з хімічними речовинами розлади, розлади харчування, розлади настрою, мігрень, епілепсія або судомні синдроми, дитячі розлади, когнітивні розлади, нейродегенерація, нейротоксичність та ішемія. Переважно, розладом центральної нервової системи є розлад з компонентом тривоги, вибраний з групи: агорафобія, генералізований розлад з компонентом тривоги (GАD), обсесивно-компульсивний розлад (ОСD), розлад панічного типу, посттравматичний стресовий розлад (РТSD), соціальна фобія та інші фобії. Переважно, розладом центральної нервової системи є психотичний розлад, вибраний з групи: шизофренія, маячний розлад, шизоафективний розлад, шизоморфний розлад та індукований речовиною психотичний розлад Переважно, розладом центральної нервової системи є розлад особистості, вибраний з групи: обсесивно-компульсивний розлад особистості та шизоїдний розлад, розлад особистості при шизофренії. Переважно, розладом центральної нервової системи є пов'язаний з хімічною речовиною, вибраний з групи: зловживання алкоголем, залежність від алкоголю, синдром відвикання від алкоголю, делірій при відвиканні від алкоголю, індукований алкоголем психотичний розлад, залежність від амфетамінів, синдром відвикання від амфетамінів, залежність від кокаїну, синдром відвикання від кокаїну, залежність від нікотину, синдром відвикання від нікотину, залежність від опіоїдів та синдром відвикання від опіоїдів. Переважно, розладом центральної нервової системи є розлад харчування, вибраний з групи: нервова анорексія та нейрогенна булімія. Переважно, розладом центральної нервової системи є розлад настрою, вибраний з групи: біполярні розлади (І & ІІ), циклотимічний розлад, депресія, психо-депресивний розлад, глибокий депресивний розлад та індукований хімічною речовиною розлад настрою. Переважно, розладом центральної нервової системи є мігрень. Переважно, розладом центральної нервової системи є епілепсія або судомний синдром, вибраний з групи: генералізована неконвульсивна епілепсія, генералізована конвульсивна епілепсія, епілептичний стан при малій епілепсії, епілептичний стан при великій епілепсії, часткова епілепсія з порушенням або без порушення свідомості, дитячі спазми, часткова повторювана епілепсія та інші форми епілепсії. Переважно, розладом центральної нервової системи є розлад з гіперактивністю та нестачею уваги. Переважно, розладом центральної нервової системи є когнітивний розлад, вибраний з групи: марення, індуковане хімічною речовиною стійке марення, деменція, деменція внаслідок ВІЧ-хвороби, деменція внаслідок хвороби Хантингтона, деменція внаслідок хвороби Паркінсона, деменція типу Альцгеймера, індукована хімічною речовиною стійка деменція та помірне когнітивне порушення. З вищезгаданих розладів лікування вибраного з групи: тривога, шизофренія, мігрень, депресія та епілепсія є особливо важливим. Зараз четверте видання Dіаgnоstіс & Stаtіstісаl Маnuаl оf Меntаl Dіsоrdеrs (DSМ-ІV) від Аmеrісаn Рsусhіаtrіс Аssосіаtіоn дає діагностичний засіб ідентифікації розладів, описаних тут. Спеціалісту ясно, що існують альтернативні термінології, нозології та системи класифікації для неврологічних та психіатричних розладів, описаних тут, та що вони еволюціонують з прогресом медицини та науки. Оскільки такі позитивні алостеричні модулятори mGluR2, охоплюючи сполуки формули (І), посилюють реакцію mGluR2 на глутамат, є перевагою, щоб представлені способи використовували ендогенний глутамат. 12 UA 100126 C2 5 10 15 20 25 30 35 40 45 50 55 Оскільки позитивні алостеричні модулятори mGluR2, охоплюючи сполуки формули (І), посилюють реакцію mGluR2 на агоністи, ясно, що цей винахід стосується лікування неврологічних та психіатричних розладів, асоційованих з глутаматною дисфункцією, застосуванням ефективної кількості позитивного алостеричного модулятору mGluR2, охоплюючи сполуки формули (І), у комбінації з агоністом mGluR2. Сполуки цього винаходу можна використовувати у комбінації із одними або більше іншими ліками у лікуванні, запобіганні, контролюванні, полегшенні або зменшенні ризику станів або хвороб, для котрих можна використовувати сполуки формули (І) або інші ліки, де комбінація ліків є безпечнішою або більш ефективною, ніж будь-які ліки поодинці. Фармацевтичні композиції Винахід також стосується фармацевтичної композиції, що містить фармацевтично прийнятний носій або розріджувач та, як активну складову, терапевтично ефективну кількість сполуки згідно з винаходом, зокрема сполуки формули (І), її фармацевтично прийнятної солі, сольвату або стереохімічно ізомерної форми. Сполуки згідно з винаходом, зокрема сполуки формули (І), їх фармацевтично прийнятні солі, сольвати та стереохімічно ізомерні форми, або будь-яку їх підгрупу або комбінацію можна формувати у різні фармацевтичні форми для застосування. На фармацевтичні композиції як прийнятні можна посилатися на усі композиції для системного застосування ліків. Для отримання фармацевтичних композицій цього винаходу, ефективну кількість певної сполуки, як варіант, у формі солі, як активної складової, комбінують у тісній суміші з фармацевтично прийнятним носієм або розріджувачем, ці носій або розріджувач можуть мати багато форм залежно від форми препарату, бажаної для застосування. Ці фармацевтичні композиції є бажаними в окремій формі дозування, придатній, зокрема, для застосування перорально, ректально, підшкірно, парентеральною ін'єкцією або інгаляцією. Наприклад, при отриманні композиції у формі пероральної дози, будь-які звичайні фармацевтичні середовища можуть бути використовуваними, як-то, наприклад, вода, гліколі, олії, спирти тощо, у випадку пероральних рідких препаратів, як-то, наприклад, суспензії, сиропи, еліксири, емульсії та розчини; або тверді носії, як-то, наприклад, крохмалі, цукри, каолін, розріджувачі, лубриканти, зв'язуючі, дезінтегратори тощо у випадку порошків, пігулок, капсул та таблеток. Внаслідок легкості застосування пероральне застосування є кращим, а таблетки та капсули представляють найсприятливіші пероральні окремі дози, у цьому випадку звичайно застосовують тверді фармацевтичні носії. Для парентеральних композицій носій звичайно містить стерильну воду, принаймні у більшій частині, хоча інші складові, наприклад, для посилення розчинності, можна уводити. Розчини для ін'єкцій, наприклад, можна отримувати з вмістом фізіологічного розчину, розчину глюкози або суміші фізіологічного розчину та розчину глюкози. Суспензії для ін'єкцій можна також отримувати, у цьому випадку можуть бути використовуваними прийнятні рідкі носії, суспендувальні агенти тощо. Також охопленими є тверді препарати, що можна також перетворити безпосередньо перед застосуванням у препарати рідкої форми. У композиціях, придатних для підшкірного застосування, носій, як варіант, містить агент посилення проникності та/або придатний змочувальний агент, як варіант, комбінований з придатними адитивами будь-якої природи у незначній кількості, ці адитиви не створюють значного шкідливого впливу на шкіру. Вказані адитиви можуть полегшувати застосування на шкіру та/або можуть бути корисними для отримання бажаних композицій. Ці композиції можна застосовувати різними шляхами, наприклад, як трансдермальний пластир, як краплі, як мазь. Особливо сприятливо формувати вищезгадані фармацевтичні композиції в окрему форму дозування для легкості застосування та однаковості дозування. Окрема форма дозування стосується фізично дискретних одиниць, придатних як окремі дози, кожна з яких містить попередньо визначену кількість активної складової, розраховану для отримання бажаної терапевтичної дії, в асоціації із потрібним фармацевтичним носієм. Прикладами таких окремих форм дозування є таблетки (у тому числі надпилювані або покриті таблетки), капсули, пігулки, пакети порошку, облатки, супозиторії, розчини або суспензії для ін'єкцій тощо, та їх розділені сегрегати. Точне дозування та частота застосування залежить від певної застосовуваної сполуки формули (І), певного стану, що лікують, суворості стану, що лікують, віку, маси, статі, ступеню розладу та загального фізичного стану певного пацієнта, а також інших застосовуваних медикаментів, як добре відомо спеціалістам. Більш того, ясно, що вказана ефективна добова кількість може бути зниженою або посиленою залежно від реакції суб'єкта, кого лікують, та/або залежно від оцінювання лікарем прописаних сполук цього винаходу. 13 UA 100126 C2 5 10 15 20 25 30 35 Залежно від режиму застосування, фармацевтична композиція містить від 0,05 до 99 мас%, переважно від 0,1 до 70 мас%, більш переважно від 0,1 до 50 мас% активної складової, та, від 1 до 99,95 мас%, переважно від 30 до 99,9 мас%, більш переважно від 50 до 99,9 мас% фармацевтично прийнятного носія, усі проценти є на основі загальної маси композиції. Як вже згадано, винахід також стосується фармацевтичної композиції, що містить сполуки згідно з винаходом та одне або більше інших ліків у лікуванні, запобіганні, контролюванні, полегшенні або зменшенні ризику станів або хвороб, для котрих можна використовувати сполуки формули (І) або інші ліки, а також для застосування такої композиції для виробництва медикаменту. Цей винахід також стосується комбінації сполуки згідно з цим винаходом та ортостеричного агоністу mGluR2. Цей винахід також стосується такої комбінації для застосування як ліків. Цей винахід також стосується продукту, що містить (а) сполуку згідно з цим винаходом, її фармацевтично прийнятну сіль або сольват, та (b) ортостеричний агоніст mGluR2, як комбінований препарат для одночасного, окремого або послідовного застосування у лікуванні або запобіганні стану у ссавця, охоплюючи людину, лікування або запобігання котрого модифікується або полегшується нейромодуляторною дією алостеричних модуляторів mGluR2, зокрема, позитивних алостеричних модуляторів. Відмінні ліки з такої комбінації або продукту можна комбінувати в одиничному препараті разом з фармацевтично прийнятними носіями або розріджувачами, або вони, кожне, можуть бути в окремому препараті разом з фармацевтично прийнятними носіями або розріджувачами. Нижченаведені приклади є ілюстративними, але не обмежують рамки цього винаходу. Хімія Кілька способів отримання сполук цього винаходу є ілюстрованими у нижченаведених прикладах. Якщо не згадане інше, усі вихідні матеріали отримували від комерційних постачальників та застосовували без наступної очистки. Далі, "ТГФ" означає тетрагідрофуран; "ДМФ" означає N, N-диметилформамід; "ЕtОАс" означає етилацетат; "ДХМ" означає дихлорметан; "ДМЕ" означає 1,2-диметоксіетан; "ДХЕ" означає 1,2-дихлоретан; "ДІПЕ" означає діізопропіл-етер; "ДМСО" означає диметилсульфоксид; "ВІNАР" означає[1,1'-бінафтален]-2,2'-діїлбіс[дифенілфосфін]; "DВU" означає 1,8-діаза-7біцикло[5,4,0]ундецен; ксантфос означає (9,9-диметил-9Н-ксантен-4,5-діїл)біс[дифенілфосфін]; МеОН означає метанол; "Т.пл." означає точку плавлення; Реакції з мікрохвильовим опроміненням проводили в одно-режимному мікрохвильовому реакторі: ІnіtіаtоrТМ Sіхtу ЕХР (Віоtаgе АВ), або у багаторежимному реакторі: МісrоSYNТН Lаbstаtіоn (Міlеstоnе, Іnс.). Опис 1 4-Бензилокси-1-циклопропілметил-1Н-піридин-2-он (О1) O N O 40 45 Бромметил-циклопропан (3,68 г, 27,33 ммоль) та калій карбонат (10,3 г, 74,52 ммоль) додавали до розчину 4-бензилокси-1Н-піридин-2-ону (5,0 г, 24,84 ммоль) в ацетонітрилі (200 мл) та суміш гріли при кипінні під зворотним холодильником протягом 16 годин. Реакційну суміш фільтрували через діатомову землю та концентрували у вакуумі. Сирий залишок тоді розтирали у порошок з діетил-етером, отримуючи чистий О1 (6,32 г, 98 %) як білий твердий матеріал. Опис 2 1-Циклопропілметил-4-гідрокси-1Н-піридин-2-он (О2) O N HO 14 UA 100126 C2 5 Суміш інтермедіату О1 (2,0 г, 7,83 ммоль) та каталітичну кількість 10 % паладію на активованому вугіллі в етанолі (300 мл) перемішували під воднем протягом двох годин. Суміш фільтрували через діатомову землю та розчинник випарювали у вакуумі, отримуючи інтермедіат О2 (1,3 г, 100 %), що застосовували без наступної очистки. Опис 3 4-Бром-1-циклопропілметил-1Н-піридин-2-он (О3) O N Br 10 15 Фосфор оксибромід (5,4 г, 18,9 ммоль) додавали до розчину інтермедіату О2 (1,42 г, 8,6 ммоль) у ДМФ (140 мл) та суміш гріли при 110 ºС протягом 1 години. Після охолодження у льодяній бані розчин розподіляли між водою та ЕtОАс. Після трьох екстракцій ЕtОАс, комбіновані органічні фракції сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат О3 (1,82 г, 93 %). Опис 7 4-Бром-1-(3-метилбутил)-1Н-піридин-2-он (О7) O N Br 20 25 Інтермедіат О7 отримували способом синтезу D3, застосовуючи 4-гідрокси-1-(3метилбутил)-1Н-піридин-2-он як вихідний матеріал, котрий отримували способом синтезу інтермедіату О2, реакцією 4-бензилокси-1Н-піридин-2-ону з 1-бром-3-метилбутаном. Опис 4 4-Бензилокси-1-бутил-1Н-піридин-2-он (О4) O N O 30 35 1-Бромбутан (3,75 г, 27,33 ммоль) та калій карбонат (10,3 г, 74,52 ммоль) додавали до розчину 4-бензилокси-1Н-піридин-2-ону (5,0 г, 24,84 ммоль) в ацетонітрилі (200 мл) та суміш гріли при кипінні під зворотним холодильником протягом 16 годин. Реакційну суміш фільтрували через діатомову землю та концентрували у вакуумі. Сирий залишок тоді розтирали у порошок з діетил-етером, отримуючи чистий О4 (6,26 г, 98 %) як білий твердий матеріал. Опис 5 1-Бутил-4-гідрокси-1Н-піридин-2-он (О5) O N HO 40 Суміш інтермедіату О4 (2,01 г, 7,83 ммоль) та каталітичну кількість 10 % паладію на активованому вугіллі в етанолі (300 мл) перемішували під воднем протягом двох годин. Суміш 15 UA 100126 C2 фільтрували через діатомову землю та розчинник випарювали у вакуумі, отримуючи інтермедіат О5 (1,3 г, 100 %), що застосовували без наступної очистки. Опис 6 4-Бром-1-бутил-1Н-піридин-2-он (О6) 5 O N Br 10 15 Фосфор оксибромід (5,4 г, 18,9 ммоль) додавали до розчину інтермедіату О5 (1,44 г, 8,6 ммоль) у ДМФ (140 мл) та суміш гріли при 110 ºС протягом 1 години. Після охолодження у льодяній бані, розчин розподіляли між водою та ЕtОАс. Після трьох екстракцій ЕtОАс, комбіновані органічні фракції сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат О6 (1,82 г, 93 %). Опис 8 1-Бутил-3-хлор-4-гідрокси-1Н-піридин-2-он (О8) O Cl N HO 20 25 N-Хлорсукцинімід (1,6 г, 11,96 ммоль) додавали до розчину інтермедіату О5 (2,0 г, 11,96 ммоль) у ДМФ (30 мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі та тоді концентрували у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; 0-5 % метанол / ДХМ як елюент), отримуючи інтермедіат О8 (2,0 г, 83 %). Опис 9 Трифлуор-метансульфонової кислоти 1-бутил-3-хлор-2-оксо-1,2-дигідропіридин-4-іл-естер (О9) O F F F 30 35 O Cl S O N O Піридин (1,60 мл, 19,8 ммоль) додавали до охолодженого (-78 °C) розчину інтермедіату О8 (2,0 г, 9,92 ммоль) у ДХМ (80 мл). Утворений розчин перемішували протягом 10 хвилин, після чого додавали трифлуорметансульфоновий ангідрид (1,90 мл, 10,9 ммоль), та утворений розчин перемішували при -78 ºС протягом 3 годин. Тоді суміш нагрівали до кімнатної температури та гасили додаванням водного насиченого амоній хлориду. Суміш розбавляли водою, екстрагували ДХМ, сушили (Nа2SО4) та розчинник випарювали у вакуумі, отримуючи інтермедіат О9 (3,31 г, 100 %) як сирий матеріал, що застосовували без наступної очистки. Опис 10 4-Бензилокси-1-циклопропілметил-3-йод-1Н-піридин-2-он (О10) O I N O 16 UA 100126 C2 5 N-Йодсукцинімід (2,64 г, 11,74 ммоль) додавали до розчину інтермедіату О1 (3,0 г, 11,74 ммоль) в оцтовій кислоті (40 мл). Реакційну суміш перемішували при кімнатній температурі протягом 1 години, після чого концентрували у вакуумі, очищали флеш-хроматографією (силікагель; 0-3 % метанол / ДХМ як елюент) та кінцево перекристалізовували з діетил-етеру, отримуючи інтермедіат О10 (4,12 г, 92 %) як твердий матеріал. Опис 11 4-Бензилокси-1-циклопропілметил-3-трифлуорметил-1Н-піридин-2-он (О11) F F O N F O 10 15 Метил 2,2-дифлуор-2-(флуорсульфоніл)ацетат (0,67 мл, 5,24 ммоль) та інтермедіат О10 (1,0 г, 2,63 ммоль) додавали до розчину купрум(І) йодиду (0,99 г, 5,24 ммоль) у ДМФ (30 мл). Суміш тоді гріли при 100 ºС протягом 5 годин, після чого фільтрували через діатомову землю та фільтрат концентрували у вакуумі. Залишок очищали колонковою хроматографією (силікагель; ДХМ як елюент), отримуючи інтермедіат О11 (0,76 г, 89 %). Опис 12 1-Циклопропілметил-4-гідрокси-3-трифлуорметил-1Н-піридин-2-он (О12) F F O N F HO 20 25 Суміш інтермедіату О11 (2,0 г, 6,19 ммоль), каталітичну кількість 10 % паладію на активованому вугіллі та етанол (60 мл) перемішували під воднем протягом 2 годин. Суміш фільтрували через діатомову землю та розчинник випарювали у вакуумі, отримуючи сирий інтермедіат О12 (1,45 г, 100 %), що застосовували без наступної очистки. Опис 13 4-Бром-1-циклопропілметил-3-трифлуорметил-1Н-піридин-2-он (О13) F F O N F Br 30 35 Фосфор оксибромід (7,03 г, 24,5 ммоль) додавали до розчину інтермедіату О12 (2,60 г, 11,1 ммоль) у ДМФ (50 мл) та суміш гріли при 110 ºС протягом 1 години. Після охолодження у льодяній бані розчин розподіляли між водою та ЕtОАс. Після трьох екстракцій ЕtОАс, комбіновані органічні фракції сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат О13 (1,38 г, 42 %). Опис 14 4-Бензилокси-1-(4-трифлуорметокси-бензил)-1Н-піридин-2-он (О14) O N O 40 O F F F 17 UA 100126 C2 5 10 1-Бромметил-4-трифлуорметоксибензен (3,32 г, 13,04 ммоль) та калій карбонат (3,51 г, 25,46 ммоль) додавали до суміші 4-бензилокси-1Н-піридин-2-ону (2,5 г, 12,42 ммоль) в ацетонітрилі (10 мл). Реакційну суміш гріли при температурі кипіння під зворотним холодильником протягом 24 годин. Після охолодження до кімнатної температури фільтрували через діатомову землю, тверді залишки промивали метанолом та комбіновані органічні екстракти випарювали у вакуумі. Сирий залишок, отриманий таким чином, осаджували ДІПЕ, отримуючи інтермедіат О14 (4,5 г, 96 %) як білий твердий матеріал. Опис 15 4-Бензилокси-3-хлор-1-(4-трифлуорметокси-бензил)-1Н-піридин-2-он (О15) O Cl N O O F F 15 F N-Хлорсукцинімід (1,68 г, 12,61 ммоль) додавали до розчину інтермедіату О14 (4,31 г, 11,47 ммоль) у ДМФ (30 мл) та суміш перемішували при кімнатній температурі протягом 24 годин. Розчинник випарювали та твердий залишок промивали водою (4 × 25 мл). Сирий твердий продукт промивали ДІПЕ, отримуючи інтермедіат О15 (4,5 г, 95 %) як білий твердий матеріал. Опис 16 3-Хлор-4-гідрокси-1-(4-трифлуорметокси-бензил)-1Н-піридин-2-он (О16) 20 O Cl N HO O F F 25 30 F Бромідну кислоту (0,1 мл) додавали до суміші інтермедіату О15 (4,5 г, 10,98 ммоль) в оцтовій кислоті (20 мл). Розчин гріли при 130 ºС протягом 30 хвилин при мікрохвильовому опроміненні. Після охолодження до кімнатної температури, розчинник випарювали у вакуумі та залишок обробляли водним насиченим розчином NаНСО3 до досягнення рН розчину приблизно 8. Білий твердий матеріал, що осаджувався, збирали фільтруванням та промивали холодним ДІПЕ, отримуючи інтермедіат О16 (1,1 г, 31 %). Опис 17 4-Бром-3-хлор-1-(4-трифлуорметокси-бензил)-1Н-піридин-2-он (О17) O Cl N Br O F F 35 40 F Фосфор оксибромід (1,05 г, 3,75 ммоль) додавали до розчину інтермедіату О16 (1,0 г, 3,13 ммоль) у ДМФ (5 мл) та суміш гріли при 115 ºС протягом 4 годин. Розчинник випарювали у вакуумі та сирий залишок обробляли водним насиченим розчином NаНСО3. Суміш екстрагували ДХМ (3 × 5 мл), органічні фракції сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; діетил-етер як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат О17 (0,21 г, 18 %) як жовту оливу. Опис 18 18 UA 100126 C2 1'-Циклопропілметил-4-феніл-3,4,5,6-тетрагідро-2Н, 1'Н-[1,4']біпіридиніл-2'-он (О18) O N N 5 10 4-Фенілпіперидин (0,45 г, 2,78 ммоль), паладій(ІІ) ацетат (0,016 г, 0,069 ммоль), натрій третбутоксид (0,34 г, 3,5 ммоль) та ВІNАР (0,065 г, 0,104 ммоль) додавали до розчину інтермедіату О3 (0,32 г, 1,39 ммоль) у толуєні (5 мл). Реакційну суміш гріли при 100 ºС протягом 16 годин у герметично закритій тубі, після чого охолоджували до кімнатної температури, розбавляли водою (5 мл) та тоді екстрагували ЕtОАс (3 × 5 мл). Комбіновані органічні фракції сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; 0-4 % метанол/ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат О18 (0,33 г, 78 %). Опис 19 1'-Бутил-4-феніл-3,4,5,6-тетрагідро-2Н, 1'Н-[1,4']біпіридиніл-2'-он (О19) 15 O N N 20 25 4-Фенілпіперидин (0,45 г, 2,78 ммоль), паладій(ІІ) ацетат (0,016 г, 0,069 ммоль), натрій третбутоксид (0,34 г, 3,5 ммоль) та ВІNАР (0,065 г, 0,104 ммоль) додавали до розчину інтермедіату О6 (0,32 г, 1,39 ммоль) у толуєні (5 мл). Реакційну суміш гріли при 100 ºС протягом 16 годин у герметично закритій тубі, після чого охолоджували до кімнатної температури та тоді розбавляли водою (5 мл) та екстрагували ЕtОАс (3 × 5 мл). Комбіновані органічні фракції сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; 0-4 % метанол / ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат О19 (0,38 г, 89 %). Опис 20 1'-Циклопропілметил-2'-оксо-4-феніл-3,4,5,6,1',2'-гексагідро-2Н-[1,4']біпіридиніл-4карбонітрил (О20) JNJ-38818468 O N N 30 35 N 4-Ціано -4-фенілпіперидин гідрохлорид (0,314 г, 1,41 ммоль), паладій(ІІ) ацетат (0,013 г, 0,059 ммоль) натрій трет-бутоксид (0,347 г, 3,54 ммоль) та ВІNАР (0,051 г, 0,08 ммоль) додавали при перемішуванні до розчину інтермедіату О3 (0,27 г, 1,18 ммоль) у толуєні (5 мл). Реакційну суміш гріли при 100 ºС протягом 16 годин у герметично закритій тубі. Після охолодження до кімнатної температури суміш розбавляли водою та екстрагували ЕtОАс. Комбіновану органічну фазу сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; 10 % аміаку у метанолі (7М) / ДХМ як 19 UA 100126 C2 елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи О20 (0,35 г, 87 %) як блідо-жовту оливу. Опис 21 4-Гідрокси-4-фенілпіперидин-1-карбонової кислоти трет-бутил-естер (О21) 5 O N O O O 10 15 20 Метил 2-бромбензоат (1,816 мл, 12,936 ммоль) [САS 610-94-6] додавали до розчину 1,2,3,6тетрагідро-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-піридину (4 г, 12,936 ммоль) [САS 375853-82-0] (синтез описано у WО 2004072025 А2 20040826) в 1,4-діоксані (28 мл) та водному насиченому розчині NаНСО3 (24 мл). Утворений розчин дегазували, застосовуючи потік азоту та Рd(РРh3)4 (0,747 г, 0,647 ммоль) додавали до цього розчину. Реакційну суміш тоді піддавали обробці мікрохвилями у герметично закритій тубі при 140 ºС протягом 5 хвилин. Утворену охолоджену реакційну суміш тоді розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат збирали, сушили Nа2SО4 та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ - ДХМ/ЕtОАс до 6 % як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи О21 (4,04 г, 98 %). Опис 22 4-(2-Флуор-4-метоксикарбоніл-феніл)-3,6-дигідро-2Н-піридин-1-карбонової кислоти третбутил-естер (О22) O N O O F O 25 30 35 Метил 4-бром-3-флуорбензоат (2,261 г, 9,702 ммоль) [САS 849758-12-9] додавали до розчину 1,2,3,6-тетрагідро-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-піридину (3 г, 9,702 ммоль) [САS 375853-82-0] (синтез описано у WО 2004072025 А2 20040826) в 1,4-діоксані (21 мл) та водному насиченому розчині NаНСО3 (18 мл). Утворений розчин дегазували, застосовуючи потік азоту та Рd(РРh3)4 (0,561 г, 0,485 ммоль) додавали до цього розчину. Реакційну суміш тоді піддавали обробці мікрохвилями у герметично закритій тубі при 150 ºС протягом 5 хвилин. Утворену охолоджену реакційну суміш тоді розбавляли ЕtОАс та фільтрували через шар діатомової землі. Фільтрат збирали, сушили Nа2SО4 та концентрували у вакуумі. Сиру реакційну суміш тоді очищали колонковою хроматографією (силікагель; ДХМ ДХМ/ЕtОАс до 6 % як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи О22 (2,107 г, 65 %). Опис 23 4-(2-Флуор-4-метоксикарбоніл-феніл)-піперидин-1-карбонової кислоти трет-бутил-естер (О23) O N O O F O 40 20 UA 100126 C2 5 Розчин інтермедіату О22 (2,81 г, 8,379 ммоль) у метанолі (120 мл) гідрували при кімнатній температурі у присутності 10 % паладію на активованому вугіллі (0,588 г) до завершення реакції. Тверді матеріали відфільтровували та фільтрат випарювали у вакуумі, отримуючи О23 (2,73 г, 97 %). Опис 24 4-[2-Флуор-4-(1-гідрокси-1-метил-етил)-феніл]-піперидин-1-карбонової кислоти трет-бутилестер (О24) O N HO O F 10 15 1,4 М розчин метилмагній броміду у толуєні/ТГФ (17,339 мл, 24,274 ммоль) додавали краплями до охолодженого (0 °C) розчину інтермедіату О23 (2,73 г, 8,091 ммоль) у діетил-етері (150 мл) під азотом. Утворену реакційну суміш тоді перемішували при 50 ºС протягом 2 годин. Після охолодження у льодяній бані суміш обережно гасили насиченим водним розчином амоній хлориду, та тоді екстрагували ЕtОАс. Комбіновану органічну фазу сушили (Nа2SО4) та розчинник випарювали у вакуумі, отримуючи О24 (3,16 г, 100 %). Опис 25 2-(3-Флуор-4-піперидин-4-іл-феніл)-пропан-2-ол (О25) NH HO F 20 25 30 Суміш інтермедіату О24 (3,067 г, 7,852 ммоль) та КОН (2,54 г, 45,268 ммоль) в ізопропіловому спирті (13,5 мл) та воді (27 мл) піддавали обробці мікрохвилями у герметично закритій тубі при 180 ºС протягом 60 хвилин. Утворену охолоджену реакційну суміш тоді розбавляли водою та розсолом та екстрагували дихлорметаном. Комбіновані органічні екстракти сушили (Nа2SО4) та розчинник випарювали у вакуумі. Залишок обробляли дихлорметаном, отримуючи твердий матеріал, що відфільтровували, отримуючи 1,03 г інтермедіату О25. Фільтрат випарювали у вакуумі та залишок, отриманий таким чином, тоді очищали колонковою хроматографією (силікагель; ДХМ/(NН3 7N розчин у МеОН) градієнт до 10 % як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи другу партію 0,5 г О25 (загальна кількість = 1,53 г, 82 %). Т.пл. 151ºС. Опис 26 4-(2-Метоксикарбоніл-феніл)-піперидин-1-карбонової кислоти трет-бутил-естер (О26) O N O O O 35 40 Розчин інтермедіату О21 (4,04 г, 12,729 ммоль) у метанолі (120 мл) гідрували при кімнатній температурі у присутності 10 % паладію на активованому вугіллі (0,846 г) до завершення реакції. Тверді матеріали відфільтровували та фільтрат випарювали у вакуумі, отримуючи О26 як білий твердий матеріал (3,67 г, 90 %). Опис 27 21 UA 100126 C2 4-[2-(1-Гідрокси-1-метил-етил)-феніл]-піперидин-1-карбонової (О27) кислоти трет-бутил-естер O N O OH 5 10 1,4 М розчин метилмагній броміду у толуєні/ТГФ (17,443 мл, 24,421 ммоль) додавали краплями до охолодженого (0 °C) розчину інтермедіату О26 (2,6 г, 8,14 ммоль) у діетил-етері (150 мл) під азотом. Утворену реакційну суміш перемішували при 45 ºС протягом 2 годин. Після охолодження у льодяній бані, суміш обережно гасили насиченим водним розчином амоній хлориду, та тоді екстрагували ЕtОАс. Комбіновану органічну фазу сушили (Nа2SО4) та розчинник випарювали у вакуумі, отримуючи О27 (2,77 г, 69 %). Опис 28 2-(2-Піперидин-4-іл-феніл)-пропан-2-ол (О28) NH OH 15 20 25 Суміш інтермедіату О27 (2,77 г, 5,636 ммоль) та КОН (2,43 г, 43,357 ммоль) в ізопропіловому спирті (13,5 мл) та воді (27 мл) піддавали обробці мікрохвилями у герметично закритій тубі при 180 ºС протягом 60 хвилин. Утворену охолоджену реакційну суміш тоді розбавляли водою та розсолом та екстрагували дихлорметаном. Залишок обробляли дихлорметаном, отримуючи твердий матеріал, що відфільтровували. Вихід: 0,737 г інтермедіату О28. Фільтрат випарювали у вакуумі та залишок тоді очищали колонковою хроматографією (силікагель; ДХМ/(NН3 7N розчин у МеОН) градієнт до 10 % як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи другу партію 0,306 г інтермедіату О28 (загальна кількість = 1,04 г, 84 %). Т.пл. 219,5ºС. Опис 29 4-Гідрокси-4-фенілпіперидин-1-карбонової кислоти трет-бутил-естер (О29) O O N OH 30 35 Ді-трет-бутил дикарбонат (2,95 г, 13,53 ммоль) додавали до розчину 4-гідрокси-4фенілпіперидину (2 г, 11,28 ммоль) у ДХМ (50 мл). Реакційну суміш перемішували при кімнатній температурі протягом 5 годин. Розчинник видаляли у вакуумі, отримуючи бажаний інтермедіат О29 (3,12 г, 100 %) як сирий матеріал, що застосовували без наступної очистки. Опис 30 4-флуор-4-фенілпіперидин-1-карбонової кислоти трет-бутил-естер (О30) 22 UA 100126 C2 O O N F 5 10 Розчин (діетиламіно)сульфур трифлуориду (0,74 мл, 5,67 ммоль) у сухому ДХМ додавали до охолодженого (-78 °C) розчину О29 (1,5 г, 5,4 ммоль) у сухому ДХМ (30 мл) під азотом. Після завершення додавання реакційну суміш перемішували при -78ºС протягом 1 години та тоді дозволяли досягти кімнатної температури та перемішували ще 30 хвилин. Водний насичений розчин NаНСО3 (90 мл) додавали та суміш перемішували протягом 15 хвилин, тоді органічний шар відділяли. Після цього 3-хлорпероксибензойну кислоту (0,2 г, 1,18 ммоль) додавали та реакційну суміш перемішували при кімнатній температурі протягом 30 хвилин. Реакційну суміш промивали водним насиченим розчином NаНСО3, Н2О та розсолом, сушили Nа2SО4, фільтрували та концентрували у вакуумі, отримуючи бажаний інтермедіат О30 (1,48 г, 98 %) як сирий матеріал, що застосовували без наступної очистки. Опис 31 4-флуор-4-фенілпіперидин гідрохлорид (О31) 15 H N F .НСl 20 D30 (1,48 г, 5,29 ммоль) розчиняли у 4 Н НСl у діоксані. Реакційну суміш перемішували при кімнатній температурі протягом 2 годин. Розчинник видаляли. Сирий матеріал розтирали у порошок з діетил-етером та сушили у вакуумі, отримуючи бажаний інтермедіат О31 (1,10 г, 97 %) як хлоргідрат, що застосовували без наступної очистки. Опис 32 1'-Бутил-4-флуор-4-феніл-3,4,5,6-тетрагідро-2Н, 1´Н-[1,4']біпіридиніл-2-он (О32) O N N 25 30 35 F D31 (0,2 г, 0,94 ммоль), паладій(ІІ) ацетат (0,009 г, 0,04 ммоль) натрій трет-бутоксид (0,25 г, 2,58 ммоль) та ВІNАР (0,037 г, 0,06 ммоль) додавали при перемішуванні до розчину інтермедіату О6 (0,20 г, 0,86 ммоль) у толуєні (5 мл). Реакційну суміш гріли при 100 ºС протягом 16 годин у герметично закритій тубі. Після охолодження до кімнатної температури суміш розбавляли водою та екстрагували ЕtОАс. Комбіновану органічну фазу сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; 10 % аміаку у метанолі (7N) / ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи О32 (0,21 г, 87 %) як блідо-жовту оливу. Опис 33 4-Бензилокси-3-бром-1-циклопропілметил-1Н-піридин-2-он (О33) 23 UA 100126 C2 O Br N O 5 Розчин інтермедіату О1 (3,0 г, 11,7 ммоль) та N-бромсукциніміду (2,09 г, 11,7 ммоль) у ДХМ (100 мл) перемішували при кімнатній температурі протягом 1 години. Розчинник випарювали у вакуумі та сирий залишок очищали колонковою хроматографією (силікагель; ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи О33 (3,56 г, 91 %). Опис 34 4-Бензилокси-3-циклопропіл-1-циклопропілметил-1Н-піридин-2-он (О34) O N O 10 15 20 NаНСО3 (1,0 г, надлишок), циклопропілборонову кислоту (0,74 г, 8,93 ммоль), калій карбонат (1,23 г, 8,93 ммоль) та [1,1’-біс(дифенілфосфіно)фероцен]дихлорпаладій(ІІ) - ДХМкомплекс (0,36 г, 0,45 ммоль) додавали до розчину інтермедіату О10 (1,0 г, 2,98 ммоль) в 1,4діоксані (10 мл). Утворену суміш гріли при 175 ºС протягом 20 хвилин при мікрохвильовому опроміненні, після чого фільтрували через діатомову землю та розчинник випарювали у вакуумі. Сирий залишок очищали колонковою хроматографією (силікагель; 0-3 % метанол / ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи О34 (0,6 г, 69 %). Опис 35 3-Циклопропіл-1-циклопропілметил-4-гідрокси-1Н-піридин-2-он (О35) O N HO 25 Суміш інтермедіату О34 (1,0 г, 3,38 ммоль) та каталітичну кількість 10 % паладію на активованому вугіллі в етанолі (150 мл) перемішували під воднем протягом 2 годин. Суміш фільтрували через діатомову землю та розчинник випарювали у вакуумі, отримуючи інтермедіат О35 (0,69 г, 100 %), що застосовували без наступної очистки. Опис 36 4-Бром-3-циклопропіл-1-циклопропілметил-1Н-піридин-2-он (О36) 30 O N Br 35 Фосфор оксибромід (2,4 г, 8,28 ммоль) додавали до розчину інтермедіату О35 (0,85 г, 4,14 ммоль) у ДМФ (60 мл), та суміш гріли при 110 ºС протягом 1 години. Після охолодження у льодяній бані, розчин розподіляли між водою та ЕtОАс. Суміш екстрагували ЕtОАс (3 × 200 мл), комбіновані органічні фракції сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи інтермедіат О36 (0,99 г, 89 %). Опис 37 24 UA 100126 C2 4-(1'-Циклопропілметил-2'-оксо-3,4,5,6,1',2'-гексагідро-2Н-[1,4']біпіридиніл-4-іл)-бензойна кислота (О37) O N N O OH 5 10 15 4-Піперидин-4-ілбензойної кислоти метил-естер (0,40 г, 1,81 ммоль), паладій(ІІ) ацетат (0,015 г, 0,069 ммоль) натрій трет-бутоксид (0,34 г, 3,44 ммоль) та ВІNАР (0,06 г, 0,096 ммоль) додавали при перемішуванні до розчину інтермедіату О3 (0,31 г, 1,37 ммоль) у толуєні (10 мл). Реакційну суміш гріли при 100 ºС протягом 16 годин у герметично закритій тубі. Після охолодження до кімнатної температури суміш розбавляли ЕtОАс та тоді фільтрували через діатомову землю, після чого розчинник випарювали у вакуумі. Сирий залишок обробляли сумішшю ДХМ / метанол та тоді відфільтровували. Фільтрат випарювали до сухого стану у вакуумі, отримуючи сирий О37 (0,48 г, 100 %), що застосовували без наступної очистки. Опис 38 4-(1'-Циклопропілметил-2'-оксо-3,4,5,6,1',2'-гексагідро-2Н-[1,4']біпіридиніл-4-іл)-бензойної кислоти метил-естер (О38) O N N O O 20 25 Суміш інтермедіату О37 (0,43 г, 1,23 ммоль), DВU (0,18 г, 1,23 ммоль), диметил карбонату (4,5 мл, надлишок, 93 ммоль), та ацетонітрилу (5 мл) гріли при 160 ºС протягом 20 хвилин при мікрохвильовому опроміненні. Охолоджену сиру суміш розбавляли водою та додавали ЕtОАс, після чого органічний шар промивали водним 10 % розчином лимонної кислоти, сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий залишок очищали колонковою хроматографією (силікагель; 0-3 % метанол / ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи О38 (0,19 г, 38 %). Опис 39 1'-Циклопропілметил-4-[4-(1-гідрокси-1-метил-етил)-феніл]-3,4,5,6-тетрагідро-2Н, 1'Н[1,4']біпіридиніл-2'-он (О39) 30 O N N HO 25 UA 100126 C2 5 10 1,4 М розчин метилмагній броміду у толуєні/ТГФ (1,12 мл, 1,57 ммоль) додавали краплями до охолодженого (0 °C) розчину інтермедіату О38 (0,19 г, 0,52 ммоль) у ТГФ (20 мл) під азотом. Утворену реакційну суміш перемішували при 45 ºС протягом 2 годин. Після охолодження у льодяній бані суміш обережно гасили насиченим водним розчином амоній хлориду, та тоді екстрагували ЕtОАс. Комбіновану органічну фазу сушили (Nа2SО4) та розчинник випарювали у вакуумі. Залишок очищали колонковою хроматографією (силікагель; 0-5 % метанол / ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи О39 (0,077 г, 40 %) як оливу. Приклад 1 3'-Хлор-1'-циклопропілметил-4-феніл-3,4,5,6-тетрагідро-2Н, 1'Н-[1,4']біпіридиніл-2'-он (П1) O Cl N N 15 20 25 Розчин інтермедіату О18 (0,2 г, 0,65 ммоль) та N-хлорсукциніміду (0,09 г, 0,65 ммоль) у ДХМ (10 мл) перемішували при кімнатній температурі протягом 1 години. Розчинник випарювали у вакуумі та сирий продукт очищали колонковою хроматографією (силікагель; 0-3 % метанол / ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі та утворений твердий продукт перекристалізовували з діетил-етеру, отримуючи сполуку П1 (0,10 г, 47 %) як білий твердий матеріал. Точка плавлення: 170,8 ºС. 1Н ЯМР (400 МГц, СDСl3) δ млн-1 0,35-0,42 (m, 2 Н), 0,57-0,64 (m, 2 Н), 1,19-1,33 (m, 1 Н), 1,85-2,00 (m, 4 Н), 2,64-2,76 (m, 1 Н), 2,85-2,99 (m, 2 Н), 3,76-3,87 (m, 4 Н), 6,05 (d, J=7,6 Гц, 1 Н), 7,19-7,29 (m, 4 Н), 7,29-7,38 (m, 2 Н). Приклад 2 1'-Бутил-3'-хлор-4-феніл-3,4,5,6-тетрагідро-2Н, 1'Н-[1,4']біпіридиніл-2'-он (П2) O Cl N N 30 35 40 Розчин інтермедіату О19 (0,43 г, 1,40 ммоль) та N-хлорсукциніміду (0,19 г, 1,40 ммоль) у ДХМ (10 мл) перемішували при кімнатній температурі протягом 1 години. Розчинник випарювали у вакуумі та сирий продукт очищали колонковою хроматографією (силікагель; 03 % метанол / ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі та утворений твердий продукт перекристалізовували з діетил-етеру, отримуючи сполуку П2 (0,39 г, 82 %) як білий твердий матеріал. Точка плавлення: 149,4 ºС. 1Н ЯМР (400 МГц, СDСl3) δ млн-1 0,95 (t, J=7,3 Гц, 3 Н), 1,31-1,42 (m, 2 Н), 1,68-1,78 (m, 2 Н), 1,85-1,98 (m, 4 Н), 2,64-2,73 (m, 1 Н), 2,87-2,96 (m, 2 Н), 3,82 (br d, J=12,1 Гц, 2 Н), 3,93 (t, J=7,3 Гц, 2 Н), 6,03 (d, J=7,6 Гц, 1 Н), 7,10 (d, J=7,6 Гц, 1 Н), 7,19-7,28 (m, 3 Н), 7,29-7,37 (m, 2 Н). Приклад 3 3'-Бром-1'-циклопропілметил-4-феніл-3,4,5,6-тетрагідро-2Н, 1'Н-[1,4']біпіридиніл-2'-он (П3) 26 UA 100126 C2 O Br N N 5 10 15 N-Бромсукцинімід (0,145 г, 0,82 ммоль) додавали до розчину інтермедіату О18 (0,25 г, 0,82 ммоль) у ДХМ (10 мл). Реакційну суміш перемішували при кімнатній температурі протягом 1 години. Далі розчинник випарювали у вакуумі та сирий залишок очищали колонковою хроматографією (силікагель; 0-3 % метанол / ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку П3 (0,20 г, 64 %) як білий твердий матеріал. Точка плавлення: 150 ºС. 1Н ЯМР (500 МГц, ДМСО-d6) δ млн-1 0,34-0,40 (m, 2 Н), 0,44-0,50 (m, 2 Н), 1,16-1,26 (m, 1 Н), 1,77 (qd, J=12,38, 3,61 Гц, 2 Н), 1,88 (br d, J=12,1 Гц, 2 Н), 2,68-2,78 (m, 1 Н), 2,91 (br t, J=11,9 Гц, 2 Н) 3,69 (br d, J=12,1 Гц, 2 Н), 3,74 (d, J=7,2 Гц, 2 Н), 6,21 (d, J=7,5 Гц, 1 Н), 7,19-7,25 (m, 1 Н), 7,27-7,36 (m, 4 Н), 7,69 (d, J=7,5 Гц, 1 Н). Приклад 4 1'-Циклопропілметил-4-феніл-3'-трифлуорметил-3,4,5,6-тетрагідро-2Н, 1'Н-[1,4']біпіридиніл2'-он (П4) F O F N F N 20 25 30 4-Фенілпіперидин (0,33 г, 2,02 ммоль), паладій(ІІ) ацетат (0,012 г, 0,05 ммоль), натрій третбутоксид (0,24 г, 2,52 ммоль) та ВІNАР (0,05 г, 0,08 ммоль) додавали до розчину інтермедіату О13 (0,3 г, 1,01 ммоль) у толуєні (7 мл). Реакційну суміш гріли при 100 ºС протягом 16 годин у герметично закритій тубі, після чого охолоджували до кімнатної температури та тоді розбавляли водою (5 мл) та екстрагували ЕtОАс (3 × 5 мл). Комбіновані органічні фракції сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; 0-4 % метанол / ДХМ як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку П4 (0,11 г, 31 %) як білий твердий матеріал. Точка плавлення: 177,2 ºС. 1Н ЯМР (500 МГц, ДМСО-d6) δ млн-1 0,33-0,38 (m, 2 Н), 0,45-0,50 (m, 2 Н), 1,13-1,22 (m, 1 Н), 1,64-1,75 (m, 2 Н), 1,84 (br d, J=11,0 Гц, 2 Н), 2,72-2,80 (m, 1 Н), 3,14 (br t, J=12,1 Гц, 2 Н), 3,59 (br d, J=13,0 Гц, 2 Н), 3,65 (d, J=7,2 Гц, 2 Н), 6,21 (d, J=7,8 Гц, 1 Н), 7,19-7,23 m, 1 Н), 7,24-7,29 (m, 2 Н), 7,29-7,34 (m, 2 Н), 7,73 (d, J=7,8 Гц, 1 Н). Приклад 5 3'-Хлор-4-феніл-1'-(4-трифлуорметоксибензил)-3,4,5,6-тетрагідро-2Н, 1'Н-[1,4']біпіридиніл-2'он (П5) 35 O Cl N N F O F F 27 UA 100126 C2 5 10 15 Суміш інтермедіату О17 (0,2 г, 0,52 ммоль), 4-фенілпіперидину (0,1 г, 0,62 ммоль), 2-(2'-Дітрет-бутилфосфін)біфенілпаладій(ІІ) ацетату (0,01 г, 0,026 ммоль) та калій фосфату (0,23 г, 1,1 ммоль) в 1,4-діоксані (3 мл) перемішували при 90 ºС протягом 35 годин. Суміш фільтрували через діатомову землю, та фільтрат випарювали до сухого стану після промивання ще 1,4діоксаном. Сирий продукт очищали колонковою хроматографією (силікагель; гептан/ діетилетер 1:1 як елюент). Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку П5 (0,075 г, 31 %) як білий твердий матеріал. Точка плавлення: 168,6 ºС. 1Н ЯМР (400 МГц, СDСl3) δ млн-1 1,83-1,98 (m, 4 Н), 2,65-2,75 (m, 1 Н), 2,89-2,98 (m, 2 Н), 3,84 (br d, J=12,2 Гц, 2 Н), 5,12 (s, 2 Н), 6,06 (d, J=7,6 Гц, 1 Н), 7,14 (d, J=7,6 Гц, 2 Н), 7,15-7,28 (m, 5 Н), 7,29-7,40 (m, 4 Н). Приклад 6 3'-Хлор-1'-циклопропілметил-2'-оксо-4-феніл-3,4,5,6,1',2'-гексагідро-2Н-[1,4']біпіридиніл-4карбонітрил (П6) O Cl N N N 20 25 30 Розчин інтермедіату О20 (0,35 г, 1,03 ммоль) та N-хлорсукциніміду (0,14 г, 1,03 ммоль) у ДХМ (25 мл) перемішували при кімнатній температурі протягом 1 години. Після додавання ще ДХМ, розчин промивали розсолом, сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; 10 % аміаку у метанолі (7N) / ДХМ як елюент) та тоді очищали препаративною ВЕРХ. Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку П6 (0,17 г, 47 %) як білий твердий матеріал. Точка плавлення: 173,7 ºС. 1Н ЯМР (400 МГц, ДМСО-d6) δ млн-1 0,17-0,23 (m, 2 Н), 0,26-0,33 (m, 2 Н), 0,97-1,09 (m, 1 Н), 1,91-2,02 (m, 2 Н), 2,11 (br d, J=12,9 Гц, 2 Н) 2,98 (br t, J=12,4 Гц, 2 Н), 3,54-3,63 (m, 4 Н), 6,14 (d, J=7,4 Гц, 1 Н), 7,20-7,26 (m, 1 Н), 7,27-7,35 (m, 2 Н), 7,40-7,44 (m, 2 Н), 7,52 (d, J=7,4 Гц, 1 Н). Приклад 7 1'-Бутил-3-хлор-4-флуор-4-феніл-3,4,5,6-тетрагідро-2Н, 1´Н-[1,4']біпіридиніл-2-он (П7) O Cl N N F 35 40 45 Розчин інтермедіату О32 (0,21 г, 0,66 ммоль) та N-хлорсукциніміду (0,08 г, 0,66 ммоль) у ДХМ (30 мл) перемішували при кімнатній температурі протягом 10 хвилин. Після додавання ще ДХМ розчин промивали розсолом, сушили (Nа2SО4) та розчинник випарювали у вакуумі. Сирий продукт очищали колонковою хроматографією (силікагель; 10 % аміаку у метанолі (7М) / ДХМ як елюент) та тоді очищали препаративною ВЕРХ. Бажані фракції збирали та випарювали у вакуумі, отримуючи сполуку П7 (0,065 г, 27 %) як білий твердий матеріал. Точка плавлення: 136,7 ºС. 1Н ЯМР (400 МГц, ДМСО-d6) δ млн-1 0,89 (t, J=7,4 Гц, 3 Н), 1,21-1,32 (m, 2 Н), 1,54-1,64 (m, 2 Н), 2,03 (t, J=11,8 Гц, 2 Н), 2,16 (td, J=13,9, 4,6 Гц, 1 Н), 2,26 (td, J=13,6, 4,6 Гц, 1 Н), 3,17 (dd, J=12,3, 11,1 Гц, 2 Н), 3,54-3,64 (m, 2 Н), 3,87 (t, J=7,2 Гц, 2 Н), 6,26 (d, J=7,6 Гц, 1 Н), 7,32-7,38 (m, 1 Н), 7,42 (t, J=7,4 Гц, 2 Н), 7,45-7,51 (m, 2 Н), 7,62 (d, J=7,4 Гц, 1 Н). Приклад 8 28
ДивитисяДодаткова інформація
Назва патенту англійською1',3'-disubstituted-4-phenyl-3,4,5,6-tetrahydro-2h, 1'h-[1, 4'] bipyridinyl-2'-ones
Автори англійськоюCid-Nunez, Jose, Maria, Trabanco-Suarez, Andres, Avelino, Macdonald, Gregor, James, Duvey, Guillaume, Albert, Jacques, Lutjens, Robert, Johannes, Finn, Terry, Patrick
Назва патенту російською1',3'-дизамещенные 4-фенил-3,4,5,6-тетрагидро-2н,1'н-[1,4']бипиридинил-2'-оны
Автори російськоюСид-Нюнез Хосе Мария, Трабанко-Суарез Андрес Авелино, Макдональд Грегор Джеймс, Дюве Гийом Альбер Якьюес, Лютьенс Роберт Йоганнес, Финн Терри Патрик
МПК / Мітки
МПК: A61K 31/4545, C07D 493/10, A61P 25/00, C07D 401/04
Мітки: 1,3-дизаміщені, 4-феніл-3,4,5,6-тетрагідро-2н,1'н-[1,4']біпіридиніл-2'-они
Код посилання
<a href="https://ua.patents.su/44-100126-13-dizamishheni-4-fenil-3456-tetragidro-2n1n-14bipiridinil-2-oni.html" target="_blank" rel="follow" title="База патентів України">1′,3′-дизаміщені 4-феніл-3,4,5,6-тетрагідро-2н,1’н-[1,4′]біпіридиніл-2′-они</a>
Попередній патент: Спосіб виділення і очищення монтелукасту
Наступний патент: Пептид cdh3 та лікарський засіб, що містить його
Випадковий патент: Маніпулятор












