2,2-дизаміщені 1,3-діоксолани, спосіб одержання та застосування як проміжних продуктів для синтезу відповідних (s)-енантіомерів та (-)3-(4-феніл-1-піперазиніл)-1,2-пропандіолу
Номер патенту: 73790
Опубліковано: 15.09.2005
Автори: Аллєгретті Марчело, Честа Марія Кандіда, Курті Роберто, Ніколіні Лука
Формула / Реферат
1. Сполуки формули (1)
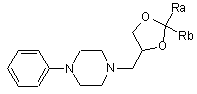 , (1)
, (1)
де кожний з Ra та Rb, які можуть бути однаковими або різними, є воднем, С1-С6-алкілом, фенілом; або
Ra та Rb разом з атомом С, до якого вони приєднані, утворюють необов'язково заміщене 4-7-членне карбоциклічне кільце.
2. Сполуки за п. 1, де Ra та Rb є однаковими.
3. Сполуки за п. 1 або 2, де Ra та Rb є метилом або етилом.
4. Сполуки за п. 1, вибрані з таких сполук:
(±) 1,2-циклопентиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол;
(±) 1,2-циклогексиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол;
(±) 1,2-(2-пропіліден)-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол;
(±) 1,2-(3-пентиліден)-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол;
S(-)-1,2-циклогексиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол L-тартрат;
S(-)-1,2-циклопентиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол L-тартрат.
5. Спосіб одержання сполук формули (1) взаємодією фенілпіперазину з (±) 1,2-гліцерилдіоксоланом формули (2):
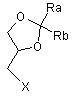 , (2)
, (2)
де Х вибраний з групи, що включає Сl, Вr, І і відповідний сульфоновий ефір (R-SO3-), R вибраний з групи, що включає С1-С3-алкіл (переважно, метил), трифторметил, феніл, п-толіл або п-метоксифеніл.
6. Спосіб за п. 5, де взаємодію проводять в присутності основи при використанні толуолу або ксилолу як розчинників.
7. Спосіб оптичного поділу сполук за пп. 1-4 шляхом переведення в солі L-винної кислоти.
8. Застосування сполук за пп. 1-4 як проміжних продуктів для синтезу відповідних (S)-енантіомерів.
9. Спосіб синтезу (-)3-(4-феніл-1-піперазиніл)-1,2-пропандіолу, де солі винної кислоти сполук (1) оптично розділяють з одержанням S(-)-енантіомерів, які піддають гідролізу при нагріванні з використанням як каталізатора молярного надлишку розбавленого водного розчину мінеральної кислоти.
10. Спосіб за п. 9, де мінеральна кислота являє собою соляну, оцтову, малонову або лимонну кислоту.
11. Застосування сполук за пп. 1-4 як проміжних продуктів для одержання (-)3-(4-феніл-1-піперазиніл)-1,2-пропандіолу.
Текст
Даний винахід відноситься до (±)3-(4-феніл-1-піперазиніл)-1,2-пропандіолових циклічних ацеталей, способу їх оптичного поділу та їх застосуванню для одержання (-)3-(4-феніл-1-піперазиніл)-1,2-пропандіолу (леводропропізину) та його солей. Більш конкретно, даний винахід відноситься до (±) 2,2-заміщених-1,3-діоксоланів формули (1): де: кожний з Ra та Rb, які можуть бути однаковими або різними, являє собою водень, С1-С6-алкіл, феніл; або Ra та Rb разом з атомом С, до якого вони приєднані, утворюють необов'язково заміщене 4-7-членне карбоциклічне кільце. Переважно, в сполуках за даним винаходом формули (1) Ra та Rb являють собою алкільні групи, які містять менше 6 атомів С. Переважно, Ra та Rb є однаковими; більш переважно, Ra та Rb являють собою метил або етил або разом з атомом С, до якого вони приєднані, утворюють кільце, яке містить від 5 до 6 атомів вуглецю. Винахід відноситься також до енантіомерно чистих моноосновних солей 2,2-заміщених-1,3-діоксоланів формули (1) з фармацевтично прийнятними хіральними кислотами, такими як L-яблучна, D- і L-винна, D- і L-мигдалева, L- і D-камфорсульфонова кислоти. Особливо переважними сполуками за даним винаходом є (±)1,2-циклопентиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол; (±) 1,2-циклогексиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол; (±) 1,2-(2-пропіліден)-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол; (±) 1,2-(3-пентиліден)-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол; S(-)-1,2-циклогексиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол L-тартрат; S(-)-1,2-циклопентиліден3-(4-фенілпіперазин-1-іл)пропан-1,2-діол L-тартрат. Сполуки за даним винаходом формули (1) одержують взаємодією фенілпіперазину з (±)1,2-гліцерилдіоксоланом формули (2) де X вибраний з групи, що включає СІ, Вr, І і відповідний сульфоновий ефір (R-SO3-), R являє собою С1С3-алкіл (переважно метил), трифторметил, феніл, п-толіл або п-метоксифеніл.) Діоксолани формули (2) є відомими сполуками і/або можуть бути одержані відомими методами. Сульфонові ефіри формули (2) (X=R-SO3-) одержують етерифікацією ангідридом або хлорангідридом алкіл- і/або арилсульфонової кислоти формули (3): R-SO3H (3) (±)-2,2-заміщеного-1,3-діоксолан-4-метанолу формули (4): де Ra та Rb приймають значення, визначені вище. Сполуки формули (4) є відомими сполуками. Рацемати формули (4) фактично використовуються як субстрати для процесів ферментативного поділу [(US 5190867 (02.03.1993)]. Одержання dlізопропіліденгліцерину (Merck 12.5232; Beil 19.65) з гліцерину описане в [Org. Synth. Coll. Vol.III]. 4-Галогенметилдіоксолани формули (2), де X являє собою СІ, Вr або І, можуть бути одержані з відповідних сульфонатів формули (2) (Х= RSO3-, де R приймає значення, визначені вище) взаємодією з галогенідом лужного або лужноземельного металу в інертному розчиннику, вибраному з групи, що включає ацетон, метилетилкетон, тетрагідрофуран, діоксан, диметилсульфоксид, ацетонітрил, С1-С4-спирт та їх суміші. Переважний спосіб синтезу вказаних сполук включає введення діоксоланових груп у відповідні 3галоген-1,2-пропандіоли, як описано в [ЕР 0930311 (21.07.1999)]. Особливо переважним є 3-хлорпропан1,2-діол; переважними агентами введення ацетальних груп є формальдегід, ацетальдегід, бензальдегід, ацетон, діетилкетон, бензофенон, циклогексанон, їх ацеталі і/або прості фенольні ефіри, такі як 2,2диметоксипропан, 2,2-диметоксіетан, 2-метоксипропен. Альтернативно, діоксолани формули (2) (Х=Сl, Вr) можуть також бути одержані введенням ацетальної групи в епіхлоргідрини або епібромгідрини за допомогою циклоалканону відповідно за способами, описаними для одержання (+)2-хлорметил-1,4-діоксаспіро[4,5]-декану в [FR 1552153] або описаними в більш загальному вигляді в публікаціях [Blicke F.F. et al., J.A.C.S, 74, 1735 (1972) і ibidem, 76, 1226 (1954)]. Реакція алкілування фенілпіперазину 1,2-глицерилдіоксоланом формули (2) проводиться в умовах, що традиційно застосовуються для перетворення вторинного аміну в третинний з використанням на кожний моль алкілуючого агента формули (2), щонайменше, одного моля або невеликого молярного надлишку фенілпіперазину в присутності, щонайменше, одного моля протиоснови. Протиоснова використовується, щонайменше, в еквімолярних кількостях відносно алкілуючого агента формули (2) і вибирається з групи, що включає тонко подрібнені неорганічні основи, такі як карбонати або гідрокарбонати лужних або лужноземельних металів (Na, К, Mg, Ca) або оксиди Са або Mg, третинні амін, такі як триетиламін, диметилабо діетиланілін, ароматичні аміни, такі як піридин, піколін або етилметилпіридин і, якщо це бажано, безпосередньо фенілпіперазин, який потім може знову циклізуватися з одержанням циклу. Реакцію алкілування можна провести при нагріванні, необов'язково в присутності інертних розчинників, таких як толуол і ксилол, які при кипінні розчинника будуть переважно зменшувати тривалість реакції. Після завершення реакції алкілування будь-які нерозчинні речовини відфільтровують або видаляють центрифугуванням, потім органічні фази повторно промивають водою для простого видалення домішок і побічних продуктів і розчинник відганяють і одержують з високими виходами залишок, що складається, по суті, з чистого 1,3-діоксолану за даним винаходом формули (1), який виділяється прямою кристалізацією або одержанням солі з молярним еквівалентом карбонової кислоти. Сполуки (1) та їх солі надзвичайно легко кристалізуються із звичайних розчинників: отже, спосіб за даним винаходом знижує до мінімуму будь-який ризик забруднення продукту слідовими кількостями гліцидолів і/або епігалогенгідринів як можливих домішок. Моноосновні солі сполук формули (1) одержані за допомогою звичайних стандартних способів, таких як одержання солей з еквімолекулярними кількостями бажаної кислоти у відповідному розчиннику з подальшою кристалізацією одержаної солі. Було встановлено, що одержання солей сполук (1) з хіральними кислотами, зокрема з L-винною кислотою, є ефективним методом оптичного поділу для виділення S-енантіомерів сполук (1) з високими виходами. Вказані (S)(-)-енантіомери та їх солі корисні як протикашльові засоби або як проміжні продукти для синтезу (-)3-(4-феніл-1-піперазиніл)-1,2-пропандіолу (леводропропізину) гідролізом водних розчинів (-)-1,3діоксоланів формули (1) при нагріванні і використанні як каталізатора молярного надлишку розбавленого водного розчину мінеральної кислоти, такої як соляна кислота, або карбонової кислоти, такої як оцтова, малонова або лимонна кислоти. Наведені далі приклади додатково ілюструють даний винахід. Приклад 1 До розчину 11,98г (±)-2,3-О-(3-пентиліден)гліцерин тозилату в н-бутанолі (70мл) при інтенсивному перемішуванні додають 4,5г тонко подрібненого карбонату натрію, потім 6мл фенілпіперазину. Суміш кип'ятять із зворотним холодильником при перемішуванні протягом 20 годин. Потім бутанол випаровують при зниженому тиску, залишок переносять у воду і екстрагують етилацетатом. Об'єднані органічні фази сушать і фільтрують, розчинник випаровують у вакуумі і одержаний залишок кристалізують з водного метанолу з одержанням 8,95г (±)1,2-(3-пентиліден)-3-(4-фенілпіперазин-1-іл)пропан-1,2-діолу, іншою назвою якого є 4-фенілпіперазин, 1-(2,2-діетил-1,3-діоксолан-4-ілметил). Приклад 2 Відповідно до методики прикладу 1 з використанням (±)2,3-О-(2-пропіліден)гліцерину тозилату одержують (±)1,2-(2-пропіліден)-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол, іншою назвою якого є 4фенілпіперазин, 1-(2,2-диметил-1,3- діоксолан-4-ілметил). Приклад 3 До розчину 3,28г (±) 1,4-діоксаспіро[4,5]декан-2-метилхлориду у толуолі (16мл) в атмосфері інертного газу додають 5,45мл фенілпіперазину. Потім суміш кип'ятять до завершення реакції (приблизно 8 годин). Реакційну суміш охолоджують до приблизно 50°С, додають 10мл води і енергійно перемішують, щонайменше, 10 хвилин. Фази розділяють, органічну фазу промивають водою. Розчинник випаровують з одержанням густого масла, яке розчиняють в теплому ізопропанолі (15мл). Одержаний розчин повільно охолоджують і виділяють (±)1,2-циклогексиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол у вигляді твердої кристалічної речовини, т. пл. 58-61°С. 1 Н ЯМР: d 7,26 (т, 2Н, J=7,4Гц); d 6, 95 (д, 2Н, J=8,9Гц); d 6,85 (т, 1Η, J=7,28Гц); d 4,3 (м, 1Η, J=6,1Гц); d 4,1 (дд, 1Н, J1=8,0Гц, J2=6,1Гц); d 3,65 (дд, 1Н, J 1=8,0Гц, J2=7,1Гц); d 3,2 (т, 4Η, J=5,05Гц); d 2,9-2,55 (м, 6Н); d 1,7-1,3 (м, 10Н). Приклад 4 Відповідно до методики, описаної в прикладах 1 і 3, взаємодією 1,3-діоксолану, вибраного з групи, що включає: (±)1,4-діоксаспіро[4,4]нонан-2-метанол мезилат; (±)1,4-діоксаспіро[4,4]нонан-2-метил хлорид; (±)1,4-діоксаспіро[4,5]декан-2-метанол трифторметансульфонат; (±)1,4-діоксаспіро[4,5]декан-2-метанол мезилат; (±)1,3-діоксолан-4-хлорметил-2,2-диметил; (±)1,3-діоксолан-4-бромметил-2,2-диметил, з фенілпіперазином одержують наступні сполуки: (±)1,2-циклопентиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол; (±)1,2-циклогексиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол; (±)1,2-(2-пропіліден)-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол. Приклад 5 3г L-Винної кислоти при перемішуванні додають до розчину (±)1,2-циклогексиліден-3-(4-фенілпіперазин1-іл)пропан-1,2-діолу (6,32г) в абсолютному етанолі (70мл). Суміш перемішують до повного розчинення речовин, потім охолоджують до 5-8°С. Одержують 4,05г твердого кристалічного продукту, який перекристалізовують з абсолютного етанолу з одержанням 3,82г S(-)-1,2-циклогексиліден-3-(4фенілпіперазин-1-іл)пропан-1,2-діолу L-тартрату, т. пл. 131-132°С, [a]D=-9,6(c=1%; CH3OH). 1 Н ЯМР: d 7,5 (дд, 2Н, J1=8,7 J2=7,3); d 7,2 (м, 3Н); d 4,8 (м, 1Н); d 4,4 (с, 2Н); d 4,35 (дд, 1Н, J1=8,9Гц, J2=6,7Гц); d 3,86 (дд, 1Н, J1=8,9Гц, J2=5,8Гц); d 3,6-3,4 (м, 10Н); d 1,8-1,48 (м, 10Н). Приклад 6 Розчин 2,4г S(-)-1,2-циклогексиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діолу L-тартрату у воді підлуговують (рН=8) додаванням 2н розчину NaOH, після чого ретельно екстрагують етилацетатом. Об'єднані органічні фази промивають 10% розчином моноосновного фосфату натрію, сушать над сульфатом натрію, випаровують досуху і кристалізують з ізопропанолу з одержанням 1,5г S(-)-1,2 циклогексиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діолу, т. пл. 63-64°С, [a]D=-7,8(1% МеОН). 1 Н ЯМР: d 7,26 (т, 2Н, J=7,4Гц); d 6,95 (д, 2Н, J=8, 9Гц); d 6,85 (т, 1Η, J=7,28Гц); d 4,3 (м, 1Η, J=6,1Гц); d 4,1 (дд, 1Н, J1=8,0Гц, J2=6,1Гц); d 3,65(дд, 1Η, J1=0,8Гц, J2=7,1Гц); d 3,2 (т, 4Η, J=5,05Гц); d 2,9-2,55 (м, 6Н); d 1,7-1,3 (м, 10Н). Приклад 7 Відповідно до способу одержання солей 1,3-діоксоланів, одержаних в прикладах 1-4, з L-винною кислотою і фракційною перекристалізацією одержаних солей одержують наступні сполуки: 2S(-)-1,2-циклопентиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол L-тартрат; 2S(-)-1,2-(2-пропіліден)-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол L-тартрат; 2S(-)-1,2-(3-пентиліден)-3-(4-фенілпіперазин-1-іл)пропан-1,2-діол L-тартрат, які потім нейтралізували відповідно до способу, описаного в прикладі 6, з одержанням відповідних вільних основ. Приклад 8 Суспензію 2,8г S(-)-1,2-циклопентиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діолу в 70мл водної оцтової кислоти (10% мас/об.) кип'ятять із зворотним холодильником протягом 2 годин, потім в неї барботують пар для відгонки циклогексанону, який відділяють. Водну фазу нейтралізують до рН 7 додаванням 10% розчину NaOH, потім охолоджують до 5-10°С з одержанням 1,97г (-)3-(4-фенілпіперазин-1іл)пропандіолу, т.пл. 102-103°С, [a]D=-23,5° (2,8% СН2СІ 2). Приклад 9 Альтернативно, 0,35 моль-еквівалентів одного з 1,3-діоксолан-похідних, описаних в прикладах 6 і 7, а саме S(-)-1,2-(2-пропіліден)-3-(4-фенілпіперазин-1-іл)пропан-1,2-діолу; S(-)-1,2-(циклопентиліден)-3-(4фенілпіперазин-1-іл)пропан-1,2-діолу; S(-)-1,2-циклогексиліден-3-(4-фенілпіперазин-1-іл)пропан-1,2-діолу, при перемішуванні додають частинами до 36% розчину соляної кислоти (36мл) в 45мл води; суспензію нагрівають до 80°С з одержанням прозорого розчину, який додатково витримують при цій температурі протягом 30 хвилин, потім охолоджують до 20-25°С, водну фазу екстрагують дихлорметаном (3´15мл), потім додають н-бутанол (0,5л). Двофазну суміш кип'ятять для відгонки азеотропної суміші вода:н-бутанол, виділяючи приблизно 300мл дистиляту, потім охолоджують для прискорення кристалізації (-)3-(4фенілпіперазин-1-іла)пропандіолу гідрохлориду (85г). Розчин гідрохлориду в 125мл води знебарвлюють активованим вугіллям (2,12г), нагріваючи до 50°С і витримуючи при цій температурі протягом 15 хвилин, фільтрують і потім нейтралізують додаванням водного розчину гідроксиду амонію (30% мас/мас). Розчин нагрівають до 50°С і ініціюють кристалізацію додаванням кристалів (-)3-(4-фенілпіперазин-1-іл)-1,2-пропандіолу. Суспензію залишають для самовільного охолоджування, потім витримують протягом 2 годин при +2 - +4°С і фільтрують з одержанням 70-72г (-)3-(4фенілпіперазин-1-іл)-1,2-пропандіолу.
ДивитисяДодаткова інформація
Назва патенту англійською2,2-disubstituted 1,3-dioxolanes, a method for the preparation and use as intermediary products for the synthesis of respective (s)- enantiomers and (-)3-(4-phenyl-1-piperazinyl)-1,2-propanediol
Назва патенту російською2,2-дизамещенные 1,3-диоксоланы, способ получения и применения как промежуточных продуктов для синтеза соответствующих (s)-энантиомеров и (-)3-(4-фенил-1-пиперазинил)-1,2-пропандиола
МПК / Мітки
МПК: A61P 11/00, C07B 61/00, C07D 317/28, A61K 31/496, C07B 57/00, C07D 317/72
Мітки: 3-(4-феніл-1-піперазиніл)-1,2-пропандіолу, застосування, спосіб, відповідних, синтезу, 1,3-діоксолани, продуктів, 2,2-дизаміщені, проміжних, одержання, s)-енантіомерів
Код посилання
<a href="https://ua.patents.su/3-73790-22-dizamishheni-13-dioksolani-sposib-oderzhannya-ta-zastosuvannya-yak-promizhnikh-produktiv-dlya-sintezu-vidpovidnikh-s-enantiomeriv-ta-3-4-fenil-1-piperazinil-12-propandiolu.html" target="_blank" rel="follow" title="База патентів України">2,2-дизаміщені 1,3-діоксолани, спосіб одержання та застосування як проміжних продуктів для синтезу відповідних (s)-енантіомерів та (-)3-(4-феніл-1-піперазиніл)-1,2-пропандіолу</a>
Попередній патент: 1,3-діоксолани з протикашльовою активністю
Наступний патент: Спосіб приведення у вихідний стан ракети-носія при пуску, що не відбувся
Випадковий патент: Суміш для дитячого харчування







