Антитіло проти dkk-1
Номер патенту: 103916
Опубліковано: 10.12.2013
Автори: Свенсон Барбара Енн, Дарлінг Райан Джеймс, Галвін Рейчелл Дженетт, Шедід Марсіу
Формула / Реферат
1. Людське сконструйоване антитіло до DKK-1, яке включає в себе варіабельну ділянку легкого ланцюга (LCVR) і варіабельну ділянку важкого ланцюга (HCVR), причому LCVR містить гіперваріабельні ділянки (CDR) LCDR1, LCDR2 та LCDR3, a HCVR містить гіперваріабельні ділянки (CDR) HCDR1, HCDR2 та HCDR3, де LCDR1 має амінокислотну послідовність SEQ ID NO:5, LCDR2 має амінокислотну послідовність SEQ ID NO:47, LCDR3 має амінокислотну послідовність SEQ ID NO:49, HCDR1 має амінокислотну послідовність SEQ ID NO:1, HCDR2 має амінокислотну послідовність SEQ ID NO:2 та HCDR3 має амінокислотну послідовність SEQ ID NO:44.
2. Людське сконструйоване антитіло до DKK-1 за п. 1, де LCVR містить амінокислотну послідовність SEQ ID NO:52 та HCVR містить амінокислотну послідовність SEQ ID NO:51.
3. Людське сконструйоване антитіло до DKK-1 за п. 1, де LCDR2 має амінокислотну послідовність SEQ ID NO:8, LCDR3 має амінокислотну послідовність SEQ ID NO:7 та HCDR3 має амінокислотну послідовність SEQ ID NO:4.
4. Людське сконструйоване антитіло до DKK-1 за п. 2, де LCVR і HCVR містять амінокислотні послідовності, вибрані з наведеної нижче групи:
(і) LCVR містить амінокислотну послідовність SEQ ID NO:13 та HCVR містить амінокислотну послідовність SEQ ID NO:11;
(іі) LCVR містить амінокислотну послідовність SEQ ID NO:14 та HCVR містить амінокислотну послідовність SEQ ID NO:12;
(ііі) LCVR містить амінокислотну послідовність SEQ ID NO:15 та HCVR містить амінокислотну послідовність SEQ ID NO:11;
(iv) LCVR містить амінокислотну послідовність SEQ ID NO: 16 та HCVR містить амінокислотну послідовність SEQ ID NO:11.
5. Людське сконструйоване антитіло до DKK-1 за п. 4, де LCVR містить амінокислотну послідовність SEQ ID NO:14 та HCVR містить амінокислотну послідовність SEQ ID NO: 12.
6. Людське сконструйоване антитіло до DKK-1 за п. 4, яке включає в себе важкий ланцюг та легкий ланцюг, які мають амінокислотні послідовності, вибрані з наведеної нижче групи:
a) важкий ланцюг має амінокислотну послідовність SEQ ID NO:17 та легкий ланцюг має амінокислотну послідовність SEQ ID NO: 19,
b) важкий ланцюг має амінокислотну послідовність SEQ ID NO:18 та легкий ланцюг має амінокислотну послідовність SEQ ID NO:20,
c) важкий ланцюг має амінокислотну послідовність SEQ ID NO:17 та легкий ланцюг має амінокислотну послідовність SEQ ID NO:21, та
d) важкий ланцюг має амінокислотну послідовність SEQ ID NO:17 та легкий ланцюг має амінокислотну послідовність SEQ ID NO: 22.
7. Людське сконструйоване антитіло до DKK-1, яке включає в себе два легкі ланцюги, причому кожен легкий ланцюг має амінокислотну послідовність SEQ ID NO:20, та два важкі ланцюги, причому кожен важкий ланцюг має амінокислотну послідовність SEQ ID NO:18.
8. Фармацевтична композиція, яка містить людське сконструйоване антитіло до DKK-1 за будь-яким з пп. 1-7 та фармацевтично прийнятний носій, розріджувач або допоміжну речовину.
9. Спосіб лікування кісток, який включає введення в організм пацієнта, який цього потребує, ефективної кількості людського сконструйованого антитіла до DKK-1 за будь-яким з пп. 1-7.
10. Спосіб лікування раку, який включає введення в організм пацієнта, який цього потребує, ефективної кількості людського сконструйованого антитіла до DKK-1 за будь-яким з пп. 1-7.
11. Спосіб за п. 10, який відрізняється тим, що згаданий рак вибраний з групи, яку складають множинна мієлома, рак молочної залози та недрібноклітинний рак легень.
Текст
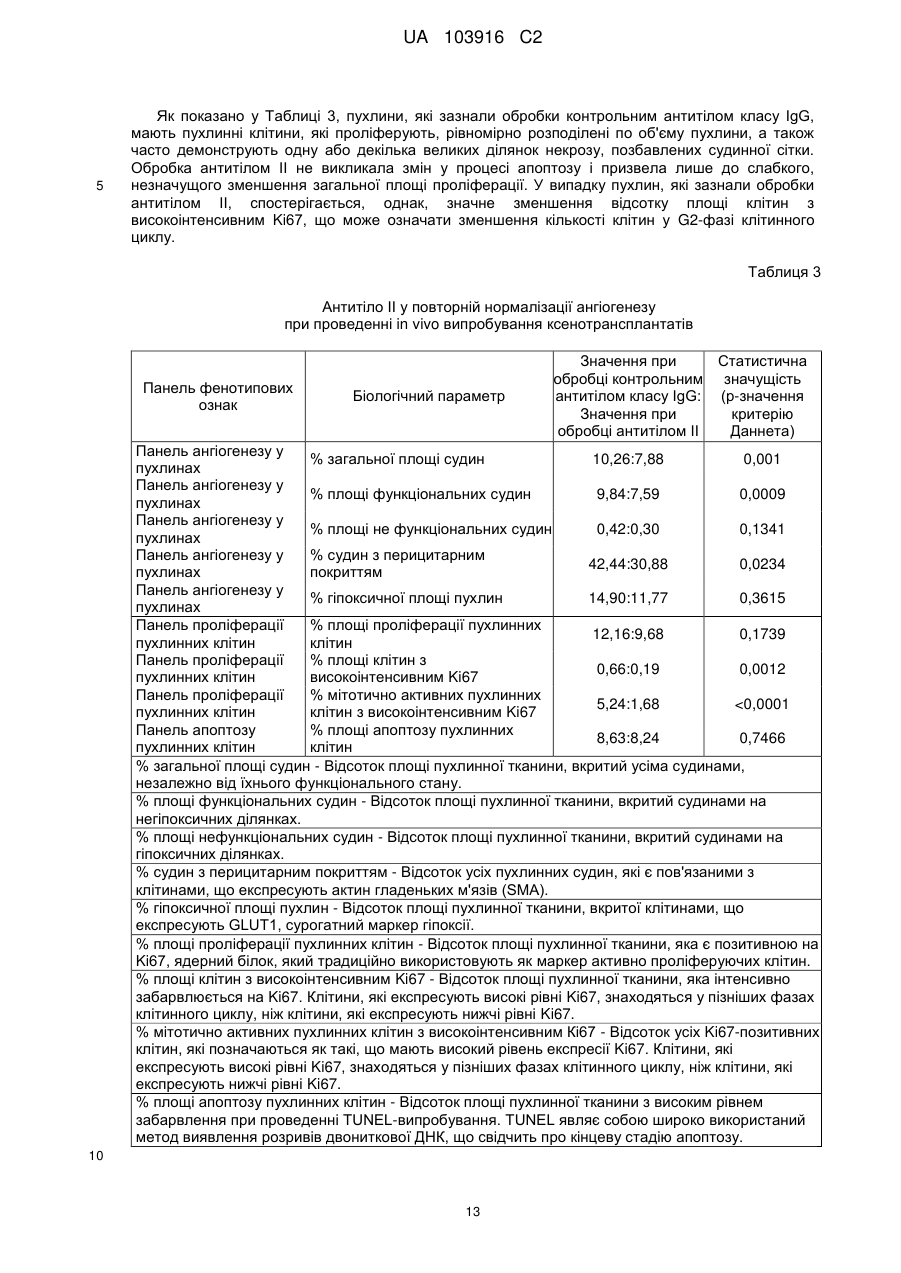
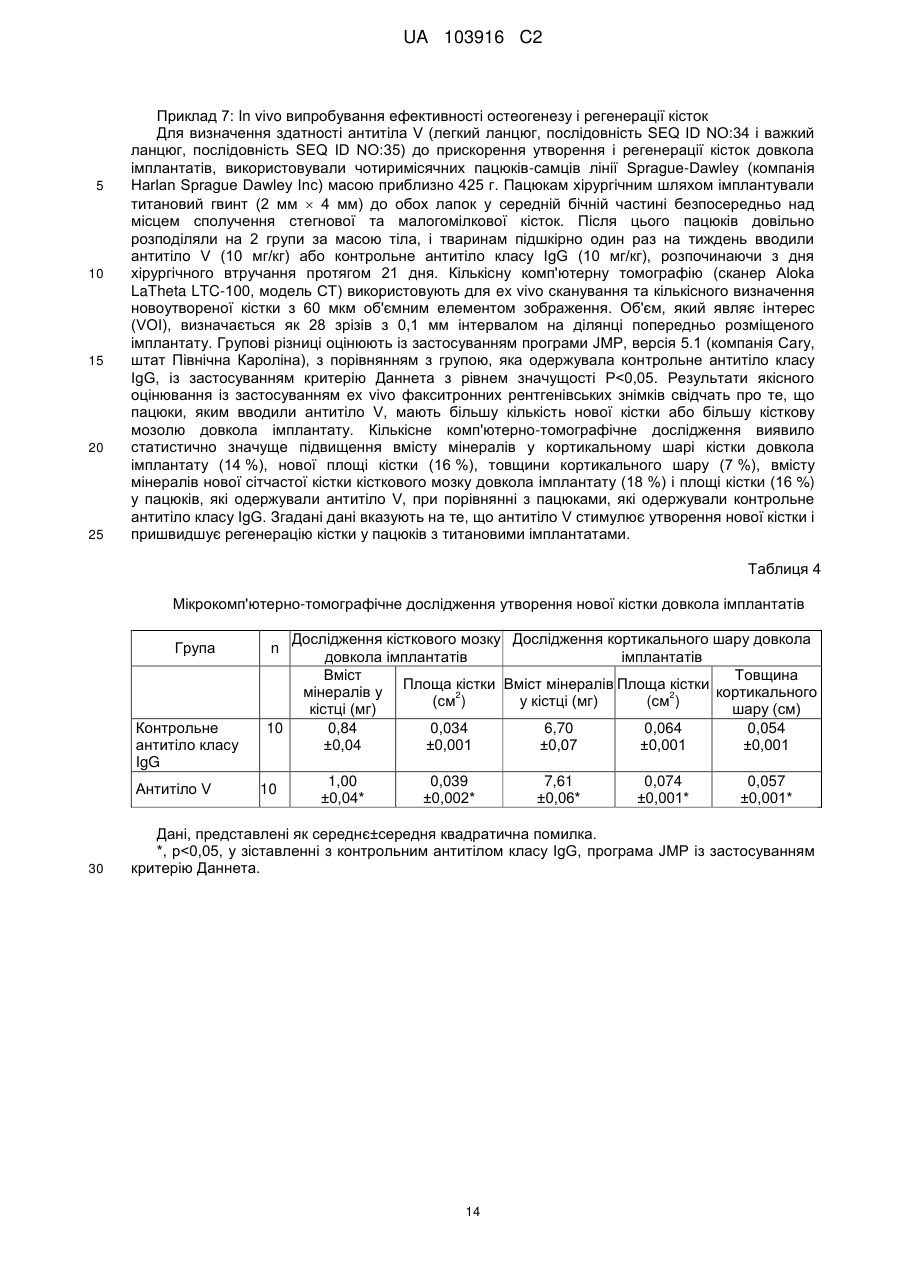
Реферат: Винахід належить до антитіла та його антигензв'язувальних фрагментів, які зв'язуються та пригнічують активність людського DKK-1, фармацевтичної композиції, що містить антитіло, UA 103916 C2 (12) UA 103916 C2 способу лікування кісток та раку за допомогою антитіла або його антигензв′язувального фрагмента проти людського DKK-1. UA 103916 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід стосується людських сконструйованих антитіл до DKK-1 та їх застосування при лікуванні захворювань, патогенез яких опосередкований DKK-1. DKK-1 (Dickkopf-1) є членом родини білків dickkopf, які, як було показано, є негативними регуляторами канонічного сигнального шляху Wnt. Цей шлях відіграє значну роль у розвитку та утворенні кісток. DKK-1 пригнічує передавання сигналу Wnt шляхом взаємодії з корецепторами Wnt LRP5 або LRP6 та білками kremen. DKK-1 запобігає взаємодії членів сигнального шляху Wnt з LRP5 або LRP6, таким чином запобігаючи Wnt-опосередкованої трансдукції сигналів. Також було показано, що DKK-1 має відношення до ракових захворюваннях, які метастазують до кісток, у тому числі множинної мієломи, раку молочної залози, раку нирок та недрібноклітинного раку легень. Були описані антитіла, які зв'язують DKK-1 (див., наприклад, WO2006015373), однак все ще залишається потреба у терапевтичних людських сконструйованих антитілах до DKK-1, які будуть пригнічувати взаємодію DKK-1 з LRP5 та LRP6. Крім того, приймаючи до уваги участь DKK-1 у регуляції утворення кісток, існує потреба у терапевтичних людських сконструйованих антитілах до DKK-1 для застосування при лікуванні кісток. Крім того, з огляду на участь DKK-1 у ракових захворюваннях, існує потреба у людських сконструйованих антитілах до DKK-1 для лікування ракових захворюваннях, у тому числі множинної мієломи, раку молочної залози, раку нирок та недрібноклітинного раку легень. Антитіла за цим винаходом є терапевтично прийнятними антагоністами DKK-1, які мають ряд бажаних властивостей. Представлені людські сконструйовані антитіла демонструють високу спорідненість (Kd) до людського DKK-1, DKK-1 макак-крабоїдів, DKK-1 пацюків, DKK-1 мишей та DKK-1 кролів. Антитіла за цим винаходом блокують DKK-1-опосередковане пригнічення лужної фосфатази, маркера активності остеобластів. Крім того, антитіла за цим винаходом демонструють на in vivo моделі підвищення густини кісткової маси як переднього, так і заднього кортикального шару у випадку кортикального дефекту, і демонструють значне пригнічення росту ксенотрансплантатів недрібноклітинного раку легенів in vivo. Цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, яке (який) має значення Kd при температурі 37 °C менше ніж -11 5,0 10 M для людського DKK-1 (послідовність SEQ ID NO:29), DKK-1 макак-крабоїдів (послідовність SEQ ID NO:30), DKK-1 пацюків (послідовність SEQ ID NO:31), DKK-1 мишей (послідовність SEQ ID NO:33) та DKK-1 кролів (послідовність SEQ ID NO:32). Цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, причому LCDR1 має амінокислотну послідовність SEQ ID NO:5, LCDR2 має амінокислотну послідовність SEQ ID NO:47, LCDR3 має амінокислотну послідовність SEQ ID NO:49, HCDR1 має амінокислотну послідовність SEQ ID NO:1, HCDR2 має амінокислотну послідовність SEQ ID NO:2 та HCDR3 має амінокислотну послідовність SEQ ID NO:44. Цей винахід також пропонує фармацевтичну композицію, як містить людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент за цим винаходом та фармацевтично прийнятний носій, розріджувач або допоміжну речовину. Цей винахід пропонує спосіб лікування кісток, який включає введення людського сконструйованого антитіла до DKK-1 або його антигензв'язувального фрагмента за цим винаходом. Цей винахід також пропонує спосіб лікування раку, який включає введення людського сконструйованого антитіла до DKK-1 або його антигензв'язувального фрагмента за цим винаходом, причому згаданий рак вибраний з групи, яку складають множинна мієлома, рак молочної залози, рак нирок та недрібноклітинний рак легень. Цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, як розкрито у цьому описі, причому згадане антитіло має -11 значення Kd менше ніж 1,5 × 10 М для людського DKK-1 (послідовність SEQ ID NO:29). За варіантом, якому віддається більша перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, причому згадане антитіло має -11 значення Kd менше ніж 1,0 × 10 М для людського DKK-1 (послідовність SEQ ID NO:29). За ще одним варіантом, якому віддається перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, причому згадане антитіло має -12 значення Kd менше ніж 5,0 × 10 М для людського DKK-1 (послідовність SEQ ID NO:29). За варіантом, якому віддається більша перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, причому згадане антитіло має -12 -11 значення Kd від 0,5 × 10 М до 1,5 × 10 М для людського DKK-1 (послідовність SEQ ID NO:29). За ще одним варіантом, якому віддається перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, причому згадане 1 UA 103916 C2 -12 5 10 15 20 25 30 35 40 45 50 55 60 -11 антитіло має значення Kd від 1,0 × 10 М до 1,0 × 10 M для людського DKK-1 (послідовність SEQ ID NO:29). Значення Kd встановлюють зв'язуванням у рівноважному стані при температурі 37 °C, як описано у Прикладі 2. Цей винахід також пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, як розкрито у цьому описі, причому згадане антитіло має -11 значення Kd менше ніж 5,0 × 10 M для людського DKK-1 (послідовність SEQ ID NO:29), DKK-1 макак-крабоїдів (послідовність SEQ ID NO:30), DKK-1 пацюків (послідовність SEQ ID NO:31), DKK-1 мишей (послідовність SEQ ID NO:33) та DKK-1 кролів (послідовність SEQ ID NO:32). За варіантом, якому віддається більша перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, причому згадане антитіло має -11 значення Kd менше ніж 3,0 10 М для людського DKK-1 (послідовність SEQ ID NO:29), DKK-1 макак-крабоїдів (послідовність SEQ ID NO:30), DKK-1 пацюків (послідовність SEQ ID NO:31), DKK-1 мишей (послідовність SEQ ID NO:33) та DKK-1 кролів (послідовність SEQ ID NO:32). За ще одним варіантом, якому віддається перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, причому згадане антитіло має -11 значення Kd менше ніж 2,0 10 М для людського DKK-1 (послідовність SEQ ID NO:29), DKK-1 пацюків (послідовність SEQ ID NO:31) та DKK-1 мишей (послідовність SEQ ID NO:33). За варіантом, якому віддається більша перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, причому згадане антитіло має -11 -11 значення Kd від 1,0 10 M та 5,0 10 М для людського DKK-1 (послідовність SEQ ID NO:29), DKK-1 макак-крабоїдів (послідовність SEQ ID NO:30), DKK-1 пацюків (послідовність SEQ ID NO:31), DKK-1 мишей (послідовність SEQ ID NO:33) та DKK-1 кролів (послідовність SEQ ID NO:32). За ще одним варіантом, якому віддається перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, причому згадане -11 -11 антитіло має значення Kd від 1,5 10 М та 3,0 × 10 М для людського DKK-1 (послідовність SEQ ID NO:29), DKK-1 пацюків (послідовність SEQ ID NO:31) та DKK-1 мишей (послідовність SEQ ID NO:33). Значення Kd встановлюють зв'язуванням у рівноважному стані при температурі 37 °C, як описано у Прикладі 2. За варіантом, якому віддається більша перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, який складають LCVR, яка містить амінокислотну послідовність SEQ ID NO:14, та HCVR, яка містить амінокислотну послідовність SEQ ID NO:12, і причому згадане людське сконструйоване антитіло -11 до DKK-1 або його антигензв'язувальний фрагмент має значення Kd менше ніж 3,0 × 10 М для людського DKK-1 (послідовність SEQ ID NO:29), DKK-1 макак-крабоїдів (послідовність SEQ ID NO:30), DKK-1 пацюків (послідовність SEQ ID NO:31), DKK-1 мишей (послідовність SEQ ID NO:33) та DKK-1 кролів (послідовність SEQ ID NO:32). За ще одним варіантом, якому віддається перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, яке (який) складають LCVR, яка містить амінокислотну послідовність SEQ ID NO:14, та HCVR, яка містить амінокислотну послідовність SEQ ID NO:12, і причому згадане людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний -11 фрагмент має значення Kd менше ніж 2,5 × 10 М для людського DKK-1 (послідовність SEQ ID NO:29), DKK-1 макак-крабоїдів (послідовність SEQ ID NO:30), DKK-1 пацюків (послідовність SEQ ID NO:31), DKK-1 мишей (послідовність SEQ ID NO:33) та DKK-1 кролів (послідовність SEQ ID NO:32). За варіантом, якому віддається більша перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, яке (який) складають LCVR, яка містить амінокислотну послідовність SEQ ID NO:14, та HCVR, яка містить амінокислотну послідовність SEQ ID NO:12, і причому згадане людське сконструйоване антитіло -11 до DKK-1 або його антигензв'язувальний фрагмент має значення Kd менше ніж 2,0 × 10 М для людського DKK-1 (послідовність SEQ ID NO:29), DKK-1 макак-крабоїдів (послідовність SEQ ID NO:30), DKK-1 пацюків (послідовність SEQ ID NO:31), DKK-1 мишей (послідовність SEQ ID NO:33) та DKK-1 кролів (послідовність SEQ ID NO:32). За ще одним варіантом, якому віддається перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, яке (який) складають LCVR, яка містить амінокислотну послідовність SEQ ID NO:14, та HCVR, яка містить амінокислотну послідовність SEQ ID NO:12, і причому згадане людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний -12 -11 фрагмент має значення Kd від 0,5 × 10 М до 3,0 × 10 М для людського DKK-1 (послідовність SEQ ID NO:29), DKK-1 макак-крабоїдів (послідовність SEQ ID NO:30), DKK-1 пацюків (послідовність SEQ ID NO:31), DKK-1 мишей (послідовність SEQ ID NO:33) та DKK-1 кролів (послідовність SEQ ID NO:32). За варіантом, якому віддається більша перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, 2 UA 103916 C2 5 10 15 20 25 30 35 40 45 50 55 яке (який) складають LCVR, яка містить амінокислотну послідовність SEQ ID NO:14, та HCVR, яка містить амінокислотну послідовність SEQ ID NO:12, і причому згадане людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент має значення Kd -12 -11 від 1,0 × 10 М до 2,5 × 10 М для людського DKK-1 (послідовність SEQ ID NO:29), DKK-1 макак-крабоїдів (послідовність SEQ ID NO:30), DKK-1 пацюків (послідовність SEQ ID NO:31), DKK-1 мишей (послідовність SEQ ID NO:33) та DKK-1 кролів (послідовність SEQ ID NO:32). Значення Kd встановлюють зв'язуванням у рівноважному стані при температурі 37 °C, як описано у Прикладі 2. Цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, яке (який) включає в себе варіабельну ділянку легкого ланцюга (LCVR) і варіабельну ділянку важкого ланцюга (HCVR), причому LCVR містить гіперваріабельні ділянки (CDRs) LCDR1, LCDR2 та LCDR3, a HCVR містить CDRs HCDR1, HCDR2 та HCDR3, де LCDR1 має амінокислотну послідовність SEQ ID NO:5, HCDR1 має амінокислотну послідовність SEQ ID NO:1 та HCDR2 має амінокислотну послідовність SEQ ID NO:2. Цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, де LCDR1 має амінокислотну послідовність SEQ ID NO:46, LCDR2 має амінокислотну послідовність SEQ ID NO:48, LCDR3 має амінокислотну послідовність SEQ ID NO:50, HCDR1 має амінокислотну послідовність SEQ ID NO:1, HCDR2 має амінокислотну послідовність SEQ ID NO:43 та HCDR3 має амінокислотну послідовність SEQ ID NO:45. Цей винахід, за варіантом, якому віддається перевага, пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, де LCDR1 має амінокислотну послідовність SEQ ID NO:5, LCDR2 має амінокислотну послідовність SEQ ID NO:47, LCDR3 має амінокислотну послідовність SEQ ID NO:49, HCDR1 має амінокислотну послідовність SEQ ID NO:1, HCDR2 має амінокислотну послідовність SEQ ID NO:2 та HCDR3 має амінокислотну послідовність SEQ ID NO:44. Цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, де LCDR1 має амінокислотну послідовність SEQ ID NO:5, LCDR2 має амінокислотну послідовність, вибрану з групи, яку складають послідовності SEQ ID NO:6, SEQ ID NO:8 та SEQ ID NO:10, LCDR3 має амінокислотну послідовність, вибрану з групи, яку складають послідовності SEQ ID NO:7 та SEQ ID NO:9, HCDR1 має амінокислотну послідовність SEQ ID NO:1, HCDR2 має амінокислотну послідовність SEQ ID NO:2 і HCDR3 має амінокислотну послідовність, вибрану з групи, яку складають послідовності SEQ ID NO:3 та SEQ ID NO:4. Цей винахід, за варіантом, якому віддається перевага, пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, де LCDR1, LCDR2, LCDR3, HCDR1, HCDR2 та HCDR3 мають амінокислотні послідовності, вибрані з наведеної нижче групи: (і) LCDR1 - послідовність SEQ ID NO:5, LCDR2 - послідовність SEQ ID NO:6, LCDR3 послідовність SEQ ID NO:7, HCDR1 - послідовність SEQ ID NO:1, HCDR2 - послідовність SEQ ID NO:2 та HCDR3 - послідовність SEQ ID NO:3, (ii) LCDR1 - послідовність SEQ ID NO:5, LCDR2 - послідовність SEQ ID NO:8, LCDR3 послідовність SEQ ID NO:7, HCDR1 - послідовність SEQ ID NO:1, HCDR2 - послідовність SEQ ID NO:2 та HCDR3 - послідовність SEQ ID NO:4, (iii) LCDR1 - послідовність SEQ ID NO:5, LCDR2 - послідовність SEQ ID NO:6, LCDR3 послідовність SEQ ID NO:9, HCDR1 - послідовність SEQ ID NO:1, HCDR2 - послідовність SEQ ID NO:2 та HCDR3 - послідовність SEQ ID NO:3, (iv) LCDR1 - послідовність SEQ ID NO:5, LCDR2 - послідовність SEQ ID NO:10, LCDR3 послідовність SEQ ID NO:9, HCDR1 - послідовність SEQ ID NO:1, HCDR2 - послідовність SEQ ID NO:2 та HCDR3 - послідовність SEQ ID NO:3. Цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, де LCVR містить амінокислотну послідовність SEQ ID NO:52 та HCVR містить амінокислотну послідовність SEQ ID NO:51. Цей винахід, за варіантом, якому віддається перевага, пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, де LCVR містить амінокислотну послідовність, вибрану з групи, яку складають послідовності SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15 та SEQ ID NO:16. Цей винахід, за варіантом, якому віддається перевага, пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, де HCVR містить амінокислотну послідовність, вибрану з групи, яку складають послідовності SEQ ID NO:11 та SEQ ID NO:12. 3 UA 103916 C2 5 10 15 20 25 30 35 40 45 50 55 Цей винахід, за варіантом, якому віддається перевага, пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, де LCVR і HCVR містять амінокислотні послідовності, вибрані з наведеної нижче групи: (і) LCVR містить амінокислотну послідовність SEQ ID NO:13 та HCVR містить амінокислотну послідовність SEQ ID NO:11; (ii) LCVR містить амінокислотну послідовність SEQ ID NO:14 та HCVR містить амінокислотну послідовність SEQ ID NO:12; (iii) LCVR містить амінокислотну послідовність SEQ ID NO:15 та HCVR містить амінокислотну послідовність SEQ ID NO:11; (iv) LCVR містить амінокислотну послідовність SEQ ID NO:16 та HCVR містить амінокислотну послідовність SEQ ID NO:11. Цей винахід, за варіантом, якому віддається перевага, пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент, яке (який) включає в себе LCVR, яка містить амінокислотну послідовність SEQ ID NO:14, та HCVR, яка містить амінокислотну послідовність SEQ ID NO:12. Цей винахід, за варіантом, якому віддається перевага, пропонує людське сконструйоване антитіло до DKK-1, яке включає в себе легкий ланцюг, причому згаданий легкий ланцюг містить амінокислотну послідовність, вибрану з групи, яку складають послідовності SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21 та SEQ ID NO:22. Цей винахід, за варіантом, якому віддається перевага, пропонує людське сконструйоване антитіло до DKK-1, яке включає в себе важкий ланцюг, причому згаданий важкий ланцюг містить амінокислотну послідовність, вибрану з групи, яку складають послідовності SEQ ID NO:17 та SEQ ID NO:18. За варіантом, якому віддається більша перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1, яке включає в себе важкий ланцюг і легкий ланцюг, які мають амінокислотні послідовності, вибрані з наведеної нижче групи: (і) важкий ланцюг має амінокислотну послідовність SEQ ID NO:17 та легкий ланцюг має амінокислотну послідовність SEQ ID NO:19, (іі) важкий ланцюг має амінокислотну послідовність SEQ ID NO:18 та легкий ланцюг має амінокислотну послідовність SEQ ID NO:20, (ііі) важкий ланцюг має амінокислотну послідовність SEQ ID NO:17 та легкий ланцюг має амінокислотну послідовність SEQ ID NO:21, та (iv) важкий ланцюг має амінокислотну послідовність SEQ ID NO:17 та легкий ланцюг має амінокислотну послідовність SEQ ID NO:22. Цей винахід, за варіантом, якому віддається перевага, пропонує людське сконструйоване антитіло до DKK-1, яке включає в себе два легкі ланцюги, причому кожен легкий ланцюг має амінокислотну послідовність SEQ ID NO:19, та два важкі ланцюги, причому кожен важкий ланцюг має амінокислотну послідовність SEQ ID NO:17. Цей винахід, за варіантом, якому віддається перевага, пропонує людське сконструйоване антитіло до DKK-1, яке включає в себе два легкі ланцюги, причому кожен легкий ланцюг має амінокислотну послідовність SEQ ID NO:21, та два важкі ланцюги, причому кожен важкий ланцюг має амінокислотну послідовність SEQ ID NO:17. Цей винахід, за варіантом, якому віддається перевага, пропонує людське сконструйоване антитіло до DKK-1, яке включає в себе два легкі ланцюги, причому кожен легкий ланцюг має амінокислотну послідовність SEQ ID NO:22, та два важкі ланцюги, причому кожен важкий ланцюг має амінокислотну послідовність SEQ ID NO:17. Цей винахід, за варіантом, якому віддається перевага, пропонує людське сконструйоване антитіло до DKK-1, яке включає в себе два легкі ланцюги, причому кожен легкий ланцюг має амінокислотну послідовність SEQ ID NO:20, та два важкі ланцюги, причому кожен важкий ланцюг має амінокислотну послідовність SEQ ID NO:18. Цей винахід також пропонує антитіло або його антигензв'язувальний фрагмент, яке (який) конкурує з людським сконструйованим антитілом до DKK-1 або його антигензв'язувальним фрагментом за цим винаходом за зв'язування з людським DKK-1 (послідовність SEQ ID NO:29), як визначається із застосуванням конкурентно-зв'язувального випробування антитіл. Цей винахід також пропонує фармацевтичну композицію, яка містить людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент за цим винаходом та фармацевтично прийнятний носій, розріджувач або допоміжну речовину. Крім того, цей винахід пропонує фармацевтичну композицію, яка містить людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент за цим винаходом 4 UA 103916 C2 5 10 15 20 25 30 35 40 45 50 55 60 спільно з фармацевтично прийнятним носієм, розріджувачем або допоміжною речовиною та факультативно іншими терапевтичними інгредієнтами. За ще одним аспектом, цей винахід пропонує спосіб лікування кісток, який включає введення людського сконструйованого антитіла до DKK-1 або його антигензв'язувального фрагмента за цим винаходом. За ще одним аспектом, цей винахід пропонує спосіб лікування раку, який включає введення людського сконструйованого антитіла до DKK-1 або його антигензв'язувального фрагмента за цим винаходом, причому згаданий рак, за варіантом, якому віддається перевага, вибраний з групи, яку складають множинна мієлома, рак молочної залози та недрібноклітинний рак легень. Крім того, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент за цим винаходом для застосування у терапії. За варіантом, якому віддається перевага, цей винахід пропонує людське сконструйоване антитіло до DKK-1 або його антигензв'язувальний фрагмент за цим винаходом для застосування при лікуванні кісток або лікуванні раку, причому згаданий рак, за варіантом, якому віддається перевага, вибраний з групи, яку складають множинна мієлома, рак молочної залози та недрібноклітинний рак легень. Крім того, цей винахід також пропонує застосування людського сконструйованого антитіла до DKK-1 або його антигензв'язувального фрагмента за цим винаходом для виготовлення лікарського засобу для терапії, лікування кісток або лікування раку, причому згаданий рак, за варіантом, якому віддається перевага, вибраний з групи, яку складають множинна мієлома, рак молочної залози та недрібноклітинний рак легень. Визначення Непроцесоване антитіло у тому вигляді, у якому воно існує за природних умов, являє собою молекулу імуноглобуліну, яка складається з двох важких (Н) ланцюгів та двох легких (L) ланцюгів, взаємозв'язаних дисульфідними зв'язками. Амінокінцева частина кожного ланцюга містить варіабельну ділянку довжиною приблизно 100-110 амінокислот, яка відповідає, головним чином, за розпізнавання антигену із застосуванням гіперваріабельних ділянок (CDRs), які входять до її складу. На карбоксильному кінці кожного ланцюга знаходиться константна ділянка, яка відповідає головним чином за ефекторну функцію. CDRs перемежовуються з ділянками, які є більш консервативними, які називають каркасними ділянками ("FR"). Кожна варіабельна ділянка легкого ланцюга (LCVR) та варіабельна ділянка важкого ланцюга (HCVR) складається з трьох CDRs та чотирьох FRs, які розміщені від амінокінця до карбоксильного кінця у такому порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Три CDRs легкого ланцюга позначені як "LCDR1, LCDR2 та LCDR3", а три CDRs важкого ланцюга позначені як "HCDR1, HCDR2 та HCDR3." CDRs містять більшість залишків, які визначають специфічні взаємодії з антигеном. Нумерація та позиціонування амінокислотних залишків CDR у межах LCVR та HCVR відповідає добре відомій схемі нумерації, яка розроблена Кабатом (Kabat). Легкі ланцюги класифікуються як каппа або лямбда і відрізняються конкретною константною ділянкою, як відомо у цій галузі. Важкі ланцюги класифікуються як гамма, мю, альфа, дельта або епсилон і визначають ізотип антитіла як IgG, IgM, IgA, IgD або IgE, відповідно. IgG антитіла можуть бути крім того поділені на підкласи, наприклад, IgGl, IgG2, IgG3, IgG4. Важкий ланцюг кожного типу відрізняється конкретною константною ділянкою з послідовністю, добре відомою у цій галузі. Термін "моноклональне антитіло" (Mab), у значенні, вживаному у цьому описі, означає антитіло, яке походить з однієї копії або клону, у тому числі, наприклад, будь-якого еукаріотного, прокаріотного або фагового клону, а не спосіб, із застосуванням якого воно продукується. За варіантом, якому віддається перевага, моноклональні антитіла за цим винаходом існують у однорідній або по суті однорідній популяції. Повні моноклональні антитіла містять 2 важкі ланцюги та 2 легкі ланцюги. "Антигензв'язувальні фрагменти" таких моноклональних антитіл включають, наприклад, Fab-фрагменти, Fab'-фрагменти, F(ab')2-фрагменти та одноланцюгові Fv-фрагменти. Моноклональні антитіла та їхні антигензв'язувальні фрагменти за цим винаходом можна одержати, наприклад, за методами рекомбінантних ДНК, із використанням технології фагового дисплею, синтетичними методами, наприклад, пересадження CDR, або комбінаціями таких методів чи інших методів, відомих у цій галузі. Наприклад, миші можуть бути імунізовані людським DKK-1 або його фрагментом, антитіла, які будуть одержані, можуть бути виділені та очищені, і визначення того, чи мають вони зв'язувальні та функціональні властивості подібні до або такі ж самі, що і у антитіл, розкритих у цьому описі, може здійснюватись за способами, розкритими у наведених нижче Прикладах. Антигензв'язувальні фрагменти можуть одержуватись також із застосуванням традиційних методів. Методи продукування та очищення 5 UA 103916 C2 5 10 15 20 25 30 35 40 45 50 55 антитіл або антигензв'язувальних фрагментів є добре відомими у цій галузі і їх можна знайти, наприклад, у Harlow and Lane (1988) Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, розділи 5-8 та 15, ISBN 0-87969-314-2. Термін "химерне антитіло" означає антитіло, яке містить домени від різних видів (як правило, 2 видів). Антитіло V являє собою химерне антитіло, варіабельні домени легкого ланцюга та важкого ланцюга якого містять залишки мишачого антитіла, у той час як до складу доменів константної ділянки легкого ланцюга входять залишки, які складають пацючий легкий ланцюг типу каппа, а до складу доменів константної ділянки важкого ланцюга входять залишки, які складають пацюче антитіло класу IgGl. Антитіло V являє собою мишачо/пацючу химеру і використовується у дослідженнях для зменшення ймовірності імунної реакції у довгострокових передклінічних моделей. Термін "людські сконструйовані антитіла" означає моноклональні антитіла, які мають зв'язувальні та функціональні властивості за цим винаходом і які мають каркасні ділянки, які є по суті людськими або повністю людськими, довкола гіперваріабельних ділянок, які походять з нелюдського антитіла. Термін "антигензв'язувальні фрагменти" таких людських сконструйованих антитіл означає, наприклад, Fab-фрагменти, Fab'-фрагменти, F(аb')2-фрагменти і одноланцюгові Fv-фрагменти. Термін "каркасна ділянка" або "каркасна послідовність" означає будь-яку з каркасних ділянок 1-4. Людські сконструйовані антитіла та їхні антигензв'язувальні фрагменти, які охоплюються цим винаходом, включають молекули, причому будь-яка одна або декілька з каркасних ділянок 1-4 є по суті або повністю людськими, тобто де є присутньою будь-яка з можливих комбінацій окремих по суті або повністю людських каркасних ділянок 1-4. Наприклад, сюди входять молекули, у яких каркасна ділянка 1 і каркасна ділянка 2, каркасна ділянка 1 і каркасна ділянка 3, каркасна ділянка 1, 2 та 3 тощо, є по суті або повністю людськими. По суті людськими каркасними ділянками є каркасні ділянки, послідовність яких є на приблизно щонайменше 80 % ідентичною до відомої людської зародкової каркасної послідовності. За варіантом, якому віддається перевага, по суті людські каркасні ділянки мають послідовність, що є на приблизно щонайменше 85 %, на приблизно 90 %, на приблизно 95 % або на приблизно 99 % ідентичною до відомої людської зародкової каркасної послідовності. Повністю людськими каркасними ділянками є каркасні ділянки, послідовність яких є ідентичною до відомої людської зародкової каркасної послідовності. Людські каркасні зародкові послідовності можна одержати з ImMunoGeneTics (IMGT) через веб-сайт http://imgt.cines.fr або з The Immunoglobulin FactsBook by Marie-Paule Lefranc and Gerard Lefranc, Academic Press, 2001, ISBN 012441351. Наприклад, зародкові каркасні ділянки легкого ланцюга можна вибрати з групи, яку складають: A11, А17, А18, А19, А20, А27, А30, LI, L1I, L12, L2, L5, L15, L6, L8, O12, O2 та O8, а зародкові каркасні ділянки важкого ланцюга можна вибрати з групи, яку складають: VH2-5, VH2-26, VH2-70, VH3-20, VH3-72, VHI-46, VH3-9, VH3-66, VH3-74, VH4-31, VHI-18, VHI-69, VI-13-7, VH3-11, VH3-15, VH3-21, VH3-23, VH3-30, VH3-48, VH4-39, VH4-59 та VH5-5I. Людські сконструйовані антитіла, на додаток до антитіл, розкритих у цьому описі, які демонструють подібні функціональні властивості за цим винаходом, можна одержати із застосуванням декількох різних способів. Конкретні антитіла, розкриті у цьому описі, можуть використовуватись як матриці або вихідні антитіла для одержання додаткових антитіл. За одним з варіантів підходу, CDRs вихідного антитіла переносять на людський каркас, який має високу ідентичність послідовності з каркасом вихідного антитіла. Ідентичність послідовності нового каркаса буде, як правило, на приблизно щонайменше 80 %, на приблизно щонайменше 85 %, на приблизно щонайменше 90 %, на приблизно щонайменше 95 % або на приблизно щонайменше 99 % ідентичною послідовності відповідного каркаса вихідного антитіла. Наслідком цього перенесення може бути зниження зв'язувальної спорідненості, порівняно з прийнятним показником вихідного антитіла. У такому разі, каркас можуть піддавати зворотній мутації до вихідного каркаса у певних положеннях, виходячи із конкретних критеріїв, розкритих Queen, et al., (1991) Proc. Natl. Acad. Sci. USA 88:2869. Додаткові посилання з описом способів, прийнятних для гуманізації мишачих антитіл, включають патенти США № 4,816,397; № 5,225,539 та № 5,693,761; комп'ютерні програми ABMOD та ENCAD, описані у Levitt (1983) J. Моl. Віоl. 168:595-620; і спосіб Winter та співробітників (Jones, et al., (1986) Nature 321:522-525; Riechmann et al., (1988) Nature, 332:323-327; та Verhoeyen, et al. (1988) Science, 239:1534-1536. Ідентифікація залишків для розгляду можливості зворотної мутації може здійснюватись таким чином: У разі, якщо амінокислота підпадає під наведену нижче категорію, каркасну амінокислоту людської зародкової послідовності, яка використовується ("каркас-акцептор"), замінюють на каркасну амінокислоту з каркаса вихідного антитіла ("каркас-донор"): 6 UA 103916 C2 5 10 15 20 25 30 35 40 45 50 55 60 (a) амінокислота на людській каркасній ділянці каркаса-акцептора є незвичною для людських каркасів у цьому положенні, у той час як відповідна амінокислота імуноглобулінадонора є типовою для людських каркасів у цьому положенні; (b) положення амінокислоти є безпосередньо прилеглим до однієї з CDRs; або с) будь-який атом бічного ланцюга каркасної амінокислоти знаходиться на відстані приблизно 5-6 Å (Ангстрем) (міжцентрова відстань) від будь-якого атома амінокислоти CDR у тривимірній моделі імуноглобуліну. У разі, якщо кожна з амінокислот людської каркасної ділянки каркаса-акцептора та відповідна амінокислота у каркасі-донорі є незвичайною загалом для людських каркасів у цьому положенні, така амінокислота може бути заміненою на амінокислоту, типову для людських каркасів у цьому положенні. Цей критерій зворотної мутації надає можливість відновлення активності вихідного антитіла. Інший підхід до одержання людських сконструйованих антитіл, які демонструють функціональні властивості, подібні до антитіл, розкритих у цьому описі, залучає випадкову неспецифічну мутацію амінокислот у межах перенесених CDRs без зміни каркаса, і відбір молекул, які одержують, за зв'язувальною спорідненістю та іншими функціональними властивостями, які є такими ж самими або кращими за прийнятні властивості вихідних антитіл. До кожного амінокислотного положення у межах кожної CDR також можуть вводитись одиночні мутації з подальшим визначенням впливу таких мутацій на зв'язувальну спорідненість та інші функціональні властивості. Одиночні мутації, які забезпечують поліпшені властивості, можуть комбінуватись для визначення їхнього впливу у комбінації між собою. Крім того, можливою є комбінація обох вищезазначених підходів. Після перенесення CDR, специфічні каркасні ділянки можуть піддаватись зворотній мутації на додаток до здійснення амінокислотних замін у CDRs. Ця загальна методика описана у публікації Wu, et al., (1999) J. Моl Вiol. 294:151-162. Використовуючи знання за цим винаходом, фахівець у цій галузі може із застосуванням звичайних методів, наприклад, сайтспрямованого мутагенезу, здійснити заміну амінокислот у межах розкритої у цьому описі гіперваріабельної ділянки та каркасних послідовностей і, тим самим, одержати амінокислотні послідовності варіабельної ділянки, які є похідними послідовностей, запропонованих цим винаходом. До конкретного сайту, на якому здійснюється заміна, можуть вводитись майже усі альтернативні природні амінокислоти. Методи, розкриті у цьому описі, можуть у подальшому використовуватись для перевірки цих додаткових амінокислотних послідовностей варіабельної ділянки для ідентифікації послідовностей, які мають вказані in vivo функції. Подібним чином можуть бути ідентифіковані послідовності, прийнятні для одержання людських сконструйованих антитіл та їхніх антигензв'язувальних фрагментів за цим винаходом. За варіантом, якому віддається перевага, амінокислотна заміна у межах каркасів обмежується одним, двома або трьома положеннями у межах будь-якої однієї або декількох з 4 каркасних ділянок легкого ланцюга та/або важкого ланцюга, розкритих у цьому описі. За варіантом, якому віддається перевага, амінокислотна заміна у межах CDRs обмежується одним, двома або трьома положеннями у межах будь-якої однієї або декількох з 3 CDRs легкого ланцюга та/або важкого ланцюга. Можливими також є комбінації різних описаних вище замін у межах цих каркасних ділянок та CDRs. За варіантом, якому віддається найбільша перевага, ці методи використовують для одержання амінокислотних послідовностей варіабельних ділянок із застосуванням амінокислотних послідовностей варіабельних ділянок важкого і легкого ланцюгів, представлених послідовностями SEQ ID NO:12 та SEQ ID NO:14, відповідно. Людськими сконструйованими антитілами або їхніми антигензв'язувальними фрагментами, що "конкурують" з молекулами, розкритими у цьому описі, є антитіла або їхні антигензв'язувальні фрагменти, які зв'язують людський DKK-1 (послідовність SEQ ID NO:29) на сайті(-ах), що є ідентичним(-и) або перекривається(-ються) з сайтом(-ами), з яким(-ими) зв'язуються згадані молекули. Конкуруючі людські сконструйовані антитіла або їхні антигензв'язувальні фрагменти можуть бути ідентифіковані, наприклад, із застосуванням конкурентно-зв'язувального випробування антитіл. Наприклад, зразок очищеного або частково очищеного людського DKK-1 (послідовність SEQ ID NO:29) може зв'язуватись з твердою основою. Після цього додають антитіло, розкрите у цьому описі, та випробовуване моноклональне антитіло або його антигензв'язувальний фрагмент, причому випробовуване антитіло, або антитіло за цим винаходом, є міченими. Якщо мічене антитіло і немічене антитіло зв'язуються з різними або дискретними сайтами на DKK-1, мічене антитіло буде зв'язуватись на однаковому рівні незалежно від того, чи є присутнім або відсутнім очікуване конкуруюче антитіло. Однак у разі, якщо сайти взаємодії є ідентичними або такими, що перекриваються, 7 UA 103916 C2 5 10 15 20 25 30 35 40 45 50 55 60 немічене антитіло буде конкурувати, і кількість міченого антитіла, зв'язана з антигеном, буде меншою. У разі, якщо немічене антитіло є присутнім з надлишком, мічене антитіло не буде зв'язуватись. Для цілей цього винаходу, конкуруючими людськими сконструйованими антитілами або їхніми антигензв'язувальними фрагментами є антитіла або їхні антигензв'язувальні фрагменти, які зменшують зв'язування запропонованих антитіл з DKK-1 на приблизно 50 %, на приблизно 60 %, на приблизно 70 %, на приблизно 80 %, на приблизно 85 %, на приблизно 90 %, на приблизно 95 % або на приблизно 99 %. Подробиці методик проведення таких конкурентно-зв'язувальних випробувань є добре відомими у цій галузі і їх можна знайти, наприклад, у Harlow and Lane (1988) Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, pages 567-569, ISBN 0-87969-314-2. Такі випробування можна перетворити на кількісні застосуванням очищених антитіл. Стандартну криву одержують титруванням одного антитіла проти його міченого варіанта. Титрують здатність неміченого конкуруючого моноклонального антитіла або його антигензв'язувального фрагмента до пригнічення зв'язування міченої молекули з планшетом. Результати наносять на графік і порівнюють концентрації, необхідні для досягнення бажаного ступеня пригнічення зв'язування. Визначення того, чи мають моноклональні антитіла або їхні антигензв'язувальні фрагменти, які конкурують з людськими сконструйованими антитілами або їхніми антигензв'язувальними фрагментами, при проведенні таких конкурентно-зв'язувальних випробувань такі ж самі або подібні функціональні властивості до запропонованих людських сконструйованих антитіл, може здійснюватись за методами, розкритими у наведених у цьому описі Прикладах. Термін "пригнічувати" означає здатність суттєво антагонізувати, перешкоджати, запобігати, стримувати, уповільнювати, порушувати, ліквідувати, припиняти, зменшувати або обертати біологічний вплив DKK-1. Термін "лікування" (або "лікувати") означає процеси, які залучають уповільнення, переривання, зупинення, контролювання, припинення, зменшення або обертання напрямку розвитку або тяжкості симптому, розладу, хворобливого стану або захворювання, але не обов'язково залучають повну ліквідацію усіх симптомів, хворобливих станів або розладів, пов'язаних із захворюванням, що асоціюються з активністю DKK-1. Термін "запобігання" (або "запобігати") означає перешкоджання, стримування або пригнічення захворюваності або виникнення симптому, розладу, хворобливого стану або захворювання. Можуть лікуватись та запобігатись гострі явища та хронічні хворобливі стани. У випадку гострого явища антитіло або його антигензв'язувальний фрагмент вводять на початку появи симптому, розладу, хворобливого стану або захворювання, і припиняють введення, коли гостре явище закінчується. У протилежність до цього, хронічний симптом, розлад, хворобливий стан або захворювання лікують протягом більш тривалого періоду часу. Термін "ефективна кількість" означає кількість або дозу антитіла за цим винаходом, яка, при введенні разовою дозою або кількома дозами в організм пацієнта, забезпечує необхідне лікування або запобігання. Терапевтично ефективні кількості сполук, які мають властивості антитіла за цим винаходом, можуть становити кількість від приблизно 0,1 мг/кг до приблизно 20 мг/кг на одну дозу. Терапевтично ефективна кількість для будь-якого окремого пацієнта може визначатись медичним працівником контролюванням ефекту сполук, які мають властивості антитіл за цим винаходом, на біомаркер. Термін "лікування кісток" означає стимулювання остеогенезу на ділянках пошкодження блокуванням DKK-1. Приклади показань для лікування кісток включають, але без обмеження ними, лікування переломів, фіксацію/утримування імплантатів та фіксацію/утримування зубних імплантатів. Людські сконструйовані антитіла за цим винаходом можуть використовуватись як лікарські засоби у медицині із введенням різноманітними шляхами. За варіантом, якому віддається найбільша перевага, такі композиції призначені для парентерального введення. Такі фармацевтичні композиції можуть виготовлятись за методами, добре відомими у цій галузі th (див., наприклад, Remington: The Science and Practice of Pharmacy, 19 ed. (1995), A. Gennaro et al., Mack Publishing Co.), та включати людське сконструйоване антитіло, розкрите у цьому описі, та фармацевтично прийнятний носій, розріджувач або допоміжну речовину. Результати подальших досліджень демонструють, що моноклональні антитіла та їхні антигензв'язувальні фрагменти за цим винаходом є прийнятними як інгібітор DKK-1. Антитіла за цим винаходом мають ряд бажаних властивостей. Наприклад, антитіло II за цим винаходом має підвищену хімічну та фізичну стабільність і розчинність. Для оцінювання хімічної стабільності антитіл здійснюють пришвидшені дослідження інкубуванням антитіл за цим винаходом за різних буферних умов (зміна рН та NaCl) і при температурі 4 °C, 25 °C та 40 °C протягом 4 тижнів. 8 UA 103916 C2 5 10 15 20 25 30 35 Хімічні модифікації антитіл за цим винаходом виявляють із застосуванням катіонообмінної ("СЕХ") хроматографії для відокремлення заряджених варіантів (наприклад, деамідування аспарагіну до аспарагінової кислоти) та LC-MS (рідинна хроматографія-мас-спектрометрія) випробувань для визначення конкретних ділянок розкладу. Антитіло II має найнижчий ступінь розкладу за даними СЕХ, і цей результат також підтверджується даними LC-MS, які показують, що усі три аспарагінові залишки на CDRs мають найнижчий ступінь деамідування порівняно з іншими антитілами, опис яких наведено у цьому описі, після 4-тижневого інкубування при температурі 40 °C у буфері при рН 8. Розчинність антитіла II є кращою порівняно з антитілом І, у випадку введення до складу композиції при рН 6+150 мМ NaCl. Крім того, антитіло II зберігало розчинність на рівні >105 мг/мл у разі зберігання при температурі 4 °C, у той час як розчинність антитіла І становить лише 48 мг/мл і воно випадає до осаду за таких же самих умов. Умовне позначення "ЕС50", у значенні, вживаному у цьому описі, означає концентрацію засобу, який продукує 50 % максимальної реакції, можливої для цього засобу. Умовне позначення "Kd" означає константу дисоціації у стані рівноваги, яка може обчислюватись за формулою: koff/kon=Kd. Приклад 1: Продукування антитіл Антитіла І, II, III і IV можна одержати і очистити як описано нижче. Відповідну лінію клітинихазяїна, таку як НЕК 293 EBNA або СНО, тимчасово або постійно трансфікують експресійною системою для секреції антитіл із застосуванням векторної системи із оптимальним заздалегідь визначеним відношенням HC:LC або одновекторною системою, яка кодує як НС, наприклад, послідовність SEQ ID NO:23 або послідовність SEQ ID NO:24, так і LC, наприклад, послідовність SEQ ID NO:25, послідовність SEQ ID NO:26, послідовність SEQ ID NO:27 або послідовність SEQ ID NO:28. Відстояне середовище, у яке було секретоване антитіло, очищають із застосуванням будь-якого з багатьох традиційних методів. Наприклад, середовище без утруднень завантажене у колонку із сумішшю білка А або G із сефарозою FF, урівноважену сумісним буфером, таким як фосфатно-сольовий буферний розчин (рН 7,4). Згадану колонку промивають для видалення неспецифічних зв'язувальних компонентів. Зв'язане антитіло елююють, наприклад, градієнтом рН (таким як градієнт від 0,1 М натрій-фосфатного буфера (рН 6,8) до 0,1 М натрій-цитратний буфера (рН 3,0)). Фракції антитіла виявляють, наприклад, за допомогою SDS-PAGE (електрофорез у поліакриламідному гелі у присутності додецилсульфату натрію), після чого змішують. Подальше очищення є факультативним, у залежності від передбачуваного застосування. Антитіло може бути сконцентроване та/або профільтроване в стерильних умовах із застосуванням традиційних методів. Розчинні агрегати і мультимери можуть бути ефективно видалені традиційними методами, у тому числі гель-хроматографією за розміром молекул, гідрофобною хроматографією, іонообмінною хроматографією або хроматографією на гідроксіапатитній адсорбційній колонці. Ступінь чистоти антитіла після згаданих операцій хроматографування є більшим ніж 99 %. Згаданий продукт можна негайно заморозити при температурі -70 °C або ліофілізувати. Амінокислотні послідовності цих антитіл наведені нижче. Послідовності SEQ ID NOs Антитіло І II III IV Важкий ланцюг 17 18 17 17 35 Легкий ланцюг 19 20 21 22 34 HCVR 11 12 11 11 37 LCVR 13 14 15 16 36 40 Антитіло І II III IV V 45 HCDR1 1 1 1 1 1 HCDR2 2 2 2 2 38 HCDR3 3 4 3 3 39 LCDR1 5 5 5 5 40 LCDR2 6 8 6 10 41 LCDR3 7 7 9 9 42 Приклад 2: Визначення спорідненості (Kd) до антитіл до DKK-1 Для встановлення зв'язування у стані рівноваги, постійну концентрацію антитіла змішують із змінними концентраціями His-міченого DKK-1 (послідовності SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32 або SEQ ID NO:33) (діапазон І нМ-1 пМ) у PBS (фосфатно-сольовий буферний розчин) (рН 7,4)+(1 мг/мл) розчину бичачого сироваткового альбуміну ("BSA") або 9 UA 103916 C2 5 10 лише буфері та інкубують протягом декількох днів при температурі 37 °C. Здійснюють дві серії реакцій зв'язування, одну з яких з низькою концентрацією антитіла (3 пМ), і одну з високою концентрацією антитіла (30 пМ або 50 пМ). Після встановлення рівноваги, із застосуванням приладу KinЕхА 3000 (компанія Sapidyne Inst. Inc.) здійснюють зондування на наявність фракції "вільного" (незв'язаного) антитіла. Коротко кажучи, His-мічений DKK-1 ковалентно зв'язують з NHS (N-гідроксисукцинімід)активованими гранулами Sepharose 4 Fast Flow (компанія GE Healthcare), які пакуються згаданим приладом з одержанням невеликої колонки. Попередньо врівноважені суміші антитіла+Нis-міченого DKK-1 пропускають через згадані гранули для захоплення лише вільного антитіла. Кількість захопленого антитіла є пропорційною концентрації вільного антитіла у врівноважених зразках і виявляється введенням другого антитіла, міченого флуоресцентним барвником. Набори даних, які були одержані з низькими та високими концентраціями антитіла, підганяють загалом шляхом випробування n-кривих із застосуванням програми KinЕхА. Ця підгонка забезпечує одержання значення Kd, а також визначення 95 % довірчого інтервалу. 15 Таблиця 1 Спорідненість антитіла II до DKK-1 різних видів Види DKK-1 Людський Макак-крабоїдів Пацючий Мишачий Кролячий 20 25 30 35 40 45 50 Kd (пМ) 3,3 14 8,4 7,0 17 95 % довірчий інтервал для Kd (пМ) 1,4-7,5 8,4-26 3,9-23 4,7-11 11-27 Приклад 3: Вплив антитіл до DKK-1 у випробуванні лужної фосфатази на лінії клітин С2С12 Канонічний сигнальний шлях Wnt є важливим для диференціації та активності остеобластів. Кондиціоноване середовище Wnt-3а СМ у поєднанні з ВМР-4 індукує диференціацію лінії мишачих плюрипотентних клітин С2С12 на остеобласти з вимірюваною кінцевою точкою лужної фосфатази ("АР"), маркеру активності остеобластів. DKK-1, інгібітор канонічного сигнального шляху Wnt, пригнічує диференціацію та продукування АР. Нейтралізуючі антитіла до DKK-1 запобігають DKK-1 -опосередкованому пригніченню АР. Антитіла, які блокують пригнічувальну активність DKK-1, запобігають втраті активності АР. Клітини лінії С2С12 вирощують до 60-80 % злиття у матрацах для вирощування клітин тканини у модифікованому за способом Дульбекко середовищі Ігла (D-MEM), яке містить Lглутамін, 10 % інактивовану нагріванням сироватку плода корови ("FBS"), 1 розчин антибіотиків/протигрибкових препаратів, 1 розчин пірувату натрію). Клітини лінії С2С12 повторно суспендують до концентрації 30000 клітин/мл у середовищі для вирощування, додають (100 мкл/лунку) у лунки 96-лункового планшета для вирощування клітин тканини і інкубують протягом ночі при температурі 37 °C, 95 % вологості з 5 % СО2. Середовище для вирощування замінюють 50 мкл аналітичного середовища (DMEM, яке містить L-глутамін, 5 % FBS, 1 розчин антибіотиків/протигрибкових препаратів, 1 розчин пірувату натрію). Для стимуляції диференціювання (і, таким чином, індукування продукування АР) додають 100 мкл аналітичного середовища плюс 1,5 Wnt-3a СМ+ВМР-4 (компанія R & D Systems, № за каталогом 314-ВР). Внаслідок чого одержують кінцеву концентрацію 1 Wnt-3а СМ та 25 нг/мл ВМР-4. Негативні контролі містять лише кондиціоноване середовище L-cell CM (без Wnt-3а або ВМР-4). Клітини інкубують при температурі 37 °C, 95 % вологості з 5 % СО2 протягом 72 год. Середовище видаляють, клітини промивають 200 мкл фосфатно-сольового буферного розчину ("PBS") з подальшим видаленням PBS. Клітини тричі заморожують-відтаюють. До лунок додають 100 мкл одноетапного субстрату pNPP (компанія Thermo Scientific, № за каталогом 37621) і планшет інкубують при кімнатній температурі. Оптичну густину визначають при 405 нм. Для визначення концентрації DKK-1, необхідної для пригнічення диференціації, молекули DKK1 різних видів титрують для визначення мінімальної концентрації, необхідної для повного пригнічення індукування АР. Мінімальна концентрація DKK-1 кожного виду, яка повністю пригнічує індукування АР, становить: людський DKK-1=38 нМ, DKK-1 макак-крабоїдів 11,4 нМ, пацючий DKK-1=5,8 нМ і кролячий DKK-1=25,0 нМ. Після визначення концентрації DKK-1, яка повністю пригнічує індукування АР, підвищені концентрації антитіла до DKK-1 піддають попередньому інкубуванню у аналітичному 10 UA 103916 C2 5 10 15 20 25 30 35 середовищі з пригнічувальною концентрацією DKK-1 протягом 30 хв при кімнатній температурі. Індукування АР визначають, як описано вище. Результати наведені у вигляді ЕС50 (нМ+середня квадратична помилка). Антитіло II блокує DKK-1-опосередковане пригнічення С2С12 АР. Для DKK-1 різних видів значення ЕС50 (наведені, як нМ+середня квадратична помилка) є такими: людський=9,8+0,41, макак-крабоїдів=6,4+0,25, пацючий= 2,9+0,25 і кролячий=6,0+0,32. Приклад 4: In vivo випробування кортикальних дефектів (CD) Шестимісячних пацюків-самиць лінії Sprague-Dawley оваріектомізують з подальшим витримуванням протягом двох місяців для розвитку остеопорозу. Із застосуванням електричного дриля з 2 мм зубним буром у правій і лівій стегнових кістках висвердлюють отвори діаметром 2 мм. Цей отвір проходить через обидва, передній і задній, кортикальні шари. Заживлення кісток контролюють у поздовжньому напрямку визначенням густини кісткової маси ("BMD") із застосуванням кількісної комп'ютерної томографії ("qCT") протягом 35 днів після хірургічного втручання. На момент закінчення експерименту тварин умертвляють і цілі стегнові кістки піддають навантаженню до руйнування для визначення біомеханічної міцності непошкодженого діафізу. Антитіла вводять підшкірно у дозах та з інтервалами, як вказано. Антитіло II дозують таким чином: 5 мг/кг один раз на два тижні, розпочинаючи через один день після хірургічного втручання (Група 1), 1 мг/кг (Група 2), 5 мг/кг (Група 3) або 15 мг/кг (Група 4) вводять один раз на два тижні, розпочинаючи через дев'ять днів після хірургічного втручання. BMD визначають із застосуванням qCT на 35 день. Група 1 продемонструвала статистично значуще підвищення BMD як переднього, так і заднього кортикального шарів. Група 4 продемонструвала статистично значуще підвищення BMD обох шарів, у той час як у Групі 2 і Групі 3 спостерігалось незначне підвищення BMD. Приклад 5: In vivo випробування ефективності у випадку раку Перед початком експериментів мишей (миші-самиці лінії С.В-17, тяжкий комбінований імунодефіцит, модель № CB17SC-M, центр Fox Chase) акліматизують у віварії протягом одного тижня. Після завершення акліматизаційного періоду, мишей довільно розподіляють на групи по 10 тварин/обробку. Культивовані клітини лінії А549 людського недрібноклітинного раку легень імплантують мишам підшкірно до задньої бічної частини і вичікують, доки пухлина не досягне 3 середнього об'єму ~100 мм . Антитіло II (1 мг/кг і 5 мг/кг), контрольне антитіло класу IgG (1 мг/кг і 5 мг/кг) або носій (фосфатно-сольовий буферний цитратом розчин, доповнений 0,02 % твін 80) вводять підшкірно. Тварин обробляють двічі з проміжком у 7 днів. Пухлини вимірюють двічі на тиждень із застосуванням електронного штангенциркулю для одержання кривих росту. Тварин також перевіряють двічі на тиждень для визначення коливань маси тіла та ознак токсичності. Об'єм пухлин, наведений у Таблиці 3, було визначено на 29 день. Як показано у Таблиці 2, дослідні групи, які одержували антитіло II, продемонстрували значне in vivo пригнічення росту клітин-ксенотрансплантатів лінії А549 людського недрібноклітинного раку легень. 40 Таблиця 2 Випробовування антитіла II на моделі ксенотрансплантата лінії А549 людського недрібноклітинного раку легень Дослідна група Цитратний носій Контрольне антитіло класу IgG (1 мг/кг) Контрольне антитіло класу IgG (5 мг/кг) Антитіло II (1 мг/кг) Антитіло II (5 мг/кг) 45 Об'єм пухлини±середня Величина р (відносно контрольної З квадратична помилка (мм ) групи, яка одержувала носій) 402+36 372+45 492+72 279+32 202+21 0,01-0,05
ДивитисяДодаткова інформація
Назва патенту англійськоюDkk-1 antibodies
Автори англійськоюChedid, Marcio, Darling, Ryan, James, Galven, Rachelle, Jeanette, Swanson, Barbara, Anne
Автори російськоюШедид Марсиу, Дарлинг Райан Джеймс, Галвин Рейчелл Дженетт, Свенсон Барбара Энн
МПК / Мітки
МПК: A61K 39/395, C07K 16/18
Код посилання
<a href="https://ua.patents.su/44-103916-antitilo-proti-dkk-1.html" target="_blank" rel="follow" title="База патентів України">Антитіло проти dkk-1</a>
Попередній патент: Тверда лікарська форма, що містить лінагліптин і інгібітор sglt2, та її застосування
Наступний патент: Застосування sns-595 для лікування суб’єктів з онкологічними захворюваннями, які мають знижену активність brca2
Випадковий патент: Пересувне обладнання для підмощування