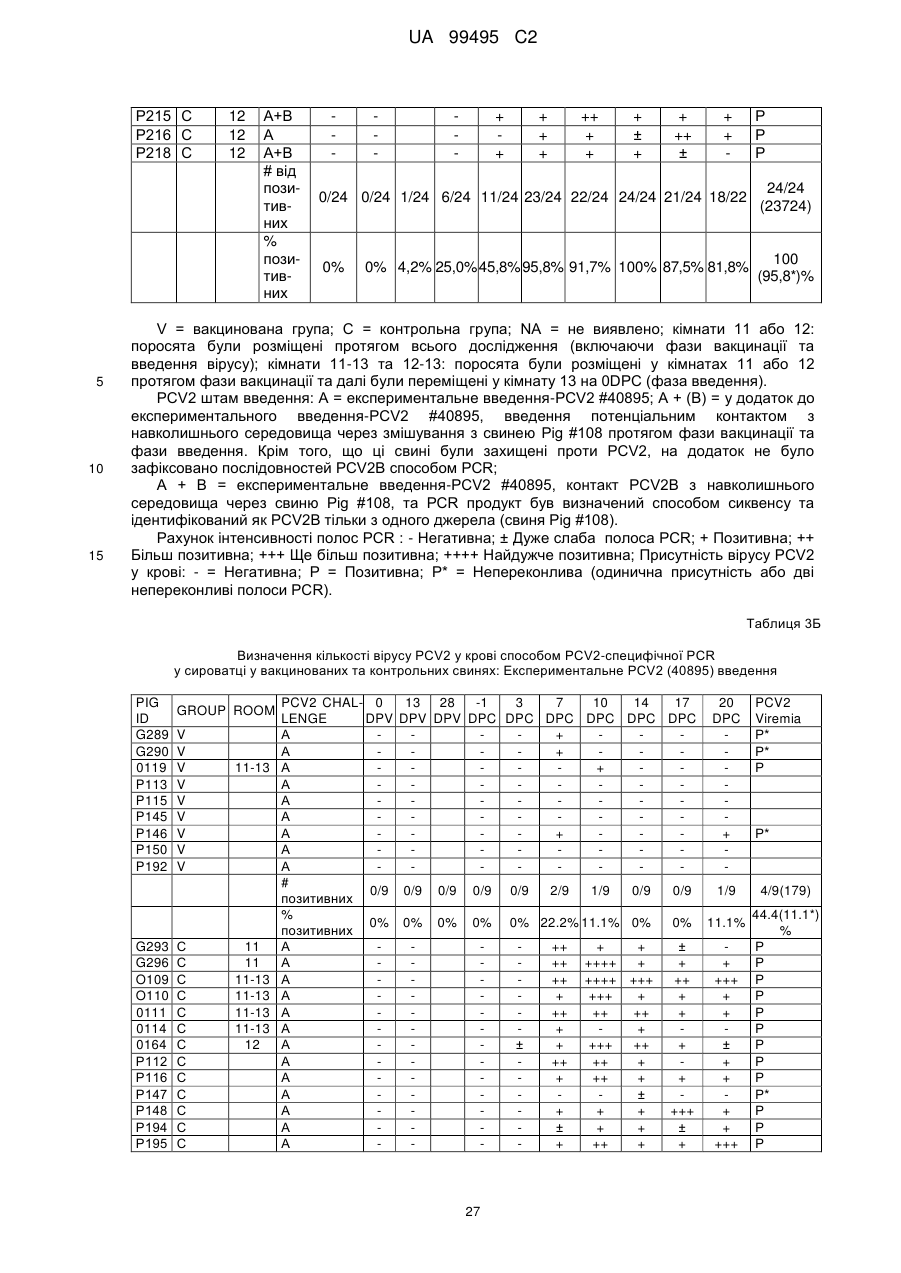
Ізольований цирковірус свиней, композиції та способи для імунізації свиней проти цирковірусу свиней
Формула / Реферат
1. Ізольований цирковірус свиней, геномна послідовність якого відповідає нуклеотидній послідовності будь-якої з послідовностей SEQ ID NО: 1 або 2.
2. Ізольований цирковірус свиней за п. 1, який є цирковірусом свиней типу 2В.
3. Ізольований цирковірус свиней за п. 2, що включає ORF2 білка, в якому амінокислотна послідовність ORF2 білка є будь-якою з послідовностей SEQ ID NO: 3 або 4.
4. Ізольований цирковірус свиней за п. 1, де нуклеотидна послідовність, що кодує ORF2 білка вказаного цирковірусу, включає залишки 1033-1734 SEQ ID NО: 5 або 6.
5. Ізольована молекула нуклеїнової кислоти, що кодує цирковірус свиней патогенного типу 2В, або кодує принаймні один білок з вищезгаданого цирковірусу, де геномна послідовність вказаного цирковірусу відповідає нуклеотидній послідовності будь-якої з послідовностей SEQ ID NО: 1 або 2 та де принаймні один білок із вказаного цирковірусу кодований нуклеотидною послідовністю будь-якої з послідовностей SEQ ID NО: 5 або 6.
6. Ізольована молекула нуклеїнової кислоти за п. 5, де нуклеотидна послідовність, що кодує ORF2 білок, відповідає залишкам 1033-1734 послідовностей SEQ ID NО: 5 або 6.
7. Ізольована молекула нуклеїнової кислоти за п. 6, де амінокислотна послідовність кодованого ORF2 білка є такою, як представлено у SEQ ID NО: 3 або 4.
8. Імуногенна композиція, що включає ізольований цирковірус свиней за будь-яким з пп. 1, 3- 5 та фармацевтично прийнятний ад'ювант.
9. Імуногенна композиція за п. 8, де ізольований цирковірус свиней є атенуйованим або інактивованим.
10. Імуногенна композиція за п. 9, що додатково включає принаймні один інший мікроорганізм або антиген, отриманий із вказаного мікроорганізму, проти якого імунна відповідь є бажаною.
11. Імуногенна композиція за п. 10, де інший мікроорганізм вибирають з групи, що складається з вірусу репродуктивного і респіраторного синдрому свиней (PRRS), парвовірусу свиней (PPV), Mycoplasma hyopneumoniae, Haemophilus parasuis, Pasteurella multocida, Streptococcum suis, Actinobacillus pleuropneumoniae, Bordetella bronchiseptica, Salmonella choleraesuis, Erysipelothrix rhusiopathiae, бактерій лептоспіри, вірусу грипу свиней, антигену Escherichia соli, респіраторного коронавірусу свиней, ротавірусу, патогену, що спричинює хворобу Ауескі, патогену, що спричинює трансмісивний гастроентерит свиней, та другого відмінного штаму цирковірусу свиней.
12. Імуногенна композиція за п. 11, де другий відмінний штам цирковірусу свиней є цирковірусом типу 2А або типу 2В.
13. Імуногенна композиція, що включає принаймні одну ізольовану молекулу нуклеїнової кислоти за будь-яким з пп. 6, 8-9 та фармацевтично прийнятний ад'ювант.
14. Імуногенна композиція за п. 13, що додатково включає молекулу нуклеїнової кислоти, що кодує принаймні один антиген принаймні з одного іншого мікроорганізму, проти якого є бажаною імунна відповідь.
15. Імуногенна композиція за п. 14, де інший мікроорганізм є вибраним із групи, що складається з вірусу репродуктивного і респіраторного синдрому свиней (PRRS), парвовірусу свиней (PPV), Mycoplasma hyopneumoniae, Haemophilus parasuis, Pasteurella multocida, Streptococcum suis, Actinobacillus pleuropneumoniae, Bordetella bronchiseptica, Salmonella choleraesuis, Erysipelothrix rhusiopathiae, бактерій лептоспіри, вірусу грипу свиней, антигену Escherichia соlі, респіраторного коронавірусу свиней, ротавірусу, патогену, що спричинює хворобу Ауескі, патогену, що спричинює трансмісивний гастроентерит свиней, та другого відмінного штаму цирковірусу свиней.
16. Імуногенна композиція за п. 15, де другий відмінний штам цирковірусу свиней є цирковірусом типу 2А або типу 2В.
17. Композиція за будь-яким з пп. 8 або 13, яку вводять однією дозою або багаторазовими дозами підшкірно, внутрішньом'язово, інтраназально, трансдермально, внутрішньопечінково або через лімфатичну систему.
18. Спосіб імунізації свиней проти вірусної інфекції або мультисистемного синдрому виснаження після відлучення (PMWS) або для запобігання мультисистемному синдрому виснаження після відлучення (PMWS) у свиней, що спричинені штамом PCV2, що включає введення свині імуногенно ефективної кількості композиції, що включає будь-яку одну або більше з наступних:
а) імуногенно ефективну кількість цирковірусу свиней типу 2 за будь-яким з пп. 1, 3-5;
b) молекулу нуклеїнової кислоти, що кодує цирковірус свиней типу 2 а);
c) імуногенно ефективну кількість принаймні одного білка, ізольованого з цирковірусу свиней типу 2 за будь-яким з пп. 1, 3-5; або
d) молекулу нуклеїнової кислоти, що кодує принаймні один білок с).
19. Спосіб за п. 18, який додатково включає введення імуногенно ефективної кількості другої відмінної імуногенної композиції перед або у поєднанні з імуногенною композицією цирковірусу свиней типу 2, або після її введення.
20. Спосіб за п. 19, де друга відмінна імуногенна композиція включає імуногенно ефективну кількість принаймні одного іншого мікроорганізму, що є патогенним для свиней, або принаймні одного антигену, отриманого із вказаного мікроорганізму, або молекулу нуклеїнової кислоти, що кодує вказаний антиген, де цей мікроорганізм вибраний із групи, що складається з вірусу репродуктивного і респіраторного синдрому свиней (PRRS), парвовірусу свиней (PPV), Mycoplasma hyopneumoniae, Haemophilus parasuis, Pasteurella multocida, Streptococcum suis, Actinobacillus pleuropneumoniae, Bordetella bronchiseptica, Salmonella choleraesuis, Erysipelothrix rhusiopathiae, бактерій лептоспіри, вірусу грипу свиней, антигену Escherichia соlі, респіраторного коронавірусу свиней, ротавірусу, патогену, що спричинює хворобу Ауескі, патогену, що спричинює трансмісивний гастроентерит свиней, та другого відмінного штаму цирковірусу свиней.
21. Спосіб за п. 20, де другий відмінний штам цирковірусу свиней є цирковірусом типу 2А або типу 2В.
22. Вектор, що включає принаймні одну екзогенну молекулу нуклеїнової кислоти, що кодує білок цирковірусу свиней, де білок цирковірусу свиней є ORF2 білка, і де екзогенна молекула нуклеїнової кислоти, що кодує вказаний білок, представлена залишками 1033-1734 послідовності SEQ ID NО: 5 або 6.
23. Вектор за п. 22, де вектором є поксвірусний вектор єнотів.
24. Вектор за будь-яким з пп. 22 або 23, що додатково включає одну або більше екзогенних молекул нуклеїнової кислоти, що кодують антиген з мікроорганізму, який є патогенним для свиней, де цей мікроорганізм вибраний із групи, що складається з вірусу репродуктивного і респіраторного синдрому свиней (PRRS), парвовірусу свиней (PPV), Mycoplasma hyopneumoniae, Haemophilus parasuis, Pasteurella multocida, Streptococcum suis, Actinobacillus pleuropneumoniae, Bordetella bronchiseptica, Salmonella choleraesuis, Erysipelothrix rhusiopathiae, бактерій лептоспіри, вірусу грипу свиней, антигену Escherichia соlі, респіраторного коронавірусу свиней, ротавірусу, патогену, що спричинює хворобу Ауескі, патогену, що спричинює трансмісивний гастроентерит свиней, та другого відмінного штаму цирковірусу свиней.
25. Спосіб визначення, чи має свиня мультисистемний синдром виснаження після відлучення (PMWS) або має ризик його розвитку, де вказаний спосіб включає:
(I) вимірювання кількості нуклеїнової кислоти PCV2 або білка, кодованого вказаною нуклеїновою кислотою, у зразку тканини, одержаному від ссавця, де вказана нуклеїнова кислота PCV2 або білок являє собою:
a) нуклеїнову кислоту, що відповідає будь-якій з послідовностей SEQ ID NO: 1, 2, 5 або 6, або нуклеїнову кислоту, що походить від них; або
b) білок, що включає будь-яку з послідовностей SEQ ID NО: 3 або 4;
(II) порівняння кількості вказаної нуклеїнової кислоти або білка у зразку тканини від ссавця, який підозрюється на наявність або має ризик розвитку PMWS, з кількістю нуклеїнової кислоти або білка, наявних у зразку тканини від нормального ссавця, або з попередньо визначеним стандартом для зразка нормальної тканини, де підвищена кількість вказаної нуклеїнової кислоти або білка у зразку тканини від ссавця, який являє собою свиню, що має PMWS або підозрюється на наявність PMWS, у порівнянні із кількістю у зразку нормальної тканини або з попередньо визначеним стандартом для нормального зразку тканини, вказує на те, що ссавець має PMWS або має ризик розвитку PMWS.
26. Спосіб за п. 25, де зразок тканини вибирають з групи, яка складається з пахового поверхневого лімфовузла, трахеобронхіального лімфовузла, субмандибулярного лімфовузла, легенів, мигдалеподібної залози, селезінки, печінки, нирок, цільної крові або клітин крові.
Текст
Реферат: Винахід належить до ізольованого цирковірусу свиней, геномна послідовність якого відповідає нуклеотидній послідовностям SEQ ID NО: 1 або 2, до імуногенної композиції, що включає зазначений ізольований цирковірус свиней та додатково принаймні один інший мікроорганізм UA 99495 C2 (12) UA 99495 C2 або антиген, отриманий із вказаного мікроорганізму, способу імунізації свиней проти вірусної інфекції або мультисистемного синдрому виснаження після відлучення (PMWS), або для запобігання мультисистемному синдрому виснаження після відлучення (PMWS) у свиней, що спричинені штамом PCV2, шляхом введення свині ефективної кількості зазначеної імуногенної композиції, до способу визначення, чи має свиня мультисистемний синдром виснаження після відлучення (PMWS) або має ризик його розвитку. UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід стосується охорони здоров'я тварин та способів та композицій для захисту свиней від патогенних штамів цирковірусу свиней типу 2B. Зокрема, даний винахід має відношення до нововиявлених патогенних штамів цирковірусу свиней типу 2B, послідовностей нуклеїнової кислоти, які кодують ці 2B штами, та білків, що кодуються цими нуклеїновими кислотами. Винахід стосується способів та композицій для виявлення імунної відповіді на патогенний свинячий цирковірус шляхом введення композиції, що містить імуногенно ефективну кількість принаймні одного з цих свинячих цирковірусів типу 2B, або нуклеїнової кислоти, що кодує принаймні один з цих свинячих цирковірусів типу 2B або, принаймні, одного з білків, що кодуються цими нуклеїновими кислотами. Цирковірус свиней (PCV) являє собою невеличкий іксаедричний неконвертований вірус, що містить одиничну скручену кільцеву ДНК приблизно 1,76 ко. Спочатку він був виділений як забруднювач лінії культур клітин свинячої нирки PK-15 (I. Tischer et al., Nature 295:64-66 (1982); I. Tischer et al., Zentralbl. Bakteriol. Hyg. Otg. A. 226(2): 153-167 (1974)). PCV відноситься до сімейства Circoviridae, яке також складається з трьох інших тваринних цирковірусів (вірус курячої анемії (CAV), вірус хвороби пір'я та дзьобу (PBFDV) та недавно виявлений голубиний цирковірус (CoCV)) та трьох рослинних цирковірусів ( вірус кущуватості верхівки банану, вірус листової гнилизни кокосу та вірус зупинки підземного зростання конюшини) (M. R. Bassami et al., Virology 249:453-459 (1998); J. Mankertz et al., Virus Genes 16:267-276 (1998); A. Mankertz et al., Arch. Virol. 145:2469-2479 (2000); B. M. Meehan et al., J. Gen. Virol. 78:221-227 (1997); B. M. Meehan et al., J. Gen. Virol. 79:2171-2179 (1998); D. Todd et al., Arch. Virol. 117:129-135 (1991)). Три раніше визначених тваринних цирковіруса (PCV, CAV, та PBFDV) не мають між собою гомології нуклеотидної послідовності або антигенних детермінантів.(M. R. Bassami et al., 1998, supra; D. Todd et al., 1991, supra). Експериментальне зараження свиней вірусом PCV, який було отримано з клітин PK-15, не викликає клінічних захворювань і, таким чином, цей вірус не вважається патогенним для свиней (G. M. Allan et al., Vet. Microbiol. 44:49-64 (1995); I. Tischer et al., Arch. Virol. 91:271-276 (1986)). Цей непатогенний PCV, отриманий із зараженої клітинної лінії ПК-15 було визначено як цирковірус свиней типу 1 або PCV1. Мультисистемний синдром виснаження після відлучення (PMWS), вперше описаний в 1991 році (J. C. Harding and E. G. Clark, Swine Health and Production 5:201-203 (1997)), є складним захворюванням відлучених поросят, що стає все більш поширеним. PMWS зачіпає в основному свиней у 5-18 тижневому віці. Клінічні симптоми PMWS включають прогресуючу втрату ваги, задишку, прискорене дихання, анемію, діарею та жовтяницю. Смертність може варіюватися від 1% до 2%, та зростати до 40% у деяких складних випадках у Великобританії (М. Muirhead, Vet. Rec. 150:456 (2002)). Мікроскопічні зміни, характерні для PMWS включають гранулематозну інтерстиціальну пневмонію, лімфаденопатію, гепатит та нефрит (G. M. Allan and J. A. Ellis, J. Vet. Diagn. Invest. 12:3-14 (2000); J. C. Harding and E. G. Clark, Swine Health and Production 5:201203(1997)). Хоча PCV1 скрізь зустрічається у свиней, він для них не є патогенним. Основний збудник PMWS, є, як правило, патогенним штамом PCV, що визначений як цирковірус свиней типу 2 або PCV2 (G. M. Allan et al., Vet. Rec. 142:467-468 (1998); G. M. Allan et al., J. Vet. Diagn. Invest. 10:310 (1998); G. M. Allan et al., Vet. Microbiol. 66:115-23 (1999); G. M. Allan and J. A. Ellis, J. Vet. Diagn. Invest. 12:3-14 (2000); J. Ellis et al. Can. Vet. J. 39:44-51 (1998); A. L. Hamel et al., J. Virol. 72:5262-5267 (1998); B. M. Meehan et al., 1998, supra; I. Morozov et al., J. Clin. Microbiol. 36:25352541 (1998)).Була також визначена повна геномна послідовність пов’язаного з PMWS PCV2 (M. Fenaux et al., J. Clin. Microbiol. 38:2494-503 (2000); A. L. Hamel et al., 1998, supra; J. Mankertz et al., 1998, supra; B. M. Meehan et al., 1997, supra; B. M. Meehan et al., 1998, supra; I. Morozov et al., 1998, supra). Аналізи послідовностей вказують, що пов’язаний з PMWS PCV2 має лише близько 75% гомології нуклеотидної послідовності із непатогенним PCV1. ORF2 ген обох вірусів, як і непатогенного PCV1, так і патогенного PCV2 кодує головний імуногенний білок вірусної оболонки.(P. Nawagitgulet al., Immunol. Clin. Diagn.Lab Immunol. 1:33-40 (2002); P. Nawagitgul et al., J. Gen. Virol. 81:2281-2287 (2000)). Згідно з її потенційним впливом на розвиток свинарства, розробка вакцини проти PCV2 має велике значення. Наприклад, у патенті U.S. Pat. No. 6, 287, 856 (Poet et al.) and WO 99/45956 описано нуклеїнові кислоти цирковірусу, що заражає птахів (вірус хвороби пір'їв та дзьобу (BFDV)), та цирковірусу свиней (PCV). Патент пропонує композиції вакцин, що містять очищені ДНК або мРНК та виявляє спрямованість нуклеїнової кислоти для швидкоплинного проявлення PCV в еукаріотичній клітині, що містить цис-орієнтовану транскрипційну або трансляційну регуляторну послідовність, отриману безпосередньо з людського цитомегаловірусу, або 1 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 початковий підсилювач гена, або промотор, який функціонально приєднаний у послідовність нуклеїнової кислоти. Патенти U.S. Pat. No. 6, 217, 883 (Allan et al.) and French Patent No. 2, 781, 159B B описують одержання п'яти штамів PCV з легеневих або гангліозних проб, що були отримані від інфікованих PMWS свиней в Канаді, Каліфорнії і Франції (Бретань), та їх застосування у поєднанні з принаймні одним антигеном парвовірусу свиней у вакцинних/імуногенних композиційах. Хоча в патенті загально описуються білки, що кодуються відкритими рамками зчитування (ORF) PCV2 від ORF1 до ORF13, там немає будь-яких прикладів білків, що мають імуногенні властивості. Патент більш описує вектори, що складаються з ДНК плазмід, лінійних молекул ДНК та рекомбінантних вірусів, що містять молекулу нуклеїнової кислоти, яка кодує антиген PCV, та здатні до її експресії in vivo. Деякі інші посилання, наприклад, U.S. Pat. No. 6, 391, 314 B1; U.S. Pat. No. 6, 368, 601 B1; French Patent No. 2, 769, 321; French Patent No. 2, 769, 322; WO 01/96377 A2; WO 00/01409; WO 99/18214; WO 00/77216 A2; WO 01/16330 A2; WO 99/29871; та ін., описують введення поліпептидів PCV1 або PCV2 або нуклеїнових кислот, що кодують поліпептиди відмінних штамів як складові частини вакцини. Цитату з будь-якого згаданого тут не слід розглядати як визнання того, що це посилання може бути прототипом даного винаходу. У поширеному вигляді, цей винахід стосується виділення та ототожнення двох нових штамів свинячих цирковірусів типу 2(PCV2), кожен з яких може бути застосований окремо, або в комбінації, для приготування вакцини або імуногенної суміші для застосування з метою захисту свиней проти патогенної інфекції PCV2 або для поліпшення щонайменше одного симптому, пов'язаного з мультисистемним синдромом виснаження після відлучення (PMWS). Відповідно до цього, перший аспект винаходу стосується виділення цирковірусу свиней типу 2, геном якого містить в собі молекулу нуклеїнової кислоти з будь-якою послідовністю SEQ ID NO: 1 (позначена як FD07) або SEQ ID NO: 2 (позначена як FDJE), або геном якого містить молекулу нуклеїнової кислоти, що має щонайменше 95% гомології своєї послідовності до будьякої з SEQ ID NO: 1 або 2. У одному з варіантів втілення, обоє з нещодавно ідентифікованих та виділених свинячих цирковірусів – це свинячі цирковіруси типу 2B(PCV2B). У одному з варіантів втілення, виділені свинячі цирковіруси мають білок ORF2 щонайменше з 92 % гомологією послідовності до будь-якої з SEQ ID NO: 3 (від FD07) або 4 (від FDJE). У одному з варіантів втілення, виділені свинячі цирковіруси мають білок ORF2, що містить будь-яку з амінокислотних послідовностей SEQ ID NO: 3 або 4. Другий аспект винаходу стосується отримання молекули нуклеїнової кислоти, що кодує цирковірус свиней патогенного типу 2B, або кодує щонайменше один білок вищезгаданого цирковірусу, де молекула нуклеїнової кислоти містить нуклеотидну послідовність, що має щонайменше 95% гомології до будь-якої з послідовностей SEQ ID NO:1 або 2. У одному з варіантів втілення, виділена молекула нуклеїнової кислоти містить нуклеотидну послідовність будь-якої з SEQ ID NO:1 або 2. У одному з варіантів втілення, виділена молекула нуклеїнової кислоти, що кодує білок ОRF 1 реплікази FD07, містить номери 51-995 послідовності SEQ ID NO:5 та виділена молекула нуклеїнової кислоти, що містить номери 1033-1734 послідовності SEQ ID NO:5, та кодує білок ORF 2 вірусної оболонки FD07. У одному з варіантів втілення, виділена молекула нуклеїнової кислоти що кодує білок ORF 1 реплікази FDJE містить номери 51-995 з SEQ ID NO: 6 та отримана молекула нуклеїнової кислоти, що кодує білок ORF 2 оболонки вірусу FDJE та містить номери 1033-1734 з SEQ ID NO: 6. У одному з варіантів втілення, виділена молекула нуклеїнової кислоти, що кодує білок ORF2, який має амінокислотну послідовність, яка визначена як SEQ ID NO: 3 або 4. Третій аспект винаходу стосується створення імуногенної композиції або композиції вакцини, що містить щонайменше одне з наступного : щонайменше один з отриманих свинячих цирковірусів типу 2В, як було тут описано,або їх суміш; щонайменше одна молекула нуклеїнової кислоти, що кодує щонайменше один з свинячих цирковірусів типу 2В, як було тут вказано, щонайменше одну молекулу нуклеїнової кислоти, що кодує щонайменше один білок від щонайменше одного з свинячих цирковірусів типу 2В, як було тут описано; або щонайменше один білок, отриманий від щонайменше одного з свинячих цирковірусів типу 2В, як тут було описано та фармацевтично прийнятий ад’ювант. У одному з варіантів втілення, вакцина або імуногенна композиція може містити один або більше з наступного: 2 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 a) Живий/послаблений, або живий змінений PCV2B, геном якого містить молекулу нуклеїнової кислоти з будь-якою з послідовностей SEQ ID NO: 1 або 2; b) Вбитий/інактивований PCV2B, геном якого містить молекулу нуклеїнової кислоти з будьякою з послідовностей SEQ ID NO: 1 або 2; c) Вакцину ДНК PCV2B (наприклад, плазмідний вектор, що здатен проявляти ORF2 PCV2B, геном якого містить молекулу нуклеїнової кислоти з будь-якою з послідовностей SEQ ID NO: 1 або 2; або d) Інактивований вірусний вектор (наприклад, бакуловірус, аденовірус, або поксвірус, такий як поксвірус єнотів; або бактерію, таку як E.coli), що здатен до експресії ORF2 PCV2B, геном якого містить молекулу нуклеїнової кислоти з будь-якою з послідовностей SEQ ID NO: 1 або 2; У одному з варіантів втілення, вакцина або імуногенна композиція з ORF 2 геном, що отриманий з послідовностей ДНК SEQ ID NO: 1 або 2 цирковірусу свиней типу 2B може перехресно захищати проти інфекцій штамів свинячого вірусу типу 2A, типу 2C або типу 2D, або будь-якого іншого варіанту. Введення такої вакцини, або імуногенної композиції забезпечує захист свиней проти штамів патогенного цирковірусу свиней типу 2A низької отруйності / низької смертності, а також забезпечує перехресний захист проти штамів патогенного цирковірусу свиней типу 2В високої отруйності / високої смертності. Вакцину або імуногенну композицію, що застосовують, можна вводити як поодинокою дозою, так і багаторазовими дозами. Результатами введення є захист свиней від одного чи багатьох симптомів або ускладнень, пов'язаних з мультисистемним синдромом виснаження після відлучення (PMWS). Більш того, введення такої вакцини або імуногенної композиції, що містить будь-яке вказане вище втілення, також веде до скорочення рівня смертності вище, ніж середній рівень смертності, пов'язаний з штамами патогенного цирковірусу свиней типу 2В високої отруйності / високої смертності. У одному з варіантів втілення, імуногенна композиція, або вакцина, що описані вище, можуть бути застосовані для створення імунної відповіді проти цирковірусу свиней, або для захисту свиней проти патогенної інфекції PCV2, або для покращення щонайменш одного симптому, пов'язаного з хворобою. У одному з варіантів втілення, імуногенна композиція або вакцина, що описані вище, окрім того включають щонайменш один інший мікроорганізм, або антиген, отриманий з цього мікроорганізму, проти якого бажано зробити імунну відповідь. Цей інший мікроорганізм може бути обраним з групи, що складається з вірусу репродуктивного та респіраторного синдрому свиней (PRRS), парвовірусу свиней (PPV), Mycoplasma hyopneumoniae, Haemophilus parasuis, Pasteurella multocida, Streptococcum suis, Actinobacillus pleuropneumoniae, Bordetella bronchiseptica, Salmonella choleraesuis, Erysipelothrix rhusiopathiae, leptospira bacteria, вірусу грипу свиней, антигену Escherichia coli, респіраторного коронавірусу свиней, ротавірусу, патогену, що спричинює хворобу Оджеского, патогену, що спричинює свинячий заразний гастроентеріт, та іншого другого штаму цирковірусу свиней. Цей інший другий штам цирковірусу свиней може бути цирковірусом типу 2A або типу 2B. У одному з варіантів втілення, імуногенну композицію або вакцину вводять з ад’ювантом, або без нього. У одному з варіантів втілення, імуногенну композицію або вакцину вводять одною дозою, або багатьма дозами через ніс, підшкірним, внутрішньо-м’язовим, інтраназальним, трансдермальним, інтергепатичним, або внутрішньо-лімфатичним шляхом. Четвертий аспект винаходу стосується створення способу імунізації свиней проти вірусної інфекції або мультисистемного синдрому виснаження після відлучення (PMWS), або для попередження свинячого PMWS, що спричинює штам PCV2, або для покращення щонайменш одного з симптомів, пов'язаних з PMWS, шляхом введення свиням імуногенно ефективної кількості композиції, що містить будь-яке одне, або інше з наступного: а) Імуногенно ефективну кількість щонайменш одного з свинячих цирковірусів типу 2, що кодуються будь-якою з послідовностей SEQ ID NO: 1 або 2 молекули нуклеїнової кислоти, як тут описано; b) Молекулу нуклеїнової кислоти, що кодує щонайменше один з свинячих цирковірусів типу 2. a); c) Імуногенно ефективну кількість щонайменше одного білку, отриманого від щонайменше з одного з свинячих цирковірусів типу 2 a); або: d) Імуногенно ефективну кількість щонайменше однієї молекули нуклеїнової кислоти, що кодує щонайменше один білок c). У одному з варіантів втілення, винахід стосується створення способів імунізації або захисту свиней щонайменше проти одного патогенного штаму цирковірусу свиней шляхом введення вакцини або імуногенної композиції, що містить нетоксичний, фізіологічно прийнятний носій та 3 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 імуногенно ефективну кількість вбитого/інактивованого цирковірусу свиней типу 2, або живого, але послабленого цирковірусу свиней типу 2, як тут описано, геном якого містить молекулу нуклеїнової кислоти з будь-якими послідовностями SEQ ID NO: 1 або 2. У одному з варіантів втілення, способи винаходу передбачають імунізацію або захист свиней проти свинячої цирковірусної інфекції шляхом введення вакцини або імуногенної суміші, як викладено вище, що, крім того, містить також ад’ювант. У одному з варіантів втілення, винахід стосується створення способів імунізації або захисту свиней проти патогенного штаму цирковірусу свиней типу 2 шляхом введення вакцини або імуногенної композиції, що містить інфекційну нуклеїнову кислоту, яка кодує цирковірус свиней типу 2 в послідовностях SEQ ID NO:1 або 2, як показано, де результатами введення є покращення одного чи багатьох симптомів цирковірусної інфекції. У одному з варіантів втілення, винахід стосується створення способів імунізації або захисту свиней проти патогенного штаму цирковірусу свиней типу 2B введенням імуногенно ефективної кількості вакцини або імуногенної композиції, де ця композиція містить щонайменше один білок цирковірусу свиней типу 2, як описано у винаході, або нуклеїнову кислоту, що кодує білок цирковірусу свиней типу 2, як описано у винаході. У одному варіанті втілення, білок цирковірусу свиней типу 2В, що розглядається у даному винаході – це білок ORF2. У одному варіанті втілення, ORF-2 ген, що кодує білок ORF2 свинячих цирковірусів типу 2В, які мають назви, стосовно даного винаходу, FD07 та FDJE містить номери нуклеотидної послідовності 1033-1074, яку визначено як SEQ ID NO: 5 та 6, відповідно, та білок, що кодується ORF-2 геном FD07 та FDJE та містить амінокислотну послідовність, яку визначено як SEQ ID NO: 3 та 4, відповідно. У одному з варіантів втілення, винахід стосується створення способів імунізації або захисту свиней проти патогенного штаму цирковірусу свиней типу 2В, що містять введення вакцини або імуногенної композиції, що має цирковірус свиней типу 2, або нуклеїнову кислоту, що кодує цирковірус свиней типу 2, де цирковірус свиней кодується нуклеотидною послідовністю, яку визначено як SEQ ID NO: 1 та 2, їх комплементарними молекулярними ланцюгами, або послідовністю нуклеїнової кислоти, що має щонайменше 95% гомології з SEQ ID NO: 1 та SEQ ID NO: 2. У одному з варіантів втілення, винахід стосується створення способів захисту свиней проти патогенного штаму цирковірусу свиней типу 2В шляхом введення вакцини або імуногенної композиції, що містить щонайменше один з обох нових свинячих цирковірусів типу 2B або нуклеїнову кислоту, що кодує щонайменше один з обох нових свинячих цирковірусів типу 2B даного винаходу, або щонайменше один білок від щонайменше одного з двох штамів 2B даного винаходу, або нуклеїнову кислоту, що кодує щонайменше один з цих двох білків, де патогенний штам цирковірусу свиней типу 2B є штамом цірковірусів свиней, який містить білок оболонки вірусу, що кодується геном ORF 2, який показує не менш, ніж 92% гомології послідовності з білком оболонки вірусу, що кодується геном ORF 2 щонайменше з двох штамів свинячих цирковірусів типу 2B, вказаних у даному винаході. Амінокислотні послідовності білків оболонки штамів типу 2B цирковірусу свиней у даному винаході вказані як SEQ ID NO: 3 та 4. У одному з варіантів втілення, способи винаходу передбачають імунізацію або захист свиней від інфекції патогенного штаму цирковірусу свиней типу 2, включаючи введення вакцини або імуногенної композиції, що містить цирковірус свиней типу 2В, або нуклеїнову кислоту, що кодує цирковірус свиней типу 2В, або кодує щонайменше один білок від вищезгаданого цирковірусу свиней даного винаходу, де це введення спричинює поліпшенню одної чи багатьох наступних клінічних симптомів: Зниження мікроскопічних ушкоджень в одної чи багатьох лімфатичних або нелімфатичних тканинах свиней, що спричинюються отруйною формою цирковірусу свиней типу 2B; Зниження присутності вірусів у крові, що пов'язана зі свинячою цирковірусною інфекцією; Зменшення рівню нуклеїнової кислоти типу 2А або типу 2В у однієї чи багатьох тканинах. У одному з варіантів втілення, спосіб крім того який полягає у введенні імуногенно ефективної кількості іншої імуногенної композиції перед, або в поєднанні, або після введення імуногенної композиції, що містить цирковірус свиней 2 типу, як описано тут. У одному з варіантів втілення, інша імуногенна композиція містить імуногенно ефективну кількість щонайменше одного іншого мікроорганізму, що є патогенний до свиней, або щонайменше одного антигену, отриманого від вищезгаданого мікроорганізму або молекули нуклеїнової кислоти, що кодує вищезгаданий антиген, де мікроорганізм є відібраний від групи, що складається з вірусу репродуктивного та респіраторного синдрому свиней (PRRS), парвовірусу свиней (PPV), Mycoplasma hyopneumoniae, Haemophilus parasuis, Pasteurella multocida, Streptococcum suis, Actinobacillus pleuropneumoniae, Bordetella bronchiseptica, Salmonella choleraesuis, Erysipelothrix rhusiopathiae, leptospira bacteria, вірусу грипу свиней, 4 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 антигену Escherichia coli, респіраторного коронавірусу свиней, ротавірусу, патогену, що спричинює хворобу Оджеского, патогену, що спричинює заразний гастроентерит свиней та інші різні штами цирковірусу свиней. Інші різні штами цирковірусу свиней можуть бути цирковірусами типів 2A або 2B. П'ятий аспект винаходу стосується створення вектору, що містить щонайменше одну екзогенну молекулу нуклеїнової кислоти, що кодує білок цирковірусу свиней типу 2A або 2B, де білок цирковірусу свиней - це білок ORF2, і де частина екзогенної молекули нуклеїнової кислоти, що кодує вищезгаданий білок, є визначеною у номерах 1033-1734 послідовностей SEQ ID NO:5 або 6. У одному з варіантів втілення, таким вектором є поксвірус єнотів, що містить молекулу нуклеїнової кислоти, яка кодує щонайменше один білок з цирковірусу свиней PCV2A, або з PCV2B, що тут описуються, або з обох вірусів. У одному з варіантів втілення, вектор крім того містить одну або більше молекул екзогенної нуклеїнової кислоти, що кодують антиген від мікроорганізму, який є патогенним до свиней, де мікроорганізм вибирається від групи, що складається з вірусу репродуктивного та респіраторного синдрому свиней(PRRS), парвовірусу свиней(PPV), Mycoplasma hyopneumoniae, Haemophilus parasuis, Pasteurella multocida, Streptococcum suis, Actinobacillus pleuropneumoniae, Bordetella bronchiseptica, Salmonella choleraesuis, Erysipelothrix rhusiopathiae, leptospira bacteria, вірусу грипу свиней, антигену Escherichia coli, респіраторного коронавірусу свиней, ротавірусу, патогену, що спричинює хворобу Оджеского, патогену, що спричинює заразний гастроентерит свиней та інших відмінних штамів цирковірусу свиней. Шостий аспект винаходу стосується створення способу визначення, чи має свиня мультисистемний синдром виснаження після відлучення (PMWS), або знаходиться в ризику розвитку мультисистемного синдрому виснаження після відлучення (PMWS), та включає: (I) вимірювання кількості нуклеїнової кислоти PCV2, або білка, що кодується вищезгаданою нуклеїновою кислотою в зразку тканини, що походить від ссавця, де є вищезгадана нуклеїнова кислота PCV2 або білок, як то: a) нуклеїнова кислота, що містить будь-яку з послідовностей SEQ ID NO: 1, 2, 5 або 6, або нуклеїнова кислота, що отримана звідти; b) Білок, що містить будь-які послідовності SEQ ID NO: 3 або 4; c) нуклеїнова кислота, яка містить послідовність, що кодує вищезгадані послідовності, здатні до гібридизації; d) нуклеїнова кислота, що має щонайменше 95% гомології з будь-якими з послідовностей SEQ ID NO: 1, 2, 5, або їх комплементарними ланцюгами, що визначається, застосовуючи алгоритм NBLAST; чи білок, закодований таким чином; (II) Порівняння кількості вищезгаданої нуклеїнової кислоти або білку в зразку тканини від ссавця, де є підозра в наявності, або в ризику розвитку PMWS з кількістю нуклеїнової кислоти або білку, що є в зразку тканини від нормального ссавця, або що зумовлено стандартом для нормального зразка тканини, де підвищений рівень вищезгаданої нуклеїнової кислоти або білку в зразку тканини свині, що має PMWS, або підозрюється в PMWS, порівнюється з рівнем в нормальному зразку, або заздалегідь визначеним стандартом для нормального зразка тканини, що вказує на те, що ссавець має PMWS або знаходиться в ризику розвитку PMWS. У одному з варіантів втілення, спосіб визначення, чи свиня має PMWS, або знаходиться в ризику розвитку PMWS, передбачає вимір кількості нуклеїнової кислоти PCV 2B або білку винаходу в зразку тканини, відібраному від групи, що складається з пахового поверхневого лімфатичного вузла, трахеобронхального лімфатичного вузла, субмандибулярного лімфатичного вузла, легенів, мигдалеподібної залози, селезінки, печінки, нирок, крові в цілому та клітин крові. КОРОТКИЙ ОПИС ФІГУР Фіг. 1. Повна послідовність геному типу 2B цирковірусу свиней, позначеного FD07 (SEQ ID NO: 1). Фіг. 2. Повна послідовність геному цирковірусу свиней типу 2B, позначеного FDJE (SEQ ID NO: 2). Фіг. 3. Послідовність амінокислоти ORF2 білку оболонки вірусу PCV2B, позначеного FD07 (SEQ ID NO: 3). Фіг 4. Послідовність амінокислоти ORF2 білку оболонки вірусу PCV2B, позначеного FDJE (SEQ ID NO: 4). Фіг. 5. Послідовність нуклеїнової кислоти, що кодує білки ORF1 і ORF2 FD07 (SEQ ID NO: 5). Фіг. 6..Послідовність нуклеїнової кислоти, що кодує білки ORF1 і ORF2 FDJE (SEQ ID NO: 6). Перед тим, як описати ці способи та методологію, має розумітися, що винахід не є 5 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 обмежений специфічними способами і вказаними експериментальними умовами, оскільки такі способи і умови можуть змінюватися. Має також розумітися, що термінологія, застосована тут, є тільки для опису специфічних втілень та не може бути обмеженою. В цій специфікації та у приєднаних заявах застосовується однина, включаючи множинні посилання, незважаючи на те, що у контексті ясно говориться інакше. Отже, наприклад, посилання на "спосіб" включає один або більше способів, та/або етапів типу описаних тут та/або як стане очевидно для фахівців при читанні цього повідомлення та надалі. Відповідно, в цьому додатку можуть бути вжити технічні прийоми, обумовлені молекулярною біологією, мікробіологією, та способи рекомбінантної ДНК в фахових межах даної галузі. Ці способи більш докладно роз'яснюються у літературі. Див, наприклад., Sambrook, Fritsch & Maniatis, Molecular Cloning: A Laboratory Manual, Second Edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York (тут "Sambrook et al., 1989"); DNA Cloning: A Practical Approach, Volumes I and II (D.N. Glover ed. 1985); Oligonucleotide Synthesis (M.J. Gait ed. 1984); Nucleic Acid Hybridization (B.D. Hames & S.J. Higgins eds. (1985)); Transcription And Translation (B.D. Hames & S.J. Higgins, eds. (1984)); Animal Cell Culture (R.I. Freshney, ed. (1986)); Immobilized Cells And Enzymes (IRL Press, (1986)); B. Perbal, A Practical Guide To Molecular Cloning (1984); F.M. Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, Inc. (1994). Хоча будь-які способи і матеріали, що подібні, або еквівалентні до описаних, можуть бути застосовані на практиці, або для перевірки винаходу, тут вказано способи та матеріали, що вважаються кращими. Усі публікації, згадані тут, поєднані з посиланнями на їх повні тексти. Визначення. Терміни, застосовані тут, мають значення та відомі фахівцям у цій галузі, проте, для зручності та закінченості, специфічні терміни та їх значення викладаються нижче. Термін "ад’ювант" посилається на компонент або суміш, яка збільшує імунну відповідь до антигену. Ад’ювант може служити як тканинне депо, що повільно звільняє антиген, а також як лімфатичний системний активатор, який неспеціфічно підсилює імунну відповідь (Hood et al., Immunology, Second Ed., 1984, Benjamin/Cummings: Menlo Park, California, p. 384). Залежно від обставин, первинне введення одного тільки антигену за відсутністю ад’юванту, може бути не в змозі викликати гуморальну, або клітинну імунну відповідь. Ад’юванти містять, але не обмежуються цим, повні ад’юванти Фрейнда, неповні ад’юванти Фрейнда, сапонін, мінеральні гелі, як наприклад гідроокис алюмінію, поверхнево-активні речовини як наприклад лізолецитин, плуронічні поліоли, поліаніони, пептиди, олії або вуглеводневі емульсії, гемоціаніни молюска KLH, дінітрофенол, та потенційно корисні людські ад’юванти, як, наприклад BCG {bacille Calmette-Guerin) та Corynebacterium parvum. Переважно, ад’ювант є фармацевтично придатним. Під "антигеном" мається на увазі молекула, яка містить один або більше антигенних детермінантів, що здатні до стимулювання імунної системи хазяїна, для того, щоби зробити клітинну антиген-специфічну імунну відповідь. або гуморальну відповідь антитіл, де антиген представлений у відповідності до даного винаходу. Зазвичай, антигену детермінанта містить близько 3-15, загалом близько 5-15 амінокислот. Антигенні детермінанти білку, що досліджується, можуть бути ідентифіковані застосуванням будь-якого числа способів картування, що добре відомо в цій галузі. Див., наприклад, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66 (Glenn E. Morris, Ed., 1996) Humana Press, Totowa, N. J. Наприклад, лінійні антигенні детермінанти, можуть бути визначені шляхом одночасного синтезування великої кількості пептидів на твердих поверхнях відповідно кількостям білкових молекул, та по реагуванню пептидів з антитілами при тому, що пептиди все ще приєднані до поверхонь. Ці способи відомі фахівцям та описуються, наприклад, у U.S. Pat. No. 4, 708, 871; Geysen et al. (1984) Proc. Natl. Acad. Sci. USA 81:3998-4002; Geysen et al. (1986) Molec. Immunol. 23:709-715, все, розміщене тут, повністю викладене в приведених джерелах інформації. Так само, структурні антигенні детермінанти швидко можуть бути ідентифіковані визначенням просторової структури амінокислот, наприклад, рентгенівською кристалографією та двомірним ядерним магнітним резонансом. Див., наприклад, Epitope Mapping Protocols, supra. Більш того, для цілей даного винаходу, поняття "антиген" посилається на білок, що містить модифікації, як наприклад видалення (делеції), доповнення та заміни (загалом консервативні в природі, але вони можуть також бути і не консервативні) своєї природної послідовності, оскільки білок підтримує здатність спричинювати імунологічну відповідь. Ці модифікації можуть бути зроблено умисно, сайтспрямованим мутагенезом, або специфічними синтетичними процедурами, або способами генної інженерії, або можуть бути випадковими, наприклад, спричиненими мутаціями хазяїв, які виробляють антигени. Термін "послаблений", як застосовано тут для опису, наприклад, "послаблений вірус" і 6 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 подібне, відноситься до мікроорганізму, наприклад, вірусу, у якого обмежена здатність рости або розмножуватися in vitro або in vivo. Термін "цирковірус", як застосовано тут, незважаючи на інше, посилається на будь-який штам цирковірусу, що лежить у межах сімейства Circoviridae. Наприклад, у цьому винаході, "цирковірус" - це патогенний цирковірус свиней. У специфічних втіленнях, патогенний цирковірус свиней - це штам патогенного цирковірусу свиней типу 2A низької отруйності / низької смертності, або штам патогенного цирковірусу свиней типу 2В високої отруйності / високої смертності. Під поняттям "комплементарний" визнано нуклеотид в одній послідовності, який може гібридизуватися з нуклеотидом у іншій послідовності згідно з правилом- AT, U and CG (та навпаки) і отже "відповідає" своєму партнерові для цілей цього визначення. Ферментна транскрипція може вимірюватися та має добре відомі частоти похибок (залежно від специфічного застосованого ферменту), отже в межах точності транскрипції, застосовуючи способи, описані тут, кваліфікований практикуючий фахівець може розуміти, що вірність додаткового ферментного синтезу молекулярного ланцюгу не є абсолютною і що амплікон не може точно відповідати в кожному нуклеотиді до мети або до матриці РНК. Процедури, де застосовані умови високої суворості, зазначено нижче. Попередня гібридизація фільтрів, що містять ДНК, здійснюється від 8 год до цілої ночі при 65°C в буфері, що складається з 6X SSC, 50 мM Tris-HCI (pH 7.5), 1 мM EDTA, 0.02% PVP, 0.02% Ficoll, 0.02% BSA, та 500 мкг/мл денатурованої ДНК лосося. Фільтри гібридизували на 48 год в 65°C в суміші для попередньої гібридизації, що містила100 мкг/мл денатурованої ДНК сперми лосося та 5-20 X 106 імп/хвил проби, що була помічена 32P. Миття фільтрів робилося при 37°C 1 годину у розчині, що містив 2X SSC, 0.01% PVP, 0.01% Ficoll, і 0.01% BSA. Далі слідувало миття в 0.1 X SSC при 50° C впродовж 45 хвилин перед авторадіографією. Інші умови високої суворості, які тут можуть бути застосовані, добре відомі у цій галузі (див., Sambrook et al., 1989, Molecular Cloning, A Laboratory Manual, 2d Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York; дивись також, Ausubel et al., eds., in the Current Protocols in Molecular Biology series of laboratory technique manuals, 1987-1997 Current Protocols, © 1994-1997 John Wiley and Sons, Inc.). Відмічено, що в цьому повідомлені, терміни, такі як, наприклад, "містить", та подібні можуть мати значення, що приписують їм в американському патентному законі; вони можуть значити "включає", "включав", "включаючи" та подібне. Терміни, такі, як наприклад "складається істотним чином з" та "складає істотним чином" можуть мати значення, що приписуються їм в американському патентному законі; вони дозволяють включення додаткових інгредієнтів або шляхів, що не ведуть до зменшення нових або основних характеристик винаходу, іншими словами, вони виключають наявність додаткових інгредієнтів, що не були вказані, або шляхів, що ведуть до зменшення нових або основних характеристик винаходу, так вони виключають інгредієнти або попередні дослідження, як, наприклад, документи, що тут були процитовані, або на які тут є посилання, особливо тому, що метою цього документу є визначення втілень, які є патентоспроможні, нові, винахідливі, такі, що не проявляються у попередніх дослідженнях, включаючи документи, що цитуються тут, або на які тут є посилання. Нарешті, терміни "складається з" та "складаючись з", мають значення, що приписуються їм в американському патентному законі; а саме, що ці терміни є закінченими, закритими. Поняття "кодується" або "кодований" відноситься до послідовності нуклеїнової кислоти, яка кодує поліпептидну послідовність, де ця поліпептидна послідовність містить амінокислотну послідовність щонайменше з 3 до 5 амінокислот, ще краще щонайменше з 8 до 10 амінокислот, та навіть найкраще щонайменше з 15 до 20 амінокислот поліпептиду, що кодується послідовністю нуклеїнової кислоти. Також охоплюються поліпептидні послідовності, які здатні імунологічно визначатися з поліпептидом, що кодується послідовністю. Отже, антигенні "поліпептид", "білок", або "послідовність амінокислот" можуть мати щонайменше 70% гомології, переважно щонайменше близько 80% гомології, прийнятніше близько 90-95% гомології, і найприйнятніше близько 99% гомології до поліпептиду або амінокислотної послідовності антигену. Поняття "ген", як застосовано в контексті даного винаходу, - це послідовність нуклеотидів у молекулі нуклеїнової кислоти (хромосома, плазміда, і т.п.), з якою асоційована генетична функція. Ген - це спадкова одиниця, на прикладі організму, містить полінуклеотидну послідовність (наприклад, послідовність ДНК для ссавців), яка займає специфічне фізичне розташування ("місце розташування гена" або "генетичне місце" розташування) в межах геному організму. Ген може кодувати продукт, що проявляється, (як наприклад поліпептид або полінуклеотид (наприклад, тРНК). Альтернативно, ген може визначати розташування геному у окремих подіях/функціях, як наприклад закріплення білків та/або нуклеїнових кислот 7 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 (наприклад, сайти прикріплення фагів), тоді ген не кодує продукт, що проявляється. Зазвичай, ген включає кодувальні послідовності, як наприклад послідовності, що кодують поліпептиди, та некодувальні послідовності, як наприклад промоторні послідовності, поліаденіловані послідовності, транскрипційно-регуляторні послідовності (наприклад, послідовностіпідсилювачи). Багато єукаріотичних генів мають "екзони" (кодувальні послідовності), що перервано "інтронами" (некодувальними послідовностями). У певних випадках, ген може мати послідовності з іншого гену (наприклад, частково збіжні гени). Поняття "гомологія" або "ідентичність" або "схожість" відносяться до схожості послідовностей між двома пептидами або між двома молекулами нуклеїнової кислоти. Гомологію можна визначити порівнянням позиції в кожній послідовності, що може бути випрямлена для порівняння. Коли позицію в порівнянній послідовності займає та ж сама база або амінокислота, тоді молекули є ідентичними в цьому положенні. Рівень гомології, або схожості, або ідентичності між послідовностями нуклеїнової кислоти це - функція кількості ідентичних або співпадаючих нуклеотидів у положеннях, розділених послідовностями нуклеїнової кислоти. Рівень ідентичності послідовностей амінокислоти це – функція кількості ідентичних амінокислот у положеннях, розділених амінокислотними послідовностями. Рівень гомології або схожості амінокислотних послідовностей це - функція кількості амінокислот, структурно спорідненої у положеннях, розділених амінокислотними послідовностями. "Неспоріднена" або "нетотожна" послідовність має менш, ніж 40% ідентичності, хоча переважно вона має менш, ніж 25% ідентичності з однією з послідовностей даного винаходу. Тому, "гомолог" цирковірусу свиней або фрагмент з того повинен мати щонайменше близько 75% гомології зі свинячим цирковірусом або фрагментом з того (більш бажано близько 80% гомології, ще більш бажано близько 90-95% гомології і найприйнятніше близько 99% гомології). "Імунна відповідь" до вакцини або імуногенної композиції - це розвиток гуморальної та/або клітинно-опосередкованої імунної відповіді на молекулу потрібної композиції, які є присутніми в антигені або у вакцині. Для даного винаходу, "гуморальна імунна відповідь" є антитілоопосередкованою імунною відповіддю та включає утворення антитіл із спорідненістю для антигену/вакцини винаходу, поки "клітинно-опосередкована імунна відповідь" пов'язана з Tлімфоцитами та/або іншими білими кров'яними клітинами. "Клітинно-опосередкована імунна відповідь" активується наявністю антигенних детермінантів в асоціації з молекулами першого та другого класу головного комплексу тканинної сумісності (MHC). Це активізує антиген-специфічні CD4+ T клітини-помічники або CD8+цитотоксичні клітини Т-лімфоцитів ("CTL"). CTL мають специфічність для пептидних антигенів, які існують в асоціації з білками, що кодуються головним комплексом (MHC) тканинної сумісності, та проявляються на поверхнях клітин. CTL допомагають виявити та сприяють внутришньоклітинному знищенню внутришньоклітинних мікробів, або знищенню клітин, що уражені цими мікробами. Інший аспект клітинного імунітету включає антиген-специфічну відповідь Т-клітин-помічників. T-клітини-помічники допомагають стимулювати функцію та зосереджують активність неспецифічних ефекторних клітин проти клітин, де проявлені пептиди антигенів, що асоційовані з MHC молекулами на їх поверхні. "Клітинно-опосередкована імунна відповідь" також стосується виробництва цитокінів, хемокінів і інших таких молекул, що виробляють активовані T-клітини та/або інші білі кров'яні клітини, у тому числі ті, що отримані від CD4+ та CD8+ Т-клітин. Здатність специфічного антигену або композиції стимулювати клітинно-опосередковану імунну відповідь може бути визначена рядом досліджень, наприклад лімфопроліферацією (лімфоцитною активацією), аналізами цитотоксічних клітин CTL, випробуванням Т-лімфоцитів, що чутливі до антигену чи вимірюванням продукування цитокінів T-клітинами у відповідь на повторне стимулювання антигеном. Такі випробування добре відомі у даній галузі. Див., наприклад, Erickson et al., J. Immunol. (1993) 151:4189-4199; Doe et al., Eur. J. Immunol. (1994) 24:2369-2376. Термін "Імуногенний" відноситься до здатності антигену або вакцини викликати імунну відповідь, що є гуморально, або клітинно опосередкованою, або гуморально та клітинно разом. Поняття "Імуногенно ефективна кількість" тут відноситься до рівня антигену або вакцини, якого буде достатньо, щоб викликати імунну відповідь, як клітинну(Т-клітини), так і гуморальну(Вклітини або антитіла) відповідь, або обидва типу, як показано стандартними випробуваннями, відомими для фахівців у цій галузі. Ефективність антигену як імуногенного можна вимірювати як аналізами проліферації, цитолітичними аналізами, так і способами звільнення хрому, вимірюванням здатності Т-клітин знищувати їх специфічні клітини-мішені, або вимірюванням рівнів активності В-клітин шляхом вимірювання рівнів циркулюючих антитіл, специфічних до антигену у сироватці. Більш того, рівень захисту імунної відповіді може бути поміряний стимулюванням імунізованого організму-хазяїна антигеном, якім він може інфікуватися. Наприклад, якщо антиген, імунна відповідь до якого є бажаною, - це вірус або пухлинна клітина, 8 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 то рівень захисту, викликаного "імуногенно ефективною кількістю" антигену, вимірюється визначенням проценту виживання або процентну смертності після введення тваринам вірусу або пухлинної клітини. У одному з варіантів втілення, "імуногенно ефективна кількість" вакцини або імуногенної композиції стосується до титру вірусних часток, який коливається від 1 до 7 Logio вірусних часток/мл, як виміряно способом FAID50 (King et al., Journal of Comparative Medicine and Vet. Science, 29:85-89 (1965)), та в U.S.патенті 4, 824, 785. У одному з варіантів втілення, "імуногенно ефективний рівень" вакцини або імуногенних композицій - це титр вірусних часток, який коливається від 1 до 7 Logio вірусних часток/мл, як виміряно способом FAID50 (King et al., Journal of Comparative Medicine and Vet. Science, 29:85-89 (1965)), та в U.S.патенті 4, 824, 785. У одному з варіантів втілення, "імуногенно ефективна кількість" інфекційної вакцини ДНК або імуногенної композиції може коливатися від, 50 до 5000 мкг. У одному з варіантів втілення, "імуногенно ефективна кількість" інфекційної вакцини ДНК або імуногенної композиції може коливатися від, 50 до 1000 мкг. У певних втіленнях, терміні "близько" означає приблизно 20%, переважно біля 10%, та прийнятніше в межах 5%. Термін "імуногенна композиція" має відношення до будь-якої фармацевтичної композиції, що містить антиген, наприклад, мікроорганізм, композиція з яким може бути застосована для отримання імунної відповіді у ссавця. Імунна відповідь може бути T-клітинною відповіддю, Bклітинною відповіддю, або В- та Т- клітинною разом. Композиція може служити для того, щоб активувати організм ссавця антигеном в асоціації з молекулами MHC на клітинній поверхні. Крім того, специфічні для антигену T-лімфоцити або антитіла можуть бути вироблені для забезпечення майбутнього захисту імунізованого хазяїна. "Імуногенна композиція" може містити живу, послаблену, або вбиту/інактивовану вакцину, що містить цілий мікроорганізм або отриману звідти імуногенну порцію, яка викликає як клітинно-опосередковану (T-клітинну), так і антитіло-опосередковану (В-клітинну) імунну відповідь, або обидві разом, та може захистити тварину від одного чи багатьох проявів, пов’язаних з ураженням мікроорганізмами, чи може захистити тварину від смерті від інфекції мікроорганізмів. "Імуногенний ORF" має відношення до відкритої рамки зчитування, що викликає імунну відповідь, наприклад, ORF2 кодує імуногенний білок вірусної оболонки. Вакцини та імуногенні композиції даного винаходу можуть крім того містити один або більше додаткових "імуномодуляторів", які є агентами, що порушують або змінюють імунну систему, так як вже помічені підвищуюча чи понижуюча регуляція гуморально- або клітинноопосередкованого імунітету. У одному специфічному варіанті втілення, підвищуюча регуляція гуморального та/або клітинно-опосередкованого забезпечення імунної системи вважається за краще. Приклади певних імуномодуляторів включають, наприклад, "фармацевтично прийнятний ад’ювант" або, серед інших, цитокін. Необмежуючі приклади "фармацевтично прийнятний ад’ювантів", які можуть бути застосовані у вакцині даного винаходу, включають RIBI ад’ювантну систему (Ribi Inc., Hamilton, Mont.), алюмінієві мінеральні гелі, як, наприклад, гель гідроксиду алюмінію, емульсії типу олія-у-воді та вода-у-олії, як вказано у, наприклад, Freund's complete and incomplete adjuvants, Block copolymer (CytRx, Atlanta Ga.), QS-21 (Cambridge Biotech Inc., Cambridge Mass.), SAF-M (Chiron, Emeryville Calif.), також ад’ювант AMPHIGEN®, сапонін, Quil А або інша сапонінова фракція, монофосфорил ліпід А та Ауридин ліпід-аміно ад’ювант. Необмежуючі приклади емульсій олія-у-воді, що корисні у вакцині винаходу, включають суміші зміненого SEAM62 та SEAM 1/2. Змінений SEAM62 є емульсією олія-у-воді, що містить 5 об% сквалену (Сигма), 1 об% детергенту SPAN® 85 ( ICI сурфактанти), 0.7 об% детергенту TWEEN® 80 (ICI сурфактанти), 2.5 об% етанолу, 200 мкг/мл Quil A, 100 мкг/мл холестерину, та 0.5 об% лецитину. Модифікований SEAM 1/2 є емульсією типу олія-у-воді, що містить 5 об% сквалену, 1 об% детергенту SPAN® 85, 0.7 об% детергенту Tween 80, 2.5 об% етанолу, 100 мкг/мл Quil A, and 50 мкг/мл холестерину. Інші "імуномодулятори", які можуть увійти до вакцини, включають один або більше інтерлейкінів, інтерферонів, або інших відомих цитокінів. У одному втілені, ад’ювант може бути циклодекстриновою похідною, або поліаніоновим полімером, що відповідно описано у U.S. patent numbers 6, 165, 995 and 6, 610, 310. Термін "інфекційний" означає, що вірус розмножується або здатний до розмноження у свиней, незважаючи на те, спричинює він будь-які хвороби чи ні. У даному винаході, приклад "інфекційної" ДНК, як показано, є PCV2 ДНК послідовностей SEQ ID NO: 1 або 2. Термін "виділений" або "очищений" означає, що цей матеріал взято з його оригінального середовища (наприклад, природне середовище, якщо це природна поява). Наприклад, "виділений" або "очищений" пептид або білок є істотно вільним від клітинного матеріалу або інших забруднюючих білків джерела, з якого протеїн було отримано (клітини або тканини), або істотно вільний від хімічних попередників або інших хімічних речовин, якщо він є хімічно синтезованим. Термін "Істотно вільний від клітинного матеріалу" включає отримання 9 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 поліпептиду/білку, в якому поліпептид/білок є відділеним від клітинних компонентів клітин, з яких він був отриманий, або виготовлений рекомбінантно. Отже, поліпептид/білок, який істотно вільний від клітинного матеріалу, включає приготування поліпептиду/білку, що має менш, ніж близько 30%, 20%, 10%, 5%, 2.5%, або 1%, (на суху вагу) забруднуюючого білку. Коли поліпептид/білок є рекомбінантно виробленим, він є також переважно істотно вільним від культури, де його було вироблено, тобто, об'єм цієї культура дорівнює менш, ніж близько 20%, 10%, або 5% об'єму приготування білку. Коли поліпептид/білок зроблено шляхом хімічного синтезу, то він є переважно істотно вільним від хімічних попередників або інших хімічних речовин, тобто, він є очищеним від хімічних попередників або інших хімічних речовин, які залучаються до синтезу білку. Відповідно, такий поліпептид/білок має менш, ніж близько 30%, 20%, 10%, 5% (на суху вагу) хімічних попередників або сумішей окрім поліпептиду/фрагменту білку, що нас цікавить. "Виділена" або "очищена" молекула нуклеїнової кислоти - це молекула, яка відокремлена від інших молекул нуклеїнової кислоти, які існують у природному джерелі молекули нуклеїнової кислоти. Крім того, "виділена" молекула нуклеїнової кислоти, така як молекула кДНК або молекула РНК, може бути суттєво вільною від іншого клітинного матеріалу, або від культури, де її було вироблено рекомбінантними способами, або суттєво вільною від хімічних попередників чи інших хімікатів, якщо вона є хімічно синтезована. Терміни "вбиті" або "інактивовані", застосовуються тут поперемінно та мають відношення до суттєвого або повного скорочення інфекційності вірусу(вірусів), що застосовані для створення композицій вакцини. Знищення або інактивація вірусів може бути вирахована будь-якими способами, що відомі фахівцям цієї галузі, наприклад, способами молекулярної біології (PCR), способами фільтрації вірусного титру, флюоресценції, імунологичними способами (ELISA, RIA та подібних ), імуноензиматичними способами, що дозволяють визначити один чи більше вірусних поліпептидів (Western та подібні.).Також можуть бути застосовані багато інших інактивуючих агентів, включаючи формалін, азид, спосіб заморожування-таяння, ультразвукову та термообробку, несподіване зниження тиску, детергенти (особливо неіонні детергенти), лізоцим, фенол, протеолітичні ферменти та бета-пропіолактон. Термін "лімфатична тканина" має відношення до будь-якої тканини, що багата лімфоцитами та супроводжуючими клітинами, такими як макрофаги та ретикулярні клітини та підтримується комірчастою структурою з’єднувальної тканини. Лімфатична тканина включає кістковий мозок, тимус, лімфатичні вузли, селезінку, мигдалини, аденоїди, ділянки Пейера та лімфоцити, що накопичуються на поверхнях слизової оболонки. Термін "нелімфатична тканина» має відношення до будь-якої іншої тканини, яка небагата на лімфоцити та супроводжуючи клітини, які що тут вказані. Термін "нуклеїнова кислота" або "молекула нуклеїнової кислоти", який тут застосовано, має відношення до ДНК, РНК, а також до любого з знаних аналогів ДНК та РНК або химер, з них сформованих. Таким чином, "нуклеїнова кислота" чи "молекула нуклеїнової кислоти" стосується до етер-фосфат-полімерної форми рибонуклеозидів (аденозин, гуанозин, уридин або цитидин; "молекули РНК") або дезоксирибонуклеозидів (дезоксиаденозин, дезоксигуанозин, дезокситимидин, або дезоксицитидин; "молекули ДНК") або у поодинокому сплетеному стані, або у вигляді подвійної переплетеної спіралі. Можливо існування подвійних переплетених спіралей типу ДНК-ДНК, РНК-ДНК та РНК-РНК. Термін "молекула нуклеїнової кислоти", стосовно до окремих молекул ДНК або РНК має відношення тільки до первинної та вторинної структури молекули, та не обмежений будь-якими специфічними третинними формами. Отже, цей термін включає дволанцюгову ДНК, що виявлена, між іншим, у лінійних або круглих молекулах ДНК (наприклад, рестрикційні фрагменти), плазмідах та хромосомах. В обговорені структур специфічних молекул дволанцюгової ДНК, ці послідовності можуть бути описані тут згідно з нормальною угодою, де беруться тільки послідовності в напряму 5N до 3N уздовж нетранскрибованого ланцюгу ДНК (тобто, ланцюгу, що має послідовність, яка відповідає мРНК). "Молекула рекомбінантної ДНК" - це молекула ДНК, яка зазнала молекулярно-біологічну маніпуляцію. Поняття "нуклеотид" стосується субодиниці ДНК або РНК, що складаються з азотних основи (аденін, гуанін, цитозин і тимін), фосфатної молекули та цукрової молекули (дезоксирибоза в ДНК та рибоза в РНК). Термін "Відкриті рамки зчитування" або "ORF", який застосовано тут, стосується мінімальної нуклеотидної послідовності, що вимагається для кодування специфічного білку цирковірусу або антигену без проміжного кодону зупинки. Термін "парентеральний" стосується субстанції, яка взята в тілі, або яка введена не через травний тракт, наприклад, внутрішньовенною або внутрішньом'язовою ін'єкцією. Термін "патогенний" стосується здатності будь-якого агента інфекції, такого, як наприклад 10 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 бактерія або вірус, викликати хворобу. У даному винаході, термін "патогенний" має відношення до здатності цирковірусу свиней, зокрема, цирковірусу свиней типу 2, викликати хворобу у свиней, посилаючись на мультисистемний синдром виснаження після відлучення (PMWS). Цю хворобу часто характеризують виснаженнями або слабкістю у свиней, яких відняли від дійок, помірними та сильними лімфатичними ушкодженнями та гістоцитичною заміною фолікул у лімфатичних тканинах. Також відомо, що свині, які страждають від PMWS, мають хвороби респіраторних шляхів, наприклад, пневмонію, лімфогістіотичні гепатити та лімфогістіотичні внутрішньотканинні нефрити. Інші прояви, пов'язані з "патогенним" свинячим цирковірусом типу 2, включають спорадичну відмову відтворення, ентерити, свинячі дерматити та синдром нефропатії (PDNS). Термін "непатогенний" мікроорганізм відноситься до мікроорганізму, який не має властивостей, відмічених вище для "патогенних" штамів цирковірусу свиней. "Непатогенний" цирковірус свиней загалом відноситься до цирковірусу свиней типу 1. "Патогенні" штами цирковірусу свиней загалом мають відношення до свинячих цирковірусів типу 2. "Непатогенний" цирковірус свиней загалом має відношення до свинячих цирковірусів типу 1. Отже, термін "відсоток ідентичності", або "відсоток ідентичності послідовності" стосується ідентичності послідовностей між двома послідовностями амінокислот або між двома послідовностями нуклеотидів. Для її обчислення можуть бути застосовані різні алгоритми та/або різні програми, у тому числі FASTA, BLAST, або ENTREZ. FASTA та BLAST є доступні як частина пакету GCG аналізу послідовностей (University of Wisconsin, Madison, Wis.), та можуть бути застосовані зі значеннями, що встановлені за умовчанням. ENTREZ є доступним у National Center for Biotechnology Information, National Library of Medicine, National Institutes of Health, Bethesda, Md. У одному з варіантів втілення, процентну ідентичність двох послідовностей можна визначити програмою GCG з вагою інтервалу 1, наприклад, кожен амінокислотний інтервал зважувався як поодинока амінокислота або нуклеотидна неузгодженість між двома послідовностями. Термін "фармацевтично прийнятий носій" має на увазі носія, схваленого Федеральним контрольним органом, урядом штату, або іншим контрольним органом, або є у реєстрі U.S.Pharmacopeia або у інший загально визнаній фармакопеї для застосування у тварин, включаючи як людей, так і інших ссавців. Термін "носій" відноситься до розріджувачу, ад’юванту, наповнювачу, або транспортного засобу, з яким введено фармацевтичну композицію. Такі фармацевтичні носії можуть бути стерильними рідинами, такими як вода та олії, включаючи нафтове, тваринне, рослинне або синтетичне походження, як наприклад горіхова, сезамова, мінеральна олія, олія сої та подібне. Вода - носій, що вважається кращим, коли фармацевтична композицію введено внутрішньовенно. Соляні розчини, водна глюкоза та розчини гліцерину також можуть бути застосовані як рідкі носії, особливо для розчинів для ін'єкцій. Відповідні фармацевтичні наповнювачі містять крохмаль, глюкозу, лактозу, сахарозу, желатин, солод, рис, борошно, крейду, силікагель, натрій стеарат, стеарат, тальк, хлорид натрію, сухе зібране молоко, гліцерин, пропілен, гліколь, воду, етанол і подібне. Композиція, якщо бажано, може також містити незначні кількості зволожуючих або емульгаторів, або pHбуферувальних агентів. Ці композиції можуть мати вигляд розчинів, суспензій, емульсій, пігулок, капсул, порошків, препаратів сповільненого вивільнення та подібних. Композиція може бути зроблена у вигляді свічки, з традиційними зв'язувальними речовинами та носіями, такими, як наприклад, тригліцериди. Пероральне введення може включати стандартні носії, як наприклад фармацевтичні сорти маніту, лактози, крохмалю, стеарат магнезії, сахарату натрію, целюлози, карбонату магнію, і т.п. Приклади придатних фармацевтичних носіїв описуються у "Remington's Pharmaceutical Sciences" by E. W. Martin. Створення такого носію повинно задовольняти спосіб введення. "Полінуклеотид" - це полімер нуклеїнової кислоти, який зазвичай кодує біологічно активний (наприклад, імуногенний) білок, або поліпептид. Залежно від природи поліпептиду, що кодується полінуклеотидом, полінуклеотид може включати найменше як 10 нуклеотидів, наприклад, коли полінуклеотид кодує антиген. До того ж, "полінуклеотид" може включати обидві - як двох-, так і одноланцюгові послідовності та відноситься до вірусної ДНК, прокаріотичної або єукаріотичної мРНК, геномної РНК та послідовностей ДНК від вірусної (наприклад, РНК і ДНК вірусів та ретровірусів) або прокаріотичної ДНК, а також синтетичних послідовностей ДНК, але не обмежується цим. Термін також охоплює послідовності, які включають будь-який з відомих базових аналогів ДНК та РНК. Термін крім того включає модифікації, як, наприклад, видалення (делеції), доповнення та заміни (наприклад, метилування або кепірування) нативної послідовності, переважно такі, що в результаті молекула нуклеїнової кислоти починає кодувати, наприклад, антигенний білок. Ці модифікації можуть бути зроблено умисно, сайт-спрямованим 11 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 мутагенезом, або специфічними синтетичними процедурами, або способами генної інженерії, або ці модифікації можуть бути випадковими, як наприклад через мутації хазяїв, які виробляють антигени. Терміни "олігонуклеотіди" або "оліго", застосовані тут взаємозамінне. Терміни "свинячі", і "свині" застосовані рівнозначно та посилаються на будь-яку тварину, яка входить до складу сімейства Suidae як наприклад, свиня. Термін "захищаючий" відноситься до захисту напр. ссавців, зокрема, свиней, від інфекції або хвороби стимулюванням імунної відповіді до специфічного патогену, напр. цирковірусу. Такий захист загалом досягається шляхом застосування композицій вакцин, що описуються тут. Терміни "білок", "поліпептид" та "пептид" стосуються залишків амінокислот полімеру та не обмеженого мінімальною довжиною продукту. Отже, в межі визначення включаються пептиди, олігопептиди, димери, мультимери і тому подібне. Внаслідок того, як і білки повного розміру, так і фрагменти теж охоплюється визначенням. Терміни також включають модифікації, як наприклад видалення (делеції), доповнення і заміни (загалом консервативні в природі, але можуть бути й не консервативними) нативної послідовності, переважно такі, що підтримують здатність білку викликати імунологічну відповідь в межах тварини, до якої було введено цей білок. Також до терміну включаються пост-експресійні модифікації, напр. глікозіляцію, ацетіляцію, фосфорилювання і подібне. Термін "гомологія послідовності", як тут застосовано, в усіх його граматичних формах відноситься до стосунків між білками, які мають загальне еволюційне походження, у тому числі до гомологічних білків від різних різновидів (Reeck et al., 1987, Cell 50:667). Дві послідовності ДНК є "істотно гомологічними" або "істотно подібними", коли щонайменше близько 75% (переважно щонайменше близько 80%, більш переважніше щонайменше близько 90 або 95%, і найприйнятніше близько 99%) нуклеотидів відповідають послідовностям ДНК певної довжини. Послідовності, які істотно гомологічні, можна ідентифікувати порівнянням послідовностей, застосовуючи стандартне програмне забезпечення, доступне у банках даних послідовностей, способом гібридизації Southern під суворими умовами, як визначається для цієї специфічної системи. Визначення відповідних умов гібридизації у фахових межах див., напр., Дивись, наприклад, Maniatis et al., supra; DNA Cloning, Vols. I & II, supra; Nucleic Acid Hybridization, supra. Так само, дві послідовності амінокислот "істотно гомологічні" або "істотно подібні", коли більше, ніж 70% амінокислот ідентичні, або функціонально ідентичні. Переважно, подібні або гомологічні послідовності ідентифікують застосуванням порівнювання, наприклад, GCG ((Genetics Computer Group, Program Manual for the GCG Package, Version 7, Madison, Wisconsin) pileup program. Термін "лікування", як тут застосовано, (у тому числі варіації того, наприклад, "лікують" або "лікував") стосується чого-небудь одного або більше з наступного : (i) запобігання інфекції або реінфекції традиційною вакциною, (ii) зниження суворості, або усунення симптомів, та (iii) істотне або повне усунення патогену або безладу, що розглядається. Отже, лікування може робитись профілактично (раніше інфекції) або терапевтично (після інфекції). У даному винаході, профілактичне лікування - це спосіб, що вважається кращим. Згідно зі специфічним втіленням даного винаходу, композиції та способи є забезпеченим бажаним лікуванням, що містить профілактичну та/або терапевтичну імунізацію тварини-хазяїна проти вірусної інфекції. Способи даного винаходу корисні для надання профілактичного та/або терапевтичного імунітету до ссавця, переважно свині. Способи даного винаходу можуть також бути застосовані на ссавцях для біомедичних дослідів. Терміни "вакцина" або "композиція вакцини", які застосовані рівнозначно, стосуються фармацевтичних композицій, що містять щонайменше одну імуногенну композицію, яка викликає імунну відповідь у тварини. Вакцина або композиція вакцини, може захистити тварину від хвороби або можливої смерті внаслідок інфекції, та може включати, або може не включати один або більше додаткових компонентів, які збільшують імунологічну діяльність активного компоненту. Вакцина або композиція вакцини може додатково містити подальші компоненти, типові до фармацевтичних композицій. Вакцина або композиція вакцини може додатково містити подальші компоненти, типові до вакцин або композицій вакцин, у тому числі, наприклад, ад’ювантів або імуномодуляторів. Імуногенно активний компонент вакцини може містити живі організми повністю, або у їх оригінальній формі, або як послаблені організми у зміненій живій вакцині, або організмах, інактивованих відповідними способами в убитій або інактивованій вакцині, або субодиничних вакцинах, що містять один або більше імуногенних компонентів вірусу, або генетично споруджених, видозмінених або клонованих вакцинах, приготованих способами, відомими фахівцям у цій галузі. Вакцина може містити один або одночасно більш, ніж один з елементів, що описуються вище. У даному винаході композиції вакцин включають, 12 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 але не обмежені цим, живі, послаблені або вбиті/інактивовани форми цілих химерних свинячих цирковірусів, інфекційні нуклеїнові кислоти, що кодують химерні свинячі цирковіруси, або інші інфекційні вакцини ДНК, у тому числі плазміди, вектори, або інші носії для безпосереднього введення ДНК свиням. Загальний опис Створення вакцини проти патогенних форм цирковірусу свиней типу 2 (PCV2) має велике значення внаслідок його потенційного впливу у свинарстві. Вважалося, що непатогенний вірус PCV1 принесе обмежену користь проти інфекцій вірусу PCV2. Окрім того, з'явилися нові отруйні штами PCV2, які характеризувалися зокрема, вищім, ніж середній рівнем смертності. Ці високо отруйні/ високо смертельні патогенні штами PCV2 були позначені як PCV2B, тоді як низько отруйні/низько смертельні патогенні штами були позначені як PCV2A. Нещодавно запропонована альтернативна номенклатура для цих двох штамів є "Genotype II" або "RFLP 422" для штаму PCV2A, та "Genotype I" або "RFLP 321" для штаму PCV2В. Поки деякі з раніш описаних композицій вакцин можливо, є ефективними проти штамів низької патогенності/низької смертності PCV2A, але немає нічого ефективного проти штамів високої патогенності PCV2B, що характеризуються зокрема вищим, ніж середнім рівнем смертності. Отримана тяжкість інфекцій та рівень смертності, що вище середнього, пов'язані з цими штамами свинячих цирковірусів PCV2B з високою патогенністю та вірулентністю, можуть бути сприятливі для визначення, відокремлення та знищення одного чи багатьох таких штамів створенням імуногенної або вакцинної композиції для імунізації та захисту свиней проти мультисистемного синдрому виснаження після відлучення (PMWS). Даний винахід спрямований на виявлення та отримання таких штамів PCV2B . У одному з варіантів втілення, нещодавно ідентифікований та виділений штам цирковірусу свиней типу 2B має, як повідомлено, обидві послідовності нуклеїнової кислоти SEQ ID NO: 1 або 2. У одному з варіантів втілення, виділений штам цирковірусу свиней типу 2B має послідовність нуклеїнової кислоти з не менш 95% гомології до кожної з послідовностей SEQ ID NO: 1 або 2 У одному з варіантів втілення, ORF2 білок нещодавно ідентифікованого та виділеного цирковірусу свиней типу 2B має щонайменше 92% гомології до кожної з послідовностей SEQ ID NO: 3 або 4. У одному з варіантів втілення даного винаходу, способи передбачають імунізацію свині проти патогенного цирковірусу свиней(PCV2) типу 2A або 2B, що містить в собі введення імуногенно ефективної кількості імуногенної композиції, що містить цирковірус свиней, який кодується нуклеїновими кислотами даного винаходу. Зокрема, способи даного винаходу передбачають застосування вакцини або імуногенної композиції. що містить одне або більше з наступного: a) Імуногенно ефективну кількість щонайменше одного з наведених свинячих цирковірусів типу 2 як тут описано, у будь-якому - або послабленому, або інактивованому/вбитому стані. b) Молекулу нуклеїнової кислоти, що кодує щонайменше один з свинячих цирковірусів типу 2 a); c) Імуногенно ефективну кількість щонайменше одного білку, виділеного від щонайменше одного з свинячих цирковірусів типу 2 a); чи d) Імуногенно ефективну кількість щонайменше однієї молекули нуклеїнової кислоти, що кодує щонайменше один протеїн c). У одному з варіантів втілення вакцина або імуногенна композиція може містити вакцину ДНК PCV2B (наприклад, плазмідний вектор, що може виробляти PCV2B ORF2. У одному з варіантів втілення, вакцина або імуногенна композиція може містити інактивований вірусний вектор (наприклад бакуловірус, аденовірус, або поксвірус, як наприклад поксвірус єнотів; чи бактерію, як наприклад E. coli), що виробляє PCV2B ORF2. Також передбачуване, що вакцина або імуногенні композиції, як описано тут, ефективні для запобігання одного або більше з симптомів, пов'язаних з мультисистемним синдромом виснаження після відлучення (PMWS). Ці симптоми можуть включати, наприклад, одне або більше з наступного: респіраторну хворобу, мікроскопічні ушкодження в одній або декількох тканинах або в органах, гістоцитічне запалення, або лімфатичне виснаження. Окрім того, вакцини, або імуногенні композиції, які тут описані, можуть бути застосовані з другою або третьою вакциною, або імуногенною композицією, яка захищає свиней проти одного або більше патогенних свинячих вірусів або бактерій, у тому числі: вірусу репродуктивного та респіраторного синдрому свиней(PRRS), парвовірусу свиней (PPV), Mycoplasma hyopneumoniae, Mycoplasma hyopneumoniae, Haemophilus parasuis, Pasteurella multocida, Streptococcum suis, Actinobacillus pleuropneumoniae, Bordetella bronchiseptica, Salmonella choleraesuis, Erysipelothrix rhusiopathiae, leptospira bacteria, вірусу грипу свиней, антигену 13 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 Escherichia coli, респіраторного коронавірусу свиней, ротавірусу, патогену, що спричинює хворобу Оджеского, та патогену, що спричинює заразний гастроентерит свиней. Наприклад, у одному з варіантів втілення, вакцина PCV або імуногенна композиція може бути скомбінована з вакциною або імуногенною композицією вірусу репродуктивного та респіраторного синдрому свиней(PRRS)). У одному з варіантів втілення, вакцина PCV або імуногенна композиція може бути скомбінована з вакциною або імуногенною композицією Mycoplasma hyopneumoniae. В одному з варіантів втілення, вакцина PCV або імуногенна композиція може бути скомбінована з вакциною або імуногенною композицією Mycoplasma hyopneumoniae та вакциною або імуногенною композицією вірусу репродуктивного та респіраторного синдрому свиней(PRRS)). Застосування PCV1-2 вакцин та імуногенних композицій. Даний винахід направлений на виявлення та виділення двох нових патогенних свинячих цирковірусів PCV2B. В зв’язку з необхідністю у вакцині або імуногенній сполуці, що може бути введена до свиней, щоб запобігти PMWS, який викликають патогенні штами свинячих цирковірусів, або, щоби поліпшити щонайменше один симптом пов'язаний з цією хворобою у свиней, було передбачено, що щонайменше один з цих двох нових штамів, або щонайменше одна з нуклеїнових кислот, що кодує ці два нових штами, або щонайменше один з білків, отриманий від щонайменше одного з цих штамів, можуть бути сформовані у вакцину чи імуногенну композицію для введення у свиню, щоб імунізувати її проти цієї хвороби, отже забезпечити захист свиней проти вірусної інфекції та мультисистемного синдрому виснаження після відлучення (PMWS). Вакцина або імуногенна композиція, що включає щонайменше один з нещодавно виявлених та отриманих свинячих цирковірусів PCV2B запропонованих для застосування у якості імуногенної композиції або композиції вакцини, була отримана у цих дослідах з застосуванням описаних тут способів. Нуклеїнові кислоти винаходу Виділені та очищені молекули нуклеїнової кислоти, які кодують повнорозмірний патогенний цирковірус свиней типу 2В, як описано в цьому документі, визначаються послідовностями SEQ ID NO: 1 та 2. Традиційні способи, які добре відомі у цій галузі, можуть бути застосовані, щоб зробити компліментарні ланцюги або нуклеотидні послідовності, що мають високу гомологія, наприклад, це стандартні способи, або способи гібридизації в умовах високої суворості. Очищена та виділена молекула нуклеїнової кислоти, що охоплює послідовність ДНК імуногенного гену оболонки PCV2, визначається залишками 1033-1734 послідовностей ID NO 5 та 6. Відповідно, будь-яка придатна тваринна клітина, що містить молекулу нуклеїнової кислоти PCV2B, описану в цьому документі, може виробляти живі, інфекційні свинячі цирковіруси. Живий інфекційний вірус може походити від клонованої ДНК шляхом трансфекції, наприклад, клітин PK-15 in vitro або in vivo. Як відзначається вище, один приклад ДНК PCV2 - це нуклеотидна послідовність, як визначено, SEQ ID NO: 1 та 2. Винахід крім того припускає, що вірус може бути отриманий від компліментарного ланцюгу або нуклеотидної послідовності, що має високий рівень гомології, щонайменше 80%, і прийнятніше, 95-99% гомології до нуклеотидної послідовності. Також у даному винаході розглядаються біологічно функціональні плазмідні, вірусні вектори і такі, що містять молекули нуклеїнової кислоти, які описані в цьому документі, відповідні хазяйські клітини, що інфікуються векторами, які містять клони ДНК та продукти експресії імуногенних поліпептидів. У одному з варіантів втілення імуногенний білок - це білок оболонки вірусу, що кодується, як описано в цьому документі, ORF2 з патогенного штаму 2B цирковірусу свиней. Послідовність амінокислот цього білку оболонки у свинячому цирковірусу визначається послідовностями SEQ ID NO:3 та 4. Внаслідок того надалі винахід містить в собі біологічно активні варіанти. Одним з пересічних умінь у цій галузі є знання, як виконувати зміни, заміни, видалення та ін., амінокислот(и) у поліпептидній послідовності та робити біологічно активні варіанти, де залишається така само, або істотно така само активність як у батьківської послідовності без неналежного втручання. Для отримання імуногенних поліпептидних продуктів цього винаходу, процес може включати наступні етапи: вирощування, за відповідних поживних умов прокаріотичних або еукаріотичних хазяйських клітин, трансфектованих молекулами нуклеїнової кислоти, описаними в цьому документі, так, щоб це забезпечувало експресію поліпептидних продуктів, та отримання бажаних поліпептидних продуктів стандартними способами, відомими у цій галузі. Передбачається, що імуногенні білки, можливо, будуть отримані іншими способами як, наприклад, біохімічний синтез і подібне. Вакцини та імуногенні композиції 14 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приготування вакцин або імуногенних композицій, що містять патогенні віруси PCV2B, як описано в цьому документі, та способи застосування їх для захисту свиней проти інфекцій патогенних штамів цирковірусу свиней та PMWS, також є у сфері застосування даного винаходу. Виявлено, що отримані PCV2B, можуть бути застосовані як у вбитому/інактивованому вигляді, або, можливо, бути послаблені або генетично змінені з метою застосування для імунізації свиней проти вірусної інфекції та PMWS. Відповідно, цій винахід пропонує способи імунізації свиней проти інфекції патогенних цирковірусів або проти PMWS, застосовуючи імуногенно ефективну кількість вакцини або імуногенну композицію, що містить щонайменше один з обох нових патогенних свинячих цирковірусів, описаних в цьому документі, або щонайменше одну молекулу нуклеїнової кислоти, що кодує щонайменше один з них двох цирковірусів, або щонайменше один білок, отриманий від щонайменше одного з цих двох цирковірусів. Спосіб може захищати свиней у потребі захисту проти вірусної інфекції або PMWS, шляхом введення до свині імуногенно ефективної кількості вакцини згідно з винаходом, як наприклад, вакцини, що містить імуногенну кількість ДНК PCV2B, клонованого вірусу, плазмідного або вірусного вектору, що містить ДНК PCV2B, продукцію поліпептидної експресії, і т.п. Вакцину, як описано в цьому документі, може бути введено з другою або третьою вакциною або імуногенною композицією проти інших свинячих патогенів, у тому числі наприклад, PRRSV, PPV, та інших інфекційних свинячих агентів, вибраних з наступних: Mycoplasma hyopneumoniae, Haemophilus parasuis, Pasteurella multocida, Streptococcum suis, Actinobacillus pleuropneumoniae, Bordetella bronchiseptica, Salmonella choleraesuis, Erysipelothrix rhusiopathiae, leptospira bacteria, вірус свинячого грипу, свинячий парвовірус, Escherichia coli, свинячий респіраторний коронавірус, ротавірус, патоген, що спричинює хворобу Оджеского та патоген, що спричинює свинячий заразний гастроентерит. Окремі комбінації можуть включати вакцину PCV або імуногенну композицію в комбінації з вакциною PRRSV або імуногенною композицією; вакцину PCV або імуногенну композицію в комбінації з вакциною Mycoplasma hyopneumoniae або імуногенною композицією; чи вакцину PSV або імуногенну композицію у сполуці з обома з вищевикладених вакцин або імуногенних композицій. Імунні стимулятори можуть бути одночасно надані свині, щоб забезпечити широкий спектр захисту проти інших вірусних або бактеріальних інфекцій. Вакцини або імуногенні композиції, застосовані в способах винаходу, не обмежуються будьяким специфічним типом або способом приготування. Вакцини або імуногенні композиції можуть включати, наприклад, нуклеїнову кислоту, що кодує один або більше білків свинячих цирковірусів, інфекційну ДНК вакцин (напр. застосовуючи плазміди, вектори, або інші традиційні носії, щоб безпосередньо вводити ДНК у свиней), живі вакцини, змінені живі вакцини, інактивовані вакцини, субодиничні вакцини, послаблені вакцини, генетично споруджені вакцини, і т.п. В певних втіленнях, вакцина може включати інфекційну ДНК PCV2B, клонований PCV ДНК геном у пристосованих для цього плазмідах або векторах, таких, як, наприклад, pSK вектор, невірулентний, живий вірус, інактивований вірус, і т.п., може бути застосовано вірусний вектор, подібний цьому, але не обмежений цим, наприклад, вектор бакуловірусу, вектор аденовірусу, або вектор поксвірусу, як, наприклад, вірус єнотів, або бактеріальний вектор, як наприклад E. coli. Будь-який з вказаних вище, може бути застосовано в комбінації з нетоксичним, фізіологічно відповідним носієм, та, опціонально, одним або декількома ад’ювантами. Інактивовані вірусні вакцини або імуногенні композиції можуть бути приготовані обробкою вірусу, отриманого з клонованої PCV ДНК, інактивуючими агентами, як, наприклад, формаліном або гідрофобними розчинниками, кислотами, і т.п., опромінюванням ультрафіолетовими або рентгенівськими променями, нагріванням, і т.п. Інактивація проводиться так, як прийнято у цій галузі. Наприклад, в хімічній інактивації відповідний зразок вірусу або зразок сироватки, що містить вірус, обробляється упродовж достатнього періоду часу з достатньою кількістю або концентрацією інактивуючого агенту в умовах з достатньо високою (або низькою, залежно від інактивуючого агенту) температурою або pH, щоби інактивувати вірус. Інактивація нагріванням проводиться при достатній температурі та за час, достатній, щоб інактивувати вірус. Інактивація опромінюванням провадиться, застосовуючи довжину хвилі світла або інше джерело енергії протягом часу, необхідного для того, щоб інактивувати вірус. Вірус вважається інактивованим, якщо він є не в змозі заразити клітину, сприйнятливу до інфекції. Приготування субодиничних вакцин зазвичай відрізняється від приготування зміненої живої вакцини або інактивованої вакцини. Перед приготуванням субодиничної вакцини, мають бути визначені її захисні або антигенні компоненти. Такі захисні або антигенні компоненти включають певні сегменти амінокислот або фрагменти білків оболонки вірусу, які дають особливо сильну захисну або імунологічну відповідь у свиней; одиничні або множинні білки вірусної оболонки безпосередньо, олігомери та асоціації білків вірусної оболонки вищого порядку, які формують 15 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 вірусні субструктури або частини, що можна визначити, або одиниці таких субструктур; олігоглікозіди, гліколіпіди або глікопротеїни, присутні біля поверхні вірусу або у вірусних субструктурах як, наприклад, ліпопротеїни або ліпідні групи, зв'язані з вірусом, і т.п. Переважно, білок оболонки вірусу, як, наприклад, білок, що кодується геном ORF2, застосовується як антигенний компонент субодиничної вакцини. Інші білки, що кодуються інфекційною клонованою ДНК, можуть також бути застосовані. Ці імунні компоненти можуть бути визначені способами, відомими в цій галузі. Визначені одного разу, захисні або антигенні кількості вірусу (тобто, "субодиниці") згодом очищуються та/або клонуються за допомогою способів, що відомі у цій галузі. Субодинична вакцина забезпечує перевагу над іншими вакцинами, заснованими на живому вірусі, тому що субодиниця, як, наприклад, високо очищені субодиниці вірусу, є менш отруйна, ніж цілий вірус. Якщо субодинична вакцина зроблена способами рекомбінантної генетики, експресія клонованої субодиниці як наприклад гену ORF2 (оболонки вірусу), може бути оптимізована відомими способами, (див. Наприклад, Maniatis et al., "Molecular Cloning: A Laboratory Manual, " Cold Spring Harbor Laboratory, Cold Spring Harbor, Mass., 1989). Якщо субодиниця, яку застосовують, уявляє собою неушкоджену структурну властивість вірусу, як, наприклад, повний білок оболонки вірусу, то процедура для його відділення від вірусу має потім бути оптимізована. В будь-якому випадку, після процедури інактивації, процедура очищення субодиниці може бути оптимізована перед виробництвом. Щоб приготувати послаблені вакцини від патогенних клонів пристосованої культури тканини, живий, патогенний PCV2 по-перше послаблюють (роблять його непатогенним або нешкідливим) відомими способами, зазвичай серійним проходженням крізь клітинні культури. Послаблення патогенних клонів може також бути зроблено делеціями або мутаціями гена, що продукує вірус. Потім, послаблені віруси PCV2 можуть бути застосовані для конструювання додаткових вірусів PCV2, які зберігають непатогенний фенотип PCV1, але можуть змінюватися в силу імуногенних особливостей, що відібрані від геному PCV2 рекомбінантними способами. Додаткові генетично споруджені вакцини, які є бажаними у цьому винаході, робляться способами, що добре відомі у цій галузі. Вони включають, але не обмежуються цим, подальшу обробку рекомбінантної ДНК, модифікацію або заміни послідовностей амінокислот рекомбінантних білків та подібне. Генетично споруджені вакцини на основі технологій рекомбінантної ДНК зроблені, наприклад, виявленням альтернативних кількостей вірусного гену, що кодує білки, відповідальні за стимулювання сильнішої імунної або захисної відповіді у свиней (наприклад, білки, що походять від ORF3, ORF4, і т.п.). Такі ідентифіковані гени або імуно-домінантні фрагменти можуть бути клоновані у стандартні вектори експресії білків, як, наприклад, вектор бакуловірусу, та можуть заражати відповідні хазяйські клітини (див., наприклад, O'Reilly et al., "Baculovirus Expression Vectors: A Lab Manual", Freeman & Co., 1992). Хазяйські клітини культивуються, а потім продукують бажані білки вакцини, що можуть бути очищені в бажаних межах та зібрані у придатному продукті вакцини. Якщо клони зберігають будь-які небажані природні властивості, що породжують хворобу, то також можливо докладно визначити відповідні нуклеотидні послідовності у вірусному геномі, що відповідають за отруйність, та генетично сконструювати невірулентний вірус шляхом, наприклад, сайт-спрямованого мутагенезу. Сайт-спрямованим мутагенезом можна додавати, видаляти або змінювати один або більше нуклеотидів (див., наприклад, Zoller et al., DNA 3:479488, 1984). Олігонуклеотидом є синтезована частина одноланцюгової вірусної ДНК, що містить бажану мутацію. Гібридна молекула, яка є результатом цієї процедури, застосовується для трансформації бактерій. Потім отримана двониткова ДНК, що містить відповідну мутацію, застосовується для вироблення повнорозмірной ДНК шляхом зшивання останнього фрагмента рестрикції, яка згодом застосовується для трансфекції у відповідній клітинній культурі. Зшивання геному у відповідному векторі-носії може бути зроблено будь-яким відомим у цій галузі стандартним способом. Трансфекція вектора у хазяйські клітині для породження вірусного потомства може бути зроблена за застосуванням будь-якого з обумовлених способів як наприклад, трансфекція, що опосередкована фосфатом кальцію або DEAE-декстрином, електропорація, протопластове злиття та іншими добре відомими способами (наприклад, Sambrook et al., "Molecular Cloning: A Laboratory Manual", Cold Spring Harbor Laboratory Press, 1989). Клонований вірус потім демонструє бажану мутацію. Альтернативно може бути синтезовано два олігонуклеотида, які містять відповідну мутацію. Вони можуть бути гібридизовані для того, щоб сформувати двониткову ДНК, яка може бути потім вставлена у вірусну ДНК, щоб зробити повнорозмірну ДНК. Генетично споруджені білки, що корисні у вакцинах, можуть, наприклад, продукуватися у клітинах комахи, клітинах дріжджів або клітинах, що відносяться до ссавців. Генетично 16 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 споруджені білки, які можна очистити або отримати обумовленими способами, можуть бути безпосередньо щеплені свиням, щоб надати їм захист проти вірусної інфекції або мультисистемного синдрому виснаження після відлучення (PMWS), викликаного PCV2. Клітинна лінія комах (подібна до HI-FIVE) може бути перетворена вектором переносу, що містить молекули нуклеїнової кислоти, що отримані від вірусного або такого, що копіюється від вірусного геному, який кодує один або більше з імуно-домінантних білків вірусу. Вектор переносу включає, наприклад, витягнуту у лінію бакуловірусну ДНК та плазміду, що містить бажані полінуклеотиди. Хазяйська клітинна лінія може бути ко-трансфектірована з лінеаризованою бакуловірусною ДНК та плазмідою для того, щоби зробити рекомбінантний бакуловірус. Альтернативно, ДНК від свині, що уражена PMWS, що кодує один або більше білків оболонки вірусу, інфекційна молекулярно-клонована ДНК PCV2 або клонований PCV ДНК геном можуть бути вставлені в живі вектори, як наприклад поксвірус або аденовірус, та бути застосовані як вакцина. Імуногенно ефективна кількість композицій даного винаходу вводиться до свині з метою захисту проти вірусної інфекції або PMWS. Імуногенно ефективна кількість або імуногенна кількість, яка потрібна для щеплення свині, може бути легко визначена або легко титрована звичайним тестуванням. Ефективна кількість - це така кількість, у якої досягнута достатня імунологічна відповідь до вакцини, щоб захистити свиню, уражену вірусом, який викликає PMWS. Переважно, свиня є захищеною у такій мірі, у якій один з усіх несприятливих фізіологічних симптомів, або ефектів вірусної хвороби є значно зменшеним, поліпшеним або його повністю усунутим. Вакцина або імуногенна композиція може бути введена одною дозою або повторними дозами. Дозування може коливатися, наприклад, з 50 до 5, 000 мікрограмів ДНК плазміди, що містить геном інфекційної ДНК (залежить від концентрації імуно-активного компонента вакцини), але не повинно містити кількість заснованого на вірусі антигену, достатнього, щоб призводити до несприятливих реакцій або фізіологічних симптомів вірусної інфекції. Широко відомі у цій галузі способи для визначення або титрування необхідних дозувань активного антигенного агенту, базуються на розрахунку ваги свині, концентрації антигену та інших типових чинників. Переважно, інфекційну вірусну клоновану ДНК застосовують як вакцину, або як живий інфекційний вірус, що може бути вироблений in vitro, а далі цей живий вірус може бути послаблений, а потім застосований як вакцина. У такому разі, від 100 до 200 мікрограмів клонованої ДНК PCV або близько 10, 000 50% інфекційної дози (TCID50) культури тканини живого послабленого вірусу можуть бути взято для бажаної свинячої вакцини або імуногенної композиції, що вводиться до свині, що не уражена вірусом PCV. Вакцина, що містить клоновану інфекційну ДНК PCV2, або інші антигенні форми внаслідок того можуть зручно бути введеними інтраназально або трансдермально (тобто, нанесені на або біля поверхні шкіри для систематичної абсорбції), парентерально, і т.п. Парентеральний шлях введення включає, але не обмежується цим, внутрішньо м’язові, внутрішньовенні, внутрішньочеревні, внутрішньо шкірні (тобто, ін'єкцією або іншим способом розміщення під шкірою) та подібні способи введення. Відколи внутрішньо м’язовий та внутрішньо шкірний способи щеплення були вдало застосовані у інших дослідах з застосуванням клонів інфекційної вірусної ДНК (E. E. Sparger et al., "Infection of cats by injection with DNA of feline immunodeficiency virus molecular clone", Virology 238:157-160 (1997); L. Willems et al., "In vivo transfection of bovine leukemia provirus into sheep", Virology 189:775-777 (1992)), ці способи введення вважаються кращими на додаток до практичного інтраназального шляху введення. Хоча це менш зручно, але також передбачуване, що вакцина буде надаватися свині інтралімфоїдним шляхом щеплення. Унікальний та надзвичайно бажаний спосіб введення включає безпосередню ін'єкцією ДНК плазміди, що містить PCV2 або вірусу (послабленого або інактивованого) PCV2 свиням внутрішньо м'язово, інтрадермально, інтралімфально, і т.п. Коли те, що вводять, є рідиною, вказана вакцина може бути приготована у формі водного розчину, сиропу, еліксиру, настоянки і подібного. Такі технології приготування відомі та зазвичай готуються розчиненням антигену та інших типових добавок у відповідні носії або розчинювальні системи. Відповідні "фізіологічно прийнятні" носії або розчинники включають, але не обмежені цим, воду, розчин солі, етанол, етилен гліколь, гліцерин, і т.п. Типовими добавками є, наприклад, сертифіковані барвники, ароматизатори, речовини, що підсолоджують, та антимікробні консерванти, як, наприклад, тимеросал (етилмеркуртіосаліцинат натрію). Такі розчини можуть бути стабілізовані, наприклад, додаванням частково гідролізованого желатину, сорбітолу або середовища клітинної культури, та можуть бути буферізовані обумовленими способами, з застосуванням відомих реактивів, таких, як, наприклад, гідрофосфат або 17 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 дигідрофосфат натрію, гідро фосфат або дигідрофосфат калію, суміш цього та подібне. Рідкі рецептури також можуть включати суспензії та емульсії, які містять суспензуючі або емульсуючі агенти у комбінації з іншими стандартними компонентами. Ці види рідких рецептур можуть бути приготовані традиційними способами. Суспензії, наприклад, можуть бути приготовані з застосуванням колоїдного млину. Емульсії, наприклад, можуть бути приготовані з застосуванням гомогенатору. Парентеральні рецептури, що створені для ін'єкції рідинних систем у тіло, вимагають належну ізотонію та pH-буферізацію відповідно до pH рівнів рідин свинячого тіла. Ізотонія може бути відповідно скоректована хлоридом натрію та іншими солями, якщо це потрібно. Придатні для цього розчинники, як, наприклад, етанол або пропілен гліколь, можуть бути застосовані, щоб збільшити розчинність інгредієнтів у рецептурі та для стабільності рідкого препарату. Подальші добавки, які можуть бути застосовані у цій вакцині, включають, але не обмежені цим, глюкозу, обумовлені антиоксиданти та хелатируючі агенти, як, наприклад етилендіамінтетраацетилова кислота (EDTA). Парентеральні форми дозування повинні також бути стерилізовані перед застосуванням. У одному з варіантів втілення, імуногенний ген ORF2 оболонки вірусу, що має походження від щонайменше одного з описаних тут цирковірусів типу 2B може бути застосований у вакцині або у імуногенної сполуці. Ад’юванти Даний винахід передбачає отримання та ідентифікацію двох нових свинячих цирковірусів типу 2B (PCV2B), що кодуються послідовностями нуклеїнової кислоти SEQ ID NO: 1 та 2. Ці нові штами PCV2B були виділені від свиней, що були заражені у природному середовищі, та можуть бути ідеальними кандидатами для застосування при отриманні вакцини та імуногенних композицій. Об'єктом винаходу є застосування цих штамів у вбитій/інактивованій формі, або приготування послабленої форми цих двох штамів для приготування вакцини або імуногенних композицій. Також об'єктом винаходу є постачання їх з або без ад’юванту до популяції свиней для того, щоб запобігти PMWS або поліпшити щонайменше один симптом, пов'язаний з цією хворобою. Відповідно, живі та послаблені свинячі цирковіруси типу 2B, або вбиті/інактивовані свинячі цирковіруси, що описані в цьому документі, або нуклеїнова кислота, що кодує ці свинячі цирковіруси, або щонайменше один білок, отриманий від цих цирковірусів, можуть бути доставлені з або без ад’ювантів. У одному з варіантів втілення, вакцина є вбитим/інактивованим PCV2B цирковірусом, який вводиться разом з ад’ювантом. Ад’ювант - це субстанція, яка підвищує імунологічну відповідь свині до вакцини. Ад’ювант може бути введеним у те саме місто та в той самий час, як і вакцина, або в різний час, наприклад, як активатор. Ад’юванти також можуть бути вигідно введені до свині таким способом або у таке місце, що відрізняється від способу та місця введення вакцини. Відповідні ад’юванти включають, але не обмежені цим, гідроокис алюмінію(alum), імуностимуляційні комплекси (ISCOMS), неіонні полімери та сополімери, цитокіни (подібно до IL-1, IL-2, IL-7, IFN, IFN-p, IFN-v, і т.п.), сапоніни, ліпід А монофосфорилу (MLA), дипептиди мурамилу (MDP) і подібне. Інші відповідні помічники включають, наприклад, алюмокалієвий сульфат, нестійкий у теплі, або стійкий у теплі ентеротоксин, отриманий від Escherichia coli, токсин холери або субодиницю B звідти же, токсин дифтерії, токсин правця, токсин коклюшу, неповний або повний ад’ювант Фреунда, і т.п. Ад’юванти на основі токсинів, як, наприклад, токсин дифтерії, токсин правця та токсин коклюшу можуть бути інактивовані перед застосуванням, наприклад, обробкою формальдегідом. Дослідження вимірювання імунних відповідей Функціональний результат вакцинації свиней проти цирковірусу свиней може бути оцінений відповідними дослідженнями, що відслідковують індукцію клітинного або гуморального імунітету або діяльності T- клітин. Ці дослідження відомі фахівцям у цій галузі, але може включати вимірювання цитолітичної T- клітинної активності, застосовуючи, наприклад, спосіб виділення хрому. Альтернативно, T-клітинні проліферативні дослідження можуть бути застосовані як індикація імунної реактивності або її брак. Крім того, дослідження in vivo можуть бути зроблені, щоб оцінити рівень захисту ссавця, щепленого проти патогену, застосовуючи способи цього винаходу. Типові дослідження in vivo можуть включати вакцинацію тварини з антигеном, як наприклад химерний цирковірус свиней, що описаний в цьому документі. Після очікування якогось часу, якого буде достатньо для індукції антитіл або для того, щоби відбулася T-клітинна відповідь, (звичайно, це час загалом від близько одного до двох тижнів після ін'єкції), тваринам вводять антиген, такий, як, наприклад будь-який з двох вірусів, досліджується послаблення одного або багатьох симптомів, пов'язаних з вірусною інфекцією, або виживання тварин. Успішний режим вакцинації проти цирковірусу свиней веде до істотного зменшення одного чи 18 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 більше симптомів, пов'язаних з вірусною інфекцією, або зменшення присутності вірусу у крові, або зменшення кількості або тяжкості ушкоджень, пов'язаних з вірусною інфекцією, або рівнем виживання порівняно з не вакцинованою контрольною групою. Для контролювання рівнів антитіл, вироблених у відповідь на ін'єкції вакцини може також бути зібрана сироватка, що можна вимірювати способами, знаними фахівцями у цій галузі. Способи для порівняння ізолятів цирковірусу свиней типу 2A та типу 2B Можливо, що нещодавно ідентифіковані свинячі цирковіруси типу 2B можуть бути ефективними як вакцина або імуногенна композиція для захисту проти інфекції як типу 2А, так і типу 2В патогенних свинячих цирковірусів. Штами типів 2A та 2B можуть бути розрізнені застосуванням аналізу довжини поліморфізму фрагменту рестрикції (RFLP). RFLP застосовує ферментне розчинення вірусної нуклеїнової кислоти (ціле або часткове), що веде до появи специфічної структури розрізання, яка може бути наочно представлена на гелі. Якщо є відмінності між вірусами на місці ферментного розрізання, треба дослідити інші структури. Цей спосіб "відбитків пальців" зазвичай застосовується для ДНК вірусів. Meng etal. (U.S. patent publication 2005/0147966) описують застосування аналізу PCR-RFLP з застосуванням рестрікційних ферментів Ncol для розрізнення між непатогенним типом 1 свинячих цирковірусів та патогенним типом 2 свинячих цирковірусів. Аналіз ORF2, який базується на PCR-RFLP, було описано в 2000 р., застосування H/nfl, H/nP1l, Kpnl, Msel, та Rsal ферментів для розрізнення PCV2 ізолятів (PCV2A, B, C, D, та E) (Hamel AL, Lin LL, Sachvie C, Grudeski E, Nayar GP: PCR detection and characterization of type-2 porcine circovirus. Can J Vet Res. 64:44-52, 2000). Аналіз ORF2, який базується на PCR-RFLP з застосуванням ферментів Sau3Al, Banll, Nspl, Xbal, and Cfrl, та здатен відрізнити 9 різних генотипів був описаний нещодавно (Wen L, Guo X, Yang H: Genotyping of porcine circovirus type 2 from a variety of clinical conditions in China. Vet Microbiol. 110:141-146, 2005). Аналізи PCV2 RFLP показали, що є істотна різниця між RFLP типом 422 та типом 321, який досліджувався в 2005 р.в Онтаріо, Канада (Delay J, McEwen B, Carman S, van Dreuel T, Fairies J: Porcine circovirus type 2-associated disease is increasing. AHL Newsletter. 9:22, 2005). На додаток до застосування аналізів RFLP, для диференціації між свинячими цирковірусами типу 2A та типу 2B, вважається, що ці два штами можуть бути диференційовані на підставі аналізу послідовностей. Наприклад, аналізом послідовності можливо характеризувати генетичну інформацію та порівнювати ізоляти один з одним (Choi J, Stevenson GW, Kiupel M, Harrach B, Anothayanontha L, Kanitz CL, Mittal SK: Sequence analysis of old and new strains of porcine circovirus associated with congenital tremors in pigs and their comparison with strains involved with postweaning multisystemic wasting syndrome. Can J Vet Res. 66:217-224, 2002 ; De Boisseson C, Beven V, Bigarre L, Thiery R, Rose N, Eveno E, Madec F, Jestin A: Molecular characterization of porcine circovirus type 2 isolates from post-weaning multisystemic wasting syndrome-affected and non-affected pigs. J Gen Virol. 85:293-304, 2004 ; Fenaux M, Halbur PG, Gill M, Toth TE, Meng XJ: Genetic characterization of type 2 porcine circovirus (PCV-2) from pigs with postweaning multisystemic wasting syndrome in different geographic regions of North America and development of a differential PCR-restriction fragment length polymorphism assay to detect and differentiate between infections with PCV-1 and PCV-2. J Clin Microbiol. 38:2494-2503, 2000; Grierson SS, King DP, Sandvik T, Hicks D, Spencer Y, Drew TW, Banks M: Detection and genetic typing of type 2 porcine circovirus in archived pig tissues from the UK. Arch Virol. 149:1171-1183, 2004; Kim JH, Lyoo YS: Genetic characterization of porcine circovirus-2 field isolates from PMWS pigs. J Vet Sci. 3:31-39, 2002 ; Mankertz A, Domingo M, Folch JM, LeCann P, Jestin A, Segales J, Chmielewicz B, Plana-Duran J, Soike D: Characterisation of PCV2 isolates from Spain, Germany and France. Virus Res. 66:65-77, 2000 ). Для подальшого вивчення можливих відмінностей серед PCV2 ізолятів можливо визначити послідовність повного геному PCV2 або послідовність тільки ORF2. Два штами також відрізняються по патології, клінічним симптомам та по смертності, що безпосередньо пов'язана з хворобою. Тип 2A проявляє менш важкі ушкодження в тілесних тканинах та нижчу норму смертності, в порівнянні із більш важкими ушкодженнями і вищій нормою смертності, що пов'язані з штамом типу 2B. Ці клінічні параметри можна вимірювати з застосуванням стандартних відомих способів, як продемонстровано у цьому винаході. ПРИКЛАДИ Наступні приклади демонструють певні аспекти даного винаходу. Проте, треба розумітися, що ці приклади є тільки для ілюстрації та не мається на увазі, що вони є цілком остаточними відносно умов та меж цього винаходу. Треба розуміти, що, коли задаються типові умови реакції (наприклад, температура, час реакції, і т.п.), також можуть бути застосовані умови як вище, так і нижче за вказані діапазони, хоча загалом це не є так зручно. Усі частини і відсотки, на які тут 19 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 посилається, є у мірах ваги і усі температури тут виражено у стоградусній шкалі, якщо не визначене інше. ПРИКЛАД 1 ВИДІЛЕННЯ ТА ВИЗНАЧЕННЯ ДВОХ НОВих ШТАМІВ ЦИРКОВІРУСУ СВИНЕЙ ТИПУ 2B Вивчення планувалося для перевірки рецептури нової вакцини у свиней, щоб оцінити її ефективність проти цирковірусу свиней та М. hyopneumoniae. Впродовж курсу дослідження спостерігали, що деяка кількість свиней у контрольній та вакцинованій групах проявили симптоми PMWS. Потім було підтверджено, що ці свині були уражені вірусом PCV2 з навколишнього середовища перед ін'єкцією. Молекулярний аналіз крові та зразки тканин з цих свиней виявили, що вони уражені штамом типу 2B, що є іншим, ніж штам, що було застосовано для дослідження. Окрім того, аналіз послідовності встановив, що штам PCV2B, позначений як FD07 та інший новий штам PCV2B, отриманий від свині на фермі (позначений FDJE) відрізняються від інших штамів типу 2B, визначених у інших дослідженнях та заздалегідь ідентифікованих іншими дослідниками. Матеріали і способи для отримання та описання цих двох нових штамів PCV2B наведено нижче. Матеріали та способи Експериментальні тварини Для цього дослідження була застосована змішана популяція звичайних свиней чоловічої та жіночої статі. Були зроблені 24 вакцинації та 24 контролю. Свині під час вакцинації були у віці 3 тижні від народження. Свині для вивчення були придбані від комерційної ферми та ідентифіковані з застосуванням вушних маркувань. Свині були отримані від єдиного початкового стада. Під час першої вакцинації свині були серонегативні до PCV2, як визначено ELISA (S/P рівень < 0.5). Цільовою популяцією для дослідження були свині, отримані від здорового годувальника. Відносно їх імунної функції, тварини, вибрані для цього дослідження, вважаються зразками відгодованих свиней у Сполучених Штатах. Свині були розміщені у ізольованих будинках у FDAH, Fort Dodge, IA. Щеплення та контролі були перемішані впродовж всього вивчення в однаковому довкіллі. Поросята були розміщені у кімнатах з підстилками. Житловий простір був у згоді з відповідними правилами тваринного добробуту. Свині годувалися стандартною комерційною дієтою з водою та їжею, доступною на вибір. Свині, що вимагають медичної уваги, лікувалися як прийнято ветеринаром установи після консультації з дослідником вивчення. Результати перевірки проб сироватки PCV2-PCR виявили номінальний природний вплив PCV2 до поросят в одній з кімнат перед експериментальним дослідженням. PCV2 був вперше виявлений в сироватці одного контрольного поросяти через 28 днів після вакцинації, та був визначений і виділяв як цирковірус свиней штаму типу 2B (PCV2B) ДНК секвенсингом. Цим PCV2B було заражене додатково ще 6 поросят. У двох з не вакцинованих контрольних свиней розвилися пов'язані з PCV2 клінічні симптоми та вони були піддані евтаназії через 18 днів після дослідження через поганий стан здоров'я. Клінічні симптоми включали, але не обмежувалися цим, втрату апетиту, летаргію, депресію, чхання, кашель, носові та очні виділення та задишку. Перед евтаназією були відібрані зразки крові та тканини для цирковірусного аналізу та секвенсингу. Відбір зразків та перевірка Відбір зразків Мазки з носу Мазки з носу були зібрані на 0 день після вакцинації, щоби при виділені PCV2 було гарантовано, що не було ніякої інфекції PCV2 у перевірених тварин раніше вакцинації. Носові мазки були розміщені в індивідуальних стерильних тубах, що містили 3 мл MEM з гідролізатом лактоальбуміну (LAH) та гентаміцин (60 мкг/мл), пеніцилін (100 U/мл) та стрептоміцин(100 мкг/мл), і зберігалися при температурі -50°C або нижче -50°C до перевірки. Зразки сироватки У свиней було взято кров для зразків сироватки (не більше, ніж десять мл) в 0, 13, 28 DPV, та - 1, 7, 14, 20 DPC для ELISA, і в 0, 13, 28 DPV, - 1, 3, 7, 10, 14, 17, 20 DPC для PCR. Зразки тканин Усім тваринам було зроблено розтинання в 20/21 DPC. Частини від трьох лімфатичних вузлів (трахеобронхіальний, клубовий та паховий), мигдалеподібної залози, та селезінки були зібрані та зафіксовані у формаліні для гістопатологічного огляду та імунохімічної перевірки на РCV2 (IHC). Перевірка зразків 20 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 Пов'язане з ферментом імуносорбентне дослідження (ELISA). Непрямий ELISA був застосований, щоб виявити анті-PCV2 антитіла в зразках сироватки, застосовуючи рекомбінантний PCV2 білок (продукований у бакуловірусі) оболонки вірусу, як захоплюючий антиген. У скороченому вигляді, на 96-луночний полістиреновий планшет був нанесений позитивний антиген захоплення (клітини Sf9 інфіковані рекомбінантним бакуловірусом, що виробляє білок PCV2 оболонки вірусу).У шість лунок на кожному планшеті було нанесено негативний антиген захоплення (клітини комахи SF9) у якості контролю. Після обробки планшету блокуючим реагентом, планшет було інкубовано з тестовими та контрольними зразками сироватки. Кожен зразок тестової сироватки був доданий у лунку планшету, де було нанесено позитивний антиген захоплення (3 лунки на кожен випробувальний зразок). Проби позитивного контролю сироватки було додано в шість лунок планшету, де було нанесено позитивний антиген захоплення (позитивний контроль) та в шість лунок планшету, де було нанесено негативний антиген захоплення (негативний контроль). Потім на планшет було додано HRP- сполучені анти-свинячі вторинні антитіла кози. Нарешті, було додано TMB (субстрат пероксидази) та інкубовано впродовж відповідного та узгодженого часу. Колір, що з'явився, був обчислений за допомогою планшетного зчитувача ELISA. Кожен реагент на планшеті ELISA був інкубований чітко по лункам та був промитий для переміщення додаткового реагенту перед кожним послідовним етапом. OD тестових зразків та позитивного контролю було обчислено відніманням середнього OD негативного контролю від середнього OD тестових зразків та позитивного контролю. Титр сироватки було проявлено як співвідношення S/P (проба/позитивний контроль) рівень, тобто, OD тестового зразка був поділений на OD зразку позитивного контролю. Аналіз PCR PCV2-специфічний аналіз PCR був застосований, щоб виявити присутність геному PCV2 вірусної ДНК у зразках сироватки. Вірусна геномна ДНК була очищена від сироватки, застосовуючи sQIAGEN MatAttract Virus Mini Kit та QIAGEN BioRobot M48 Workstation. Щоб виявити PCV2 специфічні послідовності, 592-bp фрагмент було збільшено застосуванням ABI AmpliTaq Gold ДНК полімерази та ген-спеціфічних праймерів : F1PCV2, 5'-ATGCCCAGCAAGAA GAATGG-3' (SEQ ID NO:7 ) and RPCV2, 5'-TGGTTTCCAGTATGT GGTTTCC-3' (SEQ ID NO: 8). Очищена вірусна ДНК була застосована як зразок та денатурована при 95 °C за 10 хв. PCR програма реакцій складалася з 35 циклів денатурації при 94 °C на 30 секунд, обпалювання при 59 °C впродовж 1 хвилини, та далі була продовжена при 72 °C 1 хв. Десять l продукту PCR були застосовані, щоби виявити 592bp фрагмент ДНК PCV2 електрофорезом у агарозному гелі. Гістопатологія Зразки тканини селезінки, мигдалеподібної залози, і трьох (трахеобронхіальний, клубовий та паховий) лімфовузлів, були зібрано з кожної тварини впродовж розтину трупа, зафіксовано у 10% нейтральному розчині буферизованого формаліну від 2 до 4 днів та вставлено у парафін. Чотирьохмікрометрові зрізи були пофарбовано гематоксиліном та еозином та досліджено під світловим мікроскопом для гістопатологічної оцінки. Зразки оцінювались по рівню зменшення лімфоцитів/гістологічних заміщень. Усі тканини були досліджені всліпу та були отримані суб'єктивні показники для рівня зменшення лімфоцитів та гістологічних заміщень. Відмічена ступінь зменшення лімфоцитів з 0 до 3 була позначена як зазначено нижче: 0 - нормальне, 1 - легке лімфатичне виснаження з повною втратою клітинності, 2 - помірне лімфатичне виснаження, 3 - сильне лімфатичне виснаження з втратою лімфатичної фолікулярної структури. Відмічений ступінь гістологічних заміщень з 0 до 3 був означений подібним чином як показано нижче: 0 - нормальний, 1 - легке гістоцитичногрануломатозне займання, 2 - помірне гістоцитично-грануломатозне займання, 3 - суворе гістоцитично-грануломатозне займання із заміною фолікул. Гістопатологічні оцінки проводив сертифікований патолог у ветеринарній діагностичній лабораторії коледжу ветеринарної медицини державного університету Айови (Ames, IA). Імунохімічне дослідження (IHC). PCV2-спеціфічний антиген у лімфовузлах, мигдалеподібній залозі та тканини селезінки був виявлений імунохімічними дослідженнями. У стислому вигляді, чотирьох-мікрометрові зрізи тканин були розміщені на скляних слайдах та оброблені ксиленом для усунення парафіну. Депарафіновані зрізи були оброблені ендогенною пероксидазою з 3% H 2O2 у PBS на 20 хв. Після полоскання дистильованою водою, зрізи були інкубовані при кімнатній температурі на всю ніч з анти-PCV2 поліклональною сироваткою кролика, розбавленою 1:1, 000 у PBS. Після промивання з PBS, зрізи потім були інкубовані з біотінілованим козячим анті-кроликовим IgG впродовж 30 хвилин в кімнатній температурі. Потім зрізи були інкубовані з кон’югатом пероксидази стрептавідіну та "візуалізовано" з субстратом тетрагідрохлоріду діамінобензидина. 21 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кількість антигену PCV2 була оцінена всліпу дослідженням рівню PCV2 фарбування антигену. Відмічений рівень фарбування з 0 до 3 був позначений як зазначено нижче: 0 - немає фарбування, 1 - низький рівень фарбування, 2 - середній рівень фарбування, 3 - високий рівень фарбування. IHC на тканинах проводився у ветеринарній діагностичній лабораторії коледжу ветеринарної медицини державного університету Айови (Ames, IA). РЕЗУЛЬТАТИ Виділення вірусу Мазки з носу були зібрані на 0 день після вакцинації, щоби при виділені PCV2 було гарантовано, що не було ніякої інфекції PCV2 у перевірених тваринах перед вакцинацію. Ніякого вірусу не було отримано від носових мазків кожної піддослідної тварини, вказуючи відсутність ураження цих свиней природною інфекцією PCV2 під час вакцинації. Матеріал титрування введення PCV2 Результати титрування введеного вірулентного PCV2 матеріалу (штам 40895) показуються в Таблиці 1. Середній титр введеного вірусу від потрійних титрувань склав 4.6 Logi0 FAIDso/мл. Серологія Результати PCV2-специфічних антитіл ELISA показані в Таблиці 2. На 0 DPV1, ELISA співвідношення S/P у контролях (Група C) змінювалася з - 0.009 до 0.366 з середнім співвідношенням S/P 0.135.Впродовж вакцинації, титри антитіл ELISA у контролях зменшувалися до фонових рівнів до 13, DPV і усі поросята залишилися серонегативними до дня введення. Середні співвідношення S/P склали 0.049 на 13 DPV, 0.023 на 28 DPV, та 0.004 на 35 DPV (- 1 DPC), відповідно. Впродовж введення PCV2, середні співвідношення S/P значно зросли від 0.125 на 7 DPC, 0.612 на 14 DPC, до 0.922 на 20 DPC. На 0 DPV1, ELISA S/P співвідношення в вакцинатах (Група V) змінюється з - 0.028 до 0.364 з середнім S/P співвідношенням 0.126.Впродовж за вакцинацією середнє співвідношення S/P склало 0.041 на 13 DPV, 0.097 на 28 DPV, та 0.167 на 35 DPV (- 1 DPC). Впродовж за введенням PCV2, спостерігалося істотне підвищення титрів ELISA у поросят цієї групи спочатку 7 DPC, з середніми S/P співвідношеннями 1.069 на 7 DPC, 1.373 на 14 DPC, та 1.356 на 20 DPC. Присутність PCV2 у крові (PCV2 Viremia). Виявлення PCV2 у крові PCV2-специфічною PCR у сироватках вакцинатів та контролів підсумовується у Таблиці 3A. Ця PCV2-specific PCR є щонайменше у 1, 000 разів більш чутливішою, ніж традиційний спосіб клітинної культури. На -1 день після введення (DPC), несподівано було знайдено, що 3 з 24 вакцинатів(Свині #P102, P103, та P104) та 6 з 24 контролів(Свині # G197, G205, 0162, P107, P108 і P110) були виявлені як ДНК PCV2-позитивні по зразкам сироватки, у той час як усі інші залишалися негативними. Усі 9 PCV2 позитивних свиней були розміщені в тій же кімнаті (#12).На жаль, шість PCV2-інфікованих свиней (Свині #P102, P103, P104, P107, P108 та P110) та дві незаражені свині були переміщені в кімнату #13 та змішані з 8 незараженими свинями з кімнати #11 в - 1 DPC день через вимоги простору. Тому, усі тварини в кімнатах #12 і 13 були потенційно піддані природному PCV2. Щоб вивчити джерело природної інфекції PCV2, зразки сироватки зібрали на 0, 13, і 28 DPV, та перевірили PCV2-спеціфічною PCR. Усі свині були PCV2-негативними окрім свині #P108 (контроль, кімната #12) з надзвичайно сильною позитивною полосою PCR на 13 DPV. Цей результат дозволяє зробити припущення, що випадкова природна інфекція PCV2 походить від свині #P108, а потім почала поширювалося на інших свиней у кімнатах #12 і #13. Точне походження цього PCV2 не відоме, проте, вірогідніше всього від довкілля або з ферми, в якій свиня #P108 була заражена з невиявленим рівнем вірусу перед зачисленням у дослідну групу. Щоб визначити генотип PCV2 цієї природної інфекції, продукти PCR від свині #P108 були клоновані для встановлення послідовності ДНК. Аналіз послідовності ДНК свідчить, що PCV2 від свині #P108 є штамом типу 2B, що відрізняється від штаму -#40895 (2A). Геноми цих двох штамів PCV2 мають загальну 95.98% гомологія послідовностей ДНК. Для більш поглибленого відрізнення експериментальної PCV2 (штам #40895) від природного контактного введення (2B від свині #P108), продукти PCR від усіх заражених PCV2 свиней були клоновані для встановлення послідовностей ДНК. Результати генотипінгу показуються в колонці "Введення PCV2": "A" показує, що PCV2B не був виявлений у зразках сироватки та введення мало місце тільки експериментального PCV2-#40895 штаму; "A + B" показує, що на додаток до експериментального введення, був також виявлений PCV2B та весь PCV2B був отриманий від свині #P108 з ідентичною послідовністю; та "A + (B)" виявляє що, на додаток до експериментального введення, свині були потенційно заражені PCV2B, тому що ці свині змішалося зі свинею #P108 у кімнаті #12/13. Проте, усі ці свині були захищені від ураження PCV2. 22 UA 99495 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для того, щоб оцінити дію експериментального та природного контактних впливів, результати PCR для визначення рівню PCV2 у крові були розглядані у трьох категоріях: повне порівняння (Таблиця 3A), експериментальне введення (Таблиця 3B), та експериментальне і природне контактне введення (Таблиця 3C). Повне порівняння між групами показало, що 10/24 (41.7%) вакцинатів були позитивні на присутність ДНК PCV2 у сироватках, щонайменше у одиничних позитивних та непереконливих випадках. Якщо єдиний непереконливий випадок не рахувати, то 5/24 (20.8%) вакцинатів мали PCV2-позитивну ДНК. У відмінність від цього, 24/24 (100%) контролів були позитивні на присутність ДНК PCV2 у сироватках у багатьох випадках. Частота і щільність PCV2 позитивних полос у контролів були значно вищі та сильніші, ніж у вакцинатів (див. Таблицю 3A). Порівняння між групами, інфікованими шляхом експериментального введення PCV2 (Таблиця 3B) показало, що 1/9 (11.1%) вакцинатів були ДНК PCV2 позитивними тільки у єдиному позитивного випадку. На відміну від цього, у 14/14 (100%) контролів була виявлена присутність ДНК PCV2 у сироватках у багатьох випадках. Порівняння між групами, інфікованими PCV2 шляхом експериментального та шляхом природного контактного введення (Таблиця 3C) показало, що 4/15 (26.7%) вакцинатів були PCV2 ДНК-позитивні щонайменше з єдиним позитивним випадком. У відмінність від цього, у 10/10 (100%) контролів була виявлена присутність ДНК PCV2 у сироватках у багатьох випадках. Мікроскопічні ураження - лімфатичне виснаження Тканини лімфовузлів, селезінки та мигдалеподібної залози були мікроскопічно досліджені на прояв лімфатичного виснаження. Повні результати мікроскопічних уражень та лімфатичного виснаження підсумовуються в Таблиці 4A (число тварин з рівнем 0-3). Повне порівняння між групами показало, що ненормальний лімфатичний рівень виснаження спостерігається щонайменше в одній тканині у 15/24 (62.5%) вакцинованих свиней, порівнюючи з 23/24 (95.8%) у контрольних свиней. Середні та важкі лімфатичні ушкодження та виснаження спостерігалися в 4/24 (16.7%) вакцинатів, порівнюючи з 14/24 (58.3%)у контролів. Порівняння між групами, інфікованими PCV2 шляхом експериментального введення (Таблиця 4B) показує, що рівень ненормального лімфатичного виснаження щонайменше в одній тканині спостерігався у 6/9 (66.7%) вакцинованих свиней, порівнюючи з 13/14 (92.9%) у контрольних свиней. Порівняння між групами, інфікованими PCV2 шляхами експериментального та природного контактного введення(Таблиця 4C) показало, що ненормальний рівень лімфатичного виснаження спостерігається щонайменше в одній тканині в 9/15 (60%)з вакцинованих свиней, порівняно з 10/10(100%)з контрольних свиней. Мікроскопічні ураження -гістоцитична заміна. Тканини лімфовузлів, селезінки та мигдалеподібної залози були мікроскопічно досліджені для виявлення гістоцитично--грануломатозного запалення з заміною фолікул. Повні результати мікроскопії підсумовуються в Таблиці 5. Повне порівняння показало, що порівняно з 22/24 (91.7%) з контролів, у 15/24 (62.5%) вакцинатів спостерігалися ненормальні гістоцитичні заміни щонайменше в однієї тканині лімфи. Iмуногістохімія. Результати виявлення кількості PCV2 антигену IHC фарбуванням у лімфовузлах, селезінці та мигдалеподібній залозі, підсумовуються в Таблиці 6 (число тварин з відміткою 0-3). Повне порівняння показало, що порівняно з 23/24 (95.8%) контролів, 7/24 (29.2%) вакцинатів були PCV2-специфічно IHC фарбованими щонайменше в одній тканині лімфи. Клінічні спостереження після введення. Результати щоденних спостережень для клінічних симптомів після введення у індивідуальних свиней викладено у Таблиці 7. Ніяких клінічних симптомів не спостерігалися у будь-якої свині окрім 2 контрольних свиней(#P108 та 0162). Свиня #P108 спостерігалася з кашлем на 1 DPC, діареєю на 10 DPC, схудненням, діареєю та втратою активності на 17 DPC. Ця свиня розвивала очевидні клінічні симптоми виснаження. Через поганий стан здоров'я порося було піддано евтаназії на 18 DPC. Розтин трупа виявив дуже маленький підшкірний жир, помірну краніовентральну консолідацію в легенях, порожній живіт та кишечник. У цієї свині розвивалася PCV-асоційована хвороба, що було підтверджено даними присутності PCV2 у крові (надзвичайно сильна позитивна PCR), важкі лімфатичні виснаження та високий рівень PCV2 антигену (IHC фарбування) в тканинах лімфи. Порося #0162, як спостерігалося, схудло та почало кульгати на ліву задню ногу на 14 DPC. На 17 DPC ця свиня спостерігалася знову, вона була худою, не в змозі рухатися, і з роздутими тарзальними з'єднаннями в задніх ногах. Із-за слабого стану порося було піддано евтаназії на 23 UA 99495 C2 5 18 DPC. Розтин трупа виявив важке легеневе затвердіння з фібринозними злипаннями. Мікроскопічний аналіз легеневих тканин показав важку гостру бронхопневмонію і хронічний осередковий внутришній тканинний фіброз. У цієї свині розвивалася PCV-асоційована хвороба, що підтвердили отримані дані PCV2 viremia (надзвичайно сильна позитивна PCR), сильне лімфатичне виснаження тварини, та високий рівень PCV2 антигену (фарбування IHC) в тканинах лімфи. Таблиця 1 (#40895) Титрування введення PCV2 Відновлення 1 2 3 4 5 Ave ± SD *Титр 4.6 4.8 4.4 4.6 4.6 4.6 ±0.14 *Logio FAID50 на мл Ave ± SD = Середній титр ± стандартне відхилення. 10 Таблиця 2 Сероконверсія PCV2 у сироватці вакцинованих та контрольних свиней поміряна PCV2 Antibody ELISA* № свині Група G199 V G203 V G204 V G289 V G290 V 0112 V 0113 V 0117 V 0119 V 0156 V 0158 V 0159 V P102 V P103 V P104 V P109 V P113 V P115 V P145 V P146 V P150 V P192 V P213 V P214 V Ave (S/P Ratio) G197 G205 G293 С С С ODPV 0.029 0.010 0.038 0.121 0.162 0.222 0.050 -0.028 0.030 0.058 0.099 0.082 0.108 0.206 0.139 0.179 0.113 0.141 0.069 0.158 0.124 0.288 0.364 0.264 0.126 0.094 0.072 0.028 0.202 13DPV 0.022 -0.015 -0.002 0.055 0.035 0.062 0.007 -0.010 -0.007 0.008 0.039 0.034 0.028 0.096 0.046 0.048 0.026 0.077 -0.003 0.065 0.049 0.113 0.121 0.097 0.041 0.039 0.005 -0.010 0.033 28DPV 0.425 -0.007 0.057 0.021 0.041 0.059 0.057 0.381 0.001 0.158 0.023 0.184 0.026 0.177 0.023 0.041 0.039 0.055 0.120 0.030 0.009 0.173 0.116 0.110 0.097 0.111 0.017 -0.003 0.019 24 -1 DPC 0.883 0.004 0.034 0.034 0.027 0.017 0.112 0.608 -0.013 0.272 0.128 0.234 0.017 0.238 0.034 0.630 0.011 0.077 0.219 0.037 0.108 0.072 0.085 0.135 0.167 0.228 -0.005 -0.016 -0.011 7 DPC 1.298 0.591 1.399 0.938 1.007 0.520 1.164 1.264 0.935 1.434 1.451 1.194 1.199 1.322 1.351 1.396 0.980 1.266 1.215 0.213 0.619 0.697 0.909 1.299 1.069 0.334 1.011 0.389 -0.017 14 DPC 1.367 1.373 1.524 1.530 1.438 1.145 1.460 1.334 1.209 1.438 1.462 1.433 1.307 1.457 1.438 1.492 1.251 1.436 1.521 1.372 1.265 1.399 0.847 1.444 1.373 0.150 1.135 1.072 0.376 20 DPC 1.358 1.458 1.524 1.536 1.451 1.127 1.395 1.282 1.196 1.416 1.447 1.415 1.321 1.371 1.394 1.409 1.368 1.353 1.500 1.273 1.306 1.314 0.967 1.373 1.356 0.127 1.240 1.042 0.949 UA 99495 C2 G296 С О109 С О110 С 0111 С 0114 С 0162 С 0164 С 0166 С Р105 С Р107 С Р108 С Р110 С Р112 С Р116 С Р147 С Р148 С Р194 С Р195 С Р215 С Р216 С Р218 С G197 С G205 С G293 С G296 С О109 С О110 С 0111 С 0114 С 0162 С 0164 С 0166 С Р105 С Р107 С Р108 С Р110 С Р112 С Р116 С Р147 С Р148 С Р194 С Р195 С Р215 С Р216 С Р218 С Ave (S/P Ratіо) 0.266 0.014 0.001 -0.002 -0.009 0.219 0.057 0.072 0.228 0.142 0.266 0.204 0.069 0.080 0.149 0.033 0.343 0.169 0.110 0.171 0.366 0.072 0.028 0.202 0.266 0.014 0.001 -0.002 -0.009 0.219 0.057 0.072 0.228 0.142 0.266 0.204 0.069 0.080 0.149 0.033 0.343 0.169 0.110 0.171 0.366 0.135 0.052 -0.007 -0.015 -0.019 -0.014 0.040 0.018 0.003 0.234 0.043 0.080 0.047 0.132 0.023 0.024 0.008 0.136 0.100 0.037 0.071 0.147 0.005 -0.010 0.033 0.052 -0.007 -0.015 -0.019 -0.014 0.040 0.018 0.003 0.234 0.043 0.080 0.047 0.132 0.023 0.024 0.008 0.136 0.100 0.037 0.071 0.147 0.049 0.032 -0.012 -0.017 -0.021 -0.019 0.039 -0.005 -0.003 0.035 0.037 0.039 0.027 0.036 0.006 0.029 0.016 0.106 0.046 0.032 0.044 0.082 0.017 -0.003 0.019 0.032 -0.012 -0.017 -0.021 -0.019 0.039 -0.005 -0.003 0.035 0.037 0.039 0.027 0.036 0.006 0.029 0.016 0.106 0.046 0.032 0.044 0.082 0.023 -0.001 -0.013 -0.003 -0.033 -0.028 0.032 -0.007 -0.009 0.022 0.001 -0.029 0.024 0.019 0.012 -0.006 -0.016 0.042 0.021 0.013 0.035 0.043 -0.005 -0.016 -0.011 -0.001 -0.013 -0.003 -0.033 -0.028 0.032 -0.007 -0.009 0.022 0.001 -0.029 0.024 0.019 0.012 -0.006 -0.016 0.042 0.021 0.013 0.035 0.043 0.004 0.016 0.009 -0.032 -0.034 -0.041 0.216 0.019 0.041 0.134 0.549 -0.036 0.574 0.023 -0.005 -0.005 0.006 0.070 0.028 0.029 0.036 0.027 1.011 0.389 -0.017 0.016 0.009 -0.032 -0.034 -0.041 0.216 0.019 0.041 0.134 0.549 -0.036 0.574 0.023 -0.005 -0.005 0.006 0.070 0.028 0.029 0.036 0.027 0.125 0.932 0.701 0.355 0.448 0.159 0.536 0.227 0.914 1.376 1.102 -0.029 0.704 0.783 0.338 0.199 0.642 0.208 0.816 0.433 0.600 0.664 1.135 1.072 0.376 0.932 0.701 0.355 0.448 0.159 0.536 0.227 0.914 1.376 1.102 -0.029 0.704 0.783 0.338 0.199 0.642 0.208 0.816 0.433 0.600 0.664 0.612 1.073 1.254 0.704 0.858 0.216 NA 0.675 1.146 1.428 1.195 NA 0.772 1.170 0.841 0.597 0.966 0.633 1.093 0.826 0.906 0.701 1.240 1.042 0.949 1.073 1.254 0.704 0.858 0.216 NA 0.675 1.146 1.428 1.195 NA 0.772 1.170 0.841 0.597 0.966 0.633 1.093 0.826 0.906 0.701 0.922 *Результати отримані як рівні проби/позитивного контролю (S/P); Ave (S/P Ratio) ± SD =Середній S/P рівень ± стандартна похибка; NA = не виявлено; V = вакцинована група; С = контрольна група. 25 UA 99495 C2 Таблиця 3А Визначення присутності вірусу PCV2 в крові способом PCV2-специфічної PCR у сироватці вакцинованих та контрольних свиней: Загальне порівняння Вве№ Груп Кім13 28 -1 3 7 10 14 17 20 дення 0 DPV свині а ната DPV DPV DPC DPC DPC DPC DPC DPC DPC PCV2 G199 V 12 A+(B) G203 V 12 A+B + ++ ++++ +++ ++ ++ G204 V 12 A+B ++ ++ ++ ++ + + G289 V 11 A + G290 V 11 A + 0112 V 11-13 A+(B) 0113 V 11-13 A+(B) 0117 V 11-13 A+(B) 0119 V 11-13 A + 0156 V 12 A+(B) 0158 V 12 A+(B) 0159 V 12 A+(B) P102 V 12-13 A+B + P103 V 12-13 A+B + P104 V 12-13 A+B ++ ++++ ++ +++ +++ + + P109 V 12-13 A+(B) P113 V 11 A Р115 V 11 А P145 V 11 A P146 V 11 A _+ _+ P150 V 11 A P192 V 11 A P213 V 12 A+(B) _+ P214 V 12 A+(B) # від позитивних % позитивних G197 G205 G293 G296 O109 O110 O111 O114 O162 O164 O166 P105 P107 P108 P110 P112 Р116 Р147 Р148 Р194 Р195 0/24 0/24 0/24 3/24 4/24 5/24 0% 0% C C C C C C C C C C C C C C C C С С С С С 12 12 11 11 11-13 11-13 11-13 11-13 12 12 12 12-13 12-13 12-13 12-13 11 A+B A+B A A A A A A A+B A A+B A+B A+B A+B A+B A А А А А А 12,5 % ++ ++ + + ++++ ++++ ++ 0% 26 16,7 % +++ +++ +++ _+ ++ ++++ ++++ ++++ +++ 20,8 % +++ +++ ++ ++ ++ + ++ + ++ + ++ ++ ++ +++ ++ ++ + + ± + 4/24 3/24 3/24 4/24 PCV2 Viremia P P P* P* P P P* P P* P* 10/24 (5/24) 16,7% 12,5% 12,5% 16,7% (20,8%*) ++++ +++ ++ ++ ++++ +++ + + + _+ _+ ++++ + + + ++++ +++ ++ +++ +++ + + + ++ ++ + + + ++++ +++ ++ NA +++ ++ + _+ +++ ++ ++ + ++++ ++ ++ + +++ ++ + + ++++ +++ +++ NA +++ + + +++ ++ + + ++ + + + ± + + +++ + + + ± + ++ + + +++ P P P P P P P P P P P P P P P P Р Р* Р Р Р UA 99495 C2 Р215 С Р216 С Р218 С 5 10 15 12 12 12 А+В А А+В # від позитивних % позитивних + + + + + ++ + + + ± + + ++ ± Р Р Р + + 0/24 0/24 1/24 6/24 11/24 23/24 22/24 24/24 21/24 18/22 24/24 (23724) 0% 100 (95,8*)% 0% 4,2% 25,0% 45,8% 95,8% 91,7% 100% 87,5% 81,8% V = вакцинована група; С = контрольна група; NA = не виявлено; кімнати 11 або 12: поросята були розміщені протягом всього дослідження (включаючи фази вакцинації та введення вірусу); кімнати 11-13 та 12-13: поросята були розміщені у кімнатах 11 або 12 протягом фази вакцинації та далі були переміщені у кімнату 13 на 0DPC (фаза введення). PCV2 штам введення: A = експериментальне введення-PCV2 #40895; A + (B) = у додаток до експериментального введення-PCV2 #40895, введення потенціальним контактом з навколишнього середовища через змішування з свинею Pig #108 протягом фази вакцинації та фази введення. Крім того, що ці свині були захищені проти PCV2, на додаток не було зафіксовано послідовностей PCV2B способом PCR; A + В = експериментальне введення-PCV2 #40895, контакт PCV2B з навколишнього середовища через свиню Pig #108, та PCR продукт був визначений способом сиквенсу та ідентифікований як PCV2B тільки з одного джерела (свиня Pig #108). Рахунок інтенсивності полос PCR : - Негативна; ± Дуже слаба полоса PCR; + Позитивна; ++ Більш позитивна; +++ Ще більш позитивна; ++++ Найдужче позитивна; Присутність вірусу PCV2 у крові: - = Негативна; P = Позитивна; P* = Непереконлива (одинична присутність або дві непереконливі полоси PCR). Таблиця 3Б Визначення кількості вірусу PCV2 у крові способом PCV2-специфічної PCR у сироватці у вакцинованих та контрольних свинях: Експериментальне PCV2 (40895) введення PIG ID G289 G290 0119 P113 P115 P145 P146 P150 P192 G293 G296 O109 O110 0111 0114 0164 Р112 Р116 Р147 Р148 Р194 Р195 GROUP ROOM V V V V V V V V V С С С С С С С С С С С С С 11-13 11 11 11-13 11-13 11-13 11-13 12 PCV2 CHAL- 0 LENGE DPV А А А А А А А А А # 0/9 позитивних % 0% позитивних А А А А А А А А А А А А А 13 28 -1 3 7 10 14 17 DPV DPV DPC DPC DPC DPC DPC DPC + + + + 0/9 0/9 0/9 0/9 0/9 0/9 1/9 0% 0% 0% 0% 22.2% 11.1% 0% 0% 11.1% ± + ++ + + + + +++ ± + + +++ + + ± + + + + +++ 27 ± 2/9 ++ ++ ++ + ++ + + ++ + + ± + 1/9 20 DPC + + + ++++ + ++++ +++ +++ + ++ ++ + +++ ++ ++ + ++ + ± + + + + ++ + PCV2 Viremia Р* Р* Р Р* 4/9(179) 44.4(11.1*) % Р Р Р Р Р Р Р Р Р Р* Р Р Р UA 99495 C2 Р216 С 5 10 12 А + + ± ++ + Р # 14/14 0/14 0/14 0/14 0/14 1/14 13/14 12/14 14/14 11/14 11/14 позитивних (13714) % 100(92.9*) 0% 0% 0% 0% 7.1% 92.9% 85.7% 100% 78.6% 78.6% позитивних % V = вакцинована група; С = контрольна група; NA = не виявлено; кімнати 11 або 12: поросята були розміщені протягом всього дослідження (включаючи фази вакцинації та введення вірусу); кімнати 11-13 та 12-13: поросята були розміщені у кімнатах 11 або 12 протягом фази вакцинації та далі були переміщені у кімнату 13 на 0DPC (фаза введення). PCV2 штам введення: A = експериментальне введення-PCV2 #40895 Рахунок інтенсивності полос PCR : - Негативна; ± Дуже слаба полоса PCR; + Позитивна; ++ Більш позитивна; +++ Ще більш позитивна; ++++ Найдужче позитивна; Присутність вірусу PCV2 у крові: - = Негативна; P = Позитивна; P* = Непереконлива (одинична присутність або дві непереконливі полоси PCR). Таблиця 3В Визначення кількості вірусу PCV2 у крові способом PCV2-специфічної PCR у сироватці у вакцинованих та контрольних свинях: Експериментальне PCV2 (40895) введення та введення шляхом контакту з навколишнього середовища № свин і G19 9 G20 3 G20 4 0112 0113 0117 0156 0158 0159 P10 2 P10 3 P10 4 P10 9 P21 3 P21 4 PCV2 Гру- Кім0 13 28 -1 3 10 14 вве7 DPC па ната DPV DPV DPV DPC DPC DPC DPC дення 17 DPC 20 DPC PCV2 Viremia ++ ++ P P V 12 A+(B) V 12 A+B + ++ V 12 A+B ++ ++ ++ ++ + + V V V V V V 11-13 11-13 11-13 12 12 12 A+(B) A+(B) A+(B) A+(B) A+(B) A+(B) V 12-13 A+B + P V 12-13 A+B + P* V 12-13 A+B ++ ++++ ++ +++ +++ + + P V 12-13 A+(B) ++++ +++ V 12 A+(B) + V 12 A+(B) 0/15 0/15 0/15 3/15 4/15 3/15 3/15 3/15 3/15 3/15 3/15(4715) 0/15 0/15 0/15 3/15 4/15 3/15 3/15 3/15 3/15 3/15 3/15(4715) 0% 20% 26.7% 20% 20% 20% 20% 20% + + # позитив # позитив % позитив G20 C 5 12 A+B 0% 0% ++ +++ 28 +++ ++++ +++ P* 40 (26.7*)% P
ДивитисяДодаткова інформація
Назва патенту англійськоюIsolated hog circovirus, compositions and methods for hog immunization against hog circovirus
Автори англійськоюWu, Stephen Qitu
Назва патенту російськоюИзольованный цирковирус свиней, композиции и способы для иммунизации свиней против цирковируса свиней
Автори російськоюВу Стивен Циту
МПК / Мітки
МПК: C12Q 1/68, C12N 7/00, C07K 14/01, C12N 15/00, A61K 39/12
Мітки: цирковірус, цирковірусу, ізольований, свиней, способи, композиції, імунізації
Код посилання
<a href="https://ua.patents.su/45-99495-izolovanijj-cirkovirus-svinejj-kompozici-ta-sposobi-dlya-imunizaci-svinejj-proti-cirkovirusu-svinejj.html" target="_blank" rel="follow" title="База патентів України">Ізольований цирковірус свиней, композиції та способи для імунізації свиней проти цирковірусу свиней</a>
Попередній патент: Похідні піридазинону, гербіцидні композиції та спосіб контролювання росту небажаної рослинності
Наступний патент: Складений фільтр для курильного виробу, сигарета, яка включає в себе складений фільтр та спосіб виготовлення цього фільтра
Випадковий патент: Яс