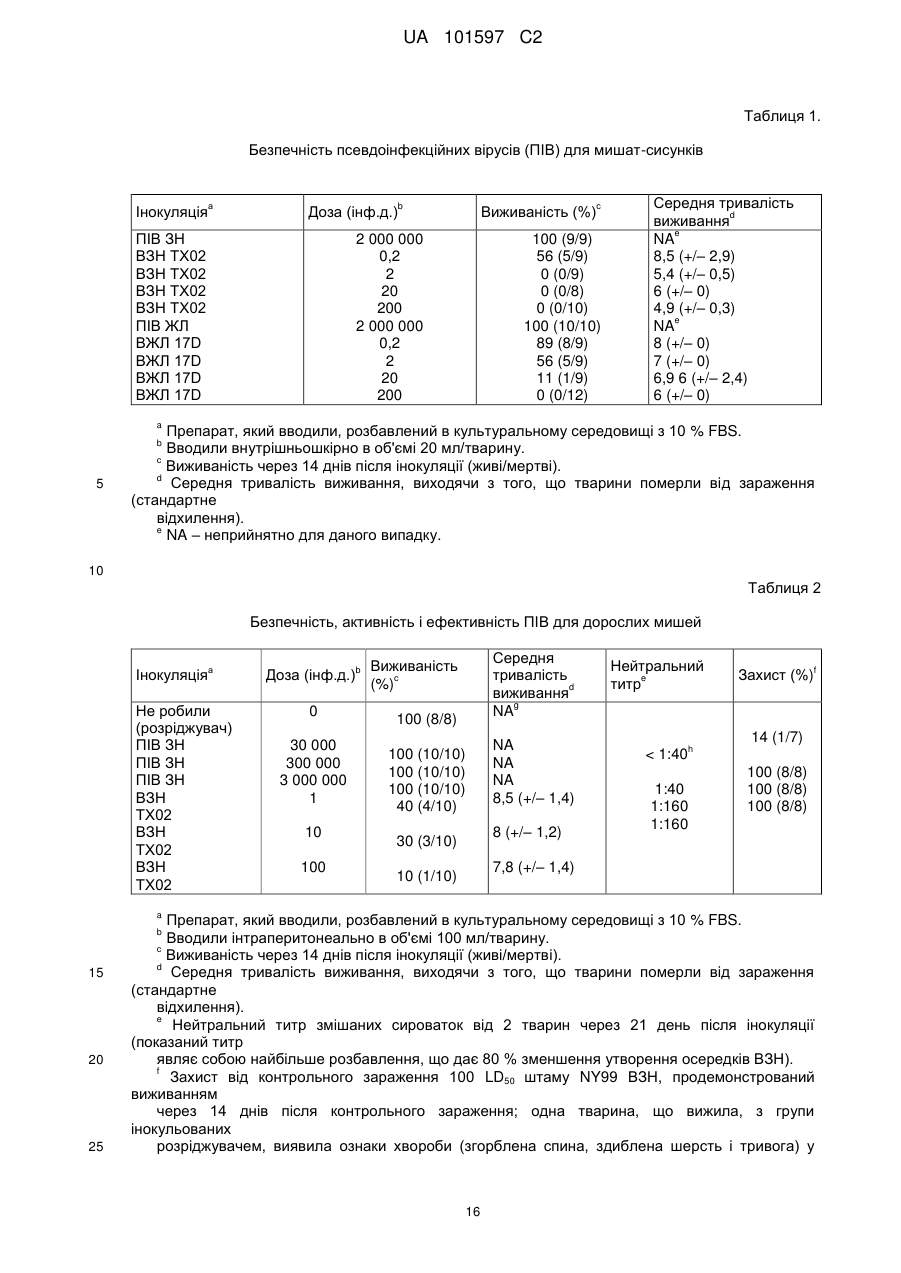
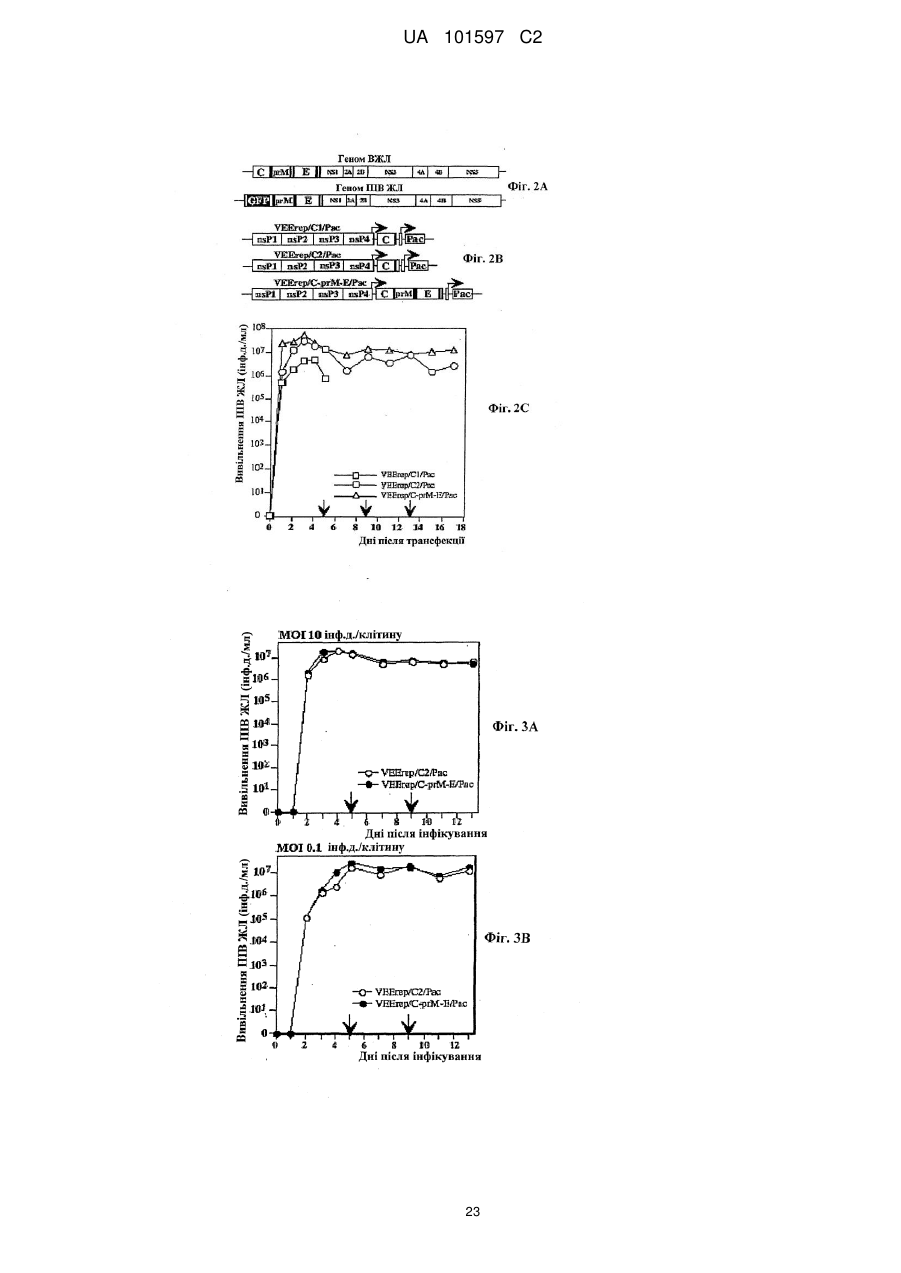
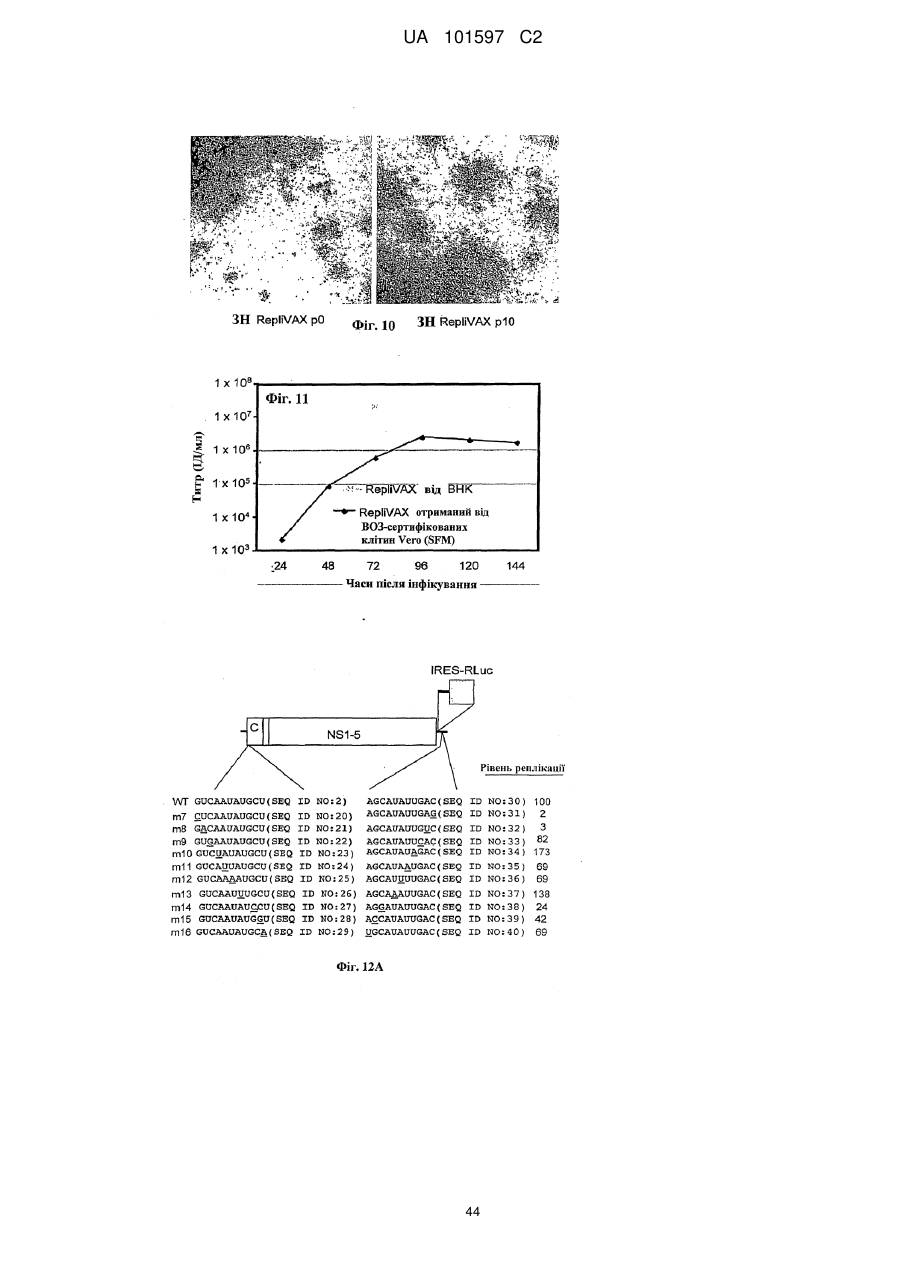
Псевдоінфекційний флавівірус та його використання
Формула / Реферат
1. Реплікаційно-дефектний псевдоінфекційний флавівірус, де геном зазначеного вірусу включає делецію в нуклеотидній послідовності, яка кодує капсидний (С) білок і ця делеція кодує амінокислоти 26-100 зазначеного С-білка або комбінацію амінокислот 26-100 зазначеного С-білка, і ця делеція не перериває РНК-послідовність, необхідну для циклізації геному, або сигнальну послідовність для білка prM, необхідну для належного дозрівання рrМ/М.
2. Реплікаційно-дефектний псевдоінфекційний флавівірус за п. 1, який відрізняється тим, що зазначений флавівірус синтезований шляхом заміни кластерів рrМ-Е інших вірусів кластерами рrМ-Е згаданого псевдоінфекційного флавірусу.
3. Реплікаційно-дефектний псевдоінфекційний флавівірус за п. 2, який відрізняється тим, що флавівірус являє собою вірус жовтої лихоманки, вірус Західного Нілу, вірус денге, вірус кліщового енцефаліту, вірус американського енцефаліту, вірус японського енцефаліту або вірус австралійського енцефаліту.
4. Реплікаційно-дефектний псевдоінфекційний флавівірус за п. 1, який відрізняється тим, що нуклеотидна послідовність, що кодує С-білок флавівірусу, який делетують, кодує амінокислоти 26-100.
5. Реплікаційно-дефектний псевдоінфекційний флавівірус за п. 1, який відрізняється тим, що делетований ген заміняють геном, що кодує маркерний білок або антиген, і зазначений маркерний білок необов’язково зелений флуоресціюючий білок.
6. Клітинна культура, що експресує С-білок флавівірусу, де зазначена експресія ефективна для забезпечення розмноження реплікаційно-дефектного псевдоінфекційного флавівірусу за п. 1 у відповідних умовах, і послідовність нуклеїнової кислоти, яка кодує С-білок, є кодон-оптимізованою таким чином, що оптимізація кодона зменшує вірогідність рекомбінації кодованого клітинною лінією С-білка з геномом псевдоінфекційного флавівірусу і/або збільшує розмноження псевдоінфекційного флавівірусу.
7. Клітинна культура за п. 6, що експресує С-білок, але не білок prM або оболонковий білок флавівірусу, ефективна для забезпечення розмноження реплікаційно-дефектного псевдоінфекційного флавівірусу за п. 1 у відповідних умовах.
8. Клітинна культура за п. 6 або 7, яка відрізняється тим, що клітини, які експресують білки дикого типу або мутовані білки вірусу, генерують за допомогою генетично сконструйованих репліконів, синтезованих з вірусних векторів.
9. Клітинна культура за п. 8, яка відрізняється тим, що
(a) зазначений реплікон експресує С-білок, який включає мутації в щонайменше 36 позиціях нуклеотидів, який кодує С-білок флавівірусу;
(b) реплікон експресує С-білок в репліконі, який включає неприродні послідовності циклізації, так що наявність таких послідовностей циклізації зменшує вірогідність продуктивної рекомбінації реплікаційно-дефектного псевдоінфекційного вірусу з природними вірусами; або
(c) зазначений реплікон експресує білки, які включають змінені нуклеотидні послідовності, що кодують процесоване з′єднання С-prM таким чином, що наявність таких змінених послідовностей збільшує вихід реплікаційно-дефектного псевдоінфекційного вірусу в клітинній культурі, вихід in vivo субвірусних частинок, що містять prM/E, або їхню комбінацію.
10. Клітинна культура за п. 8, яка відрізняється тим, що реплікони, які експресують С-білок флавівірусу, вводять в клітини трансфекцією рибонуклеїновими кислотами (РНК) синтезованих in vitro репліконів, трансфекцією плазмідними ДНК, сконструйованими для синтезу функціональних альфавірусних репліконів з промоторів, специфічних до РНК-полімерази ІΙ, або інфікуванням альфавірусними репліконами, упакованими всередині альфавірусних структурних білків.
11. Клітинна культура за п. 8, яка відрізняється тим, що вірусними векторами є альфавіруси, і альфавірусом є вірус венесуельського енцефаліту коней (VEEV), вірус Синдбіс, вірус східного енцефаліту коней (EEEV), вірус західного енцефаліту коней (WEEV) або вірус лихоманки Ross River.
12. Спосіб продукування реплікаційно-дефектного псевдоінфекційного флавівірусу, який передбачає:
генерування реплікаційно-дефектного псевдоінфекційного флавівірусу за п. 1;
генерування клітинної лінії, що експресує капсидний С-білок флавівірусу, причому ця клітинна лінія забезпечує високі рівні білків, необхідні для розмноження реплікаційно-дефектного флавівірус; та
інфікування цієї клітинної лінії псевдоінфекційним флавівірусом, в результаті чого продукується реплікаційно-дефектний псевдоінфекційний флавівірус.
13. Спосіб за п. 12, який відрізняється тим, що згаданим вірусом є вірус за будь-яким із пп. 2-4.
14. Спосіб за п. 12, який відрізняється тим, що клітини, які експресують білки дикого типу або мутовані білки вірусу, генерують як описано в пп. 7-10.
15. Спосіб за пп. 12-14, який відрізняється тим, що додатково включає стадію формування зазначеного реплікаційно-дефектного псевдоінфекційного флавівірусу.
15. Фармацевтична композиція, що включає реплікаційно-дефектний псевдоінфекційний флавівірус за будь-яким із пп. 1-5.
16. Фармацевтична композиція за п. 16 для застосування в способі захисту суб′єкта від інфекцій, викликаних флавівірусами, який передбачає введення суб′єкту імунологічно ефективної кількості зазначеної фармацевтичної композиції, причому ця композиція викликає в організмі суб′єкта імунну реакцію на флавівіруси, таким чином захищаючи суб′єкта від інфекції;
причому необов’язково згадане введення здійснюють інтраперитонеально, інтрадермально, підшкірно, внутрішньом′язово, перорально або інтраназально, і
необов’язково згаданим суб′єктом є людина або тварина.
Текст
Реферат: Винахід належить до реплікаційно-дефектного псевдоінфекційного вірусу, де геном зазначеного вірусу включає делецію в нуклеотидній послідовності, яка кодує капсидний (С) білок і ця делеція кодує амінокислоти 26-100 зазначеного С-білка або комбінацію амінокислот 26-100 зазначеного С-білка, і ця делеція не перериває РНК-послідовність, необхідну для циклізації геному, або сигнальну послідовність для білка prM, необхідну для належного дозрівання рrМ/М. Винахід також належить до способу продукування таких вірусів у великому масштабі та використання цих псевдоінфекційних вірусів в фармацевтичній композиції для профілактики хвороб, викликаних зараженням людей або тварин вірусами цього сімейства. UA 101597 C2 (12) UA 101597 C2 UA 101597 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь застосування Винахід відноситься до молекулярної біології, вірусології та імунології і, взагалі, описує структуру реплікаційно-дефектних вірусів, які належать до сімейства Flaviviridae, та використання їх як вакцини у профілактиці хвороб, викликаних вірусами, що належать до цього сімейства. Конкретніше, даний винахід пропонує реплікаційно-дефектні флавівіруси, або псевдоінфекційні флавівіруси (ПІВ, також відомі як RepliVAX), та описує використання їх як профілактичних вакцин проти флавівірусасоційованих хвороб. Опис спорідненої галузі Рід Flavivirus сімейства Flaviviridae включає ряд важливих патогенів людей і тварин і згрупований у чотири окремі антигенні комплекси на основі відмінностей у реактивності в імунологічних тестах. Флавівіруси, як правило, розповсюджуються в ампліфікуючих клітинаххазяях птахів або ссавців і векторах комарів або кліщів. Геном флавівірусу являє собою одноланцюгову кеповану РНК позитивної полярності без 3′-кінцевої полі(А)послідовності. Він кодує єдиний поліпептид, який котрансляційно та посттрансляційно процесується у вірусні структурні білки, С, prM/M та Е, утворюючи вірусні частинки та неструктурні білки, NS1, NS2A, NS2B, NS3, NS4A, NS4B та NS5, необхідні для реплікації вірусного геному та його пакування в інфекційні віріони (Chambers, 1990). Віріони містять одну копію вірусної геномної РНК, упакованої в нуклеокапсид, який містить С-білок і оточений ліпідною оболонкою, що утримує гетеродимери білків М та Е. На відміну від багатьох інших оболонкових вірусів взаємодія між нуклеокапсидом і оболонковими шипами є не дуже специфічною, і оболонка, що містить М/Е, може ефективно формуватися навколо нуклеокапсиду, синтезованого з гетерологічного флавівірусу, демонструючи обмежений рівень гомології у капсидній послідовності (Lorenz, 2002). З іншого боку, експресія prM та Е за відсутності С може привести до формування субвірусних частинок (СВЧ), що не містять ані РНК, ані С-білка (Mason, 1991). Кластери prM/M-E, що продукують субвірусні частинки, стали основою для кількох відомих в галузі кандидатів у вакцину. Ці кандидати у вакцину включають субодиничні вакцини (Konishi, 1992; 2001; 2002; Qiao, 2004), ДНК-вакцини (Phillpotts, 1996; Kochel, 1997; Schmaljohn, 1997; Colombage, 1998; Aberle, 1999; Konishi, 200; Kochel, 200; Davis, 2001) та живі векторні вакцини (Mason, 1991; Konishi, 1992; Pincus, 1992; Fonseca, 1994; Pugachev, 1995; Colombage, 1998; Kanesa, 2000; Minke, 2004). Однак ці вакцини мають серйозні недоліки. Наприклад, субодиничні вакцини є безпечними у використанні, але їх важко продукувати у великих кількостях; ДНК-вакцини є слабо імуногенними, а недоліком вірусних векторних вакцин є недостатня активність за наявності імунітету до вектора. Тому, незважаючи на велике занепокоєння з приводу флавівірусасоційованих хвороб і зростаючого поширення флавівірусів у нових ареалах, антивірусні терапевтичні методи є ще недостатньо розробленими для цих інфекцій, і на сьогодні існує дуже обмежена кількість удосконалених вакцин. Інактивовані вірусні вакцини (ІВВ) були дозволені для профілактики кліщового енцефаліту (КЕ) та японського енцефаліту (ЯЕ). Однак ці вакцини, як і інші інактивовані вірусні вакцини, мають низьку, обмежену активність і потребують багаторазових вакцінацій. Незважаючи на ці недоліки, інактивовані вірусні вакцини проти японського енцефаліту та кліщового енцефаліту мають хороші показники безпечності. Єдиною дозволеною живою атенуйованою (ослабленою) вакционою (ЖАВ) для флавівірусу є широко застосовувана жива ослаблена вакцина на основі штаму 17D вірусу жовтої лихоманки (ВЖЛ), яка була отримана шляхом серійного пасирування штаму Асібі дикого типу вірусу жовтої лихоманки в тканинах ембріону курчати. Хоча ця жива ослаблена вакцина вважається дуже безпечною та ефективною, були повідомлення про випадки жовтої лихоманки у вакцинованих пацієнтів, в тому числі про нещодавній такий випадок у американського військовослужбовця (Gerasimon, 2005). Крім того, цю вакцину не рекомендують застосовувати для дітей, вагітних жінок або осіб з ослабленим імунітетом через шкідливий ефект, в тому числі вакциноасоційований енцефаліт. Однак розробка систем "зворотної генетики" для флавівірусів привела до створення та конструювання нових типів живої атенуйованої вакцини, що базуються на раціональному ослабленні згаданих вірусів. Цей новий клас вакцин включає химери на основі 17D вірусу жовтої лихоманки, в яких кластер фрагментів геному, що кодує prM-E вірусу жовтої лихоманки, замінили prM-E-кластером, синтезованим з гетерологічних флавівірусів (Chambers, 1999). Аналогічний підхід на основі химерного вірусу застосували для каркасів на основі вірусу денге та вірусу кліщового енцефаліту (Pletnev, 2002; Huang, 2003). У більшості випадків химерні флавівіруси демонструють високо атенуйований фенотип і здатні викликати ефективну захисну імунну реакцію та захищати від наступної інфекції вірусами, структурні білки яких експресуються згаданими химерами (Monath, 2002). Виявляється, що ефективній вакцинації цими кандидатами 1 UA 101597 C2 5 10 15 20 25 30 35 40 45 50 55 60 у химерні вакцини не заважає конституціональний "векторний" імунітет (Monath, 2002), який перешкоджає активності рекомбінантних вірусних вакцин, основаних на інших вірусних векторах. Крім того, хоча химерні флавівіруси, можливо, забезпечують достатньо універсальний підхід до створення нових вакцин, існують побоювання, що самі химери можуть бути патогенними (Chambers, 1999) принаймні для осіб з ослабленим імунітетом або що патогенні химери можуть утворюватись, оскільки у процесі розмноження цих вірусів були виявлені мутації (Pugachev, 2004). Інший перспективний напрямок у розробці вакцин грунтується на створенні непоправних делецій у геномі флавівірусу, що робить продуктивну реплікацію вірусу у вакционованого хазяїна або менш ефективною, або неможливою. В останньому випадку вірусні геноми, що кодують весь реплікативний комплекс, але не мають, наприклад, області, що кодує С-білок, можна доставляти для імунізації in vivo або у вигляді синтезованої in vitro РНК, здатної до самореплікації (Kofler, 2004; Aberle, 2005), або, можливо, у формі ДНК (під контролем промоторів РНК-полімерази II або у вигляді синтезованої in vitro РНК, здатної до самореплікації (Kofler, 2004; Aberle, 2005). Безпосередня імунізація за допомогою синтезованих in vitro дефектних РНК-геномів, яка обумовлює продукування субвірусних частинок за відсутності повного реплікативного циклу вірусу, виявилася безпечною та ефективною при виробленні захисного імунітету (Kofler, 2004; Aberle, 2005). Однак можуть виникати значні перешкоди при продукуванні кандидата у вакцину на основі РНК, обумовлені проблемами синтезу, стабільності та доставки. Таким чином, на сьогодні в галузі існує потреба у безпечноій, активній та ефективній вакцині, яку можна використовувати проти хвороб, викликаних в результаті інфекції вірусами сімейства Flaviviridae. Даний винахід задовольняє цій потребі, що давно відчувається в галузі. СУТЬ ВИНАХОДУ В одному варіанті винаходу запропоновано реплікаційно-дефектний псевдоінфекційний вірус, який належить до сімейства Flaviviridae. Такий реплікаційно-дефектний псевдоінфекційний вірус із сімейства Flaviviridae включає: делецію у капсидному (С) білку, що кодує нуклеотидну послідовність таким чином, що ця делеція не перериває РНК-послідовність, необхідну для циклізації геному, сигнальну послідовність для білка prM, необхідну для належного дозрівання prM/М або їхньої комбінації, в якій реплікаційно-дефектний псевдоінфекційний вірус реплікується лише в клітинах, що експресують С-білок або С, білок prM, оболонковий білок, мутований С-білок, мутований prM, мутований оболонковий білок або комбінацію цих білків вірусу сімейства Flaviviridae. В іншому варіанті винаходу запропоновано клітинну культуру, що експресує С-білок або С, білок prM, оболонковий білок, мутований С-білок, мутований prM, мутований оболонковий білок або комбінацію цих білків вірусу сімейства Flaviviridae, яка є ефективною для розмноження за відповідних умов реплікаційно-дефектного псевдоінфекційного вірусу сімейства Flaviviridae. В ще одному варіанті запропоновано спосіб продукування вищеописаного реплікаційнодефектного псевдоінфекційного вірусу сімейства Flaviviridae. Цей спосіб включає створення реплікаційно-дефектного псевдоінфекційного вірусу сімейства Flaviviridae, який передбачає делецію у капсидному гені таким чином, що ця делеція не перериває РНК-послідовність, необхідну для циклізації геному, сигнальну послідовність для білка prM, необхідну для належного дозрівання prM/М або їхньої комбінації; генерування клітинної лінії, що експресує Сбілок або С, білок prM, оболонковий білок, мутований С-білок, мутований prM, мутований оболонковий білок або комбінацію цих білків вірусу сімейства Flaviviridae, причому ця клітинна лінія забезпечує високі рівні білків сімейства Flaviviridae, необхідних для розмноження реплікаційно-дефектного псевдоінфекційного вірусу сімейства Flaviviridae; та інфікування згаданої клітинної лінії псевдоінфекційним вірусом сімейства Flaviviridae, в результаті чого продукується реплікаційно-дефектний псевдоінфекційний вірус сімейства Flaviviridae. В ще одному варіанті винаходу запропоновано фармацевтичну композицію, що включає реплікаційно-дефектний псевдоінфекційний вірус сімейства Flaviviridae, отриманий описаним тут способом. І в ще одному варіанті запропоновано спосіб захисту суб'єкта від інфекцій, викликаних вірусами сімейства Flaviviridae. Цей спосіб передбачає введення суб'єкту імунологічно ефективної кількості фармацевтичної композиції, отриманої описаним тут способом, яка викликає в організмі суб'єкта імунну реакцію на віруси сімейства Flaviviridae, таким чином захищаючи суб'єкт від інфекцій. СТИСЛИЙ ОПИС ГРАФІЧНИХ МАТЕРІАЛІВ Фіг. 1 – схематичне зображення реплікації псевдоінфекційного флавівірусу в клітинах, що продукують С-білок або всі вірусні структурні білки для транс-комплементації дефекту. 2 UA 101597 C2 5 10 15 20 25 30 35 40 45 50 55 60 Реплікація псевдоінфекційних вірусів у нормальних клітинах in vivo або in vitro веде до вивільнення субвірусних частинок, що не мають нуклеокапсиду. Фіг. 2А – 2С показують, що клітинні лінії, які експресують С-білок вірусу жовтої лихоманки, білки prM та Е, можуть доповнювати реплікацію псевдоінфекційного вірусу жовтої лихоманки (ПІВ ЖЛ). Фіг. 2А – схематичне зображення геному ВЖЛ та геному ПІВ ЖЛ, що експресує флуоресціюючий білок GFP. Фіг. 2В – схематичне зображення репліконів VEEV, що експресують ген Рас та С вірусу жовтої лихоманки з єдиним пептидом білка prM (якірний С; VEErep/C1/Pac) або якірний С з 20 амінокислотами білка prM (VEErep/C2/Pac), або всі структурні білки вірусу жовтої лихоманки (VEErep/C-prM-E/Pac). Фіг. 2С показує вивільнення псевдоінфекційного вірусу жовтої лихоманки клітинними лініями, трансфектованими синтезованим in vitro геномом псевдоінфекційного вірусу. Середовище заміняли у зазначені моменти часу і визначали титри псевдоінфекційного вірусу. Стрілки показують моменти часу, коли клітини субпасирували при співвідношенні 1:5. Фіг. 3А – 3В показують криві росту ПІВ ЖЛ на пакувальних клітинних лініях. Клітини ВНК21, що містили реплікони VEErep/C2/Pac та VEErep/C-prM-E/Pac, інфікували псевдоінфекційним вірусом жовтої лихоманки при зазначенній множинності інфікування в інфекційних дозах (інф.д.) на клітину. В зазначені моменти часу середовище заміняли і визначали титри псевдоінфекційного вірусу. Стрілки показують моменти часу, коли клітини субпасирували при співвідношенні 1:5. На фіг. 3А показана крива росту при множинності інфікування 10 інф.д. на клітину, і на фіг. 3В – крива росту при множинності інфікування 0,1 інф.д. на клітину. Фіг. 4А – 4С показують, що клітини, які експресують ген С з оптимізованим кодоном, продукували ПІВ ЖЛ. Фіг. 4А – нуклеотидна послідовність синтетичного гена. Введені мутації позначені рядковими літерами (SEQ UD NO: 1). Фіг. 4В – криві росту ПІВ ЖЛ на пакувльних клітинних лініях. Клітини ВНК-21, що містять реплікони VEErep/C2/Pac, VEErep/C-prM-E/Pac, VEErep/C2opt/Pac та VEErep/Copt-prM-E/Pac, інфікували ПІВ ЖЛ при зазначенній множинності інфікування в інфекційних дозах (інф.д.) на клітину. В зазначені моменти часу середовище заміняли і визначали титри псевдоінфекційного вірусу. Фіг. 4С показує бляшки, що розвинулись під дією ВЖЛ та ПІВ ЖЛ у клітинній лінії, що містила VEErep/C2opt/Pac, після 4 днів інкубації при 37ºС. Фіг. 5А – 5С показують, що псевдоінфекційний вірус Західного Нілу (ЗН) розвиває у пакувальних клітинах інфекцію, що поширюється. Фіг. 5А – схематичне зображення геному псевдоінфекційного вірусу ЗН і реплікону, що експресує структурні гени вірусу ЗН (ВЗН). Фіг. 5В показує. що ПІВ ЗН продукував осередки ВЗН антиген-позитивних клітин (виявлені за допомогою антитіла до NS1 при інфікуванні клітин ВНК(VEErep/C*-E*-Pac) після 70 годин інкубації. Фіг. 5С показує ті самі препарати ПІВ ЗН, що продукували лише окремі інфіковані клітини (виявлені через 70 годин після інфікування при застосоуванні того самого методу забарвлювання трагантом, що і на фіг. 5В) при інфікуванні моношарів клітин Vero. Фіг. 6А – 6С показують детекцію Е-білка після вивільнення з клітин, інфікованих псевдоінфекційними вірусами ЖЛ та ЗН. На фіг. 6А: клітини ВНК-21 інфікували ПІВ ЖЛ при множинності інфікування 5 інф.д. на клітину. Вивільнені субвірусні частинки збирали та очищали ультрацентрифугуванням. Проби розкладали на складові методом SDS-PAGE (електрофорез у поліакриламідному гелі з додецилсульфатом натрію), переносили у фільтри, Е-білок детектували за допомогою моноклонального антитіла D1-4G2. Середовища, зібрані з неінфікованих клітин, зона 1; середовища, зібрані з клітин, інфікованих ПІВ ЖЛ через 48 годин після інфікування, зона 2; середовища, зібрані з клітин, інфікованих ПІВ ЖЛ через 72 години 7 після інфікування, зона 3; ВЖЛ (2×10 бляшкоутворюючих одиниць (БУО), зона 4. На фіг. 6В: клітини Vero інфікували псевдоінфекційним вірусом ЗН протягом 24 годин, і потім порції очищеної культуральної рідини (зібраної до виявлення будь-якого лізису клітин) розкладали на складові методом SDS-PAGE, переносили у фільтри, проводили реакцію за допомогою Еспецифічного моноклонального антитіла (7Н2; Bioreliance). Взаємодія тих самих проб з поліклональними сироватками не змогла виявити яких-небудь клітиноасоційованих неструктурних білків в цьому препараті (результаті не показані), що підтверджує, що Е-білок активно виділявся. Проба вірусу ЗН, зона 1; середовища, зібрані з неінфікованих клітин, зона 2; середовища, зібрані з клітин, інфікованих ПІВ ЗН через 48 годин після інфікування, зона 3. На фіг. 6С: вестерн-блотинг, що показує вміст Е-білка у фракціях, приготованих з градієнту густини сахарози, отриманого з субвірусних частинок, зібраних з нормальних (непакувальних) ВНКклітин, електропорованих РНК ПІВ ВЖЛ. Пік реактивності Е-білка (при 32 % сахарози) відповідав щільності субвірусних частинок і у відповідності з цим фактом мігрував повільніше, ніж проходження ВЖЛ у паралельному аналізі (42 %). Фіг. 7А–7F – схематичні зображення плазмід, використаних для продукування 3 UA 101597 C2 5 10 15 20 25 30 35 40 45 50 55 60 псевдоінфекційного вірусу (ПІВ) жовтої лихоманки (ЖЛ) та Західного Нілу (ЗН). На фіг. 7А показана плазміда ПІВ ЖЛ (pYFPIV), на фіг. 7В – плазміда ПІВ ЗН (pWNPIV), на фіг. 7С – плазміда реплікону pVEErep/C1/Pac, на фіг. 7D – плазміда реплікону pVEErep/C2/Pac, на фіг. 7Е – плазміда реплікону pVEErep/C3/Pac і на фіг. 7F – плазміда реплікону pVEErep/C*-E*-Pac. Фіг. 8А–8V показують послідовності плазмід, використаних у даному винаході. На фіг. 8А–8D показана послідовність pYFPIV (SEQ ID NO: 6), на фіг. 8Е–8Н – послідовність pVEErep/C1/Pac (SEQ ID NO: 7), на фіг. 8І–8К – послідовність pVEErep/C2/Pac (SEQ ID NO: 8), на фіг. 8L–8O – послідовність pVEErep/C-prM-E/Pac (SEQ ID NO: 9), на фіг. 8Р–8R – послідовність pVEErep/C2opt/Pac (SEQ ID NO: 10), на фіг. 8S–8V – послідовність pVEErep/CoptprM-E/Pac (SEQ ID NO: 11). Фіг. 9 – схематичне зображення ділянок, що перекриваються, геному RepliVAX і 1 реплікону VEE, застосованого для забезпечення С у транс-положенні. Тридцять шість мутацій були введені в VEErep/pac-Ubi-C* для мінімізації гомологічної рекомбінації з фрагментом С, 2 кодованим геномом RepliVAX. Позиція 5′ та 3′ CS-послідовностей в геномі RepliVAX. Фіг. 10 – паралельне порівняння інфекційних осередків, утворених в С-експресуючій клітинній лінії {BHK(VEErep/Pac-Ubi-C*)} під дією геному RepliVAX вірусу Західного Нілу, при пасажі 0 (від електропорації) і пасажі 10 виявляє, що варіанти, які краще ростуть, відбирати легко. Фіг. 11 показує титрування ПІВ RepliVAX, утвореного в клітинах Vero, сертифікованих ВОЗ, що містять полігенний С-експресуючий кластер (VEErep/Pac-Ubi-C*). Хоча отриманий в результаті ПІВ має трохи нижчий титр, ніж ПІВ, продукований у ВНК-клітинах, з клітин Vero можна багаторазово збирати ПІВ високого титру, що неможливо при використанні клітин ВНК. Фіг. 12А–12В показують мутантів циклізації. Фіг. 12А показує реплікацію реплікону WNV/IRES-Rluc з однією основою, типування CS-мутацій демонструє, що деякі одноосновні мутації реплікують на рівнях клітин дикого типу (WT). Ліва частина панелі показує тестований генóм вище 5′ та 3′ CS-послідовностей. Права сторона показує рівні реплікації, виявлені за допомогою ферменту-репортера Rluc і виражені у відсотках рівнів реплікації WT. Підкреслені основи означають мутовані основи. Фіг. 12В показує реплікацію реплікону WNV/IRES-Rluc з типуванням двоосновних змін (m17), отриманих шляхом комбінування m10 та m13 (панель А), у порівнянні з рівнями реплікації, виявленими у мутантів, які поєднують WT і мутовані CS у будьякому можливому форматі, разом з мутантом, призначеним продукувати неактивну полімеразу (негативний контроль). Ліва частина панелі показує тестований генóм вище 5′ та 3′ CSпослідовностей. Права сторона показує рівні реплікації, виявлені за допомогою ферментурепортера Rluc і виражені у відсотках рівнів реплікації WT. Підкреслені основи означають мутовані основи. * означає, що реплікації не виявлено. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Безпечні та ефективні вакцини розроблені лише для невеликої кількості хвороб, що їх викликають флавівіруси. Традиційні способи отримання інактивованої вірусної вакцини (ІВВ) та живої атенуйованої вакцини (ЖАВ), які застосовують для отримання вакцин проти ЖЛ, ЯЕ та КЕ, ще не дають ліцензованих продуктів для запобігання хворобам, викликаним іншими флавівірусами, зокрема лихоманці Денге та енцефаліту Західного Нілу (ЕЗН). Є побоювання щодо безпечності існуючих живих атенуйованих вакцин (залишкова вірулентність або повернення до вірулентності) та продуктів інактивованих вірусних вакцин (реактогенність, обумовлена антигенним навантаженням, і адвентиційні антигени). Крім того, інактивовані вірусні вакцини, як правило, потребують багаторазових вакцинацій. Більш того, обидва типи вакцин залежать від проблем процеса виробництва, в тому числі від необхідності не допускати повернення до вірулентності під час культивування ЖАВ, від кількості матеріалу, необхідного для створення сильної імунної відповіді на продукти ІВВ, а також від наявності лабораторій з високим рівнем захисту для культивування вірулентних вірусів, застосовуваних для приготування продуктів ІВВ. Хоча існують перспективні кандидати для нових типів флавівірусних вакцин, на шляху до їхньої розробки необхідно буде вирішити згадані проблеми. Даний винахід, взагалі, розглядає конструювання та використання реплікаційнодефектних псевдоінфекційних вірусів, що належать до сімейства Flaviviridae. Відповідно, винахід описує розробку нового типу реплікаційно-дефектних флавівірусів, які також іменують RepliVAX, що поєднують безпечність інактивованих вакцин та ефективність і універсальність живих атенуйованих вакцин. Ці флавівіруси, які також ідентифікують як псевдоінфекційні віруси (ПІВ), у даному винаході містять генетично сконструйовані флавівірусні геноми з делецією переважно ділянки, що кодує капсид (С), в результаті чого цей геном не може продукувати інфекційне потомство в нормальних клітинних лініях або вакцинованих тваринах. Однак ці 4 UA 101597 C2 5 10 15 20 25 30 35 40 45 50 55 60 псевдоінфекційні віруси можна розмножувати в клітинних лініях, що експресують або С, або кластер C-prM-E, в яких вони реплікуються до високих рівнів. Отже, ці псевдоінфекційні флавівіруси не можуть розвивати інфекцію, що розповсюджується, у нормальних клітинах in vitro або in vivo через відсутність транс-комплементації С-білком, тому ці віруси не можуть викликати хворобу у тварин. На відміну від відомих вакцин і способів їх виробництва даний винахід пропонує систему для промислового виробництва псевдоінфекційних флавівірусів, яка здешевить виготовлення цих вакцин порівняно з інактивованими вакцинами і одночасно забезпечить більш безпечне їх використання порівняно з живими атенуйованими вакцинами. Цього досягають завдяки створенню нового типу рекомбінантної вакцини, здатної лише на один цикл реплікації в імунізованих тваринах або людях, що веде до вивільнення субвірусних частинок (СВЧ), що не містять генетичного матеріалу, але служать ефективними імуногенами. Даний винахід показав, що псевдоінфекційні флавівіруси можна генерувати або з вірусу жовтої лихоманки (ВЖЛ), або з вірусу Західного Нілу (ВЗН). Виходячи з цього, автори винаходу припускають, що описаний тут спосіб міг би стати широкозастосовним для розробки вакцин проти інших флавівірусів. Крім того, в результаті інфікування нормальних клітинних ліній такими псевдоінфекційними флавівірусами продукувалися субвірусні частинки, що не містили нуклеокапсиду та генетичного матеріалу. Описані тут псевдоінфекційні флавівіруси продемонстрували нездатність викликати будь-яку хворобу і тим самим довели свою безпечність. Крім того, ці псевдоінфекційні флавівіруси виявляли імуногенність в мишах завдяки здатності на один цикл реплікувати та вивільняти СВЧ, які представляють вірусні антигени. Псевдоінфекційні віруси Західного Нілу (ПІВ ЗН) також захищали мишей від енцефаліту з летальним кінцем після введення вірусу ЗН. Описані тут псевдоінфекційні віруси можна продукувати способом, який дає високий вихід продукту в клітинній культурі та забезпечує нездатність викликати хворобу у тварин. Ці продукти можна було б вводити тваринам, в організмі яких дефектний процес реплікації цих продуктів не дає можливості розповсюдження і виникнення хвороби, але дає можливість продукувати СВЧ, імуноген субодиниці флавівірусу, який показав себе ефективним у відтворенні активної імунної реакції на хворобу, викликану кількома флавівірусами. Даний винахід також показав, що метод з використанням псевдоінфекційних флавівірусів можна застосувати і для двох еволюційно далеких флавівірусів, що передаються комарами. Застосовність аналогічної технології для розробки вакцин на основі РНК для флавівірусу, що передається клещами (Kofler, 2004) означає, що технологія на основі ПІВ буде прийнятною і для еволюційно більш далеких флавівірусів. Крім того, робота з вакцинами на основі РНК вірусу кліщового енцефаліту показує, що крім гуморальної імунної відповіді на субвірусні частинки (аналогічні описаним тут), введення геномів реплікаційно-активних флавівірусів у клітини вакцинованих хазяїв також викличе Т-клітинні імунні реакції (Kofler, 2004; Aberle, 2005). Хоча Т-клітинні імунні реакції не визначали тут, вважають, що псевдоінфекційні віруси здатні включати Т-клітинну імунну реакцію, яка імітує реакції, викликані вірусною інфекцією. Хоча описані тут вакцини на основі ПІВ базуються на тій самій стратегії реплікації флавівірусу та продукування СВЧ, яка була використана у вакцинах на основі РНК, приготованих проти вірусу КЕ (Kofler, 2004; Aberle, 2005), ці вакцини на основі ПІВ не потребують уведення тваринам методом "генної гармати", їх можна швидко вирощувати в клітинних культурах і піддавати тим самим типам стабілізації та зберігання (ліофілізації), які сьогодні застосовують для вакцини YFV 17D, що випускається комерційно, в результаті чого отримують здатний добре зберігатися та придатний для продажу продукт вакцини, який можна випускати у великих кількостях. Попередні дослідження стабільності RepliVAX Західного Нілу показали, що ліофілізовані препарати не виявляють помітної втрати титру при зберіганні протягом 30 днів при 4ºС. Для створення умов інтенсивного росту, необхідних для ефективної транскомплементації (отже і виходу) псевдоінфекційних флавівірусів, у даному винаході використовували клітини, що експресують високі рівні С (або C-prM-E) з репліконів VEEV. Реплікони VEEV є менш цитопатичними, ніж реплікони, отримані від інших альфавірусів, і швидко стабілізують стійку реплікацію в деяких клітинних лініях рослинного або інсектиційного походження. Ця система виявляється придатною для продукування псевдоінфекційних флавівірусів, оскільки: і) реплікони VEEV є високоефективними при синтезі гетерологічних білків і в даному винаході синтезували С до рівня, необхідного для інкапсидації геному флавівірусу; іі) реплікони VEEV суттєво не впливають на реплікацію флавівірусу (Petrakova, 2005). Більш того, реплікони VEEV та геноми ПІВ ЖЛ можуть реплікуватися разом у клітинах ВНК-21, не 5 UA 101597 C2 5 10 15 20 25 30 35 40 45 50 55 60 викликаючи цитопатогенного ефекту (ЦПЕ); ііі) реплікони VEEV можна пакувати при високих титрах у віріони VEEP, які можна використовувати для швидкої стабілізації пакувальних клітинних ліній, що продукують структурний білок(білки) флавівірусу. Крім того, дослідження впливу оточення С-експресії на вихід ПІВ показали, що пакувальні клітини, що експресують якірну форму С з додатковими 20 амінокислотами prM продукуваои більше частинок, ніж клітини, що експресують тільки якірний С, що свідчить про важливість правильної послідовності актів процесування при формуванні віріонів. Причина підвищення ефективності пакування за допомогою структурного елемента, що містить перші 20 амінокислот prM, є незрозумілою, але цей феномен можна пояснити потребою у конкретному порядку розщеплення на двох сусідніх сайтах розщеплення (специфічних до NS2B/NS3 і до сигнальної пептидази) (Yamschikov and Compans, 1994) та/або відмінностями у розподілі/стабільності продуктів С-білка в цих двох різних оточеннях. Крім того, помітили, що коекспресія С з prM та Е (VEErep/C-prM-E/Pac) викликала лише незначне збільшення виходу ПІВ порівняно з VEErep/C2/Pac, який експресував якірний С з фрагментом prM. При дослідженні оптимізації кодонів С-генів, кодованих репліконом VEEV, з метою визначення, чи така альтерація послідовності С-гена збільшила вихід ПІВ, не було виявлено великої різниці у вивільненні ПІВ ВЖЛ з клітин, не експресуючих С-гена з оптимізованим кодоном. Цей факт дав можливість припустити, що навіть з неоптимізованим геном реплікони VEEV, виявляється, продукують С на рівні насичення. Ці результати узгоджувались з іншими дослідженнями і показали, що клітинні лінії, які експресували реплікони VEEV, які кодують кластер WNV C-E, продукували рівень Е більший, ніж рівні, виявлені в клітинах, інфікованих ВЗН. Незважаючи на нездатність транс-експресованого оптимізованого С-гена збільшувати вихід ПІВ ЖЛ, клітини, що містили реплікон VEEV, експресуючий Copt, розвивали цитопатогенний ефект (ЦПЕ) і утворювали бляшки при інфікуванні ПІВ ЖЛ. Це зробило ПІВінфекцію в клітинах Copt навіть більш схожою на інфекцію, яку розвиває реплікаційнокомпетентний вірус. Додатковою перевагою використання репліконів VEEV, кодуючих ген Copt ВЖЛ при продукуванні псевдоінфекційного флавівірусу, був рівень безпечності, оскільки здійснені зміни в кодонах зменшували вірогідність гомологічної рекомбінації під дією геному псевдоінфекційного флавівірусу. Більш того, також змінювали порядок циклізації гена Copt (як описувалось тут для зони, що кодує С ВЗН в клітинах BHK(VEErep/C*-E*-Pac)) для зменшення вірогідності рекомбінації, яка продукує реплікаційно-активний С-кодуючий флавівірус. Дотепер ані система ПІВ ЗН, ані система ПІВ ЖЛ, описані тут, не продукували реплікаційно-активних флавівірусів, які можна було б детектувати або в клітинній культурі, або у високочутливих тварин. Крім того, експерименти in vivo показали, що і ПІВ ЖЛ, і ПІВ ЗН були безпечними і не могли викликати жодної хвороби навіть після внутрішньошкірної інокуляції мишам 3-4-денного віку самої високої дози цих псевдоінфекційних вірусів. Тим не менш псевдоінфекційні віруси ЗН були здатні індукувати високі рівні нейтралізуючих антитіл і захищали мишей від інфікування реплікаційно-компетентним ВЗН. Гепатит С, як і СНІД, є головною інфекційною причиною захворюваності та смертності, від якої на сьогодні не існує вакцини. В Японії та Кореї гепатит С навіть перевершує гепатит В у сприянні розвитку злоякісної гепатоми, одного з найбільш розповсюджених типів раку та поширеного виду смерті від хвороби печінки. Така схема, ймовірно, буде ставати все більш типовою в інших азіатських країнах і країніх, що розвиваються, через все більше поширення гепатиту С у поєднанні з ефективною імунізацією проти гепатиту В. В деяких общинах у Єгипті та інших країнах поширеність зараження гепатитом С є типово високою, що, можливо, обумовлено, принаймні частково, традиційною практикою охорони здоров'я та/або застосуванням небезпечних західних технологій у минулому (наприклад, перенесення голкою вірусу під час санітарних заходів, спрямованих проти шистосомозу). У багатьох країнах, що розвиваються, де рівні раку та цирозу печінки є високими, оперативний контроль наявності гепатиту С є недостатнім під час переливання крові. Гепатит С є також головною проблемою охорони здоров'я у Сполучених Штатах, де нараховують приблизно 4 мільйони носіїв вірусу гепатиту С (ВГС), багато з яких ризикують померти від хвороби печінки термінальної стадії або раку печінки. На сьогодні підраховано, що в США від гепатиту С щороку помирає 8000-10000 людей. Ця кількість, вірогідно, збільшиться втричі протягом наступних 10-20 років, що теоретично перевищить кількість смертей від СНІДу за відсутності нових терапевтичних або профілактичних заходів. Незважаючи на це, немає вакцини для профілактики цієї нфекції, а зусилля (і національні, і міжнародні) розробити вакцину є дуже обмеженими через відчутні технічні труднощі, загальну малу зацікавленість у розробці вакцини з боку великих фармацевтичних компаній та інерцію більшості фінансуючих організацій. І, як у випадку з багатьма інфекційними 6 UA 101597 C2 5 10 15 20 25 30 35 40 45 50 55 60 хворобами, саме неблагополучні верстви населення більш за все ризикують отримати серйозну хворобу печінки або померти від гепатиту С. Дотепер спроби створити ефективну вакцину проти ВГС-інфекції були невдалими. Однак протягом останніх кількох років область дослідження ВГС почала швидко розвиватися, і зараз 6 цей вірус реплікується в тканинній культурі до розумно високих титрів, наближаючись до 10 інф.одиниць/кл. Існує ряд очевидних аналогій між геномом ВГС і геномами інших флавівірусів, наприклад ЖЛ, ЯЕ, КЕ та інших вірусів. Тому стратегію розробки реплікаційно-дефектних флавівірусів можна застосовувати не тільки для членів роду Flavivirus, але і роду Hepacivirus (який включає ВГС). Капсидний білок ВГС може продукуватися рекомбінантними альфавірусними репліконами (на основі SINV, VEEV EEEV та інших) в ряді клітинних ліній, в тому числі в клітинах Huh-7 і Huh-7.5, які, як на сьогодні відомо, є чутливими до ВГС-інфекції. Реплікаційно-дефектні геноми ВГС, що не містять капсидного гена, можна трансфектувати у капсид-продукуючі клітинні лінії і пакувати в інфекційні капсидвмісні частинки. Послідовні цикли інфікування, необхідні для серійного виробництва, можна проводити і на цих клітинах. Однак invivo в незаражених гепатоцитах (і, можливо, в інших типах клітин) геноми ВГС, що не мають повного капсидного гена або капсидного гена взагалі, будуть продукуватися тільки неструктурні вірусні білки та глікопротеїни Е1 та Е2. Ці білки будуть представлені імунній системі і) після деградації протеасоми; іі) на клітинній поверхні та ііі) у формі вірусоподібних частинок з оболонкою, що містить Е1 та Е2. Відсутність капсиду зробить вірус нездатним розповсюджуватись і, таким чином, обмеженим до клітин, інфікованих вакцинуючою дозою. Таким чином, даний винахід продемонстрував, що псевдоінфекційні флавівіруси з дефіцитом капсиду і) можуть продукувати інфекцію, що поширюється, в клітинних лініях, експресуючих капсид або всі структурні гени флавівірусу; іі) псевдоінфекційні віруси були нездатні продукувати інфекцію, що поширюється, в нормальних клітинах; ііі) псевдоінфекційні віруси при інфікуванні ними нормальних клітин продукували Е-білок-вмісні субвірусні частинки; iv) псевдоінфекційні віруси виявляли високий рівень безпечності у тваринах; v) псевдоінфекційні віруси захищали мишей від подальшої флавівірусної інфекції. Враховуючи все це, даний винахід показав, що псевдоінфекційні флавівіруси можуть стати безпечною, активною та ефективною платформою для розробки вакцин проти флавівірусних інфекцій та інфекцій, викликаних вірусами, аналогічними флавівірусам. Даний винахід розглядає реплікаційно-дефектні віруси сімейства Flaviviridae, що включають делецію в нуклеотидній послідовності, що кодує капсидний (С) білок таким чином, що ця делеція не перериває РНК-послідовність, необхідну для циклізації геному, сигнальну послідовність для білка prM, необхідну для належного дозрівання prM/M або їхньої комбінації, причому віруси сімейства Flaviviridae реплікуються тільки в клітинах, що експресують С-білок або С, prM, оболонковий білок, мутований С-білок, мутований prM, мутований оболонковий білок або їхню комбінацію, вірусу сімейства Flaviviridae. Зазвичай сімейство Flaviviridae включає вірус, що належить до роду Flavivirus, Hepacivirus, Pestivirus, або інші химери цих вірусів, створені шляхом заміни кластерів prM-E інших вірусів кластерами prM-E псевдоінфекційних вірусів сімейства Flaviviridae. Прикладами вірусів, що належать до роду Flavivirus, можуть бути вірус жовтої лихоманки, вірус Західного Нілу, вірус денге, вірус кліщового енцефаліту, вірус американського енцефаліту, вірус японського енцефаліту, вірус австралійського енцефаліту та інші віруси. Крім того, прикладом вірусу роду Hepacivirus є вірус гепатиту С та інші, а прикладом вірусу роду Pestivirus є вірус діареї великої рогатої худоби, вірус лихоманки свиней, вірус холери свиней та інші. У випадку флавівірусів нуклеотидна послідовність, яка кодує С-білок флавівірусу і яку делетують, може кодувати амінокислоти 26-100 або комбінацію амінокислот в межах кислот 26100 С-білка. Такі комбінації можуть включати (але не обмежуються цим) амінокислоти 26-93, 31100 або 31-93. Фахівці в цій галузі можуть застосовувати ці рекомендації для делетування нуклеотидної послідовності С-білка з інших вірусів сімейства Flaviviridae або інших вірусів, що мають таку саму генетичну структуру. Загальним і придатним для всіх згаданих вірусів є те, що делетований ген заміняють геном, що кодує маркерний білок або антиген. Прикладом маркерного білка може бути зелений флуоресціюючий білок та інші. Даний винахід також розглядає тканинну культуру, що експресує С-білок або С, білок prM, оболонковий білок, мутований С-білок, мутований prM, мутований оболонковий білок або комбінацію цих білків вірусу сімейства Flaviviridae, яка є ефективною для розмноження за відповідних умов вищеописаного реплікаційно-дефектного псевдоінфекційного вірусу сімейства Flaviviridae. Для цього клітини, що експресують білки дикого типу або мутовані білки вірусів сімейства Flaviviridae, можна конструювати за допомогою синтезованих методами генної інженерії репліконів, отриманих з вірусних векторів. 7 UA 101597 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як правило, ген, що кодує білок (білки) вірусу сімейства Flaviviridae, в репліконі заміняють варіантом гена з оптимізованим кодоном, що кодує білок (білки) згаданого вірусу, таким чином, що ця заміна зменшує здатність генів, закодованих в клітинній культурі, рекомбінуватися з геномом псевдоінфекційного вірусу сімейства Flaviviridae та/або збільшує продукування псевдоінфекційного вірусу сімейства Flaviviridae. Наприклад, такі реплікони можуть експресувати С-білок, який включає мутації принаймні в 36 нуклеотидних позиціях гена, що кодує С-білок вірусу сімейства Flaviviridae. Цей реплікон може експресувати С-білок у репліконі, який включає неприродні послідовності циклізації, так що наявність таких послідовностей циклізації зменшує вірогідність продуктивної рекомбінації реплікаційно-дефектного вірусу з природними вірусами. Крім того, реплікон може експресувати білки, що містять змінені нуклеотидні послідовності, які кодують процесовану ділянку з'єднання C-prM таким чином, що наявність таких змінених послідовностей збільшує вихід реплікаційнодефектного псевдоінфекційного вірусу в клітинній культурі, вихід in vivo субвірусних частинок, що містять prM/E, або їхню комбінацію. Крім того, реплікони, що експресують білки вірусів сімейства Flaviviridae, вводять у клітини шляхом трансфекції рибонуклеїновими кислотами (РНК) репліконів, синтезованих in vitro, шляхом трансфекції плазмідними ДНК, сконструйованими для синтезу функціональних альфавірусних репліконів із промоторів, специфічних до клітинної РНК-полімерази II, шляхом інфікування альфавірусними репліконами, упакованими всередині альфавірусних структурних білків. Вірусні вектори, застосовані тут, можуть бути альфавірусами. Ілюстративні приклади таких альфавірусів можуть включати вірус венесуельського енцефаліту коней (VEEV), вірус Синдбіс (ВС), вірус східного енцефаліту коней (EEEV), вірус західного енцефаліту коней (WEEV), вірус лихоманки Ross River та інші. Даний винахід також розглядає спосіб продукування реплікаційно-дефектного вірусу сімейства Flaviviridae, що передбачає: генерування реплікаційно-дефектного вірусу сімейства Flaviviridae, яке включає делецію у капсидному гені таким чином, що ця делеція не перериває РНК-послідовність, необхідну для циклізації геному, сигнальну послідовність для білка prM, необхідну для належного дозрівання prM/M або їхньої комбінації; створення клітинної лінії, яка експресує С-білок або С, prM, оболонковий білок, мутований С-білок, мутований prM, мутований оболонковий білок або їхню комбінацію, вірусу сімейства Flaviviridae, причому ця клітинна лінія забезпечує високі рівні білків, необхідних для розмноження реплікаційного-дефектного псевдоінфекційного вірусу сімейства Flaviviridae; та інфікування клітинної лінії псевдоінфекційним вірусом сімейства Flaviviridae, в результаті чого продукується реплікаційного-дефектний псевдоінфекційний вірус сімейства Flaviviridae. Всі інші аспекти, що стосуються типів вірусів, позиції делецій у капсидному гені, методу створення клітинної лінії, що експресує мутований білок і білок дикого типу вірусу сімейства Flaviviridae, типу репліконів і мутацій в межах цих репліконів, а також модифікацій гена, що кодує мутований білок і білок дикого типу вірусу сімейства Flaviviridae в згаданих репліконах, є такими ж, що і описані вище. Даний винахід також розглядає фармацевтичну композицію, що включає реплікаційнодефектний псевдоінфекційний вірус сімейства Flaviviridae, отриманий способом, описаним вище. Даний винахід також розглядає спосіб захисту суб'єкта від інфекцій, викликаних вірусами сімейства Flaviviridae, який передбачає введення суб'єкту імунологічно ефективної кількості фармацевтичної композиції, описаної тут, яка викликає в організмі суб'єкта імунну реакцію на віруси сімейства Flaviviridae, таким чином захищаючи суб'єкт від інфекцій. Таку композицію можна вводити внутрішньочеревинно, внутрішньошкірно, підшкірно, внутрішньом'язово, перорально або інтраназально. Крім того, суб'єктом, якому може принести користь ця композиція, може бути людина або тварина. Використані в даному описі терміни-іменники, застосовані в однині, можуть означати один або більше. Використані в пунктах формули даного винаходу у поєднані з виразом "що включає" терміни-іменники, застосовані в однині, можуть означати один або більше. Застосовані тут визначення "другий" або "інший" можуть означати принаймні два або більше таких самих або інших елементів або компонентів формули винаходу. Термін "сімейство Flaviviridae" включає роди Flavivirus, Hepacivirus та Pestivirus. Приклади вірусів, що належать до роду Flavivirus, включають вірус жовтої лихоманки, вірус Західного Нілу, вірус денге, вірус кліщового енцефаліту, вірус американського енцефаліту, вірус японського енцефаліту, вірус австралійського енцефаліту та інші віруси. Прикладом вірусу роду Hepacivirus є вірус гепатиту С та інші, а прикладом вірусу роду Pestivirus є вірус діареї великої рогатої худоби, вірус лихоманки свиней, вірус холери свиней та інші. Хоча даний винахід описує структуру та застосуваня реплікаційно-дефектного псевдоінфекційного вірусу сімейства Flaviviridae з роду Flavivirus, фахівці в цій галузі можуть 8 UA 101597 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовувати ці рекомендації для конструювання химер, що включають інші віруси сімейства Flaviviridae, або для конструювання химер шляхом заміни кластерів prM-E вірусів у межах сімейства Flaviviridae або інших аналогічних вірусів у межах сімейства Flaviviridae. Фармацевтичні композиції, що включають псевдоінфекційні віруси сімейства Flaviviridae, описані тут, можна призначати одночасно або послідовно або з іншою фармацевтичною композицією (композиціями). Мета одночасного приймання таких композицій – захистити індивіда від інфекцій, викликаних такими вірусами, та інших хвороб, в лікуванні яких допомагають вакцини. Композицію, описану тут, іншу фармацевтичну композицію або комбінацію композицій можна вводити незалежно, системно або локально, будь-яким методом, стандартним в галузі, наприклад підшкірно, внутрішньовенно, парентерально, інтраперитонеально, інтрадермально, внутрішньом'язово, місцево, ентерально, ректально, через носову порожнину, через рот, вагінально або за допомогою інгаляційного розпилювача, інфузійного насоса-лікарської форми або у формі трансдермального пластиру або імплантата. Лікарські форми описаної тут композиції можуть включати традиційні нетоксичні, фізіологічно або фармацевтично прийнятні носії або наповнювачі, що відповідають способу введення і є добре відомими серед фахівців. Описану тут композицію, іншу фармацевтичну композицію або комбінацію композицій можна вводити незалежно один або більше разів для досягнення, підтримки або поліпшення терапевтичного ефекту. Фахівці знають, як визначати дозу і те, чи відповідна доза з однієї або двох композицій містить одну призначену дозу або декілька призначених доз. Відповідна доза залежить від здоров'я суб'єкта, імунітету індивіда проти флавівірусних інфекцій, способу введення та застосованої рецептури. Далі різні варіанти винаходу описано у вигляді прикладів, які лише ілюструють винахід і ніяким чином його не обмежують. Фахівцям очевидно, що даний винахід призначний вирішити поставлені завдання і досягти цілей, результатів і переваг, визначених тут. Також зрозуміло, що допустимі зміни та інші види застосування, що не виходять за межі об'єму винаходу, визначеного формулою винаходу. ПРИКЛАД 1 Клітинні культури Клітини ВНК-21 були надані Paul Olivo (Washington University, St. Louis, Mo). Їх утримували при 37ºС у мінімальному есенціальному середовищі (аМЕМ), доповненому 10 % фетальною бичачою сироваткою (FBS) та вітамінами. ВОЗ-сертифіковані клітини Vero, з самого початку приготовані для використання у виробництві вакцини для людей, були надані Dr. Steve Whitehead з Національного інституту охорони здоров'я (NIH). Клітини Vero утримували в МЕМ з 6 % вмістом FBS. ПРИКЛАД 2 Плазмідні структурні компоненти Для всіх плазмідних конструкцій застосовували стандартні методи рекомбінантної ДНК. Схематичне зображення застосованих плазмід показане на фіг. 7А–7F. На фіг. 8А–8F представлені генетичні карти та послідовності. Батьківська низькокопійна плазміда pACNR/FLYF-17Dx, що містить інфекційну кДНК геному штаму YFV 17D, була описана у Bredenbeek et al. (2003) і надана Dr. Charles M. Rice (Rockefeller University, New York, N.Y.). Плазміда pYFPIV містила дефектний геном ВЖЛ (YF PIV), в якому фрагмент, що кодує амінокислоти 26-93 капсидного гена ЖЛ був замінений гéном GFP з оптимізованим кодоном, отриманим з pEGFP-N1 (Clontech). Генóм ПІВ ЗН (pWNPIV) синтезували з інфекційної кДНК (Texas 2002) (Rossi et al., 2005) шляхом з'єднання кодону 30 С з кодоном 101 С (фіг. 5А). Плазміди pVEErep/C1/Pac, pVEErep/C2/Pac та pVEErep/C-prM-E/Pac (фіг. 2А) кодували подвійні субгеномні реплікони VEEV, в яких перший субгеномний промотор стимулював транскрипцію РНК, які містили 5′UTR (зону, що не транслюється) РНК 26S вірусу венесуельського енцефаліту коней (VEEV), за якими слідували послідовності, що відповідали нуклеотиди 119-481, 119-541 та 119-2452 геному ВЖЛ, відповідно. Другий субгеномний промотор стимулював експресію гена (Рас) пуроміцинацетилтрансферази, що робило клітини стійкими до трансляційного блокування, викликаного пуроміцином (Pur). Нецитопатичні реплікони VEEV, що експресують кластер C-prME вірусу Західного Нілу {синтезований з реплікону вірусу Sindbis (Scholle et al., 2004)}, з'єднаного з Рас-геном, (кластер позначено pVEErep/C*-E*-Pac), синтезували з нецитопатичного реплікону VEE (Petrakova et al., 2005); Е-кодуючу послідовність з'єднували з Рас-геном за допомогою лінкера, що складався з перших 9 кодонів білка NS1 і останніх 25 кодонів білка NS2B, за якими слідували 2 кодони білка NS3, з'єднані безпосередньо з FMDV 2A (вакциною 9 UA 101597 C2 5 10 15 20 25 30 35 40 45 50 55 60 проти ящура) (фіг. 5А). Послідовності з оптимізованими кодонами, що кодують капсид YFV 17D і перші 20 амінокислот prM, конструювали, використовуючи дані про частоту кодона, описані Haas et al. (1996). Цей ген синтезували методом полімеразно-ланцюгової реакції (ПЛР) з синтетичних олігонуклеотидів, що перекриваються. Ампліфікований фрагмент секвенували перед клонуванням у експресуючі кластери VEErep/Copt/Pac та VEErep/Copt-prM-E/Pac. Останні реплікони мали взагалі таку саму схему, як і pVEErep/C2/Pac та pVEErep/C-prM-E/Pac, але містили послідовність з оптимізованим кодоном, представлену на фіг. 4А. Крім того, також синтезували химерний WN-RepliVAX, що експресує prM-E вірусу ЯЕ. Його конструювали, замінюючи гени prM та Е штаму Накаяма вірусу ЯЕ в A RepliVAX, що кодує геном ВЗН. Генного обміну досягали безпосереднім з'єднанням останнього кодону процесованого С-білка ВЗН з першим кодоном prM, що кодує послідовність вірусу ЯЕ (штам Накаяма). Ту саму стратегію з'єднання застосовували на 3′-кінці кластера, причому кінцевий кодон Е-білка вірусу ЯЕ з'єднували безпосередньо з першим кодоном NS1 вірусу ЗН. Ці з'єднання вводили у ВАС-плазміду, що кодує всю кДНК WN-RepliVAX, з'єднану промотором Т7 і рибозимом, і РНК, видалену з цієї ВАС-ДНК, вводили в клітини BHK(VEErep/Pac-Ubi-C*). Отриманий в результаті RepliVAX (позначений як JE RepliVAX) формував на клітинах BHK(VEErep/Pac-Ubi-C*) осередки інфекції, що розповсюджувалися. Як і у випадку WNRepliVAX, осередки інфекції, сформовані на цій клітинній лінії, є меншими за осередки, продуковані повністю інфікованою химерою WNV–JEV (вірус ЗН – вірус ЯЕ). JE RepliVAX 6 виростає до титрів, приблизно у 10 разів нижчих, ніж WN-RepliVAX, досягаючи титрів більше 10 одиниць/мл у клітинах BHK(VEErep/Pac-Ubi-C*). Як і очікували, JE RepliVAX взаємодіє з ЯЕспецифічними моноклональними антитілами (Mab), і передбачають, що аналогічно химерним флавівірусам JE RepliVAX буде індукувати високі рівні ВЯЕ-нейтралізуючих антитіл і захищати від ЯЕ. ПРИКЛАД 3 РНК-транскрипції Плазміди очищали центрифугуванням у градієнтах CsCl. Перед реакцією транскрипції плазміди лінеаризували рестриктазою XhoI (для pYFPIV) або MhuI (для VEE-реплікону та VEEхелпера, що кодує плазміди), або SwaI (для pWNPIV). РНК синтезували РНК-полімеразою SP6 або T7 у присутності кеп аналога. Вихід і цілісність транскриптів аналізували гельелектрофорезом у неденатуруючих умовах. Аліквотні проби транскрипційних реакцій використовували для електропорації без додаткового очищення. ПРИКЛАД 4 Аналіз РНК-трансфекцій та реплікації ПІВ Електропорацію клітин ВНК-21 здійснювали у відомих умовах (Liljestrom et al., 1991). Для стабілізації пакувальних клітинних культур у середовище додавали Pur до концентрації 10 г/мл після 24 годин електропорації репліконів VEEV. Трансфекцію геному синтезованого in vivo ПІВ ЖЛ здійснювали через 5 днів, коли клітини, що містили реплікони, поновили ефективний ріст. Проби збирали у моменти часу, позначені на фігурах, шляхом заміни середовищ такими самими, але з вмістом Pur. В багатьох експериментах ПІВ-секретуючі клітини розділяли при досягненні конфлуентності. Реплікони VEEV пакували в інфекційні віріони VEEV шляхом ко-електропорації синтезованого in vivo реплікону і 2 хелперних РНК (Volkova et al., 2006) у клітини ВНК-21. Реплікон-вмісні вірусні частинки збирали через 24 години після трансфекції і використовували для інфікування незаражених клітин ВНК-21, після чого проводили Pur-селекцію. Щодо ПІВ ЗН, то РНК синтезованого in vitro ПІВ трансфектували в клітини ВНК-21, що містили реплікон VEErep/C*-E*-Pac, який експресує С, prM та Е вірусу ЗН і Рас [BHK(VEErep/C*-E*-PAC)-клітини]. Схема геному VEErep/C*-E*-PAC представлена на фіг. 5А. Зібрані псевдоінфекційні віруси пасирували на цих клітинах стандартними методами (Rossi et al., 2005). ПРИКЛАД 5 Вимірювання титрів ПІВ ЖЛ Для вимірювання титрів вивільненого ПІВ ЖЛ клітини ВНК-21 висівали у 6-лункові 5 планшети ф.”Costar" при концентрації 5×10 клітин на лунку. Через 4 години клітини інфікували різними концентраціями упакованих репліконів і після 1 години інкубації при 37ºС в CO2інкубаторі з 5 % СО2 їх покривали 2 мл середовища МЕМ з 10 % вмістом FBS. Ці кількості інфікованих клітин оцінювали, підраховуючи GFP-позитивні клітини під інвертованим УФ мікроскопом. Частку інфікованих клітин з висіяної кількості визначали методом рахування флуоресціюючих клітин на визначеній площі мікроскопічного поля. Підраховані кількості для 5 10 UA 101597 C2 5 10 різних полів усереднювали і перераховували на титр, що відповідав кожній наступній концентрації. В останніх експериментах титри також вимірювали шляхом аналізу бляшкоутворення на моношарах клітин ВНК-21, що несли реплікон VEErep/Copt-prM-E/Pac, забезпечуючи відомі умови (Lemm et al., 1990), з тією різницею, що клітини інкубували під агарозою для утворення бляшок упродовж 5 днів, потім фіксували 2,5 % формальдегідом і забарвлюваликристалічним фіолетовим. ПРИКЛАД 6 Пасирування псевдоінфекційних вірусів ЖЛ Пакувальні клітинні лінії стабілізували або трансфекцією РНК синтезованих in vitro репліконів VEEV або інфікуванням клітин тими самими репліконами, упакованими у структурні білки VEEV при множинності інфікування (MOI) 10 інф.д./кл. Після Pur-селекції їх інфікували ПІВ ЖЛ при різних MOI. Проби збирали у моменти часу, позначені на фігурах, шляхом заміни середовищ. 15 20 25 30 35 40 45 50 55 60 ПРИКЛАД 7 Аналіз продукування субвірусних частинок ЖЛ 6 Клітини ВНК-21 висівали при концентрації 5×10 на 100-мм планшет. Після 4 годин інкубації при 37ºС клітини інфікували ПІВ ЖЛ при MOI 10 інф.д./кл, і потім інкубували ще 24 години в 10 мл середовища МЕМ з 10 % вмістом FBS. Потім це середовище заміняли 10 мл безсироваткового середовища VP-SF (Invitrogen), яке заміняли кожні 24 години для аналізу вивільнення субвірусних частинок (СВЧ). Зібрані проби VP-SF освітлювали низькошвидкісним центрифугуванням (5000 об/хв, 10 хв, 4ºС) і потім концентрували ультрацентрифугуванням через 2 мл 10 % сахарози, приготованої на фосфатно-сольовому буфері (ФСБ), в роторі SW-41 при швидкості 39000 об/хв, при 4ºС протягом 6 годин. Матеріал осаду розчиняли у завантажувальному буфері для електрофорезу у поліакриламідному гелі з додецилсульфатом натрію, без b-меркаптоетанолу (для збереження зв'язування з MAB D1-4G2), і потім аналізували вестерн-блотингом. Післе переносу білка нітроцелюлозні мембрани обробляли MAB D1-4G2 та вторинними ослячими антимишиними антитілами, кон'югованими з пероксидазою хріну (HRP), придбаними у ф.”Santa Cruz Biotechnology". HRP детектували за допомогою реактиву люмінолу для Вестерн-блотингу, дотримуючись рекомендацій виробника (Santa Cruz Biotechnology). Для 8 отримання позитивної контрольної проби ВЖЛ (2×10 бляшкоутворюючих одиниць (БУО)) піддавали ультрацентрифугуванню через 10 % сахарозний градієнт, як описувалось вище для субвірусних частинок (СВЧ). Для аналізу СВЧ ВЖЛ клітини ВНК-21 піддавали електропорації РНК геному синтезованго in vitro ПІВ ЖЛ. Через 24 години рісля трансфекції, повне середовище MEM заміняли середовищем VP-SF, яке збирали 24 потóму. В цей час більше 95 % клітин були GFPпозитивними і не виявляли ніяких ознак ЦПЕ. Зібрану пробу освітлювали низькошвидкісним центрифугуванням (5000 об/хв, 10 хв, 4ºС) і потім концентрували центрифугуванням всю ніч в роторі SW-28 при 25000 об/хв та 4ºС. Отриманий осад суспендували у буфері (10 нм Tris HCl (pH 7,5), 100 мМ NaCl, 0,1 % BSA (бичачий сироватковий альбумін)), і далі аналіз проводили, як описано Schalich et al. (1996). Стисло, 0,5 мл-проби завантажували у переривистий сахарозний градієнт (1,5 мл 50 %, 1,5 % 35 % та 1,5 % 10 % сахарози, приготованої у ФСБ). Центрифугування здійснювали в роторі SW-28 при 45000 об/хв, 4ºС упродовж 1 години в центрифузі Optima MAX (Beckman). Осади розчиняли у завантажувальному буфері для електрофорезу у поліакриламідному гелі з додецилсульфатом натрію, без b-меркаптоетанолу (для збереження зв'язування з MAB D14G2), і потім аналізували вестерн-блотингом. Післе переносу білка нітроцелюлозні мембрани обробляли MAB D1-4G2 та вторинними ослячими антимишиними антитілами, кон'югованими з пероксидазою хріну (HRP), придбаними у ф.”Santa Cruz Biotechnology". HRP детектували за допомогою реактиву люмінолу для Вестерн-блотингу, дотримуючись рекомендацій виробника 8 (Santa Cruz Biotechnology). Паралельний градієнтний аналіз проводили з ВЖЛ (2×10 БУО) за такою самою процедурою, що описана для СВЧ, синтезованих з ПІВ ВЖЛ. ПРИКЛАД 8 Аналіз ПІВ ЗН Титри ПІВ ЗН визначали шляхом інфікування моношарів клітин Vero послідовними концентраціями вірусу, наступного фіксування 24 години потóму та імуногістохімічного забарвлювання мишиною поліклональною гіперімунною асцитною рідиною, специфічною до ВЗН, як описувалось раніше (Rossi et al., 2005). Інфіковані клітини нумерували і 11 UA 101597 C2 5 10 використовували для визначення титру. Для оцінки здатності ПІВ ВЗН утворювати осередки інфекції на клітинах Vero або на клітинах BHK(VEErep/C*-E*-PAC) моношари інфікували концентраціями ПІВ ЗН, покривали напівтвердим верхнім шаром трагаканту, інкубували при 37ºС і потім фіксували та забарвлювали моноклональним антитілом, специфічним до білка NS1 вірусу ЗН (наданим E.Konishi, Kobe, Japan), як описувалось вище. ПРИКЛАД 9 Дослідження безпечності ПІВ Безпечність ПІВ визначали інокуляцією різних доз вірусу (YFV 17D або WNV TX02, вилучених з батьківських інфекційних кДНК) або ПІВ мишам 3-4-денного віку (схрещених Swiss Webster, Harlan) інтракраніально (об'єм 20 мл) або самицям мишей віком 4-5 тижнів (аутбредні, Swiss Webster, Harlan) інтраперитонеально (об'єм 100 мл). За мишами спостерігали 14 днів, відмічаючи ознаки хвороби та смерть; тварин, які агонювали і не мали шансу дожити до наступного дня, гуманно умертвляли і ставили відмітку "мертва" наступного дня. 15 20 25 30 35 40 45 50 55 60 ПРИКЛАД 10 Дослідження активності та ефективності ПІВ ЗН Вибраних тварин, інокульованих ПІВ ЗН, як описувалось вище, умертвляли і випускали кров через 21 день після інокуляції. Збирали сироватки тварин, об'єднували в пул і тестували на здатність відновлювати утворення осередків ВЗН на моношарах клітин Vero, використовуючи вищеописані методи. Решту тварин інокулювали 1000 інф.д. (визначеними аналізом на утворення осередка інфекції на клітинах Vero), що відповідало 100 LD50 штаму NY99 вірусу ЗН (Xiao et al., 2001), і за тваринами спостерігали ще 14 днів, як описано вище. ПРИКЛАД 11 І С-еспресуючий кластер ВЖЛ, і C-prM-E-експресуючий кластер ВЖЛ можуть комплементувати реплікацію ПІВ ВЖЛ Загальна стратегія комплементації дефекту С-делеції у флавівірусному геномі представлена на фіг. 1. Вона базується на розвиненні геномів без С-гена і розмноженні цих псевдоінфекційних вірусних геномів (ПІВ-геномів) в С-експресуючих клітинах (або всіх вірусних струтурних білках), але не в нормальних клітинах. Реплікація в нормальних клітинах, що не продукують вірусних структурних білків, необхідних для транс-комплементації дефекту в геномі ПІВ, веде до вивільнення СВЧ, що містять дуже важливий захисний імуноген Е, але не мають нуклеокапсиду, який містить С і вірусний генетичний матеріал. Синтезували рекомбінантній геном ВЖЛ, який містив GFP замість амінокислот 26-93 С, клонованих всередині рамки зчитування разом з рештою поліпептиду (Фіг. 2А). Експресія GFP забезпечувала зручний спосіб визначення титрів геном-вмісних псевдоінфекційних вірусів у експериментах. Очікували, що делеція С-кодуючої послідовності із цього ПІВ-геному, позбавить С здатності утворювати функціональний нуклеокапсид, але не очікували, що це вплине на продукування функціональних форм prM та Е. Отже, клітини, експресуючі цей геном, які продукували GFP-флуоресценцію, не могли вивільняти інфекційного вірусу. Однак продукування інфекційного потомства очікували від "пакувальних" клітин, експресуючих високі рівні С. Для швидкого формування клітинних ліній для ефективного продукування ПІВ застосовували систему (реплікони) експресії на основі геному вірусу венесуельського енцефаліту коней (VEEV). VEEV-реплікони є менш цитопатичними, ніж реплікони, синтезовані з інших альфавірусів, і швидко стабілізують персистуючу реплікацію в деяких клітинних лініях хребетних тварин і комах. Полігенні експресуючі кластери конструювали у вигляді двох субгеномних структурних компонентів (фіг. 2В), в яких один з субгеномних промоторів стимулював експресію Рас, забезпечуючи ефективний засіб ліквідувати в трансфектованих культурах клітини, що не містили Рас-експресуючого реплікону VEEV. Другий субгеномний промотор стимулював транскрипцію субгеномної РНК, що кодує структурні білки ВЖЛ. Для ідентифікації найбільш ефективних пакувальних кластерів реплікони VEEV, що кодували або і) YFV C з сигнальним пептидом prM, також відомий як якірний С (Linden and Rice, 2001) (VEErep/C1/Pac), або іі) С з сигнальним пептидом і 20 амінокислотами prM (VEErep/C2/Pac), або ііі) всі структурні білки ВЖЛ (VEErep/C-prM-E/Pac), основа схеми повинна була зберігати сигнальний пептид у С-кодуючих кластерах, чого, як очікували, буде достатньо для цільової доставки C у відповідний клітинний простір. РНК синтезованих in vitro репліконів VEEV трансфектували у клітини ВНК-21, і стійкі до ® Pur клітинні лінії селектували протягом наступних 4-5 днів у Pur-вмісному середовищі. 12 UA 101597 C2 5 10 15 20 25 Упродовж перших 2-3 днів після трансфекції реплікація РНК, синтезованих з VEEV, викликала збільшення блокування росту, потім, як вже описувалось (Petrakova et al., 2005), реплікація ® ставала менш ефективною, і клітини відновлювали свій рост. Отримані Pur -культури трансфектували рибоеуклеїновими кислотами (РНК) синтезованих in vitro ПІВ ЖЛ, і в різні моменти часу після трансфекції визначали титри вивільнених інфекційних частинок, що містили GFP-експресуючі геноми (фіг. 2С). Як не дивно, наявність двох різних РНК, що реплікуються, (YFV- та VEEV-специфічних), у клітинах ВНК-21 не призвела до цитопатогенного ефекту (ЦПЕ), і клітини зберігали і стійкість до Pur, і експресію високого рівня GFP, що вказувало на реплікацію і реплікону VEEV, і РНК ПІВ ЖЛ. Як показано на фіг. 2С, культури, що експресували обидва ці маркерні гени, були здатні рости і потребували субпасирування (при співвідношенні ~1:5 кожні 4 дні), щоб уберегти культури від конфлуентності. Експерименти, проілюстровані на фіг. 2, показали, що всі три реплікони VEEV були здатними постачати YFV C на рівнях, достатніх для формування інфекційних ПІВ; інфекційні частинки не вивільнялись з незаражених клітин ВНК21, трансфектованих РНК псевдоінфекційного вірусу ЖЛ за відсутності репліконів VEEV (дані не наведені). Однак клітини, що експресували ці пакувальні кластери, відрізнялися за своєю здатністю продукувати ПІВ. Структурні компоненти, експресуючі YFV C, за якими слідував сигнальний пептид prM (якірний С; VEErep/C1/Pac), показали найнижчий рівень пакування РНК ПІВ ЖЛ порівняно з кластерами, експресуючими довші білкові послідовності. Причина такої низької ефективності пакування структурним компонентом С1 – неясна, але цей феномен, можливо, пояснюється необхідністю у специфічному алгоритмі розщеплення на двох сусідніх сайтах розщеплення (NS2B/NS3 і сигнальній пептидазі) (Yamschikov and Compans, 1994) та/або відмінностями у розподілі/стабільності С-білка, продукованого в цих двох різних оточеннях, або стабільністю цього білка. Таким чином, після цих експериментів VEErep/C1/Pac був виключений із всіх подальших експериментів. Два реплікони, VEErep/C2/Pac та VEErep/C-prM-E/Pac, 7 пакували ПІВ ЖЛ до аналогічних титрів, що досягали більше 10 інф.д./мл. Більш того, вивільнення частинок ПІВ тривало до кінця експериментів, при цьому кожна клітина вивільняла ~20 інфекційних ПІВ ЖЛ за кожний 24-годинний період. Ті самі клітини, вірогідно, також вивільняли СВЧ, що містили prM/E, але не містили нуклеокапсиду і геному, але цю вірогідність не досліджували. 30 35 40 45 50 55 60 ПРИКЛАД 12 Псевдоінфекційні віруси ЖЛ з дефектними геномами можна продукувати у промисловому масштабі Кінцева застосовність ПІВ як кандидатів у вакцину залежить від здатності продукувати ці частинки у необхідних масштабах, наприклад, для промислового виробництва. Розрахунок на систему транс-комплементації (реплікони VEEV) на основі РНК для виробництва вакцини потребує подальшої стандартизації, оскільки вірогідність накопичення мутацій в гетерологічних генах, клонованих в геноми РНК-вірусів. Використання клітинних ліній з короткочасним пасируванням є одним з рішень для подолання такого обмеження. Як варіант, накопичення мутацій в геномах VEErep можна мінімізувати багаторазовою трансфекцією реплікону в незаражені клітини або продукуванням упакованих VEEV-репліконів з наступним інфікуванням незаражених клітин. Використання упакованих VEE-репліконів вважали простим і ефективним засобом стабілізації пакувальних клітинних ліній. Для ефективного продукування псевдоінфекційних вірусів застосовували технологію, яка дає можливість продукувати клітинні культури, що експресують реплікон альфавірусу, у попередньо упакованих VEEV-репліконах. Стисло, VEEV-реплікони пакували в інфекційні віріони VEEV за допомогою вищеописаної двохелперної системи (Volkova et al., 2006), у 9 препарати, які містили титри приблизно 10 інф.д./мл. Клітини ВНК-21, інфіковані цими частинками і селектовані у присутності Pur, можна було застосовувати для отримання структурного білка ВЖЛ, що кодує клітинні культури, через 3-5 днів. Після стабілізації клітинні лінії, що містили VEErep/C2/Pac та VEErep/C-prM-E/Pac, інфікували попередньо генерованими пробами псевдоінфекційних вірусів ЖЛ при високій (10 інф.д./кл.) та низькій (0,1 інф.д./кл.) множинностях інфікування. У всіх випадках дефектні віруси ЖЛ реплікувалися продуктивно (фіг. 3) та інфікували всі клітини в моношарах, продукуючи високі титри псевдоінфекційних вірусів. Отже, стабілізація пакувальних клітинних ліній шляхом інфікування клітин з упакованими VEEVрепліконами з наступним інфікуванням псаевдоінфекційними вірусами виявляється простою та ефективною системою великомасштабного продукування псевдоінфекційних вірусів з делетованою С-послідовністю в геномі. ПРИКЛАД 13 13 UA 101597 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПІВ ЖЛ з VEE-репліконами, експресуючими форму гена С ВЖЛ з оптимізованим кодоном Іншою можливою проблемою при використанні пакувальних систем для підтримки реплікації дефектних вірусів є рекомбінація між дефектними вірусними геномами та РНК, що кодують транс-комплементуючий ген(и). Така рекомбінація може призвести до генерації інфекційних вірусів. В описаних тут експериментах інфекційні віруси ЖЛ ніколи не детектували аналізом бляшкоутворення, але було необхідно виключити вірогідність того, що в цих клітинах може утворитися живий вірус. Крім того, припускають, що білки, кодовані багатьма арбовірусами, еволюціонували до використання трансляційного механізму у двох дуже різних хазяях. Отже, використання їхнього кодону не вважають оптимальним для експресії у будь-якому хазяїні. Тому С-кодуючу послідовність у полігенному експресуючому кластері модифікували для досягнення двох цілей: і) збільшити вихід С-продукування та іі) зменшити вірогідність гомологічної рекомбінації між геномом ПІВ ЖЛ та С-кодуючою субгеномною РНК репліконів VEE. Ген С ВЖЛ (YFV C) синтезували, використовуючи частоту кодону, виявлену у найбільш ефективно трансльованих генах ссавців (фіг. 4А). Ці мутації, що мовчать, також розривали послідовність циклізації, необхідну для реплікації флавівірусного геному, таким чином зменшуючи ймовірність генерування реплікаційно-компетентного ВЖЛ в акті рекомбінації між геномом ПІВ ЖЛ та YFV С-кодуючою РНК репліконів VEEV. Ген Copt клонували в структурні компоненти VEErep, VEErep/Copt/Pac та VEErep/CoptprM-E/Pac, застосовуючи ту саму стратегію, що і для VEErep/C2/Pac та VEErep/C-prM-E/Pac, і транс-компленментуючі Pur клітинні лінії стабілізували або РНК-трансфекцією, або інфікуванням цих клітин упакованими РНК. Трансфекція цих клітин РНК геному синтезованого in vitro ПІВ продукувала ПІВ з ефективністю, аналогічною ефективності, якої досягали при використанні клітин, експресуючих VEEV-реплікони, які експресували неоптимізований ген С ВЖЛ (фіг. 4В). Однак клітини, що експресували С з оптимізованим кодоном, виявились корисним реагентом, в якому вони були здатні розвивати ЦПЕ і утворювати чіткі видимі бляшки при інфікуванні ПІВ ЖЛ та покриванні агарозою, що містила середовище з низькою концентрацією FBS (фіг. 4С). Таким чином, хоча оптимізація кодону гена С ВЖЛ не змінила ПІВпродукування в цих клітинах, клітини, що експресують ген С ВЖЛ з оптимізованим кодоном, являють собою дуже корисну систему для оцінки ПІВ ЖЛ, особливо ті, що не експресують флуоресцентні маркери. У додаткових тестах спостерігали дуже добру кореляцію між титрами одних і тих самих проб, визначених при аналізі бляшкоутворення та аналізі на GFP-осередки. Бляшки, утворені ПІВ ЖЛ, були аналогічними бляшкам ВЖЛ, що вказує на те, що структурні білки, скоріш за все, продукувалися в цис-функції більш ефективно при утворенні вірусних частинок. Причина набуття здатності утворювати бляшки ще до кінця зрозуміла. Однак припускають, що ген С ВЖЛ має певний рівень цитотоксичності через клітинні лінії, що містять VEEV-реплікони, експресуючі варіант цього білка з оптимізованим кодоном, який показав нижчі швидкості росту, ніж відповідні аналоги з репліконом, кодуючим природний ген С. Отже, реплікація геному ПІВ ЖЛ, можливо, призвела до додаткових змін у внутрішньоклітинному середовищі, достатніх, щоб спричинити ЦПЕ. ПРИКЛАД 14 Псевдоінфекційні віруси можна генерувати з інших флавівірусів Щоб довести, що ПІВ можна легко генерувати з інших флавівірусів, вищеописану стратегію застосували для вірусу Західного Нілу (ВЗН). Для цього синтезували генóм ПІВ ВЗН з С-білком довжиною 35 амінокислот (фіг. 5А). Для пакування цього геному ПІВ ВЗН використовували пакувальну клітинну лінію, створену шляхом трансфекції клітин ВНК-21 нецитопатичним VEEV-репліконом, експресуючим C/prM/E ВЗН та Pac [BHK(VEErep/C*-E*-Pac)]. Для мінімізації вірогідності того, що рекомбінація між геномами ПІВ ВЗН в цій клітинній лінії та С-білком, кодованим РНК VEErep, зможе призвести до генерації інфекційного ВЗН, ген, що кодує С-білок ВЗН у VEEV-репліконі, модифікували таким чином, щоб він містив кластермутації, що мовчать, у домені циклізації ВЗН. Середовища, зібрані з клітин BHK(VEErep/C*-E*-Pac), трансфектованих синтетичним геномом ПІВ ЗН, були здатні продукувати антиген-позитивні осередки в пакувальних клітинах (фіг. 5В), що вказує на утворення інфекційного ПІВ ЗН. Однак тільки антиген-позитивні клітини були виявлені після інфікування моношарів клітин Vero тими самими пробами (фіг. 5С). На 8 пакувальних клітинах продукувалися титри до 1×10 інф.д./мл ПІВ ЗН, і, як і очікували, ПІВ ЗН міг багаторазово передаватися на цій клітинній лінії. Отже, при використанні стабілізованої клітинної лінії можна легко отримувати лінії з високими титрами ПІВ ЗН, застосовуючи ту саму систему комплементації, описану вище для ВЖЛ. Цікаво, що у випадку ВЗН-пакувальної 14 UA 101597 C2 клітинної лінії та ПІВ ЗН спостерігали, що цей вірус дає результат повільно, наприкінці зараження, одночасно з виникненням ЦПЕ (результати не показані), тоді як клітини, що кореплікують генóм ПІВ ЖЛ і VEEV-реплікони, продовжують продукування ПІВ упродовж багатьох днів (фіг. 2). 5 10 15 20 25 30 35 40 45 ПРИКЛАД 15 Клітини, інфіковані псевдоінфекційними вірусами ЖЛ або ЗН, продукують субвірусні частинки Щоб продемонструвати, що клітини, інфіковані псевдоінфекційними вірусами, продукують субвірусні частинки (СВЧ), клітини ВНК-21 або трансфектували РНК синтезованого in vitro ПІВ ЖЛ, або інфікували псевдоінфекційними вірусами ЖЛ, продукованими в Секспресуючих клітинах. Частинки, вивільнені з клітин ВНК-21, очищали ультрацентрифугуванням і аналізували вестерн-блотингом, використовуючи мишине моноклональне антитіло (МАВ), специфічне до Е, D1-4G2 (Genry et al., 1982). І РНКтрансфектовані, і ПІВ-інфіковані клітини продукували Е-білок, який можна було осаджувати з середовищ центрифугуванням (фіг. 6А), що показувало його присутність у дисперсній формі. Оскільки ці частинки не виявляли ЦПЕ, а проби освітлювали при низькошвидкісному центрифугуванні перед ультрацентрифугуванням, малоімовірно, що Е-білок, детектований в осадженій фракції, являв собою продукт розкладу клітин. Аналогічним чином, вестерн-блот аналіз показав, що клітини Vero, інфіковані ПІВ ЗН, продукували (перед виявленням будь-яких ознак ЦПЕ) позаклітинні форми Е, які за розміром не можна було відрізнити від форм, продукованих ВЗН-інфікованими клітинами Vero (фіг. 6В). Для подальшої оцінки фізичної природи Е-білка, вивільненого ПІВ-інфікованими клітинами, середовища, зібрані з клітин, що містили ПІВ-геноми, які реплікувалися, лише піддавали аналізу у градієнті щільності сахарози згідно з опублікованими даними (Schalich et al., 1996). СВЧ були виявлені у фракції з 2 % вмістом сахарози (фіг. 6С). У тому ж експерименті ВЖЛ-віріони показали високу щільність і були детектовані у фракції з 42 % вмістом сахарози. Частинки, що містили Е-білок і мігрували при очікуваному розмірі СВЧ ВЗН, також детектували в культурах, інфікованих псевдоінфекційними вірусами ЗН. Наявність Е в середовищах ПІВінфікованих клітин відповідала продукуванню субвірусних частинок клітинами, експресуючими лише prM/E або РНК-вакцинами проти вірусу кліщового енцефаліту, які не мали функціонального С-гена. ПРИКЛАД 16 Безпечність, активність і ефективність ПІВ для тварин Безпечність пісевдоінфекційних вірусів ЗН та ЖЛ визначали шляхом внутрішньошкірної інокуляції мишиних виводків 3-4-денного віку. Дослідження показали, що миші, інокульовані ВЗЛ або ВЗН дикого типу, швидко вмирали, і кількість цих вірусів, яка являла собою середню смертельну дозу (LD50) для цих тварин, становила приблизно 1 бляшкоутворюючу одиницю (БУО) (Таблиця 1). Однак псевдоінфекційні віруси ЗН та ЖЛ, введені мишатам-сисункам в дозі 6 2×10 інф.д., не вбили жодної миши (Таблиця 1). Безпечність потім підтвердили інтраперитонеальною інокуляцією дорослих мишей вірусами дикого типу і ПІВ ЗН. Ці дослідження показали, що ПІВ ЗН були абсолютно безпечними для дорослих мишей (Таблиця 2). Більш того, ВЗН дикого типу вбив значну частину дорослих мишей, при LD50 менше 1 БУО, а 6 дози до 3×10 інф. д. ПІВ ЗН не спричинили жодної смерті (Таблиця 2). Найбільш цікавим, однак, стало відкриття, що ПІВ ЗН були дуже активними імуногенами (нейтральні титри 4 детектували при інокуляції 30000 інф.д.), і 100 % тварин, вакцинованих дозами 3×10 інф. д., 5 6 3×10 інф. д. або 3×10 інф. д., було захищено від контрольного зараження 100 LD50 штаму NY99 ВЗН (Таблиця 2). 50 55 60 15 UA 101597 C2 Таблиця 1. Безпечність псевдоінфекційних вірусів (ПІВ) для мишат-сисунків Інокуляція а Доза (інф.д.) ПІВ ЗН ВЗН ТХ02 ВЗН ТХ02 ВЗН ТХ02 ВЗН ТХ02 ПІВ ЖЛ ВЖЛ 17D ВЖЛ 17D ВЖЛ 17D ВЖЛ 17D b Виживаність (%) 2 000 000 0,2 2 20 200 2 000 000 0,2 2 20 200 с 100 (9/9) 56 (5/9) 0 (0/9) 0 (0/8) 0 (0/10) 100 (10/10) 89 (8/9) 56 (5/9) 11 (1/9) 0 (0/12) Середня тривалість d виживання e NA 8,5 (+/– 2,9) 5,4 (+/– 0,5) 6 (+/– 0) 4,9 (+/– 0,3) e NA 8 (+/– 0) 7 (+/– 0) 6,9 6 (+/– 2,4) 6 (+/– 0) a Препарат, який вводили, розбавлений в культуральному середовищі з 10 % FBS. Вводили внутрішньошкірно в об'ємі 20 мл/тварину. с Виживаність через 14 днів після інокуляції (живі/мертві). d Середня тривалість виживання, виходячи з того, що тварини померли від зараження (стандартне відхилення). e NA – неприйнятно для даного випадку. b 5 10 Таблиця 2 Безпечність, активність і ефективність ПІВ для дорослих мишей Інокуляція а Не робили (розріджувач) ПІВ ЗН ПІВ ЗН ПІВ ЗН ВЗН ТХ02 ВЗН ТХ02 ВЗН ТХ02 Доза (інф.д.) 0 30 000 300 000 3 000 000 1 10 100 b Середня тривалість d виживання g NA Виживаність с (%) 100 (8/8) 100 (10/10) 100 (10/10) 100 (10/10) 40 (4/10) 8 (+/– 1,2) 30 (3/10) 25 h 1:40 1:160 1:160 f 14 (1/7) 100 (8/8) 100 (8/8) 100 (8/8) Препарат, який вводили, розбавлений в культуральному середовищі з 10 % FBS. Вводили інтраперитонеально в об'ємі 100 мл/тварину. с Виживаність через 14 днів після інокуляції (живі/мертві). d Середня тривалість виживання, виходячи з того, що тварини померли від зараження (стандартне відхилення). e Нейтральний титр змішаних сироваток від 2 тварин через 21 день після інокуляції (показаний титр являє собою найбільше розбавлення, що дає 80 % зменшення утворення осередків ВЗН). f Захист від контрольного зараження 100 LD50 штаму NY99 ВЗН, продемонстрований виживанням через 14 днів після контрольного зараження; одна тварина, що вижила, з групи інокульованих розріджувачем, виявила ознаки хвороби (згорблена спина, здиблена шерсть і тривога) у b 20 uGC (S>C) у позиції Р4 перед сайтом розщеплення сигнальної пептидази (S(c)VGA|VTLS (SEQ ID NO: 4) в геномі RepliVAX. Друга мутація, яка була присутня лише в 30 % ампліфікованих послідовностей (знову в реакціях, здійснюваних в обох напрямках), складалася з AAG>AuG (K>M) у позиції Р3 після сайту розщеплення NS2B/NS3 (QKKR|GGK(m)T) (SEQ ID NO: 5). Хоча ці мутації знаходяться в позиції делетованого SL5, вони не змінюють прогнозованих структур РНК. Швидка селекція (тільки 10 ростових циклів) RepliVAX, що краще росте, є дуже обнадійливою, оскільки вона показує, що селекція варіантів, які краще ростуть, є ефективним способом удосконалення RepliVAX. Позиції цих мутацій не були несподіваними, оскільки відомо, що альтеруюча ефективність NS2B/NS3 по відношенню до розщеплення сигнальної пептидази може впливати на вихід флавівірусних частинок та інфекційність (Keelapang et al., 2004; Lee et al., 2000; Lobigs and Lee, 2004; Yamschikov et al., 1997). Тривають дослідження з селекції варіантів, що навіть краще ростуть, і ці дві мутації 17 UA 101597 C2 5 10 15 20 25 30 35 40 45 50 55 60 націлюють на вставляння в структурні компоненти RepliVAX другого покоління, для підтвердження своєї здатності працювати окремо (або разом) для поліпшення виходу RepliVAX і продукування антигенів. Тим не менш, наведені тут дані показують, що за цих умов пасирування: 1) не відбувається рекомбінації; 2) позитивну селекцію можна використовувати для продукування удосконалених RepliVAX. Сліпий пасаж RepliVAX ЯЕ аналогічним чином давав на виході варіанти, що краще ростуть, з мутаціями в тих самих ділянках геному. Здатність продуктів RepliVAX до сліпого пасажу для продукування варіантів, що краще ростуть, є ключовою ознакою даного винаходу і явною перевагою над традиційним лімфаденопатичним вірусом (LAV), де продукування варіантів, що краще ростуть, завжди ускладнюється занепокоєнням, що ці варіанти, що краще ростуть, можливо втратили свою атенюацію у людини. Крім того, мутований, удосконалений С-експресуючий полігенний кластер (VEErep/Pac-UbiC*), який показав себе стабільним і продемонстрував відсутність рекомбінації при використанні у клітинній лінії ВНК (не схваленій для генерування вакцини для людини), також показав себе стабільним і корисним для розмноження ПІВ при введенні в клітини Vero (дозволена клітинна лінія для виробництва вакцин для людини). Зокрема, РНК, які відповідають VEE-реплікону, вводили в клітини Vero з сертифікованого посіву, використовуючи ті самі методи, що і для ВНКклітин. Після введення РНК в ці клітини Vero останні утримували у безсироватковому середовищі (важливий момент для приготування вакцини), що містило пуроміцин, і ці клітини показали себе корисними для розмноження ПІВ. В таких умовах розмноження ці клітини продукували трохи нижчі титри ПІВ, ніж синтезовані аналогічним чином ВНК-клітини, але клітини VEErep/Pac-Ubi-C*-Vero витримували краще такі умови культивування, даючи можливість багаторазово збирати "урожай". На фіг. 11 показане продукування ПІВ за допомогою таких клітин, яке дає можливість багаторазово збирати "урожай" у безсироваткових умовах. Таким чином, розмноження ПІВ у клітинних лініях, що експресують С (особливо С-кластери, що містять сигнальну послідовність prM, або цю зону плюс ділянки генів prM i E), теоретично можуть рекомбінуватися з ПІВ-геномом, продукуючи живий вірус, який міг би викликати хворобу, що збільшує ризикованість методу виготовлення вакцини. Для вирішення цієї проблеми даний винахід показав, що клітинні лінії для розмноження ПІВ ЗН можна продукувати за допомогою Сбілка, який закінчується точно біля сайта розщеплення NS2B/NS3, що мінімізує ймовірність рекомбінації в цій зоні ПІВ-геному і забезпечує перевагу над іншими методами розмноження, в яких клітинні лінії кодують РНК, які кодують ділянку якірного С (відомого також як сигнальний пептид prM), які є спільними для ПІВ. Для подальшого підвищення безпечності згаданого С-експресуючого полігенного кластера даний винахід показав, що ділянка цього кластера, яка використовується для VEErepкодованого С, який комплементує ПІВ-геном (а саме перші 30 кодонів, що кодують амінокислотну послідовність і необхідні для продукування ПІВ-геному, що реплікується, завдяки розташованим нижче РНК-елементам, необхідним для вірусної реплікації), може специфічно мутувати і створювати кластер, який відрізняється від ПІВ-геному у 36 нуклеотидних позиціях (введених без зміни білкового продукту), в результаті чого С-ген має набагато меншу вірогідність рекомбінації з ПІВ-геномом (фіг. 9). Більш того, цей мутований С-ген створювали з трьома мутаціями в сигналі циклізації (СS), який має бути комплементарним до СS в 3′UTR ПІВгеному для надання можливості вірусної реплікації, що забезпечує додаткову ознаку безпечності для запобігання рекомбінації (фіг. 9). І нарешті, цей С-ген вставляли у VEEреплікон, який розміщується за селектованим маркерним гéном (рас), застосовуючи ген убікітина до інтактного С-продукту з результуючого поліпротеїну (убікітин можна легко замінити альтернативними послідовностями, що саморозщеплюються, наприклад аутопротеіназою 2А вакцини проти ящура, або іншими спорідненими послідовностями). Створення такого кластера з одним поліпротеїном дає перевагу, що полягає у продукуванні генетично більш стабільного VEE-реплікону, зменшуючи вірогідність рекомбінації в розмножуючих клітинних лініях, виключаючи С-експресуючий полігенний кластер і зменшуючи вихід ПІВ. Отриманий в результаті структурний компонент (VEErep/Pac-Ubi-C*, фіг. 9) вводили в ВНК-клітини, і ці клітини використовували для формування клональної клітинної лінії, експресуючої VEE-реплікон, відомими методами (Fayzulin et al., 2006). Одну клональну клітинну лінію досліджували після 18 пасажів від одноклітинного клонування і не виявили жодної ознаки якої-небудь делеції С-кластерів (методом полімеразноланцюгової реакції із зворотною транскрипцією (ЗТ ПЛР)), як не були виявлені і будь-які виявні мутації в межах С-експресуючого полігенного кластера. Найважливішим є те, що ця клітинна лінія показала аналогічну здатність розмножувати ПІВ ВЗН на рівні пасажа 41. Нарешті, після 10 пасажів ПІВ на цій клітинній лінії не спостерігали ознак рекомбінації, в результаті якої 18 UA 101597 C2 5 10 15 20 утворюються ПІВ-рекомбінанти, здатні продуктивно реплікуватися на клітинах, які не експресують С-кластер (а саме клітини Vero дикого типу), не було і ознак введення С-кодуючих послідовностей в ПІВ-геном в результаті ЗТ ПЛР. Крім того, враховуючи побоювання, що ПІВ може рекомбінуватися з флавівірусами у вакцинах під час вакцинації, продукуючи нові, вірулентні флавівіруси, даний винахід продемонстрував, що можна генерувати геноми ВЗН з "неприродними" сигналами циклізації (CS), які присутні у всіх відомих існуючих у природі флавівірусах, які реплікуються до високих рівнів. У кількох лабораторіях були отримані підтвердження, що ці два сигнали CS, виявлені на 5′- та 3′-кінцях геномів всіх флавівірусів, мають бути 100 %-во комплементарними для забезпечення продуктивної вірусної реплікації (Khromykh et al., J. Virol., 2001; Lo et al., J. Virol., 2003; Alvarez et al., J. Virol, 2003). Ці дослідження показали, що неприродні сигнали CS могли продукувати геноми, що реплікуються, оскільки ці CS були 100 %-во комплементарними. Проте ці дослідники повідомляли, що всі геноми з неприродними CS-послідовностями мали дефекти реплікації. В результаті систематичного аналізу CS в геномах ВЗН, зокрема при тестуванні здатності ретельно відібраних одноосновних замін забезпечувати високий рівень реплікації, були ідентифіковані точкові мутації, і наступні двоосновні заміни, що забезпечують високі рівні геномної реплікації (фіг. 12А). На фіг. 12В показано, що високий рівень реплікації геному ВЗН з двоосновними замінами є можливим і що геноми, навмисно створені з непарними CSпослідовностями (а саме дикого типу і двоосновним мутантом) є реплікаційно-неактивними. Тому цю мутацію та інші, подібні до неї, можна використовувати для продукування ПІВ з кращими показниками безпечності, оскільки будь-який рекомбінантний вірус, утворений в результаті точкової генетичної рекомбінації між вакциною на основі псевдоінфекційного вірусу з модифікованою CS і вірусу, що розпосюджується в місцях, де люди проходять вакцинацію, не може бути реплікаційно активним, отже не може викликати хворобу. 25 30 35 40 45 50 55 60 ПРИКЛАД 18 ВНК-клітини, що експресують С-ген ВЗН, зберігають свій фенотип упродовж багатьох пасажів Дослідження клональної клітинної лінії, експресуючої С-ген ВЗН, виведеної з ВНК-клітин, трансфектованих VEErep/Pac-Ubi-C*, продемонстрували її довготривалу стабільність і корисність при синтезуванні RepliVAX з декількох причин. По-перше, ці клітини були корисними для багаторазового пасирування RepliVAX. По-друге, паралельні тести клітин на формування осередків на двох різних рівнях пасирування (пасажі 8 та 24 після одноклітинного клонування) показали непомітні титри RepliVAX ЗН і розміри осередків. І нарешті, прямий аналіз послідовності С-кодуючого кластера в цих клітинах на рівні 24-го пасажа не виявив змін порівняно з оригінальною VEErep-послідовністю. Взяті разом ці дані свідчать про те, що клітини, які містять С-експресуючі реплікони VEErep, повинні бути достатньо стабільними для використання у прийнятому на даний момент форматі базової серії посівних культур, застосовуваної для продукування вакцин для людей. Крім того, той факт, що реплікони VEErep вже застосовували у випробуваннях на людях, дає надію на те, що застосування VEErepклітинної технології для клітин Vero не стикнеться з несподіваними перешкодами під час отримання дозволу контролюючого органу. ПРИКЛАД 19 Цільова доставка вірусоподібних частинок ВЗН у лімфоїдну тканину Як зазначось вище, вірусоподібні частинки (ВПЧ) вірусу Західного Нілу (ВЗН) є аналогічними RepliVAX, з тією різницею, що замість білків prM флавівірусів, вони можуть кодувати ген-репортер або можуть просто містити реплікон флавівірусу без репортера. ВПЧ можна легко продукувати у пакувальних клітинах, експресуючих всі три структурні білки ВЗН, і 7 вже були продуковані з високим титром (Fayzulin et al., 2006). При введенні мишам доз 10 одиниць ці тварини у своїх сироватках продукували 1000-5000 одиниць/мл інтерферону (IFN) типу I через 24 години після інокуляції. IFN-реакції викликали як інтраперитонеальні, так і підшкірні ін'єкції в подушечки лап. Крім того, підколінні лімфатичні вузли, відсічені через 24 години після введення у подушечи лап ВПЧ, експресуючих b-галактозидазу, що містили велику кількість b-галактозидаза-позитивних клітин, показали, що ВПЧ, які входять у клітини у формі, невідмітній від RepliVAX, попадають у важливі лімфоїдні органи. Цей результат узгоджується з високими рівнями інтерферону, викликаними ВПЧ-ін'єкціями, і дає можливість припустити, що аналогічна цільова доставка є причиною високої активності та ефективності RepliVAX. В даному описі використані наступні 19 UA 101597 C2 Джерела інформації: 5 10 15 20 25 30 35 40 45 50 55 60 Aberle, J. Н. et al, 1999, JImmunol 163,6756-61. Aberle, J. H. Et al, 2005, J Virol 79,15107-13. Bredenbeek, P. J. et al., 2003 JGen Virol 84,1261-8. Chambers, T. J. et al., 1999 J Virol 73, 3095-101. Clyde and HArris, 2006, J Virol 80:2170-2182. Colombage, G. etal. 1998, Virology250,151-63. Davis, B. S.et al., 2001, Journal of Virology 75,4040-4047. Fayzulin et al., 2006, Virology 351: 196-209. Filomatori et al, 2006, Genes Dev 20: 2238-2249. Fonseca, B. A., et al.,1994, Vaccine 12,279-85. Gentry, M. К et al., 1982, Am J Trop MedHyg 31, 548-55. Gerasimon, G., and Lowry, K., 2005, South MedJ9S, 653-6. Haas, J., et al., 1996 Curr Biol 6,315-24. Hall, R. A., et al., 2003, Proc Natl AcadSci USA 100,10460-10464. Huang, С Y., et al., 2003, J Virol 11,11436-47. Kanesa, T. N.. et al., 2000 Vaccine 19,483-491. Keelapang et al, 2004, J Virol 78: 2367-2381. Kofler, R. M, et al., 2004, Proc Natl Acad Sci USA 101,1951-6. Konishi, E., and Fujii, A., 2002, Vaccine 20,1058-67. Konishi, E et al., 2001 Journal of Virology 75,2204-2212. Konishi, E et al.,1992a Virology 190,454-8. Konishi, E et al., 1992b, Virology 188,714-20. Konishi, E et al., 2000a. Vaccine. Jan. 18,1133-1139. Konishi, E. et al., 2000b, Virology 268,49-55. Lee et al., 2000, J Virol, 74:24-32. Lemm,J. Aetal., 1990,./P7ro/64, 3001-11. Liijestrom, P et al., 1991 JVirol 65, 4107-13. Lobigs and Lee, 2004, J Virol 78: 178-186. Lindenbach et al., 2001, 2001, Flaviviridae : the viruses and their replication Knipe et al., (Eds. 4th Ed. Fields Virology, Vol. 1, Lippincott Williams and Wilkins, Philadelphia., pp. 991-1041(2vols)). Lorenz, I. C. et al., 2002 J Virol 76, 5480-91. Mason, P. W. et al., 1991, Virology 180,294-305. Minke, J. M. et al., 2004я Arch VirolSupph 221-30. Mishin, V. P. et al., 2001 Virus Research 81, 113-123. Monath, T. P. 1991, Am J Trop Med Hyg 45,1 -43. Monath, T. P. et al., 2002 Vaccine 20, 1004-18. Petrakova, О et al., 2005 J Virol 79, 7597-608. Phillpotts, R. J. et al., 1996 Arch Virol 141,743-9. Pincus, S., et al., 1992 Virology 187,290-7. Pletnev et al., 2002, Proc. National Academy of Sciences USA 9% 3036-3041. Pugachev, K. V. et al., 2004./ Virol 78, 1032-8. Pugachev, K. V., et al., \995Virology 212, 587-94. Qiao, M. e al., 2004 JInfect Dis 190,2104-8. Rossi, S. L. et al, 2005, Virology 331,457-70. Schalich et al., 1996, Virology, 70: 4549-4557. Schmaljohn, С et al., 1997, J Virol 71, 9563-9. Scholle, F. et al., 2004, J Virol 78,11605-14. Volkova, E. et al., 2006, Virology 344, 315-27. Xiao, S. Y. et al. 2001, Emerging Infectious Diseases Jul Aug 7, 714-721. Yamshchikov, V. F.s and Compans, R. W.. 1994), J Virol 68, 5765-71. Yamshchikov et al., 1997, J Virol, 71:4364-4371. Zuker, 2003, Nucleic Acid Res 31: 3406-3415. Будь-які патенти або публікації, згадані в цьому описі, свідчать про рівень фахівців у галузі, до якої відноситься даний винахід. Крім того, ці патенти і публікації включені тут як посилання в тій мірі, як якби кожна окрема публікація була конкретно і окремо включена як посилання. 20 UA 101597 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 40 45 50 55 1. Реплікаційно-дефектний псевдоінфекційний флавівірус, де геном зазначеного вірусу включає делецію в нуклеотидній послідовності, яка кодує капсидний (С) білок і ця делеція кодує амінокислоти 26-100 зазначеного С-білка або комбінацію амінокислот 26-100 зазначеного Сбілка, і ця делеція не перериває РНК-послідовність, необхідну для циклізації геному, або сигнальну послідовність для білка prM, необхідну для належного дозрівання рrМ/М. 2. Реплікаційно-дефектний псевдоінфекційний флавівірус за п. 1, який відрізняється тим, що зазначений флавівірус синтезований шляхом заміни кластерів рrМ-Е інших вірусів кластерами рrМ-Е згаданого псевдоінфекційного флавірусу. 3. Реплікаційно-дефектний псевдоінфекційний флавівірус за п. 2, який відрізняється тим, що флавівірус являє собою вірус жовтої лихоманки, вірус Західного Нілу, вірус денге, вірус кліщового енцефаліту, вірус американського енцефаліту, вірус японського енцефаліту або вірус австралійського енцефаліту. 4. Реплікаційно-дефектний псевдоінфекційний флавівірус за п. 1, який відрізняється тим, що нуклеотидна послідовність, що кодує С-білок флавівірусу, який делетують, кодує амінокислоти 26-100. 5. Реплікаційно-дефектний псевдоінфекційний флавівірус за п. 1, який відрізняється тим, що делетований ген заміняють геном, що кодує маркерний білок або антиген, і зазначений маркерний білок необов’язково зелений флуоресціюючий білок. 6. Клітинна культура, що експресує С-білок флавівірусу, де зазначена експресія ефективна для забезпечення розмноження реплікаційно-дефектного псевдоінфекційного флавівірусу за п. 1 у відповідних умовах, і послідовність нуклеїнової кислоти, яка кодує С-білок, є кодоноптимізованою таким чином, що оптимізація кодона зменшує вірогідність рекомбінації кодованого клітинною лінією С-білка з геномом псевдоінфекційного флавівірусу і/або збільшує розмноження псевдоінфекційного флавівірусу. 7. Клітинна культура за п. 6, що експресує С-білок, але не білок prM або оболонковий білок флавівірусу, ефективна для забезпечення розмноження реплікаційно-дефектного псевдоінфекційного флавівірусу за п. 1 у відповідних умовах. 8. Клітинна культура за п. 6 або 7, яка відрізняється тим, що клітини, які експресують білки дикого типу або мутовані білки вірусу, генерують за допомогою генетично сконструйованих репліконів, синтезованих з вірусних векторів. 9. Клітинна культура за п. 8, яка відрізняється тим, що (a) зазначений реплікон експресує С-білок, який включає мутації в щонайменше 36 позиціях нуклеотидів, який кодує С-білок флавівірусу; (b) реплікон експресує С-білок в репліконі, який включає неприродні послідовності циклізації, так що наявність таких послідовностей циклізації зменшує вірогідність продуктивної рекомбінації реплікаційно-дефектного псевдоінфекційного вірусу з природними вірусами; або (c) зазначений реплікон експресує білки, які включають змінені нуклеотидні послідовності, що кодують процесоване з′єднання С-prM таким чином, що наявність таких змінених послідовностей збільшує вихід реплікаційно-дефектного псевдоінфекційного вірусу в клітинній культурі, вихід in vivo субвірусних частинок, що містять prM/E, або їхню комбінацію. 10. Клітинна культура за п. 8, яка відрізняється тим, що реплікони, які експресують С-білок флавівірусу, вводять в клітини трансфекцією рибонуклеїновими кислотами (РНК) синтезованих in vitro репліконів, трансфекцією плазмідними ДНК, сконструйованими для синтезу функціональних альфавірусних репліконів з промоторів, специфічних до РНК-полімерази ІΙ, або інфікуванням альфавірусними репліконами, упакованими всередині альфавірусних структурних білків. 11. Клітинна культура за п. 8, яка відрізняється тим, що вірусними векторами є альфавіруси, і альфавірусом є вірус венесуельського енцефаліту коней (VEEV), вірус Синдбіс, вірус східного енцефаліту коней (EEEV), вірус західного енцефаліту коней (WEEV) або вірус лихоманки Ross River. 12. Спосіб продукування реплікаційно-дефектного псевдоінфекційного флавівірусу, який передбачає: генерування реплікаційно-дефектного псевдоінфекційного флавівірусу за п. 1; генерування клітинної лінії, що експресує капсидний С-білок флавівірусу, причому ця клітинна лінія забезпечує високі рівні білків, необхідні для розмноження реплікаційно-дефектного флавівірус; та 21 UA 101597 C2 5 10 15 інфікування цієї клітинної лінії псевдоінфекційним флавівірусом, в результаті чого продукується реплікаційно-дефектний псевдоінфекційний флавівірус. 13. Спосіб за п. 12, який відрізняється тим, що згаданим вірусом є вірус за будь-яким із пп. 2-4. 14. Спосіб за п. 12, який відрізняється тим, що клітини, які експресують білки дикого типу або мутовані білки вірусу, генерують як описано в пп. 7-10. 15. Спосіб за пп. 12-14, який відрізняється тим, що додатково включає стадію формування зазначеного реплікаційно-дефектного псевдоінфекційного флавівірусу. 15. Фармацевтична композиція, що включає реплікаційно-дефектний псевдоінфекційний флавівірус за будь-яким із пп. 1-5. 16. Фармацевтична композиція за п. 16 для застосування в способі захисту суб′єкта від інфекцій, викликаних флавівірусами, який передбачає введення суб′єкту імунологічно ефективної кількості зазначеної фармацевтичної композиції, причому ця композиція викликає в організмі суб′єкта імунну реакцію на флавівіруси, таким чином захищаючи суб′єкта від інфекції; причому необов’язково згадане введення здійснюють інтраперитонеально, інтрадермально, підшкірно, внутрішньом′язово, перорально або інтраназально, і необов’язково згаданим суб′єктом є людина або тварина. 22 UA 101597 C2 23 UA 101597 C2 24 UA 101597 C2 25 UA 101597 C2 26 UA 101597 C2 27 UA 101597 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPseudoinfectious flavivirus and its using
Автори англійськоюFrolov lllia, Frolova Yelena, Meison Peter
Назва патенту російськоюПсевдоинфекционный флавивирус и его использование
Автори російськоюФролов Илья, Фролова Елена, Мейсон Петер
МПК / Мітки
МПК: C12Q 1/70
Мітки: flavivirus, використання, псевдоінфекційний
Код посилання
<a href="https://ua.patents.su/47-101597-psevdoinfekcijjnijj-flavivirus-ta-jjogo-vikoristannya.html" target="_blank" rel="follow" title="База патентів України">Псевдоінфекційний флавівірус та його використання</a>
Попередній патент: Спосіб зневоднення концентрату мінерального шламу з збільшенням виробництва фільтраційного кеку
Наступний патент: Фунгіцидні азоциклічні аміди, спосіб боротьби з хворобами рослин та фунгіцидні композиції
Випадковий патент: Спосіб діагностики диспластичних змін слизової оболонки прямої кишки