Застосування лаквінімоду для зменшення втоми, поліпшення функціонального стану та поліпшення якості життя у пацієнтів з розсіяним склерозом
Формула / Реферат
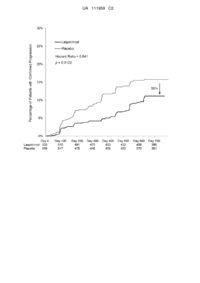
1. Застосування лаквінімоду або його фармацевтично прийнятної солі у виготовленні лікарського засобу для зменшення або уповільнення прогресування рівня втоми у людини-пацієнта з розсіяним склерозом, визнаного таким, що страждає від втоми.
2. Застосування за п. 1, де пацієнт є людиною-пацієнтом з рецидивно-ремітуючим розсіяним склерозом.
3. Застосування за п. 1 або п. 2, де рівень втоми у пацієнта оцінюють за допомогою бала за модифікованою шкалою впливу втоми (MFIS) пацієнта.
4. Застосування за п. 3, де лікарський засіб є ефективним для зниження бала MFIS людини-пацієнта у порівнянні з балом пацієнта, який не отримує лікування лаквінімодом.
5. Застосування за п. 3 або п. 4, де лікарський засіб є ефективним для зниження бала MFIS людини-пацієнта у порівнянні з балом пацієнта на початку лікування лаквінімодом.
6. Застосування за п. 4 або п. 5, де лікарський засіб є ефективним для зниження бала MFIS протягом 24 місяців від початку лікування лаквінімодом.
7. Застосування за будь-яким з пп. 1-6, де лікарський засіб сформований для введення у добовій дозі 0,3-0,9 мг лаквінімоду.
8. Застосування за п. 7, де лікарський засіб сформований для введення у добовій дозі 0,6 мг лаквінімоду.
9. Застосування за будь-яким з пп. 1-8, де лаквінімод представлений у формі лаквінімоду натрію.
10. Застосування за будь-яким з пп. 1-9, де лікарський засіб сформований для введення протягом періоду більше 24 тижнів.
11. Застосування лаквінімоду або його фармацевтично прийнятної солі у виготовленні лікарського засобу для поліпшення або уповільнення погіршення функціонального стану людини-пацієнта з розсіяним склерозом, визнаного таким, що страждає від погіршення функціонального стану.
12. Застосування за п. 11, де пацієнт є людиною-пацієнтом з рецидивно-ремітуючим розсіяним склерозом.
13. Застосування за п. 11 або п. 12, де погіршення функціонального стану пацієнта оцінюють за допомогою бала пацієнта за заповненою суб′єктом короткою формою анкети про загальний стан здоров′я (SF-36).
14. Застосування за п. 13, де лікарський засіб є ефективним для зниження бала SF-36 людини-пацієнта у порівнянні з балом пацієнта, який не отримує лікування лаквінімодом.
15. Застосування за п. 13 або п. 14, де лікарський засіб є ефективним для зниження бала SF-36 людини-пацієнта у порівнянні з балом пацієнта на початку лікування лаквінімодом.
16. Застосування за п. 14 або п. 15, де лікарський засіб є ефективним для зниження сумарного бала психічного здоров′я (MSC) пацієнта.
17. Застосування за будь-яким з пп. 14-16, де лікарський засіб є ефективним для зниження сумарного бала фізичного здоров′я (PSC) пацієнта.
18. Застосування за будь-яким з пп. 14-17, де лікарський засіб є ефективним для зниження бала SF-36 протягом 24 місяців від початку лікування лаквінімодом.
19. Застосування за будь-яким з пп. 11-18, де лікарський засіб сформований для введення у добовій дозі 0,3-0,9 мг лаквінімоду.
20. Застосування за п. 19, де лікарський засіб сформований для введення у добовій дозі 0,6 мг лаквінімоду.
21. Застосування за будь-яким з пп. 11-20, де лаквінімод представлений у формі лаквінімоду натрію.
22. Застосування за будь-яким з пп. 11-21, де лікарський засіб сформований для введення протягом періоду більше 24 тижнів.
23. Застосування лаквінімоду або його фармацевтично прийнятної солі у виготовленні лікарського засобу для поліпшення або уповільнення погіршення загального стану здоров′я людини-пацієнта з розсіяним склерозом, визнаного таким, що страждає від погіршення загального стану здоров′я.
24. Застосування за п. 23, де пацієнт є людиною-пацієнтом з рецидивно-ремітуючим розсіяним склерозом.
25. Застосування за п. 23 або п. 24, де загальний стан здоров′я пацієнта оцінюють за допомогою бала за стандартизованою анкетою EQ-5D пацієнта.
26. Застосування за п. 25, де лікарський засіб є ефективним для підвищення бала EQ-5D людини-пацієнта у порівнянні з балом пацієнта, який не отримує лікування лаквінімодом.
27. Застосування за п. 25 або п. 26, де лікарський засіб є ефективним для підвищення бала EQ-5D людини-пацієнта у порівнянні з балом пацієнта на початку лікування лаквінімодом.
28. Застосування за п. 26 або п. 27, де лікарський засіб є ефективним для підвищення бала EQ-5D протягом 24 місяців від початку лікування лаквінімодом.
29. Застосування за будь-яким з пп. 23-28, де лікарський засіб сформований для введення у добовій дозі 0,3-0,9 мг лаквінімоду.
30. Застосування за п. 29, де лікарський засіб сформований для введення у добовій дозі 0,6 мг лаквінімоду.
31. Застосування за будь-яким з пп. 23-30, де лаквінімод представлений у формі лаквінімоду натрію.
32. Застосування за будь-яким з пп. 23-31, де лікарський засіб сформований для введення протягом періоду більше 24 тижнів.
33. Застосування лаквінімоду або його фармацевтично прийнятної солі у виготовленні лікарського засобу для забезпечення нейропротекції у людини-суб'єкта, де людина-суб'єкт страждає від ураження нейронів, деградації нейронів, нейрональної дисфункції та/або нейронального апоптозу.
34. Застосування за п. 33, де лікарський засіб сформований для введення у добовій дозі більше 0,6 мг лаквінімоду.
35. Застосування за п. 33, де лікарський засіб сформований для введення у добовій дозі менше 0,6 мг лаквінімоду.
36. Застосування за будь-яким з пп. 33-35, де лікарський засіб сформований для введення частіше ніж один раз на добу.
37. Застосування за будь-яким з пп. 33-35, де лікарський засіб сформований для введення рідше ніж один раз на добу.
38. Застосування за будь-яким з пп. 33-37, де суб'єкт не страждає від рецидивно-ремітуючого розсіяного склерозу.
39. Застосування за будь-яким з пп. 33-38, де суб'єкт не страждає від інсулінозалежного цукрового діабету, системного червоного вовчаку, люпус-нефриту, люпус-артриту, ревматоїдного артриту, запального захворювання кишечнику, хвороби Крона, псоріазу, запального респіраторного захворювання, атеросклерозу, нападу, хвороби Альцгеймера або захворювання, пов′язаного з BDNF.
40. Застосування за будь-яким з пп. 33-39, де у суб'єкта починається рецидив.
41. Застосування за будь-яким з пп. 33-40, де суб'єкт є прикутим до ліжка.
42. Застосування за будь-яким з пп. 33-41, де суб'єкт має бал перетвореної EDSS Куртцке більше 5,5.
43. Застосування за будь-яким з пп. 33-42, де суб'єкт не зазнавав будь-чого з:
a) щонайменше одного задокументованого рецидиву протягом 12 місяців до початку лікування лаквінімодом,
b) щонайменше двох задокументованих рецидивів протягом 24 місяців до початку лікування лаквінімодом або
c) одного задокументованого рецидиву протягом 12-24 місяців до початку лікування лаквінімодом зі щонайменше одним задокументованим T1-Gd підсиленим осередком на MRI, проведеній не пізніше 12 місяців до початку лікування лаквінімодом.
44. Застосування за будь-яким з пп. 33-43, де суб'єкт має тривалість захворювання менше 6 місяців від першого симптому до початку лікування лаквінімодом.
45. Застосування за будь-яким з пп. 33-44, де суб'єкт є молодшим 18 років або старшим 55 років.
46. Застосування за будь-яким з пп. 33-45, де лікарський засіб є ефективним для зменшення нейрональної дисфункції, зменшення ураження нейронів, зменшення деградації нейронів або зменшення нейронального апоптозу.
47. Застосування за п. 46, де лікарський засіб є ефективним для зменшення нейрональої дисфункції в центральній нервовій системі, зменшення ураження нейронів в центральній нервовій системі, зменшення деградації нейронів в центральній нервовій системі або зменшення нейронального апоптозу в центральній нервовій системі.
48. Застосування лаквінімоду для підтримання або зниження рівня втоми у людини-пацієнта з розсіяним склерозом, визнаного таким, що страждає від втоми.
49. Застосування лаквінімоду для підтримання або поліпшення функціонального стану людини-пацієнта з розсіяним склерозом, визнаного таким, що страждає від погіршення функціонального стану.
50. Застосування лаквінімоду для підтримання або поліпшення загального стану здоров′я людини-пацієнта з розсіяним склерозом, визнаного таким, що страждає від погіршення загального стану здоров′я.
51. Застосування лаквінімоду для забезпечення нейропротекції у людини-суб'єкта, визнаного таким, що страждає від ураження нейронів, деградації нейронів, нейрональної дисфункції та/або нейронального апоптозу.
Текст
Реферат: Винахід стосується застосування лаквінімоду для виготовлення лікарського засобу для зменшення або уповільнення прогресування рівня втоми у людини-пацієнта з розсіяним склерозом, поліпшення або уповільнення погіршення загального стану здоров'я людинипацієнта з розсіяним склерозом та поліпшення або уповільнення погіршення загального стану здоров'я людини-пацієнта з розсіяним склерозом. Винахід також стосується застосування лаквінімоду для виготовлення лікарського засобу для забезпечення нейропротекції у людинисуб'єкта, де людина-суб'єкт страждає від ураження нейронів, дегенерації нейронів, нейрональної дисфункції та/або нейронального апоптозу. UA 111959 C2 (12) UA 111959 C2 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дана заявка заявляє пріоритет попередньої заявки на патент США № 61/542996, поданої 4 жовтня 2011 року, та попередньої заявки на патент США № 61/420742, поданої 7 грудня 2010 року, повний зміст кожної з яких включений в даний документ за допомогою посилання. По усій цій заявці різні публікації посилаються на першого автора та рік публікації. Повні цитування для таких публікацій представлені в розділі Посилання безпосередньо перед формулою винаходу. Розкриття публікацій, цитованих в розділі Посилання, у всій своїй повноті включені в даний документ шляхом посилання на цю заявку для більш повного опису рівня техніки на дату винаходу, описаного в даному документі. Передумови винаходу Розсіяний склероз (MS) являє собою неврологічне захворювання, що вражає більше 1 мільйона людей у всьому світі. Це найпоширеніша причина неврологічної інвалідизації серед молоді та дорослих середнього віку та має значний фізичний, психологічний, соціальний і фінансовий вплив на суб'єктів та їх родини, друзів та органи, відповідальні за охорону здоров'я (EMEA Guideline, 2006). У цілому вважають, що MS опосередковується певним типом аутоімунного процесу, можливо викликаного інфекцією та накладеного на генетичну схильність. Це хронічний запальний процес, що пошкоджує мієлін центральної нервової системи (CNS). Патогенез MS характеризується інфільтрацією аутореактивних Т-клітин з кровотоку, спрямованого проти антигенів мієліну в CNS (Bjartmar, 2002). Крім запальної фази при MS відбувається втрата аксонів на початку перебігу захворювання та з часом може поширюватися, призводячи до подальшого розвитку прогресуючого, незворотного, неврологічного погіршення та найчастіше до важкої інвалідизації (Neuhaus, 2003). Симптоми, пов’язані із захворюванням, включають втому, м'язову спастичність, атаксію, слабкість, розлади сечового міхура та кишечника, сексуальну дисфункцію, біль, тремор, пароксизмальні прояви, погіршення зору, психологічні проблеми та когнітивну дисфункцію (EMEA Guideline, 2006). Різні стадії та/або типи захворювання MS описані в Multiple Sclerosis Therapeutics (Duntiz, 1999). Серед них рецидивно-ремітуючий розсіяний склероз (RRMS) є найпоширенішою формою на час первинного діагнозу. Багато суб’єктів з RRMS мають первинний рецидивно-ремітуючий перебіг протягом 5-15 років, який потім переходить у перебіг захворювання вторинного прогресуючого MS (SPMS). Рецидиви виникають в результаті запалення та демієлінізації, тоді як відновлення нервової провідності та ремісія супроводжуються вирішенням запалення, перерозподілом натрієвих каналів у демієлінізованих аксонах та ремієлінізацією (Neuhaus, 2003; Noseworthy, 2000). В квітні 2001 року міжнародна група експертів при сприянні Національного товариства MS Америки рекомендувала діагностичні критерії для розсіяного склерозу. Дані критерії стали відомі як критерії Макдональда. Критерії Макдональда застосовують техніки MRI і призначені для заміни критеріїв Позера та більш старих критеріїв Шумахера (McDonald, 2001). Критерії Макдональда були переглянуті міжнародною групою експертів у березні 2005 року (Polman, 2005). Для зменшення та/або запобігання накопичувальної нейродегенерації на рецидивних стадіях MS пропонується втручання терапією, що модифікує захворювання (Hohlfeld, 2000; De Stefano, 1999). На даний час існує шість лікарських засобів, що модифікують захворювання, схвалених для застосування при рецидивному MS (RMS), який включає RRMS та SPMS (The Disease Modifying Drug Brochure, 2006). Такі включають інтерферон бета 1-а (Avonex® та Rebif®), інтерферон бета 1-b (Betaseron®), глатирамеру ацетат (Copaxone®), мітоксантрон (Novantrone®) та наталізумаб (Tysabri®). Більшість з них, як вважають, діють як імуномодулятори. Мітоксантрон та наталізумаб, як вважають, діють як імуносупресори. Однак механізми дії кожного з’ясовані лише частково. Імуносупресори або цитотоксичні засоби застосовуються для деяких суб'єктів після безуспішності традиційних терапій. Однак зв’язок між змінами імунної відповіді, індукованої цими засобами, та клінічною ефективністю при MS досі не встановлений (EMEA Guideline, 2006). Інші терапевтичні підходи включають симптоматичне лікування, яке стосується всіх терапій, застосовних для полегшення симптомів, викликаних захворюванням (EMEA Guideline, 2006), та лікування гострих рецидивів кортикостероїдами. Не дивлячись на те, що стероїди не впливають на перебіг MS з часом, вони можуть зменшувати тривалість та тяжкість нападів у деяких суб'єктів. Лаквінімод Лаквінімод натрію є новою синтетичною сполукою з високою пероральною біодоступністю, яка була запропонована у якості перорального складу для лікування MS (Polman, 2005; Sandberg-Wollheim, 2005). 1 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дослідження показали, що лаквінімод знижує розвиток активних, виявлених при MRI осередків при рецидивному MS (Polman, 2005). Однак клінічна значимість виключно зменшення виявленого при MRI осередку головного мозку досі не встановлена. Недивлячись на те, що в деяких дослідженнях виявлені при MRI осередки застосовують в якості основного показника ефективності, інші припускають, що кореляція між виявленими при MRI патологіями та клінічною активністю захворювання у пацієнтів з RRMS є слабкою, та що такий показник слід застосовувати в якості вторинних результатів, а не як сурогатні маркери клінічних відповідей (Rudick, 1999; Miki, 1999; Barkhof, 1999). Більш того, згідно з регулюючими органами у фармацевтичній галузі, такими як Європейське агенство з лікарських засобів (EMEA), не доведено, що кореляція між виявленими при MRI результатами та клінічними наслідками достатньо сильна, щоб визнати результати MRI як підтверджений сурогатний кінцевий показник в базових дослідженнях. Тому, згідно з EMEA, суттєвим параметром ефективності для клінічних випробувань є накопичення інвалідизації та частота рецидивів (для RRMS) (EMEA Guideline, 2006). Таким чином, на даний час частота рецидивів та прогресування інвалідизації є прийнятними показниками ефективності лікування щодо RRMS, але вони не були раніше встановлені для лаквінімоду. У рекомендаціях EMEA щодо клінічних випробувань MS додатково стверджується, що щорічна частота рецидивів при RRMS зазвичай низька, та що прогресування інвалідизації, як правило, триває роки. Отже, підтверджуючі дослідження продуктів, призначених для зміни перебігу захворювання, повинні бути більш масштабними та досить тривалими, щоб мати значну частину пацієнтів, які страждають від рецидивів, або у яких проявляється прогресування інвалідизації. Два роки вважаються мінімальним сроком, щоб продемонструвати ефективність (EMEA Guideline, 2006). Більш того, в існуючих літературних джерелах прийшли до різних висновків щодо ефективної дози лаквінімоду для лікування MS. Пероральна доза 0,3 мг/доба була показана для зниження розвитку активних, виявлених при MRI осередків при рецидивному MS (у тому числі RRMS та SPMS) в одному дослідженні (Polman, 2005), в той час як інше дослідження показало при тій самій дозі відсутність виявлення при MRI та клінічного ефекту в порівнянні з плацебо (Comi, 2007). Короткий опис винаходу Даний винахід передбачає спосіб зменшення або уповільнення прогресування рівня втоми у людини-пацієнта з розсіяним склерозом, при цьому спосіб включає етап, на якому людиніпацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль, щоб таким чином зменшити або уповільнити прогресування рівня втоми у людини-пацієнта з розсіяним склерозом. Даний винахід також передбачає спосіб поліпшення або уповільнення погіршення функціонального стану людини-пацієнта з розсіяним склерозом, при цьому спосіб включає етап, на якому людині-пацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль, щоб таким чином поліпшити або уповільнити погіршення функціонального стану людинипацієнта з розсіяним склерозом. Даний винахід також передбачає спосіб поліпшення або уповільнення погіршення загального стану здоров’я людини-пацієнта з розсіяним склерозом, при цьому спосіб включає етап, на якому людині-пацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль, щоб таким чином поліпшити або уповільнити погіршення загального стану здоров’я у людини-пацієнта з розсіяним склерозом. Даний винахід також передбачає спосіб забезпечення нейропротекції у людини-суб'єкта, при цьому спосіб включає етап, на якому людині-суб'єкту перорально вводять лаквінімод або його фармацевтично прийнятну сіль, щоб таким чином забезпечити нейропротекцію у людинисуб'єкта. Короткий опис графічних матеріалів Фігура 1: Результат ALLEGRO - сумарне число підтверджених рецидивів: число підтверджених рецидивів в динаміці за часом для пацієнтів, яких лікували лаквінімодом та плацебо. Фігура 2: Результат ALLEGRO - час до 3-місячного підтвердженого прогресування інвалідизації: графік виживання щодо ризику підтвердженого 3-місячного прогресування за EDSS як для пацієнтів, яких лікували лаквінімодом, так і для пацієнтів, яких лікували плацебо. Фігура 3: Результат ALLEGRO - число GdE-осередків: число GdE-осередків на початковому рівні, на місяцях 12 та 24, а також сумарне число на місяці 24. Фігура 4: Результат ALLEGRO - відсоткова зміна об’єму головного мозку: відсоткова зміна об’єму головного мозку для пацієнтів, яких лікували лаквінімодом та плацебо. 2 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 Детальний опис винаходу Даний винахід передбачає спосіб зменшення або уповільнення прогресування рівня втоми у людини-пацієнта з розсіяним склерозом, при цьому спосіб включає етап, на якому людиніпацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль, щоб таким чином знизити або уповільнити прогресування рівня втоми у людини-пацієнта з розсіяним склерозом. В одному варіанті здійснення пацієнт є людиною-пацієнтом з рецидивно-ремітуючим розсіяним склерозом. В одному варіанті здійснення рівень втоми оцінюють балом за модифікованою шкалою впливу втоми (MFIS) пацієнта. В іншому варіанті здійснення за допомогою введення лаквінімоду знижують бал MFIS людини-пацієнта у порівнянні з балом пацієнта, який не отримує лікування лаквінімодом. В іншому варіанті здійснення за допомогою введення лаквінімоду знижують бал MFIS людини-пацієнта у порівнянні з балом пацієнта на початку лікування лаквінімодом. У ще одному варіанті здійснення бал MFIS знижувався протягом 24 місяців від початку лікування лаквінімодом. Даний винахід також передбачає спосіб поліпшення або уповільнення погіршення функціонального стану людини-пацієнта з розсіяним склерозом, при цьому спосіб включає етап, на якому людині-пацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль, щоб таким чином поліпшити або уповільнити погіршення функціонального стану людинипацієнта з розсіяним склерозом. В одному варіанті здійснення пацієнт є людиною-пацієнтом з рецидивно-ремітуючим розсіяним склерозом. В одному варіанті здійснення функціональний стан пацієнта визначають балом пацієнта за заповненою суб’єктом короткою формою анкети про загальний стан здоров’я (SF-36). В іншому варіанті здійснення за допомогою введення лаквінімоду знижують бал SF-36 людини-пацієнта у порівнянні з пацієнтом, який не отримує лікування лаквінімодом. В іншому варіанті здійснення за допомогою введення лаквінімоду знижують бал SF-36 людини-пацієнта у порівнянні з балом пацієнта на початку лікування лаквінімодом. В іншому варіанті здійснення сумарний бал психічного здоров’я (MSC) пацієнта за SF-36 знизився. В іншому варіанті здійснення сумарний бал фізичного здоров’я (PSC) за SF-36 пацієнта знизився. У ще одному варіанті здійснення бал SF-36 знижувався протягом 24 місяців від початку лікування лаквінімодом. Даний винахід також передбачає спосіб поліпшення або уповільнення погіршення загального стану здоров’я людини-пацієнта з розсіяним склерозом, при цьому спосіб включає етап, на якому людині-пацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль, щоб таким чином поліпшити або уповільнити погіршення загального стану здоров’я у людини-пацієнта з розсіяним склерозом. В одному варіанті здійснення пацієнт є людиною-пацієнтом з рецидивно-ремітуючим розсіяним склерозом. В одному варіанті здійснення загальний стан здоров’я пацієнта оцінюють балом за стандартизованою анкетою EQ-5D пацієнта. В іншому варіанті здійснення за допомогою введення лаквінімоду підвищують бал EQ-5D людини-пацієнта у порівнянні з балом пацієнта, який не отримує лікування лаквінімодом. В іншому варіанті здійснення за допомогою введення лаквінімоду підвищують бал EQ-5D людини-пацієнта у порівнянні з балом пацієнта на початку лікування лаквінімодом. У ще одному варіанті здійснення бал EQ-5D підвищувався протягом 24 місяців від початку лікування лаквінімодом. В одному варіанті здійснення лаквінімод вводять у добовій дозі 0,3-0,9 мг лаквінімоду. В іншому варіанті здійснення лаквінімод вводять у добовій дозі 0,6 мг лаквінімоду. В іншому варіанті здійснення лаквінімод вводять у формі лаквінімоду натрію. У ще одному варіанті здійснення введення здійснюють протягом періоду більше 24 тижнів. Даний винахід також передбачає спосіб забезпечення нейропротекції у людини-суб’єкта, при цьому спосіб включає етап, на якому людині-суб'єкту перорально вводять лаквінімод або його фармацевтично прийнятну сіль, щоб таким чином забезпечити нейропротекцію у людинисуб’єкта. В одному варіанті здійснення лаквінімод вводять у добовій дозі більше 0,6 мг лаквінімоду. В іншому варіанті здійснення лаквінімод вводять у добовій дозі менше 0,6 мг лаквінімоду. В іншому варіанті здійснення лаквінімод вводять частіше ніж один раз на добу. В іншому варіанті здійснення лаквінімод вводять рідше ніж один раз на добу. В одному варіанті здійснення суб'єкт страждає від прогресивної форми розсіяного склерозу. В іншому варіанті здійснення суб'єкт страждає від рецидивно-ремітуючого розсіяного склерозу. В іншому варіанті здійснення суб'єкт не страждає від інсулінозалежного цукрового діабету, системного червоного вовчаку, люпус-нефриту, люпус-артриту, ревматоїдного артриту, запального захворювання кишечника, хвороби Крона, псоріазу, запального респіраторного 3 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання, атеросклерозу, нападу, хвороби Альцгеймера або захворювання, пов’язаного з BDNF. У варіанті здійснення пов’язане з BDNF захворювання являється хворобою Паркінсона, хворобою Хантінгтона, бічним аміотрофічним склерозом, депресивним розладом, тривожним розладом, пігментним ретинітом, еректильною дисфункцією, розладом пам'яті, синдромом Ретта, хворобою Альцгеймера, біполярним афективним розладом або гострою манією. В іншому варіанті здійснення депресивним розладом являється депресія, депресія у пацієнтів зі злоякісною пухлиною, депресія у пацієнтів з хворобою Паркінсона, депресія після інфаркту, депресія у пацієнтів з вірусом імунодефіциту людини (HIV), субсиндромальна симптоматична депресія, депресія у безплідних жінок, дитяча депресія, глибока депресія, один депресивний епізод, рекурентна депресія, дитяча депресія, викликана жорстоким поводженням, післяродова депресія, глибока депресія DSM-IV, терапевтично резистентна глибока депресія, тяжка депресія, психотична депресія, постінсультна депресія, невропатичний біль, маніакальнодепресивний психоз, включаючи маніакально-депресивний психоз зі змішаними епізодами та маніакально-депресивний психоз з депресивними епізодами, сезонний афективний розлад, біполярна депресія BP I, біполярна депресія BP II або глибока депресія з дистимією. У ще одному варіанті здійснення тривожним розладом являється генералізована тривога, панічний розлад, фобія, посттравматичний стресовий розлад, обсесивно-компульсивний розлад, сепараційна тривога або тривога у дитячому віці. В одному варіанті здійснення у суб'єкта починається рецидив. В іншому варіанті здійснення суб'єкт являється прикутим до ліжка. В іншому варіанті здійснення суб'єкт має бал перетвореної EDSS Куртцке більше 5,5. В іншому варіанті здійснення суб'єкт не зазнає будь-чого з: a) щонайменше одного задокументованого рецидиву за 12 місяців до початку лікування лаквінімодом, b) щонайменше двох задокументованих рецидивів за 24 місяців до початку лікування лаквінімодом або c) одного задокументованого рецидиву протягом 12-24 місяців до початку лікування лаквінімодом зі щонайменше одним задокументованим T 1-Gd підсиленим осередком на MRI, проведеній не пізніше 12 місяців до початку лікування лаквінімодом. В іншому варіанті здійснення тривалість захворювання у суб'єкта складає менше 6 місяців від першого симптому до початку лікування лаквінімодом. В іншому варіанті здійснення суб'єкт є молодшим 18 років або старшим 55 років. У варіанті здійснення за допомогою введення лаквінімоду зменшують нейрональну дисфункцію, зменшують ураження нейронів, зменшують деградацію нейронів та/або зменшують нейрональний апоптоз. В іншому варіанті здійснення за допомогою введення лаквінімоду зменшують нейрональну дисфункцію в центральній нервовій системі, зменшують ураження нейронів в центральній нервовій системі, зменшують деградацію нейронів в центральній нервовій системі та/або зменшують нейрональний апоптоз в центральній нервовій системі. У ще одному варіанті здійснення за допомогою введення лаквінімоду зменшують нейрональну дисфункцію у периферичній нервовій системі (PNS), зменшують ураження нейронів в периферичній нервовій системі (PNS), зменшують деградацію нейронів в периферичній нервовій системі (PNS) та/або зменшують нейрональний апоптоз в периферичній нервовій системі (PNS). Даний винахід також передбачає лаквінімод для застосування у підтриманні або зниженні рівня втоми у людини-пацієнта з розсіяним склерозом, для застосування у підтриманні або поліпшенні функціонального стану людини-пацієнта з розсіяним склерозом, для застосування у підтриманні або поліпшенні загального стану здоров’я людини-пацієнта з розсіяним склерозом та для застосування у поліпшенні нейропротекції у людини-суб’єкта. Даний винахід також передбачає спосіб зниження частоти рецидивів у людини-пацієнта з рецидивно-ремітуючим розсіяним склерозом, при цьому спосіб включає етап, на якому пацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль у добовій дозі 0,6 мг лаквінімоду, щоб таким чином знизити частоту рецидивів. В одному варіанті здійснення частоту рецидивів знижують щонайменше на 30%. В іншому варіанті здійснення частоту рецидивів знижують щонайменше до 70%. В одному варіанті здійснення лаквінімод вводять у формі лаквінімоду натрію. В одному варіанті здійснення лаквінімод вводять в якості монотерапії при рецидивноремітуючому розсіяному склерозі. В іншому варіанті здійснення лаквінімод вводять в якості допоміжної терапії з іншим лікуванням рецидивно-ремітуючого розсіяного склерозу. У ще одному варіанті здійснення іншим лікуванням рецидивно-ремітуючого розсіяного склерозу являється введення інтерферону бета 1-а, інтерферону бета 1-b, глатірамеру ацетату, мітоксантрону або наталізумабу. В одному варіанті здійснення введення здійснюють протягом періоду більше 24 тижнів. 4 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід також передбачає спосіб зниження імовірності, що людина-пацієнт з рецидивно-ремітуючим розсіяним склерозом зазнає підтвердженого рецидиву протягом попередньо заданого періоду часу, при цьому спосіб включає етап, на якому пацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль у добовій дозі 0,6 мг лаквінімоду, щоб таким чином знизити імовірність, що людина-пацієнт з рецидивно-ремітуючим розсіяним склерозом зазнає підтвердженого рецидиву протягом попередньо заданого періоду. В одному варіанті здійснення попередньо заданий період часу складає 12 місяців. В іншому варіанті здійснення попередньо заданий період часу складає 24 місяці. В одному варіанті здійснення частота рецидивів або імовірність (ризик) рецидиву знижуються щонайменше на 20% у порівнянні з такими у пацієнта, який не отримує лікування лаквінімодом. В іншому варіанті здійснення частота рецидивів або імовірність (ризик) рецидиву знижуються щонайменше на 25% у порівнянні з такими у пацієнта, який не отримує лікування лаквінімодом. В іншому варіанті здійснення частота рецидивів або імовірність (ризик) рецидиву знижуються щонайменше на 30% у порівнянні з такими у пацієнта, який не отримує лікування лаквінімодом. У ще одному варіанті здійснення частота рецидивів або імовірність (ризик) рецидиву знижуються щонайменше на 70% у порівнянні з такими у пацієнта, який не отримує лікування лаквінімодом. В одному варіанті здійснення рецидив являє собою важкий рецидив, за якого потрібні госпіталізація або лікування IV-стероїдами. В іншому варіанті здійснення річний показник рецидивів пацієнта, за яких потрібна госпіталізація, знижується щонайменше на 20% або щонайменше на 25% у порівнянні з таким у пацієнта, який не отримує лікування лаквінімодом. Даний винахід додатково передбачає спосіб зменшення тяжкості або тривалості рецидиву у людини-пацієнта з рецидивно-ремітуючим розсіяним склерозом, при цьому спосіб включає етап, на якому пацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль у добовій дозі 0,6 мг лаквінімоду, щоб таким чином зменшити тяжкість або тривалість рецидиву у людини-пацієнта з рецидивно-ремітуючим розсіяним склерозом. У варіанті здійснення за допомогою введення лаквінімоду збільшують шанси пацієнта уникнути рецидиву. В іншому варіанті здійснення пацієнт, що приймає лаквінімод, має приблизно на 55% більше шансів уникнути рецидиву в порівнянні з пацієнтом, який не отримує лікування лаквінімодом. У додаткових варіантах здійснення даного винаходу річна частота рецидивів пацієнта протягом першого року лікування знижується у порівнянні з такою пацієнта, який не отримує лікування лаквінімодом. В одному варіанті здійснення зниження відбувається щонайменше на 20%. У варіанті здійснення знижується ризик пацієнта зазнати настільки важкого рецидиву, що необхідна госпіталізація, у порівнянні з пацієнтом, який не отримує лікування лаквінімодом. В іншому варіанті здійснення ризик знижується щонайменше на 20% або щонайменше на 30%. В іншому варіанті здійснення знижується ризик пацієнта зазнати настільки важкого рецидиву, що необхідне лікування IV-стероїдами, у порівнянні з пацієнтом, який не отримує лікування лаквінімодом. В іншому варіанті здійснення ризик знижується щонайменше на 20% або щонайменше на 30% у порівнянні з таким у пацієнта, який не отримує лікування лаквінімодом. Даний винахід також передбачає спосіб поліпшення якості життя та загального стану здоров’я людини-пацієнта з рецидивно-ремітуючим розсіяним склерозом, при цьому спосіб включає етап, на якому пацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль у добовій дозі 0,6 мг лаквінімоду, щоб таким чином поліпшити якість життя та загальний стан здоров’я пацієнта. Даний винахід також передбачає спосіб зниження накопичення фізичної інвалідизації у людини-пацієнта з рецидивно-ремітуючим розсіяним склерозом, при цьому спосіб включає етап, на якому пацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль у добовій дозі 0,6 мг лаквінімоду, щоб таким чином знизити накопичення фізичної інвалідизації у людини-пацієнта з ремітуючим розсіяним склерозом. В одному варіанті здійснення накопичення фізичної інвалідизації оцінюють за прогресуванням балу суб’єкта за комплексною функціональною оцінкою при MS (MSFC). В іншому варіанті здійснення бал MSFC пацієнта поліпшується протягом 3 місяців від першого лікування лаквінімодом. В іншому варіанті здійснення бал MSFC пацієнта поліпшується протягом 6 місяців від першого лікування лаквінімодом. В іншому варіанті здійснення бал MSFC пацієнта поліпшується протягом 12 місяців від першого лікування лаквінімодом. В іншому варіанті здійснення бал MSFC пацієнта поліпшується протягом 18 місяців від першого лікування лаквінімодом. В іншому варіанті здійснення бал MSFC пацієнта поліпшується протягом 24 місяців від першого лікування лаквінімодом. 5 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному варіанті здійснення накопичення фізичної інвалідизації оцінюють за часом до підтвердженого прогресування захворювання, що визначається балом за розширеною шкалою інвалідизації Куртцке (EDSS). В одному варіанті здійснення до введення лаквінімоду пацієнт має бал EDSS 0-5,5. В іншому варіанті здійснення підтверджене прогресування захворювання являє собою підвищення балу EDSS на 1 одиницю. В одному варіанті здійснення до введення лаквінімоду пацієнт має бал EDSS 5,5 або вищий. В іншому варіанті здійснення підтверджене прогресування захворювання являє собою підвищення балу EDSS на 0,5 одиниці. В одному варіанті здійснення час для підтвердження прогресування захворювання збільшується щонайменше на 30% у порівнянні з таким у пацієнта, який не отримує лікування лаквінімодом. В іншому варіанті здійснення час для підтвердження прогресування захворювання збільшується на 20-60% у порівнянні з таким у пацієнта, який не отримує лікування лаквінімодом. В іншому варіанті здійснення час для підтвердження прогресування захворювання збільшується на 30-50% у порівнянні з таким у пацієнта, який не отримує лікування лаквінімодом. В іншому варіанті здійснення час для підтвердження прогресування захворювання збільшується щонайменше на 50% у порівнянні з таким у пацієнта, який не отримує лікування лаквінімодом. В одному варіанті здійснення за допомогою введення лаквінімоду знижують ризик пацієнта щодо підтвердженого прогресування щонайменше на 30% у порівнянні з таким пацієнта, який не отримує лікування лаквінімодом. В іншому варіанті здійснення за допомогою введення лаквінімоду знижують ризик пацієнта щодо підтвердженого прогресування щонайменше на 35% у порівнянні з таким пацієнта, який не отримує лікування лаквінімодом. В іншому варіанті здійснення за допомогою введення лаквінімоду знижують ризик пацієнта щодо підтвердженого прогресування щонайменше на 40% у порівнянні з таким пацієнта, який не отримує лікування лаквінімодом. У варіанті здійснення зниження ризику відбувається протягом 3 місяців від першого лікування лаквінімодом. В іншому варіанті здійснення зниження ризику відбувається протягом 6 місяців від першого лікування лаквінімодом. В іншому варіанті здійснення зниження ризику відбувається протягом 12 місяців від першого лікування лаквінімодом. В іншому варіанті здійснення зниження ризику відбувається протягом 18 місяців від першого лікування лаквінімодом. В іншому варіанті здійснення зниження ризику відбувається протягом 24 місяців від першого лікування лаквінімодом. В одному варіанті здійснення лаквінімод вводять у формі лаквінімоду натрію. В одному варіанті здійснення лаквінімод вводять в якості монотерапії щодо рецидивно-ремітуючого розсіяного склерозу. В іншому варіанті здійснення лаквінімод вводять в якості допоміжної терапії з іншим лікуванням рецидивно-ремітуючого розсіяного склерозу. У ще одному варіанті здійснення іншим лікуванням рецидивно-ремітуючого розсіяного склерозу являється введення інтерферону бета 1-а, інтерферону бета 1-b, глатірамеру ацетату, мітоксантрону або наталізумабу. В одному варіанті здійснення введення здійснюють протягом періоду більше 24 тижнів. В іншому варіанті здійснення будь-якого зі способів, описаних в даному документі, введення здійснюють протягом періоду більше 36 тижнів. В іншому варіанті здійснення будь-якого зі способів, описаних в даному документі, введення здійснюють протягом періоду більше 48 тижнів. Даний винахід також передбачає фармацевтичну пероральну одиничну лікарську форму 0,6 мг лаквінімоду для застосування у зниженні частоти рецидивів у людини-пацієнта з рецидивно-ремітуючим розсіяним склерозом, або для зниження імовірності, що людина-пацієнт з рецидивно-ремітуючим розсіяним склерозом зазнає підтвердженого рецидиву протягом попередньо заданого періоду часу, або для зниження тяжкості або тривалості рецидиву у людини-пацієнта з рецидивно-ремітуючим розсіяним склерозом. Даний винахід також передбачає фармацевтичну пероральну одиничну лікарську форму 0,6 мг лаквінімоду для застосування у зниженні накопичення фізичної інвалідизації у людинипацієнта з рецидивно-ремітуючим розсіяним склерозом. Даний винахід також передбачає спосіб зниження прогресування атрофії головного мозку у людини-пацієнта з рецидивно-ремітуючим розсіяним склерозом, при цьому спосіб включає етап, на якому людині-пацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль у добовій дозі 0,6 мг лаквінімоду, щоб таким чином знизити прогресування атрофії головного мозку в людини-пацієнта. Даний винахід також передбачає фармацевтичну пероральну одиничну лікарську форму 0,6 мг лаквінімоду для застосування у зниженні атрофії головного мозку у людини-пацієнта з рецидивно-ремітуючим розсіяним склерозом. 6 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід також передбачає спосіб зниження контрольованої за допомогою MRI активності захворювання у людини-пацієнта з рецидивно-ремітуючим розсіяним склерозом, при цьому спосіб включає етап, на якому людині-пацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль у добовій дозі 0,6 мг лаквінімоду, щоб таким чином знизити контрольовану за допомогою MRI активність захворювання у людини-пацієнта з рецидивноремітуючим розсіяним склерозом. У варіанті здійснення контрольована за допомогою MRI активність захворювання являє собою сумарне число підсилених осередків на T 1-зважених зображеннях, сумарне число нових гіпоінтенсивних осередків на T 1-скануваннях та сумарне число нових T 2-осередків. В іншому варіанті здійснення контрольована за допомогою MRI активність захворювання являє собою середнє сумарне число Gd-підсилених осередків, кількості Gd-підсилених осередків, зміну в видимому T2-осередку або зміну об’єму головного мозку. У додатковому варіанті здійснення даного винаходу за допомогою перорального введення лаквінімоду або його фармацевтично прийнятної солі людині-пацієнту з рецидивно-ремітуючим розсіяним склерозом у добовій дозі 0,6 мг лаквінімоду збільшують шанси пацієнта уникнути захворювання або активності захворювання. В одному варіанті здійснення шанси пацієнта уникнути захворювання збільшуються щонайменше на 50% або щонайменше на 55% у порівнянні з такими пацієнта, який не отримує лікування лаквінімодом. В іншому варіанті здійснення шанси пацієнта уникнути активності захворювання збільшуються щонайменше на 40% або щонайменше Даний винахід також передбачає спосіб контрольованої за допомогою MRI активності захворювання у людини-пацієнта з рецидивно-ремітуючим розсіяним склерозом, при цьому спосіб включає етап, на якому людині-пацієнту перорально вводять лаквінімод або його фармацевтично прийнятну сіль у добовій дозі 0,6 мг лаквінімоду, щоб таким чином знизити контрольовану за допомогою MRI активність захворювання у людини-пацієнта з рецидивноремітуючим розсіяним склерозом. У варіанті здійснення контрольована за допомогою MRI активність захворювання являє собою сумарне число підсилених осередків на T 1-зважених зображеннях, сумарне число нових гіпоінтенсивних осередків на T 1-скануваннях та сумарне число нових T2-осередків. В іншому варіанті здійснення контрольована за допомогою MRI активність захворювання являє собою середнє сумарне число Gd-підсилених осередків, кількості Gd-підсилених осередків, зміну в видимому T2-осередку або зміну об’єму головного мозку. Даний винахід також передбачає фармацевтичну пероральну одиничну лікарську форму 0,6 мг лаквінімоду для застосування у зниженні контрольованої за допомогою MRI активності захворювання у людини-пацієнта з рецидивно-ремітуючим розсіяним склерозом. У додатковому варіанті здійснення даного винаходу за допомогою перорального введення лаквінімоду або його фармацевтично прийнятної солі людині-пацієнту з рецидивно-ремітуючим розсіяним склерозом у добовій дозі 0,6 мг лаквінімоду поліпшують шанси пацієнта уникнути захворювання або активності захворювання. В одному варіанті здійснення шанси пацієнта уникнути захворювання збільшуються щонайменше на 50% або щонайменше на 55% у порівнянні з такими пацієнта, який не отримує лікування лаквінімодом. В іншому варіанті здійснення шанси пацієнта уникнути активності захворювання збільшуються щонайменше на 40% або щонайменше на 45% у порівнянні з такими пацієнта, який не отримує лікування лаквінімодом. Стосовно вищевказаних варіантів здійснення, кожний варіант здійснення, розкритий в даному документі, вважається застосовним до кожного іншого розкритого варіанта здійснення. Фармацевтично прийнятна сіль лаквінімоду, як застосовується в даній заявці, включає літій, натрій, калій, магній, кальцій, марганець, мідь, цинк, алюміній та залізо. Склади солі лаквінімоду та спосіб одержання таких розкриті, наприклад, в опублікованій заявці на патент США № 2005/0192315 та опублікованій міжнародній заявці PCT № WO 2005/074899, які включені в дану заявку шляхом посилання. Одиниця дозування може включати одну сполуку або суміші її сполук. Одиниця дозування може бути одержана для пероральних лікарських форм, таких як таблетки, капсули, пігулки, порошки та гранули. Лаквінімод можна вводити у домішку з придатними фармацевтичними розчинниками, розріджувачами, наповнювачами або носіями (разом розглянуті в даному документі як фармацевтично прийнятний носій), відповідно вибраними з урахуванням передбачуваної форми введення та відповідно до усталеної фармацевтичної практики. Одиниця повинна бути у формі, придатній для перорального введення. Лаквінімод може бути введений окремо, але, як правило, змішується з фармацевтично прийнятним носієм та сумісно вводиться у формі 7 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 60 таблетки або капсули, ліпосоми або як агломерований порошок. Приклади придатних твердих носіїв включають лактозу, цукрозу, желатин та агар. Капсула або таблетки можуть бути легко сформовані та можуть бути зроблені для легкого ковтання або жування; інші тверді форми включають гранули та нефасовані порошки. Таблетки можуть містити придатні зв'язувальні речовини, змащувальні речовини, розчинники, засоби для поліпшення розпаду, барвники, ароматизатори, засоби, що перешкоджають злежуванню, та засоби, що знижують температуру замерзання. Конкретні приклади способів, фармацевтично прийнятних носіїв та наповнювачів, що можуть бути застосовані для складання пероральних лікарських форм даного винаходу, описані, наприклад, в опублікованій заявці на патент США № 2005/0192315, опублікованих міжнародних заявках PCT №№ WO 2005/074899, WO 2007/047863 та 2007/146248. Загальні способи та композиції для створення лікарських форм, придатних для даного винаходу, описані в наступних посиланнях: 7 Modern Pharmaceutics, Chapters 9 and 10 (Banker & Rhodes, Editors, 1979); Pharmaceutical Dosage Forms: Tablets (Lieberman et al., 1981); Ansel, Introduction to Pharmaceutical Dosage Forms 2nd Edition (1976); Remington's Pharmaceutical Sciences, 17th ed (Mack Publishing Company, Easton, Pa., 1985); Advances in Pharmaceutical Sciences (David Ganderton, Trevor Jones, Eds., 1992); Advances in Pharmaceutical Sciences Vol 7 (David Ganderton, Trevor Jones, James McGinity, Eds., 1995); Aqueous Polymeric Coatings for Pharmaceutical Dosage Forms (Drugs and the Pharmaceutical Sciences, Series 36 (James McGinity, Ed., 1989); Pharmaceutical Particulate Carriers: Therapeutic Applications: Drugs and the Pharmaceutical Sciences, Vol 61 (Alain Rolland, Ed., 1993); Drug Delivery to the Gastrointestinal Tract (Ellis Horwood Books in the Biological Sciences. Series in Pharmaceutical Technology; J. G. Hardy, S. S. Davis, Clive G. Wilson, Eds.); Modern Pharmaceutics Drugs and the Pharmaceutical Sciences, Vol. 40 (Gilbert S. Banker, Christopher T. Rhodes, Eds.). Дані посилання в усій їх повноті включені шляхом посилання в дану заявку. Таблетки можуть містити придатні зв'язувальні речовини, змащувальні речовини, засоби для поліпшення розпаду, барвники, ароматизатори, засоби, що перешкоджають злежуванню, та засоби, що знижують температуру замерзання. Наприклад, для перорального введення в формі одиниці дозування, таблетки або капсули, активний лікарський компонент може бути скомбінований з пероральним, нетоксичним, фармацевтично прийнятним, інертним носієм, таким як лактоза, желатин, агар, крохмаль, цукроза, глюкоза, метилцелюлоза, дикальцію фосфат, кальцію сульфат, маніт, сорбіт, мікрокристалічна целюлоза і т. п. Придатні зв'язувальні речовини включають крохмаль, желатин, природні цукри, такі як глюкоза або бета-лактоза, кукурудзяний крохмаль, природні та синтетичні камеді, такі як гуміарабік, трагакант, або альгінат натрію, повідон, карбоксиметилцелюлоза, поліетиленгліколь, воски і т. п. Змащувальні речовини, застосовувані в таких лікарських формах, включають олеат натрію, стеарат натрію, бензоат натрію, ацетат натрію, хлорид натрію, стеаринову кислоту, натрію стеарилфумарат, тальк і т. п. Засоби для поліпшення розпаду включають без обмеження крохмаль, метилцелюлозу, агар, бентоніт, ксантанову камедь, кроскакрмелозу натрію, крохмальгліколят натрію і т. п. Вирази Як застосовується у даному документі, та якщо не вказано інше, кожний із наступних виразів буде мати визначення, викладене нижче. “Доза 0,6 мг лаквінімоду” означає, що кількість лаквінімодової кислоти в препараті складає 0,6 мг, незалежно від формі препарату. Таким чином, у формі солі, наприклад сіль лаквінімоду натрію, вага сольової форми, необхідна для забезпечення дози 0,6 мг лаквінімоду, буде більше 0,6 мг через наявність додаткового іону солі. “Рецидивно-ремітуючий розсіяний склероз” або “RRMS” характеризується чітко визначеними гострими нападами з повним одужанням або з ускладненням та залишковою недостатністю після одужання, де періоди між рецидивами захворювання характеризуються відсутністю прогресування захворювання (Lublin, 1996). “Підтверджений рецидив” визначається як прояв однієї або декількох нових неврологічних патологій або повторний прояв однієї або декількох попередньо спостережуваних неврологічних патологій, де зміна клінічного стану триває щонайменше 48 годин, та безпосередньо передує поліпшенню неврологічного стану протягом щонайменше тридцяти (30) днів від початку попереднього рецидиву. Даний критерій відрізняється від клінічного визначення рецидиву, яке вимагає всього лише 24-годинну тривалість симптомів (EMEA Guideline, 2006). Оскільки “у дослідженні” визначення рецидиву повинно бути підтверджене об'єктивною неврологічною оцінкою, як обговорюється нижче, неврологічна недостатність повинна підтримуватися досить довго для усунення псевдорецидивів. 8 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 60 Подія являє собою рецидив тільки тоді, коли симптоми суб'єкта супроводжуються спостережуваними об'єктивними неврологічними змінами відповідно щонайменше до одного з наступних: підвищення щонайменше на 0,5 балу EDSS у порівнянні з попередньою оцінкою, підвищення на одну ступінь балу 2 або більше 7 FS функцій у порівнянні з попередньою оцінкою або підвищення на 2 ступені балу однієї FS у порівнянні з попередньою оцінкою. Крім того, суб’єкт не повинен зазнавати будь-яких гострих метаболічних змін, таких як лихоманка або інша медична патологія. Зміна у функції кишечника/сечового міхура або в когнітивній функції не повинна цілком відповідати за зміни в балах EDSS або FS . “Частота рецидивів” - це число підтверджених рецидивів за одиницю часу. “Річна частота рецидивів” – це середнє значення числа підтверджених рецидивів кожного пацієнта, помножене на 365 та поділене на число днів, протягом яких пацієнт приймає ліки, що досліджуються. “Розширена шкала інвалідизації” або “EDSS” є рейтинговою системою, яка часто застосовується для класифікації та стандартизації стану людей з розсіяним склерозом. Бал знаходиться в діапазоні від 0,0, що представляє норму при неврологічному огляді, до 10,0, що представляє смерть через MS. Бал оснований на неврологічному тестуванні та обстеженні функціональних систем (FS), які являються ділянками центральної нервової системи, що контролює функції організму. Функціональними системами являються: пірамідна (здатність ходити), церебелярна (координація), стовбура мозку (мова та ковтання), сенсорна (дотик та біль), функції кишечника та сечового міхура, зорова, розумова та інші (включають будь-які інші неврологічні дані, обумовлені MS) (Куртцке JF, 1983). “Підтверджене прогресування” за EDSS або “підтверджене прогресування захворювання”, яке вимірюється балом за EDSS, визначається як збільшення на 1 одиницю від початкового рівня за EDSS, якщо початковий рівень за EDSS становив від 0 до 5,0, або збільшення на 0,5 одиниці, якщо початковий рівень за EDSS становив 5,5. Для того, щоб вважатися підтвердженим прогресуванням, зміна (або на 1 одиницю, або на 0,5 одиниці) повинна тривати щонайменше 3 місяці. Крім того, підтвердження прогресування не може бути зроблене під час рецидиву. “Побічне явище” або “AE” означає будь-який несприятливий медичний прояв у суб'єкта при клінічному випробуванні з введенням медичного продукту, який не має причинно-наслідкового зв’язку з лікуванням. Тому побічне явище може бути будь-якою несприятливою та непередбаченою ознакою, яка включає патологічні лабораторні дані, симптом або захворювання, тимчасово пов’язані із застосуванням досліджуваного медичного продукту, що так чи інакше вважаються пов’язаними з досліджуваним медичним продуктом. “Індекс здатності пересуватися” або “AI” являє собою шкалу оцінок, розроблену Хаузером та інш., для визначення мобільності шляхом оцінки часу та ступеня допомоги, необхідних для проходження 25 футів. Бали знаходяться у діапазоні від 0 (безсимптомний та повністю активний) до 10 (прикутий до ліжка). Пацієнта просять пройти відмічений 25-футових шлях так швидко та безпечно, наскільки це можливо. Експерт записує час та тип допомоги (наприклад, палиця, ходунки, милиці) (Hauser, 1983). “EQ-5D” є стандартизованим інструментом анкетування для застосування в якості показника ефекту лікування, застосовного до ряду станів здоров’я та лікування. Він забезпечує простий описовий профіль та окреме задане значення для стану здоров’я, які можуть бути використані у клінічній та економічній оцінках медичної допомоги, а також медичних обстеженнях здоров’я населення. EQ-5D був розроблений групою “EuroQoL”, яка включає мережу міжнародних, багатомовних, міждисциплінарних дослідників за походженням із семи центрів в Англії, Фінляндії, Нідерландах, Норвегії та Швеції. Анкета EQ-5D є у відкритому доступі та може бути отримана від EuroQoL. “Gd-підсилений осередок” стосується осередків, які є результатом порушення гематоенцефалічного бар'єра, що проявляються при контрастуванні із застосуванням контрастних засобів на основі гадолінію. Підсилення гадолінієм забезпечує інформацію щодо віку осередку, як наприклад, Gd-підсилені осередки типово проявляються в шеститижневий період від утворення осередків. “Візуалізація перенесення намагніченості” або “MTI” основана на взаємодії намагніченості (через біполярний та/або хімічний обмін) між протонами води основного об’єму та макромолекулярними протонами. Шляхом прикладання нерезонансного високочастотного імпульсу до макромолекулярних протонів насиченість цих протонів потім переноситься до протонів води основного об’єму. Результатом є зниження сигналу (зменшується результуюча намагніченість видимих протонів), залежно від абсолютної величини MT між макромолекулами тканини та води основного об’єму. “MT” або “перенесення намагніченості” стосується перенесення поздовжньої намагніченості від ядра водню води, що має обмежений рух, до ядра 9 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 60 водню води, що рухається з великим числом ступенів свободи. За допомогою MTI можна побачити присутність або відсутність макромолекул (наприклад, у мембранах або тканині головного мозку) (Mehta, 1996; Grossman, 1994). “Магнітно-резонансна спектроскопія” або “MRS” є спеціалізованим способом, пов’язаним з магнітно-резонансною томографією (MRI). MRS застосовуються для визначення рівнів різних метаболітів у тканинах організму. Сигнал MR виробляє спектр резонансів, що відповідають різним молекулярним розташуванням ізотопу, що є "збудженим". Ця ознака застосовується для діагностики деяких метаболічних порушень, особливо тих, які впливають на мозок (Rosen, 2007), а також для забезпечення інформації про метаболізм пухлини (Golder, 2007). “Модифікованої шкали впливу втоми” або “MFIS” є затвердженим конкретним повідомленим суб’єктом показником результату, розробленим для оцінки впливу втоми на життя людей з MS. Даний інструмент забезпечує оцінку ефектів втоми з точки зору фізичного, когнітивного та психосоціального функціонування. Детальна MFIS складається з 21 пункту, в той час як скорочена версія має 5 пунктів (Fisk et al., 1994). “Комплексна функціональна оцінка при MS” або “MSFC” є показником результату хвороби стосовно MS. MSFC включає кількісні функціональні показники трьох ключових клінічних величин MS: функція нижніх кінцівок/здатність до пересування, функція верхніх кінцівок/кисті та когнітивна функція. Бали складових показників переводять у стандартні бали (z-бали), які усереднюють для утворення єдиного балу MSFC (Fischer, 1999). “SF-36” є багатоцільовою стислою формою медичного обстеження з 36 запитаннями, яка дає 8-бальний профіль функціонального здоров’я та бали самопочуття, а також сумарні показники фізичного та психічного здоров’я на психометричній основі та індекс корисності для здоров’я на основі переваги. Це загальний показник, а не показник, націлений на конкретний вік, захворювання або групу лікування. Опитувальний лист розроблений та може бути одержаний від QualityMetric, Inc., Провіденс, Род-Айленд. “T1-зважене зображення MRI” стосується MR-зображення, що посилюється контрастом T 1, за допомогою чого можна спостерігати осередки. Патологічні ділянки на T 1-зваженому зображені MRI являються “гіпоінтенсивними” та виглядають темними плямами. Такі плями, як правило, являються більш старими осередками. “T2-зважене зображення MRI” стосується MR-зображення, що посилюється контрастом T 2, за допомогою чого можна спостерігати осередки. T 2-осередки представляють нову активність запалення. "Фармацевтично прийнятний носій" стосується носія або наповнювача, який придатний для застосування людьми та/або тваринами без надмірних шкідливих побічних явищ (таких як токсичність, подразнення та алергічна реакція) відповідно до доцільного співвідношення користь/ризик. Це може бути фармацевтично прийнятний розчинник, засіб, що суспендує, або середовище для доставки даних сполук суб’єкту. Зрозуміло, що коли передбачається діапазон параметру, всі цілі числа в межах цього діапазону та їх десяті також передбачені даним винаходом. Наприклад, “5-10%” включає 5,0%, 5,1%, 5,2%, 5,3%, 5,4% і т. д. до 10,0%. Даний винахід буде більш зрозумілим з посиланням на докладний опис експерименту, який викладений нижче, але фахівцям в даній галузі буде легко оцінити, що конкретні докладно описані експерименти лише ілюструють даний винахід, який більш повно описаний у викладеній далі формулі винаходу. Докладний опис експерименту ПРИКЛАД 1. Клінічне випробування (фаза III) – оцінка перорального лаквінімоду у попередженні прогресування MS Для оцінювання ефективності, безпечності та толерантності добового перорального введення 0,6 мг лаквінімоду у суб'єктів з рецидивно-ремітуючим розсіяним склерозом (RRMS) проводили міжнародне (24 країни), багатоцентрове (приблизно 139 центрів), рандомізоване, подвійно-сліпе, в паралельних групах, плацебо-контрольоване клінічне випробовування (“ALLEGRO” або MS-LAQ-301) тривалістю 24 місяці. Одну тисячу сто шість (1106) пацієнтів порівну рандомізували або для 0,6 мг лаквінімоду, або плацебо, та лікували подвійно-сліпим методом, а характеристики початкового рівня були пропорційними між групами. Основним кінцевим показником дослідження було число підтверджених рецидивів протягом періоду подвійно-сліпого лікування, яке відповідає річній частоті рецидивів (ARR - число рецидивів, поділене на сумарну експозицію всіх пацієнтів). Вторинний кінцевий показник включав недієздатність, як визначали за підтвердженими на місяці 3 змінами згідно розширеної шкали інвалідизації (EDSS), та сумарне число підсилених гадолінієм осередків (GdE) та нових/збільшуваних T 2-осередків на MRI. 10 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 Назва дослідження Міжнародне, багатоцентрове, рандомізоване, подвійно-сліпе плацебо-контрольоване дослідження в паралельних групах для оцінювання безпеки, толерантності та ефективності добового перорального введення 0,6 мг лаквінімоду у суб'єктів з рецидивно-ремітуючим розсіяним склерозом (RRMS). Тривалість дослідження Фаза скринінгу: 1 місяць. Подвійна сліпа фаза лікування: 24 місяці, пероральне введення один раз на добу добової дози 0,6 мг лаквінімоду або відповідного плацебо. При сліпому коливанні та потужному переоцінюванні прогресування популяції (заплановано до завершення першим суб’єктом 20-місячного лікування) тривалість подвійного сліпого дослідження може бути продовжена до 30 місяців. Це планується з метою посилення статистичної потужності для виявлення ефекту лаквінімоду на накопичення інвалідизації. Рекомендація продовжити тривалість дослідження основана на попередньо встановленому правилі. Популяція дослідження Рецидивно-ремітуючий розсіяний склероз (RRMS). Схема дослідження Придатних суб'єктів порівну рандомізували 1:1 в одну з наступних груп лікування: 1. Капсули з 0,6 мг лаквінімоду: одну капсулу з 0,6 мг лаквінімоду вводили перорально один раз на добу. Капсули з 0,6 мг лаквінімоду містили 0,6 мг лаквінімодової кислоти на капсулу з меглуміном та були виготовлені за способом, розкритим в опублікованій міжнародній заявці PCT № WO/2007/146248, опублікованій 21 грудня 2007 року (дивись від сторінки 10, рядка 5 до сторінки 11, рядка 3). 2. Відповідне плацебо для групи лаквінімоду: одну капсулу вводили один раз на добу. Суб'єктів оцінювали в центрах проведення дослідження протягом 12 запланованих візитів подвійної сліпої фази у місяцях -1 (скринінг), 0 (початковий рівень), 1, 2, 3, 6, 9, 12, 15, 18, 21 та 24 (завершення/передчасне припинення). У випадку подовженого на 6 місяців дослідження суб'єктів оцінювали в центрах проведення дослідження на місяцях 27 та 30 (завершення/передчасне припинення подовженого дослідження), у даному випадку регулярний візит, запланований на місяць 24. EDSS оцінювали кожні 3 місяці, MSFC – кожні 6 місяців, та проводили MRI щорічно в усіх пацієнтів. Підгрупу пацієнтів (n = 189) піддавали додатковому MRI скануванню на місяцях 3 та 6. Суб'єктам, що успішно завершили дослідження, була надана можливість перейти до 1-річної подовженої фази без контролю плацебо. Пацієнти, які припинили участь у дослідженні, пройшли останній кінцевий візит, та їх далі не оцінювали, за виключенням тих, хто припинив участь через побічні явища. Наступні оцінки проводили в конкретні моменти часу: 1. Показники життєво важливих функцій визначали при кожному візиті дослідження. 2. Фізичне обстеження проводили на місяцях -1 (скринінг), 0 (початковий рівень) 1, 3, 6, 12, 18 та 24 (завершення/передчасне припинення основного дослідження). У випадку подовженого на 6 місяців дослідження проводили додаткове обстеження на місяці 30 (завершення/передчасне припинення подовженого дослідження). 3. Проводили наступні клінічні лабораторні аналізи на безпечність: a. Клінічний аналіз крові (CBC) з підрахунком формених елементів - при всіх запланованих візитах. Кількість ретикулоцитів додавали до CBC на місяцях 0 (початковий рівень) та 24/30 (завершення/передчасне припинення). b. Біохімічний аналіз крові (включаючи електроліти, ферменти печінки, прямий та загальний білірубін, та підшлункову амілазу, а також CPK) та аналіз сечі – при всіх запланованих візитах. c. Експрес-аналіз сечі на β-hCG проводили у жінок дітородного віку на початковому рівні (місяць 0) а потім при кожному запланованому візиті дослідження (у центрі). d. Аналіз на β-hCG у жінок дітородного віку проводили при всіх запланованих візитах. e. Починаючи з візиту на місяці 3, експрес-аналіз сечі на β-hCG проводили у жінок дітородного віку кожні 28 (±2) днів. З суб'єктом зв’язувались по телефону не пізніше 72 годин після виконання запланованого аналізу та задавали конкретні питання щодо аналізу. У разі підозри на вагітність (позитивний результат аналізу сечі на β-hCG) оператор переконується, що прийом досліджуваного лікарського засобу припинено та дає вказівку суб'єкту прибути в центр якомога швидше з усіма досліджуваними лікарськими засобами. 11 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 4. Маркери запалення (сироватковий звичайний C-реактивний білок та фібриноген) – при скринінгу, початковому рівні та потім при всіх запланованих візитах. 5. Протягом перших 3 місяців кожні два тижні персонал центру здійснював періодичні телефонні дзвінки. Суб'єктам надавали перелік попередньо визначених питань, пов’язаних з ознаками/симптомами, що вказують на судинний тромбоз. 6. ECG проводили на місяці -1 (скринінг; проводили додатковий запис до 30 хвилин окремо, якщо QTc складав менше 450 мс), (початковий рівень; три записи, 15 хвилин окремо), 1, 2, 3, 6, 12, 18 та 24 (завершення/передчасне припинення). У випадку подовженого на 6 місяців дослідження ECG проводили на місяці 30 (завершення/передчасне припинення подовженого дослідження). 7. Рентгенографію грудної клітини проводили на місяці 1 (скринінг) (якщо не проводили за 7 місяців до скринінгового візиту). 8. Протягом усього дослідження контролювали побічні явища (AE). 9. Протягом усього дослідження контролювали супутні лікарські засоби. 10. Неврологічні оцінювання, включаючи розширену шкалу інвалідизації (EDSS), тест на проходження 25 футів/індекс здатності пересуватися (AI), функціональні системи (FS) проводили на місяці 1 (скринінг), місяці 0 (початковий рівень) та кожні 3 місяці протягом дослідження та періоду подовженого дослідження. 11. Комплексну функціональну оцінку при MS (MSFC) проводили на місяці 1 (скринінг) (три методи тільки для навчальних цілей), на місяцях 0 (початковий рівень), 6, 12, 18 та 24 (завершення/передчасне припинення). У випадку подовженого на 6 місяців дослідження останню MSFC проводили на місяці 30 (завершення/передчасне припинення подовженого дослідження). 12. Повідомлену суб’єктом втому оцінювали за модифікованою шкалою впливу втоми (MFIS) на місяцях 0, 6, 12, 18 та 24 (завершення/передчасне припинення). У випадку подовженого на 6 місяців дослідження додаткову MFIS проводили на місяці 30 (завершення/передчасне припинення подовженого дослідження). 13. Загальний стан здоров’я оцінювали за анкетою EuroQoL (EQ5D) на місяці 0 (початковий рівень) та місяці 24 (завершення/передчасне припинення дослідження). У випадку подовженого на 6 місяців дослідження останнє EuroQoL (EQ5D) проводили на місяці 30 (завершення/передчасне припинення подовженого дослідження) замість місяця 24. 14. Загальний стан здоров’я оцінювали за заповненою суб’єктом короткою формою анкети про загальний стан здоров’я (SF-36) на місяці 0 (початковий рівень), а потім кожні 6 місяців до завершення/передчасного припинення. 15. Проводили 5 оцінювань бінокулярної низькоконтрастної гостроти зору суб'єктів із застосуванням таблиць з 100%, 2,5% та 1,25% рівнями контрасту [Sloan letter або Tumbling-E] при кожному оцінюванні на місяцях 0 (початковий рівень), 6, 12, 18 та 24 (завершення/передчасне припинення). У випадку подовження дослідження на 6 місяців додаткове оцінювання бінокулярної низькоконтрастної гостроти зору проводили на місяці 30 (завершення/передчасне припинення подовженого дослідження). 16. У всіх суб'єктів збирали зразки сироватки крові для вивчення потенціального механізму дії лаквінімоду та додаткових біомаркерів запалення та потенційних біомаркерів захворювання MS на місяцях 0, 1, 12 та 24. У випадку подовження дослідження на 6 місяців останній зразок сироватки крові відбирали на місяці 30 (завершення/передчасне припинення терапії подовженого дослідження) замість місяця 24. 17. Суб'єкти проходили 3 MRI сканування на місяцях 0 (початковий рівень), 12 та 24 (завершення/передчасне припинення). У випадку подовженого на 6 місяців дослідження додаткове MRI проводили на місяці 30 (завершення/передчасне припинення подовженого дослідження). 18. Дослідження PK популяції (PPK): у всіх суб'єктів для оцінювання PPK збирали зразки крові на місяцях 1, 12 та 24. У випадку подовження дослідження на 6 місяців останнє оцінювання PPK проводили на місяці 30 (завершення/передчасне припинення подовженого дослідження) замість місяця 24. 19. Протягом дослідження підтверджували/контролювали рецидиви. Оскільки “у дослідженні” визначення рецидиву повинне бути підтверджене об’єктивним неврологічним оцінюванням, неврологічна недостатність повинна підтримуватися досить довго для усунення псевдорецидивів. Отже, в даному клінічному випробуванні рецидивом була поява однієї або декількох нових неврологічних патологій або повторна поява однієї або декількох попередньо спостережуваних неврологічних патологій, де зміна клінічного стану триває протягом 12 UA 111959 C2 5 щонайменше 48 годин та безпосередньо передує поліпшенню неврологічного стану протягом щонайменше тридцяти (30) днів від початку попереднього рецидиву. 20. Дозволеним лікуванням рецидиву було внутрішньовенне введення метилпреднізолону 1 г/доба протягом до 5 днів поспіль. Характеристики початкового рівня захворювання пацієнтів показані в таблиці 1 нижче. Таблиця 1 Характеристика 0,6 мг лаквінімоду на добу (n = 550) Плацебо (n = 556) Всього (N = 1106) Рецидиви за останній рік до скринінгу Середнє значення (SD) Медіанне значення Діапазон 1,2 (0,7) 1,0 Від 0,0 до 4,0 1,3 (0,7) 1,0 Від 0,0 до 5,0 1,2 (0,7) 1,0 Від 0,0 5,0 до Рецидиви за останні 2 роки до скринінгу Середнє значення (SD) Медіанне значення Діапазон 1,9 (1,0) 2,0 Від 0,0 до 7,0 1,9 (1,0) 2,0 Від 0,0 до 7,0 1,9 (1,0) 2,0 Від 0,0 7,0 до EDSS Середнє значення (SD) Медіанне значення Діапазон 2,6 (1,3) 2,5 0,0-5,5 2,6 (1,3) 2,5 0,0-6,0 2,6 (1,3) 2,5 Від 0,0 6,0 до Час від першого симптому (роки) Середнє значення (SD) Медіанне значення Діапазон 8,7 (6,9) 7,0 Від 0,5 до 34,5 8,7 (6,7) 7,0 Від 0,4 до 32,8 8,6 (6,8) 7,0 Від 0,4 34,5 до 206 210 (38,2%) 132 76 4 84 212 221 (39,7%) 123 82 3 89 418 431 (38,9%) 1,7 (3,9) 0,0 0,0-30,0 2,0 (5,7) 0,0 0,0-84,0 1,9 (4,9) 0,0 0,0-84,0 7,27 (46,1) 6,3 Від 0,0 до 82,1 7,31 (44,8) 6,8 Від 0,0 до 77,5 7,29 (45,5) 1578,9 (94,3) 1578,0 Від 1312,0 до 1823,0 1584,7 (92,1) 1590 Від 1299,0 до 1824,0 1581,3 (93,2) 1583,0 Від 1299,0 до 1824,0 Історія лікування, що модифікує захворювання Число (%) Інтерферон бета-1a Інтерферон бета-1b Інтерферон Глатірамеру ацетат Число GdE-осередків при T1 Середнє значення (SD) Медіанне значення Діапазон 3 Об’єм осередку при T2, мм Середнє геометричне (CV%) Медіанне значення Діапазон Нормалізоване значення об’єму 3 головного мозку, см Середнє значення (SD) Медіанне значення Діапазон 10 Критерій повторної згоди При підтвердженому діагнозі рецидиву MS (як визначено у протоколі) або підвищенні EDSS на ≥ 2,0 одиниці, що тривало протягом ≥ 3 місяців, були здійснені наступні дії: 1. Суб'єкту нагадували про доступні в даний час лікарські засоби щодо MS та можливість припинити дослідження, як записано у формі інформованої згоди. 13 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 2. Суб'єкту пропонували повторно підписати форму інформованої згоди, якщо він/вона хоче продовжити брати участь у дослідженні при тому самому призначенні лікування. Правила зупинки задля безпеки встановлені в місці для контролю: 1) підвищений рівень ферментів печінки, 2) запальні явища, 3) явища тромбоутворення та 4) панкреатит. Допоміжні дослідження: 1. Багатократні MRI (тільки окремі країни та центри): сумарне число T1-Gd підсилених осередків, взяте зі сканувань, одержаних на місяцях 0, 3, 6, 12, та 24, а у випадку подовженого дослідження - 30. Додаткові MRI для допоміжного дослідження проводили на місяцях 3 та 6. 2. Перенесення намагніченості (MT) (тільки окремі країни та центри): зміна від початкового рівня до місяця 12 та місяця 24/30 при перенесенні намагніченості MRI. MT оцінювали на місяцях 0 (початковий рівень), 12 та 24 (завершення/передчасне припинення). У випадку подовженого на 6 місяців дослідження останнє MT проводили на місяці 30 (завершення/передчасне припинення подовженого дослідження) замість місяця 24. 3. Магнітно-резонансна спектроскопія (MRS) (тільки окремі країни та центри): зміна від початкового рівня до 24/30 при магнітно-резонансній спектроскопії (співвідношення NAAS : Cr в осередках, біла речовина, що зазвичай виявляється). MRS оцінювали на місяцях 0 (початковий рівень) та 24 (завершення/передчасне припинення). У випадку подовженого на 6 місяців дослідження останню MRS проводили на місяці 30 (завершення/передчасне припинення подовженого дослідження) замість місяця 24. 4. Фармакогенетична оцінка (PGx): у всіх суб'єктів при скринінгу збирали зразки крові для параметрів PGx. 5. Атрофію головного мозку, яка визначається за відсотковим відношенням зміни об’єму головного мозку від одного сканування до наступного сканування, додатково до вимірювань виконували в основному дослідженні (постійна MRI група людей). 6. Для оцінювання імунної відповіді на лікування лаквінімодом та додаткового дослідження потенційного механізму дії збирали зразки цільної крові та сироватки крові (тільки окремі країни та центри). Зразки цільної крові збирали на місяцях 0, 1, 3, 6, 12 та 24. Зразки сироватки крові збирали на місяцях 0, 1, 6, 12 та 24 (навіть якщо дослідження подовжували до місяця 30). 7. Взаємозв’язок між PGx та відповіддю на лаквінімод з точки зору клінічних параметрів, параметрів MRI та параметрів безпеки. Критерій включення/виключення Критерій включення 1. У суб'єктів повинен бути підтверджений та задокументований діагноз, як визначено уточненими критеріями Макдональда (Polman, 2005), з рецидивно-ремітуючим перебігом захворювання. 2. Суб'єкти повинні бути не прикутими до ліжка з балом перетвореної EDSS Куртцке 0-5,5. 3. Суб'єкти мають бути у стабільному неврологічному стані та не приймати лікування кортикостероїдами [внутрішньовенне (iv), внутрішньом'язове (im) та/або пероральне (po)] за 30 днів до скринінгу (1 місяць). 4. Суб'єкти повинні перенести одне з наступного: a. Щонайменше один задокументований рецидив протягом 12 місяців до скринінгу. b. Щонайменше два задокументовані рецидиви протягом 24 місяців до скринінгу. c. Один задокументований рецидив між місяцями 12 та 24 до скринінгу зі щонайменше одним задокументованим T1-Gd підсиленим осередком на MRI, виконаній не пізніше 12 місяців до скринінгу. 5. Суб'єкти повинні бути у віці від 18 до 55 років, включно. 6. Тривалість захворювання у суб'єктів має складати щонайменше 6 місяців (від першого симптому) до скринінгу. 7. Жінки дітородного віку повинні застосовувати прийнятний спосіб попередження вагітності. Прийнятний спосіб попередження вагітності в даному дослідженні включає: хірургічну стерилізацію, внутрішньоматкові засоби, пероральні контрацептиви, контрацептивний пластир, ін’єкційний контрацептив тривалої дії, вазектомію партнера або спосіб подвійного бар’єру (презерватив або діафрагма зі сперміцидом). 8. Суб'єкти повинні бути спроможні поставити підпис та дату в письмовій інформованій згоді для включення в дослідження. 9. Суб'єкти повинні бути готові та спроможні дотримуватись вимог протоколу протягом дослідження. Критерій виключення 1. Суб'єкти з прогресивними формами MS. 14 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 60 2. Виникнення рецидиву, нестабільний неврологічний стан або будь-яке лікування кортикостероїдами [(iv), внутрішньом'язове (im) та/або пероральне (po)] або ACTH між місяцем 1 (скринінг) та 0 (початковий рівень). 3. Застосування експериментальних або досліджуваних лікарських засобів та/або участь у клінічних дослідженнях лікарського засобу за 6 місяців до скринінгу. 4. Застосування імуносупресорів, включаючи мітоксантрон (Novantrone®), або цитотоксичний засобів за 6 місяців до скринінгового візиту. 5. Попереднє застосування будь-якого одного з наступного: наталізумабу (Tysabri®), калдрибіну, лаквінімоду. 6. Попереднє лікування глатірамеру ацетатом (Copaxone®), інтерфероном-β (або 1a, або 1b) або внутрішньовенним імуноглобуліном (IVIG) за 2 місяці до скринінгового візиту. 7. Систематичне лікування кортикостероїдами тривалістю ≥ 30 днів поспіль за 2 місяці до скринінгового візиту. 8. Попереднє повне опромінення тіла або повне лімфоїдне опромінення. 9. Попереднє лікування стовбуровими клітинами, аутогенна трансплантація кісткового мозку або алогенна трансплантація кісткового мозку. 10. Відома історія хвороби туберкульозом. 11. Гостра інфекція за два тижні до візиту початкового рівня. 12. Велика травма або хірургічне втручання за два тижні до візиту початкового рівня. 13. Застосування інгібіторів CYP3A4 за 2 тижні до візиту початкового рівня (1 місяць для флуоксетину). 14. Застосування аміодарону за 2 роки до скринінгового візиту. 15. Вагітність або грудне вигодовування. 16. Підвищення ≥ 3xULN в сироватці крові, або ALT, або AST при скринінгу. 17. Прямий білірубін сироватки крові, який складає ≥ 2xULN при скринінгу. 18. Інтервал QTc, який складає 450 мс (згідно з автоматичним виводом даних) одержаний з: a. двох записів ECG при скринінговому візиті або b. середньої величини, розрахованої з 3 початкових ECG записів. 19. Суб'єкти з клінічно значимим або нестабільним медичним або хірургічним станом, що буде перешкоджати безпечній та повній участі в дослідженні, як визначається за карткою хворого, фізичним обстеженням, ECG, лабораторними аналізами або рентгенографією грудної клітини. Такі стани можуть включати: a. Серцево-судинний або пульмональний розлад, що не може бути добре контрольованим за допомогою стандартного лікування, дозволеного протоколом дослідження. b. Шлунково-кишковий розлад, що може впливати на поглинання досліджуваного лікарського засобу. c. Ниркову недостатність або порушення обміну речовин. d. Будь-яку форму хронічного захворювання печінки. e. Відомий вірус імунодефіциту людини (HIV позитивний статус). f. Сімейний анамнез синдрому продовженого інтервалу QT. g. Історію зловживання наркотиками та/або алкоголем. h. Значний психіатричний розлад. 20. Відома історія чутливості до Gd. 21. Нездатність успішно пройти MRI сканування. 22. Відома гіперчутливість до лікарського засобу, що буде перешкоджати введенню лаквінімоду, така як гіперчутливість до маніту, меглуміну або натрію стеарилфумарату. Оцінки результату Неврологічні оцінювання, включаючи оцінювання безпеки, проводили на скринінгу, початковому рівні та кожні три місяці до місяця 24. Неврологічне обстеження пацієнта та загальні медичні оцінювання проводили два невропатологи для того, щоб мінімізувати можливість розкриття відомостей; при цьому спеціально підготовлений та атестований невропатолог, що проводив огляд, оцінював неврологічний стан, а невропатолог, що проводив лікування, на основі балів EDSS/функціональних систем визначав, чи зазнавав суб'єкт рецидиву. Основний кінцевий показник являв собою число підтверджених рецидивів протягом періоду подвійно-сліпого дослідження. Рецидив визначали як виявлення однієї або декількох нових неврологічних патологій або повторне виявлення однієї або декількох попередньо спостережуваних неврологічних патологій, що тривали протягом щонайменше 48 годин та після поліпшеного неврологічного стану протягом щонайменше 30 днів. Подію приймали за рецидив, якщо симптоми суб'єкта супроводжувались спостережуваними дійсними неврологічними 15 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 60 змінами, що відповідали щонайменше одному з наступного: підвищення балу EDSS щонайменше на 0,5; підвищення на один ступінь двох або більше із семи функціональних систем; або підвищення на два ступені однієї функціональної системи. Стандартизоване лікування рецидивів являло собою внутрішньовенне введення 1 г/доба метилпреднізолону протягом періоду до п’яти днів поспіль на основі висновку невропатолога, який проводив лікування. Вторинні кінцеві показники являли собою прогресування інвалідизації, як визначали шляхом EDSS та комплексної функціональної оцінки при MS (MSFC). Підтверджене прогресування інвалідизації визначали як підвищення на ≥ 1,0 одиниці EDSS від початкового рівня, якщо початковий рівень EDSS становив від 0 до 5,0, або підвищення на ≥ 0,5 одиниці, якщо початковий рівень EDSS становив ≥ 5,5. Для того, щоб підтвердити прогресування за EDSS, дані підвищення повинні тривати протягом щонайменше трьох місяців. Додаткові попередньо визначені кінцеві показники інвалідизації включають співвідношення пацієнтів без підтвердженого прогресування інвалідизації через 24 місяці; підтверджене прогресування інвалідизації (визначене в балах EDSS ≥ 1,0 одиниці стосовно початкового рівня EDSS від 0 до 5,0 або ≥ 5,5), яке тривало протягом 6 місяців; накопичення фізичної інвалідизації, як визначали за середнім EDSS та середньою зміною в EDSS відносно початкового рівня до останньої спостережуваної величини (LOV). Щодо MSFC, показник являв собою загальний z-бал MSFC через 24 місяці (включаючи пацієнтів, які припинили участь через 12 місяців). При скринінгу три рази проводили тест по встановленню штирів у 9 лунок (9HPT) та слуховий тест на додавання в заданому темпі (PASAT), щоб зменшити змішувані ефекти вправи під час випробування. Пов’язані з MRI вторинні кінцеві показники являли собою сумарне число GdE-осередків на місяцях 12 та 24; та сумарне число нових T 2-осередків (відносно попереднього сканування) на місяцях 12 та 24; пошукові кінцеві показники MRI включали визначення відсотка зміни об’єму 10 головного мозку за допомогою SIENA. Додатковий подробиці методик MRI наступні: для всіх пацієнтів MRI-сканування проводили на місяцях 0, 12 та 24. Перш ніж зареєструвати учасників дослідження у центрі, необхідно було двічі зробити знімок пацієнта-добровольця з визначеним MS зі зміною положення згідно строгому протоколу радіологічного дослідження із застосуванням сканерів з мінімальною інтенсивністю поля 1,5 Тл. Для одержання протонної щільності та T2-зважених зображень застосовували послідовності швидке/турбо-спін-ехо (час повторення імпульсу [TR] = 2200– 3500 мс, час затримки ехо-імпульсу [TE] = 14–50/90–120 мс, довжина сліду ехо = 2–7, товщина зрізу = 3 мм та суміжні осьові зрізи = 44). Для кількісного визначення атрофії головного мозку одержували в 3D T1-зважені послідовності з попереднім контрастом високої роздільної здатності (TR = 8-15 мс, TE = 3-5 мс, час інверсійної затримки = 1,1 с, число зрізів 160, товщина зрізу 1,2 мм, кут нахилу [FA] = 10-15, сагітальна орієнтація). В результаті через 5 хвилин після ін’єкції 0,1 ммоль/кг гадолінію одержали T 1-зважені зображення (сканери з 1,5 Tл: звичайна послідовність спін-ехо; TR = 600–650 мс, TE = 10–20 мс, товщина зрізу = 3 мм та суміжні осьові зрізи = 44; сканери з 3,0 Тл: 3D послідовність; TR = 5–9 мс, TE = 2–5 мс, FA = 15, товщина зрізу = 3 мс та суміжні осьові зрізи = 44). Одержували серії аксіальних, фронтальних та сагітальних зображень, щоб створити аксіальне еталонне зображення для подальшої точної зміни положення кожного пацієнта в наступній сесії. Аксіальні зрізи розміщали паралельно лінії, що з’єднує більшість нижньо-передніх та нижньо-задніх частин мозолистого тіла. Якість знімків переглядали на MRI-AC із застосуванням попередньо визначеного критерію. За згодою двох досвідчених експертів провели ідентифікацію GdE та T 2-гіперінтенсивних осередків. Підраховували число всіх та нових GdE-осередків та нових/збільшуваних T 2гіперінтенсивних осередків. Підготовлені спеціалісти потім обводили ідентифіковані осередки із застосуванням напівавтоматичного способу сегментації на основі локального визначення меж (Jim 4.0; Xinapse System, Лестер, Великобританія), а також були автоматично розраховані об’єми осередків. На постконтрастних T 1-зважених зображеннях визначали процентне відношення змін об’єму головного мозку та нормалізовані значення об’ємів головного мозку на основі поперечного перерізу за допомогою програмного забезпечення структурної оцінки зображення із застосуванням нормалізації атрофії (SIENA) та способу поперечного перерізу (SIENAX) (доступний від FMRIB Software Library, Oxford University, Оксфорд, Великобританія; http://www.fmrib.ox.ac.uk/analysis/research/siena/siena). Первинна оцінка результату Число підтверджених рецидивів (та річна частота рецидивів) протягом періоду подвійного сліпого дослідження. Вторинні оцінки результату 16 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 55 60 1. Накопичення фізичної інвалідизації, визначене за часом до підтвердженого прогресування за EDSS, протягом періоду дослідження (підтверджене прогресування за EDSS визначали як підвищення балу EDSS на 1 одиницю від початкового рівня, якщо початковий рівень EDSS складав від 0 до 5,0, або підвищення на 0,5 одиниці, якщо початковий рівень EDSS складав 5,5, підтверджений через 3 місяці; прогресування не може бути підтверджене під час рецидиву). 2. Недієздатність, яку оцінювали балом за MSFC наприкінці періоду лікування (місяць 24/30). 3. Сумарне число нових T2-осередків на скануваннях, отриманих на місяцях 12 та 24 (а також 30, у випадку подовженого на 6 місяців дослідження). 4. Сумарне число підсилених осередків на T 1-зваженихзображеннях, отриманих на місяцях 12 та 24 (а також 30, у випадку подовження дослідження на 6 місяців). Показники результату щодо безпеки та толерантності 1. Побічні явища. 2. Показники життєво важливих функцій. 3. Вага. 4. Фізичне обстеження. 5. Результати електрокардіограми (ECG). 6. Клінічні лабораторні параметри. 7. Відносне число суб'єктів (%), які передчасно припинили участь у дослідженні, причина припинення та час виключення. 8. Відносне число суб'єктів (%), які передчасно припинили участь у дослідженні через AE, та час виключення. Додаткові пошукові кінцеві показники Наступні оцінювання проводили пошуковим способом: 1. Оцінювання сумарного числа нових гіпоінтенсивних осередків на підсилених T 1скануваннях на місяцях 12 та 24 (а також 30, у випадку подовження дослідження на 6 місяців). 2. Наявність повідомленої суб’єктом втоми, як оцінювали за модифікованою шкалою впливу втоми (MFIS). 3. Загальний стан здоров’я за анкетою EuroQoL (EQ5D). 4. Загальний стан здоров’я, оцінений за заповненою суб’єктом короткою формою анкети про загальний стан здоров’я (SF-36). 5. Час до першого підтвердженого рецидиву протягом періоду дослідження. 6. Частота підтверджених рецидивів протягом періоду дослідження, що потребує госпіталізації та/або IV-стероїдів. 7. Відносне число суб'єктів без рецидиву. 8. Зміна об’єму T2-осередку, як визначали за зміною від початкового рівня до місяця 12, від місяця 12 до місяця 24/30 та від початкового рівня до місяця 24/30. 9. Зміна об’єму T1-гіпоінтенсивного осередку, як визначали за зміною від початкового рівня до місяця 12, від місяця 12 до місяця 24/30 та від початкового рівня до місяця 24/30. 10. Атрофія головного мозку, як визначали за співвідношенням зміни від початкового рівня до місяця 12, від місяця 12 до місяця 24/30 та від початкового рівня до місяця 24/30 в об’ємі головного мозку. 11. Зразки сироватки крові збирали у всіх суб'єктів для вивчення потенційного механізму дії лаквінімоду, та додаткових біомаркерів запалення, та потенційних біомаркерів захворювання MS. Дані зразки збирали на місяцях 0 (початковий рівень), 1, 12 та 24 (навіть якщо дослідження подовжували до місяця 30). 12. PK популяції – оцінювали придатність популяційної моделі щодо різних коваріат (такі коваріати як: стать, вік, супутні лікарські препарати, вага, профіль AE, звички). 13. Зміна бінокулярної гостроти зору від початкового рівня до місяця 24/30 (завершення/передчасне припинення), як оцінювали за числом літер, які були правильно прочитані з відстані 2 метрів на таблицях літер Слоуна/Tumbling-E при рівні контрасту 100%, 2,5% та 1,25%. Статистичний аналіз Аналіз загального числа підтверджених рецидивів протягом періоду дослідження оснований на скоригованій щодо початкового рівня квазі-імовірнісній (з підвищеною дисперсією) регресії Пуассона. Застосовуючи регресію Пуассона з групою, учасників якої лікували, в якості коваріати, розраховували ARR кожної групи стосовно групи, сформованої згідно призначеного лікування (ITT), як загальне число підтверджених рецидивів для всіх пацієнтів в кожній групі, розділене на загальну кількість пацієнто-років в цій групі. Наряду з групою, учасників якої 17 UA 111959 C2 5 10 15 20 25 30 35 40 45 50 лікували, включали наступні коваріати: бал EDSS початкового рівня, log (числа рецидивів за попередні 2 роки +1) та країну або географічний регіон. Аналіз накопичення фізичної інвалідизації оснований на моделі пропорційних ризиків Кокса. Аналіз MSFC оснований на скоригованому щодо початкового рівня коваріаційному аналізі. Аналіз вторинних кінцевих показників MRI оснований на скоригованому щодо початкового рівня від'ємному біноміальному розподілі. Для контролю в залежності від похибки I роду вторинні кінцеві показники аналізували тільки після того, як був знайдений значимий ефект для основного кінцевого показника. Більш того, у дослідженні загальну похибку I роду додатково контролювали при аналізі вторинних кінцевих показників шляхом застосування наступного підходу контролю на вході: як сумарне число нових/збільшуваних T 2-осередків, так і сумарне число GdE-осередків перевіряли одночасно на місяцях 12 і 24, і вони повинні були бути статистично значимими при p < 0,05, або один повинен був бути значимим при p 34 дні (n~100) 0,114 0,071 38% зниження 0,359 0,263 27% зниження 0,243 0,976 0,153 0,964 37% зниження 1,3% зниження 1,461 1,806 1,074 1,230 27% зниження 32% зниження 50,2% 43,1% 56,3% 52,8% 28% шансів 47% шансів Нові T1-гіпоінтенсивні осередки - M12 - M24 Без T1-гіпоінтенсивного осередку - M12 - M24 21 UA 111959 C2 Продовження табл. 3 Плацебо BA від M12 до M24 BA для пацієнтів з усіма скануваннями: Зміна BL до M12 до M24 % BVC від BL до M24 Без MRI ТАК НІ Кількості GdE M12 M24 Без GdE-осередку M12 M24 Об’єм GdE M12 M24 Без T2 осередку M12 M24 Новий T2 осередок M12 M24 % зміни BV M24 GdE = 0 GdE > 0 Включаючи T1 GdE за попередніми лікарськими засобами: - інтактний - неінтактний Включаючи T2 за попередніми лікарськими засобами: - інтактний - неінтактний При гіпоінтенсивному T1 за попередніми лікарськими засобами: - інтактний - неінтактний % зміни BV за попередніми лікарськими засобами: - інтактний - неінтактний Час до підтвердженого прогресування (3 міс.) – EDSS MSFC на M24 Лаквінімод Ефект -0,561 -0,548 -0,746 -1,268 -0,337 -0,855 60% 57% -1,078 -1,346 1,142 0,793 59,9% 62,8% 1,109 1,091 24,2% 15,4% 4,23 6,50 -0,533 -1,001 0,731 0,482 69% 74,5% 1,058 1,045 30,8% 20,3% 2,81 4,45 45,5% 65,5% 36% зниження 39% зниження 49% шансів 72% шансів 4,5% 4,7% 39% шансів 40% шансів 33,5% 31,5% -1,218 -1,380 -0,859 -0,881 30% зниження 37% зниження 1,937 2,562 1,135 1,746 42% зниження 32% зниження 7,403 6,661 4,967 5,075 33% зниження 24% зниження 2,189 1,627 1,585 1,217 28% зниження 25% зниження -1,327 -1,241 14% прогресування -0,82 -0,954 9,8% прогресування 0,037 0,056 38% зниження 23% зниження 36% зниження ризику прогресування 34% зниження ризику прогресування *Одужання стосується EDSS до та після нападу 5 Зниження важких рецидивів та уповільнення прогресування інвалідизації при пероральному введенні лаквінімоду Кінцеві показники рецидиву Протягом періоду 24-місячного лікування у пацієнтів, що приймали лаквінімод, у порівнянні з пацієнтами, що приймали плацебо, значно знижувалась ARR (0,304 ± 0,022 проти 0,395 ± 0,027, 22 UA 111959 C2 5 10 15 20 25 30 35 40 45 p = 0,0024, таблиця 2). Даний результат був надійним та достовірним в усіх аналізованих сукупностях. Інші показники, пов’язані з рецидивом, такі як час до першого рецидиву та частоти без рецидиву, також позитивно змінювались в результаті лікування лаквінімодом у порівнянні з плацебо. Процентне відношення пацієнтів без рецидиву складало 62,9% для суб'єктів, що приймали лаквінімод, та 52,24% для суб'єктів, що приймали плацебо (p = 0,0006, таблиця 2), що відповідає підвищенню шансів уникнути рецидиву до 55%. Час до першого рецидиву подовжувався для пацієнтів, що приймали лаквінімод, у порівнянні з учасниками, що приймали плацебо (підвищення до 28,2% часу до першого рецидиву, p = 0,0005), та значно знижувався ризик рецидиву. Частота рецидивів за рік, при якій передбачається госпіталізація та/або внутрішньовенне лікування стероїдами, діагностичний кінцевий показник дослідження, виявлялась значно нижчою для пацієнтів, яких лікували лаквінімодом, у порівнянні з такими у групі плацебо (p = 0,0003). Частота рецидивів, при якій передбачається лікування IVстероїдами, за рік складала на 27% нижче для пацієнтів, що приймали лаквінімод (0,263 проти 0,359, p
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of laquinimod for reducing fatigue, improving functional status, and improving quality of life in multiple sclerosis patients
Автори англійськоюTarcic, Nora, Bar-Zohar, Dan, Kofler, Dina
Автори російськоюТаркик Нора, Бар-Зохар Дан, Кофлер Дина
МПК / Мітки
МПК: A61K 31/47, A61P 25/28
Мітки: втоми, розсіяним, функціонального, стану, склерозом, застосування, поліпшення, життя, якості, лаквінімоду, зменшення, пацієнтів
Код посилання
<a href="https://ua.patents.su/47-111959-zastosuvannya-lakvinimodu-dlya-zmenshennya-vtomi-polipshennya-funkcionalnogo-stanu-ta-polipshennya-yakosti-zhittya-u-paciehntiv-z-rozsiyanim-sklerozom.html" target="_blank" rel="follow" title="База патентів України">Застосування лаквінімоду для зменшення втоми, поліпшення функціонального стану та поліпшення якості життя у пацієнтів з розсіяним склерозом</a>
Попередній патент: Пересувний комплекс для бджільництва т.і. стругая і спосіб ведення бджільництва
Наступний патент: Спосіб покриття нарізного трубчастого компонента, нарізний трубчастий компонент та одержане в результаті з’єднання
Випадковий патент: Спосіб виготовлення гранульованого органомінерального добрива