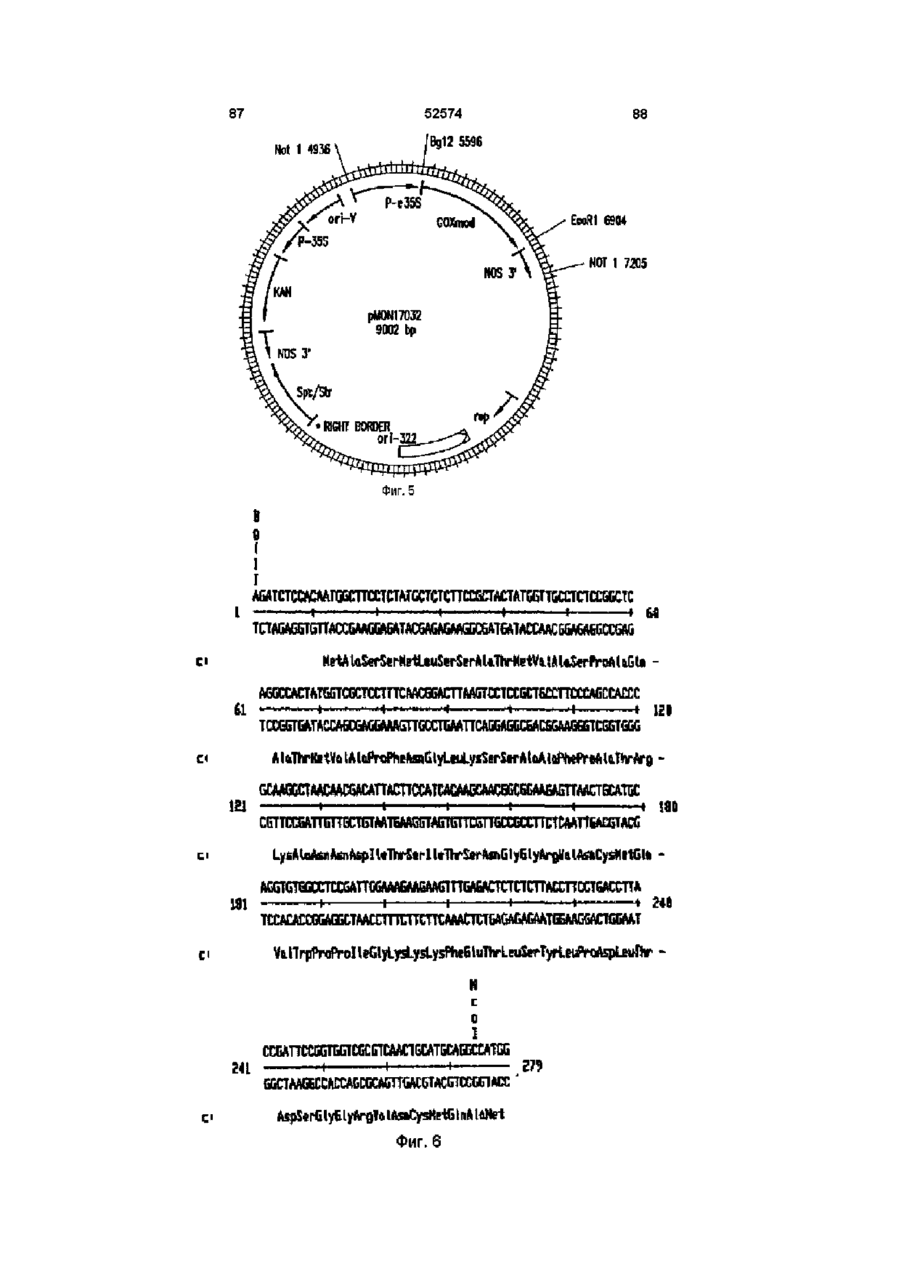
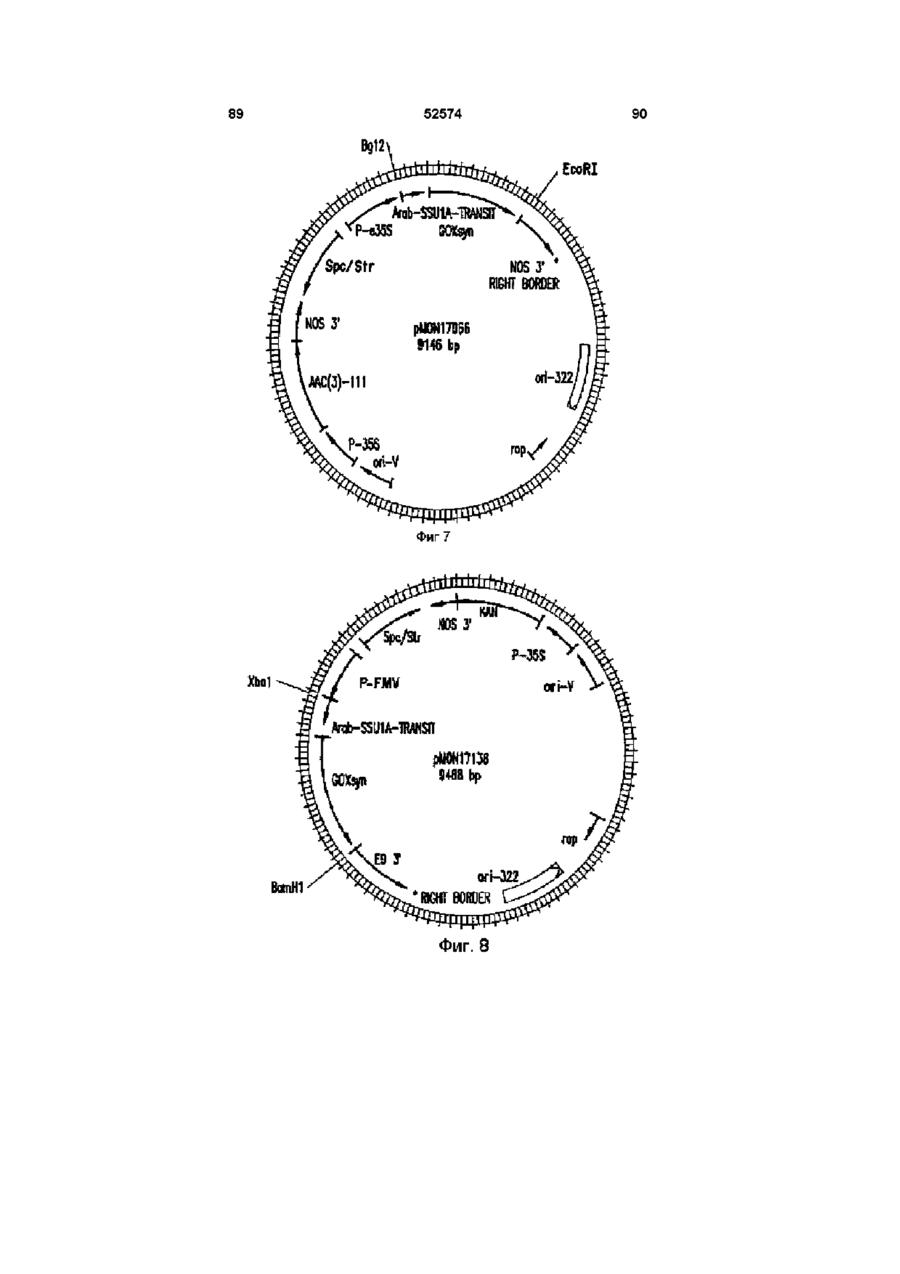
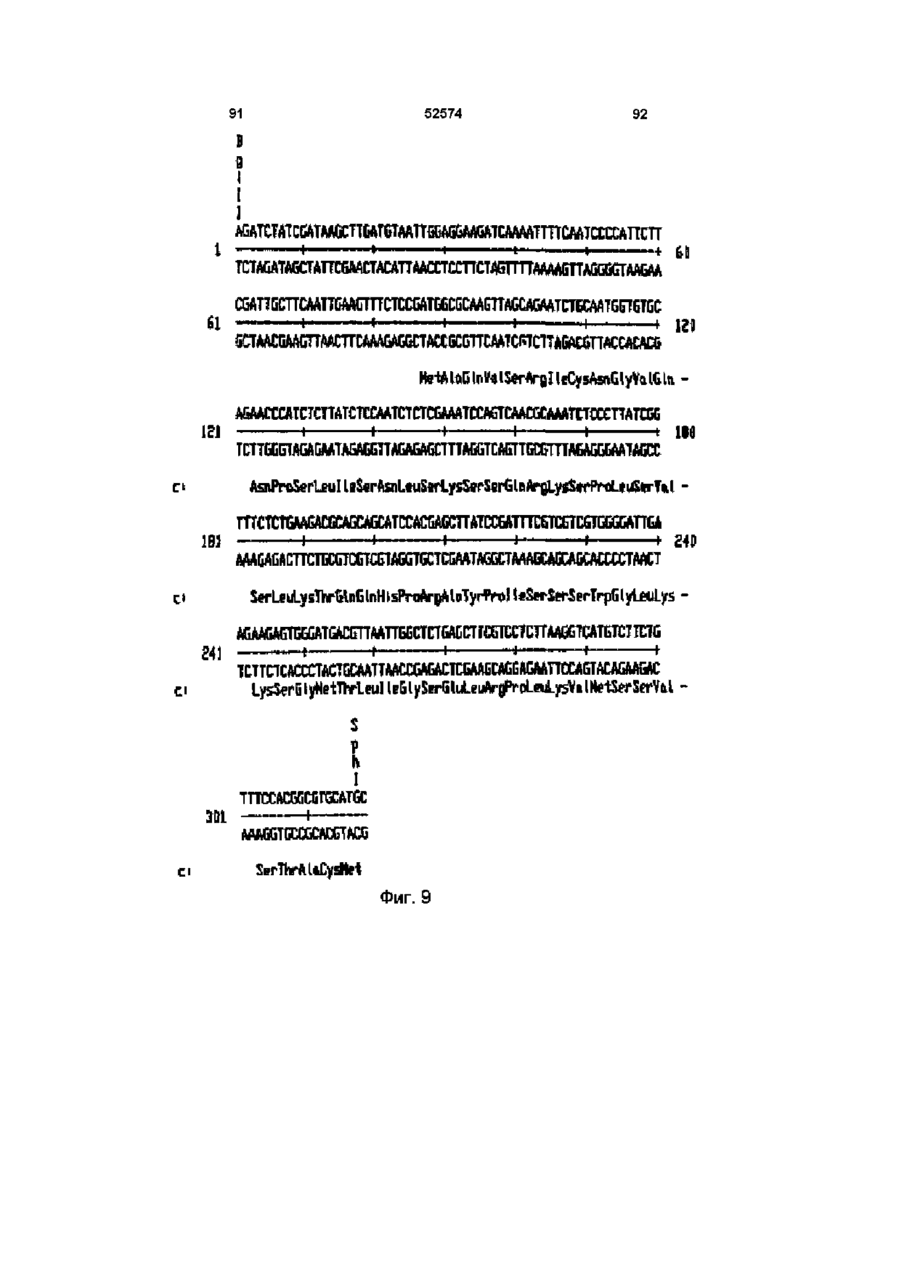
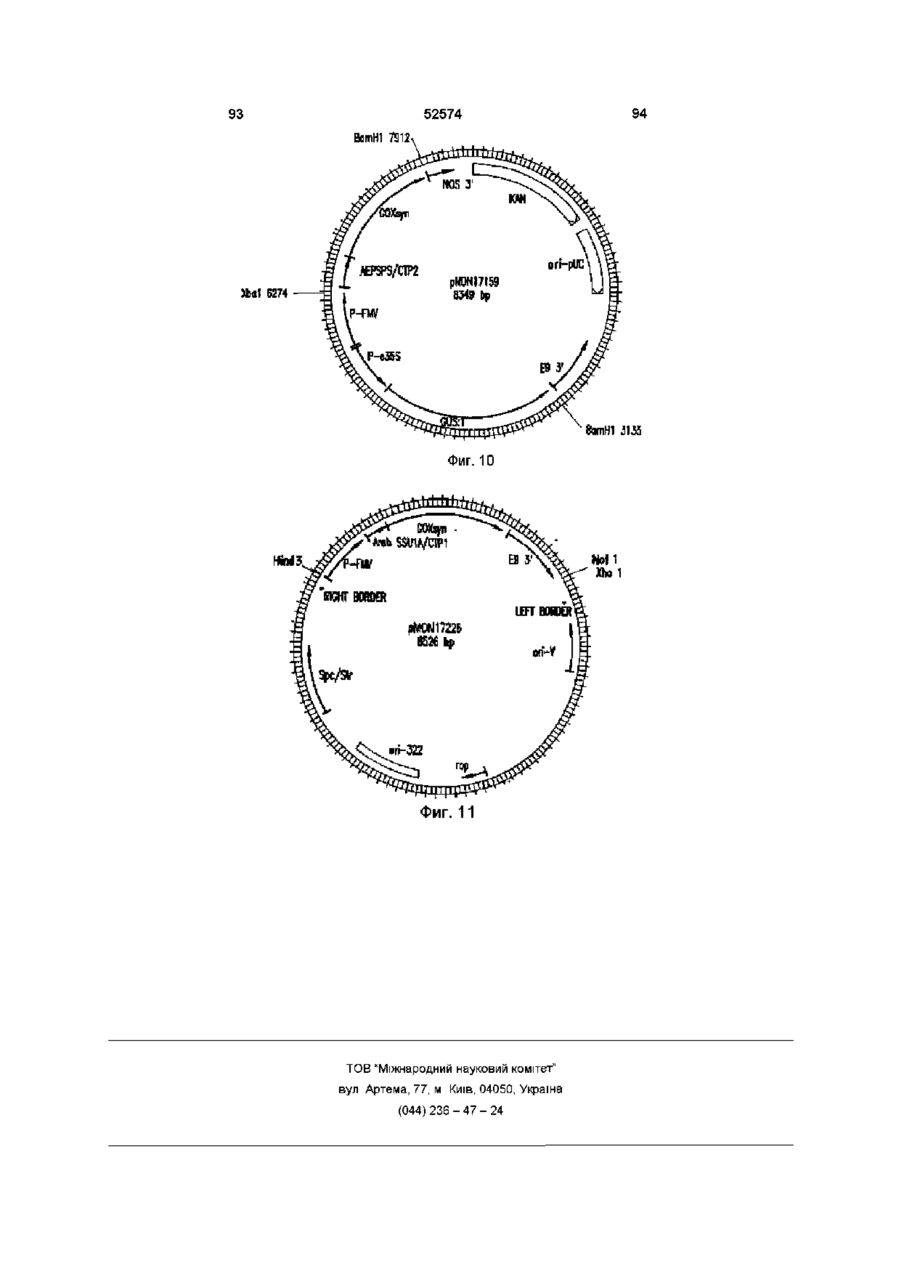
Молекула виділеної дволанцюгової днк, що включає днк послідовність, яка кодує фермент гліфосат оксидоредуктазу (варіанти), спосіб одерження генетично трансформованих рослин, ізольований пептид (варіанти), штам
Формула / Реферат
1. Молекула выделенной двухцепочечной ДНК, включающая ДНК последовательность, кодирующую фермент глифосат оксидоредуктазу, причем аминокислотная линейная последовательность указанного фермента выбирается из группы, включающей SEQ ID NO:5
причем остаток в положении 334, обозначенный через Х, выбран из группы, содержащей гистидин, аргинин, лизин, глутамин, аланин, триптофан, лейцин, изолейцин и глутаминовую кислоту и SEQ ID NО:18
.
2. Молекула выделенной двухцепочечной ДНК, включающая ДНК последовательность, кодирующую фермент глифосат оксидоредуктазу, причем указанную ДНК последовательность выбирают из группы, включающей SEQ ID NО:3
,
SEQ ID NО:4
,
SEQ ID NO:6
,
SEQ ID NO:7
,
SEQ ID NO:8
,
и SEQ ID NО:17
.
3. Молекула выделенной двухцепочечной ДНК, включающая в свою последовательность
а) промотор, действие которого в растениях вызывает продуцирование РНК последовательности,
б) структурную ДНК последовательность, представленной молекулой согласно п. 1, вызывающую продуцирование РНК последовательности, кодирующей фермент глифосат оксидоредуктазы,
в) 3' нетранслируемую область, действие которой в растениях вызывает присоединение полиаденилированных нуклеотидов к 3' концу РНК последовательности, причем промотор гетерологичен по отношению к структурной ДНК последовательности и способен вызывать достаточную экспрессию указанного фермента в растительной ткани, в том числе в меристематической ткани, с усилением толерантности растительной клетки, трансформированной указанным геном, к глифосату.
4. Молекула выделенной двухцепочечной ДНК по п. 3, отличающаяся тем, что указанная структурная ДНК последовательность кодирует слитый полипептид, включающий аминоконцевой хлоропластный транзитный пептид и фермент глифосат оксидоредуктазы.
5. Молекула выделенной двухцепочечной ДНК по п. 4, отличающаяся тем, что промотор представляет собой вирусный промотор растительной ДНК.
6. Молекула выделенной двухцепочечной ДНК по п. 5, отличающаяся тем, что промотор выбирают из группы, включающей CаMV 35S и FMV 35S промоторы.
7. Способ получения генетически трансформированных растений, толерантных к гербициду глифосату, отличающийся тем, что способ включает следующие стадии:
а) встраивание в геном растительной клетки молекулы рекомбинантной двухцепочечной ДНК, состоящей из:
і) промотора, действие которого в растениях вызывает продуцировоние РНК последовательности,
іі) структурной ДНК последовательности, представленной молекулой согласно п. 1, вызывающей продуцирование РНК последовательности, кодирующей фермент глифосат оксидоредуктазы,
ііі) 3' нетранслируемой области, действие которой в растениях вызывает присоединение полиаденилированных нуклеотидов к 3' концу РНК последовательности, причем промотор гетерологичен по отношению к структурной ДНК последовательности и способен вызывать достаточную экспрессию указанного фермента в растительной ткани, в том числе в меристематической ткани, с усилением толерантности растительной клетки, трансформированной указанным геном, к глифосату,
б) получение трансформированной растительной клетки, и
в) регенерацию из трансформированной растительной клетки генетически трансформированного растения с повышенной толерантностью к гербициду глифосату.
8. Способ по п. 7, отличающийся тем, что указанная структурная ДНК последовательность кодирует слитый полипептид, включающий аминоконцевой хлоропластный транзитный пептид и фермент глифосат оксидоредуктазы.
9. Способ по п. 8, отличающийся тем, что промотор представляет собой вирусный промотор растительной ДНК.
10. Способ по п. 9, отличающийся тем, что промотор выбирают из группы, включающей CaMV 35S и FMV 35S промоторы.
11. Изолированный пептид, включающий аминокислотную последовательность, которая кодирована ДНК последовательностью, выбранной из группы, включающей SEQ IDNО:3, SEQ ID NО:4, SEQ ID NО:6, SEQ ID NО:7, SEQ ID NО:8 и SEQ ID NО:17, описанные последовательности которых приведены в п. 2.
12. Изолированный пептид по п. 11, отличающийся тем, что пептид содержит аминокислотную последовательность, которая кодирована ДНК последовательностью SEQ ID NО:18, описанная последовательность которой приведена в п. 1.
13. Изолированный пептид по п. 11, отличающийся тем, что пептид содержит аминокислотную последовательность, которая кодирована ДНК последовательностью SEQ ID NО:5, описанная последовательность которой приведена в п. 1.
14. Штамм бактерий, включающий молекулу двухцепочечной ДНК, кодирующую фермент глифосат оксидоредуктазу, причем аминокислотная последовательность указанного фермента кодирована нуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NО:3, SEQ ID NО:4, SEQ ID NО:6, SEQ ID NО:7, SEQ ID NО:8 и SEQ ID NО:17, описанные последовательности которых приведены в п. 2.
15. Культура растительной клетки трансформированная молекулой выделенной двухцепочной ДНК по п. 1, кодирующая аминокислотную последовательность по п. 13.
16. Молекула выделенной двухцепочной ДНК по п. 2, отличающаяся тем, что включает ДНК последовательность SEQ ID NО:4.
17. Молекула выделенной двухцепочной ДНК по п. 2, отличающаяся тем, что включает ДНК последовательность SEQ ID NО:17.
Текст
1 Молекула выделенной двухцепочечной ДНК, включающая ДНК последовательность, кодирующую фермент глифосат оксидоредуктазу, причем аминокислотная линейная последовательность указанного фермента выбирается из группы, включающей SEQ ID NO 5 Met Sec Glu Asn Hia Lya Lya Val Gly lie Ala Gly Ala Gly H e Val i s io is Gly Val Cys Thr Ala Leu Met Leu Gin Arg Arg Gly Phe Lys Va. Thr 20 25 30 L E L HE Asp Pro Asn Pro Pro Gly Glu Gly Ala Ser Phe Gly Ачп Ala 35 40 Gly Cys Phe Asn Gly Ser Ser Val Val Pro Met Ser Met Pro Gly Азо 50 55 60 Leu Thr ber Val Pro Lys Trp Leu Leu ftsp Pro MeC Giy Pro Leu Ser «S 70 75 81 ! lie Arg Pbe Ser Tyr Phe Pro Thr lie Met Pro Trp Leu H e Arg Phe 85 90 95 Lej ^eu Ala Gl/ AEg Pro Asn Lys Val Lys Glu 01» Ala Lys Ala Leu 100 105 HO Arg Asn Leu He Lys Ser 115 Thr Val Pro 120 Leu He Lya Ser Leu Ala Glu 12S Glu Ala Asp Ala Set Ніз Leu H a Arg Hia Glu Gly H I E Leu Thr Val 130 135 HO Tyr Arg Gly Glu Ala Asp Phe Ala Lys Asp Arg Gly Gly Tip Glu leu 14S 150 1S5 160 Arg Arg Leu Asn Gly Val Arg Tbr Gin Tie Leu Ser Ala Asp &ла Leu ies па iis Arg Asp Phe Asp Pro Asn Leo Ser Hia A a Pbe Thr Lys G l y H e iOO ies Leu 190 le Clu Glu Asn Gly Н Л э Thr Tie Asn Pro Gin « l y Leu v a l T h r Leu 195 200 305 Leu Phe Arg Arg Phe H e 210 Ala Asn. G l y G l y Glu Phe val g e t Ala Arg 2 IS 220 О "al -Де Gly Phe Glu Thr Glu Gly Arg Аіз Leu Lys Gly H e Thr Thr 225 230 23S 210 Thr Aan Gly Val Leu Ala Val Asp Ala Ala Val Val Ala Ala Gly Ala His Ser Lys Ser Leu Ala Asn Ser Leu Gly Asp Asp H e Pro Leu Asp 260 265 Э70 Thr Glu Arg Gly Tyr His H e Val H e Ala Aan Pro Glu Ala Ala Его 375 280 285 Arg H e Pro Thr Thr Asp Ala Sec Gly Lys Phe H e Ala Thr Pro Met 290 393 30C Glu Met Gly Leu Arg Val Ala Gly Thr Val O.vi Phe йіа Gly Leu Thr 30S 310 3,5 320 Ala Ala Pro Asn Trp Lys Arg Ala His Val LKU Tyr Thr Hia Ala Arg 325 330 33S Lys Leu Leu Pro Ala Leu Ala Pro Ala Sex Ser Glu Glu Arg Tyr Ser 340 345 350 lys Trp Met Gly Phe Arg Pro Ser H e Pro Asp Ser Leu pro Val H e 3E5 360 365 Gly Arg Ala Thr Arg The Pro Аяр Val H e Tyr Ala Phe Sly Нія Gly 370 375 380 His Leu Gly Met Thr «ly Ala Pro Met Thr Ala Thr Leu Val See Slu 3B5 390 395 400 Leu Leu Ala Sly Qlu tys The Ser H e Aep H e Ser Pro Phe Ala Pro 405 410 41S Asn Arg Phe Gly H e sly Lya Sec Lys Gin Thr Gly Pco Ala Ser 420 425 430 i ю ю 5 2 5 7 4 4 Glu Met oly Leu Arg V«l *1» oly Ї М V«l Glu Pha Al» Cly Leu Thr причем остаток в положении 334, обозначенный через X, выбран из группы, содержащей гистидин, аргинин, лизин, глутамин, аланин, триптофан, лейцин, изолейцин и глутаминовую кислоту и SEQ IDNO18 305 110 31! Ala Ala Fio A m Trp Lyi Arg hit Hit Vil L»u Tyr Thr Aig Ala Acg 325 net А Н eiu А.п Йіі Ly» Lyi V*l Cly H i Al» Cly Al» Оїу II» V.I ЗІ0 J*S 3S0 ty» Tcp Met aly Pha Arg Fro Sar II* Prc Aap Sar їли Pro Val lla Oly V«l Су» Thr Л И Lau Hat b»u (X>TTTTftT SOS TATLTGCG^U T U I C S ^ C S Q C 1 rTGAGSTTG BAGGTAGGGC GCTTAAAGGC r Leu Pht Arg Mq fh* I I » Ail Лвп Cly Oly вій Pha Уії Sac Я1» Ktg T C T Q a ^ C G T T (ЗДЗЧКГАСКНЯ "TTjTCGCAGC ЧТІІСТЛЛТТС QCtaCGCCflT Ї10 SIS GALATCCCGC TCGATACCGA TCGCGAAKX 210 ССДСЄСЙТТГ caACGACCGA 840 ftCGTOGAfftT 300 САТДТСЙ"СА 360 I I » Gly Pha Slu Thr вій Oly Xrg Ala la» Lyi Oly l l a Thr 7Ы ЗЇ5 !Э0 23S TGCGTCfiCGS ЙАЙТТСАТСО 1020 СЙАСЙССТАТ GGBASTOGGG CTTCGCGTOG CQCGTACGST І Ї І А К Ї Т С В С Ї НЕЙСТСАСЙС JOfiQ CCGCTCCTBA CTGGAAACGT Vtl GSAAGCCVSCT АТТЯСРАССА CGGCGCACflC TOGAAATCAC 1140 GCGCATGTGC TCTATACQCA COCTCGbAAB OTTCTTCCUG HO Г Г Г Т О З С а С С « О С А І З Т Т С Т « А А С Д Д ' О Д І Й Т Ї £ Т А А А Т В р 260 26S Ї10 ТГГСГПЙТТС ЙСТССССеТе W T G C C ' ~ C C СЯМХСССЛ^ TCeGCSJW" 1СД1СЇГОГС ATQACAbOGG СИССВЛТОЛС ОССВДСНГТС UTC^CAGAt,!. І%?П HXltGCAC The Ляп Cly V*l Lau Al* Vil Alp A l l All Vtl V*l Al* Ala Oly *1» СОААЙДВДГС ТСДДТ^ОА^А •ҐГ'СІІСССГ* СССАС"ААЙ.С ] 3SO ТіСаСДААІС СА/ЗОїДЙСО S C f G I O C C G G TGTCAAGATO АССІ^ЙЖТА C СОСТЇТЩ,ТЙ CaT^CUGLAM « " Д Й Г Т А С Т TACGCGtTCO TdftliTACAIS" AATCTGCKCC CTCQGAGIlCS CGAflA-TQGCG 1SCC laSO TCGCAATCAC С Л Л Д Т Й С І Д ; ЛСЙ^Й^ТАЙС G A G - K A C G C " Г С З Д Д і Л С Ї Т ГС0іЗГСАС~А GTBBATTCAT T C A r C T T T L L GSTCA«:'TC CGATCAAACC AGAAGGCCftG CAGTCAGGCG TCGSAbCAAt CAGGCCACTC T O 3 T T C T C C S ОЙАТТТЙСТв l ПО The Olu Arg Oly Tyr Hi» l l a Vtl l l a «1* Aan Pro Slit Aim Al» Pro US 38S ІЬО Ars I I » Pro Tbr Thr A»S Al» Sat Cly Ly# i>h» l i e Al» t h r Pro H»t гїо ass 300 C^GACGATCT СЙТСвАТААГ 16Z0 1S80 52574 SEQ ID NO 6 SEQ ID NO 4 АТС TCT GftG AAC C6C AAA AAA G^A GGC АТС GCT GGA GCC GGA H T C GTC l r t Sec Glu йвп Вік L y K lys Val Gly lie від Gly Ala Gly H e Val *s 1 4 10 - 15 BTGQGTGAGA АССДЄААААА GOC Slv GftAGSlGCAT GTA TGC fiCG CCC W Cys I h t - й і а CTG ATG C T T CAG 1IGC CGC GGA TTC АДЛ GTC ACC l e u 4 e t b e u G i n A r g A r g G l y PBe L y s Va^ T h r RGTAGGCATC GCTGGAOCCQ GAATCGTCGG C G I A I G C A C O GCGCTQATGC TTGftGCGCCG CGGATTCKBA GTCACCTTGS T T O R C C O G A A CCCTCCTGCC C G T r a o G G A A TQaCGSATCSC TTCJUlCGGCT CATCCGTOGT Є С С Т А Т С Ї С С 120 ISO ATGCCGGGSA bCTTGACOAG CGTOCCOABG Т О О С Т О О П С ACCCQftTGGO SCCOTTCTCR "T. TOG TTG ATI CGC T P r o Г і г H e C e t P r a , r p L e a l i e Aro M e AATCCGCAAG GOCTCGTGAC C C C ' T S T - T CGGCGTTTTA TCGCGRRCGG TOGCGAftTTT ЕТДТСТВССС STSTCftTCCG С Т Т Т О А а й С Г GAAOGTAGGG CGC-IRABGG САТ-АСАІІСС CTG ТТД GCC ЗОЙ Leu leu Ala Sly ,00 AGA Arg ССА ААС рко А з и O S C Sftr С Г С Д С С A R G Т С С А С Ь Д ґ З В Е П L e u - l e Li-s S e r T h r ДАО GTC AAG G A G CAB « С « A M «СА Ь у ь V a l I,ys OIL. 6 1 » Д ї а t y s A i d I D S 1 1 C GT1. Va! CTG А Т С Leu lie G A G G C r O A T G C E B 3 C СД'г C T G А Т С C G C Git, A l s Д а р A l a S e c H i s L e u l i e A r g ] J0 1 3 5 " A T CG™ -yr Arg 4s O.& Arg SGA Giy С Ь І І-1І. Arg Leu GAA Giu QCA Ala Anil G G T A « n G l / СЙТ HIS GSC T11^ GCC А М І СДС A5p Pbe Ala Lys Asp 1 5 0 G T Vrf GC ACG СЧ5 rq Tor Glo А Д Е TCA TIG Lys S e r L e u CTG ACC Lsu'Thr CGC GGA G G T йгд Gly G l y 1 5 5 TGG Trp SCGAACGGCG TTCTCGCCGT TGATGCAGCH GTTGTCGCAG CCGGCGCACA CTCGAAATCft С Т Г С Є Т А М Т CGC^JtGOCGA ТОЙСАТСССО CICGUTftCCG АЛСОТОЗАТА TCATATCSTC ATSGCSMiTC CGGWCCCCC TCCACGCATT CCGKCSACCG STHCGTCAGG GO5 Аїа G B A O G T C A T Gla Glv Чіз i S O ПТС CTC t i e t*-n СТС Leu ДАААТТСАТС GCC GAT GCG A l a As,p u] a aCCGCTOCTA ACTGGBARCG TGCGCATOTG С Т С Т Д І Я С Е С KMCTC5AAA ACTTCITCCA 1030 GCCOTCCCGC C T G C G M T f О IGAAGARCaA TSTTCCRRAT G G M G G G G T I GAA Glu G"S Val CCGGCCGftGC 1OS0 CTG Leu 16 0 ATCCCGGATT CGCICCCCCT GATTGGCCGC GCAACCCGGA CACCCGACGT АЛТСТЯТОСТ 1140 TTCGGCCACG GTCRTCTCGG CATGBCBGGG GCGCCGATCA CCGCARCGCT CGTCTCAOBG 12DQ TTG !su C T C C I C S C R G GCGAAABGAC CTCBATCGAC A T I I C C C C C T ЇСОСДССААА 1Ї60 ATTGGCAAftT CGG Arg G A T T T C G A T C C G А Й С T"C5 T O G A^f) P a A s p P r o Sari L e u E e r *86 ATn GAA GAG AAC GGT CAC ACG АГ V He G l u G l u Asu son SCGACaCCTA IGGAAATGGG GCTTCGCBTG GCGOGTftCGG TTOAOITCGC TGGGCICACA C A T G C U ї ї " Д С ґ - A f t C S ••!; A T T H i s A l a £h - ацетилАМРА -> N-ацетил метиламин Клонирование Глифосат оксидоредуктазного гена /генов/ в Е сої і После установления факта превращения глифосата в АМРА в линии LBAA, был разработан прямой подход для клонирования гена/генов/, участвующих в раннем процессе, в Е coli Поскольку отсутствовали какие-либо другие методы, то были использованы обычные для этих целей клонированиа и генетические методы, описанные Maniatis с соавт, 1982 Методика клонирования заключается в следующем введение космидного банка линии LBAA в Е coli и селекция на гена/генов ответственных за превращение глифосата в АМРА, по необходимой степени роста на среде, включающей глифосат в качестве источника фосфора /Р/ Этот отбор основан на использовании АМРА, полученном при помощи фермента, метаболизирующего глифосат в качестве источника фосфора /Р/, что сопровождается выделением Pi ИЗ АМРА посредством Е coli "C-P лиазы" Большинство штаммов Е coli не способны к утилизации фосфонатов в качестве Р источников в первичных культурах, однако, они очень быстро адаптируются, независимо от RecA, к утилизации фосфонатов /становясь Mpu+ /M/ackett с соавт,1987/ Е coli Mpu+ изолировали из Е coli SR 200 /Leu, Pro, recA, hsdR, supE, Smr, ton А, следующим образом объем свежей L -бульонной культуры Е coli SR 200 помещали на MOPS /Neidhardt с соавт,1974/ сложный агар л" е содержащий L-лейцин и L-пролив в количестве 25мкг/мл и витаглин В1 диамин/ в количестве Юмкг/мл, агар = ДИФКО "Очищенный"/, содержащий аминометилфосфонат/АМРА, 0,2мМ, Сигма/ в качестве источника фосфора MOPS среда включает 10мл ЮХ MOPS соли 2мл 0,5мг/мл Тианин HCI 1мл 20% глюкозы 10 X MOPS соли включают на 100 мл 40мл 1MMORSpH7,4 4мл 1М Трицина рН 7,4 1мл 0,01 М FeSO 4 7H 2 O 5мл 1,9MNH4CI 1мл 0.276М K2SO4 21 52574 22 1мл сконцентрированы путем преципитации Данная 0,5мМ CaCI2 процедура дала 50мкг LBAA ДНК требуемого раз1мл 0.528М MgCI2 мера 10мл 5М NaCI 1мл 0,5% L-Метионина ДНК плазмиды рНС79 /Hohn и Collins, 1980/ и микроэлементов обработанный Hind III -фосфотазой вектор гото1мл вили согласно описанию /Maniatis с соавт,1982/ Микроэлементы включают Условия лигирования были следующие 3x109M/NH4/6Mn7O24 Вектор ДНК /обработанный Hind III и цепочной 4 х Ю 7 М Н3ВО4 фосфатазой теленка/ -1,6мкг Зх10 8 МСоС1 2 Размер фракционированных LBAA Hind III 1,6x10 8 MCuSO 4 фрагментов - 3,75мкг 8 х Ю 8 М MnCI2 10Х буфер лигирования - 2,2мкл 1 x10 8 MZnSO 4 После трех дней инкубации при 37°С 6 от250мМ Трис-НСІ, рНЗ.О, дельных колоний были посеяны штрихом с выше ЮОмМ MaClg указанной чашки на MOPS полный агар, содер100 мМ дитиотреитол, жащий или АМРА или метилфосфонат /Альфа/ в 2мМ Спермидин качестве источника фосфора Одна колония, обоТ4ДНКлигаза значенная как Е coli SR 200 Mpu+, была выбрана /Борингер - Манхейм/ -1,0мкл из всех колоний, показавших одинаково однооб/400 единиц/икл/ разный рост на обеих средах с фосфонатом Н2О до 22,0мкл 18час при 16°С Хромосомную ДНК готовили из штамма LBAA Лигированная ДНК /4мкл/ была упакована в следующим образом клеточный осадок из 100мл частицы ламбда фага /Stratagene, Gigapack Gold/, L-Бульонной /Miller, 1972/ культуры в поздней лоиспользуя метод изготовителя гарифмической фазе LBAA был ресуспензирован Культура Е Coli SR 200 Mpu+, которая росла в в 10мл раствора 1 /Birnboim и Doly, 1979/ Затем течение ночи в L-бульоне /с мальтозой 0,2%/, быдобавляли ДСН до конечной концентрации 1%, и ла инфицирована 50мкл упакованной ДНК суспензию подвергали трехкратному замораживаТрансформанты были отобраны на MOPS сложнию - оттаиванию, причем каждый такой цикл ном агаре содержащий ампициллин и глифосат в включал погружение в сухой лед на 15мин и законцентрации 0,2мМ в качестве источника Р тем в воду при 70°С на Юмин Полученный лизат Пробы определенных объемов также помечетырехкратно экстрагировали одинаковыми объщали на MOPS (Neid-hardtc соавт , 1974) сложный емами фенол хлороформа /1 1, фенол, насыагар с ампициляином, содержащий Рі в конценщенный ТЕ/ /ТЕ = ЮмМ Трис рН 8,0, 1,0мМ ЭДТК/, трации 1мМ для титрования упакованных космид и (фазы отделяли путем центрифугирования На данной среде через 2 дня инкубации при 37°С /15000д, Юмин,/ Обработанный этанолом матекосмидные трансформанты были изолированы в риал осаждался из супернатанта путем краткого объеме, примерно, 105 на мкг/ LBAA Hind III ДНК центрифугирования /8000д, 5мин /с последущим На агаре, содержащим глифосат, колонии появдобавлением двух объемов этанола Осадок релялись с 3 до 10 дня с конечной концентрацией 1 суспензировали в 5мл ТЕ и диализовали в течена 200 - 300 космид Плазмидная ДНК была пригоние 16час при 4°С против 2л ТЕ Эта процедура товлена из 21 космидных трансформантов, обрапозволила получить 6мл ДНК раствора 150мкг/мл зовавшихся в чашках с глифосатом Эти космиды можно было разделить, по крайней мере, на два Частично рестрикционная ДНК была пригокласса, основываясь на типе Hind III рестрикции товлена следующим образом три пробы ДНК плазмидной ДНК В классе 1, каждая из космид LBAA объемом 10Омкг обрабатывали в течение обычно клонировала 6,4 и 4,2кб фрагменты Hind III часа при 37°С рестрикционной эндонуклеазой рестрикции, а в классе II - фрагменты - около 23кб Hind III в дозах 4, 2 и 1 единиц фермента на мкг Десять космид, представляющие разнообразные ДНК, соответственно Пробы собирали, готовили клонируемые фрагменты, были ретрансформиро0,25мМ растворы ДНК с ЭДТК и экстрагировали ваны в Е cjh SR 200 Mpu+, и утилизация глифасата равным объемом фенол хлороформа После проверялась путем отбора на рост на MOPS добавления Na Ацетата и этанола, ДНК осаждали сложном агаре, содержащем ампициллин и глидвумя объемами этанола и получали осадок пуфосат Кроме того, определяли конечную плоттем центрифугирования /12000д, Юмин / Высуность клеток, которая достигается в культуре, исшенный осадок ДНК ресуспензировали в 500мкл пользующей глифосат (0,2мМ в MOPS среде) в ТЕ и наслаивали на 10 - 40% сахарозный градиент качестве источника Р, и только небольшие разли/на 5% прироста по 5,5мл/ в 0,5М NaCI, 50мМ Трис чия можно было выявить между отдельными рН 8,0, 5мМ ЭДТК После центрифугирования в трансформантами Трансформанты также вводитечение 20 часов при 26000об в мин с использолись в MOPS сложный бульон с АМРА в конценванием SW28 ротора и прокола пробирок были трации 0,1 мМ в качестве источника фосфора собраны фракции объемом в 1мл 15мкл пробы (чтобы гарантировать наличие "С-Р лиазной" аккаждой третьей фракции исследовали в 0,8% агативности) и через 24 часа инкубации при 37°С вырозном геле, и размер ДНК определяли путем полняли стократное разведение в MOPS сложной сравнения с линейной лямбда ДНК и Hind Ш-абрасреде с глифосатом в концентрации 0,1 мМ и [3 ботанными лямбда ДНК стандартами Фракции, 1 С] глифосатом (40000имп в мин/мл) Все содерсодержащие 25 - 35кб фрагменты ДНК были собжащие космиды клетки расщепляли глифосат и раны, подвергнуты обессоливанию на колонках с образовывали N-ацетил АМРА и N-ацетилметиАМИКОНОМ 10 /7000 об в мин, 20°С, 45мин /и 23 52574 ламин, с небольшими различиями в скорости В этих тестах в супернатанте культуры был обнаружен N-ацетил AM РА Одна из космид Класса I, идентифицированная как pMON 7468, была выбрана для дальнейшего исследования Второй глифосат оксидоредуктазный ген был идентифицирован из клона космид Класса II Свободные от клеток лизаты Е coh SR 200 Mpu+/pMON 7468 были получены из клеток, росших на MOPS сложной среде с глифосатом при 1,0Мм (с добавлением L-фенилаланина, L-тирозина и L-триптофана при концентрации каждого 100мкг/мл и пара-оксибензойной кислотой, 2,3диоксибензойной кислотой и пара-аминобензойной кислотой с концентрацией каждой 5 мкг/мл, для снижения к минимуму эффектов ингибирования Е coh EPSP синтазы) Клеточный осадок (около 0,5г влажного веса) ресуспензировали в 1м лизирущего буфера (40мМ MOPS , рН 7,4, 4мМ Трицина, рН 7,4, 10% глицерина, 1мМ ДТТ) и пропускали дважды через Френч Пресс Клеточные остатки удаляли путем центрифугирования при 15000 об в мин в течение 10 минут Супернатант исследовали после добавления МдСЬ к ЮмМ для разрушения меченого глифосата Субстрат глифосата использовали в качестве [3 14С] глифосата (конечная концентрация = 17мкМ) Обнаруживаемые продукты были представлены, в основном, АМРА и некоторым количеством N-ацетил АМРА, производство АМРА является показателем клонирования ферментативной активности из штамма LBAA, однако, наличие N-ацетилАМРА могло быть обусловлено Е coh эндогенной активностью (Avila с соавт, 1987) Специфическая активность для образования в этих условиях АМРА составляла 13,3 пмолей АМРА/мин , мг белка Характеристика Глифосат -> АМРА гена Область клонирования, ответственная за данную активность фермента глифосат оксидоредуктазы была затем локализована в плазмиде Делеции pMON 7468 были изолированы первично в пределах клонируемой области путем использования ферментов рестрикции, которые иногда производят разрезание внутри вставки, следующим образом пробы плазмидной ДНК 0,5 - 2мкг подвергали полному расщеплению с использованием эндонуклеаз рестрикции Not I, Sac I, Bgl II или BamH I, c последующей экстракцией фенол-хлороформом, осаждением этанолом, ресуспензированием в ТЕ буфере и лигированием в течение 2 - 4 часов при комнатной температуре (или в течение 18 час при 16°С) в конечном объеме 50мкл лигирующего буфера и Т4 ДНК лигазы Трансформанты подвергались селекции в Е coh SR 200 Mpu+, после чего эти делеции исследовались на потерю или торможение фенотипов, утилизирующих глифосат Эти данные в сочетании с рестрикционным картированием клонов, были использованы для локализации активной области по соседству с центральной частью вставки в Puov 468, которая включала два обычных Hind III фрагмента (6,4 и 4,2кб) Далее фрагменты Hind III рестрикции из этой области были субклонированы в р Blue Script (Stratagene) и их глифосатный фенотип определяли в Е coh J MIOI Mpu+ (Mpu+ производное J МЮІ выделяли согласно описанию для SR 200 24 Мри+) Клоны, содержащие 6,4кб Hind III фрагмент, в любой ориентации, были способны к утилизации глифосата После рестрикционного картирования этого Hind III фрагмента, была изолирована серил клонов с делецией из двух 6,4кб Hind III клонов при использовании ферментов, которые иногда производят разрезание в вставке, а также в области полилинкера Были также подвергнуты субклонированию ряд фрагментов рестрикции, внутренних по отношению к Hind III фрагменту 3,5кб Pst I и 2,5кб Bgl II фрагменты, в любой ориентации, обладали способностью к утилизации глифосата Эти данные в сочетании с данными о делециях, были использованы для локализации активной области непосредственно вблизи 1,8кб Bgl Il-Xho I фрагмента Кроме того, делеции полученные из 6,4кб Hind III фрагмента, характеризовались минимальным размером кодирующей области, примерно 0,7кб, с Eco R I и Sac I сайтами, возможно локализованными в пределах кодирующих последовательностей Направление транскрипции/экспрессии локуса, ответственного за активность фермента, обусловливающего превращение глифосата в АМРА, определяли следующим образом Е coh JM 101 Mpu+ трансформанты pMON 7469 # I и # 4 (Клоны 2,5кб Bgl II фрагмента BamH I сайте pUC 118, противоположная ориентация) росли в М9 глюкозо-тиамин-ампициллин бульоне, в присутствии и без PLAC индуктора IPTG, материал собран в поздней логарифмической фазе (Клетт 190 220), готовили, как описано выше, свободные от клеток лизаты четырех культур, которые затем исследовали на активность, ответственную за превращение глифосата в АМРА при наличии 17мкМ глифосата Самая высокая ферментативная активность была получена для pMON 7469 и I плис IPTG , где Xho I сайт располагается дистально к Plac, тем самым предполагая, что гены экспрессируются в Bgl II к Xho I направлении Таблица II Активность, ответственная за превращение глифосата в АМРА, в свободных от клеток лизатах трансформантов Е coh Клон pMON pMON pMON pMON 7469 # 7469 # 7469 # 7469 # 1 1 4 4 IPTG Специфическая активдобавлен ность пмоль АМРА/мин мг нет f (+) транслируемой области гена нопалин синтезы векторе с целью образования pMON 17034 Дан/NOS 37 /Fraley с соавт, 1983/, 0 45кб СІаІ в Dral ный вектор может быть транскрибирован ин витро фрагменте из pTi 15955 октопин Ті плазмиды, кос использованием SP6 полимеразы и с послеторая содержит Т-ДНК левую пограничную обдующей РНК трансляцией с участием 35S -Метиоласть /Barker с соавт ,1983/, 0,75кб фрагмент, сонина, что обеспечит получение материала, котодержащий ориджин репликации из RK2 плазмиды рый можно вводить в хлоропласты, /оп-V/ /Stalker с соавт, 1981/, 3,0кб Sal I в Fst I изолированные из Lactuca sativa, применяя описегменте pBR 322, обеспечивающих ориджин репсанные ниже методы della-Cioppa с соавт, 1936, ликации для поддержания Е coh /оп-322/ и bom 1937/ Вместе с тем было найдено, что данное сайт для коньюгационного переноса в клетки ХТП1-глифосат-оксидоредуктазное слияние хаAgrobactenum tumefaciens 0,93кб фрагмент, изорактеризуется 9% эффективностью поступления в лированный из транспозона Тп7, который кодихлоропласты по сравнению с контролем, 35S мерует резистентность бактерий к спектиномиченым npeEPSPS /pMON 6140, della-Cioppa с социн/стрептомицину /Spc/Str/Fhng с соавт,1935/, и авт , 1936/ Далее была получена конструкция является селективным фактором для Е coh и ХТП1-глифосат оксидоредуктазного слияния с Agrobactenum tumefaciens 0,36кб Pvul I с Всі І синтетическим глифосат оксидоредуктазным гефрагменте из pTi T37 плазмиды, которая содерном /ПОС Ю № 8/, которая вводилась в качестве жит нопалин-тип Т-ДНК правую пограничную обBgl II - Eco RI фрагмента в растительный вектор ласть /Fraley с соавт,1935/ Кассета экспрессии, pMON 979 с целью образования pMON 17066 / включающая 0,6кб 35S промотор из вируса мофиг 7/ После промежуточного этапа клонирования заики норичника шишковатого /P-FMV/ /Gowda с для приобретения большего числа сайтов клонисоавт,1939/, несколько уникальных сайтов клонирования, ХТП1-глифосат оксид оредуктазное рования, и 0,7кб 3' нетранслируеную область гена слияние также было подвергнуто клонированию в rbc S-E9 гороха /Е9 37 /Coruzzi с соавт ,1984, Мокачестве Xbal - Bam HI сайта в pMON 981 для обгеїііссоавт, 1985/ Фрагмент ХТП2-синтетического разования pMON 17133/фиг 8/ глифосат оксидоредуктазного слияния был клонирован в упомянутую кассету экспрессии В привеВо втором примере, ХТП-глифосат оксидореденных ниже примерах описаны введение этой дуктазное слияние было образовано между Arabiплазмиды в Agrobactenum и последующая трансdopsis thahana EPSPS /Klee с соавт,1937/ ХТП и формация растения синтетическими глифосат оксидоредуктазными кодирующими последовательностями Вначале, Специалисты поймут, что можно получать 33 52574 различные химерные конструкции, где используется функция специфического ХТП для сопряженного импортирования фермента глифосат оксидоредуктазы в хлоропласты растительных клеток Поступление глифосат оксидоредуктазы в хлоропласт можно протестировать посредством следующей пробы Проба на поглощение хлоропластом Интактные хлоропласты изолируют из латука /Latuca sativa вар longifoha/ путем центрифугирования в Перкол/ Фикол градиентах согласно модификации Bartlett с соавт, /1082/ Полученный осадок интактных хлоропластов суспензируется в 0,5мл стерильного ЗЗОмМ сорбитола в 50мМ Hepes-KOH, pH 7,7, исследуют на содержание хлорофилла /Arnon, 1949/ и доводят конечную концентрацию хлорофилла в растворе до 4мг/мл, добавляя сорбитол/ Hepes Выход интактных хлоропластов из одной головки летука составляет 3 6мг хлорофилла Обычный тест на поглощение с объемом ЗООмкл включает 5мМ АТФ, 8,ЗмМ немеченного метионина, 322мМ сорбитола, 58,ЗмМ Hepes-KOH /рН 8,0/, 50мкл продуктов трансляции лизата ретикулоцитов, и интактные хлоропласты из L sativa /200мкг хлорофилла/ Смесь поглощения слегка покачивали при комнатной температуре /вЮ х 75мм стеклянных пробирках/ непосредственно перед оптическим осветительным прибором при максимальной интенсивности освещения /лампочка 150вт/ Кратные пробы смеси поглощения /около 50мкл/ брали через разные периоды времени и фракционировали в ЮОмкл силиконмасляного градиента /в 150мкл полиэтиленовых пробирках/ путем центрифугирования при 11000 х g в течение ЗОмин При этих условиях интактные хлоропласты образуют осадок в нижней части силикон-масляного слоя, а инкубационная среда, /содержащая лизат ретикулоцитов/ всплывает на поверхность После центрифугирования пробы силикон-масляных градиентов немедленно замораживаются в сухом льду Далее осадок хлоропластов ресуспензируется в 50 - ЮОмкл лизисного буфера /ЮмМ Hepes-KOH pH 7,5, 1мМ PMSF, 1мМ бензамидина, 5мМ є-амино-п-капроновой кислоты, и 30мкг/мл апротинина/ и подвергается центрифугированию при 15000 х g в течение 20мин для получения осадка тилакоидных мембран Прозрачный супернатант /белки стромы/ этого центрифугата и объем инкубационной среды лизата ретикулоцитов из каждого теста поглощения смешиваются с равным объемом 2Х ДСНПААГ простого буфера для электрофореза /см ниже/ ДСН-ПААГ - метод выполняли в соответствии с Lacmmh /1970/ в 3 - 17% /вес/объем/ акриламидных гелях на пластинах /60мм X 1,5мм/ с 3% /вес/объем/ акриламидными концентрирующими гелями /5мм X 1,5мм/ Гель фиксировали в течение 20 - ЗОмин в смеси из 40% метанола и 10% уксусной кислоты Затем гель вымачивали в течение 20 - ЗОмин, в EN3HANCE™ (Du Pont), после чего его высушивали в аппарате для высушивания гелей Гель просматривали путем авторалиографии, используя интенсифицирущий экран и экспонирование в течение ночи, чтобы определить, 34 поступила ли глифосат оксидоредуктаза в изолированные хлоропласты Альтернативный протокол изолирования для других структурных генов глифосат оксидоредуктазы Были выполнены идентификация и клонирование ряда других глифосат оксидоредуктазных генов, включая второй LBAA глифосат оксидоредуктазный ген из космидной Класса II pMON 7477 Ген локализован, согласно Соузерн гибридизации, на ~ 23кб Hind III фрагменте, рассматривавшемся в выше указанном разделе клонирования, с использованием первого глифосат оксидоредуктазного гена в качестве пробы Посредством Соузерн анализа также выявлены Pst I и Bgl II полосы гибридизации ~ 3,5 и ~ 2,5кб, соответственно Bgl II фрагмент из pMON 7477 был субклонирован в Bam HI сайт pBlue Script вектора Клон в Е coh JMIOI (pMON 7482), в котором клонируемый фрагмент ориентирован относительно las промотора как в pMON 7469 # I, был индуцирован с IPTG и испытан на глифосат оксидоредуктазную активность В данном эксперименте специфическая активность составляла около 93нмоль/мин мг В последующем эксперименте, Класс I и Класс II космиды также были изолированы после заражения Е coh JMIOI тем же самым препаратом упакованных космид и отбора непосредственно на толерантность к глифосату при 3 - 5 мМ глифосата в М9 среде Глифосат оксидоредуктазный ген также был субклонирован из другого микробного изолята, первоначально идентифицированного по его способности осуществлять утилизацию глифосата в качестве источника фосфора и, как показало позднее, содержащего предполагаемый глифосат оксидоредуктазный ген, судя по результатам гибридизации с пробой LBAA глифосат оксидоредуктазного гена Этот ген вначале клонировали в космидуТ7 промотора с использованием скрининга на толерантность к глифосату в Е coh HBIO/pGPI-2 (Boyer и Rolland-Dussoix, 1969, Tabor и Bichardson, 1985) на М9 среде, содержащей глифосат в концентрации ЗмМ Наличие глифосат оксидоредуктазного гена было впервые показано положительным сигналом гибридизации с LBAA геном и путем его локализации на 2,5кб Bgl II фрагменте Этот Bgl II фрагмент клонировали в Bam HI сайт в pBlue Script (pMON 17183) и осуществляли экспрессию от lac промотора в результате добавления IPTG В данном эксперименте была получена глифосат оксидоредуктаза со специфической активностью 53нмоль/мин мг, что подтверждает изолирование гена данным методом Эти глифосат оксидоредуктазные гены обычно обладают следующими чертами гены находятся (показано путем Соузерн гибридизации с использованием проб гена глифосат оксидоредуктазы полной длины) на ~ 2,5кб Bgl II фрагментах, на ~ 3,5 Pst I фрагментах, содержат один Eco Ri сайт в пределах гена и не включают Hind III сайт Следующая диаграмма иллюстрирует некоторые общие черты этих генов 35 Spftl 52574 Ест I - GOX кодирующая область Высокая степень сходства глифосат оксидоредуктазных генов также предполагает возможность другого пути клонирования новых глифосат оксидоредуктазных генов Очевидное сохранение областей, фланкирующих гены и отсутствие определенных сайтов рестрикции указывает на использование одноцепочечных олигонуклеотидных проб для фланкирующих областей, содержащих сайты рестрикции для Bgl II, Hind III, Pst I, Bam HI, Nde I, или других подходящих сайтов клонирования, и ПЦР (Полимеразная Цепочечная реакция, см Erhch, 1989, для более детальной информации о ПЦР и ее применении) с целью амплификации фрагмента глифосат оксидоредуктазного гена, удобного для клонирования На фиг 2 представлены фланкирующие последовательности для 119нп против течения (ПОС Ю № 11) гена глифосат оксидоредуктазы дикого типа (LBAA изолята) и для ~ 290нп (ПОС Ю № 12) по течению гена В результате использования подхода с применением ПЦР был изолирован целый ряд глифосат оксидоредуктазных генов из различных источников Наличие глифосат оксидоредуктазной активности подтверждалось клонированном глифосат оксидоредуктазного гена из хромосомальной ДНК, полученной из Pseudomonas sp штамма LBr (Jacob с соавт , 1988) и использованием праймеров, гомологичных N- и С- концам LBAA глифосат оксидоредуктазного гена, а также содержанием следующих подходящих рестрикционных сайтов клонирования S'~S*GM31lCTGt CGACICCGCG GGASCATCM ATG-Г (SEQ ПІ HO:13J a n d S'-GA*CGAMCC ЫМЗСТТСТСА CG*CC5CGtA А6ЇАС-3 1 й -—— ИО!І4». (SEO ^ ID (ПОС ID № 14) Ниже даны циклотермические параметры, используемые в этих ПЦР Денатурация при 94°С в течение 1мин Отжиг при 60°С в течение 2мин Полимеризация при 72°С в течение Змин 30 циклов, без самоудлинения, линкированных при инкубации при 4°С Образованный в результате ПЦР ~ 1,3кб фрагмент был подвергнут расщеплению Nde I и Hind III и затем клонирован в pMON 2123 для экспрессии кодируемого фермента Активность глифосат оксид оредуктазы измеряли, кал описано выше, и Km для глифосата было сходно с соответствующей величиной для ферментов из LBAA, представленных выше Источник глифосата ген оксилрредуктазы Km (глифосат мМ) Pseudomonas sp штамм LBr 25 Бактерии, изолированные в ходе процессов с использованием глифосата в установках по обработке отбросов, также могут обладать способностью превращать глифосат в АМРА В качестве двух подобных примеров можно назвать Pseudomonas штаммы LBAA и LBr Такого типа бактерии могут быть использованы также de novo из этих 36 очистительных установок Популяция бактерий была изолирована из стационарной колонки иммобилизации клеток, которая была заполнена частичками Mannville R635 диатомовой земли, путем помещения на Триптон Сойя Агар (Дифко), содержащий циклогексимид в концентрации 100мкг/мл, и инкубации при 28°С Через колонку в течение трех месяцев пропускали воду с примесями с Moncanto Company's Lulmg, MS, завода по производству глифосата Колонка содержала 50мг/мл глифосата и ІЧНз в качестве NH4CI Общий органический углерод составлял 300мг/мл и БПК (Биологическая потребность в кислороде - мера "мягкого" наличия углерода) была менее 30мг/мл Такая колонка по обработке была описана Heitkamp с соавт ,(1990) Один из наиболее предпочтительных штаммов данной популяции, идентифицированный как Agrobactenum sp штамм Т10, был обнаружен при росте в минимальном бульоне, где основным источником углерода был глифосат в концентрации ЮмМ (этот бульон готовили для DF среды, но включающей глифосат, который заменяет глюкозу, глюконат и цитрат) Хромосомальную ДНК готовили из этого изолята и подвергали той же самой ПЦР процедуре и с теми же самыми праймерами, которые выше описаны для штамма LBr После получения фрагмента нужного размера его клонировали в вектор экспрессии Е coli Определяли активность глифосат оксидоредуктазы, а также Km для глифосата Источник гена Km (глифосат мМ) Agrobactenum sp штамм ТЮ 28 О превращении глифосата в АМРА сообщалось для многих разных почв (см Malik с соавт, 1989 для обзора), и имеется целый ряд методов для экстракции общей ДНК из смешанных проб, взятых из окружающей среды, таких как почва (Holben с соавт , 1988, Steffan и aTtlas,1988, Tsai и Olson, 1991), что указывает на возможность клонирования глифосат оксидоредуктазных генов в отсутствии первого изолята, такого как разрушающийся микроорганизм Конечно, процедура, описанная для клонирования глифосат оксидоредуктазных генов, основанная на обеспечении способности утилизации глифосата или толерантности к глифосату, на примере Е coli, дает схему, по которой можно клонировать другие глифосат оксидоредуктазные гены или гены, метабол изирущие глифосат, не считаясь с гомологией, указанной для описанных выше глифосат оксидоредуктазных генов Возможно также, обогащение расщепляющих глифосат бактерий, например, путем повторного использования глифосата в партии почвы(Ошпп с соавт , 1988, Talbon с соавт, 1984) Эта обогащающая стадия может быть использована для повышения легкости извлечения генов глифосат оксидоредуктазы из почвы или других источников окружающей среды Указания на присутствие глифосат оксидоредуктазного гена у почвенных бактерий и процедура для выделения таких генов заключаются в следующем Популяция подходящих бактерий обогащается путем отбора бактерий, способных расти на жидкой среде с добавлением глифосата 37 52574 (при 10мм) в качестве источника углерода (Эта среда готовится согласно описанию для DworkmFoster среды, но с изъятием источника углерода и с Рі в качестве источника Р) Материал для заражения был взят из экстракта почвы (с недавно убранного поля, засеянного соей, в Джерсивилле, Иллинойс), и популяция была подвергнута отбору путем успешного культивирования в описанной выше среде при 28°С (Для предотвращения грибкового роста в среду добавляли циклогексимид в концентрации 100мкг/мл) При помещении на среду с L -агаром, были идентифицированы 5 типов колоний Хромосомальную ДНК готовили из 2мл культуры в L -бульоне этих изолятов, и наличие глифосат оксидоредуктазного гена определяли, используя ПЦР скрининг Используя праймеры GCCGAGATGACCGTGGCCGAAAGC (ПОС Ю№ 15) и GGGAATGCCGGATGCTTCAACGGC (ПОС Ю № 16), был получен фрагмент ДНК заданного размера с хромосомальной ДНК из одного из изолятов (обозначен S3) Примененные ПЦР условия были следующие 1мин при 94°С, 2мин при 40°С, Змин при 72°С, 35 циклов Фрагмент ДНК, полученный таким путем, используется в качестве пробы (после изотопного мечения) для изолирования S3 глифосат оксидоредуктазного гена, кандидата из космидного банка, сконструированного как описано для LBAA ДНК, причем данный фрагмент облегчает изолирование других глифосат оксидоредуктазных генов Используемые праймеры гомологичны внутренним последовательностям в LBAA глифосат оксидоредуктазном гене Примененные условия ПЦР допускают определенную степень несоответствия в праймерах, и в результате предполагается, что глифосат оксидоредуктазный ген из S3 необязательно является близко родственным геном к другим генам глифосат оксидоредуктазы, которые были успешно изолированы при использовании праймеров к N- и С- концам LBAA гена Для изолирования генов известно большое разнообразие методов Некоторые из этих процедур основаны на данных о функции генов, что позволяет планировать фенотипический скрининг для целей изолирования генов Другие методы основаны, по крайней мере, на частичной информации о последовательности ДНК, в связи, с чем возможно использование проб и праймеров с частичной или полной гомологией, или методы, которые основаны на использовании антител для обнаружения генных продуктов Каждый из выше указанных вариантов может быть применен для клонирования генов глифосат оксидоредуктазы Оптимизация кинетических свойств глифосат оксидоредуктазы Предшествующие примеры гербицидной резистентности, достигнутой путем ферментативной инактивации гербицидов, используют ферменты, которые способны связывать и метаболизировать гербициды гораздо более эффективней, чем глифосат оксидоредуктаза метаболизирует глифосат Фермент глифосат оксидоредуктазы имеет Km для глифосата 20 - ЗОмМ, и как результат, скорость реакции расщепления глифосата можно повысить с оптимальной эффективностью в трансгенных растениях или путем снижения Km 38 или повышения Vmax Техника рандомного мутагенеза в сочетании с соответствующими отбором и скринингом является прекрасным инструментом, который можно успешно использовать для получения больших количеств измененных генных последовательностей и потенциальных вариантов Те же самые подходы можно использовать для изолирования и идентификации глифосат оксидоредуктазных вариантов с повышенной эффективностью расщепления глифосата К приемлемым методам мутагенеза относятся химический мутагенез бактериальных культур, содержащих нужный ген или очищенную ДНК этого гена, а также ПЦР методы, используемые для получения копий гена (или частей его) в условиях, которые благоприятны для неправильного включения нуклеотидов (ошибки) в новую цепочку Примером такого условия может быть выполнение ПЦР реакции в присутствии Мп + + Соответствующий скрининг ин виво для получения улучшенных вариантов после мутагенеза может быть также использован для повышения толерантности к глифосату у Е coh или повышенного роста в присутствии глиоосата у Мри+ штаммов С целью скрининга, ген глифосат оксидоредуктазы клонируется в векторе, содержащем слабый бактериальный промотор и/или в репликоне с небольшим числом копий Фенотипы, толерантные к глифосату, различных глифосат оксидоредуктазных конструкций, как показано, варьируют в отношении концентраций глифосата, а также коррелируют с уровнем экспрессии глифосат оксидоредуктазы Например, в условиях отсутствия индукции, Plac-глифосат оксидоредуктазные векторы экспрессируют более низкие уровни глифосат оксидоредуктазы, чем РгесАглифосат оксидоредуктазные векторы, и также проявляют более низкую толерантность к глифосату генный фрагмент после мутагенеза клонируют в более подходящий вектор и подвергают скринингу полученную библиотеку Варианты отбираются, по их способности расти в присутствии определенных уровней глифосата, которые подавляют рост контрольного штамма, содержащего родительский клон глифосат оксидоредуктазы Активность глифосат оксидоредуктазы обеспечивает Е coh способность превращать глифосат в АМРА, и, в подходящих штаммах Е coh этот АМРА может служить источником фосфата вследствие расщепления С-Р связи при помощи С-Р лиазы Подходящими штаммами Е coh являются В штаммы или Мри+ производные К штаммов Ген глифосат оксидоредуктазы обеспечивает минимальный рост на глифосате, как единственном источнике фосфора в штамме Е coh JMIOI Mpu+ (= GB993) Согласно данным, скорость роста на глифосате также коррелирует с уровнем экспрессии глифосат оксидоредуктазы Полученный в результате мутагенеза глифосат оксидоредуктазный ген клонируют в соответствующий вектор и библиотеку вариантов скринируют путем различной скорости роста в чашках или при культивировании в среде, содержащей глифосат, в качестве единственного источника фосфора Клоны, которые показывают более интенсивный рост на чашках по сравнению 39 52574 с контрольным штаммом, вновь подвергаются скринированию путем анализа кривой роста Варианты глифосат оксидоредуктазы, идентифицированные при каждом отборе/скрининге, клонируют в вектор с высоким уровнем экспрессии и подвергают ферментативному анализу для определения Km и Vmax величин для глифосата Наилучшие варианты глифосат оксидоредуктазы подвергают очистке для полной кинетической характеристики Варианты глифосат оксидоредуктазы, которые характеризовались более низкими величинами Km и сходными или более высокими величинами Vmax по сравнению с соответствующими величинами фермента дикого типа, подвергались анализу путем секвенирования нуклеиновых кислот для определения мутации (или мутаций) Основная цель процедуры заключается в изолировании вариантов с более высоким отношением Kcat/Km для расщепления глифосата, катализируемого глифосат оксидоредуктазой Изолирован вариант улучшенной модификации такого типа Процедура мутагенеза состояла из ПЦР с применением Мп + + , и матрица представляла собой линейную плазмиду с глифосат оксидоредуктазным геном, содержащую синтетический глифосат оксидоредуктазный ген (ПОСЮ № 8) Олигонуклеотидные праймеры были гомологичными с областями вектора и фланкирующими ген глифосат оксидоредуктазы ПЦР выполняли в следующих условиях 1мин при 94°С, 2мин при 55°С и Змин при 72°С, с 35 циклами Использовали отношение дЦТФ+дГТФ+ТТФ к дАТФ, равное 5 1 Реакции включали MnCI2 при 125, 250, 375 или 500мкМ После реакции амплифицированный продукт вновь подвергался клонированию в вектор, содержащий слабый промотор Е coh Этот вектор является производным pBR 327, включающим ara BAD промотор и подходящие сайты клонирования Сто колоний с данной стадии клонирования были затем скринированы в Е coh GB993 с целью отбора на повышенную толерантность к глифосату и фенотипов утилизации в среде, состоящей из MOPS минимальной среды с глифосатом и Pi ИЛИ С ОДНИМ глифосатом, соответственно Скорости роста определяли путем измерения А550 в течение 96 часового периода При данном скрининге были идентифицированы три клона, характеризующиеся наиболее интенсивной скоростью роста Эти трансформанты обладали фенотипом, способность к утилизации которого была в 1,5 2,0 раза выше Ген глифосат оксидоредуктазы был вновь клонирован в часть вектора экспрессии, после чего была выполнена верификация этого фенотипа Весь кинетический анализ проводили на интактных лизатах Е coh Предполагаемые белковые варианты глифосат оксидоредуктазы были подвергнуты дополнительной экспрессии после субклонирования варианта гена Nco I/Hind III глифосат оксидоредуктазы в Ргес А-ген 10L вектор экспрессии Для дополнительной экспрессии в Ргес А-ген 10L конструкциях, GB993 клетки, содержащие вектор, были индуцированы при Кпетт = 110 - 120 в М9 минимальной среде с 50мкг/мл налидиксовой кислоты и инкубированы в течение 2,5час при 37°С при сильном встряхивании Клетки затем собирали путем центрифугирования при 40 4000д в течение 5мин при 4°С и ресуспензировали в ЮОмМ Трис-НСІ, рН 7,1, 1мМ ЭДТК, 35мМ КСІ, 20% глицерина, и 1мМ бензамидина в Змл/г клеточного осадка Лизаты готовили путем разрушения клеток во Френч Прессе, дважды подвергая давлению в 10OOpsi (фунтов на квадратный дюйм) Нерастворимый остаток удаляли путем центрифугирования при 12000д, в течение 15мин при 4°С, и супернатант подвергали обессоливанию путем пропускания через PD-10 колонку (Сефадекс G-25, Фармацея) Выделенная фракция была использована в качестве источника фермента для кинетического анализа Концентрацию белка определяли путем использования Био-Ред связывающей краситель белковой пробы Для определения линейных пределов выполняли тестирование в разное время и с разными концентрациями Проба на фермент заключалась в следующем лизат и глифосат оксидо редуктазную смесь (конечная концентрация = 0,1 М MOPS, 0,01 М Трицина, рН 7,4, 0,01Мм FAD, ЮМм MgCI2) в 100мкл реакционной смеси предварительно инкубировали при 30°С в течение 2мин перед добавлением глифосата (аналитический маточный раствор готовили в воде, рН которой доводили до 7,0 используя NaOH) 10 минут являются оптимальным временем для тестирования фермента с использованием Юмкг лизата После 10мин инкубации при 30°С при постоянном встряхивании добавляли 0,25мл динитрофенилгидразина (ДНФГ) (0,5мг/мл в 0,5М HCI), и затем реакцию проводили еще дополнительных 5мин при 30°С при постоянном встряхивании После этого к тестируемой смеси добавляли 1,5М раствор NaOH (400мкл), и снова, реакция проходила в течение 5мин при 30°С при встряхивании Активность фермента определяли исходя из количества образованного продукта глифосат -ДНФГ путем измерения А520 по отношению к стандарту глифосата Тестирование ферментов осуществляли дважды, по крайней мере, на двух изолятах одной колонии предполагаемого варианта глифосат оксидоредуктазы Для определения Km и Vmax, тестирование фермента выполняли с использованием (0,2 - 2,0) х Km предела концентраций глифосата Km и Vmax определяли согласно Lmeweaver Burk, Eadie-Hoftee и гиперболических кинетических кривых, Vmax устанавливали после определения количества иммунореактивного глифосат оксидоредуктазного белка в лизатах иммуноблот анализа, описанного ниже Иммуноблот анализ выполняли после ДСНПААГ и переноса балка с геля на нитроцеллюлозу при 500мА в аппарате Хоффера в 25мМ Трис/НСІ, 192мМ глицине, содержащем 0,1% ДСН и 25% метанола,в течение 1 - 2 часов После переноса нитроцеллюлозу инкубировали с 50мМ Трис-НСІ, рН 7,5, 0,9% NaCI, 0,01% Твин 20, 0,02% NaN3 , содержащего 2% бычьего сывороточного альбумина при комнатной температуре при встряхивании в течение, по крайней мере, ЗОмин После слипания добавляли тот же самый буфер, содержащий 1 25000 разведение козлиной анти-глифосат оксидоредуктазной антисыворотки и помещали на фильтр при встряхивании при комнатной температуре в течение 45мин После инкубации с первичными глифосат оксидоредуктазными анти 52574 42 41 телами, фильтр промывали в течение 45мин в шедшее в ApaLi-Hmd III фрагменте (содержит кобуфере, не содержащем антител, затем добавдон 334) ответственно исключительно за изменеляли буфер, содержащий 1 5000 разведение ние в ферменте кроличьих анти - козлиная щелочная фосфотаза коньюгированных вторичных антител (от Пирса), и Кинетический анализ изменений доменов фильтр инкубировали в течение 45мин при комнатной температуре и встряхивании После чего Клон Km (мМ) Vm (Ед/мг) Vm/Km фильтр промывали в буфере без антител в течеwt(w1w2w3*) 28,4 0,65 0,022 ние ЗОмин перед тем, как добавить МВТ и BCIP v247(v1v2v3**) 2,1 0,72 0,34 (Promega) с целью окрашивания Определяли w1 v2w3 23,5 0,62 0,026 также количество иммунореактивного глифосат w1v2v3 2,1 0,6 0,28 оксидоредуктазного белка путем дот блоттинга w1w2v3 2,0 0,75 0,375 лизата на нитроцеллюлозе и последующей обраv1w2v3 2,6 0,55 0,21 ботки фильтра, как описано выше, за исключеv1 w2w3 28,0 0,75 0,027 нием того, что для обнаружения был использован v1 v2w3 26,7 0,55 0,021 125 1- Белок G Количество глифосат оксидоредуктазного белка в лизатах определяли путем под*w1 = SER 84, w2 = LYS 153, w3 = HIS 334 счета метки и сравнения радиоактивности со **v1=GLY84, v2=ARG153, v3=ARG334 стандартным белком глифосат оксидоредуктазы Один из вариантов показал (вар 247) 3 - 4-кратное Эти результаты подтверждаются и дополняувеличение специфической активности глифосат ются в результате повторного изменения Хиз на оксид оредуктазы при наличии 25мМ глифосата, а Apr в кодоне 334 и введением в этот остаток друрезультаты иммуно-блот анализа свидетельствогих специфических изменений путем сайт-направвали в пользу того, что этот факт не был связан с ленного мутагенеза Далее перечислены испольповышением уровня белка глифосат оксидоредукзованные праймеры тааы Последующее тестирование показало, что Apr CGTTCTCTAC ACTCGTGCTC данный вариант характеризовался величиной Km GTAAGTTGC для глифосата, которая была в 10 раз ниже, чем в (ПОС ID № 19), Лиз - CGTTCTCTAC ACслучае глифосат оксид оредуктазы дикого типа TAAGGCTC GTAAGTTGC Сходным образом определяли величину Km для (ПОС ID № 20), Глю - CGTTCTCTAC ИАУК Эти данные представлены ниже ACTCAAGCTC GTAAGTTGC (ПОС ID № 21), Ала - CGTTCTCTAC Кинетический анализ вариантов глифосат оксидоACTGCTGCTC GTAAGTTGC редуктазы (ПОС ID № 22) (Эти последовательности являются антисмысловыми в отношении к последоKm (мМ) Vm (Ед/мг) Vm/Km вательностям, используемым в настоящее время ) Наличие этих изменений подтверждается секвеВариант Глиф ИАУК Глиф ИАУК Глиф ИАУК нировалием генов глифосат оксидоредуктазы подикий 27,0 2,8 0,8 0,5 03 18 сле мутагенеза Выполнен кинетический анализ тип экспрессируемых ферментов глифосат оксидоревар 247 2,6 0,7 0,6 0,7 23 1,0 дуктазы, данные которого показывают, что ряд замен возможен в данном положении и, это, в Ген глифосат оксид оредуктазы из вар 247 был свою очередь, приводит к синтезу фермента с секвенировану (ПОС Ю №17) в результате чего измененными кинетическими свойствами было обнаружено пять изменений в нуклеотидах Поскольку эти изменения связаны с кодонами, то они здесь указаны GCT на GCC (кодон 43),отсутствие изменений в аминокислотах, AGC на GGC (кодон 84), Сер на Гли, AAG на AGG (кодон 153), Лиз на Apr, CAC на CGC (кодон 334), Лиз на Apr, CCA на CCG (кодон 362), без изменений в аминокислотах Аминокислотная последовательность глифосат оксидоредуктазного гена из в 247 представлена в качестве ПОС Ю № 18 Важность этих различных изменений в аминокислотах исходно оценивается путем повторного клонирования измененных участков в глифосат оксидоредуктазу дикого типа и определения эффекта на активность и кинетику глифосат оксид оредуктазы Это осуществляется путем реклонирования NcolNhel фрагмента (содержит кодон 84), Nhel-ApaLI фрагмента (содержит кодон 153) и ApaLi-Hmd III фрагмента (содержит кодон 334),по отдельности в ген дикого типа Эти гены глифосат оксидоредуктазы были экспрессированы, после чего был выполнен кинетический анализ Представленные ниже данные показывают, что изменение, проис Кинетический анализ вариантов глифосат оксидоредуктазы Вариант Дикий тип в 247 Apr 334 Лиз 334 Глн 334 Ала 334 Km (мМ) Глиф ИАУК 27,0 2,8 2,6 0,7 2,6 0,5 9,9 1,3 19,6 3,5 26,7 3,5 Vm (Ед/мг) Vm/Km Глиф ИАУК Глиф ИАУК 0,8 0,5 03 18 0,6 0,7 23 1,0 0,6 0,6 23 1,2 0,7 0,8 07 62 0,6 0,7 03 20 0,2 0,2 007 057 Дополнительный мутагенез был осуществлен для замены Хиз 334 остатка на другой аминокислотный остаток Для выполнения этой процедуры использовали следующие праймеры и новый кодон Trp CTCTACACTTGGGCTCGTAAGCTTCT TCCAGC (ПОС ID № 23) lie CTCTACACTATCGCTCGTAAGCTTCT TCCAGC (ПОС ID № 24) 43 Leu 52574 CTCTA CACTCTGGCTCGTAAGCTTCTTCCAGC (ПОС ID № 25) Glu CTCTACACTGAAGCTCGTAAGCTTCTTCCAGC (ПОС ID № 26) (Эти последовательности являются антисмысловыми в отношении последовательностей, используемых в настоящее время, эти праймеры также присоединяют "молчащий" Hind III, который облегчает идентификацию в популяции потомков, полученных в результате мутагенеза ) GLU 334 вариант сохраняет значительную активность глифосат оксидоредуктазы, в то время как TRP 334, ILE 334 и LEU 334 варианты обнаруживают значительно более низкую активность Из вариантов первой генерации, варианты с более высоким отношением Kcat/Km предпочтительно подвергаются второму циклу мутагенеза, который сопровождается последующим скринингом и анализом Альтернативный подход может заключаться в получении второй генерации вариантов глифосат оксидоредуктазы путем комбинации точечных мутаций, идентифицированных среди вариантов первой генерации Трансформация растений Используя данное изобретение, можно обеспечить толерантность к глифосату у следующих видов растений, однако, следует отметить, что данный список не является исключительным соя культурная, хлопок, зерновые, лен, подсолнечник, картофель, табак, томат, пшеница, рис, люцерна, латук, яблоня, тополь, сосна, сахарная свекла, репс, канола Двухцепочечная молекула ДНК изобретения ("химерный ген") может быть встроена в геном растения путем использования подходящего метода Удобными векторами для трансформации растений являются векторы, полученные из Ті плазмиды Agrobacterium tumefaciens, а также обнаруженные, например, Herrera-Est rella (1983), Bevan (1984), Klee (1985), и представленные в ЕРО публикации 120516 (Schilperoort с соавт) Кроме векторов трансформации растений, производных Ті ИЛИ рут-индуцирующих плазмид (Ri) Agrobacterium, могут быть использованы альтернативные методы для встраивания конструкций ДНК изобретения в растительные клетки К таким методам можно, например, отнести использование липосом, электропорации, химических веществ, повышающих степень поглощения свободной ДНК, поступление свободной ДНК посредством микро-проектирующего бомбардирующего устройства, или трансформацию, использующую вирусы или пыльцу pMON 979 вектор трансформации/экспрессии растений подучен из pMON 886 (описан ниже) путем замещения гена неомицин фосфотрансферазы типа II (KAN ) в pMON 886 0,89кб фрагментом, содержащим бактериальный ген гентамицинЗ-Ы-ацетилтрансферазы типа III (ААС(З)-Ш) (Hayford с соавт,1988) Химерный P-35S/AA(3)-III/NOS З'ген кодирует резистентность к гентамицину, что обеспечивает отбор трансформированных растительных клеток pMON 979 также содержит 0,95кб кассету экспрессии, состоящую из усиленного 44 CaMV 35S промотора (Кау с соавт,1987), нескольких уникальных сайтов рестрикции и NOS 3' конца (P-En -CaMV 35S/NOS З1) Остальные pMON 979 ДНК сегменты являются точно такими же, как в pMON 886 Плазмида pMON 886 построена из следующих сегментов ДНК Первый представлен 0,93кб Ava їв соединении с Eco RV фрагментом, изолированным из транспозона Тп 7, кодирующим бактериальную резистентность к спектиномицин/стрептомицину (Spc/Str), таким образом, являясь детерминантой для отбора у Е coh и Agrobacterium tumefaciens Данный сегмент соединяется с 1,61кб фрагментом ДНК, кодирующим химерную канамицин резистентность, что обеспечивает отбор трансформированных растительных клеток Химерный ген (P-35S/KAN/NOS 3') содержит 35S промотор BHpyca(CaMV) мозаики цветной капусты, ген неомицин фосфотрансферазы типа II (KAN) и З'-нетранслируемую область гена нопалин синтазы (NOS 3') (Fraley с соавт,1983) Следующий сегмент представлен 0,75кб on V, содержащим ориджин репликации из RK2 плазмиды Он соединяется с 3,1кб Sai І в соединении с Pvu I сегментом из pBR 322 (on 322), обеспечивающим поддержание ориджина репликации в Е coh, a также bcm сайт для коньюгационного переноса в клетки Agrobacterium tumefaciens Следующий сегмент является 0,36кб Pvu І в соединении с Всі І из рТ/Т37, который несет нопалин-тип Т- ДНК правого края (Fraley с соавт ,1985) pMON 981 плазмида содержит следующие сегменты ДНК 0,93кб фрагмент, изолированный из транспозона Тп7 и кодирующий бактериальную резистентность к спектиномицин/стрептомицину (Spc/Str), детерминанта для отбора в Е coh и Agrobacterium tumefaciens (Flmy с соавт ,1985), химерный ген резистентности к канамицину, полученный путем генной инженерии для экспрессии в растении, что обеспечивает выбор трансформированной ткани, включающий 0,35кб промотор 35S вируса мозаики цветной капусты (P-35S) (Odell с соавт,1985), С,83кб ген неомицин фосфотрансферазы типа II (KAN) и 0,26кб З'-нетранслируемую область гена нопалин синтазы (NOS 3') (Fraley с соавт,1983), 0,75кб ориджин репликации из RK2 плазмиды (onV) (Stalker с соавт ,1981), 3,1кб Sai І в соединении с Pvu I сегмент из pBR 322, который обеспечивает ориджин репликации для поддержания в Е coh (оп-322) bom сайт для коньюгационного переноса в клетки Agrobacterium tumefaciens, а также 0,36кб Pvu І в соединении с Всі І фрагмент из плазмиды рТ/Т37, включающий правую краевую область нопалин-тип Т-ДНК (Fraley с соавт , 1985) Кассета экспрессии состоит из 0,6кб 35S промотора из вируса мозаики норичника шишковатого (P-EMV) (Gowda с соавт , 1989) и 0,7кб З'-нетранслируемую область rbc S-E9 гена гороха (Е9 3') (CORUZZI с соавт,1984, Morelh с соавт, 1985) 0,6кб Ssp I фрагмент, содержащий FMV 35S промотор (фиг1), был сконструирован инженерным путем для помещения подходящих сайтов клонирования по течению транскрипционного стартового сайта Вектор растения используется в ABI Agrobacterium штамме ABI штамм является А208 Agrobac 45 46 опрыскивания 0,4 фунтов/акр (примерно, 0,448кг/га) глифосата также свидетельствовал об очень незначительных уровнях толерантности Модификация генной последовательности (описанная в данном сообщении) привела к усилению экспрессии в растениях табака, в результате использования FMV промотора и слияния ХТП с глифосат оксидоредуктазным геном В этом случае, большая часть данных получена на трансгенных растениях, трансформированных с помощью векторов, содержащих выше указанные оптимизированные конструкции глифосат оксидоредгктазы Одна из серий экспериментов с модифицированным глифосат оксидоредуктазным вектором pMON17073 описана в примере 1 Пример 2 представляет результаты исследований глифосат оксидоредуктазы, полученной в результате манипуляций, синтетической глифосат оксидоредуктазы, а также ХТП 1-синтетической глифосат оксидоредуктазы Трансформация и экспрессия глифосат оксидоредуктазы у канолы описаны в примере 3 52574 tenum tumefaciens, несущей бесплечную Ті плазмиду рТіС58 (pMP90RK) (Koncz и Sehell, 1986) Ті плазмида не обладает генами Т-ДНК фитогормонов, и поэтому штамм не способен вызывать корневой рак Сочетание вектора растения с АВІ достигается посредством системы трипарентальной конъюгации, использующей helper плазмиду pRK2013 (Litta с соавт , 1980) В том случае, если ткань растения инкубируют с коньюгатом АВІх вектор растения, то вектор переносится в клетки растения в результате vir функций, кодируемых бесплечной рТіС58 плазмидой Вектор открывает правую краевую область Т-ДНК, и полная последовательность вектора растения может быть встроена в хромосому растения хозяина рТіС58 Ті плазмида не переносится в клетки растения, а остается в Agrobactenum Регенерация растений Когда в трансформированных клетках или протопластах достигается необходимая активность глифосат оксидоредуктазы, то клетки (или протопласты) регенерируют в целые растения Методы, используемые на этапе регенерации, являются не столь исключительными в каждом конкретном случае, причем подходящие прописи имеются для растений из Legummosae (люцерна, соя культурная, клевер), Umbelliferae (морковь, сельдерей, пастернак), Cruciferae (капуста, редис, рапс и т д), Cucurbitaceae (дыни и огурцы), Grammcae (пшеница, рис, кукуруза и т д ) , Solanaсеае (картофель, табак, томат, перец) и различных цветковых культур См , например, Ammirato, 1984, Shimamoto, 1989, Fromm, 1990, Visil, 1990 Ниже приведены примеры, более детально знакомящие с использованием изобретения, однако для их интерпретации вовсе необязательно ограничиваться только рамками настоящего изобретения Специалисты поймут, что представленные здесь методы и описанные гены можно соответствующим эбразом модифицировать или сократить, однако при этом, не затрагивая самой сути изобретения Примеры Экспрессия, Активность и Фенотип Глибосал оксидоредуктазы в трансформированных растениях В следующих примерах описаны трансформация, экспрессия и активность глибосат оксидоредуктазы, а также толерантные к глифосату фенотипы, полученные у растений с помощью оксидоредукутазных генов, введенных в Nicotiana tabacum cv "Samsun" и/или Brassica napus cr Wetar, используя векторы pMON17073, pMON17032, pMON17065, pMON17066, pMON17138, pMON17164 Согласно исходным данным, полученным для табака, экспрессия гена глифосат оксидоредуктазы, полученного в результате манипуляций (ПОС Ю № 6),под контролем En-CaMV35S промотора (см данные по pMON17073 в табл VIII и IX, в качестве примера) характеризуется низкими уровнями Транскрипция гена была подтверждена у 3 - 4 растений путем Носерн и S1 анализа, однако не был обнаружен белок глифосат оксидоредуктазы (предел обнаружения в данной пробе составлял около 0,01% уровня экспрессии) Анализ Ro растений после Пример 1 Протокол трансформации листовых дисков табака представляет ткань нормальных листьев в возрасте около 1 месяца После 1 5 - 2 0 минутной стерилизации поверхности 10% Клороксом в сочетании с поверхностно-активным веществом, листья трижды промывали в стерильной воде Используя стерильный бумажный пуансон, листья пробивали и помещали вверх дном в MS104 среду (MS соли 4,3г/л, сахароза ЗОг/л, витамины В5 500Х 2мл/л, NAA 0,1мг/л и ВА 1,0мг/л) с целью преинкубации в течение одного дня Затем диски заражали ночной культурой бесплечной Agrobactenum ABI, содержащей нужный вектор, причем культура была разведена 1/5 (те около 0.6ОД - оптическая плотность) Заражение осуществляли путем помещения дисков в центрифужные пробирки с культурой По прошествии 30 - 60 секунд жидкость отсасывали, а диски промокали с помощью стерильных бумажных фильтров Затем диски помещали вверх дном в чашки с питательной средой MS104 на фильтры для сокультивирования Через 2 - 3 дня сокультивирования диски переносили, опять же вверх дном, в чашки для селекции со средой MS104 Через 2 - 3 недели образовавшийся каллюс или отдельные побеги были отделены от листовых дисков Побеги отрезали от каллюса, когда они становились уже достаточно большими, и их можна было отличить от стеблей Отобранные побеги помещали на свободную от гормонов среду, благоприятную для роста корней (MSO MS соли 4,3г/л, сахароза ЗОг/л и В5 витамины 500Х 2мл/л) Через 1 - 2 недели образовывались корни Любое тестирование листового каллюса предпочтительно выполнялось на корневых побегах, сохранявших стерильность Корневые побеги помещали в почву и содержали в условиях повышенной влажности (т е в пластических контейнерах или сумках) Корни все более укоренялись в результате поддержания влажности в окружающей среде Всего было исследовано 45 резистентных к канамицину pMON17073 линий табака (Табл V) 47 52574 Таблица V 48 18854 18858 Использование глифо# Растесата в новых каллюсах ния (0,5мМ глифосат) 18890 45 11 34 Вестерн анализ растений + 24 21 + средние значения 0,5 - 2нг/50мкг белка - значения < 0,5нг/50мкг белка Листья, вновь образующие каллюсы в среде с тканевой культурой растения обнаруживали низкий уровень толерантности к глифосату (определяется как +/- фенотип), по крайней мере, в 11 из исследованных линий Не менее 24 линий показывали обнаруживаемый уровень экспрессии глифосат оксидо-редуктазы в пределах от 0,5 до 2нг на 50мкг экстрагируемого белка Толерантность к глифосату, обнаруженная зри тестировании листьев с вновь образованным каллюсом, и более высокий уровень экспрессии глифосат оксидоредуктазы, свидетельствуют в пользу того, что изменения в кодирующих глифосат оксидоредуктазу последовательностях, обусловленные конструированием модифицированного глифосат оксидоредук-тазного гена (ПОС Ю № 7), оказали заметный эффект на способность этого гена экспрессироваться в растениях Тот же самый эффект может быть достигнут в результате экспрессии гена глифосат оксидоредуктазы, полученного с помощью манипуляций (ПОС Ю № 6) при применении сильных промоторов растений, путем использования лучших последовательностей 3' сигнала полиаденилирования, оптимизации последовательностей рядом с кодоном инициации для нагружения рибосом и инициации трансляции, или же путем комбинаций этих или других регуляторных или экспрессирующих последовательностей или факторов R1 потомки ряда из указанных линий, включая тех, которые обнаруживали наиболее высокий уровень экспрессии глифосат оксидоредуктазы (#'S18854 и 18848), были подвергнуты опрыскиванию глифосатом в объеме 0,4 и 1,0 фунтов на акр (0,448 и 1,12кг/га, соответственно), после чего втечение 4недельного периода производили оценку вегетативных признаков Таблица VI Данные опрыскивания табака для pMON17073 R1 растений 18860 18848 CD CO 18842 Объем опры- Вегетативные признаки* скивания кг/га 7 дней 14 дней 28 дней 0 448 3 3 4 1 12 1 1 2 0 448 4 8 1 12 2 6 0 448 4 8 1 12 2 6 ю со Линия 18885 Samsun 4 2 3 1 4 2 3 1 1 1 7 5 4 2 5 1 CD CM Экспрессия модифицированного глифосат оксидоредуктазного гена в растениях табака (RI трансгенные варианты pMON17073) 0 448 1 12 0 448 1 12 0 448 1 12 0 448 1 12 0 448 1 12 1 1 9 8 6 4 8 2 7 3 2 0 * Вегетативные признаки 0 = мертвые 10 = эффекта не обнаружено После исходной lag фазы эти линии обнаруживали вегетативную толерантность к глифосату при обоих режимах опрыскивания (которая со временем повышалась), причем особенно это касалось растений, характеризовавшихся наиболее высокими уровнями экспрессии глифосат оксидоредуктазы Активность фермента глифосат оксидоредуктазы определяли у двух из pMON17073 линий (#'S 18858 и 18881) Ткань листьев (1г) замораживали в жидком азоте и хранили вплоть до приготовления экстракта при -80°С С целью экстракции ткань листьев измельчали в ступке и растирали пестиком с жидким азотом К распыленной в порошок ткани листьев добавляли 1мл экстрагирующего буфера (100ММ Трис CI, рН 7,4, 1М ЭДТК, 20% глицерин, 35мМ KCI, 1мМ бензамидин HCI, 5мМ аскорбата Na, 5мМ дитиотреитола, и 1мг/мл бычьего сывороточного альбумина, 4°С), после чего пробу перетирали в течение 1мин Полученную смесь центрифугировали в течение 5мин (высокая скорость, Eppendorf) и супернатант обрабатывали насыщенным раствором сульфата аммония для получения 70% конечного насыщения (2,33мл насыщенный раствор/мл экстракта) Осажденный белок собирали, как указано выше, путем центрифугирования, и осадок ресуспензировали в 0,4мл экстрагирующего буфера После центрифугирования пробу с целью удаления частиц подвергали обессоливанию, пропуская через сефадекс G50, содержавшийся в 1мл шприце и уравновешенном экстрагирующим буфером, в соответствии с методом Penefsky (1979) Обессоленные растительные экстракты сохранялись на льду, и белковые концентрации определялись методом Bradford (1976) Реакции на глифосат оксид оредуктазу выполняли в дублированных пробах в течение бОмин при 30°С в смеси 0,1 MOPS/0,01 трицинового буфера, рН 7,4, содержащим ЮмМ МдСОг, 0,01мМ флавин аденин динуклеотида (FRD, Сигма), и 1мМ кофермента Q (Сигма) Растительные экстракты (75мил) предварительно инкубировали в выше указанной смеси в течение 2мин , после чего осуществляли инициацию реакций путем добавления иминоацетоуксусной кислоты (ИАУК, 20мкл) в качестве субстрата до конечной концентрации 50мМ (общий объем пробы 0,2мл) Реакционные смеси охлаждали и подвергали дериватизации, как описано ниже Контрольные реакции выполняли в отсутствии ИАУК и растительного экстракта Определение глиоксилата осуществляли путем использования 52574 Таблица VII Активность глифосат оксидоредуктазы в трансгенных растениях табака п Растение Samsun 18881 18858 Специфическая активность ч ^ . нмоль/мин мг 0 (не обнаружено) 0,039 0,018 Пример 2 Серия трансформированных линий табака была получена в результате использования "изогенных" глифосат оксидоредуктазных векторов pMON17073 (глифосат оксидоредуктаза, полученная путем манипуляций) (ПОС Ю№ 6), pMON17065 (синтетическая глифосат оксидоредуктаза) (ПОС Ю№ 8), и pMON17066 (ХТПІ-синтетическая глифосат оке ид оредуктаза) Путем Вестерн анализа ряда из этих линий (см табл 7) показано, что растения с манипулированной глифосат оксид оредуктазой экспрессируют до ~ 0,5нг глифосат оксид оредуктазы на 50мкг растительного белка, с синтетической глифосат оксидоредуктазой - до ~ 0,5 - 2нг на 50мкг и с ХТПІ-синтетической глифосат оксид оредуктазой - от ~ 2 до 20нг на 50мкг белка Таблица VIII Экспрессия глифосат оксид оредуктазы в растениях табака Конструкция pMON17073 (манипулированная) Растение # 21270 21281 Вестерн оценка 0 0 50 PMON17066 (ХТПІ-синтетическая) pMON17065 (синтетическая) 21286 21929 21237 21830 21845 21872 21889 21891 21199 21208 21212 21217 21218 21792 21795 21811 1 1 1 0 3 3 1 0 0 2 2 0 2 1 0 2 Шкала Вестерн оценки на 50мкг белка 0 - не обнаружено глифосат оксид оредуктазы 1 - 2нг Ряд линий первичных трансформантов Ro, экспрессирующих манипулированную или синтетическую глифосат оксидоредуктазу или ХТПІсинтетическую глифосат оксид оредуктазу, были обработаны глифосатом в концентрации 0,4 фунтов/акр (0,448кг/га), после чего была выполнена оценка, как описано выше Таблица IX Данные обработки глифосфатом pMON17066 (ХТП1-глифосфат оксидоредуктаза) Табак (растения) Объем обра- Вегетативный приЛиния Вестерн ботки фунт/арк знак коноценка кг/га (дни после обратроль ботки) 7 14 28 А 0 0 0 не обнаружено В 0 1 0 глифосат С 0 1 1 оксидоредуктаза 22933 1 3 1 0 (pMON 17073) 22741 2 2 1 9 (pMON 17065) 22810 3 3 4 6 (pMON 17066) 22825 1 2 1 1 (pMON 17066) 22822 3 10 10 10 (pMON 17066) 22844 3 10 10 10 (pMON 17066) 22854 3 9 10 10 (pMON 17066) 22860 3 8 10 10 (pMON 17066) 22880 1 3 2 9 (pMON 17066) 22881 2 2 0 0 (pMON 17066) 22886 3 9 10 10 (pMON 17066) 22887 3 9 10 10 (pMON 17066) со со со 49 2,4-динитрофенил-гкдразин (2,4-ДНФГ) дериватизации и фазообращенной высоко эффективной жидкостной хроматографии (ВЭЖХ), используя модификацию метода Qureshi с соавт, (1982) Реакционные смеси с глифосат оксидоредуктазой (0,2мл) охлаждали с 0,25мл ДНФГ реактива (0,5мг/мл ДНФГ [Aidrich] в 0,5М HCI) и подвергали дериватизации в течение 5мин при 25°С После этого пробы экстрагировали этил ацетатом (2 х 0,3мл) и комбинированные этил ацетатные экстракты экстрагировали 10% ІЧагСОз (0,3мл) ІЧагСОз фазу затем однократно отмывали этил ацетатом (0,2мл) и ІЧагСОз фазу вводили (ЮОмкл) в Reckman Ubtrasphere C18 IP ВЭЖХ колонку (5мк, 4,6мм х 25см), используя LKS GT1 бинарную ВЭЖХ систему с Waters 990 фотодиодным UV/VIS ВЭЖХ детектором, с помощью Waters VIISP ВЭЖХ аутоинъектора Изократическая мобильная фаза представлена смесью метанол-вода-уксусная кислота (60 38,5 1,5) с 5мМ тетрабутиламмоний фосфата (Пирс) ДНФГ - глиоксилатный пик (время задержки = 6,7мин) обнаружен в пределах 365нм Выполнено сравнение этого пика со стандартом глиоксилата (Сигма, 20мкМ в 0,2мл), подвергнутым дериватизации точно таким же образом Шкала Вестерн оценки (на 50мкг белка) 0 = - не обнаружено глифосат оксидоредуктазы 1 = 2ng Вегетативный признак 0 = мертвые 10 = эффект не обнаружен Линия с синтетической глифосат оксидоредук 52 51 52574 тазой обнаруживает ответ, сходный с ответом, Таблица IX который наблюдали у растений Ri с оксидоредуктазой, характеризовавшихся некоторыми непосредственными эффектами глифосата, которые Активность глифосат оксид оредуктазы визолиросо времени исчезли в результате метаболизированных хлоропластах трансгенного табака вания гербецида глифосат оксидоредуктазой на производные АМРА и глиоксилат Поскольку миСпецифическая актившень глифосата (EPSP синтаза) локализуется в Субстрат ность хлоропласте, активность глифосат оксидоредук(нмоли/мин мг) тазы должна приводить к снижению уровня глиИминоацетоуксусная ки179 фосата в данной органелле в результате удалеслота ния гербицида прежде его попадания в Глифосат 92 хлоропласт Растения с ХТП1 -синтетической глифосат оксид оредуктазой обнаружили повышенную Пример 3 толерантность к глифосату, которая проявлялась Ряд трансформированных линий канолы пов том, что глифосат не оказывал на эти растения лучены с использованием векторов pMON17138 какого-либо эффекта при данной концентрации (ХТП1-синтетическая глифосат оксидоредуктаза) обработки Обычно, обработанные толерантные и pMON171648 (ХТП2-синтетическая глифосат растения характеризовались нормальным развиоксид оредуктаза) следующим образом тием, цветением и плодородием Материал растений ХТП1 -синтетической глифосат оксидоредукСеянцы Brassia napus iv Westar были высатазные растения показывали заметно более высожены в 2 дюймовые (~ 5см) горшки, содержащие кий уровень экспрессии глифосат оксидоредукMetro Mix 350 Растения росли в ростовой камере тазы по сравнению с другими глифосат при 24°С, 16/8 часовом фотопериоде, световой оксидоредуктазными конструкциями Этот повыинтенсивности 400uEm 2 сек 1 (НЮ лампы) Среда шенный уровень глифосат оксидоредуктазы мообогащалась, применяя Peters 20-10-20 Gtntral жет быть обусловлен увеличением трансляции Purpose Special Через 2 1/2 недели их пересажиконструкции, представленной слиянием, или вывали в 6 дюймовые (~ 15см) сосуды и оставляли делением фосфат оксид оредуктазы внутри хлорорасти в камере при 15/10°С день/ночь темперапласта, что, в свою очередь приводит к более туре, при 16/8 часовом фотопериоде, световой длительному периоду полувыведения белка Боинтенсивности 800uEm 2 сек 1 (НЮ лампы) Среда лее высокий уровень глифосат оксид оредуктазы обогащалась применением Peters 15-30-15 Hiphos и/или ее локализация в хлоропласте могут быть Special причиной более высоких уровней толерантности к Трансоормация/Отбор/Регенерация глифосату благодаря быстрому разрушению глиЧетыре терминальных междоузлия удалялись фосата в хлоропласте Наличие глифосат оксидоиз растений непосредственно перед выходом в редуктазы в пределах хлоропласта установлено стрелку или в ходе этого процесса, но обязаПять листьев от каждого из четырех растений тельно перед цветением, и поверхность их под(#22844, 22854, 22886, 22887), которые, по данвергалась стерилизации в 70% объем/объем этаным Вестерн анализа, оказались положительными ноле в течение 1мин , 2% вес/объем гипохлорита на глифосат оксидоредуктазу, подвергали гомогенатрия в течение 20мин , после чего они трижды низации в Waring смесителе в 0,9 LGR + буфер промывались стерильной деионизированной во(Bartlett с соавт ,1982) в течение 3 x 3 сек при выдой Стебли с листьями могут быть заморожены сокой скорости Гомогенат фильтровали через 4 во влажных пластиковых сумках вплоть до 72 час слоя Miracloth и центрифугировали при перед стерилизацией От 6 до 7 отрезков стебля 6000об/мин в GS-3 роторе Осадок ресуспензиробыли нарезаны на 5мм диски при помощи Redco вали в 4мл смеси GR + буфер и наслаивали на Vegetable Sheer 200, обеспечивающего ориента40/80% Percoll ступенчатый градиент, после чего цию базального конца центрифугировали при 9500об/мин В течение 10 мин Интактные хлоромасты (нижняя полоса) одAgrobactenum росли в течение ночи на ротанократно промывала GR - буфером Bartlett с соторе при 24°С в 2мл бульона Лурье, содержащим авт,1982) и центрифугировали при скорости до 50мг/л канамицина, 24мг/л хлорамфеникола и 6000об/мин без торможения Затем их подвер100мг/л спектиномицина Разведение 1 10 произгали ресуспензированию в ЗООмкл 50мМ мМ Heles водили в MS (Murashige и Skoog) среде, что, прирН 7,7, ЗЗОмМ Сорбитола и последующему лидимерно, составило 9 хЮ 8 клеток на мл Этот при рованию на льду при помощи ультразвука (малая тех же условиях, как в случае культуры растений проба, 30%-3 отстаивание в микропипетках Через три недели проводила оценку проб листьев хЮсек) После осаждения остатков супернатант с вновь образованными каллюсами на толерантпропускали через колонку с сефадексом G50 в ность к гербицидам (каллюс или ткань зеленых 50мМ Heles, рн 7,5 Концентрация растворенного листьев) или чувствительность к ним (отбеливабелка составляла 2,4мг/мл Тестирование ферние) мента проводили, как указано выше, используя как Трансплантация 50мМ ИАУК, так и 50мМ глифосат в качестве субВо время отрезания стебли с побегами поместратов (ЗОмин пробы), но без добавления 1мМ щались в Rootone® и затем в 2 дюймовую (~ 5см) кофактора Q сосуды, содержащие Metro-Mix 350 и наводящиеся в условиях влажности Растения помещались в ростовую камеру при 24°С, 16,8 часовом фотопе 53 52574 риоде, 400uEm 2 сек 1 (НЮ лампы) примерно на 3 недели с целью укоренения Семя, собранное от Ro растения, представляет собой Ri семя, дающее начало Ri растению Для оценки толерантности к глифосату Ro растения тестируется его потомство Поскольку считается, что Ro растение является гемизиготным в каждом положении вставки, самоопыление приводит к максимальной генотипической сегрегации в Ri Каждая вставка действует, как доминантный аллель, поэтому в отсутствии сцепления и предположении, что только одна гемизиготная вставка требуется для проявления толерантности, одна вставка будет сегрегировать как 3 1, две вставки как 15 1, три вставки как 63 1 В связи с этим, для обнаружения хотя бы одного резистентного фенотипа, необходимо выращивать соответственно несколько Ri растений Семена от Ro растений собирают, размельчают и высушивают перед посевом для теста опрыскивания глифосатом Были использованы различные методики выращивания растений для проведения исследований по оценке R-і, обработки Тестирование проводили как в теплицах, так и в ростовых камерах Использовали две системы посева, ~ 10см горшки или посевные лотки, содержащие 32 или 36 клеток Применяемая в данном случае почва представляла собой или Metro 350 с добавлением трех типов медленно освобождающегося удобрения, или установку Metro 350 В теплицах орошение производили сверху, а в ростовых камерах использовали субирригацию Удобрение вносили, сколько требуется, с водой для орошения Температурный режим соответствовал требованиям, установленным для канолы Использовали 16 часовой фотопериод В начале цветения растения переносили в ~ 15см горшки для образования семян Партия обработки состояла из нескольких наборов R-і, потомков, причем все они обрабатывались в одно и то же время В составе некоторых партий входили растения, отличные от Ri, оценку которых также надо было выполнить Кроме того, каждая партия включала как обработанные, так и необработанные, нетрансгенные генотипы, представляющие генотипы отдельной партии, которые, предположительно должны быть трансформированы Кроме того, в партию включают один или более несегрегирущих трансформированных генотипов, предварительно идентифицированные, как обладающие определенной рсзистентностыо От двух до шести растений из каждого отдельного Ro потомства не обрабатываются и служат в качестве контролей для сравнения и измерения толерантности к глифосату, а также для изучения каких-либо изменений, обусловленных не глифосатом, а другими факторами Когда остальные растения достигают стадии 2 - 4 листа, что обычно наблюдается через 1 0 - 2 0 дней после посева, производится обработка глифосатом в концентрациях, варьирующих от 0,28 до 1,12кг/га, в зависимости от объекта исследования Была разработана технология низких доз, характери 54 зующаяся малыми объемами гербицида При лабораторных исследованиях дозы опрыскивания колибруются таким образом, чтобы получить концентрации, эквивалентные таковым в полевых условиях Для оценки обработанных растений на вегетативную резистентность используется шкала от 0 до 10 Шкала относится и к необработанным растениям от одного и того же Ro растения 0 - означает гибель растения, в то время как 10 является показателем отсутствия каких либо видимых отличий от необработанного растения Числа между 0 и 10 отражают постепенное снижение степени поражения растений при сравнении с вообще необработанными особями Оценка растении производится на 7, 14 и 28 дни после обработки (ДПО), или в период выхода стрелки, причем линия характеризуется средней оценкой обработанных растений в пределах семейства растений Ro Шесть целых чисел используются для качественного описания репродуктивных нарушений, обусловленных глифосатом, 0 отсутствие развития цветочной почки 2 цветочные почки имеются, однако останавливаются в развитии перед раскрытием, 4 цветы раскрыты, но без пыльников, или же пыльники не способны вытянуться за пределы лепестков 6 стерильные пыльники 8 частичная стерильность пыльников 10 полная фертильность цветков Оценка растений с использованием данной шкалы проводится вначале или вскоре после начала цветения, в зависимости от скорости развития структуры цветка Таблица X Оценка обработки глифосатом растений канолы, содержащих pMON17138 Название 17138-22 17138-30 17138-145 17138-158 17138-164 Нетрансформированные Партия 79 79 79 79 80 77 79 Оценке 0,56 кг/га 14 ДПО 28 ДПО Зегетативная Непродуктивная 9 10 9 10 10 10 8 10 8 10 3 0 1 0 Таблицы X и XI представляют оценки вегетативных и репродуктивных характеристик для растений канолы, трансформированных с применением, соответственно, pMON17138 (обработаны в концентрации 0,56кг/га) и pMON17164 (обработаны в концентрации 0,84кг/га) Приведенные результаты показывают, что растения канолы приобретают толерантность к глифосату в результате экспрессии в растениях гена глифосат оксидоредуктазы 55 52574 Таблица XI Оценка обработки глифосатом растений канолы, содержащих pMON17164 Конструкция Партия 17164-6 17164-9 17164-20 17164-25 17164-35 17164-45 17164-61 17164-75 17164-85 17164-97 17164-98 17164-105 17164-110 17164-115 17164-129 17164-139 17164-140 17164-164 17164-166 17164-175 17164-186 17164-202 17164-218 17164-219 17164-222 17164-225 17164-227 17164-230 17164-243 17164-247 17164-287 17164-289 17164-300 17164-337 82 83 82 83 84 83 83 84 84 84 83 83 83 83 83 84 83 83 83 83 83 83 84 83 84 83 84 83 83 84 84 83 83 83 Оценке 0,34 кг/га 14ДПО 28ДПО Зегетативная Непродуктивная 7 10 8 10 7 10 8 10 7 10 9 10 7 10 7 10 7 10 6 10 9 10 7 10 9 10 7 10 8 10 7 10 8 10 7 10 8 10 8 10 3 10 8 10 6 10 9 10 7 10 7 10 7 10 8 10 7 10 7 10 7 10 8 10 9 10 8 10 Пример 4 Ген глифосат оксидоредуктазы также вводили в растения сои обыкновенной, где он экспрессировался, в результате чего эти растения приобретали толерантность к глифосату Ген слияния ХТП2-сннтетической глифосат оксилореруктазы /описанный выше/ вводили в растения сои обыкновенной в условиях FMV промотора и с NOS 3' последовательностями в векторе pMON 17159, карта которого представлена на фиг 10 Кроме последовательностей глифосат оксилоредуктазного гена данный вектор включает следующие элементы pUC ориджин репликации, NPT11 бактериальный селективный маркерный ген /канамицина/ и ген бета-глюк-уронидазы /GUS, Jefferson с соавт,1986/ под контролем E35S промотора и с Е9 3' последовательностями Последний ген обеспечивает маркер оценки для облегчения идентификации трансформированного материала растений Трансформация растений сои обыкновенной выполняется с использованием pMON 17159 по 56 средством метода микропроектирующих инъекции с применением технологии нацеленного бомбардирования частицами, описанной Chnston с соавт,/1988/ Семена, собранные от Ro растений обозначаются как Ri семенами, которые дают начало Ri растениям Для оценки толерантности к глифосату Ro растения, оценивается потомство этих растений Поскольку Ro растение считается гемизиготным в кахлом положении вставки, то самоопыление приводит к максимальной генотипической сегрегации в Ri Так как каждая вставка функционирует как доминантный аллель, то в отсутствии сцепления и предположении, что только одна гемизиготная вставка необходима для экспрессии толерантности, одна вставка будет сегрегировать как 3 1, две вставки как 15 1, три вставки как 63 1 и т д Поэтому для обнаружения хотя бы одного резистентного фенотипа, необходимо выращивать соответственно несколько Ri растений Семена от Ro растений сои обыкновенной собирают и высушивают перед посевом для теста обработки глифосатом Семена высаживают в 4 дюймовые /~ 5см/ квадратные горшки, содержащие Metro 350 Для тестирования считается достаточным количество в 20 саженцев от каждого Ro растения Растения содержатся и развиваются в условиях, характерных для теплицы Обычно поддерживаются 12,5 - 14 часовой фотопериод и температура 30°С днем и 24°С ночью При необходимости, среда обогащается Peters Pete Lite удобрением, растворимым в воде Партия обработки включает несколько наборов Ri потомков, которые опрыскиваются в одно и то же время Некоторые партии могут также включать отличные от Ri растения с целью их оценки В каждой партии также имеются обработанные и необработанные нетрансгенные генотипы, представляющие генотипы отдельной партии, которые предположительно являются трансформированными Кроме того, партия содержит один или более несегрегирующих, трансформированных генотипов, предварительно идентифицированных, как обладающие определенной резистентностью Одно или два растения от каждого отдельного Ro потомка не обрабатываются и служат в качестве контроля для сравнения и характеристики толерантности к глифосату, а также для исследования какой-либо изменчивости, обусловленной не глифосатом, а иными факторами Когда остальные растения достигают первой трехлистной стадии, что обычно наблюдается через 2 - 3 недели после посадки, производится обработка глифосатом в концентрации 128 унций на акр /8,895 кг/га/ Roundup® При лабораторных исследованиях дозы обработки калибруются таким образом, чтобы получить концентрации, эквивалентные таковым в полевых условиях Использованы вегетативные оценки от 0 до 10 Оценка относится и к необработанным потомкам от одного и того же растения 0 - означает гибель растения, в то время как 10 - отсутствие явных отличий от необработанного растения Числа между 0 и 10 отражают постепенное снижение степени поражения растений при сравнении с 57 52574 необработанными особями Оценка растений производится на 7, 14 и 28 дни после обработки /ДПО/ Таблица XII Оценка обработки глифосатом растений сои обыкновенной, содержащих pMON17159 Линия Партия 1715917159171591715917159171591715917159Необработанные 14 14 14 14 14 14 14 15 14 Оценка 8,895кг/га 28ДПЩ 9 9 6 4 4 10 9 4 0 Пример 5 Ген глифосат оксидоредуктазы также вводили в клетки зерен пшеницы Black Mexican Sweet/BMS / с экспрессией белка, определяемого в каллюсе Пплазмида pMON 19632 была использована для введения гена глифосат оксидоредуктазы в клетки зерен Основа этой плазмиды образована путем встраивания 35S промотора РНК /E35S/ 0,6кб вируса мозаики цветной капусты /CaMV/, содержащего дупликацию -90 и -300 области /Кау с соавт ,1987/, 0,58кб фрагмента, содержащего первый интрон гена алкоголь дегидро-геназы /Calhs с соавт , 1987/, 3' терминальных последовательностей из гена копалин синтазы /NOS/ Fralty с соавт, 1933/ в pUC119 /Yamsek - Perron с соавт,1985/ pMON 19632 была образована путем встраивания 1,7кб Bgl II/ EcoRI фрагмента из pMON 17064, содержит Arabidopsis 9SU ХТП в соединении с последовательностью, кодирующей синтетическую глифосат оксидоредуктазу /ПОС Ю №8/ Плазмиду pMON 19632 вводили в BMS клетки зерен путем метода совместной бомбардировки с ЕС9, плазмидой, содержащей устойчивую к сульфонил мочевине форму гена ацетолактат синтазы кукурузы 2,5мкг каждой плазмиды были наслоены на вольфрамовые частицы и введены в BMS Клетки в логарифмической фазе, используя метод бомбардировки PDS-1000 частиц, описанный в своей основе у Klein с соавт , 1939 Трансформанты селектировали на MS среде, содержащей 20 частей на миллиард хлорсульфорона После первичного отбора на хлорсульфорон, каллюсы были исследованы посредством Вестерн блот глифосат оксидоредуктазы ВМ5 каллюс /Зг влажного веса/ высушивали на бумажном фильтре /Ватман # 1/ под вакуумом, вновь взвешивали и добавляли экстрагирующий буфер /500 мкл/г сухого веса, ЮОмМ трис, 1мМ ЭДТК, 10% глицерина/ Ткань гомогенизировали с помощью Wheaton подвесной мешалки в течение ЗОсек при 2,8 мощности установки После центрифугирования /Змин, Eppenlorf/, супернатант удаляли и подсчитывали количество белка /Вю Rad проба на белок/ Пробы наносили 58 (50мкг/лунка) на ДСН ПААГ (Julc, 3 - 17%) вместе со стандартом глифосат оксидоредуктазы (Юнг), подвергали электрофорезу, и затем переносили на нитроцеллюлозу, подобно ранее описанному метолу (Padgette, 1987) Нитроцеллилозный блот исследовали с применением козлиного антиглифосат окси-доредуктазного иммуноглобулина (IgG) и обрабатывали 1-125 Белком G Блот с радиоактивной меткой просматривали путем авторадиографии Результаты подсчитывали, используя метод денситометрии с применением ЛКБ УльтраСкан XL лазерного денситометра, и представляли в виде таблицы XIII Таблица XIII Оценка обработки глифосатом растений сои обыкновенной, содержащих pMON17159 Линия ЕС9 (без GOX) Т13-17 Т13-16 Т13-15 Т13-14 Т13-14 Т13-12 Т13-7 Т13-5 Т13-18 Т13-8 Т13-9 Т13-4 GOX экспрессия (% экстрагируемого белка) 0 0,016 0,0065 0,016 0,003 0,003 0,0079 0,01 0,004 0,026 0,019 0,01 0,027 Из Таблицы XIII видно, что глифосат оксидоредуктаза может экспрессироваться и, следовательно, ее можно обнаружить в однодольных растениях, таких как пшеница Пример 6 Ген глифосат оксидоредуктазы можно использовать в качестве селективного маркера трансформации растений непосредственно на среде, содержащей глифосат Возможность селекции и идентификации трансформированного растительного материала зависит, в большинстве случаев, от использования доминантного селективного маркерного гена для обеспечения возможности предпочтительного и непрерывного роста трансформированных тканей в присутствии ингибирущего в норме вещества Гены, ответственные за резистентность к антибиотикам и толерантность к гербицидам были использованы почти исключительно, как доминантные, селективные маркерные гены в присутствии соответствующего антибиотика или гербицида Наиболее часто, очевидно, используется схема отбора на npt 11/канамицин Было показано, что также пригодна глифосат оксид орел уктаза, которая может быть превосходным селективным маркером в схеме отбора для получения и идентификации трансформированных растений В данной схеме используется в качестве вектора трансформации растений Pmoni 7226 (фиг 11) Эта плазмида напоминает многие другие описанные плазмиды и, в основном, включает 6 0 59 52574 предварительно описанную систему репликации тельными на белок глифосат оксидоредуктазы, бактерий, которая обеспечивает репликацию этой обнаруженный путем иммуноблот аназиза Соплазмиды в Ecoli, а также ее введение и репликагласно этим данным степень трансформации социю в Agrobacterium, бактериальный селективный ставляла 15 - 19 на 100 эксплантатов, что свидемаркерный ген (Spc/Str), и XTIH глифосат оксидотельствует о высокой эффективности и экономии редуктазный синтетический ген в FMV промоторвремени благодаря процедуре трансформации Е9 3' кассете, локализованный между Т-ДНК прадля растения Сходные степени трансформации вого края и левым краем Эта плазмида также были получены при использовании pMON17226 обладает отдельными сайтами для ряда ферменпроизводного (рМОп17241), содержащего ген тов рестрикции, локализованными внутри границ глифосат оксидоредуктазы в 247 (ПОС Ю №17) или вне кассеты экспрессии Это позволяет легко Как было показано, ген глифосат оксидоредуктазы добавлять другие гены или генетические элеменобеспечивает прямой отбор трансформантов в ты к вектору, который вводится в растение других видах растений, включая Agrobacterium, картофель, сахарную свеклу Представлен протокол прямого отбора трансформированных растений табака на глифосате Из всего выше сказанного видно, что изобреДля прекультивирования растения готовили сотение позволяет осуществить все цели и задачи, о гласно стандартной методике, описанной в Прикоторых упоминалось ранее, что свидетельствует мере 1 стерилизация поверхности листьев от о преимуществах и ценности данной работы растений табака в возрасте 1 месяца (15мин в Понятно, что необязательно использовать все 10% хлороксе + поверхностно-активное вещество, комбинации и характеристики, иди же применять 3XdH2O смывы), растения нарезались на квадраих безотносительно к другим свойствам изобрететы 0,5 х 0,5см, с удалением краев листьев, средния, однако при всех изменениях необходимо учиних жилок, верхушки и концов черешка для полутывать набор требований к использованию изочения однородной ткани, эксплантаты размещали бретения в один слой, кверху дном на MS 104 чашках + 2мл При учете требований к изобретению возмож4С005К среды для увлажнения поверхности, пены, однако, различные варианты его применения, риод прекультивирования составлял 1 - 2 дня причем необходимо помнить, что приведенные Эксплантаты заражали, используя ночную культуздесь ранее и далее схемы и рисунки надо расцеру Agrobacterium, содержащую плазмиду транснивать только как иллюстративный, а вовсе не формации растения, причем титр доводится до ограничивающий материал 1,2x10 бактерий/мл 4С005К среды Эксплантаты мтосмзс МТСЯЙМТ еяятолтс лхаиимис «АИОШЯС леттттса Ю помещали в центрифужную пробирку, куда также мттссимс ОССЛАЛЛСС* лохлмллст ссемсеїєх ллоетттвтя лвоххвхт по добавляется суспензия Agrobacterium и смесь баксіслоісал леестсілел *«да*мвт лехомтстс смлсслттх ссслшост jao терий и эксплантатов подвергается максимальножсхоохвхтс м т с ы е м т сттслхтсхл к т а м с и е юттсслнс* CKSCATCAT J4O му смешиванию, с использованием "Vortex" в теGuTCMTAAO ТТТСМУЛАХ XSXCMCCXG CGWCXCTTX AAOTIACtOO ОСЛТСТТТОА 200 чение 25 сек для полной гарантии проникновения мютздтстт атсхАсиси мслпстсос ГМККВОІС слсхсААЛлл *са*лтаста на бактерий Бактерии сливались, и эксплантаты размещали между слоями сухой стерильной схахАТТатт хйососхжт хасылмс* тсетчч-сси -ТАГМСДА** опмлоем *зо ЛТТСОЇОТХв ІЛСЛАОТСФЗ CUOViMTA АОЗЇСЗМЛА йМСМТССТ ЙИСАОСССАС 4S3 фильтровальной бумаги для удаления избытка бактерии После промокания эксплантаты помещали вверх дном в MS 104 чашки + 2мл 4С005К * с о с * м « * ИСССЛГЇМ моє 56* среды + фильтровальный диск Сокультивирова(2) Информация о ПОС Ю № 2 ние продолжалось 2 - 3 дня Эксплантаты перено(і) Характеристика последовательности сили в MS 104 + Карбенициллин 1000мг/л + цефо(A) Длина 27нп таксим 100мг/л на 3 дня(фаза задержки) Затем (B) Тип нуклеотидная эксплантаты переносили в MS104 + глифосат (C) Структура двухцепочная 0,05мМ + Карбенициллин 1000мг/л + цефотаксим (D) Топология линейная 100мг/л для фазы отбора На 4 - 6 недели побеги (м) Тип молекулы ДНК (геномная) отделяли от каллюса и помещали в MSO + Карбе(хі) Описание последовательности ПОС Ю нициллин 500мг/л корневую среду На 3-5 дни об№2 разовывались корни, причем в это время из корневых чашек можно брать кусочки листьев для (2) Информация о ПОС Ю № 3 подтверждения толерантеости к глифосату, а так(і) Характеристика последовательности же трансформации материала (A) Длина 1689нп (B) Тип нуклеотидная Присутствие белка глифосат оксидоредуктазы (C) Структура двухцепочная в этих трансформированных тканях подтвержда(D) Топология линейная лось иммуноблот анализом листовых дисков Да(м) Молекулный типДНК (геномная) лее представлены данные одного эксперимента с (хі) Описание последовательности ПОС Ю pMON17226 25 побегов, образованных на глифосате от 100 эксплантатов, заражали Agrobacterium №3 КСАТОСХООТ СІС*ІЄЄ*М КВЇОИТЛС MCJBJCAASG ТЛМОСЛСОС CGAJLTTTTM 60 AB1/pMON17226, 15 из них оказались положиеасстлссос: GJUUCGGTGG мкимаоео МЗМАСЙЗТС оостсвдам ЄАОСАТЄСМ «о ССХСЫШМ вТРДОСМСО СТССКбССОв ЛАЮТТОЗОв ВІАМСАСОО Івй тельными в отношении повторного образования каллюса на глифосате, и 19 из них были положи
ДивитисяДодаткова інформація
Назва патенту англійськоюMolecule of separated two-chain dna including the dna sequence coding the enzyme glyphosate oxidoreductase (versions), method for obtaining genetically transformed plants, insulated peptide (versions), bacterial strain, culture of plant cell (versions)
Автори англійськоюBerry Gerard Francis
Назва патенту російськоюМолекула выделенной двухцепочечной днк, которая включает днк последовательность, которая кодирует фермент глифосат оксидоредуктазу (варианты), способ получения генетически трансформированных растений, изолированный пептид (варианты), штамм бактерий, культура растительной клетки (варианты)
Автори російськоюБерри Джерард Фрэнсис
МПК / Мітки
МПК: C12N 15/82, C12N 15/00, C12N 15/53, C12N 1/21, C12N 9/02, C12N 5/10, A01H 5/00, C12N 9/06, C12N 15/09
Мітки: дволанцюгової, трансформованих, спосіб, виділеної, послідовність, включає, рослин, кодує, гліфосат, фермент, пептид, молекула, штам, генетично, днк, одерження, оксидоредуктазу, ізольований, яка, варіанти
Код посилання
<a href="https://ua.patents.su/47-52574-molekula-vidileno-dvolancyugovo-dnk-shho-vklyuchaeh-dnk-poslidovnist-yaka-kodueh-ferment-glifosat-oksidoreduktazu-varianti-sposib-oderzhennya-genetichno-transformovanikh-roslin-izo.html" target="_blank" rel="follow" title="База патентів України">Молекула виділеної дволанцюгової днк, що включає днк послідовність, яка кодує фермент гліфосат оксидоредуктазу (варіанти), спосіб одерження генетично трансформованих рослин, ізольований пептид (варіанти), штам</a>
Попередній патент: Шихта для виробництва безвипалювальних вогнетривів
Випадковий патент: Напівфабрикат делікатесний маринований "гетьманський"