Оксазолідин-2-он-піримідинові похідні
Номер патенту: 114001
Опубліковано: 10.04.2017
Автори: Фейрхерст Робін Алек, Калтхофф Франк Стефан, Фуре Паскаль, Рюегер Генріх, Лерхнер Андреас
Формула / Реферат
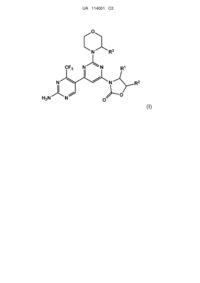
1. Сполука формули (І) та/або її фармацевтично прийнятна сіль та/або сольват
 , (І)
, (І)
де
R1 являє собою метил, етил або гідроксиметил;
R2 являє собою феніл, який є незаміщеним або заміщеним у мета- та/або пара-положеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, C1-C5-алкокси, гідроксі-С2-С4-алкокси або С1-С2-алкоксі-С2-С4-алкокси для пара-положення,
або
піридил, який є незаміщеним або заміщеним у мета- та/або пара-положеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, C1-C5-алкокси, гідроксі-С2-С4-алкокси або С1-С2-алкоксі-С2-С4-алкокси для пара-положення,
або
5-членний моноциклічний гетероарил, який містить 2-3 гетероатоми, вибрані з N, О або S, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F;
та
R3 являє собою Н або метил.
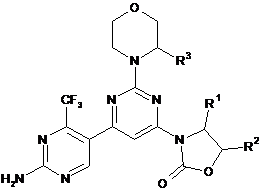
2. Сполука за п. 1 формули (Іb)
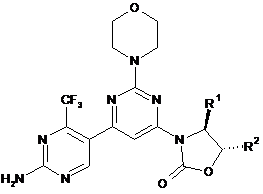 (Іb).
(Іb).
3. Сполука за п.1 або 2, де
R2 являє собою феніл, який є незаміщеним або заміщеним у мета- та/або пара-положеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, C1-C5-алкокси, гідроксі-С2-С4-алкокси або С1-С2-алкоксі-С2-С4-алкокси для пара-положення.
4. Сполука за п. 1 або 2, де
R2 являє собою піридил, який є незаміщеним або заміщеним у мета- та/або пара-положеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, C1-C5-алкокси, гідроксі-С2-С4-алкокси або С1-С2-алкоксі-С2-С4-алкокси для пара-положення.
5. Сполука за п. 1 або п. 2, де
R2 являє собою 5-членний моноциклічний гетероарил, який містить 2-3 гетероатоми, вибрані з N, О або S, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F.
6. Сполука за будь-яким з пп. 1-5, де R1 являє собою метил.
7. Сполука за будь-яким з пп. 1-5, де R1 являє собою етил.
8. Сполука за будь-яким з пп. 1-5, де R1 являє собою гідроксиметил.
9. Сполука або її фармацевтично прийнятна сіль за п. 1, вибрана з (4S,5R)-3-(2'-aмiнo-2-мopфoлiн-4-iл-4'-тpифтopмeтил-[4,5']бiпipимiдинiл-6-iл)-4-метил-5-тіазол-2-ілоксазолідин-2-ону,
(4S*,5S*)-3-(2'-аміно-2-морфоліно-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-етил-5-(4-метоксифеніл)оксазолідин-2-ону,
(4S,5S)-3-(2'-аміно-2-морфоліно-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-(гідроксиметил)-5-(4-метоксифеніл)оксазолідин-2-ону,
(4S*,5R*)-3-(2'-aмiнo-2-мopфoлiнo-4'-(тpифтopмeтил)-[4,5'-бiпipимiдин]-6-iл)-4-етил-5-фенілоксазолідин-2-ону,
(4S,5S)-3-(2'-аміно-2-морфоліно-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-метил-5-фенілоксазолідин-2-ону,
(4R*,5R*)-3-(2'-aмiнo-2-мopфoлiнo-4'-(тpифтopмeтил)-[4,5'-бiпipимiдин]-6-iл)-4-етил-5-(3-метоксифеніл)оксазолідин-2-ону,
(4S,5R)-3-(2'-аміно-2-морфоліно-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-етил-5-(тіазол-2-іл)оксазолідин-2-ону,
3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-етил-5-піридин-3-ілоксазолідин-2-ону,
3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-метил-5-піридин-3-ілоксазолідин-2-ону,
(4S,5S)-3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-гідроксиметил-5-фенілоксазолідин-2-ону,
(4S,5S)-3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-метил-5-тіазол-2-ілоксазолідин-2-ону,
(4S,5S)-3-(2'-аміно-2-морфоліно-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-(гідроксиметил)-5-(4-(2-метоксіетокси)феніл)оксазолідин-2-ону,
(4S,5S)-3-(2'-аміно-2-морфоліно-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-5-(4-(2-гідроксіетокси)феніл)-4-(гідроксиметил)оксазолідин-2-ону або
(4S,5S)-3-(2'-аміно-2-морфоліно-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-(гідроксиметил)-5-(4-(3-гідроксипропокси)феніл)оксазолідин-2-ону.
10. Сполука або її фармацевтично прийнятна сіль за п. 1, яка являє собою (4S,5R)-3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-метил-5-тіазол-2-ілоксазолідин-2-он.
11. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-10 або її фармацевтично прийнятної солі та один або більше фармацевтично прийнятних носіїв.
12. Комбінація, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-10 або її фармацевтично прийнятної солі та один або більше терапевтично активних ко-агентів.
13. Спосіб лікування суб'єкта, що включає введення суб'єкту терапевтично ефективної кількості сполуки або її фармацевтично прийнятної солі за будь-яким з пп. 1-10.
14. Сполука за будь-яким з пп. 1-10 або її фармацевтично прийнятна сіль для застосування як лікарського засобу.
15. Сполука за будь-яким з пп. 1-10 або її фармацевтично прийнятна сіль для застосування у лікуванні немеланомного раку шкіри, передракових стадій немеланомного раку шкіри або інших гіперпроліферативних захворювань шкіри, викликаних порушеною регуляцією фібробластів шкіри.
16. Сполука для застосування за п. 15, де немеланомний рак шкіри являє собою плоскоклітинний рак, передракова стадія немеланомного раку шкіри являє собою актинічний кератоз та гіперпроліферативне захворювання шкіри, викликане порушеною регуляцією фібробластів шкіри, являє собою келоїди.
17. Застосування сполуки за будь-яким з пп. 1-10 або її фармацевтично прийнятної солі у одержанні лікарського засобу для лікування немеланомного раку шкіри, передракових стадій немеланомного раку шкіри або інших гіперпроліферативних захворювань шкіри, викликаних порушеною регуляцією фібробластів шкіри.
18. Застосування сполуки у одержанні лікарського засобу за п. 17, де немеланомний рак шкіри являє собою плоскоклітинний рак, передракова стадія немеланомного раку шкіри являє собою актинічний кератоз та гіперпроліферативне захворювання шкіри, викликане порушеною регуляцією фібробластів шкіри, являє собою келоїди.
Текст
Реферат: Даний винахід стосується оксазолідин-2-онових заміщених піримідинових сполук, які діють як інгібітори РІ3К (фосфатидилінозитол-3-кінази), а також їх фармацевтичних композицій, способів їх одержання та застосування у лікуванні станів, захворювань та розладів, що залежать від РІ3К. UA 114001 C2 (12) UA 114001 C2 UA 114001 C2 5 10 15 20 25 30 35 40 45 50 Галузь техніки, до якої відноситься даний винахід Даний винахід відноситься до оксазолідин-2-онових заміщених піримідинових сполук, які діють як інгібітори PI3K (фосфатидилінозитол-3-кінази), а також їх фармацевтичних композицій, способів їх одержання та застосування у лікуванні станів, захворювань та розладів, що залежать від PI3 кіназ. Рівень техніки даного винаходу Суперсімейство фосфатидилінозитол-3-кіназ включає 4 різних споріднених PI3K ліпідних кінази або протеїнкінази. Класи I, II та III являють собою ліпідні кінази, які відрізняються за їх субстратною специфічністю, тоді як PI3K класу IV, що також називають спорідненими з PI3кіназою протеїнкіназами (PIKK), являють собою протеїнкінази. PI3K класу I включають сімейство ліпідних кіназ, які каталізують перенос фосфату у D-3'-положення інозитолліпідів, даючи фосфоінозитол-3-фосфат (PIP), фосфоінозитол-3,4-дифосфат (PIP2) та фосфоінозитол-3,4,5трифосфат (PIP3), які, у свою чергу, діють як вторинні месенджери у сигнальних каскадах стиковкою з білками, що містять плекстринову гомологію, FYVE, Phox та інші зв'язуючі фосфоліпіди домени, у ряді сигнальних комплексів, часто у плазматичній мембрані (Vanhaesebroeck et al., Annu. Rev. Biochem 70:535 (2001)). Порушена регуляція PI3K, яка часто покращує виживаність та проліферацію за рахунок активації AKT кінази, являє собою одну з найбільш розповсюджених подій при раку людини та показано, що вона виникає на множині рівнів (Liu et al., Nat Rev Drug Discov 8:627-644 (2009)). Наприклад, соматичні місенс-мутації у PIK3CA, які активують наступні сигнальні шляхи, описані при значних частотах для широкого різноманіття ракових захворювань людини (Huang et al., Science 318: 1744-1748 (2007), Zhao & Vogt, Oncogene 27:5486-5496 (2008)). Ген-супресор пухлинного росту PTEN, який дефосфорилює фосфоінозитиди у 3'-положенні інозитольного кільця та, таким чином, викликає антагонізм активності PI3K, функціонально мутований або делетований при ряді пухлин (Keniry & Parsons, Oncogene 27:5477-5485 (2008)). Деякі дослідження показують, що нездатність експресувати PTEN може сприяти зсуву сигнальної залежності з PI3Kα до β-ізоформи (Wee et al, Porc Natl Acad Sci USA 105:13057-13062 (2008)). Отже, інгібування і PI3Kα і β-ізоформ I класу може бути особливо корисним при ракових захворюваннях, які позбавлені PTEN фосфатази. Опублікована міжнародна патентна заявка WO2007/084786 описує заміщені піримідинові молекули, які інгібують PI3K. Точно встановлено, що активація Akt приводить у результаті до стимуляції кіназної активності мішені рапаміцину у клітинах (mTOR). mTOR являє собою протеїнкіназу та член PI3K IV класу. У клітинах ссавців, mTOR виявляють у двох відмінних білкових комплексах, що називаються mTORC1 та mTORC2. Активація mTORC1 залежить від активних PI3K та Akt кіназ. Регуляція mTORC2 активації є більш складною. mTORC2 відповідає за посилення кіназної активності Akt за рахунок фосфорилювання серінового залишку 473 (Sarbassov et al., Science 307:1098-1101 (2005), Bayascas & Alessi, Mol Cell 18(2):143-145 (2005)). Каталітичне інгібування ізоформ PI3K I класу, одночасно з інгібуванням mTOR може, отже, давати додаткову користь, потенційно роблячи більш сильний ефект на PI3K-Akt шлях. Плоскоклітинний рак шкіри (SCC) являє собою другий найбільш частий тип раку шкіри людини, якому звичайно передує актинічний кератоз (AK). Патогенез AK та шкірного SCC пов'язаний з постійним впливом УФ як одного з основних факторів ризику (Salasche, J Am Acad Dermatol 42: 4-7 (2000)). Підвищену активність PI3K/Akt/mTOR шляху розглядали у попередньому дослідженні (Chen et al., Br J Dermatol; 160 (2):442-445 (2009)). Було показано, що тривале опромінення УФ-B викликає зниження PTEN експресії на рівні мРНК та білку у кератиноцитах людини in vitro, сприяючи їх виживаності та росту (Ming et al., Oncogene; 29(4):492-502 (2010)). На основі нещодавньої літератури, є причинний зв'язок між постійним УФопроміненням та зниженням PTEN (Darido et al., Cancer Cell; 20(5):635-648 (2011)). Отже, всі шкірні SCC та AK та постійні ушкодження шкіри, викликані сонячними променями, пов'язані з недостатністю PTEN експресії, приводячи у результаті до активації PI3K/Akt/mTOR сигнального шляху. Суть винаходу Даний винахід відноситься до оксазолідин-2-онових заміщених піримідинових сполук формули (I), та/або їх фармацевтично прийнятних солей та/або сольватів, 1 UA 114001 C2 5 10 15 20 25 30 35 40 45 де 1 R являє собою метил, етил або гідроксиметил; 2 R являє собою феніл, який є незаміщеним або заміщеним у мета- та/або пара-положеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для параположення, або піридил, який є незаміщеним або заміщеним у мета- та/або пара-положеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для пара-положення, або 5-членний моноциклічний гетероарил, який містить 2-3 гетероатоми, вибрані з N, O або S, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F; або 3 R являє собою H або метил. Якщо не зазначено інше, термін "сполуки даного винаходу" відноситься до сполук формули (I) та їх підформул, солей сполуки, гідратів або сольватів сполук та/або солей, а також всіх стереоізомерів (включаючи діастереоізомери та енантіомери), таутомерів та ізотопно-мічених сполук (які містять дейтерієві заміщення). Крім того, сполуки даного винаходу включають поліморфи сполук формули (I) (або її підформул) та їх солі. При згадуванні сполук формули (I) мається на увазі, що вона включає також таутомери та N-оксиди сполук формули (I). Сполуки формули (I) вважають підходящими для застосування у лікуванні захворювань, що залежать від PI3 кіназ. Сполуки формули (I) вважають підходящими, наприклад, для застосування у лікуванні захворювань, що залежать від PI3 кінази I класу або що залежать від PI3 кінази I класу та mTOR. Детальний опис даного винаходу Даний винахід можна більш повно зрозуміти, посилаючись на наступний опис, включаючи наступний словник термінів та заключні приклади. Як застосовують у даному винаході, терміни "що включає", "що містить" та "що складається з" застосовують у даному винаході у їх відкритому, необмежуючому сенсі. Загальні терміни, застосовувані у даному винаході вище та нижче, переважно мають, у контексті даного опису, наступні значення, якщо не зазначено інше: Як застосовують у даному винаході, термін "алкокси" відноситься до повністю насиченої розгалуженої, що містить одне або декілька відгалужень, або нерозгалуженої вуглеводневої групи, приєднаної до залишку молекули через -O- лінкерну групу. Якщо не зазначено інше, алкокси відноситься до груп, що містять 1-16 атомів вуглецю, 1-10 атомів вуглецю, 1-7 атомів вуглецю або 1-4 атоми вуглецю. Приклади алкокси включають, але не обмежуються, метокси, етокси, н-пропокси, ізопропокси, н-бутокси, втор-бутокси, ізобутокси, трет-бутокси, н-пентокси, ізопентокси, неопентокси, н-гексилокси. Як застосовують у даному винаході, термін "піридил" відноситься до 2-піридилу, 3-піридилу або 4-піридилу. Замісники у мета- та пара-положенні приєднані до атому вуглецю піридилу. Репрезентативний приклад являє собою 3-піридил. Як застосовують у даному винаході, замісники у 5-членному моноциклічному гетероарилі, що містить 2-3 гетероатоми, вибрані з N, O або S, приєднані до атому вуглецю гетероарилу. Приклади 5-членного моноциклічного гетероарилу, що містить 2-3 гетероатоми, вибрані з N, O 2 UA 114001 C2 5 10 15 20 25 30 або S, включають, але не обмежуються, тіазоліл, оксазоліл, 1,2,4-оксадіазоліл, 1,3,4оксадіазоліл та 1,3,4-тіадіазоліл. Репрезентативний приклад являє собою тіазоліл. Різні варіанти здійснення даного винаходу описані у даному винаході. Зрозуміло, що ознаки, зазначені у кожному варіанті здійснення, можна комбінувати з іншими зазначеними ознаками, отримуючи додаткові варіанти здійснення даного винаходу. У одному варіанті здійснення даний винахід відноситься до сполуки формули (I), та/або її фармацевтично прийнятної солі та/або сольвату, вибраної зі сполуки формули (Ia) де 1 2 R та R приймають такі ж значення як визначено для сполуки формули (I) вище. У одному варіанті здійснення даний винахід відноситься до сполуки формули (I), та/або її фармацевтично прийнятної солі та/або сольвату, вибраної зі сполуки формули (Ib) де 1 2 R та R такі ж як визначено для сполуки формули (I) вище. У одному варіанті здійснення даний винахід відноситься до сполуки формул (I), (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 2 R являє собою феніл, який є незаміщеним або заміщеним у мета- та/або пара-положеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для параположення. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (I), (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 2 R являє собою піридил, який є незаміщеним або заміщеним у мета- та/або параположеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для пара-положення. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (I), (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 2 R являє собою 5-членний моноциклічний гетероарил, який містить 2-3 гетероатоми, вибрані з N, O або S, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F. У одному варіанті здійснення даний винахід відноситься до сполуки формул (I), (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 3 UA 114001 C2 2 5 10 15 20 25 30 35 40 45 50 55 R являє собою феніл, 3-метоксифеніл, 4-метоксифеніл, 4-(3-гідроксипропокси)феніл, 4-(2гідроксиетокси)феніл або 4-(2-метоксиетокси)феніл. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (I), (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 2 R являє собою 3-піридил, який є незаміщеним або заміщеним у мета- та/або параположеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для пара-положення. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (I), (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 2 R являє собою 3-піридил. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (I), (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 2 R являє собою тіазоліл, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (I), (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 2 R являє собою 2-тіазоліл, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (I), (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 2 R являє собою 2-тіазоліл. У одному варіанті здійснення даний винахід відноситься до сполуки формул (I), (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою метил. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (I), (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою етил. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (I), (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою гідроксиметил. У одному варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою метил; 2 R являє собою феніл, який є незаміщеним або заміщеним у мета- та/або пара-положеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для параположення. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою метил; 2 R являє собою піридил, який є незаміщеним або заміщеним у мета- та/або параположеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для пара-положення. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою метил; 2 R являє собою 5-членний моноциклічний гетероарил, який містить 2-3 гетероатоми, вибрані з N, O або S, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F. У одному варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою метил; 2 R являє собою феніл, 3-метоксифеніл, 4-метоксифеніл, 4-(3-гідроксипропокси)феніл, 4-(2гідроксиетокси)феніл або 4-(2-метоксиетокси)феніл. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою метил; 4 UA 114001 C2 2 5 10 15 20 25 30 35 40 45 50 55 60 R являє собою 3-піридил, який є незаміщеним або заміщеним у мета- та/або параположеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для пара-положення. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою метил; 2 R являє собою 3-піридил. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою метил; 2 R являє собою тіазоліл, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою метил; 2 R являє собою 2-тіазоліл, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою метил; 2 R являє собою 2-тіазоліл. У одному варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою етил; 2 R являє собою феніл, який є незаміщеним або заміщеним у мета- та/або пара-положеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для параположення. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою етил; 2 R являє собою піридил, який є незаміщеним або заміщеним у мета- та/або параположеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для пара-положення. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою етил; 2 R являє собою 5-членний моноциклічний гетероарил, який містить 2-3 гетероатоми, вибрані з N, O або S, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F. У одному варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою етил; 2 R являє собою феніл, 3-метоксифеніл, 4-метоксифеніл, 4-(3-гідроксипропокси)феніл, 4-(2гідроксиетокси)феніл або 4-(2-метоксиетокси)феніл. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою етил; 2 R являє собою 3-піридил, який є незаміщеним або заміщеним у мета- та/або параположеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для пара-положення. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою етил; 2 R являє собою 3-піридил. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 5 UA 114001 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 R являє собою етил; 2 R являє собою тіазоліл, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою етил; 2 R являє собою 2-тіазоліл, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою етил; 2 R являє собою 2-тіазоліл. У одному варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою гідроксиметил; 2 R являє собою феніл, який є незаміщеним або заміщеним у мета- та/або пара-положеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для параположення. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою гідроксиметил; 2 R являє собою піридил, який є незаміщеним або заміщеним у мета- та/або параположеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для пара-положення. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою гідроксиметил; 2 R являє собою 5-членний моноциклічний гетероарил, який містить 2-3 гетероатоми, вибрані з N, O або S, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F. У одному варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою гідроксиметил; 2 R являє собою феніл, 3-метоксифеніл, 4-метоксифеніл, 4-(3-гідроксипропокси)феніл, 4-(2гідроксиетокси)феніл або 4-(2-метоксиетокси)феніл. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою гідроксиметил; 2 R являє собою 3-піридил, який є незаміщеним або заміщеним у мета- та/або параположеннях 1 або 2 замісниками, незалежно вибраними з D, F або метокси для мета-положення та з D, F, метокси, C1-C5-алкокси, гідрокси-C2-C4-алкокси або C1-C2-алкокси-C2-C4-алкокси для пара-положення. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою гідроксиметил; 2 R являє собою 3-піридил. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою гідроксиметил; 2 R являє собою тіазоліл, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 1 R являє собою гідроксиметил; 2 R являє собою 2-тіазоліл, який є незаміщеним або заміщеним 1-2 замісниками, незалежно вибраними з D або F. У іншому варіанті здійснення даний винахід відноситься до сполуки формул (Ia) або (Ib), та/або її фармацевтично прийнятної солі та/або сольвату, де 6 UA 114001 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 R являє собою гідроксиметил; 2 R являє собою 2-тіазоліл. У іншому варіанті здійснення даний винахід відноситься до сполуки, та/або її фармацевтично прийнятної солі та/або сольвату, вибраної з 3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-метил-5-тіазол-2ілоксазолідин-2-ону, 3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-етил-5-(4метоксифеніл)оксазолідин-2-ону, 3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-(гідроксиметил)-5-(4метоксифеніл)оксазолідин-2-ону, 3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-етил-5фенілоксазолідин-2-ону, 3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-метил-5фенілоксазолідин-2-ону, 3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-етил-5-(3метоксифеніл)оксазолідин-2-ону, 3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-етил-5-(тіазол-2іл)оксазолідин-2-ону, 3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-етил-5-піридин-3ілоксазолідин-2-ону, 3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-метил-5-піридин-3ілоксазолідин-2-ону, 3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-гідроксиметил-5фенілоксазолідин-2-ону, 3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-метил-5-тіазол-2ілоксазолідин-2-ону, 3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-(гідроксиметил)-5-(4-(2метоксиетокси)феніл)оксазолідин-2-ону, 3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-5-(4-(2гідроксиетокси)феніл)-4-(гідроксиметил)оксазолідин-2-ону або 3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-(гідроксиметил)-5-(4-(3гідроксипропокси)феніл)оксазолідин-2-ону. У іншому варіанті здійснення даний винахід відноситься до сполуки, та/або її фармацевтично прийнятної солі та/або сольвату, вибраної з (4S, 5R)-3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-метил-5тіазол-2-ілоксазолідин-2-ону, (4S*,5S*)-3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-етил-5-(4метоксифеніл)оксазолідин-2-ону, (4S, 5S)-3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-(гідроксиметил)5-(4-метоксифеніл)оксазолідин-2-ону, (4S*,5R*)-3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-етил-5фенілоксазолідин-2-ону, (4S, 5S)-3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-метил-5фенілоксазолідин-2-ону, (4R*,5R*)-3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-етил-5-(3метоксифеніл)оксазолідин-2-ону, (4S, 5R)-3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-етил-5-(тіазол2-іл)оксазолідин-2-ону, 3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-етил-5-піридин-3ілоксазолідин-2-ону, 3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-метил-5-піридин-3ілоксазолідин-2-ону, (4S, 5S)-3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4гідроксиметил-5-фенілоксазолідин-2-ону, (4S, 5S)-3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-метил-5тіазол-2-ілоксазолідин-2-ону, (4S, 5S)-3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-(гідроксиметил)5-(4-(2-метоксиетокси)феніл)оксазолідин-2-ону, (4S, 5S)-3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-5-(4-(2гідроксиетокси)феніл)-4-(гідроксиметил)оксазолідин-2-ону або 7 UA 114001 C2 5 10 15 20 25 30 35 40 45 50 55 (4S, 5S)-3-(2'-аміно-2-морфолінo-4'-(трифторметил)-[4,5'-біпіримідин]-6-іл)-4-(гідроксиметил)5-(4-(3-гідроксипропокси)феніл)оксазолідин-2-ону. Конкретні варіанти здійснення забезпечують конкретними прикладами сполуки, описаними у даному винаході. Як застосовують у даному винаході, термін "оптичний ізомер" або "стереоізомер" відноситься до будь-якої з різних стереоізомерних конфігурацій, які можуть існувати для зазначеної сполуки згідно з даним винаходом, та вони включають геометричні ізомери. Слід розуміти, що замісник може бути приєднаний до хірального центру атому вуглецю. Термін "хіральний" відноситься до молекул, які мають властивості ненакладання на партнера, що є їх дзеркальним відображенням, тоді як термін "ахіральний" відноситься до молекул, які є накладанними на партнера, що їх дзеркальним відображенням. Отже, даний винахід включає енантіомери, діастереомери або рацемати сполуки. "Енантіомери" являють собою пару стереоізомерів, які є ненакладанними дзеркальними відображеннями один іншого. Суміш 1:1 пари енантіомерів являє собою "рацемічну" суміш. Термін застосовують для позначення рацемічної суміші, за необхідності. "Діастереоізомери" являють собою стереоізомери, які містять щонайменше два асиметричні атоми, але які не є дзеркальними відображеннями один іншого. Абсолютна стереохімія зазначена згідно R-S-системи Кана-Інгольда-Прелога. Коли сполука являє собою чистий енантіомер, стереохімію при кожному хіральному центрі можна вказати або як R, або як S. Виділені сполуки, чия абсолютна конфігурація є невідомою, можна позначити (+) або (-), залежно від напрямку (право- або лівообертальні), у якому вони обертають плоскополяризоване світло при довжині хвилі лінії D натрію. Певні сполуки, описані у даному винаході, містять один або більше асиметричних центрів або осей та можуть, таким чином, давати енантіомери, діастереомери та інші стереоізомерні форми, які можна визначити у термінах абсолютної стереохімії як (R)- або (S)-. Залежно від вибору вихідних сполук та способів, сполуки можуть бути присутніми у вигляді одного з можливих ізомерів або у вигляді їх сумішей, наприклад, у вигляді чистих оптичних ізомерів або у вигляді ізомерних сумішей, таких як рацемати та діастереоізомерні суміші, залежно від кількості асиметричних атомів вуглецю. Передбачається, що даний винахід включає всі дані можливі ізомери, включаючи рацемічні суміші, діастереомерні суміші та оптично чисті форми. Оптично активні (R)- та (S)-ізомери можна одержати, застосовуючи хіральні синтони або хіральні реагенти, або розділяти, застосовуючи загальноприйняті способи. Якщо сполука містить подвійний зв'язок, замісник може мати E- або Z-конфігурацію. Якщо сполука містить дизаміщений циклоакліл, циклоалкільний замісник може мати цис- або трансконфігурацію. Усі таутомерні форми також передбачаються включеними. Як застосовують у даному винаході, терміни "сіль" або "солі" відноситься до солі приєднання кислоти або основи сполуки даного винаходу. "Солі" включають, зокрема, "фармацевтично прийнятні солі". Термін "фармацевтично прийнятні солі" відноситься до солей, які зберігають біологічну ефективність та властивості сполук даного винаходу та які звичайно не є біологічно або інакше небажаними. У багатьох випадках сполуки даного винаходу здатні утворювати кислі та/або основні солі за рахунок наявності аміно- та/або карбоксильної груп або аналогічних ним груп. Фармацевтично прийнятні солі приєднання кислоти можна одержати з неорганічними та органічними кислотами, наприклад, ацетатну, аспартатну, бензоатну, безилатну, бромідну/гідробромідну, бікарбонатну/карбонатну, бісульфатну/сульфатну, камфорсульфонатну, хлоридну/гідрохлоридну, хлортеофілонатну, цитратну, етандисульфонатну, фумаратну, глюцептатну, глюконатну, глюкуронатну, гіпуратну, гідройодидну/йодидну, ізотіонатну, лактатну, лактобіонатну, лаурилсульфатну, малатну, малеатну, малонатну, манделатну, мезилатну, метилсульфатну, нафтоатну, напсилатну, нікотинатну, нітратну, октадеканоатну, олеатну, оксалатну, пальмітатну, памоатну, фосфатну/гідрофосфатну/дигідрофосфатну, полігалактуронатну, пропіонатну, стеаратну, сукцинатну, сульфосаліцилатну, тартратну, тозилатну та трифторацетану солі. Неорганічні кислоти, з яких можна одержати солі, включають, наприклад, хлористоводневу кислоту, бромистоводневу кислоту, сірчану кислоту, азотну кислоту, фосфорну кислоту та подібні. Органічні кислоти, з яких можна одержати солі, включають, наприклад, оцтову кислоту, пропіонову кислоту, гліколеву кислоту, щавлеву кислоту, малеїнову кислоту, малонову кислоту, бурштинову кислоту, фумарову кислоту, винну кислоту, лимонну кислоту, бензойну кислоту, мигдальну кислоту, метансульфонову кислоту, етансульфонову кислоту, толуолсульфонову 8 UA 114001 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислоту, сульфосаліцилову кислоту та подібні. Фармацевтично прийнятні солі приєднання основи можна одержати з неорганічними та органічними основами. Неорганічні основи, з яких можна одержати солі, включають, наприклад, амонієві солі та солі металів із груп I-XII періодичної таблиці. У деяких варіантах здійснення солі одержують із натрію, калію, амонію, кальцію, магнію, заліза, срібла, цинку та міді; зокрема солі, що підходять, включають солі амонію, калію, натрію, кальцію та магнію. Органічні основи, з яких можна одержати солі, включають, наприклад, первинні, вторинні та третинні аміни, заміщені аміни, включаючи природні заміщені аміни, циклічні аміни, основні іонообмінні смоли та подібні. Деякі органічні аміни включають ізопропіламін, бензатин, холінат, діетаноламін, діетиламін, лізин, піперазин, меглумін та трометамін. Фармацевтично прийнятні солі даного винаходу можна одержати з основної або кислої групи загальноприйнятими хімічними способами. Звичайно дані солі можна одержати реакцією вільних кислих форм даних сполук зі стехіометричною кількістю підходящої основи (такої як гідроксид, карбонат, бікарбонат Na, Ca, Mg або K, або подібні), або реакцією вільних основних форм даних сполук зі стехіометричною кількістю підходящої кислоти. Дані реакції звичайно проводять у воді або у органічному розчиннику, або у суміші двох. Звичайне застосування неводного середовища, подібного ефіру, етилацетату, етанолу, ізопропанолу або ацетонітрилу, є бажаним, за наявності можливості. Список додаткових підходящих солей можна знайти, наприклад, у "Remington's Pharmaceutical Sciences", 20th ed., Mack Publishing Company, Easton, Pa., (1985); та в "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" by Stahl and Wermuth (Wiley-vch, Weinheim, Germany, 2002). Якщо не зазначено інше, передбачається, що будь-яка формула, зазначена у даному винаході, також представляє немічені форми, а також ізотопно-мічені форми сполук. Ізотопномічені сполуки мають структури, зображені формулами, зазначеними у даному винаході, за винятком того, що один або більше атомів заміщені атомом, що має зазначену атомну масу або масове число. Приклади ізотопів, які можна вводити у сполуки даного винаходу, включають 2 3 11 13 14 15 ізотопи водню, вуглецю, азоту, кисню, фосфору, фтору та хлору, такі як H, H, C, C, C, N, 18 31 32 35 36 125 F P, P, S, Cl, I відповідно. Даний винахід включає різні ізотопно-мічені сполуки, як визначено у даному винаході, наприклад, ізотопно-мічені сполуки, у яких присутні радіоактивні 3 14 ізотопи, такі як H та C, або ізотопно-мічені сполуки, у яких присутні нерадіоактивні ізотопи, 2 13 14 такі як H та C. Дані ізотопно-мічені сполуки є придатними у дослідженнях метаболізму (з C), 2 3 дослідженнях кінетики реакцій (наприклад, з H або H), способах детекції або одержання зображення, таких як позитронно-емісійна томографія (PET) або однофотонна емісійна комп'ютерна томографія (SPECT), включаючи аналізи розподілу лікарських засобів або 18 субстратів у тканинах, або у радіоактивному лікуванні пацієнтів. Зокрема, F-мічена сполука може бути особливо бажаною для PET або SPECT досліджень. Ізотопно-мічені сполуки формули (I) можна звичайно одержати загальноприйнятими способами, відомими фахівцям у даній галузі техніки, або за способами, аналогічними способам, описаним у супровідних прикладах та способах одержання, застосовуючи підходящі ізотопно-мічені реагенти замість раніше застосовуваних немічених реагентів. 2 Крім того, заміщення більш важкими ізотопами, зокрема дейтерієм (тобто H або D) може давати певні терапевтичні переваги, що є результатом більшої метаболічної стабільності, наприклад, підвищений період напіврозпаду in vivo або знижені необхідні дози або поліпшення терапевтичного індексу. Зрозуміло, що дейтерій у даному контексті вважають замісником сполуки формули (I). Концентрацію даного більш важкого ізотопу, особливо дейтерію, можна визначити коефіцієнтом ізотопного збагачення. Термін "коефіцієнт ізотопного збагачення", як застосовують у даному винаході, позначає відношення між поширеністю ізотопу та поширеністю ізотопу у природі зазначеного ізотопу. Якщо замісник у сполуці даного винаходу позначений як дейтерій, дана сполука має коефіцієнт ізотопного збагачення для кожного зазначеного атому дейтерію щонайменше 3500 (52,5 % включення дейтерію для кожного зазначеного атому дейтерію), щонайменше, 4000 (60 % включення дейтерію), щонайменше 4500 (67,5 % включення дейтерію), щонайменше 5000 (75 % включення дейтерію), щонайменше 5500 (82,5 % включення дейтерію), щонайменше 6000 (90 % включення дейтерію), щонайменше 6333,3 (95 % включення дейтерію), щонайменше 6466,7 (97 % включення дейтерію), щонайменше 6600 (99 % включення дейтерію) або щонайменше 6633,3 (99,5 % включення дейтерію). Фармацевтично прийнятні сольвати згідно із даним винаходом включають сольвати, у яких розчинник кристалізації може бути ізотопно-заміщений, наприклад, D2O, d6-ацетон, d6-ДМСО. Сполуки даного винаходу, тобто сполуки формули (I), які містять групи, здатні діяти як донори та/або акцептори водневих зв'язків, можуть бути здатні утворювати співкристали з підходящими агентами, що утворюють співкристали. Дані співкристали можна одержати зі 9 UA 114001 C2 5 10 15 20 25 30 35 40 45 50 55 сполук формули (I) за відомими способами одержання співкристалів. Дані способи включають здрібнювання, нагрівання, спільну сублімацію, спільне плавлення або контакт у розчині сполук формули (I) з агентом, що утворює співкристали, в умовах кристалізації та виділення у такий спосіб кристалів, що утворилися. Підходящі агенти, що утворюють співкристали, включають агенти, описані у WO 2004/078163. Отже, даний винахід додатково відноситься до співкристалів, що містять сполуку формули (I). Як застосовують у даному винаході, термін "фармацевтично прийнятний носій" включає будь-який та всі розчинники, дисперсійні середовища, покриття, поверхнево-активні речовини, антиоксиданти, консерванти (наприклад, антибактеріальні агенти, протигрибкові агенти), ізотонічні агенти, агенти, що уповільнюють поглинання, солі, консерванти, стабілізатори, лікарські речовини, зв'язуючі агенти, наповнювачі, розпушувачі, змащуючі речовини, підсолоджувачі, ароматизатори, барвники та подібні, та їх комбінації, як відомо фахівцям у даній галузі техніки (дивись, наприклад, Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329). За виключення випадків, коли будь-який загальноприйнятий носій є несумісним з активним інгредієнтом, передбачається його застосування у терапевтичних або фармацевтичних композиціях. Термін "терапевтично ефективна кількість" сполуки даного винаходу відноситься до кількості сполуки даного винаходу, яка буде викликати біологічну або медичну відповідь у суб'єкта, наприклад, зниження або інгібування активності ферменту або білку, або полегшення симптомів, полегшення захворювань, уповільнення або затримку розвитку захворювання, або запобігання захворювання та т.д. У одному необмежуючому варіанті здійснення, термін "терапевтично ефективна кількість" відноситься до кількості сполуки даного винаходу, яка, при введенні суб'єктові, є ефективною для (1) щонайменше часткового полегшення, інгібування, запобігання та/або поліпшення стану або розладу або захворювання, (i) опосередкованого PI3 кіназою класу I або (ii) пов'язаного з активністю PI3 кінази класу I, або (iii) що характеризується активністю (нормальною або порушеною) PI3 кінази класу I; або (2) зниження або інгібування активності PI3 кінази класу I. У іншому необмежуючому варіанті здійснення термін "терапевтично ефективна кількість" відноситься до кількості сполуки даного винаходу, яка, при введенні у клітину або тканину, або неклітинний біологічний матеріал, або середовище, є ефективною для щонайменше часткового зниження або інгібування активності PI3 кінази класу I. У іншому варіанті здійснення термін "терапевтично ефективна кількість" відноситься до кількості сполуки даного винаходу, яка, при введенні суб'єктові, є ефективною для (1) щонайменше часткового полегшення, інгібування, запобігання та/або поліпшення стану або розладу або захворювання, (i) опосередкованого PI3 кіназою класу I та mTOR або (ii) пов'язаного з активністю PI3 кінази класу I та mTOR, або (iii) що характеризується активністю (нормальною або порушеною) PI3 кінази класу I та mTOR; або (2) зниження або інгібування активності PI3 кінази класу I та mTOR. У іншому необмежуючому варіанті здійснення термін "терапевтично ефективна кількість" відноситься до кількості сполуки даного винаходу, яка, при введенні у клітину або тканину, або неклітинний біологічний матеріал, або середовище, є ефективною для щонайменше часткового зниження або інгібування активності PI3 кінази класу I та mTOR. Як застосовують у даному винаході, термін "суб'єкт" відноситься до тварини. Звичайна тварина являє собою ссавця. Суб'єкт також відноситься, наприклад, до приматів (наприклад, людей чоловічої або жіночої статі), корів, овець, кіз, коней, собак, кішок, кроликів, щурів, мишей, риб, птахів та подібних. У певних варіантах здійснення суб'єкт являє собою примата. У ще інших варіантах здійснення суб'єкт являє собою людину. Як застосовують у даному винаході, термін "інгібувати" або "інгібування" відноситься до зниження або пригнічення зазначеного стану, симптому або розладу, або захворювання, або значного зниження вихідної активності біологічної активності або процесу. Як застосовують у даному винаході, термін "лікувати" або "лікування" будь-якого захворювання або розладу відноситься у одному варіанті здійснення до полегшення захворювання або розладу (тобто уповільнення або зупинки або ослаблення розвитку захворювання або щонайменше одного з його клінічних симптомів). У іншому варіанті здійснення "лікувати" або "лікування" відноситься до полегшення або ослаблення щонайменше одного фізичного параметру, включаючи параметри, які можуть бути непомітні пацієнтові. У ще іншому варіанті здійснення "лікувати" або "лікування" відноситься до регулювання захворювання або розладу, або фізично (наприклад, стабілізація видимого симптому), фізіологічно (наприклад, стабілізація фізичного параметру), або обох. У ще іншому варіанті 10 UA 114001 C2 5 10 15 20 25 30 35 40 45 50 55 здійснення "лікувати" або "лікування" відноситься до запобігання або затримки виникнення або розвитку або прогресування захворювання або розладу. Як застосовують у даному винаході, суб'єкт є таким, що "потребує" лікування, якщо суб'єкт буде одержувати користь біологічно, медично або у якості життя з даного лікування. Як застосовують у даному винаході, терміни, що згадуються у однині, застосовувані у контексті даного винаходу (особливо у контексті формули винаходу), мають на увазі включення і одиничних і множинних форм, якщо не зазначено інше у даному винаході або явно не суперечить контексту. Усі способи, описані у даному винаході, можна здійснювати у підходящому порядку, якщо не зазначено інше у даному винаході або явно не суперечить контексту. Застосування будь-якого та всіх прикладів або мови прикладів (наприклад "такий як"), що відносяться до даного винаходу, передбачається єдино з метою кращого висвітлення даного винаходу та не накладає обмеження на інакше заявлений обсяг даного винаходу. Будь-який асиметричний атом (наприклад, вуглець або подібний) сполуки (сполук) даного винаходу може бути присутнім у рацемічній або енантіомерно збагаченій, наприклад (R)-, (S)або (R, S)-конфігурації. У певних варіантах здійснення кожний асиметричний атом має щонайменше 50 % енантіомерний надлишок, щонайменше 60 % енантіомерний надлишок, щонайменше 70 % енантіомерний надлишок, щонайменше 80 % енантіомерний надлишок, щонайменше 90 % енантіомерний надлишок, щонайменше 95 % енантіомерний надлишок або щонайменше 99 % енантіомерний надлишок (R)- або (S)-конфігурації. Замісники при атомах з ненасиченими подвійними зв'язками можуть, при можливості, бути присутніми у цис- (Z)- або транс- (E)-формі. Відповідно, як застосовують у даному винаході, сполука даного винаходу може бути у вигляді одного з можливих ізомерів, ротамерів, атропізомерів, таутомерів або їх сумішей, наприклад, у вигляді по суті чистих геометричних (цис- або транс-)ізомерів, діастереомерів, оптичних ізомерів (антиподів), рацематів або їх сумішей. Будь-які отримані у результаті суміші ізомерів можна розділити на основі фізико-хімічних відмінностей складових, на чисті або по суті чисті геометричні або оптичні ізомери, діастереомери, рацемати, наприклад, хроматографією та/або фракційною кристалізацією. Будь-які отримані у результаті рацемати кінцевих продуктів або проміжних сполук можна розділити на оптичні антиподи за відомими способами, наприклад, розділенням їх діастереомерних солей, отриманих з оптично активною кислотою або основою, та вивільненням оптично активної кислої або основної сполуки. Зокрема, основну групу, можна, таким чином, застосовувати для розділення сполук даного винаходу на їх оптичні антиподи, наприклад, фракційною кристалізацією солі, отриманої з оптично активною кислотою, наприклад, винною кислотою, дибензоїлвинною кислотою, діацетилвинною кислотою, ди-О, О'-п-толуолвинною кислотою, мигдальною кислотою, яблучною кислотою або камфор-10-сульфокислотою. Рацемічні продукти можна також розділити хіральною хроматографією, наприклад, рідинною хроматографією високого тиску (ВЕРХ), застосовуючи хіральний адсорбент. Крім того, сполуки даного винаходу, включаючи їх солі, можна також одержати у вигляді їх гідратів, або таких, що містять інші розчинники, застосовувані для їх кристалізації. Сполуки даного винаходу можуть мимовільно або у спеціальних умовах утворювати сольвати з фармацевтично прийнятними розчинниками (включаючи воду); отже, передбачається, що даний винахід включає і сольватовані, і несольватовані форми. Термін "сольват" відноситься до молекулярного комплексу сполуки даного винаходу (включаючи її фармацевтично прийнятні солі) з однієї або більше молекулами розчиннику. Дані молекули розчиннику являють собою молекули розчинників, звичайно застосовуваних у фармацевтичній галузі техніки, про яких відомо, що вони є безпечними для реципієнта, наприклад, воду, етанол та подібні. Термін "гідрат" відноситься до комплексу, у якому молекулою розчиннику є вода. Сполуки даного винаходу, включаючи їх солі, гідрати та сольвати, можуть самовільно або у спеціальних умовах утворювати поліморфи. Сполуки даного винаходу можна одержати за синтетичними способами, які включають способи, аналогічні способам, добре відомим у хімічній галузі техніки, зокрема у світлі опису, що міститься у даному винаході. Вихідні сполуки звичайно є доступними з комерційних джерел, або їх легко одержати, застосовуючи способи, добре відомі фахівцям у даній галузі техніки (наприклад, отримані за способами, описаними, загалом, у Louis F. Fieser and Mary Fieser, Reagents for Organic Synthesis, тому 1-19, Wiley, New York (1967-1999 ed.), або Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включаючи допоміжні матеріали (також доступні через електронну систему бази даних Бельштейна)). 11 UA 114001 C2 5 10 15 20 25 Для ілюстративних цілей, схема реакцій, показана нижче, забезпечує потенційні шляхи одержання сполук даного винаходу, а також ключових проміжних сполук. Що стосується більш докладного опису окремих реакційних стадій, дивіться розділ прикладів нижче. Фахівцям у даній галузі техніки зрозуміло, що інші способи одержання можна застосовувати для одержання сполук даного винаходу. Хоча конкретні вихідні сполуки та реагенти показані на схемах та обговорюються нижче, їх можна легко заміняти на інші вихідні сполуки та реагенти, забезпечуючи ряд похідних та/або реакційних умов. Крім того, багато сполук, отриманих за способами, відомими нижче, можна додатково модифікувати у світлі даного опису, застосовуючи загальноприйняту хімію, добре відому фахівцям у даній галузі техніки. При одержанні сполук даного винаходу, може потребуватися захист винесених функціональних угрупувань (наприклад, гідроксильних груп) проміжних сполук. Необхідність у даному захисті буде змінюватися залежно від властивостей винесених функціональних угрупувань та умов способів одержання. Підходящі захисні групи для гідроксилу включають триалкілсилільні ефіри, у яких одну або дві алкільні групи можна заміняти на феніл. Фахівець у даній галузі техніки легко визначить необхідність у даному захисті. Що стосується загального опису захисних груп та їх застосування, дивіться T. W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991. Звичайно сполуки формули (I) можна отримати згідно зі способами, приведеним нижче. Схема 1 У одному варіанті здійснення даний винахід відноситься до способу одержання сполуки формули (I), що включає стадії a та b. У одному варіанті здійснення даний винахід відноситься до способу одержання сполуки формули (I) (спосіб A), що включає стадію a, з наступною стадією b. 3 Сполуку формули (I) отримують на стадії a) конденсацією сполуки формули (A), де R такий же, як визначено для сполуки формули (I) вище, 12 UA 114001 C2 1 2 зі сполукою формули (B), де R та R такі ж як визначено для сполуки формули (I) вище, 1 5 2 3 отримуючи сполука формули (C), де R , R та R такі ж як визначено для сполуки формули (I) вище, з наступною стадією b) конденсації сполуки формули (C) зі сполукою формули (D), де B(OR')2 являє собою циклічну або ациклічну боронову кислоту або похідну боронової кислоти, таку як пінаколато-бор, 10 15 20 У випадках, коли є присутньою захисна група, додають стадію деблокування для перетворення захищеної сполуки формули (I) у сполуку формули (I). Стадію a) здійснюють у присутності основи, такої як NaН. Реакцію здійснюють у присутності органічного розчиннику, такого як ДМФА, при температурах 0-80C протягом 20-30 хвилин. Альтернативно, реакцію можна здійснювати у стандартних умовах Бухвальда-Хартвіга, застосовуючи ліганд, такий як Xantphos, X-Phos або бутилфосфіно-2'-(N, Nдиметиламіно)біфеніл, з паладієвим каталізатором, таким як Pd2(dba)3 або Pd2(dba)3CHCl3 або Pd(OAc)2, переважно Pd2(dba)3 з Xantphos, у присутності основи, такої як переважно Cs2CO3 або трет-BuONa, у органічному розчиннику, такому як ефір, переважно діоксан або ТГФ. Реакцію переважно перемішують при температурі приблизно 80-120 °C. Реакцію переважно здійснюють у атмосфері інертного газу, такого як азот або аргон. Стандартні умови реакції, відомі у області реакцій Бухвальда-Хартвіга, можна застосовувати у даному способі. 13 UA 114001 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадію b) здійснюють у присутності каталізатору, такого як Pd(0) каталізатор, наприклад, PdCl2(dppf)-CH2Cl2, необов'язково у присутності однієї або більше допоміжних речовин для реакції, таких як основа, наприклад, водна основа, така як водний Na 2CO3, необов'язково у присутності одного або більше розріджувачів, зокрема полярних розчинників, наприклад, DME. Реакцію перемішують при температурі приблизно 80-120 °C. Реакцію можна здійснювати у атмосфері інертного газу, такого як азот або аргон. Стандартні умови реакції, відомі у галузі реакцій Сузукі, можна застосовувати у даному способі. Альтернативно, сполуки формули (I) можна також одержати, здійснюючи стадію b), з наступною стадією a) (спосіб B). Даний винахід додатково включає будь-який варіант даних способів, у яких проміжний продукт, одержуваний на будь-якій його стадії, застосовують у якості вихідної сполуки, та здійснюють стадії, що залишилися, або у яких вихідні сполуки утворюються in situ в умовах реакції, або у яких компоненти реакції застосовують у вигляді їх солей або оптично чистого матеріалу. Сполуки даного винаходу та проміжні сполуки можна також перетворювати одну у іншу згідно зі способами, звичайно відомими фахівцями у даній галузі техніки. У іншому аспекті даний винахід відноситься до фармацевтичної композиції, що містить сполуку даного винаходу, або її фармацевтично прийнятну сіль, та фармацевтично прийнятний носій. Фармацевтичну композицію можна формулювати для конкретних шляхів введення, таких як місцеве введення; ентеральне введення, таке як, наприклад, пероральне або ректальне введення; та парентеральне введення, таке як, наприклад, внутрішньовенне, внутрішньом'язове або підшкірне введення. Крім того, фармацевтичні композиції даного винаходу можна одержати у твердій формі (включаючи без обмеження капсули, таблетки, пігулки, гранули, порошки або супозиторії) або у рідкій формі (включаючи без обмеження розчини, суспензії або емульсії). Фармацевтичні композиції можна одержати згідно зі способами, відомими у даній галузі техніки. Фармацевтичні композиції можна піддавати загальноприйнятим фармацевтичним операціям, таким як стерилізація, та/або вони можуть містити загальноприйняті інертні розріджувачі, змащуючі агенти або буфери, а також ад'юванти, такі як консерванти, стабілізатори, змочуючі агенти, емульгатори та буфери, і т.д. Підходящі композиції для місцевого застосування, наприклад, на шкірі та очах, включають водні розчини, суспензії, мазі, креми, гелі, порошки, масла або розпорошуючі сполуки, наприклад, для доставки аерозолем або подібним. Дані місцеві системи доставки будуть зокрема підходити для шкірного застосування, наприклад, для застосування у кремах, лосьйонах, спреях та подібних. Таким чином, вони є особливо підходящими для застосування у місцевих, включаючи косметичні, сполуках, добре відомих у даній галузі техніки. Дані сполуки можуть містити агенти, що сприяють розчиненню, стабілізатори, агенти, що регулюють тонічність, буфери та консерванти, і т.д. Як застосовують у даному винаході, місцеве застосування може також відноситися до інгаляції або до інтраназального застосування, наприклад, у респіраторній системі. Їх можна зручно доставляти у вигляді сухого порошку (або окремо, у вигляді суміші, наприклад, сухої суміші з лактозою, або у вигляді часток змішаних компонентів, наприклад, з фосфоліпідами) з порошкового інгалятору або у вигляді спрей-аерозолю з контейнеру під тиском, насосу, розпилювача, аерозольного інгалятору або небулайзера, з або без застосування підходящого пропеленту. У контексті даного винаходу нанесення переважно відноситься до місцевого нанесення, такого як нашкірне нанесення у підходящій композиції, що містить сполуку даного винаходу або її фармацевтично прийнятну сіль, та фармацевтично дерматологічно прийнятний носій. Підходящі композиції для нашкірного нанесення можуть включати всі фармацевтичні форми, звичайно застосовувані для даного шляху введення, та вони є добре відомими у даній галузі техніки, включаючи розчини, гелі, лосьйони, суспензії, креми, порошки, масла, мазі, піни, муси, емульсії, мікроемульсії, молочко, сироватки, аерозолі, спреї, дисперсії, мікрокапсули, везикули та їх мікрочастинки. Дані сполуки формулюють згідно за загальноприйнятими способами. Як застосовують у даному винаході, термін "дерматологічно прийнятний носій" являє собою носій, який є придатним для місцевого застосування на ороговілій тканині, має гарні естетичні властивості, є сумісним з активними агентами даного винаходу та будь-якими іншими компонентами, та не буде викликати будь-яких небажаних проблем, пов'язаних з безпекою або токсичністю. Дерматологічно прийнятний носій може мати велику різноманітність форм. Наприклад, у даному винаході є придатними носії для емульсії, що включають, але не обмежувані, емульсії 14 UA 114001 C2 5 10 15 20 25 30 35 40 45 50 55 60 масла у воді, води у маслі, води у маслі у воді та масла у воді у силіконі. Як зрозуміло фахівцеві у даній галузі техніки, зазначений компонент буде розподілятися в основному або у водній або масляній/силіконовій фазі, залежно від розчинності/здатності диспергуватися у воді компоненту у композиції. Композиція, що підходить для нашкірного нанесення, за необхідності, може містити різні відомі добавки, такі як наповнювачі, зв'язувальні речовини, мастильні речовини та розпушувачі. За необхідності, вона може також містити маслянисті речовини, такі як різні жири, масла, воски, вуглеводні, жирні кислоти, вищі спирти, ефірні масла, металовмісні мила, тварини або рослинні екстракти, гідрофільні або ліпофільні гелеутворюючі агенти, гідрофільні або ліпофільні активні агенти, інші компоненти, такі як вітаміни, амінокислоти, поверхнево-активні речовини, барвники, фарби, пігменти, ароматизатори, поглиначі запаху, антисептики, консерванти, бактерицидні агенти, зволожуючі агенти, загусники, розчинники, наповнювачі, антиоксиданти, комплексоутворюючі агенти, сонцезахисні речовини, та подібні, та їх комбінації, як відомо фахівцям у даній галузі техніки, за умови, що вони є сумісними з активним інгредієнтом. Приклади підходящих масел включають мінеральні масла, рослинні олії, такі як кокосове масло, кунжутне масло, соєве масло, сафлорове масло, соняшникове масло, тваринні масла, такі як ланолін або пергідросквален, синтетичні масла, такі як пурцелінове масло, силіконові масла, такі як циклометиком серед інших. Жирні спирти, жирні кислоти, такі як стеаринова кислота, та воски, такі як парафіновий віск, карнаубський віск або бджолиний віск, також можна застосовувати як жири. Композиція може також містити емульгатори, розчинники, гідрофільні гелеутворюючі агенти, ліпофільні гелеутворюючі агенти, солі металів та жирних кислот, гідрофільні активні агенти або ліпофільні активні агенти. Сполуки формули (I) у вільній формі або у вигляді солі, мають цінні фармакологічні властивості, наприклад, властивості, що регулюють PI3 кіназу, такі як властивості, що регулюють PI3 кіназу I класу (PI3K I класу), або властивості, що регулюють PI3, у комбінації із властивостями, що регулюють mTOR, наприклад, як показано у випробуваннях in vitro та in vivo, як наведено у експериментальній частині, і, отже, вони показані для терапії або для застосування як хімічні сполуки для досліджень, наприклад, у якості сполук, що є інструментами. Сполуки формули (I) у вільній формі або сольовій формі, є придатними у лікуванні захворювань, що залежати від PI3 кінази I класу, особливо захворювань, що залежати від PI3K α I класу та β-ізоформ, а також захворювань, що залежати від PI3 кіназ I класу, особливо захворювань, що залежати від PI3K I класу α- та β-ізоформ, у сполученні з mTOR. Сполуки, які інгібують активність PI3K I класу α- та β-ізоформ, зокрема сполуки, які є по суті рівноефективними відносно PI3K I класу α- та β-ізоформ та необов'язково також інгібують активність mTOR, вважають кращими, оскільки вважають, що дані сполуки мають здатність уникати адаптаційних механізмів, пов'язаних зі шляхом, здійснюваним через інші ізоформи, у порівнянні зі сполуками з унікальною специфічністю, наприклад, специфічністю до одного члену сімейства PI3K I класу. Під "рівноефективними" мають на увазі те, що сполуки інгібують декілька ізоформ із порівнянним ступенем, наприклад, як виміряно у ферментативному або клітинному аналізі, описаному у даному винаході. Потрібно, щоб сполуки формули (I) мали достатню світлостабільність для того, щоб забезпечити та досягти максимальної активності сполук формули (I) при введенні нашкірно, мінімізуючи потенційне подразнення та побічні ефекти, пов'язані із продуктами руйнування, що утворюються. Сполуки із непоганою світлостабільністю будуть полегшувати технічну розробку та забезпечення, завдяки мінімальним ризикам руйнування на світлі. Потрібно, щоб сполуки формули (I) мали гарну активність у клітинних аналізах, застосовуючи лінії людських клітин, отримані із плоскоклітинного раку шкіри. Кращі сполуки повинні мати здатність добре проникати у шкіру. Сполуки даного винаходу можуть бути придатними у лікуванні захворювань, вибраних з, не обмежуючись наведеними, немеланомного раку шкіри, такого як базальна клітинна карцинома та плоскоклітинний рак; їх передракових стадій, таких як світлочутливий кератоз, сонячний кератоз та хронічне ушкодження шкіри сонцем; та інших гіперпроліферативних розладів шкіри, викликаних порушенням регуляції фібробластів шкіри, таких як фіброз шкіри, склеродермія, гіпертрофовані фляки або келоїди. Сполуки даного винаходу можуть бути зокрема придатними у лікуванні захворювань, вибраних з, не обмежуючись наведеним, немеланомного раку шкіри. Усі способи, описані у даному винаході, можна здійснювати у будь-якому порядку, якщо не зазначено інше у даному винаході або явно не суперечить контексту. Застосування будь-якого та всіх прикладів або зразкової мови (наприклад "такий як"), що відносяться до даного 15 UA 114001 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходу, передбачається тільки для кращої ілюстрації даного винаходу та не накладає обмеження на обсяг інакше заявленого даного винаходу. У певних випадках може бути переважно введена сполука даного винаходу у комбінації щонайменше з одним додатковим фармацевтичним (або терапевтичним) агентом (наприклад, антипроліферативним або протираковим агентом або допоміжною терапією, звичайно застосовуваною при хіміотерапії). Сполуку даного винаходу можна вводити або одночасно з або перед або після одного або більше інших терапевтичних агентів. Альтернативно, сполуку даного винаходу можна вводити окремо, тим же або відмінним шляхом введення, або разом у одній фармацевтичній композиції, як інший агент (агенти). У одному варіанті здійснення даний винахід відноситься до продукту, що містить сполуку формули (I) та щонайменше один інший терапевтичний агент у вигляді комбінованого препарату для одночасного, роздільного або послідовного застосування у терапії. У одному варіанті здійснення, терапія являє собою лікування захворювання або стану, що залежить від PI3 кіназ. Продукти, забезпечувані у вигляді комбінованого препарату, включають композицію, що містить сполуку формули (I) та інший терапевтичний агент (агенти) разом у одній фармацевтичній композиції, або сполуку формули (I) та інший терапевтичний агент (агенти) у роздільному вигляді, наприклад, у вигляді набору. У одному варіанті здійснення даний винахід відноситься до фармацевтичної композиції, що містить сполуку формули (I) та інший терапевтичний агент (агенти). Необов'язково, фармацевтична композиція може містити фармацевтично прийнятний носій, як описано вище. У одному варіанті здійснення даний винахід відноситься до набору, що містить дві або більше окремих фармацевтичних композицій, щонайменше одна з яких містить сполуку формули (I). У одному варіанті здійснення набір містить засіб роздільного зберігання зазначених композицій, такий як контейнер, роздільна пляшка або розділений пакет з фольги. Приклад даного набору являє собою блістерне упакування, як звичайно застосовують для упакування таблеток, капсул та подібних. Набір даного винаходу можна застосовувати для введення різних лікарських форм, наприклад, пероральних та парентеральних, для введення окремих композицій через різні інтервали дозування, або для титрування окремих композицій однієї відносно іншої. Для того, щоб сприяти дотриманню режиму терапії, набір даного винаходу звичайно містить вказівки щодо введення. Відповідно, даний винахід відноситься до застосування сполуки формули (I) для лікування захворювання або стану, опосередкованого PI3 кіназами, де лікарський засіб отримують для введення з іншим терапевтичним агентом. Даний винахід також відноситься до застосування іншого терапевтичного агенту для лікування захворювання або стану, опосередкованого PI3 кіназами, де лікарський засіб вводять зі сполукою формули (I). Даний винахід також відноситься до сполуки формули (I) для застосування у способі лікування захворювання або стану, опосередкованого PI3 кіназою I класу або опосередкованого PI3 кіназою I класу та mTOR, де сполуку формули (I) отримують для введення з іншим терапевтичним агентом. Даний винахід також відноситься до іншого терапевтичного агенту для застосування у способі лікування захворювання або стану, опосередкованого PI3 кіназою I класу або опосередкованого PI3 кіназою I класу та mTOR, де інший терапевтичний агент отримують для введення зі сполукою формули (I). Даний винахід також відноситься до сполуки формули (I) для застосування у способі лікування захворювання або стану, опосередкованого PI3 кіназою I класу або опосередкованого PI3 кіназою I класу та mTOR, де сполуку формули (I) вводять із іншим терапевтичним агентом. Даний винахід також відноситься до іншого терапевтичного агенту для застосування у способі лікування захворювання або стану, опосередкованого PI3 кіназою I класу або опосередкованого PI3 кіназою I класу та mTOR, де інший терапевтичний агент вводять зі сполукою формули (I). Даний винахід також відноситься до застосування сполуки формули (I) для лікування захворювання або стану, опосередкованого PI3 кіназою I класу або опосередкованого PI3 кіназою I класу та mTOR, де пацієнт раніше зазнав лікування (наприклад, у межах 24 годин) іншим терапевтичним агентом. Даний винахід також відноситься до застосування іншого терапевтичного агенту для лікування захворювання або стану, опосередкованого PI3 кіназою I класу або опосередкованого PI3 кіназою I класу та mTOR, де пацієнт раніше зазнав лікування (наприклад, у межах 24 годин) сполукою формули (I). У одному варіанті здійснення інший терапевтичний агент вибраний з терапевтичних агентів, що підходять для лікування немеланомного раку шкіри, такого як базальна клітинна карцинома та плоскоклітинний рак; їх передракових стадій, таких як світлочутливий кератоз, сонячний кератоз та хронічне ушкодження шкіри сонцем. Відповідно, дані інші терапевтичні агенти можна 16 UA 114001 C2 5 10 15 20 25 30 35 40 45 50 вибрати з імуностимулюючих сполук, наприклад, агоністів Toll-подібного рецептору, таких як іміквімод (Aldara), або з протизапальних агентів, таких як диклофенак (Solaraze). Фармацевтична композиція або комбінація даного винаходу може бути у вигляді одиничного дозування від приблизно 1 до приблизно 1000 мг активного інгредієнту (інгредієнтів) для суб'єкта від приблизно 50 до приблизно 70 кг, або від приблизно 1 до приблизно 500 мг, або від приблизно 1 до приблизно 250 мг, або від приблизно 1 до приблизно 150 мг, або від приблизно 0,5 до приблизно 100 мг, або від приблизно 1 до приблизно 50 мг активних інгредієнтів. Одинична доза може також становити від приблизно 50 до приблизно 1000 мг активного інгредієнту (інгредієнтів) для суб'єкта від приблизно 50 до приблизно 70 кг або від приблизно 50 до приблизно 500 мг, або від приблизно 50 до приблизно 250 мг, або від приблизно 50 до приблизно 150 мг, або від приблизно 50 до приблизно 100 мг активних інгредієнтів. Доза може залежати від конкретної лікарської форми, застосовуваної для доставки активного інгредієнту (інгредієнтів). Загалом, терапевтично ефективна доза сполуки, фармацевтичної композиції або їх комбінацій залежить від виду суб'єкта, маси тіла, віку та індивідуального стану, розладу або захворювання, яке будуть лікувати, або його важкості. Доза може також залежати від біодоступності активного інгредієнту у видах, які будуть піддавати лікуванню. Лікар, фармацевт, клініцист або ветеринар може легко визначити ефективну кількість кожного з активних інгредієнтів, необхідну для запобігання, лікування або інгібування розвитку розладу або захворювання. Наведені вище властивості доз можна продемонструвати in vitro та in vivo випробуваннями, застосовуючи переважно тварин, наприклад, мишей, щурів, собак, мавп, свиней, карликових свиней або виділені органі, тканини та їх препарати. Сполуки даного винаходу можна застосовувати in vitro у вигляді розчинів, наприклад, водних розчинів, отриманих наприклад, з 10 мМ ДМСО вихідного розчину, та in vivo або ентерально, парентерально, переважно внутрішньовенно або місцево, наприклад, у вигляді суспензії, у вигляді водного розчину або інших розчинів, таких як, наприклад, у вигляді розчину на основі пропіленгліколю. Доза in vitro -3 -9 може змінюватися від приблизно 10 до приблизно 10 молярних концентрацій. Терапевтично ефективна кількість in vivo може змінюватися залежно від шляху введення від приблизно 0,1 до приблизно 500 мг/кг або від приблизно 1 до приблизно 100 мг/кг. Приклади Наступні приклади передбачаються для ілюстрації даного винаходу та не передбачаються обмежуючими його. Температури наведені у градусах Цельсію. Якщо не зазначено інше, усі випарювання проводять при зниженому тиску, звичайно від приблизно 15 до 100 мм рт. ст. (20133 мбар). Структуру кінцевих продуктів, проміжних сполук та вихідних сполук підтверджували стандартними аналітичними способами, наприклад, мікроаналізом та спектроскопічним характеристиками, наприклад, МС, ІЧ, ЯМР. Застосовувані скорочення являють собою скорочення, стандартні у даній галузі техніки. Усі вихідні сполуки, складені елементи, реагенти, кислоти, основи, дегідратуючі агенти, розчинники та каталізатори, застосовувані у одержанні сполук даного винаходу, є або наявними у продажу, або їх можна одержати за методами органічного синтезу, відомими фахівцеві у даній галузі техніки (Houben-Weyl 4th Ed. 1952, Methods of Organic Synthesis, Thieme, Volume 21). Крім того, сполуки даного винаходу можна одержати за методами органічного синтезу, відомими фахівцям у даній галузі техніки, як показано у наступних прикладах. Якщо не зазначено інше, вихідні сполуки є звичайно доступними з комерційних джерел, таких як Aldrich Chemicals Co. (Milwaukee, Wis.), Lancaster Synthesis, Inc. (Windham, N.H.), Acros Organics (Fairlawn, N.J.), Maybridge Chemical Company, Ltd. (Cornwall, England), Tyger Scientific (Princeton, N.J.), Chem-Impex International, Inc. (Wood Dale, IL) та Astrazeneca Pharmaceuticals (London, England). Скорочення Скорочення, застосовувані у наступних прикладах, мають відповідні значення, перераховані нижче. AcOH водн. ax Boc соляний розчин ушир.с CDCl3 CHCl3-d оцтова кислота водний аксіальний трет-бутоксикарбоніл насичений (при кімнатній температурі) розчин хлориду натрію уширений синглет дейтерований хлороформ дейтерований хлороформ 17 UA 114001 C2 CH2Cl2 CH3CN конц. CsF CuSO4 д DIPEA DME ДМФА ДМСО ДМСО-d6 dppf eq ESI-МС Et2O EtOH EtOAc год. Hyflo 1 H-ЯМР KOAc KHSO4 K2CO3 РХ/МС LDA MeOH MgSO4 M м МС хвил. мл Т.пл. MgSO4 МГц н. NaHMDS ЯМР NEt3 Na2S2O3 Na2SO4 Pd2(dba)3 PdCl2(dppf) PdCl2(dppf)-CH2Cl2 PPh3 Pd(PPh3)4 Pd квінт. Raney-Ni RT Rf Rt с SiO2 т TBAF TBDPSCl дихлорметан ацетонітрил концентрований фторид цезію сульфат міді дублет діізопропілетиламін диметоксиетан N, N-диметилформамід диметилсульфоксид дейтерований диметилсульфоксид 1,1'-біс(дифенілфосфіно)фероцен екваторіальний електроспрей мас-спектрометрія діетиловий ефір етанол етилацетат година (години) Hyflo Super Cel протонний ядерний магнітний резонанс ацетат калію гідросульфат калію карбонат калію рідинна хроматографія-мас-спектрометрія літійдіізопропіламін метанол сульфат магнію молярний мультиплет мас-спектрометрія хвилина (хвилини) мілілітр (мілілітри) температура плавлення сульфат магнію мегагерц нормальний гексаметилдисилазан натрію ядерний магнітний резонанс триетиламін тіосульфат натрію сульфнат натрію тріс(дибензиліденацетон)дипаладій(0) дихлорид 1,1'-біс(дифенілфосфіно)фероцен-паладію(II) дихлорметановий комплекс дихлориду 1,1'біс(дифенілфосфіно)фероцен-паладію (II) трифенілфосфін тетракіс(трифенілфосфін)паладій паладій квінтет нікель Ренея кімнатна температура фактор утримання на ТШХ час утримання синглет силікагель триплет фторид тетрабутиламонію трет-бутилдифенілсилілхлорид 18 UA 114001 C2 TBME TFA ТГФ ТШХ tR УФ НЕРХ 5 10 15 20 25 30 35 40 45 трет-бутилметиловий ефір трифтороцтова кислота тетрагідрофуран тонкошарова хроматографія час утримання ультрафіолетовий надефективна рідинна хроматографія Загальні способи 1 TM H-ЯМР вимірювання здійснювали на спектрометрі Bruker Ultrashield 400 (400 МГц), Bruker TM Ultrashield 600 (600 МГц) або 500 MHz DRX Bruker CryoProbe (500 МГц), застосовуючи або не застосовуючи триметилсилан як внутрішній стандарт. Хімічні зсуви (d-величини) приводили у м.ч. у бік слабкого поля від тетраметилсилану, константи зв'язування (J) зазначені у Гц, структура розщеплення спектру позначена як синглет (с), дублет (д), дублет дублетів (дд), триплет (т), квадруплет (кв), мультиплет або більше сигнали, що перекриваються (м), уширений синглет (ушир.). Розчинники зазначені у дужках. ТШХ проводили з попередньо покритими силікагелем 60 F 254 скляними пластинками (Merck, Darmstadt, Germany), застосовуючи відповідно названі системи розчинників. Візуалізацію звичайно здійснюють в УФ світлі (254 нм). РХ/МС РХ/МС-спосіб 1 Колонка: Acquity HSS T3, 1,8 мкм, 2,150 мм; елюент: вода (+0,05 % мурашина кислота +3,75 мМ ацетат амонію):ацетонітрил (+0,04 % мурашина кислота), від 95:5 до 2:98 впродовж 1,4 хвилини, витримування 98 % впродовж 0,75 хвилини; швидкість потоку/температура: 1,0 мл/хвил. при 60C. РХ/МС-спосіб 2 Колонка: Acquity HSS T3, 1,8 мкм, 2,150 мм; елюент: вода (+0,05 % мурашина кислота + 3,75 мМ ацетат амонію):ацетонітрил (+0,04 % мурашина кислота), від 98:2 до 2:98 впродовж 1,4 хвилини, витримування 98 % впродовж 0,75 хвилини; швидкість потоку/температура: 1,2 мл/хвил. при 50C. НЕРХ 1 Колонка: Acquity НЕРХ HSS T3 C18, 1,7 мкм 2,150 мм, потік: 1,0 мл/хвил.; градієнт: 5-100 % B впродовж 1,5 хвилини, 100 % B впродовж 1 хвилини, A = вода + 0,1 % TFA, B = ацетонітрил + 0,1 % TFA; детекція: 218 нм або 254 нм. Одержання проміжного боронового ефіру Проміжний бороновий ефір, застосовуваний у одержанні сполук даного винаходу, є або таким, що наявний у продажу, або його можна отримати, як описано у літературі або аналогічним способом, або його можна отримати, як описано у даному винаході нижче або аналогічним способом. Проміжна сполука 1: 5-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-4-трифторметил)піримідин-2-амін a) 5-бром-4-трифторметил-піримідин-2-іламін До розчину 2-аміно-4-трифторметилпіримідину (25 г, 0,15 моль) у CH3CN (600 мл) додавали у темноті розчин N-бромсукциніміду (34,8 г, 195 ммоль) у ацетонітрилі (200 мл) впродовж 2,5 години. Реакційну суміш перемішували впродовж 4,5 годин при кімнатній температурі, та потім випарювали. Залишок розчиняли у EtOAc та H2O, органічні розчинники відділяли, промивали H2O та соляним розчином, сушили над Na2SO4, фільтрували та концентрували. Залишок очищали колонковою хроматографією, застосовуючи EtOAc у гексані від 10 % до 40 %, 19 UA 114001 C2 5 10 15 20 25 30 35 40 45 50 отримуючи зазначену у заголовку сполуку у вигляді бежевого твердого залишку (31,2 г, 85 %). РХ/МС: Rt 0,82 хвилини; (РХ/МС спосіб 2). b) 5-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-4-(трифторметил)піримідин-2-амін До суспензії 5-бром-4-трифторметилпіримідин-2-іламіну (16,2 г, 66,3 ммоль), біспінаколатодибору (18,5 г, 72,9 ммоль) та KOAc (19,5 г, 199 ммоль) у діоксані (300 мл) у атмосфері аргону додавали адукт PdCl2(dppf)CH2Cl2 (2,44 г, 2,98 ммоль), та суміш перемішували впродовж 4 годин при 115C. Реакційну суміш охолоджували до 50C та обробляли EtOAc. Отриману у результаті суспензію фільтрували через Hyflo та промивали EtOAc. Об'єднаний фільтрат концентрували. Залишок суспендували у 2M NaOH, перемішували при кімнатній температурі впродовж 5 хвилин, та потім додавали Et2O та H2O. Подвійну суміш знову фільтрували через Hyflo, та фази розділяли. pH отриманого у результаті водного шару доводили до 5-6 4M водної HCl, та продукт екстрагували EtOAc. Об'єднані екстракти промивали H2O та соляним розчином, сушили над Na2SO4, фільтрували та концентрували. Залишок розтирали у суміші Et2O/гексан, відфільтровували та сушили, отримуючи зазначену у заголовку сполуку у вигляді світло-жовтого твердого залишку (8,33 г, 42 %). РХ/МС: [M+H] 290,2; Rt 1,00 хвилини; (РХ/МС спосіб 2). Одержання оксазолідинонових проміжних сполук Проміжна сполука 2: (4S*,5S*)-4-етил-5-(4-метоксифеніл)оксазолідин-2-он a) (1S*,2S*)-1-(4-метоксифеніл)-2-нітробутан-1-ол До розчину LiAlH4 (2М у ТГФ) (1,84 мл, 3,67 ммоль) у сухому ТГФ (100 мл), який перемішували впродовж 30 хвилин при 0C, додавали 1-нітропропан (16,3 мл, 184 ммоль) у атмосфері аргону. Через 30 хвилин додавали однією порцією 4-метоксибензальдегід (4,45 мл, 36,7 ммоль). Суміш перемішували впродовж 6 годин при 0C та 18 годин при кімнатній температурі. Реакційну суміш гасили HCl (1M у H 2O) та екстрагували CH2Cl2. Органічні шари промивали соляним розчином, сушили над MgSO 4, фільтрували та концентрували. Залишок очищали колонковою хроматографією, застосовуючи CH2Cl2 у гексані від 0 % до 100 %, отримуючи зазначену у заголовку сполуку (1,4 г, 34 %). 1 H-ЯМР (600 МГц, ДМСО-d6): δ 7,35 (д, 2H), 6,94 (д, 2H), 5,94 (д, 1 H), 4,80 (дд, 1H), 4,68-4,52 (м, 1H), 3,76 (с, 3H), 1,75-1,69 (м, 1H), 1,25-1,20 (м, 1H), 0,74 (т, 3H). b) (1S*,2S*)-2-аміно-1-(4-метоксифеніл)бутан-1-ол Розчин (1S*,2S*)-1-(4-метоксифеніл)-2-нітробутан-1-олу (1,0 г, 4,44 ммоль) у етанолі (20 мл) продували аргоном та додавали при кімнатній температурі Pd/C (100 мг, 0,094 ммоль). Потім герметичну посудину продували та заповнювали H2, та реакційну суміш перемішували при кімнатній температурі впродовж 18 годин. Реакційну суміш фільтрували через целіт, промивали етанолом та концентрували. Залишок очищали колонковою хроматографією, застосовуючи CH2Cl2/MeOH/(NH4OH у H2O) від 100:0:0 до 80:20:1, отримуючи зазначену у заголовку сполуку у вигляді білого твердого залишку (450 мг, 51,4 %). РХ/МС: [M+H] 196,1; Rt 0,44 хвилини; (РХ/МС спосіб 2). c) (4S*,5S*)-4-етил-5-(4-метоксифеніл)оксазолідин-2-он До розчину (1S*,2S*)-2-аміно-1-(4-метоксифеніл)бутан-1-олу (440 мг, 2,25 ммоль) у CH2Cl2 (15 мл) додавали у атмосфері аргону NEt3 (0,78 мл, 5,63 ммоль) при 0C. Потім додавали дифосген впродовж 5 хвилин, та температуру підтримували рівною 0C впродовж 30 хвилин. Реакційну суміш гасили льодяною водою та 2M водним розчином Na2CO3, екстрагували CH2Cl2, сушили над Na2SO4, фільтрували та концентрували. Залишок розтирали з TBME, фільтрували та сушили, отримуючи проміжну сполуку 2, [(4S*,5S*)-4-етил-5-(4-метоксифеніл)оксазолідин-2он], у вигляді білого порошку (220 мг, 44 %). РХ/МС: [M+H] 222,2; Rt 0,77 хвилини; (РХ/МС спосіб 2). 1 H-ЯМР (600 МГц, ДМСО-d6): δ 7,94 (ушир.с, 1H), 7,32 (д, 2H), 6,96 (д, 2H), 5,06 (д, 1H), 3,74 (с, 3H), 3,51 (кв., 1H), 1,53 (кв.т, 2H), 0,85 (т, 3H). 20 UA 114001 C2 Проміжна сполука 3: (4S*,5S*)-4-етил-5-(3-метоксифеніл)оксазолідин-2-он 5 Зазначену у заголовку сполуку отримували згідно зі способом, описаним для проміжної сполуки 2, [(4R*,5R*)-4-етил-5-(4-метоксифеніл)оксазолідин-2-ону], отримуючи проміжну сполуку 3 у вигляді безбарвного масла. РХ/МС: [M+H] 222,1; Rt 0,79 хвилини; (РХ/МС спосіб 2). 1 H-ЯМР (600 МГц, ДМСО-d6): δ 7,98 (ушир.с, 1H), 7,35-7,29 (м, 1H), 6,83-6,96 (м, 3H), 5,10 (д, 1H), 3,72-3,78 (м, 3H), 3,36-3,29 (м, 1H), 1,49-1,63 (м, 2H), 0,88 (т, 3H). Проміжна сполука 4: (4S*,5R*)-4-етил-5-фенілоксазолідин-2-он 10 Зазначену у заголовку сполуку отримували згідно зі способом, описаним для проміжної сполуки 2, [(4R*,5R*)-4-етил-5-(4-метоксифеніл)оксазолідин-2-ону], отримуючи проміжну сполуку 4 у вигляді білого твердого залишку. РХ/МС: [M+H] 192,1; Rt 0,77 хвилини; (РХ/МС спосіб 2). Проміжна сполука 5: (4S, 5S)-4-метил-5-фенілоксазолідин-2-он 15 До розчину (1S, 2S)-(+)-норпсевдоефедрину (2,00 г, 13,2 ммоль) у CH2Cl2 (60 мл) додавали у атмосфері аргону Et3N (4,61 мл, 33,1 ммоль) при 0C. Потім повільно додавали трифосген (1,57 г, 5,29 ммоль), розчинений у 20 мл CH2Cl2, та температуру підвищували від 0C до кімнатної температури. Реакційну суміш перемішували впродовж 4 годин при кімнатній температурі. Потім реакційну суміш гасили додаванням водного NH4Cl. Органічні шари відділяли, сушили над MgSO4, фільтрували та концентрували. Залишок очищали колонковою хроматографією, застосовуючи EtOAc у гептані від 0 % до 100 % для того, щоб отримати потрібний продукт (2,10 г, 89 %). РХ/МС: [M+H] 178,1; Rt 0,67 хвилини; (РХ/МС спосіб 2). 1 H-ЯМР (400 МГц, ДМСО-d6) 7,88 (ушир.с, 1H), 7,50-7,32 (м, 5H), 5,09 (д, 1H), 3,78-3,62 (м, 1H), 1,26 (д, 3H). Проміжна сполука 6: (4S, 5R)-4-етил-5-(тіазол-2-іл)оксазолідин-2-он 20 25 21 UA 114001 C2 5 10 15 20 25 30 35 40 45 50 55 a) (S)-2-(((бензилокси)карбоніл)аміно)бутанова кислота До розчину (S)-2-амінобутанової кислоти (11,2 г, 109 ммоль) у ТГФ (200 мл) та 2М водного розчину карбонату натрію (65,2 мл, 130 ммоль) додавали по краплям при 0C бензилхлорформіат (17,06 мл, 119 ммоль). Після перемішування при кімнатній температурі впродовж 16 годин, реакційну суміш екстрагували H 2O/TBME, водний шар підкисляли HCl (2M у H2O) до pH=2 та екстрагували EtOAc. Органічний шар сушили над Na 2SO4, фільтрували, та фільтрат концентрували, отримуючи зазначену у заголовку сполуку (22,8 г, 77 %) у вигляді безбарвного масла. Продукт застосовували на наступній стадії без додаткового очищення. РХ/МС: [M-H] 236,2; Rt 0,76 хвилини; (РХ/МС спосіб 1). b) (S)-метил-2-(((бензилокси)карбоніл)аміно)бутаноат До розчину (S)-2-(((бензилокси)карбоніл)аміно)бутанової кислоти (10,0 г, 42,1 ммоль) у метанолі (100 мл) та толуолі (300 мл) додавали по краплям при кімнатній температурі у атмосфері аргону триметилсилілдіазометан (23,2 мл, 46,4 ммоль). Після перемішування при кімнатній температурі впродовж 1 години, реакційну суміш концентрували, та залишок екстрагували розчином EtOAc та соляним розчином. Об'єднані органічні шари сушили над Na2SO4, фільтрували та фільтрат концентрували. Залишок очищали колонковою хроматографією (120 г SiO2), застосовуючи EtOAc у гексані від 0 % до 30 % для того, щоб отримати зазначену у заголовку сполуку (5,2 г, 48 %) у вигляді безбарвного масла. РХ/МС: [M+H] 252,1; Rt 0,93 хвилини; (РХ/МС спосіб 1). c) (S)-бензил-(1-оксобутан-2-іл)карбамат До розчину (S)-метил-2-(((бензилокси)карбоніл)аміно)бутаноату (2,0 г, 7,96 ммоль) у толуолі (50 мл) додавали по краплям при -78C у атмосфері аргону DIBAL-H (1M у толуолі) (15,9 мл, 15,9 ммоль) впродовж 20 хвилин, та реакційну суміш перемішували при -78C впродовж 1 години. Реакційну суміш гасили при -78C водним 1,5M розчином тартрату калію (20 мл), та температуру підвищували до кімнатної температури. Реакційну суміш екстрагували розчином EtOAc та соляним розчином. Об'єднані органічні шари сушили над Na 2SO4, фільтрували та концентрували. Залишок очищали колонковою хроматографією (24 г SiO 2), застосовуючи EtOAc у гексані від 0 % до 30 % для того, щоб отримати зазначену у заголовку сполуку (1,18 г, 64 %) у вигляді безбарвного масла. РХ/МС: [M+H] 222,2; Rt 1,01 хвилини; (РХ/МС спосіб 1). 1 H-ЯМР (400 МГц, CHCl3-d): δ 9,61 (с, 1H), 7,27-7,43 (м, 5H), 5,39 (ушир.с, 1H), 5,15 (м, 2H), 4,15 (кв., 1H), 1,96-2,11 (м, 1H), 1,64-1,82 (м, 1H), 1,01-0,79 (м, 3H). d) бензил-((1R, 2S)-1-гідрокси-1-(тіазол-2-іл)бутан-2-іл)карбамат До розчину (S)-бензил-(1-оксобутан-2-іл)карбамату (1,1 г, 4,97 ммоль) у дихлорметані (30 мл) додавали по краплям при -30C у атмосфері аргону 2-(триметилсиліл)тіазол (939 мкл, 5,97 ммоль) впродовж 10 хвилин. Потім реакційну суміш перемішували при -30C впродовж 20 хвилин, нагрівали до кімнатної температури та перемішували при кімнатній температурі впродовж 2 годин. Потім реакційну суміш випарювали при 30C та розчиняли у ТГФ (30 мл). Додавали при 0C у атмосфері аргону TBAF (1M у ТГФ) (5,97 мл, 5,97 ммоль), та реакційну суміш перемішували при кімнатній температурі впродовж 2 годин. Реакційну суміш концентрували, та залишок екстрагували EtOAc. Об'єднані органічні шари промивали водним карбонатом натрію, водою та соляним розчином, сушили над Na 2SO4, фільтрували та фільтрат концентрували. Залишок очищали колонковою хроматографією (24 г SiO 2), застосовуючи EtOAc у гексані від 0 % до 30 % для того, щоб отримати зазначену у заголовку сполуку (1,18 г, 64 %) у вигляді безбарвного масла. Залишок очищали колонковою хроматографією (24 г SiO 2), застосовуючи MeOH у CH2Cl2 гексан від 0 % до 4 % для того, щоб отримати зазначену у заголовку сполуку (340 мг, 43 %) у вигляді безбарвного масла. РХ/МС: [M+H] 307,5; Rt 0,86 хвилини; (РХ/МС спосіб 1). e) (1R, 2S)-2-аміно-1-(тіазол-2-іл)бутан-1-ол До розчину бензил-((1R, 2S)-1-гідрокси-1-(тіазол-2-іл)бутан-2-іл)карбамату (330 мг, 1,077 ммоль) у ацетонітрилі (25 мл) при 0C у атмосфері аргону додавали піперидин (0,213 мл, 2,154 ммоль) та по краплям йодтриметилсилан (293 мкл, 2,15 ммоль) впродовж 5 хвилин. Потім температуру реакційної суміші підвищували до кімнатної температури та перемішували при кімнатній температурі впродовж 2 годин. До реакційної суміші додавали при 0C тіосульфат натрію (500 мг), з наступним додаванням води (0,5 мл), та реакційну суміш енергійно перемішували при 0C впродовж 15 хвилин. Додавали додаткові 500 мг тіосульфату натрію, та суміш розводили EtOAc (50 мл), сушили над Na 2SO4, фільтрували та концентрували. Залишок розтирали EtOAc, фільтрували, та фільтрат концентрували, отримуючи зазначену у заголовку сполуку (250 мг, 67 %) у вигляді жовтого масла. 22 UA 114001 C2 5 10 15 20 25 30 35 40 f) (4S, 5R)-4-етил-5-(тіазол-2-іл)оксазолідин-2-он Зазначену у заголовку сполуку отримували з (1R, 2S)-2-аміно-1-(тіазол-2-іл)бутан-1-олу згідно зі способом, описаним для проміжної сполуки 2, отримуючи проміжну сполуку 6 (410 мг, 95 %) у вигляді коричневого масла. Даний продукт застосовували на наступній реакційній стадії без додаткового очищення. Проміжна сполука 7: 4-етил-5-піридин-3-ілоксазолідин-2-он a) 2-Нітро-1-піридин-3-ілбутан-1-ол До розчину LiAlH4 (2M у ТГФ) (0,93 мл, 1,87 ммоль) у сухому ТГФ (80 мл) при 0C повільно додавали 1-нітропропан (8,30 мл, 93 ммоль) у атмосфері аргону. Через 60 хвилин додавали однією порцією нікотинальдегід (2,00 г, 18,7 ммоль). Суміш перемішували впродовж 16 годин, підвищуючи температуру від 0C до кімнатної температури. Реакційну суміш гасили додаванням 1 мл 2M водної HCl, з наступним додаванням 4 грам Na2SO4. Отриману у результаті суспензію перемішували впродовж 15 хвилин та потім фільтрували. Фільтрат концентрували. Залишок очищали колонковою хроматографією (40 г SiO 2), застосовуючи EtOAc у гексані від 0 % до 100 % для того, щоб отримати зазначену у заголовку сполуку у вигляді білого твердого залишку (2,6 г, 71 %) у вигляді суміші діастереоізомерів A та B. РХ/МС: [M+H] 197,1; Rt 0,52 хвилини; (РХ/МС спосіб 1). 1 A) H-ЯМР (400 МГц, CHCl3-d): δ 8,70-8,60 (м, 2H), 7,80-7,74 (м, 1H), 7,42-7,32 (м, 1H), 5,28 (дд, 1H), 4,70-4,58 (м, 1H), 2,97 (д, 1H), 2,29-2,12 (м, 1H), 1,65-1,42 (м, 1H), 0,99 (т, 3H). 1 B) H-ЯМР (400 МГц, CHCl3-d): δ 8,70-8,60 (м, 2H), 7,80-7,74 (м, 1H), 7,42-7,32 (м, 1H), 5,15 (дд, 1H), 4,70-4,58 (м, 1H), 2,81 (д, 1H), 1,99-1,85 (м, 1H), 1,65-1,42 (м, 1H), 0,94 (т, 3H). b) 2-аміно-1-піридин-3-ілбутан-1-ол Розчин 2-нітро-1-піридин-3-ілбутан-1-олу (1,0 г, 4,44 ммоль) у етанолі (20 мл) продували аргоном, та додавали при кімнатній температурі 100 мг нікелю Ренея. Реакційну суміш три рази вакуумували та заповнювали воднем. Реакційну суміш перемішували впродовж 16 годин при кімнатній температурі. Потім нікель Ренея відфільтровували через Hyflo, та Hyflo промивали EtOH. Потім фільтрат випарювали. Залишок очищали колонковою хроматографією (40 г SiO 2), застосовуючи MeOH у CH2Cl2 від 0 % до 100 % для того, щоб отримати зазначену у заголовку сполуку у вигляді жовтого масла (180 мг, 21 %). РХ/МС: [M+H] 167,1; Rt 0,21 хвилини; (РХ/МС спосіб 1). c) 4-етил-5-піридин-3-ілоксазолідин-2-он До розчину 2-аміно-1-піридин-3-ілбутан-1-олу (150 мг, 0,90 ммоль) у CH2Cl2 (5 мл) додавали у атмосфері аргону NEt3 (314 мкл, 5,63 ммоль) при 0C. Потім додавали впродовж 5 хвилин дифосген, та температуру підвищували від 0C до кімнатної температури впродовж 2 годин. Реакційну суміш гасили льодяною водою та 2M розчином Na 2CO3, екстрагували CH2Cl2, сушили над MgSO4, фільтрували та концентрували. Залишок очищали колонковою хроматографією, застосовуючи EtOAc у гептані від 0 % до 100 % для того, щоб отримати зазначену у заголовку сполуку (100 мг, 58 %) у вигляді суміші діастереоізомерів A та B. РХ/МС: [M+H] 193,1; Rt 0,43 хвилини; (РХ/МС спосіб 1). 1 A) H-ЯМР (400 МГц, CHCl3-d): δ 8,70-8,62 (м, 1H), 8,60-8,56 (м, 1H), 7,76-7,71 (м, 1H), 7,427,35 (м, 1H), 5,78 (д, 1H), 4,08-3,98 (м, 1H), 1,21-1,05 (м, 2H), 0,84 (т, 3H). 1 B) H-ЯМР (400 МГц, CHCl3-d): δ 8,70-8,62 (м, 2H), 7,80-7,76 (м, 1H), 7,42-7,35 (м, 1H), 5,21 (д, 1H), 3,75-3,68 (м, 1H), 1,89-1,69 (м, 2H), 1,05 (т, 3H). 45 Проміжна сполука 8: 4-метил-5-піридин-3-ілоксазолідин-2-он 23 UA 114001 C2 5 10 15 20 25 30 35 40 45 50 a) 2-нітро-1-піридин-3-іл-пропан-1-ол До розчину LiAlH4 (2M у ТГФ) (1,4 мл, 2,8 ммоль) у сухому ТГФ (110 мл) при 0C повільно додавали 1-нітроетан (2,00 мл, 28 ммоль) у атмосфері аргону. Через 20 хвилин при 0C додавали однією порцією нікотинальдегід (2,64 мл, 28 ммоль). Суміш перемішували впродовж 16 годин, підвищуючи температуру від 0C до кімнатної температури. Реакційну суміш гасили додаванням 5 мл 1M HCl, з наступним додаванням CH2Cl2 та Na2SO4. Отриману у результаті суспензію перемішували впродовж 15 хвилин та потім фільтрували. Фільтрат концентрували. Потім залишок очищали колонковою хроматографією (40 г SiO 2), застосовуючи EtOAc у гексані від 0 % до 100 % для того, щоб отримати продукт у вигляді масла (3,2 г, 63 %) у вигляді суміші діастереоізомерів. РХ/МС: [M+H] 183,4; Rt 0,41 хвилини; (РХ/МС спосіб 1). 1 A) H-ЯМР (400 МГц, CHCl3-d): δ 8,58-8,48 (м, 2H), 7,68 (д, 1H) 7,33-7,23 (м, 1H) 5,42-5,38 (м, 1H), 4,70-4,60 (м, 1H), 3,30-2,90 (ушир.с, 1H), 1,46 (д, 3H). 1 B) H-ЯМР (400 МГц, CHCl3-d): δ 8,58-8,48 (м, 2H), 7,68 (д, 1H) 7,33-7,23 (м, 1H) 5,04 (д, 1H), 4,76-4,69 (м, 1H), 3,30-2,90 (ушир.с, 1H), 1,31 (д, 3H). b) 4-Метил-5-піридин-3-ілоксазолідин-2-он Розчин 2-нітро-1-піридин-3-ілбутан-1-олу (3,20 г, 17,6 ммоль) у етанолі (90 мл) продували аргоном, та додавали при кімнатній температурі 200 мг нікелю Ренея. Реакційну суміш три рази вакуумували та заповнювали воднем. Реакційну суміш перемішували впродовж 16 годин у атмосфері H2 при кімнатній температурі. Потім нікель Ренея відфільтровували через Hyflo, та Hyflo промивали EtOH. Потім фільтрат випарювали для того, щоб отримати 2-аміно-1-піридин-3іл-пропан-1-ол як продукт (2,35 г, 88 %), який застосовували на наступній реакційній стадії без очищення. До розчину 2-аміно-1-піридин-3-іл-пропан-1-олу (700 мг, 4,60 ммоль) у CH2Cl2 (20 мл) додавали у атмосфері аргону Et3N (1,60 мл, 11,5 ммоль) при 0C, з наступним додаванням трифосгену (819 мг, 2,76 ммоль, розчинені у 5 мл CH 2Cl2). Реакційну температуру підвищували від 0C до кімнатної температури впродовж однієї години. Потім реакційну суміш гасили льодяною водою та 2М розчином Na2CO3, екстрагували CH2Cl2, сушили над MgSO4, фільтрували та концентрували. Залишок очищали колонковою хроматографією, застосовуючи EtOAc у гексані від 0 % до 100 % для того, щоб отримати продукт (160 мг, 20 %). РХ/МС: [M+H] 179,1; Rt 0,31 хвилини; (РХ/МС спосіб 1). Проміжна сполука 9: (4S, 5S)-4-((трет-бутилдифенілсилілокси)метил)-5-феніл-оксазолідин-2он a) (4S, 5S)-4-гідроксиметил-5-фенілоксазолідин-2-он (1S, 2S)-2-Аміно-1-фенілпропан-1,3-діол (20,0 г, 120 ммоль), діетилкарбонат (29,7 мл, 245 ммоль) та K2CO3 (1,65 г, 12,0 ммоль) загружали у колбу з магнітною мішалкою та колонкою вігре. Дану суспензію нагрівали у масляній бані при 135C, отримуючи жовтий розчин. Накопичений EtOH відганяли через колонку вігре. Реакційну суміш перемішували впродовж 3 годин, до того як неможна були відігнати EtOH. Потім реакційну суміш охолоджували до 50C, розводили EtOAc та водним NaHCO3. Органічні шари відділяли, промивали соляним розчином, сушили над MgSO4, фільтрували та концентрували. Залишок очищали колонковою хроматографією (550 г SiO2), застосовуючи EtOAc у гептані від 33 % до 100 % для того, щоб отримати зазначену у заголовку сполуку у вигляді бежевого масла (7,50 г, 33 %). 1 H-ЯМР (400 МГц, ДМСО-d6): δ 7,87 (ушир.с, 1H), 7,50-7,30 (м, 5H), 5,37 (д, 1H), 5,23-5,17 (м, 1H), 3,70-3,60 (м, 1H), 3,60-3,50 (м, 2H). b) (4S, 5S)-4-((трет-бутилдифенілсилілокси)метил)-5-фенілоксазолідин-2-он До розчину (4S, 5S)-4-гідроксиметил-5-фенілоксазолідин-2-ону (3,50 г, 17,2 ммоль), NEt3 (4,80 мл, 34,4 ммоль) та DMAP (105 мг, 861 мкмоль) у ДМФА (20 мл) додавали по краплям TBDPSCl (4,86 мл, 18,9 ммоль) при кімнатній температурі. Реакційну суміш перемішували впродовж 3 годин при кімнатній температурі. Потім реакційну суміш випарювали та розводили TBME, Органічні шари відділяли, промивали водним NaHCO3 та соляним розчином, сушили над 24 UA 114001 C2 5 10 15 20 25 30 35 MgSO4 та концентрували. Залишок очищали колонковою хроматографією (120 г SiO 2), застосовуючи EtOAc у гептані від 0 % до 60 % для того, щоб отримати зазначену у заголовку сполуку у вигляді білого твердого залишку (4,28 г, 57 %). РХ/МС: [M+H] 432,2; Rt 1,36 хвилини; (РХ/МС спосіб 2). Проміжна сполука 10: (4S, 5S)-4-(((трет-бутилдифенілсиліл)окси)метил)-5-(4метоксифеніл)оксазолідин-2-он До розчину (4S, 5S)-4-(гідроксиметил)-5-(4-метоксифеніл)оксазолідин-2-ону [545435-91-4] (0,68 г, 3,05 ммоль) та імідазолу (0,249 г, 3,66 ммоль) у ДМФА (10 мл) додавали по краплям TBDPSCl (0,97 мл, 3,66 ммоль) при 0-5C. Реакційну суміш нагрівали до кімнатної температури та перемішували впродовж ночі при кімнатній температурі. Реакційну суміш концентрували, та решту масла розчиняли у TBME та промивали 10 % водним KHSO4, H2O, насиченим розчином NaHCO3 та соляним розчином, сушили над MgSO4, фільтрували та концентрували. Залишок очищали колонковою хроматографією, застосовуючи EtOAc у гептані від 5 % до 50 % для того, щоб отримати зазначену у заголовку сполуку у вигляді білої піни (1,62 г, 55 %). ТШХ (гептан/EtOAc 1:1) Rf=0,44; РХ/МС: [M+H] 462; Rt 1,36 хвилини; (РХ/МС спосіб 2). 1 H-ЯМР (400 МГц, CDCl3): δ 7,65 (д, 4H), 7,35-7,60 (м, 6H), 7,24 (д, 2H), 6,92 (д, 2H), 5,24 (д, 1H), 5,20 (ушир.с, 1H), 3,84 (м, 4H), 3,77 (м, 2H), 1,09 (с, 9H). Проміжна сполука 11: (4S, 5S)-4-(((трет-бутилдиметилсиліл)окси)метил)-5-(4-(2метоксиетокси)феніл)оксазолідин-2-он a) (R)-метил-2-((трет-бутоксикарбоніл)аміно)-3-(4-(2-етоксиетокси)феніл)-пропаноат До суспензії (R)-метил-2-((трет-бутоксикарбоніл)аміно)-3-(4-гідроксифеніл)-пропаноату (4,43 г, 15,00 ммоль), K2CO3 (4,15 г, 30,0 ммоль) та йодиду натрію (112 мг, 750 мкмоль) у ацетонітрилі (100 мл) додавали 1-бром-2-метоксиетан (5,64 мл, 60,0 ммоль), та отриману у результаті суміш перемішували при кип'ятінні із зворотним холодильником впродовж 2 днів. Реакційну суміш розводили TBME та промивали H2O та соляним розчином. Об'єднані екстракти сушили над MgSO4, фільтрували та концентрували, отримуючи зазначену у заголовку сполуку у вигляді жовтого масла (5,3 г, 95 %). ТШХ (толуол/TBME 2:1) Rf=0,44; tR=1,084 хвил. (НЕРХ 1); РХ/МС: [M+H] 354; Rt 1,02 хвилини; (РХ/МС спосіб 2). 1 H-ЯМР (400 МГц, CDCl3): δ 7,05 (д, 2H), 6,88 (д, 2H), 4,96 (br d, 1H), 4,58 (м, 1H), 4,12 (дд, 2H), 3,76 (дд, 2H), 3,73 (с, 3H), 3,47 (с, 3H), 3,05 (м, 2H), 1,44 (с, 9H). b) (4R, 5S)-метил-5-(4-(2-метоксиетокси)феніл)-2-оксооксазолідин-4-карбоксилат До розчину (R)-метил-2-((трет-бутоксикарбоніл)аміно)-3-(4-гідроксифеніл)-пропаноату (5,34 г, 14,35 ммоль) у ацетонітрилі (260 мл) додавали у атмосфері аргону розчин персульфату калію (7,76 г, 28,7 ммоль) у H2O (190 мл) та розчин CuSO4 (0,458 г, 2,87 ммоль), розчиненого у H2O (70 мл). Отриману у результаті суміш перемішували впродовж 3 годин при 70C. Реакційну суміш екстрагували EtOAc. Об'єднані екстракти промивали соляним розчином, сушили над MgSO 4, 25 UA 114001 C2 5 10 15 20 25 30 35 40 фільтрували та концентрували. Залишок очищали колонковою хроматографією, застосовуючи EtOAc у гептані від 20 % до 100 % для того, щоб отримати зазначену у заголовку сполуку у вигляді жовтого масла (2,33 г, 52 %). ТШХ (гептан/EtOAc 1:2) Rf=0,19; tR=0,680 хвилини (НЕРХ 1); РХ/МС: [M+H] 296; Rt 0,68 хвилини; (РХ/МС спосіб 2). 1 H-ЯМР (400 МГц, CDCl3): δ 7,36 (д, 2H), 6,99 (д, 2H), 5,86 (ушир.д, 1H), 5,62 (д, 1H), 4,30 (д, 1H), 4,16 (дд, 2H), 3,88 (с, 3H), 3,79 (дд, 2H), 3,48 (с, 3H). c) (4S, 5S)-4-(гідроксиметил)-5-(4-(2-метоксиетокси)феніл)оксазолідин-2-он До суспензії (4R, 5S)-метил-5-(4-(2-метоксиетокси)феніл)-2-оксооксазолідин-4-карбоксилату (2,30 г, 7,79 ммоль) у EtOH (45 мл) додавали порціями при 0-5C боргідрид натрію (648 мг, 17,1 ммоль). Реакційну суміш перемішували впродовж 0,5 години при кімнатній температурі, та потім підкисляли 4M водною HCl (10 мл) при 0-5C. Реакційну суміш концентрували, та продукт екстрагували EtOAc. Об'єднані екстракти промивали соляним розчином, сушили над MgSO 4, фільтрували та концентрували, отримуючи зазначену у заголовку сполуку у вигляді бежевої піни (1,80 г, 81 %). tR=0,498 хвилини (НЕРХ 1); РХ/МС: [M+H] 268; Rt 0,55 хвилини; (РХ/МС спосіб 2). 1 H-ЯМР (400 МГц, CDCl3): δ 7,31 (д, 2H), 6,96 (д, 2H), 6,45 (ушир.с, 1H), 5,33 (д, 1H), 5,30 (ушир.с, 1H), 3,75-4,30 (м, 7H), 3,47 (с, 3H). d) (4S, 5S)-4-(((трет-бутилдиметилсиліл)окси)метил)-5-(4-(2-метоксиетокси)феніл)оксазолідин-2-он Зазначену у заголовку сполуку отримували аналогічно способу, описаному для проміжного сполуки 10, [(4S, 5S)-4-(((трет-бутилдифенілсиліл)окси)метил)-5-(4-метоксифеніл)оксазолідин-2ону], з (4S, 5S)-4-(гідроксиметил)-5-(4-(2-метоксиетокси)-феніл)оксазолідин-2-ону та TBDMS-Cl, отримуючи після очищення колонковою хроматографією (застосовуючи EtOAc у гептані від 5 % до 50 %) проміжна сполука 11 у вигляді світло-жовтого масла. ТШХ (гептан/EtOAc 1:1) Rf=0,26; tR=1,28 хвилини (НЕРХ 1); РХ/МС: [M+H] 382,2; Rt 1,17 хвилини; (РХ/МС спосіб 2). 1 H-ЯМР (400 МГц, CDCl3): δ 7,30 (д, 2H), 6,97 (д, 2H), 5,44 (ушир.с, 1H), 5,23 (д, 1H), 4,18 (дд, 2H), 3,70-3,85 (м, 5H), 3,48 (с, 3H), 0,91 (с, 9H), 0,11 (с, 6H). Проміжна сполука 12: (4S, 5S)-5-(4-(2-((трет-бутилдиметилсиліл)окси)етокси)-феніл)-4(((трет-бутилдиметилсиліл)окси)метил)оксазолідин-2-он Зазначену у заголовку сполуку отримували аналогічно способу, описаному для проміжного сполуки 11, виходячи з (R)-метил-2-((трет-бутоксикарбоніл)аміно)-3-(4гідроксифеніл)пропаноату та (2-брометокси)(трет-бутил)диметилсилану. ТШХ (гептан/EtOAc 1:1) Rf=0,51; tR=1,764 хвилини (НЕРХ 1); РХ/МС: [M+H] 482; Rt 1,57 хвилини; (РХ/МС спосіб 1). 1 H-ЯМР (400 МГц, CDCl3): δ 7,31 (д, 2H), 6,96 (д, 2H), 5,26 (ушир.с, 1H), 5,22 (д, 1H), 4,13 (м, 2H), 4,00 (м, 2H), 3,79 (м, 1H), 3,67 (м, 2H), 0,93 (с, 9H), 0,92 (с, 9H), 0,11 (м, 12H). Проміжна сполука 13: (4S, 5S)-4-(((трет-бутилдиметилсиліл)окси)метил)-5-(4-(3-((третбутилдиметилсиліл)окси)пропокси)феніл)оксазолідин-2-он Зазначену у заголовку сполуку отримували аналогічно способу, описаному для проміжного сполуки 12, виходячи з (R)-метил-2-((трет-бутоксикарбоніл)аміно)-3-(4 26 UA 114001 C2 5 10 15 20 25 30 35 гідроксифеніл)пропаноату та (3-бромпропокси)(трет-бутил)диметилсилану. ТШХ (гептан/EtOAc 1:1) Rf=0,49; tR=1,832 хвилини (НЕРХ 1); РХ/МС: [M+H] 496; Rt 1,62 хвилини (РХ/МС спосіб 1). 1 H-ЯМР (400 МГц, CDCl3): δ 7,30 (д, 2H), 6,95 (д, 2H), 5,27 (ушир.с, 1H), 5,22 (д, 1H), 4,13 (дд, 2H), 4,00 (м, 2H), 3,80 (м, 3H), 3,74 (м, 2H), 2,01 (м, 2H), 0,93 (с, 9H), 0,91 (с, 9H), 0,10 (с, 6H), 0,06 (с, 6H). Проміжна сполука 14: (4S, 5R)-4-метил-5-тіазол-2-ілоксазолідин-2-он a) трет-Бутиловий ефір (2-гідрокси-1-метил-2-тіазол-2-іл-етил)карбамінової кислоти Boc-L-аланаль (9,99 г, 57,7 ммоль) розчиняли у 200 мл CH2Cl2. Додавали до реакційної суміші при -20C у атмосфері аргону 2-(триметилсиліл)тіазол (9,90 г, 62,9 ммоль), розчинений у 70 мл CH2Cl2. Через 21 годину при -20C реакційну суміш концентрували. Потім залишок розчиняли у 180 мл ТГФ при додавання TBAF (1M у ТГФ, 63,4 мл, 63,4 ммоль), та реакційну суміш перемішували впродовж 4 годин при кімнатній температурі. Потім реакційну суміш випарювали. Залишок очищали колонковою хроматографією (120 г SiO2), застосовуючи EtOAc у гексані від 0 % до 100 % для того, щоб отримати зазначену у заголовку сполуку у вигляді діастереомерної суміші (14,0 г, 93 %). РХ/МС: [M+H] 259,2; Rt 0,78 хвилини; (РХ/МС спосіб 1). b) 2-аміно-1-тіазол-2-іл-пропан-1-ол трет-Бутиловий ефір 2-гідрокси-1-метил-2-тіазол-2-ілетил)карбамінової кислоти (13,8 г, 53,4 ммоль) розчиняли у 50 мл діоксану. Додавали 134 мл (534 ммоль) 4M HCl у діоксані, та реакційну суміш перемішували впродовж 4 годин при кімнатній температурі. Потім реакційну суміш випарювали, та залишок розводили діетиловим ефіром та фільтрували для того, щоб отримати зазначену у заголовку сполуку у вигляді білої солі у вигляді діастереомерної суміші (11,5 г, 92 %). РХ/МС: [M+H] 159,1; Rt 0,22 хвилини; (РХ/МС спосіб 1). c) (4S, 5R)-4-метил-5-тіазол-2-ілоксазолідин-2-он Суміш діастереоізомерів 2-аміно-1-тіазол-2-ілпропан-1-олу (4,20 г, 18,2 ммоль) розчиняли у 160 мл CH2Cl2. Додавали при 0C діізопропілетиламін (11,1 мл, 63,6 ммоль), з наступним додаванням трифосгену (2,70 г, 9,09 ммоль), розчиненого у 40 мл CH2Cl2. Реакційну суміш перемішували при кімнатній температурі впродовж 2 годин, та потім розводили CH 2Cl2. Органічні розчинники відділяли, промивали водним NaHCO 3 та соляним розчином, сушили над MgSO4, фільтрували та концентрували. Залишок очищали колонковою хроматографією (80 г SiO2), застосовуючи EtOAc у гексані від 0 % до 100 % для того, щоб отримати зазначену у заголовку сполуку у вигляді одного енантіомеру (2,16 г, 64 %). РХ/МС: [M+H] 185,3; Rt 0,45 хвилини; (РХ/МС спосіб 1). 1 H-ЯМР (400 МГц, CHCl3-d): δ 7,75 (д, 1H), 7,35 (д, 1H), 5,60 (ушир.с, 1H), 5,32 (д, 1H), 4,184,09 (м, 1H), 1,45 (д, 3H). Проміжна сполука 15: (4S, 5S)-4-метил-5-тіазол-2-ілоксазолідин-2-он 27 UA 114001 C2 5 10 До суміші (1S, 2S)-2-аміно-1-тіазол-2-ілпропан-1-олу та (1R, 2S)-2-аміно-1-тіазол-2-ілпропан1-олу (2,9 г, 12,5 ммоль) у CH2Cl2 (40 мл) додавали у атмосфері аргону NEt3 (10,5 мл, 75 ммоль) при 0C. Потім повільно додавали трифосген (1,86 г, 6,27 ммоль), розчинений у 40 мл CH 2Cl2, та температуру підвищували від 0C до кімнатної температури. Реакційну суміш перемішували впродовж 16 годин при кімнатній температурі. Потім реакційну суміш гасили додаванням водного NaHCO3. Органічні шари відділяли, сушили над MgSO 4, фільтрували та концентрували. Залишок очищали колонковою хроматографією, застосовуючи EtOAc у гептані від 0 % до 100 % для того, щоб отримати потрібний продукт (330 мг, 13 %). РХ/МС: [M+H] 185,0; Rt 0,48 хвилини; (РХ/МС спосіб 1). 1 H-ЯМР (400 МГц, CHCl3-d): δ 7,79 (д, 1H), 7,34 (д, 1H), 5,91 (д, 1H), 5,71 (ушир.с, 1H), 4,484,38 (м, 1H), 0,89 (д, 3H). Одержання прикладів сполук Приклад 1: (4S, 5R)-3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4метил-5-тіазол-2-ілоксазолідин-2-он 15 20 25 30 35 40 a) (4S, 5R)-3-(6-хлор-2-морфолін-4-іл-піримідин-4-іл)-4-метил-5-тіазол-2-іл-оксазолідин-2-он (4S, 5R)-4-Метил-5-тіазол-2-ілоксазолідин-2-он (проміжна сполука 14) (4,70 г, 20,1 ммоль) розчиняли у 70 мл ДМФА та охолоджували до 0C. Додавали у атмосфері аргону NaH (964 мг, 60 % у маслі, 24,1 ммоль), та реакційну суміш перемішували впродовж 30 хвилин при 0C. Додавали 4-(4,6-дихлорпіримідин-2-іл)морфолін (3,70 г, 20,1 ммоль), розчинений у 30 мл ДМФА, та реакційну суміш перемішували впродовж 3 годин при 0C, з наступним перемішуванням при кімнатній температурі впродовж 2 годин. Потім реакцію гасили додаванням водного NH 4Cl, з наступним розведенням EtOAc; органічні розчинники розділяли, промивали соляним розчином, сушили над MgSO4, фільтрували та концентрували. Залишок очищали колонковою хроматографією (80 г SiO2), застосовуючи EtOAc у гексані від 0 % до 100 % для того, щоб отримати зазначену у заголовку сполуку (3,64 г, 48 %). РХ/МС: [M+H] 382,2, 384,1; Rt 1,10 хвилини; (РХ/МС спосіб 1). 1 H-ЯМР (400 МГц, CHCl3-d): δ 7,77 (д, 1H), 7,38-7,33 (м, 2H), 5,39 (д, 1H), 5,07-4,98 (м, 1H), 3,75-3,55 (м, 8H), 1,64 (д, 3H). b) (4S, 5R)-3-(2'-аміно-2-морфолін-4-іл-4'-трифторметил-[4,5']біпіримідиніл-6-іл)-4-метил-5тіазол-2-ілоксазолідин-2-он До розчину (4S, 5R)-3-(6-хлор-2-морфолін-4-іл-піримідин-4-іл)-4-метил-5-тіазол-2ілоксазолідин-2-ону, отриманого на стадії a) (1,30 г, 3,40 ммоль), у 20 мл диметоксиетану додавали у атмосфері аргону 5-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-4(трифторметил)піримідин-2-амін (1,08 г, 3,75 ммоль), PdCl2(dppf)-CH2Cl2 (214 мг, 262 мкмоль) та 2М водним карбонат натрію (5,11 мл, 10,2 ммоль). Реакційну суміш перемішували при 80C впродовж 30 хвилин. Потім реакційну суміш охолоджували до кімнатної температури та розводили 80 мл EtOAc, органічні розчинники промивали водним NH4Cl та соляним розчином, сушили над MgSO4, фільтрували та концентрували. Залишок очищали колонковою хроматографією (80 г SiO2), застосовуючи EtOAc у гексані від 0 % до 100 % для того, щоб отримати приклад 1 у вигляді аморфного твердого залишку (1,20 г, 69 %). РХ/МС: [M+H] 509,0; Rt 0,99 хвилини; (РХ/МС спосіб 1). 1 H-ЯМР (400 МГц, ДМСО-d6): δ 8,58 (с, 1H), 7,92 (д, 1H), 7,87 (д, 1H), 7,64 (ушир.с, 2H), 7,41 (с, 1H), 5,89 (д, 1H), 5,10-5,04 (м, 1H), 3,75-3,55 (м, 8H), 1,62 (д, 3H). 28
ДивитисяДодаткова інформація
Назва патенту англійськоюOxazolidin-2-one-pyrimidine derivatives
Автори англійськоюFairhurst, Robin Alec, Furet, Pascal, Kalthoff, Frank Stephan, Lerchner, Andreas, Rueeger, Heinrich
Автори російськоюФэйрхерст Робин Алэк, Фурэ Паскаль, Калтхофф Франк Стэфан, Лэрхнэр Андрэас, Рюегер Генрих
МПК / Мітки
МПК: C07D 417/14, C07D 413/14, A61K 31/506
Мітки: оксазолідин-2-он-піримідинові, похідні
Код посилання
<a href="https://ua.patents.su/48-114001-oksazolidin-2-on-pirimidinovi-pokhidni.html" target="_blank" rel="follow" title="База патентів України">Оксазолідин-2-он-піримідинові похідні</a>
Попередній патент: Теплообмінник для вилучення тепла із топкових газів
Наступний патент: Закупорювальний пристрій, вузол закупорювання та засіб індикації розкривання пляшки з рідиною
Випадковий патент: Механізм лінійних переміщень