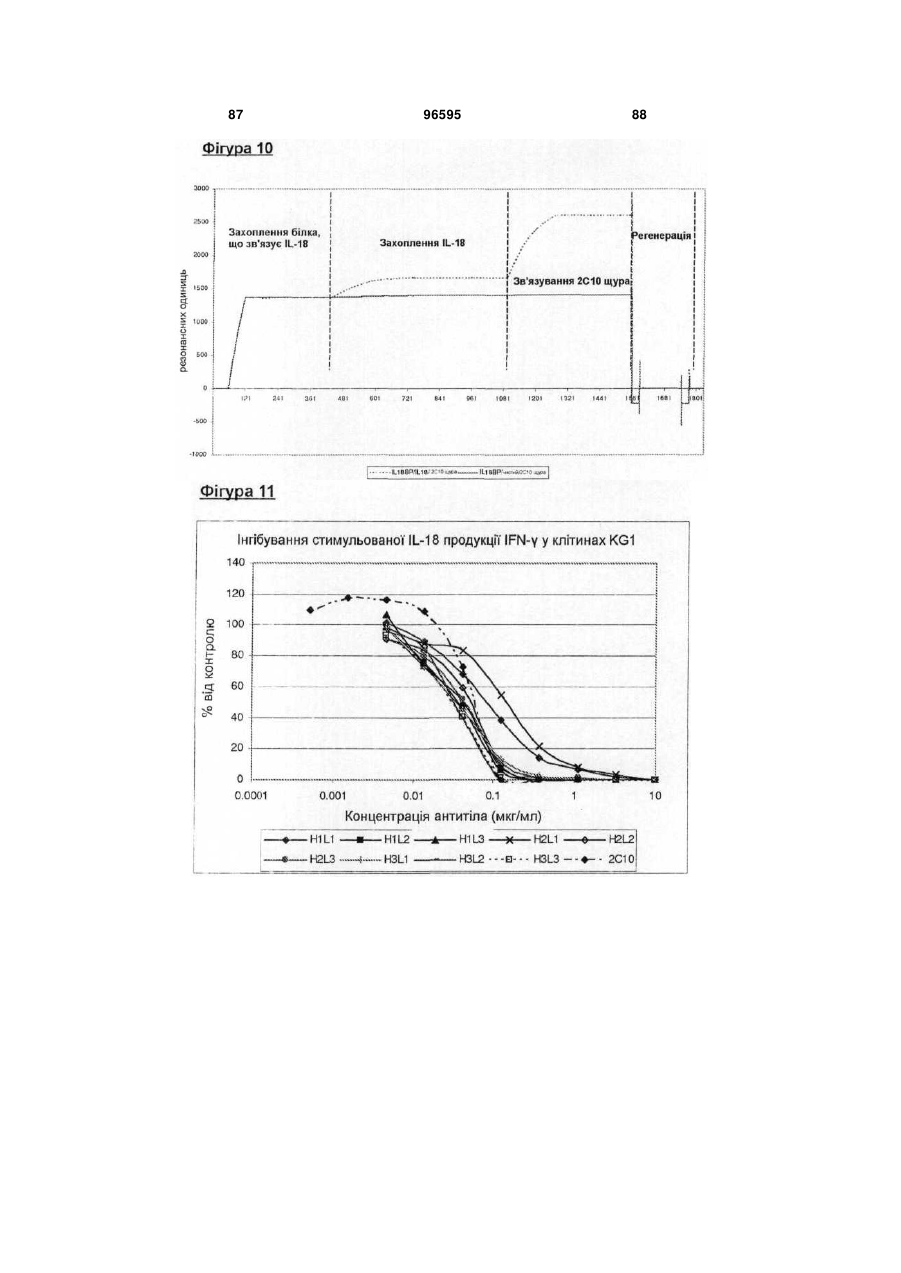
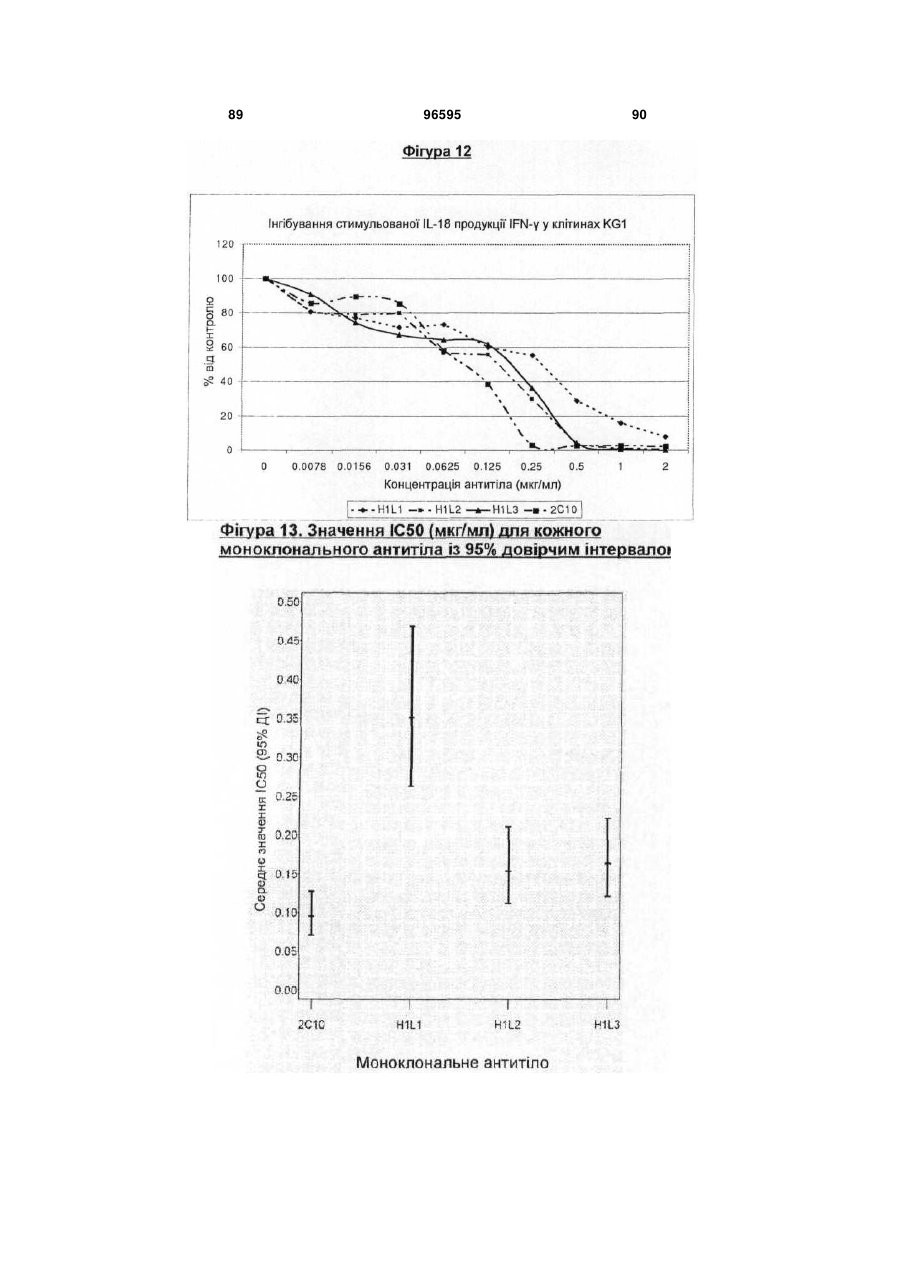
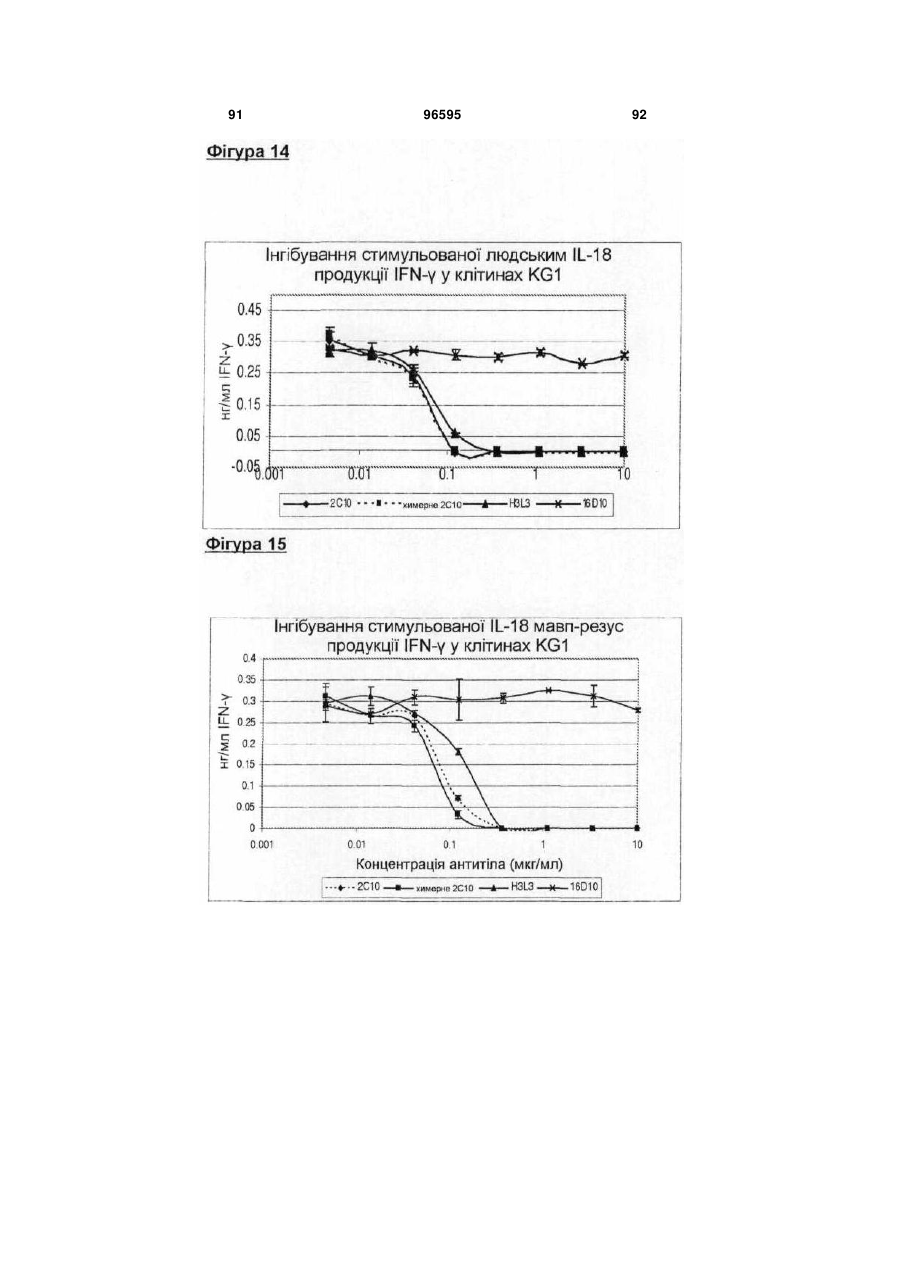
Гуманізоване анти-інтерлейкін-18 антитіло
Номер патенту: 96595
Опубліковано: 25.11.2011
Автори: Амблі Пол Ендрю, Кірбі Ян, ермащевскі Волкер, Елліс Джонатан Генрі
Формула / Реферат
1. Гуманізоване анти-інтерлейкін-18 антитіло, яке включає CDR, які походять від донорного 2С10 антитіла, прищепленого на людський акцепторний каркас, де вказане анти-інтерлейкін-18 антитіло включає CDR, які мають послідовності, що представлені у SEQ ID NO: 1, 2, 3, 4, 5 та 6, та де залишок у положенні 71 легкого ланцюга вказаного анти-інтерлейкін-18 антитіла є ідентичним залишку, який знаходиться у відповідному положенні каркаса донорного 2С10 антитіла (тобто, тирозину); та де вказаний людський акцепторний каркас легкого ланцюга включає каркасні ділянки, що походять від послідовності SEQ ID NO: 38 або її варіанта, що має 75 % або більше ідентичності з каркасом, який має послідовність, представлену у SEQ ID NO: 38; та де анти-інтерлейкін-18 антитіло демонструє константу рівноваги (KD) 90 пМ або менше 90 пМ стосовно людського IL-18 при вимірюванні за допомогою поверхневого плазмонного резонансу (наприклад, Biacore™ Т100) при 37 °С.
2. Гуманізоване анти-інтерлейкін-18 антитіло згідно з пунктом 1, де акцепторний каркас людини включає фенілаланін у положенні 71 людського легкого ланцюга.
3. Гуманізоване анти-інтерлейкін-18 антитіло згідно з пунктом 1, де акцепторний каркас легкого ланцюга людини включає у положенні 71 ароматичну амінокислоту, яка не є тирозином.
4. Гуманізоване анти-інтерлейкін-18 антитіло згідно з будь-яким з попередніх пунктів, де антитіло демонструє константу дисоціації (KD, швидкість дисоціації) 0,0002 (1/с) або менше 0,0002 (1/с) (тобто, повільнішу швидкість дисоціації) стосовно зв'язування з людським IL-18 при вимірюванні за допомогою поверхневого плазмонного резонансу (наприклад, Biacore™ Т100) при 37 °С.
5. Гуманізоване анти-інтерлейкін-18 антитіло згідно з будь-яким з попередніх пунктів, де акцепторний каркас важкого ланцюга має каркасні ділянки, які походять від послідовності, представленої у SEQ ID NO: 37, де один або більше залишків у положенні (положеннях) 27, 28, 29, 93, 39, 40, 36, 71, 89, 91 важкого ланцюга є ідентичним(и) відповідному залишку у важкому ланцюзі донорного антитіла; де акцепторний каркас легкого ланцюга має каркасні ділянки, які мають походження від послідовності, представленої у SEQ ID NO:38, де один або більше залишків у положенні (положеннях) 45, 83, 84, 85 легкого ланцюга є ідентичним(и) відповідному залишку у легкому ланцюзі донорного антитіла.
6. Гуманізоване анти-інтерлейкін-18 антитіло згідно з будь-яким з попередніх пунктів, що включає варіабельну ділянку важкого ланцюга, як представлено у SEQ ID NO: 11, та варіабельну ділянку легкого ланцюга, як представлено у SEQ ID NO: 15.
7. Гуманізоване анти-інтерлейкін-18 антитіло, що включає важкий ланцюг, вибраний з групи, яка складається з SEQ ID NO: 9, SEQ ID NO: 17, SEQ ID NO: 21; та легкий ланцюг, вибраний з групи, яка складається з SEQ ID NO: 13, SEQ ID NO: 29.
8. Гуманізоване анти-інтерлейкін-18 антитіло згідно з пунктом 7, що включає важкий ланцюг послідовності SEQ ID NO:9 та легкий ланцюг послідовності SEQ ID NO: 13 або важкий ланцюг послідовності SEQ ID NO: 9 та легкий ланцюг послідовності SEQ ID NO: 29.
9. Гуманізоване анти-інтерлейкін-18 антитіло згідно з пунктом 7, що включає важкий ланцюг послідовності SEQ ID NO: 17 та легкий ланцюг послідовності SEQ ID NO: 13 або важкий ланцюг послідовності SEQ ID NO: 17 та легкий ланцюг послідовності SEQ ID NO: 29.
10. Гуманізоване анти-інтерлейкін-18 антитіло згідно з пунктом 7, що включає важкий ланцюг послідовності SEQ ID NO: 21 та легкий ланцюг послідовності SEQ ID NO: 13 або важкий ланцюг послідовності SEQ ID NO: 21 та легкий ланцюг послідовності SEQ ID NO: 29.
11. Гуманізоване анти-інтерлейкін-18 антитіло згідно з будь-яким з попередніх пунктів, де співвідношення між швидкістю дисоціації (KD) зв'язування вказаного антитіла з людським IL-18 при 25 °С та швидкістю дисоціації (KD) зв'язування вказаного антитіла з людським IL-18 при 37 °С складає 1:5 (або 1: менше 5).
12. Фармацевтична композиція, що включає анти-інтерлейкін-18 антитіло згідно з будь-яким з пунктів 1-11 та фармацевтично прийнятний носій.
13. Aнтитіло згідно з будь-яким з пунктів 1-11 для застосування у лікуванні аутоімунних захворювань.
14. Aнтитіло згідно з пунктом 13, де аутоімунне захворювання є вибраним з групи, яка складається з: розсіяного склерозу, артритних захворювань, таких як ревматоїдний артрит, діабету типу 1, запального захворювання кишечнику (ISD) та псоріазу.
15. Застосування антитіла згідно з будь-яким з пунктів 1-11 у виробництві лікарського засобу для лікування аутоімунних захворювань.
16. Спосіб одержання антитіла згідно з будь-яким з пунктів 1-11, де спосіб включає культивування клітини-хазяїна, трансформованої або трансфікованої вектором, який включає полінуклеотид, що кодує вказане антитіло за умов, які дозволяють проводити експресію вказаного антитіла.
Текст
1. Гуманізоване анти-інтерлейкін-18 антитіло, яке включає CDR, які походять від донорного 2С10 антитіла, прищепленого на людський акцепторний каркас, де вказане анти-інтерлейкін-18 антитіло включає CDR, які мають послідовності, що представлені у SEQ ID NO: 1, 2, 3, 4, 5 та 6, та де залишок у положенні 71 легкого ланцюга вказаного анти-інтерлейкін-18 антитіла є ідентичним залишку, який знаходиться у відповідному положенні каркаса донорного 2С10 антитіла (тобто, тирозину); та де вказаний людський акцепторний каркас 2 (19) 1 3 96595 4 легкого ланцюга, як представлено у SEQ ID NO: 15. 7. Гуманізоване анти-інтерлейкін-18 антитіло, що включає важкий ланцюг, вибраний з групи, яка складається з SEQ ID NO: 9, SEQ ID NO: 17, SEQ ID NO: 21; та легкий ланцюг, вибраний з групи, яка складається з SEQ ID NO: 13, SEQ ID NO: 29. 8. Гуманізоване анти-інтерлейкін-18 антитіло згідно з пунктом 7, що включає важкий ланцюг послідовності SEQ ID NO:9 та легкий ланцюг послідовності SEQ ID NO: 13 або важкий ланцюг послідовності SEQ ID NO: 9 та легкий ланцюг послідовності SEQ ID NO: 29. 9. Гуманізоване анти-інтерлейкін-18 антитіло згідно з пунктом 7, що включає важкий ланцюг послідовності SEQ ID NO: 17 та легкий ланцюг послідовності SEQ ID NO: 13 або важкий ланцюг послідовності SEQ ID NO: 17 та легкий ланцюг послідовності SEQ ID NO: 29. 10. Гуманізоване анти-інтерлейкін-18 антитіло згідно з пунктом 7, що включає важкий ланцюг послідовності SEQ ID NO: 21 та легкий ланцюг послідовності SEQ ID NO: 13 або важкий ланцюг послідовності SEQ ID NO: 21 та легкий ланцюг послідовності SEQ ID NO: 29. 11. Гуманізоване анти-інтерлейкін-18 антитіло згідно з будь-яким з попередніх пунктів, де співвід ношення між швидкістю дисоціації (KD) зв'язування вказаного антитіла з людським IL-18 при 25 °С та швидкістю дисоціації (KD) зв'язування вказаного антитіла з людським IL-18 при 37 °С складає 1:5 (або 1: менше 5). 12. Фармацевтична композиція, що включає антиінтерлейкін-18 антитіло згідно з будь-яким з пунктів 1-11 та фармацевтично прийнятний носій. 13. Aнтитіло згідно з будь-яким з пунктів 1-11 для застосування у лікуванні аутоімунних захворювань. 14. Aнтитіло згідно з пунктом 13, де аутоімунне захворювання є вибраним з групи, яка складається з: розсіяного склерозу, артритних захворювань, таких як ревматоїдний артрит, діабету типу 1, запального захворювання кишечнику (ISD) та псоріазу. 15. Застосування антитіла згідно з будь-яким з пунктів 1-11 у виробництві лікарського засобу для лікування аутоімунних захворювань. 16. Спосіб одержання антитіла згідно з будь-яким з пунктів 1-11, де спосіб включає культивування клітини-хазяїна, трансформованої або трансфікованої вектором, який включає полінуклеотид, що кодує вказане антитіло за умов, які дозволяють проводити експресію вказаного антитіла. 1. Галузь, до якої відноситься винахід Даний винахід в загальному випадку відноситься до галузі імуноглобулінів, таких як антитіла, та, зокрема, до гуманізованих антитіл, корисних для лікування та діагностики станів, опосередкованих людським інтерлейкіном-18. 2. Передумови створення винаходу Людський інтерлейкін-18 (hlL-18) являє собою цитокін, який синтезується як біологічно неактивний білок попередника, що містить 193 амінокислоти (Ushio та ін., J. Immunol. 156:4274, 1996). Розщеплення білка попередника, наприклад, каспазою-1 або каспазою-4, вивільняє зрілий білок, що містить 156 амінокислот (Gu та ін., Science 275:206, 1997; Ghayur та ін., Nature 386:619, 1997) та демонструє біологічні активності, які включають сумісну стимуляцію проліферації Т-клітин, поліпшення цитотоксичності NK клітин, індукцію продукції IFN- Т-клітинами та NK клітинами, а також потенціювання диференціації Т-хелперів типу 1 (Th1) (Okamura та ін., Nature 378:88, 1995; Ushio та ін., J. Immunol. 156:4274, 1996; Micallef та ін., Eur. J. Immunol. 26:1647, 1996; Коhnо та ін., J. Immunol. 158:1541, 1997; Zhang та ін., Infect. Immunol. 65:3594, 1997; Robinson та ін., Immunity 7:57'1, 1997). Крім того, IL-18 є ефективним індуктором людських прозапальних медіаторів моноцитів, включаючи IL-8, фактор некрозу пухлин- (TNF-) та простагландин Е 2 (PGE 2) (Ushio, S. та ін., J. Immunol. 156:4274-4279, 1996; Puren, A. J. та ін., J. Clin. Invest. 10:711-721, 1997; Podolin та ін., J. Immunol., представлено до розгляду, 1999). Клонований раніше білок, пов'язаний з рецептором IL-1 (IL-1 Rrp) (Parnet та ін., J. Biol. Chem. 271:3967, 1996), був ідентифікований як субодиниця рецептора IL-18 (Kd=18 нМ) (Torigoe та ін., J. Biol. Chem. 272:25737, 1997). Друга субодиниця рецептора IL-18 демонструє гомологію з допоміжним білком рецептора IL-1, її було названо AcPL (для додаткової білковоподібної). Експресія як IL-1 Rrp, так і AcPL, є необхідною для IL-18індукованих NF-кВ, та активації JNK (Born та ін., J. Biol. Chem . 273:29445, 1998). Додатково до NF-кВ та JNK, IL-18 передає сигнали через асоційовану з рецептором IL-1 кіназу (IRAK), p56lck (LCK) та активовану мітогеном протеїнкіназу (МАРК) (Micallef та ін., Eur. J. Immunol. 26:1647, 1996; Matsumoto та ін., Biophys Biochem. Res. Comm. 234:454, 1997; Tsuji-Takayama та ін., Biochem. Biophys. Res. Comm. 237:126, 1997). TH1 клітини, які продукують прозапальні цитокіни, такі, як IFN-, IL-2 та TNF- (Mosmann та ін., J. Immunol. 136:2348, 1986), були втягненими в опосередковування багатьох аутоімунних захворювань, включаючи розсіяний склероз (MS), ревматоїдний артрит (RA), діабет типу 1, або інсулінзалежний діабет (IDDM), запальне захворювання кишечнику (IBD) та псоріаз (Mosmann та Sad, Immunol. Today 17:138, 1996). Таким чином, антагонізм ТН1-стимулюючого цитокіну такого, як IL-18, буде передбачатися як такий, що інгібує розвиток захворювання. Специфічні для IL-18 моноклональні антитіла можуть використовуватися як антагоніст. Була продемонстрована роль IL-18 у розвитку аутоімунних захворювань. Згідно з цим було продемонстровано, що експресія IL-18 є значно підвищеною у підшлунковій залозі та селезінці діабе 5 тичних мишей, що не страждають на ожиріння (NOD), безпосередньо до початку захворювання (Rothe та ін., J. Clin. Invest. 99:469, 1997). Подібно до цього, рівні IL-18 були показані як такі, що є значно підвищеними у синовіальній рідині пацієнтів з ревматоїдним артритом (Kawashima та ін., Arthritis and Rheumatism 39:598, 1996). Крім того, було продемонстровано, що введення IL-18 підвищує клінічну тяжкість експериментального алергічного енцефаломієліту (ЕАЕ) мишей, ТМопосередкованого імунного захворювання, що є моделлю розсіяного склерозу. Крім того, було показано, що нейтралізація антищурячою антисироваткою до IL-18 запобігає розвитку ЕАЕ у самок щурів Lewis (Wildbaum та ін., J. Immunol. 161:6368, 1998). Згідно з цим IL-18 є бажаною мішенню для розробки нових терапевтичних засобів для захворювань, спричинених аутоімунітетом. Taniguchi та ін., J. Immunol. Methods 206:107, описали сім мишиних та шість щурячих антилюдських IL-18 моноклональних антитіл (mAb), які зв'язуються з чотирма різними антигенними сайтами. Одне моноклональне антитіло миші (#12521-1) та шість щурячих моноклональних антитіл інгібують індуковану IL-18 продукцію IFN- KG-1 клітинами, при цьому щурячі монорклональні антитіла демонструють нейтралізуючі активності, що є у 10 разів нижчими, ніж такі для #125-21-1. Як було продемонстровано при використанні Вестерн-блоттінг аналізу, три моноклональні антитіла мишей, але жодне із щурячих моноклональних антитіл, є сильно реактивними із зв'язаним з мембраною людським IL-18. Крім того, є описаним твердофазний імуноферментний аналіз (ELISA) для виявлення людського IL-18, що використовує #125-2Н та щуряче моноклональне антитіло. Границя визначення цього ELISA складає 10 пг/мл. Європейська патентна заявка ЕР 0 712 931 розкриває два мишині антилюдські IL-18 моноклональні антитіла, Н1 (lgG1) та Н2 (ІgМ). Як було продемонстровано при використанні Вестернблоттінг аналізу, обидва моноклональні антитіла реагують з людським IL-18, зв'язаним з мембраною, але не з IL-12, зв'язаним з мембраною. Н1 використовується у прописі виконання імуноафінної хроматографії для очистки людського ІL-18, та в аналізі ELISA для вимірювання людського IL-18. H2 використовується у радіоімуноаналізі для вимірювання людського IL-18. Нейтралізація IL-18 антитіл може бути потенційно корисною у полегшенні аутоімунних захворювань та пов'язаних з ними симптомів у людини. Таким чином, існує необхідність у рівні техніки в одержанні високоафінного антагоніста IL-18, такого, як нейтралізуюче моноклональне антитіло до людського інтерлейкіну 18, який буде знижувати диференціацію та проліферацію Th1 клітин та, таким чином, тяжкість аутоімунного захворювання та пов'язаних з ним симптомів. Усі посилання, які згадуються у даному описі, повністю та специфічно є введеними у дану заявку як посилання. 3. Короткий виклад суті винаходу Згідно з даним винаходом забезпечується гуманізоване антиінтерлейкін-18 антитіло, яке вклю 96595 6 чає важкий ланцюг та легкий ланцюг, що містять наступні гіперваріабельні ділянки (CDR): CDRH1:SEQ.I.D.NO:1 CDRH2:SEQ.I.D.NO:2 CDRH3:SEQ.I.D.NO:3 CDRL1:SEQ.I.D.NO:4 CDRL2:SEQ.I.D.NO:5 CDRL3:SEQ.I.D.NO:6 Згідно з даним винаходом забезпечується гуманізоване антиінтерлейкін-18 антитіло, яке включає важкий ланцюг та легкий ланцюг, що містять наступні CDR: CDRH1:SEQ.I.D.NO:1 CDRH2:SEQ.I.D.NO:2 CDRH3:SEQ.I.D.NO:3 CDRL1:SEQ.I.D.NO:4 CDRL2:SEQ.I.D.NO:5 CDRL3:SEQ.I.D.NO:6, де залишок у положенні 71 легкого ланцюга є заміненим відповідним залишком, знайденим у донорному антитілі, з якого походять ці CDR. Спеціалістові в даній області техніки є зрозумілим, що термін "походить" призначений для визначення не тільки джерела одержання у розумінні фізичного джерела для матеріалу, а також для визначення матеріалу, який є структурно ідентичним до цього матеріалуі, але який не походить від цього згаданого джерела. Таким чином, відповідний залишок, "знайдений у каркасі донорного антитіла, з якого походять CDR", з необхідністю не вимагає очищення від каркасу донорного антитіла. Подібно до цього, CDR, "що походять від донорного антитіла", з необхідністю не вимагають очищення від донорного антитіла. CDR, каркасні ділянки (FR) та нумерація амінокислот відповідають, якщо не зазначено інше, таким згідно з визначенням Kabat, як представлено у Kabat та ін. "Послідовності, що представляють імунологічний інтерес", NIH. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, що включає CDR, які походять від донорного антитіла, прищеплені на людську акцепторну каркасну ділянку, де антиінтерлейкін 18 антитіло включає CDR, що мають послідовність, як представлено у SEQ.I.D.NO: 1, 2, 3, 4, 5 та 6, де залишок у положенні 71 легкого ланцюга вказаного антиінтерлейкін-18 антитіла є ідентичним із залишком, знайденим у відповідному положенні каркасу донорного антитіла. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, що включає CDR, представлені у SEQ.I.D.NO: 1, 2, 3, 4, 5 та 6, де антитіло включає тирозин у положенні 71 легкого ланцюга. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, що включає важкий ланцюг, який містить CDR, представлені у SEQ.I.D.NO: 1, 2 та 3, та легкий ланцюг, що містить CDR, представлені у SEQ.I.D.NO: 4, 5 та 6, де вказані CDR легкого ланцюга походять від донорного антитіла, що містить тирозин у положенні 71 легкого ланцюга донорного антитіла. 7 В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, що включає CDR з донорного антитіла та тирозин у положенні 71 легкого ланцюга вказаного гуманізованогог антитіла, де донорне антитіло являє собою 2С10 або його каркасний варіант (тобто гуманізоване антитіло включає ті самі CDR, але відмінний від 2С10 каркас, див. патент США 6,706,487). В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, що включає: (a) важкий ланцюг, який містить CDR з послідовностями, представленими у SEQ.I.D.NO:1, 2 та 3, прищепленими на акцепторний каркас людського важкого ланцюга та (b) легкий ланцюг, який містить CDR з послідовностями, представленими у SEQ.I.D.NO: 4, 5 та 6, прищепленими на акцепторний каркас людського легкого ланцюга, де вказаний акцепторний каркас людського легкого ланцюга включає каркасні ділянки, які походять від SEQ.I.D.NO: 38, де положення 71 SEQ.I.D.NO: 38 являє собою тирозин. В іншому аспекті даного винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, що включає; (a) важкий ланцюг, який містить CDR, які є пермісивними щодо специфічного зв'язування з людським IL-18; (b) легкий ланцюг, який містить акцепторний каркас, та має CDR з послідовностями, представленими у SEQ.I.D.NO: 4, 5 та 6, які містять тирозинів залишок у положенні 71. CDR легкого ланцюга є переважно розміщеними у положеннях у межах акцепторної каркасної ділянки, що відповідає відповідним положенням послідовностей, представлених у SEQ.I.D.NO: 4, 5 та 6, та у межах послідовності, як представлено у SEQ.I.D.NO:35. Легкий ланцюг та/або важкий ланцюг є переважно неімуногенними у пацієнта, який представляє собою людину. В іншому аспекті даного винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, що включає: (a) важкий ланцюг, який містить CDR, що мають послідовності, представлені у SEQ.I.D.NO: 1,2 та 3, та; (b) легкий ланцюг, який містить CDR, що мають послідовності, представлені у SEQ.I.D.NO: 4, 5 та 6, прищеплені на акцепторний каркас людського легкого ланцюга, де вказаний акцепторний каркас легкого ланцюга вказаного гуманізованого антиінтерлейкін-18 антитіла включає каркасні ділянки, які походять від варіанту послідовності, представленої у SEQ.I.D.NO:38, де вказаний варіант включає тирозин у положенні 71 та де вказаний варіант є на 75% або більше процентів ідентичним з каркасною ділянкою, яка має послідовність, представлену у SEQ.I.D.NO:38. Є бажаним, коли вказаний варіант є на 80% або більше, наприклад, 81%, 82%, 83%, 84%, більш бажано 85% або більше, наприклад, 86%, 87%, 88%, 89%, навіть більш бажано 90% або більше, наприклад, 91%, 92%, 93%, 94%, більш бажано 95% або більше, наприклад, на 96595 8 96%, 97%, 98%, 99% ідентичним каркасній ділянці, представленій у SEQ.I.D.NO:38. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, де антитіло включає: (a) CDR, представлені у SEQ.I.D.NO: 1, 2, 3, 4, 5 та 6, які походять від донорного антитіла, де донорне антитіло включає тирозин у положенні 71 легкого ланцюга донорного антитіла; (b) людський акцепторний каркас, де акцепторний каркас включає фенілаланін у положенні 71 людського легкого ланцюга; де антиінтерлейкін-18 антитіло включає тирозин у положенні 71 легкого ланцюга. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, що включає: (a) CDR, представлені у SEQ.I.D.NO: 1, 2, 3, 4, 5 та 6, які походять від донорного антитіла, де донорне антитіло включає ароматичну амінокислоту у положенні 71 легкого донорного антитіла; (b) людський акцепторний каркас, де акцепторний каркас включає у положенні 71 акцепторного каркасу легкого ланцюга ароматичні амінокислоти відмінного від ароматичних амінокислот частини (а) типу; де антиінтерлейкін-18 антитіло включає легкий ланцюг, що містить у положенні 71 ароматичну амінокислоту, яка походить від антитіла частини (а). В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, де антитіло демонструє константу рівноваги (KD) 300 пМ або менше стосовно зв'язування з людським IL-18 при вимірюванні за допомогою поверхневого плазмонного резонансу (наприклад, Віасоrе™, бажано при використанні Віасоrе™ 3000 приладу та умов, як описано у розділі 7.4.1, що представлений нижче) при 37°С. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, де антитіло включає CDR, які представлені у SEQ.I.D.NO:1, 2, 3, 4, 5 та 6 та демонструє константу рівноваги (KD) 300 пМ або менше стосовно зв'язування з людським IL-18 при вимірюванні за допомогою поверхневого плазмонного резонансу (наприклад, Віасоrе™, бажано при використанні Віасоrе™ 3000 приладу та умов, як описано у розділі 7.4.1, що представлений нижче) при 37°С. Бажано, коли константа рівноваги (KD) антитіла стосовно зв'язування з людським IL-18 при вимірюванні за допомогою поверхневого плазмонного резонансу (наприклад, Biacore™, бажано при використанні Biacore™ 100 приладу та умов, як описано у розділі 7.4.2, що представлений нижче) при 37°С є меншою за 90 пМ. Більш бажано, коли константа рівноваги складає 70 пМ або менше, та більш бажано, коли вона становить 65 пМ, 60 пМ, 55 пМ або 50 пМ, або менше. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, де антитіло демонструє константу дисоціації або швидкість дисоціації (kd) 0,0002 1/с або більше стосовно зв'язування з людським IL-18 при вимірюванні за допомогою поверхневого плазмонного резонансу 9 (наприклад, Biacore™, бажано при використанні Biacore™ 100 приладу та умов, як описано у розділі 7.4.2, що представлений нижче) при 37°С. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, де антитіло включає: (а) важкий ланцюг, який містить CDR, які походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 1, 2 та 3, прищеплені на акцепторний каркас важкого ланцюга, де акцепторний каркас важкого ланцюга включає каркасні ділянки, що походять від послідовності, як представлено у SEQ.I.D.NO: 37, де один або більше залишок/залишків у положенні/положеннях 27, 28, 29, 93, 39, 40, 36, 71, 89, 91 важкого ланцюга є ідентичними з відповідним залишком важкого ланцюга донорного антитіла; (b) легкий ланцюг, який містить CDR, які походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 4, 5 та 6, прищеплені на акцепторний каркас легкого ланцюга, де акцепторний каркас легкого ланцюга включає каркасні ділянки, які мають походження від послідовності, як представлено у SEQ.I.D.NO: 38, при цьому положення 71 та необов'язково один або більше (наприклад, усі) залишок/залишки у положенні/положеннях 45, 83, 84, 85 легкого ланцюга є ідентичними з відповідним залишком легкого ланцюга донорного антитіла. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло що включає: (a) важкий ланцюг, який містить CDR, які походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 1, 2 та 3, прищеплені на акцепторний каркас людського важкого ланцюга, де акцепторний каркас важкого ланцюга включає каркасні ділянки, які мають походження від послідовності, як представлено у SEQ.I.D.NO: 37, де залишки у положеннях 27, 28, 29, 93 важкого ланцюга є ідентичними з відповідними залишками у важкому ланцюзі донорного антитіла; (b) легкий ланцюг, який містить CDR, які походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO:4, 5 та 6, прищеплені на акцепторний каркас легкого ланцюга, де акцепторний каркас легкого ланцюга включає каркасні ділянки, які мають походження від послідовності, як представлено у SEQ.I.D.N0:38, де залишок у положенні 71 легкого ланцюга вказаного антиінтерлейкін-18 антитіла є ідентичними з відповідними залишками у легкому ланцюзі донорного антитіла. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло що включає: (a) важкий ланцюг, який містить CDR, які походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 1, 2 та 3, прищеплені на акцепторний каркас людського важкого ланцюга, при цьому акцепторний каркас важкого ланцюга включає каркасні ділянки, які походять від послідовності, як представлено у SEQ.I.D.NO: 37, де залишки у положеннях 27, 28, 96595 10 29, 39, 40, 93 важкого ланцюга є ідентичними з відповідними залишками у важкому ланцюзі донорного антитіла; (b) легкий ланцюг, який містить CDR, які походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 4, 5 та 6, прищеплені на акцепторний каркас легкого ланцюга, при цьому акцепторний каркас легкого ланцюга включає каркасні ділянки, які походять від послідовності, як представлено у SEQ.I.D.NO: 38, де залишок у положенні 71 легкого ланцюга є ідентичним з відповідними залишками у легкому ланцюзі донорного антитіла. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло що включає: (a) важкий ланцюг, який містить CDR, що походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 1, 2 та 3, прищеплені на акцепторний каркас людського важкого ланцюга, при цьому акцепторний каркас важкого ланцюга включає каркасні ділянки, які походять від послідовності, як представлено у SEQ.I.D.NO: 37, де залишки у положеннях 27, 28, 29, 36, 39, 40, 71, 89, 91, 93 важкого ланцюга є ідентичними з відповідними залишками у важкому ланцюзі донорного антитіла; (b) легкий ланцюг, який містить CDR, які походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 4, 5 та 6 та прищеплені на акцепторний каркас легкого ланцюга, при цьому акцепторний каркас легкого ланцюга включає каркасні ділянки, які походять від послідовності, як представлено у SEQ.I.D.NO: 38, де залишок у положенні 71 легкого ланцюга є ідентичним з відповідними залишками у легкому ланцюзі донорного антитіла. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло що включає: (a) важкий ланцюг, який містить CDR, що походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 1, 2 та 3, прищеплені на акцепторний каркас людського важкого ланцюга, при цьому акцепторний каркас важкого ланцюга включає каркасні ділянки, які походять від послідовності, як представлено у SEQ.I.D.NO:37, де залишки у положеннях 27, 28, 29, 93 важкого ланцюга є ідентичними з відповідними залишками у важкому ланцюзі донорного антитіла; (b) легкий ланцюг, який містить CDR, що походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 4, 5 та 6, прищеплені на акцепторний каркас легкого ланцюга, при цьому акцепторний каркас легкого ланцюга включає каркасні ділянки, які походять від послідовності, як представлено у SEQ.I.D.NO: 38, де залишки у положеннях 71, 45, 83, 84, 85 легкого ланцюга є ідентичними з відповідними залишками у легкому ланцюзі донорного антитіла. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло що включає: 11 (а) важкий ланцюг, який містить CDR, що походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 1, 2 та 3, прищеплені на акцепторний каркас людського важкого ланцюга, при цьому акцепторний каркас важкого ланцюга включає каркасні ділянки, які походять від послідовності, як представлено у SEQ.I.D.NO: 37, де залишки у положеннях 27, 28, 29, 93, 39, 40 важкого ланцюга є ідентичними з відповідними залишками у важкому ланцюзі донорного антитіла; (b) легкий ланцюг, який містить CDR, що походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 4, 5 та 6, прищеплені на акцепторний каркас легкого ланцюга, при цьому акцепторний каркас легкого ланцюга включає каркасні ділянки, які походять від послідовності, як представлено у SEQ.I.D.NO: 38, де залишки у положеннях 71, 45, 83, 84, 85 легкого ланцюга є ідентичним з відповідними залишками у легкому ланцюзі донорного антитіла. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло що включає: (a) важкий ланцюг, який містить CDR, що походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 1, 2 та 3, прищеплені на акцепторний каркас людського важкого ланцюга, при цьому акцепторний каркас важкого ланцюга включає каркасні ділянки, які походять від послідовності, як представлено у SEQ.I.D.NO: 37, де залишки у положеннях 27, 28, 29, 93, 39, 40, 36, 71, 89, 91 важкого ланцюга є ідентичними з відповідними залишками у важкому ланцюзі донорного антитіла; (b) легкий ланцюг, який містить CDR, які походять від донорного антитіла, де CDR мають послідовності, представлені у SEQ.I.D.NO: 4, 5 та 6, прищеплені на акцепторний каркас легкого ланцюга, при цьому акцепторний каркас легкого ланцюга включає каркасні ділянки, які походять від послідовності, як представлено у SEQ.I.D.NO: 38, де залишки у положеннях 71, 45, 83, 84, 85 легкого ланцюга є ідентичними з відповідними залишками у легкому ланцюзі донорного антитіла. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, що включає важкий ланцюг та легкий ланцюг, де співвідношення між швидкістю дисо ціації (kd) зв'язку з людським IL-18 вказа ного а нтитіла при 25°С до швидкості дисоціації (kd) зв'язку з людським IL-18 вказаного антитіла IL-18 при 37°С складає 1:5 або менше, при цьому вказане антитіло включає CDR, які походять від донорного антитіла та акцепторного каркасу людини, та де залишок у положенні 71 легкого ланцюга акцепторного каркасу є заміненим на відповідний залишком з донорного антитіла. Константу дисоцації переважно вимірюють при використанні пристрою Biacore™ Т100 та умов, як представлено у розділі 7.4.2, що приведений нижче. В іншому аспекті винаходу забезпечується гуманізоване антиінтерлейкін-18 антитіло, що включає важкий ланцюг, вибраний з групи, яка складається з SEQ.I.D.NO: 9, SEQ.I.D.NO: 17, 96595 12 SEQ.I.D.NO: 21; та легкий ланцюг, вибраний з групи, яка складається з SEQ.I.D.NO: 13, SEQ.I.D.NO: 29. Зокрема, винахід забезпечує гуманізоване антиінтерлейкін-18 антитіло, що включає важкий ланцюг послідовності SEQ.I.D.NO: 9 та легкий ланцюг послідовності SEQ.I.D.NO: 13, або важкий ланцюг послідовності SEQ.I.D.NO: 9 та легкий ланцюг послідовності SEQ.I.D.NO: 29. Винахід також забезпечує гуманізоване антиінтерлейкін-18 антитіло, що включає важкий ланцюг послідовності SEQ.I.D.NO: 17 та легкий ланцюг послідовності SEQ.I.D.NO: 13, або важкий ланцюг послідовності SEQ.I.D.NO: 17 та легкий ланцюг послідовності SEQ.I.D.NO: 29. Винахід також забезпечує гуманізоване антиінтерлейкін-18 антитіло, що включає важкий ланцюг послідовності SEQ.I.D.NO: 21 та легкий ланцюг послідовності SEQ.I.D.NO: 13, або важкий ланцюг послідовності SEQ.I.D.NO: 21 та легкий ланцюг послідовності SEQ.I.D.NO: 29. В іншому аспекті винаходу забезпечується фармацевтична композиція, що включає антиінтерлейкін-18 антитіло, як описано в даній заявці вище, та фармацевтично прийнятний носій. В іншому аспекті винаходу забезпечується спосіб вибору антитіла (зокрема, антитіла, що інгібує взаємодію між лігандом та рецептором, такого, як антиінтерлейкін-18 антитіло) для терапевтичного застосування, при цьому спосіб включає: (a) вимірювання зв'язувальної активності (при використанні, наприклад, поверхневого плазмонного резонансу, такого, як Biacore™) антитіла для антигену, з яким специфічно зв'язується антитіло, при температурі від 30 до 45°С (переважно при 37°С); (b) вимірювання зв'язувальної активності (при використанні, наприклад, поверхневого плазмонного резонансу, такого, як Biacore™) антитіла для антигену, з яким специфічно зв'язується антитіло, при температурі від 20 до 25°С (переважно при 25°С); (c) вибір вказаного антитіла для терапевтичного застосування, якщо афінність (а) є більшою, ніж афінність (b), переважно якщо вказана афінність (а) вдвічі або більше перевищує, більш переважно у чотири або більше разів перевищує афінність етапу (b). В іншому аспекті винаходу забезпечується спосіб вибору антитіла (зокрема, антитіла, що інгібує взаємодію між лігандом та рецептором, такого, як антиінтерлейкін-18 антитіло) для терапевтичного застосування, при цьому спосіб включає: (а) вимірювання швидкості дисоціації (при використанні, наприклад, поверхневого плазмонного резонансу, такого, як Biacore™) антитіла для антигену, з яким специфічно зв'язується антитіло, при температурі від 30 до 45°С (переважно при 37°С); (b) вимірювання швидкості дисоціації (при використанні, наприклад, поверхневого плазмонного резонансу, такого, як Biacore™) антитіла для антигену, з яким специфічно зв'язується антитіло, при температурі від 20 до 25°С (переважно при 25°С); 13 (c) вибір вказаного антитіла для терапевтичного застосування, якщо швидкість дисоціації (а) є нижчою за швидкість дисоціації (b). Термін "антиінтерлейкін-18" стосовно антитіл згідно з винаходом означає, що такі антитіла є здатними до нейтралізації біологічної активності людського інтерлейкіну-18. Проте це не виключає того факту, що такі антитіла можуть також додатково нейтралізувати біологічну активність інтерлейкіну-18примату, відмінного від людини (наприклад, мавп-резус та/або мавп циномолгус). Короткий опис малюнків Винахід буде далі описаний з посиланням на фігури, де: Фігура 1 показує вплив температури на швидкість зв'язування (kа) H1L1 та H1L2; Фігура 2 показує вплив температури на швидкість дисоціації (kd); Фігура 3 показує вплив температури на константу рівноваги (KD); Фігурав 4А-4С показує репрезентативні дані з одного експерименту, який дає значення ЕС50, проілюстровані у Таблиці 7; Фігура 5 показує значення ЕС50 вибраних гуманізованих варіантів, що зв'язуються з людським IL18; Фігура 6 показує значення ЕС50 чотирьох вибраних гуманізованих варіантів, що зв'язуються з IL18 мавп-резус; Фігура 7 показує зв'язування H1L2 з людським IL18 у присутності 50% синовіальної рідини; Фігура 8 показує інгібування стимульованої IL18 продукції IFN- в KG1 аналізі; Фігура 9А та 9В показують інгібування стимульованої LPS продукції IFN- у людських мононуклеарних клітинах периферичної крові донора у 10% та 25% аутологічній сироватці, відповідно; Фігура 10 показує зв'язування 2С10 з hlL18, захопленим hlL18BP; Фігура 11 показує здатність дев'яти гуманізованих варіантів інгубувати стимульоване IL18 вивільнення IFN- у KG1 клітинах; Фігура 12 показує інгібування стимульованої IL-18 продукції IFN- H1 варіантами та 2С10 у KG1 клітинах; Фігура 13 показує дані ІС50 для Н1 варіантів з 95% довірчим інтервалом; Фігура 14 показує інгібування стимульованої IL-18 продукції IFN- у KG1 клітинах; Фігура 15 показує інгібування стимульованої IL-18 мавп-резус продукції IFN- у KG1 клітинах; Фігура 16 показує результати аналізу людського IL-18 при використанні химерного 2С10; Фігура 17 показує результати зв'язування в ELISA IL-18 мавп-резус при використанні химерного 2С10; та Фігури 18А та 18В показує результати ELISA щодо зв'язування зв'язаного з IL-18ВР людського IL-18 з Н1L2та 2С10, відповідно. 4. Гуманізовані антитіла Застосування інтактних нелюдських антитіл у лікуванні захворювань та розладів людини приводить до добре відомих проблем потенційної імуногенетичності, зокрема, при повторюваних введеннях антитіла. Так, імунна система пацієнта може 96595 14 впізнавати нелюдське інтактне антитіло як не-своє та розвивати нейтралізуючу відповідь. На доповнення до одержання повних антитіл людини (див. вище), протягом багатьох років були розробленні різноманітні методики для подолання цих проблем, які в загальному випадку втягують зменшення складу нелюдських амінокислотних послідовностей в інтактному терапевтичному антитілі при збереженні відносної легкості одержання нелюдських антитіл від імунізованої тварини, наприклад, мишей, щурів або кролів. Для досягнення цього широко використовувалися два підходи. Перший з них являє собою химерні антитіла, які звичайно включають нелюдський (наприклад, такий гризунів, таких, як миша) варіабельний домен, злитий з людською константною ділянкою, див. Morrison (1984), PNAS, 81, 6851. Оскільки антигензв'язувальний сайт антитіла є локалізованим у межах варіабельних ділянок, химерне антитіло зберігає свою зв'язувальну афінність для антигену, але набуває ефекторних функцій людської константної ділянки і, таким чином, стає здатним виконувати ефекторні функції такі, як ті, що описані вище. Химерні антитіла типово одержують при використанні способів рекомбінантної ДНК. ДНК, що кодує антитіла (наприклад, кДНК), ізолюють та піддають секвенуванню при використанні традиційних процедур (наприклад, при використанні олігонуклеотидних зондів, які є здатними до специфічного зв'язування з генами, які кодують Н та L ланцюги антитіла згідно з винаходом, наприклад, ДНК, що визначається послідовностями SEQ.I.D.NO 1, 2, 3, 4, 5 та 6, описаними нижче). Гібридомні клітини служать як типове джерело такої ДНК. Якщо є бажаним експресувати химерне антитіло, то ізольовані ДНК, що кодують цілі зрілі варіабельні ділянки легкого та важкого ланцюгів, вбудовують у рамці у прийнятні експресійні вектори, що містять, серед інших, прийнятні константні ділянки імуноглобуліну, звичайно такі, що походять від людини, разом із сигнальними послідовностями, стоп-кодонами, промоторами, термінаторами та іншими елементами, які є необхідними для одержання експресії антитіла. Такі вектори потім трансфікують у хазяйські клітини, такі, як E.coli, COS клітини, СНО клітини або клітини мієломи, що іншим чином не продукують білок імуноглобуліну, для одержання синтезу антитіла. ДНК може бути модифікована шляхом заміни кодуючої послідовності на людські L та Н ланцюги відповідних нелюдських (наприклад, таких мишей) Н та L константних ділянок, див. наприклад, Morrison; PNAS 81, 6851 (1984). Другий підхід втягує одержання гуманізованих антитіл, де нелюдська частина антитіла є зниженою шляхом гуманізації варіабельних ділянок. Набули популярності дві методики гуманізації. Перша являє собою гуманізацію шляхом прищеплення CDR. CDR утворюють петлі поблизу Nтермінального кінця антитіла, де вони утворюють поверхню закріплену у скелеті, забезпечувану каркасними ділянками. Антигензв'язувальна специфічність антитіла, головним чином, визначається топографією та хімічними характеристиками поверхні CDR. Ці ознаки, у свою чергу, визначаються 15 конформацією індивідуальних CDR, відносним розміщенням CDR та природою бічних ланцюгів залишків, що складають ці CDR. Значне зниження імуногенності може бути досягнуто шляхом прищеплення тільки CDR не-людських (наприклад, мишиних) антитіл ("донорні" антитіла) на прийнятний людський каркас ("акцепторний каркас") та константні ділянки (див. Jones та ін (1986) Nature 321, 522-525 та Verhoeyen M та ін. (1988) Science 239, 1534-1536). Проте прищеплення CDR само по собі може не приводити до повного збереження антигензв'язувальних властивостей та часто виявляється, що необхідно зберігати деякі каркасні залишки донорного антитіла (це інколи називають"зворотними мутаціями") у гуманізованій молекулі, якщо відновлюють антигензв'язувальну афінність (див. Queen C та ін. (1989) PNAS 86, 10,02910,033, Co, M та ін. (1991) Nature 351, 501-502). У цьому випадку V ділянки, які демонструють найбільш високу гомологію послідовностей (типово 60% або більше) з нелюдським донорним антитілом, можуть бути вибрані з бази даних для того, щоб забезпечити людський каркас (FR). Вибір людських FR може бути зроблений або з людських консенсусних, або з індивідуальних людських антитіл. У випадку, якщо це є необхідним, то ключові залишки з донорного антитіла заміщують у людському акцепторному каркасі для збереження конформації CDR. Комп'ютерне моделювання антитіла може використовуватися для того, щоб допомогти ідентифікувати такі структурно важливі залишки, див. WO99/48523. Альтернативно, гуманізація може бути досягнута за допомогою процесу "маскування". Статистичний аналіз унікальних людських та мишиних варіабельних ділянок важкого та легкого ланцюгів імуноглобуліну виявив, що точні структури зовнішніх залишків є різними в антитілах людини та миші, найбільш індивідуальні поверхневі положення мають значну переважність для невеликої кількості різних залишків (див. Padlan E.A. та ін.; (1991) Моl.Immunol.28, 489-498 та Pedersen J.T. та ін.(1994) J.Mol.Biol. 235; 959-973). Таким чином, є можливим знизити імуногенність не людської Fv шляхом заміни зовнішніх залишків у каркасних ділянках, що відрізняються від таких, які звичайно виявляються у людських антитілах. Оскільки антигенність білка може піддаватися кореляції з поверхневою доступністю, заміна поверхневих залишків може бути достатньою для надання мишиним варіабельним ділянкам "невидимості" імунною системою людини (див. також Mark G.E. та ін. (1994) у Handbook of Experimental Pharmacology том 113: The pharmacology of monoclonal antibodies, Springer-Verlag, стор. 105-134). Ця процедура гуманізації називається "маскуванням", оскільки змінюється тільки поверхня антитіла, при цьому підтримуючі залишки не зачіпаються. Додаткові альтернативні підходи включають такі, що представлені у WO04/006955, та процес Humaneering™ (Kalobios), який використовує бактеріальні експресійні системи та забезпечує одержання антитіл, які є близькими до людської зародкової лінії за послідовністю (Alfenito-M Advancing Protein Therapeutics, January 2007, San Diego, Cali 96595 16 fornia). Інший сучасний підхід до гуманізації втягує відбір людських акцепторних каркасів на основі структурної подібності людських CDR ділянок до таких CDR ділянок донорного мишиного антитіла більше, ніж на основі гомології між іншими ділянками антитіла, такими, як каркасні ділянки. Цей процес є також відомим як Супергуманізація™ (Evogenix Inc.; Hwang та ін. (2005) Methods 36:3542). Таким чином, даний винахід стосується гуманізованих антитіл, які представлені у розділі 3, що приведений вище. Такі гуманізовані антитіла переважно включають людську константну ділянку IgG ізотипу, такого, як lgG1 або lgG4. В альтернативних втіленнях гуманізовані варіабельні ділянки, які представлені у розділі 3, що приведений вище, можуть бути злитими з нелюдською константною ділянкою ("зворотна химера"), наприклад такою, що одержана від примату, відмінного від людини, щура, миші або кроля. Спеціалістові в даній області техніки буде зрозуміло, акцепторні каркаси, представлені у SEQ.I.D.NO: 37 та 38, скла дають імуноглобулінові амінокислоти, які кодуються VH та \/каппа генами, відповідно. Як такі вони включають як каркасні ділянки, так і CDR акцепторного антитіла. У межах компетенції спеціаліста в даній області техніки знаходиться провести заміщення CDR акцепторного антитіла донорними CDR, представленими у SEQ.I.D.NO: 1, 2, 3, 4, 5 та 6, та поєднати одержані послідовності з прийнятними каркасними 4 послідовностями, такими, як ті, що представлені у SEQ.I.D.NO: 39 та SEQ.I.D.NO. 40, для того, щоб одержати повну варіабельну ділянку імуноглобуліну, як представлено у SEQ.I.D.NO: 11 та SEQ.I.D.NO: 15. 4.1. Інші модифікації Взаємодія між Fc ділянкою антитіла та різноманітними рецепторами Fc (FcR), як передбачається, опосередковується ефекторними функціями антитіла, що включають залежну від антитіла клітинну цитотоксичність (ADCC), фіксацію комплементу, фагоцитоз, період напіврозпаду/кліренс антитіла. Різні модифікації Fc ділянки антитіл згідно з винаходом можуть бути виконані в залежності від бажаних властивостей. Наприклад, специфічні мутації у Fc ділянці для одержання антитіла, відмінного від літичного, нелітичного, детально описується в ЕР 0629 240В1 та ЕР 0307 434В2, або може бути введений рятувальний епітоп зв'язування з рецептором в антитіло для збільшення періоду напіврозпаду, див. патент США № 5,739,277. На сьогоднішній день визнається п'ять людських Fс рецепторів, FcR (I), FcRlla, FcRllb, FcRІІIa та неонатальний. FcRn. Shields та ін., (2001) J.Biol.Chem 276, 6591-6604 продемонстрували, що загальний набір lgG1 залишків є втягненим у зв'язування усіх FcR, у той час, як FcRII та FcRMI використовують різні сайти поза цим загальним набором. Одна група lgG1 залишків зменшує зв'язування з усіма FcR, коли на аланін замінюють: Pro-238, Asp-265, Asp-270, Asn-297 та Рrо239. Усі вони знаходяться в межах IgG CH2 домену та розміщуються поблизу шарнірного сполучення СН1 та СН2. У той час, як FcRI використо 17 вує тільки загальний набір lgG1 залишків для зв'язування, FcRII та FcRIII взаємодіють з відмінними залишками на доповнення до загального набору. Зміни деяких залишків зменшують зв'язування з FcRII (наприклад, Arg-292) або FcRIN (наприклад, Glu-293). Деякі варіанти продемонстрували поліпшене зв'язування з FcRII або FcRIII, але не впливали на зв'язування з іншим рецептором (наприклад, Ser-267Ala забезпечував поліпшене зв'язування з FcRII, але зв'язування з FcRIII не піддавалося впливу). Інші варіанти демонстрували поліпшене зв'язування з FcRII або FcRIII зі зниженням зв'язування з іншим рецептором (наприклад, Ser-298Ala забезпечував поліпшене зв'язування з FcRIII та зменшував зв'язування з FcRII). Щодо FcRIIIa, то варіанти lgG1 поліпшеного зв'язування мали поєднані аланінові заміни у Ser-298, Glu-333 та Lys-334. Неонатальний FcRn рецептор, як передбачається, є втягненим як у виведення антитіла, так і у трансцитоз через тканини (див. Junghans R.P (1997) Immunol.Res 16. 29-57 та Ghetie та ін. (2000) Annu.Rev.Immunol. 18, 739-766). Людські lgG1 залишки, призначені для безпосередньої взаємодії з людським FcRn, включають IIе253, Ser254, Lys288, Thr307, Gln311, Asn434 та His435. Даний винахід, таким чином, стосується антитіл згідно з винаходом, які мають будь-яку одну (або більше) зміну залишків, що детально представлені вище, для модифікації періоду напіврозпаду/кліренсу та/або ефекторних функцій, таких, як ADCC та/або залежний від комплементу лізис. Інші модифікації включають варіанти глікозилювання антитіл згідно з винаходом. Глікозилювання антитіл у консервативних положеннях в їх константних ділянках є відомим як таке, що має глибокий вплив на функцію антитіла, зокрема, ефекторне функціонування, так, як описано вище, див. наприклад, Boyd та ін. (1996), Моl. Immunol. 32, 1311-1318. Варіанти глікозилювання антитіл або їх антигензв'язувальних фрагментів згідно з даним винаходом, де один або більше вуглеводневих залишків додають, заміщують, видаляють або модифікують, також передбачаються. Введення фрагменту аспарагін-Х-серин або аспарагін-Хтреонін створює потенційний сайт для ферментативного приєднання вуглеводневих залишків та може, таким чином, використовуватися для зміни глікозилювання антитіла. У Raju та ін. (2001) Biochemistry 40, 8868-8876 термінальне сіалування TNFR-IgG імуноадгезину підвищували за допомогою процесу регалактозилування та/або ресіалування при використанні бета-1,4галактозилтрансерази та/або альфа,2,3сиалілтрансеферази. Підвищуючи термінальне сіалування, як передбачається, можна збільшити період напіврозпаду імуноглобуліну. Антитіла разом з більшістю глікопротеїнів типово продукуються як суміш глікоформ. Ця суміш є особливо вираженою, коли антитіла продукуються в еукаріотичних клітинах, зокрема, у клітинах ссавців. Були розроблені різноманітні способи для виробництва певних глікоформ, див. Zhang та ін. Science (2004), 303, 371, Sears та ін., Science, (2001) 291, 2344, Wacker та ін. (2002) Science, 298 96595 18 1790, Davis та ін. (2002) Chem.Rev. 102, 579, Hang та ін. (2001) Acc.Chem.Res 34, 727. Таким чином, даний винахід передбачає множину терапевтичних (моноклональних) антитіл (які можуть належати до IgG ізотипу, наприклад, lgG1), як описано в даній заявці, що включають визначену кількість (наприклад, 7 або менше, наприклад, 5, або менше, наприклад, два або одну) глікоформ вказаного антитіла або його антигензв'язувальних фрагментів. Додаткові втілення згідно з винаходом включають антитіла згідно з винаходом або їх антигензв'язувальні фрагменти, приєднані до небілкового полімеру, такого, як поліетиленгліколь (ПЕГ), поліпропіленгліколь або поліоксіалкілен. Кон'югація білків з ПЕГ являє собою відомий спосіб для збільшення періоду напіврозпаду білків, а також для зниження антигенності та імуногенності білків. Застосування ПЕГилування з різними молекулярними масами та моделями (лінійні або розгалужені) було досліджене із інтактними антитілами, а також при використанні Fab' фрагментів, див. Koumenis I.L. та ін. (2000) Int.J.Pharmaceut. 198:83-95. 5. Способи одержання Антитіла згідно з даним винаходом можуть бути одержані у трансгенних організмах, таких, як цап (див. Pollock та ін. (1999), J.Immunol.Methods 231:147-157), курчата (див. Morrow KJJ (2000) Genet.Eng.News 20:1-55, миші (див. Pollock та ін.) або рослини (див. Doran PM, (2000) Curr.Opinion Biotechnol. 11, 199-204, Ma JK-C (1998), Nat.Med. 4; 601-606, Baez J та ін., BioPharm (2000) 13: 50-54, Stoger E та ін.; (2000) Plant Mol.Biol 42:583-590). Антитіла можуть також бути одержані за допомогою хімічного синтезу. Проте антитіла згідно з винаходом типово одержують при використанні методики культивування рекомбінантних клітин, що є добре відомою в галузі техніки. Полінуклеотид, що кодує антитіло, є ізольованим та вбудованим у здатний до реплікації вектор, такий, як плазміда, для подальшого клонування (ампліфікації) або експресії. Одна з корисних систем експресії являє собою систему глутаматсинтетази (таку, що продається Lonza Biologies), зокрема, якщо клітини представляють собою клітини СНО або NS0 (див. нижче). Полінуклеотид, що кодує антитіло, легко ізолюють та піддають секвенуванню при використанні традиційних процедур (наприклад, олігонуклеотидних зондів). Вектори, що можуть використовуватися, включають плазміду, вірус, фаг, транспозони, мініхромосоми, при цьому плазміди являють собою найбільш типове втілення. В загальному випадку такі вектори додатково включають сигнальну послідовність, джерело реплікації, один або більше маркерних генів, енхансерний елемент та послідовності термінації транскрипції, оперативно зв'язані з полінуклеотидом легкого та/або важкого ланцюга для того, щоб сприяти експресії. Полінуклеотид, що кодує легкий та важкий ланцюги, може бути вбудований в окремі вектори та введений (наприклад, шляхом трансформації, трансфекції, електропорації та трансдукції) у ту саму хазяйську клітину одночасно або послідовно або, якщо це є бажаним, то як важкий ланцюг, так і легкий ланцюг, можуть бути вбудовані у той самий вектор перед таким введенням. 19 Спеціалістові в даній області техніки є добре зрозумілим, що завдяки виродженості генетичного коду є доступними полінуклеотиди, альтернативні розкритим в даній заявці, які будуть кодувати поліпептиди згідно з винаходом. 5.1 Сигнальні послідовності Антитіла згідно з даним винаходом можуть бути одержані як злитий білок з гетерологічною сигнальною послідовністю, що має специфічний сайт розщеплення на N-термінальному кінці зрілого білка. Сигнальна послідовність буде впізнаватися та піддаватися процесингу хазяйською клітиною. Для прокаріотичних хазяйських клітин сигнальна послідовність може представляти собою таку лужної фосфатази, пеніцилінази або лідерні послідовності термостабільного ентеротоксину II. Для дріжджової секреції сигнальні послідовності можуть представляти собою лідерну послідовність інвертази, лідерну послідовність фактора або лідерні послідовності кислої фосфатази, див. наприклад, WO90/13646. У системах клітин ссавців є доступними вірусні лідерні послідовності секреції, такі, як сигнальна послідовність gD вірусу простого герпесу та сигнальна послідовність нативного імуноглобуліну. Типово сигнальну послідовність піддають лігуванню у рамці зчитування з ДНК, що кодує антитіло згідно з винаходом. 5.2 Джерело реплікації Джерела реплікації є добре відомими в області техніки, при цьому pBR322 є прийнятним для більшості грам-негативних бактерій, 2 плазміда є прийнятною для більшості дріжджів, а різноманітні вірусні джерела, такі, що походять від SV40, поліоми, аденовірусу, VSV або BPV, є прийнятними для більшості клітин ссавців. В загальному випадку компонент джерела реплікації не є необхідним для експресійних векторів ссавців, але може використовуватися SV40, оскільки він містить ранній промотор. 5.3 Селективний маркер Типові селективні гени кодують білки, що (а) надають стійкості до антибіотиків або інших токсинів, наприклад, ампіциліну, неоміцину, метотрексату або тетрацикліну або (b) компенсують ауксіотрофний дефіцит або забезпечують поживні речовини, які не є доступними із складного комплексного середовища або (с) комбінації обох. Схема селекції може втягувати затримку росту хазяйських клітин, що не містять вектора або векторів. Клітини, які були успішно трансформовані генами, що кодують терапевтичне антитіло згідно з даним винаходом, виживають завдяки, наприклад, стійкості до лікарських засобів, що забезпечується завдяки сумісно введеним селективним маркером. Інший приклад являє собою так звану DHFR-систему селекції, де трансформанти одержують у культивують у DHFR-негативних хазяйських штамах (наприклад, див. Page та Sydenham 1991 Biotechnology 9: 64-68). У цій системі DHFR ген сумісно доставляється з полінуклеотидною послідовностю антитіла згідно з винаходом, та DHFR-позитивні клітини потім відбирають за допомогою відміни нуклеозиду. Якщо це є необхідним, то інгібітор DHFR метотрексат також використовують для селекції на трансформанти з 96595 20 ампліфікацією DHFR гену. Шляхом оперативно зв'язування DHFR гену з послідовністю, що кодує антитіло згідно з винаходом або його функціональні похідні, ампліфікація DHFR гену приводить до сумісної ампліфікації бажаної послідовності антитіла, що представляє інтерес. СНО клітини є особливо корисною клітинною лінією для цієї DHFR/метотрексат селекції. Способи ампліфікації та селекції хазяйських клітин при використанні DHFR системи є добре відомими в області техніки, див. Kaufman R.J. та ін. J.Mol.Biol. (1982) 159, 601621, для огляду, див. Werner RG, Noe W, Kopp K.Schluter М, "Прийнятні експресійні системи ссавців для біологічних фармацевтичних засобів", Arzneimittel-Forschung. 48(8):870-80, 1998 Aug. Додатковий приклад являє собою експресійну систему глутаматсинтетази (Lonza Biologies). Прийнятний селективний ген для застосування у дріжджах являє собою trp1 ген, див. Stinchcomb та ін. Nature 282, 38, 1979. 5.4 Промотори Прийнятні промотори для експресії антитіл згідно з винаходом є оперативно зв'язаними з ДНК/полінуклеотидом, що кодує антитіло. Промотори для прокаріотичних хазяйських клітин включають phoA промотор, промоторні системи беталактамази та лактози, лужної фосфатази, триптофану та гібридні промотори, такі, як Тас. Промотори, прийнятні для експресії у дріжджових клітинах, включають такі 3-фосфогліцераткінази або інших гліколітичних ферментів, наприклад, енолази, гліцеральдегід 3 фосфатдегідрогенази, гексокінази, піруватдекарбоксилази, фосфофруктокінази, глюкоза 6 фосфатізомерази, 3-фосфогліцератмутази та глюкокінази. Індуцибельні дріжджові промотори включають такі алкогольдегідрогенази 2, ізоцитохрому С, кислої фосфатази, металотіонеїну та ферментів, які відповідають за метаболізм азоту або засвоєння мальтози/галактози. Промотори для експресії у системах клітин ссавців включають промотори РНК полімерази II, у тому числі вірусні промотори, що походять з таких вірусів, як вірус поліоми, пташиної віспи та аденовіруси (наприклад, аденовірус 2), вірус папіломи великої рогатої худоби, вірус пташиної саркоми, цитомегаловірус (зокрема, промотор передраннього гену), ретровірус, вірус гепатиту В, актину, промотора вірусу саркоми Рауса (RSV) ранній або пізній промотор мавпячого вірусу 40 та невірусні промотори, такі, як EF-1 альфа (Mizushima та Nagata Nucleic Acids Res 1990 18(17):5322. Вибір промотора може базуватися на прийнятній сумісності з хазяйською клітиною, яка використовується для експресії. 5.5 Енхансерний елемент Якщо це є прийнятним, наприклад, для експресії у вищих каріот, то у вектор можуть включатися додаткові енхансерні елементи замість або разом з такими, що розміщені у промоторах, описаних вище. Прийнятні енхансерні послідовності ссавців включають енхансерні елементи з глобіну, еластази, альбуміну, фетопротеїну та інсуліну. Альтернативно, може використовуватися енхансерний елемент з вірусу еукаріотичних клітин, такий, як енхансер вірусу SV40, енхансер раннього про 21 мотора цитомегаловірусу, енхансер вірусу поліоми, бакуловірусний енхансер або мишиний lgG2a локус (див. WO04/009823). Незважаючи на те, що такі енхансери типово розміщують на векторі у сайті, що розміщений вище промотор, вони можуть також розміщуватися будь-де, наприклад, у межах нетрансльованої ділянки або нижче від сигналу поліаденілування. Вибір та положення енхансера може базуватися на прийнятній сумісності з хазяйською клітиною, яка використовується для експресії. 5.6 Сигнали поліаденілування/термінації В еукаріотичних системах сигнали поліаденілування є оперативно зв'язаними з полінуклеотидом, що кодує антитіло згідно з даним винаходом. Такі сигнали типово розміщуються 3' від відкритої рамки зчитування. У системах ссавців необмежувальний приклад включає сигнали, що мають походження від гормонів росту, фактора елонгації-1 альфа та вірусних (наприклад, SV40) генів або довгих термінальних повторів ретровірусів. У дріжджових системах необмежувальні приклади сигналів поліаденілування/термінації включають такі, що мають походження від генів фосфогліцераткінази (PGK) та алкогольдегідрогенази 1 (ADH). У прокаріотичних системах сигнали поліаденілування типово не є необхідними, але замість них звичайно використовують більш короткі та більш визначені послідовності термінації. Звичайно, вибір послідовностей поліаденілування/термінації базується на прийнятній сумісності з хазяйською клітиною, що використовується для експресії. 5.7 Інші способи/елементи для поліпшення виходу Крім згаданих вище, інші характеристики, що можуть використовуватися для збільшення виходу, включають елементи, що реконструюють хроматин, інтрони та модифікації кодонів, специфічні для хазяйської клітини. Використання кодонів антитіла згідно з винаходом може бути модифіковане для того, щоб задовольнити вимогу переважності кодонів хазяйської клітини для того, щоб підвищення виходу транскрипту та/або продукту (наприклад, Hoekema А та ін. Моl Cell Biol 1987 7(8):2914-24). Вибір кодонів може базуватися на прийнятній сумісності з хазяйською клітиною, що використовується для експресії. 5.8 Хазяйські клітини Прийнятні хазяйські клітини для векторів клонування або експресії, що кодують антитіла згідно з винаходом, є прокаріотичними, дріжджовими або походять від вищих еукаріотичних клітин. Прийнятні прокаріотичні клітини включають еубактерії, наприклад, ентеробактерії, такі, як Escherichia, наприклад, E. Соli (наприклад, АТСС 31,446; 31,537; 27,325), Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, наприклад, Salmonella typhimurium, Serratia, наприклад, Serratia marcescans, та Shigella, а також Bacilli, такі, як B.subtilis та В licheniformis (див. DD 266 710), Pseudomonas, такий як P.aeruginosa, та Streptomyces. Для дріжджових хазяйських клітин також передбачаються такі, як Saccharomyces cerevisiae, Schizosaccharomyces pombe, Kluyveromyces (наприклад, АТСС 16,045; 12,424; 24178; 56,500), Yarrowia (EP402, 96595 22 226), Pichia pastoris (EP183, 070, див. також Peng та ін. J.Biotechnol. 108 (2004) 185-192), Candida, Trichoderma reesia (EP244, 234), також передбачаються такі хазяйські клітини, як Penicilum, Tolypocladium та Aspergillus, такі, як A.nidulans та А.nіgеr. Незважаючи на те, що прокаріотичні та дріжджові хазяйські клітини, зокрема, передбачаються даним винаходом, є бажаним, коли клітини згідно з даним винаходом являють собою вищі еукаріотичні клітини. Прийнятні вищі еукаріотичні хазяйські клітини включають клітини ссавців, такі, як COS-1 (ATCC No.CRL 1650) COS-7 (ATCC CRL 1651), лінію ембріональної нирки людини 293, клітини нирки хом'яка (ВНК) (ATCC CRL. 1632), ВНК570 (ATCC NO: CRL 10314), 293 (ATCC NO. CRL 1573), клітини яєчника китайського хом'яка СНО (наприклад, СНО-К1, ATCC NO: CCL 61, DHFR-CHO клітинну лінію DG44 (див. Urlaub та ін., (1986) Somatic Cell Mol.Genet.12, 555-556)), зокрема, СНО клітинні лінії, адаптовані до суспензійної культури, мишиніі клітини Сертолі, клітини нирки мавпи, клітини нирки африканської зеленої мавпи (ATCC CRL-1587), клітини HELA, клітини нирки собаки (ATCC CCL 34), клітини легені людини (ATCC CCL 75), Hep G2 та клітини мієломи або лімфоми, наприклад, NS0 (див. US 5,807,715), Sp2/0, Y0. Таким чином, в одному втіленні згідно з винаходом забезпечується стабільно трансформована хазяйська клітина, яка включає вектор, що кодує важкий ланцюг та/або легкий ланцюг антитіла або його антигензв'язувальний фрагмент, як описано в даній заявці. Типово такі хазяйські клітини включають перший вектор, що кодує легкий ланцюг, та другий вектор, що кодує вказаний важкий ланцюг. Такі хазяйські клітини можуть також бути додатково перетворені або адаптовані для модифікації якості, функції та/або виходу антитіла згідно з даним винаходом. Необмежувальні приклади включають експресію специфічних модифікуючих (наприклад, шляхом глікозилювання) ферментів та білків, які сприяють зборці інших білків (шаперони). 5.9 Способи культивування клітин Хазяйські клітини, трансформовані за допомогою векторів, що кодують терапевтичні антитіла згідно з винаходом, можуть піддаватися культивуванню за допомогою будь-якого способу, відомого спеціалістові в даній галузі техніки. Хазяйські клітини можуть культивуватися у колбах, що обертаються, роллер-флаконах або у ферментерах із системою порожніх волокон, але для масштабної продукції є бажаним, щоб для суспензійних культур використовувалися реактори з мішалкою, мішкові культуральні реактори (наприклад, Wave Biotech, Somerset, New Jersey USA) використовуються, зокрема, для суспензійних культур. Є типовим, коли реактори з мішалкою адаптують для аерації при використанні, наприклад, пульверизаторів, перегородок або лопастей низькогозсуву. Для барботажних колонок та аероліфт них реакторів може використовуватися безпосередня аерація при використанні бульбашок повітря або кисню. Коли хазяйські клітини культивують у культуральному середовищі, вільному від сироватки, є бажаним, коли у середовище вводять 23 агент для захисту клітин, такий, як плюронік F-68 для того, щоб запобігти пошкодженню клітин в результаті процесу аерації. В залежності від характеристик хазяйської клітини можуть використовуватися або мікроносії як ростові субстрати для клітинних ліній, залежних від прикріплення клітин, або клітини можуть адаптуватися до умов суспензійної культури (що є типовим). Культивування хазяйських клітин, зокрема, клітин хребетних тварин, може передбачати різноманітність операційних способів, таких, як культивування культури з підживленням, повторювана серійна обробка (див. Drapeau та ін. (1994) Cytotechnology 15: 103-109), довгостроковий серійний процес або перфузійна культура. Хоча рекомбінантно трансформовані хазяйські клітини ссавців можуть культивуватися у середовищі, що містить сироватку, таку, як фетальна сироватка теляти (FCS), є бажаним, щоб такі хазяйські клітини піддавалися культивуванню у синтетичному вільному від сироватки середовищі, такому, як розкрито у Keen та ін. (1995) Cytotechnology 17:153-163, або комерційно доступному середовищі, такому, як РrоСНО-CDM або UltraCHO™ (Cambrex NJ, USA), доповненому у разі необхідності джерелами енергії, такими, як глюкоза, або синтетичними ростовими факторами, такими, як рекомбінантний інсулін. Культивування хазяйських клітин у середовищі, вільному від сироватки, може вимагати, щоб ці клітини були адаптованими до росту в умовах відсутності сироватки. Один з підходів до адаптації полягає у тому, що культивують такі хазяйські клітини у середовищі, яке містить сироватку, та повторюють заміну 80% культурального середовища на середовище, вільне від сироватки, так, щоб хазяйські клітини навчилися адаптуватися в умовах відсутності сироватки (див. наприклад, Scharfenberg K та ін. (1995) у Animal Cell technology: Developments towards the 21st century (Beuvery E.C. та ін. eds), стор.619-623, Kluwer Academic publishers). Антитіла згідно з винаходом, які секретуються у середовище, можуть бути виділені та очищені при використанні різноманітності методик для забезпечення ступеня очистки, прийнятного для даного застосування. Наприклад, застосування терапевтичних антитіл згідно з винаходом для лікування пацієнтів, що представляють собою людей, типово вимагає принаймні 95% чистоти, більш типово 98% або 99% чистоти у порівнянні із сировим культуральним середовищем. У першому випадку клітинний дебрис з культурального середовища типово видаляють при використанні центрифугування, після чого проводять етап освітлення супернатанту при використанні, наприклад, мікрофільтрації, ультрафільтрації та/або глибинної фільтрації. Альтернативно, антитіло можна збирати шляхом мікрофільтрації, ультрафільтрації або глибинної фільтрації без попереднього центрифугування. Є доступними ряд інших методик, таких, як діаліз та гель-електрофорез, та хроматографічних методик, таких, як афінна хроматографія при використанні гідроксіапатиту (НА) (що необов'язково втягує систему маркування афінності, таку, як полігістидин) та/або хроматографію на основі гідрофобної взаємодії (НІС, див. US 5,429,746). В 96595 24 одному втіленні антитіла згідно з винаходом після проведення різноманітних етапів освітлення збирають при використанні афінної хроматографії із застосування білка А або G, після чого проводять додаткові етапи хроматографії, такі, як іонообмінна та/або НА хроматографія, аніоно-або катіонообмінна хроматографія, ексклюзійна хроматографія та осадження при використанні сульфату амонію. Типовим є також використання різноманітних етапів видалення вірусів (наприклад, нанофільтрації із застосуванням, наприклад, фільтру DV-20) Після проведення цих різноманітних етапів забезпечується одержання очищеного (типово моноклонального) препарату, що включає принаймні 10 мг/мл або більше, наприклад, 100 мг/мл або більше, антитіла згідно з винаходом, що, таким чином, представляє собою втілення згідно з винаходом. Концентрація до 100 мг/мл або більше може бути одержана за допомогою ультрацентрифугування. Є бажаним, коли такі препарати є суттєво вільними від агрегованих форм антитіл згідно з винаходом. Бактеріальні системи є особливо прийнятними для експресії фрагментів антитіла. Такі фрагменти є локалізованими усередині клітини або усередині периплазми. Нерозчинні периплазматичні білки можуть бути екстраговані та піддаватися повторному рефолдингу з утворенням активних білків згідно зі способами, відомими спеціалістові в даній області техніки, див. Sanchez та ін. (1999) J.Biotechnol. 72, 13-20 та Cupit PM та ін. (1999) Lett Appl Microbiol, 29, 273-277. 6. Фармацевтичні композиції Очищені препарати антитіл згідно з винаходом (зокрема, моноклональні препарати), як описано вище, можуть бути введені у фармацевтичні композиції для застосування у лікуванні людських захворювань та розладів, таких, як атопічні розлади, наприклад, астма, алергічний риніт, COPD. Типово такі композиції включають фармацевтично прийнятний носій, як є відомим та прийнятим у фармацевтичній практиці, див. наприклад, Remingtons Pharmaceutical Sciences, 16-е видання, (1980), Mack Publishing Co. Приклади таких носіїв включають стерильний носій, такий, як фізіологічний розчин, розчин Рингера та розчин дектрози, забуферені прийнятними буферами до значення рН у межах інтервалу від 5 до 8. Фармацевтичні композиції для ін'єкції (наприклад, шляхом внутрішньовенного, інтраперитонеального, інтрадермального, підшкірного, внутрішньом'язового або інтрапортального введення) або тривалої інфузії є суттєво вільними від видимих частинок та можуть включати від 0,1 нг до 100 мг антитіла, переважно від 5 мг та 25 мг антитіла. Способи одержання таких фармацевтичних композицій є добре відомими спеціалістові в даній області техніки. В одному втіленні фармацевтичні композиції включають від 0,1 нг до 100 мг антитіл згідно з винаходом в одиничній дозі, необов'язково разом із інструкціями щодо застосування. Фармацевтичні композиції згідно з винаходом можуть бути ліофілізованими (висушені заморожуванням) для відновлення перед застосуванням згідно зі способами, добре відомими та очевидними спеціалісту в даній області тех 25 ніки. Якщо втілення згідно з винаходом включають антитіла lgG1 ізотипу згідно з винаходом, то до фармацевтичної композиції може додаватися комплексон міді, такий, як цитрат (наприклад, цитрат натрію) або ЕДТА, або гістидин, для зниження ступеня опосередкованої міддю деградації антитіл цього ізотипу, див. ЕР0612251. Ефективні дози та режими лікування для введення антитіла згідно з винаходом в загальному випадку визначаються емпірично та залежать від факторів, таких, як вік, вага та загальний стан здоров'я пацієнта, та захворювання або розладу, що піддається лікуванню. Такі фактори знаходяться у межах компетенції практикуючого лікаря. Керівництво стосовно вибору прийнятних доз може бути знайдене, наприклад, у Smith та ін. (1977) Antibodies in human diagnosis and therapy, Raven Press, New York, але у загальному випадку дози будуть знаходитися у межах від 1 мг до 1000 мг. В одному втіленні режим дозування для лікування пацієнта, який є людиною та страждає на ревматоїдний артрит, складає 100 мг або приблизно таку кількість (тобто, від 50 мг до 200 мг) антитіла згідно з винаходом (або його антигензв'язувального фрагменту), що вводиться підшкірно один раз на тиждень або кожні два тижні. Композиції згідно з винаходом можуть також використовуватися з профілактичною метою. В залежності від захворювання або розладу, що піддається лікуванню, фармацевтичні композиції, що включають терапевтично ефективну кількість антитіла згідно з винаходом, можуть використовуватися одночасно, окремо або послідовно з ефективною кількістю іншого лікарського засобу, такого, як протизапальний агент, наприклад, NSAID, метотрексат, буциламін, тіомалат натрію або один або більше агентів для aHTH-TNF-альфа лікування, таких як Енбрел™ (етанерцепт), Ремікад™ (інфліксимаб), Хуміра™ (адалімумаб) та/або CDP870. Антитіла згідно з винаходом можуть використовуватися у комбінації з ефективною кількістю антитіла, спрямованого проти рецептора-ТNFальфа, див. Davis MW та ін. (2000) Ann Rheum Dis 59(Suppl 1): 41-43. В інших втіленнях антитіла згідно з винаходом у комбінації з ефективною кількістю агента, направленого проти; IL-1/IL-1R (наприклад, Kineret™), CTLA4-lg, IL-6 (див. Choy та ін., (2002) Ann.Rheum.Dis 61 (suppl 1): 54), IL-8, IL-15, VEGF, IL-17, IL-18 (див. Taylor та ін. (2001) Curr.Opin.Immunol. 13: 611-616), анти-ІСАМ та/або анти-СD4 антитіл, агентів, направлених проти члена родини ММР, наприклад, ММР-1, 2, 3 та/або 13. Антитіла згідно з винаходом можуть використовуватися у комбінації з агентом, що руйнує клітини, які є втягненими у запальний процес, наприклад, CD20 позитивні В клітини, при використанні наприклад, Mabthera™ (Ритуксимаб). Інші терапії у комбінації з антитілами згідно з винаходом включають антиантигенні терапії, такі, як антагоністи інтегрину v3, Kringles 1-5 (див. Sumariwalla P та ін. (2003), Arthritis Res Ther 5:R32-R39.), розчинний Flt-1 (див. Miotla та ін., (2000) Lab.lnvest. 80:11951205), анти-СОХ-2 агент або анти-OSM агент, такий, як анти-OSM антитіло, див. WO2005/095457, повний зміст яких специфічно введено у дану зая 96595 26 вку як посилання та до яких читач може, зокрема, звернутися. Традиційно фармацевтична композиція, що включає набір частин антитіла згідно з винаходом або його антигензв'язувальний фрагмент разом з іншими лікарськими засобами, необов'язково разом з інструкціями щодо застосування, також передбачається даним винаходом Ці комбінації можуть бути, зокрема, корисними у лікуванні артритних захворювань/розладів, таких, як ревматоїдний артрит. 7. Клінічні застосування Антитіла згідно з винаходом можуть використовуватися у терапевтичному лікуванні опосередкованих IL-18 захворювань, таких, як аутоімунні захворювання. Особливий інтерес представляє розсіяний склероз, артритні захворювання, такі, як ревматоїдний артрит, діабет типу 1, запальне захворювання кишечнику (IBD) та псоріаз. Таким чином, винахід додатково включає спосіб лікування пацієнта, який є людиною, що страждає на захворювання, яке є чутливим до нейтралізації hlL18 (таке, як ревматоїдний артрит, діабет типу 1, запальне захворювання кишечнику (IBD) та псоріаз), де вказаний спосіб включає введення вказаному пацієнтові терапевтично ефективної кількості антитіла згідно з винаходом, зокрема, антитіла, що містить важкий ланцюг з послідовністю, як представлено у SEQ.I.D.NO:9, та легкий ланцюг, що має послідовність, як представлено у SEQ.I.D.NO:13. Також забезпечується застосування антитіла згідно з винаходом у виробництві лікарського засобу для лікування будь-якого одного (або більше) згаданих вище захворювань/розладів. Таблиця А Опис білка або полінуклеотиду (PN) CDRH1 CDRH2 CDRH3 CDRL1 CDRL2 CDRL3 Людський IL-18 Людський 11-18 PN Н1 важкого ланцюга (варіабельна + константна ділянки) Н1 важкого ланцюга (PN) Н1 варіабельна ділянка Н1 варіабельна ділянка (PN) L2 легкий ланцюг (варіабельна + константна ділянки) L2 легкий ланцюг (PN) L2 варіабельна ділянка L2 варіабельна ділянка (PN) Н2 важкого ланцюга (варіабельна + константна) Н2 важкого ланцюга (PN) Н2 варіабельна ділянка Н2 варіабельна ділянка (PN) Н3 важкого ланцюга (варіабе Ідентифікатор послідовності (SEQ.I.D.NO:) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 27 льна + константна) Н3 важкого ланцюга (PN) Н3 варіабельна ділянка Н3 варіабельна ділянка (PN) L1 легкий ланцюг (варіабельна + константна ділянки) L1 легкий ланцюг (PN) L1 варіабельна ділянка L1 варіабельна ділянка (PN) L3 легкий ланцюг (варіабельна + константна ділянки) L3 легкий ланцюг (PN) L3 варіабельна ділянка L3 варіабельна ділянка (PN) lgG1 2c10 химерного антитіла (щур-людина) lgG1 2с10 химерного антитіла (щур-людина) (PN) Скаппа 2с10 химерного антитіла (щур-людина) Скаппа 2с10 химерного антитіла (щур-людина) (PN) Акцепторний каркас важкого ланцюга Акцепторний каркас легкого ланцюга JH6 амінокислотна послідовність, додана до SEQ.I.D.NO:37 Jkanna 2 амінокислотна послідовність, додана до SEQ.I.D.NO:38 96595 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 7. Приклади для пояснення Наступні приклади ілюструють різноманітні аспекти винаходу. Загальне клонування, літування та інші способи рекомбінантної ДНК проводили так, як у загальних рисах викладено у Maniatis та ін., Molecular cloning (A laboratory manual), Cold Spring Harbor Laboratory, або Sambrook та ін. Molecular Cloning (A laboratory manual), Cold Spring Harbor Laboratory. Векторні системи та додаткові способи молекулярної біології, що використовуються в даній заявці, є розкритими у WO2005/095457, повний зміст яких введено у дану заявку у вигляді посилання та до якого може, зокрема, звернутися читач. 7.1 Клонування гібридомних варіабельних ділянок Вихідне антитіло 2С10 є представленим у патенті США № 6,706,487. Читач, зокрема, може звернутися до цього документу. Химерне антитіло 2С10с було сконструйовано на основі опублікованих V-ділянок щурів, описаних вище, поєднаних із людським lgG1 або С каппа ділянками. Сигнальна послідовність генеричного імуноглобуліну та стар 28 товий кодон трансляції ATG вводили для конструкцій важкого та легкого ланцюгів. Hind III та BsiWI сайти рестрикції для ендонуклеази були призначені для створення VL домену та дозволяли проводити клонування в експресійні вектори ссавців, що вже містять людську С каппа ділянку (SEQ.I.D.NO:36). Hind III та Spel сайти рестрикції для ендонуклеази були призначені для створення VH домену та дозволяли проводити клонування в експресійні вектори ссавців, що вже містять людську 1С ділянку (SEQ.I.D.NO:34). Це приводило до одержання двох замін амінокислот у каркасі 4 Vh діляки 2С10 (Kabat залишки 107 та 108) з опублікованої послідовності, як показано у послідовності SEQ.ID. NO: 33. Олігонуклеотиди, що перекриваються, використовували для побудови цільної кодуючої послідовності за допомогою ПЛР та клонування в експресійні вектори зазначені вище. Після перевірки послідовностіхимерне антитіло експресувало СНО клітини. Одержане антитіло очищали від клітинних супернатантів за допомогою афінноїх хроматографії на сефарозі з використанням рекомбінантного білка А. Химерні антитіла 2С10 оцінювали в аналізах зв'язування in vitro для того, щоб продемонструвати порівняну ефективність з вихідним щурячим 2С10. Цього досягали шляхом визначення значень ЕС50 для зв'язування з IL18 людини або мавп-резус в аналізі ELISA (Фігури 16 та 17) або шляхом інгібування вивільнення IFN- в біоаналізі KG-1, див. Фігуру 15. 7.2 Гуманізація 7.2.1 Стратегія гуманізації легкого ланцюга Для послідовності варіабельного легкого ланцюга щурячого 2С10 відбирали людську зародкову лінію акцепторного каркасу (F_IGKV1D-12-1, SEQ.I.D.NO:38), що мала 64% ідентичність (включаючи CDR) з послідовністю варіабельного легкого ланцюга щурячого 2С10. V ділянку зародкової лінії поєднували при використанні комп'ютерного моделювання із прийнятною FR4, у цьому випадку Jділянка каппа 2 мінігену (Kabat Vol.II) базувалася на подібності послідовності (SEQ.I.D.NO:40). Одержували три гуманізовані варіанти на основі порівняння послідовностей та можливого впливу на функцію антитіла. Конструкція L1 була отримана в результаті безпосереднього пересаджування щурячих CDR (при використанні визначення Kabat) у людський акцепторний каркас, відібраний так, як описано вище. Конструкція L2 базувалася на L1 з однією додаткової зворотною мутацією у залишку 71. Конструкція L3 базувалася на L2 з чотирма додатковими зворотними мутаціями у залишках 45, 83, 84 та 85. Див. Таблицю 1. Таблиця 1: Загальна інформація стосовно одержаних гуманізованих варіантів VL 29 96595 30 7.2.2 стратегія гуманізації важкого ланцюга Для послідовності варіабельного важкого ланцюга щурячого 2С10 відбирали людську зародкову лінію акцепторного каркасу (Fp_IGKV1-f_2, SEQ.I.D.NO:37), що мала 59%-ну ідентичність (включаючи CDR) з послідовністю варіабельного легкого ланцюга щурячого 2С10. V ділянку зародкової лінії поєднували при використанні комп'ютерного моделювання із прийнятною FR4, у цьому випадку JH6 мініген (Kabat Vol.II) базувався на подібності послідовності (SEQ.I.D.NO:39). Конструювали три гуманізовані варіанти варіабельного важкого ланцюга на основі цього каркасу. Констру кцію Н1 одержували в результаті безпосереднього пересаджування щурячих CDR (при використанні визначення Kabat) з чотирма додатковими зворотними мутаціями у залишках 27, 28, 29 та 93). Це дозволялося виявляти незвичайну амінокислотну послідовність безпосередньо вище CDR1 вихідного (тобто донорного) антитіла, що може містити частину CDR (як визначено Chothia). Конструкція Н2 базувалася на Н1 з двома додатковими зворотними мутаціями у залишках 39 та 40. Конструкція Н3, у свою чергу, базувалася на Н2 з іншими чотирма додатковими зворотними мутаціями у залишках 36, 71, 89 та 91. Див. Таблицю 2. 7.3 Гуманізація 2С10С Гуманізовані V ділянки синтезували заново за допомогою нарощування олігонуклеотидів, що перекриваються, та ПЛР ампліфікації. Праймери включали рестрикційні сайти для клонування у експресійні вектори ссавців та людські імуноглобулінові сигнальні послідовності для секреції. Гу манізовані V ділянки клонували в експресійні вектори ссавців як Н1, Н2 та Н3 при використанні Hindlll та Spel експресійних векторів ссавців, що включають людську гамма 1 константну ділянку, та як L1, L2 та L3 при використанні Hindlll та BsiWI в експресійні вектори ссавців, які містять людську каппа константну ділянку. Таким чином, одержу 31 вали гуманізовані варіанти важкого ланцюга людського ізотипу lgG1 та гуманізовані варіанти легкого ланцюг людського ізотипу каппа. 7.3.1 Експресія антитіла, що містить комбінацію гуманізованого важкого та легкого ланцюгів СНОК1 клітини транзієнтно трансфікували у чотирьохкратній повторності. Супернатанти аналізували на концентрацію антитіла та потім використовували в in vitro аналізах зв'язування при порівнянні з щурячим-людським химерним 2С10. Транзієнтну експресію у більших масштабах для усіх 9 варіантів проводили шляхом змішування, для кожного флакону, 51,4 мкг плазміди легкого ланцюга та 8,6 мкг плазміди важкого ланцюга з 240 мкг ліпіду для трансфекції (цей ліпід є описаним у WO2006/053783, Приклад 13, повний зміст цієї заявки є введеним у дану заявку як посилання) у 8 мл середовища (OptiMEIW глутамакс/ 5% FBS) та шляхом застосування цієї суміші до двох майже конфлуентних Т175 флаконів з СНОК1 клітинами протягом 72 годин при типових для тканинної культури умовах. Антитіла також експресували у поліклональній клітинній системі СНО у міліграмових кількостях та при використанні флаконів для струшування та очищених за допомогою FPLC і білка А. 7.4 In vitro аналіз зв'язування 7.4.1 Biacore аналіз Biacore™ кінетичний аналіз гуманізованих 2С10 антитіл проводили на приладі Biacore™ 3000 при використанні захоплення білком А антитіл у буфері HBS-EP (Biacore™). Коротко, білок А імобілізували на СМ5 чіпі шляхом зв'язування первинного аміну у відповідності з рекомендованими прописами виробника до щільностей приблизно 20004000 резонансних одиниць (RU). Гуманізоване антитіло потім пропускали над поверхнею білка А 96595 32 та проводили захоплення до рівнів приблизно 200500 RU після періоду стабілізації. IL-18 (людини або мавпи-резус) пропускали над поверхнею захопленого антитіла при визначених концентраціях та одержували сенсограмми зв'язування. Регенерація при використанні умов кислотного елюювання приводила до загального видалення захопленого антитіла з поверхні білка А та значним чином не знижувала здатності до поверхневого зв'язування. Усі криві піддавали подвійному порівнюванню з ін'єкцією буфера замість IL18, ці дані піддавали апроксимації до моделі зв'язування 1:1 при використанні загальних параметрів відповідності у BiaEval 4.1. Впорядковані експерименти по вивченню швидкості дисоціації проводили при використанні того самого способу захоплення білка А, проте використовували тільки одну концентрацію IL18 (10 нМ). Хоча дані піддавали апроксимації при використанні тієї самої моделі зв'язування, що й для кінетичного аналізу, після чого представляли тільки одну концентрацію аналіту, використовуваного для визначення швидкості дисоціації аналіту, це значення є корисним для впорядковування більше, ніж надання значень точного кінетичного вимірювання, та його використовували як шлях для відбору антитіл, які будуть піддаватися додатковому дослідженню. Початкові результати при 25°С показують, що усі конструкції мають подібні зв'язувальні афінності з людським IL18, що й щуряче 2С10 вихідне антитіло. Проте, коли впорядковані експерименти по вивченню швидкості дисоціації проводили при 37°С, L1 конструкції були гіршими у порівнянні з L2 та L3 конструкціями стосовно підвищення, яке спостерігали для швидкостей дисоціації (Таблиці 3а та 3b). 33 Крім слабкої ефективності при 37°С, L1 конструкції також були гіршими стосовно афінності зв'язування з IL18 мавп-резус (Таблиця 4а) при 25°С. Базуючись на цих спостереженнях, вибрані антитіла досліджували більш детально на зв'язування з IL18 людини та мавп-резус при 37°С. Дані, представлені у Таблиці 4b для людського IL-18, є середнім значенням (та стандартне відхилення) шести окремих визначень. Дані для IL-18 мавпрезус показують середнє значення та стандартне відхилення двох експериментів для H1L2 та H1L3, у той час, як дані для H3L2 та H3L3 є такими, що одержані з одного експерименту. Порівняно високі стандартні відхилення цих даних ймовірно є ре 96595 34 зультатом проведення цього експерименту при температурі 37°С. Той факт, що L1 конструкції були відносно гіршими, є несподіваним, якщо взяти до уваги, що різниця між L1 та L2 конструкціями полягає у заміні фенілаланіну тирозиновою зворотною мутацією у положенні 71 легкого ланцюга. Як тирозин, так і фенілаланін, є звичайно ароматичними амінокислотами, тому той факт, що така непомітна заміна у каркасній структурі приводить до значних результатів (стосовно зв'язувальної афінності), що спостерігається у системі Biacore™ при 37°С (але не 25°С), є несподіваним. 35 Варіанти H1L1, H1L2 та H1L3 відбирали для подальшого аналізу у розділі 7.4.2, що приведений нижче. 7.4.2 Дані Biacore аналізу Т100 Характеристику деяких варіантів антитіл проводили далі при використанні пристрою Т100 Biacore™. Цей пристрій забезпечує переваги у порівнянні з Biacore™ 3000 стосовно чутливості, температурного контролю та стабільності базової лінії при більш високих температурах завдяки застосуванню лінійного дегазатора, який мінімізує буферні ефекти при вищих температурах. Він також пропонує поліпшене програмне забезпечення, таке, як автоматичний аналіз даних. Методика в основному є такою самою, що й для способу, який використовується у розділі 7.4.1, що описаний вище; Biacore™ кінетичний аналіз гуманізованих 2С10 антитіл проводили на приладі Biacore™ 3000 при використанні захоплення білком А антитіл у буфері HBS-EP (Biacore™). Білок А імобілізували на СМ5 чіпі шляхом зв'язування первинного аміну до щільностей приблизно 2000-4000 RU. Анти-IL18 антитіла захоплювали до рівнів приблизно 200-500 RU, людський IL18 пропускали над цією поверхнею із захопленими антитілами при концентраціях від 160,0625 нМ, концентрацію 0 нМ (тобто тільки буфер 96595 36 для ін'єкції захопленого антитіла) використовували для подвійного порівняння. Регенерацію після кожної ін'єкції IL18 проводили за допомогою елюювання при помірно кислих умовах при використанні двох ін'єкцій 10 мМ гліцину, рН1,5. Цей етап регенерації видаляв захоплене антитіло з поверхні білка А (та таким чином, будь-який IL18, зв'язаний з нею). Регенерація суттєво не змінювала здатності поверхні білка А зв'язувати подальші порції антитіла, дозволяючи, таким чином, проводити інший аналіз захоплення. Одержані криві зв'язування аналізували при використанні програмного забезпечення для аналізу, що є встановленим на пристрої Т100, при використанні моделі зв'язування 1:1. Прогони здійснювали при вказаних температурах. Аналіз зв'язування H1L1 та H1L2 при 15°С, 20°С, 25°С, 32°С та 37°С Експеримент проводили при використанні вказаного вище способу при різних температурах. Фігура 1 показує вплив температури на швидкість зв'язування (kа), у той час, як Фігура 2 показує вплив на швидкості дисоціації (kd), а Фігура 3 вплив на константу рівноваги (KD). Таблиця 5 деталізує кінетичні значення, що використовували для створення цих фігур. 37 96595 38 Ці дані показують, що швидкості зв'язування двох антитіл, які піддавали аналізу, є подібними протягом усього проаналізованого інтервалу температур, при цьому H1L2 в загальному випадку має більш високу швидкість зв'язування аж до заключного значення при 37°С, коли H1L1 має більш високу швидкість зв'язування. Проте більша відмінність спостерігається, коли аналізувати швидкості дисоціації, два антитіла мають подібні швидкості дисоціації при 15°С, 20°С, 25°С, але вони починають розходитися при 32°С та 37°С, з найбільшою швидкістю дисоціації, яку спостерігали для H1L1. Ці зміни знайшли своє відображення у загальній константі дисоціації (яка є функцією kd/ka), та показують, що різниця між H1L1 та H1L2 полягає в основному у стабільності комплексу антитіло/ІL18, як визначається швидкістю дисоціації (kd). Аналіз зв'язування H1L1, H1L2, H1L3 та химерного 2С10 при 25°С та 37°С Експерименти проводили так, як описано вище. Таблиця 6 деталізує одержані кінетичні параметри. Дані показують, що H1L2 є кращим антитілом, ніж H1L1 стосовно зв'язування, як визначається за допомогою константи рівноваги KD як при 25°С, так і при 37°С, але кінетичні параметри показують, що при 25°С H1L2 має більш високу швидкість зв'язування (ка), ніж H1L1. При 37°С положення змінюється, що свідчить про те, що відмінне зв'язування, яке спостерігали при 37°С для H1L2, є більшим завдяки швидкості дисоціації (kd), це показує, що мутація, яке відрізняє L2 від L1 надає підвищеної стабільності комплексу ІL18-антитіло при більш високих температурах. Ці дані є середнім значенням ряду окремих наборів даних (n), показані середнє значення та стандартне відхилення зі стандартним відхиленням у дужках. Значення для 25°С та 37°С прогонів для H1L1 та H1L2 одержували з аналізів при різних температурах та включали у цей набір даних. 7.4.3 Оцінка 2С10с гуманізованих варіантів в аналізі ELISA зв'язування IL18 ELISA з усіма дев'ятьма гуманізованими варіантами проводили принаймні 6 разів при використанні різних партій очищеного препарату антитіла. Фігури 4А-4С представляють собою характерні дані з одного експерименту, який забезпечував одержання ранжування значень ЕС50, які проілюстровані у Таблиці 7. Людський IL-18 імобілізували на планшеті на 96 комірок Nunc Maxisorp при ви 39 96595 40 користанні 2,5 мкг/мл 16D10 (ненейтралізоване мишине моноклональне антитіло) для захоплення 5 нг/мл рекомбінантного людського IL-18. Анти-ІL18 гуманізовані антитіла додавали при різних роз веденнях. Зв'язані гуманізовані антитіла визначали при використанні анти-людського IgG Fc спеціфічного пероксидазного кон'югату (Sigma A0170). Встановлені ефективності усіх варіантів були близькими до таких 2С10 химерного антитіла, що дає змогу запропонувати, що гуманізація приводить до незначної втрати ефективності. Незважаючи на те, що значення ЕС50, одержані при використанні декількох повторів цих аналізів, не давали ранжування варіантів, тільки один аналіз ELISA дав змогу виявити чітку відмінність між цими варіантами (див. Таблицю 7 та Фігури 4А4С). Одержання певної відмінності між варіантами досягали при використанні Biacore™ (розділи 7.4.1 та 7.4.2), що приводив до виявлення тільки 4 проаналізованих варіантів, які були близькими у декількох незалежних експериментах при використанні IL18 людини та мавп-резус (Таблиця 8, Фігура 5 [людини] та 6 [мавпи-резус]). 7.4.4 Оцінка Н1 гуманізованих варіантів 2С10 в ELISA аналізі зв'язування 1L-18 ELISA здійснювали із трьома гуманізованими варіантами Н1; H1L1, H1L2 та H1L3 для оцінки зв'язування з людським IL-18 при кімнатній температурі та при 37°С у сироватці людини та розчині для блокування (PBS 0,05% Твін з 1% БСА (ваг./об.)). Гуманізовані варіанти антитіла (мобілізували на Nunc Maxisorp планшетах на 96 комірок при концентрації 2,5 мкг/мл. Захоплення 5 нг/мл рекомбінантного людського IL-18 проводили або при кімнатній температурі, або при 37°С у сироватці людини або у розчині для блокування. Додавали анти-ІL-18 мишине моноклональне антитіло 16D10. Зв'язане мишине антитіло визначали при використанні антимишиного каппа пероксидазного кон'югату (Serotec MCA 1291Р). Репрезентативні значення ЕС50, одержані з даних цього дослідження, проілюстровані у Таблиці 9. 41 Ефективність трьох гуманізованих Н1 варіантів не піддавалася впливу при зміні температури, при якій проводили етап зв'язування людського IL-18, при температурі від кімнатної до 37°С, у цьому аналізі. Більш низькі сигнали зв'язування спостерігали тоді, коли антитіла були присутніми у людській сироватці. 7.4.5 Оцінка стабільності гуманізованого Н1 варіанту антитіла при 37°С Стабільність при зберіганні трьох гуманізованих Н1 варіантів; H1L1, H1L2 та H1L3, оцінювали протягом періоду часу 14 днів при 37°С у сироватці людини, а також у забуференому фосфатом фізіологічному розчині. Антитіла розводили до концентрації 50 мкг/мл, стабільність оцінювали шляхом аналізу ELISA зв'язування IL-18 після інкубації при 37°С протягом періодів 0, 1, 4, 6, 8 та 14 днів. Для аналізу зв'язування IL-18 16D10 (ненейтралізоване мишине моноклональне антитіло) імобілізували на Nunc Maxisorp планшетах для захоплення 5 нг/мл рекомбінантного людського IL-18. Відбирали зразки анти-ІL-18 гуманізованих антитіл у різні моменти часу при інкубації при 37°С Зв'язані гуманізовані антитіла визначали при використанні антилюдського IgG Fc специфічного пероксидазного кон'югату. Піддання впливу температури 37°С протягом 0, 1, 4, 6, 8 та 14 днів не впливало на зв'язувальну ефективність гуманізованих Н1 варіантів антитіла, як було виявлено на основі їх здатності зв'язуватися з людським IL-18 у цьому форматі аналізу. 96595 42 7.5 Зв'язування H1L2 з людським IL18 у присутності синовіальної рідини Проводили аналіз ELISA, при цьому 50% людську синовіальну рідину доповнювали рекомбінантним людським IL18 при концентрації, що коливається від 500 нг/мл до 0 нг/мл. IL-18, що міститься у цьому розчині, потім переносили до комірок Maxisorp (Nunc) планшету на 96 комірок, вкритого H1L2 антитілом. Зв'язаний IL-18 потім визначали за допомогою біотинільованого антиІL-18 антитіла (D045-6, MBL) та стрептавідинуHRP. Титрування рекомбінантного людського IL18 в 50% синовіальній рідині (СР) забезпечувало майже однакову криву з титруванням людського рекомбінантного IL-18 у буфері тільки зі слабким зсувом на половину максимального значення. Див. Фігуру 7. Цей дослід демонструє здатність антитіла зв'язувати hlL-18 навіть у присутності 50% людської синовіальної рідини, що у більшому ступені імітує навколишнє оточення при зв'язуванні антитіла, що необхідно враховувати при терапевтичному застосуванні. 7.5.1 Зв'язування з IL18 у присутності білка, що зв'язує IL18 (IL18bp) Biacore™ методику (Biacore™ 3000) та ELISA використовували для визначення, чи може H1L2 все ще зв'язувати людський IL18 у присутності людського IL18bp. IL18bp має високу афінність для IL18 та діє як природний інгібітор функції IL18 (Фігура 8, Фігура 9 А та В, Таблиця 10 та Таблиця 11). Аналіз за допомогою Biacore 43 96595 44 Коротко, білок А імобілізували на поверхні СМ5 чіпу до щільностей приблизно 4000 резонансних одиниць (RU) шляхом зв'язування первинного аміну. Рекомбінантний Fc-IL18 зв'язувальний білок (R&D Systems) потім пропускали над поверхнею при концентрації 3 мкг/мл при низькій швидкості 10 мкл/хвилина протягом 1 хвилини; це приводило до захоплення приблизно 1400 RU IL18 зв'язувального білка. IL18 потім пропускали над поверхнею захопленого IL18 зв'язувального білка при концентрації 30 нМ, при низькій швидкості, що складає 10 мкл/хвилина протягом 5 хвилин. Після цього щуряче 2С10 вихідне антитіло при концентрації 10 нМ пропускали над поверхнею IL18 зв'язувального білка/ІL18 протягом 3 хвилин при швидкості 30 мкл/хвилина протягом 3 хвилин. Якщо епітоп, який впізнається 2С10 антитілом на IL18, стикається із сайтом взаємодії для IL18 зв'язувального білка, то можна спостерігати сигнал зв'язування. Фігура 10 демонструє, що 2С10 зв'язується з hlL-18, який, у свою чергу, був захоплений hlL-18BP, що свідчить про те, що сайти зв'язування 2С10 та hlL-18BP не перекриваються. Аналіз за допомогою ELISA Зв'язування гуманізованого H1L2 або 2С10 щурячого моноклонального антитіла із зв'язаним людським IL18, захопленим IL18bp, піддавали аналізу в аналізі прямого зв'язування ELISA, де рекомбінантний людський IL18bp-Fc злитий білок (R&D Systems #119-ВР) наносили на Nunc Maxisorp планшети при концентрації 0,5 мкг/мл. Рекомбінантний людський IL18 (реагент, що був наявний на фірмі) додавали при концентрації 100 нг/мл у блокувальному буфері (PBS, що містить 1% ваг/об. БСА). Додавали очищені антитіла при концентраціях, які коливаються від 0,5 нг/мл до 1 мнг/мл. Зв'язане антитіло визначали при використанні кон'югату анти-людський каппа легкий ланцюг-специфічного HRP (Sigma) або антищурячого IgG HRP. Фігура 18А та В ілюструють одержані результати. 7.6 In vitro біоаналіз 7.6.1 Активність гуманізованих конструкцій у нейтралізації стимульованого IL18 вивільнення IFN- у KG-1 клітинній лінії Цей аналіз вимірює нейтралізуючу активність специфічного для IL-18 антитіла та базується на IL-18-опосередкованій індукції IFN- в KG-1 клітинах. KG-1 (ATCC #ССL-246) являє собою людську мієломоноцитарну клітинну лінію, що конститутивно експресує функціональний рецептор IL-18 та, таким чином, відповідає на стимуляцію екзогенним IL-18. Усі дев'ять гуманізованих варіантів оцінювали на їх здатність інгібувати стимульоване людським IL18 вивільнення IFN- у KG-1 клітинах (Таблиця 12 та Фігура 11). 45 96595 46 Проводили принаймні 6 додаткових повторюваних експериментів на чотирьох бажаних гуманізованих варіантах, які продемонстрували найкращу афінність для рекомбінантного IL18 людини та мавп-резус на основі Biacore™ аналізу. Фігура 8 ілюструє репрезентативний резуль тат для чотирьох бажаних гуманізованих варіантів та для H1L1, а Таблиця 13 підсумовує тати цих аналізів, які усі проводили при використанні тієї самої партії білка, що походить від клітин СНОеіа. У випадках, коли H1L1 порівнювали з іншими гуманізованими варіантами, H1L1 продемонстрував більш низьку ефективність у порівнянні з іншими проаналізованими гуманізованими констру кціями, а також у порівнянні з вихідним 2С10 моноклональним антитілом. Проводили додатковий аналіз з чотирма бажаними моноклональними антитілами, які порів 47 96595 48 нювали на здатність інгібувати стимульоване IL18 вивільнення INF KG-1 клітинами: 2С10 та гуманізовані варіанти, що походять від 2С10 (H1L1, H1L2 та H1L3). KG-1 біоаналіз проводили у планшетах на 96 комірок шляхом інкубації 50 нг/мл рекомбінантного людського IL-18 та різних концентрацій антитіл, специфічних для IL18 (концентрація коливалася від 2 мкг/мл до 7,8 нг/мл, у подвійних розведеннях), або негативного контролю ізотипу (Synagis, анти-RSV антитіло) протягом 1 години при 37°С та 5% СО2, після чого додава5 ли 3 х 10 KG-1 клітин на комірку. На завершення планшети інкубували протягом 20-24 годин при 37°С, 5% СО2. Збирали супернатант та продукцію IFN визначали при використанні комерційного набору ELISA для людського IFN (Biosource AHC4432; АНС4539). Були проведені три експерименти. Результати для інгібування стимульованої IL-18 продукції IFN нормалізували до негативного контролю. Статистичний аналіз призначався для одержання оцінки ІС50 для кожного моноклонального антитіла на кожному етапі корегування після експерименту для будь-якої Synagis відповіді. Значення ІС50 піддавали статистичному аналізу для одержання середньої оцінки ІС50 для кожного моноклонального антитіла з 95% довірчим інтервалом (тобто статистично достовірний інтервал). Кожний гуманізований варіант на завершення знову порівнювали з 2С10 при використанні критерію Дуннетта. Фігура 12 ілюструє репрезентативний експеримент. Таблиця 14 та Фігура 13 показують середню оцінку ІС50 для кожного моноклонального антитіла з 95% довірчим інтервалом та % відмінності від щурячого 2С10 зі значеннями р та довірчими інтервалами. H1L1 є статистично менш ефективним, ніж 2С10 (р1 мкг/мл антитіла або IL18bp. Інгібування можна спостерігати вже при 10 нг/мл та при більш високих концентраціях, ІС50 значення для цього інгібування у присутності 10% або 25% людської сироватки показані у Таблиці 11. 49 96595 50 7.6.3 Підсумовування зв'язування з ортологами IL18 Зв'язування антитіла з IL18 інших видів перевіряли при використанні ELISA та Biacore, а також біоаналізу KG-1 клітин. Зв'язування спочатку проводили при використанні вихідного 2С10 та химерного 2С10с для IL18 мавп-резус/мавп циномолгус, але потім повторювали з деякими гуманізованими варіантами. Вихідне 2С10 піддавали аналізу на зв'язування із IL18 свині, миші та щура, а 4 найкращі гуманізовані варіанти аналі зували на зв'язування з IL18 мавп-резус/мавп циномолгус та собаки при використанні Biacore та ELISA. KG-1 біоаналіз проводили при використанні IL18 мавп-резус/мавп циномолгус та трьох моноклональних антитіл, 2С10 химерного та репрезентативно для гуманізованих варіантів, H3L3. За умови подібності усіх гуманізованих варіантів це, ймовірно, є репрезентативним для інших одержаних варіантів, включаючи H1L2 (див. Таблицю 15, Фігуру 8). 7.7 Дослідження циркулярного дихроїзму та термальної денатурації IL18 антитіл Дослідження циркулярного дихроїзму (CD) використовували для вивчення вторинних структурних змін IL18 антитіл як функцію температури, зокрема, від 25°С до 37°С. Дослідження термальної денатурації цих антитіл проводили для визначення їх термальної стабільності та їх температур плавлення (Тm.) CD спосіб: CD спектри одержували на застосовуваному фотофізичному спектрометрі Chirascan при скануванні від 180 нМ до 280 нМ, застосовуючи крок 0,5 нМ та ширину смуги 1нМ. Час експозиції на одну точку складав 5 секунд. Зразки розводили до концентрації приблизно 0,2 мг/мл у PBS та поміщали у камеру з довжиною шляху 1 мм Спектри кожного білка одержували при використанні термостатичної камери, встановленої на 4°С, 25°С та 37°С. Дійсні температури зразків визначали за допомогою зонда, який поміщали у рідину, що знаходиться у камері, ці температури були у межах ~3°С від встановленої температури. Тm спосіб: Усі білки розводили до концентрації 0,2 мг/мл у 1:1000 Sypro оранжевому у забуференому фосфатом фізіологічному розчині 51 96595 52 (PBS). Флуоресценцію вимірювали при 620 нМ (збудження при 490 нМ) при використанні пристрою Віоnееr Exicycler з інтервалом кожні 0,5°С, у той час, як температуру зразка підвищували від 10°С до 95°С, при очікуванні 10 секунд у кожній температурній точці. Криві денатурації підганяли до стандартної ізотерми плавлення при використанні Grafit. Як очікувалося, порівняння форми CD спектра для усіх чотирьох антитіл показало, що їх структура являє собою таку високої бета складчастості, а також, що вони мають суттєво таку саму архітектуру. У температурному інтервалі від 4°С до 37°С три антитіла: H1L1 H1L2 H1L3 не продемонстрували значних змін у своїй вторинній структурі, як було виявлено за допомогою CD. Проте химерне 2С10 антитіло показало слабке скорочення у цьому температурному інтервалі. Це є послідовним із тенденцією до термальної стабільності, що приведена у Таблиці 16, яка представлена нижче. H1L1, H1L2 та H1L3 є виражено стабільними далеко за межами температури 37°С, без ознак будь-якої денатурації при температурі тіла. Є малоймовірним, що їх відмінність щодо термаль ної стабільності забезпечує будь-які відмінні переваги при нормальній температурі тіла та при кімнатній температурі. 53 96595 54 55 96595 56 57 96595 58 59 96595 60
ДивитисяДодаткова інформація
Назва патенту англійськоюHumanized anti-interleukin-18 antibody
Автори англійськоюEllis Jonathan Henry, Germaschewski Volker, Hamblin, Paul, Andrew, Kirby, Ian
Назва патенту російськоюГуманизированное анти-интерлейкин-18 антитело
Автори російськоюЭллис Джонатан Генри, Гермащевски Волкер, Амбли Пол Эндрю, Кирби Ян
МПК / Мітки
МПК: A61K 39/395, C07K 16/24, C12N 15/13, A61P 37/00
Мітки: анти-інтерлейкін-18, гуманізоване, антитіло
Код посилання
<a href="https://ua.patents.su/48-96595-gumanizovane-anti-interlejjkin-18-antitilo.html" target="_blank" rel="follow" title="База патентів України">Гуманізоване анти-інтерлейкін-18 антитіло</a>
Попередній патент: Монтажний вузол
Наступний патент: Поліпшений видавальний пристрій
Випадковий патент: Композиція інгредієнтів для горілки "метрополь"