Варіант людського gdnf
Номер патенту: 112981
Опубліковано: 25.11.2016
Автори: Льюнг Донмайєнн Дон Мун, Сміт Розамунд Керол, Лу Цзіжон, Ганем Махмуд, О'Брайан Лінда Морін, Мерчант Калпана Махеш
Формула / Реферат
1. Варіант людського GDNF, який містить амінокислотну послідовність, вибрану з групи, яку складають
RGQRGKQRGCVLTAIHLNVTDLGLGYETKEELIFRYCSGSCDAAETTYDKILKNLSRNRRLVSEKVGQACCRPIAFDDDLSFLDDNLVYHILRKHSAKRCGCI(SEQ ID NO: 9), RGQRGKQRGCVLTAIHLNVTDLGLGYETKEELIFRYCSGSCDAAETTYDKILANLSKNKRLVSEKVGQACCRPIAFDDDLSFLDDNLVYHILRKHSAKRCGCI(SEQ ID NO: 12).
2. Варіант людського GDNF за п. 1, який являє собою
RGQRGKQRGCVLTAIHLNVTDLGLGYETKEELIFRYCSGSCDAAETTYDKILKNLSRNRR LVSEKVGQACCRPIAFDDDLSFLDDNLVYHILRKHSAKRCGCI(SEQ ID NO: 9).
3. Варіант людського GDNF за п. 1, який являє собою RGQRGKQRGCVLTAIHLNVTDLGLGYETKEELIFRYCSGSCDAAETTYDKILANLSKNK RLVSEKVGQACCRPIAFDDDLSFLDDNLVYHILRKHSAKRCGCI(SEQ ID NO: 12).
4. Фармацевтична композиція, яка містить варіант людського GDNF за будь-яким із пп. 1-3 і один або декілька фармацевтично прийнятних розріджувачів, носіїв або наповнювачів.
5. Спосіб лікування хвороби Паркінсона, який включає введення ефективної кількості композиції за п. 4 пацієнту-людині, що потребує цього.
6. Варіант людського GDNF за будь-яким із пп. 1-3 для застосування як лікарського засобу.
7. Варіант людського GDNF за будь-яким із пп. 1-3 для застосування при лікуванні хвороби Паркінсона.
8. Спосіб лікування хвороби Паркінсона у ссавців, який включає етап введення ссавцю варіанта людського GDNF за будь-яким із пп. 1-3.
9. Варіант людського GDNF за будь-яким із пп. 1-3 для застосування як терапевтичного засобу.
10. Спосіб лікування хвороби Паркінсона, який включає введення ефективної кількості варіанта людського GDNF за будь-яким із пп. 1-3 ссавцю, який потребує цього.
Текст
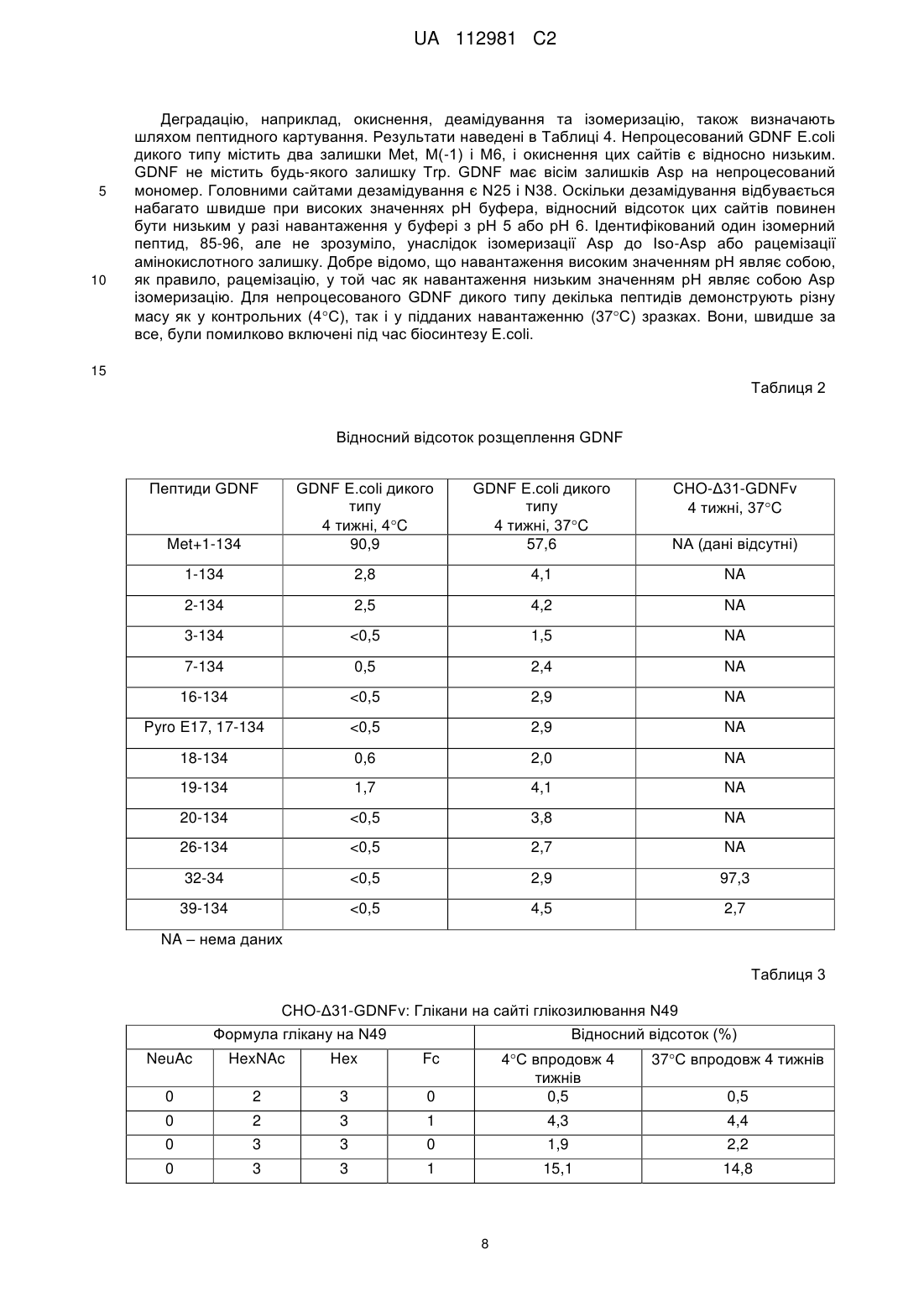
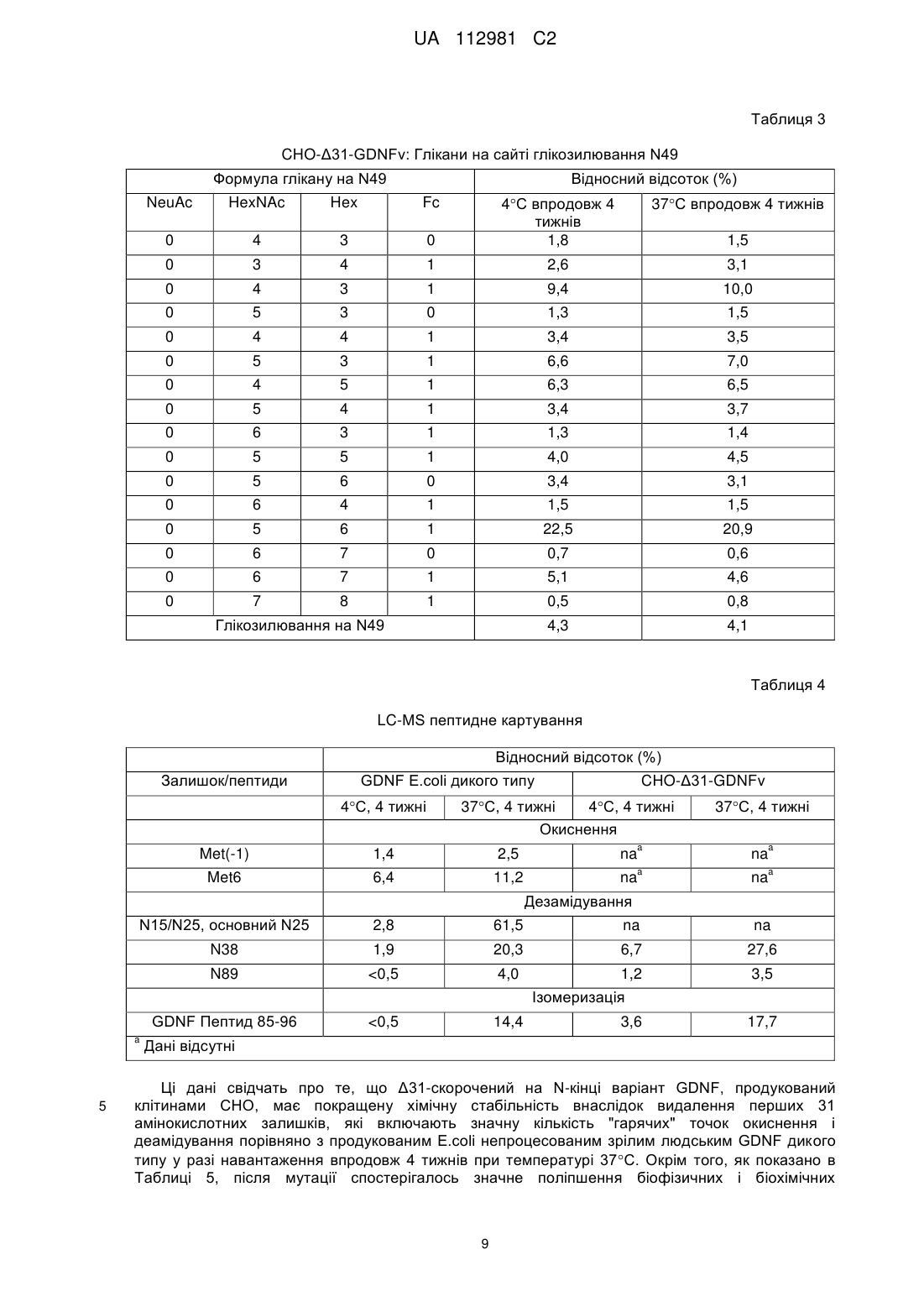
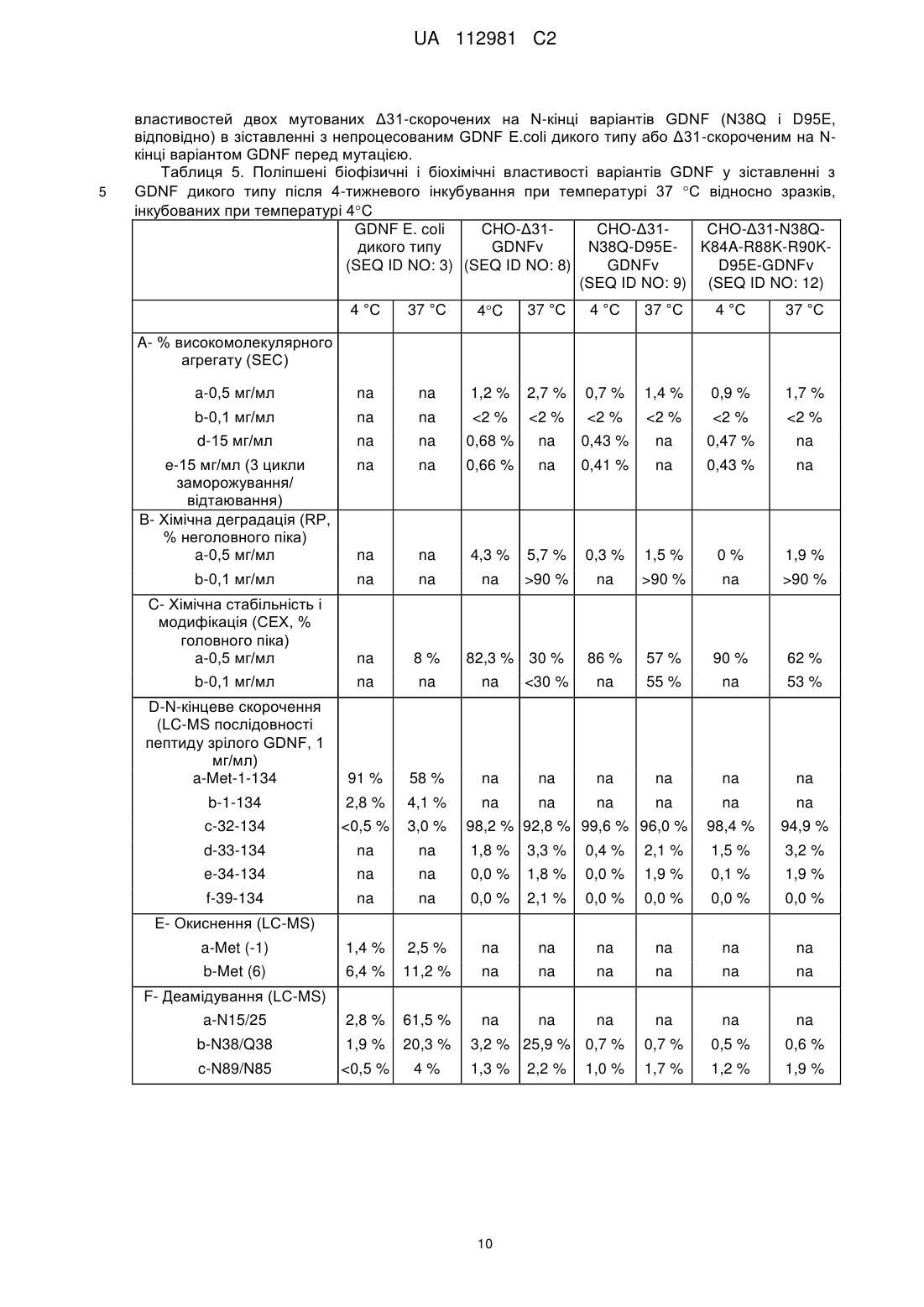
Реферат: Винахід стосується варіанта людського нейротрофного фактора з гліальних клітин (GDNF), фармацевтичної композиції, що його містить, та застосування варіанта людського GDNF як терапевтичного засобу. Винахід також стосується способу лікування хвороби Паркінсона за допомогою вказаного варіанта людського GDNF. UA 112981 C2 (12) UA 112981 C2 UA 112981 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід стосується медицини, зокрема, – терапевтичних білків. Конкретно, цей винахід стосується нових варіантів людського нейротрофного фактора з гліальних клітин (GDNF). Нові варіанти GDNF можуть бути корисними для лікування хвороби Паркінсона. GDNF є добре відомим нейротрофним фактором, який, за повідомленнями, забезпечує трофічну підтримку допамінергічних нейронів in vitro та in vivo. Крім того, повідомлялось, що GDNF забезпечує функціональні поліпшення і чинить нейропротекторну дію у моделях хвороби Паркінсона на гризунах та приматах. Білок GDNF дикого типу E.coli вводили у кору головного мозку пацієнтів, які страждають на хворобу Паркінсона, з перемінним успіхом. За результатами двох невеликих досліджень з відкритою етикеткою повідомлялось, що GDNF дикого типу забезпечує довгострокове поліпшення рухової функції. Однак в рандомізованому плацебоконтрольованому випробуванні у Фазі IIa на 34 пацієнтах введення GDNF досередини шкаралупи сочевицеподібного ядра смугастого тіла не продемонструвало симптоматичного поліпшення впродовж 6 місяців. Підвищення рівня біомаркерного сигналу було очевидним лише в тканині, яка безпосередньо оточувала місце інфузії. В одному з останніх повідомлень стверджується, що GDNF може бути перспективною молекулою для врятування умираючих нервів; однак доставляння вказаної молекули до відповідної ділянки головного мозку залишається складним завданням. Nature, Vol 466:19 August 2010. У WO97/11964 (PCT/US96/14915) повідомлено про скорочені білки GDNF; однак, як і раніше, залишається потреба в нових варіантах GDNF з бажаними фармакологічними властивостями, стабільністю та біорозподільними властивостями. Існує потреба в варіантній формі GDNF, яка є стабільною в пристрої для доставки і полегшує бажаний біорозподіл у головному мозку, з одночасною демонстрацією при цьому бажаної активності і прийнятних імуногенних властивостей. Варіанти GDNF, що демонструють одну або декілька із цих бажаних властивостей, можуть бути новим фармацевтично корисним лікарським засобом, зокрема, для застосування в лікуванні хвороби Паркінсона. Цим винаходом запропонований новий скорочений варіант GDNF зрілого людського домену GDNF, якому бракує перших 31 амінокислоти на N-кінці ("Δ31-скорочений на N-кінці GDNF"), з певними амінокислотними замінами, введеними для того, щоб надати стабільні прийнятно активні варіанти GDNF, які забезпечують бажані біорозподільні властивості і фармацевтично прийнятний профіль імуногенності. Цим винаходом запропоновані певні варіанти людського GDNF, які мають одну чи декілька переваг порівняно зі зрілим людським GDNF дикого типу, включаючи варіанти, які мають поліпшену фармацевтичну стабільність, а також поліпшений біорозподіл, знижений рівень зв'язування гепарину, знижений ступінь деамідування, знижену сприйнятливість до утворення сукциніміду і знижений потенціал імуногенності порівняно з людським GDNF дикого типу. Певні нові варіанти GDNF можуть бути корисними новими варіантами лікування для пацієнтів із хворобою Паркінсона. Цим винаходом запропонований варіант людського GDNF, який містить послідовність SEQ ID NO: 23 RGQRGKQRGCVLTAIHLNVTDLGLGYETKEELIFRYCSGSCDAAETTYDKILXaa84NLSXaa88NXaa 90RLVSEKVGQACCRPIAFDDDLSFLDDNLVYHILRXaa125HSAKXaa130CGCI (послідовність SEQ ID NO: 23), де: i) Xaa84 – K або A; ii) Xaa88 – R або K; iii) Xaa90 – R або K; iv) Xaa125 – K або E; і v) Xaa130 – R або E. Крім того, цим винаходом запропонований варіант людського GDNF, вибраний з групи, яку складають: rgqrgkqrgcvltaihlnvtdlglgyetkeelifrycsgscdaaettydkilknlsrnrrlvsekvgqaccrpiafdddlsflddnlvyhilrkhsakr cgci (SEQ ID NO: 9), rgqrgkqrgcvltaihlnvtdlglgyetkeelifrycsgscdaaettydkilanlsknkrlvsekvgqaccrpiafdddlsflddnlvyhilrkhsak rcgci (SEQ ID NO: 12), та rgqrgkqrgcvltaihlnvtdlglgyetkeelifrycsgscdaaettydkilanlsknkrlvsekvgqaccrpiafdddlsflddnlvyhilrehsa kecgci (SEQ ID NO: 15). За одним з аспектів цим винаходом запропонований варіант людського GDNF, який містить амінокислотну послідовність, представлену послідовністю SEQ ID NO: 9: rgqrgkqrgcvltaihlnvtdlglgyetkeelifrycsgscdaaettydkilknlsrnrrlvsekvgqaccrpiafdddlsflddnlvyhilrkhsakr cgci. Крім того, цим винаходом запропонована проміжна форма, придатна для одержання Δ31скороченого на N-кінці варіанта зрілого людського GDNF. Вказана проміжна форма містить 1 UA 112981 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислотну послідовність, представлену послідовністю SEQ ID NO: 23 RGQRGKQRGCVLTAIHLNVTDLGLGYETKEELIFRYCSGSCDAAETTYDKILXaa84NLSXaa88NXaa RLVSEKVGQACCRPIAFDDDLSFLDDNLVYHILRXaa125HSAKXaa130CGCI (SEQ ID NO: 23), яка є 90 подовженою на N-кінці сигнальним пептидом секреторних білків. За цим описом можуть бути використані декілька послідовностей сигнального пептиду. До прикладів послідовностей сигнального пептиду належить мишачий лідерний сигнальний пептид каппа, який має послідовність METDTLLLWVLLLWVPGSTG (SEQ ID NO: 25), і сигнальний пептид людського соматотропного гормону, який має послідовність MATGSRTSLLLAFGLLCLPWLQEGSA (SEQ ID NO: 32). Проміжні форми, які містять ці сигнальні пептиди, можуть продукувати заявлені варіанти людського GDNF з підвищеним виходом у зіставленні зі скороченими генно-інженерними варіантами GDNF, які мають інші лідерні послідовності. Розкриті у цьому описі проміжні форми, які містять сигнальний пептид секреторних білків, можуть, наприклад, мати амінокислотну послідовність metdtlllwvlllwvpgstgrgqrgkqrgcvltaihlnvtdlglgyetkeelifrycsgscdaaettydkilknlsrnrrlvsekvgqaccrpiafdd dlsflddnlvyhilrkhsakrcgci (SEQ ID NO: 28); або matgsrtslllafgllclpwlqegsargqrgkqrgcvltaihlnvtdlglgyetkeelifrycsgscdaaettydkilknlsrnrrlvsekvgqaccr piafdddlsflddnlvyhilrkhsakrcgci (SEQ ID NO: 35). Цим винаходом запропонована фармацевтична композиція, яка містить варіант людського GDNF, як заявлено цим винаходом, і один або декілька фармацевтично прийнятних розріджувачів, носіїв або наповнювачів. Цим винаходом запропонований варіант людського GDNF для застосування як лікарський засіб. Цим винаходом також запропонований варіант людського GDNF для застосування в лікуванні хвороби Паркінсона. Цим винаходом запропонований варіант GDNF для застосування як терапевтичний засіб. Перевагу віддають варіанту, де Xaa84 – А, Xaa88 – К, і Xaa90 – K. Перевагу віддають варіанту, де Xaa84 – К, Xaa88 – R, і Xaa90 – R. Перевагу віддають варіанту, де Xaa125 – К, і Xaa130 – R. Перевагу віддають варіанту, де Xaa84 – А, Xaa88 – К, Xaa90 – К, Xaa125 – Е, і Xaa130 – Е. Докладний опис Раніше повідомлялось, що GDNF дикого типу зв'язується з гепарином і позаклітинним матриксом, ймовірно, через позитивні заряди, розташовані в N-кінцевих 1-31 амінокислотних залишках, з обмеженням тим самим розподілення GDNF при доставці до головного мозку (Lin et al., J. Neurochem. 63, 758-768, 1994; Rickard et al., Glycobiology 13, 419-426, 2003; Piltonen et al., Experimental Neurology 219, 499-506, 2009). Крім того, раніше повідомлялось також, що GDNF забезпечує функціональні поліпшення і чинить нейропротекторну дію у моделях хвороби Паркінсона на гризунах та приматах (Tomac et al, 1995; Gash et al., 1996). Білок GDNF дикого типу E.coli вводили до кори головного мозку пацієнтів, які страждають на хворобу Паркінсона, з перемінним успіхом. За результатами двох невеликих досліджень із відкритою етикеткою повідомлялось, що GDNF забезпечував довгострокове поліпшення рухової функції (Gill et al., 2003, Slevin et al., 2005). На додаток до цього, підвищене проростання допамінергічних нейронів було очевидним в одного пацієнта, який помер від сторонніх причин – інфаркт міокарда (Love et al 2005). Проте, в рандомізованому плацебо-контрольованому випробуванні у Фазі IIa на 34 пацієнтах, яке було проведено компанією Amgen, введення GDNF (ліатермін (Liatermin)) досередини шкаралупи сочевицеподібного ядра смугастого тіла не продемонструвало симптоматичного поліпшення впродовж 6 місяців (Lang et al., 2006). Заявлені варіанти GDNF демонструють поліпшені властивості порівняно з попередньо випробуваним білком GDNF E.coli дикого типу. Послідовність (211 амінокислот) непроцесованого генно-інженерного білка GDNF дикого типу, який містить сигнальний пептид (перші 19 амінокислот, SEQ ID NO: 4), продомен (курсив, SEQ ID NO: 5) і зрілий пептид (підкреслений, SEQ ID NO: 3), представлено як послідовність SEQ ID NO: 1: MKLWDVVAVCLVLLHTASAFPLPAGKRPPEAPAEDRSLGRRRAPFALSSDSNMPEDYPDQFDDV MDFIQATIKRLKRSPDKQMAVLPRRERNRQAAAANPENSRGKGRRGQRGKNRGCVLTAIHLNVTDL GLGYETKEELIFRYCSGSCDAAETTYDKILKNLSRNRRLVSDKVGQACCRPIAFDDDLSFLDDNLVYHI LRKHSAKRCGCI. Послідовність непроцесованої ДНК GDNF дикого типу представлено як послідовність SEQ ID NO: 2: atgaagctgtgggacgtggtggccgtgtgcctggtgctgctgcacaccgccagcgctttcccactgccagccggcaagagacccccag aggccccagccgaggacagaagcctgggcaggcggagggccccattcgccctgagcagcgacagcaacatgccagaggactaccccg accagttcgacgacgtcatggacttcatccaggccaccatcaagaggctgaagaggtcacccgacaagcagatggccgtgctgcccaggc gggagaggaacaggcaggccgccgccgccaacccagagaattccaggggcaagggcagaaggggtcaacggggcaagaacaggg 2 UA 112981 C2 5 10 15 20 25 30 35 40 45 50 55 60 gctgcgtgctgaccgccatccacctgaacgtgaccgacctgggcctgggctacgagaccaaggaggagctgatcttcaggtactgcagcgg cagctgcgacgccgccgagaccacctacgacaagatcctgaagaacctgagcaggaacaggcggctggtctccgacaaggtgggccag gcctgctgcaggcccatcgccttcgacgacgacctgagcttcctggacgacaacctggtgtaccacatcctgaggaagcacagcgccaaga gatgcggctgcatc. Положення амінокислот в варіантах GDNF за цим винаходом визначені за поліпептидом довжиною 134 амінокислоти зрілого людського GDNF дикого типу (SEQ ID NO: 3). Мутації позначають вихідною амінокислотою з подальшим номером положення амінокислоти, за яким йде замісна амінокислота. Числове позначення кожного варіанта грунтується на послідовності зрілого GDNF дикого типу (WT) ("зрілий GDNF WT") до скорочення. Наприклад, заміна Lys (К) в положенні 84 (тобто K84) на Ala (A) позначається як K84A. Аналогічним чином, декілька замін Lys (К) в положенні 84 на Ala (A), Arg (R) у положенні 88 на Lys (K), Arg (R) у положенні 90 на Lys (К) і Asp (D) у положенні 95 на Glu (Е) позначені як K84A/R88K/R90K/D95E. У значенні, вживаному у цьому описі, скорочення "KAKKE" стосується K84A-R88K-R90K-D95E. У значенні, вживаному у цьому описі, термін "непроцесований GDNF" означає повну послідовність білка, в тому числі сигнального пептиду, продомену і зрілого домену. У значенні, вживаному у цьому описі, термін "зрілий GDNF" або "непроцесований зрілий GDNF" означає непроцесований зрілий домен GDNF (з відщепленим сигнальним пептидом і продоменом). У значенні, вживаному у цьому описі, термін "Δ31-скорочений на N-кінці GDNF" означає зрілий домен GDNF, якому бракує перших 31 амінокислоти на N-кінці. У значенні, вживаному у цьому описі, термін "Δ31-скорочений на N-кінці GDNF" і "варіант людського GDNF" (або "GDNFv") вживаються взаємозамінювано. Непроцесовані генно-інженерні варіанти GDNF, у разі трансфікування клітин HEK293 впродовж 5 днів, продукують переважно непроцесований зрілий GDNF. Якщо непроцесованими генно-інженерними варіантами GDNF трансфікують клітини СНО протягом більш тривалого періоду часу і під час утворення стабільної клітинної лінії, переважаючими формами GDNF є скорочені форми (Lin et al., Science 260, 1130-1132, 1993). Дельта31 ("Δ31"), скорочена варіантна форма зрілого людського GDNF, у якій амінокислотні залишки номерів 1-31 були видалені на N-кінці, має послідовність SEQ ID NO: 8 і може бути виділена із суміші з подальшим очищенням. Δ31-скорочений на N-кінці варіант GDNF може продукуватись у ссавцевій або бактеріальній експресійній системі шляхом видалення як пептидної послідовності продомену, так і перших 31 амінокислотних залишків зрілого пептиду GDNF на рівні ДНК, і з використанням декількох послідовностей сигнальних пептидів, таких як нативний сигнальний пептид GDNF (SEQ ID NO: 4: MKLWDVVAVCLVLLHTASA); мишачий лідерний сигнальний пептид каппа (SEQ ID NO: 25: METDTLLLWVLLLWVPGSTG) і сигнальний пептид людського соматотропного гормону (SEQ ID NO: 32: MATGSRTSLLLAFGLLCLPWLQEGSA). Ці генно-інженерні конструкції можуть продукувати однорідні Δ31-скорочені на N-кінці варіанти GDNF одного виду. Фахівцю в цій галузі буде зрозуміло, що заявлені варіанти GDNF не виключають можливості глікозилювання. Заявлені варіанти GDNF можуть бути глікозильовані в міру необхідності, залежно від використаної експресійної системи. Так, наприклад, варіанти GDNF, експресовані ссавцем, глікозилюються в положенні N49, в той час як подібне не спостерігається у випадку бактеріально експресованих варіантів. При застосуванні під час експресії непроцесованої нативної генно-інженерної послідовності (SEQ ID NO: 2) продукується суміш видів GDNF з різними N-кінцевими скороченнями, а також зріла форма (не скорочена) з або без продоменної ділянки. Наведені нижче приклади, виконані по суті як описано нижче, можуть бути використані для оцінювання певних характеристик варіантів людського GDNF за цим винаходом. Приклад 1 Експресія, очищення та дослідження імуногенності білка а) Субклонування, мутування, експресія, анфолдинг, рефолдинг і очищення GDNFv, експресованого E.coli Субклонування. Штам E.coli BL21-CodonPlus (DE3) RIPL, що містить плазміду рЕТ30а(+)/rhGDNF, вирощують на бульонному живильному середовищі Лурія-Бертані, яке містить канаміцин із кінцевою концентрацією 30 мкг/мл, протягом ночі при температурі 37 °C. Після збирання клітин шляхом центрифугування, плазмідний вектор ізолюють із застосуванням набору QIAquick Spin Miniprep Kit (компанія Qiagen) за методикою виробника. Виділену плазмідну ДНК у подальшому використовують для здійснення реакції подовження праймера генів Δ31-GDNF та Δ31-N38Q-GDNF, які кодують білок Δ31-GDNF (31 залишок, видалений з Nкінця зрілого людського GDNF) і білок Δ31-N38Q-GDNF (31 залишок, видалений з N-кінця 3 UA 112981 C2 5 10 15 20 25 30 35 40 45 50 55 60 зрілого людського GDNF, де залишок аспарагіну у положенні 38 замінено на глутамін), відповідно. Це може бути здійснено з використанням олігонуклеотидних праймерів Δ31-for, Δ31rev, Δ31-N38Q-for та Δ31-N38Q-rev (послідовності SEQ ID NO: 6, 7, 39 та 40, відповідно), що містять сайти, які розпізнаються ендонуклазами рестрикції NdeI та XhoI, призначені для приєднання до 5 та 3 кінців вказаного гена. Вказані сайти, які розпізнаються ендонуклазами рестрикції NdeI та XhoI, приєднані до 5 кінців смислових і антисмислових праймерів, надають можливість клонування Δ31-GDNF та Δ31-N38Q-GDNF на відповідних сайтах вектора pET30a(+). Реакція подовження праймера здійснюється протягом 3 хв при температурі 94 °C з подальшим здійсненням 16 триступеневих циклів: 1 хв при температурі 94 °C, 0,5 хв при температурі 55 °C і 1 хв при температурі 72 °C, з кінцевим етапом тривалістю 10 хв при температурі 72 °C, у загальному об'ємі 100 мкл з використанням 80 нг матричної ДНК, прямого і зворотного праймерів і PCR Supermix (Invitrogen, номер за каталогом 10572-014). Одержані амплікони перевіряють шляхом електрофорезу в агарозному гелі, і очищають із застосуванням набору QIAquick PCR Purification Kit (Qiagen) за методикою виробника. Обидва ампліфіковані гени Δ31-GDNF або Δ31-N38Q-GDNF і вектор pЕТ-30а(+) піддають розщепленню NdeI і XhoI протягом 2 год. при температурі 37 °C, з подальшим очищенням ДНК шляхом електрофорезу в агарозному гелі з використанням екстракційного набору QIAquick Gel Extraction kit. Після цього Δ31-GDNF або Δ31-N38Q-GDNF лігують з плазмідою рЕТ-30а(+) з використанням Т4 ДНК-лігази за методикою виробника. 2-5 мкл реакційної суміші лігування використовують для безпосередньої трансформації 50-100 мкл хімічно компетентних клітин штаму E.coli BL21-CodonPlus (DE3)-RIPL за методикою виробника (Agilent, номер за каталогом 230280). Колонії трансформантів, одержані шляхом посіву на планшети з агаром Лурія-Бертані, який містить канаміцин у кінцевій концентрації 30 мкг/мл, піддають скринінгу на присутність правильної генно-інженерної конструкції шляхом секвенування екстрагованої плазміди в обох напрямках із застосуванням стандартних Т7 промоторного і Т7 термінаторного олігонуклеотидних праймерів. Мутації. Сайт-спрямований мутагенез здійснюють із використанням набору QuikChange Multi Site-Directed Mutagenesis kit (Stratagene, La Jolla, штат Каліфорнія) для одержання Δ31-N38QD95E-GDNF та Δ31-N38Q-K84A-R88K-R90K-D95E-GDNF. За вказаним методом Δ31-N38QGDNF, вбудований в pET-30a(+), використовують як матрицю, а олігонуклеотиди Δ31-N38QD95E-for та Δ31-N38Q-D95E-rev (Таблиця 1, послідовності SEQ ID NO: 41 і SEQ ID NO: 42) – як прямий і зворотний праймери, відповідно. У подальшому, успішно мутований ген Δ31-N38QD95E, вбудований в pET-30a(+), використовують як матрицю, а олігонуклеотиди Δ31-N38QK84A-R88K-R90K-D95E-for і Δ31-K84A-R88K-R90K-D95E-D95E-rev (Таблиця 1, послідовності SEQ ID NO: 43 і SEQ ID NO: 44) – як прямий і зворотний праймери, відповідно, для одержання Δ31-N38Q-K84A-R88K-R90K-D95E-GDNF. Послідовність ДНК підтверджують, і плазміду трансформують в хімічно компетентних клітинах штаму E.coli BL21-CodonPlus (DE3)-RIPL. Експресія білка. Запаси довготерміново заморожених клітин штаму E.coli BL21-CodonPlus (DE3)-RIPL, які містять плазміду pET-30a(+)/GDNFv, використовують для інокуляції 250 мл бульйонного живильного середовища TY, яке містить канаміцин із кінцевою концентрацією 30 мкг/мл, при температурі 37 °C. Через 9 год. 5 мл стартерної культури використовують для інокулювання 62 л того самого рідкого культурального середовища при температурі 37 °C. Коли культура досягає оптичної густини при 600 нм у межах від 0,8 до 1,4, як правило, через 16 год., додають IPTG до кінцевої концентрації 1 мМ, і температуру культури знижують до 27-30 °C протягом 5 год. Клітини збирають шляхом центрифугування при 10000g протягом 20 хв при температурі 4 °C, і зберігають при температурі -80 °C. Солюбілізація-рефолдинг. Клітинну пасту суспендують в 2-3 об'ємах розчину, який містить лізоцим (0,2 мг/мл), 5 мМ MgCl2 і 50 мМ Трис-HCl при рН 8, і інкубують з перемішуванням протягом 30 хв на льоду. Одержану суспензію обробляють ультразвуком на льоду протягом 10 хв (5 с імпульси, 2 с інтервал, 30-40 % амплітуда). Після цього GDNFv відновлюють у вигляді тілець включення, які виділяють з клітинного лізату шляхом центрифугування при 20000g протягом 20 хв, і розчиняють у розчині, який містить 4 М гуанідину, 90 мМ цистеїну, 20 мМ ТрисCl, рН 8,5. Білок піддають рефолдингу в активну форму шляхом 10-кратного розрідження розчином, який містить 0,2 М гуанідину, 2 М сечовини, 20 мМ Трис-HCl, рН 8,75. Суміш після рефолдингу витримують при температурі 4 °C протягом 2 днів. Очищення. Підданий рефолдингу GDNFv очищають до гомогенності із застосуванням 3етапного хроматографування на колонках: 1. Катіонообмінна хроматографія (CEX) на колонці SP; 2. Гідрофобна хроматографія (HIC) на колонці з фенілом; 3. Гель-хроматографія за розміром молекул (SEC) на колонці Superdex-75. 4 UA 112981 C2 5 10 15 20 25 30 35 40 45 50 Ренатурований білок спочатку завантажують у швидкопротокову колонку із сульфопропілсефарозою (SP Sepharose), врівноважену 20 мМ розчином ацетату натрію, рН 5. GDNFv елююють за допомогою висхідного лінійного сольового градієнта від 0,3 М до 1 М розчину NaCl в 20 мМ розчині ацетату натрію, рН 5. У пул головного потоку CEX додають NaCl до кінцевої концентрації 2,5 М, після чого вводять у гідрофобну хроматографічну колонку із фенілсефарозою HP в 20 мМ розчині цитрату натрію, рН 5. HIC колонку елююють за допомогою низхідного лінійного сольового градієнта від 0 М до 2,5 М розчину NaCl в 20 мМ розчині цитрату натрію, рН 5. GDNFv міцно зв'язується з HIC колонкою. Після цього пул головного потоку HIC концентрують, і, нарешті, завантажують у колонку Superdex-75, і білок елююють з використанням PBS (забуферений фосфатом фізіологічний розчин), рН 7,4. Кінцевий пул концентрують, фільтрують через 0,22 мкм мембрану, і зберігають при температурі -80 °C. b) Експресія та очищення GDNFv в клітинах ссавців Гени, що кодують варіанти GDNF, можуть бути одержані із застосуванням стандартних методів молекулярної біології та синтезу генів у векторі експресії ссавців, стимульованому CMV (цитомегаловірусним) промотором. Рекомбінантні плазміди використовують для тимчасової трансфекції лінії клітин нирок 293EBNA (НЕК293) ембріона людини, і середовища збирають через 5 днів. За іншим способом для експресії варіантів GDNF одержують стабільні лінії клітин яєчника китайського хом'ячка (СНО). Гени, що кодують варіантні білки, субклонують у каркасах експресійних плазмід, які містять глутамінсинтетазу (GS) (плазміди на основі pEE12.4, Lonza Biologics, Slough, Великобританія) у рамці із сигнальною послідовністю нативного GDNF з продоменом за інструкціями виробника. Непроцесованими генно-інженерними GDNF (SEQ ID NO: 2) у векторах на основі pEE12.4 трансфікують СНО, і одержують скорочені форми GDNF, де переважаючими формами є Δ31, які можуть бути виділені із суміші з подальшим очищенням. Коли продомен і перші 31 амінокислоти видаляються з N-кінця, Δ31-скорочений на N-кінці варіант GDNF ефективно і чисто продукується у експресійній системі ссавців без необхідності очищення із суміші непроцесованих і скорочених продуктів, як повідомлялося раніше. Нативний сигнальний пептид GDNF може також бути замінений декількома сигнальними пептидами, в тому числі мишачим лідерним сигнальним пептидом каппа або сигнальним пептидом людського соматотропного гормону. Δ31-скорочений на N-кінці варіант GDNF продовжує ефективно і чисто продукуватись з усіма описаними сигнальними пептидами, але зі змінними рівнями експресії. Варіанти GDNF, які включають бажані мутації, субклонують у відповідні експресуючі вектори (наприклад, pEMK-NF2, Lonza) у рамці з мишачою сигнальною послідовністю каппа. Очищення. GDNFv очищають до гомогенності шляхом 4-етапного гель-хроматографування: 1. Катіонообмінна хроматографія (CEX) на колонці SP. 2. Гідрофобна хроматографія (HIC) на колонці з фенілом. 3. Катіонообмінна хроматографія (CEX) на колонці з мультимодальною смолою Capto MMC. 4. Гель-хроматографія за розміром молекул (SEC) на колонці Superdex-75. Стисло, зібрані культуральні середовища, які містять варіантні білки GDNF, спочатку завантажують у швидкопротокову колонку із сульфопропілсефарозою (SP Sepharose), врівноважену 20 мМ розчином ацетату натрію, рН 5. GDNFv елююють за допомогою лінійного сольового градієнта від 0 М до 1 М розчину NaCl в 20 мМ розчині ацетату натрію, рН 5. У пул головного потоку CEX додають NaCl до кінцевої концентрації 2,5 М, після чого вводять у гідрофобну хроматографічну колонку із фенілсефарозою HP в 20 мМ розчині ацетату натрію, рН 5. Гідрофобну хроматографічну колонку елююють за допомогою зворотного лінійного сольового градієнта від 2,5 М до 0 М розчину NaCl в 20 мМ розчині ацетату натрію, рН 5. GDNFv слабо зв'язується з гідрофобною хроматографічною колонкою. Після цього пул наскрізного потоку і початкові елюйовані фракції завантажують у колонку з мультимодальною смолою Capto MMC при рН 5. Колонку промивають 50 мМ розчином Трис-Cl, рН 8, після чого GDNFv елююють лінійним сольовим градієнтом від 0 М до 1 М NaCl в 50 мМ розчині Трис-Cl, рН 8. Основний потік з колонки зі смолою Capto MMC, нарешті, завантажують у колонку Superdex-75, і білок елююють PBS, рН 7,4. Кінцевий пул фільтрують через 0,22 мкм мембрану, і зберігають при температурі 2-8 °C. 5 UA 112981 C2 Таблиця 1 Олігонуклеотидні праймери, застосовані для ПЛР (полімеразна ланцюгова реакція) та сайтспрямованого мутагенезу Праймер Δ31-for Нуклеотидна послідовність a Мета 5’TATACATATGCGTGGACAACGTGGTAAAAACCGTGGTTGTGTGCTG-3' (SEQ ID NO: 6) a Δ31-rev 5’-GGTGCTCGAGTTATTAAATGCAGCCGCAACGTTTCGCGCT-3' (SEQ ID NO: 7) ПЛР Δ31N38Qa, b for Δ31N38Qa rev Δ31N38QD95E-for 5’-TATACATATGCGTGGACAACGTGGTAAACAACGTGGTTGTGTGCTG-3' (SEQ ID NO: 39) ПЛР 5’-GGTGCTCGAGTTATTAAATGCAGCCGCAACGTTTCGCGCT-3' (SEQ ID NO: 40) ПЛР 5’-GTCTGGTGAGCGAGAAAGTGGGTCAG-3' (SEQ ID NO: 41) Мутагенез ПЛР b Δ315’-CTGACCCACTTTCTCGCTCACCAGAC-3' (SEQ ID NO: 42) Мутагенез N38QD95Eb rev Δ315’Мутагенез N38Q- CCTATGATAAAATCCTGGCAAACCTGAGCAAGAACAAACGTCTGGTGAGCGAGAAAGKAKKE3' (SEQ ID NO: 43) b for Δ315’Мутагенез N38Q- CTTTCTCGCTCACCAGACGTTTGTTCTTGCTCAGGTTTGCCAGGATTTTATCATAGG-3' KAKKE(SEQ ID NO: 44) b rev a b 5 10 15 20 Сайти, які розпізнаються ендонуклазами рестрикції NdeI та XhoI, виділені курсивом. Підкреслені літери означають помилкове парування. Аналіз EpiVax потенціалу імуногенності Одержують вибрані варіанти людського GDNF зі зменшеною ймовірністю зв'язування HLADR (послідовності SEQ ID NO: 12 і SEQ ID NO: 15), і порівнюють з GDNF дикого типу в дослідженні зв'язування GFR(і гепарину. Приклад 2 Стабільність GDNF дикого типу і варіанта Δ31 GDNF Стабільність непроцесованого зрілого GDNF дикого типу і Δ31-скорочених на N-кінці варіантів можна оцінювати з використанням низки аналітичних методів, таких як RP-HPLC (високоефективна рідинна хроматографія зі зворотною фазою), SE-HPLC (високоефективна гель-хроматографія за розміром молекул), катіонообмінна високоефективна рідинна хроматографія і мас-спектрометрія, для ідентифікування будь-яких деградаційних сайтів у цих молекулах. У подальшому здійснюють мутації для видалення сайтів хімічної деградації для підвищення стабільності варіанта людського GDNF. Аналітична хроматографія зі зворотною фазою (RP-HPLC). На колонці Zorbax C8 SB-300 Å, 3,5 мкм, 4,650 мм, нагрітій до температури 60C (компанія Agilent Technologies, номер за каталогом 865973-909). Рухома фаза являє собою 0,1 % розчин TFA (трифтороцтова кислота) в H2O. GDNFv елююють у вигляді єдиного піка при 214 нм з часом утримування 19-20 хв лінійним градієнтом ацетонітрилу від 5 % до 50 % протягом 30 хв при швидкості потоку 1 мл/хв протягом 35 хв. Аналітична гель-хроматографія за розміром молекул (SEC-HPLC). На колонці ТSК-G-2000 6 UA 112981 C2 5 10 15 20 25 30 35 40 45 50 55 60 SW-XL, 5 мкм, 7,8300 мм (TOSOH BIOSEP, номер за каталогом 08540). Рухома фаза: PBS+350 мМ розчин NaCl, рН 7,4, при швидкості потоку 0,5 мл/хв протягом 35 хв. GDNFv елююють у вигляді єдиного піка при 214 нм із часом утримування ~16-17 хв. Аналітична катіонообмінна хроматографія (CEX-HPLC). На колонці Dionex, Propac WCX-10, 4250 мм (Dionex, номер за каталогом 054993). Рухома фаза являє собою 20 мМ розчин фосфату натрію, 10 % ацетонітрилу, рН 7. GDNFv елююють як складний пік з часом утримування 25-30 хв лінійним сольовим градієнтом від 0,15 М до 0,6 М NaCl протягом 45 хв при швидкості потоку 1 мл/хв протягом 52 хв. Дослідження хімічної стабільності (LC-MS) GDNF (непроцесований бактеріальний GDNF) дикого типу у порівнянні з СНО GDNFv (Δ31-скорочений на N-кінці GDNF) дикого типу GDNF (непроцесований бактеріальний GDNF) дикого типу для порівняння з СНО GDNFv дикого типу (Δ31-скорочений на N-кінці GDNF) піддають навантаженню при температурі 37C протягом 4 тижнів з метою ідентифікування амінокислот, які можуть бути пов'язані з хімічною нестабільністю. Зразки 1 – непроцесований GDNF E.coli дикого типу при температурі 4 °C протягом 4 тижнів, 1,0 мг/мл; 2 – непроцесований GDNF E.coli дикого типу при температурі 37 °C протягом 4 тижнів, 1,0 мг/мл; 3 – СНО Δ31-GDNFv дикого типу при температурі 4 °C протягом 4 тижнів, 1,0 мг/мл; 4 – СНО Δ31-GDNFv дикого типу при температурі 37 °C протягом 4 тижнів, 1,0 мг/мл. Молекулярне дослідження інтактного і частково розщепленого зразка. 10 мкл аліквоту кожного зразка (розчин змішують з 20 мкл води або 10 мкл аліквотою кожного розчину) змішують з 40 мкл 100 мМ трис-HCl буфера, pH 8, 1,0 мкл (50 мг/мл) DTT (дитіотреітол) при кімнатній температурі протягом 30 хв. Кожен зразок піддають LC/MS (рідинна хроматографія/мас-спектрометрія) аналізу. Lys-C гідролізат. 20 мкл аліквоту розчину кожного зразка ліофілізують досуха у системі швидкісного вакуумування, після чого матеріал відновлюють в 0,5 мкл розчину (50 мг/мл) DTT, 4,5 мкл 6 М розчину гуанідину-HCl, 0,5 М розчині трис-HCl буфера, рН 8. Суміш інкубують при температурі 37С протягом 30 хв, після чого кожен розчин розбавляють 93 мкл води, і обробляють 2 мкл розчину (0,2 мг/мл) Lys-C (Wako) при температурі 37С протягом 2 год. У разі СНО GDNFv, 30 мкл триптичного гідролізату обробляють 0,5 мкл пептиду PNGаза F при температурі 37С протягом 1 год. (для оцінювання профілю вуглеводів). Вказаний гідролізат підкислюють 2 мкл 10 % розчину TFA в H2O перед проведенням LC/MS аналізу. LC/MS аналіз. Розчини зразків досліджують із застосуванням мас-спектрометра SYNAPT (Waters) в поєднанні з рідинною хроматографічною системою Acquity UPLC (Waters) або із застосуванням мас-спектрометра LCT Premier (Waters) в поєднанні з рідинною хроматографічною системою 2795 HPLC (Waters). Низхідний аналіз. Продукти розщеплення GDNF дикого типу одержують шляхом LC-MS аналізу частково відновленого GDNF. Визначають численні продукти розщеплення, і кількісні дані для цих розщеплень показані в Таблиці 2. Декілька розщеплень (розщеплення між N15/R16, N22/P23, N25/S26 і N38/R39) мають подібні шляхи деградації, наприклад, дезамідування через утворення сукциніміду. Для СНО Δ31-GDNFv перші 31 амінокислотний залишок відщеплюються від N-кінця. Незважаючи на те, що СНО GDNFv має два потенційні сайти N-глікозилювання в кожному ланцюзі, N-глікозилюється лише один сайт. Головними зареєстрованими гліканами є розгалужені олігосахариди з двома або трьома ланцюгами з різним ступенем галактозилювання. Становить інтерес те, що значною мірою сіалілованих гліканів не виявлено). (Таблиця) 3) Висхідний аналіз (пептидне картування). УФ-хроматограми Lys-C гідролізату відновлених зразків дослідження стабільності GDNF показують, що, за винятком пептиду GDNF 126-129, всі очікувані пептиди виявлені. Для матеріалу СНО N-кінцеві пептиди (перед R32) не виявлені. Пептид 38-60, який містить N49, є глікозильованим, і більш ніж 95 % Asn49 зайнято. Пептид 8596, який містить N85, не глікозильований. Ці результати узгоджуються з результатами LC/MS аналізу відновлених зразків GDNF. Загалом, головним компонентом як матеріалу дикого типу, так і матеріалу СНО є гомодимер. Другорядний компонентом, який елююється на ранній стадії, є мономер. За даними мас-спектроскопічного аналізу GDNF Cys41 утворює дисульфідний зв'язок із вільним залишком Cys для мономера. Відносний відсоток мономерних піків є дуже низьким, і за даними УФдослідження вони становлять
ДивитисяДодаткова інформація
Автори англійськоюLeung, Donmienne, Doen, Mun, Lu, Jirong, Merchant, Kalpana, Mahesh, Ghanem, Mahmoud, O'bryan, Linda, Maureen, Smith, Rosamund, Carol
Автори російськоюЛьюнг Донмайенн Дон Мун, Лу Цзижон, Мерчант Калпана Махэш, Ганем Махмуд, О'Брайан Линда Морин, Смит Розамунд Керол
МПК / Мітки
МПК: A61P 25/28, C07K 14/475, A61K 38/18
Код посилання
<a href="https://ua.patents.su/49-112981-variant-lyudskogo-gdnf.html" target="_blank" rel="follow" title="База патентів України">Варіант людського gdnf</a>
Попередній патент: Рідкі катіоніти
Наступний патент: Балансуючий шар на порошкоподібній основі
Випадковий патент: Клейова мастика