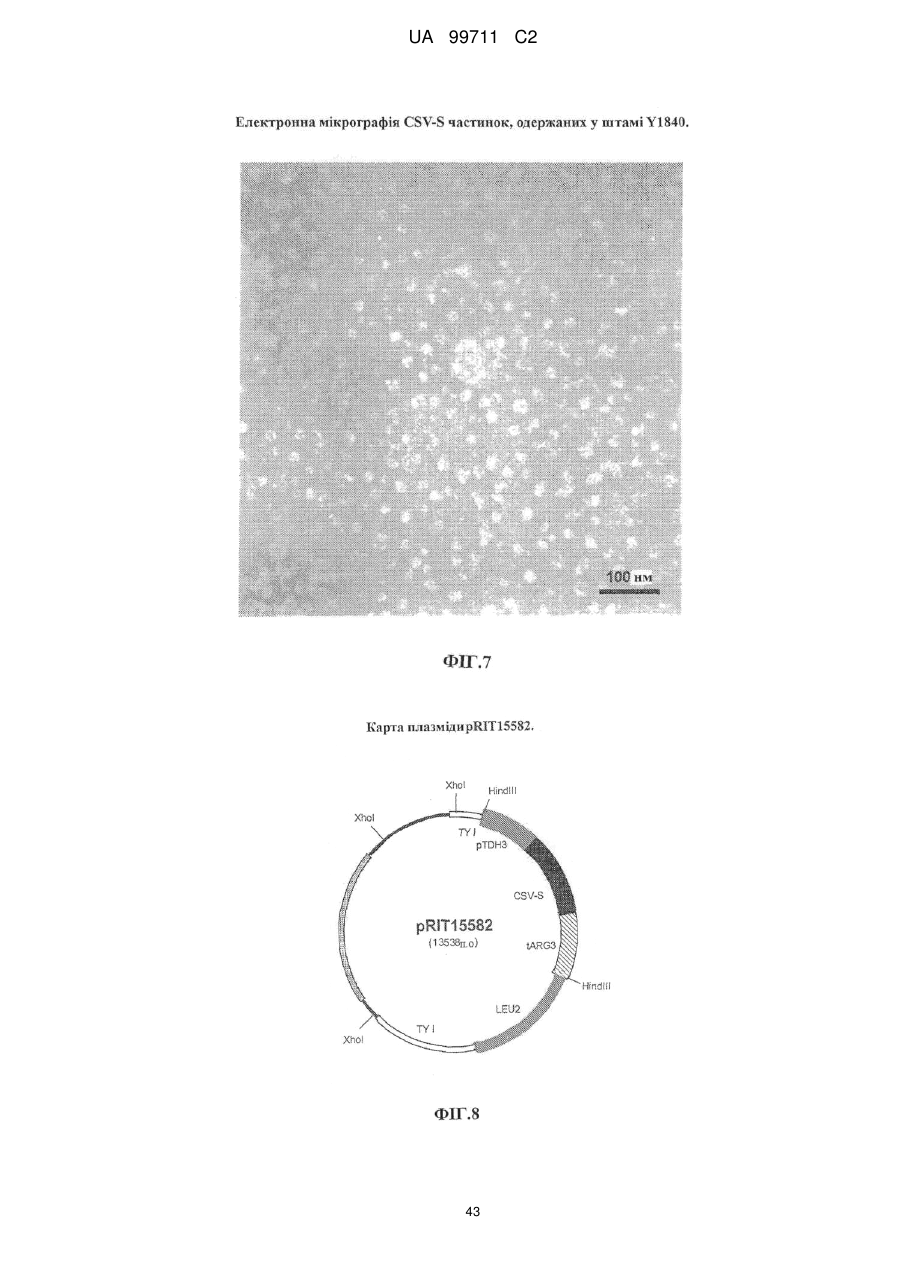
Малярійна вакцина
Номер патенту: 99711
Опубліковано: 25.09.2012
Автори: Маршан Мартін, Оукенгаус Крістіан Ф., Ядава Анджалі, Коен Джозеф Д.
Формула / Реферат
1. Імуногенний гібридний злитий білок, що включає:
a) принаймні одну повторювану одиницю, що походить від повторюваної ділянки білка типу І, що оточує спорозоїт P. vivax, що є вибраною з амінокислотних послідовностей SEQ ID NO: 3-9;
b) принаймні одну повторювану одиницю, що походить від повторюваної ділянки білка типу II, що оточує спорозоїт P. vivax, що є вибраною з амінокислотних послідовностей SEQ ID NO: 10 та SEQ ID NO: 14; та
с) поверхневий антиген S вірусу гепатиту В або його фрагмент, що зберігає його функції.
2. Білок згідно з пунктом 1, де білок додатково включає N-термінальний фрагмент з CS білка P. vivax.
3. Білок за пунктом 2, де N-термінальний фрагмент включає фрагмент, відомий як ділянка (І), як представлено у SEQ ID NO: 1.
4. Білок згідно з будь-яким з попередніх пунктів, де білок додатково включає С-термінальний фрагмент з CS білка P. vivax.
5. Білок згідно з пунктом 4, де С-термінальний фрагмент включає сегмент, відомий як ділянка (II), як представлено у SEQ ID NO: 2.
6. Білок згідно з будь-яким з попередніх пунктів, де повторювана одиниця типу І походить з одного або більше з наступних штамів P. vivax: Latina, America (тобто Sal 1, Belem), Korean, China, Thailand, Indonesia, India та Vietnam.
7. Білок за будь-яким з попередніх пунктів, де повторювана одиниця типу І є вибраною з одного або більше мономерів, представлених у SEQ ID NO: 3-9.
8. Білок за пунктом 6 або 7, що включає принаймні 9 повторюваних одиниць типу І.
9. Білок за будь-яким з попередніх пунктів, де мономер типу II є вибраним з одного або більше мономерів, представлених у SEQ ID NO: 10 або 14.
10. Білок за будь-яким з попередніх пунктів, що включає 1 повтор типу II.
11. Білок за будь-яким з попередніх пунктів, який додатково включає інсерцію з 12 амінокислот, розміщених у кінці повторюваної ділянки, що виявлена у деяких азіатських штамів P. vivax.
12. Білок за пунктом 11, де амінокислоти є такими, як представлено у SEQ ID NO: 11.
13. Білок за будь-яким з попередніх пунктів, де S антиген вірусу гепатиту В має походження від серотипу adw.
14. Білок за будь-яким з попередніх пунктів, який додатково включає один або більше додаткових антигенів, що мають походження від P. falciparium та/або P. vivax.
15. Білок за пунктом 14, де антиген є вибраним з DBP, PvTRAP, PvMSP2, PvMSP4, PvMSP5, PvMSP6, PvMSP7, PvMSP8, PvMSP9, PvAMA1 та RBP.
16. Білок за будь-яким з попередніх пунктів 1-15, який включає послідовність гібридного білка, що оточує спорозоїт, представлену у SEQ ID NO: 13.
17. Білок за будь-яким з пп. 1-16, який відрізняється тим, що застосовується у лікуванні малярії.
18. Композиція, що включає гібридний злитий білок за будь-яким з попередніх пунктів 1-17 та ад'ювант.
19. Композиція за пунктом 18, де ад'ювант є вибраним з групи, що включає:
- солі металу, такі як гідроксид алюмінію або фосфат алюмінію,
- емульсії масло-у-воді,
- агоністи Toll-подібних рецепторів (такі, як агоніст Toll-подібного рецептора 2, агоніст Toll-подібного рецептора 3, агоніст Toll-подібного рецептора 4, агоніст Toll-подібного рецептора 7, агоніст Toll-подібного рецептора 8 та агоніст Toll-подібного рецептора 9),
- сапоніни, наприклад, Quil А та його похідні, такі, як QS7 та/або QS21,
- CpG-вмісні олігонуклеотиди,
- 3D-MPL,
-(2-дезокси-6-о-[2-дезокси-2-[(R)-3-додеканоїлокситетрадеканоїламіно]-4-о-фосфоно-![]() -D-глюкопіранозил]-2-[(R)-3-гідрокситетрадеканоїламіно]-
-D-глюкопіранозил]-2-[(R)-3-гідрокситетрадеканоїламіно]-![]() -D-глюкопіранозилдигідрофосфат),
-D-глюкопіранозилдигідрофосфат),
- DP (3S-, 9R)-3-[(R)-додеканоїлокситетрадеканоїламіно]-4-oкco-5-aзa-9(R)-[(R)-3-гідрокситетрадеканоїламіно]декан-1,10-діол,1,10-біс(дигідрофосфат), та
- МР-Ас DP (3S-, 9R)-3-[(R)-додеканоїлокситетрадеканоїламіно]-4-оксo-5-aзa-9-[(R)-3-гідрокситетрадеканоїламіно]декан-1,10-діол,1-дигідрофосфат 10-(6-аміногексаноат), або їх комбінації.
20. Композиція за пунктом 18 або 19, де ад'ювант є вибраним з групи, що включає:
- сапонін, асоційований із сіллю металу, такою, як гідроксид алюмінію або фосфат алюмінію,
- 3D MPL, QS21 та CpG олігонуклеотид, наприклад, у вигляді композиції масло-у-воді,
- сапонін у формі ліпосоми, наприклад, що додатково включає QS21 та стерин, та
- ISCOM.
21. Композиція за будь-яким з попередніх пунктів 18-20, яка додатково включає один або більше додаткових антигенів, що походять від P. falciparum та/або Р. vivax, у суміші.
22. Композиція за будь-яким з попередніх пунктів 18-21, яка додатково включає поверхнево-активну сполуку.
23. Композиція за пунктом 22, де поверхнево-активна сполука є вибраною з Твіну (такого, як Твін 20), поліоксіетиленових етерів, поліетиленгліколю.
24. Композиція за будь-яким з попередніх пунктів 18-21, де композиція є вакциною, такою, як парентеральна вакцина.
25. Композиція за будь-яким з попередніх пунктів 18-24, яка відрізняється тим, що застосовується у лікуванні малярії.
26. Мультимерна ліпопротеїнова частинка, що включає гібридний білок за пунктом 1-17.
27. Композиція, що включає частинку за пунктом 26 та принаймні один наповнювач/носій.
28. Композиція за пунктом 27, яка додатково включає ад'ювант.
29. Композиція за пунктом 28, де ад'ювант є вибраним з групи, що включає:
- солі металу, такі як гідроксид алюмінію або фосфат алюмінію,
- емульсії масло-у-воді,
- агоністи Toll-подібних рецепторів (такі, як агоніст Toll-подібного рецептора 2, агоніст Toll-подібного рецептора 3, агоніст Toll-подібного рецептора 4, агоніст Toll-подібного рецептора 7, агоніст Toll-подібного рецептора 8 та агоніст Toll-подібного рецептора 9),
- сапоніни, наприклад, Quil А та його похідні, такі, як QS7 та/або QS21,
- CpG-вмісні олігонуклеотиди,
- 3D-MPL,
-(2-дезокси-6-о-[2-дезокси-2-[(R)-3-додеканоїлокситетрадеканоїламіно]-4-о-фосфоно-![]() -D-глюкопіранозил]-2-[(R)-3-гідрокситетрадеканоїламіно]-
-D-глюкопіранозил]-2-[(R)-3-гідрокситетрадеканоїламіно]-![]() -D-глюкопіранозилдигідрофосфат),
-D-глюкопіранозилдигідрофосфат),
- DP (3S,9 R)-3-[(R)-додеканоїлокситетрадеканоїламіно]-4-oксо-5-aзa-9(R)-[(R)-3-гідрокситетрадеканоїламіно]декан-1,10-діол, 1,10-біс(дигідрофосфат), та
- МР-Ас DP (3S-, 9R)-3-[(R)-додеканоїлокситетрадеканоїламіно]-4-oксo-5-aзa-9-[(R)-3-гідрокситетрадеканоїламіно]декан-1,10-діол, 1-дигідрофосфат 10-(6-аміногексаноат),
або їх комбінації.
30. Композиція за пунктом 28 або 29, де ад'ювант є вибраним з групи, що включає:
- сапонін, асоційований із сіллю металу, такою, як гідроксид алюмінію або фосфат алюмінію,
- 3D MPL, QS21 та CpG олігонуклеотид, наприклад, у вигляді композиції масло-у-воді,
- сапонін у формі ліпосоми, наприклад, що додатково включає QS21 та стерин, та
- ISCOM.
31. Композиція за будь-яким з попередніх пунктів 27-30, яка додатково включає один або більше додаткових антигенів, що походять від P. falciparium та/або Р. vivax, у суміші.
32. Композиція за будь-яким з попередніх пунктів 27-31, яка додатково включає поверхнево-активну сполуку.
33. Композиція за пунктом 32, де поверхнево-активна сполука є вибраною з Твіну (такого, як Твін 20), поліоксіетиленових етерів, поліетиленгліколю.
34. Композиція за будь-яким з попередніх пунктів 27-33, де композиція є вакциною, такою, як парентеральна вакцина.
35. Композиція за будь-яким з попередніх пунктів 27-34, яка відрізняється тим, що застосовується у лікуванні малярії.
36. Спосіб виробництва лікарського засобу для лікування/запобігання малярії, який передбачає застосування білка за будь-яким з пунктів 1-17 або мультимерної ліпопротеїнової частинки за пунктом 26.
37. Спосіб за пунктом 36, де малярія є такою, що спричинена P. vivax.
38. Нуклеотидна послідовність, що кодує білок за будь-яким з пунктів 1-17.
39. Хазяїн, що включає нуклеотидну послідовність за пунктом 38.
40. Спосіб одержання білка за будь-яким з пунктів 1-17, де спосіб включає експресію нуклеотидної послідовності, що кодує вказаний білок, у прийнятному хазяїні та відновлення продукту.
41. Спосіб за пунктом 40, де хазяїн являє собою дріжджі.
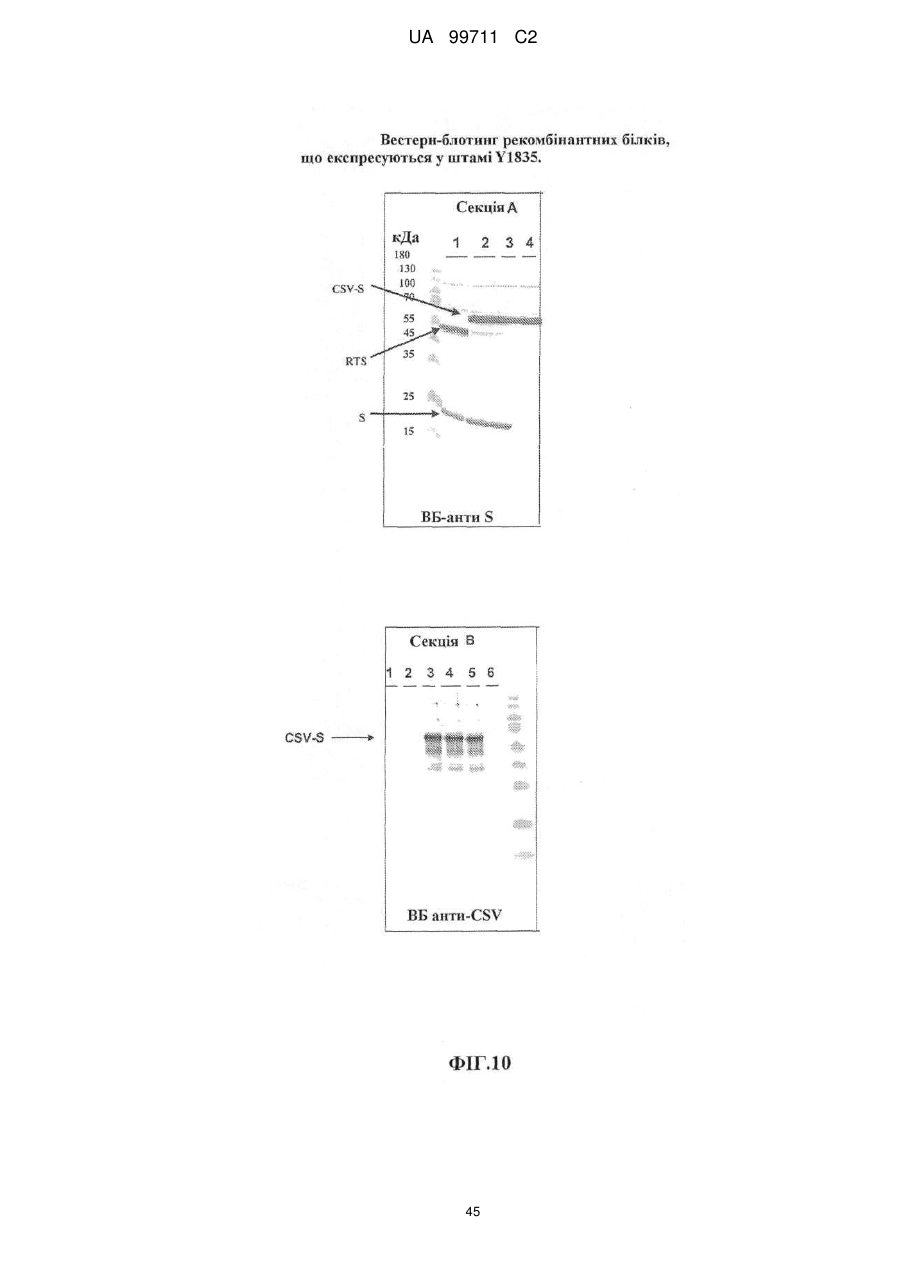
42. Спосіб за пунктом 41, де дріжджі є вибраними з групи, що включає: Saccharomyces, Schizosaccharomycees, Kluveromyces, Pichia (наприклад, Pichia pastoria), Hansenula, (наприклад, Hansenula polymorpha), Yarowia, Schwaniomyces, Schizosaccharomyces, Zygoaccharomyces, такі, як Saccharomyces cerevisiae, S. carlsberoensis, K. lactis, Y1834 та DC5.
43. Спосіб за будь-яким з попередніх пунктів 41 або 42, де продукт відновлюють шляхом лізису клітини-хазяїна при обробці прийнятною композицією, що включає поверхнево-активну сполуку.
44. Спосіб за пунктом 43, де поверхнево-активна сполука є вибраною з групи, що включає: Твін (такий, як Твін 20), поліоксіетиленові етери, поліетиленгліколь.
Текст
Реферат: Винахід належить до імуногенного гібридного злитого білка, який походить від CS білка Plasmodium vivax (P. vivax) та включає принаймні одну повторювану одиницю, що походить від повторюваної ділянки білка типу І та білка типу II, який оточує спорозоїт P. vivax, та поверхневий антиген S вірусу гепатиту В або його фрагмент, що зберігає його властивості. Винахід також належить до способу одержання імуногенного гібридного злитого білка, композиції, що його містить, мультимерної ліпопротеїнової частинки, що включає даний білок, способу виробництва лікарського засобу для лікування або запобігання малярії, спричиненої P. vivax. UA 99711 C2 (12) UA 99711 C2 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід належить до нового гібридного/злитого білка, способів його одержання та очистки, до його застосування у медицині, зокрема, у запобіганні малярійних інфекцій, наприклад тих, що спричинені Plasmodium vivax (P. vivax) до композицій/вакцин, що містять білок або антитіла проти білка, таких, як моноклональні або поліклональні антитіла, та до їх застосування, зокрема, у терапії. Винахід також охоплює ліпопротеїнові частинки вказаного гібридного/злитого білка та композиції/вакцини, що включають їх, та до їх застосування. Малярія представляє собою одну з основних проблем охорони здоров'я у світі з більше, ніж 2-4 мільйонами людей, які вмирають від цього захворювання кожного року. Одна з найбільш переважаючих форм захворювання спричинюється протозойним паразитом P. vivax, який виявлений у тропічних та субтропічних районах. Цікавим є те, що паразит може повністю завершувати свій москітний цикл при температурах, нижчих 15 °C, що дозволяє йому розповсюджуватися у районах помірного клімату. Життєвий цикл Plasmodium є складним та потребує двох хазяїв, людини та москіта, для свого завершення. Інфекція у людини ініціюється інокуляцією спорозоїтів у слину інфікованого москіта. Спорозоїти переміщуються до печінки та там інфікують гепатоцити, де вони піддаються диференціації через екзоеритроцитарну внутрішньоклітинну стадію у стадію мерозоїту, який інфікує еритроцити крові (RBC) для ініціації циклічної реплікації на безстатевій стадії у крові. RBC цикл завершується диференціацією ряду мерозоїтів у статеву стадію гаметоцитів, які споживаються москітом, там вони розвиваються через серію стадій у середній кишці з виникненням спорозоїтів, які переміщуються у слинну залозу. Завдяки тому факту, що захворювання, яке спричинюється P. vivax, лише в деяких випадках буває летальним, зусилля щодо запобігання та лікування малярії були сфокусовані на більш смертельній формі захворювання, що спричинюється Plasmodium falciparum (P. falciparum). Незважаючи на те, що захворювання, спричинене P. vivax, звичайно не приводить до смерті пацієнта, завдяки кількості випадків, яка зростає, значному впливу на якість життя пацієнта, зростанню кількості повідомлень про тяжкі випадки захворювання, що приводять до анемії та смерті, економічним втратам, залишається необхідність в ефективній вакцинації проти цього захворювання. Крім того, одна вакцина, що є здатною забезпечити захист проти обох причин цього захворювання, буде бажаною. Одна з характеристик P. vivax полягає у тому, що деякі штами є здатними спричинювати затриману інфекцію, залишаючись у латентному стані у печінці перед появою у периферичній кровоносній системі до прояву клінічних симптомів. Таким чином, індивідууми, наприклад, коли подорожують через інфіковані райони, можуть бути інфіковані та можуть не проявляти симптомів протягом кількох місяців. Це спричинює існування можливості поширення захворювання, з цієї причини особам, які подорожують до інфікованих районів, не дозволяється здавати кров для переливання протягом визначеного періоду часу після подорожі до інфікованого району. Малярійна інфекція, спричинена P. vivax, залишається латентною у печінці, хоча паразит піддається пре-еритроцитарній шизогонії. Якщо паразит контролюється на цій стадії, перед тим, як він зникає з печінки, у пацієнта не спостерігається ніяких клінічних симптомів захворювання. Стадія спорозоїту Plasmodium була ідентифікована як потенційна мішень малярійної вакцини. Вакцинація при використанні дезактивованого (опроміненого) спорозоїту була показана як така, що індукує захист проти експериментальної малярії людини (Am. J, Trop. Med. Hyg 24: 297-402, 1975). Проте не існувало можливості практично та технічно виробляти малярійну вакцину для загальної популяції на основі цієї методики, використовуючи опромінені спорозоїти. Основний поверхневий білок спорозоїту є відомим як білок, що оточує спорозоїт (CS білок). Як передбачається він є втягненим у рухливість та інвазію спорозоїту під час його проходження від початкового сайту інокуляції москітом у систему кровообігу, коли він мігрує до печінки. CS білок видів Plasmodia характеризується центральним повторюваним доменом (повторювана ділянка), що є фланкованим неповторюваними аміно (N-термінальними) та карбокси (С-термінальними) фрагментами. Центральний домен P. vivax складається з кількох блоків повторюваної одиниці, що звичайно містить тандем з 9 амінокислот. У деяких азіатських штамах після центральної повторюваної ділянки є присутньою додаткова послідовність, що складається приблизно з 12 амінокислот (див. SEQ ID No. 11). Функція останньої є невідомою. Проте деякі вважають, що вказані амінокислоти можуть бути пов'язаними із затриманим початком виявлення клінічних симптомів захворювання, проте ця гіпотеза не була досліджена. Передбачається, що N-термінальна ділянка характеризується послідовністю з 5 амінокислот, що є відомою як ділянка І (див. SEQ ID No. 1). Також передбачається, що С-термінальна ділянка характеризується тим, що вона включає 1 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 послідовність з 18 амінокислот, що є відомою як ділянка II. Остання містить фрагмент адгезії до клітини, який є високо консервативним серед усіх малярійних CS білків (див. SEQ ID No. 2). Декілька груп запропонували субодиничні вакцини на основі білка, що оточує спорозоїт. Дві з цих двох вакцин піддавалися клінічному випробуванню; одна являє собою синтетичний пептид, інша є рекомбінантним білком (Ballou та ін., Lancet: і 1277 (1987) та Herrington та ін. Nature 328: 257 (1987)). Ці вакцини були успішними у стимуляції анти-спорозоїтної відповіді. Проте величина відповіді була невтішною, при цьому деякі вакцини взагалі не давали відповіді. Крім того, відсутність "бустингу" рівнів антитіла після подальших ін'єкцій та результати in vitro аналізів проліферації лімфоцитів дають змогу запропонувати, що Т-клітини більшості цих волонтерів не впізнавали імунодомінантного повтору. Проте один волонтер у цьому дослідженні не розвивав паразитемію. WO 93/10152 та WO 98/05355 описують вакцини, що походять від CS білка Р. falciparum та демонструють деякий прогрес у вакцинації проти P. falciparum при використанні описаного підходу, див. також Неррnеr та ін. 2005, Vaccine 23, 2243-50. CS білок у P. falciparum має центральну повторювану ділянку, що є консервативною. На противагу до цього є відомими принаймні дві форми (позначаються як VK210 або тип І та VK247 або тип II) CS білка для P. vivax. Це робить більш складною ідентифікацію конструкції CS білка з усіма бажаними властивостями, такими, як імуногенність, що забезпечує загальний захист проти P. vivax, незважаючи на специфічний тип CS білка, оскільки антитіла, спрямовані проти центральної повторюваної ділянки типу І, з необхідністю не впізнають епітопи на відповідній ділянці типу II та навпаки. Рекомбінантний CS білок P. vivax було експресовано та проаналізовано як вакцину у 19801990 роках з обмеженим успіхом (Collins та ін., 1989. Am. J. Trop. Med. Hyg. 40, 455-64). Була зроблена деяка робота з розробки вакцини на основі поліантигенних пептидів (МАР) при використанні одного або більше епітопів, які є такими, що перехресно зв'язуються (Nardelli та Tarn, 1995, Pharm. Biotechnol. 6, 803-19). Даний винахід забезпечує новий поліпшений антиген для застосування у малярійних вакцинах, який, як передбачається, генерує гуморальну відповідь, а також клітинну імунну відповідь. Антиген/частинка, як передбачається, індукують утворення антитіл проти CS білка типу І та типу II. Антиген/частинка можуть також індукувати Т-хелперні клітини, наприклад, Th1 та/або Тh2 клітини. Згідно з цим даний винахід забезпечує імуногенний гібридний злитий білок, що включає: a. принаймні одну повторювану одиницю, що походить від центральної повторюваної частини білка типу І, що оточує спорозоїт P. vivax, b. принаймні одну повторювану одиницю, що походить від центральної повторюваної частини білка типу II, що оточує спорозоїт P. vivax, та c. поверхневий S антиген, який походить від вірусу гепатиту В. Список послідовностей SEQ. ID. No. 1 Ділянка І N-термінального кінця (описана вище) SEQ. ID. No. 2 Фрагмент ділянки II С-термінального кінця (описана вище) SEQ. ID. No. 3-9 Різноманітні мономери CS білка типу І SEQ. ID. No. 10 Основний мономер CS білка типу II SEQ. ID. No. 11 Додаткові амінокислоти, виявлені в азіатських штамах SEQ. ID. No. 12 Нуклеотидна послідовність гібридного білка (оптимізована для експресії в E. соlі) SEQ. ID. No. 13 Амінокислотна послідовність гібридного білка CSV SEQ. ID. No. 14 Мінорний мономер CS білка типу II SEQ. ID. No. 15 Нуклеотидна послідовність для гібридного білка CSV (оптимізована для експресії у дріжджах) SEQ. ID. No. 16 Нуклеотидна послідовність для гібридного злитого білка CSV-S SEQ. ID. No. 17 Амінокислотна послідовність для гібридного злитого білка CSV-S SEQ. ID. No. 18 Нуклеотидна послідовність для RTS експресійної касети та спрогнозований RTS,S білок SEQ. ID. No. 19 Нуклеотидна послідовність для гібридного злитого гену CSV-S (клонований у pHIL-D2 інтегративний експресійний вектор Pichia pastoris) SEQ. ID. No. 20 Амінокислотна послідовність для гібридного злитого білка CSV-S, який є експресованим у Pichia pastoris SEQ ID. No. 21 Представлене на Фіг. 12 є порівнянням послідовності рекомбінантного CSV-S білка повної довжини та вкороченого білка CSV-S 60 2 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фігури Фіг. 1 Показує електронну мікрографію мультимерних ліпопротеїнових частинок гібридного білка згідно з винаходом, які продукуються у дріжджовому штамі S.cerevisiae (з конститутивним промотором) Фіг. 2 Являє собою Вестерн-блотінг гібридного білка згідно з винаходом та порівняльних білків (частина геля) Фіг. 2а Являє собою Вестерн-блотінг гібридного білка згідно з винаходом тапорівняльних білків (повна картина гелю Фіг. 2, де смуги 1, 2 та 3 на Фігурі 2 є смугами 1, 2 та 8 на Фігурі 2а) Фіг. 3 Плазмідна карта рекомбінантного вектора pRIT15546, що використовується для вбудовування послідовності, яка кодує CSV-S злитий білок, у хазяйську клітину дріжджів (епісомальний вектор). Фіг. 4 Плазмідна карта плазміди pGF1-S2, одержаної GSK, яка використовується для утворення злитого білка бажаного антигену з S антигеном вірусу гепатиту В. Клонування гетерологічних послідовностей ДНК між сайтами Smal (після вирізування Smal фрагменту ДНК розміром 12 п.о.) утворює злиття у рамці з S геном Фіг. 5 Плазмідна карта рекомбінантного вектора pRIT15607, який використовується для утворення злитого білка бажаного антигену з S антигеном з вірусу гепатиту В. Перетравлювання за допомогою Notl вивільняє фрагмент лінійної ДНК розміром 6,8 п.о., що несе CSV-S експресійну касету плюс HIS4 селективний маркер, який використовується для інсерції у хромосому дріжджів. Фіг. 6 Показу Вестерн-блотінг рекомбінантного білка, що експресується у Y1840. Фіг. 7 Показує електронну мікрографію мультимерних ліпопротеїнових частинок гібридного білка згідно з винаходом, що продукується у Pichia pastoris ("нетрадиційні" дріжджі, метилотрофні дріжджі, в яких рекомбінантна експресія направляється метанол-індуцибельним промотором). CSV-S частинки очищали з розчинних екстрактів (на основі процесу очистки RTS, S) та піддавали аналізу при використанні електронної мікроскопії. Частинки візуалізували після негативного забарвлювання при використанні фосфовольфрамової кислоти. Шкала є еквівалентною 100 нм Фіг. 8 Плазмідна карта pRIT15582. Перетравлювання за допомогою Xhol вивільняє фрагмент лінійної ДНК розміром 8,5 кб, що несе CSV-S експресійну касету плюс LEU2 селективний маркер, що використовується для вбудовування у дріжджову хромосому Фіг. 9 Рестрикційна карта лінійного Xhol фрагменту, що використовується для інтеграції CSV-S касети Фіг. 10 Вестерн-блотінг рекомбінантних білків, що експресуються у штамі Y1835. Секція А: ВБ, виявлений за допомогою анти-S антитіла Завантажені зразки (100 мкг загального білка/комірка): 1: Y1631 (штам, що продукує RTS.S, для порівняння) 2: Y1835 3: Y1835 4: Y1834 Секція В: ВБ, виявлений за допомогою анти -SV антитіла Завантажені зразки (100 мкг загального білка/комірка): 1: Y1631 (штам, що продукує RTS.S, для порівняння) 2: Y1295 3: Y1835 4: Y1834 5: nr (інша конструкція CSVS) 6: nr (інша конструкція - тільки S-антиген) Фіг. 11 Електронна мікрографія CSV-S.S змішаних частинок, що продукуються штамом Y1835 CSV-S,S частинки очищали із розчинних екстрактів клітин (на основі процесу очистки RTS.S) та піддавали електронномікроскопічному аналізу. Частинки піддавали візуалізації після негативного забарвлювання за допомогою вольфрамової кислоти. Шкала є еквівалентною 100 нм. Фіг. 12 Показує порівняння рекомбінантного білка CS та вкороченого варіанту CS білка (CSVtr-S). Гібридний білок, як використовується в даній заявці, відноситься до білка, який має походження від P. vivax типу І та типу II. 3 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 60 Гібридний злитий білок, як використовується в даній заявці, відноситься до білка, який має походження від P. vivax типу І та типу II, злитого з іншим білком або його фрагментом. В одному аспекті гібридний злитий білок згідно з винаходом включає гібридний білок, який має походження від CS білків P. vivax (CSV) та поверхневого антигену з вірусу гепатиту В, в загальному випадку основного поверхневого білка, відомого як S антиген, такого, як S антиген, який походить від серотипу adw. CSV антигенний компонент (тобто гібридний білок) згідно з винаходом в загальному випадку є злитим з амінотермінальним кінцем S білка. Зокрема, С-термінальний кінець фрагмента CSV є злитим з N-термінальним кінцем зазначеного S антигену. Передбачається, що присутність поверхневого антигену з вірусу гепатиту В підсилює імуногенність CS частини гібридного білка, сприяє стабільності та/або поліпшує відтворюваність виробництва білка. В загальному випадку гібридний білок буде також містити N-термінальний фрагмент з CS білка Plasmodium такого, як P. vivax (типу І або II), наприклад, фрагмент, що містить ділянку І, такий, як амінокислоти, представлені в SEQ ID No. 1. Альтернативно, гібридний білок може містити N-термінальний фрагмент з CS білка P. falciparum. В одному аспекті гібридний білок може включати одну або більше повторюваних одиниць центральної ділянки P. falciparum. Наприклад, 1, 2, 3, 4, 5, 6, 7, 8, 9 або більше повторюваних одиниць. Звичайно гібридний білок буде містити С-термінальний фрагмент з CS білка Plasmodium такого, як P. vivax (типу І або II), наприклад, фрагмент, що містить ділянку II, такий, як амінокислоти, представлені в SEQ ID No. 2. Альтернативно, гібридний білок може містити С-термінальний фрагмент з CS білка P. falciparum. При відсутності бажання бути пов'язаним з будь-якою теорією, вважають, що N- та Стермінальні фрагменти включають декілька епітопів Т та В клітин. У рекомбінантних білках часто у процесі клонування вводяться неприродні амінокислоти, які потім спостерігаються в одержаних експресованих білках. Наприклад, деякі, наприклад, 1, 2, 3, 4 або 5 амінокислот можуть вводитися на початку (N-терімнальна частина) білка. Якщо вбудовуються 4 амінокислоти на початку білка, то вони можуть, наприклад, являти собою ММАР. Додатково або альтернативно, 1, 2, або 3, наприклад, 1 амінокислота, можуть вбудовуватися у білок/у середину білка, наприклад, поблизу амінокислот 259, 260, 261 або 262. Амінокислотна інсерція може являти собою амінокислоту, яка має символ Р. В одному аспекті білок, що використовується, не включає ніякої амінокислоти, вбудованої у процесі клонування у білок / у середину білка. Винахід також охоплює так звані "вкорочені" варіанти гібридного білка, наприклад, такий, як показано на Фіг. 12, що одержав назву CSVtr-S. Таким чином, винахід забезпечує вкорочений варіант гібридного білка, де принаймні ділянка, збагачена аргініном, що знаходиться в N-термінальній частині CS білка (приблизно 60 амінокислот), є видаленою/делетованою. В одному аспекті винахід забезпечує вкорочений гібридний білок, де принаймні амінокислоти від 1 до 55 (або від 1 до 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69 або 70) є делетованими. Такий вкорочений гібридний білок може включати до 4 амінокислот, вбудованих на початку білка, такі, як ММАР. В одному аспекті винахід відноситься до гібридних білків, з яких виключено від 5 до 64 (включно) амінокислоти рекомбінантного білка повної довжини. Цей/ці гібридний(і) білок(гібридні білки) можуть використовуватися в інших аспектах згідно з винаходом, описаних нижче. Будь-який прийнятний штам P. vivax може використовуватися у винаході, включаючи: Latina, America (тобто Sal 1, Belem), Korean, China, Thailand, Indonesia, India та Vietnam штами. Конструкція, що представлена у SEQ ID No. 13, базується на корейському штамі (зокрема, на південнокорейському штамі). P. vivax з CS білками типу І є більш переважним, ніж P. vivax з CS білками типу II. Таким чином, в одному аспекті винаходу використовується CS білок типу I. В альтернативному аспекті винаходу забезпечується гібридний білок, що включає повторювану одиницю типу І та повторювану одиницю типу II, наприклад, де у гібрид включається більше повторюваних одиниць типу І, ніж повторюваних одиниць типу II. Зокрема, гібридний білок згідно з винаходом може включати від 1 до 15 повторюваних одиниць, наприклад, 9 повторюваних одиниць типу І. 4 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 Приклади прийнятних повторюваних одиниць типу І CS білків представлені у SEQ ID No. 3-9. В одному втіленні винаходу забезпечується гібрид із сумішшю різних повторюваних одиниць типу І, таких, як одна з тих, що приведені у SEQ ID No. 3-9. Одна або більше повторюваних одиниць можуть бути подвоєні у гібриді, наприклад, дві повторювані одиниці SEQ ID No. 3 та/або 4 можуть бути введені у конструкцію. а а) В одному аспекті CS білок включає одиницю послідовності SEQ ID No. 3. b) В одному аспекті CS білок включає одиницю послідовності SEQ ID No. 4, необов'язково у комбінації з одиницями, як описано у пункті а) безпосередньо вище. c) В одному аспекті CS білок включає одиницю послідовності SEQ ID No. 5, необов'язково у комбінації з одиницями, як описано у пункті а) або b) безпосередньо вище. d) В одному аспекті CS білок включає одиницю послідовності SEQ ID No. 6, необов'язково у комбінації з однією або більше одиницями, як описано у пунктах а) - с) безпосередньо вище. f) В одному аспекті CS білок включає одиницю послідовності SEQ ID No. 7, необов'язково у комбінації з однією або більше одиницями, як описано у пункті а) - d) безпосередньо вище. g) В одному аспекті CS білок включає одиницю послідовності SEQ ID No. 8, необов'язково у комбінації з однією або більше одиницями, як описано у пункті а) - f) безпосередньо вище. h) В одному аспекті CS білок включає одиниці послідовності SEQ ID No. 9, необов'язково у комбінації з однією або більше одиницями, як описано у пункті а) - g) безпосередньо вище. Приклади прийнятного компоненту повторюваних одиниць з CS білків типу II приведені у послідовностях SEQ ID No. 10 та 14, такій, як 10. В одному аспекті винаходу забезпечується гібридний білок з 5 або менше повторюваними одиницями, які походять від типу II, такими, як одна повторювана одиниця, наприклад, як представлено у SEQ ID No. 10. Гібрид може також включати інсерцію розміром 12 амінокислот, що виявлена на кінці повторюваної ділянки, яку знайдено у деяких азіатських штамах P. vivax, наприклад, як показано у SEQ ID No. 11. В одному втіленні гібридний білок включає приблизно 257 амінокислот, що походять від CS білка P. vivax. В одному втіленні гібридний злитий білок включає приблизно 494 амінокислот, при цьому приблизно 257 з них походять від CS білка P. vivax. В одному аспекті CS білок включає білок повної довжини. В одному аспекті CS білок, що використовується, являє собою вкорочений варіант, наприклад, як показано на Фігурі 12, або є вкороченим відповідним чином, в якому амінокислоти від приблизно 1 до приблизно 67 є делетованими. В одному втіленні від 1 до 5 додаткових амінокислот є вбудованими на початку послідовності як результат проведення процесу клонування, наприклад, є вбудованими ММАР або MMAPG. Гібридний злитий білок може також включати додаткові антигени, які походять від P. falciparum та/або P. vivax, наприклад, антигени, вибрані з DBP, PvTRAP, PvMSP2, PvMSP4, PvMSP5, PvMSP6, PvMSP7, PvMSP8, PvMSP9, PvAMA1 та RBP або їх фрагментів. Інший приклад, антигенів, що походять від P. falciparum, включає PfEMP-1, Pfs 16 антиген, MSP-1, MSP-3, LSA-1, LSA-3, АМА-1 та TRAP. Інші антигени Plasmodium включають такі P. falciparum EBA, GLURP, RAP1, RAP2, Sequestrin, Pf332, STARP, SALSA, PfEXP1, Pfs25, Pfs28, PFS27/25, Pfs48/45, Pfs230 та їх аналоги з інших видів Plasmodium. В одному втіленні гібридний злитий білок (CSV-S) має амінокислотну послідовність, представлену в SEQ ID No. 17. У послідовності амінокислоти 6-262 є такими, що походять від CSV, а амінокислоти 269-494 є такими, що походять від S. Амінокислоти, що залишилися, вбудовують за допомогою генетичної конструкції (яка, зокрема, може відрізнятися, якщо це є прийнятним). Ці чотири амінокислоти, Met, Met Ala Pro, є такими, що специфічно походять з плазміди pGFI-S2 (див. Фіг. 4) Властивості CSV-S злитого білка послідовності SEQ ID No. 17 приведені у Таблицях, що представлені нижче. 5 UA 99711 C2 Аналіз Молекулярна вага Довжина 1 мкг = Коефіцієнт молярної екстинкції 1 А(280) = Ізоелектрична точка Заряд при рН 7 Цільний білок м.в. 51794,75 494 19,307 пмолів 90780+/-5 % 0,57 мг/мл 7,33 1,05 Аналіз складу цільного білка Амінокислота(и) Заряджені (RKHYCDE) Кислі (DE) Основні (KR) Полярні (NCQSTY) Гідрофобні (AILFWV) A Ala C Cys D Asp E Glu F Phe G Gly H His I lle K Lys L Leu M Met N Asn P Pro Q GIn R Arg S Ser T Thr V Val W Trp Y Tyr B Asx Z GIx X Xxx Ter Кількість % від ваги 106 38 39 134 167 52 18 24 14 17 64 4 17 20 42 8 32 40 21 19 30 26 25 14 7 0 0 0 1 26,35 8,82 10,68 28,15 34,68 7,14 3,58 5,33 3,49 4,83 7,05 1,06 3,71 4,95 9,18 2,03 7,05 7,50 5,20 5,73 5,04 5,08 4,78 5,03 2,21 0,00 0,00 0,00 0,00 % частоти повторюваності 21,46 7,69 7,89 27,13 33,81 10,53 3,64 4,86 2,83 3,44 12,96 0,81 3,44 4,05 8,50 1,62 6,48 8,10 4,25 3,85 6,07 5,26 5,06 2,83 1,42 0,00 0,00 0,00 0,20 5 Властивості CSV-S злитого білка послідовності SEQ ID No. 20 забезпечуються у Таблицях, що представлені нижче: Nishikawa & Ооі, 1987 Аналіз Молекулярна вага Довжина 1 мкг = Коефіцієнт молярної екстинкції 1 А(280) = Ізоелектрична точка Заряд при рН 7 Цільний білок м.в. 51762,69 494 19,319 пмолів 90780±5 % 0,57 мг/мл 7,33 1,05 10 6 UA 99711 C2 Аналіз складу цільного білка Амінокислота(и) Заряджені (RKHYCDE) Кислі (DE) Основні (KR) Полярні (NCQSTY) Гідрофобні (AILFWV) A Ala C Cys D Asp E Glu F Phe G Gly H His l lie K Lys L Leu M Met N Asn P Pro Q GIn R Arg S Ser T Thr V Val W Trp Y Tyr B Asx Z GIx X Xxx Ter 5 10 15 20 25 Кількість % від ваги 106 38 39 134 168 52 18 24 14 17 64 4 17 20 42 7 32 40 21 19 30 26 26 14 7 0 0 0 1 26,37 8,83 10,69 28,17 34,89 7,14 3,59 5,34 3,49 4,83 7,05 1,06 3,72 4,95 9,18 1,77 7,05 7,50 5,20 5,73 5,05 5,08 4,98 5,04 2,21 0,00 0,00 0,00 0,00 % частоти повторюваності 21,46 7,69 7,89 27,13 34,01 10,53 3,64 4,86 2,83 3,44 12,96 0,81 3,44 4,05 8,50 1,42 6,48 8,10 4,25 3,85 6,07 5,26 5,26 2,83 1,42 0,00 0,00 0,00 0,20 Гібридний злитий білок CSV-S може, наприклад, бути одержаний при викорситанні плазміди pGFI-S2 (див. Фіг. 4 та приклади для додаткових деталей), яка у випадку, коли прийнятна послідовність, що відповідає CSV, є вбудованою у Smal сайті клонування у процесі інсерції з одержанням злитого білка CSV-S. Нуклеотидна послідовність для гібридного злитого білка послідовності SEQ ID No. 17 є приведеною у SEQ ID No. 16. CSV частина цієї послідовності є оптимізованою для експресії у дріжджах. Альтернативно, гібридний злитий білок CSV-S може, наприклад, бути одержаний так, як описано у Прикладі 2. Альтернативна нуклеотидна послідовність для гібридного злитого білка згідно з винаходом є приведеною у SEQ ID No. 19, а амінокислотна послідовність для нього представлена у SEQ ID No. 20. Даний винахід також забезпечує нуклеотидні послідовності, наприклад, ДНК, що кодують білки згідно з даним винаходом. Послідовності ДНК, що кодують білки згідно з даним винаходом, є в одному втіленні фланкованими елементами контролю транскрипції, бажано такими, що походять від генів дріжджів, та є вбудованими в експресійний вектор. Експресійна касета для гібридних білків згідно з винаходом може, наприклад, характеризуватися наступними ознаками: - Промоторна послідовність, яка походить, наприклад, від гену TDH3 S.cerevisiae. - Послідовності, що кодують прийнятний злитий білок. - Послідовність термінації транскрипції, що міститься у межах послідовності, яка походить, наприклад, від гену ARG3 S. cerevisiae. Прикладом специфічного промотора є промотор з гену TDH3 S.cerevisiae, Musti та ін. 7 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід також охоплює вектори, які використовуються при одержанні гібридного злитого білка. Для вбудовування послідовності, яка кодує гібридний злитий білок, у прийнятного хазяїна для синтезу, потім може використовуватися прийнятна плазміда. Приклад прийнятної плазміди являє собою pRIT15546, 2 мкм вектор для розміщення прийнятної експресійної касети, див. його плазмідну карту на Фіг. 3. Альтернативно, плазміди є відомими спеціалісту в даній області та/або є описаними у прикладах. Плазміда буде у загальному випадку містити вбудований маркер для сприяння селекції, наприклад, ген, що кодує стійкість до антибіотиків, або LEU2, або HIS ауксотрофність. В одному аспекті плазміда є епісомальною, тобто ген для білка не є інтегрованим у ДНК хазяїна. Винахід також відноситься до хазяйської клітини, трансформованої вектором згідно з винаходом. Хазяйські клітини можуть бути прокаріотичними або еукаріотичними клітинами, але переважно, являють собою дріжджі, наприклад, Saccharomyces (наприклад, Saccharomyces cerevisiae, такий, як DC5 у АТСС базі даних (депозитний номер 20820), під назвою RIT DC5 сіr(о). Депозитор: Smith Kline-RIT) та дріжджі, відмінні від Saccharomyces. Такі включають Schizosaccharomyces (наприклад, Schizosaccharomyces pombe) Kluyveromyces (наприклад, Kluyveromyces lactis), Pichia (наприклад, Pichia pastoris), Hansenula (наприклад, Hansenula polymorpha), Yarrowia (наприклад, Yarrowia lipolytica) та Schwanniomyces (наприклад, Schwanniomyces occidentalis). В одному аспекті винахід відноситься до рекомбінантного дріжджового штаму Y1834 (та до його застосування), який експресує CSV-S гібридний злитий білок та/або його імуногенні частинки, див. Приклади для його одержання. В одному аспекті винахід відноситься до рекомбінантного дріжджового штаму Y1835 (та до його застосування), який експресує CSV-S гібридний злитий білок та/або його імуногенні частинки, див. Приклади для його одержання. В одному аспекті винахід відноситься до рекомбінантного дріжджового штаму Y1840 (та до його застосування), який експресує CSV-S гібридний злитий білок та/або його імуногенні частинки. В альтернативному аспекті винахід відноситься до вказаних видів дріжджів (або інших дріжджів), що включають нуклеотидну послідовність, яка кодує злитий білок згідно з винаходом, до застосування цих дріжджів для одержання вказаного злитого білка, та до способів, які втягують приготування вказаного злитого білка. Нуклеотидні послідовності або їх частина (така, як частина, що кодує CS/гібридний білок, але необов'язково не та частина, що кодує білок S), використовувані в даній заявці, можуть бути оптимізовані за кодонами для експресії у хазяїні, такому, як дріжджі. Термін "оптимізований за кодонами у контексті даного винаходу є призначеним для розуміння того, що кодони є модифікованими для забезпечення їх прийнятності для експресії у релевантному хазяїні. Це може бути або може не бути найбільш оптимальним вибором кодонів, наприклад, може бути вибраний субоптимальний варіант оптимізації, якщо експресія його є більш високою, ніж для оптимального варіанту. Коли клітини дріжджів вже експресують гібридний злитий білок (що включає S антиген), то він є здатним спонтанно утворювати ліпопротеїнові структури/частинки, які складаються з багаточисленних мономерів вказаних білків. Такі частинки можуть також називатися вірусоподібними частинками (VLP). Ці частинки можуть також бути описані як мультимерні ліпопротеїнові частинки. Ці частинки можуть бути одержані при використанні ряду способів, наприклад, шляхом злиття кожного антигену, що походить від Plasmodium, з іншим партнером злиття (наприклад, антигенами вірусу гепатиту В або вірусним структурним білком) та експресії конструкції у прийнятному хазяїні, такому, як дріжджі або бактерії. Коли вибраний реципієнтний дріжджовий штам вже несе у своєму геномі декілька інтегрованих копій експресійних касет S антигену гепатиту В, то частинки, які піддаються зборці, включають мономери незлитого S антигену. Вони можуть спонтанно поєднуватися у ліпопротеїнові частинки, які включають мономери гібридного злитого білка та мономери S антигену. Не маючи бажання бути зв'язаним будь-якою теорією, частинки, наприклад, коли експресуються в Y1834, як передбачається, суттєво складаються з одиниць/мономерів гібридного злитого білка, хоча може бути так, що композиція частинок буде варіювати у залежності від специфічності дріжджів, що використовуються. 8 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 Таким чином у деяких випадках ліпопротеїнові частинки можуть також містити незлитий S антиген, наприклад, як у частинках, які є результатом одержання у дріжджах Y1835. Так, в одному аспекті винахід забезпечує імуногенну частинку, що включає гібридні злиті білки згідно з винаходом. Так, в одному аспекті частинка є так званою простою частинкою, тому, що вона суттєво складається з одиниць гібридного злитого білка. В альтернативному аспекті згідно з винаходом імуногенна ліпопротеїнова частинка включає одну або більше одиниць гібридних злитих білків та одну або більше одиниць білка S, у так званих подвійних або змішаних частинках. Фігури 1 та 7 являють собою електронні мікрографії ліпопротеїнової частинки згідно з даним аспектом винаходу, хоча й одержані у різних видах дріжджів Частинки, показані на мікрографії, очищали за допомогою класичних методик, використовуючи градієнт хлориду цезію та сахарози, зокрема при використанні послідовних градієнтів хлориду цезію та сахарози, а саме: 1 градієнт сахарози та by 3 послідовні градієнти CsCI. Винахід включає способи очистки вказаних частинок, наприклад, при використанні градієнту хлориду цезію та сахарози. Додатково передбачається, що поверхневоактивні речовини, які використовуються для вивільнення білка з клітин, можуть також допомагати у стабілізації ліпопротеїнових частинок. У додатковому аспекті ліпопротеїнова частинка включає поверхнево-активну сполуку. Поверхнево-активна сполука може, наприклад, бути вибраною з Твіну ((такий, як Твін 20), поліоксіетиленових етерів, поліетиленгліколю. Частинка може, наприклад, включати 1 % або менше, наприклад, 0,5 % або 0,1 % за вагою поверхнево-активної сполуки. Передбачається, що білкові частинки винаходу можуть робити свій внесок у додаткову стимуляцію in vivo імунної відповіді на гібридний злитий білок. Даний винахід також відноситься до вакцин, що включають імунопротективну кількість білкових частинок згідно з винаходом у суміші із прийнятним розріджувачем або носієм. Винахід також охоплює композицію, що включає гібрид/злитий білок або частинку згідно з винаходом та вірусний вектор, що містить малярійний антиген, зокрема, малярійний антиген, що має спільне походження із вказаними частинками, та необов'язково ад'ювант. У контексті даного опису наповнювач відноситься до компонента у фармацевтичній композиції, що не виявляє терапевтичного ефекту сам по собі. Розріджувач потрапляє у визначення наповнювача. В одному аспекті композиція згідно з винаходом включає гібридний злитий білок та/або частинку, як описано в даній заявці, та ад'ювант. В одному втіленні конструкція вірусного вектора є такою, як описано у WO 2004/055187. В одному втіленні вказані злиті білки перебувають у суміші та, таким чином, є доступними як одна композиція. В альтернативному втіленні злиті білки одержують у вигляді окремих композицій та вводять пацієнтові окремо. У додатковому аспекті винахід відноситься до поєднаного лікування P. falciparum та P. vivax, що включає: імуногенний злитий білок, який включає послідовності, що походять від CS білка P. vivax, та імуногенний злитий білок, який включає послідовності, що походять від CS білка P. falciparum. У цьому аспекті винаходу антиген, який походить від компонента злиття CS білка P. vivax може бути існуючим у природі (нативним) CS білком, таким, як такий типу І та/або типу II або його фрагмент. Альтернативно, антиген може бути гібридним (химерним) білком, як описано вище, таким, як білок, що ідентифікується послідовністю SEQ ID No. 13 та/або 15. Компонент злитого білкового антигену, що походить від P. falciparum, може бути одержаний згідно з WO 93/10152, наприклад, як RTS,S (де "S" являє собою незлитий мономер), або як RTS, обидва з них є прийнятними для застосування згідно з даним аспектом винаходу. В одному втіленні антиген, що походить від P. falciparum, включає принаймні 4 повторювані одиниці центральної повторюваної ділянки. Зокрема, цей антиген включає послідовність, яка містить принаймні 160 амінокислот, які є суттєво гомологічними С-термінальній частині CS білка. CS білок може бути позбавлений останніх 12-14 (наприклад, 12) амінокислот з Стермінального кінця. Зокрема, у частинках використовували злитий білок, який включає частину CS білка P. falciparum, суттєво таку, що відповідає амінокислотам 207-395 білка CS Р. falciparum (штам NF54[3D7]) 7G8, злитий у рамці через лінійний лінкер з N-термінальним кінцем S антигену. Лінкер може включати частину preS2 з S-антигену. 9 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 Зокрема, злитий білок, що походить від використовуваного P. falciparum, є таким, що кодується нуклеотидною послідовністю для RTS експресійної касети, яка забезпечується у послідовності SEQ ID No. 18. Прийнятні S антигени можуть включати preS2. Приклад прийнятного серотипу являє собою adw (Nature 280:815-819, 1979). В одному аспекті гібридні злиті білки згідно з винаходом включають частину, що походить від мутантних білків, наприклад, як описано в опублікованій заявці США №2006/194196 (що також є опублікованою як WO 2004/113369). Цей документ описує мутант, мічений HDB05. Зокрема, він описує порівняння мутантного білка та білка дикого типу на Фігурах 1 та 6 та гени для мутанта на Фігурах 4 та 5. Послідовності 12-22 в даній заявці описують окремі поліпептиди мутантного білка S. Кожна приведена інформація є введеною в дану заявку як посилання. Винахід також відноситься до застосування вказаної комбінації для лікування, зокрема, до застосування вакцини для запобігання малярії та до способу лікування пацієнта, чутливого до інфекції Plasmodium, що включає введення ефективної кількості кожного з компонентів, або одночасно, або послідовно, для лікування або запобігання малярії. У додатковому аспекті винахід забезпечує комбінацію для лікування, що включає: імуногенний гібридний антиген, який містить a. принаймні одну повторювану одиницю, що походить від центрального повторюваного сегменту білка типу І, який оточує спорозоїт P. vivax, та b. принаймні одну повторювану одиницю, що походить від центрального повторюваного сегменту білка типу II, який оточує спорозоїт P. vivax, та імуногенний злитий білок, який включає антиген, що походить від CS білка Р. falciparum. Наприклад, якщо вказаний гібридний антиген та вказаний злитий білок вводяться сумісно, наприклад, вони можуть вводитися у суміші для введення одночасно або, альтернативно, можуть бути рецептовані для послідовного введення. У додатковому аспекті винахід забезпечує комбінацію для лікування, що включає: імуногенний гібридний антиген, який містить a. принаймні одну повторювану одиницю, що походить від центрального повторюваного сегменту білка типу І, який оточує спорозоїт P. vivax, та b. принаймні одну повторювану одиницю, що походить від центрального повторюваного сегменту білка типу II, який оточує спорозоїт P. vivax, та вірусний вектор, що кодує малярійний антиген, такий, як вказаний гібридний антиген. Наприклад, якщо вказаний гібридний антиген та вказаний вірусний вектор вводяться одночасно, наприклад, вони можуть вводитися у суміші для введення сумісно або, альтернативно, можуть бути рецептовані для послідовного введення. Як використовується в даній заявці термін "сумісно" означає, що вказана комбінація компонентів вводиться у межах періоду часу не більше 12 годин, наприклад, протягом періоду часу більше 1 години, типово за один прийом, наприклад, у ході того самого візиту до лікаря, наприклад, коли вони вводяться послідовно або одночасно. Винахід також включає вакцинну композицію, що містить вказані елементи кожного з цих втілень. Винахід також включає вакцинний набір, що містить вказані елементи, для лікування малярії. Винахід також включає режими примування-бустингу різними компонентами, описаними у даній заявці, наприклад, примування вірусним вектором та бустинг-ін'єкції вказаними частинками, або навпаки. Режим примування-бустингу може, наприклад, включати використання компонентів, які виключно походять від або походять тільки від P. vivax. В іншому втіленні примування може бути досягнуте при використанні плазміди/оголеної ДНК, а бустинг-ін'єкцій здійснюють при використанні антигену згідно з винаходом та/або навпаки. Альтернативно, примування може бути досягнуте при використанні прийнятного вірусного вектора, а бустинг-ін'єкцій - при використанні антигену згідно з винаходом та/або навпаки. Загальні режими примування-бустингу є описаними нижче: Наприклад: - примування може бути за допомогою антигену (такого, як антиген з ад'ювантом), що включає принаймні одну повторювану одиницю типу І з CS білка P. vivax та принаймні одну повторювану одиницю типу II з CS білка P. vivax, а бустинг може бути проведене за допомогою вірусного вектора, що кодує той самий/відповідний антиген, 10 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 60 - примування може бути за допомогою антигену (такого, як антиген з ад'ювантом), що включає принаймні одну повторювану одиницю або епітоп з P. vivax та принаймні одну повторювану одиницю або епітоп з CS білка P. falciparum, а бустинг може бути за допомогою вірусного білка що визначає той самий/відповідний антиген, - примування може бути за допомогою вірусного вектора, що кодує антиген, який включає принаймні одну повторювану одиницю типу І з CS білка P.vivax та принаймні одну повторювану одиницю типу Іl з CS білка P.vivax, або такого, що включає принаймні одну повторювану одиницю або епітоп з P.vivax та принаймні одну повторювану одиницю або епітоп з CS білка P. falciparum, а бустинг за допомогою того самого/відповідного антигену з ад'ювантом у формі білка та/або імуногенної частинки. Антиген у цьому контексті включає гібридний злитий білок та/або імуногенні частинки згідно з винаходом. У цих режимах примування-бустингу антиген буде звичайно використовуватися з ад'ювантом. У цьому(цих) аспекті(аспектах) згідно з винаходом також застосовуються переваги, описані вище для гібридного білка, який походить від P. vivax. Так, в одному аспекті гібридний білок має послідовність, приведену у SEQ ID No. 13. RTS, S та антиген (у формі імуногенної частинки) з P. falciparum можу бути одержані так, як описано у WO 93/10152. В одному аспекті винахід забезпечує дефектний за реплікацією вірусний вектор, що кодує гібридний білок (або альтернативно гібридний злитий білок) згідно з винаходом. Прийнятні вірусні вектори можуть являти собою такі, що походять аденовірусних векторів, аденоасоційованих вірусних векторів (AAV), векторів на основі вірусу кору, лентівірусів, альфавірусів, бакуловірусів, вірусу простого герпесу, та поксвірусів, таких, як вірус коров'ячої віспи, вірус віспи птахів, вірус віспи голубів, вірус віспи канарок, віспи свиней та віспи овецьх/кіз. Методика одержання аденовірусних векторів, що кодують малярійний антиген, є, наприклад, описаною у WO 2004/055187. Білок, що кодується вектором, може, наприклад, бути модифікованим для запобігання глікозилювання білка під час експресії, наприклад, деякі серинові залишки можуть бути замінені на аланінові залишки для зниження глікозилювання. Аденовірус Аденовірусні вектори даного винаходу включають один або більше гетерологічних полінуклеотидів (ДНК), які кодують один або більше імуногенних поліпептидів. Аденовірусні вектори для застосування у даному винаході можуть бути такими, що походять від спектру хазяїв-ссавців. Аденовіруси (які в даній заявці називаються "Ad" або "Adv") мають характерну морфологію з ікосаедричним капсидом, який складається з трьох основних білків, гексону (II), пентонової основи (III) та шишкоподібних волокон (IV), разом з рядом інших мінорних білків, VI, VIII, IX, ІІІа та IVa2 (Russell W.C. 2000, Gen Viriol, 81: 2573-2604). Вірусний геном являє собою лінійну, дволанцюгову ДНК з термінальним білком, який є приєднаним ковалентно до 5'-термінального кінця, що має інвертовані кінцеві повтори (ITR). Вірусна ДНК є безпосередньо асоційованою з високо основним білком VII та маленьким пептидом, що називається мю. Інший білок, V, є спакованим з цим комплексом ДНК-білок та забезпечує структурний зв'язок з капсидом через білок VI. Вірус також містить протеазу, яка кодується вірусом, що є необхідною для процесингу деяких структурних білків з одержанням зрілого інфекційного вірусу. Було ізольовано більше 100 різних серотипів аденовірусу, які інфікують різні види ссавців, 51 з них мають людське походження. Таким чином, один або більше аденовірусних векторів можуть походити від людського аденовірусу. Приклади таких, аденовірусів, що походять від людських, являють собою Ad1, Ad2, Ad4, Ad5, Ad6, Ad11, Ad24, Ad34, Ad35, Ad50/51, зокрема, Ad5, Ad11 та Ad35. Людські серотипи були класифіковані на шість підвидів (A-F) на основі ряду біологічних, хімічних, імунологічних та структурних критеріїв. Незважаючи на те, що вектори на основі Ad5 екстенсивно використовуються у ряді експериментів з генної терапії, існують обмеження для застосування аденовірусних векторів Ad5 та іншої групи С завдяки попередньо існуючому імунітету у загальній популяції з причини природної інфекції. Члени Ad5 та іншої групи С мають тенденцію бути серед найбільш домінуючих серотипів. Імунітет до існуючих векторів може розвиватися як результат піддання впливу вектору під час лікування. Ці типи попередньо існуючого імунітету або імунітету, що розвинувся, до векторів на основі домінуючих серотипів можуть обмежувати ефективність генної терапії або зусилля по вакцинації. Альтернативні аденовірусні серотипи, таким чином, являють собою дуже важливі цілі, які переслідуються при розробці систем для доставки генів, що є здатними, уникати імунної відповіді хазяїна. 11 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одна така область альтернативних серотипів являє собою такі, що походять від приматів, відмінних від людини, зокрема, від аденовірусів шимпанзе. Див. патент США № 6,083,716, який описує геном двох аденовірусів шимпанзе. Було показано, що аденовірусні вектори шимпанзе ("Pan" або "С") індукують сильні імунні відповіді на трансгенні продукти так ефективно, як й людські аденовірусні вектори (Fitzgerald та ін. J. Immunol. 170: 1416). Аденовіруси приматів, відмінних від людини, можуть бути ізольовані з мезентеричних лімфатичних вузлів шимпанзе. Аденовіруси шимпанзе є в достатній мірі подібними до людського аденовірусу підтипу С, що дозволяє проводити реплікацію Е1 делетованого вірусу у клітинах НЕК 293. Незважаючи на це, аденовіруси шимпанзе є філогенетично відмінними від більш загальних людських серотипів (Ad2 та Ad5). Pan 6 є найменш близькоспорідненим та серологічно відрізняється від Pan 5, 7 та 9. Таким чином, один або більше аденовірусних векторів можуть походити від аденовірусів приматів, відмінних від людини, наприклад, від аденовірусу шимпанзе, такого, як один із серотипів Раn5, Раn6б, Раn7 та Раn9. Аденовірусні вектори можуть також походити більше, ніж від одного вірусного серотипу, та кожний серотип може походити з того самого або іншого джерела. Наприклад, вони можуть походити від більше, ніж з одного, серотипу людини та/або більше, ніж з одного, серотипу примату, відмінного від людини. Способи конструювання химерних аденовірусних векторів є розкритими у WO2005/001103. Існують деякі обмеження за розмірами, асоційовані з інсерцією гетерологічної ДНК в аденовірус. Людські аденовіруси мають здатність упаковувати до 105 % довжини геному дикого типу (Bert та ін. 1993, J Virol 67 (10), 5911-21). Більш низька границя пакування для людських аденовірусів була показана як така, що становить 75 % довжину геному дикого типу (Parks та ін. 1995, J Virol 71(4), 3293-8). Один приклад аденовірусів, корисних згідно з даним винаходом, являє собою аденовіруси, які відрізняються від домінуючих природних серотипів у людській популяції, такі, як Ad2 та Ad5. Це надає можливості уникати індукції потужних імунних відповідей проти вектора, які обмежує ефективність подальших введень того самого серотипу шляхом блокування поглинання вектора за допомогою нейтралізуючого антитіла та токсичності, що виявляє свій вплив. Таким чином, аденовірус може являти собою аденовірус, який не є домінуючим існуючим у природі серотипом людського вірусу. Аденовіруси, ізольовані з тварин, мають імунологічно відмінний капсид, гексон, пентон, волокнисті компоненти, але філогенетично є близькоспорідненими. Зокрема, вірус може являти собою не-людський аденовірус, такий, як мавпячий аденовірус та, зокрема, аденовірус шимпанзе, такий, як Pan 5, 6, 7 або 9. Приклади таких штамів є описаними у WO 03/000283 та є доступними з Американської колекції типових культур, 10801 University Boulevard, Manassas, Virginia 20110-2209, та інших джерел. Бажані штами аденовірусів шимпанзе являють собою Pan 5 [АТСС VR-591], Pan 6 [АТСС VR-592] та Pan 7 [АТСС VR-593]. Застосування аденовірусів шимпанзе, як передбачається, є бажаними у порівнянні із застосуванням серотипів людських аденовірусів, оскільки є відсутнім попередньо існуючий імунітет, зокрема, є відсутніми попередньо існуючі антитіла, до аденовірусів у цільовій популяції. Перехресна реакція аденовірусів шимпанзе з попередньо існуючими антитілами є присутньою тільки у 2 % цільової популяції у порівнянні з 35 % у випадку деяких кандидатних людських аденовірусів. Аденовіруси шимпанзе відрізняються від більш загальних людських підтипів Ad2 та Ad5, але є більш спорідненими з людським Ad4 підгрупи Е, який не є домінуючим підтипом. Pan 6 є менш близькоспорідненим з Pan 5, 7 та 9. Аденовірус згідно з винаходом може бути дефектним за реплікацією. Це означає, що він має знижену здатність до реплікації в некомплементарних клітинах у порівнянні звірусом дикого типу. Це може бути викликане мутацією вірусу, наприклад, делецією гену, що є втягнений у реплікацію, наприклад, делецією Е1а, Е1b, Е3 або Е4 гену. Аденовірусні вектори згідно з даним винаходом можуть походити від аденовірусу, що є дефектним за реплікацією, включаючи функціональну Е1 делецію. Таким чином, аденовірусні вектори згідно з винаходом можуть бути дефектними за реплікацією завдяки відсутності здатності експресувати аденовірусні Е1 та Е1b, тобто є функціонально делетованими у Е1а та Е1b. Рекомбінантні аденовіруси можуть також нести функціональні делеції в інших генах [див. WO 03/000283], наприклад, делеції у генах Е3 або Е4 (або в їх частинах, таких, як частина Е3). Аденовірусний затриманий ранній ген Е3 може бути елімінований з аденовірусної послідовності, яка утворює частину рекомбінантного аденовірусу. Функція Е3 не є необхідною для утворення рекомбінантної аденовірусної частинки. Таким чином, не є необхідним замінювати функцію 12 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 60 цього генного продукту для того, щоб спакувати рекомбінантний аденовірус, корисний у даному винаході. В одному окремому втіленні рекомбінантні аденовіруси мають функціонально делетовані гени Е1 та Е3. Конструювання таких векторів є описаним у Roy та ін., Human Gene Therapy 15: 519-530, 2004. Рекомбінантні аденовіруси можуть також бути сконструйовані як такі, що мають функціональну делецію гену Е4, незважаючи на це, може бути бажаним зберігти ORF6 функцію Е4. Аденовірусні вектори згідно з винаходом можуть також містити делецію затриманого раннього гену Е2а. Можуть також бути зроблені делеції у будь-якому з пізніх генів L1-L5 аденовірусного генома. Подібно до цього, делеції у проміжних генах ІХ та IV також можуть бути корисними. Можуть бути зроблені інші делеції в інших структурних або неструктурних генах аденовірусів. Зазначені вище делеції можуть використовуватися індивідуально, тобто послідовність аденовірусу для застосування у даному винаході може містити тільки делеції Е1. Альтернативно, делеції цільних генів або їх частини, що ефективно руйнують їх біологічну активність, можуть також використовуватися у будь-якій комбінації. Наприклад, в одному з векторів аденовірусні послідовності можуть мати делеції гену Е1 та гену Е4, або генів Е1, Е2а та Е3, або генів Е1 та Е3 (такі, як функціональні делеції Е1а та Е1b, та делецію принаймні частини Е3), або генів Е1, Е2а та Е4, з делецією або без делеції Е3, тощо. Такі делеції можуть бути повними або частковими делеціями цих генів та можуть використовуватися у комбінації з іншими мутаціями, такі, як чутливі до температури мутації, для досягнення бажаного результату. Аденовірусні вектори можуть бути одержані на будь-якій прийнятній клітинній лінії, в якій вірус є здатним до реплікації. Зокрема, можуть використовуватися комплементарні клітинні лінії, які забезпечують фактори, відсутні у вірусному векторі, що приводить до їх порушених характеристик реплікації (таких, як Е1 та/або Е4). Без обмеження такі клітинні лінії можуть являти собою HeLa [АТСС депозитний номер CCL 2], А549 [АТСС депозитний номер CCL 185], НЕК 293, KB [CCL 17], Detroit [наприклад, Detroit 510, CCL 72] та WI-38 [CCL 75] клітини, серед інших. Усі ці клітинні лінії є доступними з Американської колекції типових культур, 10801 University Boulevard, Manassas, Virginia 20110-2209. Інші прийнятні вихідні клітинні лінії можуть бути одержані з інших джерел, таких, як PER.C6© клітини, як представлено клітинами, задепонованими під ЕСАСС номером 96022940 в Європейській колекції культур клітин тваринних (ЕСАСС) при Центрі прикладної мікробіології та дослідження (CAMR, UK) або Her 96 клітини (Crucell). Винахід охоплює застосування відомих клітинних ліній для одержання вірусного вектора, що кодує білок згідно з даним винаходом. Полінуклеотидні послідовності, які кодують імуногенні CS поліпептиди, можуть бути оптимізовані за кодонами для клітин ссавців. Така оптимізація за кодонами є детально описаною у WO 05/025614, наприклад, починаючи зі сторінки 37. В одному втіленні згідно з даним винаходом вірусний вектор включає полінуклеотидні конструкції, що містять N-термінальну лідерну послідовність. Сигнальна послідовність, трансмембранний домен та цитоплазматичний домен усі індивідуально необов'язково є присутніми або делетованими. В одному втіленні даного винаходу усі ці ділянки є присутніми, проте модифікованими. Промотор для застосування в аденовірусному векторі згідно з винаходом може являти собою промотор з HCMV IE гена, наприклад, такий, де 5'-ділянка, що не транслюється, HCMV IE гена містить екзон 1, а інтрон А є повністю або частково виключеним, як описано у WO 02/36792. Коли декілька антигенів піддають злиттю в один злитий білок, такий білок буде кодуватися полінуклеотидом, що знаходиться під контролем єдиного промотора. В альтеративному втіленні винаходу декілька антигенів можуть бути експресовані через індивідуальні промотори, кожний із вказаних промоторів може бути таким самим або відмінним. Ще в одному втіленні винаходу деякі антигени можуть утворювати злиття, зв'язане з першим промотором, а інший(й) антиген(и) можуть бути зв'язаними з другим промотором, який може бути таким самим або відмінним від першого промотора. Таким чином, аденовірусний вектор може включати одну або більше експресійні касети, кожна з яких кодує один антиген під контролем одного промотора. Альтернативно або додатково, він може включати одну або більше експресійні касети, кожна з яких кодує більше, ніж один антиген під контролем одного промотора, де антигени, таким чингом, експресуються як злиття. Кожна експресійна касета може бути присутньою, більше, ніж в одному локусі аденовірусного вектора. 13 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 60 Полінуклеотид або полінуклеотиди, що кодують імуногенні поліпептиди, які експресуються, можуть бути вбудовані у будь-яку аденовірусну делетовану ділянку, наприклад, у Е1 делетовану ділянку. Незважаючи на те, що два або більше полінуклеотидів, які кодують імуногенні поліпептиди, можуть бути зв'язані у вигляді злиття, одержаний білок може бути експресований у вигляді злитого білка, або він може бути експресований як окремі білкові продукти, або він може бути експресований як злитий білок, а потім послідовно розщеплений на менші субодиниці. Термін "імуногенний" у контексті даного винаходу призначений для віднесення до здатності викликати імунну відповідь. Ця відповідь може, наприклад, бути тоді, коли ліпопротеїнові частинки вводяться у складі прийнятної композиції, яка може включати/вимагати присутності прийнятного ад'юванта. Бустер-ін'єкція, що включає дозу, яка є такою самою або меншою за вихідну дозу, може бути необхідною для одержання бажаної імуногенної відповіді (включаючи бустинг при використанні різних агентів, тобто гетерологічний бустинг). Композиція/фармацевтичний склад згідно з винаходом може також включати суміш одного або більше додаткових антигенів, таких, як ті, що походять від P. falciparum та/або P. vivax, наприклад, де антигени є вибраними з DBP, PvTRAP, PvMSP2, PvMSP4, PvMSP5, PvMSP6, PvMSP7, PvMSP8, PvMSP9, PvAMA1 та RBP або їх фрагментів. Інший приклад антигенів, що походять від P. falciparum, включає PfEMP-1, Pfs 16 антиген, MSP-1, MSP-3, LSA-1, LSA-3, АМА-1 та TRAP. Інші антигени Plasmodium включають ЕВА, GLURP, RAPI, RAP2, Sequestrin, Pf332, STARP, SALSA, PfEXPI, Pfs25, Pfs28, PFS27/25, Pfs48/45, Pfs230 P. falciparum та їх аналогів з інших Plasmodium spp. У вакцині згідно з винаходом водний розчин частинок може використовуватися безпосередньо. Альтернативно, білок, який піддавався або не піддавався попередній ліофілізації, може змішуватися або піддаватися абсорбції з будь-яким з відомих ад'ювантів, які включають, але без обмеження, алюм, мураміловий дипептид, сапоніни, такі, як Quil A. Особливими ад'ювантами є ті, що вибрані з групи солей металів, емульсій масло-у-воді, агоністів Toll-подібних рецепторів, (зокрема, агоніст Toll-подібного рецептора 2, агоніст Tollподібного рецептора 3, агоніст Toll-подібного рецептора 4, агоніст Toll-подібного рецептора 7, агоніст Toll-подібного рецептора 8 та агоніст Toll-подібного рецептора 9), сапонінів та їх комбінацій, за умови, що солі металів використовуються тільки у комбінації з іншим ад'ювантом, але не окремо, якщо вони не рецептовані таким чином, що не більше, ніж приблизно 60 % антигенів піддається адсорбції на солі металу. Зокрема, не більше, ніж приблизно 50 %, наприклад, 40 % антигенів піддається адсорбції на солі металу, та в одному втіленні не більше, ніж приблизно 30 % антигенів піддається адсорбції на солі металу. Рівень антитіла, адсорбованого на солі металу, може визначатися за допомогою методик, що є добре відомими з рівня техніки. Рівень вільного антигену може бути підвищений, наприклад, шляхом рецептування композиції у присутності іонів фосфату, наприклад, забуференого фосфатом фізіологічного розчину, або шляхом підвищення співвідношення антигену до солі металу. В одному втіленні ад'ювант не включає солі металу як єдиного ад'юванту. В одному втіленні ад'ювант не включає солі металу. В одному втіленні ад'ювант являє собою ліганд Toll-подібного рецептора (TLR) 4, бажано агоніст, такий, як похідна ліпіду А, зокрема, монофосфорил ліпід А або більш бажано 3деацилований монофосфорил ліпід А (3D-MPL). 3-деацилований монофосфорил ліпід А є відомим з патенту США №4912094 та патентної заявки UK №2220211 (Ribi) та є доступним від Ribi Immunochem, Montana, USA. 3D-MPL є доступним від GlaxoSmithKline Biologicals North America та, в першу чергу, поліпшує CD4+ Т-клітинні відповіді з IFN-g (Th1) фенотипом. Він може бути одержаний згідно зі способами, розкритими в GB 2 220 211 А. Хімічно він являє собою суміш 3-деацилованого монофосфорил ліпіду А з 3, 4, 5 або 6 ацилованими ланцюгами. Бажано використовувати у композиціях згідно з даним винаходом маленькі частинки 3D-MPL. Маленькі частинки 3D-MPL мають такий розмір частинок, що вони можуть стерильно фільтруватися через фільтр 0,22 мкм. Такі препарати є описаними у міжнародній патентній заявці WO 94/21292. Синтетичні похідні ліпіду А є відомими та, як передбачається, є TLR 4 агоністами. Такі включають, але без обмеження: ОМ 174 (2-дезокси-6-O-[2-дезокси-2-[(R)-3-додеканоїлокситетра-деканоїламіно]-4-офосфоно--D-глюкопіранозил]-2-[(R)-3-гідрокситетрадеканоїламіно]--Dглюкопіранозилдигідрофосфат), (WO 95/14026) ОМ 294 DP (3S,9R)-3-[(R)-додеканоїлокситетра-деканоїламіно]-4-оксо-5-аза-9(R)-[(R)-3гідрокситетрадеканоїламіно]декан-1,10-діол, 1,10-біс(дигідроофосфат) (WO99/64301 та WO 00/0462) 14 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОМ 197 МР-Ас DP (3S-,9R)-3-[(R)-додеканоїлокситетра-деканоїламіно]-4-оксо-5-аза-9-[(R)-3гідрокситетрадеканоїл аміно]декан-1,10-діол, 1-дигідроофосфат 10-(6-аміногексаноат) (WO 01/46127) Типово, коли використовується 3D-MPL, антиген та 3D-MPL доставляються з алюмом або представлені в емульсії масло-у-воді, або у вигляді емульсії декількох масел-у-воді. Введення 3D-MPL є бажаним, оскільки він являє собою стимулятор відповідей ефекторних Т-клітин. Інші TLR4 ліганди, які можуть використовуватися, являють собою алкілглюкозамінідфосфати (AGP), такі, як ті, що розкриті в WO9850399 або US6303347 (способи для одержання AGP є також розкритими) або фармацевтично прийнятні солі AGP, як розкрито в US6764840. Деякі AGP є TLR4 агоністами, а деякі є TLR4 антагоністами. Обидва, як передбачається, є корисними як ад'юванти. Інший імуностимулятор для застосування в даному винаході являє собою Quil A та його похідні. Quil А є препаратом сапоніну, ізольованим з південноамериканського дерева Quilaja Saponaria Molina, що був вперше описаний як такий, що володіє ад'ювантною активністю Dalsgaard та ін. у 1974 ("Сапонінові ад'юванти", Archiv. fur die gesamte Virusforschung, том. 44, Springer Verlag, Berlin, стор. 243-254). Очищені фрагменти Quil А були ізольовані шляхом ВЕРХ, що зберігає ад'ювантну активність без токсичності, асоційованої з Quil А (ЕР 0 362 278), наприклад, QS7 та QS21 (що є також відомими як QA7 та QA21). QS-21 є природним сапоніном, що одержаний з кори Quillaja saponaria Molina, він індукує CD8+ цитотоксичність Т клітин (CTL), Th1 клітин та переважну відповідь lgG2a антитіла, а також є переважним сапоніном у контексті даного винаходу. Були описані окремі композиції QS21, які, зокрема, додатково включають стерин (WO96/33739). Співвідношення QS21:стерин буде типово мати порядок від 1:100 до 1:1 ваг./ваг. В загальному випадку є присутнім надлишок стерину, а співвідношення QS21:стерин є принаймні 1:2 ваг./ваг. Є типовим, коли для введення людині QS21 та стерин будуть присутніми у вакцині в інтервалі від приблизно 1 мкг до приблизно 100 мкг, наприклад, від приблизно 10 мкг до приблизно 50 мкг на дозу. Ліпосоми у загальному випадку містять нейтральний ліпід, наприклад, фосфатидилхолін, який звичайно є некристалічним при кімнатній температурі, наприклад, фосфатидилхолін яєчного жовтка, діолеїл фосфатидилхолін або дилаурил фосфатидилхолін. Ліпосоми можуть також містити заряджений ліпід, який підвищує стабільність структури ліпосома-QS21 для ліпосом, що складаються із насичених ліпідів. У цих випадках кількість зарядженого ліпіду часто становить 1-20 % ваг./ваг., наприклад, 5-10 %. Співвідношення стерину до фосфоліпіду складає 1-50 % (мол./мол.), наприклад, 20-25 %. Такі композиції можуть містити MPL (3-деацилований монофосфорил ліпід А, що також є відомим як 3D-MPL). 3D-MPL є відомим з GB2220211 (Ribi) як суміш 3 типів 3-деацилованого монофосфорил ліпіду А з 4, 5 або 6 ацилованими ланцюгами, що виробляється Ribi Immunochem, Montana. В загальному випадку у композиціях згідно з винаходом можуть використовуватися маленькі частинки 3D-MPL, які мають розмір частинок, такий, що вони можуть проходити через фільтр 0,22 мкм. Такі препарати є описаними у WO 94/21292. Сапоніни, які утворюють частину згідно з даним винаходом, можуть бути відокремлені у формі міцел, змішаних міцел, (переважно, але не виключно з солями жовчних кислот) або можуть бути у формі ISCOM матриць (ЕР 0 109 942 В1), ліпосоми або споріднені колоїдні структури, такі, як червоподібні або кільцеподібні мультимерні комплекси, або ліпідні/шаруваті структури та ламели, коли рецептуються з холестерином та ліпідом, або у формі емульсії масло-у-воді (наприклад, як у WO 95/17210). Сапоніни бажано можуть бути асоційовані із солями металів, такими, як гідроокис алюмінію або фосфат алюмінію (WO 98/15287). Звичайно, сапоніни є представленими у формі ліпосоми, ISCOM або у формі емульсії масло-у-воді. Імуностимуляторні олігонуклеотиди або будь-які інші агоністи Toll-подібного рецептора (TLR) 9 можуть також використовуватися. Бажані олігонуклеотиди для застосування в ад'ювантах або вакцинах згідно з даним винаходом являють собою CpG-вмісні олігонуклеотиди, бажано такі, що містять два або більше динуклеотидних CpG фрагментів, відокремлених принаймні трьома, більш бажано принаймні шістьома або більше нуклеотидами. CpG фрагмент являє собою цитозиновий нуклеотид, після якого йде гуаніновий нуклеотид. CpG олігонуклеотиди згідно з даним винаходом являють собою типово дезоксинуклеотиди. У бажаному втіленні інтернуклеотид в олігонуклеотиді являє собою фосфородитіоат, або більше бажано фосфородитіоатний зв'язок, хоча фосфодіестер та інші інтернуклеотидні зв'язки також передбачаються в об'ємі даного винаходу. Також в об'єм даного винаходу включаються 15 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 олігонуклеотиди зі змішаними інтернуклеотидними зв'язками. Способи одержання фосфородитіоатних олігонуклеотидів або фосфородитіоату є описаними у US5,666,153, US5,278,302 та WO95/26204. Приклади бажаних олігонуклеотидів мають наступні послідовності. Послідовністі бажано містять фосфородитіоатний модифікований інтернуклеотидний зв'язок. ТСС ATG ACG TTC CTG ACG TT (CpG 1826) ТСТ ССС AGC GTG CGC CAT (CpG 1758) АСС GAT GAC GTC GCC GGT GAC GGC ACC ACG TCG TCG TTT TGT CGT TTT GTC GTT (CpG 2006) TCC ATG ACG TTC CTG ATG CT (CpG 1668) TCG ACG TTT TCG GCG CGC GCC G (CpG 5456) Ці послідовності можуть містити інтернуклеотидні зв'язки, модифіковані фосфоротіоатом. Альтернативні CpG олігонуклеотиди можуть включати бажані послідовності, приведені вище, в яких вони мають несуттєві делеції або доповнення. CpG олігонуклеотиди, що використовуються в даному винаході, можуть бути синтезовані у відповідності із будь-якими способами, відомими в області техніки (наприклад, див. ЕР 468520). Так, ці олігонуклеотиди можуть бути синтезовані при використанні автоматичного синтезатора. Приклади TLR 2 агоніста включають пептидоглікан або ліпопротеїн. Імідазохіноліни, такі, як іміквімод та резиквімод є відомими TLR7 агоністами. Одноланцюгова РНК є також відомим TLR агоністом (TLR8 у людей та TLR7 мишей), де одноланцюгова РНК та полі ІС (поліінозиноваполіцитидилова кислота - комерційний синтетичний міметик вірусної РНК) є прикладами TLR 3 агоністів. 3D-MPL є прикладом TLR4 агоніста, у той час, як CPG являє собою приклад TLR9 агоніста. Може бути включеним імуностимулятор, альтернативно або на доповнення. В одному втіленні цей імуностимулятор буде являти собою 3 деацилований монофосфорил ліпід А(3DМРL). Ад'ювантні комбінації включають 3D-MPL та QS21 (ЕР 0 671 948 ВІ), емульсії масло-у-воді, що включають 3D-MPL та QS21 (WO 95/17210, WO 98/56414), або 3D-MPL, рецептований з іншими носіями (ЕР 0 689 454 ВІ). Інші бажані ад'ювантні системи включають комбінацію 3DMPL, QS21 та a CpG олігонуклеотиду, як описано в US 6558670 та US 6544518. В одному аспекті ад'ювант включає 3D-MPL В одному аспекті ад'ювант включає QS21. В одному аспекті ад'ювант включає CpG. В одному аспекті ад'ювант включає QS21 та 3D-MPL. В одному аспекті ад'ювант включає QS21, 3D-MPL та CpG. В одному аспекті ад'ювант є рецептованим у вигляді емульсії масло-у-воді. В одному аспекті ад'ювант є рецептованим у вигляді ліпосоми. В одному втіленні даного винаходу забезпечується вакцина, що включає гібридний білок, як описано в даній заявці, такий, як CSV-S у комбінації з 3D-MPL та носієм. Типово носій буде представляти собою емульсію масло-у-воді або алюм. Зокрема, гібридний білок є присутнім у вигляді частинки або змішаної частинки, як описано в даній заявці. Білкові частинки даного винаходу можуть також бути інкапсульовані у мікрочастинки, такі, як ліпосоми. Вакцинні препарати є в загальному випадку є описаними у джерелі "Нові тенденції та удосконалення у галузі вакцин", під ред. Voller та ін., University Park Press, Baltimore, Maryland, U.S.A., 1978. Інкапсуляція у ліпосомах є описаною, наприклад, у Fullerton, патент США № 4,235,877. Кількість білкових частинок згідно з даним винаходом, що є присутньою у кожній вакцинній дозі, вибирають як кількість, яка індукує імунопротективну відповідь без значних, шкідливих побічних ефектів у типових вакцинах. Така кількість буде варіювати в залежності від специфічного імуногену, що використовується та від того, чи містить ця вакцина ад'ювант. В загальному випадку, передбачається, що кожна доза буде включати 1-1000 мкг білка, бажано 1200 мкг, найбільш бажано 10-100 мкг. Оптимальна кількість для конкретної вакцини може бути встановлена за допомогою стандартних досліджень, що втягують спостереження за титрами антитіла та інші відповіді у суб'єктів. Після цього суб'єкти будуть переважно одержувати бустерну імунізацію у період приблизно 4 тижні, а після цього повторюють бустерні імунізації настільки довго, скільки зберігається ризик інфекції. Імунна відповідь на білок згідно з цим винаходом поліпшується шляхом застосування ад'юванту та/або імуностимулятора. 16 UA 99711 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовувана кількість 3D MPL є в загальному випадку низькою, але в залежності від вакцинної композиції може складати 1-1000 мкг на дозу, наприклад, 1-500 мкг на дозу, та таку від 1 до 100 мкг на дозу (10, 20, 30, 40, 50, 60, 70, 80 або 90 мкг на дозу). Кількість CpG або імуностимуляторних олігонуклеотидів в ад'ювантах або вакцинах згідно з даним винаходом є в загальному випадку низькою, але в залежності від вакцинної композиції може складати -1000 мкг на дозу, наприклад, 1-500 мкг на дозу, та більш бажано від 1 до 100 мкг на дозу (10, 20, 30, 40, 50, 60, 70, 80 або 90 мкг на дозу). Кількість сапоніну для застосування в ад'ювантах згідно з даним винаходом може складати таку в інтервалі 1-1000 мкг на дозу, бажано 1-500 мкг на дозу, більш бажано 1-250 мкг на дозу, та найбільш бажано від 1 до 100 мкг на дозу (10, 20, 30, 40, 50, 60, 70, 80 або 90 мкг на дозу). У додатковому аспекті винахід представляє вакцинну комбінацію, яка забезпечує імунний захист проти малярії, спричиненої P. faciparum та/або P.vivax, яка включає гібридний білок, що походить від CS білка P. vivax, такого, як описано в даній заявці. В одному аспекті забезпечується вакцина, що включає імуногенні частинки, як описано в даній заявці, та необов'язкорво додатково включає імуногенні частинки TRS, S у суміші (як описано у WO 93/10152) та прийнятний імуностимуляторний ад'ювант. Композиції згідно з даним винаходом можуть використовуватися для лікування як з профілактичною, так і з терапевтичною метою. Згідно з винаходом забезпечується застосування будь-якого аспекту винаходу, описаного в даній заявці, для лікування, зокрема, вакцинної композиції, як описано в даній заявці, для застосування у медицині. Додатковий аспект даного винаходу полягає у забезпеченні способу одержання гібридного білка згідно з винаходом, де спосіб включає експресію нуклеотидної послідовності, що кодує білок, прийнятного хазяїна, переважно дріжджів, та одержання вичленення продукту. Винахід також охоплює способи одержання фармацевтичної композиції, такої, як вакцини, при використанні одного або більше аспектів, описаних в даній заявці. Додатковий аспект згідно з винаходом полягає у способі лікування пацієнта, чутливого до інфекції Plasmodium шляхом введення ефективної кількості вакцини, як описано в даній заявці вище. Вакцина включає парентеральну вакцину. Таким чином, винахід охоплює застосування антигенів, таких, як гібридні злиті білки та/або ліпопротеїнових частинок згідно з винаходом та композиції, що їх включають, для застосування у виробництві лікарського засобу для лікування/запобігання малярії, такої, як малярія, що спричинена P. vivax та/або P. falciparum. Білки та/або вірусні вектори, що їх кодують, можуть вводитися у режимах примуваннябустингу, як зокрема, описано у WO 2004/037189. У контексті даного опису термін "такий, що включає" інтерпретується як такий, що містить. Аспекти винаходу, що включають певний елемент, також призначені для охоплення вказаних аспектів або суттєво складаються з релевантних елементів. ПРИКЛАДИ Приклад 1 Опис штаму Y1834 Дріжджовий рекомбінантний штам Y1834 можу використовуватися для експресії злитого білка. Він складається із хазяйського штаму Saccharomyces cerevisiae DC5, трансформованого рекомбінантним експресійним вектором pRIT15546. DC5 являє собою лабораторний штам дріжджів (АТСС No: 20820) з наступним генотипом: leu2-3, Ieu2-112, his3, can1-11. Подвійна leu-2 мутація дозволяє проводити селекцію на введення та підтримання вектора pRIT15546, що несе функціональну копію гена LEU-2. Тільки ті клітини, що несуть вектор з LEU-2 геном, можуть рости при відсутності лейцину у ростовому середовищі. Вектор pRIT15546 є дріжджовим епісомальним експресійним вектором (вектор на основі 2), що несе експресійну касету. Рекомбінантна експресія направляється промотором, що походить від дріжджового гена TDH3 (конститутивна експресія). Конструювання вектора pRIT15546 детально приведене нижче. Конструювання вектора pRIT15546. Синтетичний ген CSV із прийнятною переважністю кодонів для дріжджової експресії конструювали та субклонували у вектор pUC57. Одержану плазміду pUC57/CSV та дріжджовий експресійний вектор pGf1-S2 піддавали рестрикції при використанні прийнятних ферментів. Вектор pGf1-S2 конструювали (у GSK) при використанні багатоетапної процедури клонування. Цей вектор, який вже несе S експресійну касету, дозволяє проводити конструювання злитих 17 UA 99711 C2 5 10 15 20 25 30 35 40 генів, таке, як N-термінальне злиття у рамці з геном S вірусу гепатиту В. Заключний експресійний вектор після перевірки послідовності мав назву pRIT15546 (Фіг. 3) Трансформація штаму DC5. Leu- та his-ауксотрофний DC5 штам піддавали трансформації рекомбінантною плазмідою pRIT15546 при використанні стандартного пропису для трансформації дріжджів. Трансформовані клітини висаджували на агарові селективні планшети. Відбирали один трансформант, який одержував офіційну назву Y1834. Експресія рекомбінантного білка: Y1834 вирощували при 30 °C у середовищі YNB (дріжджове з доданням азотистої основи, яке одержують від Kracker Scientific Inc) мінімальному середовищі, доповненому 8 мкг/мл гістидину до оптичної густини (620 нм) 0,5. Потім клітини збирали та одержували клітинні екстракти Приготування екстракту: Клітини ресуспендували у буфері для диспергування та піддавали механічному руйнуванню (скляні кульки). Екстракт центрифугували протягом 15 хвилин при 5000 об./хв. Супернатантну фракцію розганяли на 4-20 % SDS - поліакриламідному гелі. Буфер для диспергування: буфер на основі 50 мМ фосфату Na (pH:7,5) 4 мМ EDTA Твін-20 0,5 % + суміш інгібіторів протеаз (повна/ ROCHE) Концентрація клітин: 100 мл культури (оптична густина (OD): 0,5) у 5 мл диспергувального буфера = концентрація 10 OD одиниць/мл. Освітлення сирового екстракту: екстракт центрифугували протягом 15 хвилин при 5000 об./хв. Визначення рекомбінантного білка Освітлені екстракти розганяли на 4-20 % SDS-поліакриламідному гелі, білки переносили на нітроцелюлозну мембрану та піддавали імунозабарвлюванню. Вестерн-блотінг аналіз: Реагент = Мишаче моноклональне антитіло анти-S (одержане GSK Biologicals) - (розведення: 1/500) Анти-S антитіла, які є комерційно доступними, можуть замінювати ті, що використовуються у цьому способі. Альтернативно, можуть використовуватися анти-CSV антитіла, наприклад, ті, що є відомими як MR4, доступні від NIH. CSV-S злитий білок MB теоретична: 51794 Дальтон MB одержана: 55 кДа Приклад 2: Опис штаму Y1840 Штам Pichia pastoris Y1840 експресує CSV-S злитий білок. Штам Y1840 містить чотири копії CSV-S злитого гену, інтегровані у геном. Для одержання штаму, що експресує CSV-S злитий білок, штам Pichia pastoris GS115 піддавали трансформації за допомогою фрагменту інтегративної лінійної ДНК, що несе CSV-S касету та функціональний HIS4 ген. GS115 являє собою лабораторний штам дріжджів (АТСС No: 20864) з наступним генотипом: his4. His4 мутація дозволяє проводити селекцію на введення фрагменту лінійної ДНК, що походить від вектора pRIT15607, що несе CSV-S касету та функціональний HIS4 ген. Вектор pRIT15607 являє собою інтегративний експресійний вектор Pichia pastoris, CSV-S експресійну касету. Рекомбінантна експресія направляється сильним, жорстко регульованим промотором АОХ1, що індукується метанолом. Конструювання вектора pRIT15607 детально представлене нижче. Конструювання вектора pRIT15607. CSV-S злитий ген, що є присутнім в pRIT15546, піддавали ампліфікації за допомогою ПЛР та клонували у проміжний вектор pGEM-T Easy (Promega, кат. номер # А1360). після перевірки послідовності рекомбінантну плазміду перетравлювали за допомогою прийнятних рестрикційних ферментів та клонували в інтегративний вектор pHIL-D2 Pichia pastoris. Заключний експресійний вектор після перевірки послідовності одержував назву pRIT15607 (Фіг. 5). CSV-S злитий білок, що кодується pRIT15607 плазмідою майже повністю є ідентичним послідовності в деталях приведеній у SEQ ID No. 17, за винятком того, що метіонін 2 є замінений валіном (див. SEQ. ID. No. 19 та SEQ. ID No. 20). Перетравлювання pRIT15607 при використанні Notl ендонуклеази 18 UA 99711 C2 5 10 15 20 25 30 35 40 вивільняло лінійний фрагмент розміром 6816 п.о., який може бути інтегрованим у геном дріжджів шляхом гомологічної рекомбінації у резидентному АОХ1 локусі. Трансформація штаму GS115. GS115 хазяйський штам піддавали трансформації рекомбінантною плазмідою pRIT15607. Перед трансформацією інтегративний вектор піддавали рестрикції за допомогою Notl для того, щоб вивільнити лінійний фрагмент ДНК, що несе експресійну касету та HIS4 селективний маркер. Notl рестрикція буде сприяти інтеграції в локусі АОХ1. Трансформовані клітини висаджували на планшети із селективним агаризованим середовищем. Мультикопійні клони інтегрантів піддавали селекції за допомогою дот-блот аналізу. Відібрані клони мали найвищу кількість копій інтегрованих CSV-S експресійних касет, один з них, що демонстрував найвищий рівень експресії для CSV-S рекомбінантного білка, відбирали та давали офіційне позначення Y1840. Цей клон ніс чотири копії CSV-S злитого гену. Експресія рекомбінантного білка: Y1840 вирощували при 30 °C у середовищі YNB (дріжджове з доданням азотистої основи, яке одержують від Kracker Scientific Inc) мінімальному середовищі, доповненому 1 % гліцерином як джерелом вуглецю, до оптичної густини (620 нм) приблизно 0,5. Потім клітини збирали та ресуспендували у такому самому об'ємі YNB середовища, доповненого 1 % метанолом як джерелом вуглецю (як індуктор) та інкубували при 30 °C протягом приблизно 16 годин. Приготування екстракту: Індуковані метанолом клітини центрифугували, клітинні осади ресуспендували у буфері для диспергування та піддавали механічному руйнуванню (скляні кульки або на Френч-пресі). Екстракт центрифугували протягом 5-10 хвилин при 5000 об./хв. Супернатантну фракцію розганяли на 12,5 % SDS - поліакриламідному гелі. Буфер для диспергування: 60 мМ Na2HPO4 40 мМ NaH2PO4 1 мМ MgSO4 10 мМ KСІ Твін-20 0,5 % 2 мМ PMSF Концентрація клітин: 100 мл культури (оптична густина (OD): 0,5) у 2,5 мл диспергувального буфера = концентрація 20 OD одиниць/мл. Освітлення сирового екстракту: екстракт центрифугували протягом 5-10 хвилин при 5000 об./хв. Визначення рекомбінантного білка Освітлені екстракти розганяли на 12,5 % SDS-PAGE гелі, білки переносили на нітроцелюлозну мембрану та піддавали імунозабарвлюванню. Див. Фігуру 6. Вестерн-блотінг аналіз: Реагент = Мишаче моноклональне антитіло анти-S (одержане GSK Biologicals) - (розведення: 1/250) Анти-S антитіла, які є комерційно доступними, можуть замінювати ті, що використовуються у цьому способі. Альтернативно, можуть використовуватися анти-CSV антитіла, наприклад, ті, що є відомими як MR4, доступні від NIH. CSV-S злитий білок MB теоретична: 51762 Дальтон MB одержана: 55 кДа Приклад 3 Опис штаму Y1835 Дріжджовий рекомбінантний штам Y1835 одночасно експресував CSV-S злитий білок та S антиген. Для одержання штаму, що сумісно експресує CSV-S та S білки, штам Y1295, Saccharomyces cerevisiae, який вже несе п'ять інтегрованих копій S експресійних касет, піддавали трансформації за допомогою рекомбінантного інтегративного експресійного вектора pRIT15582. Штам Y1295 конструювали на GSK шляхом багатоетапної процедури трансформації. Конструювання штаму Y1295 є описаним у WO 93/10152. Штам Y1295 має наступний генотип: leu2-3, Ieu2-112, gal1. Leu-2 мутація дозволяє проводити селекцію на поглинання лінійного фрагменту ДНК, що походить від pRIT15582, що несе CSV-S касету та функціональний ген LEU2. Вектор pRIT15582 являє собою інтегративний дріжджовий вектор (Ту-вектор), що несе CSVS експресійну касету. Рекомбінантна експресія направляється промотором, що походить від 19 UA 99711 C2 5 10 15 20 25 30 35 40 45 дріжджового гена TDH3 (конститутивна експресія). Конструювання вектора pRIT15582 у деталях приведене нижче. Конструювання pRIT15582 інтегративного вектора. Вихідний матеріал, який використовувася для конструювання вектора pRIT15582, являв собою експресійну плазміду pRIT15546 (Фіг. 1). Конструювання цієї плазміди є описаним у Прикладі 1. Перетравлювання pRIT15546 за допомогою HindIII ендонуклеази вивільняє ДНК фрагмент довжиною 3706 п.о., що відповідає повній експресійній касеті CSV-S (pTDH3+CSVS+tARG3). Цей Hindlll ДНК фрагмент (після заповнення при використанні Т4 ДНК полімерази) вбудовували у Ту-інтегративний вектор pRIT13144 в унікальному SaIl сайті клонування (такий, що піддавали рестрикції за допомогою Sall I оброблений Т4). Одержана плазміда pRIT15582 містила на доповнення до експресійної касети дріжджовий ген LEU2 як селективний маркер (Фіг. 3). Перетравлювання pRIT15582 за допомогою Xhol ендонуклеази вивільняло лінійний фрагмент довжиною 8500 п.о., показаний на Фігурі 4, що може бути інтегрований у дріжджовий геном шляхом гомологічної рекомбінації вільних кінців за допомогою резидентних Ту-елементів. Трансформація штаму Y1295. Для одержання штаму, що експресує як S, так CSV-S білки, штам Y1295 піддавали трансформації за допомогою лінійного Xhol фрагменту довжиною 8500 п.о. (Фіг. 4) із селекцією на Leu+ колонії. Одержували декілька інтегрантів, що містять набори обох експресійних касет, що є присутніми у геномі при різних співвідношеннях. Один трансформант, який несе чотири копії CSV-S касет відбирали та давали офіційне позначення Y1835. Експресія рекомбінантного білка: Y1835 вирощували при 30 °C у середовищі YNB (дріжджове з азотистою основою, яке одержують від Kracker Scientific Inc.) мінімальному середовищі до оптичної густини (620 нм) приблизно 0,5 (0,8). Потім клітини збирали та одержували клітинні екстракти. Аналіз експресії продуктів за допомогою імуноблотінгу Приготування екстракту: Клітини ресуспендували у буфері для диспергування та піддавали механічному руйнуванню (склянікульки). Екстракт центрифугували протягом 5-10 хвилин при 5000 об./хв. Супернатантну фракцію розганяли на 12,5 %.SDS - поліакриламідному гелі Буфер для диспергування: 50 мМ фосфату Na (pH: 7,5) 4 мМ EDTA Твін-20 0,5 % + суміш інгібіторів протеаз (Повна/ ROCHE) Концентрація клітин: 100 мл культури (оптична густина (OD): 0,5) у 2,5 мл диспергувального буфера = концентрація 20 OD одиниць/мл. Освітлення сирового екстракту: екстракт центрифугували протягом 5-10 хвилин при 5000 об./хв. Визначення рекомбінантного білка Освітлені екстракти розганяли на 12,5 % SDS-поліакриламідному гелі, білки переносили на нітроцелюлозну мембрану та піддавали імунозабарвлюванню. Вестерн-блотінг аналіз (Фіг: 10) Реагенти 1/ Мишаче моноклональне антитіло анти-S (одержане GSK Biologicals)- (розведення: 1/250) 2/ Кроляче поліклональне антитіло анти-CSV (люб'язно надане WRAIR) - розведення 1/20000 Посилання (1) Harford N, Cabezon T, Colau В, та ін., "Construction and Characterization of a Saccharomyces cerevisiae Strain (RIT4376) Expressing Hepatitis В Surface Antigen", Postgrad Med J 63, Supp. 2: 65-70, 1987. (2) Jacobs E, Rutgers T, Voet P, та ін., "Simultaneous Synthesis and Assembly of Various Hepatitis В Surface Proteins in Saccharomyces cerevisiae", Gene 80: 279-291, 1989. (3) Vieira J and Messing J, "The pUC plasmids, an M13mp7-Derived System for Insertion Mutagenesis and Sequencing with Synthetic Universal Primers", *_Gene 19: 259-268, 1982. (4) Hinnen A, Hicks JB, and Fink GR, "Transformation of Yeast", Proc Natl Acad Sci USA 75: 1929-1933, 1980. (5) Broach JR, Strathem JN, and Hicks JB, "Transformation in Yeast Development of a Hybrid Cloning Vector and Isolation of the CAN 1 Gene", Gene 8: 121-133, 1979. (6) Zhang H, та ін., "Double Stranded SDNA Sequencing as a Choice for DNA Sequencing", Nucleic Acids Research 16: 1220, 1988. 20 UA 99711 C2 5 10 (7) Dame JB, Williams JL. Me Cutchan TF, та ін., "Structure of the Gene Encoding the Immunodominant Surface Antigen on the Sporozoites of the Human Malaria Parasite Plasmodium falciparum", Science 225: 593-599, 1984. (8) Valenzuela P, Gray P, Quiroga M, та ін., "Nucleotide Sequences of the Gene Coding for the Major Protein of Hepatitis В Virus Surface Antigen", Nature 280: 815-819, 1979. (9) In SS, Kee-Hoyung L, Young RK, та ін., "Comparison of Immunological Responses to Various Types of Circumsporozoite Proteins of Plasmodium vivax in Malaria Patients of Korea", Microbiol. Immunol. 48(2): 119-123, 2004; Microbiol. Immunol. 2004; 48(2): 119-123. (10) Rathore D, Sacci JB, de la Vega P, та ін., "Binding and Invasion of Liver Cells by Plasmodium falciparum Sporozoites", J. Biol. Chem. 277(9): 7092-7098, 2002. Rathore та ін., 2002, J. Biol. Chem. 277, 7092-8. 21 UA 99711 C2 22 UA 99711 C2 23 UA 99711 C2 24 UA 99711 C2 25 UA 99711 C2 26 UA 99711 C2 27 UA 99711 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюVaccines for malaria
Автори англійськоюCohen Joseph D, Marchand Martine, Ockenhouse Christian F, Yadava Anjali
Назва патенту російськоюМалярийная вакцина
Автори російськоюКоэн Джозеф Д., Маршан Мартин, Оукенгаус Кристиан Ф., Ядава Анджали
МПК / Мітки
МПК: A61K 39/015, A61P 33/06
Код посилання
<a href="https://ua.patents.su/49-99711-malyarijjna-vakcina.html" target="_blank" rel="follow" title="База патентів України">Малярійна вакцина</a>
Попередній патент: Пігмент на основі діоксиду титану і спосіб його одержання
Наступний патент: Спосіб роботи двигуна і двигун внутрішнього згоряння (варіанти)
Випадковий патент: Спосіб кріоконсервування соматичних клітин