Спосіб одержання оптично активного (+)-4-деметоксидауноміцинону
Номер патенту: 19151
Опубліковано: 25.12.1997
Автори: Сільвія де Бернардініс, Тіціано Мартіненго, Франко Франкаланчі, Уолтер Кабрі
Формула / Реферат
Способ получения оптически активного (+)-4-деметоксидауномицинона формулы I
с использованием взаимодействия кетона с этиленгликолем в бензоле при температуре кипения в присутствии п-толуолсульфокислоты и удаления аминозащитной группы путем обработки трифторуксусной группы путем обработки трифторуксусной кислотой, отличающийся тем, что, в качестве кетона используют (+)-4-диметилдауномицинонформулы II
суспендированный в бензоле, который подвергают взаимодействию с этиленгликолем с получением 4-деметил-13-диоксоланилдауномицинонаформулы III
которой обрабатывают n-толуолсульфонилхлоридом при комнатной температуре в среде пиридина в присутствии Ν,Ν-диизопропилэтиламина и каталитического количества диметиламинопиридина с образованием 4-деметил-4-n-толуолсульфонил-13-диоксоланилдауномицинона формулы IV
который подвергают взаимодействию с n-метоксибензиламином при 35°С в течение 16 часов с образованием 4-деметил-4-n-метоксибензоламино-13-диоксоланилдауномицинона формулы V
удаляют аминозащитную группу путем обработки трифторуксусной кислотой при комнатной температуре в течение 3 часов, образующийся 4-деметокси-4-аминодауномицинон формулы VI
подвергают диазотированию при 0°С водным раствором нитрата натрия и полученное диазопроизводное формулы VII
восстанавливают путем обработки водным 50%-ным раствором гипофосфорной кислоты при комнатной температуре в течение часа с получением целевого продукта.
Текст
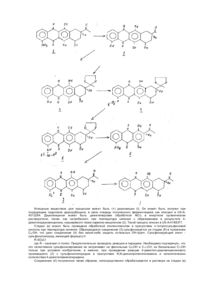
Настоящее изобретение относится к процессу получения 4-деметоксидауномицинона. Синтез гликозида -деметоксидаунорубицина описан в патенте США 4 046 878 заявителя настоящей заявки (6 сентября 1987 года; в качестве исходного материала использовалось промежуточное соединение, рацемический (±)-4-деметоксидауномицион, полученный по способу, описанному в [1]. Совершенно иной подход получения указанного промежуточного агликона был реализован позже тем же заявителем и описан им в [2]. По этому последнему способу вначале получают 1,4-диметокси-6-окси-6-ацетил-тетралин, после чего осуществляют оптическое разделение, конденсацию (-)-энантиомера с фталевым ангидридом и стереоселективное введение ОН-группы в 7-положение. Оба указанных способа имеют однако ряд недостатков: оба они проводятся в несколько стадий, что приводит к снижению общего выхода; целевой агликон, 4-деметоксидауномицинон, в случае первого способа получается в виде рацемической смеси, а в случае второго - в виде смеси (7S) и (7R)-эпимеров, которые и в том, и в др угом случае должны быть разделены. Исходя из вышесказанного следует, что усовершенствование заявляемого в данной заявке способа должно включать следующие шаги; использование в качестве исходного материала оптически активного соединения; поддержание оптической чистоты в ходе всего синтеза; отказ от использования при осуществлении синтеза вредных химикатов; уменьшения количества стадий для получения целевого соединения с высоким выходом. И заявляемый способ, и способ в соответствии с прототипом имеют, разумеется, несколько общих стадий, которыми, в частности, являются катализация для защиты 13-кето-группы с помощью этиленгликоля с образованием в результате 13-диоксоланилового производного и последующее удаление указанной защитной группы с помощью трифторуксусной кислоты. Эти общие признаки однако практически никак не сказываются на простоте заявляемого способа, гладкости протекания синтеза и общем выходе получаемого продукта. В результате выход целевого оптически активного (+)-4-деметоксидауномицинона, получаемого по способу в соответствии с настоящей заявкой, составляет 11,5% в расчете на исходный природный дауномицинон. Согласно настоящему изобретению обеспечен процесс получения 4-деметокси-дауномецинона, формула (I): который включает: (а) защиту 13-кетогруппы 4-деметил-дауномицинона, имеющего формулу (2): обработкой этиленгликолем; (б) проведение реакции образовавшегося формулу (3) 4-деметил-13-диоксоланил-дауномицинона. имеющего с сульфонилхлоридом, имеющим формулу II: R-SO2Cl где R представляет собой - толил, в присутствии N,N-диизопропилэтиламина и каталитических количеств 4-диметил-амино-пиридина; (в) в проведении реакции образовавшегося сульфонированного 4-деметил-13-ди-оксоланилдауномицинона, имеющего формулу (4): в которой R имеет вышеуказанное определение, с амином, имеющим формулу III: R1-CH2-NH2 где R1 означает n-метоксифенил; (г) удаление группы, защищающей аминогруппу, из образовавшегося 4-деметил-4(защищенная амино)13-диоксоланил-дауномицинона, имеющего формулу (5) где R имеет вышеуказанное определение; (д) диазотирование 4-аминогруппы образовавшегося 4-деметокси-4-амино-дауномицинона, имеющего формулу (6): (е) восстановление образовавшегося диазопроизводного. имеющего формулу (7): в мягких условиях, с образованием в результате 4-деметокси-дауномицинона, имеющего формулу I. 4-деметил-дауномицинон, имеющий формулу (2), может быть получен деметилированием дауномицинона, имеющего формулу (I) Таким образом, возможно обеспечить процесс с использованием в качестве исходного соединения природного (+) дауномицинона, который более эффективен и требует меньше стадий, чем полный химический синтез. Более того, процесс не требует ни стадий оптического разделения, ни стадий химической очистки. Промежуточные соединения, имеющие формулы от (3) до (5) - новые и включены в изобретение. Настоящий процесс проиллюстрирован следующей схемой реакций (схема I): Исходным веществом для процессов может быть (+) дауномицин (I). Он может быть получен при подходящем гидролизе даунорубицина, в свою очередь полученного ферментацией, как описано в US-A4012284. Дауномицинон может быть деметилирован обработкой АІСІ3 в инертном органическом растворителе, таком, как нитробензол, при температуре кипения с образованием в результате 4деметилдауномицинона, называемого также кармино-мициноном (2). Такой процесс описан в US-A-4188377. Стадия (а) может быть проведена обработкой этиленгликолом в присутствии n-толуолсульфоновой кислоты при температуре кипения. Образующееся соединение (3) сульфонируется на стадии (б) в положении С4-ОН, что дает соединение (4) без какой-либо защиты остальных ОН-групп. Сульфонирующий агент сульфонилхлорид, имеющий формулу II: R-SO2CI где R - означает n-толил. Предпочтительно проводить реакцию в пиридине. Необходимо подчеркнуть, что это селективное сульфонилирование не затрагивает ни фенольные С 6-ОН и С11-СН, ни бензильные С7-ОН только при условиях изобретения, а именно, при проведении реакции 4-деметил-дауномицинонового производного (3) с сульфонилхлоридом в присутствии Ν,Ν-диизопропилэтиламина и каталитических количествах 4-диметиламинопиридина. Соединение (4) полученное таким образом, непосредственно обрабатывается в растворе на стадии (в) подходящим амином, имеющим формулу III: R1-CH2-NH2 где R1 означает n-метоксифенил. Защищенный амин, имеющий формулу (5), может быть обработан на стадии (г) трифторуксусной кислотой, например, 3 часа при комнатной температуре, с целью освобождения 4-аминопроизводного (6), Диазотирование на следующей стадии (д) может быть проведено с использованием нитрита натрия, например, с использованием водного раствора нитрита натрия при 0-5°С. Т.о., кислотный раствор после стадии (г), к которому добавлены вода и этиленхлорид, может быть обработан нитритом натрия для получения соли диазония (7), которая может быть экстрагирована в водной фазе. Обработка водного раствора гипофосфорной кислотой, например, 50% гипофосфорной кислотой, дает на стадии (е) желаемый 4деметокси-дауномицинон (I) высокой оптической и химической чистоты. 4-деметокси-дауномицинон является агликоновой частью полезного антиопухолевого лекарства 4деметокси-даунорубицина. Пример 1. 4-деметил-дауномицинон (2). К раствору 15,04 г (37,8 ммоль) дауномицинона (I) в 1,4 л метиленхлорида при помешивании в атмосфере азота добавляли 52,8 г (396,4 ммоль) безводного хлорида алюминия порциями в течение 1,5 часа. Реакционную смесь в течение часа кипятили с обратным холодильником в течение часа, затем отгоняли растворитель. К остатку осторожно добавляли раствор 22,8 г (25,4 ммоль) щавелевой кислоты в 200 мл воды, охлажденной до 0°С, и смесь перемешивали 2 часа при комнатной температуре. Твердую фаз у отделяли фильтрованием и промывали водой. Этот продукт не очищался дальше и продемонстрировал 83% чистоту по данным анализа на ВЗЖХ. Анализ с помощью ВЗЖХ: колонка: Merck Rp 18(7) мкм (250x4,2 мм), подвижная фаза: градиент: от 20% б до 70% б в течение 25 минут, скорость: 1,5 мл/мин, детектор: УФ при 254 нм. ТСХ на пластине кизельгеля F 254 (Merck) с использованием хлороформ-ацетона (8:2 по объему) Rf=0,58. Пример 2. 4-деметил-13-диоксоланил-дауномицинон (3). К суспензии сырого 4-деметилдауноми-цинона, полученного по способу, описанному в примере 1, в бензоле (400 мл), добавляли 30 мл этиленгликоля и 0,3 г n-толуолсульфокислоты. Реакционную смесь кипятили в течение примерно 6 часов при азеотропном удалении воды. После охлаждения до комнатной температуры твердую фаз у отделяли путем фильтрования и промывали ее водой и этанолом, получая после высушивания 11,3 г соединения формулы (3) (ВЭЖХ: 98,3%, условия такие же, как и в примере І). Общий выход в расчете на соединение формулы (I) 70%. 1 H-ЯМР 300 мГц (в СDСІ3): d= 1,42 (3Н. с), 1,94 (1Н, дд), 2,42 (1Н,дт), 2,75 (1Н,д), 3,18 (1Н, дд), 4,04 (4Н, с), 5.20 (1.Н. дд). 7,25 (1Н, д), 7,65 (1Н,т), 7,84(1Н,д), 12,18(1Н.с), 12,92 (1Н,с), 13,52 (1Н, с). Масс-спектроскопия: m/z=428 (М+, основной пик) тонкослойная хроматография на силикагелевых пластинах F 254 (Merck) с использованием смеси хлороформа и ацетона в объемном соотношении 8:2:R f=0,52. Пример 3. 4-деметил-4-n-толуолсульфонил-3-диоксоланил-дауномицинон (4). К суспензии 11,3 г (26,4 ммоля) соединения формулы (3), 22,6 мл (132 ммоля) диизопропилэтиламина и 0,65 г (5,3 ммоля) 4-диметиламинопиридина в пиридине (330 мл) в течение 5 минут добавляли по каплям раствор 5,54 г (29 ммолей) n-толуолсульфонилхлорида в 25 мл пиридина. После перемешивания в течение 15 минут при комнатной температуре реакция заканчивалась. Сырой продукт, содержащий 10,46 г. (68%), использовали на следующей стадии. 1 Н-ЯМР 300 МГц (в CDCl3): d=1,45 (3Н, с), 1,92 (1Н, дд), 2,18 (1Н, с), 2,40 (3Н, с), 2.34-2,52 (1Н, м), 2,70 (1H, д), 3,15 (1Н, дд), 4,06 (4Н,м), 5,18(1 Н,д), 7,28(2Н,д). 7,53(1Н, д), 7,74 (1Н,т), 7,82 (2Н,д), 8,28(1 Н.д), 13,15 (1Н, с). 13,48 (1Н, с). Масс-спектроскопия: m/z= 582 (М+, основной пик). Тонкослойная хроматография на силикагелевой пластине F 254 (Merck) с использованием смеси хлороформа и ацетона в объемном соотношении 8;2:Rf=0,62. Пример 4. 4-деметил-4-n-метоксибензиламино-13-диоксоланил-дауномицинон (5). К раствору, полученному в примере 3, температура которого поддерживалась равной 35°С, добавляли 101 мл (792 ммоля) n-метоксибензиламина. Реакционную смесь перемешивали при 35°С в течение 16 часов, после чего охлаждали ее до 0°С и добавляли 4 л метиленхлорида и 2 л 10%-ной соляной кислоты. После разделения органическую фазу промывали водой, насыщенным раствором NaНСО3 и снова водой. Раствор высушивали над сульфатом натрия и растворитель отгоняли при пониженном давлении. Остаток в количестве 10,0 г, содержащий 4,91 г (выход 50%) целевого продукта, использовали на следующей стадии. 1 Н-ЯМР 300 МГц (в СDСІз): d =1,50 (3Н, с), 1,95(1 Н, дд), 2,45(1Н. дт), 2,78(1 Н.д), 3,20 (1Н. шир.с.), 3,23 (1Н, дд), 3,80 (1H, шир.с), 3,84 (3Н, с), 4,08 (4Н, с), 4,53 (2Н, д), 5,24(1Н, шир.с), 6,93 (2Н, д). 7,03 (1Н, д), 7,31 (2М, д), 7,48 (1Н, т), 7,63 (1Н, дд), 9,80 (1H, т), 13,47 (1Н, с, 13,72 (1Н, с). Тонкослойная хроматографии на сили-кагелевой пластине F 254 (Merck) с использованием смеси хлороформа и ацетона при объемном соотношении 8:2:Rf=0,70. Масс-спектрометрия: m/z=547 (М+. основной пик). Пример 5. Сырой продукт, полученный как это описано в примере 4, растворяли в 100 мл трифтор уксусной кислоты и перемешивали в раствор в течение 3 часов при комнатной температуре. Реакционную смесь после нейтрализации подвергали очистке с помощью колоночной хроматографии, получая в результате 2,06 г (вы ход 60%) соединения формулы (6). 1 Н-ЯМР 300 мГц (CDCI3): d =2,14 (дд, J=4,8,15 Гц, 1 Η, 8 а х.Н), 2,35 (ддд. J=2,0,2,0, 15,0 Гц, 1Н, 8 а х. Η), 2,45(с, 3Н, СОСН3), 2,92 (д, J=19 Гц, 1Н, 10 ах. Н), 3,17 (дд, J=2.0, 19,0 Гц, 1Н, 10 е.Н). 3,74 (д, J=4,8 Гц, 1Н, 7ОН), 4,54 (с, 1Н, 9-ОН), 5,32 (ддд, J=2,0, 4,8, 4,8, Гц, 1Н, 7-М), 6,80 (широкая. 2Н, 4-NH 2), 6,93 (д, J=8,0 Гц, 1H, 3-Н), 7,46 (т, J=8.0 Гц, 1H, 2-Н), 7,46 (д, J=8,0 Гц, 1H, 1-Н), 13,52 (с, 1H, 11-ОН), 14,00 (С, 1Н. 6-ОН). Масс-спектрометрия: m/z=383 (М+, основной пик). · Тонкослойная хроматография на силикагелевой пластине F254 (Merck) с использованием смеси хлороформа и ацетона в объемном соотношении 8;2:Rf=0,50. К раствору соединения формулы (6) в трифторуксусной кислоте добавляли 2 л метиленхлорида и 700 мл воды, а затем, после охлаждения до 0°С, 0,93 г (13,5 ммоля) нитрита натрия. После перемешивания в течение 10 минут водн ую фазу отделяли, промывали ее 100 мл метиленхлорида и добавляли к ней 300 мл 30%-ной гипофосфорной кислоты и 300 мл метиленхлорида. Реакционную смесь перемешивали в течение часа при комнатной температуре и разделяли фазы. Органическую фазу промывали водой, насыщенным раствором NaНСО3 и снова водой, высушивали над сульфатом натрия и растворитель отгоняли в вакууме, получая в результате 1,61 г (4,37 ммоля), 49% 4-деметоксидауномицинона (1) (ВЭЖХ 92%). Общий вы ход в расчете на дауномицинон 11,5%. 1 H-ЯМР 300 мГц (CDCI3): d=2,19 (дд, J=4,8, 14,5 Гц, 1H, 8 ах.Н), 2,37 (ддд, J=2,0, 2,0, 14,5 Гц, 1Н, 8 eq. Η), 2,43 (с, 3н, СОСН3), 2.95(д, J=18,6, 1H, 10 ах, Н), 3,20 (дд, J=2,0, 18,6 Гц, 1H, 10 eq. Η), 3,83 (д., J=4,8 Гц, 1H, 7ОН), 4,55 (с, 1H, 9-ОН), 5,32 (ддд, J=2,0,4,8, 4,8 Гц, 1H, 7-Н), 7,84-7,86 (м, 2Н, 2,3-Н), 8,33-8,36 (м, 2Н, 1,4-Н), 13,30 (с, 1H, 6-ОН), 13,60 (с, 1Н, 11-ОН). УФ-Спектр (в EtOH): l = 208, 252, 257, 285. 480, 500, 514 нм., lmax=252 нм. ИК-спектр (КВr) n=3450, 1715, 1625, 1585 см-1. [a]D20 (С=0,1 в диоксане) =+156°. Масс-спектрометрия: m/z=368 (М+, основной пик). Тонкослойная хроматография на силикагелевой пластине F254 (Merck) с использованием смеси хлороформа и ацетона в объемном соотношении 8:2;Rf=0,70.
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for preparation of optically active (+)-4- demethoxydaunomicinon
Назва патенту російськоюСпособ получения оптически активного (+)-4-деметоксидауномицинона
МПК / Мітки
МПК: C07C 50/00, C07C 46/00
Мітки: активного, спосіб, одержання, +)-4-деметоксидауноміцинону, оптично
Код посилання
<a href="https://ua.patents.su/5-19151-sposib-oderzhannya-optichno-aktivnogo-4-demetoksidaunomicinonu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання оптично активного (+)-4-деметоксидауноміцинону</a>
Попередній патент: Спосіб одержання оптично активного (+)-4-деметоксидауноміцинону
Наступний патент: Спосіб боротьби з фітопатогенними грибами класу ооміцетів
Випадковий патент: Засіб для прискорення достигання томатів у формі водорозчинного концентрату