Фторовмісні сполуки піразолінового ряду як люмінофори жовто-зеленого світіння
Номер патенту: 61385
Опубліковано: 15.06.2006
Автори: Шершуков Віктор Михайлович, Скрипкина Валентина Тихонівна
Формула / Реферат
Нові фторвміщуючі сполуки піразолінового ряду загальної формули:
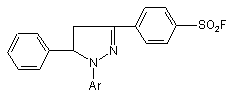 , (I)
, (I)
де Аr = -C6H4COOAlk, Alk = С1-C8;
С6Н4СОХ, де Х = Н, ОН;
С6Н4С4Н9; 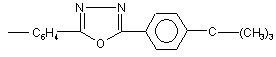 ;
;
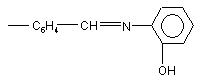 ;
; 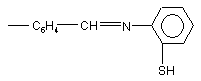 ;
;
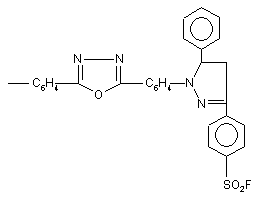
в якості люмінофорі жовто-зеленого світіння.
Текст
Нові фторвміщуючі сполуки піразолінового ряду загальної формули: SO2F (13) SO2F N O C6 H4 N N SO2F де Аr - С6Н4СООAlk, Alk - С1-С8; - С6Н4СОХ, де X=Η, ОН; N С6Н4С4Н9; СH N І N Ar C6H4 N C6 H4 (11) Винахід відноситься до області органічної хімії, зокрема, до розробки нових фторпохідних сполук піразолінового ряду загальної формули: 61385 , (I) C6H4 N C O C6H4 N OH ; СH (CH3)3 ; N SH ; Запропоновані сполуки інтенсивно люмінесциюють у жовто-зеленій області спектру з високим квантовим виходом (=0,6) і високим коефіцієнтом молярного поглинання 53100. В залежності від будови радикалу (Аr) спектр люмінесценції їх змінюється від 408 до 525нм. Сполуки добре розчинні в органічних розчинниках і полімерних матрицях, мають гарну світлостійкість. Наявність у структурі сполук, які заявляються, реакційно-здатних центрів (наприклад: SO2F, СОН, UA Ar (19) N N 3 61385 4 2 СООН) дозволяє одержувати нові люмінесциюючі арилпіразолін- формули: сполуки, що розширює їхній асортимент та область застосування. Зазначені властивості забезпечують можлиIll вість використання цих люмінофорів у сцинтиляційній техніці, квантовій електроніці, у біології і медицині, у техніці одержання спектрозсуваючої пластмаси, у наданні люмінесцентних забарвлень де Χ - Η, ОСН3 або СІ, описані в [а. с. СРСР полімерам та ін. 2 №595958, МПК C07D31/06, 1976р.] У ряді фторпохідних піразолінів відомі сполуСполуки зазначеної структури є фотостійкими ки, які люмінесциюють, формули: органічними люмінофорами, люмінесциюють в області 400410нм і використовуються в якості II люмінесцентних складових при одержанні білих пігментів і фарб. Основним достоїнством їх є підвищена стійкість до дії Уф-променів, що дає можЗазначена сполука є світлостійким люмінофоливість одержання на їхній основі пігментів і фарб ром жовто-зеленого світіння ( макс. люмінесценпідвищеної світлостійкості. ції в толуолі 495нм, квантовий вихід 0,52). Одержують зазначені сполуки конденсацією Рекомендується до використання в якості люгідрохлоридів заміщених мінесцентних складових для одержання денних диметиламінопропіофенонів з 4флуоресцентних пігментів і фарб і в люмінесцентдифторметилсульфонилфенілгідразином у спирній дефектоскопії. тово - лужному середовищі при кипінні. 3-(4-дифторметилсульфонилфеніл)-1,5Найбільш близьким аналогом до сполук, які дифеніл-2-піразолін одержують конденсацією бензаявляються, по області світіння обрано люмінозаль-4-дифторметилсульфонилацетофенону з фор зеленого світіння 1,8-нафтоілен-1’,2'фенілгідразином в оцтовому середовищі. бензімідазол, який широко застосовується і освоєНеобхідний для його синтезу 4ний у промисловості формули: дифторметилсульфонилацетофенон одержують багатостадійним методом за схемою: IV (Укр. хим. журнал 1979, т.45, с.553-556. Bull. Soc. Chim. Belg. 1965, V.74, P.270-280). Основним недоліком люмінофору який показано, є багатостадійність технології вихідних речовин для його синтезу, що включає сім незалежних технологічних процесів, низькі виходи цільових продуктів для більшості з них (особливо на стадії одержання n-меркаптоетилбензолу (~40%) і nдифторметилсульфонилацетофенону (~30%), а також висока токсичність його синтезу, оскільки технологія його виробництва передбачає утворення сильно токсичних речовин, таких як сульфохлорид, меркаптан та ін. Крім того, виробництво цього люмінофору вимагає використання дефіцитної і дорогої сировини, наприклад, перманганату калію, хлорсульфонової кислоти та ін. Таким чином, усе перераховане вище приводить до надзвичайно високої собівартості зазначеного люмінофору, що виключає можливість його промислового випуску і, у зв'язку з зазначеними недоліками, практичного використання. Відомі також люмінесциюючі сполуки в ряді похідних піразолінів з дифторметилсульфонильною групою-1-(4-дифторметилсульфонилфеніл)-3 Максимум люмінесценції його в залежності від концентрації люмінофору змінюється від 490 до 510нм, абсолютний квантовий вихід ~0,5. Люмінофор досить добре розчинний в органічних середовищах. Інтенсивно люмінесциює у вигляді порошку та в розчинах. Спосіб одержання люмінофору порівняно простий. Одержують його кип'ятінням суміші нафталевого ангідриду з орто-фенілендіаміном в оцтовокислому середовищі з наступним хроматографічним очищенням. Використовується люмінофор для одержання денних флуоресцентних пігментів, для люмінесцентної дефектоскопії, фарбування пластмасових матеріалів, мітки пісків та інших цілей (а.с. СРСР 178821, МПК С07С, 42L3/08). Основними недоліками сполуки по області світіння є низька поглинаюча здатність люмінофору (коефіцієнт екстинкції в максимумі поглинання8000), що не дає можливості створення на його основі високоефективних люмінесцентних матеріалів, особливо спектрозсуваючих світловодів, де поглинаюча здатність і квантовий вихід відіграють визначальну роль. Найбільш близькою люмінесциюючою сполукою по структурі і по області світіння, до сполук, які заявляються і обрана як прототип, є - 3-(4фторсульфонилфеніл)-1,5-дифеніл-2-піразолін, формули: V Зазначені сполуки люмінесциюють у жовто 5 61385 6 внянні з аналогом-прототипом, роблять сполуки зеленій області спектру ( Макс. люмінесценції в структури, що заявляється, більш ефективними, а толуолі 500нм) із квантовим виходом (-0,56). отже, і більш перспективними в зазначених обласСполука гарно розчиняється в органічних розтях, особливо в області розробки спектрозсуваючинниках і полімерних матрицях. Використовуєтьчих світловодів. ся в сцинтиляційній техніці, для фарбування поліОдержують сполуки, що заявляються, формумерних матеріалів, одержання денних ли І нижченаведеними прикладами. флуоресцентних пігментів і фарб, а наявність у Приклад 1 структурі реакційно-здатної фторсульфонильної Одержання 1(4-формилфеніл)-3-(4групи дозволяє використовувати його як вихідну фторсульфолилфеніл)-5-феніл-2-піразоліну сировину для одержання нових люминесциюючих До розчину 6,46г (0,017Μ) 1,5-дифеніл-3-(4сполук. фторсульфонилфеніл)-2-піразоліну в 11мл (0,15М) Синтез описаного люмінофору здійснюють диметилформаміду при перемішуванні додають шляхом конденсації бензаль-46,7г (0,044М) хлорокису фосфору при температурі фторсульфонилацетофенону з фенілгідразином у 40°С, реакційну масу нагрівають при 70°С протяспиртовому середовищі при нагріванні [а.с. СРСР гом 4 годин. Охолоджують до кімнатної темпера№1319516, МПК C07D231/00, С09К11/06]. тури, виливають на лід (140г) і витримують протяДо основних недоліків аналога-прототипу, що гом 8 годин при кімнатній температурі. Осад, що у значній мірі обмежує його практичне використанвипав, відфільтровують, багаторазово промивають ня, варто віднести, також як і в описаних вище водою, потім розчином соди і знову водою. Проаналогах, недостатньо високу поглинаючу здатдукт реакції очищають хромотографуванням бенність (коефіцієнт екстинкції 22400), і звідси низьку зольного розчину на оксиді алюмінію. інтенсивність люмінесценції при досить високому Одержують жовті кристали з температурою (0,5) квантовому виході. Наявність у структурі заплавлення 179°С, розчинні в звичайних органічних значеної сполуки тільки однієї реакційноздатної розчинниках. SО2F - групи не дає широкої можливості одержанВихід 3,6г (75%). Тпл.=179°С ня нових люмінофорів, які люмінесциюють у широЗнайдено, %: С - 64,63; N - 6,81; S - 7,82; F кій області спектру. 4,62 Незважаючи на вже існуючий різноманітний Обчислено, %: С - 64,70; N - 6,86; S - 7,84; F асортимент органічних люмінофорів, покликаних 4,65 вирішувати важливі практичні задачі, висунуті суC22H17N2O3FS часною наукою і технікою, пошук нових високое максимум поглинання в толуолі 412нм фективних люмінесциюючих сполук є актуальним. максимум люмінесценції в толуолі 475нм Задача винаходу полягала у пошуку в ряді фторвміщуючих піразоліна нових, високоефектив квантовий вихід 0,63 них люминесцируючих сполук, які володіли б не Приклад 2 тільки більш високою поглинаючою здатністю, інОдержання 1-(4-карбоксифеніл)-3-(4тенсивністю світіння й одночасно були би вихідним фторсульфонилфеніл)-5-феніл-2-піразоліну. напівпродуктом для одержання нових люмінофоУ тригорлу колбу місткістю 50мл, постачену рів інших класів. Поставлена задача забезпечумішалкою і холодильником завантажують 30мл ється розробкою нових фторпохідних піразоліна, оцтової кислоти, додають 2,9г бензаль-4які описуються формулою: фторсульфонилацетофенону, 2,4карбоксифенілгідразину, реакційну масу доводять до кипіння і кип'ятять протягом 2 годин. ОхолоІ джують до кімнатної температури, фільтрують, промивають водою до нейтральної реакції промиде Аr - С6Н4СООAlk, Alk - С1-С8; вних вод. Сушать. Хроматографують з бензольно- С6Н4СОХ, де X=Η, ОН; го розчину на оксиді алюмінію. Одержують кристаN N ли жовтого кольору. C CH (CH ) ; С6Н4С4Н9; O Тпл. = 280282°С. Знайдено, %: С - 50,83; H - 3,69; F - 4,51; N CH СH CH СH N N 6,61; S - 1,50 OH SH Обчислено, %: C - 50,89; H - 3,66; F - 4,48; N ; ; 6,60; S - 1,54 C22H17N2SO3F N N максимум поглинання в толуолі 410нм CH CH N максимум люмінесценції в толуолі дорівнює O N 485нм квантовий вихід 0,57 Приклад 3 SO F Одержання 1-(4-метилкарбоксифеніл)-3-(4Наявність у цих сполук поряд з реакційнофторметилсульфонилфеніл)-5-феніл-2-піразоліну. здатною SO2F групою інших реакційно-здатних Суміш, що складається з 2,9г бензаль-4центрів -СОН, СООН відкриває широкі можливості фторсульфонилацетофенону, 2,49г метилкарбокдля одержання цілого ряду нових сполук. Більш силфенілгідразину і 80мл оцтової кислоти кип'явисока поглинаюча здатність цих сполук у сполутять протягом 4 годин. Охолоджують реакційну ченні з досить високим квантовим виходом, у порімасу до кімнатної температури, осад, що випав 6 6 6 4 3 3 4 4 6 6 4 2 4 7 61385 8 відфільтровують і очищують хромотографуванням Суміш, що складається з 4г (0,01М) 1-(4його бензольного розчину на оксиді алюмінію. формилфеніл)-3-(4-фторсульфонилфеніл)-5Вихід 3,6г (75%). Тпл. = 245°С феніл-2-піразоліну, 1,2мл (0,012М) оЗнайдено, %: С - 62,9; Η - 3,6; F - 4,0; N - 6,31 ; амінотіофенолу і 50мл бутанолу кип'ятять 2 годиS - 7,5 ни. Охолоджують осад, що випав, фільтрують, Обчислено, %: С - 63,0; Η - 3,42; F - 4,33; Ν сушать, очищують, хроматографують з бензольно6,39; S - 7,3 го розчину на оксиді алюмінію. C23H17FN2O4S Вихід 4,35г (85%) Тпл. = 222°С Знайдено, %: С - 65,1; Η - 4,21; F - 3,65; Ν максимум поглинання в толуолі 410нм 8,20; S - 12,3 максимум люмінесценції в толуолі 475нм Обчислено, %: С - 65,2; Η - 4,27; F - 3,69; Ν квантовий вихід 0,6 8,15; S - 12,427 Приклад 4 C28H22N3О3FS Одержання 1-(4-бутилкарбоксифеніл)-3-(4 максимум поглинання в толуолі 410нм фторсульфонилфеніл)-5-феніл-2-піразоліну. максимум люмінесценції в толуолі 488нм 2,9г бензаль-4-фторсульфонилацетофенону, 3,1г 4-бутилкарбоксифенілгідразину і 40мл оцтової квантовий вихід 0,53 кислоти кип'ятять 2,5 години, охолоджують, фільтПриклад 8 рують. Очищують хроматографуванням бензольОдержання1-(4-бензаль-2-тіоанілін)-3-(4ного розчину на оксиді алюмінію. фторсульфонилфеніл)-5-фенілпіразоліну. Синтез і очищення здійснюють аналогічно Вихід 3,26г (68%) Тпл. = 170171°С прикладу 7. Знайдено, %: С - 65,0; Η - 5,2; Ν - 5,81; S Для реакції беруть 4,02г 1-(4-формилфеніл)-36,63; F - 3,8 (4-фторсульфонил)-5-феніл-2 піразоліну, 1,2г оОбчислено, %: С - 65,0; Η - 5,2; Ν - 5,8; S амінофенолу. 6,66; F - 3,95 Вихід, 3,89г (78%). Тпл. = 162-164°С C26H25FN2O4S Знайдено, %: С - 61,51; Н - 4,48; N - 8,45; максимум поглинання в толуолі 408нм F - 3,85 максимум люмінесценції в толуолі 490нм Обчислено, %: С - 61,33; Η - 4,40; Ν - 8,4; S квантовий вихід 0,5 6,41; F - 3,80 Приклад 5 C28H22N3О2S2F Одержання 1-(4-бутилфеніл)-3-(4 максимум поглинання в толуолі 420нм фторметилсульфонилфеніл)-5-феніл-2-піразоліну. максимум у толуолі 523нм Синтез і очищення здійснювали аналогічно квантовий вихід 0,54 попередньому прикладу, але для реакції брали Приклад 9 2,9г бензаль-4-фторсульфонилацетофенона, 2,46г Одержання 2,5-ди{4(1,5-дифеніл-3-(44-бутилфенілгідразину, 70мл оцтової кислоти. фторсульфонилфеніл)-2-піразолін-1}-1,3,4Вихід 3,18г (73%) Тпл. - 120122°С оксадіазолу. Знайдено, %: С - 68,75; Η - 5,70; F - 4,30; Ν Синтез цієї сполуки здійснювали циклізацією 6,41; S - 7,32 симетричного гідразиду, отриманого з хлорангідОбчислено, %: С - 68,80; Η - 5,73; F - 4,36; Ν риду 1-{4 карбоксифеніл-3-(4 фторсульфонил)-56,42; S - 7,34 феніл-2-піразоліну і гідразингідрату, хлористим C25H25N2SO4F тіонилом. максимум поглинання в толуолі 420нм У суміш, що складається з 110мл хлороформу, максимум люмінесценції в толуолі 526нм 1,6 гідразингідрату при перемішуванні додають квантовий вихід 0,5 42,6г хлорангідриду 1-(4 карбоксифеніл-3-(4 фторПриклад 6 сульфонил)-5-феніл-2-піразоліна і після 20хв. розОдержання 4-(1-(2-N-третбутилфеніл)5мішування додають 15мл триетаноламіну, нагріфенілоксазолил-1,3,4)-3-(4-фторсульфонилфеніл)вають колбу протягом 1 години. Охолоджують. 5-феніл-2-піразоліну. Осад, що випав, відфільтровують, промивають Синтез проводили аналогічно попередньому хлороформом, промивають ізопропиловим спирприкладу, але для реакції брали 2,9г халкону, 4,6г том і сушать. 45г отриманого таким способом гід2-п-третбутилфеніл, 5-(4-фенілилгідразин)-1,3,4разиду змішують з 25мл тіонилхлориду, кип'ятять оксазолу і 30мл оцтової кислоти. Одержували кри4 години, потім відганяють хлористий тіонил, досталічний порошок жовтого кольору. дають 45мл бензолу і відганяють разом із залишВихід 3,77г (65%) Тпл. = 280282°С ками хлористого тіонилу, додають 75мл бензолу, Знайдено, %: С - 68,20; Η - 5,10; F - 3,30; Ν кип'ятять, охолоджують, фільтрують. Продукт 9,67; S - 5,50 очищують хромотографуванням його розчину в Обчислено, %: С - 68,27; Η - 5,0; F - 3,27; Ν хлороформі на окису алюмінію, одержують крис9,65; S - 5,51 тали жовтого кольору з Тпл. = 235-237°С C33H29N4SO3F Вихід 24,72 (60%) максимум поглинання в толуолі 418нм Знайдено, %: С - 63,8; Н - 3,80; Ν - 10,1; F максимум люмінесценції в толуолі 514нм 4,61; S - 7,70 квантовий вихід 0,6 Обчислено, %: С - 63,9; Н - 3,87; N - 10,17; F Приклад 7 4,6; S - 7,74 Одержання 1-(4-бензаль-2-оксианілін)-3-(4C44H32N6F2О5S2 фторсульфoнилфеніл)-5-феніл-2 піразоліну. максимум поглинання в толуолі 430нм 9 61385 10 алізації і таблиці, розроблені сполуки фторпохід макс, флуоресценції в толуолі 520нм них піразоліну зазначеної структури в порівнянні з квантовий вихід 0,5 прототипом забезпечують одержання люмінофоПроведено іспити сполук, що заявляються, рів, що володіють високою стійкістю до світла, формули І в якості органічних люмінофорів. гарною розчинністю в органічних розчинниках і Спектри люмінесценції вимірювали на устанополімерних матеріалах і більш високою поглинаювці, що складається з дзеркального монохроматочою здатністю, що забезпечує більш високу інтенра ЗМР-3, фотоелектронного помножувача ФЕПсивність і яскравість їхнього світіння. Це, очевид18, мікроамперметра М-95. но, досягається тим, що коефіцієнт екстинкції Джерелом збудження служила лампа СВДТсполук, що заявляються, значно більш високий і 500, зі спектру якої виділяли лінію збудження складає 38200-53100, у прототипа коефіцієнт екс365нм. тинкції дорівнює 22400. Абсолютні квантові виходи люмінесценції виВідомо, що люмінесциюючі сполуки з більш мірювали методом рівного поглинання [Черкасов високим коефіцієнтом екстинкції є більш ефективА.С., ЖРХ 1955р. т. 29, з 2209]. ними навіть при однаковому квантовому виході Доказом структури отриманих сполук служать: люмінесценції. елементний склад і електронні спектри: поглинанКрім того, структура, що заявляється дає можня, спектри ІЧ, у яких для всіх отриманих сполук -1 ливість переходити до одержання цілого ряду спостерігається інтенсивна смуга при 1605см , що фторвміщуючих люмінесциюючих сполук інших відповідає валентним коливанням зв'язку C=N, -1 класів, що розширює асортимент високоефективвисокоінтенсивна смуга в області 690см , обумовних люмінофорів з поліпшеними спектральнолена позаплощинними деформаційними коливанлюмінесцентними властивостями для різного винями С-Н групи піразолінового циклу, а також ряд користання їх у народному господарстві. інших смуг, характерних для 1,3,5- триарил-2Сполуки можуть успішно виробляться в пропіразолшів. мислових умовах з невеликими витратами. Як видно з тексту опису заявки, прикладів реТаблиця Комп’ютерна верстка Н. Лисенко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel fluorine containing compounds of pyrazolone series of the general formula as yellow and green luminescence luminophors
Автори англійськоюShershukov Viktor Mykhailovych, Skrypkina Valentyna Tykhonivna
Назва патенту російськоюНовые фторсодержащие соединения пиразолинового ряда как органические люминофоры желто-зеленого свечения
Автори російськоюШершуков Виктор Михайлович, Скрипкина Валентина Тихоновна
МПК / Мітки
МПК: A61P 7/04, C07D 231/06, A61K 31/197, A61K 9/02, C09D 5/22, C09D 11/06
Мітки: світіння, люмінофори, фторовмісні, піразолінового, ряду, жовто-зеленого, сполуки
Код посилання
<a href="https://ua.patents.su/5-61385-ftorovmisni-spoluki-pirazolinovogo-ryadu-yak-lyuminofori-zhovto-zelenogo-svitinnya.html" target="_blank" rel="follow" title="База патентів України">Фторовмісні сполуки піразолінового ряду як люмінофори жовто-зеленого світіння</a>
Попередній патент: Спосіб виготовлення терморезистивного матеріалу на основі оксидів ванадію
Наступний патент: Спосіб аерофотознімання лінійних мереж
Випадковий патент: Спосіб сепарації сипучої суміші у текучому середовищі та пристрій для його здійснення









