Спосіб одержання 17a-ціанометил-17b-гідроксіестра-4,9-дієн-3-ону
Номер патенту: 91390
Опубліковано: 26.07.2010
Автори: Хорват Янош, Араньі Анталь, Махо Шандор, Данчі Лайошне
Формула / Реферат
1. Спосіб одержання 17![]() -ціанометил-17
-ціанометил-17![]() -гідроксіестра-4,9-дієн-3-ону (далі за текстом - дієногест) формули (І)
-гідроксіестра-4,9-дієн-3-ону (далі за текстом - дієногест) формули (І)
 (I)
(I)
з 3-метокси-17-гідроксіестра-2,5(10)-дієну формули (V)
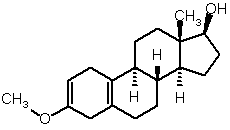 , (V)
, (V)
який відрізняється тим, що
і) проводять взаємодію 3-метокси-17-гідроксіестра-2,5(10)-дієну формули (V) з ізопропілатом алюмінію за наявності циклогексанону в інертному органічному розчиннику при нагріванні;
іі) проводять подальшу взаємодію одержаного таким чином 3-метоксіестра-2,5(10)-дієн-17-ону формули (IV)
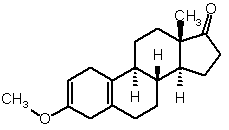 (IV)
(IV)
з ціанометиллітієм при температурі між 0 і -30 °С;
ііі) проводять подальшу взаємодію одержаного 3-метокси-17![]() -ціанометил-17
-ціанометил-17![]() -гідроксіестра-2,5(10)-дієну формули (III)
-гідроксіестра-2,5(10)-дієну формули (III)
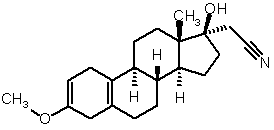 (III)
(III)
з сильною органічною кислотою в тетрагідрофурановому розчині;
iv) проводять взаємодію одержаного 17![]() -ціанометил-17
-ціанометил-17![]() -гідроксіестр-5(10)-ен-3-ону формули (II)
-гідроксіестр-5(10)-ен-3-ону формули (II)
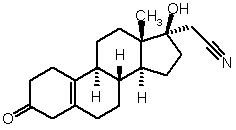 (II)
(II)
з 1-1,5 еквівалентами піридинію триброміду в піридиновому розчині при температурі між 0 і 60 °С, подальшим очищенням одержаного сирого дієногесту формули (І) перекристалізацією й препаративною ВЕРХ.
2. Спосіб за п. 1, який відрізняється тим, що виконують окислення на стадії і) у толуолі у присутності 20-25 еквівалентів циклогексанону при температурі між 100 і 120 °С.
3. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що додатково одержують ціанометиллітієвий реагент на стадії іі) in situ з гексиллітію й ацетонітрилу.
4. Спосіб за будь-яким з пп. 1-3, який відрізняється тим, що виконують реакцію ціанометилювання на стадії іі) при температурі між -10 і -20 °С.
5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що використовують 2 еквіваленти ціанометиллітієвого реагенту на стадії іі).
6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що виконують кислотну обробку на стадії ііі) дво- або триосновною органічною кислотою в тетрагідрофурані.
7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що виконують кислотну обробку на стадії ііі) 2 еквівалентами дигідрату щавлевої кислоти.
8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що вводять у взаємодію сполуку формули (II) з 1,05 еквівалентами піридинію триброміду на стадії iv).
9. Спосіб за будь-яким з пп. 1-8, який відрізняється тим, що вводять у взаємодію сполуку формули (II) з піридинієм трибромідом при температурі між 25 і 50 °С.
10. Спосіб за будь-яким з пп. 1-9, який відрізняється тим, що очищують дієногест формули (І) методом ВЕРХ з використанням силікагелю як адсорбенту.
11. Спосіб за будь-яким з пп. 1-10, який відрізняється тим, що очищують дієногест формули (І) методом ВЕРХ з використанням наступних сумішей розчинників як елюентів: 70:30 дихлорметан/етилацетат або 80:20 дихлорметан/трет-бутилметиловий ефір або 90:10 дихлорметан/ацетон.
12. Спосіб за будь-яким з пп. 1-11, який відрізняється тим, що здійснюють перекристалізацію дієногесту формули (І), одержаного за допомогою препаративної ВЕРХ, з етилацетату, ацетону, трет-бутилметилового ефіру, діізопропілового ефіру, ацетонітрилу, метанолу, етанолу або сумішей цих розчинників з водою в різних співвідношеннях.
Текст
1. Спосіб одержання 17 -ціанометил-17 гідроксіестра-4,9-дієн-3-ону (далі за текстом - дієногест) формули (І) CH OH 3 91390 4 нометиллітієвий реагент на стадії іі) in situ з гексиллітію й ацетонітрилу. 4. Спосіб за будь-яким з пп. 1-3, який відрізняється тим, що виконують реакцію ціанометилювання на стадії іі) при температурі між -10 і -20 °С. 5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що використовують 2 еквіваленти ціанометиллітієвого реагенту на стадії іі). 6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що виконують кислотну обробку на стадії ііі) дво- або триосновною органічною кислотою в тетрагідрофурані. 7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що виконують кислотну обробку на стадії ііі) 2 еквівалентами дигідрату щавлевої кислоти. 8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що вводять у взаємодію сполуку формули (II) з 1,05 еквівалентами піридинію триброміду на стадії iv). 9. Спосіб за будь-яким з пп. 1-8, який відрізняється тим, що вводять у взаємодію сполуку формули (II) з піридинієм трибромідом при температурі між 25 і 50 °С. 10. Спосіб за будь-яким з пп. 1-9, який відрізняється тим, що очищують дієногест формули (І) методом ВЕРХ з використанням силікагелю як адсорбенту. 11. Спосіб за будь-яким з пп. 1-10, який відрізняється тим, що очищують дієногест формули (І) методом ВЕРХ з використанням наступних сумішей розчинників як елюентів: 70:30 дихлорметан/етилацетат або 80:20 дихлорметан/третбутилметиловий ефір або 90:10 дихлорметан/ацетон. 12. Спосіб за будь-яким з пп. 1-11, який відрізняється тим, що здійснюють перекристалізацію дієногесту формули (І), одержаного за допомогою препаративної ВЕРХ, з етилацетату, ацетону, трет-бутилметилового ефіру, діізопропілового ефіру, ацетонітрилу, метанолу, етанолу або сумішей цих розчинників з водою в різних співвідношеннях. Галузь техніки, до якої належить винахід Даний винахід стосується нового способу синтезу високочистого 17-ціанометил-17-гідроксиестра-4,9-дієн-3-ону (далі за текстом дієногест) формули (І) Рівень техніки Відома методика синтезу дієногесту формули (І) використовує як початковий матеріал інтермедіати загального синтезу естрону. Головна відмінність між відомими методиками полягає в тому, що два подвійні зв'язки, характеристичні для цільової сполуки, вже присутні в початковій речовині чи ні, і в останньому випадку вони утворюються на останній стадії синтезу. Відповідно до патентної заявки Німеччини DD 132,497, 3-метокси-17-спіро-1’,2'-оксиран-естра2,5(10)-дієн піддають взаємодії з ціанідом лужного металу з отриманням похідної 17-ціанометил17-гідрокси-3-енолефіру. Потім одержану таким чином сполуку гідролізують, бромують і дегідробромують, одержуючи дієногест формули (І) з виходом 32%. Чистоту одержаного дієногесту характеризують температурою плавлення (204-214°С) і оптичним обертанням ([]25D= -290°, піридин с=0,5%). Згідно зі способом, описаним у патентній заявці DD 80,023, 3-метокси-17-спіро-1',2'оксиран-естра-2,5(10)-дієн, що використовується як початкова речовина, можна синтезувати реакцією диметилсульфоній метиліду й 17-оксо похідної, одержаної окисленням за Оппенауером 17гідрокси групи 3-метокси-17-гідрокси-естра-2,5(10)дієну формули (V) - при цьому останній синтезують відомими способами. Спосіб, описаний у патентній заявці Німеччини DD 160,418, є модифікацією вищеописаного способу, в якому спочатку сполуку формули (V) перетворюють на 3.3-диметокси-17-гідрокси-естр5(10)ен, 17 гідрокси групу окисляють піридиній хлорхроматом - замість окислення за Оппенауером - потім формують 17-спіро-1',2'-оксиран взаємодією з диметилсульфоній метилідом, і останній піддають взаємодії з ціанідом лужного металу, одержуючи 3,3-диметокси-17-ціанометил-17гідрокси-естр-5(10)-ен. Одержану речовину гідролізують за допомогою сірчаної кислоти з отриман з 3-метокси-17-гідрокси-естра-2,5(10)-дієну формули (V) Дана сполука використовується як активний інгредієнт у контрацептивних фармацевтичних композиціях як прогестогенний компонент, у гормон-замісній терапії, а також у композиціях проти ендометріозу. Даний винахід стосується також високочистого 17-ціанометил-17-гідрокси-естра4,9-дієн-3-ону і фармацевтичних композицій, що містять його як активний інгредієнт. Фармацевтичні композиції за даним винаходом містять високочистий дієногест згідно з даним винаходом як активний інгредієнт або, щонайменше, один з активних інгредієнтів і додаткові речовини, звичайно використовувані на практиці, такі як носії, наповнювачі або розріджувачі. У даному описі, високочистий дієногест означає, що загальна кількість домішок складає менше 0,1%, тоді як кількість 4-бром-дієногесту є нижчою за межу виявлення (0,02%). 5 ням 17-ціанометил-17-гідрокси-естр-5(10)-ену, з якого після бромування і подальшого дегідробромування одержують дієногест з виходом 48%. Загальний вихід за даним способом складає 24%. Патентна заявка Німеччини DD 296,495 описує синтез в одній реакційній судині, відповідно до якого спочатку початковий кето-стероїд - положення 3 якого містить гідрокси або оксо групу, захищену однією або більше алкокси групою - піддають взаємодії з ціанометиллітієм, що утворюється in situ в реакції літійалкілів або літій діалкіламідів з ацетонітрилом в органічному розчиннику при низькій температурі. Таким чином з 17-оксо групи формують 17-гідрокси і 17-ціанометил групу, одержану реакційну суміш обробляють водою, і одержану 17-гідрокси-17-ціанометильну похідну виділяють або перетворюють на дієногест безпосереднім гідролізом у кислому середовищі. Вихід кінцевого продукту складає 82% виходячи з 3,3-диметоксиестра-5(10),9(11)-дієн-17-ону, тоді як при використанні як початкової речовини 3,3-(1,3пропілендіокси)-естра-5(10),9(11)-дієнової похідної вихід складає 80%. Чистоту одержаного продукту характеризували за температурою плавлення: 208-211,5°С. Даний синтез складається з 6 стадій, включаючи отримання 17-оксопохідної, використовуваної як початкова речовина. Відповідно до патентної заявки ЕР 0,776,904, 3,3-(2,2-диметилпропілен-1,3-діокси)-4,5-секоестр-9-ен-5,17-діон спочатку переводять в естра4,9-дієн-3,17-діон, а останній - у 3,3-етилендіоксиестра-5(10),9(11)-дієн-17-он. Після взаємодії з диметилсульфоні йодидом одержують 17β-спіро1',2'-оксиранову похідну, яка реагує з ціанідом калію з утворенням 17-ціанометил-17-гідроксиестра-5(10),9(11)-дієн-3-етиленкеталю. Кетальну групу даної сполуки гідролізують за допомогою соляної кислоти з отриманням кінцевого продукту дієногесту з чистотою >98%. Згідно з даними способами, виходячи із згаданого вище 3-метокси-17-гідрокси-естра-2,5(10)дієну формулу (V) спочатку утворюється 3,3діалкокси-кетал-5(10)-енова похідна, потім останню окисляють у кето-сполуку, яку піддають взаємодії з диметилсульфоній-метилідом, одержуючи 17-спіро-1',2'-оксиранову похідну, і її перетворюють на 17-ціанометил-17-гідрокси похідну. Одержану сполуку гідролізують за допомогою кислоти, потім бромують і дегідробромують, одержуючи дієногест формули (І) у 6 стадій. Згідно з іншим способом, також виходячи зі сполуки формули (V), після окислення за Оппенауером гідроксильної групи в положенні 17 синтезують 17-спіро-1',2'-оксиранову похідну, яку піддають взаємодії з ціанідом лужного металу, одержаний 3-енолефір гідролізують, бромують і дегідробромують, одержуючи дієногест у 5 стадій. Згідно з іншим згаданим вище способом, 3,3етилендіокси-естра-5(10),9(11)-дієн-17-он або безпосередньо піддають взаємодії з ціанометиллітієм, або спочатку формують спіро-оксиран і розкривають оксирановий цикл ціанідом лужного металу з отриманням 17-ціанометил-17-гідрокси похідної, яку гідролізують з отриманням кінцевого продукту формули (І). 91390 6 Синтези 17-спіро-1',2'-оксиранових похідних виходячи з 17-кето сполук і диметилсульфонієвих похідних згідно зі способами, описаними в патентних заявках DD 132,497 і ЕР 0,776,904, дорогі й небезпечні для навколишнього середовища. Використання ціанідів лужних металів для розкриття оксиранового циклу вимагає суворого дотримання інструкцій техніки безпеки і призводить до проблем для навколишнього середовища після обробки реакційних сумішей. У вказаних вище заявках на патенти якість продукту характеризували тільки за температурою плавлення або, в кращому разі, за вмістом речовини. Останні вимоги фармакопеї встановлюють дещо інших способів визначення кількості речовини і домішок, такі як тонкошарова або рідинна хроматографія, а також визначають і обмежують кількість і число домішок. Суть винаходу Завданням авторів було усунути згадані вище недоліки відомих методик і розробити коротший, економічніший і сприятливий для навколишнього середовища синтез, який може проводитися в промисловому масштабі, переважно з використанням інтермедіату загального синтезу естрону, 3метокси-17-гідрокси-естра-2,5(10)-дієну формули (V) як початкової речовини. Іншим завданням авторів було синтезувати високочистий продукт, у якому загальна кількість домішок складає менше 0,1%, тоді як кількість 4бром-дієногесту є нижчою за межу виявлення (0,02%), таким чином даний продукт підходить для виробництва різних готових лікарських форм. Несподівано було виявлено, що при використанні сполуки формули (V) як початкової речовини для синтезу сполуки формули (III) не є необхідним утворення 17-оксиранової похідної з подальшим розкриттям епоксидного циклу ціанідом лужного металу, а також не потрібно синтезувати 3,3діалкокси-кеталь з енолефірної групи сполуки формули (V) і окисляти гідроксильну групу в положенні 17 піридиній хлорхроматом. При використанні умов реакції за даним винаходом, сполуку формули (V) можна окислити за Оппенауером з хорошим виходом (90%), не зачіпаючи кільце А (ароматизація). Таким чином, авторам вдалося розробити 4-стадійний синтез, який коротший за відомі методики. За даним винаходом дієногест формули (І) синтезують таким чином: i) 3-метокси-17-гідрокси-естра-2,5(10)-дієн формули (V) піддають взаємодії з ізопропілатом алюмінію в присутності циклогексанону в інертному органічному розчиннику при нагріванні; ii) одержаний таким чином 3-метокси-естра2,5(10)-дієн-17-он формули (IV) піддають взаємодії з ціанометиллітієм за температури між 0 і -30°С; 7 iii) одержаний 3-метокси-17-ціанометил-17гідрокси-естра-2,5(10)-дієн формули (III) піддають взаємодії з сильною органічною кислотою в тетрагідрофурановому розчині; IV) одержаний 17-ціанометил-17-гідрокси-естр-5(10)-ен3-он формули (II) піддають взаємодії з 1-1,5 еквівалентами піридиній триброміду в піридиновому розчині при температурі між 0 і 60°С, потім одержаний сирий дієногест формули (І) очищають перекристалізацією і препаративною ВЕРХ. Стадію II) переважно виконують при температурі між -10 і 20°С, тоді як стадію IV) між 25 і 50°С, використовуючи 1,05 еквівалента піридиній триброміду. Перекристалізацію переважно проводять з використанням ацетону, етилацетату, ацетонітрилу, метанолу, етанолу або сумішей цих розчинників з водою в різних співвідношеннях, а також сумішей дихлорметану й діізопропілового ефіру або ізопропанолу або трет-бутилметилового ефіру в різних співвідношеннях. Для досягнення високої чистоти одержаний таким чином перекристалізований продукт додатково очищають препаративною ВЕРХ з використанням силікагелю як адсорбенту й різних систем розчинників як елюентів, таких як дихлорметан/етилацетат, дихлорметан/третбутилметиловий ефір або дихлорметан/ацетон. З елюату упарюють дихлорметан, і одержаний високочистий дієногест виділяють з іншого компоненту використовуваної системи розчинників, наприклад, етилацетату, трет-бутилметилового ефіру, ацетону або діізопропілового ефіру, метанолу, етанолу або сумішей цих розчинників з водою в різних співвідношеннях. Даний процес має наступні переваги: - синтез може виконуватися в промисловому масштабі; збільшення масштабу завантаження в порівнянні з масштабом, описаним у прикладах, не викликає технічних проблем і не впливає на чистоту кінцевого продукту; - початкова речовина для синтезу, 3-метокси17-гідрокси-естра-2,5(10)-дієн формули (V), є досяжним промисловим продуктом; - синтез складається з меншої кількості стадій - всього 4 - ніж процеси, відомі в літературі - 5-6-8 стадій; - при використанні умов реакцій за даним винаходом виходи в реакційних стадіях вказаного 91390 8 синтезу набагато вищі, ніж відомі в попередньому рівні техніки. Вихід на кожній стадії перевищує 80%, тому загальний вихід складає більше 50%; - якість одержуваного високочистого дієногесту вища, ніж вимоги до якості згідно із фармакопеєю. Кількість домішок визначена методом ВЕРХ. Згідно з даними вимірювань, загальна кількість домішок у даному продукті складає менше 0,1%, і кількість 4-бром-дієногесту, який є домішкою, детектованою в продаваних фармацевтичних композиціях у кількостях вищих за 0,1%, є нижчою за межу виявлення (0,02%); - в реакції ціанометилювання не використовуються ціаніди лужних металів і диметилсульфонієві похідні, що відповідає вимогам охорони навколишнього середовища й економічним міркуванням, а також не використовується дорогий і небезпечний бутиллітій - замість них використовується гексановий розчин гексиллітію. Спосіб за даним винаходом проілюстрований наступними необмежуючими прикладами. Приклад 1 3-Метокси-естра-2,5(10)-дієн-17-он До перемішуваного розчину 106,3 г (0,52 моль) ізопропоксиду алюмінію в 2000мл сухого толуолу додали 720 мл циклогексанону, 0,35 г 2,6-дитретбутил-4-метилфенолу й 100 г (0,307 моль) 3метокси-17-гідрокси-естра-2,5(10)-дієну, потім реакційну суміш перемішували при 108-110°С протягом 1 години. Контроль за реакцією здійснювали методом ТШХ. Після закінчення реакції суміш охолодили до 20-25°С, додали 200 мл води і одержану таким чином суміш перемішували протягом 1 години. Осад гідроксиду алюмінію, що випав, відфільтрували і фільтрат упарили при зниженому тиску до об'єму 250 мл. Суміш 200 мл метанолу і 100 мл води додали до даного концентрованого теплого - близько 60°С - розчину, одержану суспензію охолодили до 20-25°С і перемішували протягом 1 години. Кристалічний продукт, що випав в осад, відфільтрували і висушили у вакуумі при температурі не вищій 40°С, одержавши 76,4 г (87%) указаного в заголовку продукту. Чистота: хв. 98% (ВЕРХ). Температура плавлення: 106-110°С. Приклад 2 3-Метокси-17-ціанометил-17-гідрокси-естра2,5(10)-дієн 410 мл (1,012 моль) 2,5М розчину гексиллітію розбавили 300 мл сухого тетрагідрофурану, розчин охолодили до -20°С і додали 58 мл (1,112 моль) ацетонітрилу. До одержаної таким чином суспензії ціанометиллітію додали розчин 144,8 г (0,506 моль) 3-метокси-естра-2,5(10)-дієн-17-ону в 1450 мл тетрагідрофурану при температурі між -20 і -10°С, і перемішували одержану реакційну суміш при температурі між -20 і -10°С до завершення реакції - контроль за ТШХ. Після закінчення реакції додали 640 мл води, відокремили органічну фазу, промили двічі 60мл води й упарили при зниженому тиску до об'єму 720 мл. Концентрований розчин охолодили до 20-25°С, додали 720 мл води, випалий в осад кристалічний продукт відфільтрували і висушили у вакуумі при температурі не вищій 40°С. Одержаний сирий продукт перекристалізо 9 91390 вували з етанолу, одержавши 143,4 г (86,5%) указаного в заголовку продукту. Чистота: хв. 98% (ВЕРХ). Температура плавлення: 145-150°С. Приклад 3 17-Ціанометил-17β-гідрокси-естр-5(10)-ен-3он До перемішуваного розчину 100,8 г (0,8 моль) дигідрату щавлевої кислоти в 560 мл води додали при охолоджуванні розчин 131 г (0,4 моль) 17ціанометил-17-гідрокси-3-метокси-естра-2,5(10)дієну в 1050 мл тетрагідрофурану. Після перемішування при 20-25°С протягом 1 години випалий в осад продукт відфільтрували і висушили у вакуумі при температурі не вищій 50°С. Одержаний сирий продукт перекристалізовували з етилацетату, одержавши 107г (85,6%) вказаного в заголовку продукту. Чистота: хв. 98% (ВЕРХ). Температура плавлення: 170-175°С. Приклад 4 17-Ціанометил-17-гідрокси-естра-4,9-дієн-3он (сирий дієногест) Перемішуваний розчин 142г (0,45 моль) 17ціанометил-17-гідрокси-естр-5(10)-ен-3-ону у 850 мл піридину охолодили до 20-25°С і додали розчин 150 г (0,47моль) піридиній триброміду в 640 мл піридину, поступово підвищуючи температуру реакційного розчину до 50°С. Після перемішування протягом 1 години, реакційну суміш додали при перемішуванні до суміші 320 мл концентрованої сірчаної кислоти і 5600 мл води. Випалі в осад кристали відфільтрували і висушили у вакуумі при температурі не вищій 60°С. Одержаний сирий продукт перекристалізовували з ацетону, одержавши 116 г (83%) вказаного в заголовку продукту. Кількість активного компоненту: хв. 97% (ВЕРХ). Домішка 4-бром-дієногесту: мкс. 1% (ВЕРХ). Температура плавлення: 210-213°С. []20D = -318° (с=1%, дихлорметан). Приклад 5 Очищення дієногесту препаративної ВЕРХ Металеву колонку динамічного аксіального стиснення (діаметр: 5 см; довжина: 60 см) заповнювали 510 г силікагелю (Uetikon C-gel C-490, розмір частинок: 15-35мкм), суспендованого в 1400 мл дихлорметану, й колонку кондиціонували з сумішшю 70:30 дихлорметан/етилацетат (2500 мл). У колонку вводили шприцом розчин 8,5 г сирого дієногесту в 210 мл дихлорметану й елюювали вказаною вище системою розчинників при швидкості потоку 85 мл/хв. Для детектування використовували УФ детектор. Фракції, що містять чисту речовину (3600 мл), концентрували, із залишку Комп’ютерна верстка М. Мацело 10 упарювали етилацетат і одержаний дієногест перекристалізовували з етилацетату, одержуючи після сушки у вакуумі при температурі не вищій 60°С 7,53 г (90,6%) чистого дієногесту. Загальна кількість домішок: максимально 0,1% (ВЕРХ). Індивідуальні домішки: максимально 0,02% (ВЕРХ). Температура плавлення: 211-214°С. []20D = -322° (с=1%, дихлорметан). Приклад 6 Очищення дієногесту препаративною ВЕРХ Скляну колонку (діаметр: 2,6 см; довжина: 46 см) заповнювали 120 г силікагелю (Uetikon C-gel C-490, розмір частинок: 15-35 мкм), і колонку кондиціонували з елюентом, що є сумішшю 90:10 дихлорметан/ацетон. У колонку вводили шприцем розчин 2 г сирого дієногесту в 50 мл дихлорметану й елюювали вказаною вище системою розчинників при швидкості потоку 10 мл/хв. Для детектування використовували УФ детектор. Фракції, що містять чисту речовину (700мл) концентрували, із залишку упарювали ацетон і одержаний дієногест перекристалізовували з ацетону, одержуючи після сушки у вакуумі при температурі не вище 60°С 1,77 г (88,5%) чистого дієногесту. Загальна кількість домішок: максимально 0,1% (ВЕРХ). Індивідуальні домішки: максимально 0,02% (ВЕРХ). Температура плавлення: 211-214°С. 20 [] D = -322° (с=1%, дихлорметан). Приклад 7 Очищення дієногесту препаративною ВЕРХ Скляну колонку (діаметр: 2,6 см; довжина: 46 см) заповнювали 120 г силікагелю (Uetikon C-gel C-490, розмір частинок: 15-35 мкм), і колонку кондиціонували з елюентом, що є сумішшю 90:10 дихлорметан/ацетон. У колонку вводили шприцем розчин 2 г сирого дієногесту в 50 мл дихлорметану й елюювали вказаною вище системою розчинників при швидкості потоку 10 мл/хв. Для детектування використовували УФ детектор. Фракції, що містять чисту речовину (700мл) концентрували, із залишку упарювали ацетон і одержаний дієногест перекристалізовували з ацетону, одержуючи після сушки у вакуумі при температурі не вище 60°С 1,77 г (88,5%) чистого дієногесту. Загальна кількість домішок: максимально 0,1% (ВЕРХ). Індивідуальні домішки: максимально 0,02% (ВЕРХ). Температура плавлення: 211-214°С. []20D = -322° (с=1%, дихлорметан). Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the synthesis of 17a-cyanomethyl-17b-hydroxy-estra-4,9-diene-3-one
Автори англійськоюDancsi Lajosne, MAKHO SHANDOR, Aranyi Antal, Horvath Janos
Назва патенту російськоюСпособ получения 17а-цианометил-17b-гидрокиэстра-4,9-диен-3-она
Автори російськоюДанчи Лайошне, Махо Шандор, Араньи Анталь, Хорват Янош
МПК / Мітки
МПК: C07J 41/00
Мітки: одержання, спосіб, 17a-ціанометил-17b-гідроксіестра-4,9-дієн-3-ону
Код посилання
<a href="https://ua.patents.su/5-91390-sposib-oderzhannya-17a-cianometil-17b-gidroksiestra-49-diehn-3-onu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 17a-ціанометил-17b-гідроксіестра-4,9-дієн-3-ону</a>
Попередній патент: Спосіб реалізації надпластичного стану матеріалу у процесі деформування
Наступний патент: Транспортний пристрій для заготовок
Випадковий патент: Вібровідцентровий сепаратор









